ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[0001] Изобретение относится к способам и композициям для доставки биологических молекул, таких как белки и нуклеиновые кислоты, к внеядерным органоидам. Более конкретно, в данной заявке описаны способы и композиции для генетической трансформации митохондрий и хлоропластов.
УРОВЕНЬ ТЕХНИКИ
[0002] Для генетического инжиниринга пищевых продуктов и сельскохозяйственных культур с целью удовлетворения мирового спроса на эти возобновляемые ресурсы требуются альтернативные сельскохозяйственные молекулярно-биологические технологии. К сожалению, растения устойчивы к большинству способов генетической трансформации, разработанных для манипуляции клетками млекопитающих. Тем не менее, технология пептидной трансфекции развивается в настоящее время в качестве успешной технологии трансфекции растений.
[0003] Пептиды, проникающие в клетку (СРР) представляют собой короткие катионные пептиды, способные к переносу полярных гидрофильных компонентов, таких как нуклеиновые кислоты, сквозь клеточные мембраны независимым от рецептора образом (Veldhoen, S., Recent Developments in Peptide-Based Nucleic Acid Delivery. IntePHKtional JouPHKI of Molecular Sciences (2008) 9(7): 1276-1320). Примером такого проникающего в клетку пептида является HIV-1 Tat 49-57 (RKKRRQRRR) (Vives, Е., P. Brodin, and В. Lebleu, A Truncated HIV-1 Tat Protein Basic Domain Rapidly Translocates through the Plasma Membrane and Accumulates in the Cell Nucleus. J. Biol. Chem. (1997) 272(25): 16010-16017; Wender, P.A., et al., The design, synthesis, and evaluation of molecules that enable or enhance cellular uptake: Peptoid molecular transporters. Proceedings of the National Academy of Sciences (2000) 97(24): 13003-13008).
[0004] Последовательность Tat содержит основные аминокислоты, что позволяет Tat проникать самой и проносить присоединенный «груз» через внешнюю плазменную мембрану клеток. Комплекс Tat-«груз» аккумулируется в ядрах клеток благодаря присутствию в пептидной последовательности внутриклеточных локализационных последовательностей, называющихся сигналом ядерной локализации (NLS) (Nagahara, Н., et al., Transduction of full-length TAT fusion proteins into mammalian cells: TAT-p27Kip1 induces cell migration. Nat Med (1998) 4(12): 1449-1452).
[0005] Такие внутриклеточные локализационные последовательности, обнаруживаемые на N-концах белков, в целом относятся к сигнальным последовательностям сортировки белков. Каждая сигнальная последовательность сортировки белков является отдельной пептидной последовательностью, направленной на возникающие белки, транслирующиеся в цитозоле в определенное внутриклеточное место внутри клеток. Сигналы сортировки белков включают сигналы ядерной локализации (NLS), направленные на ядра, пептиды, направленные на митохондрии (mTP), которые направлены на митохондрии, и пептиды хлоропластного переноса (сТР), которые направлены на хлоропласты. cTPs, mTPs и NLS распознаются механизмом переноса, способствующим транспортировке цитозольных белков, содержащих эти последовательности, через двойную мембрану к определенным органоидам (Emanuelsson, О., et al., Locating proteins in the cell using TargetP, SignalP and related tools. Nat. Protocols (2007) 2(4): 953-971).
[0006] Специфические структурные и химические свойства, способствующие эффективному клеточному поглощению и митохондриальному накоплению, использовали для разработки митохондриальных терапевтических агентов и противораковых препаратов. Например, были получены синтетические пептиды, содержащие делокализованные липофильные катионы (DLCs) (FePHKndez-Carneado, J., et al., Highly Efficient, Nonpeptidic Oligoguanidinium Vectors that Selectively IntePHKIize into Mitochondria, JouPHKI of the American Chemical Society (2004) 127(3): 869-874). Кроме того, были разработаны проникающие в клетки антиоксидантные пептиды, применяемые для понижения клеточного окислительного стресса, вызываемого реакционными кислородосодержащими веществами во внутренней митохондриальной мембране (Zhao, К., et al., Cell-permeable Peptide Antioxidants Targeted to Inner Mitochondrial Membrane inhibit Mitochondrial Swelling, Oxidative Cell Death, and Reperfusion Injury, J. Biol. Chem. (2004) 279(33): 34682-34690). Эти пептиды имеют в своем составе структурный мотив, включающий сменяющие друг друга синтетические ароматические остатки, придающие антиоксидантные свойства, и основные аминокислоты, придающие свойства клеточной проницаемости. На основе этого структурного мотива повторяющихся ароматических и основных остатков недавно были разработаны митохондриальные проникающие пептиды (MPPs), и в специфические области этих пептидов были внедрены свойства DLC (Horton, K.L. et al, Mitochondria-Penetrating Peptides, Chemistry & Biology (2008) 15: 375-382).
[0007] Определенные органоиды, такие как митохондрии и хлоропласты, содержат ДНК, которая экспрессируется, но в целом наследуется только от одного родителя, в отличие от ядерного генома. Митохондриальные гены обычно наследуются по материнской линии, и у большинства цветковых растений, например, хлоропласты не наследуются по отцовской линии. Вследствие этого такие органеллы выбирают в качестве мишеней для генетических трансформаций, особенно у растений, потому что любые трансформированные гены останутся в организме растения и не будут распространяться с пыльцой, уменьшая риск загрязнения окружающей среды. Кроме того, дисфункция митохондрий ассоциируется со специфическими заболеваниями, в отношении которых подходящим лечением может являться генетическая терапия и другие виды терапии, действующие напрямую на митохондрии.
[0008] Таким образом, является желательной разработка новых способов генетической трансформации организмов путем селективного внедрения генетического материала в геном таких органоидов, как митохондрии и хлоропласты.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0009] В одном аспекте, данное изобретение описывает способ доставки нуклеиновой кислоты в неядерный клеточный органоид, при этом этот способ включает воздействие на клетку композицией, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один носитель, направленный на органоид; при этом по меньшей мере одна нуклеиновая кислота проходит через клеточную мембрану и внедряется в неядерный органоид в присутствии по меньшей мере одного органоидно-направленного наноносителя. По меньшей мере в одном варианте осуществления данного изобретения, клетка является клеткой растения. По меньшей мере в одном варианте осуществления данного изобретения, растительная клетка выбирается из эмбриогенной соматической клетки, протопласта и микроспоры. По меньшей мере в одном варианте осуществления данного изобретения, клетка является животной клеткой. По меньшей мере в одном варианте осуществления данного изобретения, нуклеиновая кислота является ДНК.
[0010] По меньшей мере в одном варианте осуществления данного изобретения, неядерным органоидом является митохондрия. В таких вариантах осуществления данного изобретения, органоидно-направленный наноноситель может быть полипептидом, обладающим зарядом в интервале приблизительно от 4 до 7 и гидрофильностью приблизительно от 0 до -0,5. В ином случае, в таких вариантах осуществления данного изобретения, органоидно-направленный наноноситель может быть полипептидом, содержащим последовательность, выбираемую из:

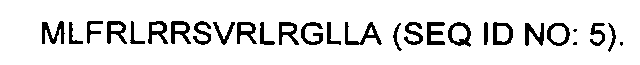
[0011] По меньшей мере в одном варианте осуществления данного изобретения, неядерным органоидом является хлоропласт. В таких вариантах осуществления данного изобретения, органоидно-направленный наноноситель может быть полипептидом, обладающим зарядом в интервале приблизительно от 2 до 4,2 и гидрофильностью приблизительно от 0 до -0,2. В ином случае, в таких вариантах осуществления данного изобретения, органоидно-направленный наноноситель может быть полипептидом, содержащим последовательность, выбираемую из:

[0012] В другом аспекте осуществления данного изобретения, оно раскрывает способ получения генетически модифицированной растительной клетки, при этом этот способ включает воздействие на растительную клетку, содержащую неядерный органоид, композиции, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный наноноситель; при этом по меньшей мере одна нуклеиновая кислота проходит через клеточную мембрану и внедряется в неядерный органоид в присутствии по меньшей мере одного органоидно-направленного наноносителя с целью трансфектировать этот неядерный органоид. По меньшей мере в одном варианте осуществления данного изобретения, растительная клетка является эмбриогенной микроспорой.
[0013] В другом аспекте данное изобретение раскрывает генетически модифицированную растительную клетку, полученную способом, описанным в этом документе.
[0014] В другом аспекте осуществления данного изобретения, раскрывается способ получения генетически модифицированного растения, при этом этот способ включает воздействие на растительную клетку, содержащую неядерный органоид, композиции, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный ленный наноноситель; при этом по меньшей мере одна нуклеиновая кислота проходит через клеточную мембрану и внедряется в неядерный органоид в присутствии по меньшей мере одного органоидно-направленного наноносителя с целью трансфектировать этот неядерный органоид; и получение растения из растительной клетки, содержащей трансфектированный неядерный органоид. По меньшей мере в одном варианте осуществления данного изобретения, растительная клетка является эмбриогенной микроспорой.
[0015] В другом аспекте данное изобретение описывает генетически модифицированное растение, полученное способом, описанным в данном документе. В другом аспекте данное изобретение описывает семя такого генетически модифицированного растения, при этом это семя содержит неядерный органоид, трансфектированный согласно данному изобретению.
[0016] В другом аспекте осуществления данного изобретения, оно описывает способ получения генетически модифицированной животной клетки, при этом этот способ включает воздействие на животную клетку, содержащую по меньшей мере одну митохондрию, композиции, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один наноноситель, направленный на митохондрию; при этом по меньшей мере одна нуклеиновая кислота проходит через клеточную мембрану и проникает в по меньшей мере одну митохондрию в присутствии по меньшей мере одного наноносителя, направленного на митохондрию, для проникновения в по меньшей мере одну митохондрию. По меньшей мере в одном варианте осуществления данного изобретения, животная клетка является клеткой млекопитающего. По меньшей мере в одном варианте осуществления данного изобретения, животная клетка является человеческой клеткой.
[0017] В другом аспекте данное изобретение описывает генетически модифицированную животную клетку, полученную способом, описанным в данном документе.
[0018] В другом аспекте данное изобретение описывает наноноситель, направленный на митохондрию, при этом этот направленный на митохондрию носитель является полипептидом, содержащим пептидную последовательность, направленную на митохондрию (mTP), с зарядом в интервале от 4 до приблизительно 7 и гидрофильностью от приблизительно 0 до приблизительно -0,5. По меньшей мере в одном варианте осуществления данного изобретения, полипептид содержит последовательность, выбираемую из:

[0019] В другом аспекте данное изобретение описывает наноноситель, направленный на хлоропласт, при этом этот хлоропласто-направленный наноноситель является полипептидом, содержащим хлоропластную транзитную пептидную последовательность (сТР), с зарядом в интервале от приблизительно 2 до приблизительно 4,2 и гидрофильностью от приблизительно 0 до приблизительно -0,2. По меньшей мере в одном варианте осуществления данного изобретения, полипептид содержит последовательность, выбираемую из:

КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0020] Эти и другие особенности данного изобретения становятся очевидны из последующего описания и формулы изобретения, а также прилагаемых чертежей, на которых изображено:
[0021] на Фиг. 1А - конфокальное микроскопное изображение (Nikon) поперечного сечения протопласта тритикале, демонстрирующее флуоресценцию под действием флуоресцеин-меченого cTP1 (SEQ ID NO: 6);
[0022] на Фиг. 1B - конфокальное микроскопное изображение (Nikon) поперечного сечения протопласта тритикале, демонстрирующее флуоресценцию под действием флуоресцеин-меченого cTP1 (SEQ ID NO: 6) и хлоропластная аутофлуоресценция;
[0023] на Фиг. 2А - конфокальное микроскопное изображение (Nikon) протопласта тритикале, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3);
[0024] на Фиг. 2B - конфокальное микроскопное изображение (Nikon) протопласта тритикале, демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0025] на Фиг. 2С - конфокальное микроскопное изображение (Nikon) протопласта тритикале, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3) и флуоресценцию под действием MitoTracker® Orange;
[0026] на Фиг. 3A - конфокальное микроскопное изображение (Olympus) поперечного сечения протопласта табака, демонстрирующее хлоропластную аутофлуоресценцию;
[0027] на Фиг. 3B - конфокальное микроскопное изображение (Olympus) поперечного сечения протопласта табака, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3);
[0028] на Фиг. 3C - конфокальное микроскопное изображение (Olympus) поперечного сечения протопласта табака, демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0029] на Фиг. 3D - конфокальное микроскопное изображение (Olympus) поперечного сечения протопласта табака, демонстрирующее хлоропластную аутофлуоресценцию, флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3) и флуоресценцию под действием MitoTracker® Orange;
[0030] на Фиг. 4А - пакетированное глубинное конфокальное микроскопное изображение (Olympus) протопласта табака, демонстрирующее хлоропластную аутофлуоресценцию;
[0031] на Фиг. 4B - пакетированное глубинное конфокальное микроскопное изображение (Olympus) протопласта табака, демонстрирующее флуоресценцию под действием флуоресцеин-меченого cTP1 (SEQ ID NO: 6);
[0032] на Фиг. 4С - пакетированное глубинное конфокальное микроскопное изображение (Olympus) протопласта табака, демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0033] на Фиг. 4D - пакетированное глубинное конфокальное микроскопное изображение (Olympus) протопласта табака, демонстрирующее хлоропластную аутофлуоресценцию, флуоресценцию под действием флуоресцеин-меченого cTP1 (SEQ ID NO: 6) и флуоресценцию под действием MitoTracker® Orange;
[0034] на Фиг. 5А - конфокальное микроскопное изображение (Nikon) микроспоры, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3);
[0035] на Фиг. 5B - конфокальное микроскопное изображение (Nikon) микроспоры, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP3 (SEQ ID NO: 3) и флуоресценцию под действием MitoTracker® Orange;
[0036] на Фиг. 6А - конфокальное микроскопное изображение (Nikon) микроспоры, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP1 (SEQ ID NO: 1);
[0037] на Фиг. 6B - конфокальное микроскопное изображение (Nikon) микроспоры, демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0038] на Фиг. 6С - конфокальное микроскопное изображение (Nikon) микроспоры, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP1 (SEQ ID NO: 1) и флуоресценцию под действием MitoTracker® Orange;
[0039] на Фиг. 7 - конфокальное микроскопное изображение (Nikon) клеток MDCK (Madin-Darby canine kidney), демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP1 (SEQ ID NO: 1);
[0040] на Фиг. 8А - конфокальное микроскопное изображение (Nikon) клеток MDCK, демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP1 (SEQ ID NO: 1);
[0041] на Фиг. 8B - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0042] на Фиг. 8С - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP1 (SEQ ID NO: 1) и флуоресценцию под действием MitoTracker® Orange;
[0043] на Фиг. 9А - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP5 (SEQ ID NO: 5);
[0044] на Фиг. 9B - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0045] на Фиг. 9С - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP5 (SEQ ID NO: 5) и флуоресценцию под действием MitoTracker® Orange;
[0046] на Фиг. 10 - конфокальное микроскопное изображение (Nikon) клеток MDCK демонстрирующее флуоресценцию под действием флуоресцеин-меченого mTP4 (SEQ ID NO: 4);
[0047] на Фиг. 11 - карта репортерной плазмиды pWMaadAGFP;
[0048] на Фиг. 12 - карта репортерной плазмиды pWCaadAGFP;
[0049] на Фиг. 13А - конфокальное микроскопное изображение (Nikon) протопласта тритикале, трансфектированного плазмидой pWMaadA16GFP в присутствии mTP4 (SEQ ID NO: 4), демонстрирующее флуоресценцию под действием зеленого флуоресцентного белка (GFP);
[0050] на Фиг. 13B - конфокальное микроскопное изображение (Nikon) протопласта тритикале трансфектированного плазмидой pWMaadA16GFP, в присутствии mTP4 (SEQ ID NO: 4), демонстрирующее флуоресценцию под действием both GFP and MitoTracker® Orange;
[0051] на Фиг. 13C - конфокальное микроскопное изображение (Nikon) протопласта тритикале трансфектированного плазмидой pWMaadA16GFP в присутствии mTP4 (SEQ ID NO: 4), демонстрирующее флуоресценцию под действием GFP и MitoTracker® Orange, и хлоропластную аутофлуоресценцию;
[0052] на Фиг. 14А - конфокальное микроскопное изображение (Nikon) протопласта тритикале трансфектированного плазмидой pWMaadA16GFP в присутствии mTP2 (SEQ ID NO: 2), демонстрирующее флуоресценцию под действием GFP;
[0053] на Фиг. 14B - конфокальное микроскопное изображение (Nikon) протопласта тритикале трансфектированного плазмидой pWMaadA16GFP в присутствии mTP2 (SEQ ID NO: 2), демонстрирующее флуоресценцию под действием MitoTracker® Orange;
[0054] на Фиг. 14С - конфокальное микроскопное изображение (Nikon) протопласта тритикале трансфектированного плазмидой pWMaadA16GFP в присутствии mTP2 (SEQ ID NO: 2), демонстрирующее флуоресценцию под действием GFP и MitoTracker® Orange;
[0055] на Фиг. 15 - конфокальное микроскопное изображение (Nikon) клеток Caco-2, трансфектированных плазмидой pWMaadA16GFP в присутствии mTP1 (SEQ ID NO: 1), демонстрирующее флуоресценцию под действием GFP и MitoTracker® Orange;
[0056] на Фиг. 16 - конфокальное микроскопное изображение (Nikon) клеток F1112, трансфектированных плазмидой pWMaadA16GFP в присутствии mTP1 (SEQ ID NO: 1), демонстрирующее флуоресценцию под действием GFP и MitoTracker® Orange;
[0057] на Фиг. 17 - диаграмма, показывающая уровень экспрессии (кратное увеличение, среднее из 4 повторений) GFP в микроспорах тритикале, трансфектированных плазмидой pWMaadA16GFP в присутствии mTP1 (SEQ ID NO: 1), mTP2 (SEQ ID NO: 2), mTP3 (SEQ ID NO: 3), mTP4 (SEQ ID NO: 4) или mTP5 (SEQ ID NO: 5) в сравнении с уровнем экспрессии (кратное увеличение) внутреннего контрольного фактора элонгации 1а (EF1a), по результатам измерения количественной PCR в реальном времени уровней mPHK;
[0058] на Фиг. 18 - диаграмма, показывающая уровень экспрессии (кратное увеличение, среднее из 4 повторений) GFP в микроспорах тритикале, трансфектированных плазмидой pWCaadA16GFP в присутствии cTP1 (SEQ ID NO: 6), сТР2 (SEQ ID NO: 7), cTP3 (SEQ ID NO: 8), cTP4 (SEQ ID NO: 9) или cTP5 (SEQ ID NO: 10) в сравнении с уровнем экспрессии (кратное увеличение) внутреннего контрольного фактора элонгации 1а (EF1a), по результатам измерения количественной PCR в реальном времени уровней mPHK;
[0059] на Фиг. 19 - диаграмма, показывающая уровень экспрессии (кратное увеличение, среднее из 4 повторений) GFP в протопластах тритикале, трансфектированных плазмидой pWMaadA16GFP в присутствии mTP1 (SEQ ID NO: 1), mTP2 (SEQ ID NO: 2), mTP3 (SEQ ID NO: 3), mTP4 (SEQ ID NO: 4) или mTP5 (SEQ ID NO: 5) в сравнении с уровнем экспрессии (кратное увеличение) внутреннего контрольного фактора элонгации 1а (EF1a), по результатам измерения количественной PCR в реальном времени уровней mPHK; и
[0060] на Фиг. 20 - диаграмма, показывающая уровень экспрессии (кратное увеличение, среднее из 4 повторений) GFP в протопластах тритикале, трансфектированных плазмидой pWCaadA16GFP в присутствии cTP1 (SEQ ID NO: 6), cTP2 (SEQ ID NO: 7), cTP3 (SEQ ID NO: 8), cTP4 (SEQ ID NO: 9) или cTP5 (SEQ ID NO: 10) в сравнении с уровнем экспрессии (кратное увеличение) внутреннего контрольного фактора элонгации 1а (EF1a), по результатам измерения количественной PCR в реальном времени уровней mPHK.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0061] В одном аспекте, данное изобретение предлагает способ доставки нуклеиновой кислоты во внеядерный клеточный органоид. По меньшей мере в одном варианте осуществления данного изобретения, клетка является растительной клеткой, включая, но не ограничиваясь этим, соматические клетки, эмбриогенные соматические клетки, мезофильные протопласты и микроспоры. По меньшей мере в одном варианте осуществления данного изобретения, клетка является животной клеткой, включая, но не ограничиваясь этим, клетки млекопитающих. По меньшей мере в одном варианте осуществления данного изобретения, клетка является человеческой клеткой.
[0062] Нуклеиновая кислота доставляется к внутриклеточному внеядерному органоиду в клетке. Подходящими целевыми внеядерными органоидами являются такие, которые содержат эндогенные нуклеиновые кислоты, включая, но не ограничиваясь этим, геномную ДНК, и которые могут экспрессировать один или несколько генов из эндогенных нуклеиновых кислот. По меньшей мере в одном варианте осуществления данного изобретения органоид является хлоропластом. По меньшей мере в одном варианте осуществления данного изобретения, органоид является митохондрией.
[0063] Клетка подвергается действию композиции, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный наноноситель. Предпочтительным образом, нуклеиновая кислота может экспрессироваться во внеядерном органоиде или может трансформировать геном внеядерного органоида. Нуклеиновая кислота может быть РНК или ДНК, и может иметь природное происхождение или являться искусственно созданной нуклеиновой кислотой. При употреблении в этом тексте, термин "искусственно созданная нуклеиновая кислота" означает нуклеиновую кислоту (РНК или ДНК), которая была получена или модифицирована искусственным или синтетическим образом. По меньшей мере в одном варианте осуществления данного изобретения, нуклеиновая кислота включает ДНК. По меньшей мере в одном варианте осуществления данного изобретения, нуклеиновая кислота включает один или несколько генов, экспрессируемых в целевом внеядерном органоиде. По меньшей мере в одном варианте осуществления данного изобретения, нуклеиновая кислота включает плазмиду, искусственную хромосому или генный конструкт. Специалисту в данной области известны подходящие аминокислоты и способы выбора и получения таких нуклеиновых кислот.
[0064] По меньшей мере в одном варианте осуществления данного изобретения, нуклеиновая кислота также содержит маркерный ген. При употреблении в этом тексте, термин "маркерный ген" означает ген, кодирующий генный продукт, присутствие которого при его экспрессии можно обнаружить и/или измерить. Маркерные гены хорошо известны в этой области и означает гены, кодирующие белки, присутствие которых можно обнаружить и/или измерить химическими или биохимическими способами, и гены, кодирующие белки, которые можно обнаружить и/или измерить по их физическим свойствам. Гены, кодирующие белки, присутствие которых можно обнаружить и измерить химическими или биохимическими способами включают, не ограничиваясь этим, гены, кодирующие ферменты и им подобные, и гены, экспрессия которых ассоциируется с устойчивостью к антибиотикам. Гены, кодирующие белки, которые можно обнаружить и/или измерить по их физическим свойствам включают, не ограничиваясь этим, гены, кодирующие белки, которые можно обнаружить по флуоресценции, такие как зеленый флуоресцентный белок Aequorea victoria (GFP), и подобные. Специалисту в данной области будет понятно, что маркерный ген можно использовать для выбора клеток, стабильно экспрессирующих маркерный ген. Например, если маркерный ген является геном, ассоциирующимся с устойчивостью к антибиотикам, то клетки, экспрессирующие этот маркерный ген, можно выбрать путем выращивания клеток в присутствии антибиотика, что будет летальным для клеток, не экспрессирующих маркерный ген.
[0065] По меньшей мере в одном варианте осуществления данного изобретения, наноноситель, направленный на органоиды, является полипептидом, который может иметь мишенью один или несколько внутриклеточных внеядерных органоидов. По меньшей мере в одном варианте осуществления данного изобретения, полипептидный наноноситель включает на N-конце белка сортирующую сигнальную последовательность. По меньшей мере в одном варианте осуществления данного изобретения, полипептидный наноноситель включает на N-конце белка сортирующую сигнальную последовательность, специфичную к внутриклеточному внеядерному органоиду, в соответствии с описание в этом тексте. По меньшей мере в одном варианте осуществления данного изобретения, сортирующая сигнальная последовательность на N-конце белка является хлоропластной транзитной пептидной (cTP) последовательностью. По меньшей мере в одном варианте осуществления данного изобретения, сортирующая сигнальная последовательность на N-конце белка является пептидной последовательностью, направленной на митохондрии (mTP). По меньшей мере в одном варианте осуществления данного изобретения, сортирующая сигнальная последовательность на N-конце белка является последовательностью, присутствующей изначально в по меньшей мере одном белке по меньшей мере одного растения.
[0066] Без привязки к теории, в настоящее время считается, что наноноситель, направленный на органоиды, взаимодействует с мембраной внеядерного органоида таким образом, чтобы облегчить проникновение нуклеиновой кислоты внутрь внеядерного органоида. Наноноситель, направленный на органоиды, может сам внедряться или не внедряться в внеклеточный органоид, и специалисту в данной области должно быть понятно, что такое внедрение самого наноносителя, направленного на органоиды, во внеклеточный органоид, не является обязательным условием для проникновения в внеядерный органоид нуклеиновой кислоты в присутствии наноносителя, направленного на органоиды.
[0067] По меньшей мере в одном варианте осуществления данного изобретения, полипептидный наноноситель, направленный на органоиды, также обладает проникающими свойствами. По меньшей мере в одном варианте осуществления данного изобретения, полипептид содержит не более 100 аминокислотных остатков. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает не более 35 аминокислотных остатков. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает от приблизительно 5 до приблизительно 35 аминокислотных остатков.
[0068] При употреблении в этом тексте, термин "суммарный катионный заряд" в отношении полипептида определяется как суммарный заряд пептида Z, вычисленный при pH 7,0, с помощью следующей формулы:
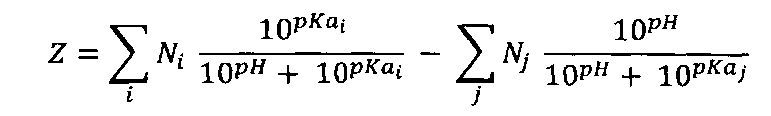
где Ni является количеством ith основных групп в пептиде (N-терминальных аминогрупп и боковых цепей аргининовых, лизиновых и гистидиновых остатков); pKa, является значением pKa основной группы ith; Nj является количеством jth кислотных групп в пептиде (C-терминальных карбоксильных групп и боковых цепей аспаргиновой кислоты, глутаминовой кислоты, цистеиновых и тирозиновых остатков); и pKaj является значением pKa кислотных групп jth. Значения pKa используются следующие (Nelson, David L, Michael M. Cox, Lehninger Principles of Biochemistry, Fourth Edition):
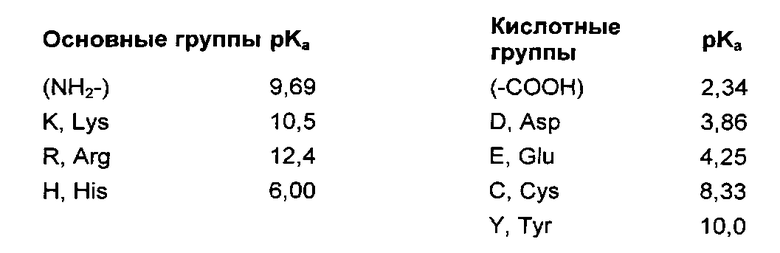
[0069] По меньшей мере в одном варианте осуществления данного изобретения, пептидный наноноситель, направленный на органоиды, включает хлоропластную транзитную пептидную (сТР) последовательность и имеет суммарный катионный заряд равный приблизительно 2 или больше. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включающий cTP последовательность, имеет суммарный катионный заряд от приблизительно 2 до приблизительно 6. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включающий сТР последовательность, имеет суммарный катионный заряд от приблизительно 2 до приблизительно 4,2.
[0070] По меньшей мере в одном варианте осуществления данного изобретения, полипептидный наноноситель, направленный на органоиды, включает пептидную последовательность, направленную на митохондрии (mTP) и имеет суммарный катионный заряд равный или больше приблизительно 3,5. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включающий mTP последовательность имеет суммарный катионный заряд от приблизительно 3,5 до приблизительно 9,2. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включающий mTP последовательность имеет суммарный катионный заряд от приблизительно 4 до приблизительно 7.
[0071] При употреблении в этом тексте, термин "гидрофильность" в отношении полипептида определяется как аффинность к воде или тенденция растворяться в воде, смешиваться с ней или смачиваться ею. Гидрофильность полипептида вычисляется как сумма значений гидрофильности индивидуальных аминокислотных остатков в полипептиде, используя значения гидрофильности, приведенные в Норр & Woods hydrophilicity scale (Норр Т.Р., Woods K.R., Proc. Natl. Acad. Sci. U.S.A. (1981) 78: 3824-3828), как показано ниже:


[0072] По меньшей мере в одном варианте осуществления данного изобретения, полипептидный наноноситель, направленный на органоиды, обладает гидрофильностью не более 0. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает пептидную последовательность, направленную на митохондрии (mTP) и обладает гидрофильностью от приблизительно 0 до приблизительно -0,6. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает mTP последовательность и обладает гидрофильностью от приблизительно 0 до приблизительно -0,5. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает хлоропластную транзитную пептидную (сТР) последовательность и обладает гидрофильностью от приблизительно 0 до приблизительно -0,5. По меньшей мере в одном варианте осуществления данного изобретения, полипептид включает сТР последовательность и обладает гидрофильностью от приблизительно 0 до приблизительно -0,2.
[0073] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает пептидную последовательность, направленную на митохондрии (mTP), полипептид имеет последовательность, которая обладает по меньшей мере приблизительно 80% сходством, по меньшей мере приблизительно 90% сходством, по меньшей мере приблизительно 95% сходством или по меньшей мере приблизительно 99% сходством с последовательностью, выбираемой из:

[0074] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает пептидную последовательность, направленную на митохондрии (mTP), полипептид имеет последовательность, которая обладает по меньшей мере приблизительно 80% идентичностью, по меньшей мере приблизительно 90% идентичностью, по меньшей мере приблизительно 95% идентичностью или по меньшей мере приблизительно 99% идентичностью с последовательностью, выбираемой из:


[0075] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает пептидную последовательность, направленную на митохондрии (mTP), полипептид имеет последовательность, выбираемую из:

или последовательность, аналогичную им, содержащую одно или несколько удалений, добавлений или консервативных замещений аминокислотных остатков, таким образом, что аналогичная последовательность включает от приблизительно 5 до приблизительно 35 аминокислот.
[0076] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает хлоропластную транзитную пептидную (сТР) последовательность, полипептид имеет последовательность, которая обладает по меньшей мере приблизительно 80% сходством, по меньшей мере приблизительно 90% сходством, по меньшей мере приблизительно 95% сходством или по меньшей мере приблизительно 99% сходством с последовательностью, выбираемой из:

[0077] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает хлоропластную транзитную пептидную (сТР) последовательность, полипептид имеет последовательность, которая обладает по меньшей мере приблизительно 80% идентичностью, по меньшей мере приблизительно 90% идентичностью, по меньшей мере приблизительно 95% идентичностью или по меньшей мере приблизительно 99% идентичностью с последовательностью, выбираемой из:


[0078] По меньшей мере в одном варианте осуществления данного изобретения, когда полипептид включает хлоропластную транзитную пептидную (сТР) последовательность, полипептид имеет последовательность, выбираемую из:

или последовательность, аналогичную им, содержащую одно или несколько удалений, добавлений или консервативных замещений аминокислотных остатков, таким образом, что аналогичная последовательность включает от приблизительно 5 до приблизительно 35 аминокислот.
[0079] При употреблении в этом тексте, термин "консервативное замещение" означает замещение аминокислотного остатка в пептидной последовательности другим аминокислотным остатком, обладающим похожими химическими и/или физическими свойствами, так что в результате такого замещения физические и/или химические свойства пептида претерпевают только минимальное изменение. Примеры физических и химических свойств включают, не ограничиваясь этим, полярность, заряд, стерический размер, pKa, и степень ароматизации. Например, один небольшой гидрофобный остаток, выбираемый из глицина, аналина или валина, может быть замещен другим небольшим гидрофобным остатком, выбираемым из этой же группы; один ароматический остаток, выбираемый из фенилаланина, тирозина или триптофана, может быть замещен на другой ароматический остаток, выбираемый из это же группы; один кислотный остаток, выбираемый из аспаргиновой кислоты или глутаминовой кислоты, может быть замещен другим кислотным остатком, выбираемым из этой же группы; один основной остаток, выбираемый из аргинина или лизина, может быть замещен на другой основной остаток, выбираемый из этой же группы; гидроксилированный остаток, выбираемый из серина и треонина, может быть замещен на другой гидроксилированный остаток, выбираемый из этой же группы, и так далее. Специалист в данной области хорошо осведомлен о других аминокислотных замещениях, которые лишь минимально изменят физические и/или химические свойства данных пептидов.
[0080] В других аспектах данное изобретение описывает животные клетки, растительные клетки, растения и их семена, полученные с использованием способов и композиций, описанных в этом документе. Способы генетической трансформации растительных клеток, создание растений из генетически трансформированных растительных клеток, полученных с помощью здесь описанных способов, и создание семян таких растений, хорошо известны в этой области, включая, но не ограничиваясь этим, биолистическую трансформацию ядер или хлоропластов растительных клеток, выбор трансформированных растительных клеток с помощью маркеров антибиотической устойчивости, и регенерацию трансгенных растений из трансформированных изолированных микроспорных культур (Chugh, А., Е. Amundsen, and F. Eudes, Translocation of cell-penetrating peptides and delivery of their cargoes in triticale microspores. Plant Cell Reports (2009) 28(5): 801-810; Lee, S.M., et al., Plastid transformation in the monocotyledonous cereal crop, rice (Oryza sativa) and transmission of transgenes to their progeny. Molecules and Cells (2006) 21(3): 401-410; and Cui, C., et al., Stable chloroplast transformation of immature scutella and inflorescences in wheat (Triticum aestivum L). Acta Biochimica et Biophysica Sinica (2011) 43(4): 284-291). Специалист в этой области также знает о других подобных способах. Кроме того, в этой области хорошо известны также способы генетической трансформации ядер животных клеток.
ПРИМЕРЫ
[0081] Данное изобретение может быть лучше понято с учетом нижеприведенных примеров, представленных только для иллюстрации специфических вариантов осуществления данного изобретения, но не с целью ограничения его объема. Специалист в данной области заметит, что способы и методики, описанные в этом документе, можно модифицировать, и такие модификации также являются включенными в данное изобретение. В этих примерах употребляются специфические термины, служащие только описательным целям и не являющиеся ограничивающими. Способы, упоминаемые в нижеприведенных примерах, но не описанные детально, являются хорошо известными специалистам в данной области.
Пример 1 - Идентификация органоидно-направленных пептидных (oTP) последовательностей
[0082] Доступные белковые последовательности для пшеницы (Triticum aestivum), риса (Oryza sativa), кукурузы (Zea mays), и Arabidopsis thaliana были скачаны из NCBI (National Center for Biotechnology Information) GenBank. Для устранения избыточности последовательностей в данных белковых последовательностей, использовали компьютерную программу Cluster Database at High Identity with Tolerance (CD-HIT) для генерирования неизбыточных последовательностей (Huang, Y., et al., CD-HIT Suite: a web server for clustering and comparing biological sequences, Bioinformatics (2010) 26(5): 680-682). Белковые последовательности анализировали с помощью программы TargetP для идентификации N-терминальных белковых сортирующих сигнальных последовательностей и для предсказания внутриклеточных локализационных свойств этих N-терминальных белковых сортирующих сигнальных последовательностей (Emanuelsson, О., et al., Predicting Subcellular Localization of Proteins Based on their N-terminal Amino Acid Sequence, JouPHKI of Molecular Biology (2000) 300(4): 1005-1016). N-терминальные белковые сортирующие сигнальные пептидные последовательности, специфичные к хлоропластам (хлоропластные транзитные пептидные (сТР) последовательности) и митохондриям (пептидные последовательности, направленные на митохондрии (mTP)) идентифицировали с помощью наборов данных белковых последовательностей. Сигнальные последовательности-кандидаты с потенциальными свойствами клеточной проницаемости далее выбирали с помощью последовательного применения специфического критерия отбора, как показано в таблицах 1 и 2.
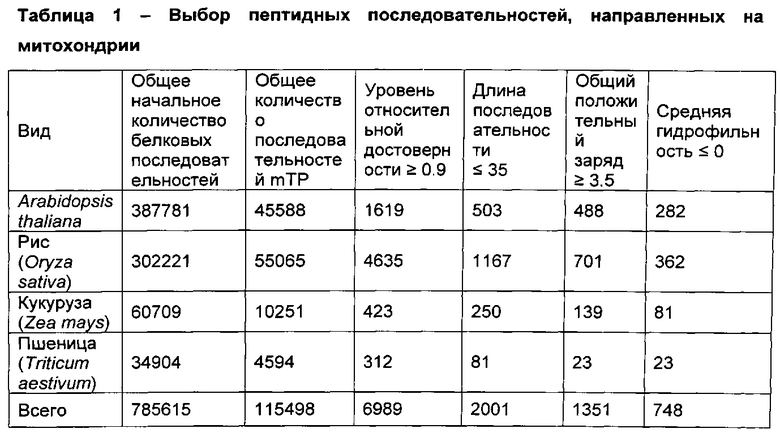
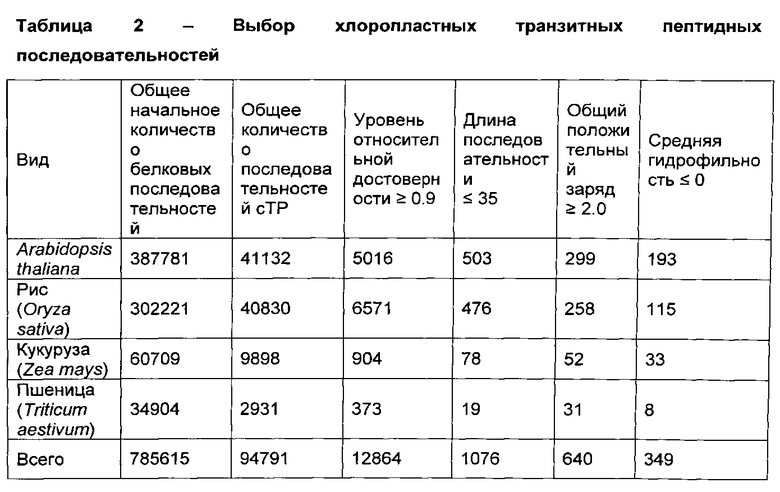
[0083] Первые три колонки цифр в таблицах 1 и 2 представляют общее количество начальных белковых последовательностей из NCBI GenBank из каждого организма, общее количество сТР или mTP последовательностей, предсказанных TargetP, и предсказанное количество сТР или mTP последовательностей с TargetP уровнем относительной достоверности ≥90%, соответственно. Остальные колонки цифр представляют количество последовательностей, предсказнное при последовательном и одновременно приложении следующих критериев выбора: длина последовательности 35 аминокислот и менее; общий позитивный заряд ≥2.0 (для сТР) или ≥3.5 (для mTP); и средняя гидрофильность ≤0. Порог заряда для mTP последовательностей был выбран выше, чем для сТР последовательностей, потому что у mTPs относительно высокое содержание аргинина, и поэтому относительно высокий общий позитивный заряд (Bhushan, S., et al., The role of the N-terminal domain of chloroplast targeting peptides in organellar protein import and miss-sorting, FEBS Letters (2006) 580(16): 3966-3972).
Пример 2 - Свойства клеточной проницаемости и органоидной направленности пептидов
Синтез и маркировка пептидов
[0084] Пятьдесят четыре органоидно-направленные (оТР) пептидные последовательности-кандидаты (31 mTP последовательности и 23 сТР последовательности, каждая выбранная из тех, которые удовлетворяли всем вышеописанным критериям) были синтезированы с помощью твердофазной Fmoc (фторенилметоксикарбонил) химии, хорошо известной в этой области. Каждый пептид был помечен флуоресцеиновой изотиоцианатной меткой (FITC) на N-конце, с помощью хорошо известных процедур, для облегчения визуального распознавания флуоресценции.
Выделение и очистка мезофильного протопласта тритикале
[0085] Выделение и очистка протопласта проводилась в асептических условиях. Поверхность эмбриональных половинок семян тритикале (cv. AC Alta) стерилизовали 4% гипохлоритом и инокулировали в базальной среде MS (Murashige and Skoog), pH 5,82 (Murashige Т. and Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures (1962) Physiol. Plant 15(3): 473-497). Очищенные листья шестидневных всходов инкубировали в ферментном растворе [2% целлюлазы и 2% мацерозима (Yakult Honsha Co Ltd, Japan) в CPW (cell protoplast washing) растворе, pH 5,6 (Frearson EM, Power JB, Cocking EC (1973) Dev Biol 33: 130-137)] в течение 4 ч при 25°C, в темноте. Протопласты изолировали центрифугированием при 100 g в течение 3 минут, при комнатной температуре (Eppendorf centrifuge 5810R, USA), дважды промывали CPW раствором и очищали расслоением на 21% сахарозе в CPW растворе. Слой протопластов, сформированный на границе раздела фаз, осторожно удаляли и суспендировали в CPW растворе. После двух промываний CPW раствором, плотность протопластов отрегулировали до 106 протопластов/мл.
Выделение и очистка протопластов табака
[0086] Растения Nicotiana benthamiana выращивали в течение 6-8 недель и держали в темноте в течение 24 часов перед всеми экспериментами. Все пипеточные работы проводились медленно, с применением широкой пипетки, для предотвращения лизиса протопластов. Листья нарезали с нижней стороны на множество тонких кусочков, вынимали центральную жилу, и инкубировали нижней частью вниз с питательным ферментным раствором [2% целлюлазы и 2% мацерозима (Yakult Honsha Co Ltd, Japan) в растворе CPW (cell protoplast washing), pH 5.6 (Frearson EM, Power JB, Cocking EC (1973) Dev Biol 33: 130-137)] в 15 мм чашках Петри в течение 3-5 часов при 28°C. После инкубирования, листья осторожно встряхивали пинцетом для высвобождения оставшихся протопластов, и осторожно фильтровали среду через 100 мкмоль/л сита и переносили в 50 мл пробирки для центрифуги. Среду центрифугировали в течение 5 минут при 300 g при 4°C, удаляли плавающие протопласты с поверхности суспензии и повторно суспендировали их в W5 промывочном растворе (154 ммоль/л NaCl, 125 ммоль/л CaCl2·2H2O, 5 ммоль/л KCl, 5 ммоль/л глюкозы, 0,5 моль/л маннитола, отрегулированный до pH 5,8 с помощью 0,1 М КОН), и центрифугировали в течение 3 минут при 300 g при 4°C. Таблетку аккуратно выкладывали в 5 мл 20% мальтозы в 15 мл пробирку для центрифуги, и центрифугировали 5 минут при 300 g. Плавающий слой из центра раствора аккуратно удаляли и повторно суспендировали в MaMg растворе (15 ммоль/л MgCl2, 0,1% MES, 0,4 М маннитола, отрегулированный до pH 5,6 с помощью КОН), и центрифугировали в течение 3 минут при 300 g при 4°C. Суспензию протопластов разбавляли до концентрации 100000 клеток/мл с помощью гемоцитомерта.
Выделение и очистка микроспор
[0087] Выделение микроспор тритикале (cv. Alta) на средне-поздней моноядерной стадии с поверхности стерилизованных пыльников проводили в среду NPB-99, pH 7,0, согласно описанию Eudes et al (Chugh, A., E. Amundsen, and F. Eudes, Translocation of cell-penetrating peptides and delivery of their cargoes in triticale microspores. Plant Cell Reports (2009) 28(5): 801-810).
Клеточная культура MDCK Cell
[0088] Клетки MDCK выращивали в среде Dulbecco′s Modified Eagle Medium (DMEM) с содержанием 5% (по объему) эмбриональной бычьей сыворотки (FBS) и 1% (по объему) пенициллина/стрептомицина при 37°C во влажной атмосфере, содержащей 5% CO2. Клетки, выращенные в 10-см чашках, извлекали с помощью трипсина и этилендиаминтетрауксусной кислоты (EDTA) и промывали DMEM/FBS. Клетки, использовавшиеся для микроскопии, готовили добавлением 100 ООО клеток в апикальную камеру 12-ммоль/л диаметра Transwell™ permeable supports (Costar, Cambridge, MA). Клетки культивировали в DMEM/FBS в течение 3-5 дней.
Клеточные культуры Caco-2 и F1112
[0089] Клетки Caco-2 и F1112 выращивали в среде Dulbecco′s Modified Eagle Medium (DMEM) содержащей 10% (по объему) эмбриональной бычьей сыворотки (FBS) и 50 мг/мл гентамицина при 37°C в атмосфере 95% влажности, содержащей 5% CO2. Клетки выращивали в колбах Falcon™ 25 см2 или 75 см2 до достижения конфлюентности, затем отделяли с помощью 0,25% трипсина и 0,02% EDTA и промывали DMEM.
[0090] Образцы для фотометрических исследований готовили добавлением 1000 клеток в камеру Nunc coverglass chamber (2,5 cm2). Клетки выращивали как описано выше в течение от 3 до 7 дней. Монослои клеток трижды промывали эпителиальным клеточным солевым раствором (pH 7,4).
Клеточная культура MG
[0091] Клетки MG выращивали в среде Dulbecco′s Modified Eagle Medium (DMEM) содержащей 20% (по объему) эмбриональной бычьей сыворотки (FBS) и 50 мг/мл гентамицина при 37°C в атмосфере 95% влажности, содержащей 5% CO2. Клетки выращивали в колбах Falcon™ 25 см2 или 75 см2 до достижения конфлюентности, затем отделяли с помощью 0.25% трипсина и 0,02% EDTA и промывали DMEM.
[0092] Образцы для фотометрических исследований готовили добавлением 1000 клеток в камеру Nunc coverglass chamber (2,5 cm2). Клетки выращивали как описано выше в течение от 3 до 7 дней. Монослои клеток трижды промывали эпителиальным клеточным солевым раствором (pH 7,4).
Инкубация протопластов тритикале с флуоресцентно-мечеными пептидами
[0093] Мезофильные протопласты (500 мкл раствора 106/мл) инкубировали с 180 мкл меченных флуоресцином mTPs или cTPs (100 мкмоль/л) в течение 1 часа в темноте при комнатной температуре, с дальнейшим промыванием раствором CPW. Затем протопласты обработали трипсин-EDTA (0,25%, Sigma-Aldrich) в растворе CPW (1:4) в течение 5 минут с дальнейшим промыванием раствором CPW и финальным суспендированием в растворе CPW (500 мкл).
Инкубация табачных протопластов с флуоресцентно-мечеными пептидами
[0094] Основной раствор флуоресцентно-меченных mTPs или cTPs (100 мкмоль/л), приготовленный с оптимальным количеством стерильной воды, добавили к суспензии протопластов до финальной концентрации 20 мкмоль/л. Каждую суспензию инкубировали при комнатной температуре в течение 1 часа в темноте. После инкубации добавили 25% Trypsin EDTA на 5 минут и раствор центрифугировали в течение 2 минут при 120 g. Таблетку повторно суспендировали в свежей MaMg среде, и добавили 1,5 мкл MitoTracker® Orange CM-H2TMRos (М7511, Invitrogen) на 15 минут, с дальнейшим центрифугированием в течение 2 минут при 120 g. Протопласты поместили на слайды в 1% низкоплавкий агар (2:1 отношение агара к протопластной суспензии) для конфокальной микроскопии (Olympus; both XY cross section and XYZ depth images).
Инкубация микроспор с флуоресцентно-мечеными пептидами
[0095] Микроспоры (500 мкл 106/мл смеси) инкубировали с 180 мкл флуоресцентно-меченных mTPs или cTPs (100 мкмоль/л) в течение 1 ч в темноте при комнатной температуре, с дальнейшим промыванием раствором NPB-99. Затем микроспоры отрабатывали трипсин-EDTA (0,25%, Sigma-Aldrich) в растворе NPB-99 (1:4) в течение 5 минут с дальнейшим промыванием раствором NPB-99 и окончательным суспендированием в растворе NPB-99 (500 мкл).
Инкубация клеток MDCK с флуоресцентно-мечеными пептидами
[0096] Клетки MDCK, выращенные в апикальных камерах проницаемых носителей Transwell™ диаметром 12 мм инкубировали с 80 мкл флуоресцентно-меченных mTPs или cTPs (100 мкмоль/л) и 320 мкл среды Dulbecco′s Modified Eagle Medium (DMEM) в течение 1 ч в темноте при комнатной температуре, с дальнейшим промыванием 400 мкл DMEM.
Инкубация клеток Caco-2, F1112 и MG с флуоресцентно-мечеными пептидами
[0097] Флуоресцентно-меченные mTPs (100 мкмоль/л) в различных концентрациях добавляли к эпителиальному клеточному солевому раствору для получения финального рабочего объема 400 мкл. Финальные концентрации, добавленные к Caco-2, F1112 и MG клеточным монослоям, согласно вышеприведенному описанию, составили 17 мкмоль/л, 9 мкмоль/л и 4 мкмоль/л. Клетки инкубировали с пептидами в течение 1 ч в темноте при 37°C в атмосфере с влажностью 95% с содержанием 5% CO2. В конце инкубационного периода, клеточный монослой трижды промыли эпителиальным клеточным солевым раствором и добавили 500 мкл эпителиального клеточного солевого раствора.
Конфокальная микроскопия
[0098] Клетки исследовали с помощью конфокального микроскопа (Nikon C1, Nikon Canada Inc. или Olympus FluoView™) для анализа локализации флуоресцентно-меченных mTPs или cTPs (длина волны возбуждения 490 нм / длина волны эмиссии 520 нм). Хлоропласты идентифицировали по аутофлуоресценции. Флуоресцентный краситель MitoTracker® Orange CM-H2TMRos (М7511, Invitrogen) использовали для окраски митохондрий (длина волны возбуждения 554 нм / длина волны эмиссии 576 нм). Эмиссию флуоресценции собирали в z-конфокальных плоскостях 10-15 нм и анализировали с помощью программы EZ-C1 версии 3.6 (Nikon) или программы Olympus FluoView™ версии 2.0b (Olympus).
Фотометрические исследования клеток
[0099] Потребление клетками меченых пептидов количественно определяли с помощью фотометрической системы детектирования (PTI). Возбуждающее сканирование проводят для определения наличия потребления по характеристическим пикам на соответствующих длинах волн и для определения изменения количества в зависимости от дозировки по сравнению с непомеченными клетками. Затем проводят сканирование по времени на длине волны, оптимальной для возбуждения и эмиссии, для количественного определения общего потребления, используя 20 клеток/просмотр/повтор. Подсчитывают количество клеток, демонстрирующих флуоресценцию.
Результаты
[00100] Из пятидесяти четырех синтезированных пептидов-кандидатов, помеченных флуоресцеином и инкубированных протопластами тритикале, было обнаружено десять органоидно-направленных пептидов (oTPs), как проникающих через клеточную мембрану, так и локализирующих хлоропласты или митохондрии, как показано на Фиг. 1А-В и 2А-С. Последовательности этих десяти пептидов представлены в таблицах 3 и 4.


[00101] Проникновение меченых oTP сквозь клеточную мембрану и локализация в хлоропластах или митохондриях также наблюдали в протопластах табака с помощью конфокальной микроскопии (Olympus). Пептиды mTP2 (SEQ ID NO: 2) и mTP3 (SEQ ID NO: 3) локализовали митохондрии (Фиг. 3A-D) а пептиды cTP1 (SEQ ID NO: 6), cTP2 (SEQ ID NO: 7), cTP4 (SEQ ID NO: 9) и cTP5 (SEQ ID NO: 10) локализовали хлоропласты (Фиг. 4A-D).
[00102] Десять оТР идентифицированных как обладающие свойствами как проникновения в клетку, так и направленности на органоиды (mTP1-mTP5, таблица 3 и cTP1-сТР5, таблица 4) также проверили на других типах клеток, включая выделенные культуры микроспор, альтернативную по отношению к мезофильным протопластам систему культуры растительных клеток, поддерживающую регенерацию целого растения. Эмбриогенные микроспоры становятся многоклеточными и дают начало эмбрионам, регенерирующим в гаплоидные и двойные гаплоидные растения (Jose, M.S.-S. and N. FePHKndo, How microspores transform into haploid embryos: changes associated with embryogenesis induction and microspore-derived embryogenesis, Physiologia Plantarum (2008) 134(1): 1-12). Трансгенные растения могут быть созданы из выделенной культуры микроспор пшеницы и тритикале с помощью протокола ядерной клеточно-проницаемой пептидной микроспорной трансфекции (Chugh, А., Е. Amundsen, and F. Eudes, Translocation of cell-penetrating peptides and delivery of their cargoes in triticale microspores. Plant Cell Reports (2009) 28(5): 801-810).
[00103] Десять флуоресцеин-меченых оТР, идентифицированных в таблицах 3 и 4, инкубировали с микроспорами тритикале и наблюдали микроспоры с помощью конфокальной микроскопии (Nikon) согласно вышеописанной процедуре. Было обнаружено, что десять оТР могут проникать в изолированные микроспоры, как видно на Фиг. 5А-В и 6А-С.
[00104] Флуоресцеин-меченые mTP, перечисленные в таблице 3, также инкубировали с клетками собачьих почек Madin-Darby canine kidney (MDCK) и наблюдали эти клетки с помощью конфокальной микроскопии (Nikon) согласно вышеописанной процедуре. Как показано на Фиг. 7, 8А-С, 9А-С и 10, все проверенные mTP обладают свойством клеточного проникновения по отношению к клеткам MDCK. Специфическая направленность на митохондрии была обнаружена для mTP1 (SEQ ID NO: 1), mTP3 (SEQ ID NO: 3) и mTP5 (SEQ ID NO: 5) (Фиг. 7, 8A-C, 9A-C), тогда как неспецифическая митохондриальная локализация наблюдалась для mTP2 (SEQ ID NO: 2) и mTP4 (SEQ ID NO: 4) (Фиг. 10).
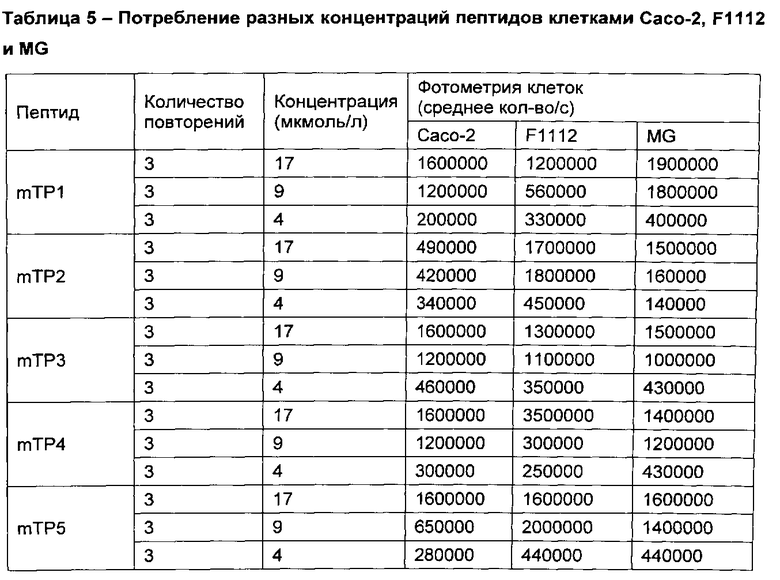
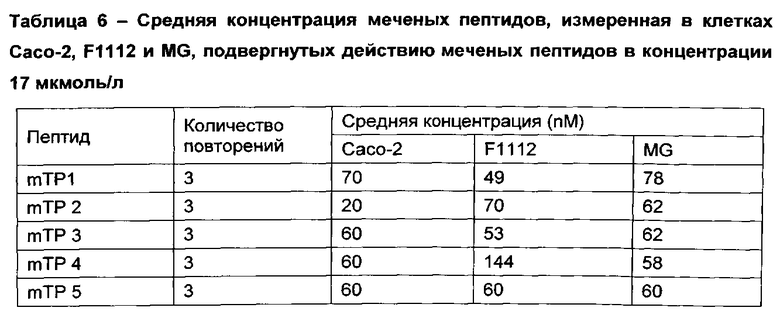
[00105] Флуоресцеин-меченые mTP, перечисленные в таблице 3 также инкубировали с клетками Caco-2 (линия эпителиальных клеток человеческого кишечника), F1112 (линия клеток коровьего кишечника) и MG (коровья молочная железа). Потребление меченых пептидов измеряли фотометрическим способом, по вышеописанной процедуре. В таблице 5 показаны результаты потребления меченых пептидов при использовании разных концентраций пептидов (4 мкмоль/л, 9 мкмоль/л или 17 мкмоль/л). Фоновая аутофлуоресценция клеточных линий составляет приблизительно 1×105 раз/с. В таблице 6 показана средняя концентрация пептида, измеренная в клетках при концентрации пептидов 17 мкмоль/л.
Пример 3 - ДНК-связующие свойства пептидов
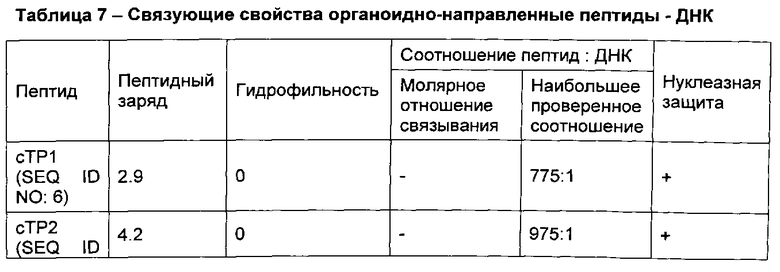
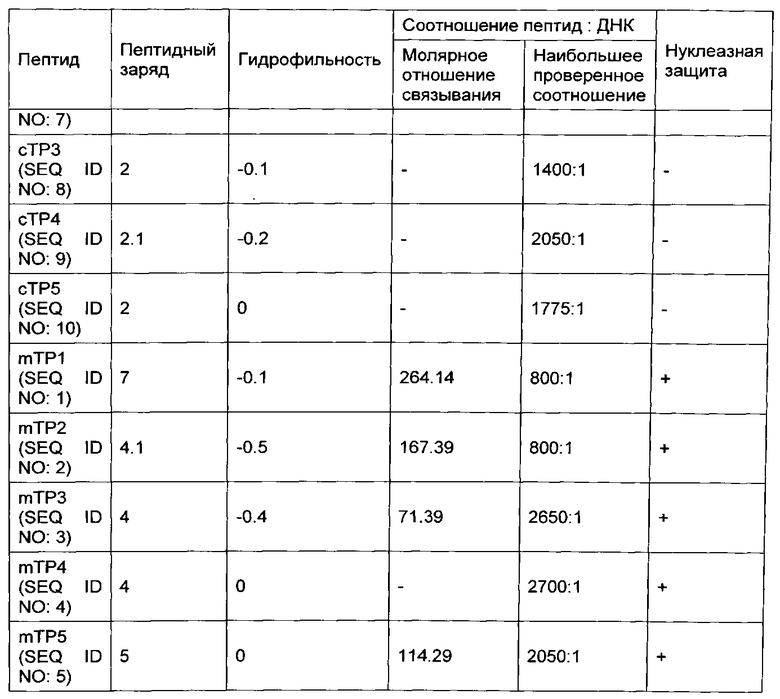
[00106] Десять не меченых оТР последовательностей, идентифицированных в качестве обладающих свойствами клеточной проницаемости и органоидной направленности (таблицы 3 и 4), проверяли с помощью анализа гелевого сдвига и анализа нуклеазной защиты на способность не ковалентно связывать нуклеиновые кислоты. Результаты этих анализов представлены в таблице 7 ниже.
Анализ гелевого сдвига
[00107] Анализ гелевого сдвига (EMSA) применяется для определения минимальной концентрации пептида, необходимой для связывания плазмидной ДНК соответствующего сдвига при электрофорезе. Очищенную линеаризованную плазмидную ДНК (100 нг линейной двухспиральной ДНК, 6,8 кб) смешивали с повышенной концентрацией каждого из десяти оТР, перечисленных в таблицах 3 и 4, в соответствии с рассчитанным возрастающим соотношением зарядов пептид:ДНК (1:1, 2:1, 3:1, 4:1, 5:1, и т.д.) до наблюдения полного сдвига плазмидной ДНК при электрофорезе. ДНК доводили до финальной концентрации 100 нг/мкл в стерильной воде. Конечный объем каждой реакции составил 25 мкл и инкубацию для образования комплекса проводили в течение 30 минут, после чего проводили электрофорез на 1% агарозном геле, окрашенном бромидом этидия.
Анализ нуклеазной защиты
[00108] Десять оТР, перечисленных в таблицах 3 и 4, смешали с плазмидной ДНК, как описано для анализа гелевого сдвига. Для анализа нуклеазной защиты, к смеси (50 мкл) добавляли 5 мкл ДНКse I (PHKse-free ДНКse set; Qiagen, Valencia, СА, USA). Смесь инкубировали при комнатной температуре в течение 15 минут и затем инкубировали на льду в течение 5 минут. Плазмид-пептидную диссоциацию и очищение плазмиды проводили с помощью коммерчески доступного набора для очищения ДНК (QIAquick™ PCR purification kit; Qiagen). ДНК разводили в стерильной воде. Аликвоту 6 мкл использовали для электрофореза на 1% агарозном геле.
Результаты
[00109] Как видно из таблицы 7, четыре из пяти mTP пептидов вызвали сдвиг ДНК при электрофорезе, что указывает на связывание с ДНК. Оставшиеся оТР перечисленные в таблице 7, не продемонстрировали сдвиг при проверенных соотношениях пептид: ДНК. Кроме того, результаты анализа нуклеазной защиты показывают, что органоидно-направленные пептиды, имеющие катионный заряд ≥2,9, защищают ДНК от деградации нуклеазы. Эти данные свидетельствуют о том, что оТР с катионным зарядом ≥2,9 обладают способностью нековалентно связывать ДНК, что предполагает возможность использовать такие пептиды для доставки нуклеиновых кислот к определенным органоидам растительных клеток.
Пример 4 - Свойства пептидов по доставке ДНК
[00110] Десять не меченых oTPs, перечисленных в таблицах 3 и 4, проверяли на их способность доставлять биологически активную ДНК к хлоропластам или митохондриям с помощью анализа трансфекции репортерного конструкта oTP-GFP. оТР смешивали с двухспиральным (ds) ДНК конструктом, кодирующим Aequorea victoria зеленый флуоресцентный белок (GFP) для образования комплекса. Образовавшиеся плазмидо-пептидные нанокомплексы инкубировали с мезофильными протопластами тритикале, микроспорами, или клетками MDCK, Caco-2, F1112 или MG. Обнаружение флуоресцентных сигналов с помощью конфокальной микроскопии и/или фотометрии говорит о том, что dsДНК транспортированы в органоиды и произошла кратковременная экспрессия GFP. Кроме того, экспрессию генов можно измерить с помощью количественной PCR в реальном времени для определения численности gfp mPHK.
Конструкт dsДНК для экспрессии в митохондрии
[00111] Митохондриальная репортерная плазмида пшеницы aadA16GFP (pWMaadA16GFP, Фиг. 11) является трансформационным вектором из 4587 пар оснований, специфичной для митохондрий пшеницы, и нацелена на включение в четвертый повторяющийся участок между trnfM и rrn18 генными кластерами, который повторяется три раза в митохондриальном геноме Triticum aestivum. Место включения находится в митохондриальном геноме Triticum aestivum у нуклеотидов 300805-300878 и 300880-302834 (GenBank accession No. АР008982.1). Сайт множественного клонирования вводится со следующей за ним вставкой целевой последовательности trnfM. Маркерным геном отбора является гибридный ген aad-gfp с органоидно-специфичным кодоном, облегчающий способ двойной селекции по устойчивости к спектиномицину посредством образования aadA и визуального обнаружения с помощью GFP флуоресценции (GenBank accession No. АВХ39486; Khan and Maliga, Nat Biotechnol. (1999 Sep) 17(9): 910-5). Ген маркера отбора управляется митохондриальным atpA генным промотором Triticum aestivum (GenBank accession No. X54387.1). Гибридный ген aad-gfp оканчивается терминирующей последовательностью TpsbA, происходящей от митохондриального генома Triticum aestivum у нуклеотидов 62871-62565 (GenBank accession No. АР008982.1).
Конструкт dsДНК для экспрессии в хлоропластах
[00112] Хлоропластная репортерная плазмида пшеницы aadA16GFP (pWCaadA16GFP, Фиг. 12) является трансформационным вектором из 4212 пар оснований, специфичной для пластидов пшеницы, и нацелена на включение в обращенные повторяющиеся участки trnl-tPHK пластидного генома Triticum aestivum у нуклеотидов 92850-93727 и 93794-94671 (GenBank accession No. АВ042240.3). Сайт множественного клонирования вводится со следующей за ним вставкой целевой последовательности trnl. Маркерным геном отбора является гибридный ген aad-gfp с органоидно-специфичным кодоном, облегчающий способ двойной селекции по устойчивости к спектиномицину посредством образования aadA и визуального обнаружения с помощью GFP флуоресценции (GenBank accession No. АВХ39486; Khan and Maliga, Nat Biotechnol. (1999 Sep) 17(9): 910-5). Ген маркера отбора управляется пластидным (psbA) генным промотором Triticum aestivum у нуклеотидов 1282-1153 (GenBank accession No. АВ042240.3). Гибридный ген aad-gfp оканчивается терминирующей последовательностью риса psbA, происходящей от вектора хлоропластной трансформации pVSR326 у нуклеотидов 4014-4387 (GenBank accession No. AF527485.1).
Трансформация протопластов gfp репортером
[00113] Конструкт dsДНК (pWMaadA16GFP для митохондриальной экспрессии или pWCaadA16GFP для экспрессии в хлоропластах) комбинировали с mTP (для митохондриальной экспрессии) или сТР (для экспрессии в хлоропластах) в конечном объеме 100 мкл CPW раствора. Для экспериментов с использованием mTP1 (SEQ ID NO: 1), mTP2 (SEQ ID NO: 2), mTP3 (SEQ ID NO: 3), или mTP5 (SEQ ID NO: 5), пептиды (масштабированные от 100 нг, до четырехкратной концентрации относительно той, что необходима для сдвига ДНК в анализе гелевого сдвига (таблица 7)) комбинировали с констуктом pWMaadA16GFP (5 мкг). Для экспериментов с использованием остальных оТР, пептиды (30 мкг) комбинировали с соответствующим конструктом dsДНК (1,5 мкг). Смесь инкубировали в течение 10 минут при комнатной температуре, затем инкубировали с выделенными мезофильными протопластами тритикале (500 мкл, 106 протопластов/мл, приготовленными как описано в примере 2) в течение 1 ч в темноте при комнатной температуре. Добавили раствор CPW (500 мкл) и инкубировали смесь в темноте в течение 24 ч. Клетки анализировали с помощью конфокальной микроскопии как описано в примере 2, с помощью окрашивания MitoTracker® Orange для визуализации митохондрий и хлорофильной аутофлуоресценции для визуализации хлоропластов.
Трансформация микроспор gfp репортером
[00114] Конструкт dsДНК (pWMaadA16GFP для митохондриальной экспрессии или pWCaadA16GFP для экспрессии в хлоропластах) комбинировали с mTP (для митохондриальной экспрессии) или сТР (для экспрессии в хлоропластах) в количествах, используемых в вышеописанных экспериментах по трансформации протопластов, в конечном объеме 100 мкл раствора NBP-99. Смесь инкубировали в течение 10 минут при комнатной температуре, затем инкубировали с выделенными микроспорами тритикале (500 мкл, 106 микроспор/мл, приготовленными как описано в примере 2) в течение 1 ч в темноте при комнатной температуре. Добавили раствор NBP-99 (500 мкл) и инкубировали смесь в темноте в течение 24 h. Клетки анализировали с помощью конфокальной микроскопии как описано в примере 2, с помощью окрашивания MitoTracker® Orange для визуализации митохондрий. Трансформация клеток MDCK gfp репортером
[00115] Конструкт dsДНК (pWMaadA16GFP) комбинировали с mTP в количествах, используемых в вышеописанных экспериментах по трансформации протопластов, в конечном объеме 100 мкл среды Dulbecco′s Modified Eagle Medium (DMEM). Смесь инкубировали в течение 10 минут при комнатной температуре, затем инкубировали с клетками MDCK (приготовленными как описано в примере 2) в 300 мкл DMEM при 37°C во влажной атмосфере, содержащей 5% CO2 в течение 24 ч. Клетки анализировали с помощью конфокальной микроскопии как описано в примере 2, с помощью окрашивания MitoTracker® Orange для визуализации митохондрий.
Трансформация клеток Caco-2, F1112 и MG gfp репортером
[00116] Конструкт dsДНК (pWMaadA16GFP, 100 мкл исходного раствора, 5 мкг) комбинировали с mTP1 (SEQ ID NO: 1) или mTP4 (SEQ ID NO: 4) (100 мкл немаркированного исходного раствора, 500 мкг) и инкубировали в течение 15 минут при 37°C.800 мкл аликвоту DMEM добавили к смеси и затем добавили 100 мкл этой смеси к каждому клеточному монослою (приготовленному как описано в примере 2) имевшему 500 мкл цельной среды. Клетки инкубировали при 37°C во влажной атмосфере с содержанием 5% CO2 в течение от 24 ч до 72 ч. Потребление и экспрессию GFP репортера измеряли через 40 ч с помощью фотометрической детекторно-визуализационной системы (PTI) как описано в примере 2. Клетки также анализировали с помощью конфокальной микроскопии как описано в примере 2 с помощью окрашивания MitoTracker® Orange для визуализации митохондрий. Экстракция РНК из трансфектированных микроспор
[00117] Микроспоры разрушали с помощью очищенного керамического шарика с агрессивным встряхиванием по мере таяния ткани. Добавили RLT buffer/B-Me (450 мкл) и взболтали образец. Образец нагревали при 55°C в течение 1 минуты и снова взбалтывали. РНК экстрагировали с помощью набора RNeasy™ Plant Mini Kit (Qiagen), включая в протокол колоночное усвоение ДНКse I. Конечный объем разбавления составил 40 мкл. РНК анализировали с помощью агарозной гель-хроматографии (чтобы убедиться в неизменности РНК) и спектрофотометрии (для количественного измерения).
Синтез сДНК
[00118] сДНК синтезировали с помощью набора First Strand Synthesis kit (Invitrogen). РНК (1 мкг) добавляли к каждому образцу и следовали описанию производителя для синтеза, с тем исключением, что объем реакционной смеси увеличили с 20 мкл до 30 мкл. Образец negRT, содержащий все реагенты, кроме РНК, включали в синтез сДНКв качестве негативного контроля.
PCR в реальном времени
[00119] Стандартные кривые были построены для генов фактора элонгации 1а (EF1a) (intePHKI control) и зеленого флуоресцентного белка (GFP) (тест). Кривая EF1a построена путем сложения 6 мкл каждого образца сДНК (за исключением контроля negRT), и дальнейшего проведения серийного разбавления по 0,5 для еще 5 разбавлений. Стандартная кривая GFP была построена с помощью плазмидной ДНК, использовавшейся для трансфекции (13 нг/мкл плазмида, из которых 3 мкл (40 нг) использовали для реакции PCR, с дальнейшей серией разбавления по 0,5 для еще 5 образцов).
[00120] Реакции PCR в реальном времени проводили с помощью QuantiTect™ SYBR™ Green PCR Master Mix (Qiagen) в объеме реакции 20 мкл. Реакцию каждого образца повторяли трижды и для каждой реакции использовали 3 мкл раствора. Использовали следующую цикличность: 95°C в течение 15 минут, 40 повторений при 94°C в течение 15 с, 58°C в течение 30 с, 72°C в течение 30 с. По окончании PCR реакций строили кривые диссоциации. Для каждого образца усредняли три дата-точки и вычисляли стандартное отклонение. Стандартные кривые строили, откладывая среднее значение СT в зависимости от логарифма количества ДНК в каждом образце таким образом, чтобы можно было оценить эффективность PCR каждого набора. Наборы усиливали со сравнительной эффективностью для прямого сравнения значений CT.
Результаты
[00121] Как видно на Фиг. 13А-С и 14А-С, mTP4 (SEQ ID NO: 4) и mTP2 (SEQ ID NO: 2) могут служить посредниками при трансфекции митохондрий мезофильных протопластов тритикале. При конфокальной микроскопии митохондрии выглядели флуоресцентно-зелеными, что говорит о том, что митохондрии в mTP трансфектированных протопластах экспрессируют GFP. Экспрессия GFP была также обнаружена в митохондриях клеток Caco-2, F1112 и MG, трансфектированных митохондриальным gfp-репортерным конструктом в присутствии mTP1 (SEQ ID NO: 1) и mTP4 (SEQ ID NO: 4) с помощью фотометрического исследования, проведенного как описано в Примере 2. Однако, как видно из таблицы 8, сила сигнала, наблюдаемого при трансфекции в присутствии mTP4 (SEQ ID NO: 4) была небольшой и флуоресценция не наблюдалась. Напротив, сила сигнала, наблюдаемого при трансфекции в присутствии mTP1 (SEQ ID NO: 1) была выше, чем в случае mTP4 (SEQ ID NO: 4) и во всех клетках наблюдалась флуоресценция. Конфокальное изображение трансфектированных клеток Caco-2 и F1112 подтверждает локализацию экспрессии gfp в митохондрии (Фиг. 15 и 16).

[00122] Кроме того, в результате анализа количественной PCR (qRT-PCR) в реальном времени было подтверждено, что GFP экспрессируется митохондриями микроспор и протопластами, трансфектированными gfp-репортерным конструктом в присутствии глТР1 (SEQ ID NO: 1), mTP2 (SEQ ID NO: 2), mTP3 (SEQ ID NO: 3), mTP4 (SEQ ID NO: 4) или mTP5 (SEQ ID NO: 5). Нормализованная представленность gfp mPHK трансфектированных митохондрий показала 0,1-0,7 кратное увеличение (среднее из 4 повторных экспериментов) в микроспорах (Фиг. 17) и 32-159 кратное увеличение (среднее из 4 повторных экспериментов) в протопластах (Фиг. 19) по сравнению с представленностью intePHKI контрольного фактора элонгации 1а (EF1a) mPHK. Далее, анализ количественной PCR (qRT-PCR) в реальном времени подтвердил, что GFP экспрессируется пропластидами микроспор и хлоропластами протопластов, трансфектированными gfp репортерным конструктом в присутствии cTP1 (SEQ ID NO: 6), сТР2 (SEQ ID NO: 7), cTP3 (SEQ ID NO: 8), cTP4 (SEQ ID NO: 9) или cTP5 (SEQ ID NO: 10). Нормализованная представленность gfp mPHK трансфектированных пропластидов показала 0,10-0,37 кратное увеличение (среднее из 4 повторных экспериментов) в микроспорах (Фиг. 18), и нормализованная представленность gfp mPHK трансфектированных протопластов показала 24-122 кратное увеличение (среднее из 4 повторных экспериментов) в протопластах (Фиг. 20), по сравнению с представленностью intePHKI контрольного фактора элонгации 1а (EF1a) mPHK.
Пример 5 - Развитие растений из трансформированных микроспор
[00123] Микроспоры, выделенные из сорта тритикале Ultima трансфектировали с митохондриальной репортерной плазмидой WMaadAGFP (Пример 4) в присутствии mTP1 (SEQ ID NO: 1), или с хлоропластной репортерной плазмидой WCaadAGFP (Пример 4) в присутствии cTP1 (SEQ ID NO: 6). Растения регенерировали из трансформированных микроспор и выращивали со спектиномициновой селекцией, и исследовали с помощью количественной PCR для измерения числа копий зеленого флуоресцентного белка (GFP) ДНК в трансфектированных митохондриях или хлоропластах. Растения, позитвные к aadA-gfp трансфекции, выращивали в почве без спектиномициновой селекции для проверки реверсии к дикому типу. Характеристики полученных растений приведены в таблице 9 ниже.
Выделение микроспор
[00124] Ости тритикале сорта Ultima удаляли ножницами в вытяжном шкафу с ламинарным потоком. Початки (восемь для выделения микроспор и четыре для сбора завязей) стерилизовали 10% отбеливателем (5,25% гипохлорит натрия) в течение 3 минут и промывали четыре раза по 1 минуте стерильной водой двойной дистилляции с постоянным перемешиванием. Внешнюю шелуху удаляли и цветки восьми початков асептически иссекали и переносили в стерильную охлажденную чашку Воринга объемом 110 мл (VWR intePHKtional, #58983-093), содержащую 50 мл фильрованного стерилизованного экстракционного раствора (0,4 М маннитол, GEM (Germination of Embryo of Monocots) (F. Eudes, S. Acharya, A. Laroche, L.B. Selinger & K.-J. Cheng. A novel method to induce direct somatic embryogenesis, secondary embryogenesis and regeneration of fertile green cereal plants. Plant Cell, Tissue and Organ Culture (2003) 73: 147-157), 10 ммоль/л 2-(N-морфолино)этансульфоновой кислоты (MES), и 100 ммоль/л Fe-EDTA, pH 6.5) жидкой среды при 4°C. Цветки дважды перемешивали в течение 7 с низкой скоростью (18000 об/мин). Суспензию пропустили через 1 М сита и затем 100 мкМ стерильный фильтр (VWR IntePHKtional, #СА21008-950) в две 50 мл пробирки для центрифуги (каждая 25 мл). Чашку смыли 50 мл экстракционным раствором при 4°C и пропустили через 100 мкМ фильтр и добавили к первой части в 50 мл пробирки. Затем клетки центрифугировали (100 × g в течение 5 минут при 4°C) с помощью вращающегося лопастного ротора. Надосадочную жидкость слили и таблетки микроспор объединили в одной 50 мл пробирке и повторно суспендировали в 50 мл холодного экстракционного раствора. Клетки снова центрифугировали (100 × g в течение 5 минут при 4°C), слили надосадочную жидкость и перенесли таблетку (в приблизительно 5 мл) в 15 мл пробирку. Таблетку повторно суспендировали в 15 мл индукционной среды (раствор NPB-99 с добавкой 2 мкмоль/л глутатиона и 10 мг/л Larcoll™ (арабиногалактан)) и промыли и центрифугировали в таких же условиях, как было описано выше. Надосадочную жидкость слили и таблетку повторно суспендировали в от 5 до 6 мл 20% мальтозы, затем на поверхность мальтозного слоя осторожно добавили 1 мл индукционной среды и центрифугировали пробирку при 100 g в течение 13 минут (мальтозное градиентное очищение). Слой микроспор, образованный на разделе фаз, собрали в новую 15 мл пробирку. Пробирку заполнили индукционной средой и снова центрифугировали при 150 g в течение 5 минут. Надосадочную жидкость слили и клетки повторно суспендировали в общем объеме 1,4 мл. При каждой экстракции и очищении микроспор, концентрацию клеток определяли с помощью гемоцитометра. Каждая экстракция микроспор приводила к созданию 15-20 экспериментальных образцов.
Получение dsДНК-oTP комплексов:
[00125] Получение проводили с использованием плазмид pWMaadAI 6GFP и pWCaadA16GFP (Пример 4) для трансфекции органоидов. pWMaadA16GFP перерабатывались рестрикционными ферментами Avrll и Spel, pWCaadA16GFP перерабатывались рестрикционными ферментами Aatll и Xmnl в соответствии с инструкциями NEB (New England Biolabs). Генетическая кассета (dsДНК) является гель-очищенной.
[00126] Для трансфекции митохондрий 1,5 мкг pWMaadA16GFP dsДНК и 7,5 мкг mTP1 (SEQ ID NO: 1) смешали в 100 мкл в 1,5 мл пробирке для центрифуги. Для трансфекции хлоропластов, 1,5 мкг pWCaadA16GFP dsДНК и 30 мкг cTP1 (SEQ ID NO: 6) смешали в 200 мкл в 1,5 мл пробирке для центрифуги. Перед использованием комплексы инкубировали в течение 15 минут при комнатной температуре.
Трансфекция микроспор
[00127] Комплексы dsДНК-oTP (100 или 200 мкл) добавляли к микроспорам, осторожно перемешивали и инкубировали с комплексами в течение 15 минут. Добавили 100 мкл индукционной среды (раствор NPB-99 с добавлением 2 мкмоль/л глутатиона и 10 мг/л Larcoll™ (арабиногалактан)) и инкубировали смесь в течение 45 минут при комнатной температуре. Трансфектированные микроспоры один раз промывали индукционной средой, центрифугировали и удалили надосадочную жидкость. Контрольную смесь, не содержащую ДНК и наноноситель, добавляли к двум экспериментальным образцам из каждой партии очищенных микроспор. Культуру микроспор возобновляли в соответствии с описанием в F. Eudes and Е. Amundsen, Isolated microspore culture of Canadian 6triticale cultivars. Plant Cell, Tissue and Organ Culture (2005) 82: 233-241.
Регенерация трансформированных растений
[00128] Трансфектированные микроспоры переносили с помощью пипетки (0,2 мл) в 35×10 мм чашки Петри, содержащие каждая 3,3 мл индукционной среды с 10% Ficoll™. Четыре или пять завязей от стерилизованных колосьев тритикале сорта Ultima добавляли в каждую чашку с микроспорами. Чашки запечатывали с помощью Parafilm™ и помещали в 150 мм чашки Петри вокруг открытой 50 мм чашки Петри, содержащей стерильную дистиллированную воду. 150 мм чашки также запечатывали с помощью Parafilm™ и инкубировали в темноте при 25°C в течение от 20 до 30 дней. Эмбрионы крупнее 0,5 мм удаляли из чашек Петри и помещали в среду GEM (20 мл в 10 см чашке Петри) (F. Eudes, S. Acharya, A. Laroche, L.B. Selinger & K.-J. Cheng. A novel method to induce direct somatic embryogenesis, secondary embryogenesis and regeneration of fertile green cereal plants. Plant Cell, Tissue and Organ Culture (2003) 73: 147-157). Чашки Петри снова запечатывали с помощью Parafilm™ и помещали на глубину 30 см под лампы Sylvania Gro-lux™ широкого спектра (40 ватт), излучающих 80 мкм m-2 s-1 (16-часовой световой период) при комнатной температуре 16°C.После приобретения эмбрионами зеленого цвета, их асептически переносили в 50 мл питательного субстрата (F. Eudes, S. Acharya, A. Laroche, L.B. Selinger & K.-J. Cheng. A novel method to induce direct somatic embryogenesis, secondary embryogenesis and regeneration of fertile green cereal plants. Plant Cell, Tissue and Organ Culture (2003) 73: 147-157) в сосуды Magenta™ (VWR IntePHKtional), в тех же условиях. После достижения растениями стадии 2-3 листов и достаточной корневой системы, их переносили на почву (4×8 Spencer-Lemaire Rootrainer™; Spencer-Lemaire Industries Ltd., Edmonton) и помещали в шкаф роста в тех же условиях, как и материнские растения. Через две недели после цветения, оценивали уровень плоидности проверкой набора семян.
Селекция с помощью антибиотиков
[00129] Спектиномициновую селекцию применяли к выбранным партиям культур микроспор и зеленых растений, выращиваемых в почве. В 1 партии, развивающиеся эмбрионы переносили в полуавтоматическую систему иммерсионной культурной среды RITA™ в возрасте 3 недель с помощью 200 мл жидкой среды GEM с добавкой 200 мкл PPM™, и добавляли 200 или 400 мг/л спектиномицина. Во 2 партии, к микроспорам добавляли первую дозу в 100 мг/л спектиномицина в начале культивирования. Через 3-4 недели развившиеся многоклеточные структуры переносили в полуавтоматическую систему иммерсионной культурной среды RITA™ и увеличивали концентрацию спектиномицина до 200 мг/л. Через две недели среду заменяли на свежую жидкую GEM с добавлением 200 мкл PPM™ (200 мл), и вносили третью дозу спектиномицина в 400 мг/л. Еще через две недели проросшие сеянцы (зеленые и пестрые) перенесли в Rootrainers™. Спектиномициновую селекцию не применяли к почве растений, развившихся из партий 1 и 2.
[00130] В последующих партиях микроспоры подвергали действию первой дозы размером 50 мг/л спектиномицина при начале культивирования. Через 3-4 недели, развившиеся многоклеточные структуры переносили в полуавтоматическую систему иммерсионной культурной среды RITA™ и увеличивали концентрацию спектиномицина до 100 мг/л. Через две недели среду заменяли на свежую жидкую GEM с добавлением 200 мкл PPM™ (200 мл), и вносили третью дозу спектиномицина в 200 мг/л). Еще через две недели проросшие сеянцы (зеленые и пестрые) перенесли в Rootrainers™. После этого спектиномициновую селекцию применяли к почве в концентрации 400 мг/л спектиномицина. Растения, культивируемые в почве, постоянно снабжали водой снизу с применением раствора спектиномицина 400 мг/л.
Экстракция геномных ДНК и РНК из регенерировавших зеленых растений
[00131] Образцы листьев разрушали с помощью очищенного керамического шарика при агрессивной встряске по мене оттаивания ткани. Добавляли RLT buffer/B-Me (450 мкл) и перемешивали образец. Образец нагревали при 55°C в течение 1 минуты и снова перемешивали. РНК экстрагировали с помощью AIIPrep™ ДНК/РНК Mini Kit (50) (Qiagen), с применением колоночного потребления ДНКазы I. Финальный объем разбавления составил 40 мкл. РНК оценивали с помощью агарозной гель-хроматографии (для уверенности в неизменности РНК) и спектрофотометрии (для количественной оценки ДНК и РНК).
Анализ SYBR™ Green qPCR для определения числа копий (копийности)
[00132] Анализ The SYBR™ Green real time PCR проводится как описано в Примере 4. Определенные значения CT применяют к стандартной кривой, для которой рассчитывают копийность относительно исходной ДНК по формуле кривой. Стандартные кривые получают, разбавляя митохондриальные или хлоропластные репортерные плазмиды (Пример 4) сериями по 6 образцов в разбавлении 1/10. Копии по стандартной кривой для митохондриальной репортерной плазмиды находятся в интервале от 882352/мкл до 0,8/мкл. Копии по стандартной кривой для хлоропластной репортерной плазмидй находятся в интервале от 234042/мкл до 0,2/мкл. Все образцы геномной ДНК количественно проанализированы на спектрофотометре, и образцы для анализа реального времени приготовлены так, чтобы во всех случаях содержать 2Х SYBR™ Green QuantiTect™ Master Mix (Qiagen) (12,5 мкл), Gfp4L Fwd primer (10 мкмоль/л, 1 мкл), Gfp4R Rev primer (10 мкмоль/л, 1 мкл), и ДНК (200 нг, 11 мкл). Все биологические образцы поверялись трижды. Цикличность была следующей: 95°C в течение 15 минут, 35 повторений при 95°C в течение 15 с, 60°C в течение 30 с, 72°C в течение 30 с. Полученные данные CT усреднили. Стандартные отклонения вычисляли для каждых трех повторений, отбрасывая аномальные значения. Стандартные кривые получили построением зависимости средних значений CT от логарифма количества ДНК в каждом образце. Средние значения CT подставляли в формулу, генерированную по регрессионной кривой каждой плазмиды (y=mx+b). Для стандартной кривой митохондриального репортера уравнение имеет вид y=-3,4845х+43,742, и значение R2 равняется 0,992. Для стандартной кривой хлоропласта уравнение имеет вид y=-3,256х+45,469 и значение R2 равняется 0,9705. Итоговое логарифмическое значение затем конвертировали в актуальные копии и сравнивали это значение с общим количеством копий ДНК в каждом 200 нг образце. Копии в 200 нг вычисляли по формуле:
Количество bp Ultima (19000 Mb) X 660 г/моль (вес bp)×109 нг/г.
Анализ Taq Man qPCR для определения числа копий
[00133] Реакции PCR в реальном времени проводили на 96-луночных планшетах с применением 7900НТ Fast Real Time PCR system (Applied Biosystems) и Qiagen химии. Пробу TaqMan для гена gfp пометили на 5′ конце с FAM™; пробу для гена рКАВА1 пометили на 5′ конце с VIC™. Обе пробы пометили тетраметилродамином (TAMRA™) на 3′ конце молекулы гасителя. Для каждой реакции 2 мкл ДНК, 12,5 мкл 2Х TaqMan Universal PCR Master Mix (Applied Biosystem, Foster City, CA), 0,4 мкмоль/л gfp и PKABA1 праймеры и добавили 200 нмоль/л каждой дважды меченой пробы, после чего реакции довели до финального объема 25 мкл с помощью H2O. PCR проводили следующим образом: 10 минут при 95°C, 40 циклов по 1 минуте при 95°C, 1 минуту при 58°C. Все реакции проводили дважды и повторяли на двух биологических образцах. Количество копий вычисляли с помощью формулы 
Результаты
[00134] Список растений, полученных из трансфектированных микроспор, приведен в таблице 9. Были получены зеленые, пестрые и альбиносные растения. В партии 1, в которой эмбрионы не подвергали действию спектиномицина до 3 недели после опыления, пестрый фенотип наблюдался у регенерировавших растений с большей частотой. Из следующих партий в основном получили смесь альбиносов и зеленых растений. Гаплоидные и двойные гаплоидные растения тритикале из партий 1 и 2 исследовали с помощью qPCR в момент первого переноса на почву (Rootrainers™).
Несколько линий тритикале из партий 1 и 2 идентифицировали с помощью qPCR (по способу SYBR™ Green или Taq Man) как имеющие позитивное свидетельство интеграции репортерного гена в геном органоида. Растения из партии 2 выращивали в почве в отсутствие спектиномицина, и было обнаружен их возврат к дикому типу в течение месяца, о чем свидетельствует уменьшение числа копий по результатам измерения qPCR, а также свидетельство того, что в тот момент цитоплазма оставалась гетеропластомной.
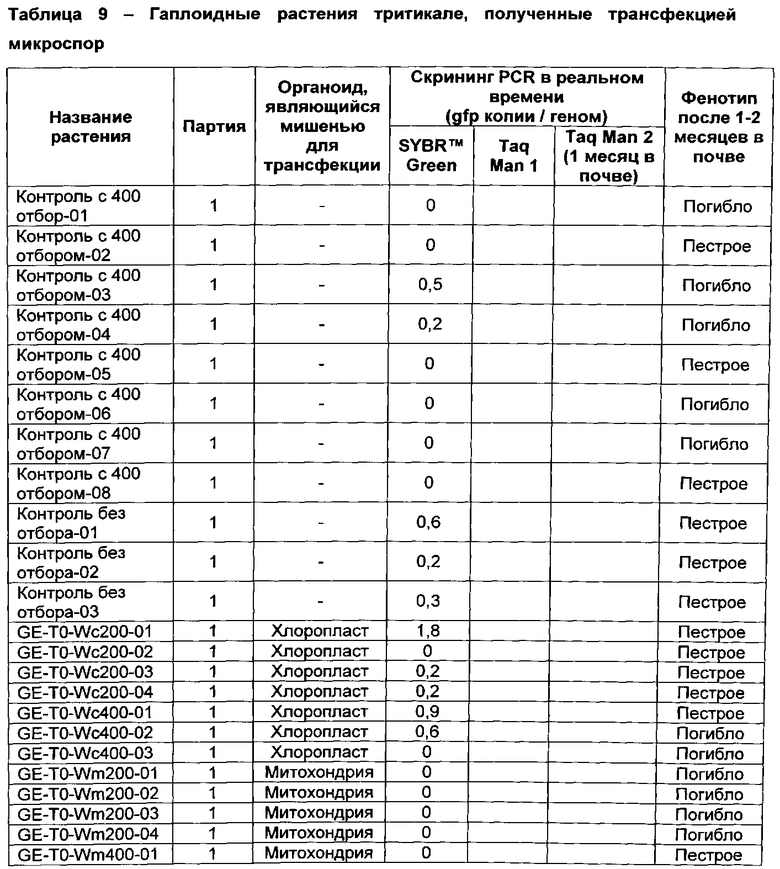
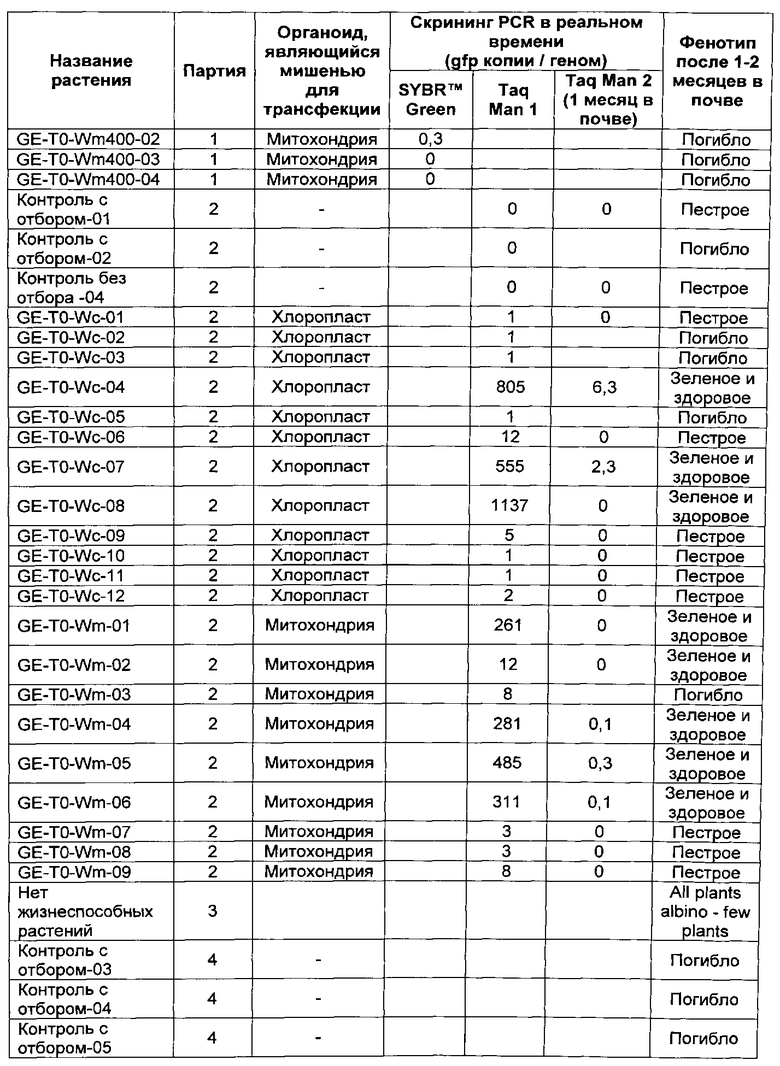
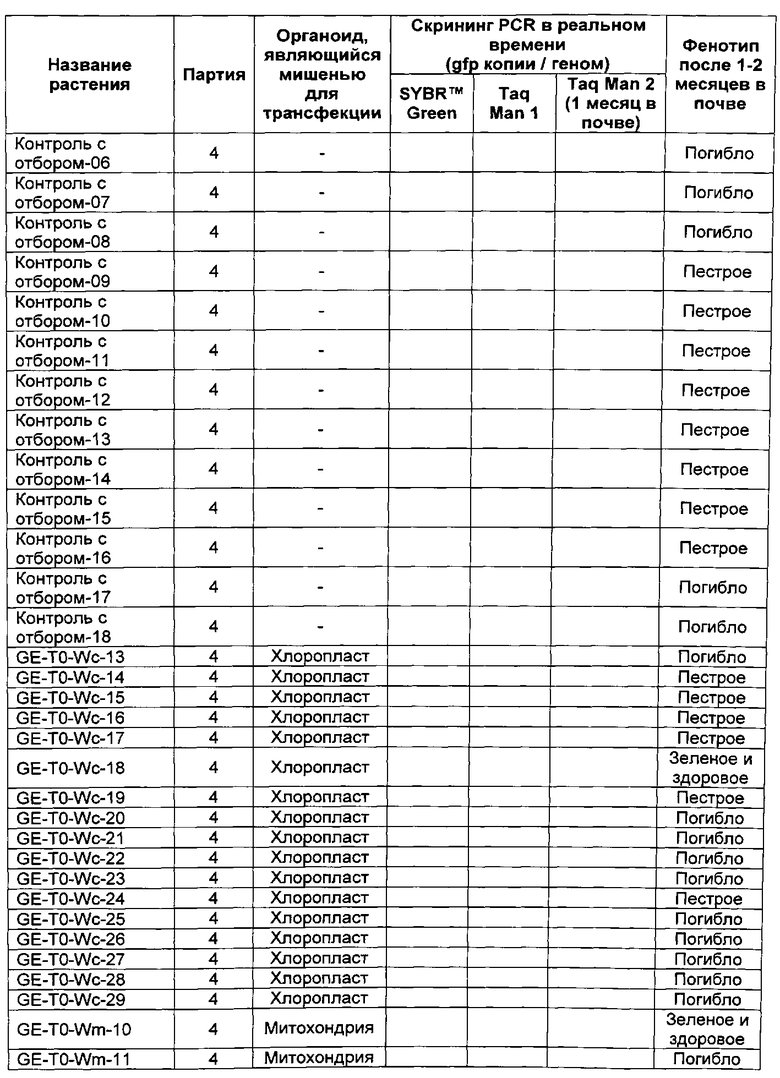
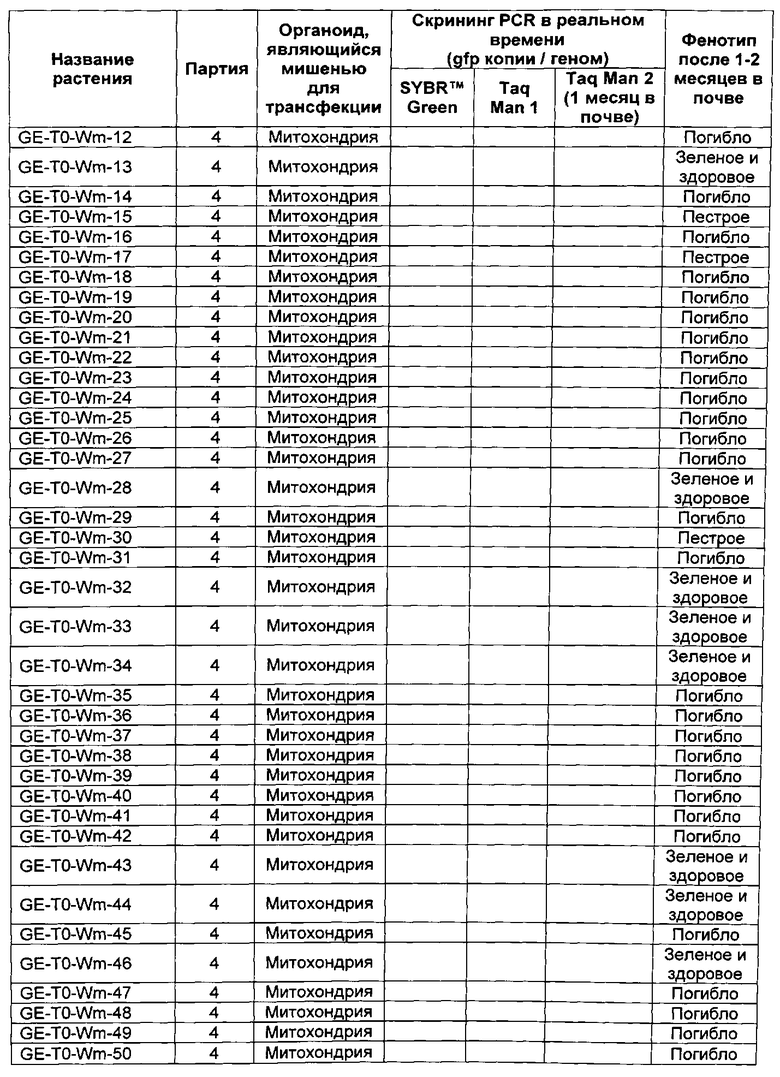
[00135] Варианты осуществления данного изобретения, описанные в этом тексте, являются иллюстративными и не являются ограничивающими. Различные модификации, очевидные для специалиста в данной области, являются включенными в объем изобретения. Объем формулы изобретения не должен быть ограничен вариантами осуществления данного изобретения, описанными в этом тексте, но должен пониматься в самом широком смысле в соответствии с общим описанием изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЙ МУТАНТ РЕКОМБИНАНТНОГО ИММУНОМОДУЛИРУЮЩЕГО БЕЛКА GANODERMA LUCIDUM И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2841540C2 |
| ПОЛУЧЕНИЕ БИОЛОГИЧЕСКИ АКТИВНЫХ БЕЛКОВ | 2007 |
|
RU2441911C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2742724C1 |
| КОНЪЮГАТЫ КВАНТОВОЙ ТОЧКИ С ПЕПТИДОМ-НОСИТЕЛЕМ, ПРИГОДНЫЕ ДЛЯ ВИЗУАЛИЗАЦИИ И ДОСТАВКИ МОЛЕКУЛ В РАСТЕНИЯ | 2012 |
|
RU2609637C2 |
| МОДИФИЦИРОВАННЫЙ ГЕНЕТИЧЕСКИ КОДИРУЕМЫЙ ФОТОСЕНСИБИЛИЗАТОР | 2013 |
|
RU2599443C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ МОДИФИКАЦИИ ЗАДАННОЙ ПОСЛЕДОВАТЕЛЬНОСТИ НУКЛЕИНОВОЙ КИСЛОТЫ-МИШЕНИ | 2012 |
|
RU2663354C2 |
| НОВЫЕ ФЛУОРЕСЦЕНТНЫЕ БЕЛКИ ИЗ ENTACMAEA QUADRICOLOR И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2395581C2 |
| ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ХРОМО- ИЛИ ФЛУОРЕСЦИРУЮЩИЙ МУТАНТНЫЙ ПОЛИПЕПТИД, ВЕКТОР ЭКСПРЕССИИ, КЛЕТКА, СПОСОБ ПОЛУЧЕНИЯ ХРОМО- ИЛИ ФЛУОРЕСЦИРУЮЩЕГО ПОЛИПЕПТИДА, НАБОР ДЛЯ ПОЛУЧЕНИЯ ХРОМО- ИЛИ ФЛУОРЕСЦИРУЮЩЕГО ПОЛИПЕПТИДА, ПРИМЕНЕНИЕ ПОЛИПЕПТИДА И ПРИМЕНЕНИЕ ПОЛИНУКЛЕОТИДА | 2002 |
|
RU2330067C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2611202C2 |
| СПОСОБЫ МОДУЛЯЦИИ ПРОВОДИМОСТИ УСТЬИЦА И РАСТИТЕЛЬНЫЕ ЭКСПРЕССИОННЫЕ КОНСТРУКЦИИ ДЛЯ ИХ ОСУЩЕСТВЛЕНИЯ | 2012 |
|
RU2664461C2 |



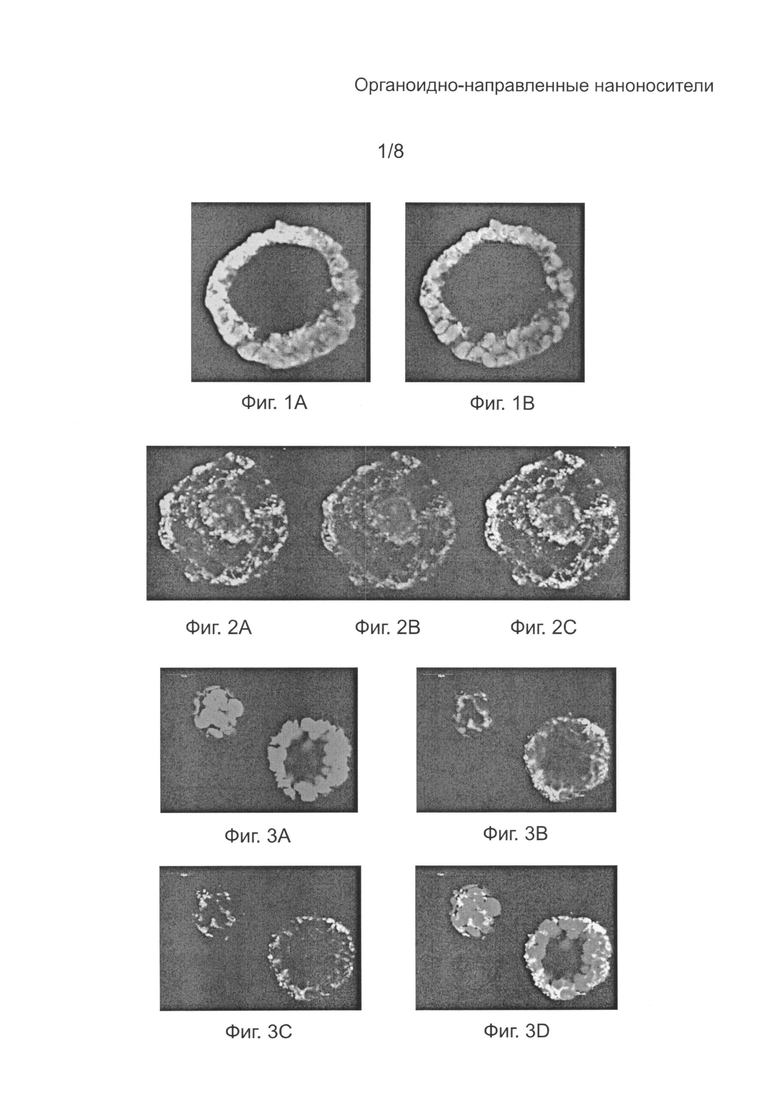
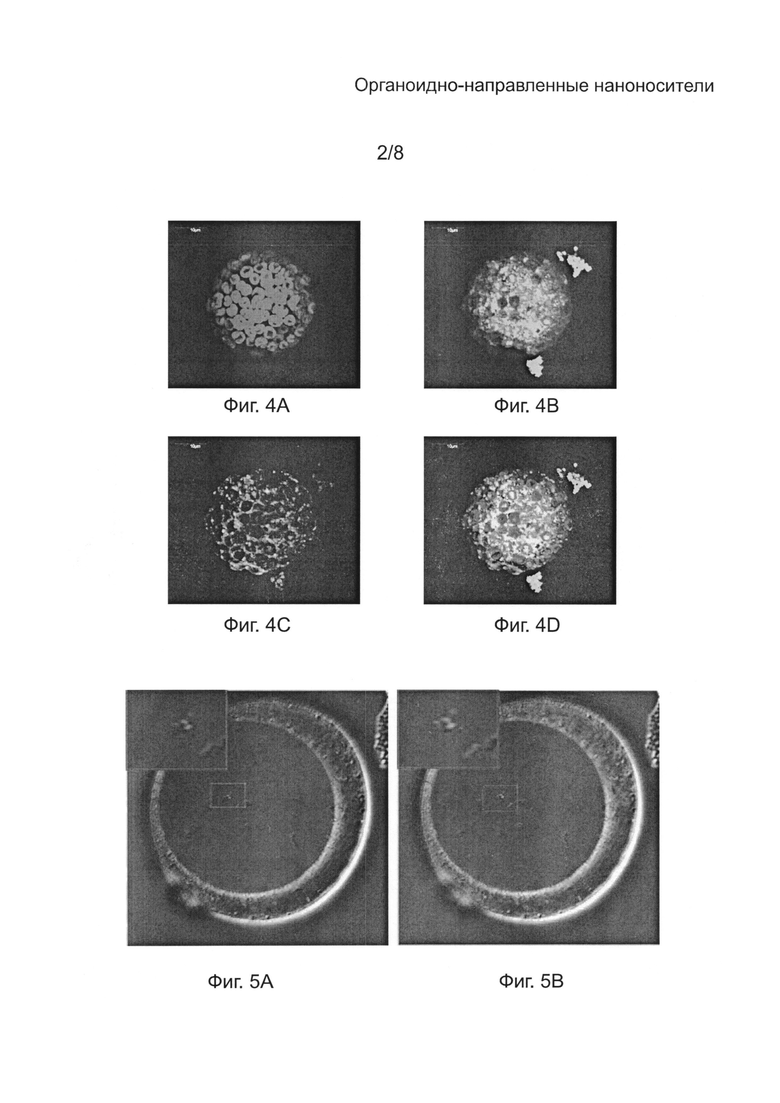

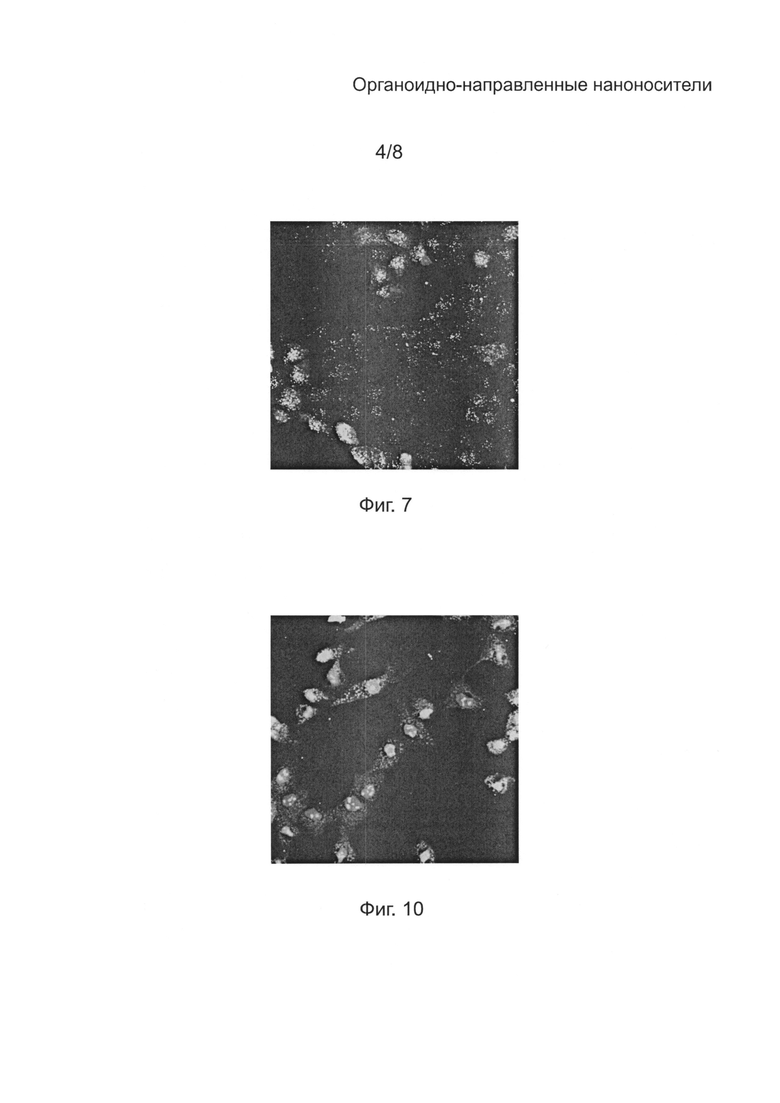
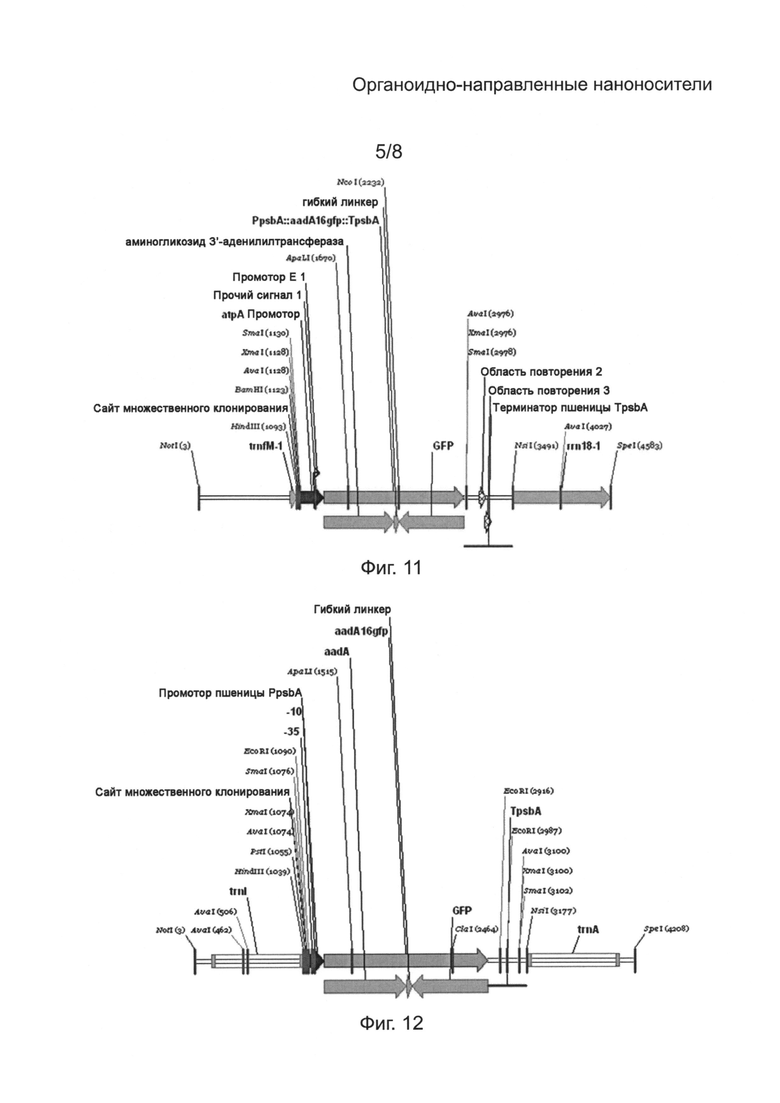
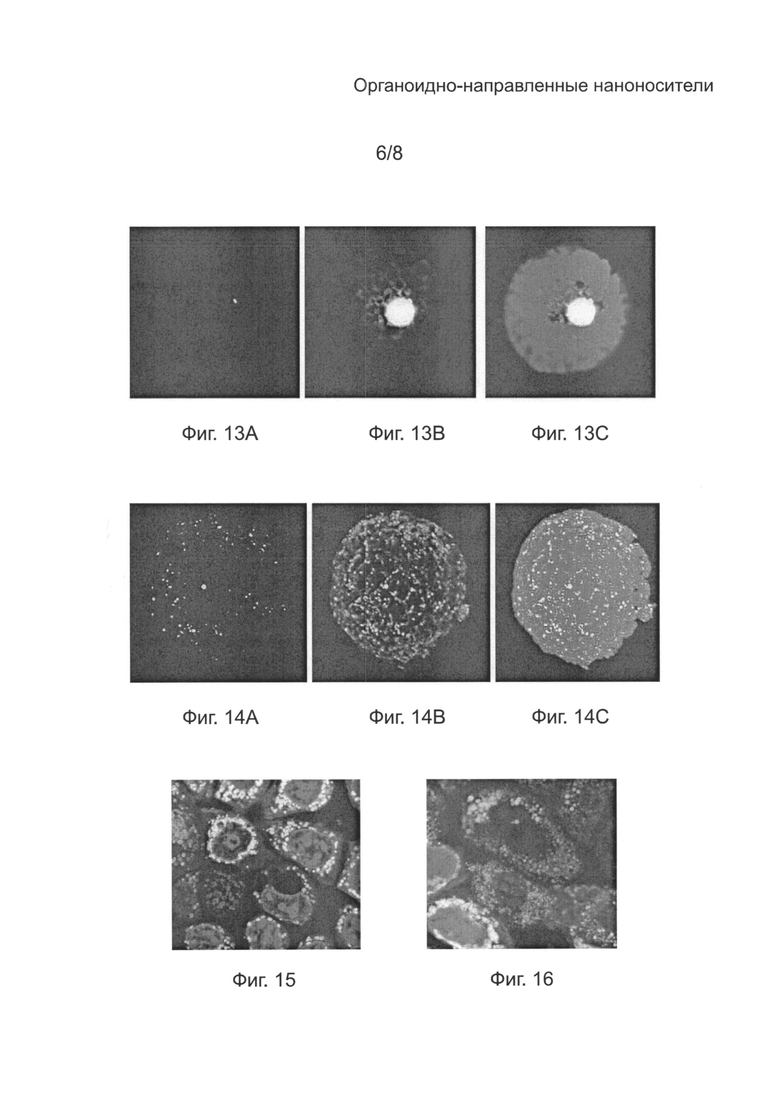
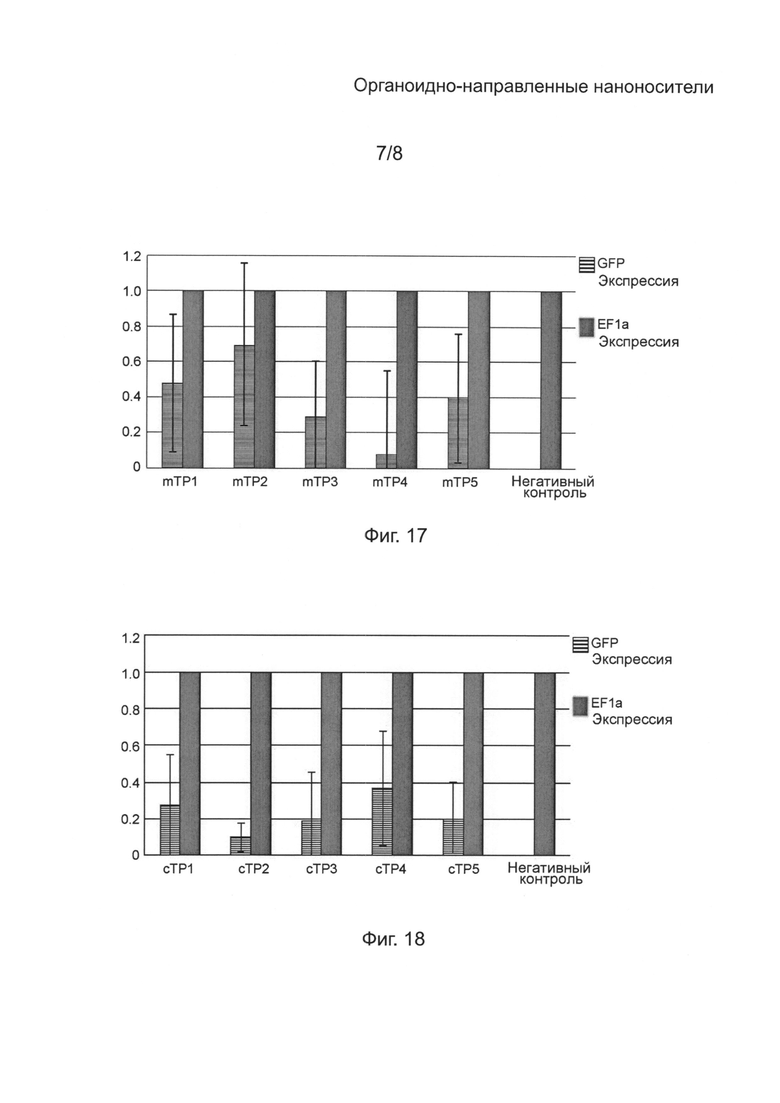
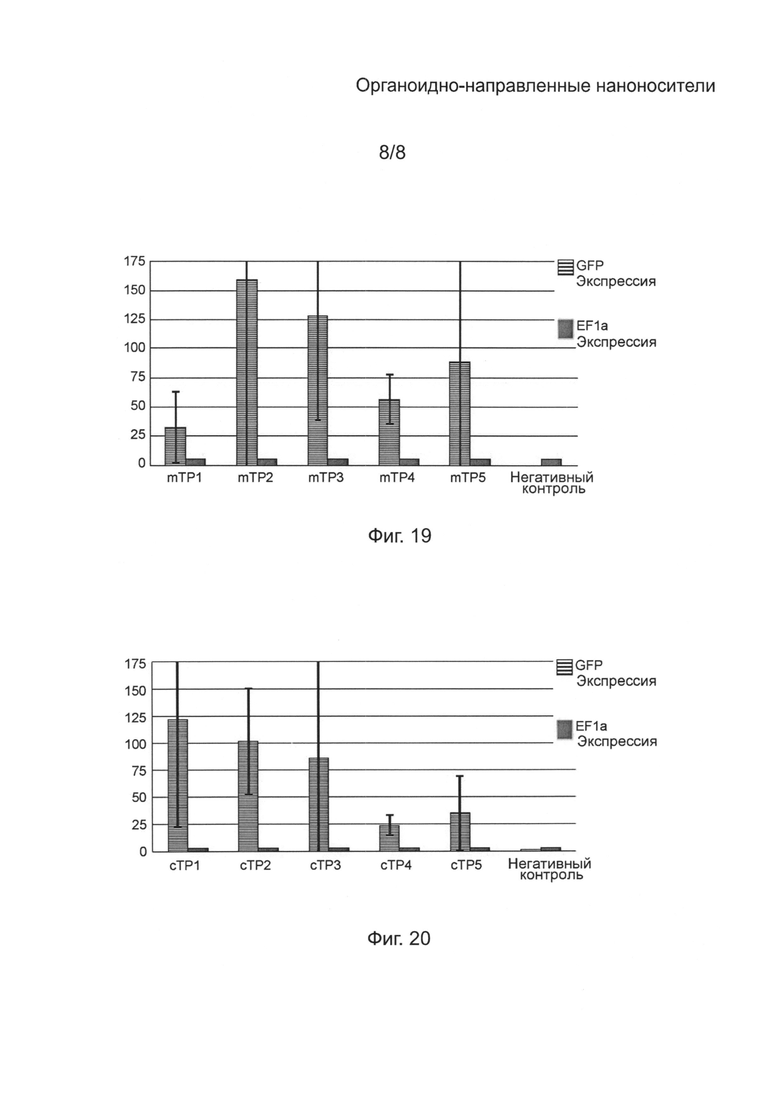
Изобретение относится к генной инженерии. Описан способ доставки нуклеиновой кислоты в митохондрию и генетической модификации клетки, включающий воздействие на клетку композицией, содержащей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный наноноситель, где наноноситель доставляет по меньшей мере одну нуклеиновую кислоту сквозь клеточную мембрану в митохондрию. Органоидно-направленный наноноситель является полипептидом, имеющим направленную на митохондрию пептидную последовательность, заряд от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5. Описан способ получения генетически модифицированного растения, включающий получение генетически модифицированной растительной клетки описанным способом и выращивание растения из генетически модифицированной растительной клетки. Представлен наноноситель, направленный на митохондрию и являющийся полипептидом, содержащим пептидную последовательность, направленную на митохондрию, заряд в интервале от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5. Описан способ идентификации направленного на митохондрию полипептидного наноносителя, включающий выбор из базы данных пептидных последовательностей первой подгруппы сигнальных пептидных последовательностей, специфических к митохондрии, выбор из первой подгруппы сигнальных пептидных последовательностей второй подгруппы пептидных последовательностей, имеющих положительный нетто-заряд по меньшей мере 3,5, выбор из второй подгруппы пептидных последовательностей третьей подгруппы пептидных последовательностей, имеющих среднюю гидрофильность не более 0. Далее приводят в контакт клетку и пептид, имеющий последовательность, выбранную из третьей подгруппы пептидных последовательностей, и осуществляют идентификацию пептида в качестве направленного на митохондрию полипептидного наноносителя, если пептид проникает через клеточную мембрану и локализируется с митохондрией в клетке. 6 н. и 10 з.п. ф-лы, 20 ил., 9 табл., 5 пр.
1. Способ доставки нуклеиновой кислоты в органоид эукариотической клетки, не являющийся ядром, включающий воздействие на клетку композицией, содержащей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный наноноситель, при котором по меньшей мере один органоидно-направленный наноноситель доставляет по меньшей мере одну нуклеиновую кислоту сквозь клеточную мембрану в органоид клетки, не являющийся ядром, при этом органоид клетки, не являющийся ядром, является митохондрией, а органоидно-направленный наноноситель является полипептидом, имеющим направленную на митохондрию пептидную последовательность, заряд от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5.
2. Способ по п. 1, в котором нуклеиновая кислота является ДНК.
3. Способ по п. 1 или 2, в котором клетка является растительной клеткой.
4. Способ по п. 1 или 2, в котором клетка является животной клеткой.
5. Способ по п. 1 или 2, в котором органоидно-направленный наноноситель является полипептидом, содержащим последовательность, выбираемую из: MFSYLPRYPLRAASARALVRATRPSYRSALLRYQ (SEQ ID NO: 1); MAAWMRSLFSPLKKLWIRMH (SEQ ID NO: 2); MKLLWRLILSRKW (SEQ ID NO: 3); MWWRRSRTNSLRYT (SEQ ID NO: 4); и MLFRLRRSVRLRGLLA (SEQ ID NO: 5).
6. Способ по п. 5, в котором клетка является растительной клеткой.
7. Способ по п. 5, в котором клетка является животной клеткой.
8. Способ получения генетически модифицированной растительной клетки, включающий воздействие на растительную клетку композицией, содержащей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один органоидно-направленный наноноситель, при котором по меньшей мере один органоидно-направленный наноноситель доставляет по меньшей мере одну нуклеиновую кислоту сквозь клеточную мембрану и в органоид клетки, не являющийся ядром, для трансфекции упомянутого органоида, при этом органоид, не являющийся ядром, является митохондрией, а органоидно-направленный наноноситель является полипептидом, имеющим направленную на митохондрию пептидную последовательность, заряд от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5.
9. Способ по п. 8, в котором растительная клетка является эмбриогенной микроспорой.
10. Способ получения генетически модифицированного растения, включающий получение генетически модифицированной растительной клетки способом по п. 8 или 9 и выращивание растения из генетически модифицированной растительной клетки.
11. Способ получения генетически модифицированной животной клетки, включающий воздействие на животную клетку, содержащую по меньшей мере одну митохондрию, композицией, включающей по меньшей мере одну нуклеиновую кислоту и по меньшей мере один наноноситель, направленный на митохондрию, в котором по меньшей мере один органоидно-направленный наноноситель доставляет по меньшей мере одну нуклеиновую кислоту сквозь клеточную мембрану в по меньшей мере одну митохондрию для трансфекции по меньшей мере одной митохондрии, при этом направленный на митохондрию наноноситель является полипептидом, имеющим направленную на митохондрию пептидную последовательность, заряд от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5.
12. Наноноситель, направленный на митохондрию и являющийся полипептидом, содержащим пептидную последовательность, направленную на митохондрию, заряд в интервале от приблизительно 4 до приблизительно 7 и гидрофильность от приблизительно 0 до приблизительно -0,5.
13. Наноноситель, направленный на митохондрии, по п. 12, в котором полипептид содержит последовательность, выбираемую из: MFSYLPRYPLRAASARALVRATRPSYRSALLRYQ (SEQ ID NO: 1); MAAWMRSLFSPLKKLWIRMH (SEQ ID NO: 2); MKLLWRLILSRKW (SEQ ID NO: 3); MWWRRSRTNSLRYT (SEQ ID NO: 4); и MLFRLRRSVRLRGLLA (SEQ ID NO: 5).
14. Способ идентификации направленного на митохондрию полипептидного наноносителя, включающий следующие стадии:
а) выбирают из базы данных пептидных последовательностей первую подгруппу сигнальных пептидных последовательностей, специфических к митохондрии,
б) выбирают из первой подгруппы сигнальных пептидных последовательностей вторую подгруппу пептидных последовательностей, имеющих положительный нетто-заряд по меньшей мере 3,5,
в) выбирают из второй подгруппы пептидных последовательностей третью подгруппу пептидных последовательностей, имеющих среднюю гидрофильность не более 0,
г) приводят в контакт клетку и пептид, имеющий последовательность, выбранную из третьей подгруппы пептидных последовательностей, и осуществляют идентификацию пептида в качестве направленного на митохондрию полипептидного наноносителя, если пептид проникает через клеточную мембрану и локализируется с митохондрией в клетке.
15. Способ по п. 14, в котором стадии а)-в) проводят с помощью компьютера.
16. Способ по п. 14 или 15, включающий между стадиями в) и г) дополнительную стадию выбора из третьей подгруппы пептидных последовательностей четвертой подгруппы пептидных последовательностей, имеющих не более 35 остатков, при этом стадия г) включает приведение в контакт клетки и пептида, имеющего последовательность, выбранную из четвертой подгруппы пептидных последовательностей.
| WO2008148223 А, 11.12.2008 | |||
| Flierl A, Targeted delivery of DNA to the mitochondrial compartment via import sequence-conjugated peptide nucleic acid, Mol Ther | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| СПОСОБ ВОЗДЕЙСТВИЯ НА ОРГАНИЗМ ПУТЕМ АДРЕСНОЙ ДОСТАВКИ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ В МИТОХОНДРИИ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ И СОЕДИНЕНИЕ, ПРИМЕНЯЕМОЕ ДЛЯ ЭТОЙ ЦЕЛИ | 2005 |
|
RU2318500C2 |
Авторы
Даты
2016-08-10—Публикация
2012-08-02—Подача