Область техники
Изобретение относится к области медицины, а именно к генетике, онкологии, молекулярной диагностике и касается способа выявления генной мутации Q61R в гене NRAS в опухолевых тканях человека и может быть использовано для быстрого поиска мутации в анализируемой точке.
Уровень техники
При многих онкологических заболеваниях, в частности при раке щитовидной железы, обязательным объектом выявления генных мутаций является ген NRAS. NRAS - онкоген, мутации которого обладают потенциалом для перерождения нормальных клеток в злокачественные, посредством активации сигнальных путей в клетках. Мутации в гене NRAS зачастую являются маркером агрессивного поведения рака щитовидной железы и неблагоприятного прогноза. Мутации в гене NRAS, которые могут вызывать безграничный рост клеток, влияют на единичную аминокислоту в белке NRAS. В частности, они заменяют аминокислотный глутамин в положении 61 на аргинин (Q61R), что приводит к образованию перманентно активного белка. Вместо того, чтобы запускать рост клеток в ответ на определенные сигналы извне, сверхактивный белок постоянно направляет клетки к росту и делению. Мутационный статус гена NRAS имеет отношение к лекарственной устойчивости, в особенности это важно для пациентов, получающих ингибиторы тирозинкиназы. Детекция данной мутации позволяет проводить таргетную клиническую терапию онкологических пациентов. Это позволит выбрать наиболее перспективный протокол лечения индивидуально, основываясь на молекулярно-генетическом профиле опухоли больного. Данная мутация характерна для развития аденокарциномы при колоректальном раке, встречается с частотой около 5%, при уротелиальной карциноме и раке мочевого пузыря - около 2%, при гепатоцеллюлярном раке - 4%, в случае аденокарциномы рака легкого - около 1%, при крупноклеточном раке легкого - 4%, и при меланоме частота встречаемости данной мутации составляет около 20%.
Классическим способом определения мутации является секвенирование по Сенгеру. Недостатки способа при применении в клинике: невысокая чувствительность, трудоемкость, риск перекрестного загрязнения клинических образцов. Кроме того, для дальнейшей расшифровки хроматограмм необходима высокая квалификация персонала, что препятствует использованию данного метода в широкомасштабных исследованиях.
Известен другой способ выявления генной мутации NRAS посредством плавления ДНК (DNA Melting Analysis), реализуемый в режиме высокого разрешения (High Resolution Melting Analysis, HRMA) (Erali and Wittwer, High resolution melting analysis for gene scanning. Methods, 2010, 50, 250-261). Недостатки способа: относительно невысокая чувствительность, необходимость дорогостоящего оборудования.
Известен способ выявления генных мутаций с применением в процессе ПЦР блокирующих агентов - пептидных нуклеиновых кислот, способных избирательно подавлять амплификацию аллелей дикого типа и тем самым повышать чувствительность определения мутаций (Guha et al., DISSECT Method Using PNA-LNA Clamp Improves Detection of T790m Mutation. PLoS ONE, 2013, 8, e67782). Недостатки способа: необходимость независимой идентификации мутантного аллеля, дорогостоящий химический синтез.
Метод гибридизации на микрочипах является наиболее перспективным для проведения одновременного генотипирования большого количества генетических локусов, однако, на данный момент, отсутствуют дешевые тест-системы на основе данного метода (Emelyanova et al., Detection of BRAF, NRAS, KIT, GNAQ, GNA11 and MAP2K1/2 mutations in Russian melanoma patients using LNA PCR clamp and biochip analysis. Oncotarget, 2017 Apr 10; 8(32): 52304-52320).
Метод постановки аллель-специфической ПЦР распространен довольно широко, однако требует постановки независимых параллельных ПЦР-реакций. Для оценки результатов также требуется постановка гель-электрофореза в полиакриламидном геле, что резко снижает его ценность для широкомасштабного анализа большого числа образцов опухолевых тканей пациентов.
На данный момент имеется лишь небольшое количество патентов, в которых бы фигурировал ген NRAS и его ассоциация с развитием опухолей щитовидной железы, один из таких патентов WO 2017117523 A1, в котором авторы предлагают при помощи метода секвенирования нового поколения (NGS) проанализировать панель генов, вовлеченных в развитие опухолей щитовидной железы. Однако данный метод является довольно дорогостоящим.
Таким образом, в настоящий момент существует острая потребность в разработке способа диагностики мутации Q61R в гене NRAS, который бы выгодно отличался от известных решений простотой проведения анализа, доступностью и низкой стоимостью. Поскольку все имеющиеся в настоящее время методы определения мутации Q61R в гене NRAS обладают теми или иными недостатками, существует реальная потребность в создании простого, недорогого и специфичного метода для выявления данной мутации, с целью дальнейшего внедрения в любую стандартную клиническую лабораторию.
Такой способ обеспечивается настоящим изобретением.
Сущность изобретения
Задачей заявляемого изобретения является создание нового, более чувствительного метода выявления мутации Q61R гена NRAS в опухолевых тканях человека, при помощи метода постановки ПЦР в реальном времени.
Определение исследуемых аллелей в указанной точке гена NRAS достигается за счет использования пары флуоресцентно-меченых TaqMan зондов, позволяющих проводить анализ по уровню накопления флуоресцентного продукта каждого из зондов в процессе прохождения ПЦР реакции.
Заявляемый способ обладает высокой чувствительностью выявления генной мутации Q61R гена NRAS, при сохранении простоты исполнения, реализации 2-часового теста в одной пробирке без промежуточных и дополнительных процедур с однократной регистрацией результатов и без риска перекрестного загрязнения образцов ДНК опухолевых тканей, заключенных в парафиновые блоки.
Сущность заявляемого способа заключается в выявлении в ДНК опухоли мутации Q61R гена NRAS с использованием ПЦР в реальном времени с двумя флуоресцентными зондами TaqMan. Наличие такого зонда составляет особенность ПЦР в реальном времени - помимо возможности проведения ПЦР с визуализацией результатов в режиме реального времени, за счет зонда также повышается специфичность реакции по сравнению с обычной ПЦР.
Указанная задача решается путем создания набора для обнаружения мутации Q61R в белке NRAS в образце опухолевой ткани человека, где указанный набор включает олигонуклеотиды, имеющие следующие последовательности: SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, при этом каждый из олигонуклеотидов с последовательностями SEQ ID NO: 1 и SEQ ID NO: 2 содержит на одном из концов флуоресцентный краситель, выбранный из группы FAM или VIC, прикрепленный при помощи ковалентной связи, и на противоположном конце гаситель флуоресценции, выбранный из группы BHQ1 или BHQ2, прикрепленный при помощи ковалентной связи, и при этом олигонуклеотиды SEQ ID NO: 1 и SEQ ID NO: 2 имеют разные красители и гасители флуоресценции.
В некоторых вариантах изобретения данный набор характеризуется тем, что дополнительно включает фермент ДНК-полимеразу, реакционный буфер, а также смесь четырех различных дезоксирибонуклеотидов.
Указанная задача также решается путем создания способа обнаружения мутации Q61R в белке NRAS у пациента, включающего по меньшей мере следующие стадии: (а) получают образец биологического материала, взятого у пациента; (б) выделяют ДНК из указанного образца, при этом ДНК содержит ген NRAS; (в) проводят реакцию ПЦР с использованием указанного выше набора; (г) при обнаружении сигнала в указанной реакции ПЦР от красителя, связанного с олигонуклеотидом SEQ ID NO: 1, констатируют присутствие мутации Q61R в белке NRAS в образце указанного пациента, а при обнаружении сигнала от красителя, связанного с олигонуклеотидом SEQ ID NO: 2, констатируют отсутствие мутации Q61R в белке NRAS в образце указанного пациента.
Техническим результатом настоящего изобретения является повышение степени специфичности и чувствительности диагностической тест-системы, предназначенной для определения наличия мутантного аллеля в точке Q61R гена NRAS, а также сокращение времени проведения диагностики при снижении вероятности технологических ошибок во время лабораторных манипуляций за счет удобного формата предложенной тест-системы.
Краткое описание рисунков
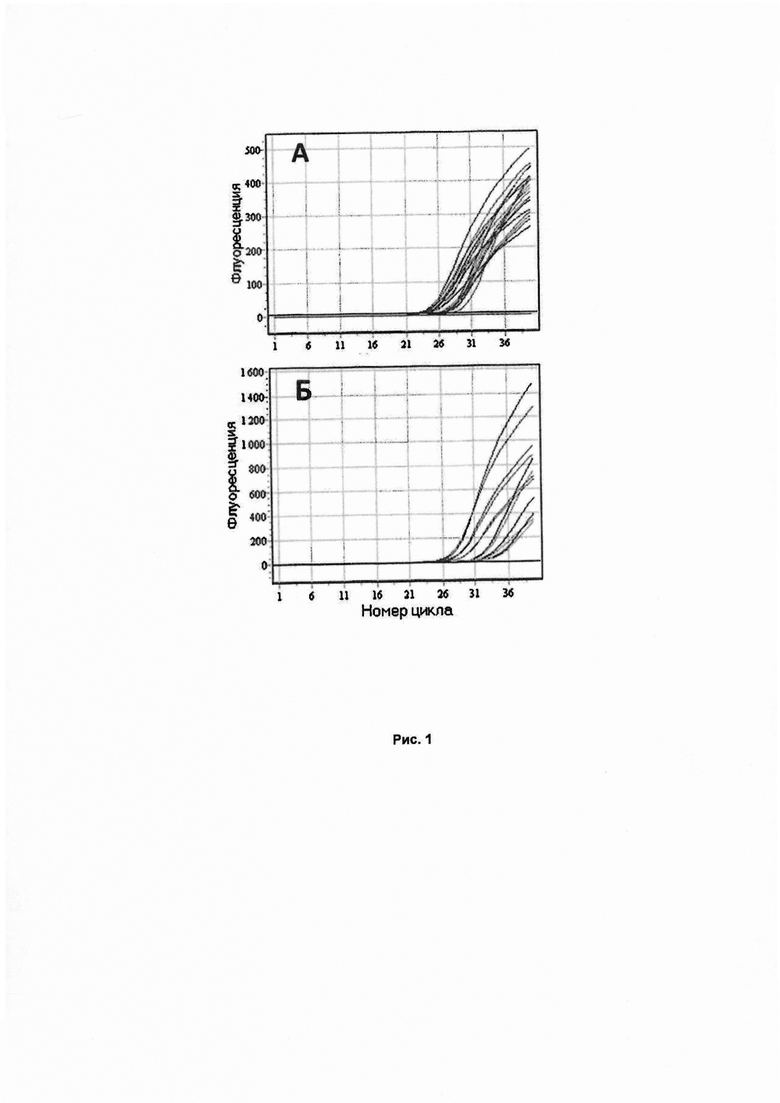
Рис. 1. Накопление флуоресценции TaqMan-зондов при проведении ПЦР-диагностики - амплификации гена NRAS. (А) График накопления сигнала флуоресценции при амплификации специфического фрагмента нуклеиновой кислоты возбудителя, канал детекции FAM; (Б) график накопления сигнала флуоресценции, канал детекции VIC.
Подробное раскрытие изобретения
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из». Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Термин «NRAS» или «человеческий NRAS» относится к гену, кодирующему малую ГТФазу (G-белок, мембрано-связанный белок, участвующий в передаче сигнала), последовательность которого приведена в Национальном центре биотехнологической информации (NCBI) под номером Gene ID_4893 (https://www.ncbi.nlm.nih.gov/gene/4893), а также к аллельным вариантам этого гена (изоформам), присутствующим в геномах пациентов. Уникальный идентификатор этого гена согласно Комитету номенклатуры генов человека Европейского биоинформатического института (HGNC): 7989. Прикрепленные к внутренней стороне клеточной мембраны белки RAS являются первыми членами сигнального каскада, которые приводят к активации транскрипции генов и к пролиферации клетки.
Основной задачей настоящего изобретения является разработка упрощенного и доступного способа анализа генетического полиморфизма в точке Q61R для проведения клинической ДНК-диагностики опухолевых тканей пациентов. Предлагаемый способ обладает высокой специфичностью и чувствительностью при анализе ДНК, выделенной из парафиновых блоков пациентов. Данная тест-система подходит для быстрого определения наличия или отсутствия точечной мутации Q61R в гене NRAS. В качестве клинических образцов могут быть использованы образцы ДНК, выделенные из парафиновых блоков, полученных от обследуемого пациента. Образец ДНК служит матрицей для дальнейшего осуществления способа детекции мутации.
Для получения специфических продуктов ПЦР подбирали олигонуклеотиды, отличающиеся специфичностью к анализируемому участку гена NRAS.
Их разрабатывали согласно следующим критериям:
- отсутствие внутренней вторичной структуры;
- отсутствие комплементарности между 3'-концами, что может быть причиной образования димеров праймеров;
- наличие единой температуры плавления (разброс температур плавления праймеров не более 1°С от среднего значения);
- отсутствие комплементарности последовательностей праймеров для 1-го раунда с последовательностями других генов в геноме человека;
- способность амплифицировать фрагменты гена, содержащие участки, позволяющие идентифицировать в дальнейшем точечную мутацию Q61R в гене NRAS.
В основе раскрываемого технического решения лежит создание оптимального набора последовательностей олигонуклеотидов для определения мутации Q61R гена NRAS, имеющих следующий нуклеотидный состав: TACTCTTCTCGTCCAGCTGT (SEQ ID NO: 1) и TACTCTTCTTGTCCAGCTGT (SEQ ID NO: 2). При этом, данные олигонуклеотиды служат основой для TaqMan-зондов, используемых в реакции ПЦР в реальном времени. Реализованный вариант зондов приведен ниже, при этом в других вариантах красители FAM и VIC могут быть использованы как с одним, так и с другим олигонуклеотидом:
FAM - TACTCTTCTTGTCCAGCTGT - BHQ1 (TaqMan-зонд для немутантного варианта аллеля в анализируемой точке), и
VIC - TACTCTTCTCGTCCAGCTGT - BHQ2 (TaqMan-зонд для мутантного варианта аллеля в анализируемой точке).
Одними из самых распространенных каналов для детекции флуоресценции, на данный момент, считаются каналы FAM и VIC. Это самая подходящая пара зондов, которые идеально подходят друг к другу по своим спектральным и химическим свойствам. Канал FAM имеет длину волны в диапазоне 492-516 нм., а канал VIC - 535-555 нм. Таким образом, оба зонда для ПЦР в реальном времени являются олигонуклеотидами, к которым присоединены молекулы флуорофора (карбоксифлуоресцеин (FAM/VIC)) и молекулы гасителя флуоресценции (Black Hole Quenchers (BHQ1/BHQ2)). При этом, для каждого из зондов может быть использован FAM или VIC, и необходимым условием является прикрепление разных красителей к каждому из двух зондов. То есть, если к SEQ ID NO: 1 прикреплен VIC, то к SEQ ID NO: 2 должен быть прикреплен FAM, и наоборот. Аналогично, для каждого из зондов может быть использован BHQ1 или BHQ2. В некоторых вариантах допускается применение единственного гасителя (BHQ1) для обоих зондов.
Последовательности праймеров, которые нарабатывают интересующий регион гена NRAS с анализируемой мутацией Q61R в реакции ПЦР, имеют следующие последовательности:
прямой праймер: 5'-CCACACCCCCAGGATTCTTAC-3' (SEQ ID NO: 3), и
обратный праймер: 5'-CGCCTGTCCTCATGTATTGG-3' (SEQ ID NO: 4).
Таким образом, при проведении реакции ПЦР с участием SEQ ID NO: 3 и SEQ ID NO: 4 нарабатывается следующая последовательность из гена NRAS (в скобках указана интересующая мутация):

Для обеспечения сбалансированной и эффективной амплификации исследуемых образцов также должны быть оптимизированы такие параметры, как концентрация хлорида магния и ПЦР-праймеров в смеси, количество циклов амплификации, время элонгации, отжига, денатурации.
Заявляемый набор праймеров применяют следующим образом:
1. Получение биологического материала от пациента. В качестве источника ДНК от пациента могут быть использованы парафиновые блоки FFPE, биоптаты после тонкоигольной биопсии, образцы клеток с цитологических стекол.
2. Выделение ДНК из FFPE блоков. Быстрое и качественное выделение ДНК можно проводить с использованием коммерчески доступных наборов реагентов, например, QIAamp DNA FFPE Tissue Kit, QIAGEN (https://www.qiagen.com/us/shop/sample-technologies/dna/genomic-dna/qiaamp-dna-ffpe-tissue-kit). Выделение ДНК из биоптатов осуществляли при помощи наборов РеалБест ДНК - экстракция 2, РеалБест ДНК - экспресс, РеалБест экстракция 100, фирмы Вектор БЕСТ (http://vector-best.ru/prod/index.php?pcat=pcr&gid=181), выделение ДНК с цитологических стекол осуществляли при помощи набора - Pinpoint Slide DNA Isolation System, компании (Zymo Research https://www.zymoresearch.eu/pinpoint-slide-dna-isolation-system). Также, могут быть использованы и другие аналогичные наборы для выделения ДНК.
3. Постановка ПЦР в режиме реального времени. Амплификация должна проходить с применением предлагаемого набора праймеров и TaqMan-зондов, специфичных для исследуемой области в анализируемой точке Q61R.
4. Анализ результатов ПЦР в режиме реального времени за счет изменения динамики накопления флуоресцентного продукта реакции для каждого из TaqMan-зондов.
Для проведения ПЦР могут быть использованы готовые коммерчески доступные наборы, содержащие все необходимые компоненты, за исключением праймеров и TaqMan-зондов. Для обнаружения в ДНК опухоли мутации гена NRAS необходимо выяснить, сигнал какого канала детектирует прибор ПЦР машины. Если в исследуемом образце присутствует немутантный вариант гена, прибор детектирует сигнал из канала FAM. Это свидетельствует о наличии «дикого», немутантного аллеля в анализируемой точечной мутации - присутствие нуклеотида А. Сигнал из канала VIC детектируется прибором во всех случаях, когда в образце присутствует мутантный вариант (нуклеотид G).
Нижеследующие примеры осуществления способа приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример. Детектирование мутации Q61R гена NRAS в образцах пациентов.
Чтобы продемонстрировать возможность использования данного набора, была произведена молекулярная диагностика гена NRAS в образцах 11 пациентов, которых была диагностирована опухоль щитовидной железы, и которым было проведено хирургическое вмешательство по удалению образований, во время которого кусочки опухолевых тканей были оперативно зафиксированы формалином и залиты парафином. Все пациенты, которым был назначен данный анализ, были направлены из Национального медицинского исследовательского центра (ФГБУ «НМИЦ эндокринологии» Минздрава России).
Для проведения молекулярно-генетического исследования биологическим материалом служила ДНК, выделенная из парафиновых FFPE блоков пациентов. Использование данных блоков является крайне удобным для исследователя, т.к. позволяет хранить зафиксированные опухолевые ткани пациента при температуре +4°С на протяжении нескольких лет. В данном случае это выражается в том, что имеется возможность взять в анализ ткани, которые были получены во время операции, которая проходила за некоторое время до анализа. FFPE блоки после операции выдаются пациенту на руки и хранятся у него. Пациент в любой момент может воспользоваться FFPE блоком и предоставить свой операционный материал, когда возникнет необходимость. ДНК из блоков выделялась стандартными протоколами, предусмотренными производителями наборов для экстракции ДНК из FFPE блоков. В анализ был взят только тот кусок ткани, который представлял собой непосредственно опухоль. Это было возможным благодаря тому, что гистолог, просматривая гистологические стекла каждого блока, делал разлиновку материала, обозначая границы опухоли. Парафиновые блоки нарезались при помощи микротома - 8 стружек по 10 мкм каждый. Материалом для прохождения ПЦР была именно ДНК опухолевого образования из FFPE блока.
Реакцию амплификации проводили с использованием специального оборудования - амплификатора ДТ-прайм М1 (фирмы "ДНК Технология") согласно следующему протоколу приготовления реакционной смеси для ПЦР:
- 2,5 мкл дезоксирибонуклеотидтрифосфатов (25 мМ/мкл);
- 2,5 мкл MgCl2 (25 мМ/мкл);
- 2,5 мкл буфер 10Х (100 мМ Tris-HCl (рН 8.8 при 25°С), 500 мМ KCl, 0.8% Р40, 20 мМ MgCl2);
- 0,5 мкл Tag-полимеразу Hot-Start (50Х);
- праймер прямой (10 пмоль/мкл) - 0.5 мкл на реакцию;
- обратный праймер (10 пмоль/мкл) - 0.5 мкл на реакцию;
- зонд-специфический олигонуклеотид, на немутантный аллель (10 пмоль/мкл) - 0.5 мкл на реакцию;
- зонд-специфический олигонуклеотид, на мутантный аллель (10 пмоль/мкл) - 0.5 мкл на реакцию;
- ДНК (33 нг/мкл) - 3 мкл на реакцию;
- вода.
Программа, используемая для амлификации, имела следующие температурные режимы:
95°С - 2 мин.
95°С - 15 сек.
58°С - 15 сек. 40 циклов
72°С - 20 сек. (ставим детектирующую метку)
72°С - 5 мин.
Хранение (+4°С)
Результаты оценивали путем сопоставления значений цикла начала флуоресценции (Ct) для контрольных и исследуемых образцов при условии эффективности амплификации 95-100% и путем анализа стандартной кривой (Рис. 1А, Б).
Определение наличия немутантного или мутантного аллеля в анализируемой точке Q61R связано с тем, какой канал детектирует прибор в образце. Если в исследуемом образце детектируется канал FAM, то в анализируемой пробе имеется немутантный аллель. При условии детекции прибором сигнала из канала VIC, в исследуемой пробе ДНК пациента был обнаружен мутантный аллель. Как видно из таблицы 1, все образцы, кроме 11, показывают сигнал из канала детекции FAM, также, как и К- (отрицательный контроль); следовательно, в данных пробах ДНК пациентов нет мутации в точке Q61R. В образце 11 и в положительном контроле (К+) системой был обнаружен сигнал из канала VIC; следовательно, в данном случае в анализируемых пробах имеется мутантный аллель. Результаты амплификации всех образцов, которые были проанализированы данным способом, были подтверждены методом секвенирования выделенной ДНК по Сенгеру.
При указанных параметрах амплификации и составе реакционной смеси были получены числовые значения, представленные в Таблице 1. Эти значения характеризуют минимальные циклы, на которых регистрируется начало флуоресценции.


Таким образом, разработанный универсальный набор праймеров и зондов, а также адаптированные для их использования условия реакции ПЦР в реальном времени, позволяют повысить эффективность и точность идентификации мутантного и немутантного аллеля в исследуемой точке Q61R гена NRAS. Применение данного изобретения позволяет оптимизировать молекулярно-генетическую диагностику в опухолях щитовидной железы, а также в образцах других опухолей человека. Низкая себестоимость и простота исследования позволяют применять данный способ детекции практически в любой ПЦР-лаборатории.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные случаи приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть, понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.


Предложенная группа изобретений относится к области медицины. Предложены способ и набор для обнаружения мутации Q61R в белке NRAS в образце опухолевой ткани человека. Способ включает получение образца биологического материала, взятого у пациента, выделение ДНК из указанного образца и проведение ПЦР с использованием набора для обнаружения мутации Q61R в белке NRAS. Предложенная группа изобретений позволяет повысить специфичность и чувствительность определения наличия мутантного аллеля в точке Q61R гена NRAS, а также снизить вероятность технологических ошибок во время лабораторных манипуляций. 2 н. и 1 з.п. ф-лы, 1 ил., 1 табл., 1 пр.
1. Набор для обнаружения мутации Q61R в белке NRAS в образце опухолевой ткани человека, где указанный набор включает олигонуклеотиды, имеющие следующие последовательности: SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, при этом каждый из олигонуклеотидов с последовательностями SEQ ID NO: 1 и SEQ ID NO: 2 содержит на одном из концов флуоресцентный краситель, выбранный из группы FAM или VIC, прикрепленный при помощи ковалентной связи, и на противоположном конце гаситель флуоресценции, выбранный из группы BHQ1 или BHQ2, прикрепленный при помощи ковалентной связи, и при этом олигонуклеотиды SEQ ID NO: 1 и SEQ ID NO: 2 имеют разные красители и гасители флуоресценции.
2. Набор по п. 1, дополнительно включающий фермент ДНК-полимеразу, реакционный буфер, а также смесь четырех различных дезоксирибонуклеотидов.
3. Способ обнаружения мутации Q61R в белке NRAS у пациента, включающий по меньшей мере следующие стадии:
(а) получают образец биологического материала, взятого у пациента;
(б) выделяют ДНК из указанного образца, при этом ДНК содержит ген NRAS;
(в) проводят реакцию ПЦР с использованием набора по п. 1;
(г) при обнаружении сигнала в указанной реакции ПЦР от красителя, связанного с олигонуклеотидом SEQ ID NO: 1, констатируют присутствие мутации Q61R в белке NRAS в образце указанного пациента, а при обнаружении сигнала от красителя, связанного с олигонуклеотидом SEQ ID NO: 2, констатируют отсутствие мутации Q61R в белке NRAS в образце указанного пациента.
| Способ анализа соматических мутаций в генах BRAF, NRAS и KIT с использованием LNA-блокирующей мультиплексной ПЦР и последующей гибридизацией с олигонуклеотидным биологическим микрочипом (биочипом) | 2017 |
|
RU2674338C1 |
| ROSS A.L | |||
| et al | |||
| Molecular nevogenesis | |||
| Dermatol Res Pract | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Найдено из Интернет: URL: https://www.ncbi.nlm.nih.gov/pubmed/21754924 | |||
| US 6284463 B1, 04.09.2001. | |||
Авторы
Даты
2019-05-21—Публикация
2019-02-20—Подача