Изобретение относится к области синтеза имидоилхлоридов, которые являются интермедиатами в синтезе биологически активных химических соединений, используемых в синтезе лекарственных препаратов [Patai, S. The chemistry of Amidines and Imidates / S. Patai. - London:Interscience, 1975. - 677 p.], а именно к новому способу получения производных N-арил-1-адамантанкарбоксимидоилхлорида.
Известен общий способ получения имидоилхлоридов взаимодействием вторичных тиоамидов с такими хлорирующими агентами, как PCl5, SOCl2 и COCl2 при комнатной температуре в течение 20 часов [Пат. DE 1166771, МПК С07С, заявл. 08.05.1962; опубл. 02.04.1964].
Недостатком указанного способа является длительность процесса и необходимость использования дополнительного лабораторного оборудования.
Известен способ получения имидоилхлоридов путем взаимодействия амида с трихлоридом фосфора в токе хлора. В качестве растворителя используют оксихлорид фосфора. Синтез проводят при температуре 110-115°C в течение 2 часов [Baumann F. Isoindolenine als Zwischenprodukte der Phthalocyanin-Synthese / F. Baumann. - Die Chemie, №4, 1956, p. 133-168].
Недостатком данного способа является необходимость дополнительного использования хлора для первоначального получения пентахлорида фосфора и выделение хлористого водорода, что требует дополнительного лабораторного оформления процесса и сильно усложняет его технологию.
Известен способ получения имидоилхлоридов при нагревании кетоксима самого по себе или в растворе толуола с пентахлоридом фосфора. Синтез осуществляют с 5-10%-ным мольным избытком пентахлорида фосфора при температуре 40-80°C в течение 1,5-3 часов. В результате перегруппировки Бекмана [Coleman, G.H., and Pyle, R.E., J.Am. Chem. Soc. 68, 2007-2009 (1946)].
Недостатком указанного способа получения является выделение хлористого водорода, что требует дополнительного лабораторного оформления процесса и сильно усложняет его технологию.
Наиболее близким к заявляемому техническому решению является способ получения имидоилхлоридов путем взаимодействия производного N-арил-1-адамантанкарбоксамида с пентахлоридом фосфора. Синтез осуществляют с 5-10%-ным мольным избытком пентахлорида при нагревании в течение 1-3 часов [Первые представители адамантилсодержащих имидоилхлоридов / Б.И. Но и др. // ЖОХ. - 1996. - Т. 32, Вып. 7. - С. 1110].
Недостатком указанного способа получения является выделение хлористого водорода, что требует дополнительного лабораторного оформления процесса и сильно усложняет его технологию.
Задачей предлагаемого изобретения является разработка нового технологичного способа получения и расширение ряда производных N-арил-1-адамантанкарбоксимидоилхлорида.
Техническим результатом является упрощение способа получения производных имидоилхлоридов при сохранении высоких выходов продуктов, а также получение новых имидоилхлоридов с высоким выходом.
Технический результат достигается в способе получения производных имидоилхлоридов общей формулы:
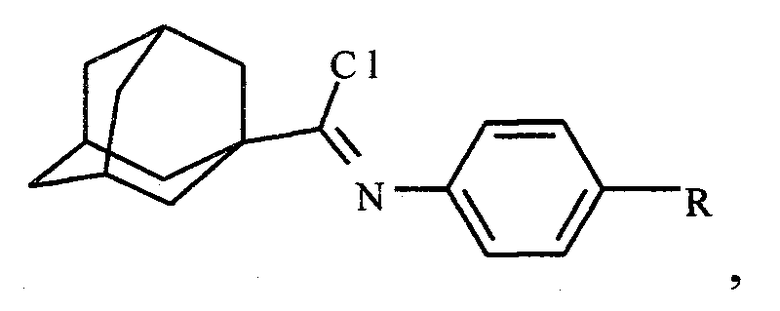
где R=-H, -СН3, -ОСН3, -С4Н9, Br,
взаимодействием производного N-арил-1-адамантанкарбоксамида с хлорирующим агентом при 75-80°C в течение 1 часа с последующим выделением продукта реакции, при этом реакцию ведут в присутствии катализатора 4-(N,N-диметиламино)пиридина, а в качестве хлорирующего агента используют трихлорид фосфора, при мольном отношении N-арил-1-адамантанкарбоксамида, трихлорида фосфора и 4-(N,N-диметиламино)пиридина, равном 1:5:1.
Использование трихлорида фосфора в качестве хлорирующего агента и 4-(N,N-диметиламино)пиридина в качестве катализатора позволяет получать целевые продукты реакции без выделения хлористого водорода, что позволяет избежать использования дополнительного оборудования для его улавливания и поглощения. Весь хлор в составе трихлорида фосфора расходуется на образование имидоилхлоридов. Использование 4-(N,N-диметиламино)пиридина определяет протекание процесса. Каталитическое действие косвенно подтверждается отсутствием реакции при замещении 4-(N,N-диметиламино)пиридина на другие азотсодержащие основания, например триэтиамин или N,N-диметиланилин, или полное изъятие катализатора из реакционной массы.
Заявленные мольные отношения компонентов являются наиболее оптимальными, так как уменьшение количества 4-(N,N-диметиламино)пиридина приводит к уменьшению выхода целевого продукта, а дальнейшее увеличение не способствует увеличению выхода. Мольное отношение N-арил-1-адамантанкарбоксамида и хлорирующего агента обусловлено максимально эффективным использованием хлора в хлорирующем агенте и обеспечением среды протекания процесса. Использование большего количества трихлорида фосфора возможно, но это не способствует лучшему протеканию реакции, а следовательно, не целесообразно.
Способ осуществляется приготовлением смеси 17,5 ммоль N-арил-1-адамантанкарбоксамида, 87,5 трихлорида фосфора и 17,5 ммоль 4-(N,N-диметиламино)-пиридина, при мольном отношении N-арил-1-адамантанкарбоксамида, трихлорида фосфора и 4-(N,N-диметиламино)-пиридина, равном 1:5:1 соответственно, и последующем нагревании при 75-80°C в течение 1 часа:
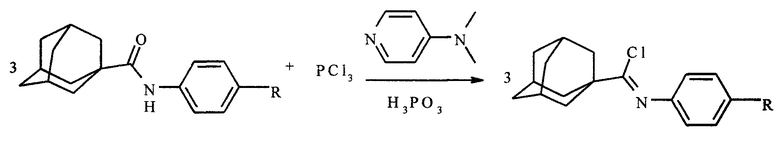
где R=-H, -СН3, -ОСН3, -С4Н9, Br.
После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают целевой продукт. Очистку производят вакуумной перегонкой.
Пример 1. (N-4-метоксифенил)-1-адамантанкарбоксимидоилхлорид.
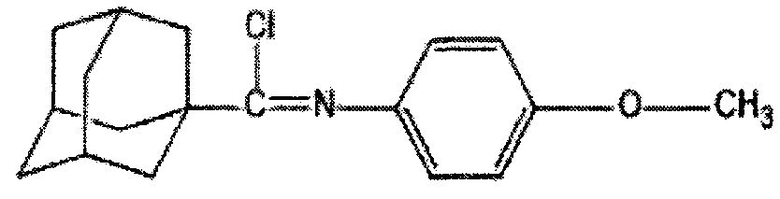
К смеси 5 г (17,5 ммоль) (N-4-метоксифенил)-1-адамантанкарбоксамида и 12 г 7,65 мл (87,5 ммоль) трихлорида фосфора при перемешивании добавляют 2,14 г (17,5 ммоль) 4-(N,N-диметиламино)пиридина и нагревают при 80°C в течение 1 часа. После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают 5,16 г (97%) (N-4-метоксифенил)-1-адамантанкарбоксимидоилхлорида. Продукт очищают вакуумной перегонкой. Тпл 58-60°C, Ткип 228-230/4-5. ИК-Спектр (KBr), ν, см-1: 1708 см-1 ν(C=N), 1594 см-1 ν(C=C Ar), 1546 см-1 δ (СН2 Ar), 1066 см-1 ν(COC), 838 см-1 ν(C-Cl), 1330, 1138, 1096 см-1 δ (ССН Ad), 982, 916, 760 см-1 δ (ССС Ad). Масс-спектр (ЭУ; 70 эВ), m/z (Iотн., %): 303 [М]+ (30), 268[М-С1]+ (100), 135 [Ad]+ (35), 107 [M-AdC(Cl)N]+. Спектр ЯМР 1Н (CDCl3), δ, м.д.: 3.71 с. (3H, ОСН3), 1.69 с. (6Н, Ad), 1.96 с. (6Н, Ad), 2.02 с. (3H, Ad), 6.74-6.81 м. (4Н, Ar). Найдено, %: С 71.35, Н 7.37, N 4.45. Вычислено, %: С 71.17, Н 7.25, N 4.61.
Пример 2. (N-4-бутилфенил)-1-адамантанкарбоксимидоилхлорид.
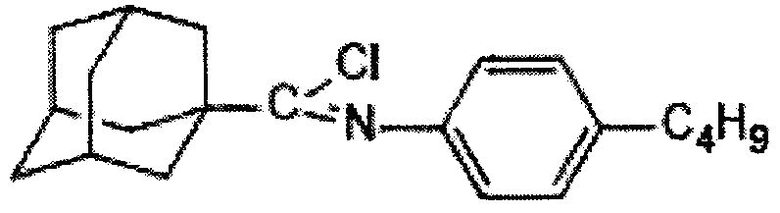
К смеси 5,44 г (17,5 ммоль) (N-4-бутил фенил)-1-адамантанкарбоксамида и 12 г 7,65 мл (87,5 ммоль) трихлорида фосфора при перемешивании добавляют 2,14 г (17,5 ммоль) 4-(N,N-диметиламино)-пиридина и нагревают при 75°C в течение 1 часа. После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают 5,47 г (95%) (N-4-бутилфенил)-1 адамантанкарбоксимидоилхлорида. Продукт очищают вакуумной перегонкой. Ткип 218-220/4-5. ИК-Спектр (KBr), ν, см-1: 2916 см-1 ν(CH3), 2898 см-1 ν (СН2), 2848 см-1 ν (СН), 1682 см-1 ν(C=N), 1607 см-1 ν(C=C Ar), 1504 см-1 δ (СН2 Ar), 1343, 1133, 1096 см-1 δ (ССН Ad), 985, 925, 805 см-1δ (ССС Ad), 847 см-1 δ(C-Cl). Масс-спектр (ЭУ; 70 эВ), m/z (Iотн., %): 329 [М]+ (5), 294[М-С1]+ (100), 238 [М-Cl-С4Н9]+ (1), 135 [Ad]+(50). Спектр ЯМР 1H (CDCl3), δ, м.д.: 0.85 тр. (3H, СН3), 1.19-1.34 м. (2Н, СН2), 1.47-1.57 м. (2Н, СН2), 2.52 тр. (2Н, СН2), 1.67 с. (6Н, Ad), 1.97 с. (6Н, Ad), 2.02 с. (3H, Ad), 6.69 д. (2Н, Ar), 7.06 д. (2Н, Ar).
Пример 3. (N-4-бромфенил)-1-адамантанкарбоксимидоилхлорид.
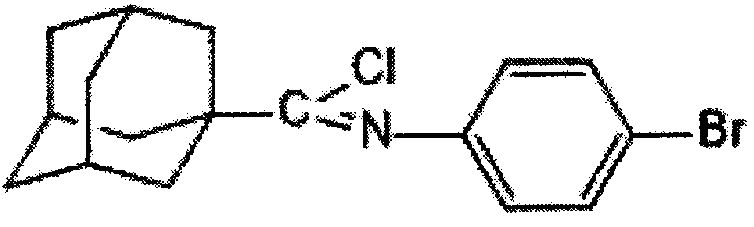
К смеси 5,85 г (17,5 ммоль) (N-4-бромфенил)-1-адамантанкарбоксамида и 12 г 7,65 мл (87,5 ммоль) трихлорида фосфора при перемешивании добавляют 2,14 г (17,5 ммоль) 4-(N,N-диметиламино)пиридина и нагревают при 78°C в течение 1 часа. После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают 4,5 г (73%) (N-4-бромфенил)-1-адамантанкарбоксимидоилхлорида. Продукт очищают перекристаллизацией из толуола. Тпл=118-120°C. ИК-Спектр (KBr), ν, см-1: 1695 см-1 ν(ON), 1584 см-1 ν(C=C Ar), 1525 см-1 δ (СН2 Ar), 1327, 1136, 1096 см-1 δ (ССН Ad), 987, 924, 805 см-1δ (ССС Ad), 842 см-1 ν(C-Cl), 706 см-1 ν(C-Br). Масс-спектр (ЭУ; 70 эВ), m/z (Iотн., %): 352,5 [М]+ (10), 317[М-Cl]+ (100), 237 [М-Br-Cl]+(2.5), 218 [M-Ad]+ (2.5), 135 [Ad]+ (90). Спектр ЯМР 1Н (COCl3), δ, м.д.: 1.68 с. (6Н, Ad), 1.95 с. (6Н, Ad), 2.04 с. (3H, Ad), 6,65 д. (2Н, Ar), 7,38 д. (2Н, Ar). Найдено, %: С 57.93, Н 5.39, N 3.94. Вычислено, %: С 57.89, Н 5.43, N 3.97.
Пример 4. N-фенил-1-адамантанкарбоксимидоилхлорид
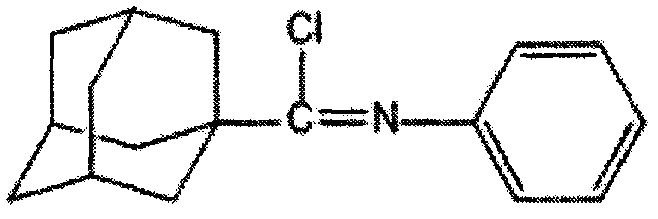
К смеси 4,46 г (17,5 ммоль) N-фенил-1-адамантанкарбоксамида и 12 г 7,65 мл (87,5 ммоль) трихлорида фосфора при перемешивании добавляют 2,14 г (17,5 ммоль) 4-(N,N-диметиламино)пиридина и нагревают при 76°C в течение 1 часа. После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают 3,02 г (63%) N-фенил-1-адамантанкарбоксимидоилхлорида. Продукт очищают вакуумной перегонкой. Тпл=59-61°C. Ткип=153-155/4-5.
Пример 5. N-(4-метил)-1-адамантанкарбоксимидоилхлорид
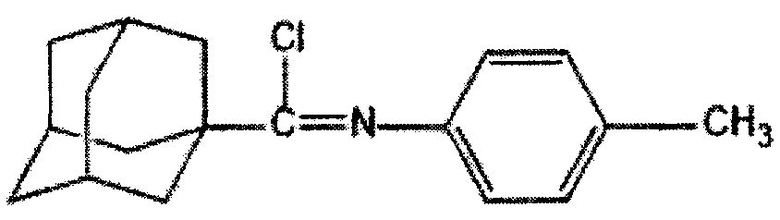
К смеси 4,7 г (17,5 ммоль) (N-4-метилфенил)-1-адамантанкарбоксамида и 12 г 7,65 мл (87,5 ммоль) трихлорида фосфора при перемешивании добавляют 2,14 г (17,5 ммоль) 4-(N,N-диметиламино)пиридина и нагревают при 75°C в течение 1 часа. После охлаждения реакционной массы отделяют жидкую фазу, отгоняют избыток трихлорида фосфора и получают 4,28 г (85%) N-(4-метил)-1-адамантанкарбоксимидоилхлорида. Продукт очищают вакуумной перегонкой. Тпл=95-97°C. Ткип=250-252/3-4.
Таким образом новый технологичный способ получения производных имидоилхлоридов, при котором реакцию ведут в присутствии 4-(N,N-диметиламино)пиридина, при мольном отношении N-арил-Т-адамантанкарбоксамида, хлорирующего агента - трихлорида фосфора и катализатора 4-(N,N-диметиламино)-пиридина, равном 1:5:1, позволяет получить новые производные имидоилхлоридов с высоким выходом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ИМИДОИЛХЛОРИДОВ | 2015 |
|
RU2599991C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОРАДАМАНТИЛ-3-ФОРМАМИДА (АМИДА 1-ХЛОРАДАМАНТИЛ-3-КАРБОНОВОЙ КИСЛОТЫ) | 2010 |
|
RU2455282C2 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ N-ИМИДОИЛИРОВАННЫХ ЭФИРОВ АМИНОКАРБОНОВЫХ КИСЛОТ | 2003 |
|
RU2250897C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ N-ИМИДОИЛИРОВАННЫХ ПРОИЗВОДНЫХ АМИНОКАРБОНОВЫХ КИСЛОТ | 2006 |
|
RU2307121C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТИОМЕТИЛИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛА И 2-(БЕНЗПИРРОЛ-3-ИЛ)УКСУСНОЙ КИСЛОТЫ | 2023 |
|
RU2819608C1 |
| Способ получения ароматических амидов 1-адамантанкарбоновой кислоты | 2019 |
|
RU2698193C1 |
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, ОБЛАДАЮЩИЕ МОДУЛЯТОРНОЙ АКТИВНОСТЬЮ ПО ОТНОШЕНИЮ К РЕЦЕПТОРАМ АМРА-ТИПА | 2019 |
|
RU2702751C1 |
| Новые α-аминофосфонаты, обладающие антикоррозионной активностью, и способ их получения | 2019 |
|
RU2706917C1 |
| ПРОИЗВОДНЫЕ АМИДИНОВ, СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1999 |
|
RU2238939C2 |
Изобретение относится к области синтеза имидоилхлоридов, являющихся интермедиатами в синтезе биологически активных химических соединений, конкретно к способу получения производных имидоилхлоридов указанной ниже общей формулы, где R=-H, -CH3, -ОСH3, -C4Н9, Br. Способ осуществляют взаимодействием производного N-арил-1-адамантанкарбоксамида с хлорирующим агентом при 75-80°C в течение 1 ч с последующим выделением продукта реакции. Способ характеризуется тем, что реакцию ведут в присутствии катализатора 4-(N,N-диметиламино)пиридина, а в качестве хлорирующего агента используют трихлорид фосфора при мольном отношении N-арил-1-адамантанкарбоксамида, трихлорида фосфора и 4-(N,N-диметиламино)пиридина, равном 1:5:1. Предлагаемый способ позволяет получать указанные производные имидоилхлоридов с высоким выходом. 5 пр.
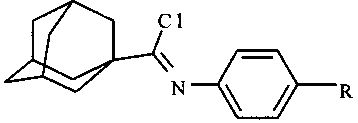
Способ получения производных имидоилхлоридов общей формулы
 ,
,
где R=-H, -CH3, -ОСH3, -C4Н9, Br,
взаимодействием производного N-арил-1-адамантанкарбоксамида с хлорирующим агентом при 75-80°C в течение 1 ч с последующим выделением продукта реакции, отличающийся тем, что реакцию ведут в присутствии катализатора 4-(N,N-диметиламино)пиридина, а в качестве хлорирующего агента используют трихлорид фосфора при мольном отношении N-арил-1-адамантанкарбоксамида, трихлорида фосфора и 4-(N,N-диметиламино)пиридина, равном 1:5:1.
| Б.И | |||
| НО и др., Первые представители адамантилсодержащих имидоилхлоридов, ЖУРН | |||
| ОРГАН | |||
| ХИМИИ, 1996, Т | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОДУКТОВ ГИДРОГЕНИЗАЦИИ ВЫСЫХАЮЩИХ И ПОЛУВЫСЫХАЮЩИХ МАСЕЛ | 1921 |
|
SU1110A1 |
| Способ стимулирования роста растений люцерны | 1983 |
|
SU1166771A1 |
Авторы
Даты
2016-08-10—Публикация
2015-07-23—Подача