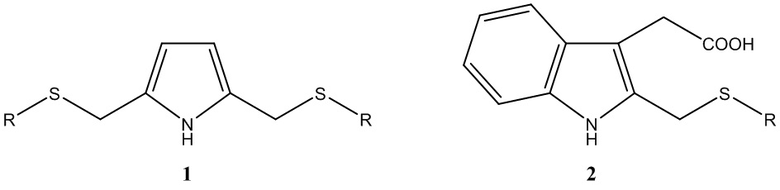
Предлагаемое изобретение относится к области синтеза органических веществ, в частности к способу получения С-тиометилированных производных пиррола и 2-(бензпиррол-3-ил)уксусной кислоты (гетероауксина) общей формулы 1 или 2.
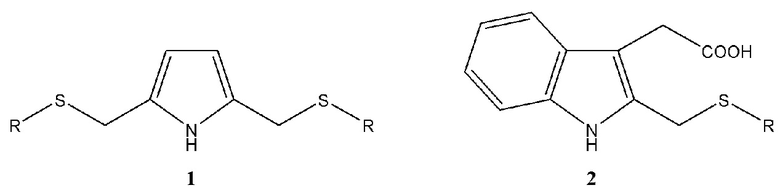
Азот и серосодержащие гетероциклы могут найти применение в качестве комплексообразователей, сорбентов и экстрагентов драгоценных металлов, а также антиоксидантов, антибиотиков, противогрибковых и противовирусных агентов.
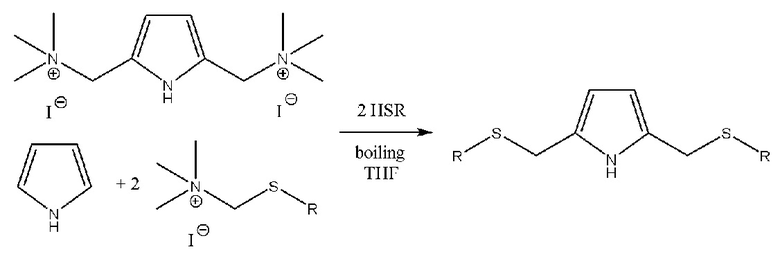
Известен способ [Kim, I.T., Convenient synthesis of 1-alkyl-2,5-bis(phenylthiomethyl)pyrroles using the Mannich reaction / I.T., Kim, R.L., Elsenbaumer //Tetrahedron Letters.–1998.–39(10).–1087-1090] получения 2,5-бис(сульфанилметил)пирролов из пиррола через стадию кватернизации 2,5-диметиламиновой группы 2,5-бис(диметиламинометил)пиррола йодистым метаном, либо прямое тиометилирование пиррола кватернизированным 2,5-диметиламинметилтиолом йодистым метаном, который получают в несколько стадий из соответствующих меркаптанов:
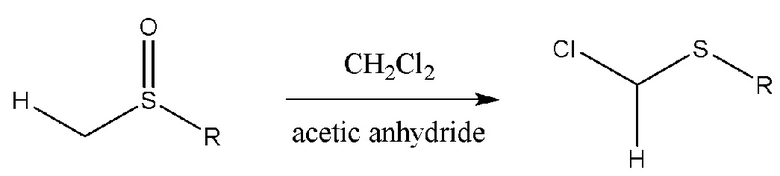
Известен способ [Semmelhack, M.F. et al Accelerated Arene Ligand Exchange in the (Arene)Cr(CO)2L Series Journal of the American Chemical Society, 127(21), 7759-7773; 2005], [K.-Y. Wu, C.-C. Hsieh, Y.-C. Horng // J Organomet. Chem., 2009, 694(13), 2085-2091] тиометилирования пиррола с галогенметилтиоэфирами, которые синтезируют перегруппировкой Пуммерера из соответствующих сульфоксидов [O De Lucchi, U. Miotti, G. Modena, ChemInform Реферат: реакция Пуммерера сульфиниловых соединений, ChemInform, 10.1002/chin.199203294, 23, 3, 2010.]:
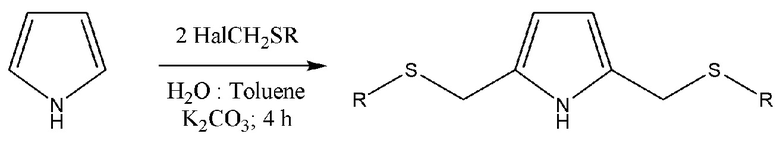
Известные способы осуществляются в несколько стадий с выделением промежуточных продуктов.
В литературе отсутствуют сведения о С-тиометилировании 3-индолилуксусной кислоты (гетероауксина).
Таким образом, в литературе отсутствуют данные об однореакторном способе С-тиометилирования пиррола и 2-(бензпиррол-3-ил)уксусной кислоты (гетероауксина) общей формулы 1 или 2.
Предлагается новый способ получения С-тиометилированных производных пиррола и 2-(бензпиррол-3-ил)уксусной кислоты общей формулы 1 или 2.
Сущность способа заключается в последовательном взаимодействии пиррола или 2-(бензпиррол-3-ил)уксусной кислоты (гетероауксина) с 37% водным формальдегидом и тиолом при их мольном соотношении 1:2:2 для пиррола (1:1:1 для гетероауксина), при 70 °С в течение 6 или 12 часов в среде пиридина. Реакция проходит по схемам:
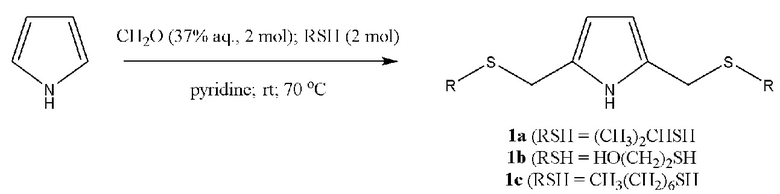
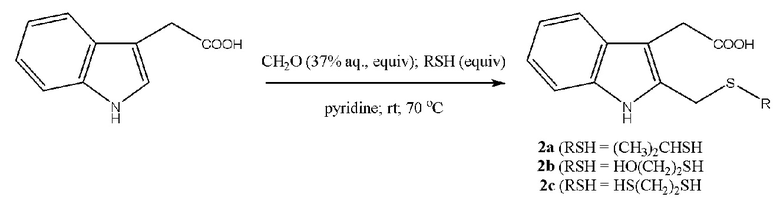
С-тиометилированные пиррол и гетероауксин общей формулы 1 или 2 образуются с участием пиррола или 2-(бензпиррол-3-ил)уксусной кислоты (гетероауксина), 37% водного формальдегида, тиола, взятых в мольном соотношении 1:2:2 для пиррола или 1:1:1 для гетероауксина. Пиридин сочетает роль полярного апротонного растворителя и катализатора. Выход целевых продуктов и время реакции представлены в табл. 1.
Существенные отличия предлагаемого способа:
Предлагаемый способ позволяет проводить one-pot реакции пиррола и гетероауксина с формальдегидом и меркаптанами.
Способ поясняется следующими примерами:
Пример 1: Методика получения С-тиометилированных производных пиррола и 3-индолилуксусной кислоты (гетероауксина)
В стеклянный реактор, установленный на магнитной мешалке с гидрозатвором и обратным холодильником, последовательно загружают при комнатной температуре 1 ммоль пиррола или гетероауксина, 2 мл пиридина, 0.16 мл (2 ммоль) 37%-формальдегида для пиррола или 0.08 мл (1 ммоль) 37%-формальдегида для гетероауксина, перемешивают 15-20 минут при 25-30°С. Затем в смесь добавляют 2 ммоль тиола для пиррола или 1 ммоль тиола для гетероауксина и нагревают до 70°С. Реакционную смесь перемешивают при этой температуре в течение 6 или 12 часов (контроль ТСХ). После окончания реакции, реакционную смесь обрабатывают н-гексаном для удаления пиридина с выделением продуктов реакции в виде масла, которое отделяют и растворяют в хлороформе или этилацетате для удаления дисульфидов в виде осадков. Отделяют раствор от осадка и упаривают, получая целевой С-тиометилированный продукт. Другие примеры, подтверждающие способ, приведены в таблице 1.
Спектральные характеристики 2,5-бис(2-пропилсульфанилметил)пиррола (1a)
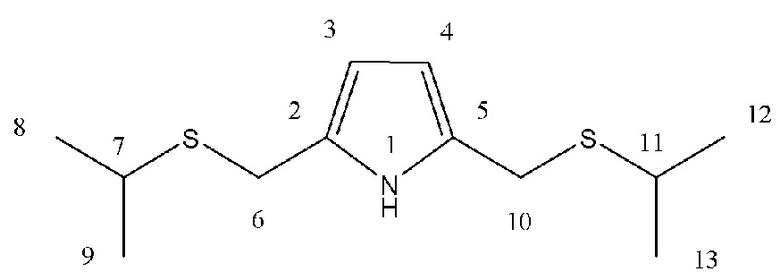
Масло бардового цвета. Выход: ~35%. Rf = 0.78 (элюент Г: ЭА 1:2). Спектр ЯМР 1Н (500 МГц, CDCl3): δ, м. д. (J, Гц): 1.23 (д, 12Н8,9,12,13, J = 6.5), 2.75 (м, 2Н7,11, J = 6.75), 3.75 (с, 4Н6,10), 5.89 (д, 2Н3,4, J = 2.5), 8.59 (с, 1Н1). Спектр ЯМР 13С (125 МГц, CDCl3): δ, м. д.: 23.05 (С8,9,12,13), 27.73 (С7,11), 34.27 (С6,10), 107.24 (С3,4), 124.06 (С2,5). Масс-спектр ГХ-МС (CH3CN), m/z (Iотн, %): 93 [M - C6H14S2], вычислено: 93.0578 [M - 150.0526]. 168 [M - C3H7S], вычислено: 168.0847 [M - 75.0268]. 243, вычислено: 243.1115. Найдено: 2S (8.6%), вычислено 2S (9%). C12H21NS2.
Спектральные характеристики 2,5-бис(гидроксиэтилсульфанилметил)пиррола (1b)
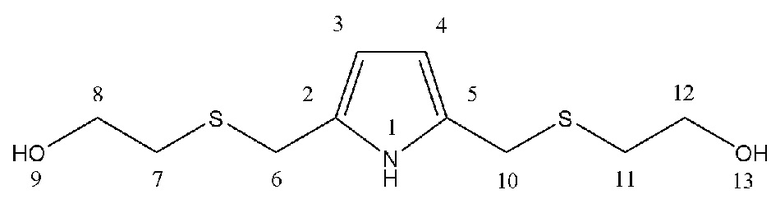
Масло коричневого цвета. Выход: ~60%. Rf = 0.18 (элюент Г: ЭА 1:2). ИК спектр (ν, см-1): 781.02 (C-S), 1410.76 и 1463.40 (C-N), 1585.72 и 1638.88 (Ar), 2874.52 и 2920.61, 3349.22 (NH,OH). Спектр ЯМР 1Н (400 МГц, CDCl3): δ, м. д. (J, Гц): 2.67 (т, 4Н8,12, J = 5.8), 3.66 (т, 4Н7,11, J = 5.8), 3.75 (с, 4Н6,10), 3.83 (с, 2Н9,13), 5.93 (д, 2Н3,4, J = 2.4), 8.77 (с, 1Н1). Спектр ЯМР 13С (100 МГц, CDCl3): δ, м. д.: 28.71 (С7,11), 34.39 (С6,10), 60.74 (С8,12), 108.13 (С3,4), 128.08 (С2,5). Масс-спектр HRMS ESI POS (CH3CN), m/z (Iотн, %): 270.0593 [M + Na]+, вычислено: 270.0593 [247.0701 + 22.9898] +. Найдено: 2S (8.9%), вычислено 2S (9%). C10H17NO2S2.
Спектральные характеристики 2,5-бис(гептилсульфанилметил)пиррола (1c)
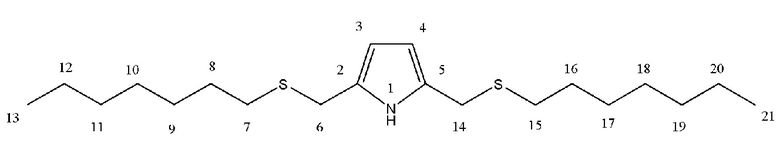
Масло коричневого цвета. Выход: ~25%. Rf = 0.27 (элюент Г: ЭА 1:2). Масс-спектр HRMS ESI POS (CH3CN), m/z (Iотн, %): 356.2438 [M + H]+, вычислено: 356.2440 [355.2367 + 1.0078] +. Найдено: 2S (9.4%), вычислено 2S (9%). C20H37NS2.
Спектральные характеристики 2-изопропилсульфанилметилгетероауксина (2a)
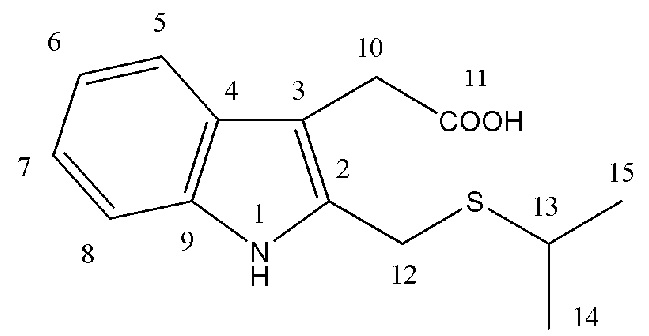
Масло жёлтого цвета. Выход: ~30%. Rf = 0.33 (элюент Г: ЭА 1:1). Спектр ЯМР 1Н (500 МГц, CDCl3): δ, м. д. (J, Гц): 1.30 (д, 6Н14,15, J = 4.5), 3.16 (м, 1H13, J = 6.625), 3.69 (с, 2Н12), 3.76 (т, 2Н10, J = 13.0), 4.83 (с, 1Н1), 4.91 (с, 1Н11), 7.10 (т, 1Н6, J = 7.25), 7.15 (т, 1Н7, J = 7.25), 7.36 (д, 1Н5, J = 8.0), 7.56 (д, 1Н8, J = 7.5). Спектр ЯМР 13С (125 МГц, CDCl3): δ, м. д.: 23.63 (С14,15), 31.45 (С12), 34.16 (С13), 34.61 (С10), 108.65, 109.91, 119.09, 119.93, 122.16, 126.74, 128.52, 135.91 (С2 - С9), 176.28 (С11). Масс-спектр HRMS ESI NEG (CH3CN), m/z (Iотн, %): 262.0904 [M - H]-, вычислено: 262.0902 [263.0980 - 1.0078]-. ESI POS: 264.0956 [M + H]+, вычислено: 264.1053 [263.0980 + 1.0078]+. 286.0769 [M + Na]+, вычислено: 286.0872 [263.0980 + 22.9898]+. Найдено: 1S (4.4%), вычислено 1S (4.5%). C14H17NO2S.
Спектральные характеристики 2-гидроксиэтилсульфанилметилгетероауксина (2b)
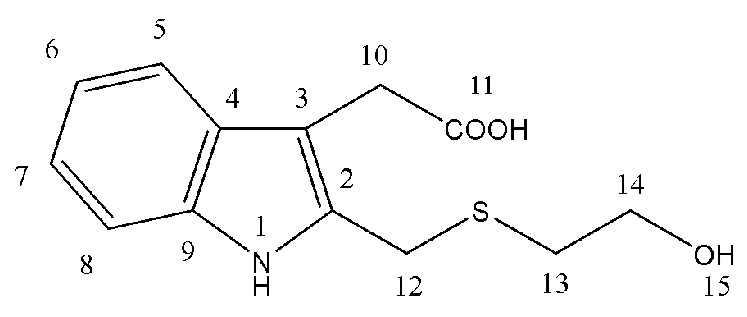
Масло жёлтого цвета. Выход: ~99%. Rf = 0.33 (элюент Г: ЭА 1:2). ИК спектр (ν, см-1): 781.02 (C-S), 1045.59, 1247.01, 1373.63 и 1464.08 (C-N), 1558.66 и 1615.31 (Ar), 1733.45 (CO), 2929.41 и 2981.42, 3422.14 (NH,OH). Уф спектр (CH3CN), λmax, нм : 280. Спектр ЯМР 1Н (500 МГц, CDCl3): δ, м. д. (J, Гц): 2.51 (т, 2Н14, J = 5.75), 3.45 (т, 2Н13, J = 5.75), 3.75 (с, 2Н12), 4.15 (к, 2Н10, J = 7.0), 5.08 (с, 1Н1), 5.76 (с, 2Н11,15), 7.15 (т, 1Н6, J = 7.3), 7.24 (т, 1Н7, J = 7.5), 7.36 (д, 1Н5, J = 8), 7.583 (д, 1Н8, J = 7.5). Спектр ЯМР 13С (125 МГц, CDCl3): δ, м. д.: 30.89 (С13), 33.35 (С12), 47.72 (С10), 61.29 (С14), 108.05, 110.20, 119.28 120.13, 122.36, 127.02, 128.44, 135.83 (С2 - С9), 176.183 (С11). Масс-спектр HRMS ESI NEG (H2O:CH3OH (9:1)), m/z (Iотн, %): 264.0602 [M - H]-, вычислено: 264.0700 [265.0773 - 1.0078]-. ESI POS: 266.0759 [M + H]+, вычислено: 266.0845 [265.0773 + 1.0078]+. 288.0572 [M + Na]+, Вычислено: 288.0665 [265.0773 + 22.9898]+. ESI NEG (CH3CN): 264.0775 [M - H]-, вычислено: 264.0700 [265.0773 - 1.0078]-. Найдено: 1S (4.2%), вычислено 1S (4.5%). C13H15NO3S.
Спектральные характеристики 2-тиоэтилсульфанилметилгетероауксина (2с)
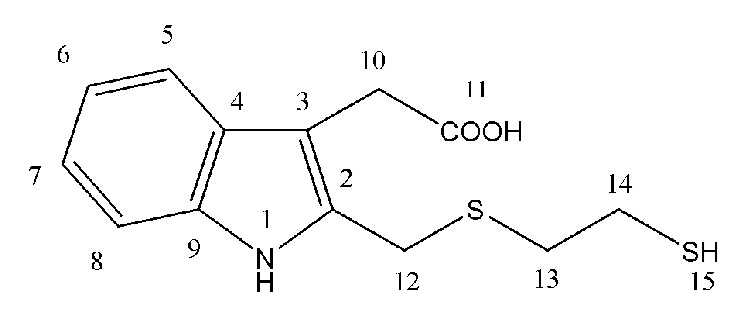
Масло жёлтого цвета. Выход: ~30%. Rf = 0.11 (элюент Г: ЭА 1:1). ИК спектр (ν, см-1): 746.25 (C-S), 1013.06, 1197.89, 1360.02 и 1413.04 (C-N), 1555.45 и 1615.89 (Ar), 1711.60 (CO), 2624.04 (SH), 2853.92 и 2918.36, 3350.00 (NH,OH). Спектр ЯМР 1Н (500 МГц, CDCl3): δ, м. д. (J, Гц): 1.72 (с, 1Н15), 2.93 (т, 2Н14, J = 7.5), 3.01 (т, 2Н13, J = 6.25), 3.82 (с, 2Н12), 5.72 (с, 2Н10), 5.77 (с, 1Н11), 5.80 (с, 1Н1), 7.18 (т, 1Н6, J = 7.25), 7.35 (д, 1Н7, J = 6.0), 7.65 (д, 1Н5, J = 7.5), 7.76 (т, 1Н8, J = 7.5). Спектр ЯМР 13С (125 МГц, CDCl3): δ, м. д.: 25.32 (С14), 30.65 (С13), 31.40 (С12), 39.09 (С10), 108.36, 111.36, 118.86, 119.58, 122.09, 123.44, 127.27, 136.14 (С2-9), 176.28 (С11). Масс-спектр HRMS ESI NEG (H2O:CH3OH (9:1)), m/z (Iотн, %): 280.0692 [M - H]-, вычислено: 280.0471 [281.0544 - 1.0078]-. Найдено: 2S (10%), вычислено 2S (9%). Масс-спектр ГХ-МС, m/z (Iотн, %): CHCl3: 221 [M - C2H4O2]. Вычислено: 221.0338 [M - 60.0206]. Найдено: 2S (10%), вычислено 2S (9%). C13H15NO2S2.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ИНФЕКЦИЙ H. PYLORI С ПРИМЕНЕНИЕМ ИНГИБИТОРОВ MTAN | 2015 |
|
RU2663803C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФАНИЛПРОИЗВОДНЫХ АНТИПИРИНА | 2020 |
|
RU2740911C1 |
| Способ получения 2-фтор-3-метилбут-2-ениламина или его гидрохлорида (Варианты) | 2016 |
|
RU2610281C1 |
| ПИКОЛИНАМИДЫ С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2703402C2 |
| ПИКОЛИНАМИДНЫЕ СОЕДИНЕНИЯ С ФУНГИЦИДНОЙ АКТИВНОСТЬЮ | 2015 |
|
RU2687160C2 |
| ИНДОЛИН-СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ | 2007 |
|
RU2402530C2 |
| 2,4,5-ТРИ(МЕТОКСИФЕНИЛ) ЦИС-ИМИДАЗОЛИН И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2730497C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ (Е)-2-(3-(1Н-ПИРРОЛ-2-ИЛ)АЛЛИЛИДЕН)-1Н-ИНДАН-1,3(2Н)-ДИОНОВ, А ТАКЖЕ ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ФОТОСЕНСИБИЛИЗАТОРОВ ДЛЯ СОЛНЕЧНЫХ БАТАРЕЙ | 2023 |
|
RU2812075C1 |
| ПРОИЗВОДНЫЕ ИМИДАЗОПИРИДИН-2-ОНА, ОБЛАДАЮЩИЕ mTOR ИНГИБИРУЮЩЕЙ АКТИВНОСТЬЮ | 2009 |
|
RU2478636C2 |
| ПРОИЗВОДНЫЕ 2-((4-(4-(БЕНЗИЛОКСИ)ПИРИМИДИН-2-ИЛ)ПИПЕРАЗИН-1-ИЛ)МЕТИЛ)-1Н-БЕНЗО[d]ИМИДАЗОЛА В КАЧЕСТВЕ НИЗКОМОЛЕКУЛЯРНЫХ АГОНИСТОВ РЕЦЕПТОРА ГЛЮКАГОНОПОДОБНОГО ПЕПТИДА-1 | 2024 |
|
RU2838323C1 |
Изобретение относится к области органической химии, в частности к способу получения С-тиометилированных производных пиррола общей формулы 1 или 2, где в формуле 1 R = изо-C3H7, (СН2)2ОН, н-С7Н15, в формуле 2 R = изо-C3H7, (СН2)2ОН, (СН2)2SН. Способ характеризуется тем, что к предварительно полученной при 25-30°С в течение 15-20 мин смеси 37%-ного водного формальдегида с пирролом или 2-(бензпиррол-3-ил)уксусной кислотой добавляют соответствующий тиол RSH с последующим перемешиванием при 70°С в течение 6 или 12 ч в среде пиридина. Предлагаемый способ является однореакторным и позволяет получать новые производные пиррола общей формулы 1 или 2. 1 табл., 1 пр. 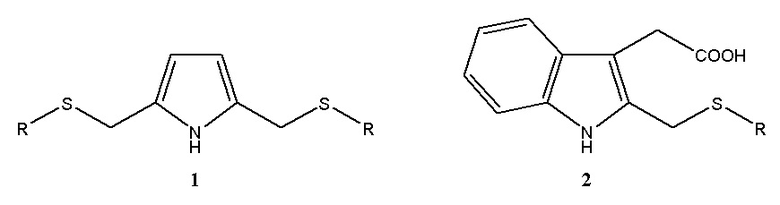
Способ получения тиометилированных производных пиррола общей формулы 1 или 2
 ,
,
где в формуле 1 R = изо-C3H7, (СН2)2ОН, н-С7Н15, в формуле 2 R = изо-C3H7, (СН2)2ОН, (СН2)2SН, отличающийся тем, что к предварительно полученной при 25-30°С в течение 15-20 мин смеси 37%-ного водного формальдегида с пирролом или 2-(бензпиррол-3-ил)уксусной кислотой добавляют соответствующий тиол RSH с последующим перемешиванием при 70°С в течение 6 или 12 ч в среде пиридина.
| I.T | |||
| KIM et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
| ПРИСПОСОБЛЕНИЕ К РОЯЛЮ ИЛИ ПИАНИНО ДЛЯ ПЕРЕДВИГАНИЯ ЛЕНТЫ С НОТНЫМИ ЗНАКАМИ | 1923 |
|
SU1087A1 |
| M.F | |||
| SEMMELHACK et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| AM | |||
| CHEM | |||
| SOC., 2005, 127, pp | |||
| ПЕРЕДВИЖНОЙ ЧЕРПАКОВЫЙ ЭЛЕВАТОР-ТРАНСПОРТЕР | 1927 |
|
SU7759A1 |
| WO 2005095352 A1, 13.10.2005 | |||
| Способ получения 2-{ [({ 2-[({ [2-(аминокарбонил)фенил]амино} метил)тио]алкил} тио)-метил]амино} бензамидов | 2021 |
|
RU2779385C2 |
Авторы
Даты
2024-05-21—Публикация
2023-01-30—Подача