Область техники
Группа изобретений относится к медицине, более конкретно к лабораторной диагностике и может быть использована для выявления ДНК Neisseria gonorrhoeae в биологических образцах.
Уровень техники
Neisseria gonorrhoeae (гонококк) - облигатный внутриклеточный бактериальный патоген человека. Гонококк является этиологическим агентом гонореи - инфекционного заболевания, передающегося половым путем. Гонорея является вторым по распространенности бактериальным инфекционным заболеванием, передающимся половым путем (после хламидиоза), инфицируя ежегодно свыше 60 миллионов человек [WHO. Global prevalence and incidence of selected curable sexually transmitted infections: overview and estimates. Geneva: World Health Organization, 2001].
Гонококки поражают преимущественно отделы урогенитального тракта, выстланные цилиндрическим эпителием: слизистые оболочки цервикального канала, уретры, парауретральные и/или большие вестибулярные железы. При попадании инфекции в урогенитальный тракт возможно развитие воспалительных заболеваний, таких как цервицит, уретрит, парауретрит, бартолинит. За пределами урогенитального тракта гонококки поражают слизистые оболочки глотки, прямой кишки, конъюнктиву и могут вызывать фарингит, тонзиллит, стоматит, проктит, конъюнктивит [Под ред. Савельевой Г.М., Бреусенко В.Г. Гинекология: Учебник. Москва, «ГЭОТАРМЕД», 2004].
Клинические симптомы гонореи могут иметь неспецифический характер, перекрываться с симптомами других инфекций, передающихся половым путем (ИППП). Более 50% случаев гонококковой инфекции цервикального канала имеют бессимптомное течение [Bignell С. et al. European Guideline on the Diagnosis and Treatment of Gonorrhoea in Adults, 2012]. Инфекции, протекающие бессимптомно, часто остаются не диагностированными и, следовательно, пациентам не назначается адекватная терапия в течение длительного периода времени. В отсутствие лечения гонорейная инфекция приводит к таким серьезным последствиям, как воспалительные заболевания органов малого таза у женщин, патология беременности, мужское и женское бесплодие, синдром хронической тазовой боли, конъюнктивит у новорожденных [WHO. Global prevalence and incidence of selected curable sexually transmitted infections: overview and estimates. Geneva: World Health Organization, 2001]. Кроме того, гонорея является одним из кофакторов передачи ВИЧ-инфекции [Verma et al. Diagnostic implications of 16S ribosomal assay for gonorrhoea. Sex Transm Infect. 2010 Nov; 86(6): 461-464].
В связи с затрудненной клинической диагностикой трудно переоценить важность надежной и эффективной лабораторной диагностики гонореи. Для выявления этиологического агента гонореи - гонококков - широко применяются традиционные методы лабораторной диагностики бактериальных инфекций - бактериоскопический (микроскопический) и бактериологический (культуральный).
Микроскопическое исследование мазков, окрашенных метиленовым синим и по Граму, представляет собой простой и быстрый метод выявления гонококков. Однако метод субъективен, обладает низкой чувствительностью (45-80%) и специфичностью (38%), особенно при наличии обильной сопутствующей микрофлоры [Под ред. Савельевой Г.М., Бреусенко В.Г. Гинекология: Учебник. Москва, «ГЭОТАРМЕД», 2004].
«Золотым стандартом» диагностики гонореи в большинстве стран мира остается бактериологический (культуральный) метод, обладающий высокой специфичностью. Однако культуральный метод требует наличия живых микроорганизмов в анализируемом образце, а гонококки являются микроорганизмами с низкой устойчивостью к воздействию факторов внешней среды и ограниченной жизнеспособностью вне организма человека. Вследствие этого чувствительность метода варьирует в широких пределах и находится в сильной зависимости от типа и качества отбора биологических образцов, условий их транспортировки и хранения, а также условий культивирования. Данный недостаток метода в совокупности с его трудоемкостью, длительными сроками культивирования и сложностями стандартизации и автоматизации заставляют исследователей искать новые возможности диагностики гонореи.
Современные молекулярно-биологические методы, основанные на амплификации нуклеиновых кислот (МАНК), имеют ряд преимуществ перед традиционными методами диагностики: более высокая чувствительность, независимость от жизнеспособности гонококков в анализируемом образце, быстрота выполнения, возможность стандартизации и автоматизации анализа. Наибольшее распространение среди МАНК получил метод полимеразной цепной реакции (ПЦР). Для некоторых ИППП, например, для хламидийной инфекции, ПЦР с успехом заменяет и вытесняет традиционные методы диагностики [Lanjouw Е. et al. European guideline for the management of Chlamydia trachomatis infections, 2010]. Однако для диагностики гонореи метод ПЦР оказался не столь успешен: существуют объективные затруднения в разработке тест-системы (набора реагентов) для выявления гонококков методом ПЦР, которая обладала бы одновременно высокой чувствительностью и высокой специфичностью [Verma et al. Diagnostic implications of 16S ribosomal assay for gonorrhoea. Sex Transm Infect. 2010 Nov; 86(6): 461-464]. Это связано с уникальными свойствами ДНК гонококков.
Во-первых, между Neisseria gonorrhoeae и другими видами бактерий рода Neisseria существует необычно высокая степень гомологии последовательностей ДНК. Гомология с патогенным представителем рода Neisseria - Neisseria meningitidis (менингококком) объясняется происхождением в процессе эволюции от общего предшественника. Гомология с непатогенным представителями (комменсалами) рода Neisseria - N. subflava, N. cinerea, N. flavescens, N. lactamica, N. sicca и другими - объясняется необычно высокой склонностью бактерий рода Neisseria к межвидовому горизонтальному переносу генов. Высокая степень межвидовой гомологии нейссерий является причиной фундаментальной проблемы недостаточной специфичности многих известных тест-систем для выявления гонококков: кросс-реактивность с негонококковыми нейссериями приводит к большому количеству ложноположительных результатов анализа [Whiley D.M. et al. Nucleic acid amplification testing for Neisseria gonorrhoeae: an ongoing challenge. J Mol Diagn. 2006 Feb; 8(1): 3-15. Review].
Во-вторых, вид Neisseria gonorrhoeae представлен большим количеством штаммов, демонстрирующих необычно высокую степень генетического полиморфизма. Распределение штаммов внутри человеческой популяции весьма неоднородно, то есть существенно различается на разных территориях, в различных группах пациентов, а также меняется с течением времени. Такая вариабельность является причиной проблемы недостаточной чувствительности некоторых известных тест-систем для выявления гонококков: утрата некоторыми штаммами последовательности-мишени ПЦР приводит к появлению ложноотрицательных результатов анализа [Whiley D.M. et al. Nucleic acid amplification testing for Neisseria gonorrhoeae: an ongoing challenge. J Mol Diagn. 2006 Feb; 8(1): 3-15. Review].
Именно вышеописанные особенности генетического материала гонококков делают очень нетривиальной задачей создание тест-системы для выявления гонококков методом ПЦР, которая обладала бы одновременно высокой чувствительностью и высокой специфичностью. Поскольку чувствительность и специфичность ПЦР тест-системы в значительной степени зависит от мишени ПЦР, создание оптимальной тест-системы прежде всего означает выбор наиболее подходящего гена-мишени и разработку оптимальных олигонуклеотидных праймеров, обеспечивающих специфическую амплификацию фрагмента гена-мишени. Существует большое количество «in house» («домашних») и серийно выпускаемых (коммерческих) наборов реагентов (тест-систем) для выявления ДНК Neisseria gonorrhoeae методом ПЦР, но многие из них демонстрируют неоптимальный выбор мишени ПЦР и соответствующих олигонуклеотидных праймеров и, как следствие, проблемы с чувствительностью и/или специфичностью анализа.
Так, широко применяемый международный коммерческий набор реагентов COBAS® AMPLICOR производства компании Roche Molecular Systems, Inc. для одновременного выявления двух патогенов, Chlamydia trachomatis и Neisseria gonorrhoeae [Регистрационное удостоверение № ФСЗ 2011/09814 25.05.2011], в качестве мишени для выявления Neisseria gonorrhoeae использует фрагмент гена цитозин-ДНК-метилтрансферазы [ЕР 0630971 В1]. Набор обладает высокой чувствительностью, однако его специфичность недостаточно высока: была продемонстрирована кросс-реактивность набора с нейссериями-комменсалами, представителями видов N. subflava, N. cinerea, N. flavescens, N. lactamica, N. sicca и даже с лактобактериями [Luijt D.S. et al. Comparison of COBAS AMPLICOR Neisseria gonorrhoeae PCR, including confirmation with N. gonorrhoeae-specific 16S rRNA PCR, with traditional culture. J Clin Microbiol. 2005 Mar; 43(3): 1445-1447]. Недостаточная специфичность приводит к получению большого количества ложноположительных результатов. Так, в исследовании Luijt D.S. et al., 2005 чувствительность набора для выявления Neisseria gonorrhoeae составила 100%, специфичность - 97.6%, что в популяции с уровнем распространенности гонореи 2.8% дало прогностическую значимость положительного результата всего 54.8%, что является неудовлетворительным. Согласно европейскому руководству 2012 года по диагностике и лечению гонореи у взрослых, рекомендуется использовать для выявления гонококков только тест-системы с прогностической значимостью положительного результата не менее 90% [Bignell С. et al. European Guideline on the Diagnosis and Treatment of Gonorrhoea in Adults, 2012]. Таким образом данный набор не подходит в качестве единственной тест-системы для диагностики гонореи и требует дополнительного «подтверждающего» теста.
Известен набор реагентов для обнаружения Гонококка (Neisseria gonorrhoeae) методом полимеразной цепной реакции (ГОНОПОЛ) производства ООО НПФ «ЛИТЕХ» [Регистрационное удостоверение № ФСР 2007/01271 от 22.11.2007]. В данном наборе в качестве мишени ПЦР используется фрагмент гена сррВ, расположенного на криптической плазмиде [Шипицына Е.В. и др. Оценка методов амплификации нуклеиновых кислот, применяемых для выявления Neisseria gonorrhoeae в России. Журнал акушерства и женских болезней. 2009, том LVIII, выпуск 1, с. 60-70]. Криптическая плазмида Neisseria gonorrhoeae мультикопийна, что теоретически дает более высокую аналитическую чувствительность тест-систем с данной мишенью по сравнению с тест-системами с однокопийными хромосомными мишенями. Однако многоцентровая валидация данной мишени в исследовании Bruisten S.M. et al., 2004 показало: она отсутствует в 5.8% штаммов Neisseria gonorrhoeae, соответственно эти штаммы дают ложноотрицательные результаты. Таким образом чувствительность тест-систем с мишенью сррВ никогда не превысит 94%, что является неприемлемым [Bruisten S.M. et al. Multicenter validation of the cppB gene as a PCR target for detection of Neisseria gonorrhoeae. J Clin Microbiol. 2004 Sep; 42(9): 4332-4334]. Специфичность тест-систем с мишенью сррВ также неоптимальна: показана кросс-реактивность с негонококковыми нейсериями: N. meningitides, N. subflava, N. cinerea [Palmer H.M. et al. Evaluation of the specificities of five DNA amplification methods for the detection of Neisseria gonorrhoeae. J Clin Microbiol. 2003 Feb; 41(2): 835-837; Boel C.H. et al. Evaluation of conventional and real-time PCR assays using two targets for confirmation of results of the COBAS AMPLICOR Chlamydia trachomatis/Neisseria gonorrhoeae test for detection of Neisseria gonorrhoeae in clinical samples. J Clin Microbiol. 2005 May; 43(5): 2231-2235; Whiley D.M. et al. Nucleic acid amplification testing for Neisseria gonorrhoeae: an ongoing challenge. J Mol Diagn. 2006 Feb; 8(1): 3-15. Review]. В совокупности это делает сррВ неподходящей мишенью для выявления Neisseria gonorrhoeae.
Известен набор реагентов для выявления ДНК Нейссерии гонореи (Neisseria gonorrhoeae) методом полимеразной цепной реакции (ГОНО-ГЕН) производства ООО «НПО ДНК-Технология» [Регистрационное удостоверение № ФСР 2008/03850 от 26.04.2010]. В данном наборе в качестве мишени ПЦР используется фрагмент псевдогена porA [Шипицына Е.В. и др. Оценка методов амплификации нуклеиновых кислот, применяемых для выявления Neisseria gonorrhoeae в России. Журнал акушерства и женских болезней. 2009, том LVIII, выпуск 1, с. 60-70]. Псевдоген porA отсутствует у нейссерий-комменсалов, значительно отличается у Neisseria meningitidis, но в тоже время является высококонсервативным среди различных штаммов гонококков, что делает его очень ценной мишенью для выявления гонококков методом ПЦР. Тест-системы с этой мишенью считаются одними из самых надежных и широко используются в качестве референсных при валидации новых тест-систем. Однако и эта мишень имеет недостатки. Псевдоген porA - однокопийная мишень, что может негативно сказаться на чувствительности тест-системы. Кроме того, в 2011 году были опубликованы данные о клиническом изоляте Neisseria gonorrhoeae, имеющем последовательность porA, на 99% гомологичную последовательности porA одного из штаммов Neisseria meningitidis. За счет этого данный изолят демонстрирует ложноотрицательный результат при анализе методом ПЦР с porA в качестве мишени [Whiley D.M. et al. False-negative results using Neisseria gonorrhoeae porA pseudogene PCR - a clinical gonococcal isolate with an N. meningitidis porA sequence, Australia, March 2011. Euro Surveill. 2011 May 26; 16(21). pii: 19874].
Одним из путей решения проблемы трудности создания тест-системы, совмещающей высокую чувствительность и специфичность, является введение дополнительной мишени для ПЦР в рамках одной тест-системы или использование комбинации двух и более тест-систем с различными мишенями. Такой подход, несомненно, повышает надежность выявления Neisseria gonorrhoeae, однако повышает трудоемкость, стоимость и сроки исполнения анализа. Кроме того, данный подход - увеличение количества мишеней для выявления одного патогена - снижает возможности одновременного выявления нескольких патогенов в одной пробирке на имеющемся в лаборатории оборудовании, что не вполне отвечает современным потребностям лабораторной диагностики урогенитальных заболеваний, часто протекающих по типу микст-инфекций.
Раскрытие группы изобретений.
Задачами настоящей группы изобретений являются: разработка и валидация набора реагентов, позволяющего с высокой чувствительностью и высокой специфичностью выявлять все клинически значимые штаммы Neisseria gonorrhoeae с помощью единственной мишени полимеразной цепной реакции, с возможностью как самостоятельного использования для выявления ДНК одного патогена - Neisseria gonorrhoeae, так и в составе мультиплексного набора для выявления ДНК нескольких патогенов, с возможностью количественного определения ДНК Neisseria gonorrhoeae.
Поставленные задачи решены созданием набора реагентов для выявления ДНК Neisseria gonorrhoeae в образце методом полимеразной цепной реакции, включающего по меньшей мере два олигонуклеотидных праймера для полимеразной цепной реакции, отличающегося тем, что один олигонуклеотидный праймер из указанных двух олигонуклеотидных праймеров имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 1, второй олигонуклеотидный праймер из указанных двух олигонуклеотидных праймеров имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 2.
В частном случае выполнения набор по изобретению характеризуется тем, что один олигонуклеотидный праймер из указанных двух олигонуклеотидных праймеров имеет последовательность SEQ ID NO: 1, второй олигонуклеотидный праймер из указанных двух олигонуклеотидных праймеров имеет последовательность SEQ ID NO: 2.
В частном случае выполнения набор по изобретению характеризуется тем, что дополнительно содержит олигонуклеотидный зонд для детекции ДНК Neisseria gonorrhoeae в режиме реального времени, где указанный зонд на 5′-конце содержит флуоресцентный краситель, на 3′-конце содержит гаситель флуоресценции.
В частном случае выполнения набор по изобретению характеризуется тем, что флуоресцентный краситель выбран из группы: JOE, FAM, R6G, ROX, Су5, Су5.5, HEX.
В частном случае выполнения набор по изобретению характеризуется тем, что гаситель флуоресценции выбран из группы: BHQ1, BHQ2, BHQ3, RTQ.
В частном случае выполнения набор по изобретению характеризуется тем, что олигонуклеотидный зонд имеет последовательность, гомологичную по меньшей мере на 90% последовательности SEQ ID NO: 3.
В частном случае выполнения набор по изобретению характеризуется тем, что олигонуклеотидный зонд имеет последовательность SEQ ID NO: 3.
В частном случае выполнения набор по изобретению характеризуется тем, что олигонуклеотидный зонд представляет собой (FAM)-CCGACATCGGCCGCCGATATTGGCA-(BHQ1).
В частном случае выполнения набор по изобретению характеризуется тем, что дополнительно содержит термостабильную ДНК-полимеразу, буферный раствор для ПЦР, дезоксинуклеозидтрифосфаты.
В частном случае выполнения набор по изобретению характеризуется тем, что дополнительно содержит по меньшей мере один калибратор для количественной оценки содержания ДНК Neisseria gonorrhoeae в образце, содержащий известные концентрации фрагмента ДНК Neisseria gonorrhoeae, используемого для выявления ДНК Neisseria gonorrhoeae.
В частном случае выполнения набор по изобретению характеризуется тем, что дополнительно содержит реагенты для выявления в образце методом мультиплексной полимеразной цепной реакции ДНК по меньшей мере одного дополнительного микроорганизма, выбранного из группы: Chlamydia trachomatis, Trichomonas vaginalis, Mycoplasma genitalium.
В частном случае выполнения набор по изобретению характеризуется тем, что образец выбран из группы: соскоб из цервикального канала, соскоб из уретры, мазок из влагалища, моча, семенная жидкость, мазок из прямой кишки, мазок из глотки, мазок с конъюнктивы, спинно-мозговая жидкость, кровь.
Объем притязаний включает также применение вышеописанных наборов реагентов для выявления ДНК Neisseria gonorrhoeae в биологических образцах.
Созданный в рамках настоящего изобретения набор реагентов использует в качестве мишени ПЦР фрагмент мультикопийного гена 16s rRNA Neisseria gonorrhoeae. Разработанные олигонуклеотидные праймеры, обеспечивающие специфическую амплификацию данного фрагмента, имеют оптимальную олигонуклеотидную последовательность: с одной стороны, достаточно высококонсервативную среди многообразия штаммов Neisseria gonorrhoeae для того, чтобы выявлять все штаммы, с другой стороны, высокоспецифичную для вида Neisseria gonorrhoeae, характеризующуюся степенью межвидовой гомологии, достаточно низкой для отсутствия кросс-реактивности с негонококковыми видами нейссерий и другими бактериями. Олигонуклеотидные праймеры, имеющие последовательности SEQ ID NO: 1 и SEQ ID NO: 2, обеспечивают амплификацию фрагмента гена 16s rRNA размером 85 нуклеотидов. Именно такой размер амплифицируемого фрагмента, как оказалось, придает процессу амплификации минимальную восприимчивость как к примесям-ингибиторам ПЦР, так и к конкуренции со стороны других ПЦР мишеней, что дополнительно увеличивает чувствительность и специфичность анализа.
Использование группы изобретений позволяет достичь следующего технического результата: выявление с высокой чувствительностью и специфичностью всех клинически значимых штаммов Neisseria gonorrhoeae с помощью единственной мишени полимеразной цепной реакции; при этом высокая специфичность достигается в том числе для образцов, взятых из мест колонизации негонококковых нейссерий. В частном случае выполнения группа изобретений позволяет определять ДНК Neisseria gonorrhoeae в количественном формате, что может быть полезно для уточнения диагноза при сомнительных/дискордантных результатах анализа. Кроме того, уровень бактериальной нагрузки может иметь патогенетическое и прогностическое значение и оказывать влияние на выбор тактики этиотропной терапии. В частном случае выполнения группа изобретений позволяет выявлять одновременно несколько возбудителей инфекций, передаваемых половым путем, что может быть полезно для диагностики часто встречающихся микст-инфекций урогенитального тракта.
Осуществление группы изобретений
Пример 1. Выявление (качественное определение) ДНК Neisseria gonorrhoeae в биологических образцах.
В исследование были включены 319 пациентов женского пола с жалобами на наличие зуда/жжения в области половых органов и/или дизурии. От каждого пациента получали по два биологических образца - соскоба из цервикального канала. Взятые у пациентов цервикальные образцы помещали в 1 мл сахарозо-фосфатного буфера. Первый образец исследовали методом полимеразной цепной реакции с использованием референсного набора реагентов для выявления ДНК Neisseria gonorrhoeae, ранее прошедшего международную валидацию (Hjelmevoll S.O. et al. Clinical validation of a real-time polymerase chain reaction detection of Neisseria gonorrheae porA pseudogene versus culture techniques. Sex Transm Dis. 2008 May; 35(5): 517-520). Второй образец исследовали методом полимеразной цепной реакции с использованием набора реагентов для выявления ДНК Neisseria gonorrhoeae по изобретению. Далее проводилось сопоставление результатов, полученных двумя наборами реагентов.
Исследование образцов с использованием референсного метода.
Выделение ДНК из биологических образцов проводили с использованием набора реагентов MagNa Pure LC DNA Isolation kit I (Roche Molecular Biochemicals, Германия) в соответствии с инструкцией производителя. Объем элюции составил 100 мкл, далее образец разводили в 2 раза, добавляя еще 100 мкл буфера. Для амплификации ДНК методом полимеразной цепной реакции использовали 11,5 мкл полученного элюата. Постановку полимеразной цепной реакции и интерпретацию результатов исследования осуществляли как описано ранее (Hjelmevoll S.O. et al. Clinical validation of a real-time polymerase chain reaction detection of Neisseria gonorrheae porA pseudogene versus culture techniques. Sex Transm Dis. 2008 May; 35(5): 517-520).
Исследование образцов с использованием набора реагентов по изобретению.
Выделение ДНК из биологических образцов проводили с использованием набора реагентов ДНК-Сорб-АМ (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва, кат. №102-22). До выделения ДНК в пробирки вносили по 10 мкл препарата внутреннего контрольного образца (ВКО). Для амплификации ДНК методом полимеразной цепной реакции использовали 10 мкл полученного элюата (объем полученного элюата после экстракции составлял 100 мкл).
Реакционную смесь для полимеразной цепной реакции готовили следующим образом. Сначала готовили ПЦР-смесь-1, содержащую олигонуклеотидные праймеры, олигонуклеотидные зонды для детекции и дезоксирибонуклеозидтрифосфаты в буфере ТЕ. Состав ПЦР-смеси-1 приведен в таблице 1.
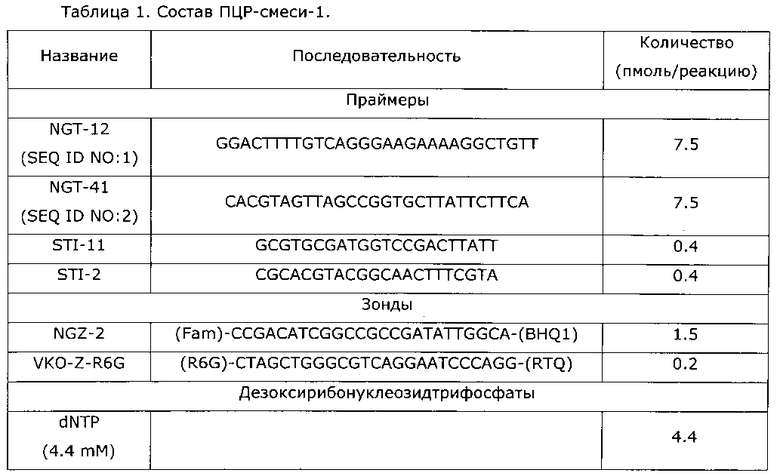
Затем в каждую реакционную пробирку вносили по 10 мкл ПЦР-смеси-1, по 5 мкл ПЦР-смеси-2 red (ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, Москва, кат. №863), содержащей Taq-полимеразу, и по 10 мкл элюата, полученного при выделении ДНК из биологических образцов.
Амплификацию проводили на приборе «Rotor-Gene Q» (QIAGEN, Германия).
Полученные данные - кривые накопления флуоресцентного сигнала по двум каналам - анализировались с помощью программного обеспечения прибора «Rotor-Gene Q». Сигнал, свидетельствующий о накоплении продукта амплификации фрагмента ДНК Neisseria gonorrhoeae, детектировался по каналу Green, ДНК ВКО детектировался по каналу Yellow. Результаты интерпретировались на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что определяет наличие (или отсутствие) для данной пробы ДНК значения порогового цикла «Ct» в соответствующей графе в таблице результатов.
Результаты интерпретировались следующим образом:
- ДНК Neisseria gonorrhoeae обнаружена, если для данной пробы в таблице результатов по каналу Green определено значение порогового цикла Ct. При этом кривая флуоресценции данной пробы должна пересекать пороговую линию на участке характерного экспоненциального подъема флуоресценции.
- ДНК Neisseria gonorrhoeae не обнаружена, если для данной пробы в таблице результатов по каналу Green не определено (отсутствует) значение порогового цикла Ct (кривая флуоресценции не пересекает пороговую линию), а в таблице результатов по каналу Yellow определено значение порогового цикла Ct, не превышающее 33.
- Результат анализа невалидный, если для данной пробы не определено (отсутствует) или превышает 33 значение порогового цикла Ct по каналу для детекции Yellow и не определено (отсутствует) значение порогового цикла Ct по каналу Green.
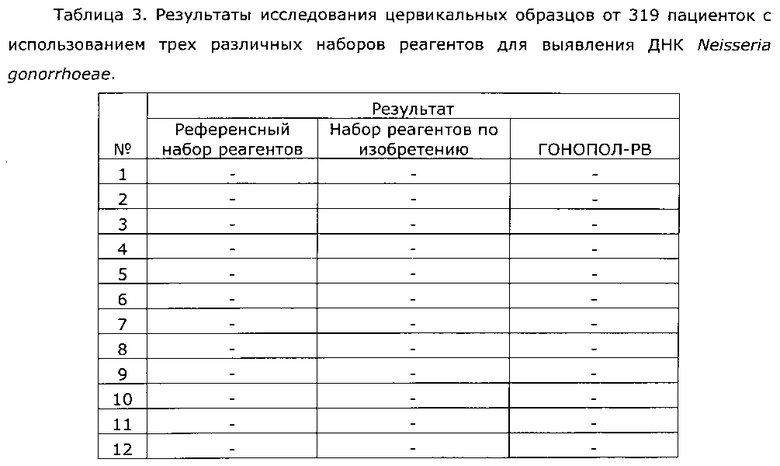
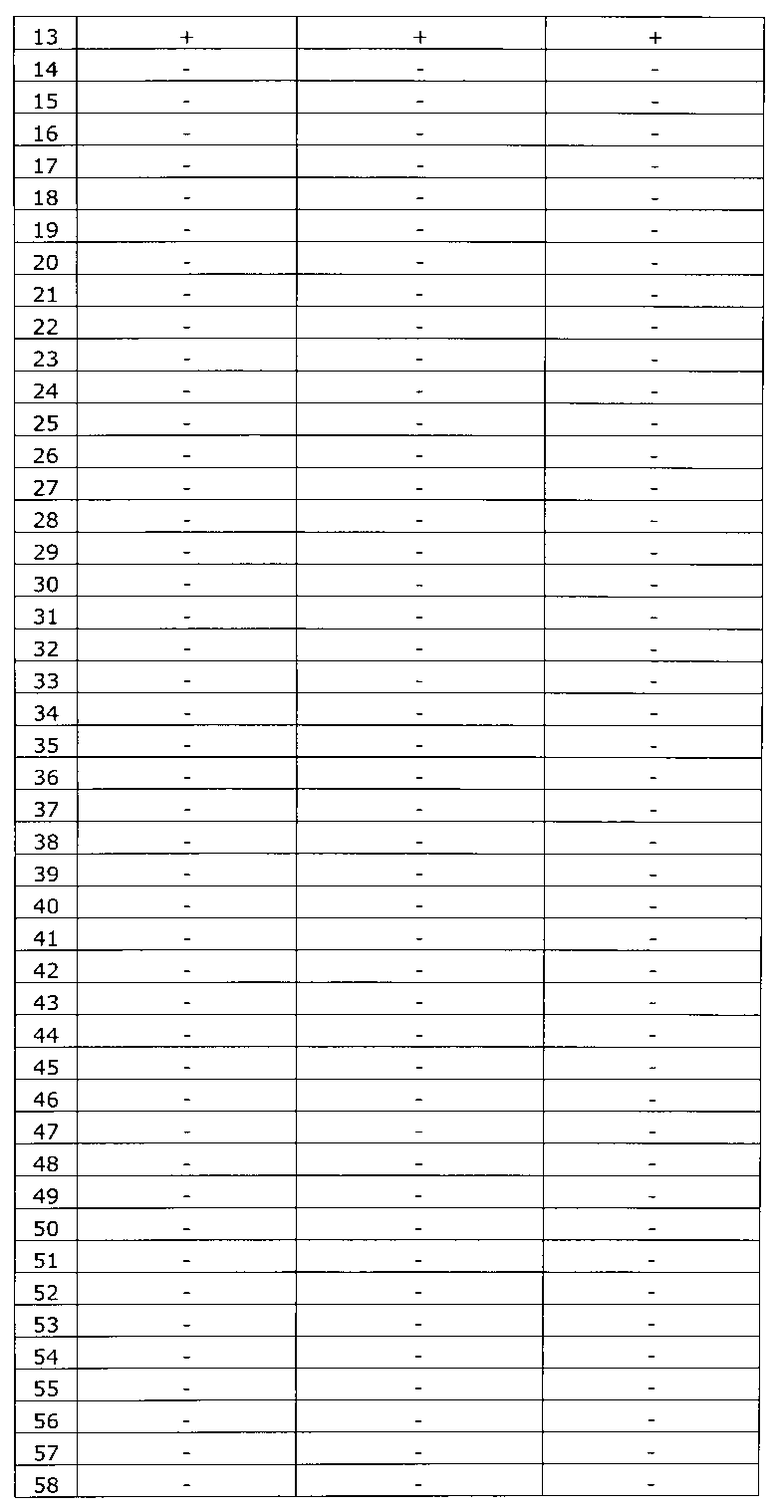
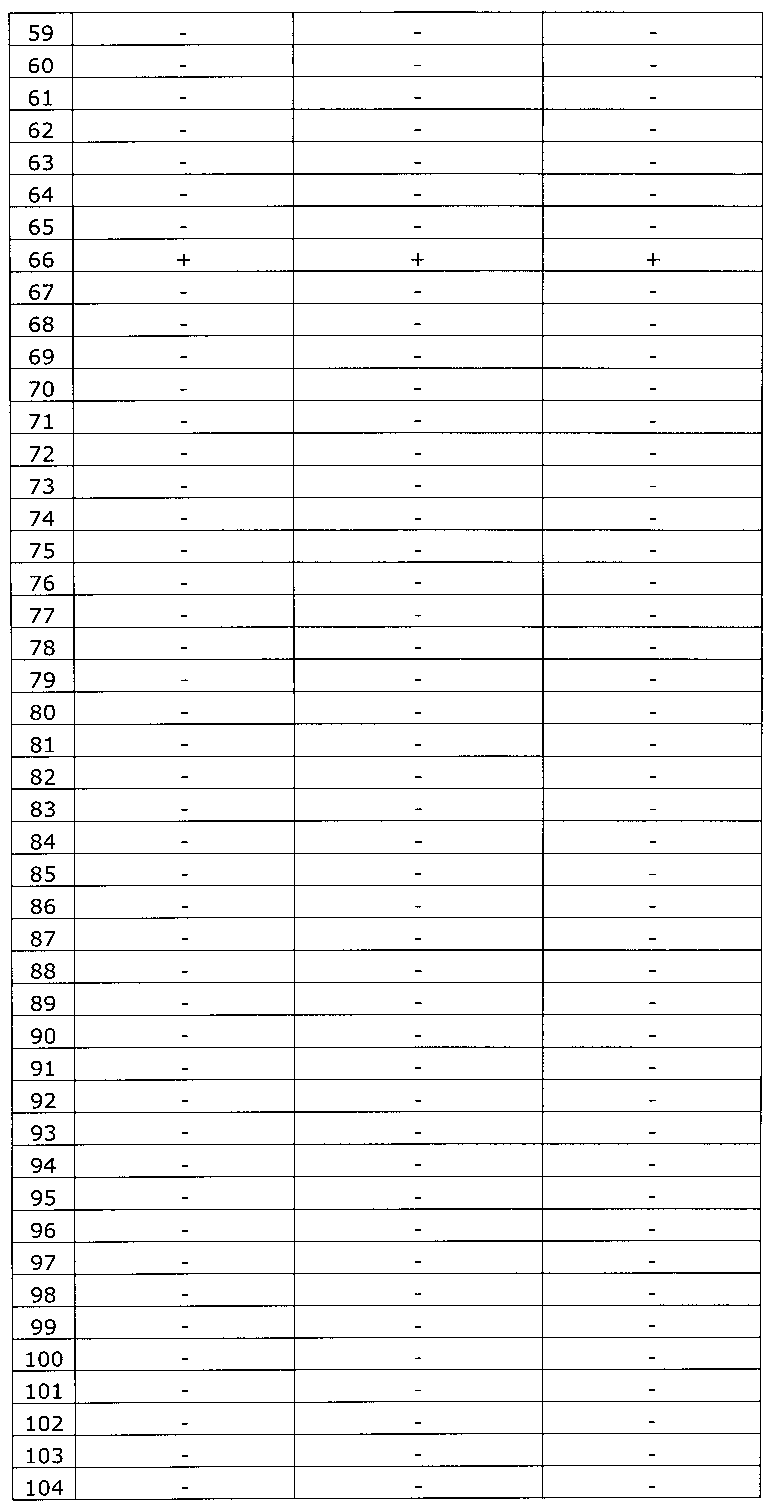
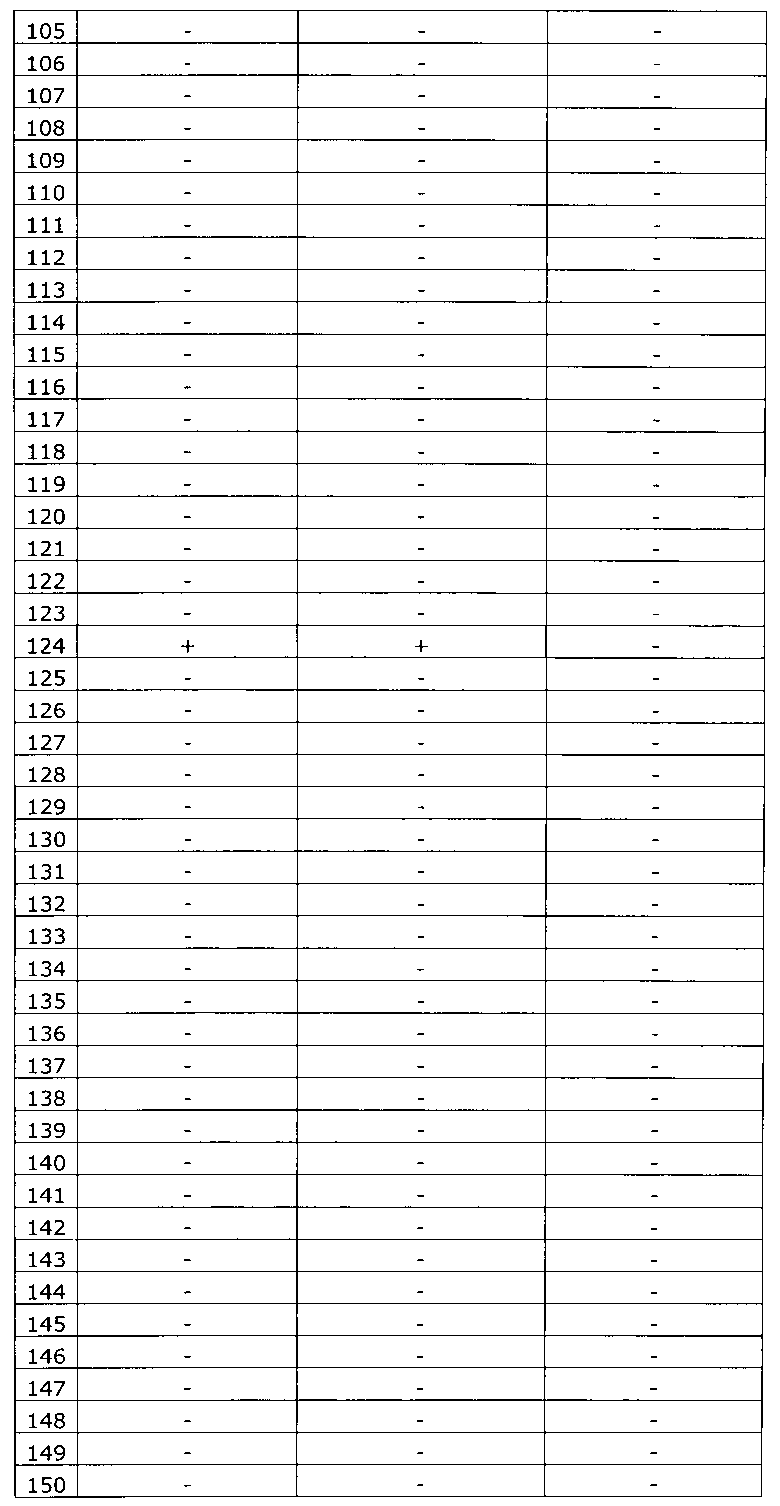
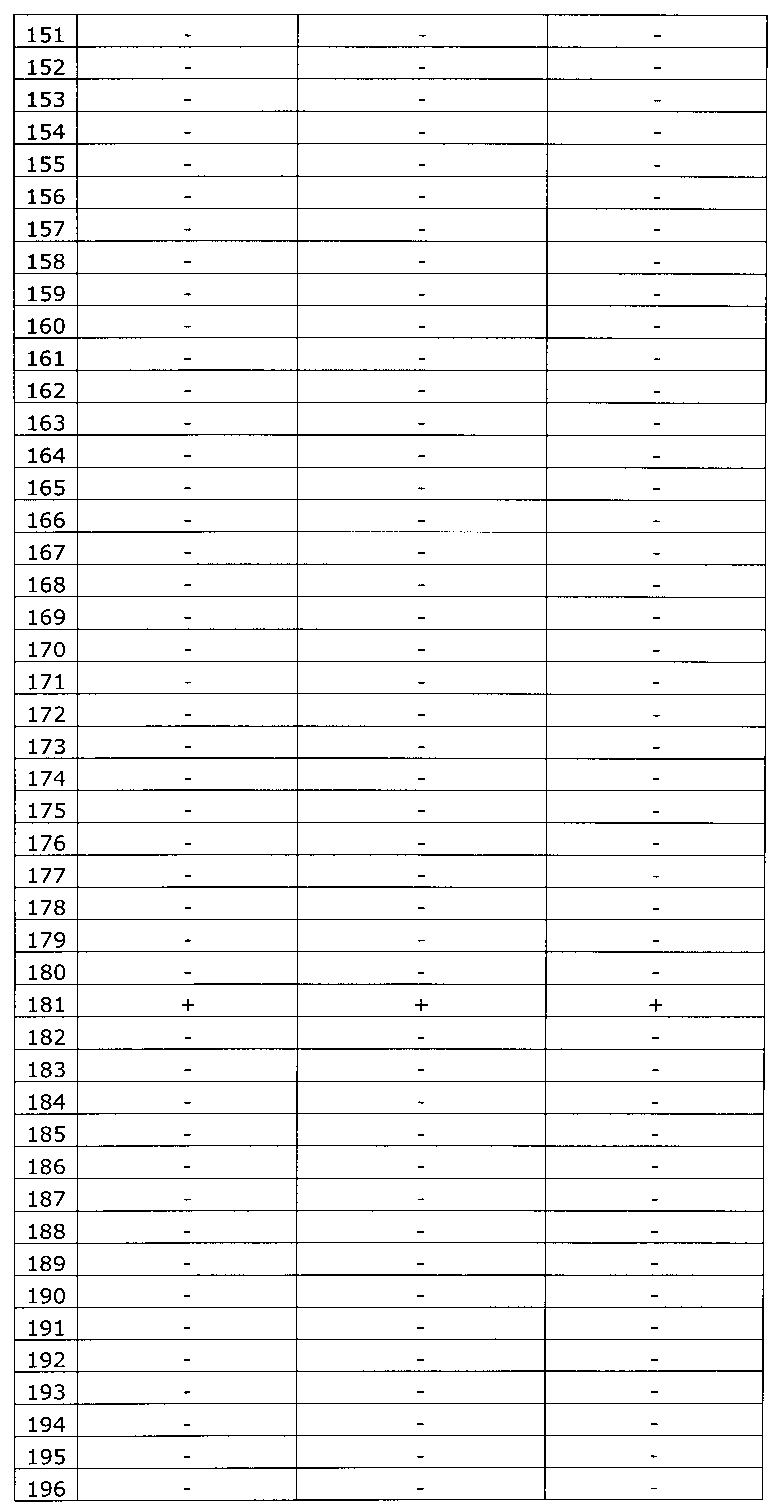
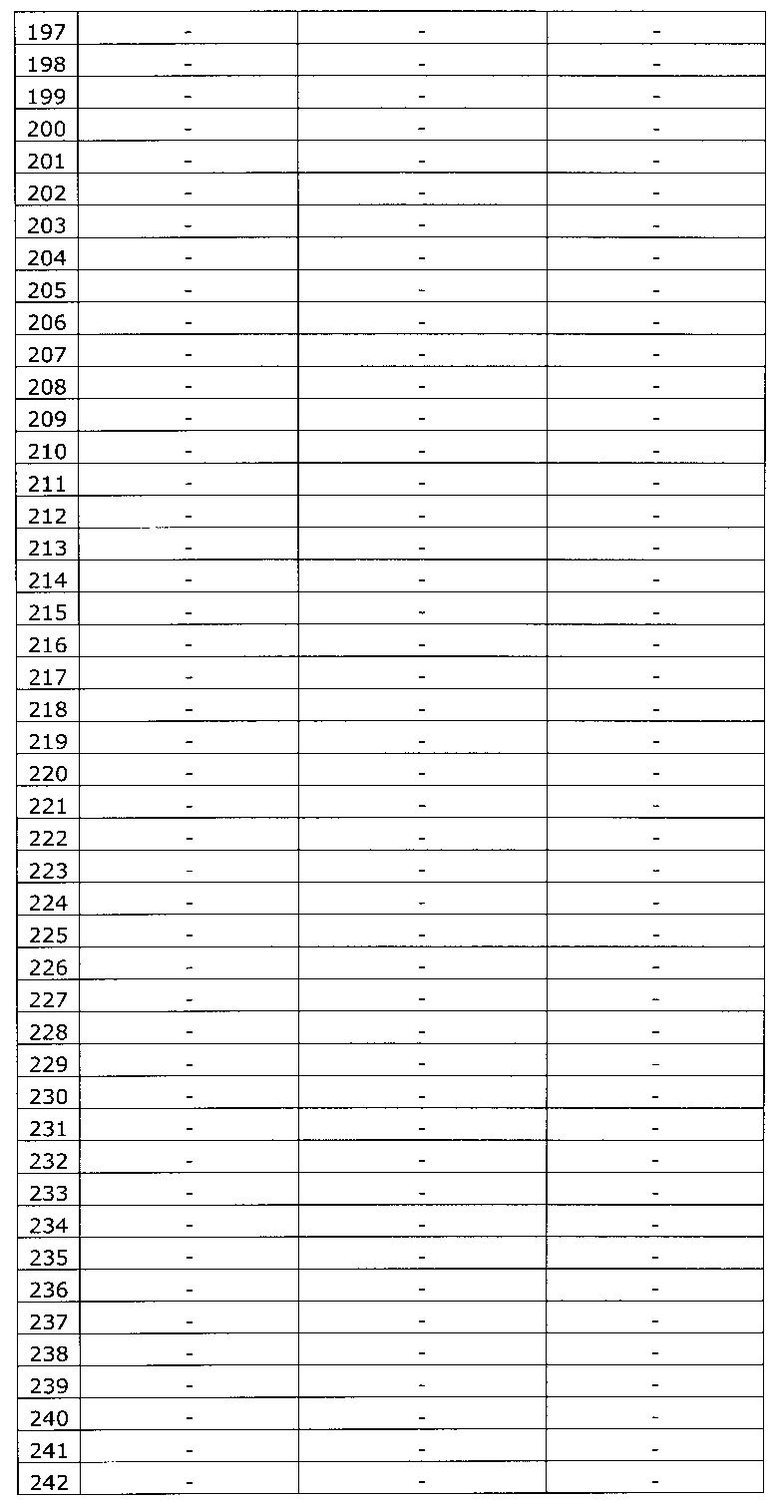
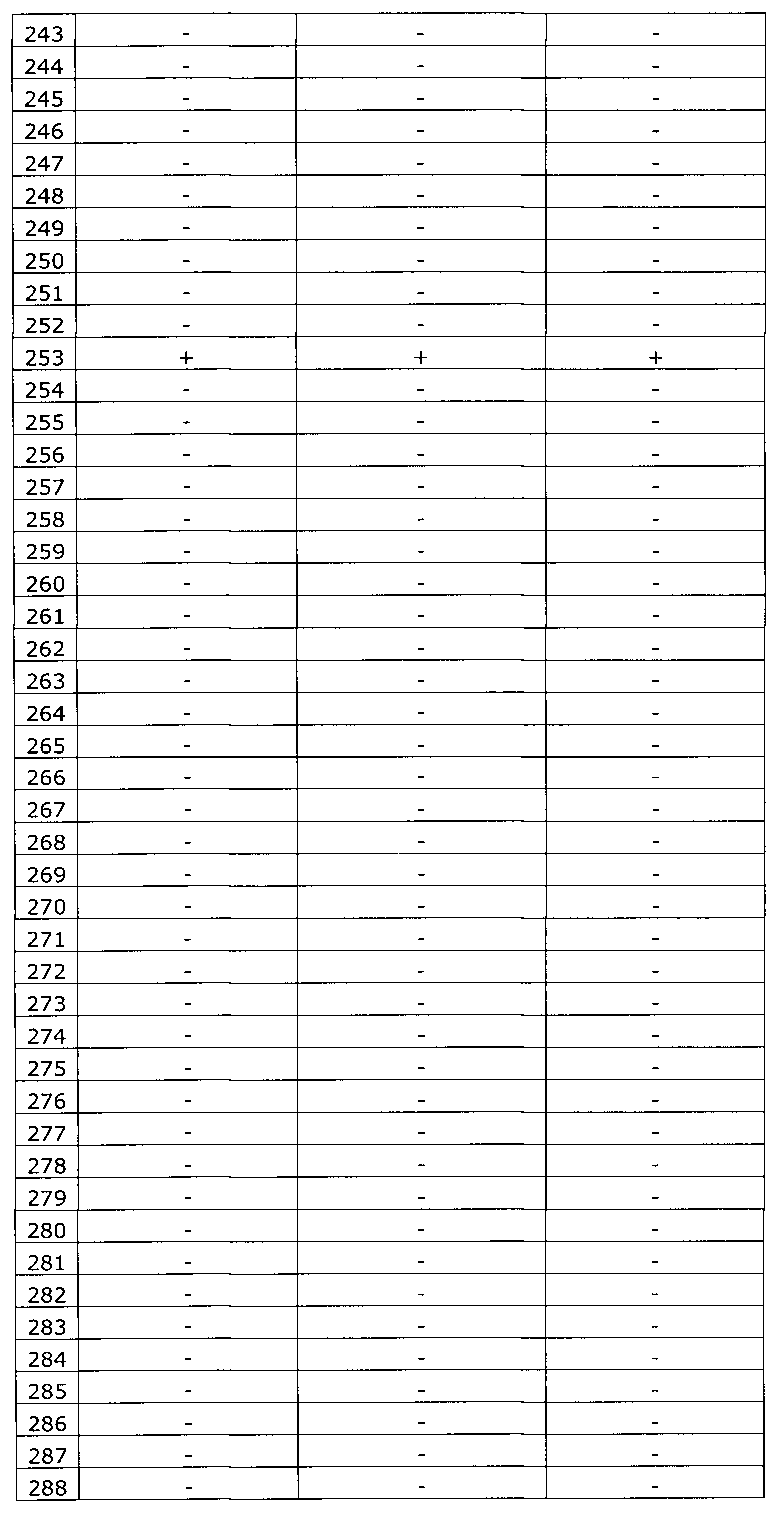
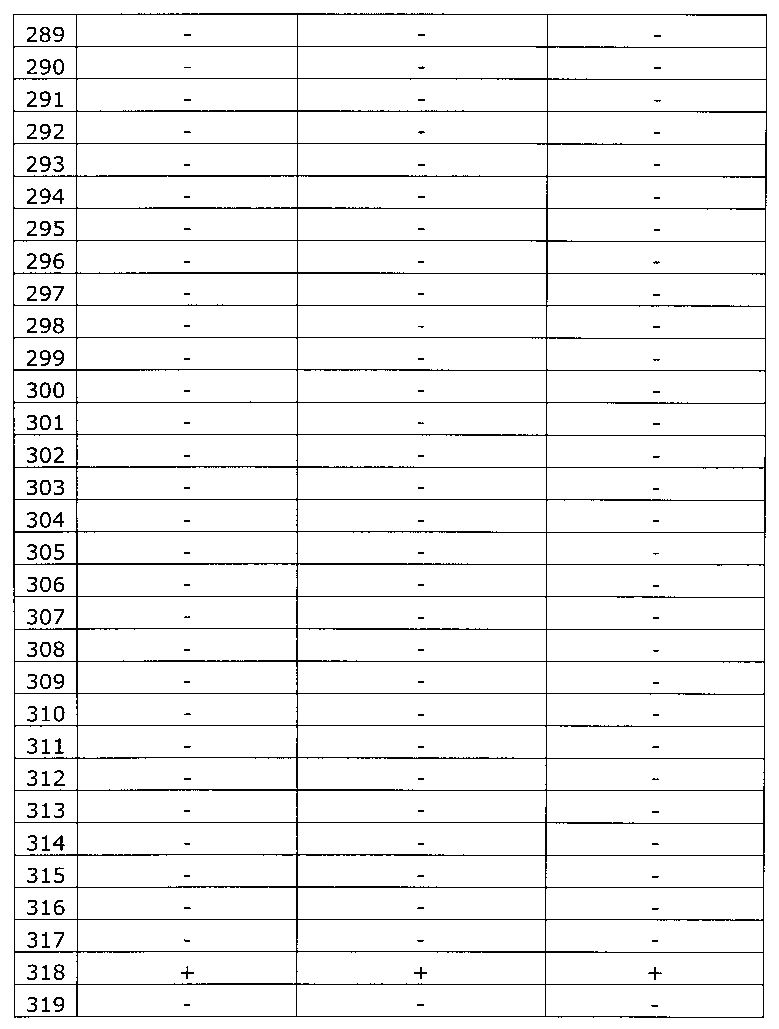
Результаты исследования цервикальных образцов от 319 пациенток приведены в таблице 2.

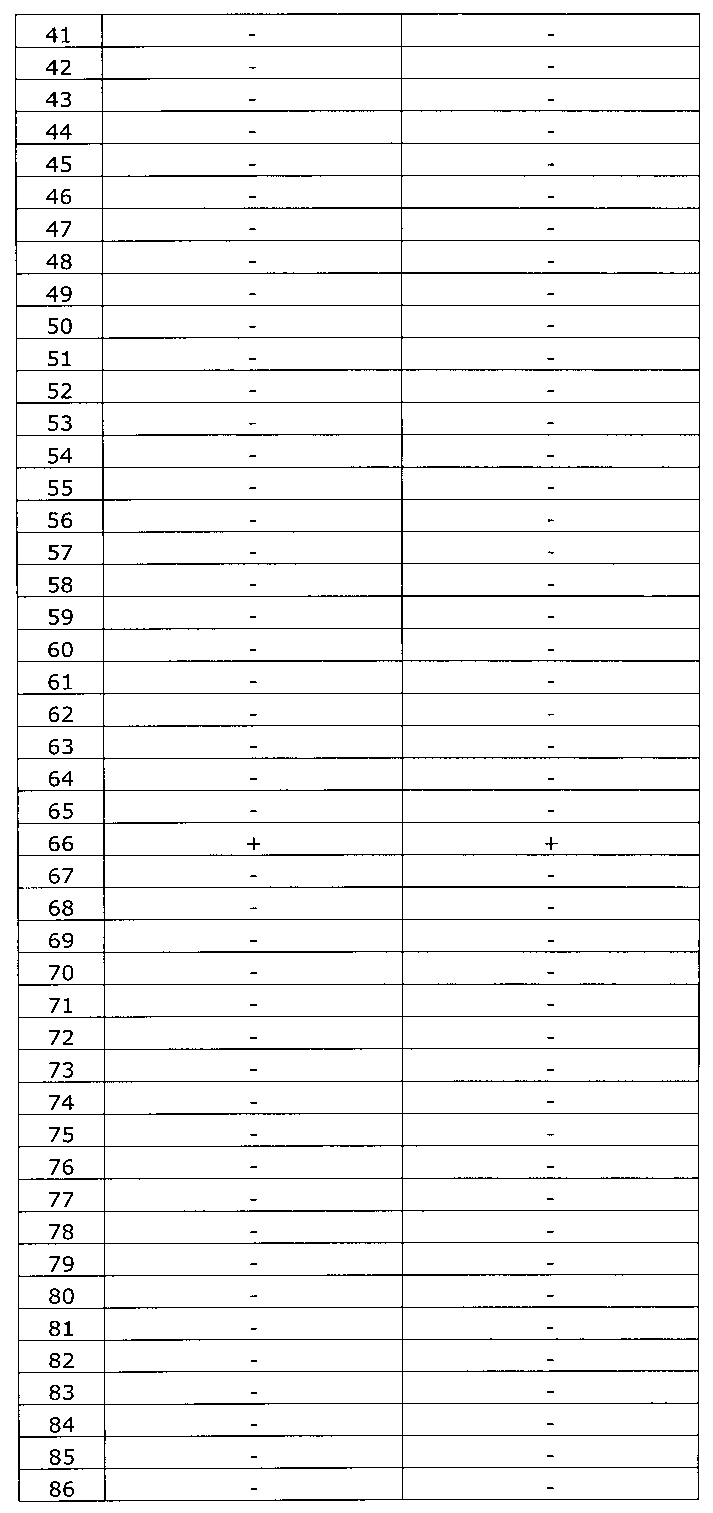
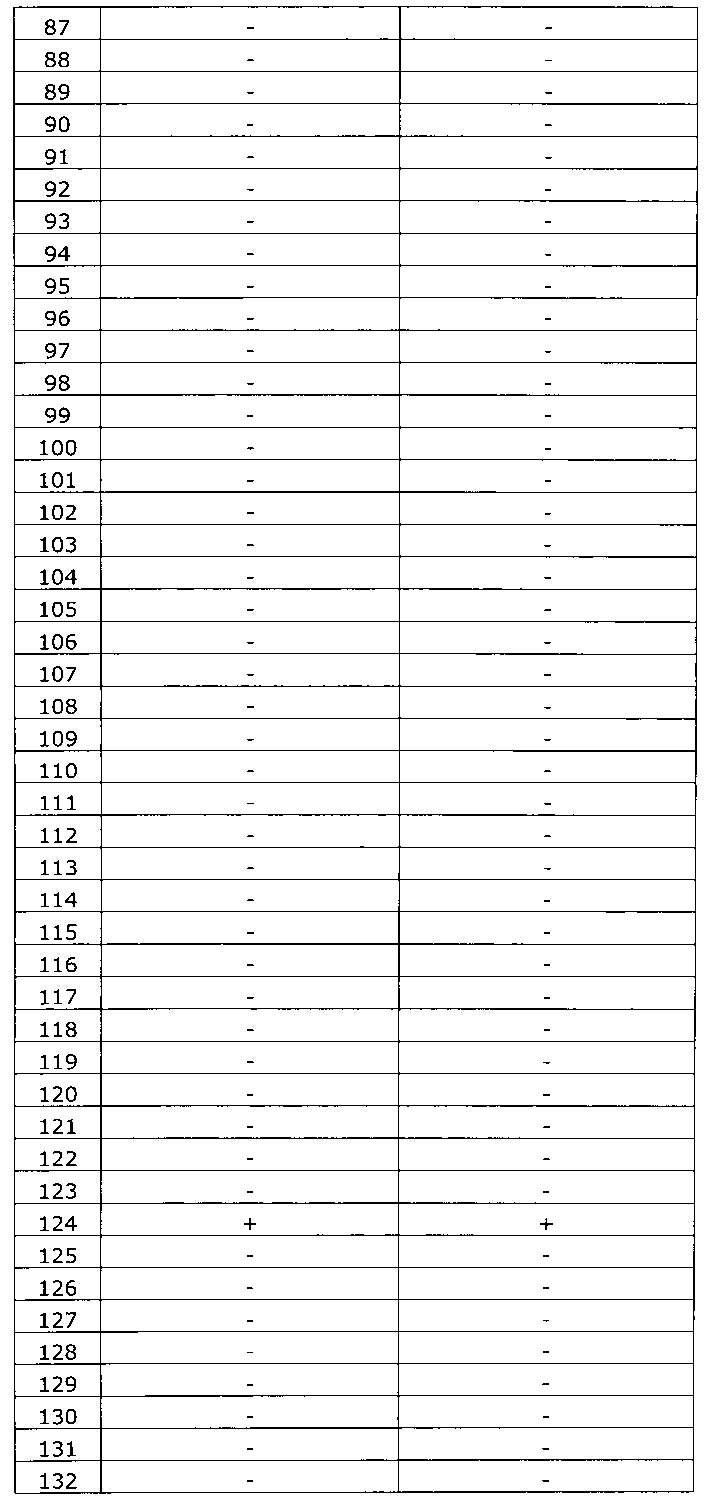

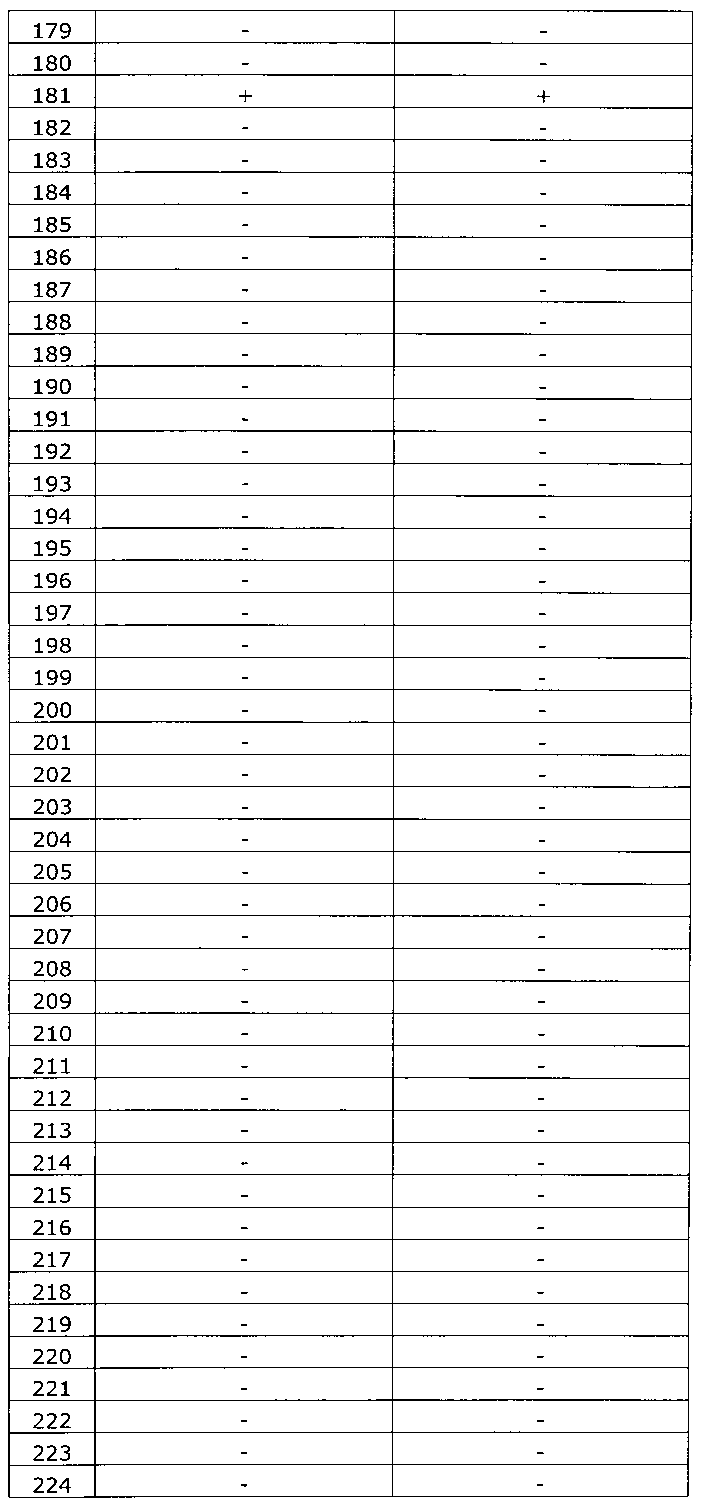
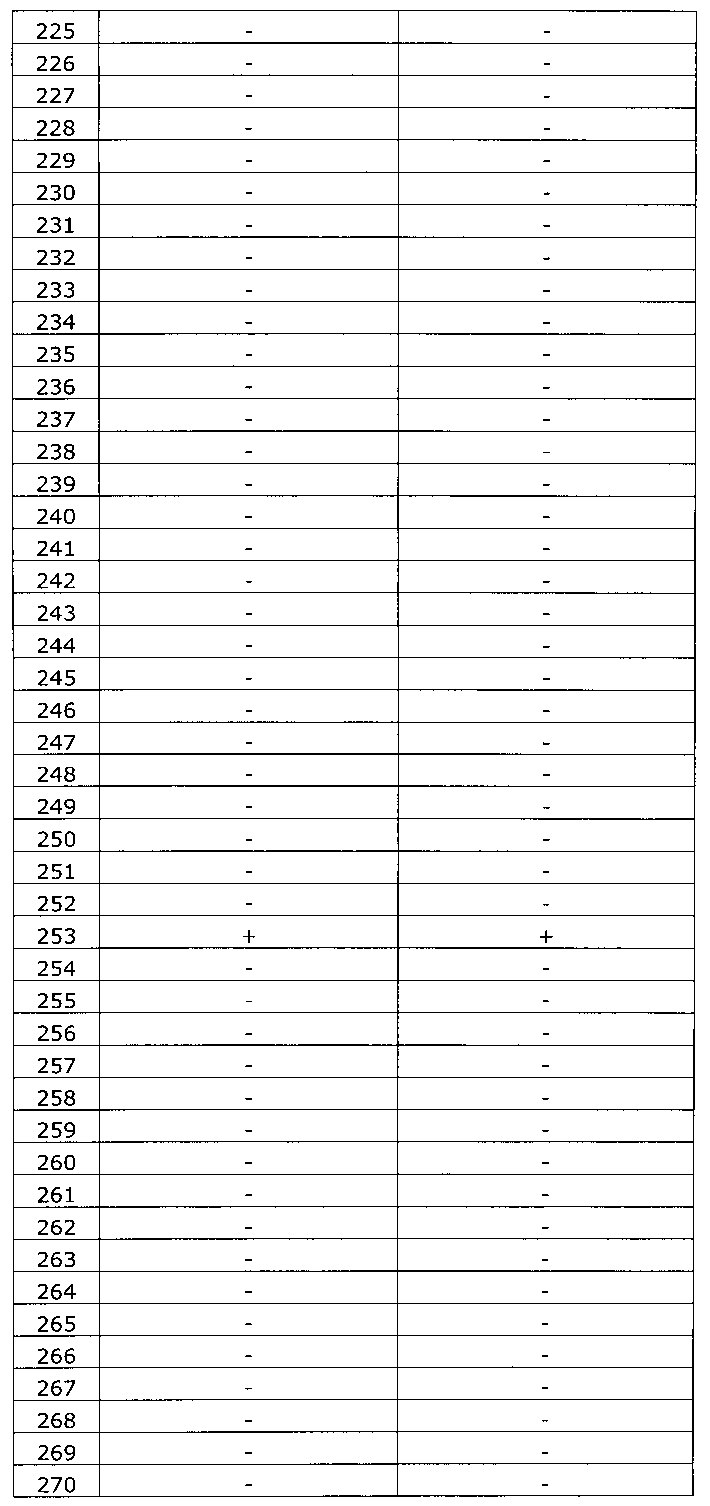
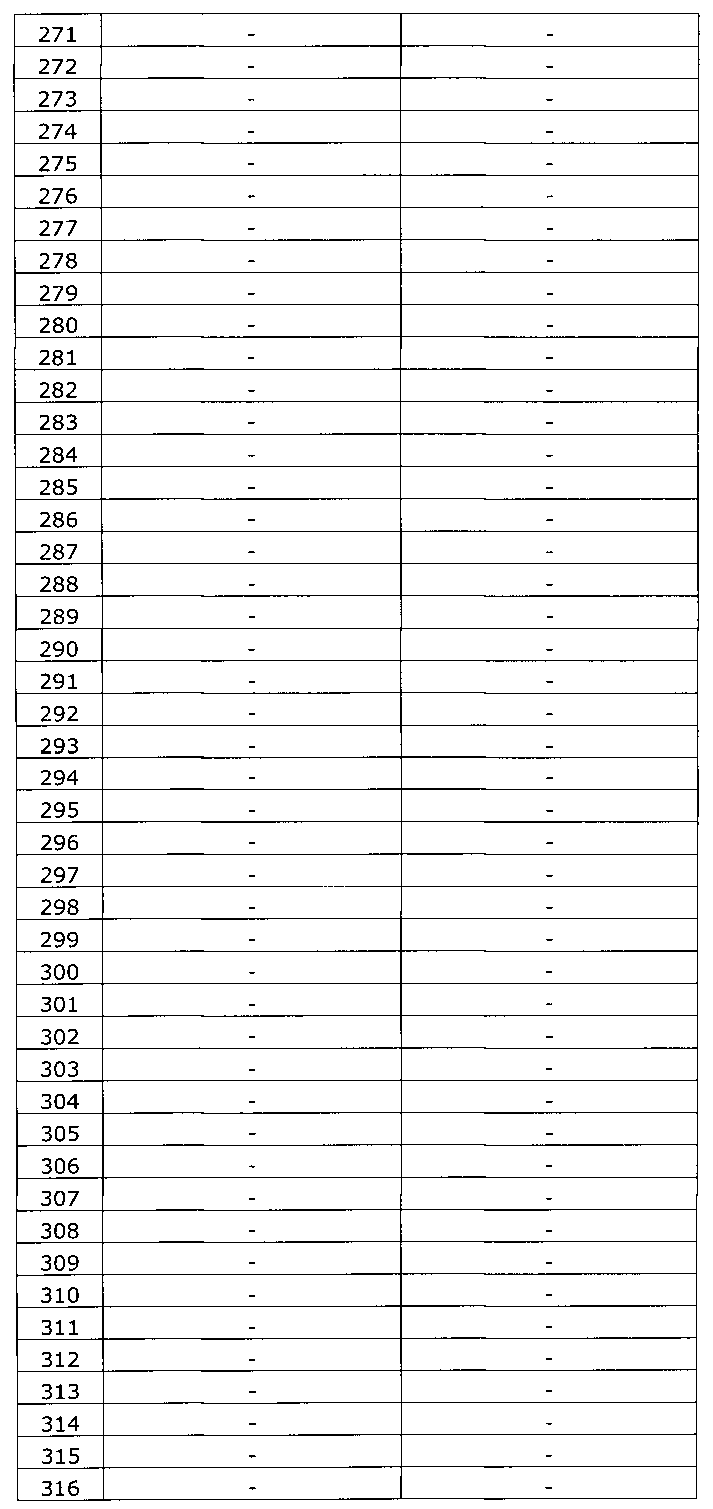
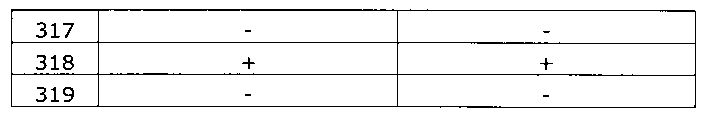
Было получено 100%-ное совпадение при тестировании набора по изобретению относительно референсного набора реагентов. Таким образом, диагностическая чувствительность, диагностическая специфичность, прогностическая значимость положительного результата и прогностическая значимость отрицательного результата набора по изобретению составили 100%.
Также было продемонстрировано, что набор по изобретению позволяет достоверно выявлять наличие ДНК Neisseria gonorrhoeae в биологических образцах методом мультиплексной полимеразной цепной реакции одновременно с выявлением ДНК других возбудителей инфекций, передаваемых половым путем: Chlamydia trahomatis, Trichomonas vaginalis, Mycoplasma genitalium.
Пример 2. Количественное определение ДНК Neisseria gonorrhoeae в биологических образцах.
Проводили исследование биологических образцов, описанных в примере 1, с использованием дополнительного набора реагентов для выявления ДНК Neisseria gonorrhoeae ГОНОПОЛ-РВ (ООО «НПФ Литех», Россия).
Результаты исследования цервикальных образцов от 319 пациенток приведены в таблице 3. При анализе результатов исследования выявлен дискордантный образец №124.
Далее все образцы, в которых была выявлена ДНК Neisseria gonorrhoeae, исследовали методом количественной полимеразной цепной реакции с применением набора по изобретению.
Количественное определение ДНК микроорганизма основывается на существовании линейной зависимости между циклом начала увеличения флуоресценции образца (пороговый цикл, Cycle threshold, Ct) и исходной концентрацией ДНК-мишени. Для реализации количественного определения в реакции амплификации параллельно используются ДНК-калибраторы - образцы с известной концентрацией ДНК Neisseria gonorrhoeae. По результатам амплификации ДНК-калибраторов выстраивается калибровочная прямая, по которой происходит определение концентрации ДНК Neisseria gonorrhoeae в образцах.
Калибраторы (К1 и К2) готовили путем разведения стандартного образца производства (СОП) №181 Neisseria gonorrhoeae ФБУН ЦНИИ Эпидемиологии Роспотребнадзора, содержащего фрагмент 16S rRNA Neisseria gonorrhoeae, клонированный по сайтам EcoRI в плечи фага λ - λgt10. Для разведения исходного СОП используется ДНК-буфер с poly(A). Конечная концентрация для калибратора К1 составляет 1*106 ГЭ/мл; для калибратора К2 - 1*104 ГЭ/мл.
Амплификацию проводили на приборе «Rotor-Gene Q» (QIAGEN, Германия). Значения пороговых циклов калибраторов и исследуемых образцов анализировались программой автоматического учета результатов. В соответствии с этими значениями автоматически была построена калибровочная прямая и рассчитаны концентрации ДНК Neisseria gonorrhoeae в исследованных цервикальных образцах от 6 пациенток (таблица 4).
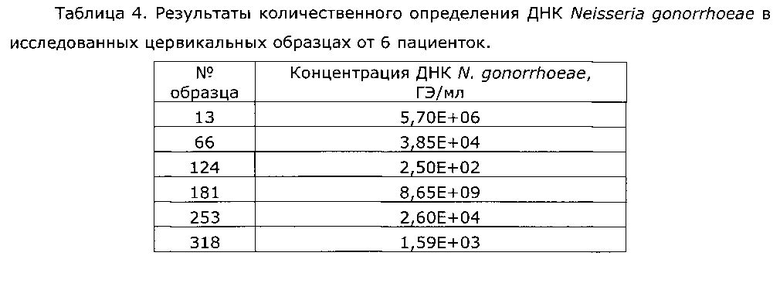
Установлено, что в дискордантном образце концентрация ДНК Neisseria gonorrhoeae самая низкая из всех исследованных образцов и составляет 2,50Е+02 ГЭ/мл. Данная концентрация ДНК N. gonorrhoeae лежит ниже границы аналитической чувствительности набора реагентов ГОНОПОЛ-РВ, что и объясняет получение отрицательного результата при исследовании с использованием этого набора.
Количественное определение ДНК Neisseria gonorrhoeae может быть полезно для различных клинико-лабораторных и научно-исследовательских целей, таких как уточнение диагноза при сомнительных/дискордантных результатах анализа, определении чувствительности различных методов диагностики, мониторинга эффективности терапии.
Пример 3. Исследование специфичности набора реагентов для выявления ДНК Neisseria gonorrhoeae по изобретению.
Проблема недостаточной специфичности наборов реагентов для выявления ДНК Neisseria gonorrhoeae стоит особенно остро для образцов, взятых из мест колонизации негонококковых нейссерий, прежде всего глотки. Поэтому исследование специфичности набора реагентов по изобретению было проведено на образцах, взятых из глотки.
В исследование были включены 80 здоровых добровольцев. От каждого добровольца получали биологический образец - мазок со слизистой задней стенки глотки. Взятые образцы помещали в 1 мл 0.9% раствора хлорида натрия и выделяли ДНК как описано в примере 1. Далее каждый образец исследовали методом полимеразной цепной реакции с использованием:
1) набора реагентов, содержащего родоспецифические праймеры к Neisseria spp. LU3 и NSN [Платонов А.Е. и др. Генодиагностика бактериальных менингитов и генотипирование их возбудителей. Пособие для врачей. Министерство здравоохранения Российской Федерации, Центральный научно-исследовательский институт эпидемиологии. Москва, 2001];
2) набора реагентов для выявления ДНК Neisseria gonorrhoeae в клиническом материале методом полимеразной цепной реакции (ПЦР) с электрофоретической детекцией продуктов амплификации в агарозном геле «АмплиСенс® Neisseria gonorrhoeae-EPh» [Регистрационное удостоверение № ФСР 2009/04067 от 18.11.2011]
3) набора реагентов по изобретению.
При исследовании образцов с использованием набора реагентов, содержащего родоспецифические праймеры к Neisseria spp. LU3 и NSN, все 80 образцов (100%) дали положительный результат. Это свидетельствует о том, что во всех образцах присутствовали представители Neisseria spp. - негонококковые нейссерии. При исследовании образцов с использованием набора реагентов «АмплиСенс® Neisseria gonorrhoeae-EPh», 10 образцов (12.5%) дали положительный результат. В данном наборе используются две мишени ПЦР, сррВ ген и ген цитозин-ДНК-метилтрансферазы; образец считается положительным только в случае положительных результатов в обеих реакциях. При исследовании образцов с использованием набора реагентов по изобретению ни один из образцов не дал положительный результат. Результаты секвенирования амплифицированных фрагментов подтвердили наличие в 10 образцах, положительных согласно набору «АмплиСенс® Neisseria gonorrhoeae-EPh», представителей Neisseria spp.: N. meningitidis, N. subflava, N. cinerea, N. flavescens, N. lactamica, N. sicca и других негонококковых нейссерий. Таким образом 10 положительных результатов, полученных при исследовании образцов с использованием этого набора, представляли собой ложноположительные результаты. Набор по изобретению не дал ни одного ложноположительного результата, таким образом его специфичность в данном эксперименте составила 100%.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАБОР РЕАГЕНТОВ ДЛЯ ВЫЯВЛЕНИЯ ДНК CHLAMYDIA TRACHOMATIS И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2621863C2 |
| НУКЛЕИНОВО-КИСЛОТНЫЙ ЗОНД | 2014 |
|
RU2668154C2 |
| Набор синтетических олигонуклеотидов для количественного определения ДНК Ureaplasma parvum, Ureaplasma urealyticum и Mycoplasma hominis в слизистой оболочке влагалища | 2017 |
|
RU2663453C1 |
| СПОСОБ ИДЕНТИФИКАЦИИ ОДНОНУКЛЕОТИДНЫХ ПОЛИМОРФИЗМОВ В МНОГОКОПИЙНОМ ЛОКУСЕ ГЕНОМА МЕТОДОМ ПЕТЛЕВОЙ ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ПОСЛЕДУЮЩЕЙ ГИБРИДИЗАЦИЕЙ НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ | 2022 |
|
RU2809184C1 |
| Способ выявления ДНК микроорганизмов класса Mollicutes в крови и других биоматериалах методом ПЦР-РВ | 2023 |
|
RU2831277C1 |
| ОЛИГОНУКЛЕОТИДНЫЙ БИОЧИП ДЛЯ ИДЕНТИФИКАЦИИ ГЕНЕТИЧЕСКИХ ДЕТЕРМИНАНТ РЕЗИСТЕНТНОСТИ Neisseria gonorrhoeae К АНТИМИКРОБНЫМ ПРЕПАРАТАМ, НАБОР ОЛИГОНУКЛЕОТИДОВ, ИСПОЛЬЗУЕМЫХ ДЛЯ ИММОБИЛИЗАЦИИ НА БИОЧИПЕ | 2016 |
|
RU2636457C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НАЛИЧИЯ МИКРООРГАНИЗМОВ В БИОЛОГИЧЕСКОМ ОБРАЗЦЕ | 2007 |
|
RU2435865C2 |
| СПОСОБ ГЕНОТИПИРОВАНИЯ ИЗОЛЯТОВ NEISSERIA GONORRHOEAE НА БИОЛОГИЧЕСКОМ МИКРОЧИПЕ | 2023 |
|
RU2816767C1 |
| СПОСОБ ТАРГЕТНОЙ АМПЛИФИКАЦИИ ГЕНОМОВ ВОЗБУДИТЕЛЕЙ ИНФЕКЦИЙ ОРГАНОВ РЕПРОДУКЦИИ ЧЕЛОВЕКА С ЦЕЛЬЮ ОДНОВРЕМЕННОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ С НАБОРОМ ПРАЙМЕРОВ | 2015 |
|
RU2625006C1 |
| Набор олигонуклеотидных праймеров для выявления вариантных штаммов Burkholderia thailandensis, содержащих кластер генов биосинтеза капсульного полисахарида, высоко гомологичный Burkholderia pseudomallei | 2019 |
|
RU2728356C1 |

Группа изобретений относится к биохимии. Описан набор реагентов для выявления ДНК Neisseria gonorrhoeae в образце, включающий по меньшей мере два олигонуклеотидных праймера для полимеразной цепной реакции и, при необходимости, олигонуклеотидный зонд, термостабильную ДНК-полимеразу, буферный раствор для ПЦР, дезоксинуклеозидтрифосфаты, отличающийся тем, что первый олигонуклеотидный праймер имеет нуклеотидную последовательность SEQ ID NO: 1, второй олигонуклеотидный праймер имеет нуклеотидную последовательность SEQ ID NO: 2. Также описан способ выявления ДНК Neisseria gonorrhoeae в образце методом полимеразной цепной реакции, отличающийся тем, что выявление проводят с использованием описанного набора реагентов. Изобретение может быть применено в лабораторной диагностике для выявления ДНК Neisseria gonorrhoeae в биологических образцах методом полимеразной цепной реакции. Группа изобретений позволяет с высокой чувствительностью и специфичностью выявлять все клинически значимые штаммы Neisseria gonorrhoeae с помощью единственной мишени полимеразной цепной реакции. 2 н. и 6 з.п. ф-лы, 4 табл., 3 пр.
1. Набор реагентов для выявления ДНК Neisseria gonorrhoeae в образце, включающий по меньшей мере два олигонуклеотидных праймера для полимеразной цепной реакции и, при необходимости, олигонуклеотидный зонд, термостабильную ДНК-полимеразу, буферный раствор для ПЦР, дезоксинуклеозидтрифосфаты, отличающийся тем, что первый олигонуклеотидный праймер имеет нуклеотидную последовательность SEQ ID NO: 1, второй олигонуклеотидный праймер имеет нуклеотидную последовательность SEQ ID NO: 2.
2. Набор реагентов по п. 1, характеризующийся тем, что олигонуклеотидный зонд представляет собой олигонуклеотидный зонд для детекции ДНК Neisseria gonorrhoeae в режиме реального времени, где указанный зонд на 5′-конце содержит флуоресцентный краситель, на 3′-конце содержит гаситель флуоресценции.
3. Набор реагентов по п. 2, характеризующийся тем, что указанный флуоресцентный краситель выбран из группы: JOE, FAM, R6G, ROX, Су5, Су5.5, HEX.
4. Набор реагентов по п. 2, характеризующийся тем, что указанный гаситель флуоресценции выбран из группы: BHQ1, BHQ2, BHQ3, RTQ.
5. Набор реагентов по п. 2, где указанный олигонуклеотидный зонд характеризуется нуклеотидной последовательностью SEQ ID NO: 3.
6. Набор реагентов по п. 2, характеризующийся тем, что указанный олигонуклеотидный зонд представляет собой (FAM)-CCGACATCGGCCGCCGATATTGGCA-(BHQ1).
7. Набор реагентов по п. 1, характеризующийся тем, что указанный образец выбран из группы: соскоб из цервикального канала, соскоб из уретры, мазок из влагалища, моча, семенная жидкость, мазок из прямой кишки, мазок из глотки, мазок с конъюнктивы, спинномозговая жидкость, кровь.
8. Способ выявления ДНК Neisseria gonorrhoeae в образце методом полимеразной цепной реакции, отличающийся тем, что выявление проводят с использованием набора реагентов по любому из пп. 1-7.
| EP 426843 B1, 13.09.1995;JP 2013188181 A, 26.09.2013;KAMEL A | |||
| ABD-ELSALAM, Bioinformatic tools and guideline for PCR primer design, African Journal of Biotechnology, 2003, v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| US5432271 A, 11.07.1995 | |||
| US5908744 A, 01.06.1999 | |||
| ДИФФЕРЕНЦИРУЮЩИЙ И СПЕЦИФИЧЕСКИЙ ОЛИГОНУКЛЕОТИДЫ ДЛЯ ИДЕНТИФИКАЦИИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДНК ИНФЕКЦИОННЫХ АГЕНТОВ В БИОЛОГИЧЕСКИХ МАТЕРИАЛАХ, СПОСОБ ВИДОВОЙ ИДЕНТИФИКАЦИИ ИНФЕКЦИОННЫХ АГЕНТОВ, БИОЧИП И НАБОР ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА | 2006 |
|
RU2348695C2 |
| СПОСОБ МОЛЕКУЛЯРНОГО ТИПИРОВАНИЯ Neisseria gonorrhoeae | 2008 |
|
RU2380408C1 |
Авторы
Даты
2016-08-27—Публикация
2015-03-12—Подача