Область техники, к которой относится изобретение
Изобретение относится к молекулярной биологии, микробиологии, эпидемиологии и медицине и представляет собой олигонуклеотидный биочип для одновременной идентификации генетических детерминант резистентности возбудителя гонококковой инфекции Neisseria gonorrhoeae к актуальным антимикробным препаратам, включая фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин, а также набор олигонуклеотидов, используемых для иммобилизации на биочипе.
Уровень техники
Гонококковая инфекция, вызываемая грамотрицательными бактериями Neisseria gonorrhoeae, является одной из наиболее распространенных бактериальных инфекций, передаваемых половым путем в мире. По данным ВОЗ в мире ежегодно регистрируется более 100 млн случаев гонококковой инфекции (Report on global sexually transmitted infection surveillance 2013. WHO Press; Geneva, Switzerland, 2014). В Российской Федерации заболеваемость гонококковой инфекцией в 2012 г. составила 36,4 случая на 100 тысяч населения и 23,5 на 100 тысяч населения в 2014 г. (Ресурсы и деятельность медицинских организаций дерматовенерологического профиля. Заболеваемость инфекциями, передаваемыми половым путем, заразными кожными болезнями и болезнями кожи. Статистические материалы, М: Дэкс Пресс, 2013). Осложнениями гонококковой инфекции являются различные воспалительные заболевания органов малого таза у женщин, эпидидимиты и орхиты у мужчин, которые способствуют развитию бесплодия, что определяет значимость заболевания для репродуктивного здоровья населения и здравоохранения.
Успешное адекватное лечение гонококковой инфекции в настоящее время несколько ограничивается быстрым формированием Neisseria gonorrhoeae устойчивости к применяемым антимикробным препаратам. В спектр антибактериальных препаратов, к которым определяется чувствительность Neisseria gonorrhoeae, включены бета-лактамные антибиотики (пенициллины, цефалоспорины), фторхинолоны (офлоксацин, ципрофлоксацин), тетрациклины, макролиды (эритромицин, азитромицин), спектиномицин. В настоящее время препаратами выбора для лечения гонококковой инфекции на территории Российской Федерации являются цефалоспорины III поколения: цефтриаксон и цефиксим (Клинические рекомендации по ведению больных инфекциями, передаваемыми половым путем, и урогенитальными инфекциями, М.: Деловой экспресс, 2013).
Возбудитель гонореи относится к микроорганизмам, которые способны быстро накапливать мутации, что приводит к приобретению резистентности к лекарственным препаратам, в том числе, множественной. К настоящему времени обнаружены штаммы, устойчивые ко всем основным препаратам, используемым для лечения. В последние несколько лет доля штаммов гонококковой инфекции, обладающих резистентностью к пенициллинам в Российской Федерации, колеблется между 9,6 и 13,2%, обнаружены штаммы с МИК 4,0 мг/мл. В период с 2009 по 2012 г. доля штаммов, устойчивых к спектиномицину, в России увеличилась с 0,9 to 11,6% (Kubanova A., Kubanov A., Frigo N., Solomka V., Semina V., Vorobyev D., et al. Russian gonococcal antimicrobial susceptibility programme (RU-GASP) - resistance in Neisseria gonorrhoeae during 2009-2012 and NG-MAST genotypes in 2011 and 2012. BMC Infect. Dis. 2014. 14: 342). В докладе ВОЗ 2014 г. (WHO, Antimicrobial resistance: global report on surveillance, Switzerland: WHO Press, 2014) отмечается, что сообщения о неэффективности лечения гонококковой инфекции в связи с резистентностью N. gonorrhoeae к цефалоспоринам III поколения получены уже из 10 стран. Кроме того, отмечается рост множественной лекарственной резистентности. Описан штамм MLST ST1901 с одновременной резистентностью к цефиксиму, ципрофлоксацину, пенициллину, тетрациклину и умеренной резистентностью к азитромицину (Lewis D.A., Sriruttan С,  Е.Е., Golparian D., Gumede L., Fick D., et al. Phenotypic and genetic characterization of the first two cases of extended-spectrum-cephalosporin-resistant Neisseria gonorrhoeae infection in South Africa and association with cefixime treatment failure J. Antimicrob. Chemother. 2013. 68: 1267-1270). Очевидно, что своевременные детекция N. gonorrhoeae и выявление лекарственно-устойчивых штаммов необходимы как для назначения адекватной антимикробной терапии и успешного лечения заболевания, так и для предотвращения распространения лекарственно-устойчивых штаммов.
Е.Е., Golparian D., Gumede L., Fick D., et al. Phenotypic and genetic characterization of the first two cases of extended-spectrum-cephalosporin-resistant Neisseria gonorrhoeae infection in South Africa and association with cefixime treatment failure J. Antimicrob. Chemother. 2013. 68: 1267-1270). Очевидно, что своевременные детекция N. gonorrhoeae и выявление лекарственно-устойчивых штаммов необходимы как для назначения адекватной антимикробной терапии и успешного лечения заболевания, так и для предотвращения распространения лекарственно-устойчивых штаммов.
Формирование микроорганизмами устойчивости к различным группам антимикробных препаратов осуществляется путями, характерными для каждой из групп. Мишенью действия фторхинолонов являются топоизомераза IV и ДНК-гираза, ответственные за процесс суперспирализации хромосомной ДНК. Основным механизмом резистентности к фторхинолонам является снижение аффинности препаратов к комплексу ДНК-фермент, обусловленное мутациями в генах gyrA, gyrB, parC, parE на участках топоизомераз, формирующих центр связывания («хинолоновый карман») (Vereshchagin V.A., Ilina E.N., Malakhova M.V., Zubkov M.M., Sidorenko S.V., Kubanova A.A, et al. Fluoroquinolone-resistant Neisseria gonorrhoeae isolates from Russia: molecular mechanisms implicated. J. Antimicrob. Chemother. 2004. 53: 653-656). Основными мутациями N. gonorrhoeae являются S91F, D95N, D95G в гене gyrA и S87N, S87R, E91Q, E91G, E91K, Е91А в гене parC.
Резистентность к β-лактамным антибактериальным препаратам N. gonorrhoeae может быть вызвана наличием гена, кодирующего β-лактамазу - фермент, гидролизующий связь C-N в β-лактамном кольце антибиотика, а также мутациями в генах ponA, penA, penB и mtrR (Unemo М. and Shafer W.M., Antimicrobial resistance in Neisseria gonorrhoeae in the 21st century: past, evolution, and future. Clin. Microbiol. Rev. 2014. 27 (3): 587-613). β-лактамазы кодируются плазмидными генами blaTEM1, blaTEM135 (хромосомные β-лактамазы у N. gonorrhoeae отсутствуют); они разрушают антибактериальные препараты пенициллинового ряда, но не способны разрушать цефалоспорины, и по этой причине цефалоспорины заняли ведущее место в лечении гонококковой инфекции. Однако в последние годы стало известно, что мутации в гене blaTEM, приводящие к заменам М182Т, G238S, вызывают появление резистентности к цефалоспоринам (Klausner J.D, Kerndt P. Cephalosporin resistance in Neisseria gonorrhoeae infections. JAMA. 2013. 309: 1989).
Известны мутации в хромосомных генах ponA и penA, приводящие к снижению аффинности соответствующих пенициллин-связывающих белков ПСБ1 и ПСБ2 к пенициллинам. Основной мутацией в гене ponA, влияющей на формирование устойчивых к пенициллинам фенотипов, является замена L421P, а в гене penA - инсерция кодона аспарагиновой кислоты D между 345 и 346 позициями (Spratt B.G. Hybrid penicillin-binding proteins in penicillin-resistant strains of Neisseria gonorrhoeae. Nature. 1988. 332: 173-176).
Механизм снижения чувствительности зависит от мозаичной структуры гена penA, которая может быть результатом межвидовой генетической рекомбинации N. gonorrhoeae, N. cinera и N. perflava (Ohnishi М., Golparian D., Shimuta К., Saika T, Hoshina S., Iwasaku K., et al. Is Neisseria gonorrhoeae initiating a future era of unbeatable gonorrhea?: Detailed characterization of the first strain with high-level resistance to ceftriaxone. Antimicrob. Agents Chemother. 2011. 55: 3538-3545). Резистентность N. gonorrhoeae к пенициллинам и цефалоспоринам связана с появлением мозаичных аллелей гена penA и немозаичных аллелей, несущих мутации остатка А501 (A501V и реже А501Т). В мозаичных аллелях обнаружено около 70 аминокислотных замен по сравнению с белком дикого типа. Мутации G545S, I312M и V316T обнаружены в штаммах, устойчивых к цефалоспоринам расширенного спектра действия; резистентность объясняется модификацией β-лактам-связывающего сайта белка (Unemo М., Golparian D., Nicholas R., Ohnishi M., Gallay A., Sednaoui P. High-level cefixime- and ceftriaxone-resistant Neisseria gonorrhoeae in France: novel penA mosaic allele in a successful international clone causes treatment failure. Antimicrob. Agents Chemother. 2012. 56: 1273-1280).
Механизм действия тетрациклинов связан с подавлением синтеза белков в клетке путем нарушения связи транспортных РНК с 16S РНК рибосомной субъединицы 30S. Основными детерминантами резистентности Neisseria gonorrhoeae к тетрациклинам являются наличие плазмидного гена tetM и мутации рибосомного белка S10 (Nguyen F., Starosta A.L., Arenz S., Sohmen D. Donhofer A., Wilson D. N. Tetracycline antibiotics and resistance mechanisms. Biol. Chem. 2014. 395: 559-575). Ген tetM кодирует белок, который связывается с 30S субъединицей рибосомы и вытесняет антимикробный препарат с его сайта связывания. Мутации rpsJ гена, кодирующего белок S10, приводящие к заменам V57M или V57L, снижают аффинность тетрациклина к 30S субъединице рибосомы.
Макролиды вызывают нарушение синтеза белка на рибосомах микробной клетки, связываясь с 23S рРНК рибосомной субъединицы 50S. Основные сайты связывания -нуклеотиды в положениях А2058, А2059 и G2505 в доменах II и V рРНК. Нуклеотидная замена A2059G в 23S рРНК N. gonorrhoeae приводит к появлению высоко-резистентных штаммов, замена С2611Т - умеренно-резистентных при одновременной мутации в нескольких аллелях (Ng L-K., Martin I., Liu G., Bryden L. Mutation in 23s rRNA associated with macrolide resistance in Neisseria gonorrhoeae. Antimicrob Agents Chemother. 2002. 46: 3020-3025). Еще одним механизмом резистентности к макролидам является наличие erm генов, кодирующих ферменты РНК-метилазы, которые метилируют нуклеотиды 23S рРНК, блокируя связывание макролидов с РНК.
Спектиномицин обладает узким спектром антимикробной активности и используется, в основном, для лечения гонореи. Препарат связывается с рибосомной субъединицей 30S и ингибирует трансляцию РНК. Резистентность к спектиномицину появляется в результате нуклеотидных замен на участке его связывания с рРНК (ген rrs) G1064C, С1192, G1058C (встречается реже) (Galimand М., Gerbaud G., Courvalin P. Spectinomycin resistance in Neisseria spp. due to mutations in 16S rRNA. Antimicrob. Agents Chemother. 2000. 44: 1365-1366). Наблюдали также мутации T24P, K28E и делецию V27 в 30S рибосомном белке S5 (ген rpsE) (Unemo М., Golparian D., Skogen V., Olsen A.O., Moi H., Syversen G., et al. Neisseria gonorrhoeae strain with high-level resistance to spectinomycin due to a novel resistance mechanism (mutated ribosomal protein S5) verified in Norway. Antimicrob. Agents Chemother. 2013. 57: 1057-1061).
Помимо механизмов формирования резистентности, связанных со свойствами препаратов (химической структурой антибактериального препарата, специфическими ферментами, модифицирующими антибиотики и др.), микроорганизмы способны формировать резистентность по общим механизмам для большинства препаратов, к которым относятся уменьшение проникновения препаратов внутрь клетки (инфлюкса) и механизмы эффлюкса - вывода препаратов из клетки. Снижение проницаемости клеточных мембран, а также изменения в системе эффлюкс-насосов обычно приводят к формированию резистентности одновременно к нескольким группам антибиотиков.
В структуре N. gonorrhoeae идентифицированы эффлюкс-насосы MtrCDE, МасАВ, NorM и FarAB, участвующие в транспорте антимикробных препаратов. Мутации в промоторной области гена mtrR: инсерции Т и ТТ в положении -10 и делеция А в положении -35, приводят к сверхэкспрессии MtrCDE помпы и повышению резистентности к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам. Реже наблюдается увеличение экспрессии MtrCDE помпы при аминокислотных заменах А39Т, R44H, G45D, and L47P в кодирующей области гена mtrR, а также инсерции 153 пар оснований между промотором оперона mtrRJmtrC и геном mtrC (Veal W.L., Nicholas R.A., Shafer W.M. Overexpression of the MtrC-MtrD-MtrE efflux pump due to an mtr mutation is required for chromosomally mediated penicillin resistance in Neisseria gonorrhoeae. J. Bacteriol. 2002. 184: 5619-5624; Golparian D., Shafer W.M., Ohnishi M., Unemo M. Importance of multidrug efflux pumps in the antimicrobial resistance property of clinical multidrug-resistant isolates of Neisseria gonorrhoeae. Antimicrob. Agents Chemother. 2014. 58: 3556-3559).
Описаны также мутации в промоторной области гена norM, влияющие на резистентность N. gonorrhoeae к тетрациклину и некоторым фторхинолонам (Rouquette-Loughlin С, Dunham S.A., Kuhn М., Balthazar J.T., Shafer W.M. The NorM efflux pump of Neisseria gonorrhoeae and Neisseria meningitidis recognizes antimicrobial cationic compounds. J. Bacteriol. 2003. 185: 1101-1106).
Активное выведение макролидов осуществляется с использованием транспортной системы, кодируемой геном mef. Белок-транспортер выводит 14- и 15-членные макролиды и обеспечивает резистентность к ним N. gonorrhoeae (Luna V.A., Cousin S. Jr., Whittington W.L.H., Roberts M.C. Identification of the conjugative mef gene in clinical Acinetobacter junii and Neisseria gonorrhoeae isolates. Antimicrob. Agents Chemother. 2000. 44: 2503-2506).
Резистентность N. gonorrhoeae к ряду препаратов возникает в результате модификации поринового белка PorB (кодируемого геном porB), который участвует в транспорте антибиотиков через внешнюю мембрану клетки. Основными мутациями гена porB, влияющими на транспорт антибиотиков, являются замены G120K, G120D/A121D. Эти детерминанты приводят к резистентности N. gonorrhoeae к тетрациклинам, а повышение резистентности к β-лактамным антибиотикам (пенициллинам, цефалоспоринам) наблюдается при сочетании этих мутаций с мутациями в гене mtrR помпы эффлюкса MtrCDE (Olesky М., Zhao S., Rosenberg R.L., Nicholas R.A. Porin-mediated antibiotic resistance in Neisseria gonorrhoeae: ion, solute, and antibiotic permeation through PIB proteins withpenB mutations. J. Bacteriol. 2006. 188: 2300-2308).
В качестве основных методов лабораторной диагностики гонококковой инфекции длительное время используются микроскопия (бактериоскопия) мазков (окрашенных метиленовым синим и по Граму) и культуральное исследование. Микроскопия мазка позволяет быстро (в течение 10-15 мин.) получить результат, однако чувствительность этого метода может варьировать от ряда факторов, в том числе в зависимости от типа исследуемого материала, и, например, составляет около 55% при исследовании материала, полученного у мужчин с бессимптомным течением заболевания. «Золотым стандартом» в диагностике гонококковой инфекции до сих пор является культуральный или бактериологический метод, заключающийся в выделении чистой культуры гонококка (Фриго Н.В., Полевщикова С.А., Волков И.А., Шаталова А.Ю., Рахматулина М.Р., Соломка B.C. Современные методы идентификации возбудителя гонококковой инфекции. Вести. Дерматол. Венерол. 2011. 3: 45-51).
Культуральное исследование обладает высокой чувствительностью и может применяться при тестировании эндоцервикальных, уретральных и других клинических образцов, необходимых для исследования. Однако бактериологический метод исследования N. gonorrhoeae требует строгого соблюдения условий культивирования, поэтому высока вероятность получения ложноотрицательных результатов. К недостаткам культурального метода следует отнести высокую стоимость, трудоемкость и строгие требования к уровню квалификации персонала (Bignell С.2009 European (IUSTT/WHO) Guidelines on the diagnosis and treatment of gonorrhoea in adults. International. J STD AIDS. 2009. 20: 453-457).
Иммунологические тесты, направленные на выявление антител к возбудителю гонореи, в настоящее время не применяются для диагностики заболевания, так как не обладают достаточно высокой чувствительностью и специфичностью.
Перспективными для диагностики гонококковой инфекции являются методы, основанные на амплификации нуклеиновых кислот. Для применения этих методов подходит клинический материал, полученный из уретры, цервикального канала и влагалища, а также моча (Janda W.M., Knapp J.S. Neisseria and Moraxella catarrhalis, In Murray P.R., Baron E.J., Jorgensen J.H. et al. (eds) Manual of clinical microbiology. 8th ed., v. 1. ASM Press. 2003, Washington D.C., USA, 585-608). Недостатком применения ПЦР-методов является риск ложноположительных результатов, возникающих при контаминации клинического материала и реактивов, и ложноотрицательных результатов при наличии в клинических образцах факторов, ингибирующих ПЦР.
«Золотым стандартом» детекции чувствительности / резистентности возбудителя к антимикробным препаратам остается метод последовательных разведений в жидкой питательной среде или в агаре. Метод трудоемкий, поэтому пригоден для исследования небольших количеств изолятов. Используются также дискодиффузионные методы, включая Е-тесты (полоски, содержащие градиент концентраций антибиотика)(Unemo М., Shafer W.M. Antimicrobial resistance in Neisseria gonorrhoeae in the 21st Century: past, evolution, and future. Clin. Microbiol. Rev. 2014. 27(3): 587-613).
В литературе описаны методики на основе ПЦР и ПЦР в реальном времени для детекции резистентности N. gonorrhoeae, используемые в отдельных лабораториях Goire N., Sloots Т.Р., Nissen M.D., Whiley D.M. Protocol for the molecular detection of antibiotic resistance mechanisms in Neisseria gonorrhoeae. Methods Mol. Biol. 2010. 903: 319-328; Peterson S.W., Martin I., Demczuk W., Bharat A., Hoang L., et. al. Molecular assay for detection of ciprofloxacin resistance in Neisseria gonorrhoeae isolates from cultures and clinical nucleic acid amplification test specimens. J. Clin. Microbiol. 2015. 53(11): 3606-3608).
Несмотря на то, что имеются наборы для мультиплексной ПЦР, позволяющие выявлять одновременно несколько возбудителей заболеваний, передающихся половым путем, включая N. gonorrhoeae, например «Амплисенс» (ООО «ИнтерЛабСервис», Россия), Bio-Rad CT/NG/MG assay (США), Abbott RealTime CTVNG и APTIMA Combo 2 Assay (Abbott, США), Roche Cobas 4800 CTVNG assay (Roche, США), BD Probetec™ ET-CT/GC (Becton Dickinson, США), ни один из них не позволяет одновременно с идентификацией проводить определение генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам.
Методы секвенирования с использованием систем нового поколения Ion PGM sequencer (Life technologies, США), GS Junior System (Roche, США), MiSeqDx Instrument (Illumina, США) позволяют анализировать биологический образец с одновременным определением всех генетических детерминант резистентности, однако эти методы не обладают чувствительностью, достаточной для анализа клинического материала, а также отличаются высокой стоимостью анализа, и поэтому пока не находят массового применения в рутинной лабораторной диагностике.
Для идентификации и анализа N. gonorrhoeae используется метод масс-спектрометрии (Carannante A., De Carolis E., Vacca P., Vella A., et al (Evaluation of matrix-assisted laser desorption ionization-time of flight mass spectrometry (MALDI-TOF MS) for identification and clustering of Neisseria gonorrhoeae. BMC Microbiol. 2015. 15: 142-152). Метод обладает хорошей чувствительностью, однако требует наличия дорогостоящей аппаратуры и специально обученного персонала, и применяется, в основном для обнаружения и типирования возбудителя, но не для анализа профиля лекарственной резистентности.
Описан ряд работ, посвященных одновременной идентификации нескольких возбудителей инфекций органов репродукции человека, основанных на мультиплексной ПЦР-амплификации с последующей детекцией продуктов методом гибридизации, гель-электрофореза, блоттинга на мембране, (см., например, Muvunyi СМ., Dhont N., Verhelst R., et al. Evaluation of a new multiplex polymerase chain reaction assay STD finder for the simultaneous detection of 7 sexually transmitted disease pathogens. Diagnostic. Microbiol. Infect. Dis. 2011. 71(l): 29-37; McKechnie M.L, Kong F., Gilbert G.L. Simultaneous direct identification of genital microorganisms in voided urine using multiplex PCR-based reverse-line blot assays. Methods Mol. Biol. 2013. 943: 229-245). Во всех случаях не проводили анализ лекарственной резистентности возбудителей.
Для проведения многопараметрического анализа биомолекул разработана технология хМАР, в которой анализ проводится с использованием суспензии флуоресцентно-маркированных микросфер. На поверхности микросфер расположены олигонуклеотидные зонды. Окрашивание микросфер смешанными в различных соотношениях флуорофорами позволяет получить множество типов микросфер с различными спектральными характеристиками. Для детекции используется система лазеров, позволяющих проводить как качественную, так и количественную оценку наличия анализируемого соединения в образце. Описан анализ резистентности N. gonorrhoeae к антимикробным препаратам с использованием технологии хМАР (микросферы MicroPlex-xTAG компании Luminex Corp., США): Balashov S., Mordechai E., Adelson M.E., Gygax S.E. Multiplex bead suspension array for screening Neisseria gonorrhoeae antibiotic resistance genetic determinants in noncultured clinical samples. J. Mol. Diagn. 2013. 15: 116-129. Процедура анализа включала амплификацию 12 хромосомных и плазмидных локусов N. gonorrhoeae, мультиплексную аллель-специфическую ПЦР и детекцию с помощью флуоресцирующих микросфер. Проводилась одновременное детектирование 2-х плазмидных генов N. gonorrhoeae и ряда геномных мутаций, служащих генетическими маркерами резистентности N. gonorrhoeae к 6 антимикробным препаратам (пенициллину, ципрофлоксацину, цефиксиму, тетрациклину, азитромицину и спектиномицину). К недостаткам данной технологии относится сложность получения микросфер, а также необходимость использования сложной и дорогостоящей аппаратуры для анализа.
Современные методы многопараметрического анализа включают также методы на основе ДНК-микроматриц (микрочипов, биочипов), которые представляют собой массивы закрепленных на твердой фазе олигонуклеотидных зондов, способных специфично связываться с детектируемыми последовательностями. Далее проводится гибридизации зонда со специфическим участком ДНК микроорганизма.
Описано и запатентовано несколько вариантов ДНК-микрочипов для одновременной детекции нескольких возбудителей заболеваний, передаваемых половым путем. ФГБУ «Государственный научный центр дерматовенерологии и косметологии» Минздрава РФ запатентован ДНК-чип для комплексной диагностики 28 патогенных, непатогенных и условно-патогенных микроорганизмов мочеполовой сферы человека, включающих N. gonorrhoeae, на котором производится детекция после проведения мультиплексной ПЦР («ДНК-чип для комплексной диагностики инфекций, передаваемых половым путем», патент РФ на полезную модель 117431, приоритет от 05.11.2009; Лихарева В.В., Фриго Н.В., Рахматулина М.Р., Нурутдинова О.С, Шаталова, Ю.А. Разработка ДНК-чипа для комплексной диагностики ИППП. Вести, дерматол. венерол. 2009. 4: 49-57). Биочип для одновременной видовой идентификации нескольких инфекционных агентов запатентован ЗАО «Молекулярно-медицинские технологии» (патент РФ №2348695, дата приоритета 23.05.2006, «Дифференцирующий и специфический олигонуклеотиды для идентификации последовательностей ДНК инфекционных агентов в биологических материалах, способ видовой идентификации инфекционных агентов, биочип и набор для осуществления этого способа»). Корейскими исследователями запатентован ДНК чип, предназначенный для диагностики инфекций мочеполовых путей (DNA chip for diagnosis of genitourinary infections, заявка на патент США №20140336082). Чип содержит олигонуклеотидные зонды, специфичные к анализируемым возбудителям. Описан также ДНК-микрочип для одновременного аназиза 17 возбудителей заболеваний, передающихся половым путем, включая возбудитель гонореи (Сао В., Wang S., Tian Z., Ни P., Feng L., Wang L. DNA microarray characterization of pathogens associated with sexually transmitted diseases, PLoS One. 2015. 10(7): e0133927). Все описанные ДНК-чипы предназначены только для обнаружения возбудителей инфекций, но не для идентификации детерминант лекарственной резистентности.
Описан олигонуклеотидный микрочип для детекции точечных мутаций в генах gyrA и parC N. gonorrhoeae (Zhou W., Du W., et al. Detection of gyrA and parC mutations associated with ciprofloxacin resistance in Neisseria gonorrhoeae by use of oligonucleotide biochip technology. J. Clin. Microbiol, 2004, v.42 (12), p.5819-5824). Микрочип позволяет детектировать 15 детерминант, приводящих к резистентности исключительно к ципрофлоксацину, в частности, мутации остатков Ser91 and Asp95 белка GyrA, остатков Glu91 и Ser87 белка ParC.
Анализ литературы позволяет сделать вывод, что существует острая потребность в разработке инструмента для проведения многопараметрического генетического анализа, включающего идентификацию генетических детерминант резистентности N. gonorrhoeae к спектру антимикробных препаратов, включая фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин, который выгодно отличался бы возможностью одновременного установления резистентности возбудителя гонореи к спектру антибиотиков, что дало бы возможность своевременно назначать адекватную антимикробную терапию.
Раскрытие изобретения
В результате проведенных обширных научных исследований, анализа баз данных нуклеотидных последовательностей NCBI, авторами изобретения предложен инструмент для многопараметрического анализа генома возбудителя гонореи в виде биочипа для идентификации генетических детерминант резистентности N. gonorrhoeae к спектру антимикробных препаратов, таких как фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин.
Заявляемый в настоящем изобретении олигонуклеотидный биочип выгодно отличается от известных из уровня техники методов возможностью одновременной идентификации 26 генетических детерминант в ДНК N. gonorrhoeae, ассоциированных с резистентностью к фторхинолонам, антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам, макролидам, спектиномицину, что дает возможность назначать эффективную персонифицированную терапию заболевания. Олигонуклеотидный биочип может быть использован для выявления мультирезистентных штаммов возбудителя и эпидемиологического генотипирования по обнаруженным детерминантам резистентности.
В своем первом аспекте данное изобретение обеспечивает биочип, представляющий собой матрицу элементов, размещенных на стеклянной или пластиковой подложке и содержащих иммобилизованные олигонуклеотиды, устанавливающие принадлежность анализируемой ДНК к виду N. gonorrhoeae и обеспечивающие идентификацию генетических детерминант, ассоциированных с резистентностью возбудителя к антимикробным препаратам. Элементы биочипа с иммобилизованными олигонуклеотидами объединены в следующие группы:
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 1, 2 которых соответствуют последовательности фрагмента гена 16S рРНК, содержащего видоспецифичный полиморфизм, для подтверждения принадлежности анализируемой ДНК к виду N. gonorrhoeae;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 3-7 которых соответствуют последовательностям гена gyrA дикого типа, либо последовательностям мутантных вариантов гена gyrA, приводящих к аминокислотным заменам S91F, D95N, D95G, встречающихся у штаммов N. gonorrhoeae, резистентных к фторхинолонам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 8-16 которых соответствуют последовательностям гена par С дикого типа, либо последовательностям мутантных вариантов гена parC, приводящих к аминокислотным заменам S87N, S87R, E91Q, E91G, E91K, Е91А, встречающихся у штаммов N. gonorrhoeae, резистентных к фторхинолонам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 17-20 которых соответствуют последовательностям плазмидного гена blaTEM дикого типа, характерных для штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, либо последовательностям мутантных вариантов гена blaTEM, приводящих к аминокислотным заменам М182Т, G238S, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда и цефалоспоринам;
- группа, состоящая из одного элемента с иммобилизованным олигонуклеотидом, нуклеотидная последовательность SEQ ID NO: 21 которого соответствует последовательности плазмидного гена tetM, продукт которого ответственен за резистентность N. gonorrhoeae к тетрациклинам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 22-24 которых соответствуют последовательностям гена rpsJ дикого типа, либо последовательностям мутантных вариантов гена rpsJ, приводящих к аминокислотным заменам V57M, V57L, встречающихся у штаммов N. gonorrhoeae, резистентных к тетрациклинам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 25, 26 которых соответствуют последовательностям гена 23S рРНК дикого типа, либо последовательностям мутатного варианта гена 23 S рРНК, приводящего к нуклеотидной замене A>G в положении 2059, встречающегося у штаммов N. gonorrhoeae, резистентных к макролидам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 27, 28 которых соответствуют последовательностям гена penA дикого типа, либо последовательностям мутатного варианта гена penA, приводящего к инсерции аминокислоты D (аспарагиновая кислота) в положении 345 гена, встречающегося у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 29, 30 которых соответствуют последовательностям гена ponA дикого типа, либо последовательностям мутатного варианта гена ponA, приводящего к аминокислотной замене L421P, встречающейся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 31-34 которых соответствуют последовательностям гена 16S РНК дикого типа, либо последовательностям мутантных вариантов гена 16S РНК, приводящих к нуклеотидным заменам С1192Т, G1064C, встречающихся у штаммов N. gonorrhoeae, резистентных к спектиномицину;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 35-39 которых соответствуют последовательностям гена mtrR дикого типа, либо последовательностям мутантных вариантов промоторной области гена mtrR, приводящих к инсерциям тимидина Т или ТТ в положении -10, или делеции аденина А в положении -35, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам;
- группа, состоящая из одного элемента с иммобилизованным олигонуклеотидом, нуклеотидная последовательность SEQ ID NO: 40 которого соответствует последовательности гена mefA, продукт которого ответствен за резистентность N. gonorrhoeae к макролидам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 41-43 которых соответствуют последовательностям гена porB дикого типа, либо последовательностям мутантных вариантов гена porB, приводящих к аминокислотным заменам G120D, G120K, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам.
Еще одним аспектом данного изобретения является набор олигонуклеотидов, используемый для получения биочипа для идентификации генетических детерминант резистентности Neisseria gonorrhoeae к спектру антимикробных препаратов, включая фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин, причем зонды имеют последовательности SEQ ID NO: 1-43.
Перечень фигур
Фиг 1. Схема размещения элементов биочипа для идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам.
Элементы биочипа представлены в виде кругов. Надпись внутри круга отображает назначение олигонуклеотида - анализ принадлежности к ДНК N. gonorrhoeae (16S ident), анализ вариабельных аминокислоты/нуклеотида на предмет соответствия дикому типу (wt), либо мутации; идентификация маркерного гена резистентности (название гена). Индекс над каждым элементом '1-43', соответствует SEQ ID олигонуклеотида.
М - элементы, содержащие маркер для обработки сигналов элементов биочипа;
О - элементы, не содержащие иммобилизованных олигонуклеотидов, используемые для вычисления фонового сигнала.
Фиг. 2. Гибридизационная картина биочипа и результаты ее интерпретации при анализе ДНК штамма дикого типа N. gonorrhoeae, чувствительного к фторхинолонам, антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам, макролидам, спектиномицину.
Фиг. 3. Гибридизационная картина биочипа и результаты ее интерпретации при анализе образца, не содержащего ДНК N. gonorrhoeae.
Фиг. 4-16. Гибридизационные картины биочипов и результаты их интерпретации при анализе образцов ДНК штаммов N. gonorrhoeae, различающихся профилями устойчивости к антимикробным препаратам.
Осуществление изобретения
Задачей изобретения являлось конструирование инструмента для проведения многопараметрического анализа генома возбудителя гонореи, предназначенного для идентификации генетических детерминант резистентности N. gonorrhoeae к широкому спектру антимикробных препаратов. В данном изобретении предлагается биочип для идентификации генетических детерминант резистентности N. gonorrhoeae к фторхинолонам, антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам, макролидам, спектиномицину.
Биочип представляет собой матрицу элементов, размещенных на стеклянной или пластиковой подложке и содержащих иммобилизованные олигонуклеотидные зонды, устанавливающие принадлежность анализируемой ДНК к виду N. gonorrhoeae, а также идентификацию генетических детерминант, включающих мутации и плазмиды, ассоциированные с резистентностью возбудителя к антимикробным препаратам.
Элементы биочипа могут быть сформированы посредством нанесения водных растворов олигонуклеотидов непосредственно на подложку, с получением варианта т.н. «планарного» биочипа (например, согласно Matson R.S. Microarray Methods and Protocols. 2009. CRC Press. 216 pages, ISBN 9781420046656), либо представлять собой массив трехмерных гидрогелевых ячеек полусферической формы, расположенных на подложке из стекла или пластика и содержащих ковалентно иммобилизованные олигонуклеотиды. Такой биочип может быть изготовлен, например, методом сополимеризационной иммобилизации (патент РФ №2216547, патент ЕР 1437368; Rubina A.Y., Pan'kov S.V. et al., Hydrogel drop microchips with immobilized DNA: properties and methods for large-scale production. Anal. Biochem. 2004. 325: 92-106).
Схема расположения олигонуклеотидов на биочипе представлена на Фиг. 1. Биочип содержит 48 элементов, включая 43 ячейки с иммобилизованными олигонуклеотидами, 2 ячейки, не содержащих зондов, необходимые для вычисления фонового сигнала, и 3 ячейки с индексом «М», содержащие иммобилизованный маркер. Ячейки с маркером используются для правильного позиционирования биочипа при регистрации гибридизационной картины и ее обработки программным обеспечением биочип-анализатора (сканера) при автоматическом получении результатов.
Биочип позволяет устанавливать принадлежность анализируемой ДНК к виду N. gonorrhoeae на основе видоспецифичного полиморфизма в гене 16S рРНК ('16S ident') (группа ячеек 1-2) и одновременно определять:
- 3 детерминанты (мутации) в гене gyrA (группа ячеек 3-7) и 7 детерминант (мутаций) в гене parC (группа ячеек 8-16), приводящие к резистентности N. gonorrhoeae к фторхинолонам;
- наличие в образце анализируемой ДНК детерминанты - плазмиды blaTEM, характеризующее резистентность возбудителя к антибиотикам пенициллинового ряда, а также 2 детерминанты (мутации) в плазмиде blaTEM, ассоциированные с резистентностью к цефалоспоринам (группа ячеек 17-20);
- наличие в образце анализируемой ДНК детерминанты - плазмиды tetM (ячейка 21) и 2-х детерминант (мутаций) в гене rpsJ (группа ячеек 22-24), ассоциированных с резистентностью N. gonorrhoeae к тетрациклинам;
- детерминанту (мутацию) в гене 23S РНК (группа ячеек 25, 26), приводящую к резистентности N. gonorrhoeae к макролидам;
- детерминанту (мутацию) в гене repA (группа ячеек 27, 28) и детерминанту (мутацию) в гене ponA (группа ячеек 29, 30), приводящих к резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда;
- 2 детерминанты (мутации) в гене 16S РНК (группа ячеек 31-34), приводящие к резистентности N. gonorrhoeae к спектиномицину;
- 3 детерминанты (мутации) в гене помпы эффлюкса mtrR (группа ячеек 35-39), ассоциированные с резистентностью возбудителя к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам;
- детерминанту - наличие гена помпы эффлюкса mefA (ячейка 40), продукт которого характерен для резистентных к макролидам изолятов N. gonorrhoeae;
- 2 детерминанты (мутации) в гене porB (группа ячеек 41-43), характеризующие резистентность N. gonorrhoeae к антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам.
Перечень последовательностей олигонуклеотидов, используемых для изготовления биочипа, и их SEQ ID приведены в Таблице 1.
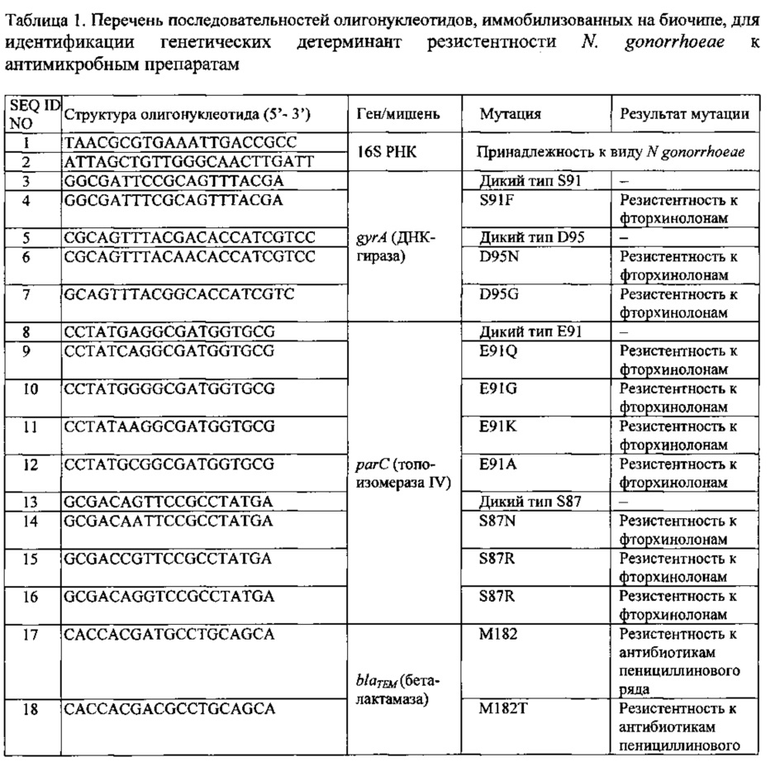
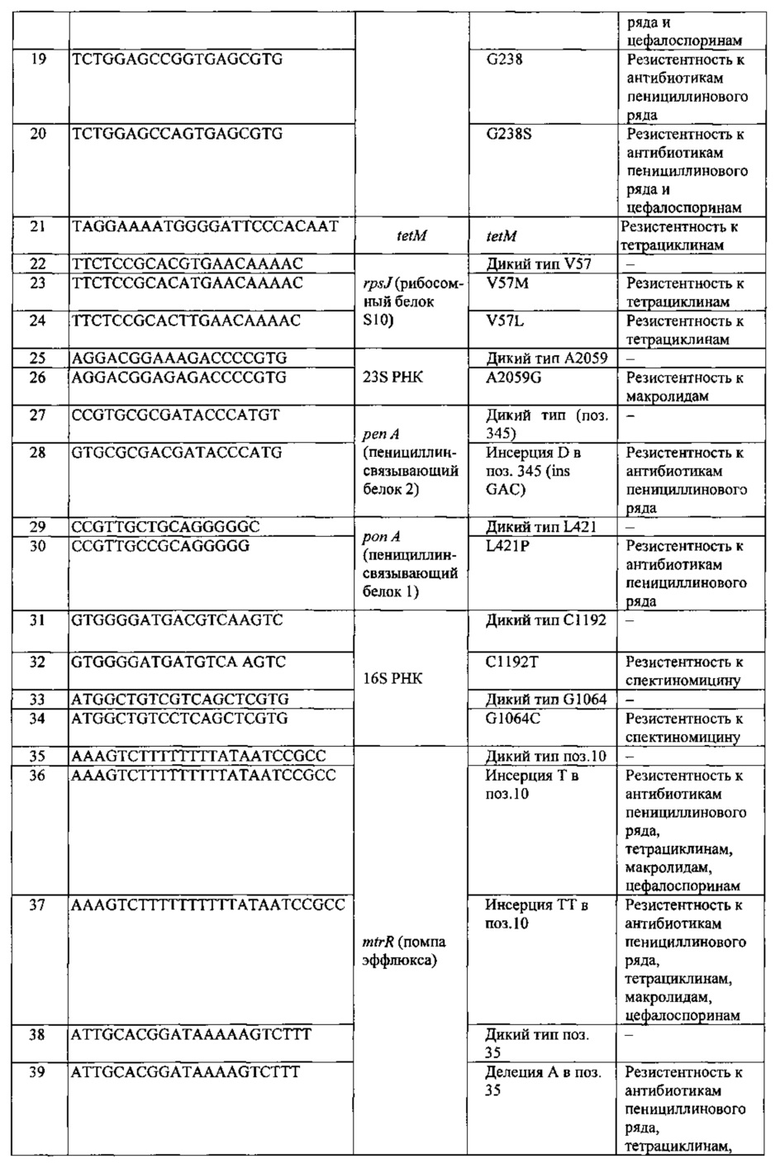
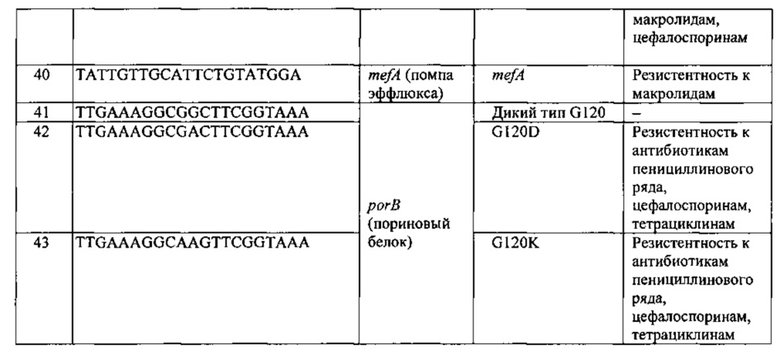
При выборе дискриминирующих олигонуклеотидов для иммобилизации на биочипе с учетом размера и сложности анализируемой последовательности и, в частности, наличия повторов и протяженных гомополимерных последовательностей, определяют длину дискриминирующих олигонуклеотидов, обеспечивающую их специфичность в отношении анализируемой последовательности. Для каждой позиции, для которой известны мутации либо видоспецифичный однонуклеотидный полиморфизм, подбирают набор специфичных дискриминирующих олигонуклеотидов, способный выявлять известные варианты замен. Используя программное обеспечение, например, Oligo v. 6.3 (Molecular Biology Insights Inc., США), рассчитывают температуры плавления олигонуклеотидов и, варьируя их длину, добиваются того, чтобы разброс температур плавления олигонуклеотидов составлял не более 2-3°С. Избегают таких олигонуклеотидов, которые способны формировать вторичные структуры типа шпильки с высокими температурами плавления. Положение определяемых вариабельных нуклеотидов и других нуклеотидных перестроек выбирают по возможности не далее 1 -4 нуклеотида от середины соответствующего дискриминирующего олигонуклеотида.
Процедура проведения идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам с использованием биочипа включает подготовку клинического образца (материал соскобов со слизистой оболочки органов мочеполовой системы), ПЦР-амплификацию с использованием олигонуклеотидных праймеров, комплементарных соответствующим фрагментам ДНК N. gonorrhoeae, гибридизацию амплифицированных продуктов на биочипах, регистрацию и интерпретацию результатов гибридизации.
ПЦР-амплификацию проводят любым способом, позволяющим получить фрагменты ДНК, соответствующие анализируемым последовательностям, например, согласно вариантам, опубликованным ранее: Зименков Д.В., Кулагина Е.В., Антонова О.В., Суржиков С.А., Беспятых Ю.А., Шитиков Е.А., Ильина Е.Н., Михайлович В.М., Заседателев А.С. Грядунов Д.А. Анализ генетических детерминант множественной и широкой лекарственной резистентности возбудителя туберкулеза с использованием олигонуклеотидного микрочипа. Молекулярная биология. 2014. 48(2): 251-264; либо Грядунов Д.А, Гетман И.А., Чижова С.Н., Михайлович В.М., Заседателев А.С., Романов Г.А. Идентификация генно-модифицированных источников растительного происхождения в пищевых продуктах и сырье с использованием гидрогелевого олигонуклеотидного микрочипа. Молекулярная биология. 2011. 45(6): 973-983; либо Фесенко Д.О., Корниенко А.Е., Чудинов А.В., Наседкина Т.В. Получение одноцепочечной ДНК в одноэтапной ПЦР с легкоплавким избыточным праймером для гибридизации на биочипах. Молекулярная биология. 2011. 45(2): 267-272.
Полученные фрагменты исследуемых сегментов генома N. gonorrhoeae далее гибридизуют с олигонуклеотидами, иммобилизованными на биочипе. Гибридизацию проводят в растворе, содержащем буферный компонент для поддержания рН, соль для создания ионной силы и хаотропный (дестабилизирующий водородные связи) агент, в герметичной гибридизационной камере при температуре, зависящей от температуры плавления иммобилизованных на микрочипе дискриминирующих олигонуклеотидов, как показано ранее Mikhailovich V.M., Lapa S.A., Gryadunov D.A., Strizhkov B.N., Sobolev A.Y., Skotnikova O.I., Irtuganova O.A., Moroz A.M., Litvinov V.I., Shipina L.K., Vladimirskii M.A., Chernousova L.N., Erokhin V.V., Mirzabekov A.D. Detection of rifampicin-resistant Mycobacterium tuberculosis strains by hybridization and polymerase chain reaction on a specialized ТВ-Microchip.Journal of Clinical Microbiology. 2001. 131(l): 94-98.
Олигонуклеотидные зонды, заявленные в настоящем изобретении, имеют температуру плавления в интервале от 42 до 44°C, что позволяет проводить гибридизацию при 37°С с использованием хаотропного агента. Температура 37°С удобна тем, что большинство клинических лабораторий оснащены термостатами, поддерживающими эту температуру.
Используя схему расположения олигонуклеотидов на биочипе (Фиг. 1), по окончании процедуры гибридизации проводят регистрацию гибридизационных картин и их интепретацию, устанавливая принадлежность анализируемой ДНК к виду N. gonorrhoeae и идентифицируя генетические детерминанты резистентности к фторхинолонам, антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам, макролидам, спектиномицину.
Принадлежность анализируемой ДНК к виду N. gonorrhoeae устанавливают, анализируя группу ячеек 1-2, выбирая максимальный сигнал из двух элементов Imax и сравнивая его со средним значением сигнала в элементах биочипа, не содержащих олигонуклеотидов <I0>. В случае выполнения соотношения Imax/<I0>≥2, считают, что анализируемая ДНК принадлежит к виду N. gonorrhoeae и далее проводят анализ на предмет идентификации генетических детерминант резистентности. Иначе, если отношение Imax/<I0> составляет менее 2, делают вывод об отсутствии ДНК N. gonorrhoeae в анализируемом образце, и анализ других элементов биочипа не проводят.
Анализ групп элементов, включающих олигонуклеотиды, специфичные для генетических детерминант резистентности, проводят посредством сравнения интенсивности сигналов элементов, содержащих олигонуклеотиды, соответствующие дикому типу и мутантным вариантам. Если максимальный сигнал регистрируют в элементе, соответствующем ДНК дикого типа, то это означает, что в данной аминокислотной/нуклеотидной позиции изучаемый образец ДНК мутаций не несет. Если регистрируют максимальный сигнал в ячейке, соответствующей ДНК с мутацией, это означает, что по данной аминокислотной/нуклеотидной позиции изучаемый образец ДНК обладает мутацией, ассоциированной с резистентностью возбудителя. Исключение составляют группы ячеек 17-20, элемент 21 и элемент 40. Для группы ячеек 17-20 выбирают элемент, имеющий максимальный сигнал Imax17-20, и сравнивают полученное значение со средним значением сигнала в элементах биочипа, не содержащих олигонуклеотидов <I0>. В случае выполнения соотношения Imax17-20/<I0>≥2, считают, что анализируемый образец ДНК содержит плазмидный ген blaTEM, ассоциированный с резистентностью к антибиотикам пенициллинового ряда, после чего проводят анализ внутри группы элементов 17-20 на предмет выявления мутантных вариантов данного гена. Аналогично, для ячеек 21 и 40, если выполняется соотношение I21/<I0>≥2, считают, что в образце ДНК присутствует плазмида tetM, ассоциированная с резистентностью к тетрациклинам; если выполняется соотношение I40/<I0>≥2, определяют наличие гена mef, продукт которого характерен для устойчивых к макролидам изолятов N. gonorrhoeae.
Таким образом, идентификация генетических детерминант резистентности N. gonorrhoeae в группах элементов биочипа выполняется следующим образом:
- в группе элементов 3-7 максимальный сигнал в ячейках 3 и 5 свидетельствует об отсутствии мутаций в фрагменте гена gyrA; максимальный сигнал от ячеек 4, 6 или 7 указывает на наличие в данном гене мутаций, приводящих к заменам S91F и S95N или S95G, соответственно, свидетельствующих о резистентности N. gonorrhoeae к фторхинолонам;
- в группе элементов 8-16 максимальный сигнал в ячейках 8 и 13 свидетельствует об отсутствии мутаций в фрагменте гена parС; максимальный сигнал от ячеек 9-12 и/или 14-16 указывает на наличие мутаций в данном гене, приводящих к заменам E91G или Е91К, или Е91А, и S87N или S87R, соответственно, свидетельствующих о резистентности N. gonorrhoeae к фторхинолонам;
- в группе элементов 17-20 при выполнении соотношения Imax17-20/<I0>≥2, считают, что анализируемый образец ДНК содержит плазмидный ген blaTEM, ассоциированный с резистентностью к антибиотикам пенициллинового ряда; при этом максимальный сигнал от ячеек 18 и/или 20 указывает на наличие замен М182Т и/или G238S, свидетельствующих о резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда и цефалоспоринам;
- в группе, состоящей из элемента 21, анализируют соотношение I21/<I0>≥2, и, если оно выполняется, то считают, что в образце ДНК присутствует плазмида tetM, ассоциированная с резистентностью N. gonorrhoeae к тетрациклинам;
- в группе элементов 22-24 максимальный сигнал в ячейке 22 свидетельствует об отсутствии мутаций в фрагменте гена rpsJ; максимальный сигнал от ячеек 23 или 24 указывает на наличие в данном гене мутаций, приводящих к заменам V57M или V57L, соответственно, свидетельствующих о резистентности N. gonorrhoeae к тетрациклинам;
- в группе элементов 25-26 максимальный сигнал в ячейке 25 свидетельствует об отсутствии мутаций в фрагменте гена 23S pPHK; максимальный сигнал от ячейки 26 указывает на наличие в данном гене мутации A2059G, свидетельствующей о резистентности N. gonorrhoeae к макролидам;
- в группе элементов 27-28 максимальный сигнал в ячейке 27 свидетельствует об отсутствии мутаций в фрагменте гена penA; максимальный сигнал от ячейки 28 указывает на наличие в данном гене мутации, приводящей к инсерции аминокислоты Asp (D) в положении 345, свидетельствующей о резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда;
- в группе элементов 29-30 максимальный сигнал в ячейке 29 свидетельствует об отсутствии мутаций в фрагменте гена ponA; максимальный сигнал от ячейки 30 указывает на наличие в данном гене мутации, приводящей к замене L421P, свидетельствующей о резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда;
- в группе элементов 31-34 максимальные сигналы в ячейках 31 и 33 свидетельствуют об отсутствии мутаций в фрагменте гена 16S рРНК; максимальные сигналы в ячейках 32 и/или 34 указывает на наличие в данном гене мутаций С1162Т, и/или G1064C, свидетельствующих о резистентности N. gonorrhoeae к спектиномицину;
- в группе элементов 35-39 максимальные сигналы в ячейках 35 и 37 свидетельствуют об отсутствии мутаций в фрагменте гена mtrR; максимальные сигналы в ячейках 36, 38-39 указывают на наличие в промоторной области данного гена мутаций - делеции А в положении -35 либо инсерций Т или ТТ в положении -10, свидетельствующих о резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам;
- в группе, состоящей из элемента 40, анализируют соотношение I40/<I0>≥2, если оно выполняется, то считают, что в образце ДНК выявлен ген, кодирующий белок помпы эффлюкса mefA, присутствующий у изолятов N. gonorrhoeae, резистентных к макролидам;
- в группе элементов 41-43 максимальный сигнал в ячейке 41 свидетельствует об отсутствии мутаций в фрагменте гена porB; максимальный сигнал от ячеек 42 или 43 указывает на наличие в данном гене мутаций, приводящих к заменам G120D или G120K, соответственно, свидетельствующих о резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам.
Данный алгоритм может быть реализован в программном обеспечении, позволяющем проводить автоматическую регистрацию и интерпретацию результатов посредством регистрации картины гибридизации, вычисления сигнала в каждой ячейке, сравнения сигналов внутри групп и выдачи отчета о принадлежности анализируемого образца ДНК к виду N. gonorrhoeae и отсутствии/наличии детерминант резистентности к фторхинолонам, антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам, макролидам, спектиномицину.
Далее изобретение будет проиллюстрировано примерами, которые предназначены для обеспечения лучшего понимания сущности заявленного изобретения, но не должны рассматриваться как ограничивающие данное изобретение.
Примеры
Пример 1. Изготовление биочипа на основе гидрогелей для идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам.
Синтез олигонуклеотидов с с последовательностями SEQ ID NO: 1-43 (Таблица 1) проводили на автоматическом синтезаторе ABI-394 DNA/RNA synthesizer («Applied Biosystems», США) с использованием стандартного фосфорамидитного метода и очищали методом обращенно-фазовой ВЭЖХ (комплекс «Gilson», Франция). Олигонуклеотиды для иммобилизации в элементах микрочипа содержали спейсер со свободной аминогруппой, введенной в процессе синтеза с использованием 5'-Amino-Modifier С6 («Glen Research)), США). Изготовление биочипов производили в соответствии с процедурой, описанной ранее (Rubina A.Y., Pan'kov S.V. et al. Hydrogel drop microchips with immobilized DNA: properties and methods for large-scale production. Anal. Biochem., 2004, v. 325, p. 92-106).
Полимеризационные смеси, содержащие смесь гелеобразующих мономеров (производные метакриламида, метилен-бис-акриламида, стабилизаторы и др.) и иммобилизуемые соединения (олигонуклеотиды или флуоресцентный краситель IMD 504), помещали ячейки 384-луночного планшета. С использованием робота QArray (Genetix, Великобритания) смеси из лунок планшета переносили в виде микрокапель на поверхность пластиковых подложек. Полимеризация геля с одновременной ковалентной иммобилизацией олигонуклеотидов в структуре геля происходила под действием УФ-излучения (УФ-лампа Sylvania GTE F15T8350 BL, Великобритания), 40 мин, 20°С, в потоке азота. После полимеризации подложки с массивами гидрогелевых ячеек (микрокапель) промывали 0,1 М фосфатным буфером, водой и высушивали в беспылевой атмосфере.
Схема изготовленного биочипа на основе гидрогеля для идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам приведена на Фиг. 1.
Биочип содержит 48 элементов, включая 43 ячейки с иммобилизованными олигонуклеотидами, 2 ячейки, не содержащих зондов, необходимые для вычисления фонового сигнала, и 3 ячейки с индексом «М», содержащие иммобилизованный маркер. Ячейки с маркером используются для правильного позиционирования биочипа при регистрации гибридизационной картины и ее обработки программным обеспечением биочип-анализатора (сканера) при автоматическом получении результатов.
Биочип позволяет устанавливать принадлежность анализируемой ДНК к виду N. gonorrhoeae на основе видоспецифичного полиморфизма в гене 16S рРНК ('16S ident') (группа ячеек 1-2) и одновременно определять:
- 3 детерминанты (мутации) в гене gyrA (группа ячеек 3-7) и 7 детерминант (мутаций) в гене parC (группа ячеек 8-16), приводящие к резистентности N. gonorrhoeae к фторхинолонам;
- наличие в образце анализируемой ДНК детерминанты - плазмиды blaTEM, характеризующее резистентность возбудителя к антибиотикам пенициллинового ряда, а также 2 детерминанты (мутации) в плазмиде blaTEM, ассоциированные с резистентностью к цефалоспоринам (группа ячеек 17-20);
- наличие в образце анализируемой ДНК детерминанты - плазмиды tetM (ячейка 21) и 2-х детерминант (мутаций) в гене rpsJ (группа ячеек 22-24), ассоциированных с резистентностью N. gonorrhoeae к тетрациклинам;
- детерминанту (мутацию) в гене 23S РНК (группа ячеек 25, 26), приводящую к резистентности N. gonorrhoeae к макролидам;
- детерминанту (мутацию) в гене penA (группа ячеек 27, 28) и детерминанту (мутацию) в гене ponA (группа ячеек 29, 30), приводящих к резистентности N. gonorrhoeae к антибиотикам пенициллинового ряда;
- 2 детерминанты (мутации) в гене 16S РНК (группа ячеек 31-34), приводящие к резистентности N. gonorrhoeae к спектиномицину; е
- 3 детерминанты (мутации) в гене помпы эффлюкса mtrR (группа ячеек 35-39), ассоциированные с резистентностью возбудителя к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам;
- детерминанту - наличие гена помпы эффлюкса mefA (ячейка 40), продукт которого характерен для резистентных к макролидам изолятов N. gonorrhoeae;
- 2 детерминанты (мутации) в гене porB (группа ячеек 41-43), характеризующие резистентность N. gonorrhoeae к антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам.
Пример 2. Идентификация генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам с использованием биочипа.
Процедура анализа включала следующие стадии: выделение ДНК из клинического материала, мультиплексную ПЦР использованием ДНК N. gonorrhoeae в качестве матрицы, набора специфичных олигонуклеотидных праймеров и смеси четырех дезоксинуклеозидтрифосфатов, один из которых содержал флуоресцентную метку, с получением флуоресцентно-меченных фрагментов ДНК; гибридизацию амплифицированных флуоресцентно-меченных продуктов на биочипах; регистрацию и интерпретацию результатов гибридизации.
а) Обработка клинического материала и выделение ДНК
Обработку образцов клинического материала - соскобов со слизистой оболочки органов мочеполовой системы, и выделение тотальной ДНК проводили с использованием набора «ДНК-Экспресс для выделения ДНК из биопроб» (ЗАО «Литех», Россия) согласно рекомендациям производителя.
б) Подготовка праймеров для мультиплексной ПЦР
При выборе последовательностей праймеров для проведения ПЦР использовали базы данных нуклеотидньгх последовательностей, известные специалистам в данной области, например, база данных http:/www.ncbi.nlm.nib.gov/Genbank/index.html. Специфичность праймеров проверяли с помощью программного обеспечения, использующего поиск в базах нуклеотидных последовательностей по алгоритму BLAST (www.ncbi.nlm.nih.gov/BLAST). Перечень использованных в данном примере праймеров приведен в Таблице 2. Праймеры синтезировали на автоматическом синтезаторе 394 DNA/RNA synthesizer (Applied Biosystems, США).

в) Проведение мультиплексной ПЦР
Готовили реакционную смесь для проведения ПЦР, внося в пробирку следующиереагенты (из расчета на 1 реакцию):
В качестве флуоресцентно-меченного субстрата использовали конъюгат дУТФ с флуоресцентным красителем IMD-515 (максимум поглощения при 645 нм, максимум флуоресценции при 670 нм) (Kuznetsova V.E., Spitsyn М.А., Shershov V.E., Guseinov Т.О., Fesenko E.E., Lapa S.A., Ikonnikova A.Iu., Avdonina M.A., Nasedkina T.V., Zasedatelev A.S., Chudinov A.V. Novel fluorescently labeled nucleotides: synthesis, spectral properties and application in polymerase chain reaction. Mendeleev Communications. 2016. 26(2): 95-98). Флуоресцентный субстрат встраивается ДНК-полимеразой в растущую цепь ДНК в ходе ПЦР.
К полученной ПЦР-смеси добавляли 3 мкл раствора ДНК, полученного из клинического образца. Для отрицательного контрольного образца использовали 3 мкл деионизованной воды. Мультиплексную ПЦР проводили на амплификаторе S1000 (Bio-Rad, США). Использовали следующую последовательность стадий: денатурация 5 мин при 95°С, 50 циклов по схеме 95°С - 30 с, 64°С - 30 с, 72°С - 30 с и 72°С - 5 мин.
Полученные растворы использовали для проведения гибридизации на биочипе, изготовленном, как описано в Примере 1.
г) Гибридизация флуоресцентно-меченных продуктов на биочипах
В пробирку вносили 10 мкл буфера для гибридизации (0,3 М HEPES, рН 7,5, 3,0 М гуанидинтиоцианата, 30 мМ ЭДТА) и 20 мкл реакционной смеси после проведения ПЦР. 30 мкл полученной гибридизационной смеси помещали в реакционную камеру биочипа. Гибридизацию проводили при 37°С в течение 6-12 часов. По окончании гибридизации биочип трижды промывали дистиллированной водой при 37°С, снимали гибридизационную камеру, и высушивали биочип в потоке воздуха, д) Регистрация и интерпретация результатов гибридизации
Регистрацию гибридизационных картин выполняли на универсальном аппаратно-программном комплексе (У АПК) (ООО «БИОЧИП-ИМБ», Россия) для анализа биологических микрочипов с использованием специализированного программного обеспечения 'TmageWare®' (ООО «БИОЧИП-ИМБ»). Гибридизационные картины биочипов приведены на Фиг. 2-16.
В соответствии с предложенным алгоритмом интерпретации результатов проводили вычисление сигналов в каждом элементе биочипа, используя УАПК. Принадлежность анализируемой ДНК к виду N. gonorrhoeae выполняли посредством оценки отношения максимального значения Imax сигнала в группе элементов 1-2 (16S ident) к среднему значению <I0>сигналов элементов биочипа, не содержащих олигонуклеотидов. Для гибридизационных картин, представленных на Фиг. 2, 4-16, выполнялось соотношение Imax/<I0>≥2, т.е. анализируемый образец ДНК был получен из штамма N. gonorrhoeae; после чего проводили анализ элементов биочипа на предмет установления детерминант резистентности. Для гибридизационной картины, представленной на Фиг. 3, отношение Imax/<I0> составляло менее 2, что означало отсутствие ДНК возбудителе гонореи в анализируемом образце, поэтому дальнейшую интерпретацию гибридизационной картины не проводили.
Для гибридизационной картины, представленной на Фиг. 2, в каждой из групп максимальные сигналы зарегистрированы в элементах, содержащих олигонуклеотиды, соответствующие дикому типу. При этом в группах элементов 17-20, 21, 40 значимых сигналов, т.е. превосходящих среднее значение сигнала в элементах, не содержащих олигонуклеотидов, в 2 и более раза, выявлено не было. Следовательно, анализируемый образец ДНК N. gonorrhoeae относится к ДНК штамма дикого типа.
Иначе, для гибридизационной картины, представленной на Фиг. 4, максимальные сигналы в группе элементов 3-7 зарегистрированы в ячейках S91F и D95G, что свидетельствует о мутациях в гене gyrA, приводящих к резистентности к фторхинолонам. В группе элементов 17-20 максимальный сигнал ячеек превосходит среднее значение сигнала в элементах, не содержащих олигонуклеотидов, в 2 и более раза, что говорит о наличии плазмидного гена Wotem, ассоциированного с устойчивостью к антибиотикам пенициллинового ряда. При этом максимальные сигналы в данной группе зарегистрированы в ячейках, соответствующих олигонуклеотидам дикого типа, что говорит об отсутствии мутаций в гене blaTEM, и, соответственно, о чувствительности анализируемого штамма к цефалоспоринам. Наконец, в группе элементов 22-24 максимальный сигнал зарегистрирован в ячейке, соответствующей мутантному варианту V57M гена rpsJ, подтверждающему резистентность данного изолята N. gonorrhoeae к тетрациклинам. Во всех остальных группах максимальные сигналы зарегистрированы в элементах, содержащих олигонуклеотиды, соответствующие дикому типу, также отсутствуют значимые сигналы в группах элементов 21 и 40. Тем самым, исследуемый изолят N. gonorrhoeae следует отнести к чувствительным к макролидам и спектиномицину.
Аналогичным образом проводили интерпретацию других гибридизационных картин биочипов, которые приведены на Фиг. 5-16.
Корректность идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам с использованием предлагаемого биочипа во всех случаях проверяли методом секвенирования соответствующих участков ДНК возбудителя. Секвенирование проводили на автоматическом секвенаторе 3130×L Applied Biosystems (США) с помощью коммерческого набора для проведения секвенирующих реакций «BigDye Terminator v 3.1 Ready Reaction Cycle Sequencing Kit». Результаты, полученные с использованием биочипа, предлагаемого в данном изобретении, и референсным методом, полностью совпали.
Таким образом, биочип, представленный в данном изобретении, является инструментом для проведения мультиплексного анализа, который позволяет за короткое время точно определять генетические детерминанты резистентности N. gonorrhoeae к актуальным антибактериальным препаратам в клиническом материале. Биочип выгодно отличается от существующих в настоящее время методов определения лекарственной чувствительности возбудителя гонореи скоростью проведения анализа (в сравнении с микробиологическими тестами) и спектром одновременно выявляемых детерминант резистентности, что дает возможность назначить эффективную персонифицированную терапию заболевания, выявлять мультирезистентные штаммы возбудителя и проводить эпидемиологическое генотипирование.








Группа изобретений относится к биотехнологии. Предложены олигонуклеотидный биочип для идентификации генетических детерминант резистентности N. gonorrhoeae к антимикробным препаратам, включающим фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин, а также набор олигонуклеотидов для иммобилизации на биочипе. Биочип представляет собой подложку с объединенными в группы элементами, содержащими 2 ячейки, не содержащие зондов, для вычисления фонового сигнала, 3 ячейки с иммобилизированным маркером для правильного позиционирования биочипа, а также ячейки с иммобилизованными олигонуклеотидами, устанавливающими принадлежность анализируемой ДНК к виду N. Gonorrhoeae, и олигонуклеотидами, обеспечивающими идентификацию генетических детерминант, ассоциированных с резистентностью возбудителя к антимикробным препаратам, причем олигонуклеотиды имеют последовательности SEQ ID NO: 1-43. Изобретения позволяют за короткое время точно определять генетические детерминанты резистентности N. gonorrhoeae к антибактериальным препаратам в клиническом материале. 2 н.п. ф-лы, 16 ил., 2 табл., 2 пр.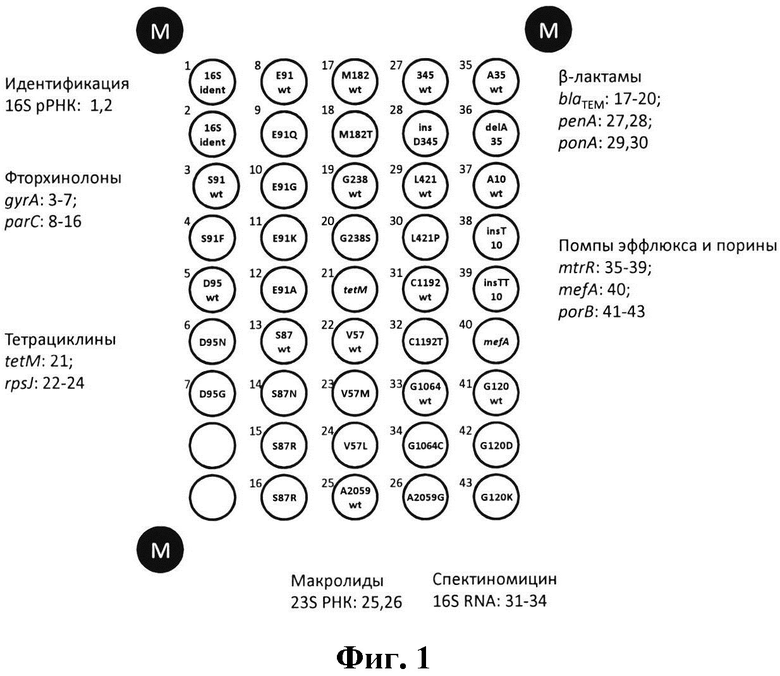
1. Олигонуклеотидный биочип для идентификации генетических детерминант резистентности Neisseria gonorrhoeae к антимикробным препаратам, включающим антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, фторхинолоны, макролиды, спектиномицин, характеризующийся тем, что он представляет собой матрицу элементов, размещенных на стеклянной или пластиковой подложке и содержащих 2 ячейки, не содержащие зондов, для вычисления фонового сигнала, и 3 ячейки с иммобилизированным маркером для правильного позиционирования биочипа, а также ячейки с иммобилизованными олигонуклеотидами, устанавливающими принадлежность анализируемой ДНК к виду N. gonorrhoeae и обеспечивающие идентификацию генетических детерминант, ассоциированных с резистентностью возбудителя к антимикробным препаратам, при этом элементы биочипа с иммобилизованными олигонуклеотидами объединены в группы:
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 1, 2 которых соответствуют последовательности фрагмента гена 16S рРНК, содержащего видоспецифичный полиморфизм, для подтверждения принадлежности анализируемой ДНК к виду N. gonorrhoeae;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 3-7 которых соответствуют последовательностям гена gyrA дикого типа, либо последовательностям мутантных вариантов гена gyrA, приводящих к аминокислотным заменам S91F, D95N, D95G, встречающихся у штаммов N. gonorrhoeae, резистентных к фторхинолонам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 8-16 которых соответствуют последовательностям гена parC дикого типа, либо последовательностям мутантных вариантов гена parC, приводящих к аминокислотным заменам S87N, S87R, E91Q, E91G, E91K, Е91А, встречающихся у штаммов N. gonorrhoeae, резистентных к фторхинолонам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 17-20 которых соответствуют последовательностям плазмидного гена blaTEM дикого типа, характерных для штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, либо последовательностям мутантных вариантов гена blaTEM, приводящих к аминокислотным заменам М182Т, G238S, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда и цефалоспоринам;
- группа, состоящая из одного элемента с иммобилизованным олигонуклеотидом, нуклеотидная последовательность SEQ ID NO: 21 которого соответствует последовательности плазмидного гена tetM, продукт которого ответствен за резистентность N. gonorrhoeae к тетрациклинам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 22-24 которых соответствуют последовательностям гена rpsJ дикого типа, либо последовательностям мутантных вариантов гена rpsJ, приводящих к аминокислотным заменам V57M, V57L, встречающихся у штаммов N. gonorrhoeae, резистентных к тетрациклинам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 25, 26 которых соответствуют последовательностям гена 23S рРНК дикого типа, либо последовательностям мутантного варианта гена 23S рРНК, приводящего к нуклеотидной замене A>G в положении 2059, встречающегося у штаммов N. gonorrhoeae, резистентных к макролидам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 27, 28 которых соответствуют последовательностям гена penA дикого типа, либо последовательностям мутантного варианта гена penA, приводящего к инсерции аминокислоты D (аспарагиновая кислота) в положении 345 гена, встречающегося у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 29, 30 которых соответствуют последовательностям гена ponA дикого типа, либо последовательностям мутантного варианта гена ponA, приводящего к аминокислотной замене L421P, встречающейся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 31-34 которых соответствуют последовательностям гена 16S РНК дикого типа, либо последовательностям мутантных вариантов гена 16S РНК, приводящих к нуклеотидным заменам С1192Т, G1064C, встречающихся у штаммов N. gonorrhoeae, резистентных к спектиномицину;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 35-39 которых соответствуют последовательностям гена mtrR дикого типа, либо последовательностям мутантных вариантов промоторной области гена mtrR, приводящих к инсерциям тимидина Т или ТТ в положении 10, или делеции аденина А в положении 35, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, тетрациклинам, макролидам, цефалоспоринам;
- группа, состоящая из одного элемента с иммобилизованным олигонуклеотидом, нуклеотидная последовательность SEQ ID NO: 40 которого соответствует последовательности гена mefA, продукт которого ответственен за резистентность N. gonorrhoeae к макролидам;
- группа элементов с олигонуклеотидами, нуклеотидные последовательности SEQ ID NO: 41-43 которых соответствуют последовательностям гена porB дикого типа, либо последовательностям мутантных вариантов гена porB, приводящих к аминокислотным заменам G120D, G120K, встречающихся у штаммов N. gonorrhoeae, резистентных к антибиотикам пенициллинового ряда, цефалоспоринам, тетрациклинам.
2. Набор олигонуклеотидов, используемых для иммобилизации на биочипе, для идентификации генетических детерминант резистентности Neisseria gonorrhoeae к антимикробным препаратам, включая фторхинолоны, антибиотики пенициллинового ряда, цефалоспорины, тетрациклины, макролиды, спектиномицин, причем олигонуклеотиды имеют последовательности SEQ ID NO: 1-43.
| BALASHOV S | |||
| et al | |||
| "Multiplex bead suspension array for screening Neisseria gonorrhoeae antibiotic resistance genetic determinants in noncultured clinical samples", J | |||
| Mol | |||
| Diagn., 2013, v.15, p.116-129 | |||
| ZHOU WENMING et al | |||
| "Detection of gyrA and parC mutations associated with ciprofloxacin resistance in Neisseria gonorrhoeae by use of oligonucleotide biochip technology", Journal of clinical microbiology, 2004, v.42, no.12, p.5819-5824 | |||
| VERESHCHAGIN V.A | |||
| et al | |||
| "Fluoroquinolone-resistant Neisseria gonorrhoeae isolates from Russia: molecular mechanisms implicated" | |||
| J | |||
| Antimicrob | |||
| Chemother., 2004, v.53, p.653-656 | |||
| UNEMO М | |||
| et al | |||
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Microbiol | |||
| Rev., 2014, v.27, no.3, p.587-613 | |||
| PETERSON S | |||
| W | |||
| et al | |||
| "Molecular Assay for Detection of Genetic Markers Associated with Decreased Susceptibility to Cephalosporins in Neisseria gonorrhoeae", Journal of clinical microbiology, v.53, no.7, p.2042-2048 | |||
| EA 200100394 A1, 28.02.2002 | |||
| Универсальное двухствольное охотничье ружье | 1958 |
|
SU117431A1 |
Авторы
Даты
2017-11-23—Публикация
2016-04-13—Подача