Изобретение относится к биотехнологии, генетической и белковой инженерии, конкретно к получению опухоль-специфических пептидов путем скрининга фаговой пептидной библиотеки на культуре раковых клеток человека.
На сегодняшний день онкологические заболевания являются одной из главных причин смертности как в России, так и за рубежом. По прогнозам ВОЗ смертность от рака будет продолжать расти, и в 2030 году ожидается до 13 миллионов случаев смерти от онкологических заболеваний. Рак молочной железы (РМЖ) является самым распространенным раковым заболеванием среди женщин во всем мире - на него приходится 16% всех случаев заболевания раком среди женщин. Особое внимание уделяют РМЖ с тройным негативным фенотипом («тройной негативный РМЖ») в связи с агрессивным течением и отсутствием привычных для этого заболевания терапевтических мишеней - рецепторов эстрогенов (ER), прогестерона (PgR) и HER2/neu [1].
Многие годы основными способами лечения онкологических заболеваний были хирургия и радиотерапия, направленные на удаление первичной опухоли. При этом главной причиной последующей смертности оставался метастатический рост опухолей. Применение "неспецифических" цитостатических и цитотоксических средств, а также гормонов для подавления роста метастазов существенно расширило возможности и повысило эффективность лечения рака. Однако несмотря на высокую противоопухолевую активность химиотерапевтических средств и их широкое применение при лечении больных метастазирующим раком, такой важный показатель эффективности терапии, как продолжительность жизни пациентов, увеличивается незначительно или вообще не меняется, и главной причиной последующей смертности остается метастатический рост опухолей [2]. Кроме того, высокая общая токсичность большинства используемых цитостатиков значительно ограничивает возможности их применения. В связи с отсутствием экспрессии рецепторов ER, PgR и HER2/neu и в силу этого неэффективностью адресной гормонотерапии и анти-HER2 терапии, основным методом лечения тройного негативного РМЖ остается химиотерапия.
Онкотрансформация здоровых клеток приводит к появлению «молекулярных маркеров», отличающих раковые клетки от нормальных здоровых клеток. К таким «молекулярным маркерам» относятся, например, рецепторы факторов роста и пролиферации клеток и факторы, отвечающие за активацию процессов ангиогенеза. Уровень экспрессии таких маркеров значительно повышен у онкотрансформированных клеток по сравнению со здоровыми клетками организма [3-5].
Эти «молекулярные маркеры» позволяют подобрать короткие пептиды (до 50 аминокислотных остатков), специфически связывающиеся с клетками и сосудами опухолей. Такие опухоль-специфические пептиды обладают высокими коэффициентами проникновения в опухоль (их концентрация внутри опухоли может превышать таковую в других органах и тканях в десятки раз), низкой иммуногенностью, высокой аффинностью к мишени, относительной стабильностью и являются удобными объектами для конъюгирования с другими противоопухолевыми агентами [6].
Создание конъюгатов опухоль-специфических пептидов с противоопухолевыми лекарственными препаратами позволит значительно снизить дозу последних, необходимую для получения терапевтического эффекта, что особенно актуально для препаратов, обладающих высокой общей токсичностью. Конъюгаты опухоль-специфических пептидов с диагностическими препаратами, а именно парамагнетиками, флуоресцентными красителями или радионуклидами, позволяют избирательно накапливать препараты в опухоли в концентрациях, значительно превышающих их концентрацию в других органах, тем самым усиливая сигнал, детектируемый прибором.
Таким образом, опухоль-специфические пептиды обеспечивают «таргетность» (адресную доставку) любому препарату или метке, конъюгированному с ними.
Известен опухоль-специфический пептид для лечения и диагностики аденокарциномы легкого и ее метастазов, отобранный в результате селекции фаговой пептидной библиотеки по признаку избирательного связывания с клетками-мишенями, обладающий способностью накапливаться в клетках аденокарциномы легких, имеющий одну из следующих аминокислотных последовательностей: RNVPPIFNDVYWIAF, SVAILPRSFSPFXVG, PFARAPVEHHDVVGL. Известный опухоль-специфический пептид позволяет осуществлять целенаправленную доставку препаратов различного назначения в клетки аденокарциномы легких [7].
Недостатком известного пептида является то, что он не обладает специфичностью к раковым клеткам молочной железы человека.
Известен опухоль-специфический пептид, специфически взаимодействующий с опухолью молочной железы Эрлиха, имеющий одну из следующих аминокислотных последовательностей: GGSACTGSSFGSVCW, LFSHHDTWSLGARWV, QFIDRPWL, RNVPPIFNDVYWIAF, RNVPPIFNDVYWIAF, RNVPPIFNDVYWIAF, RNVPPIFNDVYWIAF, GRTGPGGPGCPAVRA, EVPRLSLLAASLVAN. Пептид отобран из фаговой пептидной библиотеки путем аффинной селекции, способен специфично накапливаться в опухоли молочной железы Эрлиха, может быть использован в терапии и диагностике злокачественных новообразовавний у онкологических больных [8].
Недостатком известного пептида является то, что он специфичен к раковым клеткам молочной железы мыши. Специфичность данного пептида к раковым клеткам молочной железы человека не исследована.
Наиболее ближайшим к заявляемому пептиду - прототипом - является опухоль-специфический пептид CGWMGLELC, отобранный в результате скрининга (аффинной селекции) семимерной фаговой пептидной библиотеки на раковых клетках линии MDA-MB-231 [9].
Недостатком известного пептида является то, что он, наряду с раковыми клетками молочной железы, также связывается со здоровыми клетками почки человеческого эмбриона линии НЕК293.
Задачей изобретения является поиск новых пептидов, специфичных к клеткам рака молочной железы человека, в том числе тройного негативного фенотипа, способных обеспечивать адресную доставку («таргетность») любому препарату или метке, конъюгированному с ними.
Поставленная задача достигается предлагаемым опухоль-специфическим пептидом, имеющим одну из аминокислотных последовательностей YTYDPWLIFPAN или FIPFDPMSMRWE, полученным путем аффинной селекции фаговой пептидной библиотеки на культуре раковых клеток человека в системе in vitro.
Технический результат: получен новый опухоль-специфический пептид, обладающий свойством избирательно связываться с раковыми клетками молочной железы человека, в том числе с раковыми клетками с трижды негативным фенотипом.
Отбор целевых пептидов осуществляли из фаговой пептидной библиотеки Phage Display Library-12 (Ph.D, New England BioLabs), созданной на основе нитчатого фага M13 и экспонирующей чужеродный пептид (12 аминокислотных остатков) в составе минорного белка оболочки рIII, причем каждая фаговая частица содержит 5 копий одного пептида [10].
Скрининг фаговой пептидной библиотеки in vitro заключается в следующем [11]. Проводят негативный скрининг фаговой пептидной библиотеки на здоровых клетках молочной железы. Негативный скрининг обедняет библиотеку по тем бактериофагам, которые потенциально могут связаться со здоровыми немалигнизированными клетками или с пластиковой подложкой (пластиком пробирки). Обедненную фаговую пептидную библиотеку инкубируют с культурой раковых клеток человека линии MDA-MB-231. Клетки отмывают от несвязавшихся фагов, а связавшиеся фаги амплифицируют в E.coli в жидкой среде. Амплифицированную библиотеку используют для последующих раундов. После третьего и четвертого раундов селекции определяют последовательности экспонированных пептидов индивидуальных фаговых клонов, полученных титрованием на агаризованной среде. Экспонированные пептиды с наибольшими частотами встречаемости сравнивают по степени связываемости с раковыми клетками. В качестве контроля используют бактериофаг дикого типа без экспонированного пептида.
В результате скрининга (аффинной селекции) фаговой пептидной библиотеки на культурах раковых клеток человека в системе in vitro отобраны пептиды, имеющие аминокислотную последовательность YTYDPWLIFPAN и FIPFDPMSMRWE, обладающие специфичностью к раковым клеткам молочной железы человека, в том числе к раковым клеткам тройного негативного фенотипа, которые могут быть использованы для адресной химиотерапии опухолей молочной железы человека.
Изобретение иллюстрируется следующими чертежами:
Фиг. 1. Аминокислотные последовательности пептидов, экспонированных на поверхности бактериофагов и специфичных к раковым клеткам человека.
Фиг. 2. Анализ специфичности индивидуальных фаговых клонов, экспонирующих отобранные пептиды, к раковым клеткам человека.
Фиг. 3. Анализ специфичности индивидуальных фаговых клонов, экспонирующих отобранные пептиды, к раковым клеткам человека методом проточной цитофлуориметрии.
Для лучшего понимания сущности предлагаемого изобретения ниже следуют примеры его осуществления.
Пример 1. Негативный скрининг фаговой пептидной библиотеки на клетках первичной культуры здоровой молочной железы человека.
Клетки молочной железы человека культивировали в среде IMDM (кат. №31980-022, Life technologies, USA) с добавлением 10 мМ L-глутамина, 200 ед/мл пенициллина, 200 мг/мл стрептомицина сульфата, 0,5 мкг/мл амфотерицина в присутствии 10% эмбриональной сыворотки крупного рогатого скота при 37°С в атмосфере 5% СO2.
Клетки первичной культуры молочной железы промывали один раз 4 мл PBS-буфера (137 мМ NaCl, 2.7 мМ КСl, 10 мМ Na2HPO4, 2 мМ КН2РO4) и инкубировали в течение 1 ч при 4°С с 3 мл фаговой пептидной библиотеки (0,3*1011БОЕ/мл), разведенной в PBS-БСА Ca/Mg буфере (0,1% БСА (бычий сывороточный альбумин), 1 мМ СаСl2, 10мМ MgCl2*6H2O). Супернатант, содержащий популяцию не связавшихся с клетками бактериофагов, отбирали, и обедненную фаговую библиотеку амплифицировали согласно рекомендациям производителя библиотеки (New England Biolabs). Полученную фаговую пептидную библиотеку использовали для селекции in vitro на культурах раковых клеток человека.
Пример 2. Скрининг фаговой пептидной библиотеки на культуре раковых клеток человека линии MDA-MB-231.
Клетки MDA-MB-231 культивировали в среде L-15 (кат. №11415-049, Life technologies, USA) с добавлением 100 ед/мл пенициллина, 100 мг/мл стрептомицина сульфата, 0,25 мкг/мл амфотерицина в присутствии 10% эмбриональной сыворотки крупного рогатого скота при 37°С в атмосфере 5% СO2.
Клетки использовали при достижении 70-80% конфлюэнтности в культуральных флаконах с поверхностью роста 25 см2. Клетки промывали два раза 4 мл PBS и инкубировали с 4 мл блокирующего буфера (5% БСА в PBS) в течение 10 мин при 37°С. После блокировки клетки промывали 4 мл PBS и добавляли 3 мл обедненной фаговой пептидной библиотеки (0,3*1011БОЕ/мл), разведенной в PBS-BSA Ca/Mg буфере. Клетки инкубировали с фаговой пептидной библиотекой 1 ч при 4°С. Затем клетки четырежды отмывали 4 мл PBS от несвязавшихся бактериофагов и инкубировали с нагретой до 37°С средой RPMI (кат. №61870-010, Life technologies, USA) без сыворотки в течение 15 мин при 37°С для проведения интернализации рецепторов. После инкубации клетки отмывали: в первом раунде скрининга клетки отмывали четыре раза 4 мл PBS, на последующих раундах клетки отмывали четыре раза 4 мл PBST рН 5,0 (0,2% Tween-20, PBS, рН 5,0), затем четыре раза 4 мл PBST, рН 7,4 (0,2% Tween-20, PBS, рН 7,4) [11]. После отмывок к клеткам добавляли 400 мкл трипсина для удаления неинтернализованных бактериофагов. Через 2-3 мин клетки отмывали четырежды 4 мл PB S и лизировали в 1 мл воды. Полученную суспензию бактериофагов амплифицировали.
После третьего и четвертого раунда селекции фаговые частицы титровали на агаризованной среде LB (10 г триптона, 5 г NaCl, 5 г дрожжевого экстракта) с добавлением 1 мг/мл X-Gal (от англ. bromo-chloro-indolyl-galactopyranoside) и 1,25 мг/мл ИПТГ (изопропил-β-D-1-тиогалактопиранозид) для получения индивидуальных фаговых колоний с целью определения последовательности экспонированной пептидной вставки.
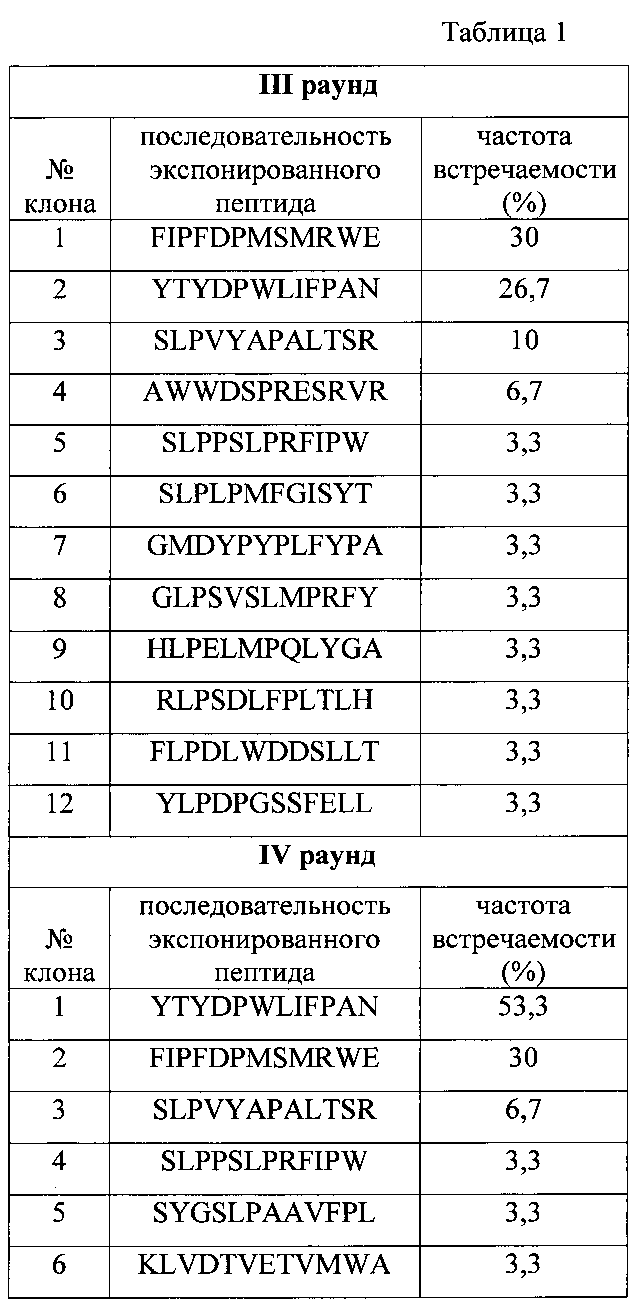
Были определены и проанализированы последовательности 30 клонов бактериофагов, отобранных после третьего раунда, и 30 клонов, отобранных после четвертого раунда на клетки MDA-MB-231. Частота встречаемости экспонированных пептидов после третьего и четвертого раунда аффинной селекции на раковых клетках человека линии MDA-MB-231 представлена в таблице 1.
Пример 3. Получение оцДНК бактериофагов и определение нуклеотидной последовательности вставки, кодирующей чужеродный пептид, экспонированный бактериофагом.
Индивидуальные фаговые колонии, полученные путем титрования на агаризованной LB-среде, использовали для получения оцДНК. Фаговую колонию помещали в 1 мл жидкой культуры E.coli ER2738 в ранней лог-фазе (OD600=0,01-0,05) и инкубировали в шейкер-инкубаторе при 170 об/мин в течение 4,5 ч при 37°С. Для осаждения клеток E.coli полученную суспензию клеток с бактериофагами центрифугировали при 12000 g, 4°С, 5 мин. Супернатант, содержащий фаговые частицы, переносили в новые пробирки. К 500 мкл супернатанта бактериофагов добавляли 200 мкл раствора полиэтиленгликоля (ПЭГ/NaCl: 20% ПЭГ-8000 (вес/объем), 2,5 M NaCl) и инкубировали 10-20 мин при комнатной температуре. Суспензию бактериофагов с ПЭГ/NaCl центрифугировали при 12000 g, 4°С, 5 мин и тщательно удаляли супернатант. Затем к полученному осадку добавляли 100 мкл йодного буфера (4M Nal, 10 мМ Трис-HCl (рН 8,0), 1 мМ ЭДТА) и 250 мкл 96% этилового спирта, перемешивали и инкубировали 10-20 мин при комнатной температуре. Далее проводили центрифугирование при 12000 g, 4°С, 5 мин и тщательно удаляли супернатант. Осадок, образованный оцДНК бактериофагов, промывали 500 мкл предварительно охлажденного 70% этилового спирта, центрифугировали 5 мин при 12000 g, 4°С. Затем осадок промывали 500 мкл предварительно охлажденного 96% этилового спирта, центрифугировали 5 мин при 12000 g, 4°С. Полученный осадок высушивали при 45°С на ротационном испарителе.
Последовательности вставок, кодирующих экспонированные бактериофагом пептиды, определяли секвенированием по методу Сэнгера [12], используя -96III секвенирующий праймер (5`-gccctcatagcgtaacg-3`). Анализ полученных нуклеотидных последовательностей вставок, кодирующих экспонированные пептиды, проводили с помощью компьютерной программы "MEGA 4.0". На основе полученных нуклеотидных последовательностей вставок были выведены аминокислотные последовательности экспонированных пептидов, которые представлены на фиг. 1.
Пример 4. Сравнительной анализ специфичности пептидов, экспонированных бактериофагами, к раковым клеткам человека.
Клетки инкубировали в 24-луночных культуральных планшетах и использовали в эксперименте при достижении 80-90% конфлюэнтности. Клетки промывали два раза 1 мл PBS и инкубировали с 1 мл блокирующего буфера (5% БСА/PBS) в течение 10 мин при 37°С. После блокировки клетки промывали один раз 1 мл PB S и добавляли 350 мкл суспензии индивидуального фагового клона (109 БОЕ/мл), разведенной в PBS-BSA Ca/Mg буфере. Инкубировали 1 ч при 4°С. Клетки четырежды отмывали 1 мл PB S от не связавшихся бактериофагов и инкубировали с нагретой до 37°С средой RPMI без сыворотки в течение 1 ч при 37°С. Далее клетки отмывали четыре раза 1 мл PBST рН 5,0, четыре раза 1 мл PBST рН 7,4 и четыре раза 1 мл PBS, затем лизировали в 500 мкл воды. В полученном лизате определяли титр бактериофагов.
Результаты анализа специфичности индивидуальных фаговых клонов, экспонирующих отобранные пептиды, представлены на фиг. 2, где №0 - бактериофаг дикого типа (не экспонирующий пептиды), №1 - бактериофаг, экспонирующий пептид YTYDPWLIFPAN, №2 - бактериофаг, экспонирующий пептид FIPFDPMSMRWE, символом* отмечены достоверные различия связывания с клетками бактериофагов, экспонирующих отобранные пептиды, по сравнению с бактериофагом дикого типа (без вставки) (р≤0,05, критерий Манна-Уитни).
Полученные данные титрования показывают, что бактериофаги, экспонирующие пептиды YTYDPWLIFPAN и FIPFDPMSMRWE, достоверно связываются с раковыми клетками человека линии MDA-MB-231 по сравнению с бактериофагом дикого типа. Клон бактериофага, экспонирующего пептид YTYDPWLIFPAN, обладает наибольшей специфичностью, его выявленный титр в 174 раза выше, по сравнению с титром бактериофага дикого типа. Кроме того, клон бактериофага, экспонирующего пептид FIPFDPMSMRWE, достоверно связывается с раковыми клетками человека линии MCF-7 по сравнению с бактериофагом дикого типа.
Пример 5. Анализ специфичности связывания бактериофагов, экспонирующих отобранные пептиды, с раковыми клетками человека методом проточной цитофлуориметрии.
Клетки инкубировали в 6-луночных культуральных планшетах и использовали в эксперименте при достижении 80-90% конфлюэнтности. Клетки обрабатывали 10 мМ ЭДТА/PBS в течение 3 мин при 37°С для открепления их от подложки, затем добавляли 1 мл соответствующей для данной линии клеток ростовой среды, ресуспендировали и переносили в новые пробирки. Клетки промывали один раз 1 мл PBS и инкубировали в течение 2 ч при 37°С в 1 мл соответствующей для данной линии клеток ростовой среде. Клетки промывали один раз 1 мл буфера A (PBS, содержащий 1% FCS (от англ. fetal calf serum) и инкубировали 30 мин на льду с 200 мкл суспензии наработанного клона бактериофага (1010 БОЕ/мл). Клетки промывали один раз 1 мл буфера А, затем инкубировали в 200 мкл буфера Б (PBS, содержащий 10% FCS, 2% глицина) в течение 15 мин на льду. Клетки центрифугировали в течение 5 мин, при 900 g, удаляли супернатант, затем клетки инкубировали с мышиными анти-М13 моноклональными антителами, разведенными в буфере А (1:200), в течение 30 мин на льду в объеме 200 мкл. Клетки промывали 1 мл буфера А и инкубировали со вторичными антителами к мышиному иммуноглобулину G (donkey anti-mouse IgG (H+L)), разведенными в буфере А (1:200), в течение 30 мин на льду в объеме 100 мкл. Клетки промывали 1 мл буфера А и ресуспендировали в 500 мкл буфера А для анализа на проточном цитофлуориметре BD FACS Canto II.
Результаты анализа специфичности индивидуальных фаговых клонов, экспонирующих отобранные пептиды, представлены на фиг. 3, где: №0 - бактериофаг дикого типа, №1 - бактериофаг, экспонирующий пептид YTYDPWLIFPAN, №2 - бактериофаг, экспонирующий пептид FIPFDPMSMRWE. Результаты эксперимента подтверждают, что экспонированные пептиды YTYDPWLIFPAN и FIPFDPMSMRWE обладают специфичностью к раковым клеткам человека линии MDA-MB-231.
Таким образом, получен новый опухоль-специфический пептид, имеющий одну из аминокислотных последовательностей, которые приведены на фиг. 1, обладающий свойством избирательно связываться с раковыми клетками молочной железы человека, в том числе с раковыми клетками с трижды негативным фенотипом, и который может быть использован для создания конъюгатов с радиоактивными изотопами и с известными цитотоксическими препаратами, разрешенными для терапии онкологических заболеваний, а также может быть включен в состав липосомальных препаратов для использования как в терапии, так и в диагностике опухолей и их метастазов.
Источники информации
1. Тюляндин С.А., Стенина М.Б., Фролова М.А. Тройной негативный рак молочной железы // Практическая онкология. - 2010. - Т.11. - №4. - С. 247-252.
2. Соухами Р., Тобиас Дж. Рак и его лечение. - М.: Бином, 2009. - 440 с.
3. Wicki Α., Witzigmann D., Balasubramanian V., Huwyler J. Nanomedicine in cancer therapy: Challenges, opportunities, and clinical applications // J Control Release. - 2014. - doi: 10.1016/j.jconrel.2014.12.030.
4. Ruoslahti E. Specialization of tumour vasculature // Nat Rev Cancer. - 2002. - V.2. - N 2. - P. 83-90.
5. Arachchige M.C., Reshetnyak Y.K., Andreev O.A. Advanced targeted nanomedicine // J Biotechnol. - 2015. - doi: 10.1016/j.jbiotec.2015.01.009.
6. Sugahara K.N., Teesalu T., Karmali P.P. Tissue-penetrating delivery of compounds and nanoparticles into tumors // Cancer Cell. - 2009 - V.8. - N 16(6). - P. 510-20.
7. Некрасов Б.Г., Кувшинов В.Н., Ушакова Т.А., Каледин В.И., Николин В.П., Туманова О.Ю., Ильичев А.А., Сандахчиев Л.С. Опухоль-адресованный пептид // Патент RU 2273644 C1, оп. 10.04.2006.
8. Некрасов Б.Г., Кувшинов В.Н., Ушакова Т.А., Каледин В.И., Николин В.П., Туманова О.Ю., Ильичев А.А., Сандахчиев Л.С. Опухоль-адресованный пептид // Патент RU 2265027 C1, оп. 27.11.2005.
9. Rasmussen U.B., Schreiber V., Schultz H., Mischler F., Schughart K. Tumor cell-targeting by phage-displayed peptides // Cancer Gene Ther. - 2002. - V.9(7). - P. 606-12.
10. Hamzeh-Mivehroud M., Alizadeh A.A., Morris M.B., Church W.B., Dastmalchi S. Phage display as a technology delivering on the promise of peptide drug discovery // Drug Discov Today. - 2013. - V. 18. - N 23-24. P. 1144-57.
11. Shadidi M., Sioud M. Identification of novel carrier peptides for the specific delivery of therapeutics into cancer cells // FASEB J. - 2003. - V. 17(2). - P. 256-8.
12. Kretz K., Callen W., Hedden V. Cycle sequencing // Methods of Enzimology. - V.154. - P. 527-536.


Изобретение относится к биотехнологии, генетической и белковой инженерии и касается опухоль-специфического пептида для адресной химиотерапии опухолей молочной железы человека. Представленный пептид отобран с помощью фаговой пептидной библиотеки и имеет одну из следующих аминокислотных последовательностей: YTYDPWLIFPAN (SEQ ID NO 1) или FIPFDPMSMRWE (SEQ ID NO 2). Пептид обладает высокой сцецифичностью к клеткам рака молочной железы человека, в том числе тройного негативного фенотипа. 3 ил., 1 табл., 5 пр.
Опухоль-специфический пептид для адресной химиотерапии опухолей молочной железы человека, имеющий одну из аминокислотных последовательностей YTYDPWLIFPAN (SEQ ID NO 1) или FIPFDPMSMRWE (SEQ ID NO 2), полученный путем аффинной селекции фаговой пептидной библиотеки на культуре раковых клеток человека в системе in vitro.
| ОПУХОЛЬ-АДРЕСОВАННЫЙ ПЕПТИД | 2003 |
|
RU2265027C2 |
| ULLA B RASMUSSEN et al., Tumor cell-targeting by phage-displayed peptides, Cancer Gene Therapy, 2002, Vol.9, pp.606 - 612. | |||
Авторы
Даты
2016-08-27—Публикация
2015-08-04—Подача