ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение, в общем, относится к антителам, специфичным для индуцируемого глюкокортикоидами рецептора TNF (GITR), и их применениям. Более конкретно изобретение относится к гуманизированным антителам, которые узнают GITR человека и модулируют его активность, особенно при иммунных и пролиферативных нарушениях.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Индуцированный глюкокортикоидами TNFR-родственный белок (GITR), представитель надсемейства TNFR, экспрессируется во многих компонентах врожденной и адаптивной иммунной системы (смотри, например, Hanabuchi et al. (2006) Blood 107: 3617-3623; и Nocentim and Riccardi (2005) Eur. J. Immunol. 2005. 35: 1016-1022). Его экспрессия в мембране возрастает после активации T-клеток (Hanabuchi, выше; и Nocentini and Riccardi, выше); ее усиление коактивирует эффекторные T-лимфоциты и модулирует активность регуляторных T-клеток (Treg) (смотри, например, McHugh et al. (2002) Immunity 2002. 16: 311-323; Shimizu et al. (2002) Nat. Immunol. 3: 135-142; Ronchetti et al. (2004) Eur. J. Immunol. 34: 613-622; и Tone et al. (2003) Proc. Natl. Acad. Sci. USA 100: 15059-15064.
GITR активируется лигандом GITR (GITRL), который экспрессируется, главным образом, на АПК и, как предполагалось, доставляет сигналы благодаря своему цитоплазматическому домену, хотя необходимы дополнительные исследования для определения передачи биохимических сигналов (Nocentini, выше; Ronchetti, выше; Suvas et al. (2005) J. Virol. 79: 11935-11942; и Shin et al. (2002) Cytokine 19: 187-192).
Активация GITR повышает устойчивость к опухолям и вирусным инфекциям, вовлечена в аутоиммунные/воспалительные процессы и регулирует просачивание лейкоцитов (Nocentini, выше; Cuzzocrea et al. (2004) J. Leukoc. Biol. 76: 933-940; Shevach et al. (2006) Nat. Rev. Immunol. 6: 613-618; Cuzzocrea et al. (2006) J. Immunol. 177: 631-641; и Cuzzocrea et al. (2007) FASEB J. 21: 117-129).
Существует потребность в улучшенных способах и композициях для лечения иммунных и пролиферативных нарушений, например, опухолей и злокачественных опухолей с использованием средств, которые модулируют активность GITR. Предпочтительно такие агонисты обладают высокой аффинностью по отношению к молекуле-мишени и способны стимулировать передачу сигнала GITR в относительно низких дозах. Предпочтительно, такие способы и композиции являются высокоспецифичными для GITR и не мешают активности других рецепторов. Предпочтительно, в таких способах и композициях применяют агонисты, подходящие для модификации доставки цитотоксических нагрузок к клеткам-мишеням, но также подходящие для нетоксических применений. Предпочтительно, в таких способах и композициях применяют антитела, модифицированные с целью ограничения их антигенности при введении субъекту, нуждающемуся в таком введении.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 показано синергетическое влияние комбинированного лечения с использованием DTA-1 (специфичного для mGITR; смотри, например, Shimizu et al. (2002) Nature Immunol. 3: 135-142) и местного облучения. «CR» означает полную регрессию.
На фигуре 2 показаны модули GITR, которые определены способом, описанным в публикации Naismith and Sprang (1998) Trends Biochem. Sci. 23: 74-79. Изображенными жирным шрифтом остатками указан конформационный DTA-1-подобный эпитоп, который определен ниже.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение отвечает указанным и другим потребности в данной области благодаря получению агонистов GITR, например, гуманизированных анти-GITR-антител.
В одном аспекте изобретение относится к связывающим соединениям, таким как антитела или их фрагменты, включая гуманизированные или химерные рекомбинантные антитела, которые связывают GITR человека, содержащие вариабельный домен легкой цепи антитела или его антигенсвязывающий фрагмент, имеющий по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из последовательностей SEQ ID NO: 56-88, и вариабельный домен тяжелой цепи, имеющий по меньшей мере одну или несколько CDR, выбранных из группы, состоящей из последовательностей SEQ ID NO: 23-55.
В других вариантах осуществления связывающее соединение согласно настоящему изобретению содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи или их антигенсвязывающие фрагменты, описанные в предшествующих двух абзацах.
В некоторых вариантах осуществления связывающее соединение содержит каркасную область, при этом аминокислотная последовательность каркасной области вся или по существу вся состоит из аминокислотной последовательности иммуноглобулина человека.
В некоторых вариантах осуществления вариабельный домен легкой цепи содержит последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 12-22 или их вариантов. В некоторых вариантах вариабельный домен тяжелой цепи содержит последовательность, выбранную из группы, состоящей из последовательностей SEQ ID NO: 1-11. В следующем варианте связывающее соединение содержит вариабельный домен легкой цепи и вариабельный домен тяжелой цепи или их антигенсвязывающие фрагменты, описанные в данном абзаце.
В других вариантах осуществления связывающее соединение согласно настоящему изобретению содержит вариабельный домен легкой цепи или его антигенсвязывающий фрагмент, по существу состоящий из последовательности, выбранной из группы, состоящей из SEQ ID NO: 91, 93, 95, 97, 99, 101, 103, 105, 107, 109, 111, и/или вариабельный домен тяжелой цепи или его антигенсвязывающий фрагмент, по существу состоящий из последовательности, выбранной из группы, состоящей из SEQ ID NO: 90, 92, 94, 96, 98, 100, 102, 104, 106, 108, 110.
В одном варианте осуществления изобретение относится к антителам, которые способны блокировать связывание связывающего соединения согласно настоящему изобретению с GITR человека в анализе перекрестного блокирования. В различных вариантах антитело способно блокировать связывание GITR человека с антителом, содержащим последовательности CDR антител 36E5, 3D6, 61G6, 6H6, 61F6, 1D8, 17F10, 35D8, 49A1, 9E5 или 31H6, которые описаны в настоящей публикации. В другом варианте изобретение относится к связывающим соединениям, которые способны блокировать GITR-опосредованную активность, такие активности включают без ограничения костимуляцию наивных T-клеток CD4+ в анализе пролиферации.
В некоторых вариантах осуществления связывающее соединение согласно настоящему изобретению дополнительно содержит константную область тяжелой цепи, при этом константная область тяжелой цепи содержит константную область тяжелой цепи γ1, γ2, γ3 или γ4 человека или ее вариант. В различных вариантах константная область легкой цепи содержит константную область легкой цепи лямбда или каппа человека.
В различных вариантах осуществления связывающие соединения согласно настоящему изобретению являются поликлональными, моноклональными, химерными, гуманизированными или полностью человеческими антителами или их фрагментами. Настоящее изобретение также предполагает, что антигенсвязывающим фрагментом является фрагмент антитела, выбранный из группы, состоящей из Fab, Fab', Fab'-SH, Fv, scFv, F(ab')2 и диантитела.
Настоящее изобретение охватывает способ усиления иммунного ответа у человека, включающий введение субъекту, нуждающемуся в этом, антитела (или его антигенсвязывающего фрагмента), специфичного для GITR, в количестве, эффективном для стимуляции передачи сигнала GITR. В некоторых вариантах осуществления антитело, специфичное для GITR, является гуманизированным или химерным антителом. В следующих вариантах осуществления иммунный ответ представляет собой противоинфекционный или противовирусный ответ. В некоторых вариантах осуществления GITR-антитело или его антигенсвязывающий фрагмент применяют совместно с TGFβ-антителом или местным облучением.
Настоящее изобретение относится к изолированной нуклеиновой кислоте, кодирующей полипептидную последовательность варианта связывающего соединения в виде антитела согласно настоящему изобретению. Нуклеиновая кислота может находиться в экспрессирующем векторе, функционально связанном с регуляторными последовательностями, узнаваемыми клеткой-хозяином, трансфицированной вектором. Также предлагается клетка-хозяин, содержащая вектор, и способ получения полипептида, включающий культивирование клетки-хозяина в условиях, в которых экспрессируется последовательность нуклеиновой кислоты, с получением таким образом полипептида, и извлечение полипептида из клетки-хозяина или среды.
Настоящее изобретение относится к антителу или его антигенсвязывающему фрагменту, полученному с использованием гидридомы, депонированной в Американской коллекции типовых культур (ATCC), при этом гибридома выбрана из группы, состоящей из PTA-9889, PTA-9890, PTA-9891, PTA-9892, PTA-9893, PTA-10286, PTA-10287, PTA-10288, PTA-10289, PTA-10290 и PTA- 10291.
Настоящее изобретение относится к антителу или антигенсвязывающему фрагменту, который связывается с белком GITR человека, при этом антитело или антигенсвязывающий фрагмент узнает эпитоп, охватывающий модуль 3 и модуль 4 белка GITR человека (SEQ ID NO: 89). В некоторых вариантах осуществления эпитоп содержит Gly57, Arg65, His67, Lys80, Phe81, Ser82 и Gln86. В других вариантах осуществления антитело перекрестно блокирует по меньшей мере одно из антител или фрагментов антител, полученных с использованием гибридом, выбранных из группы, состоящей из PTA-9889, PTA-9890, PTA-9891, PTA-9892, PTA-9893, PTA-10286, PTA-10287, PTA-10288, PTA-10289, PTA-10290 и PTA-10291.
ПОДРОБНОЕ ОПИСАНИЕ
При использовании в настоящем описании, включая прилагаемую формулу изобретения, формы слов единственного числа включают соответствующие им значения множественного числа, если контекст ясно не диктует иное. В таблице 15, ниже, приведен список идентификационных номеров последовательностей, используемых в настоящей заявке. Все публикации, цитированные в настоящем описании, включены путем ссылки в такой же степени, как в случае, когда специально и по отдельности указано, что каждая отдельная публикация, доступ в базу данных (например, доступы в базы последовательностей Genbank или GeneID), заявка на выдачу патента или патент включены путем ссылки. Цитирование публикаций в настоящем описании не предназначено в качестве признания того, что любая из указанных выше публикаций представляет предшествующий уровень техники, а также признания в таком качестве содержания или данных, приведенных в таких публикациях или документах.
I. Определения
Термины «GITR», «индуцируемый глюкокортикоидами TNFR-родственный белок», «индуцируемый при активации рецептор семейства TNFR», «AITR», «представитель 18 надсемейства рецепторов фактора некроза опухолей» и «TNFSF18» хорошо известны в данной области. Нуклеотидные и полипептидные последовательности GITR человека и мыши описаны в WO 98/06842. Также доступны депозиты в GenBank® аминокислотной последовательности GITR человека (Q9Y5U5) и нуклеотидной и аминокислотной последовательностей GITR мыши (AF109216).
Термин «пролиферативная активность» включает активность, которая стимулирует, которая необходима или которая специфично ассоциирована, например, с нормальным делением клеток, а также со злокачественными опухолями, опухолями, дисплазией, трансформацией клеток, метастазами и ангиогенезом.
«Введение» и «лечение» в применении к животному, человеку, объекту эксперимента, клетке, ткани, органу или биологической жидкости относится к контакту с экзогенным фармацевтическим, терапевтическим, диагностическим средством или композицией животного, человека, субъекта, клетки, ткани, органа или биологической жидкости. «Введение» и «лечение» («обработка») может относиться, например, к терапевтическим, фармакокинетическим, диагностическим, исследовательским и экспериментальным способам. Обработка клетки включает контакт реагента с клеткой, а также контакт реагента с жидкостью, когда жидкость находится в контакте с клеткой. «Введение» и «лечение» также означает обработки in vitro и ex vivo, например, клетки, реагентом, диагностическим средством, связывающей композицией или другой клеткой. Термин «лечение», который применяют по отношению к человеку, объекту ветеринарии или исследования, относится к терапевтическому лечению, профилактическим или превентивным мерам, к исследовательским и диагностическим применениям. Термин «лечение» в применении к человеку, объекту ветеринарии или исследования или к клетке, ткани или органу охватывает контакт животного, клетки, ткани, физиологического отдела или физиологической жидкости со средством. «Обработка клетки» также охватывает ситуации, когда средство контактирует с GITR, например, в жидкой фазе или коллоидной фазе, а также ситуации, когда агонист или антагонист не контактирует с клеткой или рецептором.
При использовании в настоящем описании термин «антитело» относится к любой форме антитела, которая проявляет требуемую биологическую активность. Таким образом, термин используют в наиболее широком смысле, и он, как правило, охватывает моноклональные антитела (включая полноразмерные моноклональные антитела), поликлональные антитела, полиспецифичные антитела (например, биспецифичные антитела), химерные антитела, гуманизированные антитела, полностью человеческие антитела и т.д., при условии, что они проявляют требуемую биологическую активность.
При использовании в настоящем описании термины «GITR-связывающий фрагмент», «его связывающий фрагмент» или «его антигенсвязывающий фрагмент» охватывают фрагмент или производное антитела, которые в значительной степени сохраняют свою биологическую активность в индукции передачи сигнала GITR, называемую в настоящем описании «GITR-индуцирующей активностью». Термин «фрагмент антитела» или GITR-связывающий фрагмент относится к части полноразмерного антитела, обычно его антигенсвязывающей или вариабельной части. Примеры фрагментов антител включают Fab, Fab', F(ab')2 и Fv-фрагменты; диантитела; линейные антитела; одноцепочечные молекулы антител, например, sc-Fv; и полиспецифичные антитела, образованные из фрагментов антител. Обычно связывающий фрагмент или производное сохраняет по меньшей мере 10% от активности агониста GITR. Предпочтительно связывающий фрагмент или производное сохраняет по меньшей мере 25%, 50%, 60%, 70%, 80%, 90%, 95%, 99% или 100% (или больше) активности агониста GITR, хотя может быть применим любой связывающий фрагмент с аффинностью, достаточной для проявления требуемого биологического эффекта. Также предполагается, что GITR-связывающий фрагмент может включать варианты, имеющие консервативные аминокислотные замены, которые по существу не меняют его биологическую активность.
Термин «моноклональное антитело» при использовании в настоящем описании относится к антителу, полученному из популяции по существу гомогенных антител, т.е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в минорных количествах. Моноклональные антитела являются высокоспецифичными, будучи направленными против одного антигенного эпитопа. Напротив, обычные препараты (поликлональных) антител обычно содержат множество антител, направленных против (или специфичных для) разных эпитопов. Определение «моноклональное» указывает на природу антитела, как антитела, полученного по существу из гомогенной популяции антител, и его не следует рассматривать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, применяемые согласно настоящему изобретению, могут быть получены способом на основе гибридом, впервые описанным Kohler с соавторами ((1975) Nature 256: 495) или могут быть получены способами на основе рекомбинантной ДНК (смотри, например, патент США № 4816567). «Моноклональные антитела» также могут быть выделены из фаговых библиотек антител с использованием способов, описанных, например, Clackson с соавторами (1991) (Nature 352: 624-628) и Marks с соавторами (1991) (J. Mol. Biol. 222: 581-597).
Моноклональные антитела согласно изобретению, в частности, включают «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных от конкретного вида или относящихся к конкретному классу или подклассу антител, при этом остальная часть цепи (цепей) идентична или гомологична соответствующим последовательностям в антителах, полученных от другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность (патент США № 4816567; Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81: 6851-6855).
«Доменное антитело» представляет собой иммунологически функциональный фрагмент иммуноглобулина, содержащий только вариабельную область тяжелой цепи или вариабельную область легкой цепи. В некоторых случаях две или больше области VH ковалентно связаны пептидным линкером с образованием бивалентного доменного антитела. Две области VH бивалентного доменного антитела могут быть нацелены на одни и те же или разные антигены.
«Бивалентное антитело» содержит два антигенсвязывающих участка. В некоторых случаях два связывающих участка имеют одинаковые антигенные специфичности. Однако бивалентные антитела могут быть биспецифичными (смотри ниже).
При использовании в настоящем описании термин «одноцепочечное Fv» или «scFv» антитело относится к фрагментам антител, содержащим домены VH и VL антитела, при этом указанные домены присутствуют в одной полипептидной цепи. В общем, полипептид Fv дополнительно содержит полипептидный линкер между доменами VH и VL, который позволяет scFv образовывать требуемую структуру для связывания антигена. Обзор scFv смотри в Pluckthun (1994), Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315.
Моноклональные антитела в настоящем описании также включают камелизированные однодоменные антитела. Смотри, например, Muyldermans et al. (2001) Trends Biochem. Sci. 26: 230; Reichmann et al. (1999) J. Immunol. Methods 231: 25; WO 94/04678; WO 94/25591; патент США № 6005079. В одном варианте осуществления настоящее изобретение относится к однодоменным антителам, содержащим два домена VH с модификациями, так что образуются однодоменные антитела.
При использовании в настоящем описании термин «диантитела» относится к небольшим фрагментам антител с двумя антигенсвязывающими участками, и такие фрагменты содержат вариабельный домен тяжелой цепи (VH), связанный с вариабельным доменом легкой цепи (VL) в одной и той же полипептидной цепи (VH-VL или VL-VH). При использовании линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной и той же цепи, домены вынуждены образовывать пару с комплементарными доменами другой цепи и создавать два антигенсвязывающих участка. Диантитела более полно описаны, например, в EP 404097; WO 93/11161; и Hollinger et al., (1993) Proc. Natl. Acad. Sci. USA, 90: 6444-6448. Обзор сконструированных вариантов антител, в общем, приведен в Holliger and Hudson (2005) Nat. Biotechnol. 23: 1126-1136.
При использовании в настоящем описании термин «гуманизированное антитело» относится к формам антител, которые содержат последовательности антител животных, отличных от человека (например, мыши), а также антител человека. Такие антитела содержат минимальную последовательность, полученную из иммуноглобулина животного, отличного от человека. В общем, гуманизированное антитело будет содержать в основном целиком по меньшей мере один и обычно два вариабельных домена, в которых все или по существу все гипервариабельные петли соответствуют петлям иммуноглобулина животного, отличного от человека, и все или по существу все области FR являются областями FR из последовательности иммуноглобулина человека. Гуманизированное антитело необязательно также будет содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Приставку «hum», «hu» или «h» добавляют к обозначению клона антитела, когда необходимо отличить гуманизированные антитела от исходных антител грызунов. Гуманизированные формы антител грызунов обычно будут содержать те же самые последовательности CDR исходных антител грызунов, хотя могут быть введены некоторые аминокислотные замены, чтобы повысить аффинность, повысить стабильность гуманизированного антитела или по другим причинам.
Антитела согласно настоящему изобретению также включают антитела с модифицированными (или блокированными) областями Fc, чтобы обеспечить измененные эффекторные функции. Смотри, например, патент США №№ 5624821, WO2003/086310, WO2005/120571, WO2006/0057702, Presta (2006) Adv. Drug Delivery Rev. 58: 640-656. Такая модификация может быть использована для усиления или подавления различных реакций иммунной системы с возможными полезными эффектами для диагностики и терапии. Изменения Fc-области включают изменения аминокислот (замены, делеции и инсерции), гликозилирование или дегликозилирование и добавление нескольких Fc. Изменения Fc также могут изменять время полужизни антител в случае терапевтических антител, и более длительное время полужизни может обеспечивать менее частое введение доз с сопутствующим более удобным применением и использованием меньшего количества материала. Смотри Presta (2005) J. Allergy Clin. Immunol. 116: 731, 734-35.
Антитела согласно настоящему изобретению также включают антитела с интактными областями Fc, которые обеспечивают полные эффекторные функции, например, антитела изотипа IgG1, которые индуцируют зависимую от комплемента цитотоксичность (CDC) или зависимую от антител клеточную цитотоксичность (ADCC) в клетках-мишенях.
Антитела согласно настоящему изобретению также включают антитела, конъюгированные с цитотоксической нагрузкой, такой как цитотоксические средства или радионуклиды. Такие конъюгаты антител можно использовать в иммунотерапии в сочетании с анти-GITR-обработкой, чтобы избирательно направить к цели и убить клетки, экспрессирующие определенные антигены на своей поверхности. Примеры цитотоксических средств включают рицин, алкалоид барвинка, метотрексат, экзотоксин Psuedomonas, сапонин, дифтерийный токсин, цисплатин, доксорубицин, токсин абрин, гелонин и антивирусный белок лаконоса. Примерами радионуклидов для применения в иммунотерапии с использованием антител согласно настоящему изобретению являются 125I, 131I, 90Y, 67Cu, 211At, 177Lu, 143Pr и 213Bi. Смотри, например, публикацию заявки на выдачу патента № 2006/0014225.
Термин «полностью человеческое антитело» относится к антителу, которое содержит только последовательности белка иммуноглобулина человека. Полностью человеческое антитело может содержать мышиные углеводные цепи, если они продуцируются в организме мыши, в мышиной клетке или в гибридоме, полученной из мышиной клетки. Подобным образом, термины «мышиное антитело» или «антитело крысы» относятся к антителу, которое содержит только последовательности иммуноглобулина мыши или крысы, соответственно. Полностью человеческое антитело может быть образовано в организме человека, в трансгенном животном, имеющем последовательности зародышевой линии иммуноглобулина человека, с помощью фагового дисплея или других молекулярно-биологических способов.
При использовании в настоящем описании термин «гипервариабельная область» относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность» или «CDR» (например, остатки 24-34 (CDRL1), 50-56 (CDRL2) и 89-97 (CDRL3) в вариабельном домене легкой цепи и остатки 31-35 (CDRH1), 50-65 (CDRH2) и 95-102 (CDRH3) в вариабельном домене тяжелой цепи (Kabat et al.(1991) Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md.)) и/или остатки из «гипервариабельной петли» (например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (H1), 53-55 (H2) и 96-101 (H3) в вариабельном домене тяжелой цепи (Chothia and Lesk (1987) J. Mol. Biol. 196: 901-917)). При использовании в настоящем описании остатки «каркаса» или «FR» представляют собой другие остатки вариабельного домена, отличные от остатков гипервариабельной области, которые определены в данном описании как остатки CDR. Нумерация остатков, указанная выше, относится к системе нумерации по Кабату и необязательно должна в точности соответствовать нумерации последовательностей, приведенных в прилагаемом списке последовательностей.
«Связывающее соединение» относится к молекуле, малой молекуле, макромолекуле, полипептиду, антителу или его фрагменту или аналогу или растворимому рецептору, способному связываться с мишенью. «Связывающее соединение» также может относиться к комплексу молекул, например, нековалентному комплексу, к ионизированной молекуле и к ковалентно или нековалентно модифицированной молекуле, например, модифицированной фосфорилированием, ацилированием, поперечным связыванием, циклизацией или ограниченным расщеплением, которая способна связываться с мишенью. При использовании в отношении антител термин «связывающее соединение» относится как к антителам, так и их антигенсвязывающим фрагментам. «Связывание» относится к ассоциации связывающей композиции с мишенью, при этом ассоциация приводит к уменьшению нормального броуновского движения связывающей композиции в случаях, когда связывающая композиция может быть растворена или суспендирована в растворе. «Связывающая композиция» относится к молекуле, например, связывающему соединению, в сочетании со стабилизатором, эксципиентом, солью, буфером, растворителем или добавкой, способной к связыванию с мишенью.
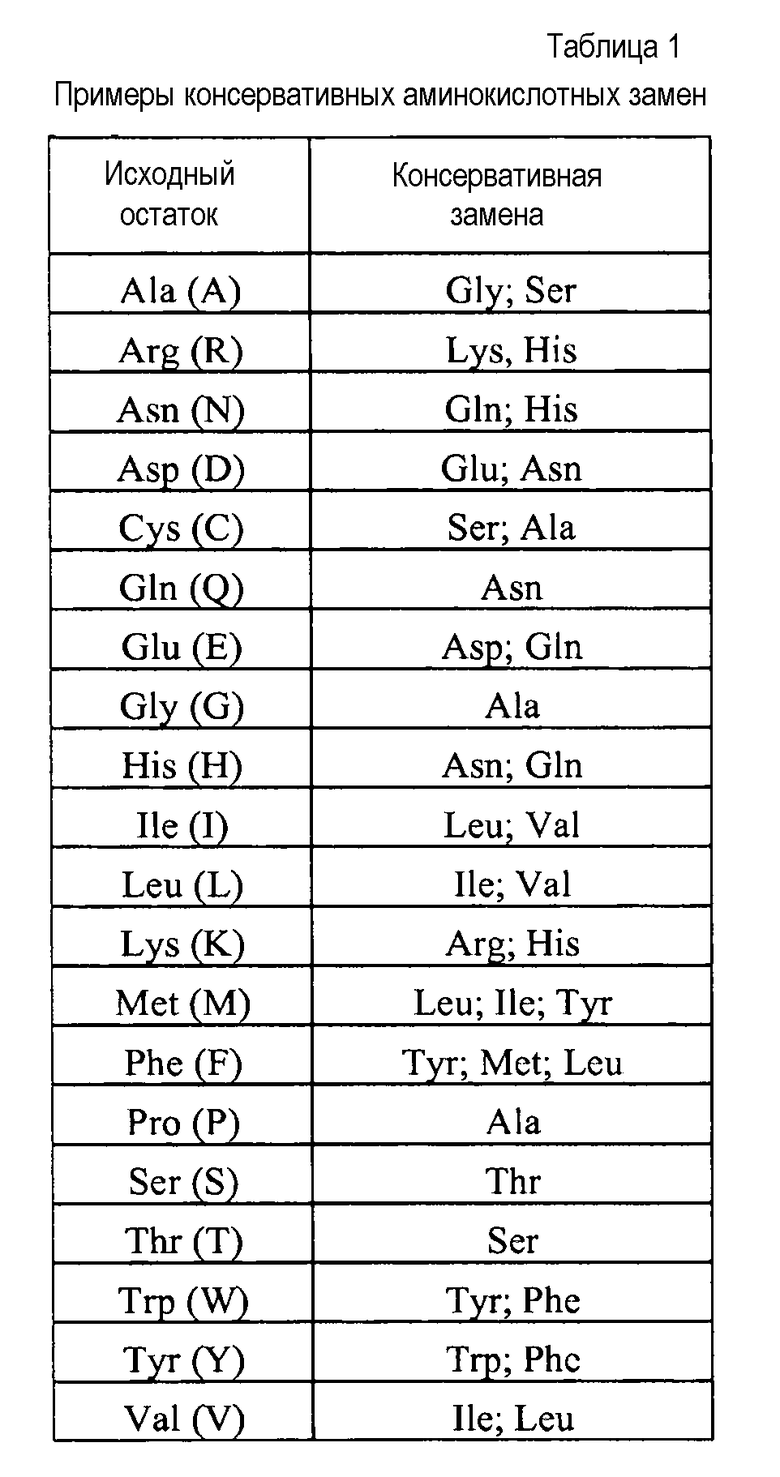
Термины «консервативно модифицированные варианты» или «консервативная замена» относятся к заменам аминокислот, известным специалистам в данной области, и часто могут быть осуществлены даже в важных областях полипептида без изменения биологической активности полученной в результате молекулы. Такие примерные замены предпочтительно осуществляют в соответствии с заменами, указанными в приведенной ниже таблице 1:
Специалистам в данной области понятно, что, в общем, одиночные аминокислотные замены в несущественных областях полипептида могут незначительно изменять биологическую активность. Смотри, например, Watson et al. (1987) Molecular Biology of the Gene, The Benjamin/Cummings Pub. Co., p. 224 (4th Edition).
Фраза «по существу состоит из» или варианты, такие как «по существу состоят из» или «по существу состоящий из», которые использованы на протяжении описания и формулы изобретения, указывают на включение любого из перечисленных элементов или группы элементов и необязательно включение других элементов, сходных или отличающихся по своей природе от перечисленных элементов, которые фактически не изменяют основные или новые свойства указанной схемы дозирования, способа или композиции. В качестве неограничивающего примера связывающее соединение, которое по существу состоит из указанной аминокислотной последовательности, также может содержать одну или несколько аминокислот, включая замены одного или нескольких аминокислотных остатков, которые фактически не влияют на свойства связывающего соединения.
«Эффективное количество» охватывает количество, достаточное для ослабления или предотвращения симптома или признака патологического состояния. Эффективное количество также означает количество, достаточное для обеспечения возможности или облегчения диагностики. Эффективное количество для конкретного пациента или объекта ветеринарии может варьировать в зависимости от таких факторов, как состояние, подвергаемое лечению, общее состояние здоровья пациента, способ, путь и доза введения и тяжесть побочных эффектов. Смотри, например, патент США № 5888530. Эффективное количество может соответствовать максимальной дозе или протоколу дозирования, которые позволяют избегать значимых побочных эффектов или токсических эффектов. Эффект будет приводить к улучшению диагностического показателя или параметра по меньшей мере на 5%, обычно по меньшей мере на 10%, более обычно по меньшей мере на 20%, чаще всего по меньшей мере на 30%, предпочтительно по меньшей мере на 40%, более предпочтительно по меньшей мере на 50%, наиболее предпочтительно по меньшей мере на 60%, в оптимальном варианте по меньшей мере на 70%, более оптимально по меньшей мере на 80% и наиболее оптимально по меньшей мере на 90%, при этом 100% определяют в качестве диагностического параметра, наблюдаемого у здорового субъекта. Смотри, например, Maynard et al. (1996) A Handbook of SOPs or Good Clinical Practice, Interpharm Press, Boca Raton, FL; Dent (2001) Good Laboratory and Good Clinical Practice, Urch Publ., London, UK.
«Связанное с иммунной системой состояние» или «иммунное нарушение» охватывает, например, патологическое воспаление, воспалительное нарушение и аутоиммунное нарушение или заболевание. «Связанное с иммунной системой состояние» также относится к инфекциям, хроническим инфекциям и пролиферативным состояниям, таким как злокачественная опухоль, опухоли и ангиогенез, включая инфекции, опухоли и злокачественные опухоли, которые резистентны к подавлению иммунной системой. «Злокачественное состояние» включает, например, рак, злокачественные клетки, опухоли, ангиогенез и предзлокачественные состояния, такие как дисплазия.
Термин «иммунное заболевание» означает заболевание, при котором компонент иммунной системы млекопитающего вызывает, опосредует или иным образом вносит вклад в заболеваемость млекопитающих. Термин также включает заболевания, при которых стимуляция или препятствование иммунному ответу оказывает ослабляющее влияние на прогрессирование заболевания. В данный термин включены аутоиммунные заболевания, опосредованные иммунной системой воспалительные заболевания, не опосредованные иммунной системой воспалительные заболевания, инфекционные болезни и иммунодефицитные заболевания. Примеры иммунных и воспалительных заболеваний, некоторые из которых опосредованы иммунной системой или T-клетками, которые можно лечить согласно изобретению, включают системную красную волчанку, ревматоидный артрит, ювенильный хронический артрит, спондилоартропатии, системный склероз (склеродермию), идиопатические воспалительные миопатии (дерматомиозит, полимиозит), синдром Шегрена, системный васкулит, саркоидоз, аутоиммунную гемолитическую анемию (иммунную панцитопению, пароксизмальную ночную гемоглобинурию), аутоиммунную тромбоцитопению (идиопатическую тромбоцитопеническую пурпуру, опосредованную иммунной системой тромбоцитопению), тиреоидит (диффузный токсический зоб, тиреоидит Хашимото, ювенильный лимфоцитарный тиреоидит, атрофический тиреоидит), сахарный диабет, опосредованное иммунной системой заболевание почек (гломерулонефрит, тубулярно-интерстициальный нефрит), демиелинизирующие заболевания центральной и периферической нервной системы, такие как рассеянный склероз, идиопатическая димиелинизирующая полинейропатия или синдром Гийена-Барре и хроническая воспалительная демиелинизирующая полинейропатия, гепатобилиарные заболевания, такие как инфекционный гепатит (гепатит A, B, C, D, E и другие негепатотропные вирусы), аутоиммунный хронический активный гепатит, первичный билиарный цирроз, гранулематозный гепатит и склерозирующий холангит, воспалительное и фиброзные заболевания легких, воспалительное заболевание кишечника (язвенный колит, болезнь Крона), глутен-чувствительную энтеропатию и болезнь Уиппла, аутоиммунные или опосредованные иммунной системой заболевании кожи, включая буллезные заболевания кожи, экссудативную многоформную эритему и контактный дерматит, псориаз, аллергические болезни, такие как астма, аллергический ринит, атопический дерматит, гиперчувствительность к пищевым продуктам и крапивница, иммунологические заболевания легких, такие как эозинофильная пневмония, идиопатический легочный фиброз и гиперчувствительный пневмонит, заболевания, связанные с трансплантацией, включая отторжение трансплантата и болезнь трансплантат против хозяина. Инфекционные болезни включают СПИД (ВИЧ-инфекцию), гепатит A, B, C, D и E, бактериальные инфекции, грибковые инфекции, протозойные инфекции и паразитарные инфекции.
Термины «злокачественная опухоль», «опухоль» и «злокачественный» относятся или описывают физиологическое состояние у млекопитающих, которое обычно характеризуется нерегулируемым клеточным ростом. Примеры злокачественной опухоли включают без ограничения карциному, включая аденокарциному, лимфому, бластому, меланому, саркому и лейкоз. Более конкретные примеры таких злокачественных опухолей включают плоскоклеточный рак, мелкоклеточный рак легкого, немелкоклеточный рак легкого, рак желудочно-кишечного тракта, лимфому Ходжкина и неходжкинскую лимфому, рак поджелудочной железы, глиобластому, глиому, рак шейки матки, рак яичника, рак печени, такой как карцинома печени и гепатома, рак мочевого пузыря, рак молочной железы, рак ободочной кишки, рак ободочной и прямой кишки, эндометриальную карциному, миелому (такую как множественная миелома), карциному слюнных желез, рак почек, такой как почечноклеточная карцинома и опухоли Вильмса, карциному базальных клеток, меланому, рак простаты, рак вульвы, рак щитовидной железы, рак семенников, рак пищевода и различные типы рака головы и шеи.
По мере того, как злокачественные клетки растут и размножаются, они образуют массу злокачественной ткани, которая представляет собой опухоль, которая внедряется и нарушает нормальные близлежащие ткани. Злокачественные новообразования представляют собой злокачественную опухоль. Злокачественные опухоли обычно можно удалить, но они могут вырасти вновь. Клетки из злокачественных опухолей могут проникать и повреждать близлежащие ткани и органы. Также злокачественные клетки могут отрываться от злокачественной опухоли и поступать в кровоток или лимфатическую систему, и таким путем злокачественные клетки распространяются от первичной опухоли (т.е. исходной злокачественной опухоли), образуя новые опухоли в других органах. Распространение злокачественной опухоли в организме называют метастазированием (What You Need to Know About Cancer - an Overview, NIH Publication No. 00-1566; posted Sept. 26, 2000, updated Sept. 16, 2002 (2002)).
При использовании в настоящем описании термин «солидная опухоль» относится к аномальному росту или аномальной массе ткани, которая обычно не содержит пузырей или областей, заполненных жидкостью. Солидные опухоли могут быть доброкачественными (незлокачественными) или злокачественными. Разные типы солидных опухолей называют по типу клеток, которые их образуют. Примерами солидных опухолей являются саркомы, карциномы и лимфомы. Лейкозы (рак крови) обычно не образуют солидных опухолей (National Cancer Institute, Dictionary of Cancer Terms).
При использовании в настоящем описании термин «первичная злокачественная опухоль» относится к исходной опухоли или первой опухоли. Злокачественная опухоль может возникать в любом органе или ткани организма. Ее обычно называют по части тела или по типу клеток, в которых она возникает (Metastatic Cancer: Questions and Answers, Cancer Facts 6.20, National Cancer Institute, reviewed Sept. 1, 2004 (2004)).
При использовании в настоящем описании термин «карцинома in situ» относится к злокачественным клеткам, которые еще находятся в ткани, в которой начали расти и еще не стали инвазивными или не распространились на другие части тела.
При использовании в настоящем описании термин «карциномы» относится к злокачественным опухолям эпителиальных клеток, которые представляют собой клетки, которые покрывают поверхность тела, продуцируют гормоны и образуют гланды. Примерами карцином являются злокачественные опухоли кожи, легкого, ободочной кишки, желудка, молочной железы, простаты и тиреоидной железы.
При использовании в настоящем описании термин «изолированная молекула нуклеиновой кислоты» относится к молекуле нуклеиновой кислоты, которую идентифицируют и отделяют по меньшей мере от одной примесной молекулы нуклеиновой кислоты, с которой она обычно ассоциирована в природном источнике нуклеиновой кислоты. Изолированная молекула нуклеиновой кислоты имеет другую форму или окружение, отличные от той формы и окружения, в которых она встречается в природе. Поэтому изолированные молекулы нуклеиновой кислоты отличаются от молекулы нуклеиновой кислоты, в виде которой она существует в природных клетках. Однако изолированная молекула нуклеиновой кислоты включает молекулы нуклеиновой кислоты, которые содержатся в клетках, которые обычно экспрессируют антитело, при этом молекула нуклеиновой кислоты находится, например, в положении хромосомы, отличном от положения в хромосоме природных клеток.
Выражение «регуляторные последовательности» относится к последовательностям ДНК, вовлеченным в экспрессию функционально связанной кодирующей последовательности в организме конкретного хозяина. Регуляторные последовательности, которые подходят для прокариот, например, включают промотор, необязательно последовательность оператора и участок связывания рибосомы. Эукариотические клетки, как известно, используют промоторы, сигналы полиаденилирования и энхансеры.
Нуклеиновая кислота является «функционально связанной», когда она размещена в функциональной взаимосвязи с другой последовательностью нуклеиновой кислоты. Например, ДНК для препоследовательности или лидера секреции является функционально связанной с ДНК для полипептида, если она экспрессируется в виде пребелка, который принимает участие в секреции полипептида; промотор или энхансер является функционально связанным с кодирующей последовательностью, если он влияет на транскрипцию последовательности; или участок связывания рибосом является функционально связанным с кодирующей последовательностью, если он расположен так, чтобы способствовать трансляции. Обычно «функционально связанные» означает, что последовательности ДНК, которые связаны, являются соседними, и в случае лидера секреции являются соседними и находятся в рамке считывания. Однако энхансеры не обязательно должны быть соседними. Связывание осуществляют лигированием в подходящих сайтах рестрикции. Если таких сайтов не существует, то используют синтетические олигонуклеотидные адаптеры или линкеры согласно обычной практике.
При использовании в настоящем описании выражения «клетка», «линия клеток» и «культура клеток» используют взаимозаменяемо, и все такие обозначения включают потомство. Таким образом, слова «трансформанты» и «трансформированные клетки» включают первичные клетки и культуры, полученные из них, независимо от количества переносов. Также следует понимать, что все потомство может быть не точно идентичным по содержанию ДНК вследствие преднамеренных или спонтанных мутаций. Термины включают мутантное потомство, которое имеет такую же функцию или биологическую активность, как и исходно трансформированная клетка, отобранная при скрининге. В том случае, когда предполагаются другие определения, это будет ясно из контекста.
При использовании в настоящем описании «полимеразная цепная реакция» или «ПЦР» относится к способу или методике, при которой небольшое количество конкретного фрагмента нуклеиновой кислоты, РНК и/или ДНК амплифицируют, как описано, например, в патенте США № 4683195. В общем, требуется наличие информации о последовательности на концах представляющей интерес области или за ее пределами, чтобы можно было сконструировать олигонуклеотидные праймеры; такие праймеры обычно идентичны или сходны по последовательности с противоположными нитями матрицы, подвергаемой амплификации. 5'-концевые нуклеотиды двух праймеров могут совпадать с концами амплифицируемого материала. ПЦР можно использовать для амплификации конкретных последовательностей РНК, конкретных последовательностей ДНК с суммарной геномной ДНК и кДНК, транскрибированной с суммарной клеточной РНК, последовательностей бактериофага или плазмиды и т.д. В общем, смотри публикацию Mullis et al. (1987) Cold Spring Harbor Symp. Quant. Biol. 51: 263; Erlich, ed., (1989) PCR TECHNOLOGY (Stockton Press, N.Y.). При использовании в настоящем описании полагают, что ПЦР является одним, но не единственным примером способа полимеразной реакции нуклеиновых кислот для амплификации тестируемого образца нуклеиновой кислоты, включающего использование известной нуклеиновой кислоты в качестве праймера и полимеразы нуклеиновой кислоты для амплификации или образования конкретного участка нуклеиновой кислоты.
При использовании в настоящем описании термин «последовательность зародышевой линии» относится к последовательности не подвергнутых реарранжировке последовательностей ДНК иммуноглобулина, включая последовательности зародышевой линии грызуна (например, мыши) и человека. Можно использовать любой подходящий источник не подвергнутой реарранжировке ДНК иммуноглобулина. Последовательности зародышевой линии человека могут быть получены, например, из баз данных для зародышевой линии JOINSOLVER® на веб-сайте Национального института артрита и скелетно-мышечных и кожных заболеваний Национальных институтов здравоохранения США. Последовательности зародышевой линии мышей могут быть получены, например, как описано в публикации Giudicelli et al. (2005) Nucleic Acid Res. 33: D256-D261.
Чтобы исследовать степень усиления активности GITR, например, образцы или пробы для анализа, содержащие, например, данный белок, ген, клетку или организм, обрабатывают потенциальным активирующим или ингибирующим средством и сравнивают с контрольными образцами без средства. Контрольным образцам, т.е. не обработанным средством, приписывают значение относительной активности 100%. Ингибирование достигается, когда значение активности по сравнению с контролем составляет примерно 90% или меньше, обычно 85% или меньше, более обычно 80% или меньше, наиболее обычно 75% или меньше, как правило 70% или меньше, более часто 65% или меньше, наиболее часто 60% или меньше, обычно 55% или меньше, обычно 50% или меньше, более обычно 45% или меньше, наиболее обычно 40% или меньше, предпочтительно 35% или меньше, более предпочтительно 30% или меньше, еще более предпочтительно 25% или меньше и наиболее предпочтительно менее 20%. Активация достигается, когда значение активности по сравнению с контролем составляет примерно 110%, обычно по меньшей мере 120%, более обычно по меньшей мере 140%, более обычно по меньшей мере 160%, часто по меньшей мере 180%, более часто по меньшей мере 2-кратное значение, наиболее часто по меньшей мере 2,5-кратное значение, обычно по меньшей мере 5-кратное значение, более обычно по меньшей мере 10-кратное значение, предпочтительно по меньшей мере 20-кратное значение, более предпочтительно по меньшей мере 40-кратное значение и наиболее предпочтительно более чем в 40 раз выше.
Конечные значения активации или ингибирования можно контролировать следующим образом. Активацию, ингибирование и ответ на обработку, например, клетки, физиологической жидкости, ткани, органа и животного или человека можно контролировать по конечному результату. Конечный результат может включать предварительно определяемое количество или процент, например, показателей воспаления, онкогенности или дегрануляции клеток или секреции, например, высвобождения цитокина, токсического кислорода или протеазы. Конечный результат может включать, например, предварительно определяемый количественный показатель потока или транспорта ионов; миграции клеток; адгезии клеток; пролиферации клеток; метастатического потенциала; дифференцировки клеток; и изменения фенотипа, например, изменения экспрессии гена, имеющего отношение к воспалению, апоптозу, трансформации, клеточному циклу или метастазам (смотри, например,

Конечный результат ингибирования обычно составляет 75% от контроля или меньше, предпочтительно 50% от контроля или меньше, более предпочтительно 25% от контроля или меньше и наиболее предпочтительно 10% от контроля или меньше. Обычно конечный результат активации составляет по меньшей мере 150% от контроля, предпочтительно по меньшей мере в два раза превышает контроль, более предпочтительно по меньшей мере в четыре раза превышает контроль и наиболее предпочтительно по меньшей мере в 10 раз превышает контроль.
«Малую молекулу» определяют как молекулу с молекулярной массой, которая составляет менее чем 10 кДа, обычно менее чем 2 кДа и предпочтительно менее чем 1 кДа. Малые молекулы включают без ограничения неорганические молекулы, органические молекулы, органические молекулы, содержащие неорганический компонент, молекулы, содержащие радиоактивный атом, синтетические молекулы, миметики пептидов и миметики антител. В качестве терапевтического средства малая молекула может лучше проникать в клетку, может быть менее чувствительной к распаду и менее способной вызывать иммунный ответ, чем крупные молекулы. Описаны малые молекулы, такие как пептидомиметики антител и цитокины, а также молекулярные токсины. Смотри, например,

патент США № 6326482.
Термины «специфично» или «избирательно» связывает в случае пар лиганд/рецептор, антитело/антиген или другой связывающейся пары указывают на реакцию связывания, которая позволяет определять присутствие белка в гетерогенной популяции белков и других биологических веществ. Таким образом, в указанных условиях указанный лиганд связывается с конкретным рецептором и не связывается в значимом количестве с другими белками, присутствующими в образце. При использовании в настоящем описании говорят, что антитело специфично связывается с полипептидом, содержащим указанную последовательность (в данном случае GITR), если оно связывается с полипептидами, содержащими последовательность GITR, но не связывается с белками, в которых отсутствует последовательность GITR. Например, антитело, которое специфично связывается с полипептидом, содержащим GITR, может связываться с меченной FLAG® формой GITR, но не будет связываться с другими меченными FLAG® белками.
Антитело или связывающая композиция, полученная из антигенсвязывающего участка антитела, согласно рассматриваемому способу связывается со своим антигеном с аффинностью, которая по меньшей мере в два раза превышает, предпочтительно по меньшей мере в десять раз превышает, более предпочтительно по меньшей мере в 20 раз превышает и наиболее предпочтительно по меньшей мере в 100 раз превышает аффинность по отношению к неродственным антигенам. В предпочтительном варианте антитело будет иметь аффинность, которая составляет более чем примерно 109 литров/моль, которую определяют, например, в анализе по Скэтчарду. Munsen et al. (1980) Analyt. Biochem. 107: 220-239.
«Хроническая вирусная инфекция» или «персистирующая вирусная инфекция» при использовании в настоящем описании означает инфекцию у людей или других животных, вызванную вирусами, которые способны инфицировать хозяина и репродуцироваться в клетках хозяина в течение длительного периода времени - обычно в течение недель, месяцев или лет, не приводя к гибели. К вирусам, вызывающим хронические инфекции, которые можно лечить согласно настоящему изобретению, относятся вирусы папилломы человека (HPV), вирус простого герпеса и другие вирусы герпеса, вирусы гепатита B и C (HBV и HCV), а также другие вирусы гепатита, вирус кори, которые все могут вызывать важные клинические заболевания, и ВИЧ. Длительная инфекция в конце концов может приводить к индукции заболевания, которое может быть летальным для пациента, например, как в случае вызванного вирусом гепатита C рака печени. Другие хронические вирусные инфекции, которые можно лечить согласно настоящему изобретению, включают вирус Эпштейна - Барр (EBV), а также другие вирусы, такие как вирусы, которые могут быть ассоциированы с опухолями или, в случае животных, с различными вирусными заболеваниями животных, например, заболеваниями домашних питомцев или животных, важных для сельского хозяйства.
Термин «противовирусная активность» относится к ингибированию передачи вирусов в неинфицированные клетки, ингибированию репликации вируса, предотвращению поселения вируса в хозяине или ослаблению или облегчению симптомов заболевания, вызванного вирусной инфекцией. Такие эффекты могут быть доказаны на основании уменьшения вирусной нагрузки или снижения смертности и/или заболеваемости, и такие анализы описаны ниже. Противовирусные агент или лекарственное средство обладает противовирусной активностью и применимо для лечения персистирующих или хронических вирусных инфекций по отдельности или в виде части комбинированной терапии с применением нескольких лекарственных средств.
II. Общие положения
Настоящее изобретение относится к сконструированным анти-GITR-антителам и их применениям для лечения иммунных нарушений, в частности, нарушенного ответа на инфекционные заболевания (включая вирусные инфекции) и злокачественную опухоль.
GITR, также известный как TNFRSF 18, является рецептором, относящимся к надсемейству TNR-R. До настоящего времени кристаллические структуры GITR человека или мыши не получены, однако может быть установлена модульная структура молекулы на основе исследований, описанных, например, в публикации Naismith and Sprang (1998) Trends Biochem. Sci. 23: 74-79. Фигура 2 иллюстрирует, что GITR человека можно разделить на 6 модулей. На основании описанных ниже исследований некоторые антитела, обладающие агонистической активностью, могут иметь конформационные эпитопы, которые охватывают модули 3 и 4.
II. Создание GITR-специфичных антител
Можно использовать любой подходящий способ создания моноклональных антител. Например, реципиента можно иммунизировать GITR или его фрагментом. Можно использовать любой подходящий способ иммунизации. Такие способы могут включать применение адъювантов, других иммуностимуляторов, многократных бустер-иммунизаций и применение одного или нескольких путей иммунизации. Можно использовать любой источник GITR в качестве иммуногена для создания антитела животного, отличного от человека, для композиций и способов, описанных в настоящей публикации. Такие формы включают без ограничения целый белок, пептид (пептиды) и эпитопы, созданные способами рекомбинации, синтеза, химического или ферментативного разрушения, известными в данной области. В предпочтительных вариантах иммуноген содержит внеклеточную часть GITR.
Можно использовать любую форму антигена для создания антитела, которая достаточна для образования биологически активного антитела. Таким образом, вызывающий ответ антиген может представлять собой отдельный эпитоп, множество эпитопов или полный белок отдельно или в сочетании с одним или несколькими усиливающими иммуногенность средствами, известными в данной области. Вызывающий ответ антиген может представлять собой изолированный полноразмерный белок, белок клеточной поверхности (например, при иммунизации клетками, трансфицированными по меньшей мере частью антигена) или растворимый белок (например, при иммунизации только частью внеклеточного домена белка). Антиген может быть продуцирован в генетически модифицированной клетке. ДНК, кодирующая антиген, может быть геномной или негеномной (например, кДНК) и кодирует по меньшей мере часть внеклеточного домена. При использовании в настоящем описании термин «часть» относится к минимальному количеству аминокислот или нуклеиновых кислот, в зависимости от обстоятельств, которые составляют иммуногенный эпитоп представляющего интерес антигена. Можно использовать любые генетические векторы, подходящие для трансформации представляющих интерес клеток, включая без ограничения аденовирусные векторы, плазмиды и невирусные векторы, такие как катионные липиды.
Можно использовать любой подходящий способ, чтобы получить антитело с требуемыми биологическими свойствами, чтобы усилить передачу сигнала GITR. Желательно получение моноклональных антител (мАт) из различных млекопитающих-хозяев, таких как мыши, крысы, другие грызуны, человек, другие приматы и т.д. Описание способов получения таких моноклональных антител можно найти, например, в публикации Stites et al. (eds.) Basic and clinical immunology (4th ed.) Lange Medical Publications, Los Altos, CA, и цитированных в указанной публикации ссылках; а также в Harlow and Lane (1988) Antibodies: A laboratory manual CSH Press; Goding (1986), Monoclonal Antibodies: Principles and Practice (2d ed.) Academic Press, New York, NY. Таким образом, моноклональные антитела могут быть получены различными способами, известными специалистам в данной области. Обычно клетки селезенки от животного, иммунизированного требуемым антигеном, иммортализуют, обычно посредством слияния с клеткой миеломы. Смотри Kohler and Milstein (1976) Eur. J. Immunol. 6: 511-519. Альтернативные способы иммортализации включают трансформацию вирусом Эпштейна - Барр, онкогенами или ретровирусами или другие способы, известные в данной области. Смотри, например, Doyle et al. (1994 и периодические приложения), Cell and Tissue Culture: Laboratory Procedures, John Wiley and Sons, New York, NY. Колонии, возникающие из отдельных иммортализованных клеток, подвергают скринингу в отношении продукции антител с требуемой специфичностью и аффинностью для данного антигена, и выход моноклональных антител, продуцируемых такими клетками, может быть повышен различными способами, включая инъекцию в брюшную полость хозяина-позвоночного. Альтернативно можно выделить последовательности ДНК, которые кодируют моноклональное антитело или его антигенсвязывающий фрагмент, в результате скрининга библиотеки ДНК из B-клеток человека согласно, например, общему протоколу, описанному в Huse et al. (1989) Science 246: 1275- 1281.
Другие подходящие методики включают селекцию библиотек антител в фаговых или подобных векторах. Смотри, например, публикации Huse с соавторами, выше, и Ward с соавторами (1989) (Nature 341: 544-546). Полипептиды и антитела согласно настоящему изобретению можно применять с модификацией или без модификации, включая химерные или гуманизированные антитела. Часто полипептиды и антитела метят посредством связывания, либо ковалентно, либо нековалентно, с веществом, которое обеспечивает регистрируемый сигнал. Широкое множество меток и методик конъюгации известно и подробно описано как в научной, так и в патентной литературе. Подходящие метки включают радионуклиды, ферменты, субстраты, кофакторы, ингибиторы, флуоресцирующие остатки, хемилюминесцентные остатки, магнитные частицы и тому подобное. В патентах описано применение таких меток, включая патенты США №№ 3817837, 3850752, 3939350, 3996345, 4277437, 4275149 и 4366241. Также могут быть получены рекомбинантные иммуноглобулины, смотри публикации Cabilly (патент США № 4816567) и Queen с соавторами (1989) (Proc. Natl. Acad. Sci. USA 86: 10029-10033), или получены в трансгенных мышах, смотри Mendez с соавторами (1997) (Nature Genetics 15: 146-156). Также смотри методики Abgenix и Medarex.
Альтернативно моноклональные антитела могут быть получены обогащением клональных популяций B-клеток, выделенных из селезенок животных (например, мышей, крыс, кроликов и т.д.), иммунизированных GITR человека (смотри, например, WO2008045140, US5627052 и US20030186327).
Антитела или связывающие композиции против предварительно определяемых фрагментов GITR могут быть получены в результате иммунизации животных конъюгатами полипептида, фрагментов, пептидов или эпитопов с белками-носителями. Моноклональные антитела получают из клеток, секретирующих требуемое антитело. Такие антитела могут быть подвергнуты скринингу в отношении связывания с нормальным или дефектным GITR. Такие моноклональные антитела обычно будут связываться по меньшей мере с Kd, составляющей примерно 1 мкМ, более предпочтительно по меньшей мере примерно 300 нМ, 30 нМ, 10 нМ, 3 нМ, 1 нМ, 300 пМ, 100 пМ, 30 пМ или лучше, обычно определяемой в ELISA или Biacore. Подходящие антитела животного, отличного от человека также можно выявить, используя биологические анализы, описанные в примерах 5 и 6, ниже.
Гибридомы, соответствующие клонам 36E5, 3D6, 61G6, 6H6 и 61F6, депонировали в Американской коллекции типовых культур («ATCC») согласно требованиям Будапештского договора, под названием PTA-9890, PTA-9889, PTA-9891, PTA-9892 и PTA-9893, соответственно, 25 марта 2009.
Гибридомы, соответствующие клонам 1D8, 17F10, 35D8, 49A1, 9E5 и 31H6 депонировали в ATCC согласно требованиям Будапештского договора 21 августа 2009 под названием PTA-10286, PTA-10287, PTA-10288, PTA-10289, PTA-10290 и PTA-10291.
IV. Гуманизация GITR-специфичных антител
Любое подходящее антитело животного, отличного от человека, можно использовать в качестве источника гипервариабельной области. Источники антител животных, отличных от человека, включают без ограничения мышей (например, Mus musculus), крыс (например, Rattus norvegicus), зайцеобразных (включая кроликов), коров и приматов. В большинстве случаев гуманизированные антитела представляют собой иммуноглобулины человека (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области вида, отличного от человека (донорное антитело), такого как мышь, крыса, кролик или примат, отличный от человека, обладающей требуемой специфичностью, аффинностью и емкостью. В некоторых случаях остатки Fv каркасной области (FR) иммуноглобулина человека заменяют соответствующими остатками животного, отличного от человека. Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются ни в реципиентном антителе, ни в донорном антителе. Такие модификации осуществляют для того, чтобы дополнительно улучшить эффективность антитела в отношении требуемой биологической активности. Более подробное описание смотри в Jones et al. (1986) Nature 321: 522-525; Reichmann et al. (1988) Nature 332: 323-329; и Presta (1992) Curr. Op. Struct. Biol. 2: 593-596.
Способы основанного на рекомбинации конструирования антител описаны, например, Boss с соавторами (патент США № 4816397), Cabilly с соавторами (патент США № 4816567), Law с соавторами (публикация заявки на выдачу на европейский патент № 438310) и Winter (публикация на выдачу заявки на европейский патент № 239400).
Варианты аминокислотной последовательности гуманизированного анти-GITR-антитела получают введением соответствующих изменений нуклеотидов в ДНК гуманизированного анти-GITR-антитела или пептидным синтезом. Такие варианты включают, например, делеции и/или инсерции и/или замены остатков в аминокислотных последовательностях, показанных для гуманизированного анти-GITR-антитела. Осуществляют любое сочетание делеции, инсерции и замены, чтобы получить конечную конструкцию, при условии, что конечная конструкция обладает требуемыми характеристиками. Изменения аминокислот также могут изменять посттрансляционные процессы в гуманизированном анти-GITR-антителе, такие как изменение количества или положения сайтов гликозилирования.
Применимый способ идентификации некоторых остатков или областей полипептида гуманизированного анти-GITR-антитела, которые являются предпочтительными положениями для мутагенеза, называют «мутагенезом на основе сканирования аланином», который описан в Cunningham and Wells (1989) Science 244: 1081-1085. В данном случае идентифицируют остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) и заменяют нейтральной или отрицательно заряженной аминокислотой (наиболее предпочтительно аланином или полиаланином), чтобы оказать влияние на взаимодействие аминокислот с антигеном GITR. Затем аминокислотные остатки, проявляющие функциональную чувствительность к заменам, улучшают введением дополнительных или других вариантов в участки или вместо участков замены. Таким образом, хотя участок введения варианта аминокислотной последовательности предварительно определяют, нет необходимости в предварительном определении природы мутации как таковой. Например, чтобы проанализировать эффективность мутации в данном участке, проводят Ala-сканирование или случайный мутагенез в кодоне-мишени или области-мишени и экспрессированные варианты гуманизированного анти-GITR-антитела подвергают скринингу в отношении требуемой активности.
Инсерции в аминокислотных последовательностях включают слияния с амино- и/или карбоксильным концом длиной в диапазоне от одного остатка до полипептидов, содержащих сто или более остатков, а также инсерции внутри последовательности одного или нескольких аминокислотных остатков. Примеры концевых инсерций включают гуманизированное анти-GITR-антитело с N-концевым остатком метионила или антитело, слитое с эпитопной меткой. Другие инсерционные варианты молекулы гуманизированного анти-GITR-антитела включают слияние N- или C-конца гуманизированного анти-GITR-антитела с ферментом или полипептидом, который увеличивает время полужизни антитела в сыворотке.
Вариантом другого типа является вариант с аминокислотными заменами. В таких вариантах по меньшей мере один аминокислотный остаток в молекуле гуманизированного анти-GITR-антитела удаляют, а другой остаток встроен на его место. Места, представляющие наибольший интерес для мутагенеза путем замен, включают гипервариабельные петли, но также предполагаются изменения и в FR.
В другом типе аминокислотного варианта антитела изменена исходная картина гликозилирования антитела. Под изменением подразумевают делецию одного или нескольких углеводных остатков, обнаруженных в антителе, и/или добавление одного или нескольких сайтов гликозилирования, которые не присутствуют в антителе. Гликозилирование антител обычно является либо N-связанным, либо O-связанным. N-связанный относится к связыванию углеводного остатка с боковой цепью остатка аспарагина. Трипептидные последовательности аспарагин-X-серин и аспарагин-X-треонин, где X означает любую аминокислоту за исключением пролина, являются последовательностями узнавания для ферментативного связывания углеводного остатка с боковой цепью аспарагина. Таким образом, присутствие любой из указанных трипептидных последовательностей в полипептиде создает потенциальный сайт гликозилирования. O-связанное гликозилирование относится к связыванию одного из сахаров N-ацетилгалактозамина, галактозы или ксилозы с гидроксиаминокислотой, чаще всего серином или треонином, хотя также можно использовать 5-гидроксипролин или 5-гидроксилизин.
Добавление сайтов гликозилирования к антителу обычно осуществляют посредством изменения аминокислотной последовательности так, чтобы она содержала одну или несколько из описанных выше трипептидных последовательностей (для сайтов N-связанного гликозилирования). Изменение также можно осуществить добавлением или заменой одного или нескольких остатков серина или треонина в последовательности исходного антитела (для сайтов O-связанного гликозилирования).
Еще одним типом аминокислотного варианта является замена остатков так, чтобы обеспечить более высокую химическую стабильность конечного гуманизированного антитела. Например, остаток аспарагина (N) может быть изменен для уменьшения потенциального образования изоаспартата в любых последовательностях NG в CDR грызунов. Сходная проблема может возникать в последовательности DG. Reissner and Aswad (2003) Cell. Mol. Life Sci. 60: 1281. Образование изоаспартата может ослаблять или полностью отменять связывание антитела с его антигеном-мишенью. Presta (2005) J. Allergy Clin. Immunol. 116: 731-734. В одном варианте аспарагин заменяют на глутамин (Q). Кроме того, остатки метионина в CDR грызунов могут быть изменены, чтобы уменьшить вероятность того, что сера метионина может окислиться, что может уменьшать аффинность связывания антигена, а также вносить вклад в молекулярную гетерогенность в конечном препарате антитела. Там же. В одном варианте осуществления метионин заменяют на аланин (A). Затем антитела с такими заменами подвергают скринингу, чтобы убедиться, что замены не снижают аффинность связывания GITR до неприемлемых уровней.
Молекулы нуклеиновых кислот, кодирующие варианты аминокислотной последовательности антитела, получают различными способами, известными в данной области. Такие способы включают без ограничения выделение из природного источника (в случае встречающихся в природе вариантов аминокислотной последовательности) или получение с использованием опосредованного олигонуклеотидами (или сайт-специфичного) мутагенеза, ПЦР-мутагенеза и кассетного мутагенеза ранее полученного варианта или версии гуманизированного анти-GITR-антитела, не являющейся вариантом.
Обычно варианты аминокислотной последовательности гуманизированного анти-GITR-антитела будут содержать аминокислотную последовательность, имеющую по меньшей мере 75% идентичность аминокислотной последовательности с аминокислотными последовательностями исходного гуманизированного антитела либо тяжелой, либо легкой цепи, более предпочтительно по меньшей мере 80%, более предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно по меньшей мере 95%, 98% или 99%. Идентичность или гомологию по отношению к данной последовательности определяют в настоящем описании как процент аминокислотных остатков в выбранной для исследования последовательности, которые идентичны остаткам гуманизированного анти-GITR-антитела после выравнивания последовательностей и введения пробелов, если это необходимо, чтобы достичь максимальной идентичности последовательностей в процентах, без учета каких-либо консервативных замен в качестве части идентичности последовательностей. Ни N-концевые, ни C-концевые ни внутренние удлинения, делеции или инсерции в последовательности антитела не следует рассматривать как влияющие на идентичность или гомологию последовательностей.
Гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE. Предпочтительно антитело представляет собой IgG-антитело. Можно использовать любой изотип IgG, включая IgG1, IgG2, IgG3 и IgG4. Также рассматриваются варианты изотипов IgG. Гуманизированное антитело может содержать последовательности из более чем одного класса или изотипа. Оптимизацию необходимых последовательностей константных доменов для получения требуемой биологической активности легко осуществляют посредством скрининга антител в биологических анализах, описанных в примерах.
Подобным образом, любой класс легкой цепи можно использовать в композициях и способах согласно изобретению. В частности, цепи каппа, лямбда или их варианты применимы в композициях и способах согласно изобретению.
Можно использовать любую подходящую часть последовательностей CDR из антитела животного, отличного от человека. Последовательности CDR могут быть подвергнуты мутагенезу посредством замены, инсерции или делеции по меньшей мере одного остатка, так чтобы последовательность CDR отличалась от используемой последовательности антитела человека и животного, отличного от человека. Предполагается, что такие мутации могут быть минимальными. Обычно по меньшей мере 75% остатков гуманизированного антитела будут соответствовать остаткам CDR животного, отличного от человека, более часто 90% и наиболее предпочтительно более 95%.
Любая подходящая часть последовательностей FR из антитела человека может быть использована. Последовательности FR могут быть подвергнуты мутагенезу посредством замены, инсерции или делеции по меньшей мере одного остатка, так чтобы последовательность FR отличалась от используемой последовательности антитела человека и животного, отличного от человека. Предполагается, что такие мутации могут быть минимальными. Обычно по меньшей мере 75% остатков гуманизированного антитела будут соответствовать остаткам FR человека, более часто 90% и наиболее предпочтительно более 95%, 98% или 99%.
Остатки CDR и FR определяют согласно стандартному определению последовательности по Кабату. Kabat et al. (1987) Sequences of Proteins of Immunological Interest, National Institutes of Health, Bethesda Md. В SEQ ID NO: 1-11 показаны последовательности вариабельных доменов тяжелой цепи различных антител грызунов против GITR человека, и в SEQ ID NO: 12-22 показаны последовательности вариабельных доменов легкой цепи.

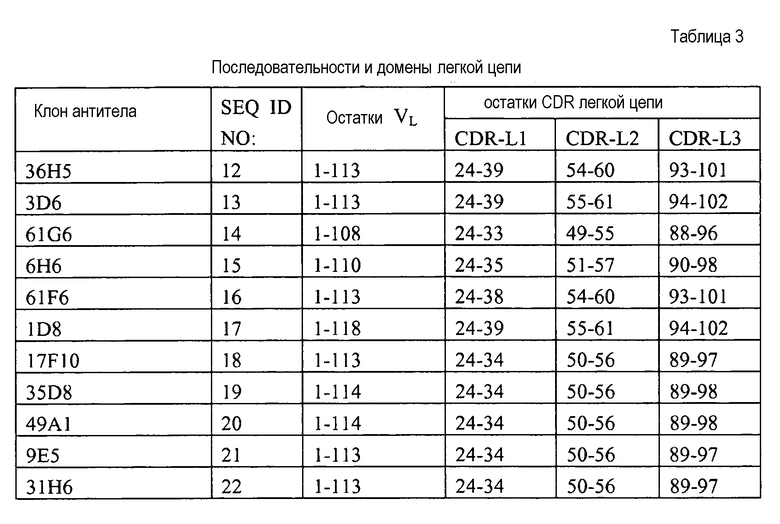
В одном варианте CDR включают варианты любой одной последовательности CDR, описанной в настоящей публикации (SEQ ID NO: 23-88), при этом вариант содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или больше консервативных аминокислотных замен по сравнению с описанной последовательностью, которые определены с использованием данных из таблицы 1.
Также рассматриваются химерные антитела. Как указано выше, типичные химерные антитела содержат часть тяжелой и/или легкой цепи, идентичную или гомологичную соответствующим последовательностям в антителах, полученных из конкретных видов или относящихся к конкретному классу или подклассу антител, при этом остальная цепь (цепи) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или относящихся к другому классу или подклассу антител, а также фрагменты таких антител, при условии, что они проявляют требуемую биологическую активность. Смотри патент США № 4816567 и Morrison et al. (1984) Proc. Natl. Acad. Sci. USA 81: 6851-6855.
Биспецифичные антитела также применимы в способах и композициях согласно изобретению. При использовании в настоящем описании термин «биспецифичное антитело» относится к антителу, обычно моноклональному антителу, имеющему специфичности связывания по меньшей мере двух разных антигенных эпитопов. В одном варианте осуществления эпитопы происходят из одного и того же антигена. В другом варианте осуществления эпитопы происходят из разных антигенов. Способы получения биспецифичных антител известны в данной области. Например, биспецифичные антитела могут быть получены рекомбинантно с использованием коэкспрессии двух пар тяжелая цепь/легкая цепь иммуноглобулина. Смотри, например, Milstein et al. (1983) Nature 305: 537-39. Альтернативно биспецифичные антитела могут быть получены с использованием химического связывания. Смотри, например, Brennan et al. (1985) Science 229: 81. Биспецифичные антитела включают фрагменты биспецифичных антител. Смотри, например, Holliger et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90: 6444-48, Gruber et al. (1994) J. Immunol. 152: 5368.
В следующих вариантах разные константные домены могут быть добавлены к гуманизированным областям VL и VH, полученным из CDR, предложенных в настоящем изобретении. Например, если конкретное предполагаемое применение антитела (или фрагмента) согласно настоящему изобретению направлено на получение измененных эффекторных функций, можно использовать другой константный домен тяжелой цепи, отличный от IgG1. Хотя IgG1-антитела обеспечивают длительное время полужизни и такие эффекторные функции, как активация комплемента и зависимая от антител клеточная цитотоксичность, такие активности могут быть нежелательными для применений антитела. В таких случаях можно использовать, например, константный домен IgG4 или IgG2.
Исходные и сконструированные формы антител согласно настоящему изобретению также могут быть конъюгированы с химическим остатком. Химический остаток помимо прочего может представлять собой полимер, радионуклид или цитотоксический фактор. Предпочтительно химический остаток представляет собой полимер, который увеличивает время полужизни молекулы антитела в организме субъекта. Подходящие полимеры включают без ограничения полиэтиленгликоль (ПЭГ) (например, ПЭГ с молекулярной массой 2 кДа, 5 кДа, 10 кДа, 12 кДа, 20 кДа, 30 кДа или 40 кДа), декстран и монометоксиполиэтиленгликоль (мПЭГ). Lee с соавторами (1999) (Bioconj. Chem. 10: 973-981) описывают конъюгированные с ПЭГ одноцепочечные антитела. Wen с соавторами (2001) (Bioconj. Chem. 12: 545-553) описывают антитела, конъюгированные с ПЭГ, который связан с хелатором радиоактивного металла (диэтилентриаминпентауксусной кислотой (DTPA)).
Антитела и фрагменты антител или растворимые белки GITR или их фрагменты согласно изобретению также могут быть конъюгированы с метками, такими как 99Tc, 90Y, 111In, 32P, 14C, 125I, 3H, 131I, 11C, 15O, 13N, 18F, 35S, 51Cr, 57To, 226Ra, 60Co, 59Fe, 57Se, 152Eu, 67Cu, 217Ci, 211At, 212Pb, 47Sc, 109Pd, 234Th и 40K, 157Gd, 55Mn, 52Tr и 56Fe.
Антитела и фрагменты антител или растворимые белки GITR или их фрагменты согласно изобретению также могут быть конъюгированы с флуоресцирующими или хемилюминесцентными метками, включая флюорофоры, такие как редкоземельные хелаты, флуоресцеин и его производные, родамин и его производные, изотиоцианат, фикоэритрин, фикоцианин, аллофикоцианин, o-фталевый альдегид, флуорескамин, 152Eu, дансил, умбеллиферон, люциферин, метку люминолом, метку изолюминолом, метку ароматическим сложным эфиром акридиния, метку имидазолом, метку солью акридиния, метку сложным оксалатным эфиром, метку экворином, 2,3-дигидрофталазиндионы, биотин/авидин, спиновые метки и стабильные свободные радикалы.
Можно использовать любой способ, известный в данной области для конъюгирования молекул антител или молекул белков согласно изобретению с различными остатками, включая способы, описанные в

Способы конъюгирования антител и белков являются обычными и очень хорошо известными в данной области.
V. Биологическая активность гуманизированных анти-GITR-антител
Антитела, обладающие свойствами, идентифицированными в настоящей публикации как желательные для гуманизированного анти-GITR-антитела, могут быть подвергнуты скринингу в отношении ингибирующей биологической активности in vitro или в отношении подходящей аффинности связывания. Агонистические антитела можно отличать от антагонистических антител, используя биологический анализ, описанный в примере 5. Антитела, которые проявляют агонистическую активность, не будут блокировать активность GITR, а наоборот, будут стимулировать ответ, обычно опосредуемый передачей сигнала GITR.
Чтобы осуществить скрининг антител, которые связываются с эпитопом на GITR человека, связанным представляющим интерес антителом (например, антителами, которые блокируют связывание GITR), можно осуществить общепринятый анализ перекрестного блокирования, такой как анализ, описанный в Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory, Ed Harlow and David Lane (1988). Антитела, которые связываются с одним и тем же эпитопом, вероятно, перекрестно блокируют в таком анализе, но не все перекрестно блокирующие антитела будут обязательно точно связываться с одним и тем же эпитопом, так как перекрестное блокирование может возникать в результате стерического препятствия для связывания антитела, создаваемого антителами, связываемыми с перекрывающимися эпитопами или даже соседними неперекрывающимися эпитопами.
Альтернативно можно осуществить картирование эпитопов, например, как описано в Champe et al. (1995) J. Biol. Chem. 270: 1388-1394, чтобы определить, связывает ли антитело представляющий интерес эпитоп. «Мутагенез на основе сканирования аланином», который описан в Cunningham and Wells (1989) Science 244: 1081-1085, или другую форму точечного мутагенеза аминокислотных остатков в GITR человека также можно использовать для определения функционального эпитопа для анти-GITR-антитела согласно настоящему изобретению. Однако исследования с использованием мутагенеза также могут выявить аминокислотные остатки, которые являются ключевыми для общей трехмерной структуры GITR, но которые непосредственно не вовлечены в контакты антитело-антиген, и, следовательно, могут потребоваться другие способы для подтверждения функционального эпитопа, определенного с использованием такого способа.
Эпитоп, связываемый конкретным антителом, также может быть определен при анализе связывания антитела с пептидами, содержащими фрагменты GITR человека (SEQ ID NO: 41). Серию перекрывающихся пептидов, охватывающих последовательность GITR, можно синтезировать и подвергнуть скринингу в отношении связывания, например, в прямом анализе ELISA, конкурентном ELISA (при этом пептид оценивают в отношении его способности предотвращать связывание антитела с GITR, связанным с лункой планшета для микротитрования), или на чипе. Такие способы скрининга пептидов могут оказаться неспособными выявлять некоторые прерывистые функциональные эпитопы, т.е. функциональные эпитопы, которые включают аминокислотные остатки, которые не являются непрерывно следующими друг за другом вдоль первичной последовательности полипептидной цепи GITR.
Эпитоп, связываемый антителами согласно настоящему изобретению, также может быть определен структурными способами, такими как определение кристаллической структуры с использованием рентгеновского излучения (например, WO2005/044853), молекулярное моделирование и ядерная магнитно-резонансная (ЯМР) спектроскопия, включая определение ЯМР скоростей H-D-обмена лабильных атомов водорода амида в GITR в свободном состоянии и связанном в комплексе с представляющим интерес антителом (Zinn-Justin et al. (1992) Biochemistry 31: 11335-11347; Zinn-Justin et al. (1993) Biochemistry 32: 6884-6891).
Что касается рентгеновской кристаллографии, то кристаллизация может быть осуществлена с использованием любых способов, известных в данной области (например, Giege et al. (1994) Acta Crystallogr. D50: 339-350; McPherson (1990) Eur. J. Biochem. 189: 1-23), включая использование микропартий (например, Chayen (1997) Structure 5: 1269-1274), диффузию паров в висящей капле (например, McPherson (1976) J. Biol. Chem. 251: 6300-6303), затравку и диализ. Желательно использовать препарат белка, имеющий концентрацию по меньшей мере примерно 1 мг/мл и предпочтительно от примерно 10 мг/мл до примерно 20 мг/мл. Лучше всего кристаллизация может быть достигнута в растворе преципитирующего агента, содержащем полиэтиленгликоль 1000-20000 (ПЭГ; средняя молекулярная масса в диапазоне от примерно 1000 до примерно 20000 Да), предпочтительно от примерно 5000 до примерно 7000 Да, более предпочтительно примерно 6000 Да, в концентрациях в диапазоне от примерно 10% до примерно 30% (масс./об.). Также может быть желательным включение стабилизатора белка, например, глицерина, в концентрации в диапазоне от примерно 0,5% до примерно 20%. Подходящая соль, такая как хлорид натрия, хлорид лития или цитрат натрия, также может быть желательна в растворе преципитирующего агента, предпочтительно в концентрации в диапазоне от примерно 1 мМ до примерно 1000 мМ. Преципитирующий агент предпочтительно забуферен до pH от примерно 3,0 до примерно 5,0, предпочтительно примерно 4,0. Конкретные буферы, применимые в растворе преципитирующего агента, могут варьировать и хорошо известны в данной области. Scopes, Protein Purification: Principles and Practice, Third ed., (1994) Springer-Verlag, New York. Примеры применимых буферов включают без ограничения HEPES, Трис, MES и ацетат. Кристаллы можно выращивать в широком диапазоне температур, включая 2°C, 4°C, 8°C и 26°C.
Кристаллы антитело:антиген можно исследовать, используя хорошо известные способы дифракции рентгеновских лучей, и уточнение можно осуществить, используя компьютерную программу, такую как X-PLOR (Yale University, 1992, распространяемую Molecular Simulations, Inc.; смотри, например, Blundell and Johnson (1985) Meth. Enzymol. 114-115, H. W. Wyckoff et al. eds., Academic Press; публикацию заявки на выдачу патента США № 2004/0014194) и BUSTER (Bricogne (1993) Acta Cryst. D49: 37-60; Bricogne (1997) Meth. Enzymol. 276A:361-423, Carter and Sweet, eds.; Roversi et al. (2000) Acta Cryst. D56: 1313-1323).
Могут быть получены дополнительные антитела, связывающиеся с тем же эпитопом, что и антитело согласно настоящему изобретению, например, в результате скрининга антител, полученных против GITR, в отношении связывания с эпитопом или с использованием иммунизации животного пептидом, содержащим фрагмент GITR человека, включающий последовательность эпитопа. Можно ожидать, что антитела, которые связываются с одним и тем же функциональным эпитопом, проявляют сходные биологические активности, такие как блокирование связывания рецептора, и такие активности могут быть подтверждены в функциональных анализах антител.
Аффинности антител могут быть определены с использованием стандартного анализа. Предпочтительными гуманизированными антителами являются антитела, которые связывают GITR человека со значением Kd не более чем примерно 1×10-7; предпочтительно не более чем примерно 1×10-8; более предпочтительно не более чем примерно 1×10-9; и наиболее предпочтительно не более чем примерно 1×10-10 или даже 1×10-11 М.
Антитела и их фрагменты, применимые в композициях и способах согласно настоящему изобретению, являются биологически активными антителами и фрагментами. При использовании в настоящем описании термин «биологически активный» относится к антителу или фрагменту антитела, который способен связывать требуемый антигенный эпитоп и прямо или опосредованно вызывать биологический эффект. При использовании в настоящем описании термин «специфичное» относится к избирательному связыванию антитела с эпитопом антигена-мишени. Антитела можно тестировать в отношении специфичности связывания посредством сравнения связывания с GITR со связыванием с нерелевантным антигеном или смесью антигенов в заданных условиях. Если антитело связывается с GITR по меньшей мере в 10 и предпочтительно в 50 раз больше, чем с нерелевантным антигеном или смесью антигенов, то оно считается специфичным. Антитело, которое «специфично связывается» с GITR, не связывается с белками, которые не содержат полученных из GITR последовательностей, т.е. «специфичность» при использовании в настоящем описании относится к специфичности по отношению к GITR, а не к любым другим последовательностям, которые могут присутствовать в рассматриваемом белке. Например, при использовании в настоящем описании антитело, которое «специфично связывается» с полипептидом, содержащим GITR, обычно будет связываться с FLAG®-GITR, который представляет собой слитый белок, содержащий GITR и пептидную метку FLAG®, но не будет связываться с пептидной меткой FLAG® отдельно или когда она слита с другим белком, отличным от GITR.
GITR-специфичные связывающие соединения согласно настоящему изобретению, такие как агонистические GITR-специфичные антитела, могут усиливать свою биологическую активность любым способом, включая без ограничения увеличение иммунного ответа на микробную инфекцию.
VI. Фармацевтические композиции
Чтобы получить фармацевтические или стерильные композиции, содержащие GITR-антитело, аналог цитокина или мутеин, антитело к нему или его нуклеиновую кислоту смешивают с фармацевтически приемлемым носителем или эксципиентом. Смотри, например, Remington's Pharmaceutical Sciences и U.S. Pharmacopeia: National Formulary, Mack Publishing Company, Easton, PA (1984).
Препараты терапевтических и диагностических средств могут быть получены смешиванием с физиологически приемлемыми носителями, эксципиентами или стабилизаторами, например, в форме лиофилизированных порошков, взвесей, водных растворов или суспензий. Смотри, например,

Токсичность и терапевтическую эффективность композиций антител, вводимых отдельно или в сочетании с иммунодепрессантом, можно определить стандартными фармацевтическими способами в культурах клеток или на экспериментальных животных, например, для определения LD50 (дозы, летальной для 50% популяции) и ED50 (дозы, терапевтически эффективной для 50% популяции). Соотношение доз для токсического и терапевтического эффектов является терапевтическим индексом, и он может быть выражен в виде отношения LD50 к ED50. Антитела с высокими терапевтическими индексами являются предпочтительными. Данные, полученные в таких анализах на культурах клеток и исследованиях на животных, можно использовать при приготовлении диапазона доз для применения на человеке. Доза таких соединений предпочтительно находится в диапазоне циркулирующих концентраций, которые включают ED50 с небольшой токсичностью или без токсичности. Доза может варьировать в данном диапазоне в зависимости от используемой формы дозирования и пути введения.
Способ введения не является особенно важным. Подходящие пути введения могут включать, например, пероральное, ректальное, трансмукозальное или кишечное введение; парентеральную доставку, включая внутримышечные, подкожные, внутримозговые инъекции, а также интратекальные, прямые внутрижелудочковые, внутривенные, внутрибрюшинные, интраназальные или внутриглазные инъекции. Введение антитела, используемого в фармацевтической композиции или при практическом осуществлении способа согласно настоящему изобретению, можно осуществлять с использованием множества обычных путей, таких как пероральный прием вовнутрь, ингаляция, местное применение или кожная, подкожная, внутрибрюшинная, парентеральная, внутриартериальная или внутривенная инъекция.
Альтернативно можно вводить антитело локальным, а не системным образом, например, посредством инъекции антитела непосредственно в пораженный артритом сустав или индуцированное патогеном повреждение, характеризуемое иммунопатологией, часто в виде депонируемого препарата или препарата с длительным высвобождением. Кроме того, можно вводить антитело в системе целевой доставки лекарственного средства, например, в липосоме, покрытой тканеспецифичным антителом, мишенью которого является, например, пораженный артритом сустав или индуцированное патогеном повреждение, характеризуемое иммунопатологией. Липосомы будут направляться и избирательно захватываться пораженной тканью.
Выбор схемы введения терапевтического средства зависит от нескольких факторов, включая скорость метаболизма объекта в сыворотке или ткани, уровень симптомов, иммуногенность объекта и доступность клеток-мишеней в биологическом матриксе. Предпочтительно в схеме введения максимизируют количество терапевтического средства, доставляемого пациенту в соответствии с приемлемым уровнем побочных эффектов. Соответственно, количество доставляемого биологического средства отчасти зависит от конкретного объекта и тяжести состояния, подвергаемого лечению. Имеется руководство по выбору подходящих доз антител, цитокинов и малых молекул. Смотри, например,

Определение подходящей дозы осуществляет лечащий врач, например, используя параметры или факторы, которые, как известно или предполагается в данной области, влияют на лечение или предположительно влияют на лечение. В общем, доза начинается с количества, немного меньшего, чем оптимальная доза, и затем ее увеличивают небольшими добавками вплоть до достижения оптимального эффекта в отношении любых негативных побочных эффектов. Важные диагностические измерения включают измерения симптомов, например, воспаления или уровня продуцируемых воспалительных цитокинов. Предпочтительно, биологическое средство, которое может быть использовано, в основном получают из того же вида, что и животное, подвергаемое лечению (например, гуманизированное антитело для лечения человека), минимизируя при этом любой иммунный ответ на реагент.
Антитела, фрагменты антител и цитокины могут быть доставлены непрерывной инфузией или в виде доз с интервалами, например, один раз в сутки, 1-7 раз в неделю, раз в неделю, раз в две недели, ежемесячно, раз в два месяца и т.д. Дозы могут быть введены внутривенно, подкожно, местно, перорально, назально, ректально, внутримышечно, внутрицеребрально, интраспинально или путем ингаляции. Предпочтительным протоколом дозирования является протокол, включающий максимальную дозу или частоту введения доз, которые позволяют избежать значимых нежелательных побочных эффектов. Общая недельная доза обычно составляет по меньшей мере 0,05 мкг/кг, 0,2 мкг/кг, 0,5 мкг/кг, 1 мкг/кг, 10 мкг/кг, 100 мкг/кг, 0,2 мг/кг, 1,0 мг/кг, 2,0 мг/кг, 10 мг/кг, 25 мг/кг, 50 мг/кг массы тела или больше. Смотри, например, Yang et al. (2003) New Engl. J. Med. 349: 427-434; Herold et al. (2002) New Engl. J. Med. 346: 1692-1698; Liu et al. (1999) J. Neurol. Neurosurg. Psych. 67: 451-456; Portielji et al. (20003) Cancer Immunol. Immunother. 52: 133-144. Желательная доза низкомолекулярного терапевтического средства, например, пептидомиметика, природного продукта или органического химического вещества, примерно такая же, как и доза антитела или полипептида в расчете в моль/кг.
При использовании в настоящем описании термины «ингибировать» или «лечить» или «лечение» включают отсрочку развития симптомов, ассоциированных с аутоиммунным заболеванием или индуцированной патогеном иммунопатологией, и/или уменьшение тяжести таких симптомов, которые могут развиваться или предположительно могут развиваться. Термины дополнительно включают ослабление существующих неконтролируемых или неблагоприятных симптомов, связанных с аутоиммунным заболеванием или индуцированной патогеном иммунопатологией, предотвращение дополнительных симптомов и ослабление или предотвращение причин, лежащих в основе таких симптомов. Таким образом, термины означают, что полезный результат был подтвержден на позвоночном субъекте с аутоиммунным заболеванием или индуцированной патогеном иммунопатологией или симптомом таких заболеваний, или с потенциальным развитием такого заболевания или симптома.
При использовании в настоящем описании термин «терапевтически эффективное количество» или «эффективное количество» относится к количеству GITR-специфичного связывающего соединения, например, антитела, которое при введении отдельно или в сочетании с дополнительным терапевтическим средством в клетку, ткань или в организм субъекта является эффективным в отношении предотвращения или ослабления аутоиммунного заболевания или ассоциированного с индуцированной патогеном иммунопатологией заболевания или состояния или прогрессирования заболевания. Терапевтически эффективная доза, кроме того, относится к количеству соединения, эффективному для того, чтобы получить ослабление симптомов, например, для лечения, исцеления или предотвращения или ослабления релевантного патологического состояния, или для ускорения лечения, исцеления, предотвращения или ослабления таких состояний. В применении к отдельному активному ингредиенту, вводимому отдельно, терапевтически эффективная доза относится только к такому ингредиенту. В применении к сочетанию терапевтически эффективная доза относится к объединенным количествам активных ингредиентов, которые приводят к терапевтическому эффекту, независимо от введения в сочетании, последовательно или одновременно. Эффективное количество терапевтического средства будет снижать симптомы обычно по меньшей мере на 10%; обычно по меньшей мере на 20%; предпочтительно по меньшей мере примерно на 30%; более предпочтительно по меньшей мере на 40% и наиболее предпочтительно по меньшей мере на 50%.
Способы совместного введения или лечения с использованием второго терапевтического средства, например, цитокина, антитела, стероида, химиотерапевтического средства, антибиотика, противовирусного средства или облучения, хорошо известны в данной области, смотри, например,

Химиотерапевтические средства включают алкилирующие агенты, такие как тиотепа и CYTOXAN® циклофосфамид; алкилсульфонаты, такие как бусульфан, импросульфан и пипосульфан; азиридины, такие как бензодопа, карбоквон, метуредопа и уредопа; этиленимины и метилмеламины, включая алтретамин, триэтиленмеламин, триэтиленфосфорамид, триэтилентиофосфорамид и триметилолмеламин; ацетогенины (в частности, буллатацин и буллатацинон); камптотецин (включая синтетический аналог топотекан); бриостатин; каллистатин; CC-1065 (включая его синтетические аналоги адозелезин, карзелезин и бизелезин); криптофицины (в частности, криптофицин 1 и криптофицин 8); доластатин; дуокармицин (включая синтетические аналоги KW-2189 и CB1-TM1); элеутеробин; панкратистатин; саркодиктиин; спонгистатин; азотистые иприты, такие как хлорамбуцил, хлорнафазин, холофосфамид, эстрамустин, ифосфамид, мехлорэтамин, гидрохлорид оксида мехлорэтамина, мелфалан, новембихин, фенестерин, преднимустин, трофосфамид, урамустин; нитрозомочевины, такие как кармустин, хлорозотоцин, фотемустин, ломустин, нимустин и ранимустин; антибиотики, такие как энедииновые антибиотики (например, калихеамицин, в частности калихеамицин гамма II и калихеамицин омега II (смотри, например, Agnew, Chem Intl. Ed. Engl., 33: 183-186 (1994)); динемицин, включая динемицин A; бифосфонаты, такие как клодронат; эсперамицин; а также хромофор неокарциностатина и родственные хромофоры хромопротеинов - энедииновые антибиотики, аклациномизины, актиномицин, аутрамицин, азасерин, блеомицины, кактиномицин, карабицин, каминомицин, карзинофилин, хромомицины, дактиномицин, даунорубицин, деторубицин, 6-диазо-5-оксо-L-норлейцин, доксорубицин ADRIAMICIN® (включая морфолинодоксорубицин, цианоморфолинодоксорубицин, 2-пирролинодоксорубицин и дезоксидоксорубицин), эпирубицин, эзорубицин, идарубицин, марцелломицин, митомицины, такие как митомицин C, микофеноловую кислоту, ногаламицин, оливомицины, пепломицин, потфиромицин, пуромицин, квеламицин, родорубицин, стрептонигрин, стрептозоцин, туберцидин, убенимекс, зиностатин, зорубицин; антиметаболиты, такие как метотрексат и 5-фторурацил (5-FU); аналоги фолиевой кислоты, такие как деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурина, такие как флударабин, 6-меркаптопурин, тиамиприн, тиогуанин; аналоги пиримидина, такие как анцитабин, азацитидин, 6-азауридин, кармофур, цитарабин, дидезоксиуридин, доксифлуридин, эноцитабин, флоксуридин; андрогены, такие как калустерон, пропионат дромостанолона, эпитиостанол, мепитиостан, тестолактон; средства, подавляющие функции надпочечников, такие как аминоглютетимид, митотан и трилостан; компенсатор фолиевой кислоты, такой как фролиновая кислота; ацеглатон; гликозид альдофосфамида; аминолевулиновую кислоту; энилурацил; амсакрин; бестрабуцил; бисантрен; эдатраксат; дефофамин; демеколцин; диазиквон; элформитин; ацетат эллиптиния; эпотилон; этоглуцид; нитрат галлия; гидроксимочевину; лентинан; лонидаинин; майтанзиноиды, такие как майтанзин и ансамитоцины; митогуазон; митоксантрон; мопиданмол; нитраэрин; пентостатин; фенамет; пирарубицин; лозоксантрон; подофиллиновую кислоту; 2-этилгидразид; прокарбазин; полисахаридный комплекс PSK® (JHS Natural Products, Eugene, Oreg.); разоксан; ризоксин; сизофуран; спирогерманий; тенуазоновую кислоту; триазиквон; 2,2',2”-трихлортриэтиламин; трихотецены (в частности токсин T-2, верракурин A, роридин A и ангуидин); уретан; виндезин; дакарбазин; манномустин; митобронитол; митолактол; пипоброман; гацитозин; арабинозид («ara-C»); циклофосфамид; тиотепа; таксоиды, например, паклитаксел TAXOL® (Bristol-Myers Squibb Oncology, Princeton, N.J.), не содержащий кремофора ABRAXANETM, препарат паклитаксела на основе сконструированных связанных с альбумином наночастиц (American Pharmaceutical Partners, Schaumberg, Ill.), и доксетаксел TAXOTERE® (Rhone-Poulene Rorer, Antony, France); хлорамбуцил; гемцитабин (GEMZAR®); 6-тиогуанин; меркаптопурин; метотрексат; аналоги платины, такие как цисплатин и карбоплатин; винбластин; платину; этопозид (VP-16); ифосфамид; митоксантрон; винкристин; винорелбин (NAVELBINE®); новантрон; тенипозид; эдатрексат; дауномицин; аминоптерин; капецитабин XELODA®; ибандронат; CPT-11; ингибитор топоизомеразы RFS 2000; дифторметилорнитин (DMFO); ретиноиды, такие как ретиноевая кислота; и фармацевтически приемлемые соли, кислоты и производные любого агента, указанного выше.
Также в указанное определение включены противогормональные средства, которые действуют, регулируя или ингибируя действие гормонов на опухоли, такие как антиэстрогены и избирательные модуляторы рецепторов эстрогена (SERM), включая, например, тамоксифен (включая тамоксифен NOLVADEX®), ралоксифен, дролоксифен, 4-гидрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон и торемифен FARESTON®; ингибиторы ароматазы, которые ингибируют фермент ароматазу, которая регулирует продукцию эстрогена в надпочечниках, такие как, например, 4(5)-имидазолы, аминоглутетимид, ацетат мегестрола MEGASE®, экземестан AROMASIN®, форместан, фадрозол, ворозол RIVISOR®, летрозол FEMARA® и анастрозол ARIMIDEX®; и антиандрогены, такие как флутамид, нилутамид, бикалутамид, лейпролид и гозерелин; а также троксацитабин (1,3-диоксолановый нуклеозидный аналог цитозина); антисмысловые олигонуклеотиды, в частности олигонуклеотиды, которые ингибируют экспрессию генов в путях передачи сигналов, вовлеченных в пролиферацию аберрантных клеток, таких как, например, PKC-альфа, Ralf, H-Ras; рибозимы, такие как ингибитор экспрессии VEGF (например, рибозим ANGIOZYME®) и ингибитор экспрессии HER2; вакцины, такие как вакцины для генной терапии, например вакцина ALLOVECTIN®, вакцина LEUVECTIN® и вакцина VAXID®; rIL-2 PROLEUKIN®; ингибитор топоизомеразы 1 LURTOTECAN®; rmRH ABARELIX®; и фармацевтически приемлемые соли, кислоты или производные любого из указанных выше средств.
В частности, трансформирующий фактор роста (TGF)-β проявляет ряд плейотропных эффектов в отношении клеточных функций, таких как пролиферация, гомеостаз, ангиогенез и заживление ран. Аномальная регуляция функции TGF-β вносит вклад в прогрессирование злокачественной опухоли. Большинство злокачественных опухолей характеризуются избыточной продукцией трансформирующего фактора роста-β опухолями, который может стимулировать рост опухолей и опосредовать перенос из эпителия в мезенхиму. TGF-β также играет ведущую роль в поддержании толерантности иммунной системы посредством регуляции пролиферации, дифференцировки и жизнеспособности лимфоцитов. Доказано, что TGF-β является важным супрессирующим элементом в усилении функции Treg и ослаблении опухолевого иммунитета. Предполагается введение ингибиторов TGF-β вместе с агонистами GITR, например, антителами.
Также предполагается совместное введение с противовирусными терапевтическими средствами. Противовирусные средства включают любое лекарственное средство, которое разрушает вирусы. Противовирусные средства могут включать интерфероны, которые функционируют, ингибируя репликацию вируса, ингибиторы протеаз и ингибиторы обратной транскриптазы или средства, входящие в сочетание с высокоактивной противоретровирусной терапией (HAART) в случае ВИЧ.
Типичные объекты ветеринарии, экспериментов или исследований включают обезьян, собак, кошек, крыс, мышей, кроликов, морских свинок, лошадей и человека.
VII. Получение антител
В одном варианте осуществления для получения антител согласно настоящему изобретению способами на основе рекомбинации нуклеиновые кислоты, кодирующие две цепи, выделяют и встраивают в один или несколько реплицирующихся векторов для дальнейшего клонирования (амплификации ДНК) или для экспрессии. ДНК, кодирующую моноклональное антитело, легко выделяют и секвенируют, используя обычные способы (например, используя олигонуклеотидные зонды, которые способны специфично связываться с генами, кодирующими тяжелые и легкие цепи антитела). Имеется множество векторов. Компоненты векторов обычно включают без ограничения один или несколько из следующих компонентов: сигнальная последовательность, начало репликации, один или несколько маркерных генов, энхансерный элемент, промотор и последовательность терминации транскрипции. В одном варианте осуществления и легкая и тяжелая цепи гуманизированного анти-GITR-антитела согласно настоящему изобретению экспрессируются с одного и того же вектора, например, плазмидного или аденовирусного вектора.
Антитела согласно настоящему изобретению могут быть получены любым способом, известным в данной области. В одном варианте осуществления антитела экспрессируют в клетках млекопитающих или насекомых в культуре, таких как клетки яичника китайского хомячка (CHO), клетки эмбриональной почки человека (HEK) 293, клетки миеломы мышей NSO, клетки почки сирийского хомячка (BHK), клетки яичника Spodoptera frugiperda (Sf9). В одном варианте осуществления антитела, секретируемые из клеток CHO, извлекают и очищают стандартными хроматографическими способами, такими как хроматография на белке A, катионообменная, анионообменная хроматография, хроматография на основе гидрофобного взаимодействия и хроматография на гидроксиапатите. Полученные антитела концентрируют и хранят в 20 мМ ацетате натрия, pH 5,5.
В другом варианте осуществления антитела согласно настоящему изобретению получают в дрожжах согласно способам, описанным в WO2005/040395. Коротко, векторы, кодирующие отдельные легкие или тяжелые цепи представляющего интерес антитела, вводят в разные гаплоидные клетки дрожжей, например, дрожжей Pichia pastoris с разными типами спаривания, и такие гаплоидные клетки дрожжей необязательно являются комплементируемыми ауксотрофами. Затем трансформированные гаплоидные клетки дрожжей можно спаривать или сливать с получением диплоидной дрожжевой клетки, способной продуцировать и тяжелые и легкие цепи. После этого диплоидная линия способна секретировать полностью собранное и биологически активное антитело. Относительные уровни экспрессии двух цепей могут быть оптимизированы, например, с использованием векторов с разным числом копий, с использованием транскрипционных промоторов разной силы или индуцируя экспрессию с индуцируемых промоторов, управляющих транскрипцией генов, кодирующих одну или обе цепи.
В одном варианте осуществления соответствующие тяжелые и легкие цепи множества разных анти-GITR-антител («исходных» антител) вводят в дрожжевые гаплоидные клетки, создавая библиотеку гаплоидных штаммов дрожжей одного типа спаривания, экспрессирующих множество легких цепей, и библиотеку гаплоидных штаммов дрожжей с другим типом спаривания, экспрессирующих множество тяжелых цепей. Такие библиотеки гаплоидных штаммов можно спаривать (или сливать в виде сферопластов), получая серию диплоидных дрожжевых клеток, экспрессирующих комбинаторную библиотеку антител, состоящую из различных возможных перестановок легких и тяжелых цепей. Комбинаторная библиотека антител затем может быть подвергнута скринингу для того, чтобы определить, обладает ли какое-либо из антител свойствами, которые превосходят (например, более высокая аффинность по отношению к GITR) свойства исходных антител. Смотри, например, WO2005/040395.
В другом варианте осуществления антитела согласно настоящему изобретению представляют собой человеческие доменные антитела, в которых части вариабельного домена антитела связаны с образованием полипептида с молекулярной массой примерно 13 кДа. Смотри, например, публикацию патента США № 2004/0110941. Такие однодоменные низкомолекулярные средства обеспечивают многочисленные преимущества, связанные с простым синтезом, стабильностью и путем введения.
III. Применения
Настоящее изобретение относится к способам применения анти-GITR-антител и их фрагментов для лечения и диагностики пролиферативных или воспалительных нарушений и состояний.
Настоящее изобретение относится к способам диагностики наличия микробной инфекции или злокачественной опухоли посредством анализа уровней экспрессии GITR в тестируемых клетках, ткани или жидкостях организма по сравнению с уровнями GITR в клетках, тканях или жидкостях организма предпочтительно такого же типа в контроле. Как показано в настоящем описании, увеличение уровня экспрессии GITR, например, у пациента по сравнению с контролем, ассоциировано с присутствием злокачественной опухоли.
Обычно в случае количественного диагностического анализа позитивным результатом, свидетельствующим о том, что проходящий исследование пациент имеет злокачественную опухоль или инфекционную болезнь, является результат, когда клетки, ткани или жидкости организма имеют уровень экспрессии GITR по меньшей мере в два раза выше, в пять раз выше, в десять раз выше, в пятнадцать раз выше, в двадцать раз выше, в двадцать пять раз выше.
Способы анализа, которые можно применять для определения уровней экспрессии гена и белка, такого как GITR согласно настоящему изобретению в образце, полученном от хозяина, хорошо известны специалистам в данной области. Такие способы анализа включают радиоиммуноанализы, анализы ПЦР с обратной транскриптазой (ОТ-ПЦР), количественные ПЦР-анализы в реальном времени, иммуногистохимические анализы, анализы гибридизации in situ, анализы конкурентного связывания, вестерн-блот-анализы, анализы ELISA и проточно-цитометрические анализы, например, анализы FACS с двумя красителями для фенотипирования ассоциированных с опухолями макрофагов M2 и M1 (Mantovani et al., (2002) TRENDS in Immunology 23: 549-555).
Анализ ELISA включает сначала получение антител согласно настоящему изобретению, специфичных к GITR, предпочтительно 36E5, 3D6, 61G6, 6H6, 61F6, 1D8, 17F10, 35D8, 49A1, 9E5 и 31H6 (вместе называемых «GITR-антителами»). Кроме того, обычно получают репортерное антитело, которое специфично связывается с GITR. Репортерное антитело связывают с детектируемым реагентом, таким как радиоактивный, флуоресцирующий или ферментативный реагент, например, фермент пероксидаза хрена или щелочная фосфатаза.
Для осуществления ELISA по меньшей мере одно из GITR-антител, описанных выше, инкубируют на твердой подложке, например, чашке из полистирола, которая связывает антитело. Затем любые свободные участки связывания белков на чашке покрывают, инкубируя с неспецифичным белком, таким как бычий сывороточный альбумин. Затем анализируемый образец инкубируют в чашке, при этом в течение определенного периода времени GITR связывается со специфичным GITR-антителом, связанным чашкой из полистирола. Несвязанный образец отмывают буфером. Репортерное антитело, специфично направленное к GITR и связанное с пероксидазой хрена, помещают в чашку, что приводит к связыванию репортерного антитела с каким-либо моноклональным антителом, связанным с GITR. Затем несвязанное репортерное антитело отмывают. Затем в чашку добавляют реагенты для определения пероксидазной активности, включая калориметрический субстрат. Иммобилизованная пероксидаза, связанная с GITR-антителами, дает окрашенный продукт реакции. Количество окраски, развившейся за определенный период времени, пропорционально количеству белка GITR, присутствующего в образце. Количественные результаты обычно получают, обращаясь к стандартной кривой.
Конкурентный анализ можно применять, когда антитела, специфичные к GITR, связывают с твердой подложкой и меченый GITR и образец, полученный от хозяина, пропускают над поверхностью твердой подложки, и количество выявляемой метки, связанной с твердой подложкой, может коррелировать с количеством GITR в образце.
Описанные выше тесты можно осуществлять на образцах, полученных из различных клеток, жидкостей организма и/или экстрактов тканей, таких как гомогенаты или солюбилизированная ткань, полученная от пациента. Экстракты тканей получают обычным способом из биопсии ткани и материала аутопсии. Жидкости организма, применимые в настоящем изобретении, включают кровь, мочу, слюну или любой другой материал секреции организма или его производное. Подразумевают, что термин «кровь» включает цельную кровь, плазму, сыворотку или любое производное крови.
Антитела согласно настоящему изобретению можно применять для лечения вирусных инфекций. Инфекция ВИЧ характеризуется дефектами в формировании и поддержании центральных клеток памяти. Центральные клетки памяти CD8+ имеют более короткое время полужизни и менее распространены у ВИЧ-инфицированных людей, чем в контроле. Также частота встречаемости ВИЧ-специфичных T-клеток CD4+ и CD8+ быстро снижается после начала высокоактивной противоретровирусной терапии (HAART). Костимуляция CD4+ анти-GITR-антителами может обеспечивать механизм увеличения ответа клеток памяти CD8+ и вносить вклад в элиминацию вируса. Было показано, что лечение персистентно инфицированных вирусом Фрейнда мышей анти-GITR-антителом для снижения супрессии клетками Treg значимо повышает продукцию IFN-γ T-клетками CD8+ и обеспечивает значимое снижение вирусной нагрузки (Dittmer et al., (2004) Immunity 20: 293-303).
Другим признаком ВИЧ-инфекции является массивный апоптоз T-клеток CD4+, начинающийся на ранних этапах ВИЧ-инфекции. Прогрессирующее апоптозное удаление T-клеток CD4 вносит вклад в ослабление ВИЧ-специфичных клеточных иммунных ответов и в развитие СПИДа. Показано, что костимуляция GITR усиливает секрецию мышиных цитокинов, специфичных для антигена, благодаря защите T-клеток от апоптоза. Lahey с соавторами (2007) (J. Infect. Dis. 196: 43-49) показали, что обработка анти-GITR-антителами ВИЧ-специфичных T-клеток CD4+ усиливает экспрессию их цитокинов и защищает их от апоптоза.
В случае инфекций, причиной которых являются вирусы, антитела согласно изобретению можно сочетать, применяя их одновременно, перед или после применения стандартных способов терапии для лечения вирусных инфекций. Такие стандартные способы терапии варьируют в зависимости от типа вируса, хотя почти во всех случаях эффективным может быть введение сыворотки человека, содержащей антитела (например, IgA, IgG), специфичные по отношению к вирусу.
Инфекция вирусом гриппа приводит к лихорадке, кашлю, миалгии, головной боли и недомоганию, которые часто встречаются при сезонных эпидемиях. Грипп также ассоциирован с несколькими постинфекционными нарушениями, такими как энцефалит, миоперикардит, синдром Гудпасчера и синдром Рея. Инфекция вирусом гриппа также подавляет нормальную легочную противобактериальную защиту, так что для пациента, выздоравливающего от гриппа, существует повышенный риск развития бактериальной пневмонии.
Поверхностные белки вируса гриппа проявляют заметную антигенную вариабельность, возникающую в результате мутации и рекомбинации. Таким образом, цитолитические T-лимфоциты являются основным средством хозяина для элиминации вируса после инфекции. Вирус гриппа классифицируют на три основных типа: A, B и C. Вирус гриппа A является уникальным в том отношении, что он инфицирует как людей, так и многих других животных (например, свиней, лошадей, птиц и тюленей) и является основной причиной пандемического гриппа. Также, когда клетка инфицирована двумя разными штаммами вируса гриппа A, сегментированные РНК-геномы двух исходных типов вирусов смешиваются во время репликации, создавая гибридный продукт репликации и приводя к появлению новых эпидемических штаммов. Вирус гриппа B не реплицируется у животных и, следовательно, имеет меньшую генетическую вариабельность, а вирус гриппа C имеет только один серотип.
Большинство обычных способов терапии являются паллиативными в отношении симптомов, возникающих в результате инфекции, тогда как иммунный ответ хозяина действительно устраняет заболевание. Однако некоторые штаммы (например, вируса гриппа A) могут вызывать более серьезное заболевание и гибель. Грипп A можно лечить клинически и профилактически посредством введения ингибирующих циклических аминов амантадина и римантадина, которые ингибируют репликацию вирусов. Однако клиническое применение таких лекарственных средств ограничено вследствие относительно высокой частоты возникновения неблагоприятных реакций, их узкого противовирусного спектра (только вирус гриппа A) и склонности вируса к появлению резистентности. Введение сывороточного IgG-антитела к основным поверхностным белкам вируса гриппа, гемагглютинину и нейраминидазе, может предотвращать легочную инфекцию, тогда как IgA слизистой оболочки необходим для предотвращения инфекции верхних дыхательных путей и трахеи. Наиболее эффективным современным способом лечения гриппа является вакцинация с использованием введения вируса, инактивированного формалином или β-пропиолактоном.
После инкубации в течение 9-11 дней у хозяев, инфицированных вирусом кори, развивается лихорадка, кашель, ринит и конъюнктивит. В течение 1-2 дней развиваются эритематозная макулопопулезная сыпь, которая быстро распространяется по всему телу. Поскольку инфекция также подавляет клеточный иммунитет, у хозяина появляется еще больший риск развития бактериальных суперинфекций, включая отит среднего уха, пневмонию и постинфекционный энцефаломиелит. Острая инфекция ассоциирована со значительной заболеваемостью и смертностью, особенно у подростков при плохом питании.
Лечение кори включает пассивное введение суммарного IgG человека, который может предотвращать инфекцию у неиммунных субъектов, даже если введение осуществлено через неделю после воздействия.
Однако предварительная иммунизация живым аттенуированным вирусом является наиболее эффективным способом лечения и предотвращает заболевание более чем у 95% иммунизированных. Так как существует один серотип такого вируса, то одна иммунизация или инфекция обычно приводит к защите в течение всей жизни от последующей инфекции.
У небольшой части инфицированных хозяев корь может развиваться в SSPE, который является хроническим прогрессирующим неврологическим нарушением, возникающим в результате персистирующей инфекции центральной нервной системы. SSPE вызывают клональные варианты вируса кори с дефектами, которые мешают сборке и отпочкованию вирионов. Для таких пациентов может быть желательная реактивация T-клеток антителами согласно изобретению, чтобы облегчить элиминацию вирусов.
Вирус гепатита B (HB-V) является наиболее инфекционным из известных переносимых кровью патогенов. Он является основной причиной острого и хронического гепатита и карциномы печени, а также пожизненной хронической инфекции. После инфекции вирус реплицируется в гепатоцитах, которые затем также выделяют поверхностный антиген HBsAg. Выявление избыточных уровней HBsAg в сыворотке используют в качестве стандартного способа диагностики инфекции гепатита B. Острая инфекция может разрешаться или может развиваться в хроническую персистирующую инфекцию.
Современное лечение хронического HBV включает использование α-интерферона, который увеличивает экспрессию лейкоцитарных антигенов человека (HLA) класса I на поверхности гепатоцитов, тем самым облегчая их узнавание цитотоксическими T-лимфоцитами. Кроме того, аналоги нуклеозидов ганцикловир, фамцикловир и ламивудин также проявляли некоторую эффективность в лечении HBV-инфекции в клиническом испытании. Дополнительные средства лечения HBV включают пегилированный α-интерферон, аденфовир, энтекавир и телбивудин. В то время как пассивный иммунитет можно придать в результате парентерального введения сывороточных антител против HBsAg, вакцинация инактивированным или рекомбинантным HBsAg также придает устойчивость к инфекции. Антитела согласно изобретению можно сочетать с обычными средствами лечения инфекций гепатита B для получения терапевтического преимущества.
Инфекция вирусом гепатита C (HC-V) может приводить к хронической форме гепатита и в результате к циррозу. Хотя симптомы сходны с инфекциями вирусами гепатита B, в отличие от HB-V инфицированные хозяева могут оставаться без симптомов на протяжении 10-20 лет. Лечение инфекции HC-V включает введение сочетания α-интерферона и рибавирина. Многообещающим потенциальным терапевтическим средством для лечения инфекции HC-V является ингибитор протеазы телапревир (VX-960). Дополнительные средства лечения включают: анти-PD-1-антитело (MDX-1106, Medarex), бавитуксимаб (антитело, которое связывает анионный фосфолипид фосфатидилсерин зависимым от B2-гликопротеида I образом, Peregrine Pharmaceuticals), антитело (антитела) против белка E2 оболочки вируса HPV (например, ATL 6865-Ab68+Ab65, XTL Pharmaceuticals) и Civacir® (поликлональный иммуноглобулин человека против HCV). Антитела согласно изобретению можно сочетать с одной или несколькими из указанных средств лечения инфекции вирусом гепатита C для получения терапевтического преимущества.
Широкий объем настоящего изобретения лучше понятен при обращении к следующим примерам, которые не предназначены для ограничения изобретения конкретными вариантами. Конкретные варианты, описанные в настоящей публикации, предлагаются только в качестве примера, и изобретение ограничено прилагаемой формулой изобретения, наряду с полным объемом эквивалентов, на которые дает право формула изобретения.
ПРИМЕРЫ
Пример 1
Общие способы
Стандартные способы молекулярной биологии описаны.

Стандартные способы также описаны Ausbel с соавторами (2001) (Current Protocols in Molecular Biology, Vols.1-4, John Wiley and Sons, Inc. New York, NY), которые описали клонирование в бактериальных клетках и мутагенез ДНК (том 1), клонирование в клетках млекопитающих и дрожжей (том 2), экспрессию гликоконъюгатов и белков (том 3) и способы биоинформатики (том 4).
Способы очистки белков, включая иммунопреципитацию, хроматографию, электрофорез, центрифугирование и кристаллизацию, описаны. Coligan с соавторами (2000) Current Protocols in Protein Science, Vol. I, John Wiley and Sons, Inc., New York. Химический анализ, химическая модификация, посттрансляционная модификация, получение слитых белков, гликозилирование белков описаны. Смотри, например,

Получение, очистка и фрагментация поликлональных и моноклональных антител описаны. Coligan et al. (2001) Current Protocols in Immunology, Vol. I, John Wiley and Sons, Inc., New York; Harlow and Lane (1999) Using Antibodies, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Harlow and Lane, выше. Имеются стандартные способы характеристики взаимодействий лиганд/рецептор. Смотри, например, Coligan et al. (2001) Current Protocols in Immunology, Vol. 4, John Wiley, Inc., New York.
Доступны способы проточной цитометрии, включая системы регистрации на основе активируемой флуоресценцией сортировки клеток (FACS®). Смотри, например, Owens et al. (1994) Flow Cytometry Principles for Clinical Laboratory Practice, John Wiley and Sons, Hoboken, NJ; Givan (2001) Flow Cytometry, 2nd ed.; Wiley-Liss, Hoboken, NJ; Shapiro (2003) Practical Flow Cytometry, John Wiley and Sons, Hoboken, NJ. Имеются флуоресцирующие реагенты, подходящие для модификации нуклеиновых кислот, включая праймеры и зонды нуклеиновых кислот, полипептидов и антител для применения, например, в качестве диагностических реагентов. Molecular Probes (2003) Catalogue, Molecular Probes, Inc., Eugene, OR; Sigma-Aldrich (2003) Catalogue, St. Louis, MO.
Описаны стандартные способы гистологии иммунной системы. Смотри, например,

Имеются компьютерные программы и базы данных для определения, например, антигенных фрагментов, лидерных последовательностей, фолдинга белка, функциональных доменов, сайтов гликозилирования и выравнивания последовательностей. Смотри, например, GenBank, пакет Vector NTI® (Informax, Inc, Bethesda, MD); пакет GCG Wisconsin (Accelrys, Inc., San Diego, CA);

Пример 2
Гуманизация антител против GITR человека
Гуманизация антител в общем описана, например, в публикациях заявок на выдачу патента PCT WO 2005/047324 и WO 2005/047326.
Коротко, аминокислотную последовательность домена VH животного, отличного от человека, (например, SEQ ID NO: 1-11) сравнивают с группой из пяти аминокислотных последовательностей VH зародышевой линии человека; по одному представителю из подгрупп IGHV1 и IGHV4 и три представителя из подгруппы IGHV3. Подгруппы VH перечислены в M.-P. Lefranc (2001) «Nomenclature of the Human Immunoglobulin Heavy (IGH) Genes», Experimental and Clinical Immunogenetics 18: 100-116. Каркасные последовательности из последовательности зародышевой линии человека с наилучшими совпадениями использовали для конструирования гуманизированного домена VH.
Анти-huGITR-антитела грызунов, описанные в настоящей публикации, все относятся к подклассу каппа VL. Аминокислотные последовательности домена VL животного, отличного от человека, (например, SEQ ID NO: 12-22) сравнивают с группой из четырех аминокислотных последовательностей зародышевой линии каппа VL человека. Группа из четырех последовательностей включает по одному представителю из каждой из четырех установленных подгрупп VL человека, перечисленных в

Четыре подгруппы также соответствуют четырем подгруппам, перечисленным в публикации Kabat с соавторами (1991 - 5th Ed.) («Sequences of Proteins of Immunological Interest», U. S. Department of Health and Human Services, NIH Pub. 91-3242, pp. 103-130). Каркасные последовательности из последовательности зародышевой линии человека с наилучшим совпадением использовали для конструирования гуманизированного домена VL.
После определения аминокислотных последовательностей-мишеней вариабельной области тяжелой и легкой цепей могут быть созданы плазмиды, кодирующие полноразмерное гуманизированное антитело. Плазмидные последовательности могут быть изменены с использованием мутагенеза, описанного Kunkel (смотри, например, Kunkel T. A. (1985) Proc. Natl. Acad. Sci. U.S.A 82: 488-492), чтобы заменить последовательность ДНК на целевые последовательности гуманизированного антитела. Одновременно может быть осуществлена оптимизация кодонов, чтобы обеспечить возможную оптимальную экспрессию.
Антитела согласно настоящему изобретению могут быть гуманизированы с использованием способа, в котором идентифицируют акцепторную последовательность зародышевой линии для гуманизированного антитела и который включает стадии: a) идентификации антитела животного, отличного от человека, которое обладает требуемой биологической активностью; b) определения аминокислотной последовательности доменов VH и VL антитела животного, отличного от человека; и c) сравнения последовательности антитела животного, отличного от человека, с группой последовательностей зародышевой линии человека, при этом сравнение включает подстадии: 1) определения номеров остатков V-последовательностей животного, отличного от человека, согласно Кабату (выше); 2) картирования областей CDR и FR в последовательности согласно Кабату (выше); 3) присвоения предварительно определяемой оценки в баллах конкретному положению остатка, по которому последовательности зародышевой линии антитела животного, отличного от человека, и антитела человека являются идентичными; и 4) суммирования всех оценок остатков, чтобы получить суммарную оценку для каждой последовательности зародышевой линии человека; и d) идентификации последовательности зародышевой линии человека с наивысшей суммарной оценкой остатков в качестве акцепторной последовательности зародышевой линии. В одном варианте осуществления способ дополнительно включает подстадии: 5) присвоения оценки в 1 балл каждому положению остатка FR, по которому последовательности зародышевой линии антитела животного, отличного от человека, и антитела человека являются идентичными, которые не были оценены на подстадии (3), в последовательностях зародышей линии с идентичными суммарными оценками остатков в баллах после подстадии (4); 6) суммирования всех оценок остатков в баллах для получения общей оценки для каждой последовательности зародышевой линии человека. В конкретном варианте осуществления антитело животного, отличного от человека, является специфичным для GITR и усиливает биологическую активность GITR. Также в настоящем изобретении предлагается антитело, полученное описанным выше способом.
В одном варианте осуществления GITR-антитело гуманизируют, используя следующий способ. Сначала домены VL и VH GITR-антитела животного, отличного от человека, клонируют и секвенируют и определяют аминокислотную последовательность. Затем последовательность VH животного, отличного от человека, сравнивают с группой из трех аминокислотных последовательностей VH зародышевой линии человека. Группа из трех последовательностей включает по одному представителю из каждой подгруппы IGHV1, IGHV3 и IGHV4. Подгруппы VH перечислены в M.-P. Lefranc, Exp. Clin. Immunogenetics, 18: 100-116 (2001). В частности, сравнение с тремя последовательностями зародышевой линии начинается с определения номеров остатков в последовательности VH животного, отличного от человека, согласно системе нумерации по Кабату. Смотри Kabat, et al., U. S. Department of Health and Human Services, NIH Pub. 91-3242 (5th Ed., 1991). Затем последовательность VH животного, отличного от человека, выравнивают с каждой из трех последовательностей зародышевой линии человека. Так как V-гены содержат только остатки VH 1-94, то при выравнивании учитывают только указанные остатки. Затем определяют границы определяющих комплементарность областей (CDR) и каркасных областей (FR) согласно сочетанию определений, предложенных в публикациях Kabat et al., U. S. Department of Health and Human Services, NIH Pub. 91-3242 (5th Ed., 1991) и C. Chothia and A.M. Lesk, J. Mol. Biol., 196: 901-917 (1987). Таким образом, используют следующее определение CDR: остатки 26-35 для CDR1, остатки 50-65 для CDR2 и остатки 95-102 для CDR3 в домене VH. Следующая стадия заключается в определении оценок в баллах для идентифицированных положений остатков, по которым последовательности животного, отличного от человека, и последовательности человека являются идентичными. Один пример такой оценки показан в таблице 4 ниже.
После определения оценки в баллах для положений остатков все оценки остатков суммируют. Акцепторной последовательностью зародышевой линии является последовательность с самой высокой общей оценкой. В том случае, когда две или более последовательностей зародышевой линии имеют идентичные оценки, добавляют 1 балл к сумме для каждого положения, в котором последовательность животного, отличного от человека, и последовательность человека являются ИДЕНТИЧНЫМИ, в случае следующих остатков FR: 1-23, 25, 36, 38-47, 66, 68, 70, 72, 74, 75, 77 и 79-93 (максимум 60). Оценки остатков снова суммируют, и акцепторной последовательностью зародышевой линии является последовательность с наибольшей общей оценкой. Если две или больше последовательностей зародышевой линии все же имеют идентичные оценки, то любую из них можно использовать в качестве акцепторной последовательности зародышевой линии.
Если последовательность VL является представителем подкласса каппа VL, последовательность VL животного, отличного от человека, из GITR-специфичного антитела сравнивают с группой из четырех аминокислотных последовательностей зародышевой линии VL каппа человека. Четыре последовательности включают по одному представителю из каждой из четырех установленных подгрупп VL человека, указанных в V. Barbie and M.-P. Lefranc, Exp. Clin. Immunogenetics L5: 171-183 (1998) и M.-P. Lefranc, Exp. Clin. Immunogenetics 18: 161-174 (2001). Четыре последовательности также соответствуют четырем подгруппам, указанным в Kabat et al., U. S. Department of Health and Human Services, NIH Pub. 91-3242, pp. 103-130 (5th Ed., 1991). Сравнение последовательности животного, отличного от человека, с четырьмя последовательностями зародышевой линии начинается с присвоения номеров остатков остаткам последовательности VL животного, отличного от человека, согласно системе Кабата (Kabat et al., U. S. Department of Health and Human Services, NIH Pub. 91-3242 (5th Ed., 1991)). Затем последовательности VL животного, отличного от человека, выравнивают с каждой из четырех последовательностей зародышевой линии человека. Так как V-гены содержат только остатки VL 1-95, то при выравнивании учитывают только указанные остатки. Затем в последовательности определяют границы определяющих комплементарность областей (CDR) и каркасных областей (FR). Границы CDR и FR определяют согласно сочетанию определений, предложенных в публикациях Kabat et al., U. S. Department of Health and Human Services, NIH Pub. 91-3242 (5th Ed., 1991) и C. Chothia and A.M. Lesk, J. Mol. Biol., 196: 901-917 (1987). Таким образом, используют следующее определение CDR: остатки 24-34 для CDR1, остатки 50-56 для CDR2 и остатки 89-97 для CDR3 в домене VL. Следующая стадия заключается в определении оценок в баллах для идентифицированных положений остатков, по которым последовательности животного, отличного от человека, и последовательности человека являются идентичными. Один пример такой оценки показан в таблице 5 ниже.
После определения оценки в баллах для положений остатков все оценки остатков суммируют. Акцепторной последовательностью зародышевой линии является последовательность с самой высокой общей оценкой. В том случае, когда две или более последовательностей зародышевой линии имеют идентичные оценки, добавляют 1 балл к сумме для каждого положения, в котором последовательность животного, отличного от человека, и последовательность человека являются ИДЕНТИЧНЫМИ, в случае следующих остатков FR: 1-3, 5-23, 35-42, 44-49, 57, 59-88 (максимум 67). Оценки остатков снова суммируют, и акцепторной последовательностью зародышевой линии является последовательность с наибольшей общей оценкой. Если две или больше последовательностей зародышевой линии все же имеют идентичные оценки, то любую из них можно использовать в качестве акцепторной последовательности зародышевой линии.
Указанные выше исходные моноклональные антитела гуманизировали, используя указанный способ. Последовательности SEQ ID NO: 90, 92, 94, 96, 98, 100, 102, 104, 106, 108 и 110 представляют собой последовательности полипептидов вариабельной области тяжелой цепи, и последовательности SEQ ID NO: 91, 93, 95, 97, 99, 101, 103, 105, 107, 109 и 111 представляют собой последовательности вариабельных областей легкой цепи.
Пример 3
Определение равновесной константы диссоциации (K d ) для антител против GITR человека с использованием методики KinExA
Равновесные константы диссоциации (Kd) для антител против GITR человека определяли, используя устройство KinExA 3000. Sapidyne Instruments Inc., Boise Idaho, USA. В KinExA использован принцип способа кинетического эксклюзионного анализа, основанного на измерении концентрации не образующего комплекса антитела в смеси антитела, антигена и комплекса антитело-антиген. Концентрацию свободного антитела измеряют, экспонируя смесь с иммобилизованным на твердой фазе антигеном в течение очень короткого периода времени. На практике это осуществляют, пропуская смесь антиген-антитело в растворе через покрытые антигеном частицы, захваченные в проточную ячейку. Данные, регистрируемые на приборе, анализируют, используя специальное программное обеспечение. Равновесные константы вычисляют, используя математическую теорию, основанную на следующих допущениях:
1. Связывание подчиняется уравнению обратимого связывания для равновесия:
kon[Ab][Ag]=koff[AbAg]
2. Антитело и антиген связываются 1:1, и общее количество антитела равно количеству антитела в комплексе антиген-антитело плюс количество свободного антитела.
3. Сигнал прибора линейно связан с концентрацией свободного антитела.
Частицы PMMA (Sapidyne, № в каталоге 440198) покрывают биотинилированным GITR (или его фрагментом, таким как внеклеточный домен) согласно протоколу Sapidyne «Protocol for coating PMMA particles with biotinylated ligands having short or nonexistent linker arms». EZ-link TFP PEO-биотин (Pierce, № в каталоге 21219) используют для биотинилирования GITR согласно рекомендациям производителя (Pierce bulletin 0874).
Пример 4
Определение равновесной константы диссоциации (Kd) для гуманизированных антител против GITR человека с использованием методики BIAcore
Определения BIAcore осуществляют по существу как описано в примере 4 в одновременно находящейся на рассмотрении заявке на выдачу патента США № 11/511635 (поданной 29 августа 2006). Коротко, партнеров в связывании иммобилизуют на сенсорном чипе BIAcore CM5, используя стандартный способ связывания аминов. Кинетические константы для различных взаимодействиий определяют, используя компьютерную программу BIAevaluation 3.1. Kd определяют, используя вычисленные константы скорости диссоциации и ассоциации.
GITR-антитела 36E5, 3D6, 61G6, 6H6, 61F6, 1D8, 17F10, 35D8, 49A1, 9E5 и 31H6 имели следующие значения Kd:
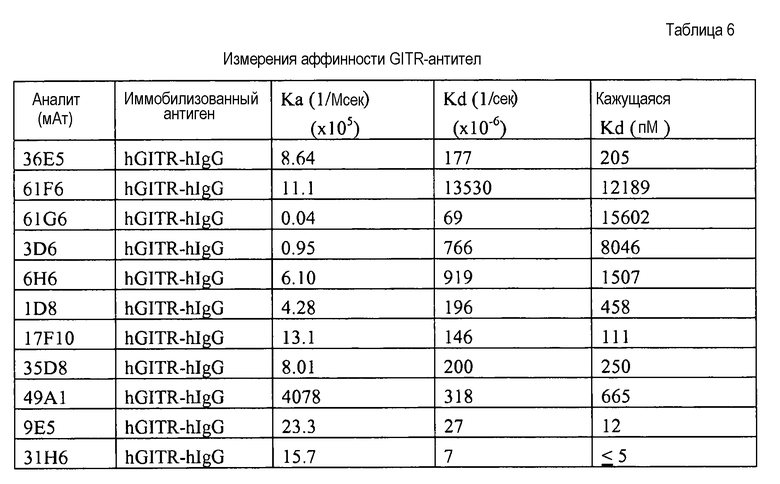
Пример 5
Биоанализы для оценки активации анти-GITR-антител
Способность моноклонального антитела биологически усиливать активность GITR оценивали на основании влияния на пролиферацию наивных T-клеток (смотри, например, Ito et al., (2006) PNAS 103(35): 13138-43). Наивные T-клетки CD4+ выделяли из мононуклеарных клеток периферической крови (PBMC) центрифугированием на фиколе с последующим использованием набора для выделения наивных T-клеток CD4 STEMCELL Technologies.
В 96-луночных планшетах для культивирования ткани с плоским дном 2×104 свежеочищенных наивных T-клеток CD4 культивировали совместно с облученными CD32-экспрессирующими L-клетками в присутствии анти-hGITR-антитела или антитела для контроля изотипа, которые были предварительно покрыты анти-CD3.
В таблицах 7A и 7B показано влияние различных доз анти-GITR-антител на пролиферацию наивных T-клеток CD4+ (KM4-R63 является антителом для контроля изотипа).
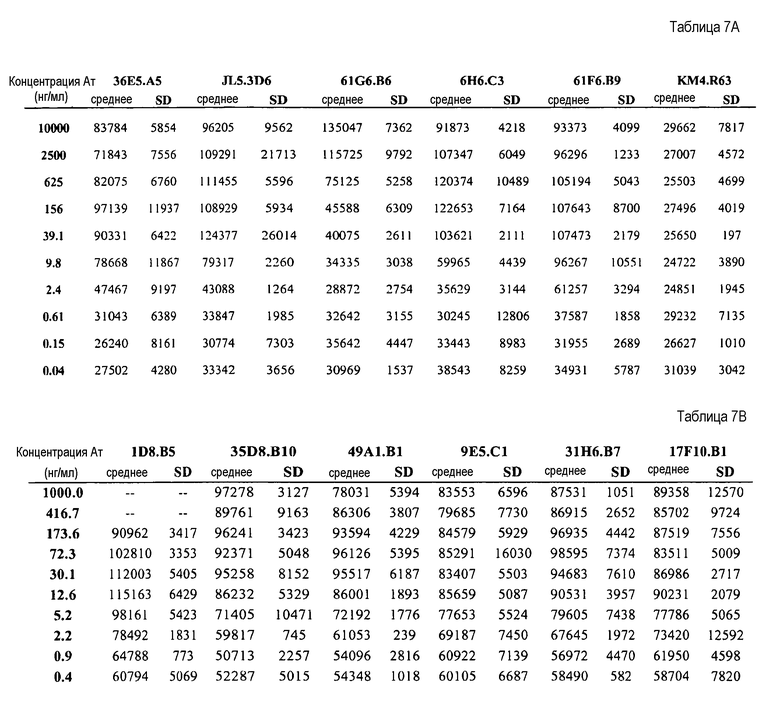
Пример 5
Лечение опухолей антителами к TGF-β и GITR
Предварительные исследования показали, что при экспрессии генов опухолей 4T1 имели место повышенные уровни мРНК TGF-β. Была выдвинута гипотеза о том, что иммунная костимуляция анти-GITR-агонистом в сочетании с удалением подавления иммунного ответа при ингибировании передачи сигнала TGF-β может индуцировать синергетическую противоопухолевую эффективность.
Для проверки такой гипотезы 1,5×105 клеток опухоли 4T1 подкожно имплантировали в правый бок мышей Balb/C. Через четыре или семь дней после имплантации опухолей инъецировали нейтрализующее антитело к мышиному TGF-β (1D11; Bioexpress) в концентрации 100 мкг/200 мкл подкожно в шею и повторяли каждые три дня, всего 7 доз. Агонистическое антитело против GITR мыши, DTA-1, инъецировали на 7, 14 и 21 день в концентрации 500 мкг/200 мкл. Объем опухоли измеряли каждые три дня. Как показано в таблице 8 ниже, DTA-1 или анти-TGF-β по отдельности оказывают небольшое влияние. Комбинированная обработка индуцирует синергетическое влияние в случае использования любых дней для начальной обработки анти-TGF-β-антителом (4 день или 7 день после имплантации опухолей). Приведены значения объема опухолей (мм3).
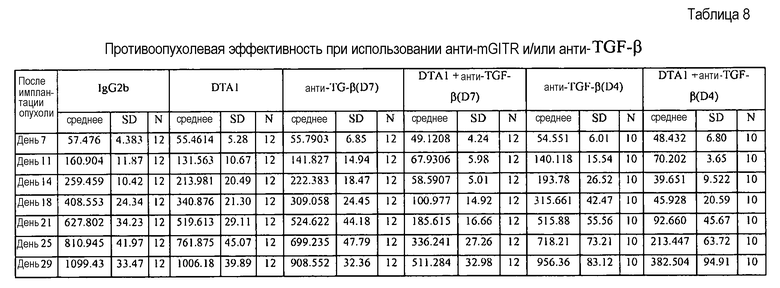
Пример 6
Комбинированная терапия опухолей CT26 антителом-облучением
Опухолевые клетки CT26 (3×105) имплантировали подкожно в левый бок мышам Balb/c. Локальное облучение (10 Гр) применяли к опухолям, которые вырастали до 300 мм3, после выявления того, что DTA-1 отдельно не обладал эффективностью в уничтожении опухоли. Через день после облучения подкожно инъецировали DTA-1 (500 мкг) в область шеи и повторяли каждую неделю, всего вводили три дозы. Объем опухоли измеряли через каждые два-пять дней. В группе из 10 мышей, которые перенесли комбинированную обработку локальным облучением и DTA-1, у 5 мышей наблюдали полное отторжение опухолей, и они выживали вплоть до 3 месяцев. DTA-1 или облучение по отдельности не вызывали отторжения опухолей (смотри, например, фигуру 1).
Пример 7
Картирование эпитопов GITR-антител
Как указано выше, DTA-1 является агонистическим антителом против GITR мыши (смотри, например, Shimizu, et al. выше). Показано, что DTA-1 обладает мощными противоопухолевыми активностями в мышиных моделях злокачественной опухоли (смотри, например, Cohen et al. (2006) Cancer Res. 66: 4904-4912; Ramirez-Montagut et al. (2006) J. Immunol. 176: 6434-6442; Zhou et al. (2007) J. Immunol. 179: 7365-7375; и Ko et al. (2005) J. Exp. Med. 202:885-891).
Чтобы определить, связываются ли антитела, описанные выше, с DTA-1-подобным эпитопом в белке GITR человека, эпитоп DTA-1 сначала картировали в белке GITR мыши. Не имея кристаллической структуры GITR человека или мыши, эпитоп DTA-1 определяли, используя стандартный способ сайт-специфичного мутагенеза (смотри, например, Kunkel (1985) Proc. Natl. Acad. Sci. 82: 488-492) и общие принципы модульной структуры семейства TNF-рецепторов (смотри, например, Naismith и Sprang, выше).
После определения эпитопа GITR мыши, узнаваемого DTA-1, соответствующие остатки GITR человека заменяли на мышиные остатки, тем самым придавая DTA-1 способность связываться с GITR человека. В результате было определено, что DTA-1-подобный эпитоп на GITR человека охватывает модули 3 и 4 (смотри фигуру 2), и эпитоп GITR человека (SEQ ID NO: 89), узнаваемый двумя указанными выше антителами, содержит Gly57, Arg65, His67, Lys80, Phe81, Ser82 и Gin86.
Пример 8
Лечение вирусных инфекций анти-GITR-антителами
Инфекция ВИЧ характеризуется дефектами в формировании и поддержании центральных клеток памяти. Центральные клетки памяти CD8+ имеют более короткое время полужизни и менее распространены у ВИЧ-инфицированных людей, чем в контроле. Также частота встречаемости ВИЧ-специфичных T-клеток CD4+ и CD8+ быстро снижается после начала высокоактивной противоретровирусной терапии (HAART). Костимуляция CD4+ анти-GITR-антителами может обеспечивать механизм увеличения ответа клеток памяти CD8+ и вносить вклад в элиминацию вируса. Было показано, что лечение персистентно инфицированных вирусом Фрейнда мышей анти-GITR-антителом для снижения супрессии клетками Treg значимо повышает продукцию IFN-γ T-клетками CD8+ и обеспечивает значимое снижение вирусной нагрузки (Dittmer et al., (2004) Immunity 20: 293-303).
Другим признаком ВИЧ-инфекции является массивный апоптоз T-клеток CD4+, начинающийся на ранних этапах ВИЧ-инфекции. Прогрессирующее апоптозное удаление T-клеток CD4 вносит вклад в ослабление ВИЧ-специфичных клеточных иммунных ответов и в развитие СПИДа. Показано, что костимуляция GITR усиливает секрецию мышиных цитокинов, специфичных для антигена, благодаря защите T-клеток от апоптоза. Lahey с соавторами (2007) (J. Infect. Dis. 196: 43-49) показали, что обработка анти-GITR-антителами ВИЧ-специфичных T-клеток CD4+ усиливает экспрессию их цитокинов и защищает их от апоптоза.
В случае инфекций, причиной которых являются вирусы, антитела согласно изобретению можно сочетать, применяя их одновременно, перед или после применения стандартных способов терапии для лечения вирусных инфекций. Такие стандартные способы терапии варьируют в зависимости от типа вируса, хотя почти во всех случаях эффективным может быть введение сыворотки человека, содержащей антитела (например, IgA, IgG), специфичные по отношению к вирусу.
Инфекция вирусом гриппа приводит к лихорадке, кашлю, миалгии, головной боли и недомоганию, которые часто встречаются при сезонных эпидемиях. Грипп также ассоциирован с несколькими постинфекционными расстройствами, такими как энцефалит, миоперикардит, синдром Гудпасчера и синдром Рея. Инфекция вирусом гриппа также подавляет нормальную легочную противобактериальную защиту, так что для пациента, выздоравливающего от гриппа, существует повышенный риск развития бактериальной пневмонии.
Поверхностные белки вируса гриппа проявляют заметную антигенную вариабельность, возникающую в результате мутации и рекомбинации. Таким образом, цитолитические T-лимфоциты являются основным средством хозяина для элиминации вируса после инфекции. Вирус гриппа классифицируют на три основных типа: A, B и C. Вирус гриппа A является уникальным в том отношении, что он инфицирует как людей, так и многих других животных (например, свиней, лошадей, птиц и тюленей) и является основной причиной пандемического гриппа. Также, когда клетка инфицирована двумя разными штаммами вируса гриппа A, сегментированные РНК-геномы двух исходных типов вирусов смешиваются во время репликации, создавая гибридный продукт репликации и приводя к появлению новых эпидемических штаммов. Вирус гриппа B не реплицируется у животных и, следовательно, имеет меньшую генетическую вариабельность, а вирус гриппа C имеет только один серотип.
Большинство обычных способов терапии являются паллиативными в отношении симптомов, возникающих в результате инфекции, тогда как иммунный ответ хозяина действительно устраняет заболевание. Однако некоторые штаммы (например, вируса гриппа A) могут вызывать более серьезное заболевание и гибель. Грипп A можно лечить клинически и профилактически посредством введения ингибирующих циклических аминов амантадина и римантадина, которые ингибируют репликацию вирусов. Однако клиническое применение таких лекарственных средств ограничено вследствие относительно высокой частоты возникновения неблагоприятных реакций, их узкого противовирусного спектра (только вирус гриппа A) и склонности вируса к появлению резистентности. Введение сывороточного IgG-антитела к основным поверхностным белкам вируса гриппа, гемагглютинину и нейраминидазе, может предотвращать легочную инфекцию, тогда как IgA слизистой оболочки необходим для предотвращения инфекции верхних дыхательных путей и трахеи. Наиболее эффективным современным способом лечения гриппа является вакцинация с использованием введения вируса, инактивированного формалином или β-пропиолактоном.
После инкубации в течение 9-11 дней у хозяев, инфицированных вирусом кори, развивается лихорадка, кашель, ринит и конъюнктивит. В течение 1-2 дней развиваются эритематозная макулопопулезная сыпь, которая быстро распространяется по всему телу. Поскольку инфекция также подавляет клеточный иммунитет, у хозяина появляется еще больший риск развития бактериальных суперинфекций, включая отит среднего уха, пневмонию и постинфекционный энцефаломиелит. Острая инфекция ассоциирована со значительной заболеваемостью и смертностью, особенно у подростков при плохом питании.
Лечение кори включает пассивное введение суммарного IgG человека, который может предотвращать инфекцию у неиммунных субъектов, даже если введение осуществлено через неделю после воздействия.
Однако предварительная иммунизация живым аттенуированным вирусом является наиболее эффективным способом лечения и предотвращает заболевание более чем у 95% иммунизированных. Так как существует один серотип такого вируса, то одна иммунизация или инфекция обычно приводит к защите в течение всей жизни от последующей инфекции.
У небольшой части инфицированных хозяев корь может развиваться в SSPE, который является хроническим прогрессирующим неврологическим нарушением, возникающим в результате персистирующей инфекции центральной нервной системы. SSPE вызывают клональные варианты вируса кори с дефектами, которые мешают сборке и отпочкованию вирионов. Для таких пациентов может быть желательная реактивация T-клеток антителами согласно изобретению, чтобы облегчить элиминацию вирусов.
Вирус гепатита B (HB-V) является наиболее инфекционным из известных переносимых кровью патогенов. Он является основной причиной острого и хронического гепатита и карциномы печени, а также пожизненной хронической инфекции. После инфекции вирус реплицируется в гепатоцитах, которые затем также выделяют поверхностный антиген HBsAg. Выявление избыточных уровней HBsAg в сыворотке используют в качестве стандартного способа диагностики инфекции гепатита B. Острая инфекция может разрешаться или может развиваться в хроническую персистирующую инфекцию.
Современное лечение хронического HBV включает использование α-интерферона, который увеличивает экспрессию лейкоцитарных антигенов человека (HLA) класса I на поверхности гепатоцитов, тем самым облегчая их узнавание цитотоксическими T-лимфоцитами. Кроме того, аналоги нуклеозидов ганцикловир, фамцикловир и ламивудин также проявляли некоторую эффективность в лечении HBV-инфекции в клиническом испытании. Дополнительные средства лечения HBV включают пегилированный α-интерферон, аденфовир, энтекавир и телбивудин. В то время как пассивный иммунитет можно придать в результате парентерального введения сывороточных антител против HBsAg, вакцинация инактивированным или рекомбинантным HBsAg также придает устойчивость к инфекции. Анти-GITR-антитела согласно изобретению можно сочетать с обычными средствами лечения инфекций гепатита B для получения терапевтического преимущества.
Инфекция вирусом гепатита C (HC-V) может приводить к хронической форме гепатита и в результате к циррозу. Хотя симптомы сходны с инфекциями вирусами гепатита B, в отличие от HB-V инфицированные хозяева могут оставаться без симптомов на протяжении 10-20 лет. Лечение инфекции HC-V включает введение сочетания α-интерферона и рибавирина. Многообещающим потенциальным терапевтическим средством для лечения инфекции HC-V является ингибитор протеазы телапревир (VX-960). Дополнительные средства лечения включают: анти-PD-1-антитело (MDX-1106, Medarex), бавитуксимаб (антитело, которое связывает анионный фосфолипид фосфатидилсерин зависимым от B2-гликопротеида I образом, Peregrine Pharmaceuticals), антитело (антитела) против белка E2 оболочки вируса HPV (например, ATL 6865-Ab68+Ab65, XTL Pharmaceuticals) и Civacir® (поликлональный иммуноглобулин человека против HCV). Анти-GITR-антитела согласно изобретению можно сочетать с одним или несколькими из указанных средств лечения инфекции вирусом гепатита C для получения терапевтического преимущества.
В таблице 9 приведено краткое описание последовательностей из списка последовательностей.
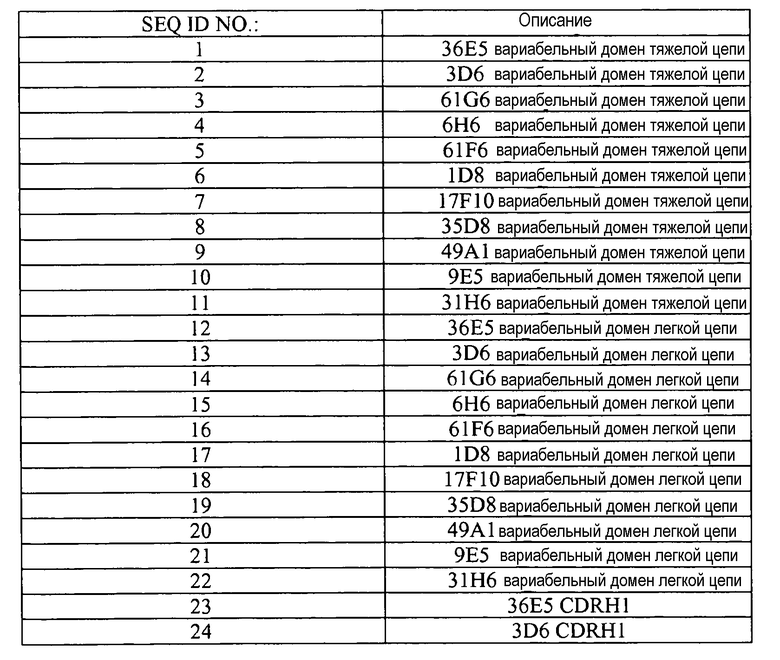
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-GITR-АНТИТЕЛА | 2010 |
|
RU2646139C1 |
| НОВЫЕ АНТИТЕЛА | 2008 |
|
RU2490277C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2013 |
|
RU2599417C2 |
| АНТИТЕЛА К БЕЛКУ ПРОГРАММИРУЕМОЙ КЛЕТОЧНОЙ СМЕРТИ 1 | 2018 |
|
RU2812915C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2012 |
|
RU2605327C2 |
| КОНЪЮГАТЫ АНТИ-РТК7 АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2015 |
|
RU2708075C2 |
| АНТИ-αvβ8 АНТИТЕЛА И КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812478C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2016 |
|
RU2650767C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2406760C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2494107C2 |














































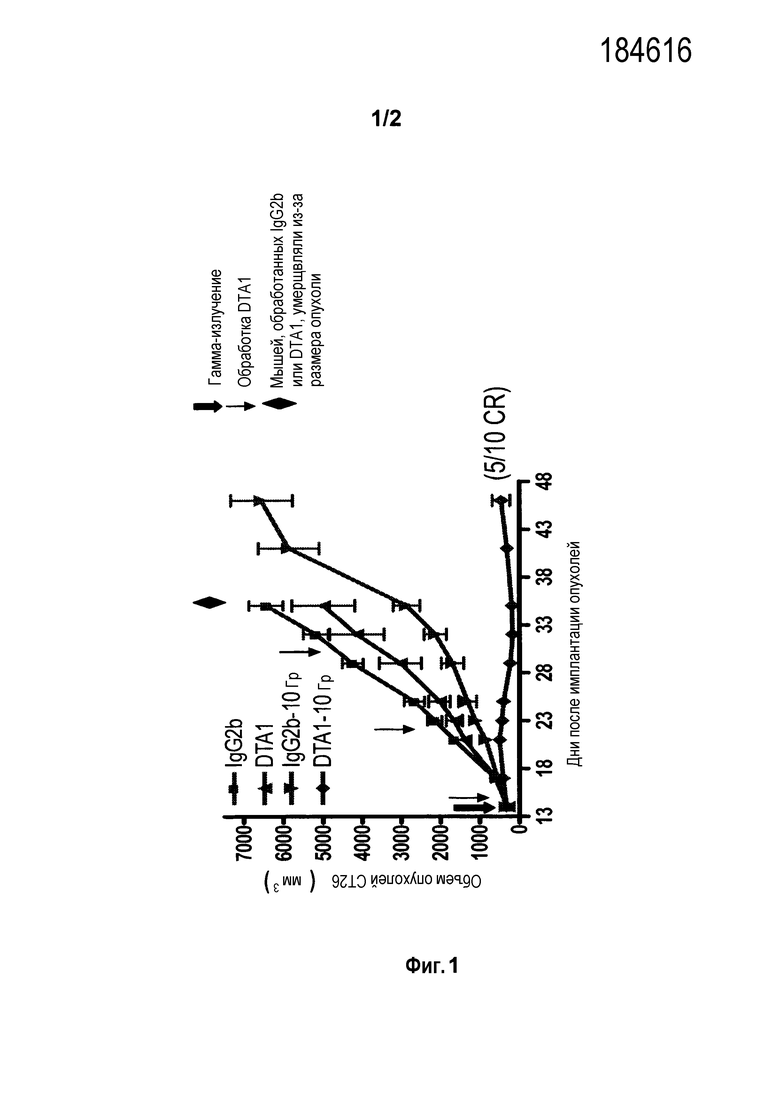

Настоящее изобретение относится к области иммунологии. Предложено выделенное антитело и его антигенсвязывающий фрагмент, которые специфически связываются с индуцируемым глюкокортикоидами рецептором TNF (GITR) человека; а также композиции, в том числе фармацевтическая композиция, и способ усиления иммунного ответа у человека. Рассмотрена изолированная нуклеиновая кислота, кодирующая легкую цепь и тяжелую цепь антитела или его антигенсвязывающего фрагмента; вектор, клетка-хозяин и способ получения антитела по изобретению или его антигенсвязывающего фрагмента. Антитела по настоящему изобретению способны усиливать активность GITR человека и могут найти дальнейшее применение в комбинированной терапии различных заболеваний. 10 н. и 20 з.п. ф-лы, 2 ил., 9 табл., 8 пр.
1. Выделенное антитело или его антигенсвязывающий фрагмент, которые специфически связываются с белком GITR человека, содержащие:
CDR-L1, CDR-L2 и CDR-L3 легкой цепи иммуноглобулина, содержащей аминокислотную последовательность, представленную в SEQ ID NO: 105, и CDR-H1, CDR-H2 и CDR-H3 тяжелой цепи иммуноглобулина, содержащей аминокислотную последовательность, представленную в SEQ ID NO: 104.
2. Антитело или его антигенсвязывающий фрагмент по п.1, где антитело или его антигенсвязывающий фрагмент представляют собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab′, Fab′-SH, Fv, scFv, F(ab′)2 и диантитела.
3. Антитело или его антигенсвязывающий фрагмент по п.1, которое представляет собой антитело.
4. Антитело или его антигенсвязывающий фрагмент по п.1, которое представляет собой моноклональное антитело.
5. Антитело или его антигенсвязывающий фрагмент по п.1, которое представляет собой гуманизированное антитело.
6. Антитело или его антигенсвязывающий фрагмент по п.1, где тяжелая цепь иммуноглобулина слита с константной областью тяжелой цепи γ1 человека.
7. Антитело или его антигенсвязывающий фрагмент по п.1, где тяжелая цепь иммуноглобулина слита с константной областью тяжелой цепи γ1 человека или ее вариантом, при этом вариант константной области содержит до 20 консервативно модифицированных аминокислотных замен.
8. Антитело или его антигенсвязывающий фрагмент по п.1, где тяжелая цепь иммуноглобулина слита с константной областью тяжелой цепи γ4 человека или ее вариантом, при этом вариант константной области содержит до 20 консервативно модифицированных аминокислотных замен.
9. Фармацевтическая композиция усиления иммунного ответа у человека, содержащая в эффективном количестве антитело или его антигенсвязывающий фрагмент по п.1 и фармацевтически приемлемый носитель.
10. Изолированная нуклеиновая кислота, кодирующая легкую цепь иммуноглобулина и тяжелую цепь иммуноглобулина антитела или его антигенсвязывающего фрагмента по п.1.
11. Экспрессирующий вектор, содержащий нуклеиновую кислоту по п.10, где нуклеиновая кислота, кодирующая легкую цепь иммуноглобулина, функционально связана с регуляторной последовательностью экспрессии, которую распознает клетка-хозяин, когда клетка-хозяин трансформирована вектором, и где нуклеиновая кислота, кодирующая тяжелую цепь иммуноглобулина, функционально связана с регуляторной последовательностью экспрессии, которую распознает клетка-хозяин, когда клетка-хозяин трансформирована вектором.
12. Клетка-хозяин для экспрессии антитела или его антигенсвязывающего фрагмента по п.1, содержащая экспрессирующий вектор по п.11.
13. Клетка-хозяин по п.12, которая представляет собой клетку яичника китайского хомячка или клетку Pichia pastoris.
14. Композиция усиления иммунного ответа у человека, содержащая в эффективном количестве антитело или антигенсвязывающий фрагмент по п.1 и второе терапевтическое средство.
15. Композиция по п.14, где второе терапевтическое средство представляет собой антитело.
16. Композиция усиления иммунного ответа у человека, содержащая в эффективном количестве антитело или его антигенсвязывающий фрагмент по п.1 и компонент, выбранный из группы, состоящей из тиотепы, бусульфана, импросульфана, пипосульфана, бензодопы, карбоквона, метуредопы, уредопы, алтретамина, триэтиленмеламина, триэтиленфосфорамида, триэтилентиофосфорамида и триметилолмеламина, буллатацина, буллатацинона, камптотецина, топотекана, бриостатина, каллистатина, СС-1065, криптофицина 1, криптофицина 8, доластатина, дуокармицина, KW-2189, СВ1-ТМ1, элеутеробина, панкратистатина, саркодиктиина, спонгистатина, хлорамбуцила, хлорнафазина, холофосфамида, эстрамустина, ифосфамида, мехлорэтамина, гидрохлорида оксида мехлорэтамина, мелфалана, новембихина, фенестерина, преднимустина, трофосфамида, урамустина, кармустина, хлорозотоцина, фотемустина, ломустина, нимустина, ранимустина, калихеамицина, калихеамицина гамма 1I, калихеамицина омега 1I, динемицина, динемицина А, клодроната, хромофора неокарциностатина, аклациномизина, актиномицина, аутрамицина, азасерина, блеомицина, кактиномицина, карабицина, каминомицина, карзинофилина, хромомицина, дактиномицина, даунорубицина, деторубицина, 6-диазо-5-оксо-L-норлейцина, доксорубицина, морфолинодоксорубицина, цианоморфолинодоксорубицина, 2-пирролинодоксорубицина, дезоксидоксорубицина, эпирубицина, эзорубицина, идарубицина, марцелломицина, митомицина С, микофеноловой кислоты, ногаламицина, оливомицина, пепломицина, потфиромицина, пуромицина, квеламицина, родорубицина, стрептонигрина, стрептозоцина, туберцидина, убенимекса, зиностатина, зорубицина, 5-фторурацила (5-FU), деноптерина, метотрексата, птероптерина, триметрексата, флударабина, 6-меркаптопурина, тиамиприна, тиогуанина, анцитабина, азацитидина, 6-азауридина, кармофура, цитарабина, дидезоксиуридина, доксифлуридина, эноцитабина, флоксуридина, калустерона, пропионата дромостанолона, эпитиостанола, мепитиостана, тестолактона, аминоглютетимида, митотана, трилостана, ацеглатона, гликозида альдофосфамида, аминолевулиновой кислоты, энилурацила, амсакрина, бестрабуцила, бисантрена, эдатраксата, дефофамина, демеколцина, диазиквона, элформитина, ацетата эллиптиния, эпотилона, этоглуцида, нитрата галлия, гидроксимочевины, лентинана, лонидаинина, майтанзина, ансамитоцинов, митогуазона, митоксантрона, мопиданмола, нитраэрина, пентостатина, фенамета, пирарубицина, лозоксантрона, подофиллиновой кислоты, 2-этилгидразида, прокарбазина, разоксана, ризоксина, сизофурана, спирогермания, тенуазоновой кислоты, триазиквона, 2,2′,2′′-трихлортриэтиламина, токсина Т-2, верракурина А, роридина А, ангуидина, уретана, виндезина, дакарбазина, манномустина, митобронитола, митолактола, пипобромана, гацитозина, арабинозида, циклофосфамида, паклитаксела, не содержащего кремофора состава паклитаксела на основе сконструированных связанных с альбумином наночастиц, доксетаксела, хлорамбуцила, гемцитабина, 6-тиогуанина, меркаптопурина, метотрексата, цисплатина, карбоплатина, винбластина, платины, этопозида, ифосфамида, митоксантрона, винкристина, винорелбина, новантрона, тенипозида, эдатрексата, дауномицина, аминоптерина, капецитабина, ибандроната, СРТ-11, RFS2000, дифторметилорнитина (DMFO), ретиноевой кислоты, тамоксифена, ралоксифена, дролоксифена, 4-гидрокситамоксифена, триоксифена, кеоксифена, LY117018, онапристона, торемифена, 4(5)-имидазолов, аминоглутетимида, ацетата мегестрола, экземестана, форместана, фадрозола, ворозола, летрозола, анастрозола, флутамида, нилутамида, бикалутамида, лейпролида, гозерелина, троксацитабина, ангиозима, алловектина, лейвектина, ваксида, рекомбинантного IL-2, луртотекана и абареликса.
17. Композиция усиления иммунного ответа у человека, содержащая в эффективном количестве антитело или его антигенсвязывающий фрагмент по п.1 и компонент, выбранный из группы, состоящей из алкилирующего агента, этиленимина, метилмеламина, ацетогенина, камптотецина, криптофицина, саркодиктиина, антибиотика, бифосфоната, митомицина, антиметаболита, аналога фолиевой кислоты, аналога пурина, андрогена, средства, подавляющего функции надпочечников, компенсатора фолиевой кислоты, эпотилона, трихотецена, таксоида, ретиноида, противогормонального средства, ингибитора ароматазы, антиандрогена, антисмыслового олигонуклеотида, рибозима, ингибитора экспрессии HER2 и вакцины.
18. Способ получения антитела или его антигенсвязывающего фрагмента, включающий:
культивирование клетки-хозяина по п.12 в культуральной среде в условиях, в которых экспрессируются иммуноглобулиновые цепи; и
извлечение иммуноглобулиновых цепей из клетки-хозяина, или культуральной среды, или обоих.
19. Способ усиления иммунного ответа у человека, включающий введение человеку, нуждающемуся в этом, антитела или его антигенсвязывающего фрагмента по п.1 в количестве, эффективном для усиления биологической активности GITR человека.
20. Способ по п.19, где антитело или антигенсвязывающий фрагмент совместно вводят со вторым терапевтическим агентом.
21. Способ по п.20, где второй терапевтический агент представляет собой антитело.
22. Способ по п.19, в котором антитело или его антигенсвязывающий фрагмент вводят совместно с анти-TGFβ-антителом.
23. Способ по п.18, в котором антитело или его антигенсвязывающий фрагмент применяют совместно с местным облучением.
24. Способ по п.19, где антитело или его антигенсвязывающий фрагмент совместно вводят с компонентом, выбранным из группы, состоящей из тиотепы, бусульфана, импросульфана, пипосульфана, бензодопы, карбоквона, метуредопы, уредопы, алтретамина, триэтиленмеламина, триэтиленфосфорамида, триэтилентиофосфорамида и триметилолмеламина, буллатацина, буллатацинона, камптотецина, топотекана, бриостатина, каллистатина, СС-1065, криптофицина 1, криптофицина 8, доластатина, дуокармицина, KW-2189, СВ1-ТМ1, элеутеробина, панкратистатина, саркодиктиина, спонгистатина, хлорамбуцила, хлорнафазина, холофосфамида, эстрамустина, ифосфамида, мехлорэтамина, гидрохлорида оксида мехлорэтамина, мелфалана, новембихина, фенестерина, преднимустина, трофосфамида, урамустина, кармустина, хлорозотоцина, фотемустина, ломустина, нимустина, ранимустина, калихеамицина, калихеамицина гамма 1I, калихеамицина омега 1I, динемицина, динемицина А, клодроната, хромофора неокарциностатина, аклациномизина, актиномицина, аутрамицина, азасерина, блеомицина, кактиномицина, карабицина, каминомицина, карзинофилина, хромомицина, дактиномицина, даунорубицина, деторубицина, 6-диазо-5-оксо-L-норлейцина, доксорубицина, морфолинодоксорубицина, цианоморфолинодоксорубицина, 2-пирролинодоксорубицина, дезоксидоксорубицина, эпирубицина, эзорубицина, идарубицина, марцелломицина, митомицина С, микофеноловой кислоты, ногаламицина, оливомицина, пепломицина, потфиромицина, пуромицина, квеламицина, родорубицина, стрептонигрина, стрептозоцина, туберцидина, убенимекса, зиностатина, зорубицина, 5-фторурацила (5-FU), деноптерина, метотрексата, птероптерина, триметрексата, флударабина, 6-меркаптопурина, тиамиприна, тиогуанина, анцитабина, азацитидина, 6-азауридина, кармофура, цитарабина, дидезоксиуридина, доксифлуридина, эноцитабина, флоксуридина, калустерона, пропионата дромостанолона, эпитиостанола, мепитиостана, тестолактона, аминоглютетимида, митотана, трилостана, ацеглатона, гликозида альдофосфамида, аминолевулиновой кислоты, энилурацила, амсакрина, бестрабуцила, бисантрена, эдатраксата, дефофамина, демеколцина, диазиквона, элформитина, ацетата эллиптиния, эпотилона, этоглуцида, нитрата галлия, гидроксимочевины, лентинана, лонидаинина, майтанзина, ансамитоцинов, митогуазона, митоксантрона, мопиданмола, нитраэрина, пентостатина, фенамета, пирарубицина, лозоксантрона, подофиллиновой кислоты, 2-этилгидразида, прокарбазина, разоксана, ризоксина, сизофурана, спирогермания, тенуазоновой кислоты, триазиквона, 2,2′,2′′-трихлортриэтиламина, токсина Т-2, верракурина А, роридина А, ангуидина, уретана, виндезина, дакарбазина, манномустина, митобронитола, митолактола, пипобромана, гацитозина, арабинозида, циклофосфамида, паклитаксела, не содержащего кремофора состава паклитаксела на основе сконструированных связанных с альбумином наночастиц, доксетаксела, хлорамбуцила, гемцитабина, 6-тиогуанина, меркаптопурина, метотрексата, цисплатина, карбоплатина, винбластина, платины, этопозида, ифосфамида, митоксантрона, винкристина, винорелбина, новантрона, тенипозида, эдатрексата, дауномицина, аминоптерина, капецитабина, ибандроната, СРТ-11, RFS2000, дифторметилорнитина (DMFO), ретиноевой кислоты, тамоксифена, ралоксифена, дролоксифена, 4-гидрокситамоксифена, триоксифена, кеоксифена, LY117018, онапристона, торемифена, 4(5)-имидазолов, аминоглутетимида, ацетата мегестрола, экземестана, форместана, фадрозола, ворозола, летрозола, анастрозола, флутамида, нилутамида, бикалутамида, лейпролида, гозерелина, троксацитабина, ангиозима, алловектина, лейвектина, ваксида, рекомбинантного IL-2, луртотекана и абареликса.
25. Способ по п.19, где антитело или его антигенсвязывающий фрагмент совместно вводят с компонентом, выбранным из группы, состоящей из алкилирующего агента, этиленимина, метилмеламина, ацетогенина, камптотецина, криптофицина, саркодиктиина, антибиотика, бифосфоната, митомицина, антиметаболита, аналога фолиевой кислоты, аналога пурина, андрогена, средства, подавляющего функции надпочечников, компенсатора фолиевой кислоты, эпотилона, трихотецена, таксоида, ретиноида, противогормонального средства, ингибитора ароматазы, антиандрогена, антисмыслового олигонуклеотида, рибозима, ингибитора экспрессии HER2 и вакцины.
26. Способ по п.19, в котором иммунный ответ направлен против пролиферативного нарушения.
27. Способ по п.19, в котором иммунный ответ направлен против рака.
28. Способ по п.27, где рак выбран из группы, состоящей из аденокарциномы, лимфомы, бластомы, меланомы, саркомы, лейкоза, плоскоклеточного рака, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака желудочно-кишечного тракта, лимфомы Ходжкина и неходжкинской лимфомы, рака поджелудочной железы, глиобластомы, глиомы, рака шейки матки, рака яичника, рака печени, рака мочевого пузыря, рака молочной железы, рака ободочной кишки, рака ободочной и прямой кишки, эндометриальной карциномы, миеломы, карциномы слюнных желез, рака почек, карциномы базальных клеток, рака простаты, рака вульвы, рака щитовидной железы, рака семенников, рака пищевода и рака головы и шеи.
29. Способ по п.19, в котором иммунный ответ направлен против вирусной инфекции.
30. Способ по п.29, где вирусная инфекция вызвана вирусом, который выбран из группы, состоящей из вирусов папилломы человека (HPV), вируса простого герпеса, вируса гепатита В, вируса гепатита С, вируса кори, вируса иммунодефицита человека (ВИЧ) и вируса Эпштейна - Барр (EBV).
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| et al | |||
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| et al | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
Авторы
Даты
2016-08-27—Публикация
2010-08-31—Подача