Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет предварительной заявки США № 60/843249, поданной 8 сентября 2006 года.
Область изобретения
Настоящая заявка относится к IL-13-связывающим белкам и, в частности, к их применению для профилактики и/или лечения различных заболеваний, включая астму, аллергию, COPD (ХОБЛ), фиброз и рак.
Ссылка на соглашение о совместном исследовании
Содержание настоящей заявки находится под защитой соглашения о совместном исследовании, заключенном между Protein Design Labs, Inc. и Abbott Laboratories 14 декабря 2005 года, и относится к рекомбинантно сконструированным антителам против IL-13.
Уровень техники
IL-13 человека является гликопротеином с размером 17 кДа, клонированным из активированных Т-клеток (Zurawski and de Vries 1994 Immunol Today 15 19-26) и продуцируемым активированными Т-клетками линии Th2, хотя IL-13 также продуцируют Т-клетки Th0 и Th1 CD4+, Т-клетки CD8+ и некоторые не-T-клеточные популяции, такие как мастоциты (Zurawski and de Vries 1994 Immunol Today 15 19-26). Функция IL-13 включает переключение изотипа иммуноглобулина на IgE в В-клетках человека (Punnonen, Aversa et al. 1993 Proc Natl Acad Sci USA 90 3730-4) и супрессию продукции воспалительных цитокинов как у человека, так и у мыши (de Waal Malefyt, Figdor et al. 1993 J Immunol 151 6370-81; Doherty, Kastelein et al. 1993 J Immunol 151 7151-60). IL-13 связывается с рецепторами на поверхности клеток, IL-13Rα1 и IL-13Rα2. IL-13Rα1 взаимодействует с IL-13 с низкой аффинностью (KD~10 нМ), с последующим рекрутингом IL-4Ra с образованием сигнального гетеродимерного рецепторного комплекса с высокой аффинностью (KD~0,4 нМ) (Aman, Tayebi et al. 1996 J Biol Chem 271 29265-70; Hilton, Zhang et al. 1996 Proc Natl Acad Sci USA 93 497-501). Этот комплекс IL-4R/IL-13α1 экспрессируется на многих типах клеток, таких как В-клетки, моноциты/макрофаги, дендритные клетки, эозинофилы, базофилы, фибробласты, эндотелиальные клетки, эпителиальные клетки дыхательных путей и гладкомышечные клетки дыхательных путей (Graber, Gretener et al. 1998 Eur J Immunol 28 4286-98; Murata, Husain et al. 1998 Int Immunol 10 1103-10; Akaiwa, Yu et al. 2001 Cytokine 13 75-84). Лигирование рецепторного комплекса IL-13α1/IL-4R приводит к активации различных путей передачи сигнала, включая пути передачи сигнала и активатора транскрипции (STAT6) и пути субстрата рецептора-2 инсулина (IRS-2) (Wang, Michieli et al. 1995 Blood 864218-27; Takeda, Kamanaka et al. 1996 J Immunol 157 3220-2). Сама по себе цепь IL-13α2 имеет высокую аффинность (KD~0,25-0,4 нМ) в отношении IL-13 и функционирует как «рецептор-ловушка», отрицательно регулирующий связывание IL-13 (Donaldson, Whitters et al. 1998 J Immunol 161 2317-24), и как рецептор передачи сигнала, который индуцирует синтез TGF-β и фиброз через АР-1-путь в макрофагах и, возможно, других типах клеток (Fichtner-Feigl, Strober et al. 2006 Nat Med 12 99-106).
Несколько исследований, проведенных на преклинических моделях астмы животных, показывают, что IL-13 играет важную роль в астме. Эти данные включают устойчивость к астме у мышей с нокаутом IL-13, а также ингибирование фенотипа астмы антагонистами IL-13 (растворимыми рецепторами IL-13, анти-IL-13-mAb и т.д.) в различных мышиных моделях (Sela 1999 Harefuah 137 317-9; Wills-Karp and Chiaramonte 2003 Curr Opin Pulm Med 9 21-7; Wills-Karp 2004 Immunol Rev 202 175-90). Многочисленные исследования продемонстрировали, что фармакологическое введение рекомбинантного IL-13 в легкие мышей, а также морских свинок индуцирует гиперсекрецию слизи дыхательных путей, эозинофилию и AHR (Grunig, Warnock et al. 1998 Science 282 2261-3; Wills-Karp, Luyimbazi et al. 1998 Science 282 2258-61; Kibe, Inoue et al. 2003 Am J Respir Crit Care Med 167 50-6; Vargaftig and Singer 2003 Am J Physiol Lung Cell Mol Physiol 284 L260-9; Vargaftig and Singer 2003 Am J Respir Cell Mol Biol 28 410-9). Эти эффекты IL-13 воспроизводятся в системах трансгенных мышей с конститутивной или индуцируемой экспрессией IL-13 (Zhu, Homer et al. 1999 J Clin Invest 103 779-88; Zhu, Lee et al. 2001 Am J Respir Crit Care Med 164 S67-70; Lanone, Zheng et al. 2002 J Clin Invest 110 463-74). Постоянная трансгенная сверхэкспрессия IL-13 индуцирует субэпителиальный фиброз и эмфизему. Мыши, дефектные по IL-13 (и IL-4) и молекулы передачи сигнала STAT6, неспособны развивать индуцируемое аллергенами AHR и сверхпродукцию слизи (Kuperman, Huang et al. 2002 Nat Med 8 885-9). Исследования с использованием растворимого слитого белка рецептора IL-13 (sIL-13Rα2Fc) продемонстрировали центральную роль этого цитокина в экспериментальном заболевании дыхательных путей, индуцированном аллергеном овальбумином (OVA) (Grunig, Warnock et al. 1998 Science 282 2261-3; Wills-Karp, Luyimbazi et al. 1998 Science 282 2258-61; Taube, Duez et al. 2002 J Immunol 169 6482-9). Эффективность лечения с использованием анти-IL-13 также была продемонстрирована в модели хронической астмы мышей. Кроме проявления признаков гиперсекреции слизи и AHR, эта модель хронической астмы демонстрирует несколько отличительных признаков заболевания человека, которые отсутствуют в моделях острой формы заболевания. К ним относятся эозинофилия ткани легкого, локализованной в межэпителиальных пространствах, а также фиброз гладких мышц, как измерено по увеличению отложения коллагена. Эту модель хронической астмы индуцируют повторяемыми аэрозольными введениями OVA в чувствительных к OVA мышей 1 раз в неделю в течение 4 недель в целом. Анти-IL-13-антитело, вводимое в течение последних 2 недель введений OVA (со дня 36 с регистрациями эффективности, оцениваемыми в день 53 исследования), значимо ингибировало AHR, легочное воспаление, гиперплазию бокаловидных клеток, гиперсекрецию слизи и фиброз дыхательных путей (Yang, Li et al. 2005 J Pharmacol Exp Ther). Кроме того, было также продемонстрировано, что терапевтическое действие антагониста IL-13 ингибирует AHR в модели астмы приматов [Abstract, American Thoracic Society 2005].
Предполагается, что IL-13 участвует в патогенезе астмы человека, так как в легких астматических пациентов были обнаружены повышенные уровни мРНК и белка IL-13, которые коррелируют с тяжестью этого заболевания (Huang, Xiao et al. 1995 J Immunol 155 2688-94). Кроме того, были идентифицированы генетические полиморфизмы IL-13 человека, которые приводят к повышенным уровням IL-13, которые связаны с астмой и атопией (Heinzmann, Mao et al. 2000 Hum Mol Genet 9 549-59; Hoerauf, Kruse et al. 2002 Microbes Infect 4 37-42; Vercelli 2002 Curr Opin Allergy Clin Immunol 2 389-93; Heinzmann, Jerkic et al. 2003 J Allergy Clin Immunol 112 735-9; Chen, Ericksen et al. 2004 J Allergy Clin Immunol 114 553-60; Vladich, Brazille et al. 2005 J Clin Invest), и повышенные уровни IL-13 были детектированы в легких пациентов с астмой (Huang, Xiao et al. 1995 J Immunol 155 2688-94; Arima, Umeshita-Suyama et al. 2002 J Allergy Clin Immunol 109 980-7; Berry, Parker et al. 2004 J Allergy Clin Immunol 114 1106-9). Генетическое сцепление между IL-13 и астмой было также продемонстрировано, так как индивидуумы с полиморфизмом в гене IL-13, который вызывает более высокие уровни IL-13 плазмы, имеют увеличенный риск атопии и астмы (Wills-Karp 2000 Respir Res 1 19-23).
Вследствие этой роли IL-13 человека при различных нарушениях человека, были созданы терапевтические подходы для ингибирования активности IL-13 или противодействия активности IL-13. В частности, проводились поиски антител, которые связываются с IL-13 и нейтрализуют IL-13, в качестве средства ингибирования активности IL-13. Однако в данной области существует потребность в улучшенных антителах, способных связывать IL-13. Предпочтительно, такие антитела связывают IL-13 человека. Предпочтительно, эти антитела способны нейтрализовать IL-13 человека. Настоящее изобретение относится к новому семейству связывающих белков, CDR-трансплантированных антител, гуманизированных антител, и их фрагментов, способных связывать IL-13 человека, связывающихся с высокой аффинностью и связывающих и нейтрализующих IL-13 человека.
Сущность изобретения
Настоящее изобретение относится к IL-13-связывающим белкам. Связывающие белки по изобретению включают, но не ограничиваются ими, антитела, антигенсвязывающие части и другие антигенсвязывающие белки, способные связывать IL-13 человека. Кроме того, изобретение относится к способам получения и применения IL-13-связывающих белков.
В одном из аспектов настоящее изобретение относится к связывающему белку, способному связывать IL-13. В предпочтительном варианте осуществления связывающий белок связывает IL-13 человека. Предпочтительно, связывающий белок способен модулировать биологическую функцию IL-13. Более предпочтительно, связывающий белок способен нейтрализовать IL-13.
В одном из аспектов изобретения связывающий белок способен связывать IL-13 и предотвращать связывание IL-13 с IL-13α1-рецептором. В другом аспекте изобретения связывающий белок способен связывать IL-13 и предотвращать связывание IL-13 с IL-13α2-рецептором. В предпочтительном варианте осуществления связывающий белок способен связывать IL-13 и предотвращать связывание IL-13 как с IL-13α1-рецептором, так и с IL-13α2-рецептором.
Один вариант изобретения относится к выделенному антителу или его антигенсвязывающему фрагменту, в котором указанное антитело или его антигенсвязывающий фрагмент связывает IL-13 человека и ингибирует связывание указанного IL-13 с IL-13α2-рецептором в анализе связывания рецептора на основе клеточной поверхности с IC50, выбранной из группы, состоящей из приблизительно 1,5×10-8-1×10-8 M, 1×10-8-1×10-9 M, 10-9-10-10 M и 10-10-10-11 M или в анализе связывания рецептора на основе ELISA с IC50, выбранной из группы, состоящей из приблизительно 1,8×10-8-1×10-8 M, 1×10-8-1×10-9 M, 10-9-10-10 M и 10-10-10-11 M. Предпочтительно, это антитело связывает IL-13 человека и ингибирует связывание указанного IL-13 с IL-13α2-рецептором в анализе связывания рецептора на клеточной поверхности с IC50 2,7×10-9 М и в анализе связывания рецептора на основе ELISA IC50 1,1×10-9 M. Предпочтительно, антитело или его антигенсвязывающий фрагмент связывает IL-13 человека и ингибирует связывание указанного IL-13 с его IL-13α2-рецептором в анализе связывания рецептора на основе клеточной поверхности или в анализе связывания рецептора на основе ELISA приблизительно на 70-100% при концентрации 100 нМ. Предпочтительно, этим антителом является антитело 13C5.5. Более предпочтительно, это антитело не является антителом BAK502G9, mAb13.2 или MJ2-7.
В другом аспекте изобретение относится к выделенному антителу, или его антигенсвязывающему фрагменту, где указанное антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека и ингибирует AHR приблизительно на 50%, 60%, 70%, 80%, 90% или 100% на модели астмы человека, индуцированной IL-13. Предпочтительно, антитело ингибирует AHR более, чем на 86%, в модели астмы человека, индуцированной IL-13. В другом варианте осуществления выделенное антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека и ингибирует AHR приблизительно на 50%, 60%, 70%, 80%, 90% или 100% и ингибирует продукцию слизи приблизительно на 40%, 50%, 60%, 70%, 80% 90% или 100% в модели астмы человека, индуцированной IL-13. Предпочтительно, антителом является антитело 13C5.5. Более предпочтительно, антитело не является антителом BAK502G9, mAb13.2 или MJ2-7.
В одном из вариантов осуществления связывающий белок по изобретению имеет константу скорости ассоциации (kon) в отношении IL-13 по меньшей мере приблизительно 102 M-1c-1; по меньшей мере приблизительно 103 M-1c-1; по меньшей мере приблизительно 104 M-1c-1; по меньшей мере приблизительно 105 M-1c-1; или по меньшей мере приблизительно 106 M-1c-1, при измерении с помощью резонанса поверхностных плазмонов. Предпочтительно, связывающий белок по изобретению имеет константу скорости ассоциации (kon) в отношении IL-13, равной 102-103 M-1c-1; 103-104 M-1с-1; 104-105 M-1c-1 или 105-106 M-1c-1, при измерении с помощью резонанса поверхностных плазмонов.
В другом варианте осуществления связывающий белок по изобретению имеет константу скорости диссоциации (koff) в отношении IL-13 максимально приблизительно 10-3 с-1; максимально приблизительно 10-4 с-1; максимально приблизительно 10-5 с-1 или максимально приблизительно 10-6 с-1, при измерении с помощью резонанса поверхностных плазмонов. Предпочтительно, связывающий белок по изобретению имеет константу скорости диссоциации (koff) в отношении IL-13 10-3-10-4 с-1; 10-4-10-5 с-1 или 10-5-10-6 с-1, при измерении с помощью резонанса поверхностных плазмонов.
В другом варианте осуществления связывающий белок по изобретению имеет константу диссоциации (KD) в отношении IL-13 максимально приблизительно 10-7 M; максимально приблизительно 10-8 M; максимально приблизительно 10-9 M; максимально приблизительно 10-10 M; максимально приблизительно 10-11 M; максимально приблизительно 10-12 M или максимально приблизительно 10-13 M. Предпочтительно, связывающий белок по изобретению имеет константу диссоциации (KD) в отношении IL-13 10-7-10-8 M; 10-8-10-9 M; 10-9-10-10 M; 10-10-10-11 M; 10-11-10-12 M или 10-12-10-13 M.
Предпочтительно, антитело, или его антигенсвязывающий фрагмент, связывает IL-13 с характеристиками связывания, выбранными из группы, состоящей из: a) константы скорости ассоциации (kon), равной приблизительно 105-106 M-1с-1 или приблизительно 106-107 M-1с-1, или b) константы скорости диссоциации (koff), равной приблизительно 10-4-10-5 с-1 или приблизительно 10-5-10-6 с-1, при измерении с помощью резонанса поверхностных плазмонов, или c) константы диссоциации (KD), равной приблизительно 1,5×10-10-1×10-10 M или приблизительно 10-10-10-11 M. Предпочтительно, антитело, или его антигенсвязывающий фрагмент, имеет константу скорости ассоциации (kon) в отношении IL-13, выбранную из группы, состоящей из: 6,68×105 M-1с-1, 7,86×105 M-1с-1, 8,35×105 M-1с-1, 8,69×105 M-1с-1, 9,15×105 M-1с-1, 1,26×106 M-1с-1, 1,7×106 M-1с-1 и 2,51×106 M-1с-1. Предпочтительно, антитело, или его антигенсвязывающий фрагмент, имеет константу скорости диссоциации (koff) в отношении IL-13, выбранную из группы, состоящей из: 1,23×10-4 с-1; 1,76×10-4 с-1; 4,74×10-4 с-1; 1,91×10-5 с-1; 2,14×10-5 с-1; 3,82×10-5 с-1; 8,81×10-5 с-1; и 9,65×10-5с-1, при измерении по резонансу поверхностных плазмонов. Предпочтительно, антитело, или его антигенсвязывающий фрагмент, имеет константу диссоциации (KD) в отношении IL-13, выбранную из группы, состоящей из: 1,05×10-10 M; 7,10×10-10 M; 1×10-11 M; 2,20×10-11 M; 2,72×10-11 M; 4,17×10-11 M; 5,68×10-11 M; 7,01×10-11 M; 7,10×10-11 M и 9,79×10-11 M.
Один из аспектов настоящего изобретения относится к связывающим белкам, способным связывать специфический эпитоп на IL-13. Предпочтительно, специфический эпитоп содержит область С-концевой спирали D IL-13 человека. Более предпочтительно, этот специфический эпитоп содержит аминокислотную последовательность VRDTK IEVAQ FVKDL LL HLK KLFRE GR, соответствующую аминокислотам 104-130 последовательности SEQ ID NO:1. В другом аспекте антитело, или его антигенсвязывающая часть, связывает эпитоп, содержащий область С-концевой спирали D и область N-концевой спирали А IL-13 человека. Предпочтительно, антитело, или его антигенсвязывающая часть, связывает IL-13 человека, чтобы IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Ser26-Thr27-Ala28-Leu29-Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leu125-Phe126-Arg127-Glu-128-Gly129-Arg130 последовательности SEQ ID NO:1, был ингибирован для связывания с IL-13-рецептором. Предпочтительно, это антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека, чтобы IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leu125-Phe126-Arg127 последовательности SEQ ID NO:1, был ингибирован для связывания с IL-13-рецептором. Предпочтительно, антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека, чтобы IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Ser26-Thr27-Ala28-Leu29-Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leu125-Phe126-Arg127-Glu-128-Gly129-Arg130 последовательности SEQ ID NO:1 был ингибирован для связывания с IL-13α2-рецептором. Более предпочтительно, антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека, чтобы IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Ser26-Thr27-Ala28-Leu29-Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leu125-Phe126-Arg127-Glu-128-Gly129-Arg130 последовательности SEQ ID NO:1 был ингибирован для связывания с IL-13α2-рецептором, при условии, что указанное антитело не является антителом BAK502G9 или MJ2-7. Наиболее предпочтительно, этим антителом является антитело 13C5.5.
В одном из аспектов выделенное антитело, или его антигенсвязывающий фрагмент, связывает IL-13 и предотвращает связывание IL-13 с IL-13α2-рецептором с характеристиками связывания, выбранными из группы, состоящей из связывания с эпитопом на IL-13, включающим спирали А и D; константы скорости ассоциации (kon) приблизительно 105-106 M-1с-1 или приблизительно 106-107 M-1с-1; константы скорости диссоциации (koff) приблизительно 10-4-10-5 с-1 или приблизительно 10-5-10-6 с-1, при измерении с помощью резонанса поверхностных плазмонов; и константы диссоциации (KD) приблизительно 1,5×10-10-1×10-10 M или приблизительно 10-10-10-11 M. В другом аспекте выделенное антитело, или его антигенсвязывающий фрагмент, связывает IL-13 и предотвращает связывание IL-13 с IL-13α2-рецептором с характеристиками связывания, выбранными из группы, состоящей из связывания с эпитопом на IL-13, включающим спирали А и D; константы скорости ассоциации (kon) приблизительно 105-106 M-1с-1 или приблизительно 106-107 M-1с-1; константы скорости диссоциации (koff) приблизительно 10-4-10-5 с-1 или приблизительно 10-5-10-6 с-1, при измерении с помощью резонанса поверхностных плазмонов; и константы диссоциации (KD) приблизительно 1,5×10-10-1×10-10 M или приблизительно 10-10-10-11 M.
В одном из аспектов изобретение относится к связывающему белку, способному связывать IL-13, причем указанный антигенсвязывающий домен содержит по меньшей мере один CDR, содержащий аминокислотную последовательность, выбранную из группы, состоящей из:
CDR-H1. X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO:64), где:
X1 обозначает T, D, G или S;
X2 обозначает S;
X3 обозначает D;
X4 обозначает M, S, Y, L или H;
X5 обозначает G, W, Y, A, S или N;
X6 обозначает V, I или M; и
X7 обозначает D, H, S, Y, N или G;
CDR-H2. X1-X2-X3-X4-X5-X6-X7-X8-X9-X10-X11-X12-X13-X14-X15-X16-X17 (SEQ ID NO:65), где:
X1 обозначает M, E, H, R, S, G или L;
X2 обозначает I или не присутствует;
X3 обозначает H, Y, A, D, S или W;
X4 обозначает P, S, W или G;
X5 обозначает S, G, E или D;
X6 обозначает D, G, S, E или N;
X7 обозначает S, Y или G;
X8 обозначает E, N, Y, V или R;
X9 обозначает T, I или K;
X10 обозначает R, Y, I, D или A;
X11 обозначает L, Y, D или F;
X12 обозначает N, P, S или D;
X13 обозначает Q, E, D, P или S;
X14 обозначает K, M, S, T, A или V;
X15 обозначает F, L, V или M;
X16 обозначает K, R или Q; и
X17 обозначает D, G или S;
CDR-H3. X1-X2-X3-X4-X5-X6-X7-X8-X9-Х10-X11-X12-X13-X14 (SEQ ID NO:66), где:
X1 обозначает W, T, G, Υ, D или I;
X2 обозначает R, A, S, G или V;
X3 обозначает T, F, Y или S;
X4 обозначает S, T или Y;
X5 обозначает Y, F или G;
X6 обозначает F или Y;
X7 обозначает S, Y, I или F;
X8 обозначает D, L, Y или P;
X9 обозначает Y;
X10 обозначает G;
X11 обозначает Y, A, P или E;
X12 обозначает F, M, S, L или I;
X13 обозначает D, V, N или K; и
X14 обозначает Y или F;
CDR-L1. X1-X2-X3-X4-Х5-Х6-Х7-X8-X9-Х10-X11-X12-X13-X14-Х15-Х16-Х17 (SEQ ID NO:67), где:
X1 обозначает K или R;
X2 обозначает S или A;
X3 обозначает S или T;
X4 обозначает Q, K или I;
X5 обозначает N, S, T, G или E;
X6 обозначает L, T или S;
X7 обозначает L, Q или V;
X8 обозначает Y, N, H, D или T;
X9 обозначает S, I или T;
X10 обозначает S, D, N, H или Y;
X11 обозначает N или G;
X12 обозначает Q;
X13 обозначает K, F, N, E или S;
X14 обозначает N, T или S;
X15 обозначает Y или F;
X16 обозначает L, A или M; и
X17 обозначает A, D, E, H или N;
CDR-L2. X1-X2-X3-X4-X5-X6-X7 (SEQ ID NO:68), где:
X1 обозначает L, S, K, T, W или Y;
X2 обозначает V, T или A;
X3 обозначает S или N;
X4 обозначает N, K, T, M или R;
X5 обозначает R, K или L;
X6 обозначает F, D, E, H, P или A; и
X7 обозначает S, R или P; и
CDR-L3. X1-X2-X3-X4-X5-X6-X7-X8-X9 (SEQ ID NO:69), где:
X1 обозначает F, W, Q или A;
X2 обозначает Q или L;
X3 обозначает H, G, Y, W или N;
X4 обозначает N, S, T, L или Y;
X5 обозначает Y, T, S, E или H;
X6 обозначает L, V, F, Y, N, G, P или D;
X7 обозначает P или H;
X8 обозначает L, F, Y, W или R; и
X9 обозначает T или V.
Предпочтительно, антигенсвязывающий домен содержит по меньшей мере один CDR, содержащий аминокислотную последовательность, выбранную из группы, состоящей из:
остатки 31-35 SEQ ID NO:32;
остатки 50-66 SEQ ID NO:32;
остатки 99-105 SEQ ID NO:32;
остатки 24-39 SEQ ID NO:33;
остатки 55-61 SEQ ID NO:33;
остатки 94-102 SEQ ID NO:33;
остатки 31-35 SEQ ID NO:34;
остатки 50-66 SEQ ID NO:34;
остатки 99-105 SEQ ID NO:34;
остатки 24-39 SEQ ID NO:35;
остатки 55-61 SEQ ID NO:35;
остатки 94-102 SEQ ID NO:35;
остатки 31-35 SEQ ID NO:36;
остатки 50-66 SEQ ID NO:36;
остатки 99-109 SEQ ID NO:36;
остатки 24-39 SEQ ID NO:37;
остатки 55-61 SEQ ID NO:37;
остатки 94-102 SEQ ID NO:37;
остатки 31-35 SEQ ID NO:38;
остатки 50-66 SEQ ID NO:38;
остатки 99-109 SEQ ID NO:38;
остатки 31-35 SEQ ID NO:39;
остатки 50-66 SEQ ID NO:39;
остатки 99-112 SEQ ID NO:39;
остатки 24-39 SEQ ID NO:40;
остатки 55-61 SEQ ID NO:40;
остатки 94-102 SEQ ID NO:40;
остатки 31-35 SEQ ID NO:41;
остатки 50-66 SEQ ID NO:41;
остатки 99-112 SEQ ID NO:41;
остатки 31-35 SEQ ID NO:42;
остатки 50-66 SEQ ID NO:42;
остатки 99-100 SEQ ID NO:42;
остатки 24-39 SEQ ID NO:43;
остатки 55-61 SEQ ID NO:43;
остатки 94-102 SEQ ID NO:43;
остатки 31-35 SEQ ID NO:44;
остатки 50-65 SEQ ID NO:44;
остатки 98-106 SEQ ID NO:44;
остатки 24-40 SEQ ID NO:45;
остатки 56-62 SEQ ID NO:45;
остатки 95-103 SEQ ID NO:45;
остатки 32-38 SEQ ID NO:46;
остатки 52-67 SEQ ID NO:46;
остатки 100-112 SEQ ID NO:46;
остатки 24-34 SEQ ID NO:47;
остатки 50-56 SEQ ID NO:47;
остатки 89-97 SEQ ID NO:47;
остатки 31-37 SEQ ID NO:48;
остатки 52-67 SEQ ID NO:48;
остатки 100-112 SEQ ID NO:48;
остатки 24-34 SEQ ID NO:49;
остатки 50-56 SEQ ID NO:49;
остатки 89-97 SEQ ID NO:49;
остатки 31-37 SEQ ID NO:50;
остатки 52-67 SEQ ID NO:50;
остатки 100-112 SEQ ID NO:50;
остатки 24-34 SEQ ID NO:51;
остатки 60-66 SEQ ID NO:51;
остатки 89-97 SEQ ID NO:51;
остатки 31-35 SEQ ID NO:52;
остатки 50-66 SEQ ID NO:52;
остатки 99-107 SEQ ID NO:52;
остатки 23-36 SEQ ID NO:53;
остатки 52-58 SEQ ID NO:53;
остатки 91-99 SEQ ID NO:53;
остатки 31-35 SEQ ID NO:54;
остатки 50-65 SEQ ID NO:54;
остатки 98-107 SEQ ID NO:54;
остатки 24-38 SEQ ID NO:55;
остатки 54-60 SEQ ID NO:55;
остатки 93-101 SEQ ID NO:55;
остатки 31-35 SEQ ID NO:56;
остатки 50-65 SEQ ID NO:56;
остатки 98-107 SEQ ID NO:56;
остатки 24-38 SEQ ID NO:57;
остатки 54-60 SEQ ID NO:57;
остатки 93-101 SEQ ID NO:57;
остатки 31-35 SEQ ID NO:58;
остатки 50-65 SEQ ID NO:58;
остатки 98-107 SEQ ID NO:58;
остатки 24-38 SEQ ID NO:59;
остатки 54-60 SEQ ID NO:59;
остатки 93-101 SEQ ID NO:59;
остатки 31-35 SEQ ID NO:60;
остатки 50-65 SEQ ID NO:60;
остатки 98-107 SEQ ID NO:60;
остатки 24-38 SEQ ID NO:61;
остатки 54-60 SEQ ID NO:61;
остатки 93-101 SEQ ID NO:61;
остатки 31-35 SEQ ID NO:62;
остатки 50-65 SEQ ID NO:62;
остатки 98-107 SEQ ID NO:62;
остатки 24-38 SEQ ID NO:63;
остатки 54-60 SEQ ID NO:63; и
остатки 93-101 SEQ ID NO:63.
В предпочтительном варианте осуществления этот связывающий белок содержит по меньшей мере 3 CDR, выбранных из набора CDR вариабельного домена, состоящего из:
Предпочтительно, связывающий белок содержит по меньшей мере два набора CDR вариабельных доменов. Предпочтительно, по меньшей мере два набора CDR вариабельных доменов выбраны из группы, состоящей из:
Набор CDR VH 25C8 и набор CDR VL 25C8;
Набор CDR VH 9C11 и набор CDR VL 9C11;
Набор CDR VH 21D9 и набор CDR VL 21D9;
Набор CDR VH 22D10 и набор CDR VL 22D10;
Набор CDR VH 5F1 и набор CDR VL 5F1;
набор CDR VH 5G1 и набор CDR VL 5G1;
Набор CDR VH 3H7 и набор CDR VL 3H7;
Набор CDR VH 14B2 и набор CDR VL 14B2;
Набор CDR VH 13C5 и набор CDR VL 13C5;
Набор CDR VH 29G5 и набор CDR VL 29G5;
Набор CDR VH 33C3 и набор CDR VL 33C3;
Набор CDR VH 4A8 и набор CDR VL 4A8;
Набор CDR VH 1B6 и набор CDR VL 1B6;
Набор CDR VH 3E5 и набор CDR VL 3E5;
Набор CDR VH 6C8 и набор CDR VL 6C8;
Набор CDR VH 5D3 и набор CDR VL 5D3 и
набор CDR VH 8B6 и набор CDR VL 8B6.
В другом варианте осуществления описанный выше связывающий белок дополнительно содержит акцепторный каркас человека. Предпочтительно, акцепторный каркас человека содержит аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO:6,
SEQ ID NO:7,
SEQ ID NO:8,
SEQ ID NO:9,
SEQ ID NO:10,
SEQ ID NO:11,
SEQ ID NO:12,
SEQ ID NO:13,
SEQ ID NO:14,
SEQ ID NO:15,
SEQ ID NO:16,
SEQ ID NO:17,
SEQ ID NO:18,
SEQ ID NO:19,
SEQ ID NO:20,
SEQ ID NO:21,
SEQ ID NO:22,
SEQ ID NO:23,
SEQ ID NO:24,
SEQ ID NO:25,
SEQ ID NO:26,
SEQ ID NO:27,
SEQ ID NO:28,
SEQ ID NO:29,
SEQ ID NO:30 и
SEQ ID NO:31.
В предпочтительном варианте осуществления связывающим белком является CDR-трансплантированное антитело, или его антигенсвязывающая часть, способное связывать IL-13. Предпочтительно, CDR-трансплантированное антитело, или его антигенсвязывающая часть, содержит один или несколько вышеописанных CDR. Предпочтительно, это CDR-трансплантированное антитело, или его антигенсвязывающая часть, содержит акцепторный каркас человека. Более предпочтительно, акцепторным каркасом человека является любой из акцепторных каркасов человека, описанных выше.
В предпочтительном варианте осуществления связывающим белком является гуманизированное антитело, или его антигенсвязывающая часть, способное связывать IL-13. Предпочтительно, гуманизированное антитело, или его антигенсвязывающая часть, содержит один или несколько вышеописанных CDR, включенных в вариабельный домен антитела человека акцепторного каркаса человека. Предпочтительно, вариабельный домен антитела человека является консенсусным вариабельным доменом человека. Более предпочтительно, акцепторный каркас человека содержит по меньшей мере одну аминокислотную замену каркасной области в качестве ключевого остатка, причем ключевой остаток выбран из группы, состоящей из остатка, смежного с CDR; остатка сайта гликозилирования; необычного остатка; остатка, способного взаимодействовать с IL-13 человека; остатка, способного взаимодействовать с CDR; канонического остатка; контактного остатка между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи; остатка в зоне верньера и остатка в области, которая перекрывается между CDR1 вариабельной тяжелой цепи по определению Хотиа и первым каркасом тяжелой цепи по определению Кабата. Предпочтительно, акцепторный каркас человека содержит по меньшей мере одну аминокислотную замену каркасной области, причем аминокислотная последовательность данного каркаса является по меньшей мере на 65% идентичной последовательности указанного акцепторного каркаса человека и содержит по меньшей мере 70 аминокислотных остатков, идентичных указанному акцепторному каркасу человека. Предпочтительно, эта аминокислотная замена в ключевом остатке выбрана из группы, состоящей из 2L, 15L, 22L, 41L, 42L, 44L, 49L, 50L, 51L, 62L, 71L, 73L, 10H, 44H, 46H, 48H, 67H, 68H, 70H, 72H, 74H, 76H, 83H, 84H, 86H, 87H и 97H.
В предпочтительном варианте осуществления связывающим белком является гуманизированное антитело или его антигенсвязывающая часть, способные связывать IL-13. Предпочтительно, гуманизированное антитело, или его антигенсвязывающая часть, содержит один или несколько CDR, описанных выше. Более предпочтительно, гуманизированное антитело, или его антигенсвязывающая часть, содержит три или более CDR, описанных выше. Наиболее предпочтительно, гуманизированное антитело, или его антигенсвязывающая часть, содержит шесть CDR, описанных выше.
В другом варианте осуществления изобретения гуманизированное антитело, или его антигенсвязывающая часть, содержит по меньшей мере один вариабельный домен, имеющий аминокислотную последовательность, выбранную из группы, состоящей из:
SEQ ID NO:70,
SEQ ID NO:71,
SEQ ID NO:72,
SEQ ID NO:73,
SEQ ID NO:74,
SEQ ID NO:75,
SEQ ID NO:76,
SEQ ID NO:77,
SEQ ID NO:78,
SEQ ID NO:79,
SEQ ID NO:80,
SEQ ID NO:81,
SEQ ID NO:82,
SEQ ID NO:83,
SEQ ID NO:84,
SEQ ID NO:85,
SEQ ID NO:92,
SEQ ID NO:93 и
SEQ ID NO:94.
Более предпочтительно гуманизированное антитело, или его антигенсвязывающая часть, содержит два вариабельных домена, выбранных из вышеописанной группы. Более предпочтительно, связывающий белок содержит два вариабельных домена, причем указанные два вариабельных домена имеют аминокислотные последовательности, выбранные из группы, состоящей из:
SEQ ID NO:70 и SEQ ID NO:71,
SEQ ID NO:72 и SEQ ID NO:73,
SEQ ID NO:74 и SEQ ID NO:75,
SEQ ID NO:76 и SEQ ID NO:77,
SEQ ID NO:78 и SEQ ID NO:79,
SEQ ID NO:80 и SEQ ID NO:81,
SEQ ID NO:82 и SEQ ID NO:83,
SEQ ID NO:84 и SEQ ID NO:85,
SEQ ID NO:80 и SEQ ID NO:92,
SEQ ID NO:80 и SEQ ID NO:93, и
SEQ ID NO:80 и SEQ ID NO:94.
Один из вариантов осуществления изобретения относится к конструкции антитела, содержащей любой из вышеописанных связывающих белков и линкерный полипептид или иммуноглобулин. В предпочтительном варианте осуществления конструкция антитела выбрана из группы, состоящей из молекулы иммуноглобулина, моноклонального антитела, химерного антитела, CDR-трансплантированного антитела, гуманизированного антитела, Fab, Fab', F(ab')2, Fv, дисульфид-связанного Fv, scFv, однодоменного антитела, диатела, мультиспецифического антитела, антитела с двойной специфичностью и биспецифического антитела. В предпочтительном варианте осуществления эта конструкция антитела содержит константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена IgM человека, константного домена IgG1 человека, константного домена IgG2 человека, константного домена IgG3 человека, константного домена IgG4 человека, константного домена IgE человека и константного домена IgA человека. Более предпочтительно, эта конструкция антитела содержит SEQ ID NO:2; SEQ ID NO:3; SEQ ID NO:4 и SEQ ID NO:5. В другом варианте осуществления изобретение относится к конъюгату антитела, содержащему вышеописанную конструкцию и агент, выбранный из группы, состоящей из: молекулы иммуноадгезии, агента визуализации, терапевтического агента и цитотоксического средства. В предпочтительном варианте осуществления агент визуализации выбран из группы, состоящей из радиоактивной метки, фермента, флуоресцентной метки, люминесцентной метки, биолюминесцентной метки, магнитной метки и биотина. Более предпочтительно агент визуализации является радиоактивной меткой, выбранной из группы, состоящей из: 3H, 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho и 153Sm. В предпочтительном варианте осуществления терапевтическое или цитотоксическое средство выбрано из группы, состоящей из антиметаболита, алкилирующего агента, антибиотика, фактора роста, цитокина, антиангиогенного средства, антимитотического средства, антрациклина, токсина и апоптотического средства.
В другом варианте осуществления конструкция антитела является гликозилированной. Предпочтительно, гликозилирование имеет характер гликозилирования человека.
В другом варианте осуществления связывающий белок, конструкция антитела или конъюгат антитела, описанные выше, находится в виде кристалла. Предпочтительно, кристалл представляет собой фармацевтический кристалл с регулируемым высвобождением, не имеющим носителя. В предпочтительном варианте осуществления кристаллизуемый связывающий белок, кристаллизуемая конструкция антитела или кристаллизуемый конъюгат антитела имеет более высокое время полужизни in vivo, чем их растворимая копия. В другом предпочтительном варианте осуществления кристаллизуемый связывающий белок, кристаллизуемая конструкция антитела или кристаллизуемый конъюгат антитела сохраняет биологическую активность после кристаллизации.
Один из аспектов настоящего изобретения относится к DVD-связывающему белку, содержащему связывающие белки, способные связывать IL-13. Предпочтительно, DVD-связывающий белок способен связывать IL-13 и вторую мишень. Эта вторая мишень выбрана из группы, состоящей из CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNα1, IFNβ1, IFNγ, гистамина и рецепторов гистамина, IL-1α, IL-1β, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-10, IL-11, IL-12α, IL-12β, IL-14, IL-15, IL-16, IL-17, IL-18, IL-19, KITLG, PDGFB, IL-2Rα, IL-4R, IL-5Rα, IL-8Rα, IL-8Rβ, IL-12Rβ1, IL-12Rβ2, IL-13Rα1, IL-13Rα2, IL-18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы. Более предпочтительно, DVD-белок способен распознавать IL-13 и IL-1β, IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MIF; IL-13 и TGF-β; IL-13 и агонист LHR; IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b или IL-13 и ADAM8. Наиболее предпочтительно, DVD-белок способен связывать IL-13 и TNFα.
Один из аспектов настоящего изобретения относится к выделенной нуклеиновой кислоте, кодирующей связывающий белок или конструкцию антитела или конъюгат антитела, описанные выше. Другой вариант осуществления относится к вектору, содержащему выделенную нуклеиновую кислоту, описанную выше, причем указанный вектор выбран из группы, состоящей из pcDNA; pTT (Durocher et al., Nucleic Acids Research 2002, VoI 30, No.2); pTT3 (pTT с дополнительным сайтом множественного клонирования); pEFBOS (Mizushima, S. and Nagata, S., (1990) Nucleic acids Research Vol 18, No. 17); pBV; pJV и pBJ.
В другом аспекте клетку-хозяина трансформируют вышеописанным вектором. Предпочтительно, клетка-хозяин является прокариотической клеткой. Более предпочтительно, клетка-хозяин является E. coli. В другом варианте осуществления клетка-хозяин является эукариотической клеткой. Предпочтительно, эукариотическая клетка выбрана из группы, состоящей из клетки протиста (одноклеточного организма), клетки животного, клетки растения и грибной клетки. Более предпочтительно, клетка-хозяин является клеткой млекопитающего, в том числе, но не только, СНО и COS; или грибной клеткой, такой как Saccharomyces cerevisiae; или клеткой насекомого, такой как Sf9.
Другой аспект изобретения включает способ получения связывающего белка, который связывает IL-13, включающий культивирование вышеописанных клеток-хозяев в культуральной среде при условиях, достаточных для продуцирования связывающего белка, который связывает IL-13. Другой вариант осуществления относится к связывающему белку, полученному в соответствии с описанным выше способом.
Один из вариантов осуществления относится к композиции для высвобождения связывающего белка, причем эта композиция содержит готовую форму, которая, в свою очередь, содержит кристаллизуемый связывающий белок, кристаллизуемую конструкцию антитела или кристаллизуемый конъюгат антитела, описанные выше, и ингредиент; и по меньшей мере один полимерный носитель. Предпочтительно, полимерный носитель выбран из одного или нескольких из группы, состоящей из: поли(акриловой кислоты), поли(цианоакрилатов), поли(аминокислот), поли(ангидридов), поли(депсипептидов), поли(эфиров), поли(молочной кислоты), поли(сополимера молочной кислоты и гликолевой кислоты) или PLGA, поли(β-гидроксибутирата), поли(капролактона), поли(диоксанона); поли(этиленгликоля), поли((гидроксипропил)метакриламида), поли[(органо)фосфацена], поли(ортоэфиров), поли(винилового спирта), поли(винилпирролидона), сополимеров малеинового ангидрида и алкилвинилового эфира, полиолов плюроников, альбумина, альгината, целлюлозы и производных целлюлозы, коллагена, фибрина, желатина, гиалуроновой кислоты, олигосахаридов, гликаминогликанов, сульфатированных полисахаридов, их смесей и сополимеров. Предпочтительно, этот ингредиент выбран из группы, состоящей из альбумина, сахарозы, трегалозы, лактита, желатина, гидроксипропил-β-циклодекстрина, метоксиполиэтиленгликоля и полиэтиленгликоля. Другой вариант осуществления относится к способу лечения млекопитающего, включающий стадию введения млекопитающему эффективного количества вышеописанной композиции.
Изобретение также относится к фармацевтической композиции, содержащей связывающий белок, конструкцию антитела или конъюгат антитела, описанные выше, и фармацевтически приемлемый носитель. В еще одном варианте осуществления фармацевтическая композиция содержит по меньшей мере одно дополнительное терапевтическое средство для лечения нарушения, в котором активность IL-13 оказывает отрицательное воздействие на здоровье. Предпочтительно, дополнительное средство выбрано из группы, состоящей из терапевтического средства, агента визуализации, цитотоксического агента, ингибиторов ангиогенеза (в том числе, но не только, анти-VEGF-антител или VEGF-ловушки); ингибиторов киназ (в том числе, но не только, KDR- и TIE-2-ингибиторов); блокаторов костимулирующих молекул (в том числе, но не только, анти-B7.1, анти-B7.2, CTLA4-Ig, анти-CD20); блокаторов адгезионных молекул (в том числе, но не только, анти-LFA-1-Ab, анти-E/L-селектин-Ab, ингибиторов с малой молекулой); анти-цитокин-антитела или его функционального фрагмента (в том числе, но не только, антител анти-IL-18, анти-TNF, анти-IL-6/рецептор цитокина); метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста TNF; противоревматического средства; миорелаксанта, наркотического агента, нестероидного противовоспалительного средства (NSAID), анальгезирующего средства, анестетика, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства, антипсориатического средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего агента, иммуноглобулина, иммуносупрессирующего средства, гормона роста, гормонозаместительного лекарственного средства, радиофармацевтического средства, антидепрессанта, антипсихотического средства (нейролептика), стимулятора, лекарственного средства для астмы, бета-агониста, ингалируемого стероида, эпинефрина или аналога эпинефрина, цитокина и антагониста цитокина.
В другом аспекте изобретение относится к способу ингибирования активности IL-13, включающему контактирование IL-13 человека с вышеописанным связывающим белком, при котором ингибируется активность IL-13. В другом аспекте изобретение относится к способу ингибирования активности IL-13 человека у индивида-человека, страдающего от нарушения, связанного с активностью IL-13, включающему введение этому индивиду вышеописанного связывающего белка, при этом активность IL-13 человека у индивида ингибируется, и происходит лечение.
В другом аспекте изобретение относится к способу лечения (например, лечения, супрессии, ослабления, задержки или профилактики появления или предотвращения повторяемости или рецидива) или профилактики IL-13-опосредованного нарушения у индивида. Способ предусматривает: введение индивиду IL-13-связывающего агента (в частности, антагониста); например, анти-IL-13-антитела или его фрагмента, описанных в настоящем описании, в количестве, достаточном для лечения или предупреждения IL-13-опосредованного нарушения. Этот антагонист IL-13, например, анти-IL-13-антитело или его фрагмент, может быть введен этому индивиду отдельно или в комбинации с другими терапевтическими схемами, как описано в настоящем описании.
В одном из вариантов осуществления индивидом является млекопитающее, например, человек, страдающий одним или несколькими IL-13 нарушениями, включающими, например, респираторные нарушения (например, астму (например, аллергическую и неаллергическую астму), хроническую обструктивную болезнь легких (COPD, ХОБЛ) и другие состояния, включающие воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи; атопические нарушения (например, атопический дерматит и аллергический ринит); воспалительные и/или аутоиммунные состояния кожи, желудочно-кишечных органов (например, воспалительных заболеваний пищеварительного тракта (IBD), таких как язвенный колит и/или болезнь Крона), и печени (например, цирроза, фиброза); склеродермии; опухоли или раковые опухоли, например, лимфому Ходжкина, как описано в настоящем описании. Таким образом, изобретение относится к применению IL-13-связывающего агента (такого как анти-IL-13-антитело или его фрагмент, описанные в настоящем описании) для описанного лечения и применение IL-13-связывающего агента (такого как анти-IL-13-антитело или его фрагмент, описанные в настоящем описании) для получения лекарственного средства для описанного лечения. Примеры IL-13-опосредованных заболеваний включают, но не ограничиваются ими, нарушение, выбранное из одного или нескольких из: респираторных нарушений (например, астмы (например, аллергической и неаллергической астмы (например, астмы вследствие инфицирования, например, респираторным синцитиальным вирусом (RSV), например, у детей малого возраста)), хронической обструктивной болезни легких (COPD, ХОБЛ) и других состояний, включающих воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи, например, муковисцидоз и пневмофиброз; атопических нарушений, например, происходящих из увеличенной чувствительности к IL-13 (например, атопического дерматита, крапивницы, экземы, аллергического ринита и аллергического энтерогастрита); воспалительных и/или аутоиммунных состояний кожи (например, атопического дерматита), желудочно-кишечных органов (например, воспалительных заболеваний пищеварительного тракта (IBD), таких как язвенный колит и/или болезнь Крона), печени (например, цирроза, гепатоцеллюлярной карциномы) и склеродермии; опухолей или раковых опухолей (например, мягкой ткани или солидных опухолей), таких как лейкоз, глиобластома и лимфома, например, лимфома Ходжкина; вирусных инфекций (например, из HTLV-1); фиброза других органов, например, фиброза печени (например, фиброза, вызываемого вирусом гепатита В и/или С); и супрессии проявления иммунных реакций защитного типа 1 (например, во время вакцинации), как описано в настоящем описании.
В других вариантах осуществления изобретение относится к способу лечения (т.е. уменьшения, ослабления) или профилактики одного или нескольких симптомов, связанных с респираторным нарушением, например, астмой (например, аллергической и неаллергической астмой); аллергиями; хронической обструктивной болезнью легких (COPD, ХОБЛ); состоянием, включающим воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи, например, муковисцидозом и пневмофиброзом. Например, симптомы астмы включают, но не ограничиваются ими, свистящее дыхание, одышку, бронхостеноз, гиперреактивность дыхательных путей, уменьшенную емкость легких, фиброз, воспаление дыхательных путей и продуцирование слизи. Способ включает введение этому индивиду антагониста IL-13, например, IL-13-антитела или его фрагмента, в количестве, достаточном для лечения (например, уменьшения, ослабления) или профилактики одного или нескольких симптомов. IL-13-антитело можно вводить терапевтически или профилактически или обоими способами. Антагонист IL-13, например, анти-IL-13-антитело или его фрагмент, можно вводить индивиду отдельно или в сочетании с другими терапевтическими режимами, как описано в настоящем описании. Предпочтительно, индивидом является млекопитающее, например, человек, страдающий IL-13-опосредованным нарушением, описанным в настоящем описании.
В другом аспекте изобретение относится к способу детекции IL-13 в пробе in vitro (например, биологической пробе, такой как сыворотка, плазма, ткань, биопсия). Рассматриваемый способ может быть использован для диагностики нарушения, например, связанного с иммунными клетками нарушения. Способ предусматривает: (i) контактирование пробы или контрольной пробы с анти-IL-13-антителом или его фрагментом, описанными в настоящем описании; и (ii) детектирование образования комплекса между анти-IL-13-антителом или его фрагментом и пробой или контрольной пробой, причем статистически значимое изменение в образовании комплекса в пробе относительно контрольной пробы является показателем наличия IL-13 в этой пробе.
Еще в одном аспекте изобретение относится к способу детекции IL-13 in vivo (например, визуализации in vivo в индивиде). Рассматриваемый способ может быть использован для диагностики нарушения, например, IL-13-опосредованного нарушения. Способ включает: (i) введение анти-IL-13-антитела или его фрагмента, описанных в настоящем описании, индивиду или контрольному индивиду в условиях, при которых возможно связывание антитела или фрагмента с IL-13; и (ii) детектирование комплекса между анти-IL-13-антителом или его фрагментом и IL-13, причем статистически значимое изменение в образовании комплекса у индивида относительно контрольного индивида является показателем наличия IL-13.
В другом аспекте связывающие белки изобретения можно использовать для лечения нарушения, выбранного из группы, состоящей из артрита, остеоартрита, ювенильного хронического артрита, септического артрита, артрита Лайма, псориатического артрита, реактивного артрита, спондилоартропатии, системной красной волчанки, болезни Крона, язвенного колита, воспалительного заболевания пищеварительного тракта, инсулинзависимого сахарного диабета, тироидита, астмы, аллергических заболеваний, псориаза, дерматита, склеродермии, реакции трансплантат против хозяина, отторжения трансплантированного органа, острого или хронического иммунного заболевания, связанного с трансплантацией органа, саркоидоза, атеросклероза, диссеминированного внутрисосудистого свертывания, болезни Кавасаки, болезни Грейвса, нефротического синдрома, синдрома хронической усталости, гранулематоза Вегенера, пурпуры Шенлейна-Геноха, микроскопического васкулита почек, хронического активного гепатита, увеита, септического шока, синдрома токсического шока, синдрома сепсиса, кахексии, инфекционных заболеваний, паразитарных заболеваний, синдрома приобретенного иммунодефицита, острого поперечного миелита, хореи Хантингтона, болезни Паркинсона, болезни Альцгеймера, инсульта, первичного билиарного цирроза, гемолитической анемии, злокачественностей, сердечной недостаточности, болезни Аддисона, спорадической, плюригландулярной недостаточности типа I и плюригландулярной недостаточности типа II, синдрома Шмидта, (острого) дистресс-синдрома взрослых, алопеции, гнездной (очаговой) алопеции, серонегативной артропатии, артропатии, болезни Рейтера, псориатической артропатии, связанной с язвенным колитом артропатия, энтеропатического синовита, связанной с хламидией, иерсинией и сальмонеллой артропатии, спондилоартропатии, атероматозного заболевания/артериосклероза, апопической аллергии, аутоиммунного буллезного заболевания, обыкновенной пузырчатки, листовидной пузырчатки, линейного IgA-заболевания, аутоиммунной гемолитической анемии, Кумбс-положительной гемолитической анемии, приобретенной пенициозной анемии, ювенильной пенициозной анемии, миалгического энцефалита/британского миалгического энцефалита, поражающего кожу и слизистые оболочки кандидоза, гигантоклеточного артериита, первичного склерозирующего гепатита, криптогенного аутоиммунного гепатита, приобретенного синдрома иммунодефицита, родственных заболеваний приобретенного иммунодефицита, гепатита В, гепатита С, вариабельного неклассифицируемого иммунодефицита (вариабельной неклассифицируемой гипогаммаглобулинемии), дилатационной (застойной) кардиомиопатии, женского бесплодия, нарушения функции яичников, преждевременного нарушения функции яичников, фибротического заболевания легких, криптогенного фиброзирующего альвеолита, поствоспалительного интерстициального заболевания легких, интерстициального пневмонита, связанного с заболеванием соединительной ткани интерстициального легочного заболевания, связанного с ревматоидным артритом интерстициального легочного заболевания, связанного с системной красной волчанкой интерстициального легочного заболевания, связанного с дерматомиозитом/полимиозитом легочного заболевания, связанного с болезнью Шегрена легочного заболевания, связанного с анкилозирующим спондилитом легочного заболевания, васкулитного диффузного легочного заболевания, связанного с гемосидерозом легочного заболевания, индуцированного лекарственным средством интерстициального легочного заболевания, фиброза, лучевого фиброза, облитерирующего (констриктивного) бронхиолита, хронической эозинофильной пневмонии, лимфоцитарного инфильтративного легочного заболевания, постинфекционного интерстициального легочного заболевания, подагрического артрита, аутоиммунного гепатита, аутоиммунного гепатита типа 1 (классического аутоиммунного или волчаночного гепатита), аутоиммунного гепатита типа 2 (гепатита с анти-LKM-антителом), аутоиммунно опосредованной гипогликемии, инсулинорезистентности типа В с черным акантозом, гипопаратиреоидизма, острого иммунного заболевания, связанного с трансплантацией органов, хронического иммунного заболевания, связанного с трансплантацией органов, остеоартроза, первичного склерозирующего холангита, псориаза типа 1, псориаза типа 2, идиопатической лейкопении, аутоиммунной нейтропении, ренального заболевания NOS (БДУ), гломерулонефрита, микроскопического васкулита почек, болезни Лайма, дискоидной красной волчанки, мужского бесплодия, идиопатического или NOS (БДУ), аутоиммунности спермы, рассеянного склероза (всех типов), симпатической офтальмии, легочной гипертензии, вторичной относительно заболевания соединительной ткани, синдрома Гудпасчера, легочной манифестации нодозного полиартериита, острой ревматической лихорадки, ревматоидного спондилита, болезни Стилла, системного склероза, синдрома Шегрена, болезни Такаясу/артериита, аутоиммунной тромбоцитопении, идиопатической тромбоцитопении, аутоиммунного тиреоидного заболевания, гипертиреоза, зобного аутоиммунного гипотиреоза (болезни Хашимото), атрофического аутоиммунного гипотиреоза, первичной микседемы, факоантигенного увеита, первичного васкулита, заболевания печени с очаговой пигментацией кожи (витилиго), хронических заболеваний печени, алкогольного цирроза, индуцированного алкоголем повреждения печени, холеостеатоза, идиосинкратического заболевания печени, индуцированного лекарственным средством гепатита, неалкогольного стеатогепатита, аллергии и астмы, инфекции стрептококков группы В (GBS), психических нарушений (например, депрессии и шизофрении), опосредованных Th2 и Th1 заболеваний, острой и хронической боли (различных форм боли) и раковых заболеваний, таких как рак легкого, молочной железы, желудка, мочевого пузыря, ободочной кишки, поджелудочной железы, яичника, предстательной железы, ректального рака и гематопоэтических злокачественностей (лейкоза и лимфомы), абеталипопротеинемии, акроцианоза, острых и хронических паразитарных или инфекционных процессов, острого лейкоза, острого лимфобластного лейкоза (ALL), острого миелобластного лейкоза (AML), острой или хронической бактериальной инфекции, острого панкреатита, острой почечной недостаточности, аденокарцином, атриального эктопического ритма, комплекса СПИД-деменция, индуцированного алкоголем гепатита, аллергического конъюнктивита, аллергического контактного дерматита, аллергического ринита, отторжения трансплантата, недостаточности альфа-1-антитрипсина, амиотрофического бокового склероза, анемии, стенокардии, дегенерации клеток переднего рога, анти-CD3-терапии, антифосфолипидного синдрома, реакций гиперчувствительности против рецептора, аневризм аорты и периферических аневризм, расслаивающей аневризмы аорты, артериальной гипертензии, артериосклероза, артериовенозного свища, атаксии, мерцательной аритмии (атриальной фибрилляции) (поддерживаемой или пароксизмальной), трепетания предсердий, атриовентрикулярной блокады, В-клеточной лимфомы, отторжения костного трансплантата, отторжения трансплантата костного мозга (BMT), блокады ножки пучка Гиса, лимфомы Беркитта, ожогов, сердечных аритмий, синдрома временной остановки сердца, опухолей сердца, кардиомиопатии, воспалительной реакции при экстракорпоральном кровообращении, отторжения трансплантата хряща, мозжечковых кортикальных дегенераций, мозжечковых нарушений, хаотической или многоочаговой предсердной тахикардии, связанных с химиотерапией нарушений, хронического миелоцитарного лейкоза (CML), хронического алкоголизма, хронических воспалительных патологий, хронического лимфоцитарного лейкоза (CLL), хронической обструктивной болезни легких (COPD, ХОБЛ), хронической интоксикации салицилатом, колоректальной карциномы, застойной сердечной недостаточности; конъюнктивита, контактного дерматита, легочного сердца (cor pulmonale), заболевания коронарной артерии, болезни Крейтцфельдта-Якоба, культура-негативного сепсиса, муковисцидоза, связанных с терапией цитокинами нарушений, деменции боксеров, демиелинизирующих заболеваний, геморрагической лихорадки Денге, дерматита, дерматологических состояний, диабета, сахарного диабета, диабетического атеросклеротического заболевания, болезни с диффузными тельцами Леви, дилатационной застойной кардиомиопатии, нарушений базальных ядер, синдрома Дауна в среднем возрасте, индуцированных лекарственным средством нарушений движения, которые блокируют рецепторы допамина ЦНС, чувствительности к лекарственным средствам, экземы, энцефаломиелита, эндокардита, эндокринопатии, эпиглоттита, инфекции вируса Эпштейна-Барр, эритромелалгии, экстрапирамидных и мозжечковых нарушений, семейного гематофагоцитарного лимфогистиоцитоза, фетального отторжения имплантата вилочковой железы (тимуса), атаксии Фридрейха, функциональных периферических артериальных нарушений, грибкового сепсиса, газовой гангрены, язвы желудка, гломерулярного нефрита, отторжения трансплантата любых органа или ткани, грамотрицательного сепсиса, грамположительного сепсиса, гранулем вследствие внутриклеточных организмов, ретикулоэндотелиоза, болезни Халлерродена-Шпатца, тиреоидита Хашимото, сенной лихорадки, отторжения трансплантата сердца, гемохроматоза, гемодиализа, гемолитического уремического синдрома/тромболитической тромбоцитопенической пурпуры, кровотечения, гепатита (A), аритмии пучков Гиса, ВИЧ-инфекции/ВИЧ-невропатии, болезни Ходжкина, гиперкинетических нарушений движений, реакций гиперчувствительности, гиперчувствительного пневмонита, гипертензии, гипокинетических нарушений движений, оценки системы гипоталамус-гипофиза-надпочечников, идиопатической болезни Аддисона, идиопатического пневмофиброза, опосредованной антителом цитотоксичности, астении, детской спинально-мышечной атрофии, воспаления аорты, гриппа А, воздействия ионизирующей радиацией, иридоциклита/увеита/ретробульбарного неврита, ишемического-реперфузионного повреждения, ишемического инсульта, ювенильного ревматоидного артрита, ювенильной спинально-мышечной атрофии, саркомы Капоши, отторжения трансплантата почки, болезни легионеров, лейшманиоза, проказы, повреждений кортико-спинальной системы, липодемии, отторжения трансплантата печени, лимфедемы, малярии, злокачественной лимфомы, злокачественного гистиоцитоза, злокачественной меланомы, менингита, менингококкемии, метаболической/идиопатической мигрени-головной боли, нарушения митохондриальной мультисистемы, заболевания смешанной соединительной ткани, моноклональной гаммапатии, множественной миеломы, дегенераций множественных систем (Менцеля-Томаса Ши-Дрегера и Махадо-Жозефа), тяжелой псевдопаралитической миастении, Mycobacterium avium intracellulare, Mycobacterium tuberculosis, миелопластического синдрома, инфаркта миокарда, ишемических нарушений миокарда, носоглоточного рака, неонатального хронического заболевания легких, нефрита, нефроза нейродегенеративных заболеваний, нейрогенных мышечных атрофий I, нейтропенической лихорадки, не-ходжкинской лимфомы, окклюзии брюшной аорты и ее ответвлений, окклюзионных артериальных нарушений, okt3-терапии, орхита/эпидидимита, процедур аннулирования орхита/вазэктомии, органомегалии, остеопороза, отторжения трансплантата поджелудочной железы, рака поджелудочной железы, паранеопластического синдрома/гиперкальциемии злокачественности, отторжения трансплантата паращитовидной железы, воспалительного заболевания тазовой полости, хронического аллергического ринита, заболевания перикарда, периферического атеросклеротического заболевания, периферических сосудистых заболеваний, перитонита, пернициозной анемии, пневмонии, вызываемой Pneumocystis carinii, пневмонии, синдрома POEMS (полиневропатии, органомегалии, эндокринопатии, моноклональной гаммапатии и синдрома изменений кожи), постперфузионного синдрома, постгемодиализного синдрома, синдрома пост-MI-кардиотомии, преэклампсии, прогрессирующего супрануклеарного паралича, первичной легочной гипертензии, лучевой терапии, феномена и заболевания Рейно, болезни Рефсума, регулярной тахикардии с узким QRS, вазоренальной гипертензии, реперфузионного повреждения, рестриктивной кардиомиопатии, сарком, склеродермии, сенильной хореи, сенильной деменции, развивающейся при болезни диффузных телец Леви, серонегативных артропатий, шока, серповидно-клеточной анемии, отторжения кожного трансплантата, синдрома изменений кожи, отторжения трансплантата тонкой кишки, солидных опухолей, конкретных аритмий, спинальной атаксии, спинально-мозжечковых дегенераций, стрептококкового миозита, структурных повреждений мозжечка, подострого склерозирующего панэнцефалита, синкопе (обморока), сифилиса сердечно-сосудистой системы, системной анафилаксии, синдрома системной воспалительной реакции, ревматоидного артрита системного проявления, T-клеточного или FAB ALL, телеангиэктазии, облитерирующего тромбангиита, тромбоцитопении, токсичности, трансплантатов, травмы/кровотечения, реакций гиперчувствительности типа III, реакций гиперчувствительности типа IV, нестабильной стенокардии, уремии, уросепсиса, крапивницы, клапанных заболеваний сердца, варикозных вен, васкулита, венозных заболеваний, венозного тромбоза, фибрилляции желудочков, вирусных и грибковых инфекций, угрожающего жизни энцефалита/асептического менингита, угрожающего жизни гемофагоцитарного синдрома, синдрома Вернике-Козакова, болезни Вильсона, отторжения трансплантата любых органа или ткани, острых коронарных синдромов острого идиопатического полиневрита, острой воспалительной демиелинизирующей полирадикулоневропатии, острой ишемии, болезни Стилла взрослых, гнездной (очаговой алопеции, анафилаксии, синдрома антифосфолипидных антител, апластической анемии, артериосклероза, атопической экземы, атопического дерматита, аутоиммунного дерматита, аутоиммунного нарушения, связанного с инфекцией Streptococcus, аутоиммунной энтеропатии, аутоиммунной потери слуха, аутоиммунного лимфопролиферативного синдрома (ALPS), аутоиммунного миокардита, аутоиммунного преждевременного угасания функции яичника, блефарита, бронхоэктаза, буллезной пузырчатки, сердечно-сосудистого заболевания, острого антифосфолипидного синдрома, глютеновой энтеропатии (спру), шейного спондилеза, хронической ишемии, рубцовой пузырчатки, клинически выделенного синдрома (CIS) с риском рассеянного склероза, конъюнктивита, проявления психиатрического нарушения у детей, хронической обструктивной болезни легких (COPD, ХОБЛ), дакриоцистита, дерматомиозита, диабетической ретинопатии, сахарного диабета, грыжи межпозвоночного диска, пролапса грыжи, индуцированной лекарственным средством иммунной гемолитической анемии, эндокардита, эндометриоза, эндофтальмита, эписклерита, многоформной (экссудативной) эритемы, большой многоформной эритемы, гестационной пузырчатки, синдрома Гийена-Барре (GBS), сенной лихорадки, синдрома Hughes, идиопатической болезни Паркинсона, идиопатической интерстициальной пневмонии, IgE-опосредованной аллергии, иммунной гемолитической анемии, миозита с тельцами включений, инфекционного глазного воспалительного заболевания, воспалительного димелинизирующего заболевания, воспалительного заболевания сердца, воспалительного заболевания почек, IPF/UIP, ирита, кератита, сухого кератоконъюнктивита, болезни Куссмауля или болезни Куссмауля-Мейера, паралича Ландри, гистиоцитоза клеток Лангерганса, ретикулярного ливедо, дегенерации желтого пятна, микроскопического полиангиита, болезни Бехтерева; нарушений мотонейронов, пузырчатки слизистой оболочки, нарушений функций множественных органов, тяжелой псевдопаралитической миастении, миелодиспластического синдрома, миокардита, нарушений нервных окончаний, невропатии, гепатита ни А, ни В, неврита зрительного нерва (ретробульбарного неврита), остеолиза, ювенильного ревматоидного артрита (JRA) с малым количеством пораженных суставов, окклюзивного заболевания периферических артерий (PAOD), заболевания периферических сосудов (PVD), заболевания периферических артерий (PAD), флебита, нодозного полиартериита (или нодозного периартериита), полихондрита, ревматической полимиалгии (PMR), постгемодиализного синдрома, первичного паркинсонизма, простатита, истинной эритроцитарной аплазии, первичной недостаточности надпочечников, рецидивирующего нейромиелита зрительного нерва, рестеноза, ревматического заболевания сердца, SAPHO (синовита, акне, пустулеза, гиперостоза и остеита), склеродермии, вторичного амилоидоза, синдрома шокового легкого, склерита, ишиалгии, вторичной недостаточности надпочечников, кремний-связанной болезни соединительной ткани, синдром Снеддона-Уилкинсона, анкилозирующего спондилита, синдрома Стевенса-Джонсона (SJS), синдрома системной воспалительной реакции, артериита височных артерий, токсоплазмозного ретинита, токсического эпидермального некролиза, поперечного миелита, TRAPS (рецептора фактора некроза опухолей, аллергической реакции типа I, диабета типа II, крапивницы), обычной интерстициальной пневмонии (UIP), васкулита, весеннего конъюнктивита, синдрома Фогта-Коянаги-Харада (синдрома VKH), влажной дегенерации желтого пятна и заживления ран.
В другом аспекте связывающие белки настоящего изобретения применимы для лечения нарушения, выбранного из группы, состоящей из острого лимфобластного лейкоза, острого миелоидного лейкоза, адренокортикальной карциномы, анального рака, рака аппендикса, мозжечковой астроцитомы, церебральной астроцитомы, базальноклеточной карциномы, внепеченочного рака желчных протоков, рака мочевого пузыря, рака кости, остеосаркомы/злокачественной фиброзной гистиоцитомы/глиомы ствола головного мозга, опухоли головного мозга, глиомы ствола головного мозга, церебральной астроцитомы/злокачественной глиомы, эпендимомы, медуллобластомы, супратенториальных недифференцированных нейроэктодермальных опухолей, глиом зрительного пути и гипоталамических глиом, рака молочной железы, бронхиальных аденом/карциноидов, карциноидной опухоли, желудочно-кишечного рака неизвестного происхождения, лимфомы центральной нервной системы, первичной мозжечковой астроцитомы, рака шейки матки, хронического лимфоцитарного лейкоза, хронического миелогенного лейкоза хронических миелопролиферативных нарушений, рака ободочной кишки, колоректального рака, кожной Т-клеточной лимфомы, эндометриального рака, эпендимомы, рака пищевода, семейства опухолей Эвинга, экстракраниальной герминомы (эмбрионально-клеточной опухоли), экстрагонадной герминомы, внепеченочного рака желчных протоков, глазного рака, внутриглазной меланомы/ретинобластомы, рака желчного пузыря, рака желудка, карциноидной опухоли желудочно-кишечного тракта, стромальной опухоли желудочно-кишечного тракта (GIST), экстракраниальной герминомы, экстрагонадной герминомы, герминомы яичника, гестационной трофобластной опухоли, глиомы, глиомы головного мозга, церебральной астроцитомы/глиомы, глиомы зрительного пути и гипоталамуса детей, ретикулоэндотелиоза, рака головы и шеи, гепатоцеллюлярного рака, лимфомы Ходжкина, гипофарингеального рака, внутриглазной меланомы, карциномы островковых клеток (эндокринной поджелудочной железы), саркомы Капоши, рака почки, ларингеального рака, острого лимфобластного лейкоза, острого миелоидного лейкоза, хронического лимфоцитарного лейкоза, ретикулоэндотелиоза, рака губ и полости рта, рака печени, немелкоклеточного рака легкого, мелкоклеточного рака легкого, СПИД-связанной лимфомы, лимфомы Беркитта, кожной Т-клеточной лимфомы, лимфомы Ходжкина, не-ходжкинской лимфомы, первичной лимфомы центральной нервной системы, макроглобулинемии Вальденстрома, злокачественной фиброзной гистиоцитомы кости/остеосаркомы, медуллобластомы, меланомы, внутриглазной меланомы, рака из клеток Меркеля, злокачественной мезотелиомы, метастатического плоскоклеточного рака шеи со скрытым первичным происхождением, рак полости рта, синдром множественной эндокринной неоплазии, множественной миеломы/неоплазмы плазмацитов, вызванной грибками саркомы кожи, миелодиспластических синдромов, миелодиспластических/миелопролиферативных синдромов, миелогенного лейкоза, хронического миелоидного лейкоза, множественной миеломы, миелопролиферативных нарушений, рака носовой полости и околоносовых пазух, рака носоглотки, нейробластомы, орального рака, рака полости рта, рака губ и носоглотки, остеосаркомы/злокачественной волокнистой гистиоцитомы кости, рака яичника, эпителиального рака яичника, герминомы яичника, потенциальной опухоли яичника с низкой злокачественностью, рака поджелудочной железы, рака панкреатических островковых клеток, рака околоносовых пазух и полости носа, рака паращитовидной железы, рака полового члена, фарингеального рака, феохромоцитомы, пинеобластомы и супратенториальных недифференцированных нейроэктодермальных опухолей, опухоли гипофиза, неоплазмы плазмацитов/множественной миеломы, плевропульмональной бластомы, рака предстательной железы, ректального рака, почечноклеточного рака, рака почечной лоханки и мочеточника, переходноклеточного рака, ретинобластомы, рака слюнных желез, саркомы, опухолей семейства Эвинга, саркомы Капоши, саркомы мягких тканей, саркомы матки, синдрома Сезари, рака кожи (не-меланомы), рака кожи (меланомы), карциномы клеток Меркеля, рака тонкой кишки, плоскоклеточного рака, метастатического плоскоклеточного рака шеи со скрытым первичным происхождением, рака желудка, супратенториальных недифференцированных нейроэктодермальных опухолей, кожной Т-клеточной лимфомы, рака яичек рака глотки, тимомы, тимомы и тимической карциномы, рака щитовидной железы, переходноклеточного рака почечной лоханки и мочеточника, гестационной трофобластной опухоли мочеточника и почечной лоханки, переходноклеточного рака, рака мочеиспускательного канала, рака матки, саркомы эндометрия матки, рака вагины, глиомы зрительного пути и гипоталамуса, рака вульвы, макроглобулинемии Вальденстрема, опухоли Вильмса.
В другом аспекте настоящее изобретение обеспечивает способ лечения пациента, страдающего от нарушения, в котором IL-13 человека является вредным для здоровья, предусматривающий стадию введения любого из связывающих белков, описанных выше, до, одновременно или после введения второго агента, как обсуждалось выше. В предпочтительном варианте осуществления дополнительный терапевтический агент, который может вводиться одновременно и/или может быть приготовлен с одним или несколькими антагонистами IL-13 (например, анти-IL-13-антителами или их фрагментами), включает, но не ограничиваются ими, один или несколько из: ингалируемых стероидов; вводимых перорально стероидов; бета-агонистов, например, краткосрочно действующих или долгосрочно действующих бета-агонистов; антагонистов лейкотриенов или рецепторов лейкотриенов; комбинированных лекарственных средств, таких как ADVAIR; ингибиторов IgE, например, анти-IgE-антител (например, XOLAIR); ингибиторов фосфодиэстеразы (например, ингибиторов PDE4); ксантинов; антихолинергических лекарственных средств; стабилизирующих мастоциты агентов, таких как кромолин; ингибиторов IL-4; ингибиторов IL-5; ингибиторов эотаксина/CCR3; антагонистов гистамина или его рецепторов, включающих H1, H2, H3 и H4, и антагонистов простагландина D или его рецепторов (DP1 и CRTH2). Такие комбинации могут быть использованы для лечения астмы и других респираторных нарушений. Дополнительные примеры терапевтических агентов, которые могут быть совместно введены или приготовлены вместе с одним или несколькими анти-IL-13-антителами или их фрагментами, включают один или несколько из: антагонистов TNF (например, растворимого фрагмента TNF-рецептора, например, р55 или р75 рецептора TNF человека или его производных, например, TNFR-IgG с размером 75 кДа (слитый белок с размером 75 кДа TNF-рецептор-IgG, ENBREL)); антагонисты TNF-фермента, например, ингибиторы TNF-превращающего фермента (TACE); антагонисты мускаринового рецептора; антагонисты TGF-β; интерферон гамма; перфенидон; химиотерапевтические агенты, например, метотрексат, лефлуномид или сиролимус (рапамицин) или его аналог, например, CCI-779; ингибиторы COX2 и cPLA2; NSAID; иммуномодуляторы; ингибиторы p38, TPL-2, MK-2 и ингибиторы NF-κB, среди прочих. Дополнительный второй агент выбран из группы, состоящей из буденосида, эпидермального фактора роста, кортикостероида, циклоспорина, сульфалазина, аминосалицилатов, 6-меркаптопурина, азатиоприна, метронидазола, ингибиторов липоксигеназы, мезаламина, олсалазина, балсалазида, антиоксидантов, ингибиторов тромбоксана, антагонистов IL-1-рецепторов, моноклональных антител анти-IL-1β, моноклональных антител анти-IL-6, факторов роста, ингибиторов эластазы, пиридинилимидазольных соединений, антител или агонистов TNF, LT, IL-1, IL-2, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, EMAP-II, GM-CSF, FGF и PDGF, антител CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов, метотрексата, циклоспорина, FK506, рапамицина, микофенолята-мофетила, лефлуномида, NSAID, ибупрофена, кортикостероидов, преднизолона, ингибиторов фосфодиэстеразы, агонистов аденозина, антитромботических агентов, ингибиторов комплемента, адренергических агентов, ингибиторов IRAK, NIK, IKK, p38, MAP-киназы, ингибиторов IL-1β-превращающего фермента, ингибиторов TNFα-превращающего фермента, ингибиторов передачи сигнала Т-клеток, ингибиторов металлопротеиназы, сульфалазина, азатиоприна, 6-меркаптопуринов, ингибиторов ангиотензин-превращающего фермента, растворимых рецепторов цитокинов, растворимого рецептора TNF р55, растворимого рецептора TNF р75, sIL-1RI, sIL-1RII, sIL-6R, противовоспалительных цитокинов, IL-4, IL-10, IL-11 и TGFβ.
В предпочтительном варианте осуществления вышеописанные фармацевтические композиции вводят индивиду по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, внутримозжечкового, интрацеребровентрикулярного, внутрь толстой кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутрибрюшинного, интраперикардиального, интраперитонеального, интраплеврального, внутрипростатного, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, интраторакального, внутриматочного, внутрипузырного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов.
Один из аспектов изобретения относится по меньшей мере к одному IL-13-антиидиотипическому антителу, по меньшей мере к одному IL-13-связывающему белку по изобретению. Антиидиотипическое антитело включает любую белок- или пептид-содержащую молекулу, которая содержит по меньшей мере часть молекулы иммуноглобулина, такую как, но не только, по меньшей мере одну область, определяющую комплементарность (CDR) тяжелой цепи или легкой цепи или его лиганд-связывающую часть, вариабельную область тяжелой цепи или легкой цепи, константную область тяжелой цепи или легкой цепи, каркасную область или их любую часть, которая может быть включена в связывающий белок по изобретению.
Подробное описание изобретения
Изобретение относится к белкам, связывающим IL-13 человека, в частности, к анти-IL-антителам, или их антигенсвязывающим частям, которые связывают IL-13. Различные аспекты изобретения относятся к антителам и фрагментам антител и их фармацевтическим композициям, а также к нуклеиновым кислотам, рекомбинантным экспрессирующим векторам и клеткам-хозяевам для получения таких антител и фрагментов. Изобретение также относится к способам применения антител по изобретению для детектирования IL-13 человека, ингибирования активности IL-13 человека, либо in vitro, либо in vivo, и регуляции экспрессии генов.
Если не указано иного, научные и технические термины, используемые в данном изобретении, имеют значения, общепринятые в данной области и понятные среднему специалисту. Однако, следует отметить, что в случае любой неясности представленные в настоящем описании определения главенствуют над любым определением справочников или посторонним определением. Далее, если контекст не подразумевает другого, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. В настоящей заявке «или» означает «и/или», если не указано другого. Кроме того, использование термина «включающий», а также другие формы, такие как «включает» и «включали» не являются ограничивающими. Такие термины, как «элемент» и «компонент» включают как элементы и компоненты, содержащие одну единицу, так и элементы и компоненты, которые содержат более одной субъединицы, если нет других указаний.
Обычно номенклатура, используемая в связи со способами, и способы культуры клеток и тканей, молекулярной биологии, иммунологии, микробиологии, генетики и химии белков и нуклеиновых кислот и гибридизации, описанные в настоящем описании, являются номенклатурами и способами, хорошо известными и обычно используемыми в данной области. Эти методы и способы по изобретению обычно выполняют в соответствии с общепринятыми способами, хорошо известными в данной области, описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются во всем описании, если нет других указаний. Ферментативные реакции и способы очистки в соответствии с указаниями изготовителя, как обычно осуществляется в данной области или как описано в настоящем описании. Номенклатуры, используемые в связи с лабораторными процедурами и способами, и лабораторные процедуры и способы аналитической химии, синтетической органической химии и медицинской и фармацевтической химии, описанные в настоящем описании, являются номенклатурами и процедурами и способами, хорошо известными и обычно используемыми в данной области. Стандартные способы используются для химических синтезов, химических анализов, фармацевтического получения, приготовления и доставки и лечения пациентов.
Для лучшего понимания изобретения выбранные термины определены ниже.
Термин «полипептид» относится в данном контексте к любой полимерной цепи аминокислот. Термины «пептид» и «белок» используются взаимозаменяемо с термином «полипептид» и также относятся к полимерной цепи аминокислот. Термин «полипептид» включает природные или искусственные белки, фрагменты белков и полипептидные аналоги белковой последовательности. Полипептид может быть мономерным и полимерным.
Термин «выделенный белок» или «выделенный полипептид» обозначает белок или полипептид, который вследствие его происхождения или источника деривации не связан с природно связанными компонентами, которые сопровождают его в его природном состоянии; он по существу не содержит других белков из того же самого вида; экспрессируется клеткой из отличающегося вида; или не существует в природе. Таким образом, полипептид, который химически синтезирован или синтезирован в клеточной системе, отличающейся от клетки, из которой он природно происходит, будет «выделенным» из его природно связанных компонентов посредством выделения. Белок может быть также освобожден от природно связанных компонентов выделением с использованием способов очистки белка, хорошо известными в данной области.
Термин «выделение» относится в этом контексте к способу получения химической молекулы, такой как полипептид, по существу свободной от природных компонентов посредством выделения, например, с использованием способов очистки белка, хорошо известных в данной области.
Термины «IL-13 человека» и «IL-13 человека дикого типа» (сокращаемые в настоящем описании как hIL-13, hIL-13wt), включают в данном контексте цитокин человека, который секретируется первично Т-хелперными клетками 2. Этот термин включает мономерный полипептид с размером 13 кДа. Структура IL-13 человека описана дополнительно, например, в Moy, Diblasio et al. 2001 J Mol Biol 310 219-30. Предполагается, что термин IL-13 человека включает рекомбинантный IL-13 человека (rhIL-13), который может быть получен стандартными способами экспрессии рекомбинантных белков. В таблице 1 показана аминокислотная последовательность IL-13 человека, SEQ ID NO:1, которая известна в данной области.
Последовательность IL-13 человека
Термин «вариант IL-13 человека» (сокращаемый в настоящем описании как hIL-13v), в данном контексте, включает вариант IL-13 человека, в котором аминокислотный остаток 130 SEQ ID NO:1 изменен с аргинина на глутамин (R130Q).
«Биологическая активность» обозначает в данном контексте все неотъемлемые биологические свойства этого цитокина. Биологические свойства IL-13 включают, но не ограничиваются ими, связывание рецептора IL-13 (другие примеры включают переключение изотипа иммуноглобулина на изотип IgE в В-клетках человека и супрессию продуцирования воспалительных цитокинов).
Термины «специфическое связывание» или «связывание специфически», в данном контексте, при ссылке на взаимодействие антитела, белка или пептида со второй химической молекулой, обозначают, что это взаимодействие зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на этой химической молекуле; например, антитело узнает специфическую структуру белка и связывается со специфической структурой белка, а не с белками вообще. Если антитело является специфическим в отношении эпитопа «А», присутствие молекулы, содержащей эпитоп А (или свободного, немеченого А), в реакции, содержащей меченый «А» и это антитело, будет уменьшать количество меченого А, связанного с этим антителом.
Термин «антитело», в данном контексте, относится в широком смысле к любой молекуле иммуноглобулина (Ig), состоящей из четырех полипептидных цепей, двух тяжелых (Н) цепей и двух легких (L) цепей, или любому их фрагменту, мутанту, варианту или производному, которые содержат признаки связывания основного эпитопа молекулы Ig. Такие форматы антитела, мутант, вариант или производное, известны в данной области. Их неограничивающие варианты обсуждаются ниже.
В полноразмерном антителе каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращаемой в настоящем описании как HCVR или VH) и константной области тяжелой цепи. Константная область тяжелой цепи состоит из трех доменов, СН1, СН2 и СН3. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращаемой в настоящем описании как LCVR или VL) и константной области легкой цепи. Константная область легкой цепи состоит из одного домена, CL. VH- и VL-области могут быть дополнительно подразделены на области гипервариабельности, называемые определяющими комплементарность районами (CDR), имеющие в промежутках между ними каркасные области (FR). Каждая из VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4. Молекулы иммуноглобулина могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA и IgY), класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подкласса.
Термин «антигенсвязывающая часть» антитела (или просто «часть антитела»), в данном контексте, относится к одному или нескольким фрагментам антитела, которые сохраняют способность специфически связываться с антигеном (например, hIL-13). Было показано, что антигенсвязывающая функция антитела может выполняться фрагментами полноразмерного антитела. Такие варианты антител могут быть также биспецифическими, двойными специфическими или мультиспецифическими форматами; специфически связывающимися с двумя или несколькими различными антигенами. Примеры связывающих фрагментов, охватываемых термином «антигенсвязывающая часть», включают (i) Fab-фрагмент, моновалентный фрагмент, состоящий из доменов VL, VH, CL и CH1; (ii) F(ab')2-фрагмент, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из доменов VH и CH1; (iv) Fv-фрагмент, состоящий из доменов VL и VH единственного плеча антитела; (v) dAb-фрагмент (Ward et al, (1989) Nature 341:544-546, Winter et al., публикация PCT WO 90/05144 A1, включенные в настоящем описании в качестве ссылки), который содержит единственный вариабельный домен; и (vi) выделенный определяющий комплементарность район (CDR). Кроме того, хотя эти два домена Fv-фрагмента, VL и VH, кодируются разными генами, они могут быть соединены, с использованием рекомбинантных способов, синтетическим линкером, который может делать их единой белковой цепью, в которой VL- и VH-области спариваются с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); смотрите, например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988) Proc. Natl. Acad. ScL USA 85:5879-5883). Предполагается, что такие одноцепочечные антитела также включены в термин «антигенсвязывающая часть» антитела. Другие формы одноцепочечных антител, такие как диатела, также включены в этот термин. Диатела являются двухвалентными, биспецифическими антителами, в которых VH- и VL-домены экспрессируются на единой полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы позволить спаривание между этими двумя доменами на одной и той же цепи, что заставляет эти домены спариваться с комплементарными доменами другой цепи и создавать два антигенсвязывающих сайта (смотрите, например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci USA 90:6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123). Такие антигенсвязывающие части известны в данной области (Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5)).
Термин «конструкция антитела» относится, в данном контексте, к полипептиду, содержащему одну или несколько антигенсвязывающих частей настоящего изобретения, связанных с линкерным полипептидом или константным доменом иммуноглобулина. Линкерные полипептиды содержат один или несколько аминокислотных остатков, соединенных пептидными связями, и используются для связывания одной или нескольких антигенсвязывающих частей. Такие линкерные полипептиды хорошо известны в данной области (смотрите, например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci USA 90:6444-6448; Poljak, R.J., et al. (1994) Structure 2: 1121-1123). Константным доменом иммуноглобулина называют константный домен тяжелой или легкой цепи. Аминокислотные последовательности константных доменов тяжелой цепи и легкой цепи IgG человека известны в данной области и представлены в таблице 2.
Последовательность константного домена тяжелой цепи и константного домена легкой цепи IgG человека


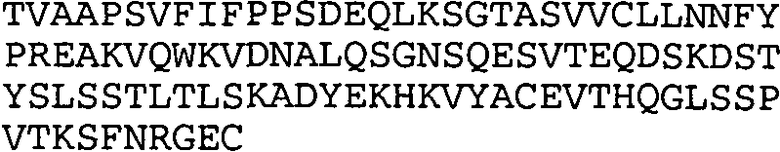
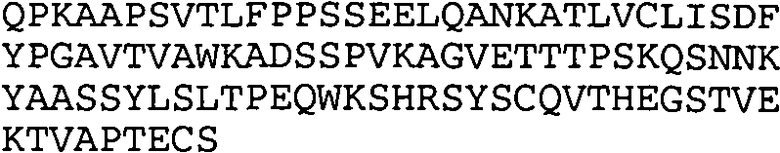
Кроме того, антитело или его антигенсвязывающая часть могут быть частью более крупных молекул иммуноадгезии, образованных ковалентной или нековалентной ассоциацией этого антитела или антигенсвязывающей части с одним или несколькими другими белками или пептидами. Примеры таких молекул иммуноадгезии включают использование стрептавидина в качестве центрального района для образования тетрамерной молекулы scFv (Kipriyanov, S.M., et al. (1995) Human Antibodies and Hybridomas 6:93-101) и использование остатка цистеина, маркерного пептида и С-концевой полигистидиновой метки для получения бивалентных и биотинилированных молекул scFv (Kipriyanov, S.M., et al. (1994) Mol. Immunol. 31 1047-1058). Части антител, такие как Fab- и F(ab')2-фрагменты, могут быть получены из полных антител с использованием общепринятых способов, таких как расщепление папаином или пепсином, соответственно, полных антител. Кроме того, антитела, части антител и молекулы иммуноадгезии могут быть получены с использованием стандартных способов рекомбинантных ДНК, описанных в настоящем описании.
«Выделенное антитело», в данном контексте, обозначает антитело, которое по существу не содержит других антител, имеющих отличающиеся антигенные специфичности (например, выделенное антитело, которое специфически связывает hIL-13, по существу не содержит антител, которые специфически связывают антигены, другие, чем hEL-13). Однако, выделенное антитело, которое специфически связывает hIL-13, может иметь перекрестную реактивность с другими антигенами, такими как молекулы IL-13 из других видов. Кроме того, выделенное антитело может не содержать другого клеточного материала и/или химикалиев.
Термин «антитело человека» включает, в данном контексте, антитела, имеющие вариабельные и константные области, произведенные из последовательностей иммуноглобулина зародышевой линии человека. Антитела человека настоящего изобретения могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулинов зародышевой линии человека (например, мутации, введенные случайным или сайт-специфическим мутагенезом in vitro, или соматическая мутация in vivo), например, в CDR и, в частности, в CDR3. Однако, предполагается, что термин «антитело человека», в данном контексте, не включает антитела, в которых последовательности CDR, полученные из зародышевой линии другого вида млекопитающего, например, мыши, были трансплантированы на каркасные последовательности иммуноглобулина человека.
Термин «рекомбинантное антитело человека», в данном контексте, включает все антитела человека, которые получены, экспрессированы, созданы или выделены рекомбинантными средствами, такие как антитела, экспрессированные с использованием рекомбинантного экспрессирующего вектора, трансфицированного в клетку-хозяина (как описано в разделе II C, ниже), антитела, выделенные из рекомбинантной, комбинаторной библиотеки антител человека (Hoogenboom H.R., (1997) TIB Tech. 15:62-70; Azzazy H., и Highsmith W.E., (2002) Clin. Biochem. 35:425-445; Gavilondo J.V., и Larrick J.W. (2002) BioTechniques 29:128-145; Hoogenboom H., и Chames P. (2000) Immunology Today 21:371-378), антитела, выделенные из животного (например, мыши), которое является трансгенным в отношении генов иммуноглобулина человека (смотрите, например, Taylor, L. D., et al. (1992) Nucl. Acids Res. 20:6287-6295; Kellermann S-A., and Green L.L. (2002) Current Opinion in Biotechnology 13:593-597; Little M. et al (2000) Immunology Today 21:364-370), или антитела, полученные, экспрессированные или выделенные любым другим способом, который включает сплайсинг последовательностей генов иммуноглобулина с другими ДНК-последовательностями. Такие рекомбинантные антитела человека имеют вариабельные и константные области, происходящие из последовательностей иммуноглобулина зародышевой линии человека. Однако, в некоторых вариантах осуществления, такие рекомбинантные антитела человека подвергают мутагенезу in vitro (или, когда используют животных, трансгенных в отношении последовательностей Ig человека, соматическому мутагенезу in vivo), и, следовательно, аминокислотные последовательности VH- и VL-областей этих рекомбинантных антител являются последовательностями, которые, хотя они и произведены из VH- и VL-последовательностей зародышевой линии человека и являются родственными VH- и VL-последовательностям зародышевой линии человека, могут не существовать в природе в репертуаре антител зародышевой линии человека in vivo. Один вариант осуществления обеспечивает полные антитела человека, способные связывать IL-13 человека, которые могут быть генерированы с использованием способов, хорошо известных в данной области, таких как, но не только, использование фаговых библиотек Ig человека, таких как фаговые библиотеки, описанные в Jermutus et al., публикация РСТ WO 2005/007699 A2.
Термин «химерное антитело» относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из одного вида и последовательности константных областей из другого вида, такие как антитела, имеющие вариабельные области тяжелой цепи мыши, связанные с константными областями человека.
Термин «CDR-трансплантированное антитело» относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из одного вида, но в которых последовательности одного или нескольких CDR-областей VH и/или VL заменены последовательностями CDR другого вида, таким как антитела, имеющие мышиные вариабельные области тяжелой и легкой цепей, в которых один или несколько мышиных CDR (например, CDR3) заменены CDR-последовательностями человека.
Термин «гуманизированное антитело» относится к антителам, которые содержат последовательности вариабельных областей тяжелой и легкой цепей из вида нечеловека (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL была изменена, чтобы быть более «подобной последовательности человека», т.е. более подобной вариабельным последовательностям зародышевой линии человека. Одним типом гуманизированного антитела является CDR-трансплантированное антитело, в котором последовательности CDR человека введены в последовательности VH и VL нечеловека для замены соответствующих последовательностей CDR нечеловека. В одном варианте осуществления обеспечены гуманизированные антитела и антигенсвязывающие части анти-IL-13 человека. Такие антитела были генерированы для получения мышиных моноклональных анти-hIL-13-антител с использованием традиционной гибридомной технологии с последующей гуманизацией при помощи генной инженерии in vitro, например, антитела, описанные в Kasaian et al, публикация РСТ WO 2005/123126 A2.
Термины «нумерация Кабата», «определения Кабата» и «маркировка Кабата» используются в настоящем описании взаимозаменяемо. Эти термины, которые являются признанными в данной области, относятся к системе нумерации аминокислотных остатков, которые являются более вариабельными (т.е. гипервариабельными), чем другие аминокислотные остатки в вариабельных областях тяжелой и легкой цепей антитела или его антигенсвязывающей части (Kabat et al. (1971) Ann. NY Acad, Sci. 190:382-391 и Kabat, E.A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, публикация NIH 91-3242). Для вариабельной области тяжелой цепи эта гипервариабельная область находится в диапазоне положений аминокислот 31-35 для CDR1, положений аминокислот 50-65 для CDR2 и положений аминокислот 95-102 для CDR3. Для вариабельной области легкой цепи эта гипервариабельная область находится в диапазоне положений аминокислот 24-34 для CDR1, положений аминокислот 50-56 для CDR2 и положений аминокислот 89-97 для CDR3.
В данном контексте термины «акцептор» и «акцепторное антитело» относятся к антителу, обеспечивающему, или последовательности нуклеиновой кислоты, кодирующей по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% аминокислотных последовательностей одной или нескольких каркасных областей. В некоторых вариантах осуществления термин «акцептор» относится к аминокислотной последовательности антитела или последовательности нуклеиновой кислоты антитела, обеспечивающей или кодирующей одну или несколько константных областей. Еще в одном варианте осуществления термин «акцептор» относится к аминокислотной последовательности антитела или последовательности нуклеиновой кислоты антитела, обеспечивающей или кодирующей одну или несколько каркасных областей и константных областей. В конкретном варианте осуществления термин «акцептор» относится к аминокислотной последовательности антитела или последовательности нуклеиновой кислоты антитела, которая обеспечивает или кодирует по меньшей мере 80%, предпочтительно по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или 100% аминокислотных последовательностей одной или нескольких каркасных областей. В соответствии с этим вариантом осуществления акцептор может содержать по меньшей мере 1, по меньшей мере 2, по меньшей мере 3, по меньшей мере 4, по меньшей мере 5 или по меньшей мере 10 аминокислотных остатков, которые не встречаются в одном или нескольких положениях антитела человека. Акцепторная каркасная область и/или константная область (константные области) могут быть, например, произведены или получены из гена антитела зародышевой линии, зрелого гена антитела, функционального антитела (например, антител, хорошо известных в данной области, антител находящихся в разработке, или антител, доступных коммерчески).
В данном контексте термин «CDR» относится к определяющей комплементарность области в вариабельных последовательностях антител. Имеются три CDR в каждой из вариабельных областей тяжелой цепи и легкой цепи, которые названы CDR1, CDR2 и CDR3, для каждой из вариабельных областей. Термин «набор CDR» относится в данном контексте к группе из трех CDR, которые присутствуют в единственной вариабельной области, способной связывать антиген. Точные границы этих CDR определяются различно в соответствии с различными системами. Система, описанная Кабатом (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) and (1991)) не только обеспечивает недвусмысленную систему нумерации, применимую к любой вариабельной области антитела, но также обеспечивает точные границы остатков, определяющие эти три CDR. Эти CDR могут быть названы CDR Кабата. Хотиа и сотрудники (Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987) и Chothia et al., Nature 342:877-883 (1989)) обнаружили, что некоторые подчасти в CDR Кабата используют почти идентичные конформации пептидного скелета, несмотря на большое разнообразие на уровне аминокислотной последовательности. Эти подчасти были названы L1, L2 и L3 или H1, H2 и H3, где «L» и «H» обозначает области легкой цепи и тяжелой цепи, соответственно. Эти области могут быть названы CDR Хотиа, которые имеют границы, которые перекрываются с CDR Кабата. Другие границы, определяющие CDR, соответствующие CDR Кабата, были описаны Pedlan (FASEB J. 9: 133-139 (1995)) и MacCallum (J Mol Biol 262(5):732-45 (1996)). Другие определения границ CDR могут не соответствовать строго одной из вышеописанных систем, но будут тем не менее соответствовать CDR Кабата, хотя они могут быть укороченными или удлиненными, в свете предсказания или экспериментальных данных о том, что конкретные остатки или группы остатков или даже полные CDR не влияют значимо на связывание антигена. Используемые в настоящем описании способы могут использовать CDR, определенные в соответствии с любой из этих систем, хотя предпочтительные варианты осуществления используют определенные Кабатом и Хотиа CDR.
В данном контексте термин «канонический остаток» относится к остатку в CDR или каркасе, который определяет конкретную каноническую структуру CDR, определенную Хотиа и сотрудниками (Chothia et al. J. Mol. Biol. 196:901-907 (1987); Chothia et al., J. Mol. Biol. 227:799 (1992), включенные в настоящем описании в качестве ссылки). Согласно Chothia et al., критические части CDR многих антител имеют почти идентичные конформации пептидного скелета, несмотря на большое разнообразие на уровне аминокислотной последовательности. Каждая каноническая структура указывает прежде всего набор торсионных углов пептидного скелета для прилегающего сегмента аминокислотных остатков, образующих петлю.
В данном контексте термин «донор» и «донорское антитело» относятся к антителу, обеспечивающему один или несколько CDR. В предпочтительном варианте осуществления, донорским антителом является антитело из вида, отличающееся от антитела, из которого получены или произведены каркасные области. В контексте гуманизированного антитела, термин «донорское антитело» относится к антителу нечеловека, обеспечивающему один или несколько CDR.
В данном контексте термин «каркас» или «каркасная последовательность» относится к остальным последовательностям вариабельной области минус CDR. Поскольку точное определение последовательности CDR может быть определено с использованием разных систем, значение каркасной последовательности является предметом соответственно различных интерпретаций. Эти шесть областей CDR (CDR-L1, CDR-L2 и CDR-L3 легкой цепи и CDR-H1, CDR-H2 и CDR-H3 тяжелой цепи) также разделяют каркасные области на легкой цепи и тяжелой цепи на четыре субрайона (FR1, FR2, FR3 и FR4) на каждой цепи, в которых CDR1 расположен между FR1 и FR2, CDR2 между FR2 и FR3 и CDR3 между FR3 и FR4. Без указания этих конкретных субрайонов, таких как FR1, FR2, FR3 или FR4, каркасная область, как ее называют другие авторы, представляет эти комбинированные FR в вариабельной области единой природно-встречающейся цепи иммуноглобулина. В данном контексте, FR представляет один из четырех субрайонов, составляющих каркасную область.
Акцепторные последовательности тяжелой цепи и легкой цепи человека известны в данной области. В одном варианте осуществления настоящего изобретения акцепторные последовательности тяжелой цепи и легкой цепи выбраны из последовательностей, описанных в таблице 3 и таблице 4.
Акцепторные последовательности тяжелой цепи
Акцепторные последовательности легкой цепи
В данном контексте термин «ген антитела зародышевой линии» или «фрагмент гена» относится к последовательности иммуноглобулина, кодируемой нелимфоидными клетками, которые не подвергались процессу созревания, который приводит к генетической реаранжировке и мутации для экспрессии конкретного иммуноглобулина (смотрите, например, Shapiro et al., Crit. Rev. Immunol. 22(3): 183-200 (2002); Marchalonis et al., Adv Exp Med Biol. 484: 13-30 (2001)). Одно из преимуществ, обеспечиваемых различными вариантами настоящего изобретения, происходит из признания того, что гены антитела зародышевой линии с большей вероятностью, чем зрелые гены антител, сохраняют эссенциальные структуры аминокислотной последовательности, характерные для индивидов в этом виде, и, следовательно, в меньшей степени узнаются как гены из чужеродного источника при применении терапевтически в этом виде.
В данном контексте термин «ключевые» остатки относится к определенным остаткам в вариабельной области, которые имеют большее влияние на специфичность связывания и/или аффинность антитела, в частности, гуманизированного антитела. Ключевой остаток включает, но не ограничиваются ими, одно или несколько из следующего: остаток, который является смежным с CDR, потенциальный сайт гликозилирования (который может быть сайтом N- или O-гликозилирования), необычный остаток, остаток, способный взаимодействовать с антигеном, остаток, способный взаимодействовать с CDR, канонический остаток, остаток контакта между вариабельной областью тяжелой цепи и вариабельной областью легкой цепи, остаток в зоне Верньера и остаток в области, которая соответствует области между определением Хотиа CDR1 вариабельной области тяжелой цепи и определением Кабата первой каркасной области тяжелой цепи.
В данном контексте термин «гуманизированное антитело» является антителом или его вариантом, производным, аналогом или фрагментом, которые специфически связываются с представляющим интерес антигеном и которые содержат каркасную область (FR), имеющую по существу аминокислотную последовательность антитела человека, и определяющую комплементарность область (CDR), имеющий по существу аминокислотную последовательность антитела нечеловека. В применении в настоящем описании, термин «по существу» в контексте CDR относится к CDR, имеющему аминокислотную последовательность, по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентичную аминокислотной последовательности CDR антитела нечеловека. Гуманизированное антитело содержит по существу все из по меньшей мере одного, обычно двух, вариабельных доменов (Fab, Fab', F(ab')2, FabC, Fv), в которых все или по существу все из CDR-областей соответствуют CDR-областям иммуноглобулина нечеловека (т.е. донорского антитела), и все или по существу все из каркасных областей являются каркасными областями консенсусной последовательности иммуноглобулина человека. Предпочтительно, гуманизированное антитело содержит также по меньшей мере часть константной области иммуноглобулина (Fc), обычно часть константной области иммуноглобулина человека. В некоторых вариантах осуществления гуманизированное антитело содержит как легкую цепь, так и по меньшей мере вариабельный домен тяжелой цепи. Это антитело может включать области СН1, шарнира, СН2, СН3 и СН4 тяжелой цепи. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную легкую цепь. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную тяжелую цепь. В некоторых вариантах осуществления гуманизированное антитело содержит только гуманизированную вариабельную область легкой цепи и/или гуманизированную тяжелую цепь.
Гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, в том числе IgM, IgG, IgD, IgA и IgE, и любого изотипа, в том числе, без ограничения, IgG1, IgG2, IgG3 и IgG4. Гуманизированное антитело может содержать последовательности из более чем одного класса или изотипа, и конкретные константные домены могут быть выбраны для оптимизации желаемых эффекторных функций с использованием способов, хорошо известных в данной области.
Эти каркасные области и CDR-области гуманизированного антитела не должны обязательно точно соответствовать исходным последовательностям, например, CDR донорского антитела или консенсусного каркаса, так что остаток CDR или остаток каркаса в конкретном сайте не соответствует ни донорскому антителу, ни консенсусному каркасу. Однако в предпочтительном варианте осуществления такие мутации будут неэффективными. Обычно по меньшей мере 80%, предпочтительно по меньшей мере 85%, более предпочтительно по меньшей мере 90% и наиболее предпочтительно 95% остатков гуманизированного антитела будут соответствовать остаткам исходных последовательностей FR и CDR. В данном контексте термин «консенсусный каркас» относится к каркасной области в консенсусной последовательности иммуноглобулина. В данном контексте термин «консенсусная последовательность иммуноглобулина» относится к последовательности, образованной из наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей иммуноглобулинов (смотрите, например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987). В семействе иммуноглобулинов каждое положение в консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении в данном семействе. Если две аминокислоты встречаются одинаково часто, любая может быть включена в эту консенсусную последовательность.
В данном контексте зоной «Верньера» называют субнабор остатков каркаса, которые могут корректировать структуру CDR и тонко подгонять ее к антигену, как описано в работе Foote and Winter, 1992, J. Mol. Biol. 224:487-499, которая включена в настоящем описании в качестве ссылки. Остатки зоны Верньера образуют слой, лежащий в основе этих CDR, и могут влиять на структуру CDR и аффинность этого антитела.
Термин «мультивалентный связывающий белок» используется в этом контексте для обозначения связывающего белка, содержащего два или более антигенсвязывающих сайтов. Мультивалентный связывающий белок предпочтительно конструируют таким образом, что он имеет три или более антигенсвязывающих сайтов и обычно не является природно-встречающимся антителом. Термин «мультиспецифический связывающий белок» относится к связывающему белку, способному связывать две или более родственные или неродственные мишени. Связывающие белки с двойным вариабельным доменом (DVD), в данном контексте, являются связывающими белками, которые содержат два или более антигенсвязывающих сайта и являются тетравалентными или мультивалентными связывающими белками. Такие DVD могут быть моноспецифическими, т.е. способными связывать один антиген, или мультиспецифическими, т.е. способными связывать два или более антигенов. DVD-связывающие белки, содержащие два DVD-полипептида тяжелой цепи и два DVD-полипептида легкой цепи, называют DVD-Ig. Каждая половина DVD-Ig содержит DVD-полипептид тяжелой цепи и DVD-полипептид легкой цепи и два антигенсвязывающих сайта. Каждый сайт связывания содержит вариабельный домен тяжелой цепи и вариабельный домен легкой цепи, причем в целом 6 CDR участвуют в связывании антигена на каждый антигенсвязывающий сайт.
В данном контексте термин «нейтрализация» относится к нейтрализации биологической активности цитокина при специфическом связывании цитокина связывающим белком. Предпочтительно, нейтрализующим связывающим белком является нейтрализующее антитело, связывание которого с IL-13 и/или hIL-13 приводит к ингибированию биологической активности IL-13 и/или hIL-13. Предпочтительно, нейтрализующий связывающий белок связывает IL-13 и/или hIL-13 и уменьшает биологическую активность IL-13 и/или hIL-13 по меньшей мере приблизительно на 20%, 40%, 60%, 80%, 85% или более. Ингибирование биологической активности IL-13 и/или hIL-13 нейтрализующим связывающим белком может оцениваться измерением одного или нескольких индикаторов биологической активности IL-13 и/или hIL-13, хорошо известным в данной области. Например, ингибирование IL-13 человека индуцировало продуцирование TARC (CCL-17) клетками A-549 (смотрите пример 1.1.C).
Термин «активность» включает такие активности, как специфичность связывания/аффинность антитела в отношении антигена, например, анти-hIL-13-антитела, которое связывается с антигеном IL-13, и/или нейтрализующая эффективность антитела, например, анти-hIL-13-антитела, связывание которого с hIL-13 ингибирует биологическую активность hIL-13. Например, ингибирование IL-13 человека индуцировало продуцирование TARC (CCL-17) клетками A-549 (смотрите пример 1.1.C).
Термин «эпитоп» включает любую полипептидную детерминанту, способную специфически связываться с иммуноглобулином или Т-клеточным рецептором. В некоторых вариантах осуществления эпитопные детерминанты включают химически активные поверхностные группировки молекул, такие как аминокислоты, сахарные боковые цепи, фосфорил или сульфонил, и, в некоторых вариантах осуществления, могут иметь специфические трехмерные структурные свойства и/или специфические свойства зарядов. Эпитоп является областью антигена, которая связывается антителом. В некоторых вариантах осуществления говорят, что антитело специфически связывает антиген, когда оно предпочтительно узнает его антиген-мишень в комплексной смеси белков и/или макромолекул.
Термин «резонанс поверхностных плазмонов» относится в данном контексте к оптическому явлению, которое позволяет анализировать биоспецифические взаимодействия реального времени детектированием изменений в концентрациях белков в биосенсорном матриксе, например, с использованием системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, NJ). В отношении дополнительных описаний смотрите Jonsson, U., et al. (1993) Ann. Biol. Clin. 51: 19-26; Jonsson, U., et al. (1991) Biotechniques 11:620-627; Johnsson, B., et al (1995) J. Mol. Recognit. 8: 125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198:268-277.
Термин «kon», в данном контексте, относится к константе скорости ассоциации антитела с антигеном с образованием комплекса антитело/антиген, как известно в данной области. Термин «koff», в данном контексте, относится к константе скорости диссоциации антитела из комплекса антитело/антиген, как известно в данной области.
Термин «KD», в данном контексте, относится к константе диссоциации конкретного взаимодействия антитело/антиген, как известно в данной области.
Термин «меченый связывающий белок», в данном контексте, относится к белку с включенной меткой, которая обеспечивает идентификацию связывающего белка. Предпочтительно, меткой является детектируемый маркер, например, включение радиоактивно меченной аминокислоты, или присоединение к полипептиду с биотинильными частями молекулы, которые могут быть детектированы меченым авидином (например, стрептавидином, содержащим флуоресцентный маркер или ферментативную активность, которая может быть детектирована оптическими или колориметрическими способами. Примеры меток включают, но не ограничиваются ими: радиоизотопы или радионуклиды (например, 3H 14C, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm); флуоресцентные метки (например, FITC, родамин, лантанидные люминофоры (фосфоры)), ферментативные метки (например, пероксидазу хрена, люциферазу, щелочную фосфатазу); хемилюминесцентные маркеры; биотинильные группы; заранее определенные полипептидные эпитопы, узнаваемые вторичным репортером (например, пары последовательностей лейциновых молний, сайты связывания для вторичных антител, металлсвязывающие домены, эпитопные метки); и магнитные агенты, такие как хелаты гадолиния.
Термин «конъюгат антитела» относится к связывающему белку, такому как антитело, химически связанному со второй химической частью молекулы, такой как терапевтический или цитотоксический агент. Термин «агент» используется в настоящем описании для обозначения химического соединения, смеси химических соединений, биологической макромолекулы или экстракта, приготовленного из биологических материалов. Предпочтительно, эти терапевтические или цитотоксические агенты включают, но не ограничиваются ими, коклюшный токсин, таксол, цитохалазин В, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол и пуромицин и их аналоги или гомологи.
Термины «кристалл» и «кристаллизуемый» относятся, в данном контексте, к антителу или его антигенсвязывающей части, которые находятся в форме кристалла. Кристаллы являются одной формой твердого состояния вещества, которая отличается от других форм, таких как аморфное твердое состояние или жидкокристаллическое состояние. Кристаллы состоят из регулярных, повторяющихся, трехмерных матриц атомов, ионов, молекул (например, белков, таких как антитела), или молекулярных ансамблей (например, комплексов антитело/антиген). Эти трехмерные матрицы аранжированы в соответствии с конкретными математическими зависимостями, которые хорошо понимаются в данной области. Фундаментальную единицу, или элемент структуры, который повторяется в кристалле, называют асимметричным звеном. Повторение этого асимметричного звена в расположении атомов, которое подчиняется правилам конкретной, хорошо определенной кристаллографической симметрии, обеспечивает «элементарную ячейку» кристалла. Повторение этой элементарной ячейки регулярными переносами (трансляциями) во всех трех измерениях обеспечивает кристалл. Смотрите Giege, R. and Ducruix, A. Barrett, Crystallization of Nucleic Acids and Proteins, a Practical Approach, 2nd ea., pp. 20 1-16, Oxford University Press, New York, New York, (1999).
Термин «полинуклеотид» обозначает, в данном контексте, полимерную форму двух или более нуклеотидов, либо рибонуклеотидов, либо дезоксинуклеотидов, или модифицированной формы любого типа нуклеотида. Этот термин включает одноцепочечные и двухцепочечные формы ДНК, но предпочтительно двухцепочечную ДНК.
Термин «выделенный полинуклеотид» будет обозначать в данном контексте полинуклеотид (например, геномную ДНК, кДНК или ДНК синтетического происхождения или некоторую их комбинацию), который, в силу его происхождения в качестве «выделенного полинуклеотида» не связан со всеми полинуклеотидами или с частью полинуклеотидов, с которыми этот «выделенный полинуклеотид» обнаруживается в природе; функционально связан с полинуклеотидом, с которым он не связан в природе; или не встречается в природе в виде части большей последовательности.
Термин «вектор» относится в данном контексте к молекуле нуклеиновой кислоты, способной транспортировать другую нуклеиновую кислоту, с которой она связана. Одним типом вектора является «плазмида», которая является кольцевой двухцепочечной петлей ДНК, в которую могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является вирусный вектор, причем дополнительные ДНК-сегменты могут быть лигированы в этот вирусный геном. Некоторые векторы способны к автономной репликации в клетке-хозяине, в которую они введены (например, бактериальные векторы, имеющие бактериальный сайт инициации репликации, или эписомные векторы млекопитающих). Другие векторы (например, неэписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина и посредством этого реплицируются вместе с геномом хозяина. Кроме того, некоторые векторы способны управлять экспрессией генов, с которыми они функционально связаны. Такие векторы называют в настоящем описании «рекомбинантными экспрессирующими векторами» (или просто «экспрессирующими векторами»). Обычно экспрессирующие векторы, используемые в способах рекомбинантных ДНК, часто находятся в форме плазмид. В настоящей заявке «плазмида» и «вектор» могут использоваться взаимозаменяемо, так как плазмида является наиболее часто используемой формой вектора. Однако это изобретение включает такие другие формы экспрессирующих векторов, как вирусные векторы (например, дефектные в отношении репликации ретровирусы, аденовирусы и аденосвязанные вирусы), которые выполняют эквивалентные функции.
Термин «функционально связанные» относится к смежному расположению, в котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предполагаемым образом. Регуляторную последовательность, «функционально связанную» с кодирующей последовательностью, лигируют таким образом, что достигается экспрессия этой кодирующей последовательности в условиях, совместимых с регуляторными последовательностями. «Функционально связанные» последовательности включают как регуляторные последовательности экспрессии, которые являются смежными с представляющим интерес геном, так и регуляторные последовательности экспрессии, которые действуют in trans, или на расстоянии, для регуляции представляющего интерес гена. Термин «регуляторная последовательность экспрессии» относится в данном контексте к полинуклеотидным последовательностям, которые необходимы для осуществления экспрессии и процессинга кодирующих последовательностей, с которыми они лигированы. Регуляторные последовательности экспрессии включают подходящие последовательности инициации, терминации транскрипции, промоторные и энхансерные последовательности; сигналы эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые усиливают эффективность трансляции (т.е. консенсусную последовательность Козака); последовательности, которые увеличивают стабильность белка; и, если желательно, последовательности, которые усиливают секрецию белка. Природа таких регуляторных последовательностей различается в зависимости от организма-хозяина; в прокариотах, такие регуляторные последовательности обычно включают промотор, сайт связывания рибосом и последовательность терминации транскрипции; в эукариотах, обычно такие регуляторные последовательности включают промоторы и последовательность терминации транскрипции. Термин «регуляторные последовательности» включает компоненты, присутствие которых является необходимым для экспрессии и процессинга, и может также включать дополнительные компоненты, присутствие которых является предпочтительным, например, лидерные последовательности и последовательности партнера слияния. Конструкции белков настоящего изобретения могут быть экспрессированы и очищены с использованием экспрессирующих векторов и клеток-хозяев, известных в данной области, включающих экспрессионные кассеты, векторы, рекомбинантные клетки-хозяева и способы рекомбинантной экспрессии и протеолитического процессинга рекомбинантных полипротеинов и белков-предшественников из единой открытой рамки считывания (например, WO 2007/014162, включенный в настоящем описании в качестве ссылки).
«Трансформация», в данном контексте, обозначает любой процесс, посредством которого экзогенная ДНК входит в клетку-хозяина. Трансформация может происходить при природных или искусственных условиях с использованием способов, хорошо известных в данной области. Трансформация может основываться на любом известном способе встраивания чужеродных последовательностей нуклеиновых кислот в прокариотическую или эукариотическую клетку-хозяина. Способ выбирают на основе клетки-хозяина, подлежащей трансформации, и может включать, но не ограничивается ими, вирусную инфекцию, электропорацию, липофекцию и бомбардировку частицами. Такие «трансформированные» клетки включают стабильно трансформированные клетки, в которых инсертированная ДНК способна к репликации либо в виде автономно реплицирующейся плазмиды, либо в виде части хромосомы хозяина. Они включают также клетки, которые транзиторно экспрессируют инсертированную ДНК или РНК в течение ограниченных периодов времени.
Термин «рекомбинантная клетка-хозяин» (или просто «клетка-хозяин») обозначает, в данном контексте, клетку, в которую была введена экзогенная ДНК. Должно быть понятно, что такие термины относятся не только к конкретной рассматриваемой клетке, но и к потомству такой клетки. Поскольку в последующих генерациях могут встречаться определенные модификации вследствие либо мутации, либо влияний окружающей среды, такое потомство может быть фактически не идентичным родительской клетке, но оно все еще включено в объем термина «клетка-хозяин», используемого в настоящем описании. Предпочтительно, клетки-хозяева включают прокариотические и эукариотические клетки, выбранные из любого из царств жизни. Предпочтительные клетки-хозяева включают клетки одноклеточных организмов (протистов), грибов, растений и животных. Наиболее предпочтительные клетки-хозяева включают, но не ограничиваются ими, линию прокариотических клеток E. coli; линии клеток млекопитающих СНО, НЕК 293 и COS; линию клеток насекомых Sf9; и грибные клетки Saccharomyces cerevisiae.
Могут быть использованы стандартные способы для рекомбинантных ДНК, синтеза олигонуклеотидов и культуры ткани и трансформации (например, электропорации, липофекции). Ферментативные реакции и способы очистки могут выполняться в соответствии с описаниями изготовителя или как обычно выполняются в данной области или как описано в настоящем описании. Предыдущие способы и процедуры могут обычно выполняться в соответствии с общепринятыми способами, хорошо известными в данной области и описанными в различных общих или более конкретных ссылках, которые цитируются и обсуждаются на протяжении настоящего описания. Смотрите, например, справочник Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N. Y. (1989)), который включен в настоящем описании в качестве ссылки, для любой цели.
«Трансгенный организм», известный в данной области и описанный в настоящем описании, обозначает организм, имеющий клетки, которые содержат трансген, причем трансген, введенный в этот организм (или в предка этого организма), экспрессирует полипептид, природно не экспрессируемый в этом организме. «Трансген» является ДНК-конструкцией, которая стабильно и функционально интегрирована в геном клетки, из которой развивается трансгенный организм, управляющей экспрессией кодируемого продукта гена в одном или нескольких типах клеток или тканей этого трансгенного организма.
Термины «регулируют» и «модулируют» используются взаимозаменяемо и, в данном контексте, относятся к изменению или модуляции активности представляющей интерес молекулы (например, биологической активности hIL-13). Модуляция может быть увеличением или уменьшением величины определенной активности или функции представляющей интерес молекулы. Примерные активности и функции молекулы включают, но не ограничиваются ими, связывающие свойства, ферментативную активность, активацию клеточных рецепторов и трансдукцию сигналов.
Таким образом, термин «модулятор» обозначает, в данном контексте, соединение, способное изменять или модулировать активность или функцию представляющей интерес молекулы (например, биологическую активность hIL-13). Например, модулятор может вызывать увеличение или уменьшение величины активности или функции, наблюдаемой в отсутствие этого модулятора. В некоторых вариантах осуществления модулятор является ингибитором, который уменьшает величину по меньшей мере одной активности или функции молекулы. Примерные ингибиторы включают, но не ограничиваются ими, белки, пептиды, антитела, пептитела, углеводы или малые органические молекулы. Пептитела описаны, например, в WO01/83525.
Термин «агонист» относится, в данном контексте, к модулятору, который, при контакте с представляющей интерес молекулой, вызывает увеличение величины определенной активности или функции этой молекулы в сравнении с величиной этой активности или функции, наблюдаемой в отсутствие этого агониста. Конкретные представляющие интерес агонисты могут включать, но не ограничиваются ими, полипептиды IL-13 или полипептиды, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с hIL-13.
Термины «антагонист» или «ингибитор» относятся, в данном контексте, к модулятору, который, при контакте с представляющей интерес молекулой, вызывает уменьшение величины определенной активности или функции этой молекулы в сравнении с величиной этой активности или функции, наблюдаемой в отсутствие этого антагониста. Конкретные представляющие интерес антагонисты включают антагонисты, которые блокируют или модулируют биологическую или иммунологическую активность IL-13 и/или hIL-13. Антагонисты и ингибиторы IL-13 и/или hIL-13 могут включать, но не ограничиваются ими, белки, нуклеиновые кислоты, углеводы или любые другие молекулы, которые связываются с IL-13 и/или hIL-13.
Термин «ингибируют связывание с рецептором» относится к способности связывающего белка предотвращать связывание IL-13 с одним или несколькими его рецепторами. Такое ингибирование связывания с рецептором может приводить к уменьшению или устранению биологической активности, опосредуемой связыванием IL-13 с его рецептором или рецепторами.
В данном контексте термин «эффективное количество» относится к количеству терапевтического средства, которое является достаточным для уменьшения или ослабления тяжести и/или продолжительности нарушения или одного или нескольких симптомов нарушения, предотвращает прогрессирование нарушения, вызывает регресс нарушения, предотвращает рецидив, развитие, появление или прогрессирование одного или нескольких симптомов, связанных с нарушением, детектирует нарушение или усиливает или улучшает профилактические или терапевтические эффекты другого терапевтического средства (например, профилактического или терапевтического агента).
Термин «проба» используется в настоящем описании в его самом широком смысле. «Биологическая проба», в данном контексте, включает, но не ограничивается этим, любое количество вещества из живого организма или ранее живого организма. Такие живые организмы включают, но не ограничиваются ими, людей, мышей, крыс, обезьян, собак, кроликов и других животных. Такие вещества включают, но не ограничиваются ими, кровь, сыворотку, мочу, синовиальную жидкость, клетки, органы, ткани, костный мозг, лимфатические узлы и селезенку.
I. Антитела, которые связывают IL-13 человека
Один аспект настоящего изобретения обеспечивает выделенные мышиные моноклональные антитела, или их антигенсвязывающие части, которые связываются с IL-13 с высокой аффинностью, низкой скоростью диссоциации и высокой нейтрализующей способностью. Второй аспект настоящего изобретения обеспечивает химерные антитела, которые связывают IL-13. Третий аспект настоящего изобретения обеспечивает гуманизированные антитела, или их антигенсвязывающие части, которые связывают IL-13. Предпочтительно, эти антитела, или их части, являются выделенными антителами. Предпочтительно, антитела настоящего изобретения являются нейтрализующими анти-IL-13-антителами человека и/или анти-IL-13-антителами человека.
А. Способ получения анти-IL-13-антител
Антитела настоящего изобретения могут быть получены любым из ряда способов, известных в данной области.
1. Моноклональные анти-IL-13-антитела, полученные с использованием гибридомной технологии
Моноклональные антитела могут быть получены с использованием большого разнообразия способов, известных в данной области, включающих применение гибридом, рекомбинантные способы или технологии фагового дисплея или их комбинации. Например, моноклональные антитела могут быть получены гибридомными способами, в том числе способами, известными в данной области и описанными, например, в Harlow et al., Antibodies: A Laboratory Manual, (Gold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981) (указанные ссылки включены в настоящем описании в качестве ссылки в их полном виде). Термин «моноклональное антитело», в данном контексте, не ограничивается антителами, полученными при помощи гибридомного способа. Термин «моноклональное антитело» относится к антителу, которое получено из единственного клона, в том числе любого эукариотического, прокариотического или фагового клона, но не к способу, при помощи которого оно получено.
Способы получения специфических антител и скрининга на специфические антитела с использованием гибридомной технологии являются рутинными и хорошо известны в данной области. В одном варианте осуществления настоящее изобретение обеспечивает способы генерирования моноклональных антител, а также антитела, полученные этим способом, предусматривающие культивирование гибридомной клетки, секретирующей антитело настоящего изобретения, причем, предпочтительно, эту гибридому генерируют слиянием спленоцитов, выделенных из мыши, иммунизированной антигеном настоящего изобретения, с миеломными клетками и последующим скринингом гибридом, полученных из этого слияния, на гибридомные клоны, которые секретируют антитело, способное связывать полипептид настоящего изобретения (смотрите пример 1.2). Вкратце, мыши могут быть иммунизированы антигеном IL-13. В предпочтительном варианте осуществления этот антиген IL-13 вводят с адъювантом для стимуляции иммунной реакции. Такие адъюванты включают полный и неполный адъюванты Фрейнда, RIBI (мурамилдипептиды) или ISCOM (иммуностимулирующие комплексы). Такие адъюванты могут защищать этот полипептид от быстрого диспергирования секвестрированием его в локальный депозит, или они могут содержать вещества, которые стимулируют хозяина для секреции факторов, которые являются хемотаксическими для макрофагов и других компонентов иммунной системы. Предпочтительно, при введении полипептида схема иммунизации будет включать два или более введений этого полипептида, растянутых на несколько недель.
После иммунизации животного антигеном IL-13, из этого животного могут быть получены антитела и/или продуцирующие антитела клетки. Содержащую анти-IL-13-антитело сыворотку получают из животного кровопусканием или умерщвлением животного. Эта сыворотка может быть использована в таком виде, в каком она получена из животного, из этой сыворотки может быть получена фракция иммуноглобулинов, или анти-IL-13-антитела могут быть очищены из этой сыворотки. Сыворотка или иммуноглобулины, полученные таким образом, являются поликлональными, т.е. имеющими гетерогенный набор свойств.
После детектирования иммунной реакции, например, после детектирования антител, специфических для антигена IL-13, в сыворотке мыши, извлекают селезенку мыши и выделяют спленоциты. Затем эти спленоциты сливают хорошо известными способами с подходящими миеломными клетками, например, клетками из клеточной линии SP20, доступной из ATCC. Гибридомы отбирают и клонируют лимитирующим разведением. Затем эти гибридомные клоны анализируют способами, известными в данной области, на клетки, которые секретируют антитела, способные связывать IL-13. Асцитическая жидкость, которая обычно содержит высокие уровни антител, может быть получена иммунизацией мышей положительными гибридомными клонами.
В другом варианте осуществления могут быть получены продуцирующие антитело иммортализованные гибридомы из иммунизированного животного. После иммунизации это животное умерщвляют и В-клетки селезенки сливают с иммортализованными миеломными клетками, как хорошо известно в данной области. Смотрите, например, Harlow and Lane, смотрите ранее. В предпочтительном варианте осуществления миеломные клетки не секретируют полипептиды иммуноглобулина (несекреторная клеточная линия). После слияния и отбора с использованием антибиотика эти гибридомы подвергают скринингу с использованием IL-13, или его части, или клетки, экспрессирующей IL-13. В предпочтительном варианте осуществления начальный скрининг выполняют с использованием твердофазного иммуносорбентного анализа (ELISA) или радиоиммуноанализа (RIA), предпочтительно ELISA. Пример ELISA-скрининга обеспечен в WO 00/37504, включенном в настоящем описании в качестве ссылки.
Анти-IL-13-антитело-продуцирующие гибридомы отбирают, клонируют и дополнительно подвергают скринингу на желаемые характеристики, включающие сильный рост гибридомы, высокое продуцирование антител и желаемые свойства антител, обсуждаемые дополнительно ниже. Гибридомы могут культивироваться и размножаться in vivo в сингенных животных, в животных, которые не имеют иммунной системы, например, голых (бестимусных) мышах или в культурах клеток in vitro. Способы отбора, клонирования и размножения гибридом хорошо известны специалисту с обычной квалификацией в данной области.
В предпочтительном варианте осуществления эти гибридомы являются гибридомами мыши, описанными выше. В другом предпочтительном варианте осуществления эти гибридомы получают в видах, других, чем человек и мышь, таких как крысы, овцы, свиньи, козы, крупный рогатый скот или лошади. В другом варианте осуществления эти гибридомы являются гибридомами человека, в которых несекреторная миеломная клетка человека слита с клеткой человека, экспрессирующей анти-IL-13-антитело.
Фрагменты антител, которые узнают специфические эпитопы, могут быть генерированы известными способами. Например, Fab- и F(ab')2-фрагменты настоящего изобретения могут быть получены протеолитическим расщеплением молекул иммуноглобулина с использованием ферментов, таких как папаин (для получения Fab-фрагментов) или пепсин (для получения F(ab')2-фрагментов). F(ab')2-фрагменты содержат вариабельную область, константную область легкой цепи и домен СН1 тяжелой цепи.
2. Моноклональные анти-IL-13-антитела, полученные с использованием SLAM
В другом аспекте настоящего изобретения рекомбинантные антитела генерируют из отдельных, выделенных лимфоцитов с использованием процедуры, называемой в данной области способом выбранных лимфоцитных антител (SLAM), описанным в патенте США № 5627052, публикации PCT WO 92/02551 и Babcock, J.S. et al. (1996) Proc. Natl. Acad. Sci USA 93:7843-7848. В этом способе отдельные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, полученные из любого из иммунизированных животных, описанных в разделе 1, подвергают скринингу с использованием антиген-специфического анализа гемолитических бляшек, в котором антиген IL-13, субъединицу IL-13, или их фрагмент, связывают с эритроцитами овцы с использованием линкера, такого как биотин, и используют для идентификации отдельных клеток, которые секретируют антитела, специфические в отношении IL-13. После идентификации секретирующих антитела представляющих интерес клеток кДНК вариабельной области тяжелой цепи и легкой цепи спасают из этих клеток при помощи ПЦР с обратной транскриптазой и затем эти вариабельные области экспрессируют, вместе с подходящими константными областями иммуноглобулина (например, константными областями иммуноглобулина человека), в клетках-хозяевах млекопитающих, таких как клетки COS или СНО. Затем клетки-хозяева, трансфицированные этими амплифицированными последовательностями иммуноглобулина, полученные из выбранных лимфоцитов in vivo, могут быть подвергнуты дополнительному анализу и отбору in vitro, например, пэннингом трансфицированных клеток для выделения клеток, экспрессирующих антитела к IL-13. Эти амплифицированные последовательности иммуноглобулина могут быть дополнительно подвергнуты манипуляциям in vitro, таким как способы созревания аффинности in vitro, такие как способы, описанные в публикации РСТ WO 07/29131 и публикации PCT WO 00/56772.
3. Моноклональные анти-IL-13-антитела, полученные с использованием трансгенных животных
В другом варианте осуществления настоящего изобретения антитела получают иммунизацией животного-нечеловека, содержащего локус иммуноглобулина человека, антигеном IL-13. В предпочтительном варианте осуществления этим животным-нечеловеком является трансгенная мышь XENOMOUSE, полученный генной инженерией штамм мыши, который содержит большие фрагменты локусов иммуноглобулина человека и является недостаточным в отношении продуцирования антител мыши. Смотрите, например, Green et al. Nature Genetics 7: 13-21 (1994) и патенты Соединенных Штатов 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. Смотрите также WO 91/10741, опубликованный 25 июля 1991 года, WO 94/02602, опубликованный 3 февраля 1994 года, WO 96/34096 и WO 96/33735, оба опубликованные 13 октября 1996 года, WO 98/16654, опубликованного 23 апреля 1998 года, WO 98/24893, опубликованного 11 июня 1998 года, WO 98/50433, опубликованного 12 ноября 1998 года, WO 99/45031, опубликованного 10 сентября 1999 года, WO 99/53049, опубликованного 21 октября 1999 года, WO 00 09560, опубликованного 24 февраля 2000 года и WO 00/037504, опубликованного 29 июня 2000 года. Эта трансгенная мышь XENOMOUSE продуцирует репертуар полных антител человека, подобный репертуару антител взрослого человека, и генерирует антиген-специфические mAb человека. Эта трансгенная мышь XENOMOUSE содержит приблизительно 80% репертуара антител человека посредством введения YAC-фрагментов конфигурации зародышевой линии с размером миллионов пар нуклеотидов (м.п.н.) локусов тяжелой цепи и х локусов легкой цепи человека. Смотрите Mendez et al., Nature Genetics 15: 146-156 (1997), Green and Jakobovits J. Exp. Med. 188:483-495 (1998), описания которых включены в настоящем описании в качестве ссылки.
4. Моноклональные анти-IL-13-антитела, полученные с использованием библиотек рекомбинантных антител
Способы in vitro также могут быть использованы для получения антител настоящего изобретения, причем в этих способах библиотеку антител подвергают скринингу для идентификации антитела, имеющего желаемую специфичность связывания. Способы такого скрининга библиотек рекомбинантных антител хорошо известны в данной области и включают способы, описанные, например, в Ladner et al. U.S. Patent No. 5223409; Kang et al. публикация РСТ WO 92/18619; Dower et al. публикация РСТ WO 91/17271; Winter et al. публикация РСТ WO 92/20791; Markland et al. публикация РСТ WO 92/15679; Breitling et al. публикация РСТ WO 93/01288; McCafferty et al. публикация РСТ WO 92/01047; Garrard et al. публикация РСТ WO 92/09690; Fuchs et al. (1991) Bio/Technology 9: 1370-1372; Hay et al. (1992) Hum Antibod Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; McCafferty et al, Nature (1990) 348:552-554; Griffiths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrad et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982, опубликованная заявка на патент США 20030186374 и публикация РСТ WO 97/29131, содержания которых включены в настоящем описании в качестве ссылки.
Библиотекой рекомбинантных антител может быть библиотека из индивида, иммунизированного IL-13 или hIL-13 или частью IL-13 или hIL-13. Альтернативно, эта библиотека рекомбинантных антител может быть библиотекой из «необученного» индивида, т.е. индивида, который не был иммунизирован IL-13 человека. Антитела настоящего изобретения отбирают скринингом библиотеки рекомбинантных антител пептидом, содержащим IL-13 человека, для отбора посредством этого антител, которые узнают IL-13. Способы проведения такого скрининга и отбора хорошо известны в данной области, например, способы, описанные в ссылках предыдущего абзаца. Для отбора антител настоящего изобретения, имеющих конкретные связывающие аффинности в отношении hIL-13, таких как антитела, которые диссоциируются от IL-13 человека с конкретной константой скорости диссоциации koff, может быть использован известный в данной области способ резонанса поверхностных плазмонов для отбора антител, имеющих желаемую константу скорости диссоциации koff. Для отбора антител настоящего изобретения, имеющих конкретную нейтрализующую активность в отношении hIL-13, таких как антитела с конкретной IC50, могут быть использованы стандартные способы, известные в данной области, для оценки ингибирования активности hIL-13.
В одном аспекте настоящее изобретение относится к выделенному антителу, или его антигенсвязывающей части, которые связывают IL-13 человека. Предпочтительно, это антитело является нейтрализующим антителом. В различных вариантах осуществления это антитело является рекомбинантным антителом или моноклональным антителом.
Например, антитела настоящего изобретения могут быть также получены с использованием различных способов фагового дисплея, известных в данной области. В способах фагового дисплея функциональные домены антител представлены на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. В частности, такой фаг может быть использован для представления антигенсвязывающих доменов, экспрессируемых из репертуарной или комбинаторной библиотеки антител (например, человека или мыши). Фаг, экспрессирующий антигенсвязывающий домен, который связывает представляющий интерес антиген, может быть отобран или идентифицирован антигеном, например, с использованием меченого антигена или антигена, связанного или захваченного на твердой поверхности или на грануле. Фаги, используемые в этих способах, являются обычно нитевидными фагами, включающими домены fd и M13, экспрессируемые из фага, с доменами антитела Fab, Fv или стабилизированного дисульфидом Fv, слитыми с белком либо гена III, либо гена VIII фага. Примеры способов фагового дисплея, которые могут быть использованы для получения антител настоящего изобретения, включают способы, описанные в Brinkman et al., J. Immunol. Methods 182:41-50 (1995); Ames et al., J. Immunol. Methods 184: 177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persic et al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57:191-280 (1994); публикацию РСТ № PCT/GB91/01134; публикации РСТ WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и патенты США с номерами 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108; все из которых включены в настоящем описании в качестве ссылки в полном виде.
Как описано в приведенных выше ссылках, после фагового отбора кодирующие области из этого фага могут быть выделены и использованы для генерирования полных антител, в том числе антител человека или любого другого желаемого антигенсвязывающего фрагмента, и экспрессированы в любом желаемом хозяине, в том числе в клетках млекопитающих, клетках насекомых, клетках растений, дрожжах и бактериях, например, как описано более подробно ниже. Например, способы рекомбинантного получения Fab-, Fab'- и F(ab')2-фрагментов могут быть также использованы с использованием способов, известных в данной области, таких как способы, описанные в публикации PCT WO 92/22324; Mullinax et al., BioTechniques 12(6):864-869 (1992); и Sawai et al., AJRI 34:26-34 (1995); и Better et al., Science 240: 1041-1043 (1988) (указанные ссылки включены в качестве ссылки в их полном виде). Примеры способов, которые могут быть использованы для получения одноцепочечных Fv и антител включают способы, описанные в патентах США 4946778 и 5258498; Huston et al., Methods in Enzymology 203:46-88 (1991); Shu et al., PNAS 90:7995-7999 (1993) и Skerra et al., Science 240:1038-1040 (1988).
В качестве альтернативы скринингу библиотек рекомбинантных антител с использованием фагового дисплея, другие методологии, известные в данной области, для скрининга больших комбинаторных библиотек могут быть применены для идентификации антител двойной специфичности настоящего изобретения. Одним типом альтернативной системы экспрессии является тип, в котором библиотека рекомбинантных антител экспрессируется в виде слияний РНК-белок, как описано в публикации РСТ WO 98/31700 by Szostak and Roberts и в Roberts, R. W. and Szostak, J.W. (1997) Proc. Natl. Acad. Sci USA 94: 12297-12302. В этой системе создают ковалентное слияние между мРНК и пептидом или белком, которые она кодирует, посредством in vitro трансляции синтетических мРНК, которые несут пуромицин, пептидил-акцепторный антибиотик, на их 3'-конце. Таким образом, специфическая мРНК может быть обогащена из комплексной смеси мРНК (например, комбинаторной библиотеки) на основе свойств кодируемого пептида или белка, например, антитела, или его части, например, связыванием этого антитела, или его части, с антигеном двойной специфичности. Последовательности нуклеиновых кислот, кодирующие антитела, или их части, извлеченные из скрининга таких библиотек, могут быть экспрессированы рекомбинантными способами, описанными выше (например, в клетках-хозяевах млекопитающих), и, кроме того, могут быть подвергнуты дополнительному созреванию аффинности либо дополнительными раундами скрининга слияний мРНК-пептид, в котором вводят мутации в первоначально отобранную последовательность (последовательности), либо другими способами созревания аффинности in vitro рекомбинантных антител, как описано выше.
В другом подходе антитела настоящего изобретения могут быть генерированы с использованием способов дрожжевого дисплея, известных в данной области. В способах дрожжевого дисплея используют генетические способы прикрепления доменов антител к стенке клетки дрожжей и представления их на поверхности дрожжей. В частности, такие дрожжи могут быть использованы для представления антигенсвязывающих доменов, экспрессируемых из репертуарной или комбинаторной библиотеки антител (например, человека или мыши). Примеры способов дрожжевого дисплея, которые могут быть использованы для получения антител настоящего изобретения, включают способы, описанные Wittrup, et al. в патенте США № 6699658, включенном в настоящем описании в качестве ссылки.
В. Получение рекомбинантных IL-13-антител
Антитела настоящего изобретения могут быть получены любым из ряда способов, известных в данной области. Например, экспрессией из клеток-хозяев, где экспрессирующий вектор (экспрессирующие векторы), кодирующий тяжелую и легкую цепи, трансфицирован в клетку-хозяина стандартными способами. Предполагается, что различные формы термина «трансфекция» включают большое разнообразие способов, обычно используемых для введения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева, например, электропорацию, осаждение фосфатом кальция, ДЭАЭ-декстрановой трансфекции и т.п. Хотя антитела настоящего изобретения могут быть экспрессированы либо в прокариотических, либо в эукариотических клетках-хозяевах, экспрессия антител в эукариотических клетках является предпочтительной, и наиболее предпочтительной является экспрессия антител в клетках-хозяевах млекопитающих, так как такие эукариотические клетки (и, в частности, клетки млекопитающих) имеют бóльшую вероятность, чем прокариотические клетки, сборки и секреции правильно уложенного и иммунологически активного антитела.
Предпочтительные клетки-хозяева млекопитающих для экспрессии рекомбинантных антител настоящего изобретения включают клетки яичника китайского хомячка (клетки СНО) (в том числе dhfr-клетки CHO, описанные в Urlaub and Chasin, (1980) Proc. Natl. Acad. ScL USA 77:4216-4220, используемые с селектируемым маркером DHFR, например, как описано в R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621), клетки миеломы NSO, клетки COS и клетки SP2. При введении рекомбинантных экспрессирующих векторов, кодирующих гены антитела, в клетки-хозяева млекопитающих, антитела получают культивированием клеток-хозяев в течение периода времени, достаточного для возможности экспрессии антитела в клетках-хозяевах, или, более предпочтительно, секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела могут быть извлечены из культуральной среды с использованием стандартных способов очистки белков.
Клетки-хозяева могут быть также использованы для получения функциональных фрагментов антител, таких как Fab-фрагменты или scFv-молекулы. Будет понятно, что вариации вышеописанной процедуры находятся в объеме настоящего изобретения. Например, может быть желательной трансфекция клетки-хозяина ДНК, кодирующей функциональные фрагменты легкой цепи и/или тяжелой цепи антитела настоящего изобретения. Технология рекомбинантных ДНК может быть также использована для удаления некоторой части или всей ДНК, кодирующей любую из легкой цепи и тяжелой цепи или обе цепи, которая не является необходимой для связывания с представляющими интерес антигенами. Молекулы, экспрессируемые из таких укороченных молекул ДНК, также включены в антитела настоящего изобретения. Кроме того, могут быть получены бифункциональные антитела, в которых одна тяжелая и одна легкая цепи являются антителом настоящего изобретения, а другие тяжелая и легкая цепи являются специфическими в отношении антигена, другого, чем представляющий интерес антиген, сшиванием антитела настоящего изобретения со вторым антителом стандартными химическими способами сшивания.
В предпочтительной системе рекомбинантной экспрессии антитела, или его антигенсвязывающей части, настоящего изобретения рекомбинантный экспрессирующий вектор, кодирующий как тяжелую цепь антитела, так и легкую цепь антитела, вводят в dhfr-CHO-клетки опосредованной фосфатом кальция трансфекцией. В этом рекомбинантном экспрессирующем векторе гены тяжелой цепи и легкой цепи, каждый, функционально связаны с регуляторными элементами энхансером CMV/промотором AdMLP, для запуска высоких уровней транскрипции этих генов. Этот рекомбинантный экспрессирующий вектор несет также ген DHFR, который делает возможным отбор СНО-клеток, которые были трансфицированы этим вектором, с использованием отбора с метотрексатом/амплификации. Отобранные трансформированные клетки-хозяева культивируют для возможности экспрессии тяжелой и легкой цепей антитела, и интактное антитело из культуральной среды. Стандартные способы молекулярной биологии используют для получения рекомбинантного экспрессирующего вектора, трансфекции клеток-хозяев, отбора на трансформанты, культивирования клеток-хозяев и извлечения антитела из культуральной среды. Кроме того, настоящее изобретение обеспечивает способ синтеза рекомбинантного антитела настоящего изобретения культивированием клетки-хозяина настоящего изобретения в подходящей культуральной среде, пока не синтезируется рекомбинантное антитело настоящего изобретения. Этот способ может дополнительно предусматривать выделение рекомбинантного антитела из культуральной среды.
1. Анти-IL-13-антитела
Таблица 5 является списком аминокислотных последовательностей VH- и VL-областей предпочтительных анти-hIL-13-антител настоящего изобретения.
Список аминокислотных последовательностей VH- и VL-областей

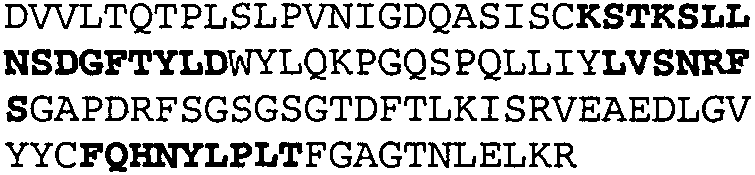
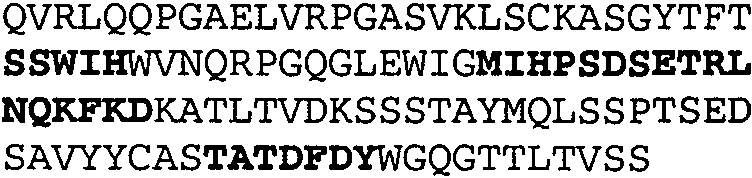
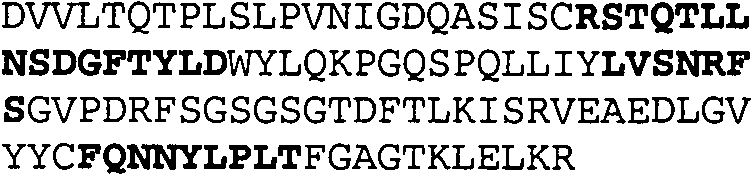
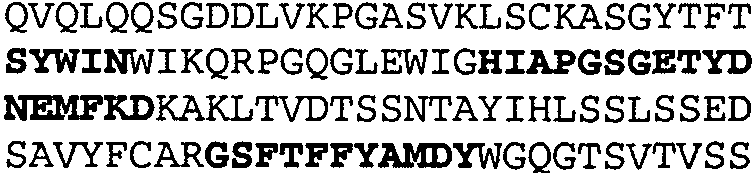
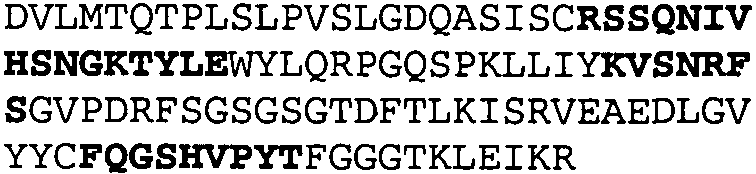
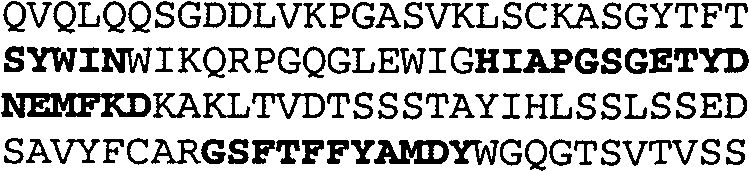
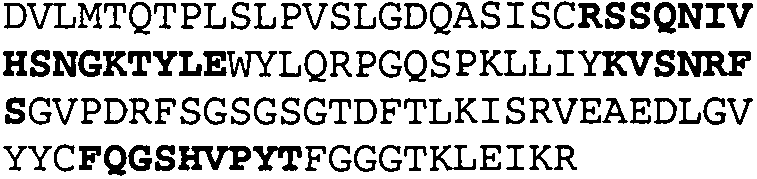

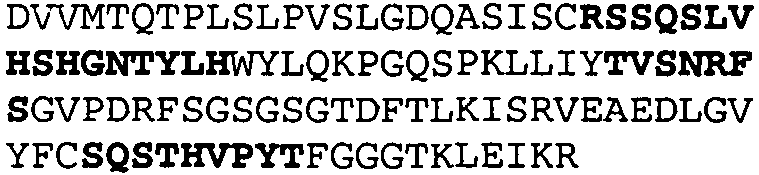

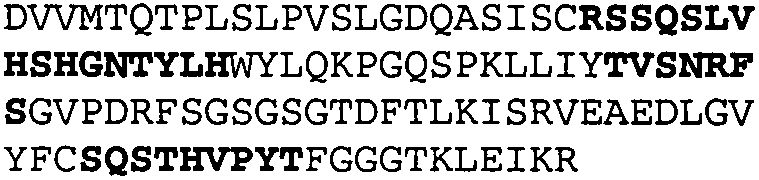


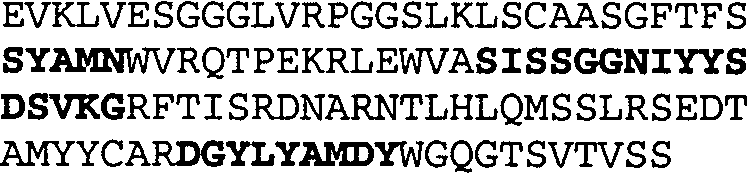






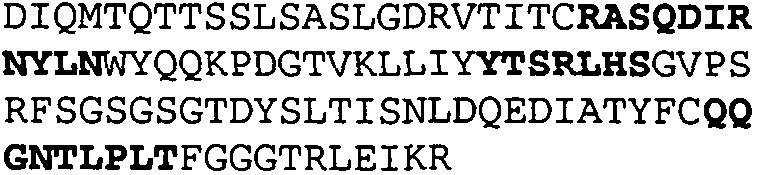
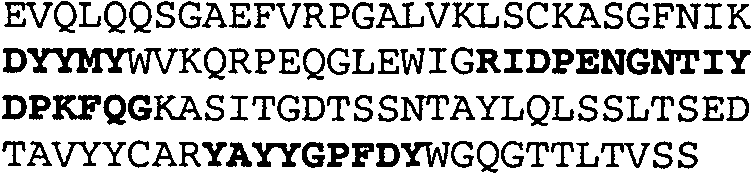
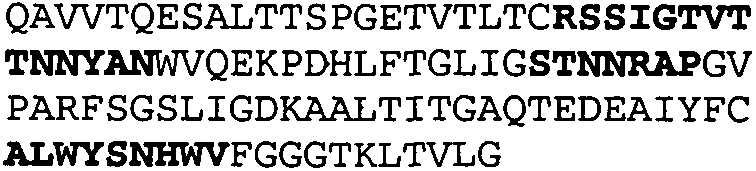
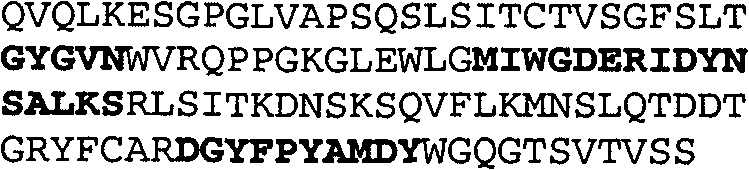
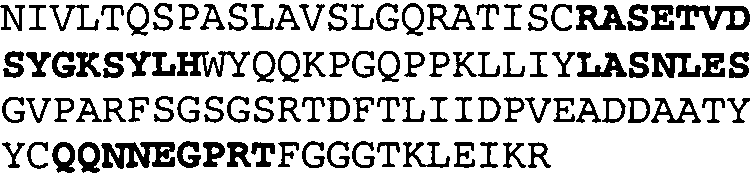
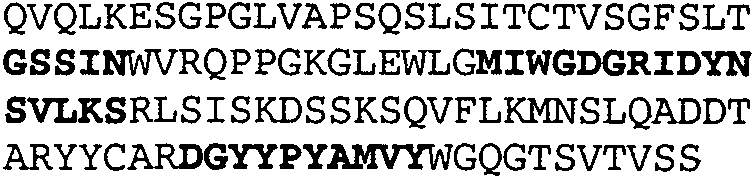
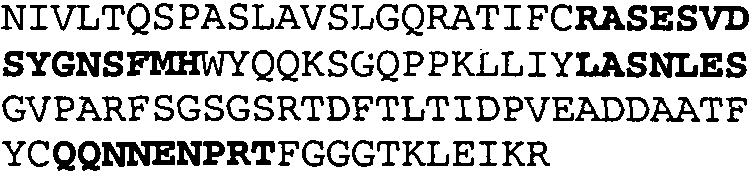
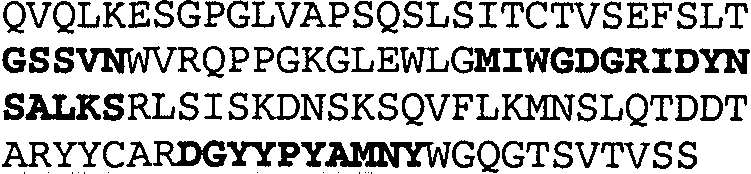
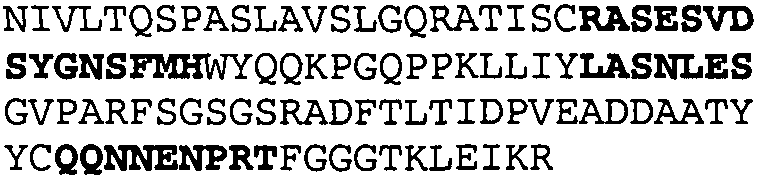
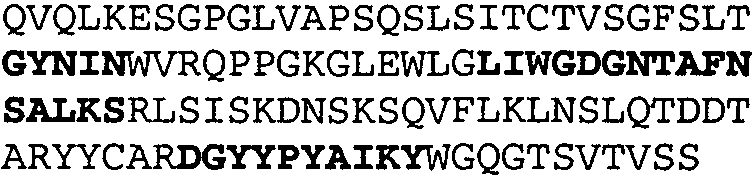
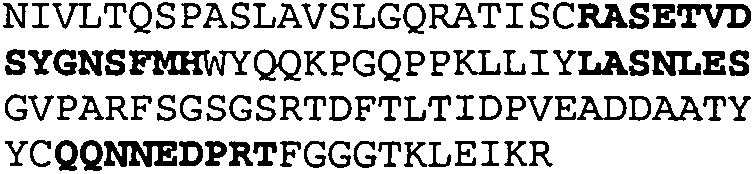
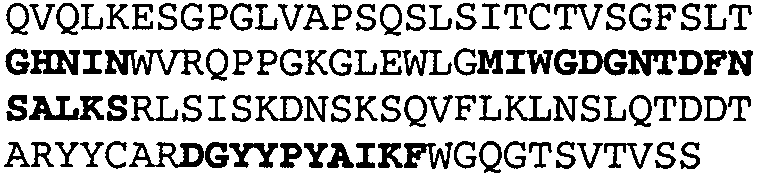
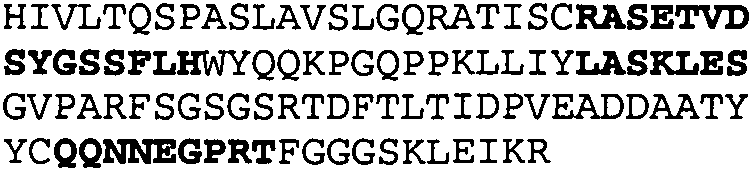
Предыдущие CDR-последовательности выделенного анти-IL-13-антитела устанавливают новое семейство IL-13-связывающих белков, выделенных в соответствии с настоящим изобретением, содержащее полипептиды, которые включают CDR-последовательности, перечисленные в таблице 6 ниже. Для генерирования и отбора CDR настоящего изобретения, имеющих предпочтительное связывание IL-13 и/или предпочтительную нейтрализующую активность в отношении IL-13 и/или hIL-13, могут быть использованы стандартные способы, известные в данной области, для генерирования связывающих белков настоящего изобретения и оценки связывания IL-13 и/или hIL-13 и/или нейтрализующих свойств этих связывающих белков, в том числе, но не только, конкретно описанных в настоящем описании.
Консенсусные аффинные лиганды CDR IL-13 (альтернативные остатки перечислены ниже каждого положения аминокислоты; - указывает на то, что этот остаток может отсутствовать)
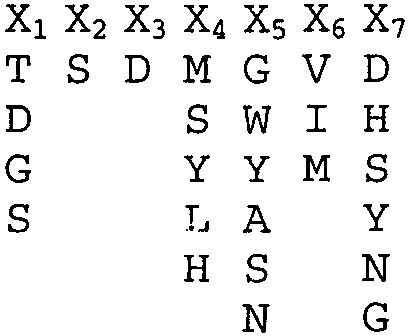


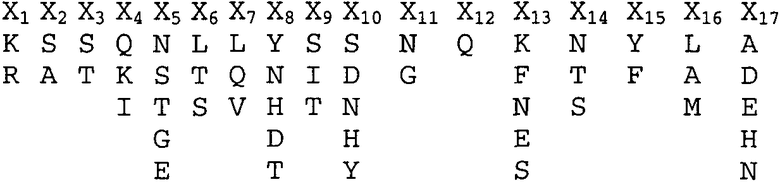


2. Химерные анти-IL-13-антитела
Химерное антитело является молекулой, в которой разные части этого антитела произведены из разных видов животных, например, антитела имеют вариабельную область, произведенную из мышиного моноклонального антитела, и константную область иммуноглобулина человека. Способы получения химерных антител известны в данной области и обсуждаются подробно в примере 2.1. Смотрите, например, Morrison, Science 229: 1202 (1985); Oi et al., BioTechniques 4:214 (1986); Gillies et al., (1989) J. Immunol. Methods 125:191-202; патенты США с номерами 5807715; 4816567; и 4816397, которые включены в настоящем описании в качестве ссылки в их полном виде. Кроме того, могут быть использованы способы, разработанные для получения «химерных антител» (Morrison et al., 1984, Proc. Natl. Acad. Sci. 81:851-855; Neuberger et al., 1984, Nature 312:604-608; Takeda et al., 1985, Nature 314:452-454, которые включены в настоящем описании в качестве ссылки в их полном виде) сплайсингом генов из молекулы мышиного антитела подходящей антиген-специфичности вместе с генами из молекулы антитела человека подходящей биологической активности.
В одном варианте осуществления химерные антитела настоящего изобретения получают заменой константной области тяжелой цепи мышиных моноклональных антител против IL-13 человека, описанных в разделе 1, константной областью IgG1 человека. В конкретном варианте осуществления химерное антитело настоящего изобретения содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность SEQ ID NO:34; SEQ ID NO:36; SEQ ID NO:41; SEQ ID NO:42; SEQ ID NO:46 и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность SEQ ID NO:35; SEQ ID NO:37; SEQ ID NO:40; SEQ ID NO:43 или SEQ ID NO:47.
3. Гуманизированные анти-IL-13-антитела
Гуманизированные антитела являются молекулами антител из антитела вида нечеловека, которые связывают желаемый антиген, имеющий один или несколько определяющих комплементарность областей (CDR) из вида нечеловека и каркасные области из молекулы иммуноглобулина человека. Известные последовательности Ig человека описаны, например, www.ncbi.nlm.nih.gov/entrez-/query.fcgi; www.atcc.org/phage/hdb.html; www.sciquest.com/; www.abcam.com/; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/.about.pedro/research_tools.html; www.mgen.uni-heidelberg.de/SD/IT/IT.html; www.whfreeman.com/immunology/CH-05/kuby05.htm; www.library.thinkquest.org/12429/Immune/Antibody.html; www.hhmi.org/grants/lectures/1996/vlab/; www.path.cam.ac.uk/.about.mrc7/m-ikeimages.html; www.antibodyresource.com/; mcb.harvard.edu/BioLinks/Immuno- logy.html.www.immunologylink.com/; pathbox.wustl.edu/.about.hcenter/index.-html; www.biotech.ufl.edu/.about.hcl/; www.pebio.com/pa/340913/340913.html-; www.nal.usda.gov/awic/pubs/antibody/; www.m.ehime-u.acjp/.about.yasuhito-/Elisa.html; www.biodesign.com/table.asp; www.icnet.uk/axp/facs/davies/lin-ks.html; www.biotech.ufl.edu/.about.fccl/protocol.html; www.isac-net.org/sites_geo.html; aximtl.imt.uni- marburg.de/.about.rek/AEP- Start.html; baserv.uci.kun.nl/.about.jraats/linksl.html; www.recab.uni-hd.de/immuno.bme.nwu.edu/; www.mrc-cpe.cam.ac.uk/imt-doc/pu- blic/INTRO.html; www.ibt.unam.mx/vir/V_mice.html; imgt.cnusc.fr:8104/; www.biochem.ucl.ac.uk/.about.martin/abs/index.html; antibody.bath.ac.uk/; abgen.cvm.tamu.edu/lab/wwwabgen.html; www.unizh.ch/.about.honegger/AHOsem-inar/Slide0l.html; www.cryst.bbk.ac.uk/.about.ubcg07s/; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.htm; www.path.cam.ac.uk/.about.mrc7/h-umanisation/TAHHP.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.cryst.bioc.cam.ac. uk/.about.fmolina/Web- pages/Pept/spottech.html; www.jerini.de/fr roducts.htm; www.patents.ibm.com/ibm.html.Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1983), каждая включена в настоящем описании полностью в качестве ссылки. Такие импортируемые (экзогенные) последовательности могут быть использованы для уменьшения иммуногенности или уменьшения, усиления или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, периода полужизни или другой подходящей характеристики, как известно в данной области.
Каркасные остатки в каркасных областях иммуноглобулина человека могут быть заменены соответствующим остатком из CDR-донорского антитела для изменения, предпочтительно улучшения, связывания антигена. Эти каркасные замены идентифицируют способами, известными в данной области, например, моделированием взаимодействий CDR и каркасных остатков для идентификации каркасных остатков, важных для связывания антигена и сравнения последовательностей для идентификации необычных каркасных остатков в конкретных положениях. (Смотрите, например, Queen et al., патент США № 5585089; Riechmann et al., Nature 332:323 (1988), которые включены в настоящем описании в качестве ссылки в их полном виде). Трехмерные модели иммуноглобулинов обычно доступны и известны квалифицированным в данной области специалистам. Доступны компьютерные программы, которые иллюстрируют и изображают возможные трехмерные конформационные структуры выбранных кандидатных последовательностей иммуноглобулинов. Обследование этих изображений позволяет анализировать вероятную роль остатков в функционировании кандидатной последовательности иммуноглобулина, т.е. анализировать остатки, которые влияют на способность кандидатного иммуноглобулина связывать его антиген. Таким путем FR-остатки могут быть отобраны и объединены из консенсусных и импортируемых (экзогенных) последовательностей таким образом, что достигается желаемое свойство антитела, такое как увеличенная аффинность в отношении антигена-мишени (антигенов-мишеней). Обычно остатки CDR непосредственно и наиболее существенно участвуют во влиянии на связывание антигена. Антитела могут быть гуманизированы с использованием разнообразных способов, известных в данной области, таких как, но не только, способы, описанные в Jones et al., Nature 321:522 (1986); Verhoeyen et al., Science 239:1534 (1988)), Sims et al., J. Immunol. 151: 2296 (1993); Chothia and Lesk, J. Mol. Biol. 196:901 (1987), Carter et al., Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992); Presta et al., J. Immunol. 151:2623 (1993), Padlan, Molecular Immunology 28 (4/5):489-498 (1991); Studnicka et al., Protein Engineering 7(6):805-814 (1994); Roguska. et al., PNAS 91:969-973 (1994); публикации PCT WO 91/09967, PCT/: US98/16280, US96/18978, US91/09630, US91/05939, US94/01234, GB89/01334, GB91/01134, GB92/01755; WO90/14443, WO90/14424, WO90/14430, EP 229246, EP 592106; EP 519596, EP 239400, патентах США с номерами 5565332, 5723323, 5976862, 5824514, 5817483, 5814476, 5763192, 5723323, 5766886, 5714352, 6204023, 6180370, 5693762, 5530101, 5585089, 5225539; 4816567, описания которых, в том числе цитируемые в них ссылки, включены в настоящем описании в качестве ссылки в полном виде.
С. Получение антител и продуцирующих антитела клеточных линий
Предпочтительно, анти-IL-13-антитела настоящего изобретения проявляют высокую способность уменьшения или нейтрализации активности IL-13, например, как оценено одним или несколькими анализами in vitro и in vivo, известными в данной области (например, смотрите пример 1.1.С). Например, эти антитела нейтрализуют индуцированное IL-13 продуцирование TARC клетками A-549 с величинами IC50 в диапазоне по меньшей мере приблизительно 10-8 M, приблизительно 10-9 M или приблизительно 10-10 M.
В предпочтительных вариантах осуществления выделенное антитело, или его антигенсвязывающая часть, связывает IL-13 человека, причем это антитело, или его антигенсвязывающая часть, диссоциируется от IL-13 человека с константой скорости диссоциации koff приблизительно 0,1 с-1 или менее, как определено по резонансу поверхностных плазмонов, или ингибирует IL-13 человека или активность IL-13 человека с IC50 приблизительно 1×10-6 M или менее. Альтернативно, это антитело, или его антигенсвязывающая часть, может диссоциироваться от IL-13 человека с константой скорости диссоциации koff приблизительно 1×10-2 с-1 или менее, как определено по резонансу поверхностных плазмонов, или может ингибировать IL-13 человека и/или активность IL-13 человека с IC50 приблизительно 1×10-7 M или менее. Альтернативно, это антитело, или его антигенсвязывающая часть, может диссоциироваться от IL-13 человека с константой скорости диссоциации koff приблизительно 1×10-3 с-1 или менее, как определено по резонансу поверхностных плазмонов, или может ингибировать IL-13 человека и/или активность IL-13 человека с IC50 приблизительно 1×10-8 M или менее. Альтернативно, это антитело, или его антигенсвязывающая часть, может диссоциироваться от IL-13 человека с константой скорости диссоциации koff приблизительно 1×10-4 с-1 или менее, как определено по резонансу поверхностных плазмонов, или может ингибировать IL-13 человека и/или активность IL-13 человека с IC50 приблизительно 1×10-9 M или менее. Альтернативно, это антитело, или его антигенсвязывающая часть, может диссоциироваться от IL-13 человека с константой скорости диссоциации koff приблизительно 1×10-5 с-1 или менее, как определено по резонансу поверхностных плазмонов, или может ингибировать IL-13 человека и/или активность IL-13 человека с IC50 приблизительно 1×10-10 M или менее. Альтернативно, это антитело, или его антигенсвязывающая часть, может диссоциироваться от IL-13 человека с константой скорости диссоциации koff приблизительно 1×10-5 с-1 или менее, как определено по резонансу поверхностных плазмонов, или может ингибировать IL-13 человека и/или активность IL-13 человека с IC50 приблизительно 1×10-11 M или менее.
IL-13 проявляет свои действия связыванием с IL-13-рецептором (IL-13R) на поверхности клетки, гетеродимером, состоящим из цепи IL-13Rα1 (IL-13Rα1) и цепи IL-4R (IL-4R). IL-13 связывается сначала с IL-13Rα1 с низкой аффинностью (KD=2-10 нМ) и затем рекрутирует IL-4R в этот комплекс, генерируя высокоаффинный рецептор (KD=0,03-0,4 нМ) (Aman, M. J., et al. 1996 J. Biol. Chem. 271, 29265-29270; Miloux, et al. 1997 FEBS Lett. 401, 163-166; Andrews, et al 2002 J. Biol. Chem. 277, 46073-46078). Гетеродимеризация IL-13R вызывает активацию киназ Janus (Януса), TYK2 и JAK1, конститутивно связанных с IL-13Rα1 и IL-4R, соответственно, с последующей активацией трансдуктора сигнала и активатора транскрипции 6 (STAT6) (Izuhara, K., and Arima, K. 2004 Drug News Perspect. 17, 91-98). Имеется другая IL-13-связывающая единица, IL-13Rα2-цепь (IL-13Rα2), которая связывается с IL-13 с высокой аффинностью (0,25-1,2 нМ) (Caput, et al 1996 J. Biol. Chem. 271, 16921-16926; Donaldson et al 1998 J. Immunol. 161, 2317-2324). Другие рецепторные молекулы, участвующие в комплексе IL-13·IL-13R2, неизвестны. Сначала считали, что IL-13R2 действует как не передающий сигнала «рецептор-ловушка». Однако впоследствии было обнаружено, что он может связываться с IL-13 и передавать сигнал через АР-1-путь, приводя к продуцированию TNF-β в некоторых типах клеток, в том числе макрофагах, что, в свою очередь, приводит к фиброзу легких (Fichtner-Feigl, 2006 Nat Med 12:99-106). Таким образом, как IL-13Rα1/IL-4Rα-путь, так и IL-13Rα2-путь вносят вклад в общую патофизиологию астмы и других легочных воспалительных состояний. Таким образом, терапевтическое анти-IL-13-антитело, которое блокирует связывание IL-13 с обоими рецепторами, будет более эффективным, чем антитело, которое блокирует только один рецептор.
Авторы выделили моноклональные антитела, которые блокируют связывание IL-13 как с IL-13Rα1, так и с IL-13Rα2. Как анализ связывания рецептора на основе ELISA, так и анализ связывания 125I-меченного IL-13 на поверхности клеток продемонстрировали, что 13C5, как мышиная версия, так и гуманизированная версия (т.е. 13C5.5), были способны эффективно блокировать связывание IL-13 с обоими рецепторами. Антитела в той же самой линии дифференцировки, что и 13C5, в том числе 25C8 и 33C3, были также способны блокировать связывание IL-13 с обоими рецепторами. Картирование эпитопа 13C5 показало, что его сайт связывания (сайты связывания) включали область C-концевой спирали D IL-13 человека (остатки VRDTK IEVAQ FVKDL LLHLK KLFRE GR, соответствующие аминокислотам 104-130 SEQ ID NO:1). Было сделано предположение, что область С-концевой спирали D участвует во взаимодействиях с IL-13-рецептором (Zuegg et al 2001 Immunol Cell Biol. 79:332-9). Структура кристалла IL-13 человека, в комплексе с Fab-частью антитела 13C5.5, показала, что 13C5.5 связывает область С-концевой спирали D, а также область N-концевой спирали А IL-13 человека. Предпочтительно, это антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека таким образом, что IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Ser26-Thr27-Ala28-Leu29-Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leu125-Phe126-Arg127-Glu-128-Gly129-Arg130 SEQ ID NO:1, ингибируется от связывания с IL-13-рецептором. Предпочтительно, это антитело, или его антигенсвязывающий фрагмент, связывает IL-13 человека таким образом, что IL-13 с указанным антителом, или его антигенсвязывающим фрагментом, связанным с эпитопом, определяемым топографическими областями Arg30-Glu31-Leu32-Ile33-Glu34-Glu35-Leu36-Val37-Asn38 и Lys123-Lys124-Leul25-Phel26-Arg127 SEQ ID NO:1 ингибируется от связывания с IL-13α2-рецептором.
В некоторых вариантах осуществления это антитело содержит константную область тяжелой цепи, такую как константная область IgG1, IgG2, IgG3, IgG4, IgA, IgE, IgM или IgD. Предпочтительно, константной областью тяжелой цепи является константная область тяжелой цепи IgG1 или константная область тяжелой цепи IgG4. Кроме того, это антитело может содержать константную область легкой цепи, либо константную область легкой цепи каппа, либо константную область легкой цепи лямбда. Предпочтительно, это антитело содержит константную область легкой цепи каппа. Альтернативно, частью антитела может быть Fab-фрагмент или одноцепочечный Fv-фрагмент.
Замены аминокислотных остатков в Fc-части для изменения эффекторной функции антител известны в данной области (Winter, et al. патенты США с номерами 5648260; 5624821). Fc-часть антитела опосредует несколько важных эффекторных функций, например, индукцию цитокинов, ADCC, фагоцитоз, комплементзависимую цитотоксичность (CDC) и период полужизни/скорость клиренса антитела и комплексов антиген-антитело. В некоторых случаях эти эффекторные функции являются желательными для терапевтического антитела, но в других случаях могут быть необязательными или даже вредными, в зависимости от целей терапии. Некоторые изотипы IgG человека, в частности, IgG1 и IgG3, опосредуют ADCC и CDC через связывание с FcγR и CIq комплемента, соответственно. Неонатальные Fc-рецепторы (FcRn) являются критическими компонентами, определяющими время полужизни антител в кровотоке. Еще в одном варианте осуществления по меньшей мере один аминокислотный остаток заменяют в константной области антитела, например, Fc-области этого антитела, так что эффекторные функции антитела изменяются.
Один вариант осуществления обеспечивает меченый связывающий белок, в котором антитело или часть антитела настоящего изобретения дериватизованы или связаны с другой функциональной молекулой (например, другим пептидом или белком). Например, меченый связывающий белок настоящего изобретения может быть произведен функциональным связыванием антитела или части антитела настоящего изобретения (химическим связыванием, генетическим слиянием, нековалентной ассоциацией или иным образом) с одной или несколькими другими молекулярными частицами, такими как другое антитело (например, биспецифическое антитело или диатело), детектируемый агент, цитотоксический агент, фармацевтический агент и/или белок или пептид, которые могут опосредовать ассоциацию этого антитела или части антитела с другой молекулой (такой как область центральной части (кора) стрептавидина или полигистидиновая метка).
Применимые детектируемые агенты, которыми может быть дериватизовано антитело или часть антитела настоящего изобретения, включают флуоресцентные соединения. Примерные флуоресцентные детектируемые агенты включают флуоресцеин, флуоресцеинизотиоцианат, родамин, 5-диметиламин-1-нафталинсульфонилхлорид, фикоэритрин и т.п. Антитело может быть также дериватизовано детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена, глюкозооксидаза и т.п. При дериватизации антитела детектируемым ферментом, его детектируют добавлением дополнительных реагентов, которые этот фермент использует для образования детектируемого продукта реакции. Например, когда присутствует детектируемая пероксидаза хрена, добавление пероксида водорода и диаминобензидина приводит к окрашенному продукту реакции, который является детектируемым. Антитело может быть также дериватизовано биотином и детектировано непрямым измерением связывания авидина или стрептавидина.
Другой вариант осуществления настоящего изобретения обеспечивает кристаллизуемый связывающий белок. Предпочтительно, изобретение относится к кристаллам полных анти-IL-13-антител и их фрагментов, как описано в настоящем описании, и готовым формам и композициям, содержащим такие кристаллы. В одном варианте осуществления кристаллизуемый связывающий белок имеет более продолжительный период полужизни in vivo, чем растворимая копия связывающего белка. В другом варианте осуществления связывающий белок сохраняет биологическую активность после кристаллизации.
Кристаллизуемый связывающий белок настоящего изобретения может быть получен в соответствии со способами, известными в данной области и описанными в WO 02072636, включенном в настоящем описании в качестве ссылки.
Другой вариант осуществления настоящего изобретения обеспечивает гликозилированный связывающий белок, в котором антитело, или его антигенсвязывающая часть, содержит один или несколько углеводных остатков. Продуцирование возникающего in vivo белка может подвергаться дополнительному процессингу, известному как посттрансляционная модификация. В частности, остатки сахара (гликозильные остатки) могут добавляться ферментативно посредством процесса, называемого гликозилированием. Полученные белки, несущие ковалентно связанные олигосахаридные боковые цепи, известны как гликозилированные белки или гликопротеины. Антитела являются гликопротеинами с одним или несколькими углеводными остатками в Fc-домене, а также вариабельном домене. Углеводные остатки в Fc-домене оказывают существенное действие на эффекторную функцию Fc-домена с минимальным действием на связывание антигена или время полужизни этого антитела (R. Jefferis, Biotechnol. Prog. 21 (2005), pp. 11-16). В отличие от этого, гликозилирование вариабельного домена может оказывать влияние на антигенсвязывающую активность этого антитела. Гликозилирование в вариабельном домене может оказывать отрицательное действие на аффинность связывания антитела, вероятно, вследствие стерического препятствия (Co, M.S., et al., MoI. Immunol. (1993) 30:1361-1367), или приводят к увеличенной аффинности в отношении антигена (Wallick, S.C., et al., Exp. Med. (1988) 168:1099-1109; Wright, A., et al., EMBO J. (1991) 10:2717 2723).
Один из аспектов настоящего изобретения направлен на генерирование мутантов сайтов гликозилирования, в которых О-связанный или N-связанный сайт гликозилирования связывающего белка был мутирован. Квалифицированный в данной области специалист может генерировать такие мутанты, используя стандартные хорошо известные технологии. Мутанты сайтов гликозилирования, которые сохраняют биологическую активность, но имеют увеличенную или уменьшенную связывающую активность, являются другим объектом настоящего изобретения.
Еще в одном варианте осуществления гликозилирование антитела, или его антигенсвязывающей части, является модифицированным. Например, может быть получено агликозилированное антитело (т.е. антитело, которое лишено гликозилирования). Гликозилирование может быть изменено, например, для увеличения аффинности антитела в отношении антигена. Такие углеводные модификации могут выполняться, например, изменением одного или нескольких сайтов гликозилирования в последовательности антитела. Например, могут быть произведены одна или несколько аминокислотных замен, которые приводят к элиминации одного или нескольких сайтов гликозилирования вариабельной области для элиминации посредством гликозилирования в сайте. Такое агликозилирование может увеличивать аффинность антитела в отношении антигена. Такой подход описан более подробно в публикации РСТ WO2003016466A2 и патентах США с номерами 5714350 и 6350861, каждый из которых включен в настоящем описании в качестве ссылки в полном виде.
Дополнительно или альтернативно, может быть получено модифицированное антитело настоящего изобретения, которое имеет измененный тип гликозилирования, например, гипофукозилированное антитело, имеющее уменьшенные количества фукозильных остатков, или антитело, имеющее увеличенные разделяющие на две равные части структуры GlcNA. Было показано, что такие измененные картины гликозилирования увеличивают ADCC-способность антител. Такие углеводные модификации могут выполняться, например, экспрессией антитела в клетке-хозяине с измененным аппаратом гликозилирования. Клетки с измененным аппаратом гликозилирования были описаны в данной области и могут быть использованы в качестве клеток-хозяев для экспрессии в них рекомбинантных антител настоящего изобретения для получения посредством этого антитела с измененным гликозилированием. Смотрите, например, Shields, R. L. et al. (2002) J. Biol. Chem. 277:26733-26740; Umana et al. (1999) Nat. Biotech. 17: 176-1, а также Европейский патент EP 1176195; публикации PCT WO 03/035835; WO 99/54342 80, описания которых включены в настоящем описании в качестве ссылки в полном виде.
Гликозилирование белка зависит от аминокислотной последовательности представляющего интерес белка, а также от клетки-хозяина, в которой экспрессируется этот белок. Разные организмы могут продуцировать различные ферменты гликозилирования (например, гликозилтрансферазы и гликозидазы) и имеют различные доступные субстраты (нуклеотидсахара). Вследствие таких факторов, картина гликозилирования белков и состав гликозильных остатков могут различаться в зависимости от системы-хозяина, в которой экспрессируется конкретный белок. Гликозильные остатки, применимые в этом изобретении, включают, но не ограничиваются ими, глюкозу, галактозу, маннозу, фукозу, н-ацетилглюкозамин и сиаловую кислоту. Предпочтительно, гликозилированный связывающий белок содержит гликозильные остатки, так что характер (паттерн) гликозилирования является таким же, что и характер (паттерн) гликозилирования антитела человека.
Квалифицированным в данной области специалистам известно, что отличающееся гликозилирование белка может приводить к отличающимся свойствам белка. Например, эффективность терапевтического белка, продуцируемого в микроорганизме-хозяине, таком как дрожжи, и гликозилирование, использующее эндогенный путь дрожжей, может быть уменьшенным в сравнении с гликозилированием того же самого белка, экспрессируемого в клетке млекопитающего, такой как клетка клеточной линии СНО. Такие гликопротеины могут быть также иммуногенными у человека и обнаруживают уменьшенное время полужизни in vivo после введения. Конкретные рецепторы у человека и других животных могут узнавать специфические гликозильные остатки и ускорять быстрый клиренс этого белка из кровотока. Другие вредные эффекты могут включать изменения укладки, растворимости, чувствительности к протеазам, направленной миграции, транспорта, компартментализации, секреции, узнавания другими белками или факторами, антигенности или аллергенности белков. Таким образом, практик может предпочесть терапевтический белок с конкретными составом и картиной гликозилирования, например, составом и характером гликозилирования, идентичными, или по меньшей мере сходными, с составом и характером гликозилирования в клетках человека или в видоспецифических клетках предполагаемого индивида-животного.
Экспрессия гликозилированных белков, отличающихся от гликозилированных белков клетки-хозяина, может быть достигнута генетической модификацией клетки-хозяина для экспрессии гетерологичных ферментов гликозилирования. С использованием способов, известных в данной области, практик может генерировать антитела или их антигенсвязывающие части, обнаруживающие гликозилирование белков человека. Например, штаммы дрожжей были генетически модифицированы для экспрессии не встречающихся в природе ферментов гликозилирования, так что гликозилированные белки (гликопротеины), продуцируемые в этих штаммах дрожжей, обнаруживали гликозилирование белков, идентичное гликозилированию белков животных клеток, в частности, клеток человека (заявки на патент США 20040018590 и 20020137134 и публикация PCT WO2005100584 A2).
Кроме этих связывающих белков, настоящее изобретение относится также к антиидиотипическому (анти-Id) антителу, специфическому в отношении таких связывающих белков настоящего изобретения. Анти-Id-антитело является антителом, которое узнает уникальные детерминанты, обычно связанные с антигенсвязывающей областью другого антитела. Это анти-Id может быть получено иммунизацией животного связывающим белком или его CDR-содержащей областью. Это иммунизированное животное будет узнавать идиотипические детерминанты и отвечать на идиотипические детерминанты иммунизирующего антитела и продуцировать анти-Id-антитело. Это анти-Id-антитело может быть также использовано в качестве «иммуногена» для индукции иммунной реакции в другом животном, продуцирующей так называемое анти-анти-Id-антитело.
Далее, квалифицированному в данной области специалисту будет понятно, что представляющий интерес белок может быть экспрессирован с использованием библиотеки клеток-хозяев, генетически сконструированных для экспрессии различных ферментов гликозилирования, так что клетки-хозяева, являющиеся членами этой библиотеки, продуцируют представляющий интерес белок с вариантными картинами гликозилирования. Затем практик может отобрать и выделить представляющий интерес белок с конкретными новыми картинами гликозилирования. Предпочтительно, белок, имеющий конкретную выбранную картину гликозилирования, обнаруживает улучшенные или измененные биологические свойства.
D. Применения анти-IL-13-антител
Вследствие их способности связываться с IL-13 человека, антитела против IL-13 человека, или их части, настоящего изобретения могут быть использованы для детекции IL-13 человека (например, в биологической пробе, такой как сыворотка или плазма) с использованием общепринятого иммуноанализа, такого как твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (RIA) или иммуногистохимия ткани. Настоящее изобретение обеспечивает способ детекции IL-13 человека в биологической пробе, предусматривающий контактирование биологической пробы с антителом, или частью антитела, настоящего изобретения и детектирование либо антитела (или части антитела), связанного с IL-13 человека, либо несвязанного антитела (или части антитела), для детекции посредством IL-13 человека в биологической пробе. Антитело прямо или опосредованно метят детектируемым веществом для облегчения детекции связанного или несвязанного антитела. Подходящие детектируемые вещества включают различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы и радиоактивные материалы. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу или ацетилхолинэстеразу; примеры подходящих комплексов простетической группы включают стрептавидин/биотин и авидин/биотин; примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеинизотиоцианат, родамин, дихлортриазиниламин-флуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; и примеры подходящего радиоактивного материала включают 3Н, 14С, 35S, 90Y, 99Tc, 111In, 125I, 131I, 177Lu, 166Ho или 153Sm.
Альтернативно мечению антитела, IL-13 человека может быть анализирован в биологических жидкостях конкурентным иммуноанализом с использованием rhIL-13-стандартов, меченных детектируемым веществом, и немеченого антитела против IL-13 человека. В этом анализе биологическую пробу, меченные rhIL-13-стандарты и антитело против IL-13 человека объединяют и определяют количество меченного rhIL-13-стандарта, связанного с немеченым антителом. Количество IL-13 человека в биологической пробе обратно пропорционально количеству меченного rhIL-13-стандарта, связанного с анти-IL-13-антителом. Подобным образом, IL-13 человека может быть также анализирован в биологических жидкостях конкурентным иммуноанализом с использованием rhIL-13-стандартов, меченных детектируемым веществом, и немеченого антитела против IL-13 человека.
Антитела и части антител настоящего изобретения предпочтительно способны нейтрализовать активность IL-13 человека как in vitro, так и in vivo. Таким образом, такие антитела и части антител настоящего изобретения могут быть использованы для ингибирования активности hIL-13, например, в культуре клеток, содержащих hIL-13, в индивидах-людях или в других индивидах-млекопитающих, имеющих IL-13, с которым перекрестно взаимодействует антитело настоящего изобретения. В одном варианте осуществления настоящее изобретение обеспечивает способ ингибирования активности hIL-13, предусматривающий контактирование hIL-13 с антителом или частью антитела настоящего изобретения, так что активность hIL-13 ингибируется. Например, в культуре клеток, содержащей или предположительно содержащей hIL-13, антитело или часть антитела настоящего изобретения, могут быть добавлены к культуральной среде для ингибирования активности hIL-13 в этой культуре.
В другом варианте осуществления настоящее изобретение обеспечивает способ уменьшения активности hIL-13 у индивида, предпочтительно у индивида, страдающего от заболевания или нарушения, в котором активность IL-13 является вредной для здоровья. Настоящее изобретение обеспечивает способы уменьшения активности IL-13 у индивида, страдающего от такого заболевания или нарушения, причем этот способ предусматривает введение индивиду антитела или части антитела настоящего изобретения, так что активность IL-13 у индивида уменьшается. Предпочтительно, IL-13 является IL-13 человека и индивид является индивидом-человеком. Альтернативно, этот индивид может быть млекопитающим, экспрессирующим IL-13, с которым способно связываться антитело настоящего изобретения. Кроме того, этот индивид может быть млекопитающим, в которого был введен IL-13 (например, введением IL-13 или экспрессией анти-IL-13-трансгена). Антитело настоящего изобретения может вводиться индивиду-человеку для терапевтических целей. Кроме того, антитело настоящего изобретения может быть введено млекопитающему (нечеловеку), экспрессирующему IL-13, с которым способно связываться это антитело, для ветеринарных целей или в качестве модели заболевания человека в животном. Что касается последнего применения, такие модели животных могут быть применимы для оценки терапевтической эффективности антител настоящего изобретения (например, испытания доз и временных схем введения).
В данном контексте термин «нарушение, в котором активность IL-13 является вредной» включает заболевания и другие нарушения, для которых было показано, что присутствие IL-13 у индивидов, страдающих от этого нарушения, является ответственным за патофизиологию этого нарушения или является фактором, который способствует ухудшению этого нарушения. Таким образом, нарушение, в котором активность IL-13 является вредной, является нарушением, в котором, как ожидается, уменьшение активности IL-13 будет уменьшать симптомы и/или прогрессирование этого нарушения. Такие нарушения могут быть обнаружены, например, по увеличению концентрации IL-13 в биологической жидкости индивида, страдающего от этого нарушения (например, увеличению концентраций IL-13 в сыворотке, плазме, синовиальной жидкости и т.д. индивида), которое может быть детектировано, например, с использованием анти-IL-13-антитела, как описано выше. Неограничивающие примеры нарушений, которые могут лечиться антителами настоящего изобретения, включают нарушения, обсуждаемые в разделе ниже, относящемся к фармацевтическим композициям антител настоящего изобретения.
Предполагалось, что IL-13 играет центральную роль в вызывании патологических реакций, связанных с астмой. Однако, другие медиаторы иммунологических путей также участвуют в патогенезе астмы, и блокирование этих медиаторов, наряду с IL-13, может предоставлять дополнительную терапевтическую пользу. Таким образом, связывающие белки настоящего изобретения могут быть включены в белки DVD-Ig, где этот DVD способен связывать пары-мишени, в том числе, но не только, IL-13 и провоспалительный цитокин, такой как фактор некроза опухолей альфа (TNF-α). TNF-α может усиливать воспалительную реакцию в астме и может быть связан с тяжестью заболевания (McDonnell, et al., Progress in Respiratory Research (2001), 31 (New Drugs for Asthma, Allergy and COPD), 247-250). Это позволяет предположить, что блокирование как IL-13, так и TNF-α может иметь полезные действия, в частности, в тяжелом заболевании дыхательных путей. В предпочтительном варианте осуществления DVD-Ig настоящего изобретения связывает мишени IL-13 и TNF-α и используется для лечения астмы.
В другом варианте осуществления связывающие белки настоящего изобретения могут быть использованы для генерирования молекул DVD-Ig, которые связывают IL-13 и IL-1β, IL-13 и IL-9; IL-13 и IL-4; IL-13 и IL-5; IL-13 и IL-25; IL-13 и TARC; IL-13 и MDC; IL-13 и MIF; IL-13 и TGF-β; IL-13 и агонист LHR; IL-13 и CL25; IL-13 и SPRR2a; IL-13 и SPRR2b; и IL-13 и ADAM8. Настоящее изобретение обеспечивает также DVD-Ig, способные связывать IL-13 и одну или несколько мишеней, участвующих в астме, выбранных из группы, состоящей из CSF1 (MCSF), CSF2 (GM-CSF), CSF3 (GCSF), FGF2, IFNA1, IFNB1; IFNG, гистамина и рецепторов гистамина, IL1A, IL1B, IL2, IL3, IL4, IL5, IL6, IL7, IL8, IL9, IL10, IL11, IL12A, IL12B, IL14, IL15, IL16, IL17, IL18, IL19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-30, IL-31, IL-32, IL-33, KITLG, PDGFB, IL2RA, IL4R, IL5RA, IL8RA, IL8RB, IL12RB1, IL12RB2, IL13RA1, IL13RA2, IL18R1, TSLP, CCL1, CCL2, CCL3, CCL4, CCL5, CCL7, CCL8, CCL13, CCL17, CCL18, CCL19, CCL20, CCL22, CCL24, CX3CL1, CXCL1, CXCL2, CXCL3, XCL1, CCR2, CCR3, CCR4, CCR5, CCR6, CCR7, CCR8, CX3CR1, GPR2, XCR1, FOS, GATA3, JAK1, JAK3, STAT6, TBX21, TGFB1, TNFSF6, YY1, CYSLTR1, FCER1A, FCER2, LTB4R, TB4R2, LTBR и хитиназы.
D. Фармацевтическая композиция
Настоящее изобретение обеспечивает также фармацевтические композиции, содержащие антитело, или его антигенсвязывающую часть, настоящего изобретения и фармацевтически приемлемый носитель. Эти фармацевтические композиции, содержащие антитела настоящего изобретения, применимы в (но не только) диагностике, детектировании или мониторинге нарушения, в предотвращении, лечении, ослаблении или уменьшении нарушения или его одного или нескольких симптомов и/или в исследованиях. В конкретном варианте осуществления композиция содержит одно или несколько антител настоящего изобретения. В другом варианте осуществления эта фармацевтическая композиция содержит одно или несколько антител настоящего изобретения и один или несколько профилактических или терапевтических агентов, других, чем антитела настоящего изобретения, для лечения нарушения, в котором активность IL-13 является вредной для здоровья. Предпочтительно, используют профилактические или терапевтические агенты, о которых известно, что они применимы или использовались или используются в настоящее время для предотвращения, лечения, устранения или уменьшения нарушения или его одного или нескольких симптомов. В соответствии с вариантами осуществления эта композиция может дополнительно содержать носитель, разбавитель или эксципиент.
Антитела и части антител настоящего изобретения могут быть включены в фармацевтические композиции, пригодные для введения индивиду. Обычно эта фармацевтическая композиция содержит антитело или часть антитела настоящего изобретения и фармацевтически приемлемый носитель. В данном контексте «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические и задерживающие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Примеры фармацевтически приемлемых носителей включают один или несколько компонентов из воды, солевого раствора, забуференного фосфатом солевого раствора, декстрозы, глицерина, этанола и т.п., а также их комбинаций. Во многих случаях будет предпочтительным включение изотонических агентов, например, сахаров, полиспиртов, таких как маннит, сорбит или хлорид натрия, в эту композицию. Фармацевтически приемлемые носители могут дополнительно содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, консерванты или буферы, которые увеличивают срок хранения или эффективность антитела или части антитела.
Известны различные системы доставки, и они могут быть использованы для введения одного или нескольких антител настоящего изобретения или комбинации одного или нескольких антител настоящего изобретения и профилактического агента или терапевтического агента, применимого для предотвращения, контроля, лечения или уменьшения нарушения или его одного или нескольких симптомов, например, инкапсулирование в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные экспрессировать антитело или фрагмент антитела, опосредованный рецептором эндоцитоз (смотрите, например, Wu and Wu, J. Biol. Chem. 262:4429-4432 (1987)), конструирование нуклеиновой кислоты в виде части ретровирусного или другого вектора и т.д. Способы введения профилактического или терапевтического агента настоящего изобретения включают, но не ограничиваются ими, парентеральное введение (например, интрадермальное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, внутриопухолевое введение и мукозное введение (например, интраназальный и оральный способы). Кроме того, может быть использовано легочное введение, например, с использованием ингалятора или распылителя, и формы с аэрозолирующем агентом. Смотрите, например, патенты США с номерами 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации РСТ с номерами WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, каждая из которых включена в настоящем описании в качестве ссылки в полном виде. В одном варианте осуществления антитело настоящего изобретения, комбинированное терапевтическое средство или композицию настоящего изобретения вводят с использованием технологии легочной доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.). В конкретном варианте осуществления профилактические или терапевтические агенты настоящего изобретения вводят внутримышечно, внутривенно, интратуморально, орально, интраназально, введением в легкие или подкожно. Профилактические или терапевтические агенты могут вводиться любым подходящим способом, например, инфузией или болюсной инъекцией, абсорбцией через эпителиальные или кожно-слизистые выстилки (например, через слизистую оболочку полости рта, ректальную или кишечную слизистую оболочку и т.д.) и могут вводиться вместе с другими биологически активными агентами. Введение может быть системным или локальным.
В конкретном варианте осуществления может быть желательным введение профилактических или терапевтических агентов настоящего изобретения локально в зону, требующую лечения; это может достигаться, например, без ограничения, локальной инфузией, инъекцией или посредством имплантата, являющегося пористым или непористым материалом, включающим мембраны и матриксы, такие как мембраны из силастика, полимеры, волокнистые матриксы (например, Tissuel®) или коллагеновые матриксы. В одном варианте осуществления эффективное количество одного или нескольких антител настоящего изобретения вводят локально в пораженную зону индивиду для предотвращения, лечения, контроля и/или ослабления нарушения или его симптома. В другом варианте осуществления эффективное количество одного или нескольких антител настоящего изобретения вводят локально в пораженную зону в комбинации с эффективным количеством одного или нескольких терапевтических средств (например, одного или нескольких профилактических или терапевтических агентов), других, чем антитело настоящего изобретения, индивиду для предотвращения, лечения, контроля и/или ослабления нарушения или одного или нескольких его симптомов.
В другом варианте осуществления профилактический или терапевтический агент настоящего изобретения может быть доставлен в системе регулируемого высвобождения или системе пролонгированного высвобождения. В одном варианте осуществления может быть использован насос для достижения регулируемого или пролонгированного высвобождения (смотрите Langer, смотрите ранее; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:20; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321:574). В другом варианте осуществления могут быть использованы полимерные материалы для достижения регулируемого или пролонгированного высвобождения терапевтических средств настоящего изобретения (смотрите, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, FIa. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J. Macromol. Sci. Rev. Macromol. Chem. 23:61; смотрите также Levy et al., 1985, Science 228: 190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 7 1:105); патент США № 5679377; патент США № 5916597; патент США № 5912015; патент США № 5989463; патент США № 5128326; публикация PCT № WO 99/15154 и публикация PCT № WO 99/20253. Примеры полимеров, используемых в препаратах пролонгированного высвобождения, включают, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), поли(метилметакрилат), поли(акриловую кислоту), поли(сополимер этилена и винилацетата), поли(метакриловую кислоту), полигликолиды (PLG), полиангидриды, поли(N-винилпирролидон), поли(виниловый спирт), полиакриламид, поли(этиленгликоль), полилактиды (PLA), поли(сополимер лактида и гликолида) (PLGA) и полиортоэфиры. В предпочтительном варианте осуществления полимер, используемый в форме пролонгированного высвобождения, является инертным, свободным от выщелачивающихся примесей, стабильным при хранении, стерильным и биодеградируемым. Еще в одном варианте осуществления система регулируемого или пролонгированного высвобождения может быть помещена вблизи профилактической или терапевтической мишени, так что для нее требуется только часть системной дозы (смотрите, например, Goodson, in Medical Applications of Controlled Release, смотрите ранее, vol. 2, pp. 115-138 (1984)).
Системы регулируемого высвобождения обсуждаются в обзоре Langer (1990, Science 249: 1527-1533). Любой способ, известный квалифицированному в данной области специалисту, может быть использован для получения форм пролонгированного высвобождения, содержащих один или несколько терапевтических агентов настоящего изобретения. Смотрите, например, патент США № 4526938, публикацию PCT WO 91/05548, публикацию PCT WO 96/20698, Ning et al., 1996, «Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel,» Radiotherapy & Oncology 39: 179-189, Song et al., 1995, «Antibody Mediated Lung Targeting of Long-Circulating Emulsions,» PDA Journal of Pharmaceutical Science &Technology 50:372-397, Cleek et al., 1997, «Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application,» Pro. Intl. Symp. Control. Rel. Bioact. Mater. 24:853-854 и Lam et al., 1997, «Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery,» Proc. Intl. Symp. Control Rel. Bioact. Mater. 24:759-760, описания которых включены в настоящем описании в качестве ссылки в их полном виде.
В конкретном варианте осуществления, где композицией настоящего изобретения является нуклеиновая кислота, кодирующая профилактический или терапевтический агент, эта нуклеиновая кислота может быть введена in vivo для стимуляции экспрессии кодируемого ею профилактического или терапевтического агента, конструированием ее в виде части подходящего экспрессирующего вектора нуклеиновой кислоты и введением его таким образом, что он становится внутриклеточным, например, с использованием ретровирусного вектора (смотрите патент США № 4980286), или прямой инъекцией, или с использованием бомбардировки микрочастицами (например, генным пистолетом; Biolistic, Dupont), или покрытием липидами или рецепторами клеточной поверхности или введением его в связи с гомеобокс-подобным пептидом, который, как известно, входит в ядро (смотрите, например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88: 1864-1868). Альтернативно, нуклеиновая кислота может быть введена внутриклеточно и включена в ДНК клетки-хозяина для экспрессии гомологичной рекомбинацией.
Фармацевтическую композицию настоящего изобретения готовят таким образом, что она является совместимой с предполагаемым способом ее введения. Примеры способов введения включают, но не ограничиваются ими, парентеральное, например, внутривенное, интрадермальное, подкожное, пероральное, интраназальное (например, ингаляцией), трансдермальное (например, местное), трансмукозное и ректальное введение. В конкретном варианте осуществления эту композицию готовят в соответствии с рутинными процедурами в виде фармацевтической композиции, адаптированной для внутривенного, подкожного, внутримышечного, перорального, интраназального или местного введения человеку. Обычно композиции для внутривенного введения являются растворами в стерильном изотоническом водном буфере. Если необходимо, композиция может также включать солюбилизирующий агент и локальный анестетик, такой как липокаин, для уменьшения боли в месте инъекции.
Если композиции настоящего изобретения должны вводиться местно, эти композиции могут быть приготовлены в форме мази, крема, трансдермального пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной специалисту с квалификацией в данной области. Смотрите, например, Remington's Pharmaceutical Sciences and Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995). Для неразбрызгиваемых местных лекарственных форм используют обычно полутвердые или твердые формы, содержащие носитель или один или несколько эксципиентов, совместимых с местным нанесением и имеющих динамическую вязкость, предпочтительно более высокую, чем вязкость воды. Подходящие формы включают, без ограничения, растворы, суспензии, эмульсии, кремы, мази, порошки, линименты (жидкие мази), целебные мази и т.п., которые, если желательно, стерилизуют или смешивают со вспомогательными агентами (например, консервантами, стабилизаторами, увлажняющими агентами, буферами или солями) для влияния на различные свойства, такие как, например, осмотическое давление. Другие подходящие местные лекарственные формы включают разбрызгиваемые аэрозольные препараты, в которых активный ингредиент, предпочтительно в комбинации с твердым или жидким инертным носителем, упакован в смеси с находящимся под давлением летучим средством (например, газообразным пропеллентом, таким как фреон) или в герметизируемые флаконы. Увлажнители или смачивающие средства также могут быть добавлены к фармацевтическим композициям и лекарственным формам, если желательно. Примеры таких дополнительных ингредиентов хорошо известны в данной области.
Если способ настоящего изобретения предусматривает интраназальное введение композиции, эта композиция может быть приготовлена в аэрозольной форме, в форме спрея, «тумана» (аэрозоля) или в форме капель. В частности, профилактические или терапевтические агенты для применения в соответствии с настоящим изобретением могут быть удобным образом доставлены в форме презентации аэрозольного спрея из находящихся под давлением упаковок или распылителя, с использованием подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В случае находящегося под давлением аэрозоля единица дозы может определяться обеспечением клапана для доставки отмеренного количества. Капсулы и патроны (картриджи) (изготовленные, например, из желатина) для применения в ингаляторе или в инсуффляторе могут быть приготовлены таким образом, что они содержат порошкообразную смесь соединения и подходящую порошковую основу, такую как лактоза или крахмал.
Если способ настоящего изобретения предусматривает пероральное введение, композиции могут быть приготовлены для перорального введения в форме таблеток, капсул, крахмальных облаток (капсул), желатиновых капсул, растворов, суспензий и т.п. Таблетки или капсулы могут быть приготовлены общепринятыми средствами с фармацевтически приемлемыми эксципиентами, такими как связывающие агенты (например, предварительно желатинированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнителями (например, лактозой, микрокристаллической целлюлозой или гидрофосфатом кальция); смазывающими агентами (например, стеаратом магния, тальком или кремнеземом); дезинтеграторами (например, картофельным крахмалом или гликолятом натрий-крахмала) или увлажняющими агентами (например, лаурилсульфатом натрия). Таблетки могут быть покрыты способами, известными в данной области. Жидкие препараты для перорального введения могут иметь форму, но не ограничиваются ими, растворов, сиропов или суспензий, или они могут быть представлены в виде сухого продукта для воссоздания с водой или другими носителями перед использованием. Такие жидкие препараты могут быть приготовлены общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, производные целлюлозы, или гидрогенизированные съедобные жиры); эмульгирующие агенты (такие как лецитин или аравийская камедь); неводные носители (например, миндальное масло, масляные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Эти препараты могут содержать также буферные соли, ароматизирующие, красящие и подслащивающие агенты при необходимости. Препараты для перорального введения могут быть подходящим образом приготовлены для медленного высвобождения, регулируемого высвобождения или пролонгированного высвобождения профилактического или терапевтического агента (агентов).
Способ настоящего изобретения может предусматривать легочное введение, например, с использованием ингалятора или распылителя, композиции, приготовленной с аэрозолирующим агентом. Смотрите, например, патенты США с номерами 6019968, 5985320, 5985309, 5934272, 5874064, 5855913, 5290540 и 4880078; и публикации РСТ с номерами WO 92/19244, WO 97/32572, WO 97/44013, WO 98/31346 и WO 99/66903, содержания которых включены в настоящем описании в качестве ссылки в их полном виде. В одном конкретном варианте осуществления антитело настоящего изобретения, комбинированное терапевтическое средство и/или композицию настоящего изобретения вводят с использованием технологии легочной доставки лекарственного средства Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.).
Способ настоящего изобретения может предусматривать введение композиции, приготовленной для парентерального введения, инъекцией (например, болюсной инъекцией или непрерывной инфузией). Готовые формы для инъекции могут быть представлены в форме унифицированной (стандартной) дозы (например, в ампулах или в многодозовых контейнерах) с добавленным консервантом. Эти композиции могут быть в форме суспензий, растворов или эмульсий в масляных или водных носителях и могут содержать облегчающие приготовление агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть в порошкообразной форме для воссоздания подходящим носителем (например, стерильной апирогенной водой) перед использованием.
Способы настоящего изобретения могут дополнительно предусматривать введение композиций, приготовленных в виде депо-препаратов. Такие препараты продолжительного действия могут вводиться имплантацией (например, подкожно или внутримышечно) или внутримышечной инъекцией. Так, например, эти композиции могут быть приготовлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами или слаборастворимыми производными (например, в виде слаборастворимой соли).
Способ настоящего изобретения включают введение композиций, приготовленных в виде нейтральных форм или форм солей. Фармацевтически приемлемые соли включают соли, образованные с анионами, такие как соли, произведенные из хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и т.д., и соли, образованные с катионами, такими как катионы, произведенные из натрия, калия, аммония, кальция, гидроксида трехвалентного железа, изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.д.
Обычно ингредиенты композиций поставляются или по отдельности, или смешанными вместе в унифицированной дозированной форме, например, в виде сухого лиофилизированного порошка или безводного концентрата в герметически заделанном контейнере, таком как ампула или пакетик с порошком, с указанным количеством активного агента. Когда способом введения является инфузия, композиция может фасоваться с инфузионным флаконом, содержащим стерильную воду или солевой раствор фармацевтической категории. Когда способом введения является инъекция, может быть обеспечена ампула стерильной воды для инъекции или солевого раствора, так что ингредиенты могут быть смешаны перед введением.
В частности, это изобретение обеспечивает также один или несколько профилактических или терапевтических агентов, или фармацевтические композиции настоящего изобретения упакованы в герметически заделанный контейнер, такой как ампула или пакетик с порошком, с указанным количеством агента. В одном варианте осуществления один или несколько профилактических или терапевтических агентов или фармацевтические композиции настоящего изобретения поставляются в виде сухого лиофилизированного порошка или безводного концентрата в герметически заделанном контейнере и могут быть воссозданы (например, водой или солевым раствором) до подходящей концентрации для введения индивиду. Предпочтительно, один или несколько профилактических или терапевтических агентов или фармацевтических композиций поставляются в виде унифицированной дозы по меньшей мере 5 мг, более предпочтительно по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг. Эти лиофилизированные профилактические или терапевтические агенты или фармацевтические композиции настоящего изобретения должны храниться при 2-8°C в их первоначальном контейнере и эти профилактические или терапевтические агенты или фармацевтические композиции настоящего изобретения должны вводиться в пределах 1 недели, предпочтительно в пределах 5 дней, в пределах 72 часов, в пределах 48 часов, в пределах 24 часов, в пределах 12 часов, в пределах 6 часов, в пределах 5 часов, в пределах 3 часов или в пределах 1 часа после воссоздания. В альтернативном варианте осуществления один или несколько профилактических или терапевтических агентов или фармацевтических композиций настоящего изобретения поставляются в жидкой форме в герметично заделанном контейнере с указанными количеством и концентрацией агента. Предпочтительно, жидкая форма вводимой композиции поставляется в герметично заделанном контейнере в концентрации по меньшей мере 0,25 мг/мл, более предпочтительно по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/мл, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Эта жидкая форма должна храниться при 2-8°C в ее первоначальном контейнере.
Антитела и части антител настоящего изобретения могут быть включены в фармацевтическую композицию, подходящую для парентерального введения. Предпочтительно, антитело или часть антитела готовят в виде инъекционного раствора, содержащего 0,1-250 мг/мл антитела. Этот инъекционный раствор может состоять либо из жидкой, либо из лиофилизированной дозированной формы во флаконе из флинтгласа или янтаря, ампуле или предварительно заполненном шприце. Буфером может быть L-гистидин (1-50 мМ), оптимально 5-10 мМ, при pH 5,0-7,0 (оптимально pH 6,0). Другие подходящие буферы включают, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия может быть использован для модификации токсичности этого раствора в концентрации 0-300 мМ (оптимально 150 мМ для жидкой лекарственной формы). Для лиофилизированной лекарственной формы могут быть включены криопротекторные агенты, в основном 0-10% сахароза (оптимально 0,5-1,0%). Другие подходящие криопротекторы включают трегалозу и лактозу. Для лиофилизированной лекарственной формы могут быть включены наполнители, в основном 1-10% маннит (оптимально 2-4%). Как для жидкой, так и для лиофилизированной форм могут быть использованы стабилизаторы, в основном 1-50 мМ L-метионин (оптимально 5-10 мМ). Другие подходящие наполнители включают глицин, аргинин и могут быть включены в виде 0-0,05% полисорбата-80 (оптимально 0,005-0,01%). Дополнительные поверхностно-активные вещества включают, но не ограничиваются ими, полисорбат 20 и поверхностно-активные вещества BRIJ. Фармацевтическая композиция, содержащая антитела и части антител настоящего изобретения, приготовленная в виде инъекционного раствора для парентерального введения, может дополнительно включать агент, применимый в качестве адъюванта, такой как агенты, используемые для увеличения абсорбции или дисперсии терапевтического белка (например, антитела). Особенно применимым адъювантом является гиалуронидаза, такая как Hylenex® (рекомбинантная гиалуронидаза человека). Добавление гиалуронидазы в инъекционный раствор улучшает биодоступность для человека после парентерального введения, особенно подкожного введения. Она позволяет также использовать большие объемы для одного места инъекции (т.е. более 1 мл) с меньшей болью и дискомфортом и иметь меньшую встречаемость реакций места инъекции (смотрите WO2004078140, US2006104968, включенные в настоящем описании в качестве ссылки).
Композиции настоящего изобретения могут находиться в различных формах. Они включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, инъекционные или инфузируемые растворы), дисперсии или суспензии, таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Типичные предпочтительные композиции находятся в форме инъекционных и инфузируемых растворов, таких как композиции, сходные с композициями, используемыми для пассивной иммунизации людей другими антителами. Предпочтительным способом введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В одном предпочтительном варианте осуществления это антитело вводят внутривенной инфузией или инъекцией. В другом предпочтительном варианте осуществления это антитело вводят внутримышечной или подкожной инъекцией.
Терапевтические композиции обычно должны быть стерильными и стабильными при условиях приготовления и хранения. Композиция может быть приготовлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные инъекционные растворы могут быть приготовлены включением активного соединения (т.е. антитела или части антитела) в требуемом количестве в подходящем растворителе с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, если необходимо, с последующей стерилизацией при помощи стерилизующего фильтра. Обычно дисперсии готовят включением активного соединения в стерильный носитель, который содержит базовую дисперсионную среду и требуемые другие ингредиенты из перечисленных выше. В случае стерильных, лиофилизированных порошков для приготовления стерильных инъекционных растворов, предпочтительными способами являются сушка в вакууме и сушка распылением, которая дает порошок активного ингредиента плюс любой дополнительный желаемый ингредиент из предварительно стерильно-отфильтрованного раствора. Необходимая текучесть раствора может поддерживаться, например, при помощи покрытия, такого как лецитин, посредством поддержания требуемого размера частиц в случае дисперсии и при помощи поверхностно-активных веществ. Пролонгированная абсорбция инъекционных композиций может достигаться включением в эту композицию агента, который задерживает абсорбцию, например, моностеаратных солей и желатина.
Эти антитела и части антител настоящего изобретения могут вводиться различными способами, известными в данной области, хотя для многих терапевтических применений предпочтительным способом/типом введения является подкожная инъекция, внутривенная инъекция или инфузия. Как будет понятно квалифицированному в данной области специалисту, способ и/или тип введения будет варьироваться в зависимости от желаемых результатов. В некоторых вариантах осуществления активное соединение может быть приготовлено с носителем, который будет защищать это соединение против быстрого высвобождения, например, в виде формы регулируемого высвобождения, включающей имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Могут быть использованы биодеградируемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы для приготовления таких готовых форм запатентованы или обычно известны квалифицированным в данной области специалистам. Смотрите, например, Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В некоторых вариантах осуществления антитело или его часть настоящего изобретения может вводиться перорально, например, с инертным разбавителем или ассимилируемым съедобным носителем. Это соединение (и необязательные другие ингредиенты) может быть также заключено в желатиновые капсулы с твердой или мягкой оболочкой, спрессовано в таблетки или включено непосредственно в рацион индивида. Для перорального терапевтического введения эти соединения могут быть включены с эксципиентами и использованы в форме таблеток для глотания, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Для введения соединения настоящего изобретения другим, непарентеральным, введением соединение может быть обязательно покрыто материалом или вводиться вместе с материалом для предотвращения его инактивации.
Дополнительные активные соединения могут быть также включены в композиции. В некоторых вариантах осуществления антитело или часть антитела настоящего изобретения готовят вместе и/или вводят вместе с одним или несколькими дополнительными терапевтическими агентами, которые применимы для лечения нарушений, в которых активность IL-13 является вредной для здоровья. Например, анти-IL-13-антитело или часть антитела настоящего изобретения могут быть приготовлены и/или могут быть введены с одним или несколькими дополнительными антителами, которые связывают другие мишени (например, антителами, которые связывают другие цитокины или которые связывают молекулы поверхности клеток). Кроме того, одно или несколько антител настоящего изобретения могут быть использованы в комбинации с двумя или более из предыдущих агентов. Такие комбинированные терапии могут преимущественно использовать более низкие дозы вводимых терапевтических агентов, что позволяет, следовательно, избежать возможных токсичностей или осложнений, связанных с различными монотерапиями.
В некоторых вариантах осуществления антитело к IL-13 или его фрагмент связывают с удлиняющим время полужизни носителем, известным в данной области. Такие носители включают, но не ограничиваются ими, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в заявке на патент США с порядковым номером 09/428082 и опубликованной заявке РСТ № WO 99/25044, которые включены в настоящем описании в качестве ссылки для всех целей.
В одном конкретном варианте осуществления, последовательности нуклеиновой кислоты, включающие нуклеотидные последовательности, кодирующие антитело настоящего изобретения или другой профилактический или терапевтический агент настоящего изобретения, вводят для лечения, предупреждения, контроля или ослабления нарушения или одного или нескольких его симптомов, посредством генной терапии. Генной терапией (генотерапией) называют терапию, выполняемую введением индивиду экспрессируемой или способной к экспрессии нуклеиновой кислоты. В этом варианте осуществления настоящего изобретения нуклеиновые кислоты продуцируют кодируемое ими антитело или профилактический или терапевтический агент настоящего изобретения, который опосредует профилактическое или терапевтическое действие.
Любой из способов генной терапии, доступных в данной области, может быть использован в соответствии с настоящим изобретением. В отношении общих обзоров способов генной терапии, смотрите Goldspiel et al., 1993, Clinical Pharmacy 12:488-505; Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, Science 260:926-932 (1993); и Morgan and Anderson, 1993, Ann. Rev. Biochem. 62: 191-217; May, 1993, TIBTECH 11(5): 155-215. Способы, обычно известные в области технологии рекомбинантных ДНК, которые могут быть использованы, описаны в Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Подробное описание различных способов генной терапии описано в US20050042664 A1, который включен в настоящем описании в качестве ссылки.
В другом аспекте настоящая заявка описывает способ лечения (например, контролирования, супрессии, ослабления, задержки или предотвращения появления, рецидива или повторяемости) или предотвращения IL-13-опосредованного нарушения у индивида. Этот способ предусматривает: введение индивиду IL-13-связывающего агента (в частности, антагониста), например, анти-IL-13-антитела или его фрагмента, описанных в настоящем описании, в количестве, достаточном для лечения или предупреждения IL-13-опосредованного нарушения. Этот антагонист IL-13, например, анти-IL-13-антитело или его фрагмент, может вводиться индивиду отдельно или в комбинации с другими терапевтическими воздействиями, описанными в настоящем описании.
В одном варианте осуществления индивидом является млекопитающее, например, человек, страдающий от одного или нескольких IL-13-опосредованных нарушений, включающих, например, респираторные нарушения (например, астму (например, аллергическую и неаллергическую астму), хроническую обструктивную болезнь легких (COPD, ХОБЛ) и другие состояния, включающие воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи; атопические нарушения (например, атопический дерматит и аллергический ринит); воспалительные и/или аутоиммунные состояния кожи, желудочно-кишечных органов (например, воспалительных заболеваний пищеварительного тракта (IBD), таких как язвенный колит и/или болезнь Крона), и печени (например, цирроза, фиброза); склеродермии; опухоли или раковые опухоли, например, лимфому Ходжкина, как описано в настоящем описании. Таким образом, настоящее изобретение включает применение IL-13-связывающего агента (такого как анти-IL-13-антитело или его фрагмент, описанные в настоящем описании) для описанного в настоящем описании лечения и применение IL-13-связывающего агента (такого как анти-IL-13-антитело или его фрагмент, описанные в настоящем описании) для приготовления лекарственного средства для описанного в настоящем описании лечения.
Примеры IL-13-опосредованных заболеваний включают, но не ограничиваются ими, нарушение, выбранное из одного или нескольких из респираторных нарушений (например, астмы (например, аллергической и неаллергической астмы (например, астмы вследствие инфицирования, например, респираторным синцитиальным вирусом (RSV), например, в детях малого возраста)), хронической обструктивной болезни легких (COPD, ХОБЛ) и других состояний, включающих воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи, например, муковисцидоз и пневмофиброз; атопических нарушений, например, происходящих из увеличенной чувствительности к IL-13 (например, атопического дерматита, крапивницы, экземы, аллергического ринита и аллергического энтерогастрита); воспалительных и/или аутоиммунных состояний кожи (например, атопического дерматита), желудочно-кишечных органов (например, воспалительных заболеваний пищеварительного тракта (IBD), таких как язвенный колит и/или болезнь Крона), печени (например, цирроза, гепатоцеллюлярной карциномы) и склеродермии; опухолей или раковых опухолей (например, мягкой ткани или солидных опухолей), таких как лейкоз, глиобластома и лимфома, например, лимфома Ходжкина; вирусных инфекций (например, из HTLV-1); фиброза других органов, например, фиброза печени (например, фиброза, вызываемого вирусом гепатита В и/или С); и супрессии проявления иммунных реакций защитного типа 1 (например, во время вакцинации), как описано в настоящем описании.
В других вариантах осуществления, настоящая заявка обеспечивает способ лечения (т.е. уменьшения, ослабления) или предупреждения одного или нескольких симптомов, связанных с респираторным нарушением, например, астмой (например, аллергической и неаллергической астмой); аллергиями; хронической обструктивной болезнью легких (COPD, ХОБЛ); состоянием, включающим воспаление дыхательных путей, эозинофилию, фиброз и избыточное продуцирование слизи, например, муковисцидозом и пневмофиброзом. Например, симптомы астмы включают, но не ограничиваются ими, стридор (свистящее дыхание), одышку, бронхостеноз, гиперреактивность дыхательных путей, уменьшенную емкость легких, фиброз, воспаление дыхательных путей и продуцирование слизи. Этот способ предусматривает введение индивиду антагониста IL-13, например, IL-13-антитела или его фрагмента, в количестве, достаточном для лечения (например, уменьшения, ослабления) или предотвращения одного или нескольких симптомов. IL-13-антитело может вводиться терапевтически или профилактически или обоими способами. Антагонист IL-13, например, анти-IL-13-антитело или его фрагмент, может вводиться индивиду отдельно или в комбинации с другими терапевтическими режимами, как описано в настоящем описании. Предпочтительно, индивидом является млекопитающее, например, человек, страдающий от IL-13-опосредованного нарушения, описанного в настоящем описании.
В другом аспекте, настоящая заявка обеспечивает способ детекции IL-13 в пробе in vitro (например, биологической пробе, такой как сыворотка, плазма, ткань, биопсия). Рассматриваемый способ может быть использован для диагностики нарушения, например, связанного с иммунными клетками нарушения. Этот способ предусматривает: (i) контактирование пробы или контрольной пробы с анти-IL-13-антителом или его фрагментом, описанными в настоящем описании; и (ii) детектирование образования комплекса между анти-IL-13-антителом или его фрагментом и пробой или контрольной пробой, причем статистически значимое изменение в образовании этого комплекса в пробе относительно контрольной пробы является показателем присутствия IL-13 в этой пробе.
Еще в одном аспекте настоящая заявка обеспечивает способ детекции IL-13 in vivo (например, визуализации in vivo у индивида). Рассматриваемый способ может быть использован для диагностики нарушения, например, IL-13-опосредованного нарушения. Этот способ предусматривает: (i) введение анти-IL-13-антитела или его фрагмента, описанных в настоящем описании, индивиду или контрольному индивиду в условиях, которые позволяют связывание этого антитела или фрагмента с IL-13; и (ii) детектирование образования комплекса между анти-IL-13-антителом или его фрагментом и IL-13, причем статистически значимое изменение в образовании этого комплекса у индивида относительно контрольного индивида является показателем присутствия IL-13.
Антитела настоящего изобретения, или их антигенсвязывающие части, могут быть использованы отдельно или в комбинации для лечения таких заболеваний. Должно быть понятно, что антитела настоящего изобретения, или их антигенсвязывающие части, могут быть использованы отдельно или в комбинации с дополнительным агентом, например, терапевтическим агентом, причем указанный дополнительный агент выбирает квалифицированный в данной области специалист для его предполагаемой цели. Например, этот дополнительный агент может быть терапевтическим агентом, который признан в данной области как применимый для лечения заболевания или состояния, которое лечат антителом настоящего изобретения. Этот дополнительный агент может быть также агентом, который придает полезный признак терапевтической композиции, например, агентом, который влияет на вязкость композиции.
Кроме того, должно быть понятно, что комбинации, которые должны быть включены в настоящее изобретение, являются комбинациями, применимыми для их предполагаемой цели. Агенты, представленные ниже, являются иллюстративными для этих целей и не должны рассматриваться как ограничивающие настоящее изобретение. Эти комбинации, которые являются частью настоящего изобретения, могут быть антителами настоящего изобретения и по меньшей мере одним дополнительным агентом, выбранным из приведенных ниже списков. Эта комбинация может также включать более одного дополнительного агента, например, два или три дополнительных агента, если эта комбинация является такой, что образованная композиция выполняет ее предполагаемую функцию.
Комбинированная терапия может включать один или несколько антагонистов IL-13, например, анти-IL-13-антител или их фрагментов, приготовленных совместно и/или вводимых совместно с одним или несколькими дополнительными терапевтическими агентами, например, одним или несколькими ингибиторами цитокинов и факторов роста, иммуносупрессорами, противовоспалительными агентами (например, системными противовоспалительными агентами), антифибротическим агентами, метаболическими ингибиторами, ингибиторами ферментов и/или цитотоксическими или цитостатическими агентами, как описано более подробно в настоящем описании.
Примеры предпочтительных дополнительных терапевтических агентов, которые могут одновременно вводиться и/или могут быть приготовлены с одним или несколькими антагонистами IL-13, например, анти-IL-13-антителами или их фрагментами, включает, но не ограничиваются ими, один или несколько из ингалируемых стероидов; бета-агонистов, например, краткосрочно действующих или долгосрочно действующих бета-агонистов; антагонистов лейкотриенов или рецепторов лейкотриенов; комбинированных лекарственных средств, таких как ADVAIR; ингибиторов IgE, например, анти-IgE-антител (например, XOLAIR); ингибиторов фосфодиэстеразы (например, ингибиторов PDE4); ксантинов; антихолинергических лекарственных средств; стабилизирующих мастоциты агентов, таких как кромолин; ингибиторов IL-4; ингибиторов IL-5; ингибиторов эотаксина/CCR3; антагонистов гистамина или его рецепторов, включающих H1, H2, H3 и H4, и антагонистов простагландина D или его рецепторов (DP1 и CRTH2). Такие комбинации могут быть использованы для лечения астмы и других респираторных нарушений. Дополнительные примеры терапевтических агентов, которые могут быть совместно введены или приготовлены вместе с одним или несколькими анти-IL-13-антителами или их фрагментами, включают один или несколько из антагонистов TNF (например, растворимого фрагмента TNF-рецептора, например, р55 или р75 рецептора TNF человека или его производных, например, TNFR-IgG с размером 75 кДа (слитый белок с размером 75 кДа TNF-рецептор-IgG, ENBREL)); антагонисты TNF-фермента, например, ингибиторы TNF-превращающего фермента (TACE); антагонисты мускаринового рецептора; антагонисты TGF-β; интерферон гамма; перфенидон; химиотерапевтические агенты, например, метотрексат, лефлуномид или сиролимус (рапамицин) или его аналог, например, CCI-779; ингибиторы COX2 и cPLA2; NSAID; иммуномодуляторы; ингибиторы p38, TPL-2, MK-2 и ингибиторы NF-κB, среди прочих.
Другие предпочтительные комбинации являются цитокин-супрессирующими противовоспалительными лекарственными средствами (CSAID); антителами к другим цитокинам или факторам роста человека или антагонистами других цитокинов и факторов роста человека, например, IL-1, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-15, IL-16, IL-18, IL-21, IL-31, интерферонов, EMAP-II, GM-CSF, FGF, EGF, PDGF и эндотелина-1, а также рецепторов этих цитокинов и факторов роста. Антитела настоящего изобретения, или их антигенсвязывающие части, могут комбинироваться с антителами к молекулам поверхности клетки, таким как CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD80 (B7.1), CD86 (B7.2), CD90, CTLA или их лиганды, в том числе CD154 (gp39 или CD40L).
Предпочтительные комбинации терапевтических агентов могут интерферировать в различных точках в воспалительном каскаде; предпочтительные примеры включают антагонисты TNF, такие как химерные, гуманизированные антитела или TNF-антитела человека, D2E7, (публикация PCT № WO 97/29131), CA2 (RemicadeTM), CDP 571 и растворимые TNF-рецепторы p55 или p75, и их производные, (p75TNFR1gG (EnbrelTM) или p55TNFR1gG (Lenercept), а также ингибиторы TNF-превращающего фермента (TACE); подобным образом ингибиторы IL-1 (ингибиторы интерлейкин-1-превращающего фермента, IL-1RA и т.д.) могут быть эффективными по той же самой причине. Другие предпочтительные комбинации включают интерлейкин 4. Другой предпочтительной комбинацией являются другие ключевые члены астматической реакции, которые могут действовать параллельно с функцией IL-13; особенно предпочтительными являются антагонисты IL-9, в том числе IL-9-антитела. Было показано, что IL-13 и IL-9 имеют перекрывающиеся, но различные функции, и комбинация антагонистов обоих из них может быть наиболее эффективной. Еще одной предпочтительной комбинацией являются анти-IL-5-антитела. Другие предпочтительные комбинации включают антагонисты хемокинов, включающие MCP-1, MCP-4, эотаксины, RANTES, MDC, CCL-12 и CCL-17 (TARC), и рецепторы хемокинов, включающие CCR2, CCR3, CCR4 и CXCR4. Другие комбинации могут включать антагонисты к медиаторам астмы, включающие кислую хитиназу млекопитающих, CRHT2, химазу, S1P1, S1P2, Tyk2, ROCKII, Stat6, p38, NFκB, фосфодиэстеразу 4 (PDE-4), триптазу мастоцитов, NO, аденозин, IKK2, GATA3, ICAM-1, VCAM-1 и ICOS.
Фармацевтические композиции настоящего изобретения могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела или части антитела настоящего изобретения. Термин «терапевтически эффективное количество» относится к количеству, эффективному, в дозах и в течение периодов времени, необходимых для достижения желаемого терапевтического результата. Терапевтически эффективное количество антитела или части антитела может быть определено специалистом с квалификацией в данной области и может варьироваться в соответствии с такими факторами, как состояние заболевания, возраст, пол и масса индивида, и способностью этого антитела или его части индуцировать желаемую реакцию в этом индивиде. Терапевтически эффективное количество является также количеством, в котором любые токсичные или вредные действия этого антитела или его части перевешиваются терапевтически полезными действиями. Термин «профилактически эффективное количество» относится к количеству, эффективному, в дозах и в течение периодов времени, необходимых для достижения желаемого профилактического результата. Обычно, поскольку профилактическую дозу используют в индивидах до заболевания или на ранней стадии заболевания, профилактически эффективное количество будет меньшим, чем терапевтически эффективное количество.
Схемы введения доз могут корректироваться для обеспечения желаемой реакции (например, терапевтической или профилактической реакции). Например, может вводиться единственный болюс, несколько разделенных доз на протяжении времени, или доза может быть пропорционально уменьшена или увеличена в соответствии с необходимостью терапевтической ситуации. Особенно предпочтительно готовить парентеральные композиции в дозированной унифицированной форме для облегчения введения и однородности дозы. Дозированная унифицированная форма обозначает в данном контексте физически дискретные единицы, подходящие в качестве однократных доз для подлежащих лечению индивидов-млекопитающих; каждая единица, содержащая заданное количество активного соединения, рассчитывается таким образом, что она производит желаемое терапевтическое действие в ассоциации с требуемым фармацевтическим носителем. Спецификация для дозированных однократных форм настоящего изобретения диктуется (а) уникальными свойствами активного соединения и зависит непосредственно от уникальных свойств активного соединения и конкретным терапевтическим или профилактическим действием, которое должно быть достигнуто, и (b) ограничениями, существующими в области компаундирования такого активного соединения, для лечения чувствительности у индивидов.
Примерный, неограничивающий диапазон для терапевтически или профилактически эффективного количества антитела или его части настоящего изобретения составляет 0,1-20 мг/кг, более предпочтительно 1-10 мг/кг. Следует отметить, что величины доз могут варьироваться в зависимости от типа и тяжести состояния, подлежащего ослаблению. Кроме того, должно быть понятно, что для любого конкретного индивида, конкретные схемы введения доз должны корректироваться на протяжении времени в соответствии с индивидуальной потребностью и профессиональным суждением специалиста, вводящего или контролирующего введение этих композиций, и что приведенные в настоящем описании диапазоны доз являются только примерными и не предназначены для ограничения объема или практики заявленной композиции.
Квалифицированным в данной области специалистам будет вполне понятно, что другие подходящие модификации и адаптации описанных в настоящем описании способов настоящего изобретения являются очевидными и могут быть произведены с использованием подходящих эквивалентов без отклонения от объема настоящего изобретения или описанных в настоящем описании вариантов осуществления. После подробного описания настоящего изобретения, описание будет еще более понятным при ссылке на следующие примеры, которые включены только для целей иллюстрации и не предназначены для ограничения настоящего изобретения.
ПРИМЕРЫ
Пример 1: Генерирование и выделение моноклональных антител против IL-13 человека
Пример 1.1: Анализы для идентификации антител против IL-13 человека
В примере 1 использовали следующие анализы для идентификации и характеристики антител против IL-13 человека, если нет других указаний.
Пример 1.1.А: ELISA
Твердофазный иммуносорбентный анализ для скрининга на антитела, которые связывают IL-13 человека, выполняли следующим образом.
Планшеты ELISA (Corning Costar, Acton, MA) покрывали 50 мкл на лунку 5 мкг/мл козьим антителом против Fc IgG мыши (Pierce # 31170, Rockford, IL) в фосфатно-солевом буфере (PBS) в течение ночи при 4ºС. Планшеты промывали один раз PBS, содержащим 0,05% Твин-20. Планшеты блокировали добавлением 200 мкл на лунку блокирующего раствора, разведенного до 2% в PBS (BioRad #170-6404, Hercules, CA), в течение 1 часа при комнатной температуре. Планшеты промывали один раз после блокирования PBS, содержащим 0,05% Твин-20.
Пятьдесят микролитров на лунку сывороток или гибридомных супернатантов мыши, разведенных в PBS, содержащем 0,1% бычий сывороточный альбумин (BSA) (Sigma, St. Louis, MO), добавляли в планшет ELISA, как описано выше, и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали три раза PBS, содержащим 0,05% Твин-20. В каждую лунку добавляли пятьдесят микролитров биотинилированного рекомбинантного очищенного варианта IL-13 человека (R110Q), разбавленного до 100 нг/мл в PBS, содержащем 0,1% BSA, и инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза PBS, содержащим 0,05% Твин-20. Стрептавидин-HRP (Pierce # 21126, Rockland, IL) разбавляли 1:20000 в PBS, содержащем 0,1% BSA; добавляли 50 мкл на лунку и планшеты инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза PBS, содержащим 0,05% Твин-20. Пятьдесят микролитров раствора TMB (Sigma # T0440, St. Louis, MO) добавляли в каждую лунку и инкубировали в течение 10 минут при комнатной температуре. Реакцию останавливали добавлением 1 н. серной кислоты. Планшеты считывали спектрофотометрически при длине волны 450 нм.
Пример 1.1.В: Определения аффинности с использованием технологии BIACORE
Анализ BIACORE (Biacore, Inc, Piscataway, NJ) определяет аффинность антител кинетическими измерениями констант скорости ассоциации, скорости диссоциации. Связывание антител с рекомбинантным очищенным IL-13 человека или рекомбинантным очищенным вариантом IL-13 человека (R110Q) определяли измерениями на основе резонанса поверхностных плазмонов при помощи прибора Biacore® 3000 (Biacore® AB, Uppsala, Sweden) с использованием проведения HBS-EP (10 мМ HEPES [pH 7,4], 150 мМ NaCl, 3 мМ ЭДТА и 0,005% поверхностно-активного вещества P20) при 25°C. Все химикалии получали из Biacore® AB (Uppsala, Sweden) или, в противном случае, из другого источника, как описано в тексте. Приблизительно 5000 RU козьего антитела против мышиного IgG, (Fcγ), фрагмент-специфического поликлонального антитела (Pierce Biotechnology Inc, Rockford, EL), разбавленного в 10 мМ ацетате натрия (pH 4,5), непосредственно иммобилизовали на биосенсорном чипе CM5 исследовательской чистоты с использованием стандартного набора амино-связывания в соответствии с инструкциями и процедурами изготовителя при 25 мкг/мл. Непрореагировавшие частицы на поверхности биосенсора блокировали этаноламином. Поверхность модифицированного карбоксиметилдекстрана в проточной ячейке 2 и 4 использовали в качестве поверхности реакции. Немодифицированный карбоксиметилдекстран без козьего антитела против мышиного IgG в проточной ячейке 1 и 3 использовали в качестве ссылочной поверхности. Для кинетического анализа уравнения скорости, произведенные из модели связывания 1:1 Langmuir, строили одновременно для фаз ассоциации и диссоциации всех восьми инжекций (с использованием глобального анализа подгонки) с применением программного обеспечения Biaevaluation 4.0.1. Очищенные антитела разбавляли в HEPES-забуференном солевом растворе для захвата через поверхности специфической для козьего антитела против мышиного IgG реакции. Мышиные антитела, подлежащие захвату в качестве лиганда (25 мкг/мл), инъецировали на матриксы реакции при скорости потока 5 мкл/мин. Константы скорости ассоциации и диссоциации, kon (в единицах M-1с-1) и koff (в единицах с-1) определяли при непрерывной скорости потока 25 мкл/мин. Константы скорости определяли проведением кинетических измерений связывания при десяти разных концентрациях антигена в диапазоне 10-200 нМ. Затем константу диссоциации (равновесия) (в единицах М) реакции между мышиными антителами и рекомбинантным очищенным IL-13 человека или рекомбинантным очищенным вариантом IL-13 человека рассчитывали из кинетических констант скорости по следующей формуле: KD=koff/kon. Связывание регистрировали как функцию времени и рассчитывали кинетические константы скорости. В этом анализе могли быть измерены такие высокие скорости ассоциации, как 106 M-1с-1, и такие медленные скорости диссоциации как 10-6 с-1.
Пример 1.1.С: Функциональная активность антител против IL-13 человека
Для испытания функциональной активности антител против IL-13 человека настоящего изобретения эти антитела использовали в следующих анализах, которые измеряют способность антитела ингибировать активность IL-13.
Пример 1.1.С 1: Биоанализ А-549
Способность антител против IL-13 человека ингибировать индуцированное IL-13 человека продуцирование TARC (CCL-17) клетками A-549 анализировали следующим образом. Клетки A-549 высевали в день 1 в 96-луночном планшете (25 клеток/мл) в среде для выращивания RPMI (с 10% FBS). В день 2 эту среду заменяли свежей средой для выращивания RPMI, содержащей 400 нг/мл rhTNF (100 мкл на лунку). Тем временем, различные концентрации сыворотки иммунизированной мыши, супернатанта мышиной гибридомы или очищенных антител против IL-13 человека предварительно инкубировали в течение одного часа при 37ºС с 10 нг/мл рекомбинантного очищенного IL-13 человека или варианта IL-13 в 100 мкл полной среды RPMI в микротитрационном планшете (U-донном, 96-луночном, Costar). Затем смесь антитело плюс рекомбинантный очищенный IL-13 человека добавляли (100 мкг на лунку) к TNF-обработанным клеткам A-549, с конечным объемом 200 мкл на лунку (конечные концентрации IL-13 и TNF были равны 5 нг/мл и 200 нг/мл, соответственно), и инкубировали в течение 18 часов при 37ºС. После инкубации брали 150 мкл бесклеточного супернатанта из каждой лунки и уровень продуцированного TARC человека измеряли с использованием ELISA для TARC человека (R&D Systems Cat#DDN00).
Клетки A-549 отвечали также на IL-13 других видов, в том числе собакоподобной обезьяны, мыши, крысы и овцы, с величинами ED50, сходными с величинами IL-13 человека. Таким образом, использовали перекрестно-реактивный анализ анти-hIL-13-mAb относительно IL-13 других видов с использованием того же самого экспериментального протокола.
Пример 1.2: Генерирование моноклональных антител против IL-13 человека
Мышиные моноклональные антитела против IL-13 человека получали следующим образом.
Пример 1.2.А: Иммунизация мышей антигеном IL-13 человека
Двадцать микрограммов рекомбинантного очищенного варианта IL-13 человека (Peprotech), смешанного с полным адъювантом Фрейнда или адъювантом Immunoeasy (Qiagen, Valencia, CA), инъецировали подкожно в пять 6-8-недельных мышей Balb/C, пять мышей C57B/6 и пять мышей AJ в день 1. В дни 24, 38 и 49 двадцать микрограммов рекомбинантного очищенного варианта IL-13 человека, смешанного с неполным адъювантом Фрейнда или адъювантом Immunoeasy, инъецировали подкожно в тех же самых мышей. В день 84 или день 112, или день 144 мышей инъецировали внутривенно 1 мкг рекомбинантного очищенного варианта IL-13 человека.
Пример 1.2.В: Генерирование гибридомы
Спленоциты, полученные из иммунизированных мышей, описанных в примере 1.2.А, сливали с клетками SP2/O-Ag-14 в соотношении 5:1 в соответствии с установленным способом, описанным в Kohler, G. and Milstein 1975, Nature, 256:495, для генерирования гибридом. Слитые белки высевали в селективную среду, содержащую азасерин и гипоксантин, в 96-луночных планшетах при плотности 2,5×106 спленоцитов на лунку. Через семь-десять дней после слияния наблюдали макроскопические гибридомные колонии. Супернатант из каждой лунки, содержащей гибридомные колонии, испытывали при помощи ELISA на присутствие варианта антитела к IL-13 (как описано в примере 1.1.А). Затем супернатанты, обнаруживающие IL-13-вариант-специфическую активность, испытывали на способность нейтрализовать IL-13-вариант и IL-13 дикого типа в биоанализе А-549 на TARC (как описано в примере 1.1.С).
Пример 1.2.С: Идентификация и характеристика моноклональных антител против IL-13 человека
Гибридомы, продуцирующие антитела, которые связывали IL-13-вариант, генерированные в соответствии с примерами 1.2.В и 1.2.С и способные связывать специфически IL-13-вариант, и, в частности, гибридомы с величинами IC50 в А-549-биоанализе 5 нМ или менее 5 нМ определяли и клонировали лимитирующим разведением.
Гибридомные клетки размножали в среде, содержащей 10% фетальную телячью сыворотку с низким IgG (Hyclone #SH30151, Logan, UT). В среднем, 250 мл каждого гибридомного супернатанта (произведенного из клональной популяции) собирали, концентрировали и очищали белок А-аффинной хроматографией, как описано в Harlow, E. and Lane, D. 1988 «Antibodies: A Laboratory Manual». Способность очищенных mAb ингибировать активность IL-13 определяли с использованием биоанализа А-549, как описано в примере 1.1.С. Таблица 7 показывает величины IC50 из биоанализов А-549 для 17 моноклональных антител.
Нейтрализация IL-13 анти-IL-13-mAb в биоанализе А-549
Аффинности связывания моноклональных антител с рекомбинантным очищенным IL-13-вариантом человека и IL-13 человека дикого типа определяли с использованием измерения резонанса поверхностных плазмонов (Biacore®), как описано в примере 1.1.В. Таблица 8 показывает аффинность 18 моноклональных антител, описанных выше, для IL-13 человека.
Аффинность анти-IL-13-mAb в отношении IL-13 дикого типа и варианта IL-13 человека
Пример 1.2.С.1: Видоспецифичность мышиных моноклональных антител против IL-13 человека
Для определения, узнают ли 17 моноклональных антител, описанных выше, мышиный IL-13, проводили непрямой ELISA покрытием планшетов ELISA 5 мкг/мл козьего антитела против мышиного IgG, Fc-фрагмента, (Pierce # 31170, Rockland, IL). Мышиные mAb против IL-13 человека готовили в различных концентрациях в диапазоне от 0,1 до 100 нг/мл в PBS, содержащем 0,1% BSA; 50 мкл каждого разведения антител добавляли в покрытый планшет ELISA и инкубировали в течение 1 часа при комнатной температуре. Лунки промывали 3 раза PBS, содержащим 0,05% Твин-20. Рекомбинантный биотинилированный мышиный IL-13 (R&D Systems) разбавляли при 0,1 мкг/мл в PBS, содержащем 0,1% BSA; добавляли 50 мкл на лунку и эти планшеты инкубировали в течение 1 часа при комнатной температуре. Лунки промывали 3 раза PBS, содержащим 0,05% Твин-20. Стрептавидин-HRP (Pierce # 21126, Rockland, IL) разбавляли 1:20000 в PBS, содержащем 0,1% BSA; 50 мл на лунку добавляли и эти планшеты инкубировали в течение 1 часа при комнатной температуре. Планшеты промывали 3 раза PBS, содержащим 0,05% Твин-20. Пятьдесят микролитров раствора TMB (Sigma # T0440, St. Louis, MO) добавляли в каждую лунку и инкубировали в течение 10 минут при комнатной температуре. Реакцию останавливали добавлением 1 н. серной кислоты. Планшеты считывали спектрофотометрически при длине волны 450 нм. Результаты из этого непрямого анализа ELISA показали, что mAb 3Н7 было способно связывать mIL-13. В следующем биоанализе было показано, что 3Н7 могло ингибировать mIL-13-стимулированное продуцирование TARC зависимым от дозы образом, с IC50 2,4 нМ. Анализ Biacore продемонстрировал также положительное связывание 3Н7 с mIL-13, с KD 12 нМ. Все другие mAb в таблице 8 не показали какого-либо положительного связывания с мышиным IL-13.
Активность нейтрализации анти-hIL-13-mAb против IL-13 примата нечеловека (собакоподобной обезьяны) и IL-13 овцы также измеряли в биоанализе А-549. Для генерирования IL-13 собакоподобной обезьяны и овцы кДНК для каждого белка получали при помощи ПЦР на геномной ДНК в качестве матрицы с использованием вырожденных праймеров на основе последовательности IL-13 человека. Затем рекомбинантные IL-13-белки собакоподобной обезьяны и овцы экспрессировали в транзиторно трансфицированных клетках COS. IL-13 человека дикого типа также генерировали параллельно в качестве контроля во всех функциональных исследованиях. Клетки А-549 отвечали как на IL-13 собакоподобной обезьяны, так и на IL-13 овцы со сходной ED50 относительно ED50 IL-13 человека. Большинство этих mAb нейтрализовали активность IL-13 собакоподобной обезьяны, демонстрируя перекрестную реактивность с IL-13 собакоподобной обезьяны (таблица 7). Однако ни одно из этих антител не обнаруживало значимой нейтрализации IL-13 овцы.
Пример 1.2.С.2: Мышиные моноклональные антитела против IL-13 человека блокируют связывание IL-13 с IL-13-рецепторами (IL-13Rα1 и IL-13Rα2)
Активность IL-13 опосредована через рецепторный комплекс, состоящий из цепей IL-13Rα1 и IL-4Rα. Этот цитокин сначала подвергается взаимодействию с относительно низкой аффинностью с IL-13Rα1 на поверхности клеток. Затем комплекс IL-13/IL-13Rα1 рекрутирует IL-4Rα с образованием полного IL-13-рецептора, который связывается с его лигандом (IL-13) с высокой аффинностью (Zurawski et al. (1993) EMBO J. 12:2663; Zurawski et al. (1995) J. Biol. Chem. 270:23869). Затем это связывание IL-13 с рецептором с высокой аффинностью посылает сигналы далее через цепь IL-4Rα, вовлекая путь трансдуктора сигнала киназы Януса и активатора транскрипции (JAK-STAT), например, посредством фосфорилирования STAT6, что может быть подвергнуто мониторингу в виде одной из самых ранних клеточных реакций на IL-13 (Murata et al., смотрите ранее).
Имеется другой IL-13-связывающий рецептор, цепь IL-13Rα2 (IL-13Ra2), который связывается с IL-13 с высокой аффинностью (0,25-1,2 нМ) (Caput, et al 1996 J. Biol. Chem. 271, 16921-16926; Donaldson et al 1998 J. Immunol. 161, 2317-2324). Ни одна другая рецепторная молекула, участвующая в комплексе IL-13/IL-13Rα2, не известна. Сначала считали, что IL-13Rα2 действует в качестве не передающего сигнала «рецептора-ловушки». Однако впоследствии было обнаружено, что он может связываться с IL-13 и передавать сигнал через АР-1-путь, приводя к продуцированию TGF-β в некоторых типах клеток, в том числе макрофагах, что, в свою очередь, приводит к фиброзу легких (Fichtner-Feigl, 2006 Nat Med 12:99-106). Таким образом, как комплекс IL-13Rα1/IL-4R, так и IL-13Rα2-путь вносят вклад в общую патофизиологию астмы и других IL-13-опосредованных заболеваний. Несколько подходов, таких как картирование эпитопов, анализы связывания рецептора, вытеснительная хроматография на основе размера молекул (SEC) и последующий анализ BIACORE, использовали для выяснения взаимодействия между анти-IL-13-антителами настоящего изобретения и IL-13 человека.
Для определения, способны ли описанные выше моноклональные антитела блокировать связывание IL-13 с IL-13-рецепторами (IL-13Rα1 и IL-13Rα2), был разработан анализ ELISA для связывания рецептора следующим образом. 96-луночные планшеты ELISA высокого связывания покрывали 4 мкг/мл рекомбинантного IL-13Rα1/Fc или IL-13Rα2/Fc (R&D Systems) в 100 мкл на лунку буфера для покрытия (карбонатного-бикарбонатного буфера, Pierce) при 4ºC. Через 16 часов раствор для покрытия удаляли постукиванием планшетов для стряхивания содержимого планшетов в водосток и эти планшеты промывали и блокировали 4 раза с использованием блокирующего буфера Superblock (240 мкл на лунку) (Pierce). Добавляли анти-IL-13-mAb (1:4 серийно разведенные из 40 мкг/мл, 50 мкг/мл на лунку) и биотин-IL-13 (50 мкл на лунку, конечные концентрации 5 нМ для hIL-13Rα1/Fc и 0,5 нМ для hIL-13Rα2/Fc) и инкубировали в течение 2 часов при комнатной температуре (RT). Планшеты промывали 5 раз 300 мкл 0,1% PBST и затем добавляли 100 мкл 1:5000 разведенных мышиных анти-биотин-mAb (Jackson Immunosciences) и инкубировали при комнатной температуре в течение 45 минут. Эти планшеты вновь промывали 5 раз 300 мкл 0,1% PBST с последующим добавлением реагента TMB-субстрата (100 мкл на лунку, Pharmingen); проявляли в течение 5 минут и останавливали добавлением 50 мкл 2 M H2SO4 (VWR). OD при 450 нм определяли спектрофотометрически.
Кроме того, блокирующие рецептор свойства этих mAb оценивали также анализом связывания рецептора с использованием IL-13Rα2-трансфицированных клеток COS. Рекомбинантный IL-13 человека метили 125I (Amersham, Arlington Heights, IL) с использованием реагента IODO-GEN (Pierce, Rockford, IL), как описано ранее (Obiri NI et al., (1995) J Biol Chem. 270:8797-8804). Было определено, что удельная активность радиоактивно меченного IL-13 была равна 158 мкКи/мкг белка. Этот меченый IL-13 обнаруживал сходную биоактивность с биоактивностью немеченого IL-13, как оценено биоанализом А-549. Для экспериментов по связыванию, клетки COS транзиторно трансфицировали IL-13Rα2 человека с применением Липофектамина 2000 (Invitrogen) и инкубировали в течение 48 часов. Трансфицированные клетки COS (5×105 клеток в 100 мкл буфера для связывания: RPMI 1640, содержащая 0,2% сывороточный альбумин человека и 10 ммоль HEPES), инкубировали с 1,0 нМ 125I-IL-13 с 1 мкМ немеченым IL-13 или без него при 4ºС в течение 2 часов. Клеточносвязанный 125I-IL-13 отделяли от несвязанного 125I-IL-13 центрифугированием через градиент фталат-масло и радиоактивность определяли гамма-счетчиком (Wallac, Gaithersburg, MD). Для анализа вытеснения антител трансфицированные клетки COS инкубировали с 125I-IL-13 (1,0 нМ) с увеличивающимися концентрациями (до 50 мкг/мл) или без увеличивающихся концентраций анти-IL-13-антител, как описано выше. Обе формы анализа связывания рецептора продемонстрировали следующее: во-первых, 13C5 и 9C11 блокировали связывание IL-13 с IL-13α1; во-вторых, 13C5 сильно блокировало связывание IL-13 с IL-13Rα2 (IC50~1-3 нМ как в RBA клеточной поверхности, так и в RB ELISA), в то время как 9C11 блокировало связывание IL-13 IL-13Rα2 с более низкой эффективностью (IC50>10 нМ); и, в-третьих, антитела 5G1 и 3E5 не были способны блокировать связывание IL-13 ни с IL-13Rα1, ни с IL-13Rα2. Три других анти-IL-13-антитела, BAK502G9 (CAT PCT WO 2005/007699), mAb13.2 (Wyeth PCT WO 2005/123126A2) и MJ2-7 (Wyeth PCT WO 2006/0073148A1) также анализировали на их способность блокирования связывания IL-13 человека с IL-13Rα2 человека как в ELISA для связывания рецептора, так и RBA поверхности клетки. Антитело mAb13.2 не блокировало связывание IL-13 ни с IL-13Rα1, ни с IL-13Rα2. BAK502G9 и MJ2-7 были способны блокировать связывание IL-13 с IL-13Rα1; однако они обнаруживали более низкую активность блокирования связывания IL-13 с IL-13Rα2 с концентрациями антитела до 50 мкг/мл (330 нМ).
Взаимодействие между IL-13 и IL-13Rα1/α2 в присутствии анти-IL-13-mAb анализировали также при помощи BIACORE. Этот анализ выполняли в нескольких форматах. Во-первых, IL-13Rα1/Fc связывали с биочипом Biacore и IL-13 пропускали через этот биочип, в присутствии и в отсутствие анти-IL-13-mAb. mAb 13C5 и 9C11, среди прочих, были способны блокировать связывание IL-13 с IL-13Rα1, тогда как 5G1 и 3E5 не были способны ингибировать связывание IL-13 с IL-13Rα1, что согласовалось с анализами связывания рецептора. Во-вторых, IL-4R связывали с этим биочипом BIACORE и комплекс IL-13, предварительно связанного с IL-13Rα1, пропускали через этот биочип. В отсутствие анти-IL-13-mAb, демонстрировали образование комплекса из трех молекул. Однако, добавление анти-IL-13-антитела 5G1 к смеси IL-13, предварительно связанного с IL-13Rα1, предотвращало связывание с IL-4R на биочипе. Это показало, что, даже хотя 5G1 не могло блокировать связывание IL-13 IL-13Rα1, оно могло блокировать связывание IL-13 с IL-4R, обеспечивая механистическую основу для его IL-13-нейтрализующей активности. Эти наблюдения были дополнительно подтверждены вытеснительной хроматографией на основе размера молекул (SEC), где гетеротримерные комплексы (mAb-IL-13-IL-13Rα1/Fc) наблюдали для mAb 5G1, но не для 13C5. Последующие исследования по картированию эпитопов с использованием протеиназного процессинга комплекса mAb-IL-13, исследованного при помощи масс-спектрометрического анализа, показали следующее: во-первых, 5G1 связывается с остатками IL-13, включающими N-концевой состоящий из 11 аминокислот пептид (GPVPPSTALRE), охватывающий часть области спирали А, который, как было показано, взаимодействует с IL-4R (Moy et al 2001 J Mol Biol. 310:219 и Horita et al., (2001) J Mol Biol. 310:231); во-вторых, антитело 9C11 взаимодействует с областью между спиралью С и спиралью D (VSAGQFSSLHVR); и, в-третьих, антитело 13C5 взаимодействует с остатками IL-13, включающими область, охватывающую спираль D (VRDTK IEVAQ FVKDL LLHLK KLFRE GR, соответствующие аминокислотам 104-130 SEQ ID NO:1). Было показано, что спираль D взаимодействует с рецепторами IL-13 (Moy et al 2001 J Mol Biol. 310:219; Horita et al 2001 J Mol Biol. 310:231 и Madhankumar et al 2002 JBC 277:43194). Поскольку 13C5 связывает вариант IL-13 человека (KD=50 пМ) гораздо более сильно, чем IL-13 собакоподобной обезьяны (KD=1800 пМ), и единственным различием последовательности между IL-13 человека и IL-13 собакоподобной обезьяны в этой потенциальной эпитопной области 13C5 является L в IL-13 человека, но V в IL-13 собакоподобной обезьяны в положении 120, авторы генерировали V120L-мутант IL-13 собакоподобной обезьяны и испытывали, будет ли эта мутация IL-13 собакоподобной обезьяны увеличивать аффинность связывания, а также нейтрализующую активность в отношении 13C5 в сравнении с IL-13 дикого типа собакоподобной обезьяны. На основе результатов Biacore и биоанализа, аффинность связывания, а также нейтрализующая активность 13C5 в отношении V120L-мутанта IL-13 собакоподобной обезьяны были эквивалентными аффинности связывания и нейтрализующей активности IL-13 дикого типа собакоподобной обезьяны, что указывает на то, что это различие V/L в положении 120 в С-концевой области не участвует в различии аффинности 13C5 в отношении варианта IL-13 человека против IL-13 собакоподобной обезьяны и что должны быть другие остатки вне этой С-концевой области, которые вносят вклад в дифференциальную аффинность связывания 13C5 в отношении IL-13 человека и собакоподобной обезьяны. Это согласуется с наблюдением, что 13C5 не узнает денатурированный IL-13 человека в Вестерн-блот-анализе, свидетельствуя о том, что эпитоп связывания 13C5 на IL-13 человека является в сильной степени конформационным.
Исследования по связыванию и картированию эпитопов показали, что 5G1 не ингибировало взаимодействие IL-13 с IL-13Rα1, но разрушало взаимодействие IL-13/IL-13Rα1 с IL-4Rα. Считается, что это разрушение препятствует образованию функционального комплекса передачи сигнала IL-13. Эти наблюдения обеспечивают теоретическую модель для нейтрализующей активности этого антитела в IL-13Rα1/IL-4R-опосредованной системе, такой как клетки A-549. В противоположность этому, 13C5 блокировало связывание IL-13 как с IL-13Rα1, так и IL-13Rα2. Интересно, что, даже хотя антитело 9C11 было способно блокировать связывание IL-13 с IL-13Rα1, оно обнаруживало только частичное (или низкую активность) ингибирование связывания IL-13 с IL-13Rα2. Хотя IL-13Rα1 и -Rα2 имеют сходную 3-мерную укладку и ориентацию связывания IL-13, они имеют низкую идентичность последовательности, и, следовательно, специфические остатки, ответственные за связывание IL-13, могут варьироваться (Arima 2005 JBC 280:24915 и Madhankumar et al 2002 JBC 277:43194). Таким образом, специфические остатки на IL-13, ответственные за связывание с IL-13Rα1 и IL-13Rα2, могут различаться, что могло бы объяснять дифференциальные свойства блокирования рецептора антитела 9C11.
Анализы связывания рецептора, картирования эпитопов, Biacore и биоанализ, описанные выше, вместе указывают на то, что нейтрализующее анти-IL-13-антитело может ингибировать IL-13-опосредованную активность посредством следующих механизмов:
1) Ингибирует связывание IL-13 как с IL-13Rα1, так и с IL-13Roc2 взаимодействием с IL-13 в области, участвующей в связывании рецептора как IL-13Rα1, так и IL-13Rα2. Примером такого антитела является 13C5. Такие антитела будут ингибировать передачу сигнала IL-13 как через комплекс IL-13Rα1/IL-4R, так и через IL-13Rα2.
2) Не ингибирует связывание IL-13 ни с IL-13Rα1, ни с IL-13Rα2. Однако это антитело ингибирует взаимодействие с IL-4-рецептором, следовательно, ингибирует передачу сигнала через комплекс IL-13Rα1/IL-4R. Такое антитело не может ингибировать передачу сигнала IL-13Rα2. Примерами таких антител являются 5G1 и mAb13.2 (Wyeth PCT WO 2005/123126).
3) Ингибирует связывание IL-13 с IL-13Rα1, но не ингибирует эффективно связывание IL-13 с IL-13Rα2. Это могло бы иметь место по следующим причинам: a) эпитоп: область, которая участвует в связывании с IL-13Rα1, но не в связывании с IL-13Ra2 или не участвует эффективно в связывании с IL-13Rα2. Одним примером является 9С11; b) аффинность: поскольку IL-13Rα2 имеет гораздо более высокую аффинность, чем IL-13Rα1, в отношении IL-13, антитело более низкой аффинности может быть способно блокировать связывание IL-13 с IL-13Rα1, но не с IL-13Rα2 при физиологических концентрациях терапевтического антитела. Одним примером является BAK502G9, которое обнаруживает аффинность 2,11 нМ в отношении рекомбинантного IL-13 дикого типа человека, как оценено при помощи Biacore (CAT PCT WO 2005/007699). Другим примером является MJ2-7, которое обнаруживает аффинность 1,4 нМ в отношении рекомбинантного IL-13 дикого типа человека и более высокую аффинность (43 пМ) в отношении IL-13 обезьяны, как оценено при помощи Biacore (Wyeth PCT WO 2006/0073148A1). Вследствие этого различия в аффинности, это mAb может эффективно ингибировать связывание IL-13 обезьяны с IL-13Rα2; однако оно ингибирует связывание IL-13 человека с тем же самым рецептором с гораздо меньшей эффективностью.
mAb BAK502G9 и MJ2-7 имеют сходные эпитопы (CAT PCT WO 2005/007699 и Wyeth PCT WO 2006/0073148A1) и они конкурируют за связывание с IL-13, как оценено конкурентным анализом ELISA. Вкратце, BAK502G9 иммобилизовали на планшете ELISA с последующим промыванием и блокированием. Затем в планшет добавляли IL-13 человека (10 нг/мл) в присутствии различных концентраций MJ2-7 (0,2 нг/мл - 20 мкг/мл) с последующим промыванием и детектированием с использованием HRP-конъюгированного анти-биотин-антитела. Это исследование показало, что MJ2-7 зависимым от дозы образом конкурировал с BAK502G9 за связывание с IL-13 человека. Отрицательный контроль IgG не обнаруживал конкуренции с BAK502G9.
Пример 1.2.D: Определение аминокислотной последовательности вариабельной области для каждого из мышиных mAb против IL-13 человека
Для определения каждой аминокислотной последовательности, приблизительно 10×l06 гибридомных клеток выделяли центрифугированием и обрабатывали для выделения тотальной РНК с использованием Тризола (Gibco BRL/Invitrogen, Carlsbad, CA) в соответствии с инструкциями изготовителя. Тотальную РНК подвергали синтезу ДНК первой цепи с использованием системы синтеза первой цепи SuperScript (Invitrogen, Carlsbad, CA) в соответствии с инструкциями изготовителя. Олиго(dT) использовали для праймирования синтеза первой цепи для отбора на поли(А)+ РНК. Затем кДНК-продукт первой цепи амплифицировали при помощи ПЦР с праймерами, сконструированными для амплификации вариабельных областей мышиного иммуноглобулина (Ig-Primer Sets, Novagen, Madison, WI). Продукты ПЦР разделяли на агарозном геле, вырезали, очищали и затем клонировали с набором для клонирования TOPO в вектор pCR2.1-TOPO (Invitrogen, Carlsbad, CA) и трансформировали в TOP10 химически компетентную E. coli (Invitrogen, Carlsbad, CA). ПЦР колоний выполняли на трансформантах для идентификации клонов, содержащих инсерт. Плазмидную ДНК выделяли из клонов, содержащих инсерт, с использованием набора QIAprep Miniprep (Qiagen, Valencia, CA). Инсерты в этих плазмидах секвенировали на обеих цепях для определения ДНК-последовательностей вариабельной тяжелой цепи или вариабельно легкой цепи с использованием прямого праймера М13 и обратного праймера М13 (Fermentas Life Sciences, Hanover MD). Последовательности вариабельной тяжелой цепи и вариабельной легкой цепи 17 моноклональных антител, описанных в примере 1.2.С, описаны в таблице 5.
Пример 2: Рекомбинантные антитела против IL-13 человека
Пример 2.1: Конструирование и экспрессия рекомбинантных химерных антител против IL-13 человека
ДНК, кодирующую константную область тяжелой цепи мышиных моноклональных антител против IL-13 человека 5G1, 13C5, 9C11, 21D9 и 3H7, заменяли кДНК-фрагментом, кодирующим константную область IgG1 человека, содержащую 2 аминокислотные мутации шарнирной области, посредством гомологичной рекомбинации в бактериях. Этими мутациями являются изменение лейцина на аланин в положении 234 (EU-нумерация) и изменение лейцина на аланин в положении 235 (Lund et al., 1991, J. Immunol., 147:2657). Константная область легкой цепи каждого из этих антител была заменена константной областью каппа человека. Полноразмерные химерные антитела транзиторно экспрессировали в клетках COS котрансфекцией химерных кДНК тяжелой цепи и легкой цепи, лигированных в экспрессионную плазмиду pBOS (Mizushima and Nagata, Nucleic Acids Research 1990, Vol 18, pg 5322). Супернатанты клеток, содержащие рекомбинантное химерное антитело, очищали белок А-сефарозной хроматографией и связанное антитело элюировали добавлением кислотного буфера. Антитела нейтрализовали и диализовали в PBS.
Затем химерные моноклональные антитела против IL-13 человека испытывали на их способность ингибировать IL-13-индуцированное продуцирование TARC клетками A-549, как описано в примерах 1.1.C2 и 1.1.C3. Таблица 12 показывает величины IC50 из биоанализов А-549 для трех химерных антител.
Нейтрализация rhIL-13 wt химерными антителами против IL-13 человека в биоанализе А-549
Пример 2.2: Конструирование и экспрессия гуманизированных антител против IL-13 человека
Пример 2.2.1: Отбор каркасов антител человека
Каждую последовательность гена вариабельной тяжелой и вариабельной легкой цепей мыши (описанных в таблице 3) отдельно сопоставляли против 44 последовательностей вариабельной тяжелой цепи зародышевой линии иммуноглобулина человека или 46 последовательностей вариабельной легкой цепи зародышевой линии (полученных из веб-сайта NCBI Ig Blast в http://www.ncbi.nlm.nih.gov/igblast/retrieveig.html.) с использованием программы Vector NTI.
Гуманизация была основана на гомологии аминокислотных последовательностей, анализе кластеров CDR, частоте использования среди экспрессируемых антител человека и доступной информации в отношении кристаллических структур антител человека. С учетом возможных действий на связывание антител, VH-VL-спаривание и других факторов, мышиные остатки мутировали в остатки иммуноглобулина человека, причем мышиные и человеческие каркасные остатки были различными, за некоторыми исключениями. Дополнительные стратегии гуманизации строились на основе анализа последовательностей антител зародышевой линии человека или их подгруппы, которая обладала высокой степенью гомологии, т.е. сходства последовательностей, относительно фактической аминокислотной последовательности вариабельных областей мышиного антитела.
Моделирование гомологии использовали для идентификации остатков, уникальных для последовательностей мышиного антитела, которые, как было предсказано, являются критическими для структуры антигенсвязывающего сайта антитела (CDR). Моделирование гомологии является компьютерным способом, при помощи которого для белка генерируют приблизительные трехмерные координаты. Источником начальных координат и руководства в отношении их дополнительного уточнения является второй белок, ссылочный белок, для которого эти трехмерные координаты известны и последовательность которого является родственной последовательности первого белка. Это родство среди последовательностей двух белков используется для генерирования соответствия между ссылочным белком и белком, для которого являются желаемыми координаты, белком-мишенью. Первичные последовательности ссылочного белка и белка-мишени сопоставляют с координатами идентичных частей этих двух белков, переносимых непосредственно от ссылочного белка к белку-мишени. Координаты для ошибочно спаренных частей этих двух белков, например, из мутаций, инсерций или делеций остатков, конструируют из общих структурных матриц и энергии, уточненных для гарантии совместимости с уже перенесенными координатами модели. Эта компьютеризованная структура белка может быть дополнительно уточнена или может использоваться непосредственно в исследованиях, использующих моделирование. Из настоящего описания должно быть ясно, что качество модельной структуры определяется точностью утверждения, что этот ссылочный белок и белок-мишень являются родственными, и точностью, с которой выполняется сопоставление. Для мышиных последовательностей 5G1, 13C5 и 9C11 использовали комбинацию поиска BLAST и визуального обследования для идентификации подходящих ссылочных структур. Идентичность последовательностей 25% между ссылочной аминокислотной последовательностью и аминокислотной последовательностью-мишенью считается минимально необходимой для попытки выполнения моделирования гомологии. Сопоставления последовательностей конструируют вручную, а координаты модели генерируют с использованием программы Jackal (смотрите Petrey, D., Xiang, Z., Tang, C.L., Xie, L., Gimpelev, M., Mitros, T., Soto, CS., Goldsmith-Fischman, S., Kernytsky, A., Schlessinger, A., et al. 2003. Using multiple structure alignments, fast model building, and energetic analysis in fold recognition and homology modeling. Proteins 53 (Suppl. 6): 430-435).
Первичные последовательности каркасных областей выбранных антител мыши и человека имеют значимую идентичность. Положения остатков, которые различаются, являются кандидатами для включения мышиного остатка в гуманизированную последовательность для сохранения наблюдаемой эффективности связывания мышиного антитела. Перечень остатков каркаса, которые различаются между последовательностями человека и мыши, конструируют вручную.
Вероятность того, что конкретный остаток каркаса мог бы влиять на связывающие свойства антитела, зависит от его близости к остаткам CDR. Таким образом, с использованием этих модельных структур, остатки, которые различаются между последовательностями мыши и человека, ранжировали в соответствии с их расстоянием от любого атома в CDR. Остатки, которые попадают с пределы 4,5 Å от любого атома CDR, идентифицировали как наиболее важные и рекомендовали их в качестве кандидатов для сохранения мышиного остатка в этом гуманизированном антителе (т.е. обратной мутации).
Для гуманизации вариабельных областей 5G1, общим подходом, обеспеченным в настоящем изобретении, был следующий подход. Сначала конструировали молекулярную модель вариабельных областей 5G1 с использованием компьютерных программ ABMOD и ENCAD (Levitt, M., J. Mol. Biol. 168: 595-620 (1983)). Затем на основе поиска гомологии против последовательностей человека V- и J-сегментов выбирали VH-сегмент 21/28 (Dersimonian, H., et al., J. Immunol. 139: 2496-2501 (1987)) и J-сегмент JH4 (Ravetch, J.V., et al., Cell 27: 583-591 (1981)) для обеспечения каркасов для вариабельной области тяжелой цепи Hu5G1. Для вариабельной области легкой цепи 5G1 использовали VL-сегмент HF-21/28 (Chastagner, P., et al., Gene 101: 305-306 (1991)) и J-сегмент JK4 (Hieter, P.A., et al., J. Biol. Chem. 257: 1516-1522 (1982)). Идентичность аминокислот каркаса между VH 5G1 и акцепторными сегментами 21/28 и JH4-сегментами человека была равна 72%, тогда как идентичность между VL 5G1 и акцепторными сегментами HF21/28 и JK4 человека была равна 83%. В положениях каркаса, в которых компьютерная модель предполагала существенный контакт с CDR, аминокислотами V-областей мыши заменяли исходные аминокислоты каркаса человека. Это было сделано в остатках 48, 67, 68, 70, 72, 74 и 97 тяжелой цепи. Для легкой цепи была произведена замена в остатке 50. Каркасные остатки, которые встречаются только редко в их соответствующих положениях в соответствующих подгруппах V-областей человека, заменяли консенсусными аминокислотами человека в этих положениях. Это было сделано в остатках 44 и 76 тяжелой цепи и в остатках 2, 15, 41, 42, 44 и 51 легкой цепи.
Для гуманизации вариабельных областей 13C5 общим подходом, обеспеченным в настоящем изобретении, был следующий подход. Сначала конструировали молекулярную модель вариабельных областей 13С5 с использованием компьютерных программ ABMOD и ENCAD (Levitt, M., J. Mol. Biol. 168: 595-620 (1983)). Затем на основе поиска гомологии против последовательностей человека V- и J-сегментов выбирали VH-сегмент М60 (Schroeder, Jr., H.W. and Wang, J. Y., Proc. Natl. Acad. Sci. USA 87: 6146-6150 (1990)) и J-сегмент JH4 (Ravetch, J.V., et al., Cell 27: 583-591 (1981)) для обеспечения каркасов для вариабельной области тяжелой цепи Hu13C5. Для вариабельной области легкой цепи Hu13C5, использовали VL-сегмент III-3R (Manheimer-Lory, A., et al., J. Exp. Med. 174: 1639-1652 (1991)) и J-сегмент JK4 (Hieter, P.A., et al., J. Biol. Chem. 257: 1516-1522 (1982)). Идентичность аминокислот каркаса между VH 13C5 и акцепторными сегментами М60 и JH4 человека была равна 74%, тогда как идентичность между VL 13C5 и акцепторными сегментами III-3R и JK4 человека была 75%.
В положениях каркаса, в которых компьютерная модель предполагала существенный контакт с CDR, аминокислотами V-областей мыши заменяли исходные аминокислоты каркаса человека. Это было произведено в остатках 22, 49 и 71 для легкой цепи. Каркасные остатки, которые встречаются только редко в их соответствующих положениях в соответствующих подгруппах V-областей человека, заменяли консенсусными аминокислотами человека в этих положениях. Это было сделано в остатках 10, 46, 83, 84, 86 и 87 тяжелой цепи и в остатках 62 и 73 легкой цепи.
Аминокислотные последовательности VL и VH гуманизированных mAb показаны в таблице 10.
Список аминокислотных последовательностей гуманизированных mAb





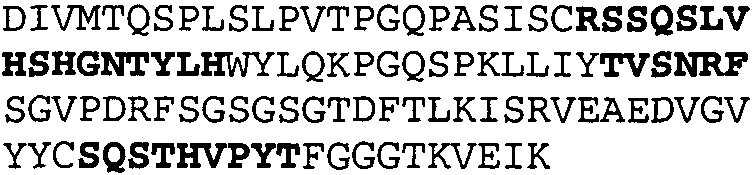

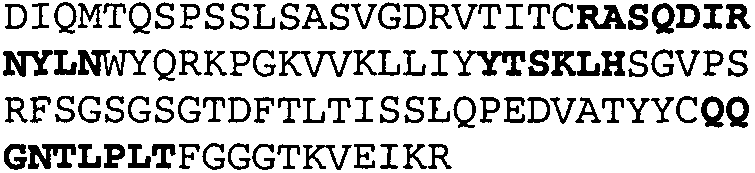

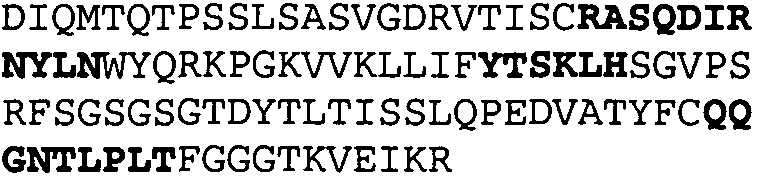



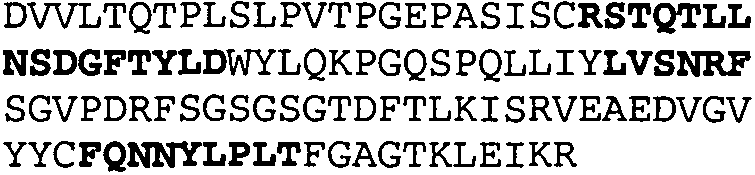
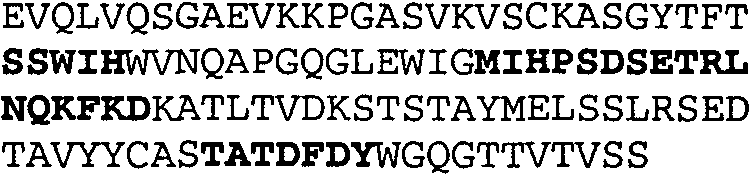
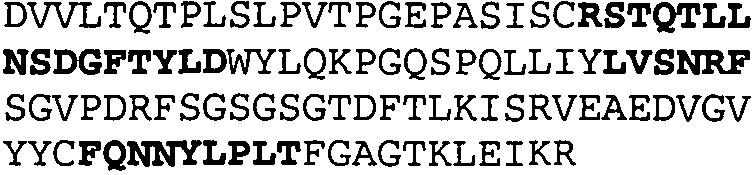





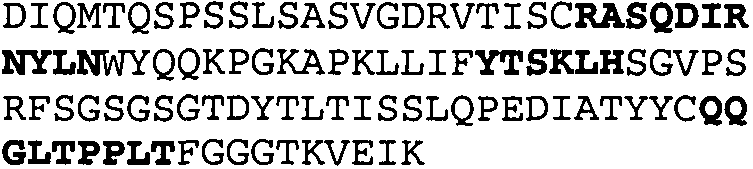


Пример 2.2.2: Конструирование гуманизированных антител
Сконструированные in silico вышеописанные гуманизированные антитела конструировали de novo с использованием олигонуклеотидов. Для каждой кДНК вариабельной области конструировали 6 олигонуклеотидов из 60-80 нуклеотидов, каждый, для перекрывания друг с другом 20 нуклеотидами на 5'- и 3'-конце каждого олигонуклеотида. В реакции отжига, все 6 олигонуклеотидов объединяли, кипятили и отжигали в присутствии dNTP. Затем добавляли ДНК-полимеразу I, большой фрагмент (фрагмент Кленова) (New England Biolabs #M0210, Beverley, MA) для достраивания приблизительно 40 п.н.-гэпов между перекрывающимися олигонуклеотидами. Затем выполняли ПЦР для амплификации полного гена вариабельной области с использованием двух самых крайних праймеров, содержащих выступающую последовательность, комплементарную сайту множественного клонирования в модифицированном векторе pBOS (Mizushima, S. and Nagata, S., (1990) Nucleic acids Research Vol 18, No. 17)). Продукты ПЦР, полученные из каждой сборки кДНК, разделяли на агарозном геле и полосу, соответствующую предсказанному размеру кДНК вариабельной области, вырезали и очищали. Вариабельную тяжелую область встраивали в рамке считывания на кДНК-фрагмент, кодирующий константную область IgG1 человека, содержащий 2 аминокислотные мутации шарнирной области, посредством гомологичной рекомбинации в бактериях. Эти мутации являются заменой лейцина на аланин в положении 234 (нумерация EU) и лейцина на аланин в положении 235 (Lund et al., 1991, J. Immunol., 147:2657). Область вариабельной легкой цепи инсертировали в рамке считывания с константной областью каппа человека гомологичной рекомбинацией. Бактериальные колонии выделяли и экстрагировали плазмидную ДНК; кДНК-инсерты секвенировали в их полном виде. Точные гуманизированные тяжелые и легкие цепи, соответствующие каждому антителу, котрансфицировали в клетки COS для транзиторного получения полноразмерных гуманизированных антител против IL-13 человека. Для 13С5, векторы pBOS, содержащие трансплантированные тяжелой цепью 13C5 кДНК и трансплантированные легкой цепью 13C5 кДНК, котрансфицировали в клетки COS. Супернатанты клеток, содержащие рекомбинантное химерное антитело, очищали белок А-сефарозной хроматографией и связанное антитело элюировали добавлением кислотного буфера. Антитела нейтрализовали и диализовали в PBS. Несколько гуманизированных антител описаны в таблице 10.
Способность очищенных гуманизированных антител ингибировать активность IL-13 определяли с использованием А-549-биоанализа, как описано в примерах 1.1.С. Аффинности связывания этих гуманизированных антител с рекомбинантным IL-13 человека определяли с использованием измерения резонанса поверхностных плазмонов (Biacore®), как описано в примере 1.1.В. Таблица 11 показывает величины IC50 из А-549-биоанализов, а аффинность первых шести гуманизированных антител описана в таблице 10 для IL-13 человека дикого типа и варианта.
Эффективность нейтрализации и аффинность гуманизированных анти-IL-13-mAb
CDR-последовательности гуманизированного антитела 13C5.5 дополнительно мутировали с использованием способов, известных в данной области, и генерировали три дополнительных гуманизированных антитела. Способность этих дополнительных гуманизированных антител ингибировать активность IL-13 человека, собакоподобной обезьяны и обезьяны резус определяли с использованием А-549-биоанализа, как описано в примерах 1.1.С. Аффинности связывания этих дополнительных гуманизированных антител с рекомбинантным IL-13 человека, собакоподобной обезьяны и обезьяны резус определяли с использованием измерения резонанса поверхностных плазмонов (Biacore®), как описано в примере 1.1.В. Кроме связывания и ингибирования IL-13 человека, эти три дополнительных антитела обнаруживали увеличенную аффинность в отношении IL-13 собакоподобной обезьяны и обезьяны резус. Таблица 12 показывает величины IC50 из А-549-биоанализов, а таблица 13 показывает аффинность дополнительных гуманизированных антител в отношении IL-13 человека, собакоподобной обезьяны и обезьяны резус.
Эффективность нейтрализации дополнительных гуманизированных анти-IL-13-mAb
Аффинность связывания дополнительных гуманизированных анти-IL-13-mAb
Пример 2.2.3: Характеристика гуманизированных анти-IL-13-антител
Авторы изобретения выделили моноклональные антитела, которые блокируют связывание IL-13 как с IL-13Rα1, так и с IL-13Rα2. Как анализ на основе ELISA, так и анализ связывания 125I-меченного IL-13 на клеточной поверхности показали, что 13C5, как мышиная версия, так и гуманизированная версия (т.е. 13C5.5), были способны эффективно блокировать связывание IL-13 с обоими рецепторами. Антитела в той же самой линии дифференцировки, что и 13C5, в том числе 25C8 и 33C3, также были способны блокировать связывание IL-13 с обоими рецепторами.
Пример 2.2.3.а: Гуманизированные анти-IL-13-антитела блокируют связывание IL-13 с IL-13-рецептором
Для определения способности гуманизированного антитела 13С5.5 блокировать связывание IL-13 с IL-13-рецепторами (IL-13Rα1 и IL-13Rα2), использовали анализ связывания рецептора на основе ELISA. 96-луночные планшеты ELISA высокого связывания покрывали 4 мкг/мл рекомбинантного IL-13Rα1/Fc или IL-13Rα2/Fc (R&D Systems) в 100 мкл на лунку буфера для покрытия (карбонатного-бикарбонатного буфера, Pierce) при 4ºC. Через 16 часов раствор для покрытия удаляли постукиванием планшетов для стряхивания содержимого планшетов в водосток и эти планшеты промывали и блокировали 4 раза с использованием блокирующего буфера Superblock (240 мкл на лунку) (Pierce). Добавляли гуманизированное анти-IL-13-mAb 13С5.5 и контрольные mAb (1:4 серийно разведенные из 40 мкг/мл, 50 мкг/мл на лунку) и биотин-IL-13 (50 мкл на лунку, конечные концентрации 5 нМ для hIL-13Rα1/Fc и 0,5 нМ для hIL-13Rα2/Fc) и инкубировали в течение 2 часов при комнатной температуре (RT). Планшеты промывали 5 раз 300 мкл 0,1% PBST и затем добавляли 100 мкл 1:5000 разведенных мышиных анти-биотин-mAb (Jackson Immunosciences) и инкубировали при комнатной температуре в течение 45 минут. Эти планшеты вновь промывали 5 раз 300 мкл 0,1% PBST с последующим добавлением реагента TMB-субстрата (100 мкл на лунку, Pharmingen); проявляли в течение 5 минут и останавливали добавлением 50 мкл 2 M H2SO4 (VWR). OD при 450 нм определяли спектрофотометрически. Эти результаты показаны в таблице 14.
Кроме того, блокирующие рецептор свойства этих mAb оценивали также анализом связывания рецептора на основе клеточной поверхности с использованием IL-13Rα2-трансфицированных клеток COS. Рекомбинантный IL-13 человека метили 125I (Amersham, Arlington Heights, IL) с использованием реагента IODO-GEN (Pierce, Rockford, IL), как описано ранее (Obiri NI et al., (1995) J Biol Chem. 270:8797-8804). Было определено, что удельная активность радиоактивно меченного IL-13 была равна 158 мкКи/мкг белка. Этот меченый IL-13 обнаруживал сходную биоактивность с биоактивностью немеченого IL-13, как оценено биоанализом А-549. Для экспериментов по связыванию, клетки COS транзиторно трансфицировали IL-13Rα2 человека с применением Липофектамина 2000 (Invitrogen) и инкубировали в течение 48 часов. Трансфицированные клетки COS (5×105 клеток в 100 мкл буфера для связывания: RPMI 1640, содержащая 0,2% сывороточный альбумин человека и 10 ммоль HEPES), инкубировали с 1,0 нМ 125I-IL-13 с 1 мкМ немеченым IL-13 или без него при 4ºС в течение 2 часов. Клеточносвязанный 125I-IL-13 отделяли от несвязанного 125I-IL-13 центрифугированием через градиент фталат-масло и радиоактивность определяли гамма-счетчиком (Wallac, Gaithersburg, MD). Для анализа вытеснения антител трансфицированные клетки COS инкубировали с 125I-IL-13 (1,0 нМ) с увеличивающимися концентрациями (до 50 мкг/мл) или без увеличивающихся концентраций гуманизированного анти-IL-13-антитела 13С5.5, как описано выше. Эти результаты показаны в таблице 14.
Эффективность mAb в блокировании связывания IL-13 человека (дикого типа) с IL-13Rα2 человека в анализах связывания рецептора на основе клеточной поверхности и на основе ELISA
Таблица 15 показывает аффинность связывания гуманизированного антитела 13C5.5 и других анти-IL-13-антител.
Аффинность связывания анти-IL-13-mAb, оцениваемая при помощи Biacore
В анализе связывания рецептора как на основе клеточной поверхности, так и на основе ELISA антитело 13C5.5 обнаруживает высокую эффективность в блокировании связывания IL-13 человека с IL-13Rα2 человека, с IC50 между 1 и 3 нМ. Хотя BAK502G9 и MJ2-7 также были способны уменьшать сигнал связывания, их эффективности были гораздо более низкими, чем эффективность 13C5.5 (смотрите таблицу 14), по меньшей мере частично вследствие их более низкой аффинности в отношении IL-13 человека дикого типа (смотрите таблицу 15). MAb13.2 не было способно ингибировать связывание IL-13 в обоих анализах при концентрации 100 нМ (или 15 мкг/мл). При той же самой концентрации, BAK502G9 и MJ2-7 обнаруживали только 40% и 70% ингибирование, соответственно, в анализе связывания рецептора на основе клеточной поверхности, и оба обнаруживали только 60% ингибирование в анализе связывания рецептора на основе ELISA.
Для терапевтических mAb с полупериодом жизни между 10 и 20 днями у человека, сывороточная концентрация равна в норме 5-15 мкг/мл со схемой введения доз один раз в неделю или один раз в две неделю IV или SC 3 mpk или менее. На основе этого расчета, 13С5.5 является в настоящее время единственным анти-IL-13-mAb, которое, по-видимому, полностью (на 100%) блокирует связывание IL-13 человека с IL-13Rα2 in vivo в качестве терапевтического mAb, при концентрации в сыворотке 100 нМ (или 15 мкг/мл) при общепринятой схеме введения доз моноклонального антитела.
Пример 2.2.3.b: Связывание анти-IL-13-антител со специфическим эпитопом на IL-13
Эпитопы на IL-13 человека, которые связывают анти-IL-13-mAb 13C5, 13C5.5, 9C11 и 5G1, картировали с использованием способов эксцизии эпитопа с последующим пептидным анализом при помощи масс-спектрометрии (MS). В эксцизии эпитопов, белок сначала связывали с иммобилизованным mAb и затем расщепляли протеолитическими ферментами. Области эпитопа на белке определяли с использованием MS и MS/MS для идентификации эпитопсодержащих пептидов. Гранулы CNBr-активированной сефарозы (Amersham Biosciences, 10 мг на реакцию) суспендировали в 500 мкл 0,1 М HCl и уравновешивали в течение 15 минут. Эти гранулы переносили в компактные реакционные колонки (USB Corporation) и промывали 0,1 M HCl и затем 0,1 M NaHCO3 буфером для связывания. К этой суспензии добавляли mAb (100 мкг) и инкубировали в течение 2 часов при медленном вращении при комнатной температуре. Гранулы с ковалентно присоединенным mAb промывали 0,1 M Трис-HCl-буфером ~pH 8,0. Блокирование непрореагировавших групп на гранулах CNBr-сефарозы выполняли инкубированием в течение 2 часов с 0,1 M Трис-HCl-буфером ~pH 8,0. Несвязавшиеся mAb удаляли последовательным промыванием двумя буферами с различным рН: 1) буфером 0,1 M Na-ацетат, 0,5 M NaCl ~pH 4,0; и 2) буфером 0,1 M Трис-HCl, 0,5 M NaCl ~pH 8,0. Эти гранулы уравновешивали в PBS ~0,14 M NaCl, 2,7 мМ KCl, 4,3 мМ Na2HPO4, 1,5 мМ КН2РО4, pH 7,2 и инкубировали в течение 2 часов при комнатной температуре с IL-13 или без IL-13. После промывания этих гранул PBS ~pH 7,2, брали аликвоту этой суспензии для анализа MALDI-TOF.
Аффинно связанный белок расщепляли различными протеазами (отношение фермент-субстрат 1:100-1:20) в течение 12 часов. Используемые протеазы включали: трипсин, GluC, химотрипсин, карбоксипептидазу Y и аминопептидазу M. После протеолиза, гранулы промывали 500 мкл буфера для расщепления. Последние 100 мкл промывного раствора сохраняли в качестве контроля. Приблизительно 100 мкл 2% ТФА добавляли к этим гранулам и гранулы собирали. Как контрольные, так и промывные растворы сначала концентрировали до приблизительно 20 мкл в вакууме. Затем пептиды обессоливали с использованием ziptips C18. Эти пробы анализировали MALDI-TOF MS с использованием либо системы Voyager DE, либо системы Voyager DE-Pro. Анализ при помощи nano-ESI-LC-MS/MS выполняли на системе Agilent 1100 Capillary HPLC, сопряженной с системой Sciex Q-Star Pulsar i MS.
В исследовании эпитопов 13С5, две протеазы, использованные в последовательных стадиях, давали наилучшие результаты. С химотрипсином детектировали основной пептид, состоящий из аминокислотных остатков 100-130 SEQ ID NO:1, что свидетельствовало о том, что он может содержать эпитоп (эпитопы). Детектировали также малые количества пептидов из аминокислотных остатков 103-130 и 104-130 SEQ ID NO:1. После расщепления химотрипсином использовали аминопептидазу М. Основным детектированным пептидом были аминокислотные остатки 104-130 SEQ ID NO:1, что предполагает, что 4 N-концевых аминокислотных остатка (80-83) не были частью этого эпитопа. Дополнительное расщепление карбоксипептидазой Y приводило к потере аффинности. После расщепления и промывания не наблюдали пептида. Все пептидные последовательности были подтверждены с использованием nano-ESI-LC-MS/MS.
Картирование эпитопов 13C5 и 13C5.5 показало, что их сайт (сайты) связывания включали область С-концевой спирали D IL-13 человека (остатки VRDTK EEVAQ FVKDL LL HLK KLFRE GR, соответствующие аминокислотам 104-130 SEQ ID NO:1). Было сделано предположение, что область С-концевой спирали D участвует во взаимодействиях с IL-13-рецептором (Zuegg et al 2001 Immunol Cell Biol. 79:332-9).
Пример 2.3: Кристаллизация анти-IL-13-антитела в комплексе с IL-13
Образовывали комплекс Fab-части 13C5.5 с IL-13 человека и кристаллы этого комплекса генерировали следующим образом.
Пример 2.3.1: Получение и очистка Fab-фрагмента 13C5.5
Для получения Fab-фрагмента 13C5.5, IgG 13C5.5 в 0,15 M PBS-буфере сначала концентрировали до 2 мг/мл с использованием центрифужного фильтрующего устройства (Millipore) Ultrafree-15 Biomax с отсечением молекулярной массы 10 кДа (MWCO). Взвесь геля папаина (Pierce) предварительно промывали и загружали в 2-3X буфере А (20 мМ Na2HPO4, 10 мМ ЭДТА, 20 мМ цистеин) при соотношении объемов 1:1. Затем это концентрированное антитело смешивали с 50% взвесью геля папаина и инкубировали при 37ºС в течение 24 часов при энергичном встряхивании. Смесь антитело/взвесь центрифугировали (Beckman 6KR) и супернатант наносили на предварительно уравновешенный PBS Супердекс 75. Элюировали основной пик и белок объединяли. Аффинную колонку 25 мл Protein A Sepharose 4 Fast Flow (Amersham Pharmacia) готовили промыванием 100 мл PBS. Объединенные фрагменты антитела наносили на эту аффинную колонку (скорость потока 2 мл/мин). Фракции, содержащие Fab-фрагменты 13C5.5, (подвергаемые мониторингу по оптической плотности УФ 280 нм), собирали в проходящем через колонку потоке. Фракции, содержащие Fab-фрагмент 13C5.5 в концентрации, большей, чем 0,3 мг/мл (определенные по УФ-оптической плотности при 280 нм), объединяли и замораживали при -80ºC. Чистоту проб оценивали электрофорезом в SDS-PAGE.
Пример 2.3.2: Приготовление комплекса IL-13/13C5.5 Fab
Рекомбинантный IL-13 человека экспрессировали в экспрессионной системе млекопитающего и затем очищали с использованием способов, хорошо известных в данной области. Рекомбинантный IL-13 человека и Fab-белок 13C5.5 смешивали при молярном соотношении 1:1 и инкубировали в течение 1 часа при 4ºС. Пробу комплекса наносили на предварительно уравновешенную (20 мМ Трис pH 7,5, 150 мМ NaCl) колонку Супердекса 200 при 0,5 мл/мин. Комплекс объединяли и концентрировали до 24 мг/мл с использованием центрифужного фильтрующего устройства (Millipore) Ultrafree-15 Biomax с отсечением молекулярной массы 10 кДа (MWCO) и замораживали при -80ºC. Чистоту пробы оценивали электрофорезом в SDS-PAGE.
Пример 2.3.3: Кристаллизация комплекса IL-13/13C5.5 Fab
Замороженный исходный раствор комплекса IL-13/13C5.5 (~24 мг/мл) оттаивали на льду. Этот комплекс (1,0 мкл) смешивали с 1,0 мкл раствора резервуара (1,75 М сульфат аммония, 100 мМ MES pH 6,5, 10 мМ CaCl2). Полученную каплю смешивали в лунке для сидящей капли (планшет для сидящих капель CrysChem) на этот резервуар при приблизительно 18°C. Похожие на алмаз кристаллы появлялись в пределах одной недели.
Пример 2.3.4: Криопротекция и быстрое охлаждение кристаллов комплекса IL-13/13C5.5 Fab
Кристаллы комплекса IL-13/13C5.5 Fab собирали при помощи волокнистой петли в маточном растворе +20% глицерин. Затем эти кристаллы быстро охлаждали проталкиванием их поршнем в жидкий азот.
Пример 2.3.5: Сбор данных рентгенографии комплекса IL-13/13C5.5 Fab
Данные рентгенографии из кристаллов IL-13/13C5.5 Fab собирали в IMCA beamline at the Advanced Photon Source in Argonne, EL. Эти кристаллы поддерживали при температуре 100 К с использованием холодильника Oxford Cryosystems Cryostream во время сбора данных. В целом, собирали 180 рамок при диапазоне осцилляций 1,0°. Эти данные обрабатывали с использованием комплекта программ HKL2000 (Otwinowski and Minor, 1997). После определения ориентации кристаллов эти данные интегрировали с использованием DENZO и масштабировали и объединяли с использованием SCALEPACK и помещали на абсолютную шкалу и уменьшали до величин структурного фактора с использованием TRUNCATE (French and Wilson, 1978). Пять процентов уникальных отражений относили, случайным образом, к «свободному» набору, для расчета свободного R-фактора (Rfree) (Brϋnger, 1992); оставшиеся 95% этих отражений составляли «рабочий» набор, для расчета R-фактора (R). Данные рентгенографии суммированы в таблице 16. Следующие перечни индексации для формы кристалла: (1) IL-13/13C5.5 Fab: пространственная группа P2(1)2(1)2(1), a=163,578 Å, b=163,318 Å, c=228,627 Å, α=90,0°, β=90,0°, γ=90,0°. Таблица 17 дает статистические данные рентгенографии для этого набора данных.
Суммирование информации о кристаллографических элементарных ячейках комплекса IL-13/13C5.5 Fab
Суммирование статистических данных рентгенографии
для комплекса IL-13/13C5.5 Fab
Пример 2.3.6: Решение молекулярной замены и уточнение кристаллической структуры комплекса IL-13/13C5.5 Fab
Решение молекулярной замены максимальной вероятности определяли с использованием программы PHASER (Read, 2001). В целом, шесть мономеров 13C5.5 были разрешены при разрешении 3,0 Å в пространственной группе P2(1)2(1)2(1). Моделью поиска была кристаллическая структура Fab, сообщенная ранее (Protein Data Bank entry IBJl; Muller et al. 1998). Координаты были получены на основе решения молекулярной замены.
Уточнение кристаллической структуры комплекса IL-13/13C5.5 Fab начиналось с координат молекулярной замены, описанных выше, в пространственной группе P2(1)2(1)2(1). Уточнение начиналось с использованием уточнения фиксированного объекта при помощи программы REFMAC, доступной в комплекте программ CCP (Murshudov et al., 1997, Collaborative Computational Project, 1994), которое приводило к следующей статистике при 2,6 Å: R 40,00% (Rfree 39,00%). Наблюдали de novo электронную плотность IL-13. Ручное построение шести мономеров IL-13 определялось публично доступной ЯМР-структурой 1IJZ IL-13 (Moy et al., 2001) с использованием программы О молекулярной графики (Jones et al., 1991) и испытания карт электронной плотности 2Fo-Fc и Fo-Fc. Программу уточнения REFMAC (Murshudov et al., 1997) использовали для итеративных раундов замедленного уточнения, с получением следующей статистики: R 25,8% (Rfree 30,5%). Результаты показаны в таблице 18.
Суммирование статистики кристаллографического уточнения комплекса IL-13/13C5.5 Fab
Пример 2.3.6: Структура комплекса IL-13/13C5.5 Fab
Наблюдали экстенсивные контакты между IL-13 человека и множественными CDR 13C5.5. Скрытая зона поверхности на поверхности раздела антитело-антиген составляет 1415,50 Å2. Эти контакты состоят из критической водородной связи и гидрофобных взаимодействий, которые стабилизируют поверхность раздела. Два минимальных сегмента последовательности, которые содержат большинство контактов поверхности раздела, являются спиралями А и D IL-13 (в отношении структуры IL-13 смотрите публикацию патента № 2003-0013851 A1, включенную в настоящем описании в качестве ссылки). Эти контакты вовлекают CDR L1 и L3, и Н2 и Н3. На основании предыдущего описания диапазон связывания эпитопа 13C5.5 включает топографическую область, определяемую Ser26-Asn38, Lys123-Arg130 SEQ ID NO:1. Более предпочтительно, диапазон связывания эпитопа 13C5.5 включает топографическую область, определяемую Arg30-Asn38, Lys123-Arg127 SEQ ID NO:1.
Пример 2.4: Эффективность in vivo гуманизированных IL-13-антител
Эффективность in vivo анти-hIL-13-антител оценивали следующим образом.
Пример 2.4.1: Эффективность in vivo гуманизированных IL-13-антител в модели индуцированной IL-13 человека астмы
Эффективность анти-hIL-13-антител 5G1, 13C5 и 13C5.5 испытывали в модели индуцированной IL-13 человека астмы в мышах. Мышей стимулировали рекомбинантным IL-13 человека в дозе 1 мкг в 50 мкл стерильного PBS, доставляемой в трахею микроразбрызгивателем с использованием ларингоскопа для грызунов для визуализации открытия трахеи. В целом 2 дозы IL-13 давали в дни 1 и 2 этого исследования и гиперреактивность дыхательных путей (AHR; Hoymann, H.G.; J Pharmacol Toxicol Methods. 2007 Jan-Feb; 55(1): 16-26), а также слизь, кислую хондроитиназу (AMCase, Donnelly LE, Barnes PJ., 1: Trends Pharmacol Sci. 2004 Oct;25(10):509-11) и регулируемый тимусом активацией хемокин (TARC; Bisset LR, Schmid-Grendelmeier P., Curr Opin Pulm Med. 2005 Jan;1 1(1):35-42) измеряли в жидкости бронхоальвеолярного лаважа через 24 часа после конечной стимуляции. Дозы антитела 100, 300 и 1000 мкг вводили внутрибрюшинной инъекцией за 1 день перед первой стимуляцией IL-13, и результаты суммированы в таблице 19. Антитело 5G1, которое не блокирует связывание IL-13 ни с IL-13Rα1, ни с IL-13Rα2, не было способно нейтрализовать биоактивность IL-13 в этой модели in vivo, имеющей сравнимые уровни AHR, AMCase и Muc5ac, детектированные в животных, обработанных 5G1, в сравнении с обработанными PBS контрольными животными. В противоположность этому, антитело 13C5, которое блокирует связывание как с α1-, так и с α2-рецепторами, было эффективным в уменьшении всех параметров. Обработка IL-13 увеличивала сопротивление дыхательных путей с 3,6 см H2O/мл/с до 5,7 см H2O/мл/с. Обработка 13C5 (1000 мкг) уменьшала сопротивление дыхательных путей до 4,3 см H2O/мл/с. Гиперсекреция слизи, измеряемая уровнями muc5ac, уменьшалась с 356,5 единиц до максимально 211 единиц обработкой антителом, что соответствует 40% уменьшению. Подобным образом, уровни кислой хондроитиназы млекопитающих (AMCase) уменьшались с 202 Е до 68 Е, что соответствует 66% уменьшению, со сравнимым уменьшением, наблюдаемым в уровнях TARC (n=10, p<0,05, при всех дозах). Рекомбинантное гуманизированное антитело 13C5.5 продемонстрировало сходные результаты в этой модели. IL-13 индуцировал увеличение сопротивления дыхательных путей после введения 30 мкг/мл метахолина с 3,9 до 5,5 см H2O/мл/с. Антитело 13C5.5 ингибировало сопротивление дыхательных путей до 4,1, 4,45 и 4,3 см H2O/мл/с при дозах 100, 300 и 1000 мкг, соответственно. Гиперсекреция слизи, измеряемая уровнями muc5ac, уменьшалась с 247 Е, индуцированных обработкой IL-13, до 154, 30,2 и 11,1 Е при дозах обработки 100, 300 и 1000 мкг антитела, соответственно. Это представляет собой 38, 88 и 96% ингибирование продуцирования слизи этим антителом. Индуцированная обработкой IL-13 активность AMCase 130 Е, которая уменьшалась до 113, 98 и 55 Е обработкой антителом (дозами 100, 300 и 1000 мкг), представляет собой 14, 24 и 68% ингибирование. Эти данные демонстрируют, что 13C5 и рекомбинантное гуманизированное антитело 13C5.5, которые блокируют связывание IL-13 как с IL-13Rα1, так и с -α2, могут нейтрализовать IL-13-индуцированные реакции AHR, продуцирование слизи и AMCase в легких, в то время как антитела, которые не блокируют связывание IL-13 с α1- и α2-рецепторами, являются неэффективными в блокировании всех этих биологических реакций.
Эффективность антител против IL-13 человека в индуцированной IL-13 модели астмы
**p<0,05, ANOVA, Бонферрони
***p<0,01, ANOVA, Бонферрони
В другом исследовании эффективность анти-hIL-13-антител BAK502G9, MJ2-7 и 13C5.5 сравнивали в модели астмы человека, индуцированной IL-13 в мышах. Мышей стимулировали рекомбинантным IL-13 человека в дозе 1 мкг в 50 мкл стерильного PBS, доставляемого интраназально при легком воздействии седативным средством. В целом 2 дозы IL-13 давали в дни 1 и 2 этого исследования и гиперреактивность дыхательных путей, а также слизь и AMCase, измеряли в жидкости бронхоальвеолярного лаважа через 24 часа после конечной стимуляции. Дозы антитела 1000 мкг вводили внутрибрюшинной инъекцией за 1 день перед первой стимуляцией IL-13. Результаты суммированы в таблице 20. Антитело 13C5.5, которое блокирует связывание IL-13 как с IL-13α1, так и с -α2-рецепторами, было эффективным в значимом уменьшении всех параметров. Обработка IL-13 увеличивала сопротивление дыхательных путей после стимуляции 30 мг/мл метахолина с 4,2 см H2O/мл/с до 7,2 см H2O/мл/с. Обработка 13C5.5 (1000 мкг) уменьшала сопротивление дыхательных путей на 86,8% с 4,6 см H2O/мл/с. Гиперсекреция слизи, измеряемая уровнями muc5ac, уменьшалась с 768,2 единиц до 412,9 Е, что соответствует 58,8% уменьшению. Подобным образом, уровни кислой хондроитиназы млекопитающих (AMCase) уменьшались с 316,5 Е до 147 Е, что соответствует 52% уменьшению. (n=10, p<0,001). Как BAK502G9-, так и MJ2-7-антитела, которые ингибируют связывание IL-13 с IL-13Rα1, но не ингибируют эффективно связывание IL-13 с IL-13Rα2, продемонстрировали сравнимую способность нейтрализовать IL-13-индуцированное AHR в этой модели. Антитела BAK502G9 и MJ2-7 ингибировали сопротивление дыхательных путей только с 7,2 до 5,96 см H2O/мл/с и 5,93 см H2O/мл/с, соответственно, что представляет собой 42% и 41,5% уменьшение AHR. Гиперсекреция слизи, измеряемая уровнями muc5ac, уменьшалась с 768,2 единиц, индуцированных обработкой IL-13, до 627,8 и 380 Е при дозах 1000 мкг антитела, что соответствует 23% и 64% ингибирования антителами BAK502G9 или MJ2-7, соответственно. Антитело BAK502G9 было менее эффективным в ингибировании AMCase в сравнении с антителами 13C5.5 или MJ2-7. Индуцированная обработкой IL-13 активность AMCase 316,5 Е, которая уменьшалась до 279 и 169 Е обработкой антителом BAK502G9 или MJ2-7 (дозой 1000 мкг), представляет собой 8% и 45% ингибирование, соответственно. Эти данные демонстрируют, что рекомбинантное гуманизированное антитело 13C5.5, которое блокирует связывание IL-13 как с IL-13Rα1, так и с -α2, является наиболее эффективным в нейтрализации индуцированных IL-13 реакций AHR, продуцирования слизи и AMCase в легком, тогда как антитела, которые блокируют связывание IL-13 с рецептором IL-13Rα2 с меньшей активностью, не являются такими эффективными в блокировании этих биологических реакций, что способствует патогенезу астмы.
Сравнение антител 13C5.5, BAK502G9 и MJ2-7 индуцированной IL-13 модели астмы
Пример 2.4.2: In vivo эффективность IL-13-антител OVA-индуцированной модели астмы
Для определения, влияют ли свойства блокирования рецепторов (в частности, рецептора IL-13Rα2) на эффективность in vivo mAb в моделях астмы мыши, генерировали панель крысиных антител против мышиного IL-13, которые обнаруживали различные свойства блокирования рецепторов, как определено ELISA связывания рецепторов с использованием белков mIL-13Rα1/Fc и mIL-13Rα2/Fc (R&D Systems) (смотрите таблицу 21). Поскольку анти-hIL-13-mAb 3H7 перекрестно реагирует с мышиным IL-13, его анти-mIL-13-свойства также включены в таблицу 21. Аффинности связывания этих антител в отношении мышиного IL-13 измеряли с использованием анализа BIACORE против рекомбинантного мышиного IL-13 (R&D Systems), а эффективности (IC50) антител против мышиного IL-13 определяли биоанализом A-549 против рекомбинантного мышиного IL-13. Последовательности вариабельных доменов 51D9 и 48D3 показаны в таблице 22.
Характеристика моноклональных анти-mIL-13-антител
Перечень аминокислотных последовательностей областей VH и VL анти-mIL-13-mAb крысы

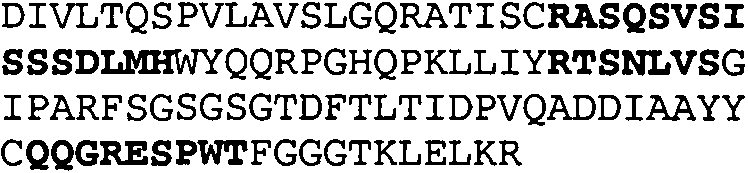
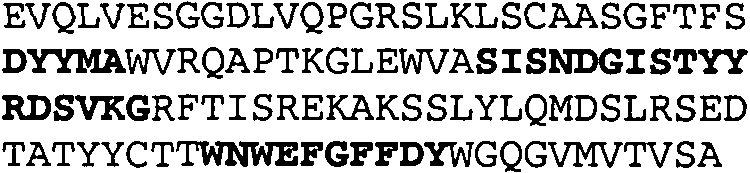
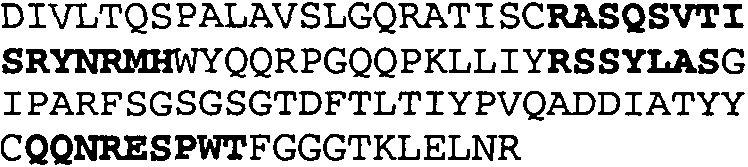
Для исследования эффективности in vivo в мышиной модели астмы, животных (самок мышей Balb/c) покупали из Taconic, содержали в Abbott Bioresearch Center и использовали в 8-12-недельном возрасте. Все протоколы были одобрены IACUC. Мышей сенсибилизировали к OVA (Sigma, эндотоксин выделяли из овальбумина с использованием DetoxiGel (Pierce) в соответствии с протоколом изготовителя, и конечный материал, содержащий менее 0,1 EU/мг белка) вводили в день 0 и 7 внутрибрюшинной инъекций 8 мкг OVA в 2 мг квасцов (Pierce). В дни 14 и 16 животные получали интраназальную стимуляцию 0,3 мг OVA в 50 мл стерильного PBS. Антитела 51D9 и 48D3 (очищенные из супернатанта гибридомных клонов 51D9 и 48D3 в соответствии со стандартными процедурами, которые содержали менее 0,1 EU/мг белка и были отрицательными в отношении патогенов грызунов согласно ПЦР-тестированию), вводили в день 13 в виде единственной внутрибрюшинной инъекции в стерильном PBS. Дексаметазон (Sigma) вводили перорально один раз в день в дни 13-17 в дозе 3 мг/кг. Все конечные точки анализировали в день 17, через 24 часа после 2-ой стимуляции OVA. Гиперчувствительность дыхательных путей (AHR) оценивали с использованием плетизмографии всего тела. Вкратце, хирургический уровень анестезии индуцировали внутрибрюшинной инъекцией кетамина и ксилазина. Трахеальную канюлю хирургическим путем вставляли между 3-им и 4-ым трахеальными кольцами. Самопроизвольное дыхание предотвращали внутривенозной инъекцией бромида панкурония и животных помещали в плетизмограф для целостного организма (Buxco) и механически вентилировали 0,2 мл комнатного воздуха при 150 вдохов в минуту респиратором с контролируемым объемом (Harvard Apparatus). Давление в легком и поток воздуха внутри плетизмографа измеряли с использованием преобразователей (сенсоров) и сопротивление легкого рассчитывали в виде давление/поток с использованием программного обеспечения Biosystem Xa. Измеряли фоновое сопротивление, а также сопротивление после стимуляции метахолином (3, 10 и 30 мг/мл), который доставляли с использованием подключенного ультразвукового распылителя. После завершения тестирования легочной функции легкие промывали 4 раза 0,5 мл стерильного PBS. Жидкость лаважа анализировали на TARC, AMCase и клеточный инфильтрат. Собирали сыворотку для количественного определения уровней антител в конце этого исследования.
Мышиные уровни TARC определяли при помощи ELISA (R&D) в соответствии с протоколом изготовителя. Активность кислой хондроитиназы млекопитающих (AMCase) определяли в жидкости бронхоальвеолярного лаважа (BAL) (разведения 1:10 с использованием 0,01% BSA, 30 мМ цитрата натрия, 60 мМ фосфата натрия, pH 5,2 в присутствии 80 мкМ 4-метилумбеллиферил-β-D-N,N'-диацетилцитобиозида). Реакции инкубировали в течение 15 минут при комнатной температуре и останавливали добавлением 100 мкл 1 М глицин/NaOH рН 10,6. Образование продукта определяли по испусканию флуоресценции при 460 нм с использованием возбуждения при 385 нм на флуорометре Fluoroskan Ascent. Для оценки гиперплазии бокаловидных клеток, легкие раздували 10% нейтрально забуференным формалином при высоте 22 см в течение 15 минут для достижения подходящей площади поверхности легкого. Срезы заливали в парафин, нарезали и окрашивали периодной кислотой Шиффа (PAS). Площадь PAS-положительных клеток вместе с главным бронхом оставшегося легкого определяли количественно с использованием программного обеспечения ImagePro Plus. Уровни Muc5ac определяли при помощи ELISA. 96-луночный планшет покрывают жидкостью BAL, сушат в течение ночи и затем добавляют биотинилированное анти-Muc5ac-антитело и детектируют HRP-конъюгированным стрептавидином с последующим отщеплением колориметрического субстрата TMB.
Относительный вклад IL-13Rα1 и -α2 в патогенез астмы испытывали в стандартной модели индуцированной овальбумином астмы у мышей. Антитела, которые блокируют связывание IL-13 как с рецептором α1, так и с рецептором α2 (51D9, 54D1 и 3H7 с эффективностями 340, 24 и 2430 пМ, соответственно), а также антитело, которое блокирует связывание IL-13 только с рецептором α1 (48D3, эффективность 50 пМ), испытывали обработкой животных этими антителами за один день перед локальными стимуляциями овальбумином, и эти результаты представлены в таблице 23. OVA-стимуляция индуцировала увеличения сопротивления легкого после стимуляции метахолином, гиперсекреции слизи, как измерено по увеличению уровней Muc5ac в жидкости BAL, а также увеличивала PAS-положительное окрашивание эпителиальных клеток согласно гистологической оценке, инфильтрацию легкого эозинофилами и Т-клетками и продуцирование связанных с астмой белков AMCase и TARC.
Антитела, которые блокировали связывание IL-13 как с IL-13Rα1, так и с -α2, все, демонстрировали эффективность и активность in vivo этих реагентов, смещенные в соответствии с их измеренной активностью in vitro. 51D9 испытывали в дозах 100, 300 и 1000 мкг на мышь. OVA-обработка вызывала увеличение сопротивления в дыхательных путях после стимуляции 30 мг/мл метахолина до 6,2 см H2O/мл/с в сравнении с 3,6 см H2O/мл/с в неастматических животных. Обработка мышей 51D9 полностью предотвращала увеличение сопротивления легких с величинами, сравнимыми с величинами, наблюдаемыми в неастматических контрольных животных, 4,1, 4,0 и 3,5 см H2O/мл/с для доз 100, 300 и 1000 мкг, соответственно (n=8-10/группа; p<0,05). Величина ингибирования, наблюдаемая для 51D9, была сравнима с величиной, достигаемой обработкой стероидами (3,3 см H2O/мл/с). Обработка 51D9 также ингибировала зависимым от дозы образом гиперсекрецию слизи с 404 единиц Muc5ac до 55 Е в животных, обработанных 1000 мкг 51D9. Ингибирование гиперсекреции слизи наблюдали также по гистологической оценке PAS-реактивных эпителиальных клеток. Диапазон процента положительных клеток уменьшался с 1,0% до 0,6% и 0,5% с дозой 300 и 1000 мкг антитела, что, соответственно, обозначает уменьшение 47-65% (n=8, p<0,01). Обработка 51D9 ингибировала также TARC и AMCase. OVA-стимуляция индуцировала 61 пг/мл TARC, который уменьшался до 7,8 пг/мл обработкой 1000 мкг 51D9 (n=10, p<0,05). OVA-стимуляция индуцировала 96 относительных единиц активности AMCase, которая уменьшалась зависимым от дозы образом антителом 51D9 до 52, 45 и 21 Е при 100, 300 и 1000 мкг антитела, соответственно (n=9-10, p<0,01). 54D1, которое имело в 10 раз более высокую активность in vitro (24 пМ), демонстрировало ингибирование AHR при дозе 30 мкг с уменьшением сопротивления дыхательных путей с 6,58 см H2O/мл/с до 4,4 см H2O/мл/с и максимальным ингибированием, наблюдаемым с обработкой 300 мкг антитела для уменьшения сопротивления дыхательных путей, до величины 3,65 см H2O/мл/с. Сходную активность наблюдали при ингибировании продуцирования слизи, AMCase и TARC. Третье антитело 3H7, которое имеет активность 25 нМ, все еще демонстрировало ингибирование уровней AHR, слизи и AMCase, но только при дозе 1000 мкг, что соответствует 10-кратному смещению активности, описанной в биоанализах in vitro.
Эффективность антител, которые блокируют связывание IL-13 только с IL-13Rα1, испытывали с антителом 48D3. Животных обрабатывали 30, 100, 300 и 1000 мкг/мышь. OVA-стимуляция индуцировала повышение сопротивления дыхательных путей до 5,69 см Н2О/мл/с в сравнении с 4,1 см Н2О/мл/с в неастматических обработанных PBS мышах. Обработка 30 мкг 48D3 не влияла на OVA-индуцированное сопротивление легких, хотя обработка 100, 300 и 1000 мкг 48D3 ингибировала OVA-индуцированные изменения сопротивления легких максимально до 4,4 см H2O/мл/с или до ~80% контрольных уровней OVA (n=10, p<0,05). В отличие от действий, наблюдаемых с 51D9, 48D3 не ингибировало OVA-индуцированную секрецию слизи, как измерено либо при помощи Muc5ac-ELISA, либо при помощи PAS-реактивных эпителиальных клеток. Небольшое, но статистически значимое уменьшение слизи (30%) наблюдали с обработкой 48D3 в дозе 30 мкг, тогда как все другие дозы были эквивалентны OVA-стимулированным животным. Гистологическое количественное определение PAS-положительного окрашивания показало 0,6% в OVA-стимулированных животных против 0,8% в животных, стимулированных OVA и обработанных 1000 мкг 48D3. В этих исследованиях 48D3 ингибировало OVA-индуцированную экспрессию AMCase с 196 Е, детектированных в OVA-обработанных животных, до 63, 90, 87 и 96 Е при дозах 30, 100, 300 и 1000 мкг, соответственно. Анализ уровней антител показал, что сравнимые уровни 48D3 и 51D9 детектировались как в сыворотке, так и в жидкости BAL обработанных антителом мышей. Несмотря на 7-кратную более высокую активность антитела 48D3 в сравнении с антителом 51D9 и эквивалентное воздействие этих двух антител, антитело 48D3 не было способно ингибировать AHR или AMCase в той же самой степени, что и антитело, которое блокировало связывание IL-13 с IL-13Rα1 и -α2, и не было способно ослаблять продуцирование слизи. Вместе эти данные предполагают, что IL-13Rα2 играет центральную роль в опосредовании OVA-индуцированной гиперсекреции слизи и что IL-13Rα2 вносит вклад в регуляцию астматического фенотипа in vivo.
Эффективность антител против мышиного IL-13 в мышиной модели индуцированной овальбумином астмы
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2016 |
|
RU2650767C2 |
| ИНТЕРЛЕЙКИН-13-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2007 |
|
RU2472807C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ АСТМЫ С ИСПОЛЬЗОВАНИЕМ АНТИТЕЛ ПРОТИВ IL-13 | 2012 |
|
RU2640025C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ЧЕЛОВЕКА К IL-13 | 2004 |
|
RU2387667C2 |
| ИММУНОГЛОБУЛИНЫ | 2005 |
|
RU2404192C2 |
| МУЛЬТИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО СО СПЕЦИФИЧНОСТЬЮ СВЯЗЫВАНИЯ IL-13 И IL-17 ЧЕЛОВЕКА | 2020 |
|
RU2827946C1 |
| ТЕРАПЕВТИЧЕСКИЕ DLL4-СВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2570639C2 |
| АНТИ-IL-22R-АНТИТЕЛА | 2017 |
|
RU2758721C2 |
| АНТИТЕЛА К РЕЦЕПТОРУ АЛЬФА 1 IL-13 И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2413736C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ IL4R, И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2834713C1 |















































Изобретение относится к биохимии. Описаны антитела, которые являются химерными, CDR-трансплантированными и гуманизированными антителами, имеющими высокую аффинность в отношении hIL-13 и нейтрализующую активность в отношении hIL-13 in vitro и in vivo. Раскрыт способ получения и способ применения антител по изобретению. Антитела, или части антител, по изобретению применимы для детекции hIL-13 и для ингибирования активности hIL-13, например, у индивида-человека, страдающего нарушением, в котором активность hIL-13 негативно влияет на здоровье. 8 н. и 28 з.п. ф-лы, 23 табл., 2 пр.
1. Антитело, содержащее антигенсвязывающий домен, где указанное антитело связывает IL-13 и где указанный антигенсвязывающий домен содержит шесть CDR: CDR-H1, CDR-H2, CDR-H3, CDR-L1, CDR-L2 и CDR-L3, где:
CDR-H1 представляет собой: D-Y-A-M-H (остатки 31-35 последовательности SEQ ID NO: 86),
CDR-H2 представляет собой: W-I-N-T-Y-T-G-K-P-T-Y-A-D-D-F-K-G (остатки 50-66 последовательности SEQ ID NO: 86),
CDR-H3 представляет собой: A-G-R-T-E-G-T-H-Y-Y-A-M-D-A (остатки 99-112 последовательности SEQ ID NO: 86),
CDR-L1 представляет собой: R-A-S-Q-S-V-S-I-S-S-S-D-L-M-H (остатки 23-37 последовательности SEQ ID NO: 87),
CDR-L2 представляет собой: R-T-S-N-L-V-S (остатки 53-59 последовательности SEQ ID NO: 87) и
CDR-L3 представляет собой: Q-Q-G-R-E-S-P-W-T (остатки 92-100 последовательности SEQ ID NO: 87).
2. Антитело по п. 1, дополнительно содержащее акцепторный каркас человека.
3. Антитело по п. 2, где указанный акцепторный каркас человека состоит из аминокислотной последовательности, которая представляет собой:
SEQ ID NO: 6
SEQ ID NO: 7
SEQ ID NO: 8
SEQ ID NO: 9
SEQ ID NO: 10
SEQ ID NO: 11
SEQ ID NO: 12
SEQ ID NO: 13
SEQ ID NO: 14
SEQ ID NO: 15
SEQ ID NO: 16
SEQ ID NO: 17
SEQ ID NO: 18
SEQ ID NO: 19
SEQ ID NO: 20
SEQ ID NO: 21
SEQ ID NO: 22
SEQ ID NO: 23
SEQ ID NO: 24
SEQ ID NO: 25
SEQ ID NO: 26
SEQ ID NO: 27
SEQ ID NO: 28
SEQ ID NO: 29
SEQ ID NO: 30
или SEQ ID NO: 31.
4. Антитело по п. 1, где указанное антитело содержит по меньшей мере один вариабельный домен, содержащий аминокислотную последовательность, которая представляет собой последовательность SEQ ID NO: 86 или SEQ ID NO: 87.
5. Антитело по п. 4, где указанное антитело содержит последовательность вариабельного домена тяжелой цепи (VH), содержащую SEQ ID NO: 86, и последовательность вариабельного домена легкой цепи (VL), содержащую SEQ ID NO: 87.
6. Антитело по п. 4, где указанное антитело содержит две последовательности вариабельного домена тяжелой цепи (VH), где каждая последовательность VH содержит последовательность SEQ ID NO: 86, и две последовательности вариабельного домена легкой цепи (VL), где каждая последовательность VL содержит SEQ ID NO: 87.
7. Антитело по любому из пп. 1-6, где антитело способно модулировать биологическую функцию IL-13.
8. Антитело по любому из пп. 1-6, где антитело способно нейтрализовать биологическую функцию IL-13.
9. Антитело по любому из пп. 1-6, где указанное антитело имеет константу скорости ассоциации (Kon) в отношении указанной мишени, равную по меньшей мере 102 М-1с-1, как измерено при помощи резонанса поверхностных плазмонов,
или
имеет константу скорости диссоциации (Koff) в отношении указанной мишени, равную не больше 10-3 с-1, как измерено при помощи резонанса поверхностных плазмонов,
или
имеет константу диссоциации (KD) в отношении указанной мишени, равную не больше 10-7 М.
10. Антитело по любому из пп. 1-9, где указанное антитело ингибирует связывание IL-13 с рецептором IL-13α1 и с рецептором IL-13α2 в анализе связывания рецептора на основе клеточной поверхности или в анализе связывания рецептора на основе ELISA.
11. Выделенная нуклеиновая кислота, кодирующая антитело по любому из пп. 1-10.
12. Вектор, содержащий выделенную нуклеиновую кислоту по п. 11, для репликации указанной нуклеиновой кислоты.
13. Вектор, содержащий выделенную нуклеиновую кислоту по п. 11, для экспрессии указанной нуклеиновой кислоты.
14. Вектор по п. 13, где указанный вектор выбран из группы, состоящей из pcDNA, рТТ, рТТ3, pEFBOS, pBV, pJV и pBJ.
15. Выделенная клетка-хозяин, содержащая вектор по п. 12, для репликации указанного вектора, где указанная клетка-хозяин представляет собой прокариотическую клетку или эукариотическую клетку.
16. Выделенная клетка-хозяин, содержащая вектор по п. 13 или 14, для экспрессии антитела, кодируемого нуклеиновой кислотой указанного вектора, где указанная клетка-хозяин представляет собой прокариотическую клетку или эукариотическую клетку.
17. Клетка-хозяин по п. 15 или 16, где указанная клетка-хозяин представляет собой прокариотическую клетку.
18. Клетка-хозяин по п. 17, где указанная прокариотическая клетка представляет собой клетку Escherichia coli.
19. Клетка-хозяин по п. 15 или 16, где указанная клетка-хозяин представляет собой эукариотическую клетку.
20. Клетка-хозяин по п. 19, где указанная эукариотическая клетка выбрана из группы, состоящей из одноклеточных организмов (протистов), клеток животных, растений и грибов.
21. Клетка-хозяин по п. 20, где указанная клетка грибов представляет собой дрожжевую клетку.
22. Клетка-хозяин по п. 20, где указанная клетка животных выбрана из группы, состоящей из клетки млекопитающего, клетки птиц и клетки насекомого.
23. Клетка-хозяин по п. 22, где указанная клетка млекопитающего представляет собой клетку СНО или клетку COS.
24. Способ получения антитела, способного связываться с IL-13, включающий культивирование клетки-хозяина по п. 16 в культуральной среде в условиях, подходящих для продукции антитела.
25. Антитело, способное связываться с IL-13 по п. 1, продуцируемое способом по п. 24.
26. Антитело по любому из пп. 1-10 для применения для лечения млекопитающего, страдающего нарушением, при котором нарушена активность IL-13.
27. Антитело по п. 26, где указанное нарушение выбрано из группы, состоящей из респираторных нарушений; астмы; аллергической и неаллергической астмы; астмы, связанной с инфекцией; астмы, связанной с респираторным синцитиальным вирусом (RSV); хронической обструктивной болезнью легких (COPD); других состояний, включающих воспаление дыхательных путей; эозинофилии, фиброза и избыточного продуцирования слизи; муковисцидоза; пневмофиброза; атопического нарушения; атопического дерматита; крапивницы; экземы; аллергического ринита; аллергического энтерогастрита; воспалительных и/или аутоиммунных состояний кожи; воспалительных и/или аутоиммунных состояний желудочно-кишечных органов; воспалительных заболеваний пищеварительного тракта (IBD); язвенного колита; болезни Крона; воспалительных и/или аутоиммунных состояний печени; цирроза печени; фиброза печени; фиброза, вызванного вирусом гепатита В и/или С; склеродермии; опухолей или злокачественных опухолей; гепатоцеллюлярной карциномы; глиобластомы; лимфомы; лимфомы Ходжкина; вирусных инфекций; инфекции HTLV-1; супрессии проявления иммунных реакций защитного типа 1 и супрессии проявления иммунных реакций защитного типа 1 во время вакцинации.
28. Фармацевтическая композиция для лечения заболевания, связанного с IL-13, содержащая антитело по любому из пп. 1-10 и фармацевтически приемлемый носитель.
29. Фармацевтическая композиция по п. 28, где указанный фармацевтически приемлемый носитель действует как адъювант, эффективный для увеличения абсорбции или дисперсии указанного антитела.
30. Фармацевтическая композиция по п. 29, где указанный адъювант представляет собой гиалуронидазу.
31. Фармацевтическая композиция по п. 28, дополнительно содержащая по меньшей мере одно дополнительное средство.
32. Фармацевтическая композиция по п. 31, где указанное дополнительное средство выбрано из группы, состоящей из терапевтического средства, агента для визуализации, цитотоксического агента, ингибитора ангиогенеза, ингибитора киназы, блокатора костимулирующих молекул, блокатора адгезионных молекул, анти-цитокин-антитела или его функционального фрагмента; метотрексата; циклоспорина; рапамицина; FK506; детектируемой метки или репортера; антагониста TNF; противоревматического средства; миорелаксанта, наркотического агента, нестероидного противовоспалительного средства (NSAID), анальгезирующего средства, анестетика, седативного средства, местного анестетика, нейромышечного блокатора, противомикробного средства, антипсориатического средства, кортикостероида, анаболического стероида, эритропоэтина, иммунизирующего агента, иммуноглобулина, иммуносупрессирующего средства, гормона роста, гормонозаместительного лекарственного средства, радиофармацевтического средства, антидепрессанта, антипсихотического средства (нейролептика), стимулятора, лекарственного средства для астмы, бета-агониста, ингалируемого стероида, эпинефрина или аналога эпинефрина, цитокина и антагониста цитокина.
33. Фармацевтическая композиция по любому из пп. 28-32 для лечения у млекопитающего нарушения, при котором нарушена активность IL-13.
34. Фармацевтическая композиция по п. 33, где указанное нарушение, при котором нарушена активность IL-13, выбрано из группы, состоящей из респираторных нарушений; астмы; аллергической и неаллергической астмы; астмы, связанной с инфекцией; астмы, связанной с респираторным синцитиальным вирусом (RSV); хронической обструктивной болезнью легких (COPD); других состояний, включающих воспаление дыхательных путей; эозинофилии, фиброза и избыточного продуцирования слизи; муковисцидоза; пневмофиброза; атопического нарушения; атопического дерматита; крапивницы; экземы; аллергического ринита; аллергического энтерогастрита; воспалительных и/или аутоиммунных состояний кожи; воспалительных и/или аутоиммунных состояний желудочно-кишечных органов; воспалительных заболеваний пищеварительного тракта (IBD); язвенного колита; болезни Крона; воспалительных и/или аутоиммунных состояний печени; цирроза печени; фиброза печени; фиброза, вызванного вирусом гепатита В и/или С; склеродермии; опухолей или злокачественных опухолей; гепатоцеллюлярной карциномы; глиобластомы; лимфомы; лимфомы Ходжкина; вирусных инфекций; инфекции HTLV-1; супрессии проявления иммунных реакций защитного типа 1 и супрессии проявления иммунных реакций защитного типа 1 во время вакцинации.
35. Фармацевтическая композиция по п. 33 или 34, где указанную фармацевтическую композицию вводят до, вместе или после введения второго средства, где второе средство выбрано из группы, состоящей из ингалируемых стероидов; бета-агонистов; краткосрочно действующих или долгосрочно действующих бета-агонистов; антагонистов лейкотриенов или рецепторов лейкотриенов; ADVAIR; ингибиторов IgE; анти-IgE-антител; XOLAIR; ингибиторов фосфодиэстеразы; ксантинов; антихолинергических лекарственных средств; стабилизирующих мастоциты агентов; кромолина; ингибиторов IL-4; ингибиторов IL-5; ингибиторов эотаксина/CCR3; антагонистов гистамина или их рецепторов, включая H1, Н2, Н3 и Н4; антагонистов простагландина D или их рецепторов DP1 и CRTH2; антагонистов TNF; растворимого фрагмента TNF-рецептора; ENBREL; антагонистов ферментов TNF; ингибиторов TNF-превращающего фермента (ТАСЕ); антагонистов мускаринового рецептора; антагонистов TGF-β; интерферона гамма; перфенидона; химиотерапевтических агентов; метотрексата, лефлуномида; сиролимуса (рапамицина) или его аналога; CCI-779; ингибиторов COX2 и cPLA2; NSAID; иммуномодуляторов; ингибиторов р38; TPL-2; MK-2 и ингибиторов NF-kB; буденосида; эпидермального фактора роста; кортикостероидов; циклоспорина; сульфалазина; аминосалицилатов; 6-меркаптопурина; азатиоприна; метронидазола; ингибиторов липоксигеназы; мезаламина; олсалазина; балсалазида; антиоксидантов; ингибиторов тромбоксана; антагонистов IL-1-рецепторов; моноклональных антител против IL-1β; моноклональных антител против IL-6; факторов роста; ингибиторов эластазы; пиридинилимидазольных соединений; антител или агонистов TNF, LT, ингибитора PDE4, IL-1, IL-2, IL-3, IL-5, IL-6, IL-7, IL-8, IL-9, IL-12, IL-14,IL-15, IL-16, IL-17, IL-18, IL-19, IL-20, IL-21, IL-22, IL-23, IL-24, IL-25, IL-26, IL-27, IL-28, IL-29, IL-30, IL-31, IL-32, IL-33, EMAP-II, GM-CSF, FGF и PDGF; антител CD2, CD3, CD4, CD8, CD25, CD28, CD30, CD40, CD45, CD69, CD90 или их лигандов; FK506; рапамицина; микофенолята-мофетила; ибупрофена; преднизолона; ингибиторов фосфодиэстеразы; агонистов аденозина; антитромботических агентов; ингибиторов комплемента; адренергических агентов; ингибиторов IRAK, NIK, IKK, р38, МАР-киназы; ингибиторов IL-1β-превращающего фермента; ингибиторов TNFα-превращающего фермента; ингибиторов передачи сигнала Т-клеток; ингибиторов металлопротеиназы; 6-меркаптопуринов; ингибиторов ангиотензин-превращающего фермента; растворимых рецепторов цитокинов; растворимого рецептора TNF р55; растворимого рецептора TNF р75; sIL-1RI; sIL-1RII; sIL-6R; противовоспалительных цитокинов; IL-4; IL-10; IL-11; и TGFβ.
36. Фармацевтическая композиция по любому из пп. 33-35, где указанную фармацевтическую композицию вводят млекопитающему по меньшей мере одним способом, выбранным из парентерального, подкожного, внутримышечного, внутривенного, внутрисуставного, внутрибронхиального, внутрибрюшного, интракапсулярного, внутрихрящевого, внутриполостного, интрацелиального, внутримозжечкового, интрацеребровентрикулярного, внутрь толстой кишки, интрацервикального, внутрижелудочного, внутрипеченочного, интрамиокардиального, внутрикостного, внутрибрюшинного, интраперикардиального, интраперитонеального, интраплеврального, внутрипростатного, внутрилегочного, интраректального, интраренального, интраретинального, интраспинального, интрасиновиального, интраторакального, внутриматочного, внутрипузырного, болюсного, вагинального, ректального, буккального, сублингвального, интраназального и трансдермального способов.
| WO2005007699 A, 27.01.2005 | |||
| Ройт и др | |||
| Иммунология | |||
| - М.: Мир, 2000, с.110-116. |
Авторы
Даты
2016-12-20—Публикация
2012-10-04—Подача