ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к применению клеток Сертоли (фолликулярных клеток яичка; английское обозначение: Sertoli cell, соответствующее сокращение: SC), заключенных в микрокапсулы из материала, полученного на основе гидрогеля, для предотвращения и/или лечения сахарного диабета 1 типа (СД Т1), и к способу получения микрокапсул, предпочтительно имеющих форму микросфер. Продукт, являющийся объектом настоящего изобретения, может вызывать как регенерацию (неогенез) бета-клеток, пораженных диабетической патологией, так и "остановку" аутоиммунного процесса, обусловливающего поражение бета-клеток при развитии СД Т1.
Терапия с использованием заключенных в микрокапсулы SC позволяет предотвращать возникновение и производить лечение СД Т1, не прибегая к трансплантации экзогенных панкреатических островков (островков Лангерганса) (как человеческих, так и полученных из тканей животных). Следует отметить, что продукт, полученный при микроинкапсулировании SC, полностью сравним с "традиционным" лекарственным средством.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
В настоящее время во всем мире ежегодно регистрируют приблизительно 30000 новых случаев заболевания сахарным диабетом 1 типа (СД Т1). В основе патогенеза СД 1 типа, который главным образом, но не исключительно поражает молодых людей и подростков, лежит поражение (уничтожение) большей части вырабатывающих инсулин бета-клеток поджелудочной железы в соответствии с механизмом аутоиммунного воздействия. Коротко говоря, организм теряет иммунологическую толерантность по отношению к бета-клеткам поджелудочной железы, ответственным за выработку инсулина, и вызывает ответную иммунную реакцию, в основном, клеточно-опосредованную, связанную с выработкой аутоиммунных антител, которая приводит к самоуничтожению бета-клеток.
Применяемая в настоящее время терапия СД Т1, основанная на введении экзогенного инсулина, направлена на восстановление глюцидного гомеостаза до уровня, максимально приближенного к нормальному физиологическому состоянию. Тем не менее, инсулиновая терапия не в состоянии воспроизвести пульсирующий ритм секреции инсулина, характерный для нормальной ответной реакции бета-клетки поджелудочной железы на сигналы стимуляторов секреции.
Таким образом, конечной целью и радикальным средством в устранении патологии является восстановление физиологической и стабильной эндокринной функции поджелудочной железы. Для этого были предложены новые стратегии, например, трансплантация всей поджелудочной железы или трансплантация островков, выделенных из поджелудочных желез донора-человека.
Применяемая в настоящее время терапия с использованием экзогенного инсулина не отвечает требованиям, предъявляемым к радикальной терапии, подходящей для лечения СД Т1. Для решения этой проблемы давно были предложены подходы, включающие трансплантацию всей поджелудочной железы или трансплантацию островков, выделенных из поджелудочных желез доноров-людей или доноров-животных. Трансплантация островков представляет собой менее инвазивное вмешательство по сравнению с трансплантацией всей поджелудочной железы, но приводит к аналогичным проблемам, которые, в частности, заключаются в следующем:
1. Малая доступность поджелудочных желез человека, получаемых от мертвых доноров, и, как следствие, малая доступность островков.
2. После пересадки реципиент должен в течение всей жизни принимать иммуносупрессанты. Тем не менее такое терапевтическое воздействие, необходимое для предотвращения иммунного отторжения трансплантированной ткани, осложняется побочными явлениями, которые в настоящее время все еще мало изучены, но потенциально могут представлять серьезную опасность.
3. Отторжение трансплантатов гетерологических островков, поскольку ни одно из существующих ныне иммуносупрессивных лекарственных средств не способно эффективно предотвращать их отторжение.
4. Плохая выживаемость трансплантированной островковой ткани в течение длительного периода времени.
В последние годы была произведена переоценка функций клеток Сертоли (SC), и было показано, что они являются не просто структурными поддерживающими элементами семенных канальцев яичка, а настоящей биохимической лабораторией, имеющей великое множество трофических и иммунологических функций. В частности, было показано, что культуры SC вырабатывают молекулы, которые ингибируют пролиферацию В и Т лимфоцитов (библиографический источник (1), см. список в конце описания). Кроме того, усиление иммунорегуляторной функции SC заключается в том, что они могут вызывать апоптоз T, B клеток и NK-клеток (естественных клеток-киллеров), связывающихся посредством своего лиганда FAS с FAS, экспрессированным клетками-мишенями (2).
Другой механизм, в соответствии с которым осуществляется иммуномодулирующее действие SC - это выработка трансформирующего фактора роста-β (английское обозначение: Transforming Growth Factor-β, соответствующее сокращение: TGF-β) (3). Эта молекула влияет на фенотип дифференциации Т CD4+лимфоцитов, больше способствуя образованию типа Th2 (защитный иммунитет), чем типа Th1 (незащитный иммунитет). Таким образом, в целом, активность клеток Сертоли может оказывать непосредственное клиническое воздействие при заболевании СД Т1, поскольку бета-клетки разрушаются инфильтратом, главным образом состоящим из лимфоцитов Th1 (INF-гамма-положительных).
Кроме того, иммунорегуляторное действие SC связано с выработкой нескольких факторов роста, дифференциации и антиапоптоза, например, трансформирующего фактора роста (TGF-D), глиального нейротрофического фактора (английское обозначение: Glial-Derived Neurotrophic Factor, соответствующее сокращение: GDNF), интерлейкина-1 (IL-1), фактора стволовых клеток (cKit-лиганда), Fas/Fas Лиганда (Fas-L), активина A и, наконец, BCL-w (4).
В наиболее тематически близкой публикации предшествующего уровня техники (библиографический источник No.5) описано введение SC в ультрачистые микрокапсулы из альгината, в результате чего получают микрокапсулы, имеющие средний конечный диаметр 520±14 мкм. На момент выхода упомянутой статьи, удовлетворительными согласно общемировым стандартам считались микрокапсулы диаметром приблизительно 500 мкм с процентной долей "отростков (дефектов формы)", не превышающей 5%. Как диаметр капсулы, так и наличие отростка представляют собой очень важные параметры. Для более эффективного обмена метаболитами, диаметр капсулы должен быть минимально возможным, и, как было недавно обнаружено, наличие даже менее 5% микрокапсул с отростками может вызывать серьезное воспаление, создавая "loci minoris resistentiae", т.е. участки наименьшего сопротивления, в которых наиболее уязвимыми для внешнего (микробного) воздействия оказываются клеточные антигены.
Неожиданно авторами настоящего изобретения был обнаружен способ, позволяющий получать одинаковые микрокапсулы меньших размеров, не имеющие отростков, в которые могут быть заключены SC без снижения их жизнеспособности и функциональных характеристик.
Учитывая все вышесказанное, настоящим изобретением впервые предоставлена возможность предотвращения и/или лечения СД Т1 посредством трансплантации SC, заключенных в микросферические микрокапсулы, полученные из материала на основе гидрогеля, не содержащие экзогенной островковой ткани.
Таким образом, задачей настоящего изобретения является создание способа получения микрокапсул на основе гидрогеля, содержащих клетки Сертоли (SC), по пункту 1 формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Предлагаемое описание сопровождается девятью изображениями, на которых представлено следующее:
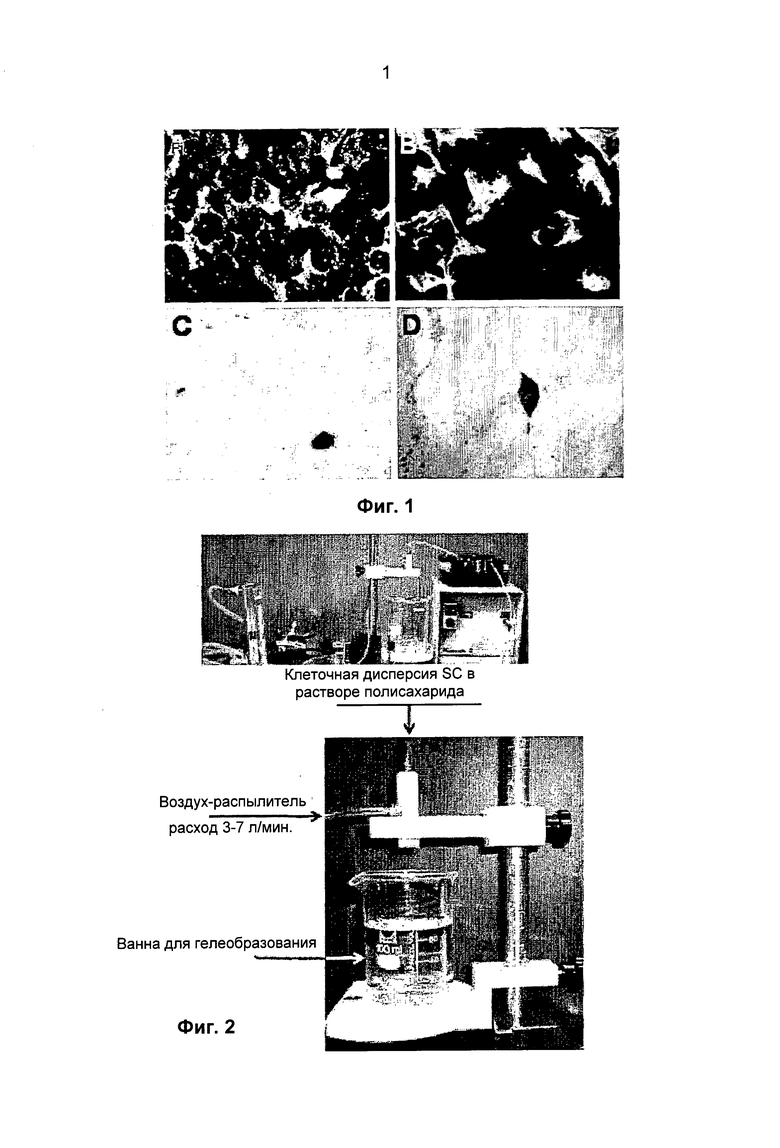
Фиг 1. Микрофотографии SC свиньи. A: Иммуноцитохимические данные, полученные при инкубации препарата с антителами к мюллерову ингибирующему фактору (антимюллерову гормону, английское обозначение: mullerian inhibiting factor, MIS). В: Иммуноцитохимические данные, полученные при инкубации препарата с антителами к виментину. C-D: Для подтверждения наличия малых количеств клеток Лейдига и околоканальцевых клеток, препарат подвергали гистохимическому анализу для определения присутствия щелочной фосфатазы, окрашивая красителем быстрый красный (Fast-Red) (характеристическим реактивом для околоканальцевых клеток) (С), и для определения активности 3-β-гидрокси-стероидодегидрогеназы, окрашивая красителем нитросиний тетразолий (Nitro-blue tetrazolium) (характеристическим реактивом для клеток Лейдига) (D).
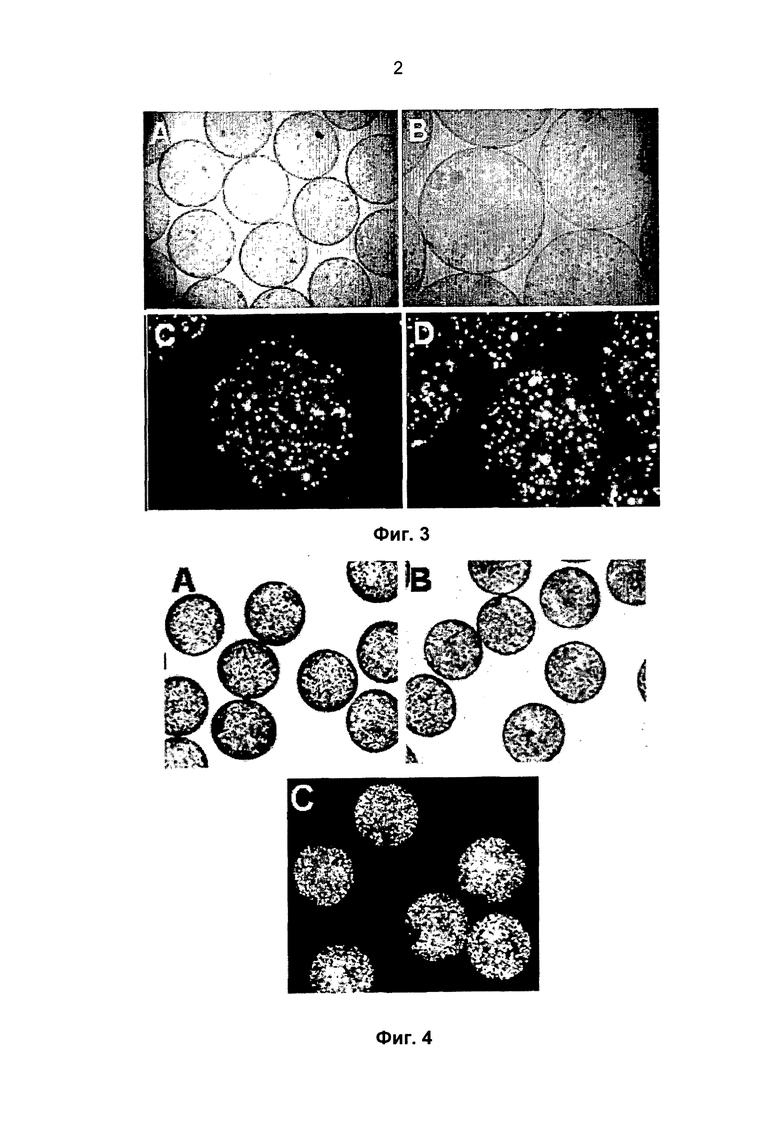
Фиг 2. Устройство для получения SC, заключенных в микрокапсулы из гидрогеля на основе альгината, включающее "воздушную монострую" (Фото A). На Фото B представлены наиболее важные компоненты разработанной системы.
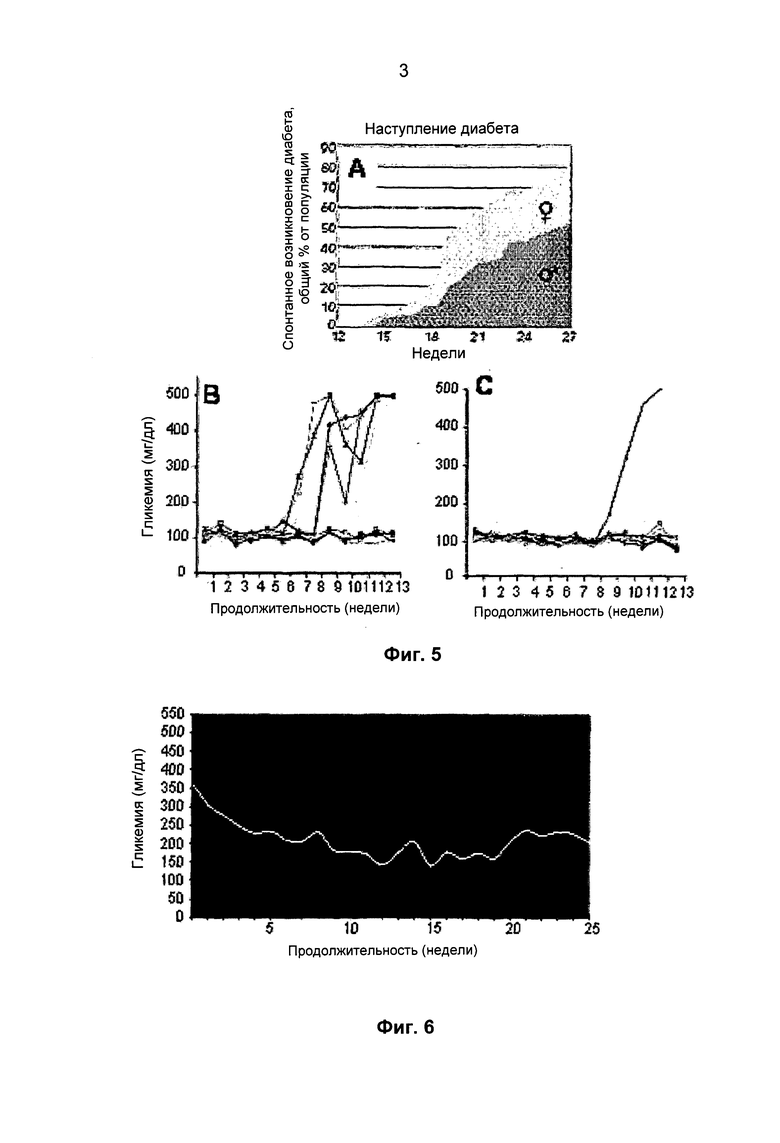
Фиг 3. Микрофотографии микрочастиц, изготовленных на основе альгината, полученных с помощью распылительной системы "воздушная моноструя" с использованием в качестве гелеобразователей BaCl2 (A-C) и CaCl2+полиорнитин (B-D).
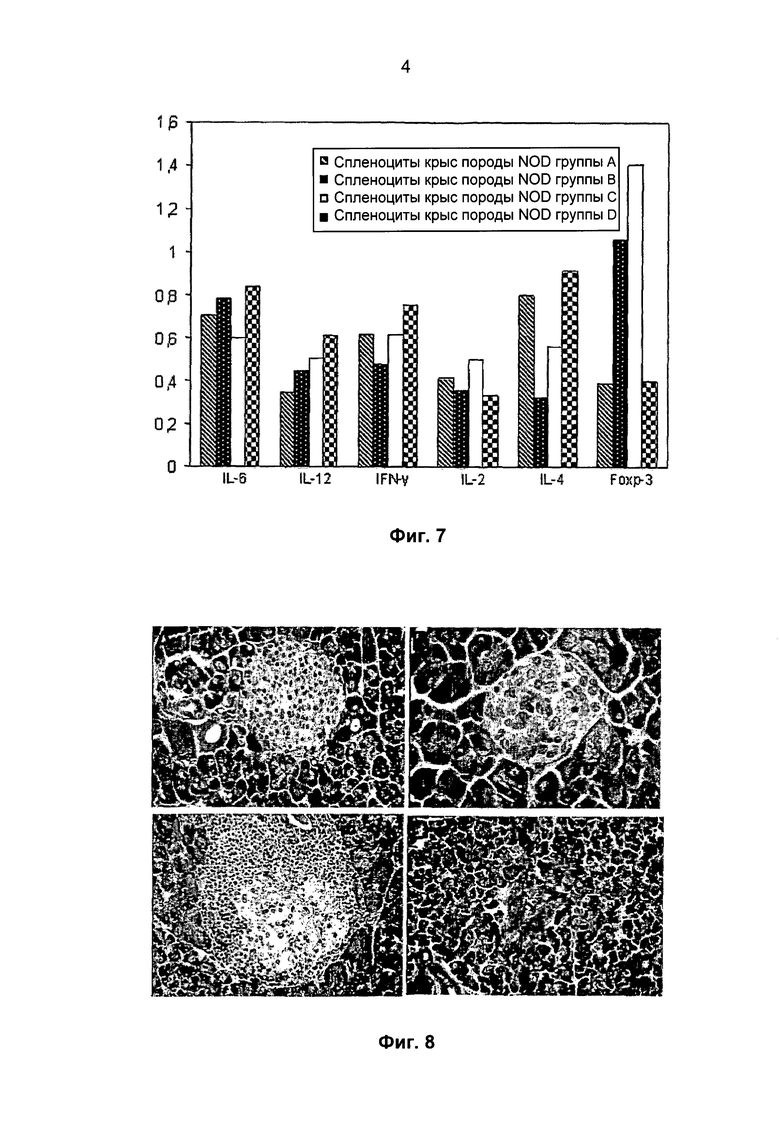
Фиг 4. Полученные на прозрачном поле микрофотографии полисахаридных микрочастиц, поперечно сшитых ионами бария (A) и кальция (B), после извлечения из брюшной полости крыс породы NOD (Non-obese diabetic rats, не страдающих ожирением больных диабетом крыс), спустя 4 месяца после имплантации. На Фото C представлена микрофотография SC, заключенных в микрокапсулы из альгината бария, после двойного окрашивания ЕВ/FDA (бромидом этидия / флуоресцеиндиацетатом), полученная с помощью флуоресцентного микроскопа.
Фиг 5. Частота спонтанного возникновения СД Т1 у крыс NOD (85%), заявленная поставщиком (Taconic) (A), выраженная в процентах, в сравнении с частотой спонтанного возникновения СД Т1 у животных в преддиабетическом состоянии "интактной" (т.е. ранее не подвергавшейся воздействию) контрольной группы, которым вводили пустые микрокапсулы (B). С другой стороны, на Фиг.5С показано значительное снижение, до 9%, частоты возникновения СД Т1 у животных в преддиабетическом состоянии, которым вводили инкапсулированные SC (профилактическое действие).
Фиг 6. Значения средней гликемии после трансплантации у крыс породы NOD (Группа E), страдающих выраженным спонтанным диабетом, которым вводили микроинкапсулированные SC (терапевтическое действие).
Фиг 7. Результаты анализов спленоцитов животных, которым вводили микроинкапсулированные SC, полученные с помощью ПЦР в режиме реального времени. Результаты показывают, что введение SC животным Групп C и E (см. раздел VII) может повышать количество положительных in vivo клеток Foxp3. Этот результат указывает на значительное повышение количества T-клеток с регулирующими функциями, то есть, способных регулировать активацию и пролиферацию некоторых клеток, участвующих в опосредовании ответных иммунных реакций.
Фиг 8. Гистологический анализ панкреатических островков крыс породы NOD в преддиабетическом/диабетическом состоянии (A) и крыс, страдающих спонтанным диабетом (B). На изображениях видно, что островок совершенно не содержит как внутриостровкового, так и межостровкового инфильтрата, оказывающего воспалительное действие на островки. На Фото C и D показаны результаты гистологических анализов островков, полученных из организмов "интактных" крыс породы NOD в преддиабетическом состоянии (С) и крыс, страдающих спонтанным диабетом (D), которым вводили пустые капсулы.
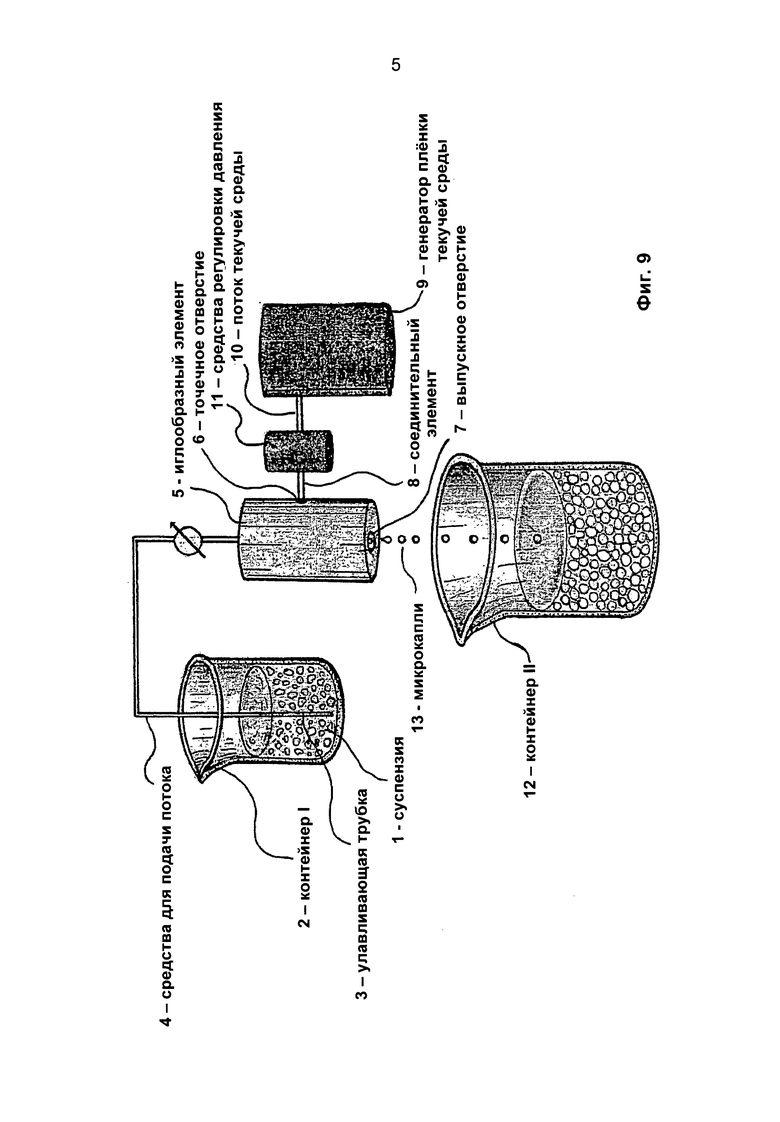
Фиг 9. Схема установки, применяемой для осуществления изобретения.
СВЕДЕНИЯ, ПОДТВЕРЖДАЮЩИЕ ВОЗМОЖНОСТЬ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Первоначально получали гомогенную суспензию SC в полисахариде: чистота раствора по клеточному составу составляла 90%; раствор был приготовлен в физиологическом солевом растворе ультрачистого альгината натрия в концентрации от 1 до 5% мас./об., предпочтительно от 1 до 3%. Применяли ультрачистый альгинат, содержание эндотоксинов в котором не превышало 20 EU/г (эндотоксиновых единиц/г), и содержание белка составляло <0,4%; в качестве текучей среды предпочтительно применяли воздух. Для получения гомогенной клеточной суспензии, клетки SC предварительно обрабатывали трипсином и ЭДТУ (этилендиаминтетрауксусной кислотой) (2 минуты). Для оценки использовали следующие методики:
- иммуноцитохимические методики, включающие инкубацию препарата с антителами к мюллерову ингибирующему фактору (MIS) и антителами к виментину, мечеными флуоресцеином, которыми, соответственно, метят молекулы MIS и виментина, экспрессируемые только SC.
- гистохимические методики оценки присутствия щелочной фосфатазы (окрашивание быстрым красным), характерной для околоканальцевых клеток, и фермента 3-β-гидрокси-стероидодегидрогеназы (окрашивание нитросиним тетразолием), который, в свою очередь, характерен для клеток Лейдига.
Результаты, полученные с помощью гистохимического анализа, позволили подтвердить присутствие 5-8% околоканальцевых клеток и клеток Лейдига; кроме того, эти клеточные популяции обеспечивают (если их количества соответствуют указанным) "сообщение" молекул между собой, способствующее правильному функционированию SC.
Полученную суспензию отсасывают со скоростью, составляющей от 10 до 60 мл/мин, генерируя в результате засасывания и экструзии под действием потока текучей среды, предпочтительно воздуха, имеющего установленное давление, непрерывный поток микрокапель одинакового размера. Отсосанную таким образом суспензию вводят в иглообразный элемент, в котором происходит разделение на микрокапли по существу одинакового размера. Предпочтительно, в боковой поверхности иглообразного элемента имеется точечное отверстие, в которое вводят поток текучей среды со скоростью 3-7 литров/мин, получая непрерывный поток одинаковых по размеру микрокапель. Поток текучей среды получают в генераторе, и перед использованием давление потока понижают, получая перепад давления при переходе от течения к остановке потока, составляющий не менее 0,3 бар (3×104 Па); регулируют, создавая высокую воспроизводимость перепада при переходе от течения к остановке потока, а также линейную зависимость между числом оборотов и дозированием потока текучей среды, и регулируют, устанавливая расход на выходе в диапазоне от 0 до 10 нл/мин (нанолитров/мин).
Средний диаметр микрокапель может составлять от 300 до 700 мкм при стандартном отклонении менее 40 мкм. Полученные микрокапли вводят в водный раствор, предпочтительно полученный в стерилизованной воде для инъецируемых препаратов, F.U., содержащий двухвалентные катионы или поликатионные вещества, что приводит к образованию геля и получению целевых микрокапсул.
Другая задача настоящего изобретения состоит в применении клеток Сертоли в качестве единственного терапевтического средства для предотвращения и полного излечения СД Т1.
Предпочтительно, в соответствии со способом согласно изобретению, отсасывание производят в непрерывном режиме с помощью перистальтического насоса; при этом скорость потока составляет от 10 до 16 мл/мин; и экструзию производят с помощью системы "воздушной моноструи", применяя поток текучей среды, предпочтительно воздуха, расход которого составляет от 3 до 7 л/мин. Согласно способу, точную калибровку параметров потока воздуха, которая является характерной особенностью всего способа, обеспечивают с помощью перечисленных ниже компонентов системы, не применяемых в способах предшествующего уровня техники (включая системы, применяемые в способах "ближайшего аналога"). Перед контактом с суспензией, получаемой при выполнении этапа b), поток воздуха подвергают следующим воздействиям с помощью следующих устройств:
- мембранного редуктора давления Swagelok (KPR1JRF411А20000), обеспечивающего высокую воспроизводимость давления на выходе и, таким образом, создающего очень малый перепад давления при переходе от течения к остановке потока, составляющий менее 0,3 бар, который служит для стабилизации и подачи потока воздуха в экструдер с воспроизводимыми параметрами;
- регулирование с помощью прецизионного (микрометрического) клапана Swagelok (SS-SS6MM), установленного на выходе регулятора давления, позволяющего регулировать выходной поток воздуха (0-10 нл/мин) с высокой точностью и высокой воспроизводимостью перепада давления при переходе от течения к остановке потока, а также поддерживать линейную зависимость между числом оборотов и дозированием потока;
- вращающегося поплавкового расходомера (rotating float flow meter) (ROTAMETRO) Yokogawa, поставляемого Precision Fluid (RAGK41-TOSS-SSNNN-M741A-TTCGN*A), установленного после прецизионного клапана, который обеспечивает точное и быстрое измерение скорости выходного потока (0-10 нл/мин) и его последующее регулирование с помощью прецизионного клапана.
Другая задача настоящего изобретения состоит в создании микрокапсул, содержащих SC, получаемых в соответствии со способом согласно изобретению, одним из отличительных признаков которых является секреция IGF-1 (инсулиноподобного фактора роста 1) клетками Сертоли, содержащимися в микрокапсулах, идентичная секреции IGF-1 "свободными" или не содержащимися в микрокапсулах клетками Сертоли.
Другая задача настоящего изобретения состоит в применении клеток Сертоли, предпочтительно микроинкапсулированных в соответствии со способом согласно изобретению, в качестве единственного терапевтического средства для получения медикамента для предотвращения и полного излечения СД Т1.
Согласно изобретению, полученные микрокапсулы могут быть подвергнуты промывке и/или на них может быть нанесено дополнительное покрытие из натуральных и/или искусственных полимеров.
В отличие от способов предшествующего уровня техники, способ согласно изобретению позволяет: a) получать совершенно одинаковые микрокапсулы меньших размеров, с фиксированными диаметрами (от 300 мкм), не имеющие "отростков", и при этом жизнеспособность и функциональные характеристики микроинкапсулированных SC не ухудшаются; b) повысить число микроинкапсулированных SC в расчете на 1 мл альгината от 106 SC до 206 SC на 1 мл альгината, и в перспективе обеспечить возможность введения большего количества SC в минимально возможный объем полимера; и c) улучшить функционирование микроинкапсулированных SC, в частности, связанное с выработкой IGF-1, обеспечивающее повышение его секреции с 50 нг/мл/20×106 клеток до 80 нг/мл/20×106 клеток, что по существу соответствует секреции IGF-1 "свободными" SC.
В отношении настоящего изобретения, следует отметить, что:
1. Впервые микроинкапсулированные SC предложены в качестве окончательного терапевтического подхода, включающего неогенез бета-клеток пациента, уничтоженных в результате протекания аутоиммунного процесса.
2. Произведена оптимизация способа микроинкапсулирования, которая позволяет получать микрокапсулы с улучшенными свойствами, например, с меньшими средними размерами, пониженной полидисперсностью и отсутствием морфологических дефектов ("отростков" и слияния капсул).
Другая задача настоящего изобретения состоит в создании композиций, включающих SC, содержащиеся в микрокапсулах, получаемых способом согласно изобретению, и физиологически переносимые носители, применяемые для предотвращения и лечения СД Т1. Пример носителя включает солевой раствор для интраперитонеального (внутрибрюшинного) введения.
Ниже подробно описаны аспекты настоящего изобретения.
Очистка полимеров
Полимеры, подходящие для микроинкапсулирования SC, не являются коммерчески доступными в высокочистом виде, который является обязательным требованием при парентеральном введении, например, для изготовления трансплантатов, вводимых в организм человека. В этих случаях необходимо соблюдение строгих международных критериев "контроля качества" (см. нормативные акты Министерства Здравоохранения и Фармакопеи США).
Действительно, большинство коммерчески доступных продуктов содержат высокие уровни эндотоксинов (обычно составляющие от 30000 до 60000 EU/г), что делает их абсолютно непригодными для изготовления трансплантатов, уровни эндотоксинов в которых не должны превышать 100 EU/г. Вследствие этого, все полимеры, применяемые для получения микрочастиц, подвергают подходящей очистке, включающей несколько последовательных циклов, которая позволяет значительно снизить концентрацию эндотоксинов.
Выделение SC
Клетки Сертоли могут быть выделены из различных источников животного происхождения, обычно из организмов животных, не достигших пубертатного возраста, и очищены. После анестезии животных подвергают двусторонней орхидэктомии. После удаления эпидидимиса яички подвергают ферментативному разложению под действием нескольких ферментов. По завершении разложения ткани канальцев подвергают фильтрованию. Полученные таким образом канальцы культивируют при 37°C в атмосфере, содержащей 5% СO2. После выдерживания в инкубаторе в течение 48 часов SC начинают прикрепляться к культуральным планшетам, образуя клеточный монослой. Затем исследуют чистоту, жизнеспособность и функциональные характеристики полученных SC. Определение жизнеспособности клеток обычно производят непосредственно после выделения, на второй день после высевания и непосредственно до и после микроинкапсулирования.
Получение микроинкапсулированных клеток Сертоли
Клетки Сертоли могут быть иммобилизованы внутри микрокапсул, состоящих из различных гидрогелей, включающих гидрофильные полимеры, применяемые как таковые или в виде смесей. Начальный этап способа микроинкапсулирования включает создание непрерывного и откалиброванного потока микрокапель. Для получения микрокапель могут быть использованы различные устройства: (a) микроинкапсулятор с использованием "воздушной моноструи", (b) автоматический инкапсулятор с вибрирующим соплом (automatic vibrating encapsulator), (c) электростатический микроинкапсулятор, и (d) микрожидкостные системы типа "лаборатория на чипе" (английское обозначение "lab-on-a-chip").
После получения потока микрокапель, имеющих одинаковый установленный размер, их превращают в твердые микросферы гелеобразованием. Например: обрабатывают сливающиеся монослои SC, получая гомогенную клеточную суспензию; SC повторно суспендируют в различных растворах ультрачистых полимеров (полученных как описано в разделе "Очистка полимеров") и, наконец, микрокапсулы, образованные в ванне для гелеобразования, промывают и извлекают. Полученные микрокапсулы могут быть использованы как таковые, или на них может быть нанесено дополнительное покрытие, состоящее из слоев различных натуральных, полусинтетических или синтетических полимеров. Таким образом, предлагаемый способ (представленный на Фиг.3) позволяет производить иммобилизацию SC внутри микрокапсул, имеющих по существу одинаковый размер и не имеющих морфологических дефектов (слияний или "отростков"), и, в то же время, обеспечивает жизнеспособность и поддержание функциональных характеристик инкапсулированных клеток.
Биосовместимость инкапсулированных SC in vivo
Биосовместимость микрочастиц оценивали с помощью интраперитонеального имплантата, вводимого посредством лапаротомии. Массу тела каждого подопытного животного измеряли во время всего исследования in vivo. Спустя различные периоды времени после трансплантации, микрокапсулы извлекали из организма для оценки их морфологии и функционирования инкапсулированных клеток. Общие особенности извлеченных микросфер определяли под микроскопом, оценивая морфологию и наличие воспалительных клеток на поверхностях капсул. Жизнеспособность заключенных в микрокапсулы SC оценивали с помощью методик двойного окрашивания EB/FDA.
Исследование in vivo активности микроинкапсулированных SC
Было показано, что интраперитонеальный трансплантат, содержащий микроинкапсулированные SC в солевом растворе, позволяет как предотвращать, так и лечить СД Т1 в узкоспецифичных опытах с животными, соответствующих человеческому СД Т1, например, у крыс NOD. Предпочтительно, но не обязательно, введение продукта микроинкапсулирования SC согласно изобретению осуществляют интраперитонеальным введением продукта, находящегося в солевом растворе.
Другая задача изобретения состоит в создании установки для получения микрокапсул, предпочтительно в соответствии со способом согласно изобретению. Установка и принцип ее действия описаны ниже со ссылками на Фиг.9. Первый контейнер 2 соединен со средствами 4 распределения потока, предпочтительно объемным насосом, предназначенными для подачи суспензии 1 через улавливающую трубку 3 в иглообразный элемент 5. В боковой стенке иглообразного элемента 5 имеется точечное отверстие 6 и выходное отверстие 7. Соединительный элемент 8 позволяет направлять в элемент 5 поток 10 текучей среды, предпочтительно воздуха, находящейся под давлением и поступающей из генератора 9, параметры которой регулируют с помощью регулирующих средств 11. Подходящее регулирование параметров потока 10 позволяет производить прерывание потока суспензии с образованием микрокапель 13 одинакового размера, которые образуют гель при попадании в раствор, содержащий двухвалентные катионы, находящийся во втором контейнере 12. Упомянутое выше устройство, генерирующее струю воздуха, и описанные условия применяют для получения микрокапсул одинакового размера.
Разработка прототипа микроинкапсулятора, применяемого в стерильных условиях, и надлежащей лабораторной практики (Good Laboratory Practise, соответствующее сокращение - GLP)
ПРИМЕРЫ
Микроинкапсулирование клеток Сертоли внутри микросфер на основе альгината и исследование их биосовместимости и функциональных характеристик in vivo
A) Очистка полимера
В качестве основного полимера для получения микрокапсул применяли полученный способом последовательного фильтрования альгинат натрия, обычно доступный в виде 1-6%-ного (мас./об.) раствора, который, соответственно, хранят в помещении, недоступном для солнечного света, при температуре 4°-6°C. Полученное таким образом соединение стабильно в течение приблизительно 5 лет, содержание эндотоксинов в нем не превышает 20 EU/г, и содержание белков практически равно нулю (составляет менее 0,4%, что соответствует еще одному критерию "бионевидимости", устанавливаемому Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США).
B) Извлечение SC из организмов детенышей свиньи, не достигших пубертатного возраста
SC были извлечены из яичек детенышей свиньи породы "Large-White" (в возрасте 7-15 суток). После проведения анестезии посредством внутримышечного введения 0,1 мг/кг азаперона (Stresnil® 40 мг/мл, Janssen, Brusselle, Belgium) и 15 мг/кг кетамина (Imalgene⊕ 100 мг/мл, Gellini Farmaceutici), поросят подвергали двусторонней орхидэктоми. После удаления придатков, с яичек удаляли белочную оболочку, измельчали, получая мелкие фрагменты ткани (1-3 мм3), и немедленно подвергали первому ферментативному разложению в присутствии коллагеназы Р (Roche Diagnostics, S.p.A., Monza, Italy) (2 мг/мл) в HBSS (сбалансированном солевом растворе Хенкса) (Sigma Chemical Со, St.Louis, USA). Разложение проводили до отделения семенных канальцев. Затем извлеченные канальцы промывали в HBSS и центрифугировали на скорости 500 об/мин. После промывки, канальцы инкубировали с раствором HBSS, содержащим трипсин (2 мг/мл) и ДНКазу I (Sigma). По завершении второго разложения, для прекращения ферментативного действия, трипсиновый раствор разбавляли 1:1 раствором Хенкса, содержащим 20% ЭБС (эмбриональной бычьей сыворотки). После проведения еще нескольких промывок HBSS, канальцы отделяли от околоканальцевых клеток с помощью медленного центрифугирования на скорости 300 об/мин. Осадок, содержащий ткани канальцев, фильтровали через фильтр из нержавеющей стали с диаметром ячеек 500 мкм. Наконец, для удаления следов околоканальцевых клеток и клеток Лейдига, загрязняющих препарат, суспензию, содержащую канальцы, дополнительно центрифугировали на скорости 800 об/мин в течение 5 минут, и полученный осадок в течение 7 минут обрабатывали раствором глицина концентрацией 1М и ЭДТУ концентрацией 2 мМ в HBSS при рН 7.2.
Подготовленные таким образом канальцы помещали для культурирования в среду НАМ F12 (Euroclone), дополненную 0,166 нМ ретиноевой кислотой (Sigma) и 5 мл/500 мл смесью инсулин-трансферрин-селен (ITS) (Becton Dickinson#354352), при 37°C в атмосфере, содержащей 5% СO2. После проведения культивирования в течение 48 часов, SC начинали закрепляться на планшетах для культивирования с образованием клеточного монослоя. Для удаления остаточных зародышевых клеток (которые, как известно, при имплантации в брюшной полости могут вызывать дисгерминому), монослои SC обрабатывали буфером, гидрохлоридом трис-(гидроксиметил)-аминометана (TRIS) (Sigma), который позволяет удалять остаточные зародышевые клетки посредством осмотического лизиса. Наконец, SC выращивали в рассмотренных выше условиях, обычно в колбах емкостью 75 см2.
Затем анализировали чистоту, жизнеспособность и функциональные характеристики полученных SC. Чистоту SC, превышающую 90%, оценивали с помощью иммуноцитохимических методик, инкубируя препарат с антителами к мюллеровому ингибирующему фактору (MIS) и антителами к виментину, мечеными флуоресцеином, которые, соответственно, окрашивают молекулы MIS и виментина, экспрессируемые только клетками Сертоли (Фиг.1A, B).
Для подтверждения наличия пониженных концентраций клеток Лейдига и околоканальцевых клеток, представляющих собой возможные загрязняющие вещества, препараты SC подвергали гистохимическим исследованиям. Проводимые испытания позволяли оценить как присутствие щелочной фосфатазы (окрашивание быстрым красным), характерное для околоканальцевых клеток, так и наличие фермента 3-β-гидрокси-стероидодегидрогеназы (окрашивание нитросиним тетразолием), характерное для клеток Лейдига (Фиг.1С, D). Результаты гистохимического анализа позволили определить присутствие 5-8% околоканальцевых клеток и клеток Лейдига; кроме того, эти клеточные популяции (именно в указанных концентрациях) нужны для обеспечения "сообщения" между молекулами, способствующего созданию требуемого функционирования этих популяций клеток яичка.
Жизнеспособность SC оценивали обработкой бромидом этидия (EB) и флуоресцеиндиацетатом (FDA) (Sigma). Клетки, наблюдаемые под флуоресцентным микроскопом, при всех условиях проявляли жизнеспособность, превышающую 95%. Определение жизнеспособности клеток обычно проводят немедленно после их извлечения, на вторые сутки культивирования и непосредственно перед проведением микроинкапсулирования.
C) Получение микрокапель для инкапсулирования клеток Сертоли
SC заключали внутри микрокапсул, состоящих из различных полисахаридных полимеров, применяемых в чистом виде или в виде смесей. Выбранный полимер представлял собой альгинат натрия, прошедший ультраочистку в лабораториях заявителя. Начальный этап способа микроинкапсулирования включает создание непрерывного и откалиброванного потока микрокапель из клеточной суспензии SC, находящейся в водной суспензии полисахарида при концентрации полимера от 1 до 5% (мас./об.).
Для получения микрокапель могут быть использованы и используют различные устройства: (a) микроинкапсулятор с использованием "воздушной моноструи", (b) автоматический инкапсулятор с вибрирующим соплом, (c) электростатический микроинкапсулятор, и (d) микрожидкостные системы типа "лаборатория на чипе". В частности, выбранный способ (а), включающий применение полуавтоматического, компактного, стерилизуемого и транспортабельного микроинкапсулятора (на Фиг.2А показан общий вид системы), позволяет получать содержащие SC микрокапсулы по существу одинакового размера (с диаметром от 300 до 700 мкм), без видимых морфологических дефектов (например, слияний или "отростков") и, кроме того, без снижения жизнеспособности и без ухудшения функциональных характеристик микроинкапсулированных SC.
На Фиг.2В схематически представлена процедура микроинкапсулирования с помощью "воздушной моноструи".
D) Получение микрокапсул на основе ультраочищенного альгината
После получения потока микрокапель одинакового регулируемого размера, микрокапли превращают в твердые микросферы посредством гелеобразования, которое включает образование ионных связей с двухвалентными ионами в соответствии со способом, разработанным и протестированным в лабораториях заявителя.
В частности, слившиеся монослои SC обрабатывают 0,05% трипсином/ЭДТУ (Gibco, Garndisland, USA) (2 минуты), для образования гомогенной клеточной суспензии. После промывки, SC пересчитывают с помощью гемоцитометрического анализа и определяют их жизнеспособность. После этого, SC повторно суспендируют в различных суспензиях ультрачистых полимеров при концентрациях альгината, составляющих 1,5-2% (мас./об.). Для изготовления микрокапсул с помощью системы с "воздушной моноструей", суспензию SC в полимерах непрерывно отсасывают с помощью перистальтического насоса при скорости потока, составляющей от 10 до 16 мл/мин. Затем клеточную суспензию экструдируют через систему "воздушной моноструи" (применяя поток воздуха, расход которого составляет от 3 до 7 л/мин). На протяжении всей обработки, суспензию SC непрерывно осторожно перемешивают во избежание слипания клеток и возможного образования микрокапсул с негомогенным распределением содержащихся в них SC.
Затем получаемые микрокапли превращают в гель в растворе, содержащем двухвалентные катионы, например, Са+2 или Ва+2 (0,5-2,5% масс./об.). В этих условиях микрокапли мгновенно превращаются в гелевые микросферы. После этого микрокапсулы оставляют осаждаться в бане для гелеобразования в течение 2-15 минут. По окончании этого этапа микрокапсулы подвергают нескольким циклам промывки солевым раствором.
Получаемые микрокапсулы могут быть использованы как таковые или на них может быть нанесено дополнительное покрытие, которое наносят последовательным выдерживанием в растворах, содержащих натуральные, полусинтетические или синтетические катионные полимеры. Например, для получения покрытия проводили выдерживание в растворах поли-L-орнитина (PLO) концентрацией 0,12% (в течение 10 минут) и 0,06% (в течение 6 минут). Наконец, микрокапсулы с покрытием из PLO дополнительно обрабатывали разбавленным раствором полисахарида, получая наружное покрытие с высокой биосовместимостью.
На Фиг.3 представлены микрофотографии микрокапсул на основе альгината, полученных в соответствии с процедурой, рассмотренной выше, с использованием только ионов бария (A-C), и микрокапсул, на которые были нанесены несколько покрытий с использованием ионов кальция / полиорнитина / полимера (B-D). Таким образом, предлагаемый способ (как показано на Фиг.3) позволяет производить иммобилизацию SC внутри микрокапсул по существу одинакового размера, не имеющих морфологических дефектов, таких как слияние капсул или наличие "отростков", и, кроме того, обеспечивает сохранение жизнеспособности и функциональных характеристик инкапсулированных клеток.
Биосовместимость инкапсулированных SC in vivo
После проведения общего наркоза посредством интраперитонеального введения 100 мг/кг кетамина (Parke-Davis/Pfizer, Karlsruhe, Germany) и 15 мг/кг ксилазина (Bayer, Leverkusen, Germany), альгинатные микрочастицы были введены через небольшой разрез (лапаротомия) в брюшную полость самок крыс породы NOD (Harlan, Italy, приблизительная масса тела 25 г). Каждому животному имплантировали 106 микроинкапсулированных SC. Массу тела каждой подопытной крысы отслеживали в течение всего исследования in vivo.
Спустя 4 месяца после проведения трансплантации микрокапсулы, после проведения анестезии, извлекали из брюшной полости животных для оценки морфологии капсул и функционирования их содержимого. Микрокапсулы извлекали промывкой брюшной полости солевым физиологическим раствором. Общие особенности извлеченных микросфер определяли под микроскопом, оценивая морфологию и наличие воспалительных клеток на поверхностях капсул. Жизнеспособность заключенных в микрокапсулы SC оценивали с помощью методик двойного окрашивания EB/FDA.
На микрофотографиях, представленных на Фиг.4 (A-B), видно, что полисахаридные микрочастицы соответствуют высоким стандартам биосовместимости, поскольку на поверхностях капсул имеются лишь минимальные количества воспалительных клеток. Кроме того, SC, заключенные в микрокапсулы из альгината бария (Фиг.4А) и альгината кальция (Фиг.4B), сохраняют высокую жизнеспособность после 4 месяцев пребывания в организме в виде имплантата (Фиг.4С).
Исследование активности микроинкапсулированных SC in vivo и in vitro
Областью применения настоящего изобретения являются трансплантационные биотехнологии, например, связанные с предотвращением и лечением СД Т1. Действительно, в лабораториях заявителя было показано, что введение интраперитонеального трансплантата, содержащего SC, заключенные в микрокапсулы, представляющие собой микросферы из альгината бария (20 одной крысе), может предотвратить возникновение и излечить СД Т1 в узкоспецифичных опытах с животными, соответствующих человеческому СД Т1, например, у крыс NOD. В частности, SC, заключенные в микрокапсулы, представляющие собой микросферы из альгината бария (BaAG), после 72 часов культивирования, были трансплантированы в брюшную полость крыс NOD, находящихся в преддиабетическом состоянии, и крыс NOD, страдающих выраженным диабетом. Имплантацию выполняли посредством лапаротомии под общим наркозом. Затем животных после трансплантации еженедельно осматривали, измеряя массу тела и уровень гликемии до и после еды. Протокол проводимого эксперимента предусматривал разделение животных на нижеследующие группы, подвергаемые разным воздействиям.
Группа A: "интактные" контрольные животные в преддиабетическом состоянии (им вводили пустые микрокапсулы).
Группа B: контрольные животные (им вводили пустые микрокапсулы), страдающие спонтанным диабетом.
Группа C: "интактные" контрольные животные в преддиабетическом состоянии, которым вводили интраперитонеальный имплантат, содержащий микроинкапсулированные SC.
Группа D: "интактные" контрольные животные в преддиабетическом состоянии, которым вводили интраперитонеальный имплантат, содержащий "свободные" SC: (206 одной крысе).
Группа ЕE: животные, страдающие спонтанным диабетом, которым вводили интраперитонеальный имплантат, содержащий микроинкапсулированные SC.
Во время проведения исследования in vivo некоторых животных умерщвляли для иммунологической оценки состояния периферийных систем, проводимой посредством гистоморфологического и иммуноцитохимического анализа извлекаемых селезенки, перипанкреатических лимфатических узлов и поджелудочной железы.
Полный анализ, проведенный в экспериментах in vivo на крысах породы NOD, показал, что трансплантация животным, находящимся в преддиабетическом состоянии, страдающим спонтанным диабетом, микроинкапсулированных SC приводит к следующим важным терапевтическим результатам:
(A) Микроинкапсулированные SC могут предотвращать возникновение СД Т1 у крыс породы NOD. Этот сенсационный результат может быть получен из анализа частоты спонтанного возникновения СД Т1, выраженной в процентах. Действительно, эта патология спонтанно возникала у 85% животных группы A (Фиг.5 В). Этот результат прекрасно согласуется с частотой возникновения СД Т1, заявленной поставщиком крыс NOD (Taconic) (Фиг.5А).
С другой стороны, у животных группы С (животные в преддиабетическом состоянии, которым вводили инкапсулированные SC), частота возникновения СД Т1 составила лишь 9% (Фиг.5С). Наконец, у животных группы D (животные в преддиабетическом состоянии, которым вводили интраперитонеальный имплантат из "свободных" SC), частота возникновения СД Т1 была гораздо ниже, чем в группе "интактных" животных (19%), но все же выше, чем у животных группы С (Фиг.5D).
(B) Микроинкапсулированные SC могут в течение всего лишь 7-15 суток после имплантации нормализовать уровни гликемии (снижая гликемию до значений ниже 200 мг/дл) у более чем 60% крыс группы Е (N=30), у которых наблюдали спонтанное развитие диабета (Фиг.6А). С другой стороны, у животных группы B (животные, страдающие диабетом, которым были введены пустые капсулы) все время сохранялись высокие уровни гликемии, и эти животные быстро, т.е. в течение 1-2 недель, погибали. Наконец, у животных группы F (N=30) (животные, страдающие диабетом, которым был введен интраперитонеальный имплантат, содержащий "свободные" SC) наблюдали нормализацию уровней гликемии, хотя доля таких животных была ниже, а именно, приблизительно составляла 40%.
(C) Исследования лимфатических узлов, поджелудочных желез и селезенок показали, что SC могут "вновь научить" иммунную систему животных групп C и E "блокировать" аутоиммунную атаку, обусловливающую развитие заболевания; это видно из данных Фиг.7, на котором показаны результаты полимеразной цепной реакции (ПЦР) в режиме реального времени с использованием спленоцитов подвергаемых лечению животных. В частности, такие результаты показывают, что одним из основных эффектов воздействия SC является их способность индуцировать in vivo Рохр3+клетки. Foxp3 представляет собой селективный маркер Т-клеток, обладающий регуляторными свойствами, то есть, способный регулировать активацию и пролиферацию некоторых клеток, участвующих в иммунных ответных реакциях, а некоторые из таких клеток представлены в организмах крыс породы NOD в недостаточном количестве.
(D) Гистохимические исследования, проведенные на материалах, полученных для каждой из групп животных, показали, что введение SC может устранять воспалительный мононуклеарный инфильтрат в островках поджелудочной железы животных групп C и E, в отличие от животных контрольных групп (A и B) (Фиг.8). Кроме того, после достижения указанного эффекта следует активация мезенхимальных стволовых клеток поджелудочной железы, которые могут продуцировать новые B-клетки, способные нормализовать уровни гликемии у животных, которым вводили SC, поскольку эти клетки более не поражаются в результате аутоиммунной атаки. Ремодуляция иммунной ответной реакции после лечения SC опосредуется активацией иммунорегуляторного пути фермента индоламин-2,3-диоксигеназы (IDO), одна из изоформ которого также экспрессируется и функционирует в SC.
Литература
1. DeCesaris P., Filippini A., Cervelli С, Riccioloi, A.; Muci, S.; Starace, G.; Stefanini, M.; Ziparo, E. Immunosuppressive molecules produced by Sertoli cells cultured in vitro: Biological effects on lymphocytes. Biochem. Biophys Res. Commun. 1992, 186: 1639-1646.
2. Lynch D.H., Ramsdell F., Alderson M.R. Fas and FasL in the homeostatic regulation of immune responses. Immunol. Today 1995, 16: 569-574.
3. Suarez-Pinzon W., Korbutt G.S., Power R., Hooten J., Rajotte R.V., Rabinovitch A. Testicular Sertoli cells protect islet B-cells from autoimmune destruction by a transforming growth factor-BI-dependent mechanism. Diabetes 2000, 49:1810-1818.
4. Emerich, D. F., Hemendinger, R., and Halberstadt, C.R. The Testicular-Derived Sertoli Cell: Cellular Immunoscience to Enable Transplantation. Cell Transplantation 12, 335, 2003.
5. Luca, G., Calvitti, M., Nastruzzi, C, Bilancetti, L, Becchetti, E., Mancuso, F., Calafiore R. Encapsulation, in Vitro Characterization and in Vivo Biocompatibility of Sertoli's Cells in Alginate Based Microcapsules. Tissue Eng. 2007, 13:641-648.
| название | год | авторы | номер документа |
|---|---|---|---|
| УСТРОЙСТВО ДЛЯ МИКРОИНКАПСУЛИРОВАНИЯ ЖИЗНЕСПОСОБНЫХ КЛЕТОК И ТКАНЕЙ | 2007 |
|
RU2366696C2 |
| МАКРОГРАНУЛА С СЕКРЕТОРНЫМИ КЛЕТКАМИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ НАРУШЕНИЕМ ФУНКЦИОНИРОВАНИЯ СЕКРЕТОРНЫХ КЛЕТОК | 1995 |
|
RU2177503C2 |
| МАКРОГРАНУЛА С СЕКРЕТОРНЫМИ КЛЕТКАМИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ НАРУШЕНИЕМ ФУНКЦИОНИРОВАНИЯ СЕКРЕТОРНЫХ КЛЕТОК | 1995 |
|
RU2208636C2 |
| Способ приготовления микрокапсул с островками Лангерганса и микрокапсула по предложенному способу | 2023 |
|
RU2822875C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЧАСТИЦ МИКРОКАПСУЛИРОВАННОГО ФЕНИБУТА В АЛЬГИНАТЕ НАТРИЯ | 2017 |
|
RU2662173C1 |
| Способ получения альгинат-хитозановых микрокапсул с винпоцетином | 2019 |
|
RU2716000C1 |
| СПОСОБ МИКРОИНКАПСУЛИРОВАНИЯ СТВОЛОВЫХ КЛЕТОК | 2016 |
|
RU2618435C1 |
| МАКРОГРАНУЛЫ АГАРОЗЫ SEAKEM GOLD, СОДЕРЖАЩИЕ СЕКРЕТОРНЫЕ КЛЕТКИ, И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2417090C2 |
| ЭЛЮИРУЮЩАЯ МАТРИЦА И ЕЕ ПРИМЕНЕНИЯ | 2013 |
|
RU2665359C2 |
| Способ создания клеточных трансплантатов для лечения сахарного диабета 1-го типа | 2020 |
|
RU2765913C1 |
Группа изобретений относится к медицине, в частности к эндокринологии, и описывает способ получения микрокапсул на основе гидрогеля, содержащих клетки Сертоли (SC), микрокапсулы, содержащие SC, и применение микрокапсул на основе гидрогеля, содержащих SC. Способ характеризуется тем, что получают гомогенную суспензию SC, чистота которой по клеточному составу составляет более 90%, в солевом растворе ультрачистого альгината натрия в концентрации от 1 до 5% мас./об., отсасывают суспензию со скоростью, составляющей от 10 до 60 мл/мин, и вводят суспензию в иглообразный элемент, получают с помощью генератора поток текучей среды, где указанная текучая среда представляет собой воздух, проводят экструзию суспензии внутри иглообразного элемента посредством выпуска потока текучей среды, расход которого составляет 3-7 литров/мин, в результате чего получают непрерывный поток микрокапель, имеющих одинаковые размеры, вводят микрокапли потока в водный раствор, содержащий двухвалентные катионы или поликатионные вещества, что приводит к гелеобразованию и получению микрокапсул, размер которых составляет 300-500 мкм. Микрокапсулы на основе гидрогеля, содержащие SC, применяют для предотвращения и/или лечения сахарного диабета 1 типа (СД Т1). 3 н. и 4 з.п. ф-лы, 9 ил.
1. Способ получения микрокапсул на основе гидрогеля, содержащих клетки Сертоли (SC), включающий следующие этапы:
a. получение гомогенной суспензии SC, чистота которой по клеточному составу составляет более 90%, в солевом растворе ультрачистого альгината натрия в концентрации от 1 до 5% мас./об.;
b. отсасывание суспензии со скоростью, составляющей от 10 до 60 мл/мин, и введение суспензии в иглообразный элемент;
c. получение с помощью генератора потока текучей среды, где указанная текучая среда представляет собой воздух, и указанный поток подвергают следующим воздействиям:
- снижению давления для создания перепада давления при переходе от течения к остановке потока, составляющего менее 0,3 бар;
- регулировке для получения высокой воспроизводимости перепада давления при переходе от течения к остановке потока и для получения линейной зависимости между количеством оборотов и получаемым потоком текучей среды; и
- регулировке и установке расхода выходящего потока в диапазоне от 0 до 10 нл/мин;
d. экструзию суспензии внутри иглообразного элемента посредством выпуска потока текучей среды, расход которого составляет 3-7 литров/мин, в результате чего получают непрерывный поток микрокапель, имеющих одинаковые размеры; и
e. введение микрокапель потока в водный раствор, содержащий двухвалентные катионы или поликатионные вещества, приводящее к гелеобразованию и получению микрокапсул, размер которых составляет 300-500 мкм.
2. Способ по п. 1, в котором в боковой стенке иглообразного элемента имеется точечное отверстие, и поток текучей среды вводят через это отверстие.
3. Способ по п. 1, в котором микрокапсулы получены из альгината натрия в концентрации 1-3% мас./об., содержание эндотоксинов в котором не превышает 20 EU/r и содержание белка составляет менее 0,4%.
4. Способ по п. 1, в котором микрокапсулы, получаемые при выполнении этапа е), подвергают промывке и/или последовательному дополнительному нанесению покрытия из натуральных и/или искусственных полимеров.
5. Микрокапсулы, содержащие SC, получаемые в соответствии со способом по любому из предшествующих пунктов.
6. Микрокапсулы по п. 5, содержащие по меньшей мере 20×106 SC.
7. Применение микрокапсул на основе гидрогеля, содержащих клетки Сертоли (SC), полученных способом по п. 1, в качестве единственного терапевтического средства для предотвращения и лечения сахарного диабета 1 типа (СД Т1).
| Luca G., Calvitti M | |||
| et.al | |||
| Encapsulation, in vitro characterization, and in vivo biocompatibility of Sertoli cells in alginate-based microcapsules | |||
| Tissue Eng | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| et.al | |||
| Testicular sertoli cells protect islet beta-cells from | |||
Авторы
Даты
2016-09-27—Публикация
2009-12-18—Подача