Перекрестные ссылки на родственные заявки
Настоящее изобретение заявляет приоритет Предварительной заявки на изобретение США №61/454289 от 18 марта 2011 года, которая включается в настоящее изобретение во всей своей полноте для любых целей.
Уровень техники
У большинства видов, включая человека, физиологическим глюкокортикоидом является кортизол (гидрокортизон). Глюкокортикоиды секретируют в ответ на действие АКТГ (кортикотропина), который демонстрирует как вариацию в соответствии с циркадным ритмом, так и повышение уровня в ответ на стресс и пищу. Уровни кортизола изменяются в пределах минут в ответ на многие физические и физиологические стрессы, включая травмы, хирургическое вмешательство, физические упражнения, тревожное состояние и депрессию. Кортизол представляет собой стероид и действует через связывание с внутриклеточным глюкокортикоидным рецептором (ГР). У человека глюкокортикоидные рецепторы представлены двумя формами: лигандосвязывающей ГР-альфа формой, состоящей из 777 аминокислот, и ГР-бета изоформой, которая отличается только пятнадцатью последними аминокислотами. Эти оба типа ГР имеют высокое сродство для своих специфических лигандов и, как считается, функционируют через одинаковые пути передачи сигнала.
Биологические эффекты кортизола, включая таковые, вызванные гиперкортизолемией, могут модулироваться на уровне ГР с применением модуляторов рецепторов, таких как агонисты, частичные агонисты и антагонисты. Несколько разных классов таких агентов способны блокировать физиологические эффекты связывания агонистов с ГР. Эти антагонисты включают соединения, которые при связывании с ГР блокируют способность агониста эффективно связываться и/или активировать ГР. Было показано, что один такой известный антагонист ГР, мифепристон, является эффективным анти-глюкокортикоидным агентом у человека (Bertagna (1984) J. Clin. Endocrinol. Metab. 59:25). Мифепристон связывается с ГР с высоким сродством с константой диссоциации (Kd), равной 10-9 М (Cadepond (1997) Annu. Rev. Med. 48:129).
Помимо кортизола, биологические эффекты других стероидов могут модулироваться на уровне ГР с применением модуляторов рецепторов, таких как агонисты, частичные агонисты и антагонисты. При введении субъектам, которые в этом нуждаются, стероиды могут обеспечивать как нужные терапевтические эффекты например, путем стимулирования трансрепрессии глюкокортикоидных рецепторов, так и отрицательные побочные эффекты, например, путем хронической трансактивацик глюкокортикоидных рецепторов. В данной области техники необходимы новые композиции и способы для модуляции глюкокортикоидных рецепторов. Удивительно, на настоящее изобретение удовлетворяет эти и другие потребности.
Раскрытие изобретения
В одном воплощении настоящее изобретение предоставляет соединение формулы I:

где пунктирная линия либо отсутствует, либо представляет собой связь. X представляет собой О или S. R1 представляет собой циклоалкил, гетероциклоалкил, арил или гетероарил, необязательно замещенный от 1 до 3 группами R1a. Каждая группа R1a представляет собой независимо Н, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкокси, C1-6алкил-OR1b, галоген, C1-6галоалкил, C1-6галоалкокси, -OR1b, -NR1bR1c, -C(O)R1b, -C(O)OR1b, -OC(O)R1b, -C(O)NR1bR1c, -NR1bC(O)R1c, -SO2R1b, -SO2NR1bR1c, циклоалкил, гетероциклоалкил, арил или гетероарил. R1b и R1c представляют собой каждая Н или C1-6алкил. R2 представляет собой Н, C1-6алкил, C1-6алкил-OR1b, C1-6алкил-NR1bR1c или C1-6алкилен-гетероциклоалкил. R3 представляет собой Н или C1-6алкил. Ar представляет собой арил, необязательно замещенный 1-4 группами R4. Каждая группа R4 представляет собой Н, C1-6алкил, C1-6алкокси, галоген, C1-6галоалкил или C1-6галоалкокси. L1 представляет собой связь или C1-6алкилен. Подстрочная буква n представляет собой целое число от 0 до 3. Соли и изомеры перечисленных здесь соединений также включены в настоящее изобретение.
Во втором воплощении настоящее изобретение предоставляет фармацевтическую композицию, включающую фармацевтически приемлемый наполнитель и соединение формулы I.
В третьем воплощении настоящее изобретение предоставляет способ лечения расстройства или состояния путем модулирования глюкокортикоидного рецептора, включающий введение субъекту, который нуждается в таком лечении, терапевтически эффективного количества соединения формулы I, тем самым обеспечивая лечение данного расстройства или состояния.
В четвертом воплощении настоящее изобретение предоставляет способ лечения расстройства или состояния с применением антагониста глюкокортикоидного рецептора, включающий введение субъекту, который нуждается в таком лечении, эффективного количества соединения формулы I.
Краткое описание чертежей
Фигура 1 показывает способ получения соединений настоящего изобретения.
Фигура 2 показывает дополнительный способ получения соединений настоящего изобретения.
Осуществление изобретения
I. Общие замечания
Настоящее изобретение предоставляет соединения, способные модулировать глюкокортикоидный рецептор (ГР), и, таким образом, обеспечивающие желаемые терапевтические эффекты. Соединения включают бензилпиримидиндион-циклогексил-фенилы. Настоящее изобретение также предоставляет способы лечения заболеваний и расстройств путем модулирования рецептора ГР соединениями настоящего изобретения.
II. Определения
Используемые здесь сокращения имеют свое обычное значение, принятое в областях химии и биологии.
Там где группы заместителей определены своими обычными химическими формулами, написанными слева направо, они равным образом включают химически идентичные заместители, которые будут получаться при написании структуры справа налево, например, -CH2O- представляет собой эквивалент -OCH2-.
В используемом здесь значении термин ″алкил″ обозначает линейный или разветвленный, насыщенный, алифатический радикал, имеющий указанное число атомов углерода. Например, C1-C6алкил включает, но ими не ограничивается, метил, этил, пропил, бутил, пентил, гексил, изопропил, изобутил, вторбутил, третбутил, и т.д.
В используемом здесь значении термин ″алкилен″ обозначает линейный или разветвленный алкилен с числом атомов углерода от 1 до 7, то есть, двухвалентный углеводородный радикал с числом атомов углерода от 1 до 7, например, линейный алкилен представляет собой двухвалентный радикал формулы -(CH2)n-, где n равно 1, 2, 3, 4, 5, 6 или 7. Предпочтительно алкилен представляет собой линейный алкилен с числом атомов углерода от 1 до 4, например, цепь метилена, этилена, пропилена или бутилена, или цепь метилена, этилена, пропилена или бутилена, однозамещенную C1-C3-алкилом (предпочтительно метилом) или дважды замещенную по одному и тому же или разным атомам углерода C1-C3-алкилом (предпочтительно метилом), с общим числом атомов углерода до и включая 7. Специалист в данной области техники должен понимать, что единственный атом углерода в алкилене может быть двухвалентным, как в -CH((CH2)nCH3)-, где n=0-5.
В используемом здесь значении термин ″алкенил″ обозначает либо линейный, либо разветвленный углеводород, содержащий от 2 до 6 атомов углерода, имеющий, по меньшей мере, одну двойную связь. Примеры алкенильных групп включают, но ими не ограничиваются: винил, пропенил, изопропенил, 1-бутенил, 2-бутенил, изобутенил, бутадиенил, 1-пентенил, 2-пентенил, изопентенил, 1,3-пентадиенил, 1,4-пентадиенил, 1-гексенил, 2-гексенил, 3-гексенил, 1,3-гексадиенил, 1,4-гексадиенил, 1,5-гексадиенил, 2,4-гексадиенил, или 1,3,5-гексатриенил. Алкенильные группы также могут иметь от 2 до 3, от 2 до 4, от 2 до 5, от 3 до 4, от 3 до 5, от 3 до 6, от 4 до 5, от 4 до 6 и от 5 до 6 атомов углерода. Алкенильные группы обычно являются одновалентными, но могут быть двухвалентными, как в случае, когда алкенильная группа связывает вместе два компонента.
В используемом здесь значении термин ″алкинил″ обозначает либо линейный, либо разветвленный углеводород, содержащий от 2 до 6 атомов углерода, имеющий, по меньшей мере, одну тройную связь. Примеры алкинильных групп включают, но ими не ограничиваются: ацетиленил, пропинил, 1-бутинил, 2-бутинил, изобутинил, втор-бутинил, бутадиинил, 1-пентинил, 2-пентинил, изопентинил, 1,3-пентадиинил, 1,4-пентадиинил, 1-гексинил, 2-гексинил, 3-гексинил, 1,3-гексадиинил, 1,4-гексадиинил, 1,5-гексадиинил, 2,4-гексадиинил, или 1,3,5-гексатриинил. Алкинильные группы также могут иметь от 2 до 3, от 2 до 4, от 2 до 5, от 3 до 4, от 3 до 5, от 3 до 6, от 4 до 5, от 4 до 6 и от 5 до 6 атомов углерода. Алкинильные группы обычно являются одновалентными, но могут быть двухвалентными, как в случае, когда алкинильная группа связывает вместе два компонента.
В используемом здесь значении термин ″алкокси″ обозначает алкильный радикал, как описано выше, который также имеет один кислородный заместитель, способный к ковалентному присоединению к другому углеводороду, например, метокси, этокси или t-бутокси группу.
В используемом здесь значении термин ″галоген″ сам по себе или как часть другого заместителя обозначает, если не указано по другому, атом фтора, хлора, брома или йода.
В используемом здесь значении термин ″галоалкил″ обозначает алкил, как определено выше, в котором некоторые или все атомы водорода заменены на атомы галогенов. Галоген (гало) предпочтительно представляет собой хлор или фтор, но может также представлять собой бром или йод. Например, галоалкил включает трифторметил, фторметил, 1,2,3,4,5-пентафтор-фенил и т.д. Термин ″перфтор″ определяется как соединение или радикал, который содержит, по меньшей мере, два доступных водорода замещенных на фтор. Например, перфторметан обозначает 1,1,1-трифторметил.
В используемом здесь значении термин ″галоалкокси″ обозначает алкокси, как определено выше, в котором некоторые или все атомы водорода заменены на атомы галогенов. ″Галоалкокси″ включает моногалоалкил(окси) и полигалоалкил(окси).
В используемом здесь значении термин ″алкиламин″ обозначает алкильные группы, как определено выше, содержащий одну или больше аминогрупп. Аминогруппы могут быть первичными, вторичными или третичными. Алкиламин может быть дополнительно замещенным гидрокси группой. Алкиламины, пригодные в настоящем изобретении, включают, но ими не ограничиваются: этиламин, пропиламин, изопропиламин, этилендиамин и этаноламин. Аминогруппа может связывать алкиламин с точкой присоединения к остальной части соединения, находиться в омега-положении алкильной группы, или связывать вместе, по меньшей мере, два атома углерода в алкильной группе. Специалист в данной области техники должен понимать, что другие алкиламины являются применимыми в настоящем изобретении.
В используемом здесь значении термин ″циклоалкил″ обозначает насыщенную или частично ненасыщенную, моноциклическую, слитую бициклическую или связанную полициклическую кольцевую структуру, содержащую от 3 до 12 атомов в кольце или указанное число атомов. Например, C3-C8циклоалкил включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Циклоалкил также включает норборнил и адамантил.
В используемом здесь значении термин ″гетероциклоалкил″ обозначает систему колец, имеющую от трех кольцевых членов до примерно 20 кольцевых членов и от 1 до примерно 5 гетероатомов, таких как N, О и S. Дополнительные гетероатомы также могут быть пригодны, включая, но ими не ограничиваясь, B, Al, Si и P. Гетероатомы также могут быть окислены, как, например, но ими не ограничиваясь, -S(O)- и -S(O)2-. Например, гетероцикл включает, но ими не ограничивается, тетрагидрофуранил, тетрагидротиофенил, морфолин, пирролидинил, пирролинил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, пиперидинил, индолинил, хинуклидинил и 1,4-диокса-8-аза-спиро[4.5]дец-8-ил.
В используемом здесь значении термин ″алкилен-гетероциклоалкил″ обозначает гетероциклоалкильную группу, как определено выше, которая присоединена к другой группе через алкилен. Гетероциклоалкил и группа, к которой гетероциклоалкил присоединен через алкилен, могут быть связаны с одним и тем же атомом или с разными атомами алкилена.
В используемом здесь значении термин ″арил″ обозначает, если не определено по-другому, полиненасыщенный, ароматический, углеводородный заместитель, который может представлять собой одно кольцо или множество колец (предпочтительно от 1 до 3 колец), которые конденсированы вместе или ковалентно связаны друг с другом. Примеры включают, но ими не ограничиваются: фенил, бифенил, нафтил и бензил.
В используемом здесь значении термин ″гетероарил″ обозначает арильные группы (или кольца), которые содержат от одного до четырех гетероатомов, выбираемых из N, О и S, где атомы азота и серы являются необязательно окисленными, и атом(ы) азота являются необязательно четвертичными. Гетероарильная группа может быть присоединена к остальной части молекулы через углерод или гетероатом. Неограничивающие примеры арильных и гетероарильных групп включают: фенил, 1-нафтил, 2-нафтил, 4-бифенил, 1-пирролил, 2-пирролил, 3-пирролил, 3-пиразолил, 2-имидазолил, 4-имидазолил, пиразинил, 2-оксазолил, 4-оксазолил, 2-фенил-4-оксазолил, 5-оксазолил, 3-изоксазолил, 4-изоксазолил, 5-изоксазолил, 2-тиазолил, 4-тиазолил, 5-тиазолил, 2-фурил, 3-фурил, 2-тиенил, 3-тиенил, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидил, 4-пиримидил, 5-бензотиазолил, пуринил, 2-бензимидазолил, 5-индолил, 1-изохинолил, 5-изохинолил, 2-хиноксалинил, 5-хиноксалинил, 3-хинолил и 6-хинолил. Заместители для каждой из указанных выше арильных и гетероарильных кольцевых систем выбираются из группы пригодных заместителей, описанных ниже.
Для краткости, термин ″арил″ при использовании в комбинации с другими терминами (например, арилокси, арилтиоокси, арилалкил) включает в себя как арильные, так и гетероарильные кольца, как определено выше. Таким образом, это означает, что термин ″арилалкил″ включает такие радикалы, в которых арильная группа присоединена к алкильной группе (например, бензил, фенэтил, пиридилметил и т.п.), включая такие алкильные группы, в которых атом углерода (например, метиленовая группа) заменен, например, на атом кислорода (например, феноксиметил, 2-пиридилоксиметил, 3-(1-нафтилокси)пропил и т.п.). Аналогично этому, это означает, что термин ″гетероарилалкил″ включает такие радикалы, в которых гетероарильная группа присоединена к алкильной группе.
Это означает, что каждый из указанных выше терминов (например, ″алкил,″ ″арил″ и ″гетероарил″) включает как замещенную, так и незамещенную формы указанного радикала. Примеры заместителей для каждого типа радикалов представлены ниже.
Заместителями для алкильных и гетероалкильных радикалов (включая таковые группы, часто обозначаемые как алкилен, алкенил, гетероалкилен, гетероалкенил, алкинил, циклоалкил, гетероциклоалкил, циклоалкенил и гетероциклоалкенил) могут быть одна или более из множества групп, выбираемых из, но ими не ограничиваясь: -OR′, =O, =NR′, =N-OR′, -NR′R″, -SR′, -галоген, -SiR′R″R′″, -OC(O)R′, -C(O)R′, -CO2R′, -CONR′R″, -OC(O)NR′R″, -NR″C(O)R′, -NR′-C(O)NR″R′″, -NR″C(O)2R′, -NR-C(NR′R″R′″)=NR″″, -NR-C(NR′R″)=NR′″, -S(O)R′, -S(O)2R′, -S(O)2NR′R″, -NR(SO2)R′, -CN и -NO2 в разном количестве от нуля до (2m′+1), где m′ это общее число атомов углерода в таком радикале. R′, R″, R′″ и R″″ каждый предпочтительно независимо друг от друга обозначают водород, замещенный или незамещенный гетероалкил, замещенный или незамещенный циклоалкил, замещенный или незамещенный гетероциклоалкил, замещенный или незамещенный арил (например, арил, замещенный 1-3 галогенами), замещенный или незамещенный алкил, алкокси или тиоалкокси группы, или арилалкильные группы. Когда соединение настоящего изобретения включает более чем одну R группу, например, каждая из R групп независимо выбирается как каждая из R′, R″, R′″ и R″″ групп, когда присутствует более чем одна из таких групп. Когда R′ и R″ присоединены к одному и тому же атому азота, они могут быть объединены с этим атомом азота с образованием 4-, 5-, 6-, или 7-членного кольца. Например, это означает, что -NR′R″ включает, но ими не ограничивается, 1-пирролидинил и 4-морфолинил. Из приведенного выше обсуждения заместителей специалист в данной области техники будет понимать, что термин ″алкил″ будет включать группы, включающие атомы углерода, связанные с группами, отличными от групп водорода, такими как галоалкил (например, -CF3 и -CH2CF3) и ацил (например, -C(O)CH3, -C(O)CF3, -C(O)CH2OCH3 и т.п.).
Подобно заместителям, описанным для алкильного радикала, заместители для арильных и гетероарильных групп являются разнообразными и выбираются, например, из: галогена, -OR′, -NR′R″, -SR′, -галогена, -SiR′R″R″′, -OC(O)R′, -C(O)R′, -CO2R′, -CONR′R″, -OC(O)NR′R″, -NR″C(O)R′, -NR′-C(O)NR″R″′, -NR″C(O)2R′, -NR-C(NR′R″R″′)=NR″″, -NR-C(NR′R″)=NR′″, -S(O)R′, -S(O)2R′, -S(O)2NR′R″, -NR(SO2)R′, -CN и -NO2, -R′, -N3, -CH(Ph)2, фтор(C1-C4)алкокси и фтор(C1-C4)алкила, в количестве от нуля до общего числа открытых валентностей ароматической кольцевой системы; и где R′, R″, R′″ и R″″ предпочтительно независимо выбираются из водорода, замещенного или незамещенного алкила, замещенного или незамещенного гетероалкила, замещенного или незамещенного циклоалкила, замещенного или незамещенного гетероциклоалкила, замещенного или незамещенного арила и замещенного или незамещенного гетероарила. Когда соединение настоящего изобретения включает более чем одну R группу, например, каждая из R групп независимо выбирается как каждая из R′, R″, R′″ и R″″ групп, когда присутствует более чем одна из таких групп.
Когда два заместителя являются ″необязательно связанными друг с другом с образованием кольца″, эти два заместителя ковалентно связаны вместе с атомом или атомами, к которым эти два заместителя присоединены, с образованием замещенного или незамещенного арильного, замещенного или незамещенного гетероарильного, замещенного или незамещенного циклоалкильного или замещенного или незамещенного гетероциклоалкильного кольца.
″Соль″ означает кислые или щелочные соли соединений, применяемых в способах настоящего изобретения. Иллюстративные примеры фармацевтически пригодных солей представляют собой соли минеральных кислот (соляная кислота, бромистоводородная кислота, фосфорная кислота и т.п.), соли органических кислот (уксусная кислоты, пропионовая кислоты, глутаминовая кислоты, лимонная кислота и т.п.), соли четвертичного аммония (метил йодид, этил йодид и т.п.). Необходимо понимать, что фармацевтически пригодные соли являются нетоксичными. Дополнительная информация о пригодных фармацевтически приемлемых солях может быть найдена в книге Remington′s Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, Pa., 1985, которая включается в настоящее изобретение путем отсылки.
″Гидрат″ обозначает соединение, которое находится в комплексе, по меньшей мере, с одной молекулой воды. Соединения настоящего изобретения могут находиться в комплексе с от 1 до 10 молекул воды.
″Изомеры″ обозначают соединения с одинаковой химической формулой, которые различаются по структуре.
″Таутомер″ обозначает один из двух или более структурных изомеров, которые существуют в равновесии и которые легко превращаются из одной формы в другую.
В используемом здесь значении фразы ″фармацевтически приемлемый наполнитель″ и ″фармацевтически приемлемый носитель″ обозначают вещество, которое помогает введению активного агента и его всасыванию субъектом и может быть включено в композиции настоящего изобретения, не вызывая значительного вредного токсикологического эффекта у пациента. Нелимитирующие примеры фармацевтически пригодных наполнителей включают: воду, NaCl, стандартные солевые растворы, раствор Рингера с лактатом, стандартную сахарозу, стандартную глюкозу, связующие вещества, наполнители, дезинтегрирующие агенты, любриканты, покрывающие агенты, подсластители, ароматизаторы и красители и т.п. Специалист в данной области техники будет понимать, что другие фармацевтические наполнители являются применимыми в настоящем изобретении.
В используемом здесь значении термины ″лечить″, ″вылечивание″, ″лечение″ обозначает любые признаки успешности лечения или облегчения при травме, патологии или состоянии, включая любой объективный или субъективный параметр, такой как облегчение, ремиссия, устранение симптомов или приведение травмы, патологии или состояния в более переносимое состояние для пациента, замедление скорости дегенерации или ухудшения, приведение конечной стадии дегенерации в менее вредное для здоровья состояние, улучшение физического или душевного состояния пациента. Устранение или облегчение симптомов может основываться на объективных или субъективных параметрах, включая результаты физических исследований, нейропсихиатрических обследований и/или психиатрической оценки.
В используемом здесь значении термины ″заболевание″ или ″состояние″ обозначают состояние организма или состояние здоровья пациента или субъекта, который получал лечение с применением модуляторов глюкокортикоидных рецепторов настоящего изобретения. Примеры заболеваний или состояний включают, но ими не ограничиваются: ожирение, гипертензию, депрессию, тревожность и синдром Кушинга.
В используемом здесь значении фраза ″глюкокортикоидный рецептор (ГР)″ обозначает семейство внутриклеточных рецепторов, которые специфически связывают кортизол и/или аналоги кортизола (например, дексаметазон). Глюкокортикоидный рецептор также обозначается как ″рецептор кортизола″. Термин включает изоформы ГР, рекомбинантный ГР и мутантный ГР.
В используемом здесь значении термин ″модулирование глюкокортикоидного рецептора″ обозначает способы для регулирования ответа глюкокортикоидного рецептора на глюкокортикоиды, антагонисты, агонисты и частичные агонисты глюкокортикоидов. Способы включают контактирование глюкокортикоидного рецептора с эффективным количеством либо антагониста, либо агониста или частичного агониста и определение изменения активности ГР.
В используемом здесь значении термин ″модулятор глюкокортикоидного рецептора″ обозначает любую композицию или соединение, которые модулируют связывание агониста глюкокортикоидного рецептора (ГР), такого как кортизол или аналогов кортизола, как синтетических, так и природных, с ГР. Модулирование может включать частичное или полное ингибирование (противодействие) связывания агониста ГР с ГР. Термин ″специфический антагонист глюкокортикоидного рецептора″ обозначает любую композицию или соединение, которые ингибируют любой биологический ответ, обусловленный связыванием агониста с ГР. Под словом ″специфический″ мы подразумеваем вещество, которое предпочтительно связывается с ГР, скорее, чем с другими ядерными рецепторами, такими как рецептор минералокортикоидов (MP) или рецептор прогестерона (ПР). Модуляторы ГР настоящего изобретения включают приведенные ниже соединения формулы I.
В используемом здесь значении термин ″противодействие (″антагонизм″) обозначает блокирование связывания агониста с молекулой рецептора или ингибирование сигнала, который вызывает комплекс агонист-рецептор. Антагонист рецептора блокирует или ослабляет опосредованные агонистом ответы.
В используемом здесь значении термины ″пациент″ или ″субъект″ обозначают живой организм, страдающий от или предрасположенный к состоянию, которое может вылечиваться путем введения фармацевтической композиции, предоставляемой настоящим изобретением. Неограничивающие примеры включают человека, других млекопитающих и других животных, не относящихся к млекопитающим.
В используемом здесь значении фраза ″терапевтически эффективное количество″ обозначает количество конъюгированного функционального агента или фармацевтической композиции, пригодной для лечения или облегчения установленной болезни или состояния, или для демонстрации заметного терапевтического или ингибиторного эффекта. Эффект может быть определен с помощью любого способа, известного в данной области техники.
Употребляемые здесь неопределенные артикли в отношении группы заместителей или ″группы-заместителя″ обозначают, по меньшей мере, один заместитель. Например, когда соединение замещено алкилом или арилом, данное соединение необязательно замещено, по меньшей мере, одним алкилом и/или, по меньшей мере, одним арилом, где каждый алкил и/или арил является необязательно разным. В другом примере, где соединение замещено группой-заместителем, соединение замещено, по меньшей мере, одной группой-заместителем, где каждая группа-заместитель является необязательно разной.
Описание соединений настоящего изобретения ограничено принципами химического связывания, известными специалистам в данной области техники. В соответствии с этим, когда группа может быть замещена одним или большим числом заместителей, такие заместители выбираются таким образом, чтобы соответствовать принципам химического связывания и давать соединения, которые не являются внутренне нестабильными и/или про которые известно среднему специалисту в данной области техники, что они вероятно будут нестабильны в обычных условиях, таких как водные растворы, нейтральные или физиологические условия.
III. Соединения
В некоторых воплощениях настоящее изобретение предоставляет соединение формулы I:

где пунктирная линия отсутствует или представляет собой связь. X представляет собой О или S. R1 представляет собой циклоалкил, гетероциклоалкил, арил или гетероарил, необязательно замещенный от 1 до 3 R1a группами. Каждая из R1a групп представляет собой независимо Н, C1-6алкил, C2-6алкенил, C2-6алкинил, C1-6алкокси, C1-6алкил-OR1b, галоген, C1-6галоалкил, C1-6галоалкокси, -OR1b, -NR1bR1c, -C(O)R1b, -C(O)OR1b, -OC(O)R1b, -C(O)NR1bR1c, -NR1bC(O)R1c, -SO2R1b, -SO2NR1bR1c, циклоалкил, гетероциклоалкил, арил или гетероарил. R1b и R1c группы представляют собой каждая H или C1-6алкил. R2 представляет собой H, C1-6алкил, C1-6алкил-OR1b, C1-6алкил-NR1bR1c или C1-6алкилен-гетероциклоалкил. R3 представляет собой Н или C1-6алкил. Ar представляет собой арил, необязательно замещенный 1-4 R4 группами. Каждая группа R4 представляет собой Н, C1-6алкил, C1-6алкокси, галоген, C1-6галоалкил или C1-6галоалкокси. L1 представляет собой связь или C1-6алкилен. Подстрочная буква n представляет собой целое число от 0 до 3. Также включенными являются соли и изомеры указанных здесь соединений.
В некоторых других воплощениях настоящее изобретение предоставляет соединение формулы Ia:

В некоторых воплощениях L1 представляет собой метилен. В других воплощениях Ar представляет собой фенил.
В некоторых воплощениях настоящее изобретение предоставляет соединение формулы Ib:
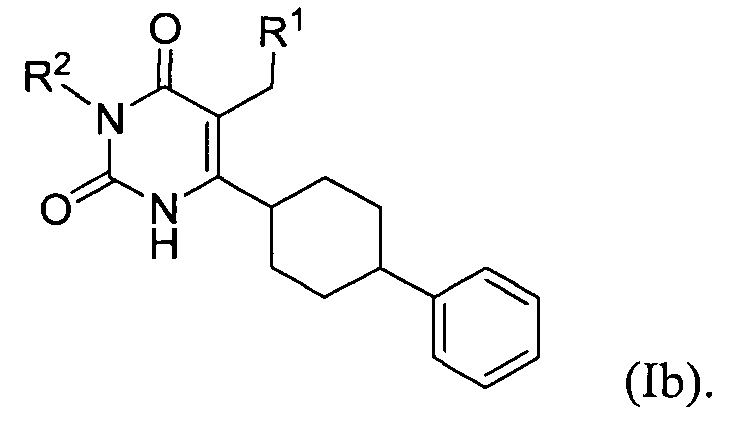
В некоторых других воплощениях настоящее изобретение предоставляет соединение формулы Ic:

В некоторых воплощениях настоящее изобретение предоставляет соединение, где R1 представляет собой арил или гетероарил. В других воплощениях R1 выбирается из группы, состоящей из фенила, пиридила, пиримидина и тиазола. В некоторых других воплощениях каждый R1a представляет собой независимо Н, C1-6алкил, C1-6алкокси, галоген, C1-6галоалкил, -NR1bR1c или -SO2R1b. Во все еще других воплощениях каждый R1a представляет собой C1-6галоалкил. В некоторых других воплощениях каждый R1a представляет собой независимо Н, Me, Et, -ОМе, F, Cl, -CF3, -NMe2 или -SO2Me. В других воплощениях каждый R1a представляет собой -CF3. В некоторых других воплощениях R2 представляет собой Н или C1-6алкил. В других воплощениях R2 представляет собой Н.
В некоторых воплощениях настоящее изобретение предоставляет соединение, выбираемое из следующей группы:
 ,
,  ,
,  ,
,
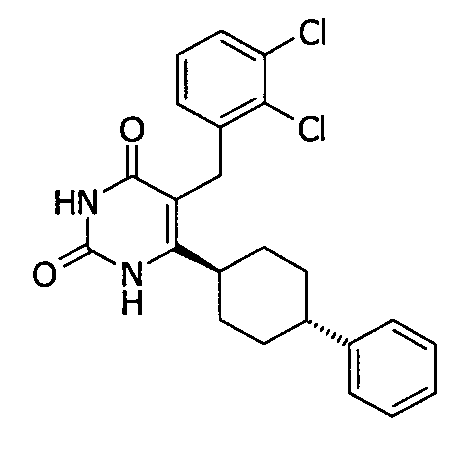 ,
,  ,
,  ,
,
 ,
, 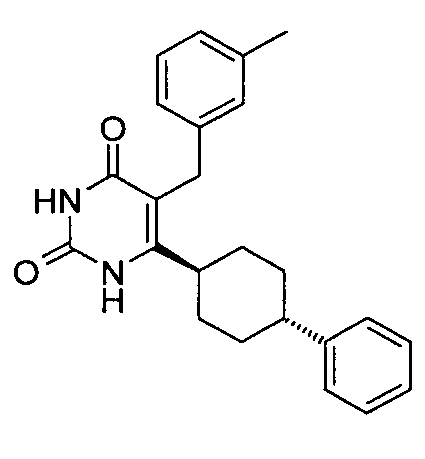 ,
,  ,
,
 ,
,  ,
, 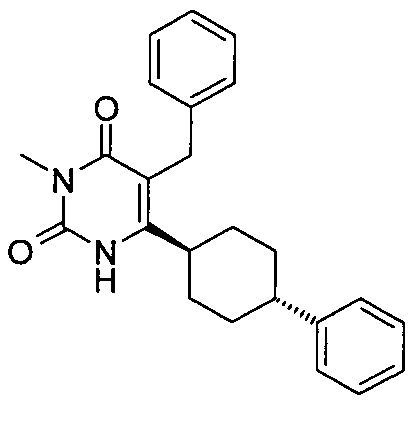 ,
,
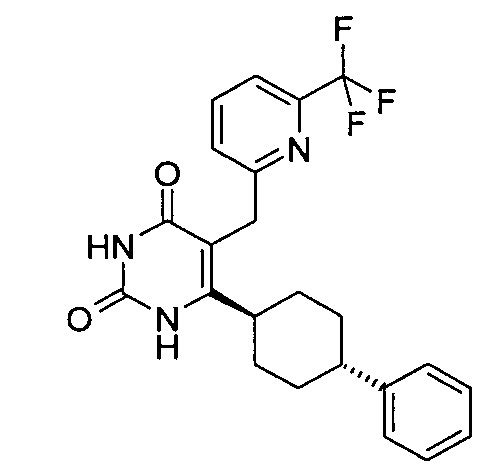 ,
, 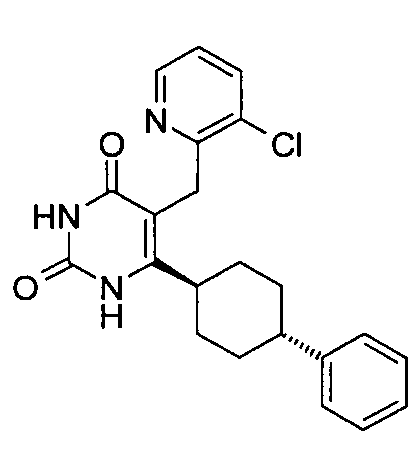 ,
, 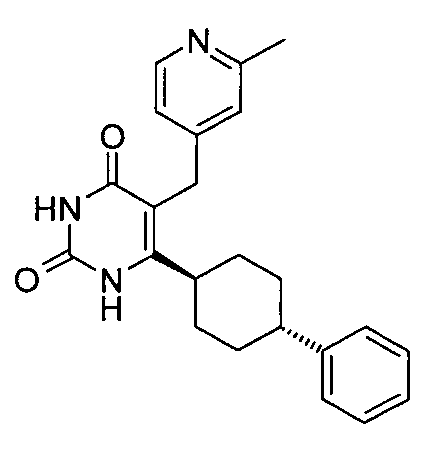 ,
,
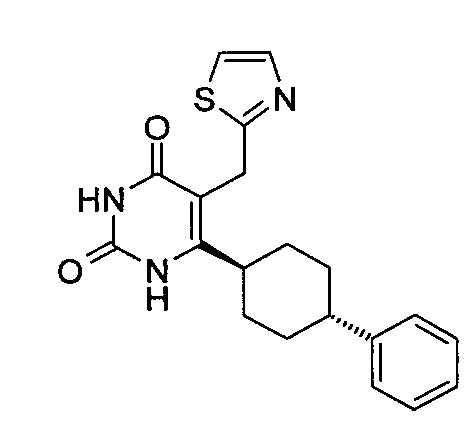 ,
,  ,
,  ,
,
 ,
,  ,
,  ,
,
 ,
, 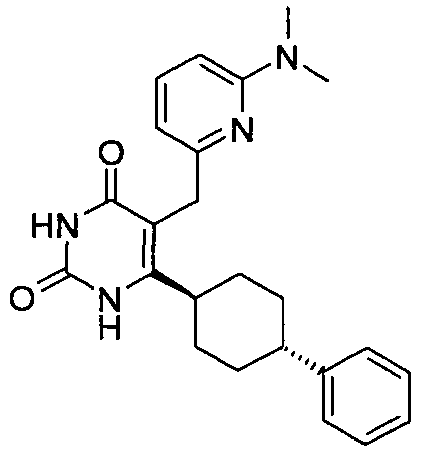 ,
,  ,
,
 ,
,  ,
, 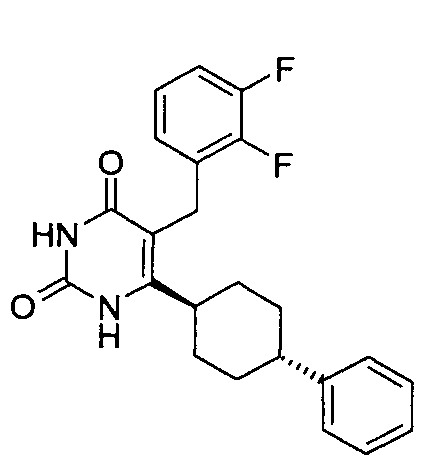 ,
,
 ,
,  ,
, 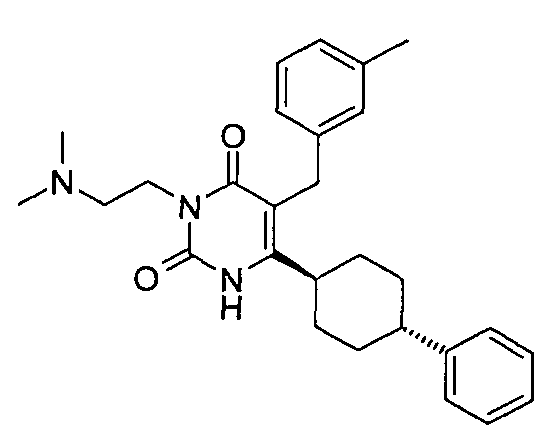 ,
,
 или
или 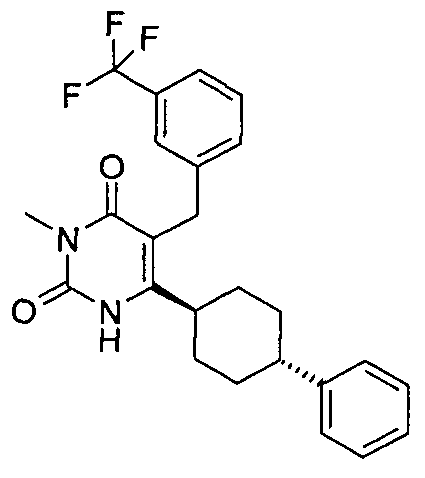 .
.
В некоторых других воплощениях настоящее изобретение предоставляет соединение формулы:

Соединения настоящего изобретения могут существовать в виде солей. Настоящее изобретение включает такие соли. Примеры пригодных солевых форм включают: гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты, например, (+)-тартраты, (-)-тартраты или их смеси, включая рацематные смеси, сукцинаты, бензоаты и соли с аминокислотами, такими как глутаминовая кислота. Эти соли могут быть получены способами, известными в данной области техники. Также включенными являются соли присоединения основания, такие как соли натрия, калия, кальция, аммония, органических аминов или магния или подобные им соли. Когда соединения настоящего изобретения содержат относительно щелочные функциональные группы, могут быть получены соли присоединения кислоты путем контактирования нейтральной формы таких соединений с достаточным количеством желаемой кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры пригодных солей присоединения кислоты включают таковые, получаемые с неорганическими кислотами, такими как соляная, бромистоводородная, азотная, угольная, моноводородугольная, фосфорная, моноводородфосфорная, диводородфосфорная, серная, моноводородсерная, йодистоводородная или фосфористая кислоты и тому подобные, а также соли, получаемые с органическими кислотами, такими как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая (субериновая) фумаровая, молочная, миндальная, фталевая, бензосульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая и тому подобные. Также включены соли аминокислот, такие как аргинаты и тому подобные, и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и тому подобные. Определенные специфические соединения настоящего изобретения содержат как щелочные, так и кислые функциональные группы, что позволяет переводить эти соединения либо в соли присоединения основания, либо в соли присоединения кислоты.
Другие соли включают кислые или основные соли соединений, применяемых в способах настоящего изобретения. Иллюстративные примеры фармацевтически приемлемых солей представляют собой соли минеральных кислот (соляная кислота, бромистоводородная кислота, фосфорная кислота и т.п.), соли органических кислот (уксусная кислота, пропионовая кислота, глутаминовая кислота, лимонная кислота и т.п.) и соли четвертичного аммония (метил йодид, этил йодид и т.п.). Необходимо понимать, что фармацевтически приемлемые соли являются нетоксичными. Дополнительная информация о пригодных фармацевтически приемлемых солях может быть найдена в книге Remington′s Pharmaceutical Sciences, 17 th ed., Mack Publishing Company, Easton, Pa., 1985, которая включается в настоящее изобретение путем отсылки.
Фармацевтически приемлемые соли включают соли активных соединений, которые получают с относительно нетоксичными кислотами или щелочами, в зависимости от конкретных заместителей, имеющихся в описанных здесь соединениях. Когда соединения настоящего изобретения содержат относительно кислые функциональные группы, соли присоединения основания могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством желаемой щелочи, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения основания включают: соли натрия, калия, кальция, аммония, органических аминов или магния или подобные им соли. Когда соединения настоящего изобретения содержат относительно щелочные функциональные группы, соли присоединения кислоты могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством желаемой кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей присоединения кислоты включают таковые, получаемые с неорганическими кислотами, такими как соляная, бромистоводородная, азотная, угольная, моноводородугольная, фосфорная, моноводородфосфорная, диводородфосфорная, серная, моноводородсерная, йодистоводородная или фосфористая кислоты и тому подобные, а также соли, получаемые с относительно нетоксичными органическими кислотами, такими как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая (субериновая) фумаровая, молочная, миндальная, фталевая, бензосульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая и тому подобные. Также включены соли аминокислот, такие как аргинаты и тому подобные, и соли органических кислот, таких как глюкуроновая или галактуроновая кислоты и тому подобные (смотри, например, Berge et al, ″Pharmaceutical Salts″, Journal of Pharmaceutical Science, 1977, 66, 1-19). Определенные специфические соединения настоящего изобретения содержат как щелочные, так и кислые функциональные группы, что позволяет переводить эти соединения либо в соли присоединения основания, либо в соли присоединения кислоты.
Нейтральные формы соединений предпочтительно регенерируются путем контактирования соли со щелочью или кислотой и выделения исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях.
Определенные соединения настоящего изобретения могут существовать как в несольватированных формах, так и в сольватированных формах, включая гидратированные формы. Как правило, сольватированные формы являются эквивалентными несольватированным формам и являются включенными в рамки настоящего изобретения. Определенные соединения настоящего изобретения могут существовать в разных кристаллических или аморфных формах. Как правило, все физические формы являются эквивалентными для применения, предполагаемого в настоящем изобретении, и являются включенными в рамки настоящего изобретения.
Определенные соединения настоящего изобретения включают: асимметрические атомы углерода (оптические центры) или двойные связи; энантиомеры, рацематы, диастереомеры, таутомеры, геометрические изомеры, стереоизомерные формы, которые могут быть определены в терминах абсолютной стереохимии как (R)- или (S)-, или как (D)- или (L)- для аминокислот, и индивидуальные изомеры являются включенными в рамки настоящего изобретения. Соединения настоящего изобретения не включают таковые, которые, как известно в данной области техники, будут слишком нестабильными в процессе синтеза и/или очистки. Это означает, что настоящее изобретение включает соединения в рацематных и оптически чистых формах. Оптически активные (R)- и (S)-, или (D)- и (L)-изомеры могут быть получены с использованием хиральных компонентов для синтеза или хиральных реагентов, или разделены с использованием стандартных способов.
Изомеры включают соединения, содержащие одинаковое количество атомов разных видов и, следовательно, имеющие одинаковый молекулярный вес, но различающиеся по структурной организации или конфигурации атомов.
Специалисту в данной области техники должно быть понятно, что определенные соединения настоящего изобретения могут существовать в таутомерных формах, все такие таутомерные формы соединений включены в рамки настоящего изобретения. Таутомером называется один из двух или более структурных изомеров, которые существуют в равновесии и которые легко превращаются из одной изомерной формы в другую.
Если не указано по-другому, предполагается, что приведенные здесь структуры также включают все стереохимические формы структуры, то есть R и S конфигурации для каждого асимметрического центра. Таким образом, как единственные стереохимические изомеры, так и энантиомерные и диастереомерные смеси настоящих соединений являются включенными в рамки настоящего изобретения.
Если не указано по-другому, соединения настоящего изобретения могут также содержать неприродные пропорции атомных изотопов одного или более атомов, которые входят в такие соединения. Например, соединения настоящего изобретения могут быть радиоактивно мечеными радиоактивными изотопами, такими, как, например, дейтерий (2H), тритий (3H), йод-125 (125I), углерод-13 (13C) или углерод-14 (14C). Все изотопные варианты соединений настоящего изобретения, как радиоактивные, так и нерадиоактивные, являются включенными в рамки настоящего изобретения.
В дополнения к солевым формам настоящее изобретение предоставляет соединения, которые находятся в форме пролекарства. Пролекарства описанных здесь соединений представляют собой такие соединения, которые легко подвергаются химическим изменениям в физиологических условиях, превращаясь в соединения настоящего изобретения. Кроме того, пролекарства могут превращаться в соединения настоящего изобретения химическими или биохимическими методами в условиях ex vivo. Например, пролекарства могут медленно превращаться в соединения настоящего изобретения при помещении в трансдермальный трансплантат вместе с подходящим ферментативным или химическим реагентом.
Соединения настоящего изобретения могут быть получены разными способами, известными в данной области техники. Например, соединения могут быть получены, как показано на фигуре 1. На фигуре I хлор-пиримидиндионы 1 (описаны в WO 06/014394 и включены в настоящее изобретение) реагируют с 4-фенилциклогекс-1-енилборонатным эфиром в присутствии катализатора Pd для получения циклогексенилпиримидиндионов 2. Следующая затем каталитическая гидрогенизация дает цис/транс-смесь, из которой желаемый трансизомер 3 может быть получен с помощью стандартных методов разделения, например, с помощью колоночной хроматографии.
Соединение 3 может быть получено путем стереоспецифического синтеза, описанного в фигуре 2. Коммерчески доступная транс-4-(4-хлорфенил)-циклогексанкарбоновая кислота (4) гидрогенизируется в присутствии палладия на углеродном катализаторе в спирте, предпочтительно в этаноле, для получения транс-4-фенил циклогексанкарбоновой кислоты (5). Кислота 5 превращается в кетоэфир 7 посредством обработки кислотой Мелдрума (6) в присутствии 4-диметиламинопиридина и дициклогексилкарбодиимида с последующим нагреванием в этаноле. Алкилирование кетоэфира 7 может быть проведено посредством обработки щелочью (основанием), такой как NaH, и бензилгалидом 8 в растворителе, таком как тетрагидрофуран, с получением бензилированного кетоэфира 11. Альтернативно этому, кетоэфир 7 может быть конденсирован с бензальдегидом 9 путем нагревания в толуоле в присутствии уксусной кислоты и пиперидина с получением олефина 10. Каталитическая гидрогенизация 10 дает бензилированный кетоэфир 11. Обработка 11 тиомочевиной в этаноле в присутствии этоксида натрия дает 2-тиохо-2,3-дигидро-1H-пиримидин-4-оны 12, которые далее превращаются в искомые соединения 3 кислотным гидролизом, предпочтительно с водной хлоруксусной кислотой в диоксане.
Соединения, в которых группы R2 представляют собой гетероарильную группу, получают сходным способом с использованием гетероарилметилгалида или гетероарилальдегида вместо бензилгалида (8) или бензальдегида (9) на фигуре 2.
Соединения, в которых группы R1 представляют собой алкильные или замещенные алкильные группы, могут быть получены обработкой 3 щелочью, такой как гидрид натрия, и требуемым алкилирующим агентом, предпочтительно алкилгалидом или замещенным алкилгалидом.
IV. Фармацевтические композиции
В некоторых воплощениях настоящее изобретение предоставляет фармацевтическую композицию, включающую фармацевтически приемлемый наполнитель и соединение формулы I.
Соединения настоящего изобретения могут изготавливаться и вводиться в большом количестве пероральных, парентеральных и топических лекарственных форм. Пероральные препараты включают: таблетки, пилюли, порошки, драже, капсулы, жидкости, сосательные таблетки, гели, сиропы, густые суспензии, суспензии и т.д., пригодные для проглатывания пациентом. Соединения настоящего изобретения также могут вводиться путем инъекции, например, внутривенно, внутримышечно, внутрикожно, подкожно, интродуоденально или внутрибрюшинно. Описанные здесь соединения могут вводиться также путем ингаляции, например, внутриназально. Кроме того, соединения настоящего изобретения могут вводиться трансдермально. Модуляторы ГР настоящего изобретения могут также вводиться внутрь глаз, интравагинально и интраректально с помощью суппозиториев, вдувания, порошков и аэрозольных лекарственных форм (в качестве примеров ингаляций стероидов, смотри: Rohatagi, J. Clin. Pharmacol. 35: 1187-1193, 1995; Tjwa, Ann. Allergy Asthma Immunol. 75:107-111, 1995). В соответствии с этим настоящее изобретение также предоставляет фармацевтические композиции, включающие фармацевтически приемлемый носитель или эксципиент и либо соединение формулы (I), либо фармацевтически приемлемую соль соединения формулы (I).
Для получения фармацевтических композиций из соединений настоящего изобретения фармацевтически приемлемые носители могут быть либо твердыми, либо жидкими. Твердые формы композиций включают: порошки, таблетки, пилюли, капсулы, крахмальные облатки, суппозитории и дисперсные гранулы. Твердым носителем может быть одно или более веществ, которые также могут выступать в качестве растворителей, ароматизирующих агентов, связующих веществ, консервантов, дезинтегрирующих таблетки агентов или материала капсул. Детали способов приготовления и введения композиций хорошо описаны в научной и патентной литературе, смотри, например, последнее издание книги Remington′s Pharmaceutical Sciences, Maack Publishing Co, Easton PA (″Remington′s″).
В порошках носитель представляет собой хорошо измельченную твердую форму, которая находится в смеси с хорошо измельченным активным компонентом. В таблетках активный компонент смешан с носителем, обладающим необходимыми связывающими свойствами, в подходящих пропорциях и в компактном виде желаемого размера и формы.
Порошки и таблетки предпочтительно содержат от 5% или 10% до 70% активного соединения. Пригодными носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатин, трагакант, метилцеллюлоза, карбоксиметилцеллюлоза натрия, легкоплавкий воск, масло какао и тому подобное. Термин ″препарат″ предназначен для обозначения лекарственной формы активного соединения с инкапсулирующим материалом в качестве носителя, образующего капсулу, в которой активный компонент с другими наполнителями или без них окружен носителем, который, таким образом, находится с ним в ассоциации. Подобным образом этот термин обозначает крахмальные облатки и леденцы. Таблетки, порошки, капсулы, пилюли, крахмальные облатки и леденцы могут применяться в виде твердых лекарственных форм, пригодных для перорального введения.
Пригодными твердыми эксципиентами являются углеводородные или белковые наполнители, включая, но ими не ограничиваясь, сахара, включая лактозу, сахарозу, маннитол или сорбитол, крахмал из кукурузы, пшеницы, риса, картофеля или других растений; целлюлоза, такая как метилцеллюлоза, гидроксипропилметилцеллюлоза, или карбоксиметилцеллюлоза натрия; и камеди, включая гуммиарабик и трагакант; а также белки, такие как желатин и коллаген. Если желательно, могут быть добавлены дезинтегрирующие или солюбилизирующие агенты, такие как сшитый поливинилпирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
Покрытия драже изготавливаются из подходящих покрывающих агентов, таких как концентрированные сахарные растворы, которые могут также содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. К покрытиям таблеток или драже могут добавляться красители или пигменты для обеспечения идентификации продукта или для обозначения количества активного соединения (то есть дозировки). Фармацевтические композиции настоящего изобретения могут также применяться для перорального введения, например, заполненные капсулы, сделанные из желатина, а также мягкие, закрытые капсулы, сделанные из желатина с покрытием из глицерина или сорбитола. Заполненные капсулы могут содержать модулятор ГР, смешанный с наполнителем или связующими агентами, такими как лактоза или крахмалы, смазывающими агентами, такими как тальк или стеарат магния, и необязательно стабилизаторами. В мягких капсулах соединения-модуляторы ГР могут быть растворены или суспендированы в подходящих жидкостях, таких как нелетучие жирные масла, жидкий парафин или жидкий полиэтиленгликоль с добавлением или без добавления стабилизаторов.
Для приготовления суппозиториев легкоплавкий воск, такой как смесь глицеридов жирных кислот или масло какао, сначала расплавляется и в нем гомогенно диспергируется активный компонент, например, перемешиванием. Расплавленная гомогенная смесь затем заливается в формы подходящего размера, где оставляется остывать до твердого состояния.
Жидкие формы композиций включают растворы, суспензии и эмульсии, например, в воде или растворах вода/пропиленгликоль. Для парентеральной инъекции жидкие композиции могут готовиться в виде раствора - водного раствора полиэтиленгликоля.
Водные растворы, пригодные для перорального введения, могут готовиться путем растворения активного компонента в воде с добавлением пригодных красителей, ароматизаторов, стабилизаторов и загустителей, как это необходимо. Водные суспензии, пригодные для перорального введения, могут готовиться путем диспергирования тонко измельченного активного компонента в воде с вязким материалом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакант и гуммиарабик, и диспергирующими или смачивающими агентами, такими как природные фосфатиды (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с частичным эфиром, полученным из жирной кислоты и гекситола (например, полиоксиэтиленсорбитола моноолеат), или продукт конденсации этиленоксида с частичным эфиром, полученным из жирной кислоты и гекситолангидрида (например, полиоксиэтиленсорбитана моноолеат). Водные суспензии могут также содержать один или более консервантов, таких как этил- или н-пропил-n-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза, аспартам или сахарин. Композиции могут быть доведены до нужной осмолярности.
Также включенным в настоящее изобретение являются твердые композиции, которые предназначены для превращения непосредственно перед применением в жидкие формы композиций для перорального введения. Такие жидкие формы включают растворы, суспензии и эмульсии. Эти композиции могут содержать в дополнение к активному компоненту красители, ароматизаторы, стабилизаторы, буферы, искусственные и натуральные подсластители, диспергирующие агенты, загустители, солюбилизирующие агенты и тому подобное.
Масляные суспензии могут быть приготовлены путем суспендирования модулятора ГР в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин, или их смеси. Масляные суспензии могут содержать загустители, такие как пчелиный воск, твердый парафин или цетиловый спирт. Также могут добавляться подсластители для получения приятной на вкус пероральной композиции, такие как глицерин, сорбитол или сахароза. Эти композиции могут консервироваться путем добавления антиоксиданта, такого как аскорбиновая кислота. Для примера пригодного для инъекции масляного носителя, смотри: Minto, J. Pharmacol. Exp. Ther. 281: 93-102, 1997. Фармацевтические композиции настоящего изобретения могут также готовиться в форме масляно-водных эмульсий. Масляной фазой может быть растительное или минеральное масло, описанное выше, или их смесь. Подходящие эмульгирующие агенты включают природные камеди, такие как гуммиарабик и трагакант, природные фосфатиды, такие, как лецитин из соевых бобов, эфиры или частичные эфиры, полученные из жирных кислот и гекситолангидридов, такие как сорбитана моноолеат, и продукты конденсации этих частичных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитана моноолеат. Эмульсия также может содержать подсластители и ароматизаторы, как, например, в композициях в виде сиропов и эликсиров. Такие композиции могут также содержать успокоительное (снижающее раздражение) средство, консервант или краситель.
Модуляторы ГР настоящего изобретения могут вводиться трансдермально путем местного введения в таких лекарственных формах, как аппликаторные пластыри, растворы, суспензии, эмульсии, гели, кремы, мази, пасты, желе, лекарства в вязких носителях, порошки и аэрозоли.
Модуляторы ГР и композиции настоящего изобретения могут также вводиться в виде микросфер для медленного высвобождения в организме. Например, микросферы могут вводиться путем внутрикожной инъекции содержащих лекарство микросфер, которые медленно высвобождают лекарство под кожей (смотри: Rao, J. Biomater Sci. Polym. Ed. 1: 623-645, 1995; как биодеградируемые лекарственные формы в виде геля для инъекций (смотри, например, Gao Pharm. Res. 12:857-863, 1995); или как микросферы для перорального введения (смотри, например, Eyles, J. Pharm. Pharmacol. 49: 669-674, 1997). Как трансдермальное, так и внутрикожное введение обеспечивает постоянную доставку лекарства в течение недель или месяцев.
Фармацевтические композиции с модулятором ГР настоящего изобретения могут предоставляться в виде соли и могут быть получены с разными кислотами, включая, но ими не ограничиваясь, соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли обычно более растворимы в водных или других протонирующих растворителях, чем соответствующие формы в виде свободного основания. В других случаях композиция может быть в виде лиофилизированного порошка в 1-50 мМ гистидине, 0,1-2% сахарозе, 2-7% маннитоле с диапазоном pH от 4,5 до 5,5, что достигается смешиванием с буфером перед применением.
В другом воплощении композиции с модулятором ГР настоящего изобретения могут вводиться с помощью липосом, которые сливаются с клеточной мембраной или поглощаются путем эндоцитоза, то есть, с применением лигандов, присоединенных к липосоме, или присоединенных непосредственно к олигонуклеотиду, который связывается с белковыми рецепторами поверхностной мембраны клетки и индуцирует эндоцитоз. С применением липосом, особенно когда липосома несет на поверхности лиганды, специфичные к клеткам-мишеням, или каким-либо другим способом она предпочтительно нацелена на определенный орган, можно сфокусировать доставку модулятора ГР в клетки-мишени in vivo. (Смотри, например, Al-Muhammed, J. Microencapsul. 13: 293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6: 698-708, 1995; Ostro, Am. J. Hosp. Pharm. 46: 1576-1587, 1989).
Фармацевтическая композиция предпочтительно готовится в форме стандартных доз. В такой форме композиция разделяется на стандартные дозы, содержащие необходимые количества активного компонента. Стандартные дозы могут упаковываться в пакеты, содержащие определенные количества композиции, например, в виде пакетированных таблеток, капсул и порошков во флаконах или ампулах. Стандартная дозированная форма также может представлять собой капсулу, таблетку, крахмальную облатку или леденец сам по себе, или в одной упаковке может содержаться определенное количество любых таких форм.
Количество активного компонента в стандартной дозе композиции может варьировать или составлять от 0,1 до 10000 мг, более типично от 1,0 до 1000 мг, наиболее типично от 10 до 500 мг, согласно конкретному назначению и силе активного компонента. Композиция может, если это желательно, также содержать и другие терапевтические агенты.
Схема приема также должна учитывать фармакокинетические параметры, хорошо известные в данной области техники, то есть скорость всасывания, биодоступность, метаболизм, клиренс и т.п.(смотри, например, Hidalgo-Aragones (1996) J. Steroid Biochem. Mol. Biol. 58: 611-617; Groning (1996) Pharmazie 51: 337-341; Fotherby (1996) Contraception 54: 59-69; Johnson (1995) J. Pharm. Sci. 84: 1144-1146; Rohatagi (1995) Pharmazie 50: 610-613; Brophy (1983) Eur. J. Clin. Pharmacol. 24: 103-108; последнее издание Remington′s, supra). Уровень техники позволяет клиницисту определить схему приема для каждого индивидуального пациента, модулятора ГР и требующего лечения заболевания или состояния.
Может назначаться однократное или многократное введение композиций с модулятором ГР в зависимости от требуемой дозировки и частоты введения и переносимости лекарства пациентом. Композиции должны предоставлять достаточное количество активного агента для эффективного лечения болезненного состояния. Так, в одном воплощении фармацевтические композиции для перорального введения модулятора ГР имеют дневную дозу от примерно 0,5 до примерно 20 мг/кг веса тела в день. В альтернативном воплощении применяются дозировки от примерно 1 мг до примерно 4 мг на кг веса тела пациента в день. Могут применяться более низкие дозировки, в частности, когда лекарство вводится в анатомически изолированный участок, такой как пространство спинномозговой жидкости (СМЖ), в отличие от перорального введения, введения в кровоток, в полость тела или в полость органа. При местном введении могут применяться значительно более высокие дозы. Конкретные способы для приготовления композиций с модулятором ГР для парентерального введения будут хорошо известны или будут очевидны для специалистов в данной области техники и описаны более детально в таких публикациях, как Remington′s, supra. Смотри также: Nieman, в ″Receptor Mediated Antisteroid Action,″ Agarwal, et al., eds., De Gruyter, New York (1987).
Описанные здесь соединения могут применяться в комбинации друг с другом, с другими активными агентами, о которых известно, что они являются пригодными для модулирования активности глюкокортикоидного рецептора, или со вспомогательными агентами, которые могут быть неэффективными сами по себе, но могут повышать эффективность активного агента.
В некоторых воплощениях совместное введение включает введение одного активного агента в пределах 0,5, 1, 2, 4, 6, 8, 10, 12, 16, 20 или 24 часов после введения второго активного агента. Совместное введение включает введение двух активных агентов одновременно, примерно одновременно (например, с интервалом в пределах примерно 1, 5, 10, 15, 20 или 30 минут между введением каждого из них), или последовательно в любом порядке. В некоторых воплощениях совместное введение может заключаться в совместном приготовлении, то есть приготовлении одной фармацевтической композиции, включающей оба активных агента. В других воплощениях активные агенты могут готовиться по отдельности. В другом воплощении активные и/или вспомогательные агенты могут быть связаны или конъюгированы друг с другом.
После приготовления фармацевтической композиции, включающей модулятор ГР настоящего изобретения в приемлемом носителе, она может быть помещена в подходящий контейнер и снабжена этикеткой, указывающей, для лечения какого конкретного состояния она предназначена. Для введения модуляторов ГР такая этикетка должна содержать, например, инструкцию относительно количества, частоты и способа введения.
Фармацевтические композиции настоящего изобретения могут предоставляться в виде соли и могут быть получены с разными кислотами, включая, но ими не ограничиваясь, соляную, серную, уксусную, молочную, винную, яблочную, янтарную и т.д. Соли обычно более растворимы в водных или других протонирующих растворителях, чем соответствующие формы в виде свободного основания. В других случаях композиция может быть в виде лиофилизированного порошка в 1-50 мМ гистидине, 0,1-2% сахарозе, 2-7% маннитоле с диапазоном pH от 4,5 до 5,5, что достигается смешиванием с буфером перед применением.
В другом воплощении композиции настоящего изобретения являются пригодными для парентерального введения, такого как внутривенное (в/в) введение или введение в полость тела или полость органа. Композиции для введения обычно будут включать раствор композиций настоящего изобретения, разведенный в фармацевтически приемлемом носителе. Приемлемые носители и растворители, которые могут применяться, включают воду и раствор Рингера, изотонический раствор хлористого натрия. Кроме того, обычно могут применяться стерильные жирные (нелетучие) масла в качестве растворителя или среды для суспендирования. Для этой цели могут применяться любые чистые жирные масла, включая синтетические моно- и диглицериды. Кроме того, в композиции для инъекций сходным образом могут применяться жирные кислоты, такие как олеиновая кислота. Эти растворы являются стерильными и обычно свободны от нежелательных веществ. Эти композиции могут стерилизоваться обычными, хорошо известными способами стерилизации. Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для соответствия физиологическим условиям, такие как регулирующие pH и буферные агенты, регулирующие токсичность агенты, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобное. Концентрация композиций настоящего изобретения в препаратах может широко варьировать, и может подбираться на основе, в первую очередь, объема жидкости, вязкости, веса тела и т.п. в соответствии с конкретным способом введения, подобранным с учетом нужд пациента. Для в/в введения лекарственная форма может представлять собой стерильную композицию для инъекций, такую как стерильная водная или масляная суспензия для инъекций. Эта суспензия может быть приготовлена согласно имеющемуся уровню техники с применением подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильная композиция для инъекций может также представлять собой стерильный раствор или суспензию для инъекций в нетоксичном пригодном для парентерального введения разбавителе или растворителе, таком как раствор 1,3-бутандиола.
В другом воплощении лекарственные формы композиций настоящего изобретения могут доставляться с применением липосом, которые сливаются с клеточной мембраной или поглощаются путем эндоцитоза, то есть с применением лигандов, присоединенных к липосоме, или присоединенных непосредственно к олигонуклеотиду, который связывается с белковыми рецепторами поверхностной мембраны клетки и индуцирует эндоцитоз. С применением липосом, особенно когда липосома несет на поверхности лиганды, специфичные к клеткам-мишеням, или она каким-либо другим способом предпочтительно нацелена на определенный орган, можно сфокусировать доставку модулятора ГР в клетки-мишени in vivo. (Смотри, например, Al-Muhammed, J. Microencapsul. 13: 293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6: 698-708, 1995; Ostro, Am. J. Hosp. Pharm. 46: 1576-1587, 1989).
V. Способ лечения посредством модуляции глюкокортикоидных рецепторов
В некоторых воплощениях настоящее изобретение предоставляет способ лечения заболевания или состояния посредством модулирования глюкокортикоидного рецептора, включающий введение субъекту, который нуждается в таком лечении, терапевтически эффективного количества соединения формулы I.
В некоторых других воплощениях настоящее изобретение предоставляет способ лечения заболевания или состояния через блокирование глюкокортикоидного рецептора, включающий введение субъекту, который нуждается в таком лечении, эффективного количества соединения формулы I.
В другом воплощении настоящее изобретение предоставляет способы модулирования активности глюкокортикоидного рецептора с применением описанных здесь способов. В иллюстративном воплощении способ включает контактирование ГР с эффективным количеством соединения настоящего изобретения, такого как соединение формулы I, и определение изменения активности ГР.
В иллюстративном воплощении модулятор ГР представляет собой антагонист активности ГР (также называемый здесь ″антагонист глюкокортикоидного рецептора″). Термин ″антагонист глюкокортикоидного рецептора″ в используемом здесь значении обозначает любую композицию или соединение, которые частично или полностью ингибируют (блокируют) связывание агониста глюкокортикоидного рецептора (например, кортизола или синтетического или природного аналога кортизола) с ГР, ингибируя, таким образом, любой биологический ответ, обусловленный связыванием агониста с ГР.
В родственном воплощении модулятор ГР представляет собой специфический антагонист глюкокортикоидного рецептора. В используемом здесь значении термин ″специфический антагонист глюкокортикоидного рецептора″ обозначает композицию или соединение, которые ингибируют любой биологический ответ, обусловленный связыванием агониста с ГР, за счет предпочтительного связывания с ГР по сравнению с другим ядерным рецептором (ЯР). В некоторых воплощениях специфический антагонист глюкокортикоидного рецептора связывается предпочтительно с ГР скорее, чем с минералокортикоидным рецептором (MP) или рецептором прогестерона (ПР). В иллюстративном воплощении специфический антагонист глюкокортикоидного рецептора связывается предпочтительно с ГР по сравнению с минералокортикоидным рецептором (MP). В другом иллюстративном воплощении специфический антагонист глюкокортикоидного рецептора связывается предпочтительно с ГР по сравнению с рецептором прогестерона (ПР).
В родственном воплощении специфический антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), которая, по меньшей мере, в 10 раз меньше, чем Kd для ЯР. В другом воплощении специфический антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), которая, по меньшей мере, в 100 раз меньше, чем Kd для ЯР. В другом воплощении специфический антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), которая, по меньшей мере, в 1000 раз меньше, чем Kd для ЯР.
Примеры заболеваний или состояний, пригодных для применения настоящего изобретения, включают, но ими не ограничиваются: ожирение, диабет, сердечно-сосудистые заболевания, гипертензию, синдром X, депрессию, тревожность, глаукому, вирус иммунодефицита человека (ВИЧ) или синдром приобретенного иммунодефицита (СПИД), нейродегенерацию, болезнь Альцгеймера, болезнь Паркинсона, когнитивные расстройства, синдром Кушинга, болезнь Эдисона, остеопороз, хрупкость костей, мышечную слабость, воспалительные заболевания, остеоартрит, ревматоидный артрит, астму и ринит, нарушения, связанные с заболеванием надпочечников, вирусные инфекции, иммунодефицит, иммуномодуляцию, аутоиммунные заболевания, аллергию, заживление ран, компульсивное поведение, множественная лекарственная устойчивость, зависимость, психоз, анорексию, кахексию (истощение), посттравматический стрессовый синдром, постхирургические переломы костей, нарушения катаболизма, глубокую психотическую депрессию, умеренные когнитивные нарушения, психозы, деменцию, гипергликемию, стрессовые заболевания, вызванное нейролептиками увеличение веса, расстройства сознания (делириозный синдром), когнитивные расстройства у депрессивных пациентов, когнитивные нарушения у индивидуумов с синдромом Дауна, психозы, связанные с лечением альфа-интерфероном, хроническую боль, боль, связанную с заболеванием рефлюксным гастроэзофагитом, послеродовой психоз, послеродовую депрессию, неврологические заболевания недоношенных детей и связанные с мигренью головные боли. В некоторых воплощениях заболевание или состояние представляет собой глубокую психотическую депрессию, связанные со стрессом нарушения, или вызванное нейролептиками увеличение веса.
VI. Исследования и способы для модулирования активности глюкокортикоидного рецептора
Соединения настоящего изобретения могут быть протестированы для оценки их антиглюкокортикоидных свойств. Здесь представлены способы исследования соединений, обладающих модулирующей глюкокортикоидные рецепторы активностью. Как правило, соединения настоящего изобретения способны модулировать активность глюкокортикоидных рецепторов за счет селективного связывания с ГР или за счет предотвращения связывания лигандов с ГР. В некоторых воплощениях соединения демонстрируют слабый цитотоксический эффект или отсутствие такого эффекта.
A. Определение связывания
В некоторых воплощениях модуляторы ГР идентифицируются путем скрининга молекул, которые конкурируют с лигандом ГР, таким как дексаметазон. Специалист в данной области техники должен знать, что существует множество способов проведения исследования конкурентного связывания. В некоторых воплощениях ГР преинкубируется с меченым лигандом ГР, а затем контактирует с тестируемым соединением. Этот способ исследования конкурентного связывания может также обозначаться здесь как исследование вытеснения при связывании. Изменение (например, уменьшение) количества связанного с ГР лиганда указывает на то, что данная молекула является потенциальным модулятором ГР. Альтернативно этому, может быть прямо измерено связывание тестируемого соединения с ГР с использованием меченого тестируемого соединения. Данный способ исследования называется прямым измерением связывания.
Как прямое измерение связывания, так и исследование вытеснения при связывании могут применяться во множестве разных вариантов. Варианты могут быть подобными тем, которые применяются в иммуноанализе и исследовании связывания рецепторов. Для описания разных вариантов для исследования связывания, включая определение вытеснения при связывании и прямое измерение связывания, смотри: Basic and Clinical Immunology 7th Edition (D. Stites and A. Terr ed.) 1991; Enzyme Immunoassay, E.T. Maggio, ed., CRC Press, Boca Raton, Florida (1980); и ″Practice and Theory of Enzyme Immunoassays,″ P. Tijssen, Laboratory Techniques in Biochemistry and Molecular Biology, Elsevier Science Publishers B.V. Amsterdam (1985), каждая из которых включена в настоящее изобретение путем отсылки.
В случае твердофазного исследования конкурентного связывания, например, соединение-образец может конкурировать с меченым анализируемым соединением за специфические участки связывания на связывающем агенте, прикрепленном к твердой поверхности. В таком варианте меченым анализируемым веществом может быть лиганд ГР и связывающим агентом может быть ГР, прикрепленный к твердой фазе. Альтернативно этому, меченым анализируемым веществом может быть ГР и связывающим агентом может быть лиганд ГР, прикрепленный к твердой фазе. Концентрация меченого анализируемого вещества, связавшегося со связывающим агентом, обратно пропорциональна способности тестируемого соединения конкурировать за связывание.
Альтернативно этому, исследование конкурентного связывания может проводиться в жидкой фазе, и в данной области существует множество способов для разделения связавшегося меченого белка от несвязавшегося меченого белка. Например, разработано несколько способов, позволяющих различить связавшийся лиганд и избыток несвязавшегося лиганда или связавшееся тестируемое соединение и избыток несвязавшегося тестируемого соединения. Эти способы включают идентификацию связанного комплекса по седиментации в градиенте сахарозы, с помощью гель-электрофореза или изоэлектрофокусирования в геле, преципитации комплекса рецептор-лиганд протаминсульфатом или его адсорбции на гидроксилаппатите; удаление несвязавшихся соединений или лигандов путем адсорбции на покрытом декстраном активированном угле (dextran-coated charcoal, DCC) или посредством связывания с иммобилизованными антителами. После разделения проводится измерение количества связанного лиганда или тестируемого соединения.
Альтернативно этому, может проводиться анализ связывания в гомогенной фазе, при котором не требуется стадии разделения. Например, метка на ГР может изменяться при связывании ГР со своим лигандом или тестируемым соединением. Это изменение в меченом ГР выражается в уменьшении или увеличении сигнала, излучаемого меткой, что позволяет по измерению метки в конце анализа связывания выявлять или количественно определять ГР в связанном состоянии. Для такого анализа можно применять множество меток. Компонент анализа можно пометить одним из нескольких способов. Пригодные радиоактивные метки включают таковые, в составе которых имеется 3H, 125I, 35S, 14C или 32P. Пригодные нерадиоактивные метки включают таковые, в составе которых имеются флуорофоры, хемилюминесцентные агенты, фосфоресцентные агенты, электрохеми люминесцентные агенты и т.п. Флуоресцентные агенты являются особенно пригодными в аналитических методах, поскольку они применяются для определения сдвигов в структуре белка, таких как анизотропия флуоресценции и/или поляризация флуоресценции. Выбор метки зависит от требуемой чувствительности, легкости конъюгации с соединением, требуемой стабильности и доступности приборной базы. Для примеров разных способов мечения или систем получения сигнала, которые могут применяться, смотри: патент США No. 4391904, которые включаются в настоящее изобретение путем отсылки для любых целей. Метка может быть связана напрямую или не напрямую с желаемым компонентом в опыте, согласно способам, хорошо известным в данной области техники.
Для исследования большого количества соединений - потенциальных модуляторов, могут применяться способы высокопроизводительного скрининга. После этого проводится скрининг таких ″библиотек соединений″ в одном или более анализах, описанных здесь, для идентификации таких членов библиотек (в частности, химических видов или подклассов), которые обладают желаемой характеристической активностью. Получение и скрининг химических библиотек хорошо известны специалистам в данной области техники. Оборудование для получения химических библиотек является коммерчески доступным (смотри, например, 357 MPS, 390 MPS, Advanced Chem Tech, Louisville KY, Symphony, Rainin, Woburn, MA, 433A Applied Biosystems, Foster City, CA, 9050 Plus, Millipore, Bedford, MA).
B. Клеточные исследования
Исследования на основе клеток подразумевают применение целых клеток или содержащих ГР клеточных фракций для анализа связывания или модулирования активности ГР соединением настоящего изобретения. Примеры клеточных типов, которые могут применяться в способах настоящего изобретения, включают, например, любые клетки млекопитающих, включая лейкоциты, такие как нейтрофилы, моноциты, макрофаги, эозинофилы, базофилы, тучные клетки и лимфоциты, такие как Т-клетки и В-клетки, клетки лейкемии, лимфомы Беркитта (африканская лимфома), опухолевые клетки (включая клетки вирусной опухоли молочной железы мыши), эндотелиальные клетки, фибробласты, клетки сердца, клетки мышц, клетки опухоли молочной железы, клетки раковой карциномы яичников, карциномы шейки матки, глиобластомы, клетки печени, клетки почек и нейрональные клетки, а также клетки грибов, включая дрожжи. Клетки могут быть первичными клетками или клетками опухоли, или другими типами бессмертных клеточных линий. Естественно, ГР должен быть экспрессирован в клетках, которые не экспрессируют эндогенной версии ГР.
В некоторых случаях для скрининга могут применяться фрагменты ГР, а также слитые белки. Когда исследуются молекулы, которые конкурируют за связывание с лигандами ГР, применяемыми фрагментами ГР являются фрагменты, способные связывать лиганды (например, дексаметазон). Альтернативно этому, в качестве мишени для идентификации молекулы, которая связывается с ГР, может применяться любой фрагмент ГР. Фрагменты ГР могут включать любые фрагменты, например, по меньшей мере, от 20, 30, 40, 50 аминокислот до белка, содержащего все аминокислоты ГР минус одна аминокислота. Как правило, лиганд-связывающие фрагменты будут содержать трансмембранные участки и/или большинство, или все внеклеточные домены ГР.
В некоторых воплощениях для идентификации модуляторов ГР исследуется передача сигнала, запускаемая активацией ГР. Сигнальная активность ГР может быть определена разными способами. Например, для определения сигнальной активности могут анализироваться молекулярные события, происходящие ниже в этом сигнальном пути. События, происходящие ниже в этом сигнальном пути, включают такие активности или проявления, которые являются результатом активации ГР. Примеры событий, происходящих ниже в этом сигнальном пути, пригодных для функциональной оценки активации и блокирования транскрипции в неизмененных клетках, включают положительную регуляцию (активацию) множества генов, зависимых от элементов, отвечающих на глюкокортикоиды (glucocorticoid response element, GRE) (фосфоенолпируваткарбоксикиназа (РЕРСК), тирозинаминотрансфераза, ароматаза). Кроме того, могут применяться специфические клеточные типы, чувствительные к активации ГР, такие как экспрессия остеокальцина в остеобластах, которая отрицательно регулируется (подавляется) глюкокортикоидами, первичные гепатоциты, которые демонстрируют опосредуемую глюкокортикоидами положительную регуляцию РЕРСК и глюкозо-6-фосфатазы (Г-6-фазы). GRE-опосредуемая экспрессия генов может также быть показана в трансфецированных клеточных линиях с применением хорошо известных GRE-регулируемых последовательностей (например, промотор вируса опухоли молочной железы мышей (MMTV), который трансфецирован в участок перед конструкцией репортерного гена). Примеры пригодных репортерных генных конструкций включают люциферазу (luc), щелочную фосфатазу (ALP) и хлорамфениколацетилтрансферазу (CAT). Функциональная оценка репрессии транскрипции может быть проведена на клеточных линиях, таких как моноциты или фибробласты кожи человека. Пригодные функциональные измерения включают измерение IL-1-бета-стимулируемой экспрессии IL-6, отрицательную регуляцию коллагеназы, циклооксигеназы-2 и различных хемокинов (МСР-1, RANTES); или экспрессию генов, регулируемых транскрипционными факторами NFkB или АР-1 в трансфецированных клеточных линиях.
Как правило, соединения, которые тестируются в анализах на целых клетках, также тестируются для измерения цитотоксичности. Анализ цитотоксичности применяется для определения степени, в которой получаемый модулирующий эффект обусловлен клеточными эффектами, не обусловленными связыванием с ГР. В иллюстративном воплощении измерение цитотоксичности включает контактирование конститутивно активной клетки с тестируемым соединением. Любое снижение клеточной активности указывает на цитотоксический эффект.
C. Специфичность
Соединения настоящего изобретения могут быть проанализированы на их специфичность (что также здесь называется анализом селективности). Как правило, исследование специфичности включает тестирование соединения, которое связываются с ГР in vitro или в клеточных исследованиях, на степень связывания с белками, не являющимися ГР. Исследование селективности может проводиться in vitro или в клеточных системах, как описано выше. Связывание с ГР может тестироваться в сравнении с любым подходящим белком, не являющимся ГР, включая антитела, рецепторы, ферменты и т.п. В иллюстративном воплощении белок, не связывающий глюкокортикоиды, представляет собой рецептор клеточной поверхности или ядерный рецептор. В другом иллюстративном воплощении белок, не являющийся ГР, представляет собой рецептор стероидов, такой как рецептор эстрогенов, рецептор прогестерона, рецептор андрогенов или рецептор минералокортикоидов.
Термины и выражения, которые употребляются в настоящем изобретении, применяются как термины для описания и не являются ограничивающими, и применение таких терминов и выражений не является намерением исключить показанные или описанные эквиваленты, или их части, то есть необходимо понимать, что в рамках заявленного изобретения различные модификации являются возможными. Более того, любая одна или несколько характеристик любого воплощения настоящего изобретения может комбинироваться с любой одной или несколькими другими характеристиками любого другого воплощения настоящего изобретения, оставаясь в рамках настоящего изобретения. Например, характеристики соединений - модуляторов ГР - являются в равной степени применимыми в способах лечения заболеваний и/или фармацевтических композиций, которые здесь описаны. Все публикации, патенты и заявки на патенты, процитированные в настоящем изобретении, являются включенными в настоящее изобретение путем отсылки во всей своей полноте для любых целей.
VII. Примеры
Методы LCMS (жидкостная хроматография - масс-спектрометрии):
Метод A: эксперименты проводили с использованием Waters Platform LC квадрупольного масс-спектрометра с электрораспылением положительных и отрицательных ионов и системы ELS/Diode array detection с использованием Phenomenex Luna 3 микрон C18 (2) 30×4,6 мм колонки и скорости потока 2 мл/мин. Система растворителей представляла собой 95% воду, содержащую 0,1% муравьиной кислоты (растворитель А) и 5% ацетонитрил, содержащий 0,1% муравьиной кислоты (растворитель В) в течение первых 50 секунд, с последующим градиентом до 5% растворителя A и 95% растворителя B в течение следующих 4 минут. Финальная система растворителей поддерживалась постоянной в течение последующей 1 минуты.
Метод B: эксперименты проводили с использованием Waters Micromass ZQ2000 квадрупольного масс-спектрометра с электрораспылением положительных и отрицательных ионов и системы ELS/Diode array detection с использованием Higgins Clipeus 5 микрон C18 100×3,0 мм колонки и скорости потока 1 мл/мин. Начальная система растворителей представляла собой 95% воду, содержащую 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрил, содержащий 0,1% муравьиной кислоты (растворитель B) в течение первой минуты с последующим градиентом до 5% растворителя A и 95% растворителя B в течение следующих 8 минут. Финальная система растворителей поддерживалась постоянной в течение последующих 5 минут.
Метод C: эксперименты проводили с использованием Waters ZMD квадрупольного масс-спектрометра с электрораспылением положительных и отрицательных ионов и ELS/Diode array detection с использованием Phenomenex Luna 3 микрон C18 (2) 30×4,6 мм колонки и скорости потока 2 мл/мин. Система растворителей представляла собой 95% воду, содержащую 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрил, содержащий 0,1% муравьиной кислоты (растворитель B) в течение первых 50 секунд с последующим градиентом до 5% растворителя A и 95% растворителя B в течение следующих 4 минут. Финальная система растворителей поддерживалась постоянной в течение последующей 1 минуты.
Метод D: эксперименты проводили с использованием Waters Micromass ZQ2000 квадрупольного масс-спектрометра, соединенного с системой Waters Acquity UPLC с PDA UV детектором с использованием Acquity UPLC BEH C18 1,7 микрон 100×2,1 мм колонки при температуре 40°C. Спектрометр имел источник электрораспыления, работающий в режиме положительных и отрицательных ионов. Начальная система растворителей представляла собой 95% воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 5% ацетонитрил, содержащий 0,1% муравьиной кислоты (растворитель B) в течение 0,4 минут с последующим градиентом до 5% растворителя A и 95% растворителя B в течение следующих 6,4 минут.
Метод E: эксперименты проводили с использованием Waters Quattro Micro triple квадрупольного масс-спектрометра, соединенного с системой Hewlett Packard HP 1100 LC с электрораспылением положительных и отрицательных ионов и ELS/Diode array detection с использованием Higgins Clipeus 5 микрон C18 100×3,0 мм колонки и скорости потока 1 мл/мин. Начальная система растворителей представляла собой 85% воды, содержащей 0,1% муравьиной кислоты (растворитель A) и 15% ацетонитрил, содержащий 0,1% муравьиной кислоты (растворитель B) в течение первой минуты с последующим градиентом до 5% растворителя А и 95% растворителя B в течение следующих 13 минут. Система растворителей поддерживалась постоянной в течение последующих 7 минут до возвращения к условиям начальных растворителей.
Пример 1. Получение 5-Бензил-6-(4-фенилциклогекс-1-енил)-1H-пиримидин-2,4-диона(2a)

4-фенил-циклогекс-1-ениловый эфир трифторметансульфоновой кислоты. Раствор диизопропиламина (4.46 мл) в тетрагидрофуране (25 мл) в атмосфере азота при -20°C был обработан 2,5 М раствором н-бутиллития (12,6 мл) и перемешивался в течение 15 минут. Получившаяся смесь охлаждалась до -78°C, перед тем, как был добавлен раствор 4-фенилциклогексанона (5,0 г) в тетрагидрофуране (20 мл) в течение 20 минут. Получившийся раствор перемешивался при -78°C в течение 3 часов, а затем обрабатывался раствором N-фенил-бис(трифторметансульфонимида) (10,76 г) в тетрагидрофуране (25 мл). Смесь перемешивалась при -78°C в течение 1,5 часов, после чего нагревалась до комнатной температуры и перемешивалась в течение следующих 18 часов. Реакционная смесь была сконцентрирована при пониженном давлении, и получившийся остаток был распределен между этилацетатом и водой. Органический слой промывался 2M раствором гидроокиси натрия и солевым раствором, после чего высушивался над сульфатом натрия. Растворитель удаляли при пониженном давлении для получения титульного соединения в виде масла (7,3 г). 1H ЯМР (CDCl3): δ 7,32-7,31 (2H, m), 7,24-7,22 (3H, m), 5,87-5,84 (1H, m), 2,85-2,84 (1H, m), 2,55-2,54 (1H, m), 2,44-2,43 (2H, m), 2,35-2,34 (1H, m), 2,09-2,07 (1H, m), 1,96-1,95 (1H, m).
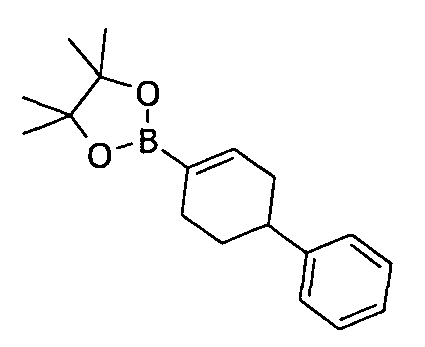
4,4,5,5-Тетраметил-2-(4-фенилциклогекс-1-енил)-[1,3,2]диоксаборолан. Смесь 4-фенил-циклогекс-1-енилового эфира трифтор-метансульфоновой кислоты (5,8 г), бис(пинаколато)дибора (5,3 г), ацетата калия (5,58 г) и [1,Г-бис(дифенилфосфин)ферроцен]дихлорпалладия (II) (0,77 г) в 1,4-диоксане (150 мл) была дегазирована, после чего нагрета до 80°C в течение 2 часов. Реакционную смесь фильтровали и получившийся фильтрат концентрировали при пониженном давлении. Получившийся остаток очищали колоночной хроматографией на силикагеле, элюируя смесью диэтилового эфира и циклогексана (0:1 до 1:20 по объему) для получения титульного соединения (4,0 г). 1H ЯМР (CDCl3): δ 7,30-7,28 (2H, m), 7,24-7,15 (3H, m), 6,65-6,64 (1H, m), 2,82-2,71 (1H, m), 2,40-2,36 (2H, m), 2,23-2,22 (2H, m), 1,95-1,94 (1H, m), 1,70-1,68 (1H, m), 1,43 (3H, s), 1,28 (9H, s).

5-Бензил-6-(4-фенилциклогекс-1-енил)-1H-пиримидин-2,4-дион (2а). Смесь 5-бензил-6-хлор-1H-пиримидин-2,4-диона (WO 06014394) (1,0 г), 4,4,5,5-тетраметил-2-(4-фенилциклогекс-1-енил)-[1,3,2]диоксаборолана (1,4 г), бис[ди-трет-бутил(4-диметиламинофенил)фосфин]дихлорпалладия (II) (0,06 г) и фторида цезия (1,92 г) в 1,4-диоксане (18 мл) и воде (2 мл) нагревали при 140°C в микроволновом реакторе в течение 20 минут. Получившуюся смесь разводили насыщенным водным хлоридом аммония и фильтровали для удаления осадка. Фильтрат экстрагировали дихлорметаном и объединенные органические слои промывали водой и солевым раствором, после чего высушивали над сульфатом натрия и концентрировали при пониженном давлении.
Получившийся остаток очищали колоночной хроматографией на силикагеле, элюируя смесью метанола и дихлорметана (от 0:1 до 1:20 по объему) для получения титульного соединения 2а в виде твердого вещества грязно-белого цвета (0.48 г). LCMS (метод A): Rt=3,56 мин, (М+H)+=359, 1H ЯМР (ДМСО-d6): δ 11,06 (1H, s), 10,69 (1H, s), 7,23-7,21 (10H, m), 5,84-5,79 (1H, m), 3,61 (2H, s), 3,57 (1H, s), 2,77-2,67 (1H, m), 2,19-2,16 (3H, m), 1,84-1,81 (1H, m), 1,68-1,67 (1H, m).
Примеры 2-4. Получение 5-Замещенных 6-(4-Фенилциклогекс-1-енил)-1H-пиримидин-2,4-дионов
Интермедиаты, показанные в таблице 1, были получены согласно способам, описанным в WO06014394, содержание которого включается в настоящее изобретение путем отсылки во всей своей полноте.



Примеры, показанные в таблице 2, были получены с использованием методов, подобных тем, которые описаны в примере 1, с использованием интермедиатов 1a-1c из таблицы 1 на стадии финального перекрестного сочетания.

5-(3-Метил-бензил)-6-(4-фенил-циклогекс-1-енил)-1H-пиримидин-2,4-дион
5-(2-Хлор-бензил)-6-(4-фенил-циклогекс-1-енил)-1H-пиримидин-2,4-дион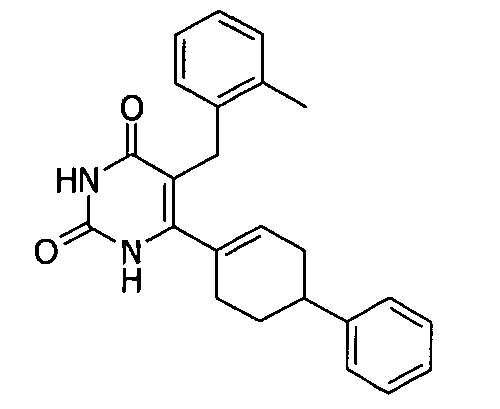
5-(2-Метил-бензил)-6-(4-фенил-циклогекс-1-енил)-1H-пиримидин-2,4-дион
Пример 5. Получение (E)-5-Бензил-6-(4-фенилциклогексил)-1H-пиримидин-2,4-диона (3а)

(E)-5-Бензил-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион (3а). Раствор 5-бензил-6-(4-фенилциклогекс-1-енил)-1H-пиримидин-2,4-диона (2а) (380 мг) в смеси [5:2 IMS/DCM был прогидрогенизирован над Pd(OH)2 (150 мг) и 10% Pd/C (100 мг) при давлении 45 psi (фунтов на квадратный дюйм) при 50°C в течение 18 часов. Грубук реакционную смесь дегазировали аргоном, фильтровали через целитовый фильтр и концентрировали под вакуумом для получения твердого вещества кремового цвета. 1F ЯМР показал смесь цис/трас изомеров, часть которых была разделена на индивидуальные изомеры с использованием колонки C18 Synergy с элюцией 70-80% МеОН/вода (+0,1% муравьиной кислоты) в течение 20 минут и затем в изократическом режиме (80%) е течение дополнительных 5 минут. 1H ЯМР (константы взаимодействия протонов е циклогексане) позволил установить, что первым элюировался транс-изомер 3a и вторым элюировался цис-изомер 3bb. Элюирующийся первым изомер 3a: Rt=10,86 мин, (М+H)+=361. Элюирующийся вторым цис-изомер 3bb: Rt=11,01 мин, (М+H)+=361.
Пример 6. Получение (E)-6-(4-Фенилциклогексил)-5-(3-трифторметилбензил-1H-пиримидин-2,4-диона (3b)
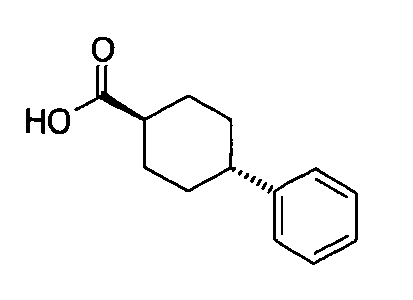
(E)-4-Фенилциклогексанкарбоновая кислота (5). Смесь (E)-4-(4-хлорфенил)-циклогексанкарбоновой кислоты (4) (15 г) и 10% палладия на углероде (4 г) в этаноле (400 мл) перемешивали в атмосфере водорода в течение 4 дней. Реакционную смесь разводили дихлорметаном, фильтровали через Celite® и фильтрат концентрировали при пониженном давлении. Получившийся остаток растворяли в этаноле (150 мл) и обрабатывали 5 М водным раствором гидроокиси натрия (25 мл). Получившуюся смесь перемешивали при комнатной температуре в течение 16 часов, после чего концентрировали при пониженном давлении. Осадок обрабатывали 1 М водным раствором соляной кислоты (200 мл) и перемешивали в течение 15 минут, после чего экстрагировали этилацетатом. Объединенные органические фазы высушивали над сульфатом натрия и концентрировали при пониженном давлении для получения титульного соединения в виде твердого вещества белого цвета (11 г). 1H ЯМР (CDCl3): δ 7,27-7,25 (5H, m), 2,52 (1H, tt, J=11,9(3,44 Hz), 2,48-2,29 (1H, m), 2,17-2,14 (2H, m), 2,02-1,98 (2H, m), 1,56-1,55 (4H, m).

Этиловый эфир (E)-3-оксо-3-(4-фенилциклогексил)-пропионовой кислоты (7) Смесь (E)-4-фенилциклогексанкарбоновой кислоты (5) (11 г), диметилпиридин-4-ил амина (7,3 г), 2,2-диметил-[1,3]диоксан-4,6-диона (8,5 г) и 4 А молекулярного сита (2,0 г) в дихлорметане (200 мл) перемешивали при комнатной температуре в течение 10 минут после чего обрабатывали раствором дициклогексилкарбодиимида (12,4 г) в дихлорметане (40 мл). Получившуюся смесь перемешивали при комнатной температуре в течение 1,1 часов, после чего фильтровали и фильтрат промывали 1 М водным раствором соляной кислоты и водой, после чего высушивали над сульфатом натрия и концентрировали пру пониженном давлении. Полученное твердое вещество растворяли в этаноле (100 мл) и нагревали с обратным холодильником в течение 1,5 часов, после чего концентрировали при пониженном давлении. Получившийся остаток очищали колоночной хроматографией на силикагеле, элюируя смесью этил ацетата и циклогексана (от 0:1 до 3:7 по объему) для получения титульного соединения в виде твердого вещества белого цвета (11 г). 1H ЯМР (CDCl3): δ 7,23-7,22 (5H, m), 4,25-4,17 (2H, m), 3,52 (2H, s), 2,54-2,53 (2H, m), 2,09-1,99 (4H, m), 1,54-1,51 (4H, m), 1,32-1,25 (3H, m).

Этиловый эфир (Z)-2-(4-фенилциклогексанкарбонил)-3-(3-трифторметилфенил)-акриловой кислоты (10). Этиловый эфир 3-оксо-3-(4-фенил-циклогексил)-пропионовой кислоты (7) (11,56 г, 42,1 ммоль), 3-трифторметилбензальдегид (11 г, 63,15 ммоль), ледяную уксусную кислоту (7,16 ммоль, 0,41 мл) и пиперидин (2,1 ммоль, 0,21 мл) растворяли в толуоле (250 мл) и нагревали в условиях Дина и Старка с обратным холодильником в течение 48 часов. Охлажденную реакционную смесь разводили равным объемом этилацетата и промывали 1 M водным раствором HCl и солевым раствором. Органический слой высушивали над сульфатом натрия, фильтровали и упаривали с получением прозрачного масла коричневого цвета. Полученный материал очищали колоночной хроматографией на силикагеле (градиент: от 0 до 10% трет-бутилметилового эфира в циклогексане) для получения 12,3 г (68%) этилового эфира (7)-2-(4-фенил-циклогексанкарбонил)-3-(3-трифторметил-фенил)-акриловой кислоты. 1H ЯМР (400 MHz, 192191), LCMS (метод C), Rt=4,77 мин, (М+H)+=431,2.

Этиловый эфир 3-оксо-3-(4-фенилциклогексил)-2-(3-трифторметил бензил) пропионовой кислоты (11). Смесь этилового эфира (2)-2-(4-фенилциклогексанкарбонил) 3-(3-трифторметилфенил)-акриловой кислоты (10) (12,3 г, 28,6 ммоль) и 10% Pd на углероде (2,5 г, 20% по весу) в денатурированном этаноле (250 мл) перемешивали в атмосфере водорода в течение 2 часов. Твердое вещество удаляли фильтрацией через целит и промывали этанолом. Фильтрат упаривали под вакуумом с получением прозрачного масла. Материал очищали колоночной хроматографией на силикагеле (градиент: от 0 до 10% трет-бутилметилового эфир в циклогексане) с получением 8,6 г (70%) этилового эфира 3-оксо-3-(4-фенилциклогексил)-2-(3-трифторметилбензил)-пропионовой кислоты (22). 1H ЯМР (400 MHz, 192227). LCMS (метод A), Rt=4,76 мин; (М+H)+=433,2 (94%); Rt=5,22 мин, (М+H)+=262,9 (6.5%).

(E)-6-(4-Фенилциклогексил)-2-тиоксо-5-(3-трифторметилбензил)-2,3-дигидро-1H-пиримидин-4-он (12а). Натрий (5 г, 217,8 ммоль) и тиомочевина (18 г, 236 ммоль) растворяли в абсолютном этаноле (300 мл) и нагревали с обратным холодильником в атмосфере азота в течение 1 часа. Реакционную смесь охлаждали до 0°C и медленно добавляли этиловый эфир 3-оксо-3-(4-фенилциклогексил)-2-(3-трифторметилбензил)-пропионовой кислоты (11) (15,7 г, 36,3 ммоль) в абсолютном этаноле (150 мл) (температура реакционной смеси <10°C). Реакционную смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционную смесь охлаждали, после чего упаривали под вакуумом с получением твердого вещества персикового цвета. Твердое вещество суспендировали в воде (500 мл) и доводили до pH=5 ледяной уксусной кислотой. Получившийся осадок выделяли фильтрацией, перерастворяли в DCM и пропускали через картридж для разделения фаз для удаления воды. Фильтрат упаривали до получения твердого вещества грязно-белого цвета, которое растирали в порошок в горячем этаноле. Твердое вещество собирали фильтрацией и высушивали под вакуумом при 50°C получением 4,8 г (30%) титульного соединения. 1H ЯМР (400 MHz, 192268). LCMS (метод C): Rt=4,10 мин, (М+H)+=444,9.

(E)-6-(4-Фенилциклогексил)-5-(3-трифторметилбензил)-1H-пиримидин-2,4-дион (3b). (E)-6-(4-Фенилциклогексил)-2-тиохо-5-(3-трифторметилбензил)-2,3-дигидро-1H-пиримидин-4-он (12а) (4,8 г, 10,8 ммоль) суспендировали в диоксане (150 мл), и добавляли 10% (вес/объем) водной хлоруксусной кислоты (100 мл). Реакционную смесь нагревали при 100°C, и дополнительно добавляли диоксан (25 мл) для достижения полной растворения. Нагревание продолжали в течение 64 часов. Охлажденную реакционную смесь разводили водой и экстрагировали дихлорметаном. Комбинированные органические фазы промывали насыщенным водным раствором карбоната натрия и солевым раствором высушивали над сульфатом натрия, фильтровали и упаривали до получения твердого вещества грязно-белого цвета, которое растирали в порошок в горячем этаноле. Твердое вещество собирали фильтрацией, высушивали под вакуумом при 50°C с получением 3,7 г (80%) титульного соединения. 1H ЯМР (ДМСО-d6): δ 11,12 (1H, s), 10,52 (1H, s), 7,61 (1H, s), 7,51 (3H, m), 7,30-7,13 (5H, m), 3,83 (2H, s), 2,90 (1H, m), 1,83-1,80 (4H, m), 1,50-1,40 (4H, m). LCMS (метод В): Rt=5,26 мин, (М+H)+=429,01.
Пример 7. Получение (E)-5-(3-Метилбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-диона (3h)

Этиловый эфир (E)-2-(2-этилбензил)-3-оксо-3-(4-фенилциклогексил)-пропионовой кислоты (11а). Суспензию гидрида натрия (0,07 г) в тетрагидрофуране (10 мл) обрабатывали раствором этилового эфира (Е)-3-оксо-3-(4-фенилциклогексил)-пропионовой кислоты (7) (0,50 г) в тетрагидрофуране (8 мл), и полученную смесь перемешивали в течение 1 часа при комнатной температуре. Был добавлен 1-бромметил-2-этилбензол (0,38 г) и полученную смесь нагревали с обратным холодильником в течение 2 часов, охлаждали до комнатной температуры, и останавливали реакцию добавлением 1 М водного раствора соляной кислоты. Водную фазу экстрагировали этил ацетатом и объединенные органические фазы промывали солевым раствором, высушивали над сульфатом магния и концентрировали при пониженном давлении. Получившийся остаток очищали колоночной хроматографией на силикагеле, элюируя смесью дихлорметана и циклогексана (от 0:1 до 4:6 по объему) для получения титульного соединения (0,86 г). 1H ЯМР (CDCl3): δ 7,31-7,27 (1H, m), 7,17-7,16 (6H, m), 7,09-7,08 (2H, m), 4,16-4,16 (2H, m), 3,97 (1H, t, J=7,47 Hz), 3,22-3,21 (2H, m), 2,68 (2H, q, J=7,55 Hz), 2,41-2,41 (2H, m), 1,94-1,92 (3H, m), 1,75-1,68 (1H, m), 1,54 (1H, s), 1,40-1,39 (3H, m), 1,27-1,18 (6H, m).

Этиловый эфир (Е)-2-(3-метилбензил)-3-оксо-3-(4-фенилциклогексил)-пропионовой кислоты (11h). Титульное соединение было получено, как описано выше для соединения 11a. 1H ЯМР (CDCl3): 7,29 (2H, m), 7,17-7,12 (4H, m), 7,02-6,95 (3H, m), 4,16 (2H, qd, J=7,13, 2,38 Hz), 3,95 (1H, t, J=7,51 Hz), 3,13 (2H, dd, J=7,52, 2,32 Hz), 2,45 (2H, m), 2,31 (3H, s), 1,97-1,94 (3H, m), 1,80-1,73 (1H, m), 1,53-1,27 (4H, m), 1,22 (3H, t, J=7,13 Hz).

(Е)-6-(4-Фенилциклогексил)-2-тиоксо-5-(3-метилбензил)-2,3-дигидро-1H-пиримидин-4-он (12 г). Титульное соединение было получено из соединения 11h, как описано выше для соединения 12a. LCMS (метод A): Rt=4,07 мин, (М+H)+=391.
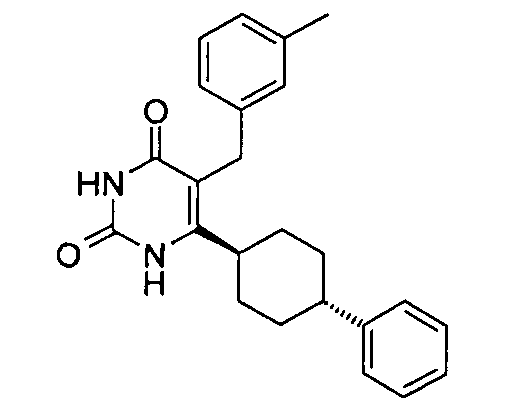
(Е)-5-(3-Метилбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион (3h).
Титульное соединение было получено из соединения 12g, как описано выше для соединения 3b. 1H ЯМР (ДМСО-d6): 11,06 (1H, s), 10,46 (1H, s), 7,32-7,24 (2H, m), 7,18-7,16 (4H, m), 7,00-6,98 (3H, m), 3,68 (2H, s), 2,90-2,79 (1H, m), 2,48-2,44 (1H, m), 2,25 (3H, s), 1,91-1,73 (4H, m), 1,46-1,43 (4H, m). LCMS (метод B), Rt=5,17 мин, (М+H)+=375.
Примеры 8-34. Получение 5-Замещенных (Е)-6-(4-циклогексил)-1H-пиримидин-2,4-дионов
Интермедиаты 11 в таблице 3 ниже были получены из 7b, как описано для соединения 11а в примере 7.


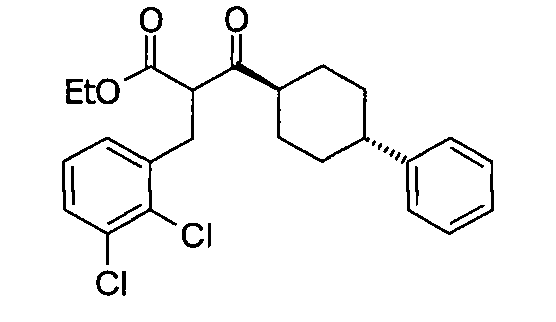

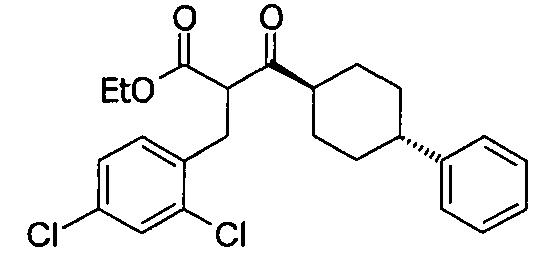
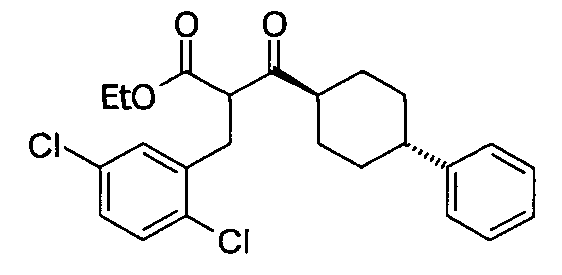

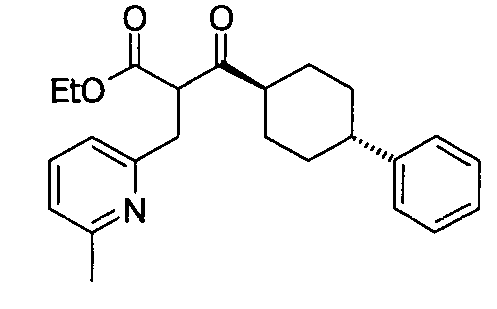

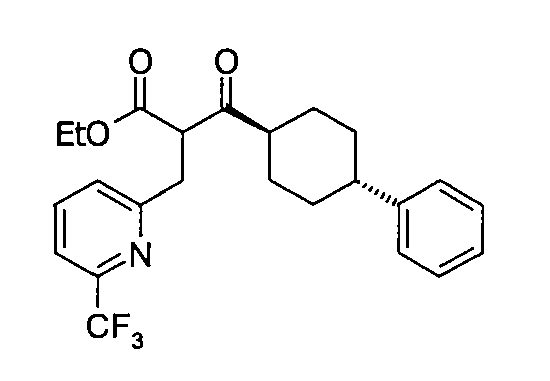
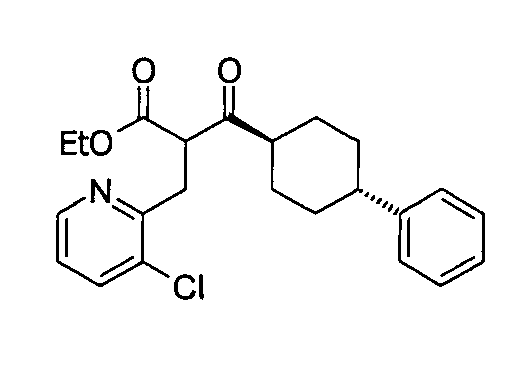
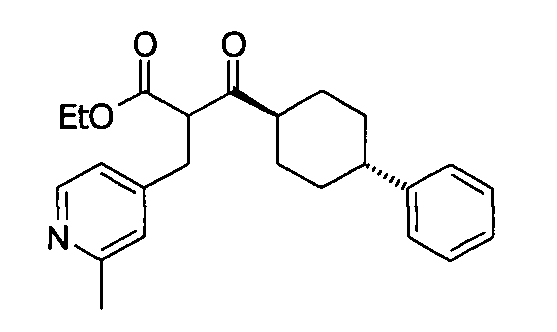


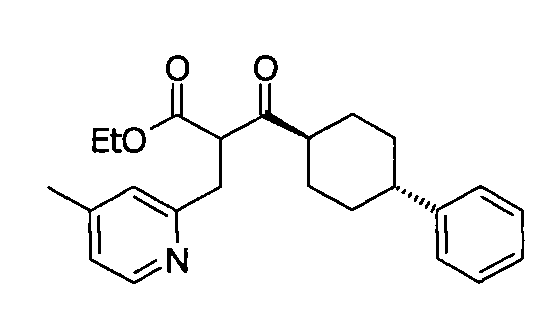



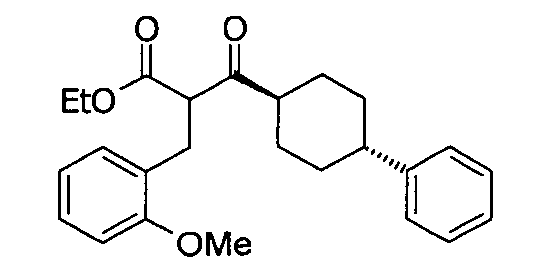



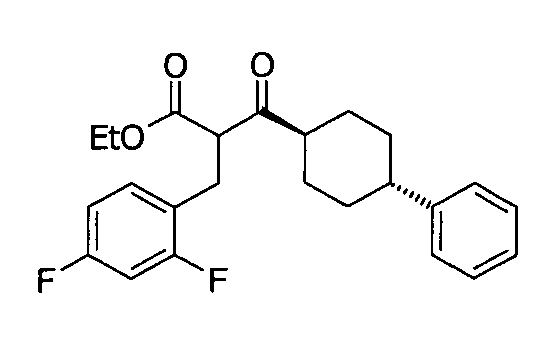
Интермедиаты 11 были превращены в интермедиаты 12 в таблице 4 ниже, как описано для получения соединения 12a в примере 6.



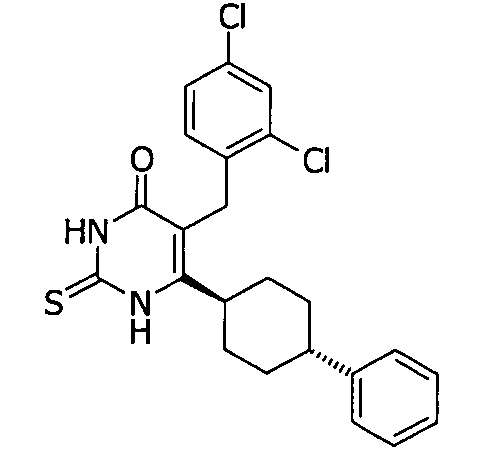

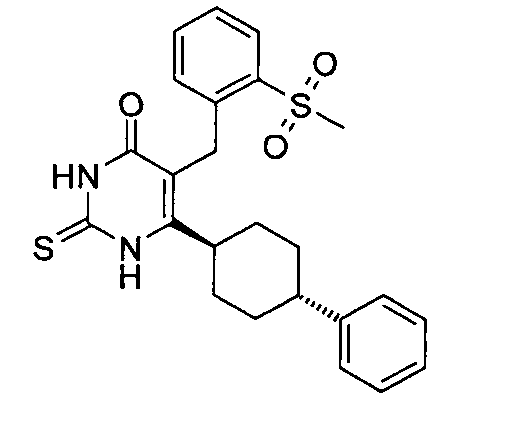





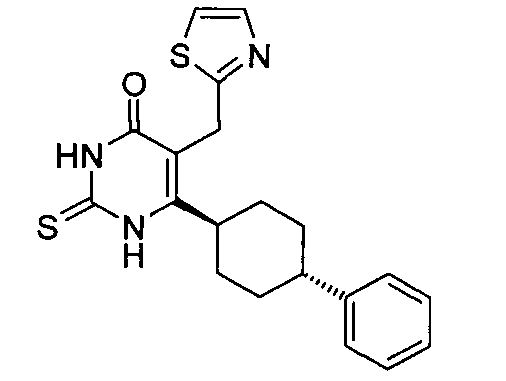
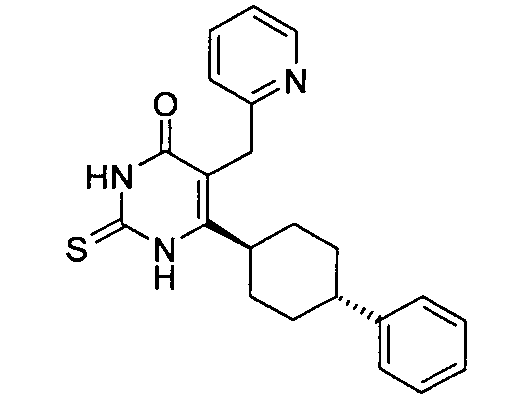


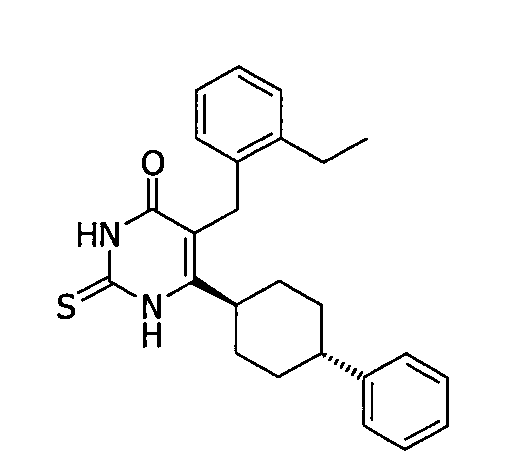


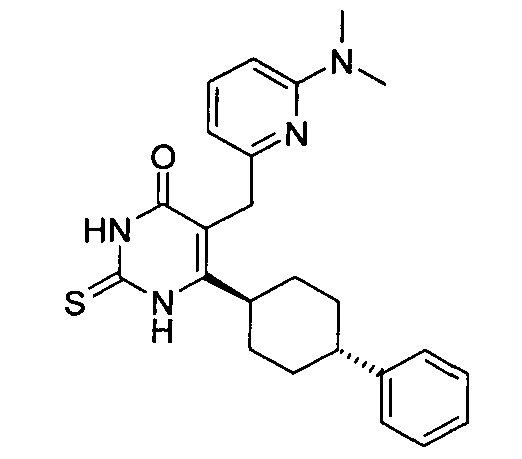


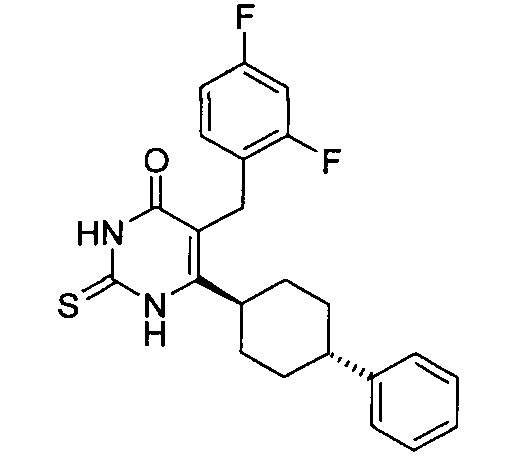

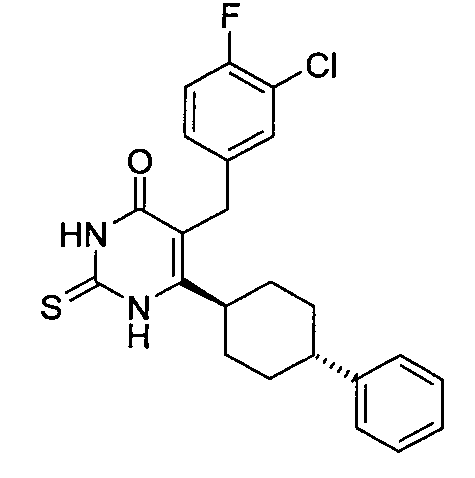
Интермедиаты 12 были превращены в соединения 3 в таблице 5 ниже, как описано для получения соединения 3b в примере 6.

(Е)-5-Бензил-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион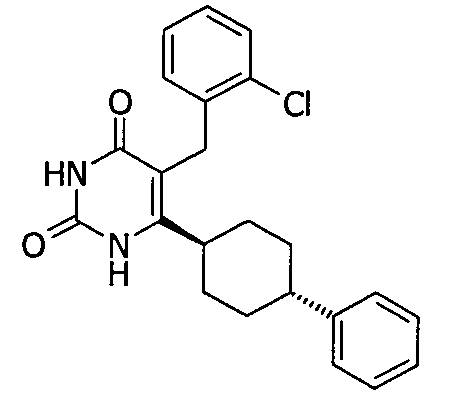
(Е)-5-(2-Хлорбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(2,3-Дихлорбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион

(Е)-5-(2,6-Дихлорбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион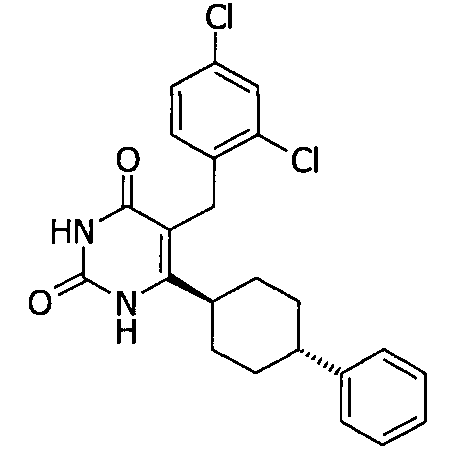
(Е)-5-(2,4-Дихлорбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(2,5-Дихлорбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(E)-5-(2-Метансульфонилбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
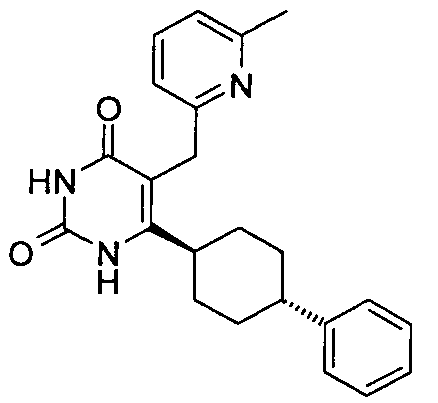
(Е)-5-(6-Метилпиридин-2-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион (выделен как гидрохлорид)
(Е)-6-(4-Фенилциклогексил)-5-пиримидин-2-илметил-1H-пиримидин-2,4-дион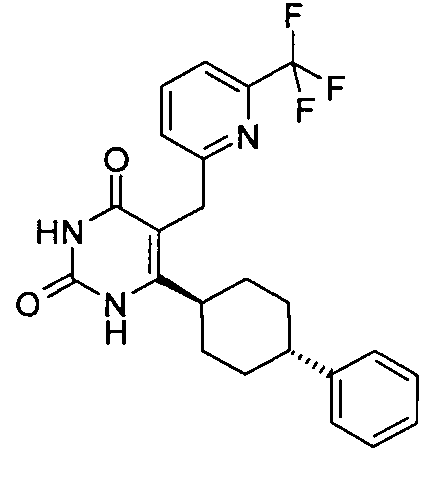
(Е)-5-(6-Трифторметилпиридин-2-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион

(Е)-5-(3-Хлорпиридин-2-
илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(2-Метилпиридин-4-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-6-(4-Фенилциклогексил)-5-тиазол-2-илметил-1H-пиримидин-2,4-дион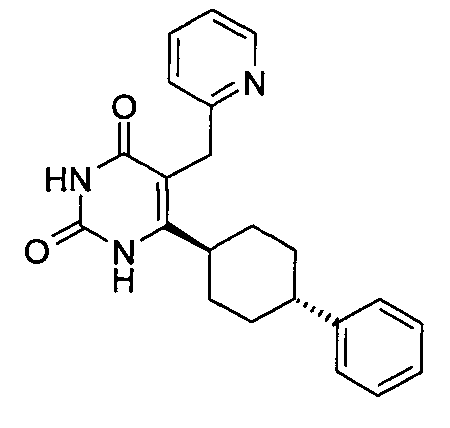
(Е)-5-(Пиридин-2-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион

(Е)-5-(4-Метилпиридин-2-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(4-Трифторметил-метилпиридин-2-илметил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион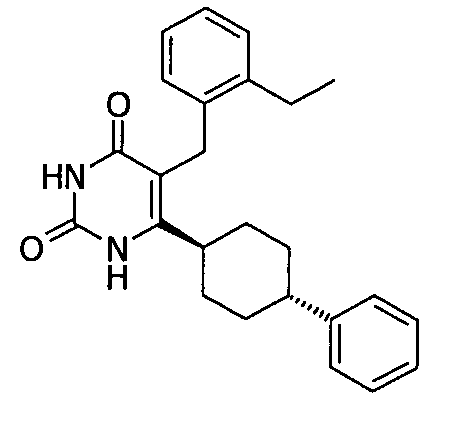
(Е)-5-(2-Этилбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион

(Е)-5-(4-Метилтиазол-2-илметил)-6-(4-Фенилциклогексил)-1H-пиримидин-2,4-дион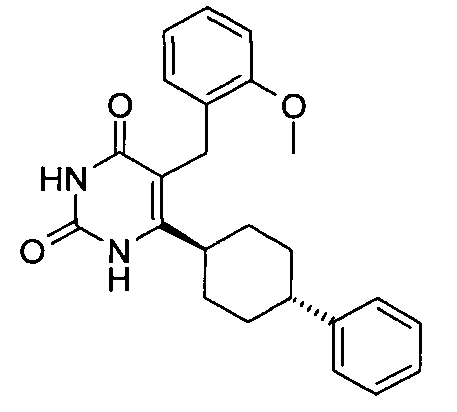
(Е)-5-(2-Метоксибензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(6-Диметиламинопиридин-2-ил)метил-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион

(Е)-5-(3,4-Дифторбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(2-Хлор-4-фторбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион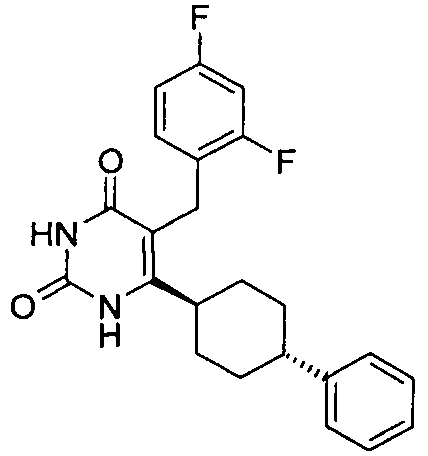
(Е)-5-(2,4-Дифторбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион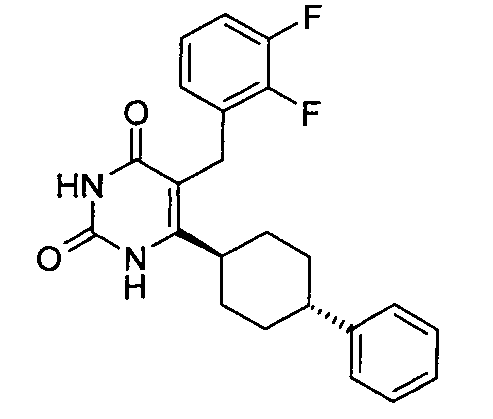
(Е)-5-(2,3-Дифторбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион
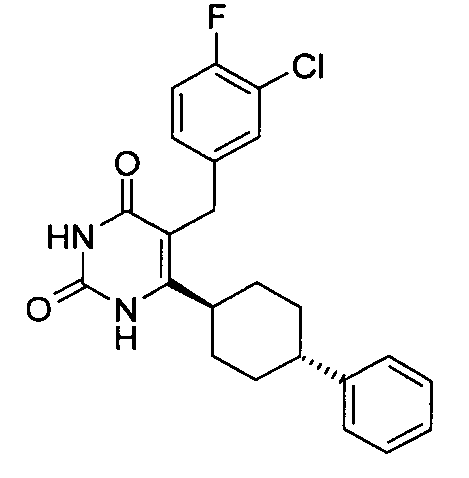
(Е)-5-(3-Хлор-4-фторбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион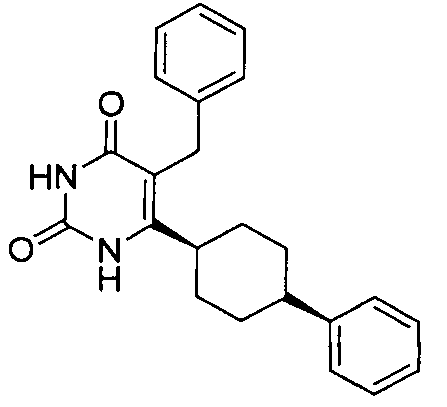
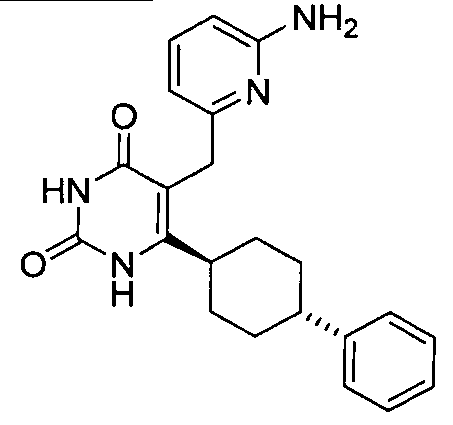
Пример 35. (Е)-3-Метил-5-(3-метилбензил)-6-(4-(фенилциклогексил)-1H-пиримидин-2,4-дион (13а)
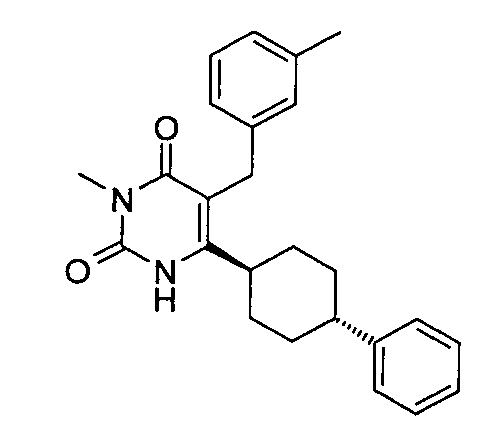
(Е)-3-Метил-5-(3-метилбензил)-6-(4-фенилциклогексил)-1H-пиримидин-2,4-дион (13а). Гидрид натрия (2,1 мг; 0,053 ммоль) был добавлен в раствор соединения 3h (20 мг; 0,053 ммоль) в сухом DMF (2 мл), после чего было добавлено 3,3 мкл (0,053 ммоль) MeI. Смесь перемешивали при комнатной температуре в течение 16 часов. Дополнительно было добавлено 1 eq. NaH и MeI в течение следующих 24 часов. Содержимое разводили водой (0,5 мл) и концентрировали под вакуумом и получившийся остаток очищали препаративной жидкостной хроматографией LC (C18 колонка, элюция 30-95% CH3CN/H2O+0,1% муравьиной кислоты), с получением титульного продукта (13 мг) после высушивания с заморозкой. 1H ЯМР δ (ppm) (ДМСО-d6): 10,76 (1H, s), 7,28 (2H, m), 7,18-7,17 (4H, m), 7,05-6,92 (3H, m), 3,74 (2H, s), 3,16 (3H, s), 2,90 (1H, s), 2,25 (3H, s), 1,90-1,78 (4H, m), 1,48 (4H, m). LCMS (метод В): Rt=5,56 минут, (М+H)+=389.
Примеры 36-42. Получение 5-Замещенных (Е)-3-Алкил-6-(4-циклогексил)-1H-пиримидин-2,4-дионов
Иллюстративные соединения в таблице 6 ниже были получены из соответствующих соединений 3 с применением необходимых алкилирующих агентов, таких как описанные ниже для примеров 38-41. Для близких реакций, описывающих алкилирование аминов, смотри страницы 397-408 в Larock, R.C. Comprehensive Organic Transformations. New York: VCH Publishers, Inc., 1989, содержание которого включается в настоящее изобретение путем отсылки во всей своей полноте.

(Е)-3-(2-Диметиламино-этил)-5-(3-метил-бензил)-6-(4-фенил-циклогексил)-1H-пиримидин-2,4-дион (Е)-5-(2,3-Дихлор-бензил)-3-(3-морфолин-4-ил-пропил)-6-(4-фенил-циклогексил)-1H-пиримидин-2,4-дион
(Е)-5-(2,3-Дихлор-бензил)-3-(3-морфолин-4-ил-пропил)-6-(4-фенил-циклогексил)-1H-пиримидин-2,4-дион

(Е)-3-Метил-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-дион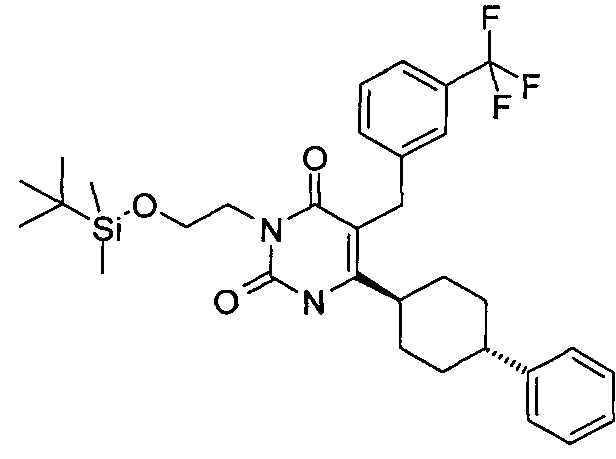
(Е)-3-[2-(трет-Бутил-диметил-силанилокси)-этил]-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-дион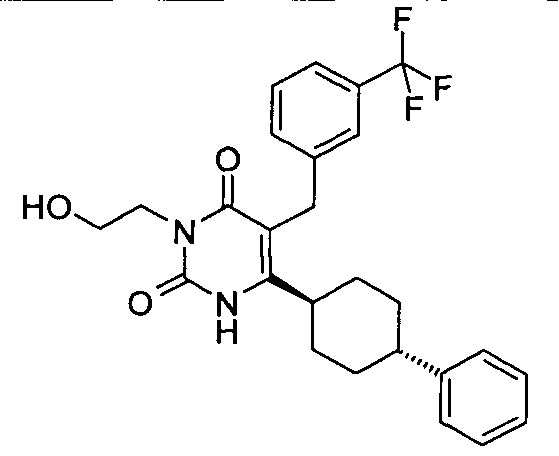
(Е)-3-(2-Гидрокси-этил)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-дион

(Е)-3-(2-Метокси-этил)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-дион
Пример 38. Получение (Е)-3-Метил-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (13d)
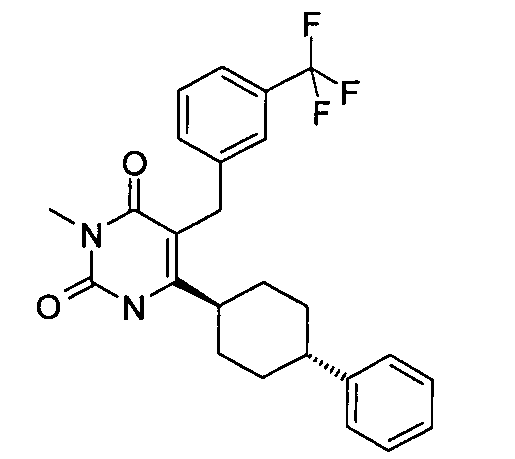
Гидрид натрия (6 мг; 0,14 ммоль) был добавлен в раствор (Е)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (3b) (50 мг; 0,117 ммоль) в сухом DMF (3 мл), после чего через 30 минут было добавлено 9 мкл (0,14 ммоль) метилиодида. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов. Было добавлено дополнительно по 0,2 эквивалента NaH и MeI, после чего перемешивание продолжалось в течение 2 часов и 25 минут. После этого содержимое разводили водой (10 мл). Смесь экстрагировали этилацетатом (2×20 мл) и органические фазы высушивали (Na2SO4), фильтровали и упаривали. Осадок перекристаллизовывали из кипящего метанола для получения продукта, 10,2 мг. Rt=5,63 минут.
Пример 39. Получение (Е)-3-[2-(трет-Бутил-диметил-силанилокси)-этил]-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (13е)

Гидрид натрия (18 мг; 0,46 ммоль) был добавлен в раствор (E)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (3b) (150 мг; 0,35 ммоль) в сухом DMF (5 мл), после чего через 25 минут при 80°C было добавлено 9 мкл (0,14 ммоль) (2-бром-этокси)-трет-бутил-диметил-силана. Реакционную смесь перемешивали при 80°C в течение 18 часов. В течение 24 часов было дополнительно добавлено по 2,5 эквивалента NaH и MeI. Реакционную смесь разводили водой (10 мл) и экстрагировали этилацетатом (4×10 мл), после чего органическую фазу высушивали (Na2SO4), фильтровали и упаривали. Материал был очищен колоночной хроматографией с элюцией смесью этилацетата и циклогексана (от 0:1 до 1:0 по объему) для получения титульного соединения, 57 мг. Rt=5,09 минут.
Пример 40. Получение (Е)-3-(2-Гидрокси-этил)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (13f)
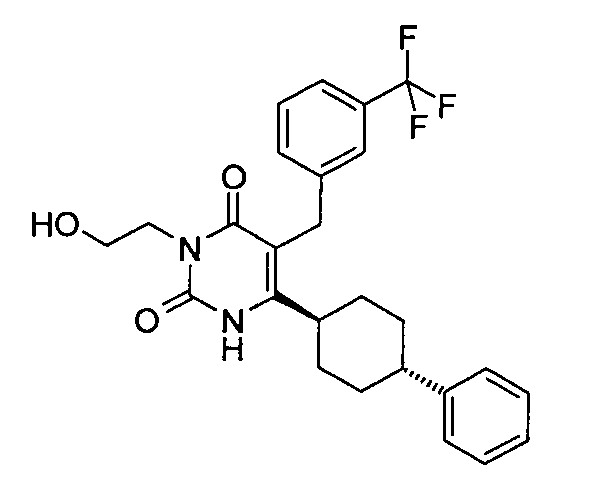
Тетрабутил аммонийфторид (1 M в THF, 141 мкл; 0,141 ммоль) был добавлен к перемешиваемому раствору (Е)-3-[2-(трет-бутил-диметил-силанилокси)-этил]-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (13f) (55 мг; 0,094 ммоль) в THF (5 мл). Реакционную смесь перемешивали в течение 1 часа, после чего оставляли стоять в течение 5 дней. Была добавлена вода (10 мл) и смесь экстрагировали диэтиловым эфиром (2×10 мл). Органические фазы высушивали (Na2SO4), фильтровали и упаривали. Материал очищали колоночной хроматографией, элюируя смесью этилацетата и циклогексана (от 0:1 до 1:0 по объему) для получения титульного соединения, 20 мг. Rt=5,28 минут.
Пример 41. Получение (Е)-3-(2-Метокси-этил)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (13г)

Гидрид натрия (13 мг; 0,316 ммоль) был добавлен к раствору (Е)-6-(4-фенил-циклогексил)-5-(3-трифторметил-бензил)-1H-пиримидин-2,4-диона (3b) (104 мг; 0,243 ммоль) в сухом DMF (4 мл), после чего через 30 минут было добавлено 30 мкл (0,316 ммоль) 1-бром-2-метоксиэтана. Реакционную смесь перемешивали при 80°C в течение 42 часов. Реакционную смесь разводили водой (10 мл) и экстрагировали этилацетатом (3×10 мл), после чего органические фазы высушивали (Na2SO4), фильтровали и упаривали. Материал очищали колоночной хроматографией, элюируя смесью этилацетата и циклогексана (от 0:1 до 1:0 по объему), после чего дополнительно очищали препаративной жидкостной хроматографией LC (C18 колонка, элюция 10-98% CH3CN/H2O+0,1% муравьиной кислоты, для получения продукта, 7 мг, высушиванием после заморозки. Rt=5,70 минут.
Пример 43. Определение связывания с глюкокортикоидным рецептором
Далее представлено описание определения ингибирования связывания дексаметазона с рекомбинантным глюкокортикоидным рецептором человека.
Протокол для определения связывания: соединения тестировались путем измерения вытеснения при связывании с использованием рекомбинантного глюкокортикоидного рецептора человека с 3H-дексаметазоном в качестве лиганда. Источником рецептора были рекомбинантные инфицированные бакуловирусом клетки насекомых. Данный ГР представлял собой полноразмерный рецептор стероидных гормонов, вероятно связанный с белками теплового шока и другими эндогенными белками.
Определение проводили в 96-луночных полипропиленовых планшетах с v-образным дном в конечном объеме 100 мкл, в растворе, содержащем 0,5 нМ ГР, 2,5 нМ 3H-дексаметазона (Perkin Elmer NET119200) в присутствии тестируемых соединений, растворителя тестируемых соединений (для определения общего связывания) или избытка дексаметазона (20 мкМ, для определения неспецифического связывания) в соответствующем объеме буфера для определения.
Для измерений IC50 тестируемые соединения анализировались в 6 разных концентрациях в двух повторах. Соединения разводили из 10 мМ исходного раствора в 100% ДМСО. Растворы для тестирования готовили в 2 раза более концентрированными, чем в конечном растворе для определения в 2% ДМСО/буфер для измерения.
Все реагенты и планшеты для измерений выдерживали на льду во время добавления реагентов. Реагенты вносили в лунки полипропиленового планшета с v-образным дном в следующем порядке: 25 мкл 10 нМ раствора 3H-дексаметазона, 50 мкл раствора TB/NSB/соединение и 25 мкл 2 нМ раствора ГР. После внесения всех добавок инкубационная смесь перемешивалась и инкубировалась в течение 2,5 часов при 4°C.
После 2,5-часовой инкубации несвязавшаяся метка удалялась обработкой покрытым декстраном активированным углем (dextran coated charcoal, DCC) следующим образом: 15 мкл раствора DCC (10% DCC в буфере для измерения) добавляли во все лунки и перемешивали (общий объем 115 мкл). Планшеты центрифугировали при 4000 об/мин в течение 10 минут при 4°C. По 75 мкл супернатанта аккуратно переносили пипеткой в планшеты для счета радиоактивности. Добавляли по 150 мкл сцинтилляционной смеси (Microscint-40, Perkin Elmer). Планшеты интенсивно встряхивали в течение 10 минут и считали радиоактивность в приборе Topcount.
Для измерения значений IC50 результаты рассчитывали как процент ингибирования связывания [3H]-дексаметазона и откладывали в виде сигмоидальной кривой (фиксирована на 100 и 0) для получения значений IC50 (концентрация соединения, которая вытесняет 50% связанной метки). Значения IC50 переводили в значения Ki (константа ингибирования) с использованием уравнения Ченга-Прусоффа. Результаты тестирования представлены в таблице 7.
Реагенты: буфер для измерения: 10 мМ фосфат калия, pH 7,6, содержащий 5 мМ ДТТ, 10 мМ молибдата натрия, 100 мкМ ЭДТА и 0,1% БСА.
Пример 44. Измерение функциональной активности ГР с использованием клеток SW1353/MMTV-5
Клетки SW1353/MMTV-5 представляют собой прикрепленную клеточную линию хондросаркомы человека, которая содержит эндогенные глюкокортикоидные рецепторы. Клетки трансфецировали плазмидой (pMAMneo-Luc), кодирующей люциферазу светлячка, локализованную позади элемента, отвечающего на глюкокортикоиды (ГРЕ), происходящего из вирусного промотора (длинный терминальный повтор вируса опухоли молочной железы мыши). Стабильная клеточная линия SW1353/MMTV-5 была выделена с помощью генетицина, который необходим для поддержания данной плазмиды. Таким образом, эта клеточная линия была чувствительна к глюкокортикоидам (дексаметазону), который вызывал экспрессию люциферазы (ЕС50 декс 10 нМ). Этот индуцируемый дексаметазоном ответ медленно затухает во времени, поэтому каждые три месяца берется новая культура из более ранних пассажей (из аликвот, хранящихся в криохранилище).
Для тестирования антагонистов ГР клетки SW1353/MMTV-5 инкубировали с несколькими разведениями соединений в присутствии 5×ЕС50 декс (50 нМ) и измеряли ингибирование индуцируемой экспрессии люциферазы путем детекции люминесценции на Topcount (Britelite Plus kit, Perking Elmer). Для каждого измерения получали кривую доза-ответ для дексаметазона, чтобы определить значение EC50 dex, необходимое для рассчета Ki на основании значений IC50 для каждого тестируемого соединения.
Клетки SW1353/MMTV-5 разливали в 96-луночные планшеты и инкубировали в среде (без генетицина) в течение 24 часов. Вносили разные разведения соединений в среде +50 нМ дексаметазона и инкубировали планшеты еще в течение 24 часов, после чего измеряли экспрессию люциферазы.
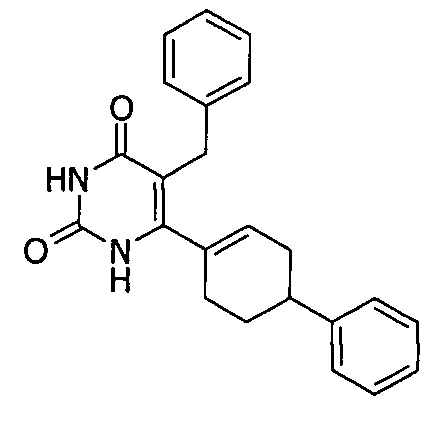

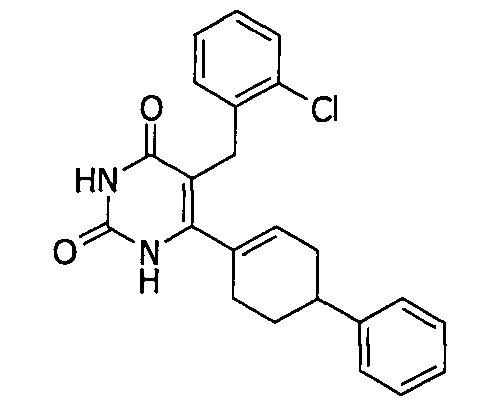
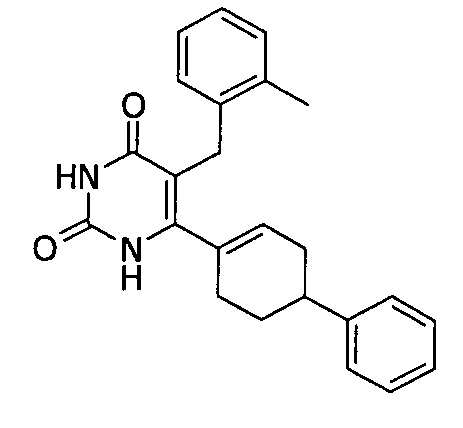
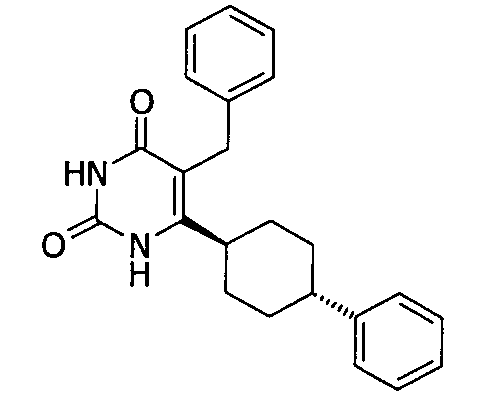
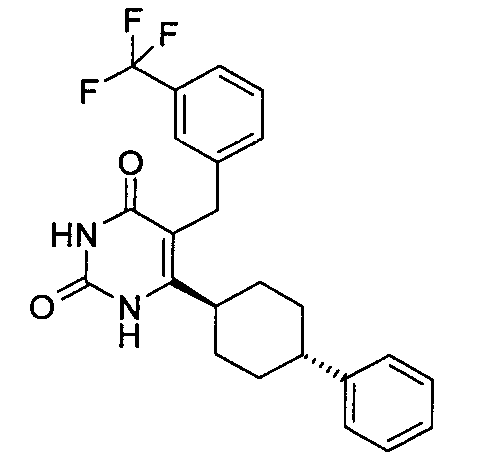

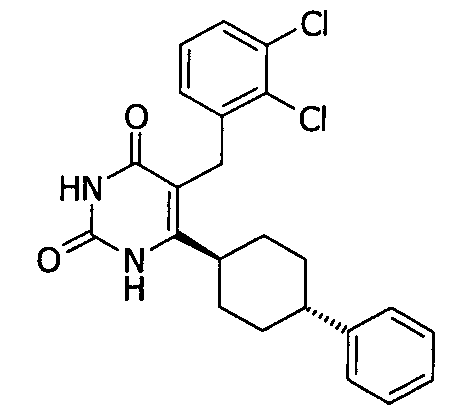
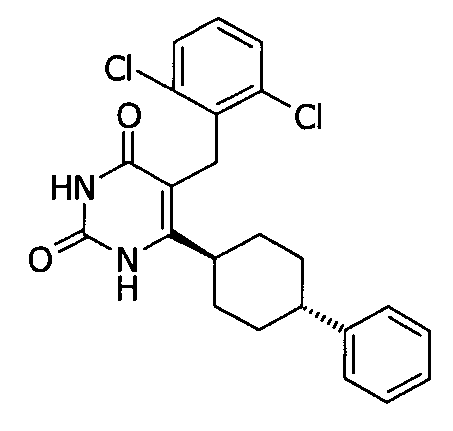
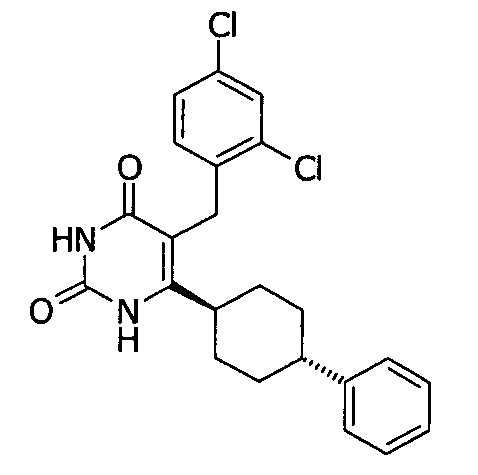

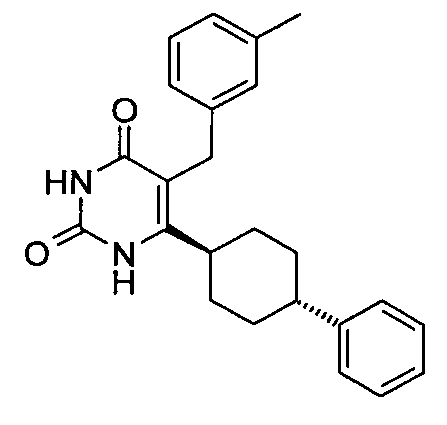

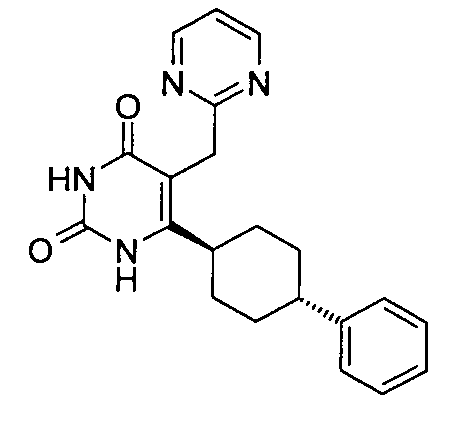

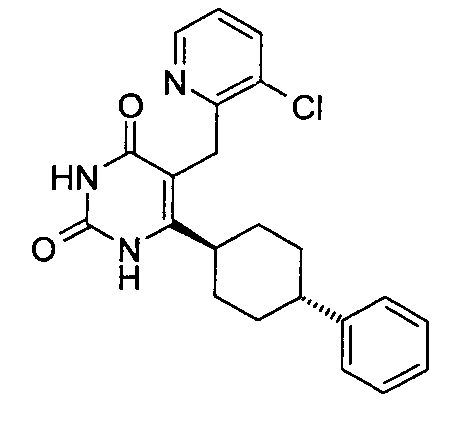

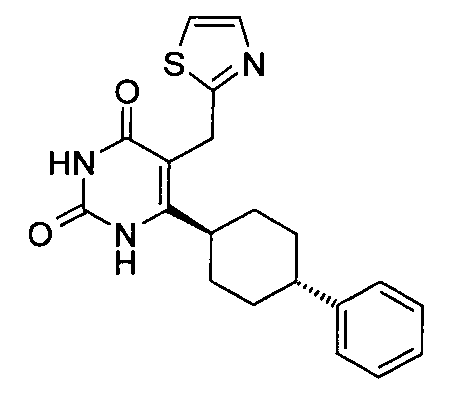





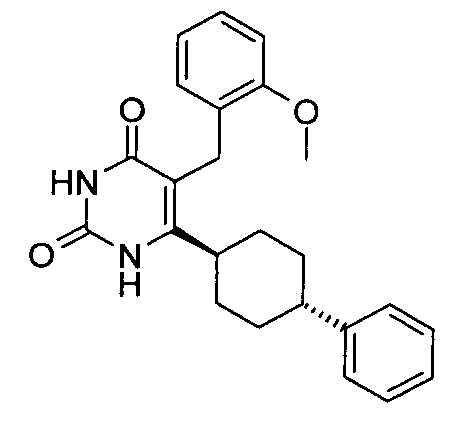
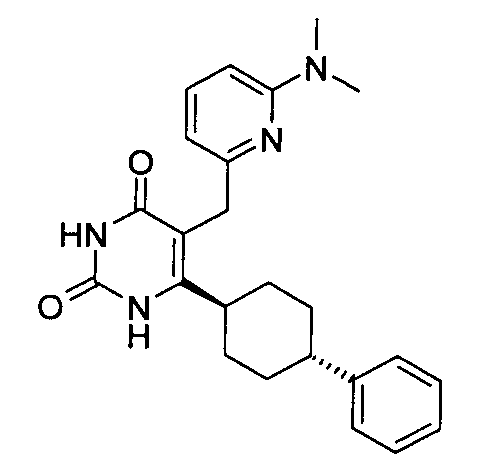
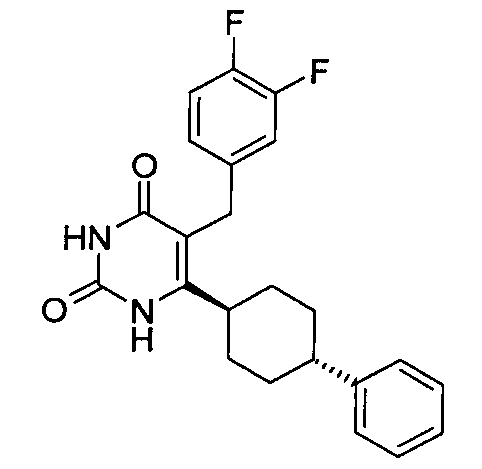


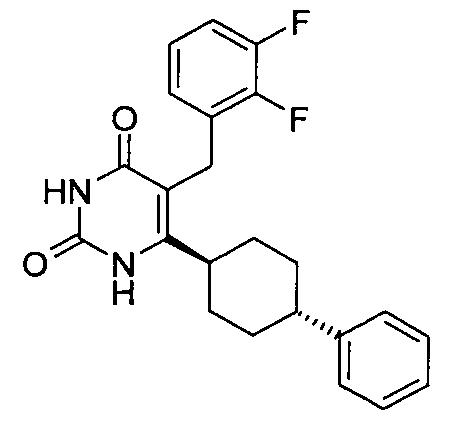

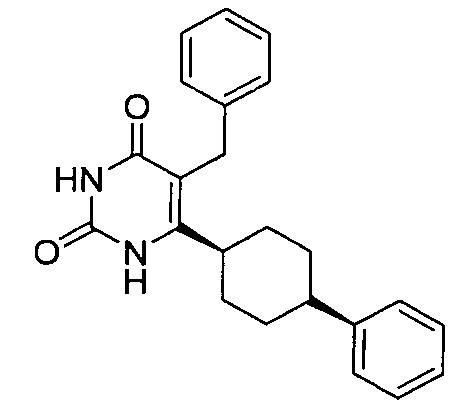
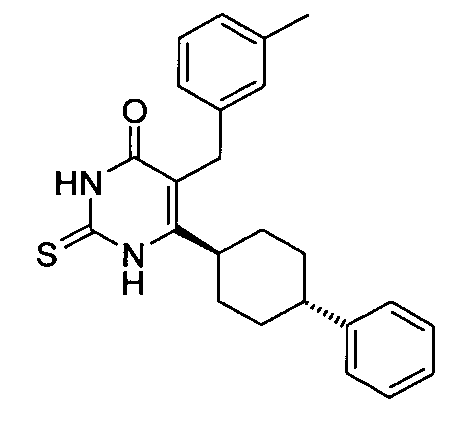


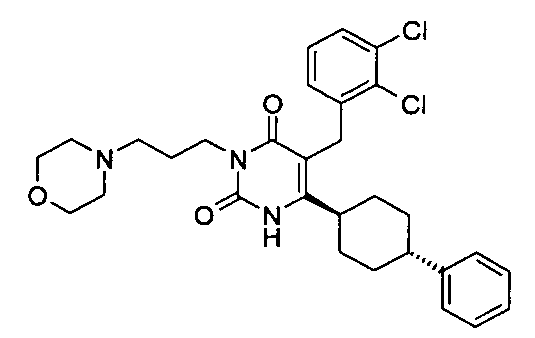
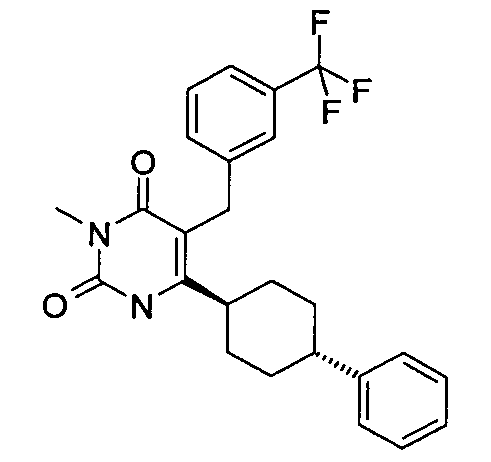
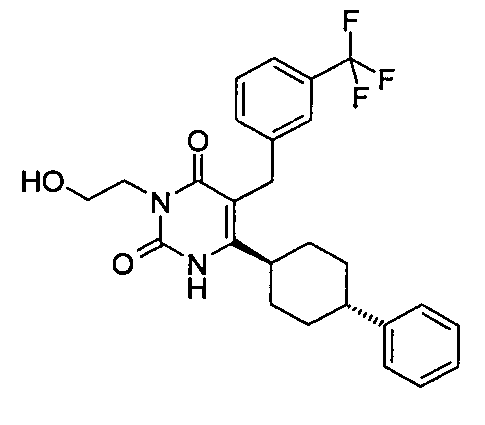
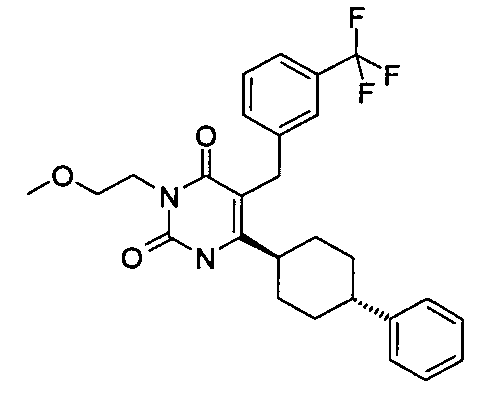
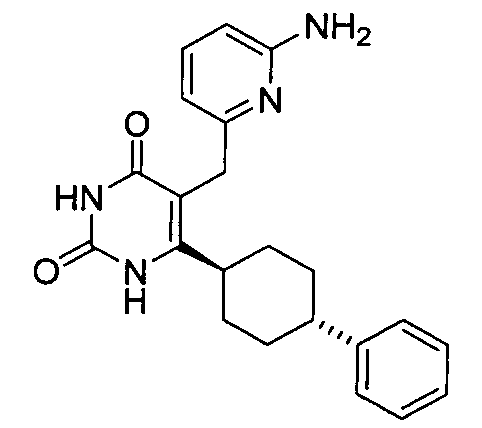
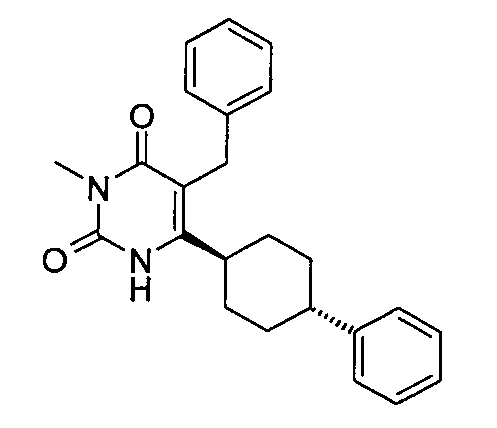
В таблице 7 соединения, связывающиеся с ГР со значением Ki меньше чем 5 нМ, обозначены +++; соединения со значением Ki от 5 нМ до 10 нМ обозначены ++; и соединения со значением Ki больше чем 10 нМ, обозначены +. Подавляющие функциональную активность соединения со значением Ki меньше чем 50 нМ, обозначены +++; соединения со значением Ki от 50 нМ до 100 нМ обозначены ++; и соединения со значением Ki больше чем 100 нМ, обозначены +.
Хотя настоящее изобретение было описано в некоторых деталях с помощью иллюстраций и примеров с целью ясности и понимания, специалист в данной области техники должен понимать, что определенные изменения и модификации могут практиковаться в рамках прилагаемой Формулы изобретения. Кроме того, каждая приведенная здесь ссылка является включенной во всей своей полноте путем включения в той же степени, как если бы каждая ссылка была индивидуально включена в настоящее изобретение путем отсылки. Там, где возникает конфликт между рассматриваемой заявкой и приводимой в ней ссылкой, рассматриваемая заявка должна рассматриваться, как преобладающая.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ С ГЕТЕРОАРИЛКЕТОНАМИ АЗАДЕКАЛИНЫ - МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2639867C2 |
| ГИДРОКСИМЕТИЛЦИКЛОГЕКСИЛАМИНЫ | 2009 |
|
RU2514192C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНА | 2009 |
|
RU2503660C2 |
| СОЕДИНЕНИЯ, ПРИГОДНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPM8 | 2011 |
|
RU2608109C2 |
| ОКТАГИДРО КОНДЕНСИРОВАННЫЕ АЗАДЕКАЛИНОВЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА | 2014 |
|
RU2674983C1 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2716136C2 |
| ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ 4-АМИНОЦИКЛОГЕКСАНА | 2009 |
|
RU2532545C2 |
| ПРОИЗВОДНЫЕ 2-ОКСОХИНАЗОЛИНА КАК ИНГИБИТОРЫ МЕТИОНИН АДЕНОЗИЛТРАНСФЕРАЗЫ 2A | 2019 |
|
RU2830169C2 |
| АМИНОИНДАНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ БОЛИ | 2012 |
|
RU2612959C2 |
| АЗАСПИРОПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТАГОНИСТОВ TRPM8 | 2015 |
|
RU2683309C2 |

Настоящее изобретение относится к новым пиримидиндион-циклогексильным соединениям формулы I, его фармацевтически приемлемым солям и изомерам, которые обладают свойствами ингибитора глюкокортикоидного рецептора (ГР). Соединения могут быть использованы для лечения заболевания или состояния путем модулирования глюкокортикоидного рецептора. При этом заболевание или состояние включает ожирение и вызванное нейролептиками увеличение веса. Изобретение также относится к фармацевтической композиции. В формуле I
 ,
,
пунктирная линия отсутствует или представляет собой связь; X выбирается из группы, состоящей из О и S; R1 выбирается из группы, состоящей из фенила и 5-6-членного гетероарила, содержащего от 1 до 3 гетероатомов, независимо выбираемых из N, О и S, необязательно замещенных от 1 до 3 группами R1a; каждый R1a независимо выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкокси, галогена, C1-6 галоалкила, -NR1bR1c и -SO2R1b; R1b и R1c каждый независимо выбираются из группы, состоящей из Н и C1-6 алкила; R2 выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкил-OR1b, C1-6 алкил-NR1bR1c и C1-6 алкилен-гетероциклоалкила; R3 выбирается из группы, состоящей из Н и C1-6 алкила; Ar представляет собой фенил, необязательно замещенный 1-4 группами R4; каждый R4 независимо выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкокси, галогена, C1-6 галоалкила и С1-6 галоалкокси; L1 представляет собой C1-6 алкилен; подстрочная n представляет собой целое число от 0 до 3. 4 н. и 13 з.п. ф-лы, 7 табл., 44 пр., 2 ил.
.
1. Соединение формулы I
 ,
,
где
пунктирная линия отсутствует или представляет собой связь;
X выбирается из группы, состоящей из О и S;
R1 выбирается из группы, состоящей из фенила и 5-6-членного гетероарила, содержащего от 1 до 3 гетероатомов, независимо выбираемых из N, О и S, необязательно замещенных от 1 до 3 группами R1a;
каждый R1a независимо выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкокси, галогена, C1-6 галоалкила, -NR1bR1c и -SO2R1b;
R1b и R1c каждый независимо выбираются из группы, состоящей из Н и C1-6 алкила;
R2 выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкил-OR1b, C1-6 алкил-NR1bR1c и C1-6 алкилен-гетероциклоалкила;
R3 выбирается из группы, состоящей из Н и C1-6 алкила;
Ar представляет собой фенил, необязательно замещенный 1-4 группами R4;
каждый R4 независимо выбирается из группы, состоящей из Н, C1-6 алкила, C1-6 алкокси, галогена, C1-6 галоалкила и С1-6 галоалкокси;
L1 представляет собой C1-6 алкилен;
подстрочная n представляет собой целое число от 0 до 3,
и его фармацевтически приемлемые соли и изомеры.
2. Соединение по п. 1 формулы Ia:
 .
.
3. Соединение по п. 1 формулы Ib
 .
.
4. Соединение по п. 1 формулы Iс
 .
.
5. Соединение по п. 1, где R1 выбирается из группы, состоящей из фенила, пиридила, пиримидина и тиазола.
6. Соединение по п. 1, где каждый R1a представляет собой C1-6 галоалкил.
7. Соединение по п. 1, где каждый R1a независимо выбирается из группы, состоящей из Н, Me, Et, -ОМе, F, Cl, -CF3, -NMe2 и -SO2Me.
8. Соединение по п. 1, где каждый R1a представляет собой -CF3.
9. Соединение по п. 1, где R2 выбирается из группы, состоящей из Н и C1-6 алкила.
10. Соединение по п. 1, где R2 представляет собой Н.
11. Соединение по п. 1, выбираемое из группы, состоящей из:
 ,
,  ,
, 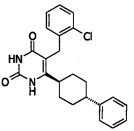 ,
,
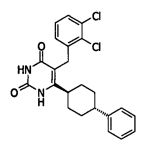 ,
,  ,
, 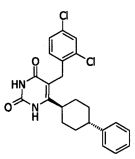 ,
,
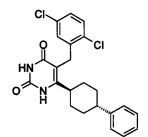 ,
, 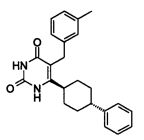 ,
, 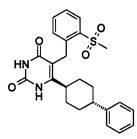 ,
,
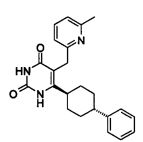 ,
, 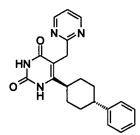 ,
, 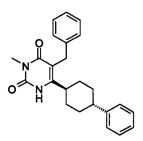 ,
,
 ,
, 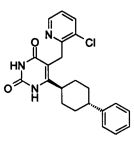 ,
, 
 ,
,  ,
, 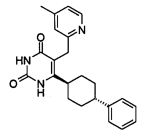 ,
,
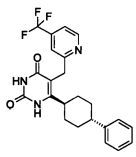 ,
,  ,
, 
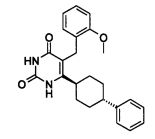 ,
,  ,
, 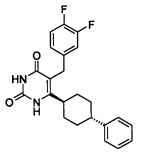 ,
,
 ,
,  ,
, 
 ,
,  ,
,  ,
,
 и
и  .
.
12. Соединение по п. 1 формулы
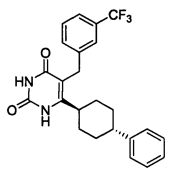 .
.
13. Фармацевтическая композиция, обладающая свойствами ингибитора глюкокортикоидного рецептора (ГР), содержащая фармацевтически приемлемый эксципиент и терапевтически эффективное количество соединения по любому из пп. от 1 до 12.
14. Способ лечения заболевания или состояния путем модулирования глюкокортикоидного рецептора, включающий введение терапевтически эффективного количества соединения по любому из пп. от 1 до 12, тем самым обеспечивая лечение данного заболевания или состояния.
15. Способ лечения заболевания или состояния путем блокирования глюкокортикоидного рецептора, включающий введение эффективного количества соединения по любому из пп. от 1 до 12.
16. Способ по п. 15, где заболевание или состояние выбирается из группы, включающей ожирение и вызванное нейролептиками увеличение веса.
17. Способ по п. 15, где заболевание или состояние представляет собой вызванное нейролептиками увеличение веса.
| US 7576076 B2, 18.08.2009 | |||
| BLEDSOE R K; ET AL Crystal Structure of the Glucocorticoid ReceptOR Ligand Binding Domain Reveals a Novel Mode of Receptor Dimerization and Coactivator Recognition CELL, 2002, Vol:110, Page(s):93-105 | |||
| WO 2006014394 A1, 09.02.2006-02-09 | |||
| ПРОИЗВОДНЫЕ ПИРИМИДИНДИОНА, ТРИАЗИНДИОНА, ТЕТРАГИДРОХИНАЗОЛИНДИОНА В КАЧЕСТВЕ АНТАГОНИСТОВ α-АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2175322C2 |
Авторы
Даты
2016-10-10—Публикация
2012-03-16—Подача