ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет согласно предварительной заявке США за номерами 61/985035, поданной 28 апреля 2014 года, и 61/908333, поданной 25 ноября 2013 года, каждая из которых для любых целей включена в настоящую заявку в полном объеме.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
[0002] У большинства биологических видов, включая человека, физиологическим глюкокортикоидом является кортизол (гидрокортизон). Глюкокортикоиды секретируются в ответ на АКТГ (кортикотропин), что показывает как изменение циркадных ритмов, так и повышение в ответ на стресс и рацион. Уровни кортизола в считанные минуты реагируют на многие физические и физиологические стрессы, включая травму, хирургическое вмешательство, физические упражнения, страх и депрессию. Кортизол представляет собой стероидный гормон и действует, связываясь с внутриклеточным глюкокортикоидным рецептором (ГР). В организме человека глюкокортикоидные рецепторы представлены в двух формах: лиганд-связывающая изоформа ГР-альфа, состоящая из 777 аминокислот; и ГР-бета изоформа, не содержащая 50 карбокси концевых остатков. Поскольку указанные остатки включают лиганд-связывающий домен, ГР-бета не способен связывать природный лиганд, и постоянно локализован в ядре. Указанный ГР также называют рецептором ГР-II.
[0003] Биологические эффекты кортизола, включая эффекты, обусловленные гиперкортизолемией, могут регулироваться на уровне ГР с использованием модуляторов рецепторов, таких как агонисты, частичные агонисты и антагонисты. Несколько различных классов агентов способны блокировать физиологические эффекты связывания ГР-агониста. Указанные антагонисты включают композиции, которые, посредством связывания с ГР, блокируют способность агониста эффективно связываться с ГР и/или активировать ГР. Было обнаружено, что один из таких известных антагонистов ГР, мифепристон, является эффективным анти-глюкокортикоидным агентом для человека (Bertagna (1984) J. Clin. Endocrinol. Metab. 59:25). Мифепристон связывается с ГР с высокой аффинностью с константой диссоциации (Kd), равной 10-9 М (Cadepond (1997) Annu. Rev. Med 48:129). В данной области техники существует необходимость в разработке новых композиций и способов модулирования рецепторов ГР. Неожиданным образом, настоящее изобретение отвечает этим и другим требованиям.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0004] В настоящем изобретении предложено множество конденсированных азадекалиновых соединений. В некоторых вариантах реализации настоящего изобретения предложены соединения формулы:
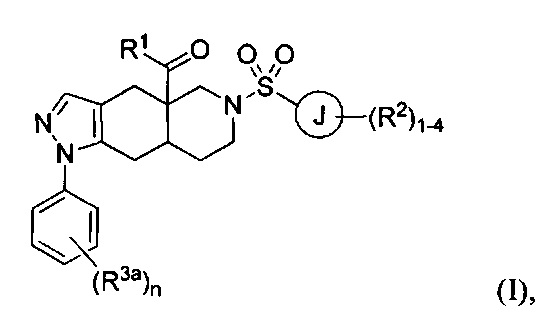
где R1 в формуле I представляет собой гетероарильное кольцо, содержащее от 5 до 6 членов и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a. Каждый из R1a в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, N-оксид или С3-8 циклоалкил. Кольцо J в формуле I может представлять собой арильное кольцо или гетероарильное кольцо, содержащее от 5 до 6 членов и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S. Каждый из R2 в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, C1-6 алкил-C1-6 алкокси, -CN, -ОН, -NR2aR2b, -C(O)R2a, -C(O)OR2a, -C(O)NR2aR2b, -SR2a, -S(O)R2a, -S(O)2R2a, С3-8 циклоалкил или С3-8 гетероциклоалкил, содержащий от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S. В качестве альтернативы две группы R2 на соседних атомах кольца объединены с образованием гетероциклоалкильного кольца, содержащего от 5 до 6 членов и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О и S, причем указанное гетероциклоалкильное кольцо необязательно в качестве заместителя содержит от 1 до 3 групп R2c; каждый из R2a, R2b и R2c в формуле I может независимо представлять собой водород и C1-6 алкил. Каждый R3a в формуле I может независимо представлять собой галоген. Нижний индекс n в формуле I может представлять собой целое число от 0 до 3. Соединения формулы I также могут представлять собой соли и изомеры указанного соединения.
[0005] В некоторых вариантах реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению и фармацевтически приемлемое вспомогательное вещество.
[0006] В некоторых вариантах реализации настоящего изобретения предложен способ модулирования глюкокортикоидного рецептора, включающий приведение глюкокортикоидного рецептора в контакт с соединением согласно настоящему изобретению, обеспечивая таким образом модулирование глюкокортикоидного рецептора.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0007] На Фиг. 1, 2, 3 и 4 показаны различные схемы синтеза для получения соединений согласно настоящему изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Общие сведения
[0008] В настоящем изобретении предложены соединения, способные модулировать глюкокортикоидный рецептор (ГР) и обеспечивающие таким образом благоприятные терапевтические эффекты. Указанные соединения включают октагидро конденсированные азадекалины. В настоящем изобретении также предложены способы лечения заболеваний и нарушений посредством модулирования рецептора ГР с помощью соединений согласно настоящему изобретению.
II. Определения
[0009] Условные обозначения, используемые в настоящей заявке, имеют значение, общепринятое в области химии и биологии.
[0010] В случае, когда группы заместителей определяются своими общепринятыми химическими формулами, написанными слева направо, они в равной степени охватывают химически идентичные заместители, полученные в результате написания указанной структуры справа налево, например, -СН2О- эквивалентен -ОСН2-.
[0011] «Алкил» относится к линейному или разветвленному насыщенному алифатическому радикалу, содержащему указанное число атомов углерода. Алкил может содержать любое число атомов углерода, как например, С1-2, С1-3, С1-4, С1-5, C1-6, С1-7, С1-8, С1-9, C1-10, С2-3, С2-4, С2-5, С2-6, С3-4, С3-5, С3-6, С4-5, С4-6 и С5-6. Например, C1-6 алкил включает, но не ограничивается указанными, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, гексил, и т.д.
[0012] «Алкокси» относится к алкильной группе, содержащей атом кислорода, соединяющий указанную алкильную группу с точкой присоединения: алкил-О-. В отношении алкильной группы, алкокси группа может содержать любое подходящее число атомов углерода, например, C1-6. Алкокси группы включают, например, метокси, этокси, пропокси, изо-пропокси, бутокси, 2-бутокси, изо-бутокси, втор-бутокси, трет-бутокси, пентокси, гексокси, и т.д.
[0013] «Галоген» относится к фтору, хлору, брому и иоду.
[0014] «Галогеналкил» относится к алкилу, описанному выше, в котором некоторые или все атомы водорода заменены атомами галогена. В отношении алкильной группы, группа галогеналкил может содержать любое подходящее число атомов углерода, например, С1-6. Например, галогеналкил включает трифторметил, фторметил, и т.д. В некоторых случаях может быть использован термин "перфтор" для определения соединения или радикала, где все атомы водорода заменены на фтор. Например, перфторметан включает 1,1,1-трифторметил.
[0015] «Галогеналкокси» относится к алкокси группе, в которой некоторые или все атомы водорода заменены атомами галогена. В отношении алкильной группы, группы галогеналкокси могут содержать любое подходящее число атомов углерода, например, C1-6. Алкокси группы могут быть замещены 1, 2, 3 или более галогенами. В случае, когда все атомы водорода заменены галогеном, например, фтором, указанные соединения являются перзамещенными, например, перфторированными. Галогеналкокси включает, но не ограничивается указанными, трифторметокси, 2,2,2-трифторэтокси, перфторэтокси и т.д.
[0016] «Циклоалкил» относится к насыщенной или частично ненасыщенной моноциклической, конденсированной бициклической или соединенной мостиками полициклической системе колец, содержащей от 3 до 12 атомов в кольце, или указанное число атомов. Циклоалкил может включать любое число атомов углерода, например, С3-6, С4-6, С5-6, С3-8, С4-8, С5-8, С6-8, С3-9, С3-10, С3-11 и С3-12. Насыщенные моноциклические циклоалкильные кольца включают, например, циклопропил, циклобутил, циклопентил, циклогексил и циклооктил. Насыщенные бициклические и полициклические циклоалкильные кольца включают, например, норборнан, [2,2,2] бициклооктан, декагидронафталин и адамантан. Циклоалкильные группы также могут быть частично ненасыщенными, содержащими одну или более двойных или тройных связей в кольце. Типичные циклоалкильные группы, которые являются частично ненасыщенными, включают, но не ограничиваются указанными, циклобутен, циклопентен, циклогексен, циклогексадиен (1,3- и 1,4-изомеры), циклогептен, циклогептадиен, циклооктен, циклооктадиен (1,3-, 1,4- и 1,5-изомеры), норборнен и норборнадиен. В случае, когда циклоалкил представляет собой насыщенный моноциклический С3-8 циклоалкил, типичные группы включают, но не ограничиваются циклопропилом, циклобутилом, циклопентилом, циклогексилом, циклогептилом и циклооктилом. В случае, когда циклоалкил представляет собой насыщенный моноциклический С3-6 циклоалкил, типичные группы включают, но не ограничиваются циклопропилом, циклобутилом, циклопентилом и циклогексилом.
[0017] «Гетероциклоалкил» относится к насыщенной кольцевой системе, содержащей от 3 до 12 членов в кольце и от 1 до 4 гетероатомов из N, О и S. Подходящими также являются дополнительные гетероатомы, включая, но не ограничиваясь указанными, В, Al, Si и Р. Указанные гетероатомы также могут быть окисленными, например, но не ограничиваясь указанными, -S(O)- и -S(O)2-. Гетероциклоалкильные группы могут содержать любое число атомов в кольце, например, от 3 до 6, от 4 до 6, от 5 до 6, от 3 до 8, от 4 до 8, от 5 до 8, от 6 до 8, от 3 до 9, от 3 до 10, от 3 до 11 или от 3 до 12 членов в кольце. Гетероциклоалкильные группы могут содержать любое подходящее число гетероатомов, например 1, 2, 3 или 4, или от 1 до 2, от 1 до 3, от 1 до 4, от 2 до 3, от 2 до 4, или от 3 до 4. Гетероциклоалкильная группа может включать такие группы, как азиридин, азетидин, пирролидин, пиперидин, азепан, азокан, хинуклидин, пиразолидин, имидазолидин, пиперазин (1,2-, 1,3- и 1,4-изомеры), оксиран, оксетан, тетрагидрофуран, океан (тетрагидропиран), оксепан, тииран, тиетан, тиолан (тетрагидротиофен), тиан (тетрагидротиопиран), оксазолидин, изоксалидин, тиазолидин, изотиазолидин, диоксолан, дитиолан, морфолин, тиоморфолин, диоксан или дитиан. Гетероциклоалкильные группы также могут быть конденсированы с ароматическими или неароматическими системами колец с образованием типичных представителей, включая, но не ограничиваясь указанным, индолин.
[0018] В случае, когда циклоалкил содержит от 3 до 8 членов в кольце и от 1 до 3 гетероатомов, типичные представители включают, но не ограничиваются указанными, пирролидин, пиперидин, тетрагидрофуран, оксан, тетрагидротиофен, тиан, пиразолидин, имидазолидин, пиперазин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, морфолин, тиоморфолин, диоксан и дитиан. Гетероциклоалкил может также образовывать кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 2 гетероатомов, типичные представители указного гетероциклоалкила включают, но не ограничиваются указанными, пирролидин, пиперидин, тетрагидрофуран, тетрагидротиофен, пиразолидин, имидазолидин, пиперазин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин и морфолин.
[0019] «Арил» относится к ароматической системе колец, содержащей любое подходящее число атомов в кольце и любое подходящее число колец. Арильные группы могут содержать любое подходящее число атомов в кольце, например, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 атомов в кольце, а также от 6 до 10, от 6 до 12 или от 6 до 14 членов в кольце. Арильные группы могут быть моноциклическими, конденсированными с образованием бициклических или трициклических групп, или соединенными связью с образованием биарильной группы. Типичные арильные группы включают фенил, нафтил и бифенил. Другие арильные группы включают бензил, содержащий метиленовую соединяющую группу. Некоторые арильные группы содержат от 6 до 12 членов в кольце, такие как фенил, нафтил или бифенил. Другие арильные группы содержат от 6 до 10 членов в кольце, такие как фенил или нафтил. Некоторые другие арильные группы содержат 6 членов в кольце, например, фенил. Арильные группы могут быть замещенными или незамещенными.
[0020] «Гетероарил» относится к моноциклической или конденсированной бициклической или трициклической ароматической кольцевой системе, содержащей от 5 до 16 атомов в кольце, причем от 1 до 5 указанных атомов в кольце представляют собой гетероатомы, такие как N, О или S. Также подходящими могут являться дополнительные гетероатомы, включая, но не ограничиваясь указанными, В, Al, Si и Р. Указанные гетероатомы также могут быть окисленными, например, но не ограничиваясь указанными, N-оксид, -S(O)- и -S(O)2-. Гетероарильные группы могут содержать любое число атомов в кольце, например, от 3 до 6, от 4 до 6, от 5 до 6, от 3 до 8, от 4 до 8, от 5 до 8, от 6 до 8, от 3 до 9, от 3 до 10, от 3 до 11 или от 3 до 12 членов в кольце. Гетероарильные группы могут содержать любое подходящее число гетероатомов, например 1, 2, 3, 4 или 5, или от 1 до 2, от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 3, от 2 до 4, от 2 до 5, от 3 до 4 или от 3 до 5. Гетероарильные группы могут содержать от 5 до 8 членов в кольце и от 1 до 4 гетероатомов, или от 5 до 8 членов в кольце и от 1 до 3 гетероатомов, или от 5 до 6 членов в кольце и от 1 до 4 гетероатомов, или от 5 до 6 членов в кольце и от 1 до 3 гетероатомов. Гетероарильная группа может включать такие группы, как пиррол, пиридин, имидазол, пиразол, триазол, тетразол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), тиофен, фуран, тиазол, изотиазол, оксазол, и изоксазол. Гетероарильные группы могут быть также сконденсированы с ароматическими кольцевыми системами, например, с фенильным кольцом с образованием представителей, включающих, но не ограничивающихся указанными, бензопирролы, такие как индол и изоиндол, бензопиридины, такие как хинолин и изохинолин, бензопиразин (хиноксалин), бензопиримидин (хиназолин), бензопиридазины, такие как фталазин и циннолин, бензотиофен и бензофуран. Другие гетероарильные группы включают гетероарильные кольца, соединенные связью, такие как бипиридин. Гетероарильные группы могут быть замещенными или незамещенными.
[0021] Гетероарильные группы могут быть соединены по любому положению в кольце. Например, пиррол включает 1-, 2- и 3-пиррол, пиридин включает 2-, 3- и 4-пиридин, имидазол включает 1-, 2-, 4- и 5-имидазол, пиразол включает 1-, 3-, 4- и 5-пиразол, триазол включает 1-, 4- и 5-триазол, тетразол включает 1- и 5-тетразол, пиримидин включает 2-, 4-, 5- и 6- пиримидин, пиридазин включает 3- и 4-пиридазин, 1,2,3-триазин включает 4- и 5-триазин, 1,2,4-триазин включает 3-, 5- и 6-триазин, 1,3,5-триазин включает 2-триазин, тиофен включает 2- и 3-тиофен, фуран включает 2- и 3-фуран, тиазол включает 2-, 4- и 5-тиазол, изотиазол включает 3-, 4- и 5-изотиазол, оксазол включает 2-, 4- и 5-оксазол, изоксазол включает 3-, 4- и 5-изоксазол, индол включает 1-, 2- и 3-индол, изоиндол включает 1- и 2-изоиндол, хинолин включает 2-, 3- и 4-хинолин, изохинолин включает 1-, 3- и 4-изохинолин, хиназолин включает 2- и 4-хиназолин, циннолин включает 3- и 4-циннолин, бензотиофен включает 2- и 3-бензотиофен, и бензофуран включает 2- и 3-бензофуран.
[0022] Некоторые гетероарильные группы включают группы, содержащие от 5 до 10 членов в кольце и от 1 до 3 атомов в кольце, включающих N, О или S, такие как пиррол, пиридин, имидазол, пиразол, триазол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), тиофен, фуран, тиазол, изотиазол, оксазол, изоксазол, индол, изоиндол, хинолин, изохинолин, хиноксалин, хиназолин, фталазин, циннолин, бензотиофен и бензофуран. Другие гетероарильные группы включают группы, содержащие от 5 до 8 членов в кольце и от 1 до 3 гетероатомов, такие как пиррол, пиридин, имидазол, пиразол, триазол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), тиофен, фуран, тиазол, изотиазол, оксазол и изоксазол. Некоторые другие гетероарильные группы включают группы, содержащие от 9 до 12 членов в кольце и от 1 до 3 гетероатомов, такие как индол, изоиндол, хинолин, изохинолин, хиноксалин, хиназолин, фталазин, циннолин, бензотиофен, бензофуран и бипиридин. Еще другие гетероарильные группы включают группы, содержащие от 5 до 6 членов в кольце и от 1 до 2 гетероатомов, включающих N, О или S, такие как пиррол, пиридин, имидазол, пиразол, пиразин, пиримидин, пиридазин, тиофен, фуран, тиазол, изотиазол, оксазол и изоксазол.
[0023] Некоторые гетероарильные группы содержат от 5 до 10 членов в кольце и только гетероатомы азота, такие как пиррол, пиридин, имидазол, пиразол, триазол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), индол, изоиндол, хинолин, изохинолин, хиноксалин, хиназолин, фталазин и циннолин. Другие гетероарильные группы содержат от 5 до 10 членов в кольце и только гетероатомы кислорода, такие как фуран и бензофуран. Некоторые другие гетероарильные группы содержат от 5 до 10 членов в кольце и только гетероатомы серы, такие как тиофен и бензотиофен. Еще другие гетероарильные группы содержат от 5 до 10 членов в кольце и по меньшей мере два гетероатома, такие как имидазол, пиразол, триазол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), тиазол, изотиазол, оксазол, изоксазол, хиноксалин, хиназолин, фталазин и циннолин.
[0024] «Гетероатомы» относятся к О, S или N.
[0025] «Соль» относится к кислым или основным солям соединений, используемых в способах согласно настоящему изобретению. Иллюстративные примеры фармацевтически приемлемых солей представляют собой соли минеральных кислот (соляной кислоты, бромистоводородной кислоты, фосфорной кислоты и тому подобных), соли органических кислот (уксусной кислоты, пропионовой кислоты, глутаминовой кислоты, лимонной кислоты и тому подобных), соли четвертичного аммония (метил иодид, этил иодид и тому подобные). Необходимо понимать, что фармацевтически приемлемые соли являются нетоксичными. Дополнительную информацию о подходящих фармацевтически приемлемых солях можно найти в справочнике Remington's Pharmaceutical Sciences, 17-е изд., Mack Publishing Company, Easton, Pa., 1985, полностью включенном в настоящую заявку посредством ссылки.
[0026] «Изомеры» относятся к соединениям, имеющим одинаковую химическую формулу, но отличающимся друг от друга по структуре.
[0027] «Таутомер» относится к одному из двух или более структурных изомеров, которые существуют в равновесии и легко переходят из одной формы в другую.
[0028] «Фармацевтически приемлемое вспомогательное вещество» и «фармацевтически приемлемый носитель» относятся к веществу, которое предназначено для введения активного агента субъекту и его абсорбции и может входить в состав композиций согласно настоящему изобретению, не оказывая значительного побочного токсикологического действия на пациента. Неограничивающие примеры фармацевтически приемлемых вспомогательных веществ включают воду, NaCl, физиологические растворы, раствор Рингера с лактатом, стандартный раствор сахарозы, стандартный раствор глюкозы, связующие вещества, наполнители, дезинтегрирующие вещества, лубриканты, покрытия, подсластители, ароматизаторы и красители, и тому подобные. Специалисту в области техники будет понятно, что другие фармацевтически приемлемые вспомогательные вещества также являются подходящими согласно настоящему изобретению.
[0029] «Модулирование глюкокортикоидного рецептора» относится к способам регулирования ответа глюкокортикоидного рецептора по отношению к глюкокортикоидам, антагонистам глюкокортикоидов, агонистам и частичным агонистам. Указанные способы включают приведение глюкокортикоидного рецептора в контакт с эффективным количеством антагониста, агониста или частичного агониста и определение изменения активности ГР.
[0030] «Модулятор ГР» относится к соединениям, которые выступают в роли агониста и/или антагониста глюкокортикоидного рецептора и определяется как соединения Формулы I, как представлено ниже.
[0031] «Глюкокортикоидный рецептор» («ГР») относится к семейству внутриклеточных рецепторов, которые специфически связываются с кортизолом и/или аналогами кортизола (например, дексаметазон). Глюкокортикоидный рецептор также называют рецептором кортизола. Указанный термин включает изоформы ГР, рекомбинантный ГР и мутировавший ГР.
[0032] «Антагонист глюкокортикоидного рецептора» относится к любой композиции или соединению, которое частично или полностью ингибирует (выступает в роли антагониста) связывание агониста глюкокортикоидного рецептора (ГР), например, кортизола или аналогов кортизола, синтетических или природных, по отношению к ГР. «Специфичный антагонист глюкокортикоидного рецептора» относится к любой композиции или соединению, которое ингибирует любой биологический ответ, ассоциированный со связыванием ГР с агонистом. Под «специфичным» понимается лекарственное средство, предпочтительно связывающееся с ГР, в отличие от других ядерных рецепторов, таких как минералокортикоидный рецептор (MP) или прогестероновый рецептор (ПР).
[0033] «Приведение в контакт» относится к процессу приведения в контакт по меньшей мере двух различных соединений таким образом, что они вступают в реакцию друг с другом или взаимодействуют таким образом, что одно из них оказывает действие на другое.
[0034] «Лечить» или «лечение» относятся к любому признаку успешного лечения или облегчения повреждения, патологии или состояния, включая любой объективный или субъективный параметр, такой как ослабление боли или выраженности симптома; ремиссия; уменьшение симптомов или обеспечение лучшей переносимости пациентом травмы, патологии или состояния; снижение скорости дегенерации или ухудшения здоровья; обеспечение условий, при которых конечная точка дегенерации будет менее изнуряющей; улучшение физического и ментального состояния здоровья пациента. Лечение или облегчение симптомов может быть основано на объективных или субъективных параметрах; влючая результаты физического обследования, нейропсихиатрического обследования и/или психиатрической оценки.
[0035] «Пациент» или «субъект, нуждающийся в этом», относится к живому организму, страдающему от или предрасположенному к состоянию, подходящему для лечения посредством введения фармацевтической композиции согласно настоящей заявке. Неограничивающие примеры включают человека, других млекопитающих и немлекопитающих животных.
[0036] «Нарушение» или «состояние» относится к состоянию или состоянию здоровья пациента или субъекта, подходящему для лечения модуляторами глюкокортикоидных рецепторов согласно настоящему изобретению. Примеры нарушений или состояний включают, но не ограничиваются указанными, ожирение, гипертензию, депрессивный синдром, тревожность и синдром Кушинга.
[0037] «Выступать в роли антагониста» относится к блокированию связывания агониста с молекулой рецептора или к ингибированию сигнала, вырабатываемого агонистом рецептора. Антагонист рецептора блокирует или замедляет агонист-опосредованные ответы.
[0038] «Терапевтически эффективное количество» относится к количеству конъюгированного функционального агента или фармацевтической композиции, подходящей для лечения или облегчения обнаруженного заболевания или состояния, или для проявления видимого терапевтического или ингибиторного эффекта. Указанный эффект может быть определен любым способом анализа, известным в области техники.
[0039] Описание изобретений согласно настоящему изобретению ограничено принципами образования химических связей, известными специалистам в области техники. Соответственно, в случае, когда группа может быть замещена одним или более из некоторого количества заместителей, такие замещения выбирают таким образом, чтобы они соответствовали принципам образования химических связей и образовывали соединения, которые не были бы внутренне нестабильны и/или были бы известны специалисту в области техники как вероятно нестабильные при условиях окружающей среды, например, водные, нейтральные или физиологические условия.
III. Соединения
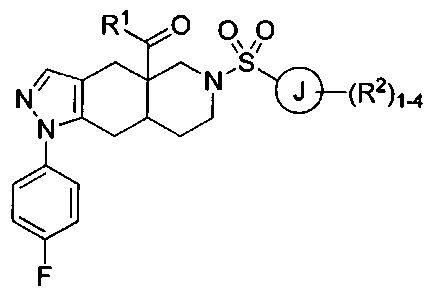
[0040] В настоящем изобретении предложено множество конденсированных азадекалиновых соединений. В некоторых вариантах реализации настоящего изобретения предложены соединения формулы:
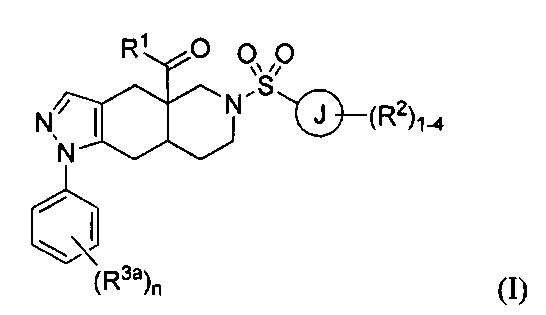
где R1 в формуле I представляет собой гетероарильное кольцо, содержащее от 5 до 6 членов и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a. Каждый из R1a в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, N-оксид или С3-8 циклоалкил. Кольцо J в формуле I может представлять собой арильное кольцо или гетероарильное кольцо, содержащее от 5 до 6 членов и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S. Каждый из R2 в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, С1-6 алкил-С1-6 алкокси, -CN, -ОН, -NR2aR2b, -C(O)R2a, -C(O)OR2a, -C(O)NR2aR2b, -SR2a, -S(O)R2a, -S(O)2R2a, С3-8 циклоалкил или С3-8 гетероциклоалкил, содержащий от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S. В качестве альтернативы две группы R2 на соседних атомах кольца объединены с образованием гетероциклоалкильного кольца, содержащего от 5 до 6 членов и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S, причем указанное гетероциклоалкильное кольцо необязательно в качестве заместителя содержит от 1 до 3 групп R2c; каждый из R2a, R2b и R2c в формуле I может независимо представлять собой водород или C1-6 алкил. Каждый R3a в формуле I может независимо представлять собой галоген. Нижний индекс n в формуле I может представлять собой целое число от 0 до 3. Соединения формулы I также могут представлять собой соли и изомеры указанного соединения.
[0041] Согласно некоторым вариантам реализации изобретения R1 в формуле I может представлять собой гетероарильное кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-3 группами, каждая из которых независимо выбрана из R1a. Каждый R1a в формуле I может представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси или С3-8 циклоалкил. Кольцо J в формуле I может представлять собой арильное кольцо или гетероарильное кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S. Каждый R2 в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, CN, -NR2aR2b, С3-8 циклоалкил или С3-8 гетероциклоалкил, содержащий от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S, причем указанное гетероциклоалкильное кольцо необязательно в качестве заместителя содержит от 1 до 3 групп R2c. Каждый из R2a, R2b и R2c в формуле I может независимо представлять собой водород или C1-6 алкил. Каждый R3a может независимо представлять собой галоген. Нижний индекс n в формуле I может представлять собой целое число от 0 до 3. Соединения формулы I также могут представлять собой соли или изомеры указанных соединений.
[0042] Согласно некоторым вариантам реализации изобретения R1 может представлять собой гетероарильное кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-2 группами, каждая из которых может независимо представлять собой R1a. Каждый R1a может независимо представлять собой водород, C1-6 алкил, галоген или C1-6 галогеналкил. Кольцо J может представлять собой арильное кольцо или гетероарильное кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 3 гетероатомов, каждый из которых независимо может представлять собой N или S. Каждый R2 в формуле I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил или -CN. R3a может представлять собой F. Нижний индекс n в формуле I может представлять собой целое число от 0 до 1.
[0043] Согласно некоторым вариантам реализации изобретения R1 может представлять собой гетероарильное кольцо, содержащее от 5 до 6 членов в кольце и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N или S, необязательно замещенный 1-2 группами, каждая из которых может независимо представлять собой R1a. Каждый R1a может независимо представлять собой водород, C1-6 алкил или C1-6 галогеналкил. Кольцо J может представлять собой фенил, пиридин, пиразол или триазол. Каждый R2 может независимо представлять собой водород, С1-6 алкил, галоген, C1-6 галогеналкил или -CN. R3a может представлять собой F.
[0044] Согласно некоторым вариантам реализации изобретения R1 может представлять собой пиридин или тиазол. Кольцо J может представлять собой фенил, пиридин, пиразол, или триазол. Каждый из R2 может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил или -CN. R3a может представлять собой F. Согласно некоторым вариантам реализации изобретения R1 может представлять собой 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин или 4-пиридин. Согласно некоторым вариантам реализации изобретения R1 может представлять собой 2-пиридин; 2-тиазол; или 4-тиазол. Согласно некоторым вариантам реализации изобретения R1 может представлять собой пиридин. Согласно некоторым вариантам реализации изобретения R1 может представлять собой триазол. Согласно некоторым вариантам реализации изобретения R1a может независимо представлять собой водород, C1-6 алкил или C1-6 галогеналкил. Согласно некоторым вариантам реализации изобретения R1a может независимо представлять собой водород, метил, или трифторметил.
[0045] Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил, пиридин, пиразол, или триазол. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил, 2-пиридин, 3-пиридин, 4-пиридин, 1-пиразол, 3-пиразол, 4-пиразол, 5-пиразол, 1,2,3-триазол-4-ил, 1,2,3,-триазол-5-ил, 1,2,4-триазол-3-ил или 1,2,4-триазол-5-ил. Согласно некоторым вариантам реализации изобретения R2 может независимо представлять собой водород, метил, этил, пропил, изопропил, F, Cl или -CF3.
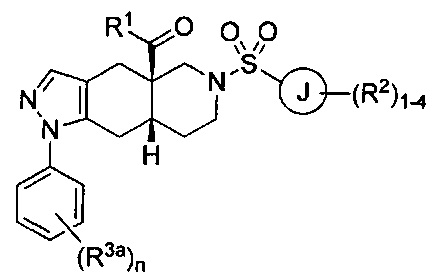
[0046] Соединения согласно настоящему изобретению содержат по меньшей мере один стереогенный центр на атоме углерода, расположенном в голове моста. Соответственно, указанные соединения могут включать смесь изомеров, включая энантиомеры в рацемической смеси или в энантиомерно чистых смесях, которые по существу представляют собой R- или S-изомер. Указанные соединения также могут принимать цис- или транс-конформацию через атомы углерода, расположенные в голове моста (атомы углерода 4а и 8а) во фрагменте 4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин указанных соединений. Согласно некоторым вариантам реализации изобретения соединения формулы I могут характеризоваться следующей структурной формулой:
 или
или 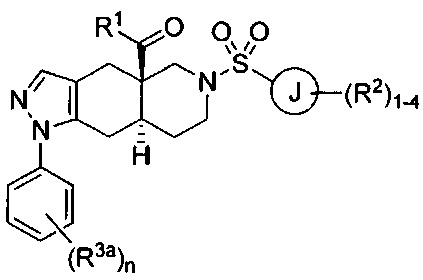
[0047] Для R1 в соединениях согласно настоящему изобретению подходит любой гетероарил, как описано в определениях выше. Согласно некоторым вариантам реализации изобретения гетероарил R1 может содержать от 5 до 6 членов кольца и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a. Согласно некоторым вариантам реализации изобретения гетероарил R1 может содержать от 5 до 6 членов кольца и от 1 до 3 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a. Согласно некоторым вариантам реализации изобретения гетероарил R1 может содержать от 5 до 6 членов кольца и от 1 до 2 гетероатомов, каждый из которых может независимо представлять собой N, О или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a. Согласно некоторым вариантам реализации изобретения гетероарил R1 может содержать от 5 до 6 членов кольца и от 1 до 2 гетероатомов, каждый из которых может независимо представлять собой N или S, необязательно замещенный 1-4 группами, каждая из которых может независимо представлять собой R1a.
[0048] Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой пиррол, пиразол, имидазол, триазол, тетразол, фуран, оксазол, изоксазол, оксадиазол, тиофен, тиазол, изотиазол, тиадиазол, пиридин, пиразин, пиримидин или пиридазин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 2-пиррол, 3- пиррол, 1-пиразол, 3-пиразол, 4-пиразол, 5-пиразол, 2-имидазол, 4-имидазол, 5- имидазол, 1,2,3-триазол-4-ил, 1,2,3,-триазол-5-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 1,2,3,4-тетразол-1-ил, 1,2,3,4,тетразол-5-ил, 2-фуран, 3-фуран, 2-оксазол, 4-оксазол, 5-оксазол, 3-изоксазол, 4-изоксазол, 5-изооксазол, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,5-оксадиазол-3-ил, 1,3,4-оксадиазол-2-ил, 2-тиофен, 3-тиофен, 2-тиазол, 4-тиазол, 5-тиазол, 3-изотиазол, 4-изотиазол, 5-изотиазол, 1,2,3-тиадиазол-4-ил, 1,2,3-тиадиазол-5-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,5-тиадиазол-3-ил, 1,3,4-тиадиазол-2-ил, 2-пиридин, 3-пиридин, 4-пиридин, пиразин, 2-пиримидин, 4-пиримидин, 5-пиримидин, 6-пиримидин, 3-пиридазин, 4-пиридазин, 5-пиридазин или 6-пиридазин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой пиразол, имидазол, триазол, фуран, оксазол, оксадиазол, тиофен, тиазол, пиридин, пиразин или пиримидин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой имидазол, фуран, оксазол, оксадиазол, тиофен, тиазол или пиридин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 1-пиразол, 3-пиразол, 4-пиразол, 5-пиразол, 2-имидазол, 4-имидазол, 5-имидазол, 1,2,3-триазол-4-ил, 1,2,3,-триазол-5-ил, 1,2,4-триазол-3-ил, 1,2,4-триазол-5-ил, 2-фуран, 3-фуран, 2-оксазол, 4-оксазол, 5-оксазол, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,5-оксадиазол-3-ил, 1,3,4-оксадиазол-2-ил, 2-тиофен, 3-тиофен, 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин, 4-пиридин, пиразин, 2-пиримидин, 4-пиримидин, 5-пиримидин или 6-пиримидин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 3-пиразол, 4-пиразол, 2-имидазол, 1,2,4-триазол-5-ил, 2-фуран, 2-оксазол, 4-оксазол, 1,3,4-оксадиазол-2-ил, 2-тиофен, 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин, 4-пиридин, пиразин или 2-пиримидин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 2-имидазол, 4-имидазол, 5-имидазол, 2-фуран, 3-фуран, 2-оксазол, 4-оксазол, 5-оксазол, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 1,2,5-оксадиазол-3-ил, 1,3,4-оксадиазол-2-ил, 2-тиофен, 3-тиофен, 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин или 4-пиридин.
[0049] Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой пиридин или тиазол. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин или 4-пиридин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 2-тиазол, 4-тиазол или 2-пиридин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой пиридин. Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой тиазол.
[0050] Согласно некоторым вариантам реализации изобретения гетероарил в R1 может быть необязательно замещен 1-4 группами, каждая из которых независимо может представлять собой R1a. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, C1-6 алкил, галоген, С1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, -CN, N-оксид, С3-8 циклоалкил или С3-8 гетероциклоалкил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, C1-6 алкил, C1-6 галогеналкил, C1-6 алкокси или С3-8 гетероциклоалкил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, C1-6 алкил, С1-6 галогеналкил или C1-6 алкокси. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, C1-6 алкил или C1-6 галогеналкил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород или C1-6 алкил. Алкил в R1a может представлять собой любую подходящую алкильную группу, такую как, помимо прочих, метил, этил, пропил, бутил, пентил и гексил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, метил, этил, трифторметил, метокси или пирролидинил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород, метил или трифторметил. Согласно некоторым вариантам реализации изобретения каждый из R1a независимо может представлять собой водород или метил.
[0051] Согласно некоторым вариантам реализации изобретения гетероарил в R1 может представлять собой 3-пиразол, 4-пиразол, 2-имидазол, 1,2,4-триазол-5-ил, 2-фуран, 2-оксазол, 4-оксазол, 1,3,4-оксадиазол-2-ил, 2-тиофен, 2-тиазол, 4-тиазол, 5-тиазол, 2-пиридин, 3-пиридин, 4-пиридин, пиразин или 2-пиримидин, и кольцо J может представлять собой 2-пиридин, 3-пиридин, 4-пиридин, имидазол-2-ил, имидазол-4-ил, имидазол-5-ил, пиразол-3-ил, пиразол-4-ил,  , 1,2,3-триазол-4-ил, 1,2,3-триазол-5-ил или изоксазол-4-ил.
, 1,2,3-триазол-4-ил, 1,2,3-триазол-5-ил или изоксазол-4-ил.
[0052] Кольцо J формулы I может представлять собой любое подходящее кольцо. Согласно некоторым вариантам реализации изобретения кольцо J формулы I может представлять собой циклоалкильное кольцо, гетероциклоалкильное кольцо, арильное кольцо или гетероарильное кольцо, причем указанные гетероциклоалкильное и гетероарильное кольца могут содержать от 5 до 6 членов в кольце и от 1 до 4 гетероатомов, каждый из которых может независимо представлять собой N, О или S. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой гетероциклоалкил, арил или гетероарил. Подходящие гетероциклоалкильные группы включают группы, описанные в определениях выше. Согласно некоторым вариантам реализации изобретения гетероциклоалкил может представлять собой тетрагидрофуран. Арильные группы, подходящие для кольца J включают группы, описанные в определениях выше. Типичные арильные группы включают фенил и нафтил. Согласно некоторым вариантам реализации изобретения арильная группа кольца J может представлять собой фенил. Гетероарильные группы, подходящие для кольца J, включают группы, описанные в определениях выше. Типичные гетероарильные группы включают пиррол, пиридин, имидазол, пиразол, триазол, тетразол, пиразин, пиримидин, пиридазин, триазин (1,2,3-, 1,2,4- и 1,3,5-изомеры), тиофен, фуран, тиазол, изотиазол, оксазол и изоксазол. Согласно некоторым вариантам реализации изобретения гетероарил может представлять собой пиридил или тиофен. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой арил или гетероарил. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил, пиридин, имидазол, пиразол, триазол, тетразол, тиадиазол, изотиазол или изоксазол. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил, пиридин, пиразол или триазол. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил, 2-пиридин, 3-пиридин, 4-пиридин, 1-пиразол, 3-пиразол, 4-пиразол, 5-пиразол, 1,2,3-триазол-4-ил, 1,2,3-триазол-5-ил, 1,2,4-триазол-3-ил и 1,2,4-триазол-5-ил. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой фенил. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой пиридин. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой пиразол. Согласно некоторым вариантам реализации изобретения кольцо J может представлять собой триазол.
[0053] Кольцо J формулы I может содержать в качестве заместителей любое подходящее число групп R2. Каждый R2 формулы I может независимо представлять собой водород, С1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, C1-6 алкил-C1-6 алкокси, -CN, -ОН, -NR2aR2b, -C(O)R2a, -C(O)OR2a, -C(O)NR2aR2b, -SR2a, -S(O)R2a, - S(O)2R2a, С3-8 циклоалкил или С3-8 гетероциклоалкил, причем указанные гетероциклоалкильные группы необязательно замещены 1-4 группами R2c. Согласно некоторым вариантам реализации изобретения каждый R2 формулы I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, С1-6 алкил-С1-6 алкокси, -CN, -NR2aR2b, -C(O)OR2a, -S(O)2R2a, С3-8 циклоалкил или С3-8 гетероциклоалкил, причем указанная гетероциклоалкильная группа содержит 5-6 членов в кольце и от 1 до 2 гетероатомов. Согласно некоторым вариантам реализации изобретения каждый R2 формулы I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, C1-6 галогеналкокси, C1-6 алкил-С1-6 алкокси, -CN, -NR2aR2b, -S(O)2R2a, С3-8 циклоалкил или С3-8 гетероциклоалкил, причем указанная гетероциклоалкильная группа содержит 5-6 членов в кольце и от 1 до 2 гетероатомов. Каждый R2 формулы I может независимо представлять собой водород, C1-6 алкил, галоген, C1-6 галогеналкил, C1-6 алкокси, С1-6 галогеналкокси, -CN, -NR2aR2b, С3-8 циклоалкил или С3-8 гетероциклоалкил, причем указанные гетероциклоалкильные группы могут необязательно быть замещены 1-4 группами R2c. Согласно некоторым вариантам реализации изобретения каждый R2 может независимо представлять собой водород, галоген, C1-6 галогеналкил, -CN, или гетероциклоалкил, содержащий 5-6 членов в кольце и от 1 до 2 гетероатомов, причем по меньшей мере один гетероатом представляет собой N. Гетероциклоалкильные группы, содержащие 5-6 членов в кольце и от 1 до 2 гетероатомов, среди которых по меньшей мере один представляет собой азот, включают, но не ограничиваются указанными, пирролидин, пиперидин, пиразолидин, имидазолидин, пиперазин (1,2-, 1,3- и 1,4-изомеры), оксазолидин, изоксалидин, тиазолидин, изотиазолидин, морфолин или тиоморфолин. Согласно некоторым вариантам реализации изобретения каждый R2 может независимо представлять собой водород, метил, этил, пропил, изопропил, F, Cl, -CF3, CH2OMe, ОМе, OCHF2, -CN, -NMe2, -С(O)ОН, -C(O)NMe2, -S(O)2Me, пирролидин, пиперидин или морфолин. Согласно некоторым вариантам реализации изобретения каждый R2 может независимо представлять собой водород, метил, этил, F, Cl, -CF3, ОМе, OCHF2, -CN, -NMe2, -S(O)2Me, пирролидин, пиперидин или морфолин. Согласно некоторым вариантам реализации изобретения каждый R2 может независимо представлять собой водород, метил, этил, н-пропил, изопропил, F, Cl, и -CF3. Согласно некоторым вариантам реализации изобретения R2 может представлять собой -CF3. Кольцо J может содержать в качестве заместителей 1, 2, 3 или 4 группы R2. Согласно некоторым вариантам реализации изобретения кольцо J замещено одной группой R2.
[0054] В качестве альтернативы две группы R2 у соседних атомов кольца J могут быть объединены с образованием гетероциклоалкильного кольца, содержащего от 5 до 6 членов в кольце и от 1 до 3 гетероатомов, каждый из которых может представлять собой N, О или S, причем указанное гетероциклоалкильное кольцо необязательно содержит в качестве заместителя от 1 до 3 групп R2c. В случае, когда две группы R2 объединены, могут образовываться любые подходящие гетероциклоалкильные группы. Согласно некоторым вариантам реализации изобретения гетероциклоалкил, образованный при объединении двух групп R2 может содержать 6 членов в кольце и от 1 до 2 гетероатомов, каждый из которых может представлять собой N, О или S. Согласно некоторым вариантам реализации изобретения гетероциклоалкил, образованный при объединении двух групп R2 может содержать 6 членов в кольце и от 1 до 2 гетероатомов, каждый из которых может представлять собой N или О. Согласно некоторым вариантам реализации изобретения гетероциклоалкил, образованный при объединении двух групп R2 может содержать 6 членов в кольце и 2 гетероатома, каждый из которых может представлять собой N или О. Согласно некоторым вариантам реализации изобретения гетероциклоалкил, образованный при объединении двух групп R2 может представлять собой морфолин. В случае, когда кольцо J представляет собой пиридин и гетероциклоалкил, образованный объединением двух групп R2, указанная комбинация может представлять собой любой пиридо-оксазин, такой как 3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил. И в случае, когда две группы R2 объединены с образованием гетероциклоалкила, указанный гетероциклоалкил может содержать в качестве заместителей от 1 до 3 групп R2c, таких как Н или Me.
[0055] Несколько групп R2 могут быть дополнительно замещены одним или более из R2a и R2b. Каждый из R2a и R2b может независимо представлять собой водород или C1-6 алкил.
[0056] Каждый R3a может представлять собой любой галоген. Согласно некоторым вариантам реализации каждая группа R3a может независимо представлять собой F, I, Cl, или Br. Согласно некоторым вариантам реализации R3a может представлять собой F. Группа R3a может присутствовать в любом положении фенильного кольца с образованием 2-, 3- или 4-замещенного кольца. Согласно некоторым вариантам реализации фенильное кольцо является замещенным по положению 4.
[0057] Нижний индекс n формулы I может представлять собой целое число от 0 до 3. Согласно некоторым вариантам реализации изобретения нижний индекс n может быть равен 0, 1, 2 или 3. Согласно некоторым вариантам реализации изобретения нижний индекс n может быть равен 0 или 1. Согласно некоторым вариантам реализации изобретения нижний индекс n может быть равен 0. Согласно некоторым вариантам реализации изобретения нижний индекс n может быть равен 1.
[0058] В случае, когда R3a формулы I представляет собой 4-фтор, соединения согласно настоящему изобретению могут быть представлены следующей структурой:
 или
или 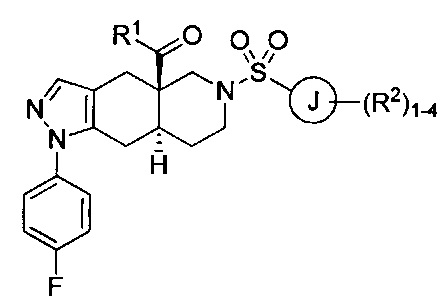
[0059] В некоторых вариантах реализации изобретения соединение формулы I может представлять собой:
((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-6-((3,4-дихлорфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-6-((3,4-дифторфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((3-фторфенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-3-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-д]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-д]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-6-((1-этил-1Н-пиразол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-6-((1-этил-1Н-пиразол-5-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-6-((2-этил-2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-метилпиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон,
3-(((4aR,8aS)-1-(4-фторфенил)-4а-пиколиноил-4а,5,7,8,8a,9-гексагидро-1H-пиразоло[3,4-g]изохинолин-6(4Н)-ил)сульфонил)бензонитрил,
((4aR,8aS)-6-((3-фтор-4-(трифторметил)фенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((4-метил-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-6-((2-этил-2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-д]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-6-((2Н-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон или
((4aR,8aS)-6-((2-этил-2Н-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон.
[0060] Соединения согласно настоящему изобретению могут также представлять собой соли и изомеры указанных соединений. В некоторых вариантах реализации соединения согласно настоящему изобретению включают формы солей указанных соединений. Примеры подходящих солей включают гидрохлориды, гидробромиды, сульфаты, метансульфонаты, нитраты, малеаты, ацетаты, цитраты, фумараты, тартраты (например, (+)-тартраты, (-)-тартраты или их смеси, включая рацемические смеси), сукцинаты, бензоаты и соли аминокислот, таких как глутаминовая кислота. Указанные соли могут быть получены способами, известными специалистам в области техники. В случае, когда соединения согласно настоящему изобретению содержат относительно простые функциональные группы, их кислотно-аддитивные соли могут быть получены путем приведения нейтральной формы таких соединений в контакт со значительным количеством желательной кислоты или в чистом виде, или в подходящем инертном растворителе. Примеры подходящих кислотно-аддитивных солей включают соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, азотная, угольная, одноосновная угольная, фосфорная, одноосновная фосфорная, двухосновная фосфорная, серная, одноосновная серная, иодистоводородная или фосфорная кислоты и тому подобные, а также соли, полученные из органических кислот, таких как уксусная, пропионовая, изомасляная, малеиновая, малоновая, бензойная, янтарная, пробковая, фумаровая, молочная, миндальная, фталевая, бензосульфокислота, п-толуолсульфокислота, лимонная, винная кислоты, метансульфокислота и тому подобные. Настоящее изобретение также включает соли аминокислот, такие как аргинаты и тому подобные, и соли органических кислот, таких как глюкуроновой или галактуроновой кислот, и тому подобные (см, например, Berge et al., "Pharmaceutical Salts", Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые конкретные соединения согласно настоящему изобретению содержат функциональные группы, обеспечивающие возможность превращения указанных соединений либо в соли присоединения оснований, либо в соли присоединения кислот. Дополнительную информацию о подходящих фармацевтически приемлемых солях можно найти в справочнике Remington's Pharmaceutical Sciences, 17-е изд., Mack Publishing Company, Easton, Pa., 1985, полностью включенном в настоящую заявку посредством ссылки.
[0061] Нейтральные формы указанных соединений предпочтительно выделяют путем приведения указанной соли в контакт с основанием или кислотой и выделения исходного соединения с помощью традиционно применяемых способов. Исходная форма соединения отличается от различных солевых форм по некоторым физическим свойствам, таким как растворимость в полярных растворителях.
[0062] Конкретные соединения согласно настоящему изобретению могут существовать как в несольватированных, так и в сольватированных формах, включая гидратированные формы. В общем, сольватированные формы эквивалентны несольватированным формам и охвачены объемом настоящего изобретения. Конкретные соединения согласно настоящему изобретению могут существовать во многих кристаллических или аморфных формах. В общем случае, все физические формы являются эквивалентными для применения согласно настоящему изобретению, при этом предполагается, что каждая из таких форм включена в объем настоящего изобретения.
[0063] Конкретные соединения согласно настоящему изобретению содержат ассиметрические углеродные атомы (оптические центры) или двойные связи; энантиомеры, рацематы, диастереомеры, таутомеры, геометрические изомеры, стереоизомерные формы, характеризуемые с точки зрения абсолютной стереохимии, такие как (R)- или (S)-, или (D)- или (L)-формы в случае аминокислот, а также индивидуальные изомеры включены в объем настоящего изобретения. Соединения согласно настоящему изобретению не включают соединения, которые, как известно в данной области техники, являются слишком нестабильными для их получения и/или выделения. Подразумевается, что настоящее изобретение включает соединения в рацемически и оптически чистых формах. Оптически активные (R)- и (S)- или (D)- и (L)-изомеры могут быть получены с использованием хиральных синтонов или хиральных реагентов или выделены с помощью традиционных способов.
[0064] Изомеры включают соединения, содержащие одинаковое число и тип атомов и, таким образом, имеющие одинаковую молекулярную массу, но различные в отношении структурного расположения или конфигурации атомов.
[0065] Для специалиста в данной области техники будет очевидно, что некоторые соединения согласно настоящему изобретению могут существовать в виде таутомерных форм, при этом все такие таутомерные формы указанных соединений включены в объем настоящего изобретения. Таутомер относится к одному или более структурным изомерам, находящимся в равновесии, которые легко переходят из одной изомерной формы в другую.
[0066] Если не указано иное, предполагается, что структурные формулы, изображенные в настоящей заявке, также включают все стереометрические формы указанных структурных формул; т.е., R и S конфигурации для каждого ассиметрического центра. Таким образом, отдельные стереометрические изомеры, так же, как энантиомерные и диастереомерные смеси настоящих соединений, включены в объем настоящего изобретения.
[0067] Если не указано иное, соединения согласно настоящему изобретению также могут содержать изотопы одного или нескольких атомов, входящих в состав указанных соединений, в нехарактерных соотношениях. Например, соединения согласно настоящему изобретению могут быть помечены радиоактивными изотопами, такими как, например, дейтерий (2Н), тритий (3Н), иод- 125 (125I), углерод-13 (13С) или углерод-14 (14С). Все изотопные варианты соединений согласно настоящему изобретению как радиоактивные, так и не являющиеся радиоактивными входят в объем настоящего изобретения.
[0068] Помимо солевых форм в настоящем изобретении предложены соединения, представленные в форме пролекарства. Пролекарствами указанных соединений, описанными в настоящей заявке, являются те соединения, которые легко претерпевают химические изменения в физиологических условиях с получением соединений согласно настоящему изобретению. Кроме того, пролекарства могут превращаться в соединения согласно настоящему изобретению химическими или биохимическими способами в среде ex vivo. Например, постепенное превращение пролекарств в соединения согласно настоящему изобретению может обеспечиваться при помещении указанных пролекарств в емкость трансдермального пластыря совместно с подходящим ферментом или химическим реагентом.
[0069] Соединения согласно настоящему изобретению могут быть получены, как показано на Фигуре 1. Исходные вещества могут быть получены из коммерческих исочников, при использовании известных способов синтеза, и при использовании способов, описанных в патенте США No. 7,928,237, полностью включенном в настоящую заявку посредством ссылки. Сложные эфиры I превращают в кетоны IV посредством реакции с подходящим металлорганическим реагентом, таким как реагент Гриньяра, литийорганический реагент, борорганический реагент, органоцериевый реагент или органоцинковый реагент в растворителе, таком как эфир или тетрагидрофуран, или подобном апротонном растворителе. Предпочтительно, реакцию проводят с использованием арил-литиевого реагента в растворителе, таком как эфир или тетрагидрофуран. Преимуществом является проведение реакции при пониженной температуре. Кетоны формулы IV также получают путем проведения реакции альдегида формулы II с подходящим органометаллическим реагентом, после чего полученные в результате спирты формулы III окисляют подходящими окислителями, такими как периодинан Десса-Мартина в инертном растворителе, таком как дихлорметан. Трет-бутоксикарбонильную защитную группу удаляют из IV посредством обработки кислотой, такой как HCl, HBr, трифторуксусная кислота, п-толуолсульфоновая кислота или метансульфоновая кислота, предпочтительно HCl или трифторуксусная кислота, необязательно в растворителе, таком как диоксан, дихлорметан, этанол или тетрагидрофуран, как в безводных, так и в водных условиях. Предпочтительно, реакцию проводят с использованием либо HCl в диоксане, либо трифторуксусной кислоты в дихлорметане. Амины V превращают в соединения формулы (1), обрабатывая соответствующим замещенным сульфонилгалогенидом, таким как сульфонилхлорид VI, в инертном растворителе, таком как дихлорметан, толуол или тетрагидрофуран, предпочтительно дихлорметан, в присутствии основания, такого как N,N-ди-изопропилэтиламин или триэтиламин. Целесообразным может быть проведение реакции сульфонилирования в условиях in situ, не выделяя амин V. Соединения формулы (1) также могут быть получены из аминов формулы V в два последовательных этапа, начиная с реакции аминов V с галоген-замещенным сульфонил хлоридом, VII, с получением галогензамещенного сульфонамидного производного, примером которого является VIII (где X представляет собой галоген). Галогеновый заместитель X может быть превращен в заместитель R2 любым стандартным способом, известным специалистам в области техники.
[0070] В качестве альтернативы, соединения формулы (1) могут быть получены, как показано на Фигуре 2. Трет-бутоксикарбонильную защитную группу удаляют из I посредством обработки кислотой, такой как HCl, HBr, трифторуксусная кислота, п-толуолсульфоновая кислота или метансульфоновая кислота, предпочтительно HCl или трифторуксусная кислота, необязательно в растворителе, таком как диоксан, дихлорметан, этанол или тетрагидрофуран, как в безводных, так и в водных условиях. Предпочтительно, реакцию проводят с использованием либо HCl в диоксане, либо трифторуксусной кислоты в дихлорметане. Амины IX превращают сульфонамиды формулы X, как описано для превращения аминов формулы V в сульфонамиды формулы (1). Сложноэфирную группу в соединениях формулы X превращают в альдегид формулы XI с использованием восстанавливающего агента, такого как DIBAL-H, LiAlH4 или RED-AL, предпочтительно DIBAL-H в инертном растворителе, таким как дихлорметан, тетрагидрофуран, бензол или толуол, предпочтительно, дихлорметан. Целесообразным может быть превращение X в XI с применением двухэтапного способа, включающего восстановление сложного эфира до спирта и последовательного окисления спирта до альдегида формулы XI. Окисление может быть проведено с использованием любого подходящего способа, такого как реакция Сверна, или окислителя, такого как периодинан Десса-Мартина в подходящем растворителе, таком как дихлорметан. Альдегиды формулы XI превращают в спирты формулы XII с использованием пододящего органометаллического реагента, такого как реагент Гриньяра, литийорганический реагент, борорганический реагент, органоцериевый реагент или органоцинковый реагент.Спирты формулы XII превращают в кетоны формулы (1) путем окисления. Подходящие условия окисления включают реакцию Сверна и применение периодинана Десса-Мартина. В качестве альтернативы, сложные эфиры формулы X превращают непосредственно в кетоны формулы (1) с использованием соответствующего органометаллического реагента, предпочтительно, арил-литиевого реагента в подходящем растворителе, таком как эфир или тетрагидрофуран.
[0071] Для соединений формулы I, в которых J представляет собой триазол и R2 представляет собой алкил, необходимо получение соответствующего триазол сульфонил хлорида. Указанные триазол сульфонил хлориды, используемые согласно настоящему изобретению, могут быть получены любым подходящим способом, известным специалистам в области техники, как, например, способ, изображенный на Фигуре 3. На Фигуре 3, alk представляет собой алкильную группу. Коммерчески доступный триазол тиол XIII превращают в подходящим образом защищенный тиол, такой как бензилтио триазол XIV с использованием любых подходящих условий, известных специалистам в области техники. Предпочтительно, тиол XIII обрабатывают бромистым бензилом в подходящем растворителе, таком как этанол. Алкилирование защищенного тиола, такого как бензил тиол XIV, обеспечивает получение смеси трех региоизомерных алкильных пиразолов XVa, XVb и XVc. Точное соотношение продуктов зависит от условий, используемых для реакции алкилирования. Например, использование подходящего алкил иодида в N,N-диметилформамиде в присутствии карбоната калия обеспечивает получение триазола XVa в качестве основного продукта. Региохимию алкилированных триазолов определяют, используя любые подходящие способы, известные специалистам в данной области техники. Например, региохимия может быть определена по сравнению с информацией, представленной в научной литературе, путем проведения экспериментов NOE, путем химических манипуляций для получения соединений известной структуры, или путем сравнения с образцами, полученными альтернативным, определенным путем синтеза. Например, путь синтеза, изображенный на Фигуре 4 определенным образом обеспечивает получение триазол сульфидов формулы XVc. На Фигуре 4, alk представляет собой алкильную группу.
[0072] Триазолы формулы XV превращают в сульфонил хлориды формулы XVI с использованием любого подходящего споосба, известного специалистам в данной области техники. Например, может использоваться окислтельное расщепление тиобензильной группы с применением подходящего окислителя. Применение N-хлорсукцинимида или газообразногохлора в подходящем растворителе, таком как уксусная кислота, обеспечивает получение сульфонил хлоридов формулы XVI.
IV. Фармацевтические композиции
[0073] В некоторых вариантах реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединение согласно настоящему изобретению, и фармацевтически приемлемое вспомогательное вещество.
А. Лекарственная форма
[0074] Композиции согласно настоящему изобретению могут быть приготовлены в виде широкого ряда пероральных, парентеральных и местных дозированных форм. Пероральные лекарственные средства включают таблетки, пилюли, порошки, драже, капсулы, жидкости, пастилки, капсулы для приема порошковых лекарств, гели, сиропы, жидкие растворы, суспензии и тому подобные, подходящие для приема внутрь для пациента. Композиции согласно настоящему изобретению также могут быть введены путем инъекции, то есть, внутривенно, внутримышечно, внутрикожно, подкожно, интрадуоденально или внутрибрюшинно. Кроме того, композиции, описанные в настоящей заявке, могут быть введены путем ингаляции, например, интраназально. Дополнительно композиции согласно настоящему изобретению могут быть введены трансдермально. Композиции согласно настоящему изобретению могут быть также введены интраокулярным, внутривагинальным и ректальным путем, включая суппозитории, инсуффляцию, порошки и аэрозольные лекарственные формы (например, для стероидных ингаляторов, см Rohatagi, J. Clin. Pharmacol. 35:1187-1193, 1995; Tjwa, Ann. Allergy Asthma Immunol. 75:107-111, 1995). Соответственно, в настоящем изобретении также предложены фармацевтические композиции, содержащие фармацевтически приемлемый носитель или вспомогательное вещество и соединение согласно настоящему изобретению.
[0075] Для приготовления фармацевтических композиций из соединений согласно настоящему изобретению фармацевтически приемлемые носители могут быть твердыми или жидкими. Препараты в твердой форме включают порошки, таблетки, пилюли, капсулы, капсулы для приема порошковых лекарств, суппозитории и дисперсные гранулы. Твердый носитель может представлять собой одно или более веществ, которые могут также действовать как разбавители, ароматизаторы, связующие вещества, консерванты, дезинтегрирующие агенты или вещество для инкапсулирования. Методики приготовления и введения лекарственных форм подробно описаны в научной и патентной литературе, см., например, последнее издание Remington's Pharmaceutical Sciences, Maack Publishing Co, Easton PA ("Remington's").
[0076] В случае порошков носитель представляет собой мелкодисперсное твердое вещество, которое находится в смеси с мелкодисперсным активным компонентом. В случае таблеток активный компонент смешан с носителем, имеющим необходимую связующую способность, в подходящем соотношении и спрессован в таблетку нужной формы и размера. Порошки и таблетки предпочтительно содержат от 5% или 10% до 70% соединений согласно настоящему изобретению.
[0077] Подходящие вспомогательные вещества в твердой форме включают, но не ограничиваются указанными, карбонат магния; стерат магния; тальк; пектин; декстрин; крахмал; трагакант; тугоплавкий воск; какао-масло; углеводы; сахара, включая, но не ограничиваясь указанными, лактозу, сахарозу, манит или сорбит, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, или крахмал, полученный из других растений; целлюлозу, такую как метил целлюлозу, гидроксипропилметилцеллюлозу или карбоксиметилцеллюлозу натрия; и камедь, включая аравийскую и трагакантовую; а также белки, включая, но не ограничиваясь указанными, желатин и коллаген. При желании могут быть добавлены дезинтегрирующий или солюбилизирующий агенты, такие как поперечно сшитый поливинил пирролидон, агар, альгиновая кислота или ее соль, такая как альгинат натрия.
[0078] Ядра драже обеспечивают подходящими покрытиями, такими как концентрированные растворы сахаров, которые могут также содержать гуммиарабик, тальк, поливинилпирролидон, карбопол гель, полиэтиленгликоль и/или диоксид титана, растворы глазури и подходящие органические растворители или смеси растворителей. К покрытиям таблеток или драже могут быть добавлены красители или пигменты для идентификации продукта или характеристики количества активного соединения (т.е., дозы). Фармацевтические препараты согласно настоящему изобретению могут быть также пригодны для перорального применения, например, твердые капсулы, приготовленные из желатина, а также мягкие герметичные капсулы, приготовленные из желатина и покрытия, такого как глицерин или сорбит. Твердые капсулы могут содержать соединения согласно настоящему изобретению, смешанные с наполнителем или связующими веществами, такими как лактоза или крахмалы, смазывающими веществами, такими как тальк или стеарат магния, и, необязательно, стабилизаторами. В мягких капсулах соединения согласно настоящему изобретению могут быть растворены или суспендированы в подходящих жидкостях, таких как нелетучие масла, жидкий парафин или жидкий полиэтиленгликоль в присутствии или отсутствии стабилизаторов.
[0079] Для приготовления суппозиториев тугоплавкий воск, такой как смесь глицеридов жирных кислот или какао-масло, сначала растапливают и равномерно распределяют в нем соединения согласно настоящему изобретению, например, путем перемешивания. Затем гомогенную жидкую смесь разливают по пресс-формам подходящего размера, оставляют для охлаждения и затем для затвердевания.
[0080] Жидкие лекарственные формы включают растворы, суспензии и эмульсии, например, водные растворы или растворы вода/пропиленгликоль. Жидкие лекарственные формы для парентеральной инъекции могут быть приготовлены в водном растворе полиэтиленгликоля.
[0081] Водные растворы, подходящие для перорального применения, могут быть приготовлены путем растворения соединений согласно настоящему изобретению в воде и добавления подходящих красителей, ароматизаторов, стабилизаторов и загустителей по желанию. Водные суспензии, подходящие для перорального применения, могут быть получены путем диспергирования мелкодисперсного активного компонента в воде с вязким веществом, таким как природные или синтетические камеди, смолы, метилцеллюлоза, карбоксиметилцеллюлоза натрия, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, трагакантовая камедь и гуммиарабик, и диспергирующими или смачивающими агентами, такими как встречающиеся в природе фосфатиды (например, лецитин), продуктом конденсации алкиленоксида с жирной кислотой (например, полиоксиэтилен стеарат), продуктом конденсации этиленоксида с длинноцепочечным алифатическим спиртом (например, гептадекаэтилен оксицетанол), продуктом конденсации этиленоксида с частичным сложным эфиром, полученным из жирных кислот и гекситола (например, полиоксиэтилен сорбитол моноолеат), или продуктом конденсации этиленоксида с частичным сложным эфиром, полученные из жирных кислот и гекситола ангидрида (например, полиоксиэтилен сорбитан моноолеат). Водные суспензии также могут содержать один или более консервантов, таких как этил или н-пропил п-гидроксибензоат, один или более красителей, один или более ароматизаторов и один или более подсластителей, таких как сахароза, аспартам или сахарин. Лекарственные формы могут быть скорректированы по осмолярности.
[0082] Также в объем настоящего изобретения включены твердые формы препаратов, которые предназначены для превращения в жидкие формы препаратов для перорального применения непосредственно перед применением. Такие жидкие формы включают растворы, суспензии и эмульсии. Указанные препараты могут помимо активного компонента содержать красители, ароматизаторы, стабилизаторы, буферы, натуральные и синтетические подсластители, диспергирующие вещества, загустители, солюбилизирующие агенты и тому подобные.
[0083] Масляные суспензии могут быть получены путем суспендирования соединений согласно настоящему изобретению в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как жидкий парафин; или в смеси указанных масел. Масляные суспензии могут содержать загуститель, такой как пчелиный воск, твердый парафин или цетиловый спирт. Для получения приятного на вкус лекарственного средства для перорального применения могут быть добавлены подсластители, такие как глицерин, сорбит или сахароза. Для сохранения указанных лекарственных форм может быть добавлен антиоксидант, такой как аскорбиновая кислота. В качестве примера масляного носителя, подходящего для инъекций, см. Minto, J. Pharmacol. Exp. Ther. 281:93-102, 1997. Фармацевтические лекарственные формы согласно настоящему изобретению могут быть также представлены в форме эмульсий масло-в-воде. Масляная фаза может предсавлять собой раствительное масло или минеральное масло, описанные выше, или смесь указанных масел. Подходящие эмульгирующие агенты включают встречающиеся в природе камеди, такие как аравийская камедь или трагакантовая камедь, встречающиеся в природе фосфатиды, такие как соевый лецитин, сложные эфиры или неполные сложные эфиры, полученные из жирных кислот и гекситоловых ангидидов, такие как сорбитан моноолеат, и продукт конденсации указанных неполных сложных эфиров с этиленоксидом, такой как полиоксиэтилен сорбитан моноолеат. Эмульсии также могут содержать подсластители и ароматизаторы, как в лекарственной форме сиропов и эликсиров. Такие лекарственные формы могут также содержать смягчающие вещества, консерванты или красители.
[0084] Композиции согласно настоящему изобретению могут также быть доставлены в виде микросфер для медленного высвобождения в организме. Например, микросферы могут быть приготовлены для введения путем интрадермальной инъекции микросфер, содержащих лекарственное средство, которое замедленно высвобождается подкожно (см. Rao, J. Biomater Sci. Polym. Ed. 7:623-645, 1995); в качестве биоразлагаемых и инъецируемых лекарственных форм в виде геля (см., например, Gao Pharm. Res. 12:857-863, 1995); или, в виде микросфер для перорального введения (см., например, Eyles, J. Pharm. Pharmacol. 49:669-674, 1997). Как трансдермальный, так и интрадермальный пути позволяют осуществлять постоянную доставку в течение недель или месяцев.
[0085] Согласно другому варианту реализации композиции согласно настоящему изобретению могут быть представлены в виде лекарственной формы для парентерального введения, например, внутривенного (IV) введения или введения в полость тела или просвет трубчатого органа. Лекарственные формы для введения обычно содержат раствор композиций по настоящему изобретению, растворенных в фармацевтически приемлемом носителе. Среди приемлемых носителей и растворителей, которые могут быть использованы, представлены вода и раствор Рингера, изотонический хлорид натрия. Кроме того, стерильные нелетучие масла традиционно могут быть использованы в качестве растворителя или суспендирующей среды. Для этой цели может быть использовано любое нелетучее масло, в том числе синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, также могут быть использованы при приготовлении инъецируемых лекарственных средств. Эти растворы являются стерильными и, как правило, не содержат нежелательных веществ. Эти композиции могут быть стерилизованы с помощью обычных, хорошо известных методик стерилизации. Лекарственные формы могут содержать фармацевтически приемлемые вспомогательные вещества, которые необходимы для создания физиологических условий, такие как рН корректирующие и буферные агенты, агенты, регулирующие токсичность, например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и тому подобные. Концентрация композиций согласно настоящему изобретению в этих лекарственных формах может изменяться в широких пределах, и должна выбираться, в первую очередь, на основании объемов, вязкости жидкости, массы тела, и тому подобного, в соответствии с конкретным выбранным способом введения и потребностями пациента. Для внутривенного введения, препарат может представлять собой стерильный инъекционный препарат, например стерильную инъекционную водную или масляную суспензию. Эта суспензия может быть приготовлена в соответствии с известным уровнем техники с использованием подходящих диспергирующих или смачивающих агентов и суспендирующих агентов. Стерильный инъекционный препарат может также быть стерильным инъекционным раствором или суспензией в нетоксичном парентерально приемлемом разбавителе или растворителе, таком как раствор 1,3-бутандиола.
[0086] Согласно другому варианту реализации лекарственные формы композиций согласно настоящему изобретению могут быть доставлены с использованием липосом, слитых с клеточной мембраной или эндоцитозированных, т.е., с использованием лигандов, присоединенных к липосоме или присоединенных непосредственно к олигонуклеотиду, которые связываются с рецепторами поверхностного мембранного белка клетки, в результате чего происходит эндоцитоз. При использовании липосом, в частности, в случае, когда поверхность липосомы переносит лиганд, специфичный для клеток-мишеней, или они иным образом предпочтительно направлены на конкретный орган, доставка композиций согласно настоящему изобретению может быть сфокусирована на клетках-мишенях в условиях in vivo, (см, например, Al-Muhammed, J. Microencapsul. 13:293-306, 1996; Chonn, Curr. Opin. Biotechnol. 6:698-708, 1995; Ostro, Am. J. Hosp.Pharm. 46:1576-1587, 1989).
[0087] Системы для доставки лекарственных средств на основе липидов включают растворы липидов, эмульсии липидов, дисперсии липидов, самоэмульгирующиеся системы для доставки лекарственных средств (SEDDS) и системы для доставки лекарственных средств с самопроизвольным образованием микроэмульсий (SMEDDS). В частности, SEDDS и SMEDDS представляют собой изотропные смеси липидов, поверхностно-активных веществ и вспомогательных поверхностно-активных веществ, которые могут спонтанно диспергироваться в водной среде и образовывать тонкие эмульсии (SEDDS) или микроэмульсии (SMEDDS). Липиды, подходящие для лекарственных форм согласно настоящему изобретению включают любые природные или синтетические липиды, включая, но не ограничиваясь указанными, масло кунжутного семени, оливковое масло, касторовое масло, арахисовое масло, сложные эфиры жирных кислот, сложные эфиры глицерина, Labrafil®, Labrasol®, Cremophor®, Solutol®, Tween®, Capryol®, Capmul®, Captex®, и Peceol®.
В. Введение
[0088] Для доставки соединений и композиций согласно настоящему изобретению могут применяться любые подходящие способы, включая пероральный, парентеральный и местный способы. Лекарственные средства для трансдермальных способов введения местным путем могут быть выполнены в виде палочек-аппликаторов, растворов, суспензий, эмульсий, гелей, кремов, мазей, пастообразных масс, желе, красок, порошков и аэрозолей.
[0089] Фармацевтический препарат предпочтительно представлен в единичной дозированной форме. В такой форме препарат разделен на дозы для однократного применения, содержащие соответствующие количества соединений и композиций согласно настоящему изобретению. Единичная дозированная форма может представлять собой упакованный препарат, причем указанная упаковка содержит дискретные количества лекарственного средства, например, упакованные таблетки, капсулы и порошки во флаконах или ампулах. Кроме того, единичная дозированная форма может представлять собой капсулу, таблетку, капсулу для приема порошковых лекарств или пастилку отдельно, либо она может быть представлена в виде подходящего количества любой из указанных упакованных форм.
[0090] Соединения и композиции согласно настоящему изобретению могут быть введены совместно с другими агентами. Совместное введение включает введение соединения или композиции согласно настоящему изобретению с разницей 0, 5, 1, 2, 4, 6, 8, 10, 12, 16, 20 или 24 часов по отношению к другому агенту. Совместное введение также включает одновременное введение, почти одновременное введение (например, с разницей в 1, 5, 10, 15, 20 или 30 минут по отношению друг к другу), или последовательное введение в любом порядке. Кроме того, каждое из соединений и композиций согласно настоящему изобретению могут быть введены один раз в день или два, три или более раз в день, обеспечивая таким образом предпочтительный уровень дозирования в течение дня.
[0091] Согласно некоторым вариантам реализации изобретения совместное введение может сопровождаться одной лекарственной формой для одного и более лекарственных средств, т.е. приготовление одной фармацевтической композиции, содержащей соединения и композиции согласно настощему изобретению и любой другой агент. В качестве альтернативы, различные компоненты могут быть представлены в виде отдельных лекарственных форм.
[0092] Соединения и композиции согласно настоящему изобретению и любые другие агенты могут быть представлены в любом подходящем количестве и могут зависеть от различных факторов, включая, но не ограничиваясь указанными, вес и возраст субъекта, болезненное состояние и тому подобные. Подходящие диапазоны дозирования включают от приблизительно 0,1 мг до приблизительно 10000 мг, или от приблизительно 1 мг до приблизительно 1000 мг, или от приблизительно 10 мг до приблизительно 750 мг, или от приблизительно 25 мг до приблизительно 500 мг, или от приблизительно 50 мг до приблизительно 250 мг. Подходящие дозы также включают приблизительно 1 мг, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 мг.
[0093] Указанная композиция может также содержать другие совместимые терапевтические агенты. Соединения, описанные в настоящей заявке, могут быть использованы в сочетании друг с другом, с другими активными агентами, которые, как известно, являются подходящими для модулирования глюкокортикоидных рецепторов, или со вспомогательными агентами, которые по отдельности могут не обладать эффективностью, но могут вносить вклад в эффективность активного агента.
V. Способ модулирования глюкокортикоидного рецептора и лечения нарушения
[0094] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ модулирования глюкокортикоидного рецептора, включающий приведение глюкокортикоидного рецептора в контакт с соединением согласно настоящему изобретению, модулируя таким образом глюкокортикоидный рецептор.
[0095] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ лечения нарушения посредством инициирования антагонизма к глюкокортикоидному рецептору, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения согласно настоящему изобретению, таким образом, обеспечивая лечение нарушения.
[0096] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ лечения нарушения посредством инициирования антагонизма к глюкокортикоидному рецептору, включающий введение субъекту, нуждающемуся в таком лечении, эффективного количества соединения согласно настоящему изобретению, таким образом, обеспечивая лечение нарушения.
[0097] Согласно типичному варианту реализации изобретения модулятор ГР представляет собой антагонист активности ГР (также называемый в настоящей заявке «антагонист глюкокортикоидного рецептора»). Антагонист глюкокортикоидного рецептора, используемый в настоящей заявке, относится к любой композиции или соединению, частично или полностью ингибирующим (выступающим в роли антагониста) связывание агониста глюкокортикоидного рецептора (ГР) (например, кортизола и синтетических или природных аналогов кортизола) с ГР, таким образом ингибируя любой биологический ответ, ассоциированный со связыванием ГР с агонистом.
[0098] Согласно сопутствующему варианту реализации изобретения модулятор ГР представляет собой специфичный антагонист глюкокортикоидного рецептора. Используемый в настоящей заявке специфичный антагонист глюкокортикоидного рецептора относится к композиции или соединению, ингибирующим биологический ответ, ассоциированный со связыванием ГР с агонистом предпочтительно путем связывания с ГР в отличие от другого ядерного рецептора (ЯР). Согласно некоторым вариантам реализации изобретения специфичный антагонист глюкокортикоидного рецептора преддпочтительно связывается с ГР, в отличие от минералокортикоидного рецептора (MP) или прогестеронового рецептора (ПР). Согласно типичному варианту реализации изобретения специфичный антагонист глюкокортикоидного рецептора преддпочтительно связывается с ГР, в отличие от минералокортикоидного рецептора (MP). Согласно другому типичному варианту реализации изобретения специфичный антагонист глюкокортикоидного рецептора преддпочтительно связывается с ГР, в отличие от прогестеронового рецептора (ПР).
[0099] Согласно сопутствующему варианту реализации изобретения специфичный антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), по меньшей мере в 10 раз меньшей, чем Kd для другого ядерного рецептора. Согласно другому варианту реализации изобретения специфичный антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), по меньшей мере в 100 раз меньшей, чем Kd для другого ядерного рецептора. Согласно другому варианту реализации изобретения специфичный антагонист глюкокортикоидного рецептора связывается с ГР с константой ассоциации (Kd), по меньшей мере в 1000 раз меньшей, чем Kd для другого ядерного рецептора.
[0100] Примеры нарушений или состояний, подходящих для применения настоящего изобретения включают, но не ограничиваются указанными, ожирение, диабет, сердечно-сосудистые заболевания, гипертензию, синдром X, депрессивный синдром, тревожность, глаукому, вирус иммунодефицита человека (ВИЧ) или синдром приобретенного иммунодефицита (СПИД), нейродегенерацию, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, усиление когнитивной способности, синдром Кушинга, болезнь Аддисона, остеопороз, слабость, мышечную слабость, воспалительные заболевания, остеоартрит, ревматоидный артрит, астму и ринит, заболевания, связанные с функцией надпочечников, вирусную инфекцию, иммунодефицит, иммуномодуляцию, аутоиммунные заболевания, аллергии, заживление ран, компульсивное поведение, множественную лекарственную устойчивость, зависимости, психозы, анорексию, кахексию, посттравматическое стрессовое расстройство, послеоперационный перелом кости, медицинский катаболизм, основную психотическую депрессию, умеренные когнитивные нарушения, психоз, деменцию, гипергликемию, центральную серозную ретинопатию, алкогольную зависимость, стрессовые расстройства, набор веса, индуцированный нейролептиком, бред, нарушение когнитивных функций у пациентов с депрессией, когнитивные нарушения у лиц с синдромом Дауна, психоз, связанный с терапией интерфероном-альфа, хронические боли, боли, связанные с гастроэзофагеальной рефлюксной болезнью, послеродовой психоз, послеродовую депрессию, неврологические расстройства у недоношенных детей, мигрени, а также виды раковых заболеваний, такие как рак яичников, рак молочной железы и рак предстательной железы. Согласно некоторым вариантам реализации настоящего изобретения расстройство или состояние может представлять собой основную психотическую депрессию, стрессовые расстройства или набор веса, индуцированный нейролептиком. Согласно другим вариантам реализации настоящего изобретения расстройство или состояние может представлять собой синдром Кушинга.
А. Анализы связывания
[0101] Связывающая способность модуляторов ГР согласно настоящему изобретению может быть проанализирована с помощью различных исследований. Например, посредством анализа способности конкурировать с лигандом ГР, таким как дексаметазон, за связывание глюкокортикоидного рецептора. Специалистам в данной области техники будет понятно, что существует множество способов осуществления такого конкурентно связывающего анализа. Согласно некоторым вариантам реализации изобретения ГР предварительно инкубируют с меченым ГР лигандом и затем приводят в контакт с исследуемым соединением. Такой тип конкурентно-связывающего анализа также в настоящей заявке может называться вытесняющий анализ связывания. Изменение (например, уменьшение) количества лиганда, связанного с ГР указывает на то, что исследуемая молекула потенциально представляет собой модулятор ГР. В качестве альтернативы связывание исследуемого соединения с ГР может быть определено непосредственно с меченым исследуемым соединением. Указанный последний тип анализа называют анализом прямого связывания.
[0102] Как анализ прямого связывания, так и конкурентно-связывающий анализ могут применяться в многообразии различных форматов. Указанные форматы анализов могут быть аналогичны форматам, применяемым в иммунологических анализах и анализах связывания рецептора. Описание различных форматов анализов связывания, включая конкурентно-связывающих анализов и анализов прямого связывания представлены в работах Basic and Clinical Immunology 7e издание (D. Stites and A. Terr ed.) 1991; Enzyme Immunoassay, E.T. Maggio, ed., CRC Press, Boca Raton, Florida (1980); и "Practice and Theory of Enzyme Immunoassays," P. Tijssen, Laboratory Techniques in Biochemistry and Molecular Biology, Elsevier Science Publishers B.V. Amsterdam (1985), каждая из которых включена в настоящее описание посредством ссылки.
[0103] В твердофазных конкурентно-связывающих анализах, например, исследуемое соединение может конкурировать с меченым аналитом за специфическое связывание сайтов связывающего агента, закрепленного на твердой поверхности. В таком формате меченый аналит может представлять собой лиганд ГР, а связывающий агент может представлять собой ГР, прикрепленный к твердой фазе. В качестве альтернативы меченый аналит может представлять собой меченый ГР, а связывающий агент может представлять собой твердофазный лиганд ГР. Концентрация меченого аналита, связанного с агентом захвата, обратно пропорциональна способности исследуемого соединения конкурировать в анализе связывания.
[0104] В качестве альтернативы конкурентно-связывающий анализ может проводиться в жидкой фазе, и для разделения связанного меченого белка от несвязанного меченого белка может применяться любая из множества методик, известных в данной области техники. Например, было разработано несколько способов для различения связанного лиганда и избытка связанного лиганда или связанного исследуемого соединения и избытка несвязанного исследуемого соединения. Указанные способы включают определение связанного комплекса путем седиментации в сахарозных градиентах, гель-электрофореза, или изоэлектрического фокусирования в геле; осаждение комплекса рецептор-лиганд с протамин сульфатом или адсорбцию на гидроксилапатите; и удаление несвязанных комплексов или лигандов путем адсорбции на нагруженной декстраном угольной пыли (dextran-coated charcoal (DCC)) или связывания с иммобилизованным антителом. После разделения определяют количество связанного лиганда или исследуемого соединения.
[0105] В качестве альтернативы может быть проведен гомогенный анализ связывания, в котором не нужна стадия разделения. Например, метка на ГР может изменяться при связывании ГР с его лигандом или исследуемым соединением. Такое изменение меченого ГР приводит к снижению или увеличению сигнала, испускаемого меткой, и, таким образом анализ метки в конце анализа связывания позволяет определить или количественно оценить ГР в связанном состоянии. Может быть использован широкий ряд меток. Компонент может быть помечен любым из некольких способов. Подходящие радиоактивные метки включают метки, содержащие 3Н, 125I, 35S, 14С или 32Р. Подходящие нерадиоактивные метки включают метки, содержащие флуорофоры, хемилюминесцентные агенты, фосфоресцирующие агенты, электрохемилюминесцентные агенты и тому подобные. Флуоресцирующие агенты являются особенно подходящими для аналитических методик, применяемых для обнаружения изменений в структуре белка, например, флуоресцентной анизотропии и/или флуоресцентной поляризации. Выбор метки зависит от необходимой чувствительности, простоты конъюгирования с соединением, требований стабильности и доступного оборудования. Для ознакомления с различными системами мечения и продуцирования сигналов, которые могут быть использованы, см. U.S. Patent No. 4,391,904, полностью включенный в настоящую заявку посредством ссылки для любых целей. Метка может быть соединена с желательным компонентом анализа прямо или опосредованно согласно способам, хорошо известным в данной области техники.
[0106] Способы скрининга с высокой пропускной способностью могут применяться для исследования большого количества потенциальных модулирующих соединений. Такие «библиотеки соединений» затем подвергаются скринингу в одном или более исследований, описанных в настоящей заявке, для определения тех членов библиотеки (конкретных химических соединений или подклассов), которые отображают желательную специфическую активность. Получение и скрининг химических библиотек хорошо известны специалистам в области техники. Устройства для получения химических библиотек коммерчески доступны (см, например, 357 MPS, 390 MPS, Advanced Chem Tech, Louisville KY, Symphony, Rainin, Woburn, MA, 433A Applied Biosystems, Foster City, CA, 9050 Plus, Millipore, Bedford, MA).
В. Клеточный анализ
[0107] Клеточный анализ включает исследование цельных клеток или клеточных фракций, содержащих ГР, для определения связывания или модулирования активности ГР посредством соединения согласно настоящему изобретению. Типичные типы клеток, которые могут применяться в способах согласно настоящему изобретению, включают, например, любые клетки млекопитающих, включая лейкоциты, такие как нейтрофилы, моноциты, макрофаги, эозинофилы, базофилы, мастоциты и лимфоциты, такие как Т-клетки и В-клетки, клетки лейкоза, лимфомы Беркитта, опухолевые клетки (включая клетки вирусной опухоли молочной железы мыши), клетки эндотелия, фибробласты, кардиомиоциты, мышечные клетки, клетки опухоли груди, карциномы яичника, карциномы шейки матки, глиобластомы, клетки печени, клетки почек и нейрональные клетки, а также грибковые клетки, включая дрожжи. Клетки могут представлять собой первичные клетки или опухолевые клетки или другие типы иммортализованных клеточных линий. Разумеется, ГР может экспрессироваться в клетках, которые не экспрессируют эндогенный вариант ГР.
[0108] В некоторых случаях для скрининга могут применяться фрагменты ГР, а также слитые белки. В случае, когда желательны молекулы, конкурирующие за связывание с лигандами ГР, применяются фрагменты ГР, способные связываться с лигандами (например, дексаметазон). В качестве альтернативы любой фрагмент ГР может применяться в качестве мишени для обнаружения молекул, связывающих ГР. Фрагменты ГР могут включать любой фрагмент, состоящий, например, из по меньшей мере 20, 30, 40, 50 аминокислот и до белка, содержащего все, кроме одной, аминокислоты ГР.
[0109] Согласно некоторым вариантам реализации изобретения для обнаружения модуляторов ГР применяется сигнальный путь, запускаемый активацией ГР. Сигнальную активность ГР можно определить множеством способов. Например, для определения сигнальной активности можно контролировать нисходящие молекулярные каскады. Нисходящие каскады включают такие активности или явления, которые происходят в результате стимулирования рецептора ГР. Типичные нисходящие каскады, подходящие для функциональной оценки транскрипционной активации и антагонизма в немодифицированный клетках включают повышающую регуляцию числа глюкокортикоид-отвечающий элемент (GRE)-зависимых генов (фосфоенолпируваткарбоксиназа (PEPCK), тирозинаминотрансфераза, ароматаза). Кроме того, могут быть использованы специфичные типы клеток, восприимчивых к активации ГР, например, экспрессия остеокальцина в остеобластах, понижающе регулируемая глюкокортикодами; первичные гепатоциты, проявляющие опосредованное глюкокортикоидом повышающее регулирование PEPCK и глюкоза-6-фосфата (G-6-Pase)). GRE-опосредванная экспрессия генов также была показана в трансфицированных клеточных линиях с использванием хорошо известных GRE-регулируемых последовательностей (трансфицированная промотором вируса опухоли молочной железы мыши (MMTV) последовательность конструкта репортерного гена). Примеры подходящих конструктов репортерных генов включают люциферазу (luc), щелочную фосфатазу (ALP) и хлорамфеникол ацетилтрансферазу (CAT). Функциональная оценка транскрипционной репрессии может быть проведена в таких клеточных линиях, как моноциты или фибробласты кожи человека. Подходящие функциональные анализы включают анализы для определения IL-1бета-стимулированной экспрессии IL-6; понижающей регуляции коллагеназы, циклооксигеназы-2 и различных хемокинов (МСР-1, RANTES); LPS стимулированное высвобождение цитокинов, например, TNFα или экспрессии генов, регулируемых NFkB или АР-1 транскрипционными факторами в трансфицированных клеточных линиях.
[0110] Как правило, соединения, исследуемые в анализах цельных клеток, также исследуют в анализах цитотоксичности. Анализы цитотоксичности применяются для определения степени, в которой выявленный эффект модулирования зависит от не-ГР связующих клеточных эффектов. Согласно типичному варианту реализации изобретения, исследование цитотоксичности включает приведение конститутивно активной клетки в контакт с исследуемым соединением. Любое снижение клеточной активности указывает на цитотоксический эффект.
С. Специфичность
[0111] Соединения согласно настоящему изобретению могут подвергаться анализу специфичности (также называемому в настоящей заявке анализом селективности). Как правило, анализы специфичности включают исследование соединения, связывающего ГР, in vitro или в клеточном исследовании на предмет степени связывания с не-ГР белками. Анализы селективности могут проводиться в условиях in vitro или в клеточных системах, как описано выше. Связывание может быть исследовано в отношении любого подходящего не-ГР белка, включая антитела, рецепторы, ферменты и тому подобные. Согласно типичному варианту реализации изобретения не-ГР связывающий белок представляет собой рецептор клеточной поверхности или ядерный рецептор. Согласно другому типичному варианту реализации изобретения не-ГР связывающий белок представляет собой стероидный рецептор, такой как рецептор эстрогена, рецептор прогестерона, рецептор андрогена или минералокортикоидный рецептор.
[0112] Термины и выражения, используемые в настоящей заявке, используются как описательные, но не ограничительные термины, и не предполагается использование указанных терминов и выражений для исключения эквивалентов показанных и описанных признаков, или их фрагментов, также необходимо осознавать, что возможны различные модификации в рамках заявленного изобретения. Более того, любой один или более признаков любого варианта реализации изобретения может быть скомбинирован с любым другим одним или более признаками любого другого варианта реализации изобретения, не выходя за рамки объема изобретения. Например, признаки соединений, модулирующих ГР, в равной степени применимы к способам лечения болезненных состояний и/или фармацевтическим композициям, описанным в настоящей заявке. Все публикации, патенты и заявки на выдачу патента, процитированные в настоящей заявке, включены в настоящее изобретение посредством ссылки во всей полноте и для любых целей.
VI. Примеры
[0113] Названия структурных формул приведены в соответствии с общепринятой номенклатурой IUPAC с применением пакета для наименования веществ CambridgeSoft ChemDraw.
[0114] 1Н ЯМР спектры регистрировали при температуре окружающей среды с использованием спектрометра Bruker Avance III (400 МГц).
[0115] Масс-спектрометрические (ЖХМС) эксперименты для определения времени удержания и связанных масс-ионов определяли в следующем порядке: эксперименты проводили с использованием квадрупольного масс-спектрометра Agilent Infinity 1260 LC 6120 с электрораспылением положительных и отрицательных ионов и определение ELS / UV @ 254 нм с использованием Agilent Zorbax Extend С18, Rapid Resolution HT 1,8 мкм С18 30×4,6 мм колонки со скоростью потока 2,5 мл/мин. Исходная система растворителей представляла собой 95% воды, содержащей 0,1% муравьиной кислоты (растворитель А) и 5% ацетонитрила, содержащего 0,1% муравьиной кислоты (растворитель В), возрастая до 5% растворителя А и 95% растворителя В в течение следующих 3,0 минут, затем скорость потока увеличивали до 4,5 мл /мин и выдерживали в течение 0,5 минут при 95% В. Через 0,1 минуту градиент возвращали к 95% А и 5% В и 3,5 мл/мин и выдерживали при этих условиях в течение 0,3 минуты; в результате последних 0,1 минуты возвращали исходные условия, 95% А 5% В при 2,5 мл/мин.
Промежуточное соединение 1А. (4aR,8aS)-метил 1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-карбоксилат
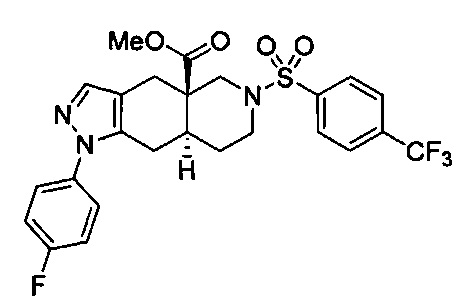
[0116] Раствор (4aR,8aS)-6-трет-бутил 4а-метил 1-(4-фторфенил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-4а,6(4Н)-дикарбоксилата (WO 2005087769; 0,35 г, 0,815 ммоль) в HCl (4М раствор в диоксане) (4,07 мл, 16,30 ммоль) перемешивали при комнатной температуре в течение 1 часа, затем растворитель выпаривали с получением твердого вещества белого цвета. Указанное вещество растворяли в дихлорметане (10 мл) и добавляли основание Хунига (0,712 мл, 4,07 ммоль), а затем 4-(трифторметил)бензол-1-сульфонил хлорид (0,239 г, 0,978 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 дней перед выпариванием растворителя, и очищали неочищенный продукт посредством колоночной хроматографии на силикагеле (градиент: 20-40% этилацетата в изогексане) с получением (4aR,8aS)-метил 1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-карбоксилата (0,38 г) в виде бесцветной смолы, ЖХМС: RT 2,66 мин, m+Н=538,0.
[0117] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ:
Промежуточное соединение 1В. (4aR,8aS)-метил 6-((3,4-дихлорфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-карбоксилат
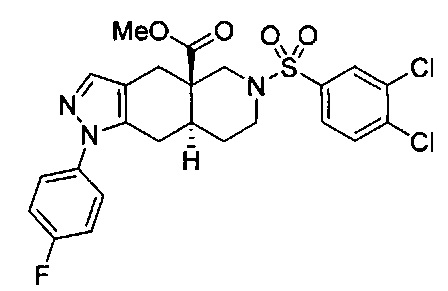
[0118] ЖХМС: RT 3,12 мин, m+Н=538,1/540,1
Промежуточное соединение 1С. (4aR,8aS)-метил- 6-((3,4-дифторфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3.4-g]изохинолин-4а-карбоксилат
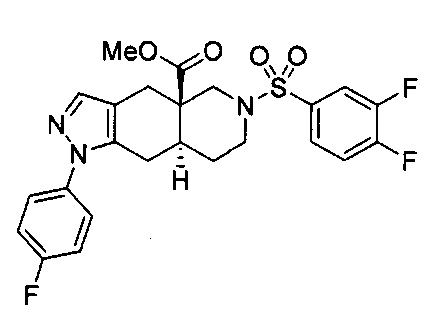
[0119] ЖХМС: RT 2,80 мин, m+Н=506,0.
Промежуточное соединение 2A. (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-пиколиноил-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилат
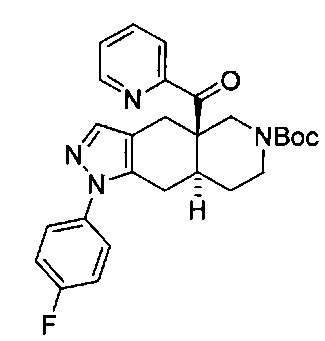
[0120] 2-Бромпиридин (0,690 мл, 7,10 ммоль) в сухом тетрагидрофуране (5 мл) добавляли к бутиллитию (2,5М в гексанах) (2,91 мл, 7,28 ммоль) в сухом тетрагидрофуране (3 мл) при -78°C. Реакционную смесь перемешивали при -78°C в течение 45 минут. По каплям добавляли раствор (4aR,8aS)-6-трет-бутил 4а-метил 1-(4-фторфенил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-4а,6(4Н)-дикарбоксилата (1,0 г, 2,328 ммоль) в сухом тетрагидрофуране (8 мл) и реакционную смесь перемешивали в течение 45 минут при -78°C. Добавляли воду (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 10 минут. Водную фазу экстрагировали этилацетатом (2×10 мл). Объединенные органические фазы промывали солевым раствором (10 мл), высушивали (сульфат магния) и удаляли растворитель с получением масла коричневого цвета. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (градиент: 10-70% этилацетата в изогексане) с получением (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-пиколиноил-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилата (766 мг) в виде твердого вещества светло-желтого цвета, ЖХМС: RT 2,70 мин, m+Н=477.
[0121] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ:
Промежуточное соединение 2 В. (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-(4-(трифторметил)пиколиноил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4H)-карбоксилат
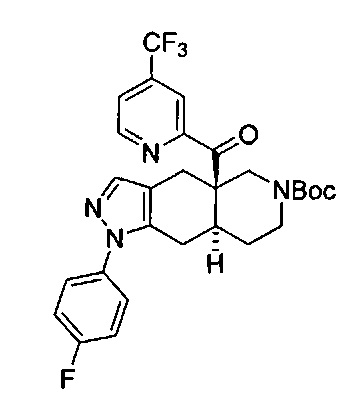
[0122] ЖХМС: RT 2,88 мин, m+Н=545,3.
Промежуточное соединение 2С. (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-2-карбонил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4H)-карбоксилат
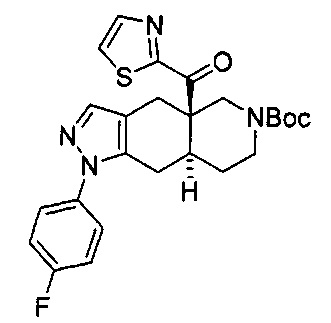
[0123] В качестве растворителя применяли диэтиловый эфир вместо тетрагидрофурана. ЖХМС: RT 2,67 мин, m+Н=482,9.
Промежуточное соединение 2D. (R)-трет-бутил 1-(4-фторфенил)-4а-(4-метилпиколиноил)-4а,5,7,8,8а,9-гексагидро-1H-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилат
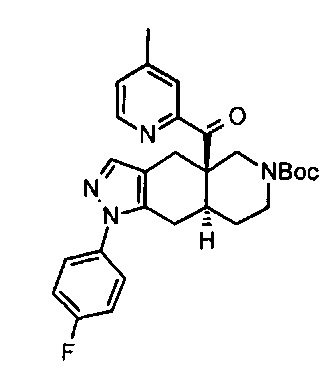
[0124] ЖХМС: RT 2,77 мин, m+Н=491,3.
Промежуточное соединение 2Е. (R-трет-бутил 1-(4-фторфенил)-4а-(тиазол-5-карбонил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилат
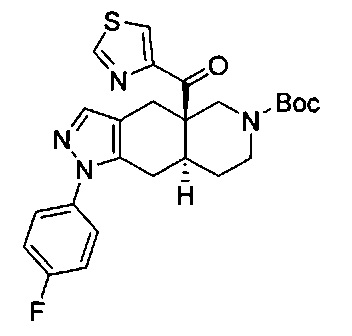
[0125] В качестве растворителя применяли диэтиловый эфир вместо тетрагидрофурана. ЖХМС: RT 2,51 мин, m+Н=483,2.
Промежуточное соединение 3А. 4-(бензилтио)-1Н-1,2,3-триазол
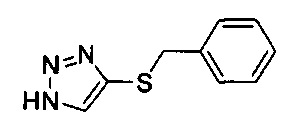
[0126] Бромистый бензил (11,79 мл, 99 ммоль) по каплям добавляли к раствору 1Н-1,2,3-триазол-4-тиолата натрия (12,2 г, 99 ммоль) в этаноле (100 мл) при 0°C. Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 20 минут.Реакционную смесь разбавляли этилацетатом (100 мл) и промывали водой (100 мл), солевым раствором (100 мл) и высушивали (сульфат натрия). Растворитель удаляли с получением 4-(бензилтио)-1Н-1,2,3-триазола (16,9 г) в виде твердого вещества белого цвета, ЖХМС: RT 1,66 мин, m+Н=191; 1Н ЯМР (400 МГц, CDCl3): δ 9,72 (1H, v br s), 7,47 (1H, s), 7,30-7,21 (5Н, m), 4,12 (2Н, s).
Промежуточное соединение 3 В. 2-(бензилтио)-6-(трифторметил)пиридин
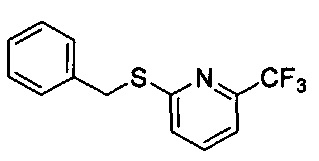
[0127] К суспензии гидрида натрия (0,170 г, 4,24 ммоль) в тетрагидрофуране (10 мл) по каплям добавляли бензилтиол (0,338 мл, 2,88 ммоль) при 0°C. Реакционную смесь перемешивали при 0°C в течение 15 минут, затем по каплям добавляли 2-фтор-6-(трифторметил)пиридин (0,365 мл, 3,03 ммоль). Реакционную смесь перемешивали при 0°C в течение 30 минут. Осторожно добавляли метанол (1 мл) и перемешивали реакционную смесь при 0°C в течение дополнительных 10 минут, затем добавляли воду (5 мл) и дихлорметан (10 мл). Органический слой выделяли с использованием картриджа фазового сепаратора, затем концентрировали в вакууме с получением 2-(бензилтио)-6-(трифторметил)пиридина (538 мг) в виде бесцветного масла. ЖХМС: RT 2,80 мин, m+Н=270,1.
Промежуточное соединение 4А. 4-(Бензилтио)-2-метил-2Н-1,2,3-триазол
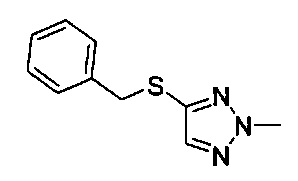
[0128] Иодметан (2,409 мл, 38,7 ммоль) по каплям добавляли к смеси 4-(бензилтио)- 1Н-1,2,3-триазола (3,7 г, 19,35 ммоль) и карбоната калия (5,88 г, 42,6 ммоль) в N,N-диметилформамиде (40 мл) при 0°C. Затем реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 1 часа. Добавляли воду (40 мл) и этилацетат (40 мл) и разделяли фазы. Органическую фазу промывали водой (2×40 мл), солевым раствором (40 мл), высушивали (сульфат натрия) и удаляли растворитель с получением масла желтого цвета. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (градиент: 0-100% этилацетата в изогексане) с получением 4-(бензилтио)-2-метил-2Н-1,2,3-триазола (1,61 г) в качестве главного и первого элюируемого региоизомерного продукта в виде бесцветного масла, ЖХМС: RT 2,05 мин, m+Н=206; 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,68 (1Н, s), 7,35-7,19 (5Н, m), 4,18 (2Н, s), 4,11(3Н, s).
Промежуточное соединение 4В. 4-(Бензилтио)-1-метил-1Н-1,2,3-триазол
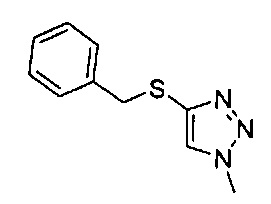
[0129] Получали в виде масла светло-желтого цвета (883 мг) как третий элюируемый региоизомерный продукт согласно приведенной выше реакции. ЖХМС: RT 1,68 мин, m+H=206; 1H ЯМР (400 МГц, ДМСО-d6): δ 8,02 (1H, s), 7,34-7,19 (5H, m), 4,12 (2H, s), 4,00 (3H, s).
[0130] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ
Промежуточное соединение 4С. 4-(Бензилтио)-2-пропил-2Н-1,2,3-триазол
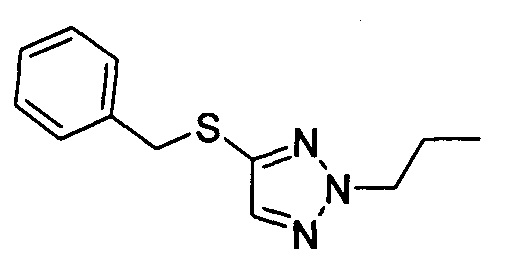
[0131] Получали в качестве главного, первого элюируемого региоизомерного продукта. ЖХМС: RT 2,36 мин, m+H=234,2; 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,69 (1Н, s), 7,28-7,27 (4Н, m), 7,25-7,20 (1Н, m), 4,32 (2Н, t, J=7,0 Гц), 4,18 (2Н, s), 1,83 (2Н, sext, J=7,0 Гц), 0,78 (3Н, t, J=7,0 Гц).
Промежуточное соединение 4D. 4-(Бензилтио)-2-изопропил-2Н-1,2,3-триазол
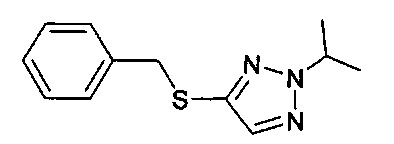
[0132] Получали в качестве главного, первого элюируемого региоизомерного продукта. ЖХМС: RT 2,41 мин, m+H=234; 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,67 (1Н, s), 7,31-7,21 (5Н, m), 4,76 (1Н, sept, J=6,7 Гц), 4,17 (2Н, s), 1,44 (6Н, d, J=6,7 Гц).
Промежуточное соединение 4Е. 4-(Бензилтио)-2-этил-2Н-1,2,3-триазол
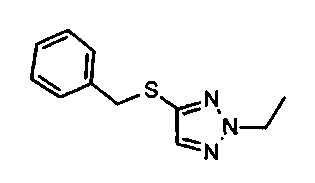
[0133] Получали в качестве главного, первого элюируемого региоизомерного продукта. ЖХМС: RT 2,24 мин, m+H=220; 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,69 (1Н, s), 7,32-7,21 (5Н, m), 4,39 (2Н, q, J=7,3 Гц), 4,18 (2Н, s), 1,40 (3Н, t, J=7,3 Гц).
Промежуточное соединение 4F. 4-(Бензилтио)-1-метил-1Н-1,2,3-триазол
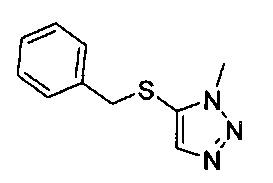
[0134] Получали в качестве минорного, второго элюируемого региоизомерного продукта. ЖХМС: RT 1,79 мин, m+Н=206; 1Н ЯМР (400 МГц, ДМСО-d6): δ 7,71 (1H, s), 7,36-7,23 (3Н, m), 7,22-7,14 (2Н, m), 4,09 (2Н, s), 3,73 (3Н, s).
Промежуточное соединение 4G. 1-пропил-1Н-1,2,3-триазол-5-сульфонил хлорид
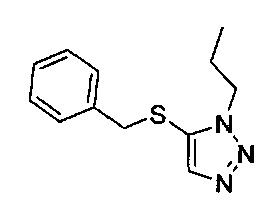
[0135] Получали в качестве минорного, второго элюируемого региоизомерного продукта. ЖХМС: RT 2,08 мин, m+Н=234,2; 1H ЯМР (400 МГц, ДМСО-d6): δ 7,74 (1Н, s), 7,38-7,12 (5Н, m), 4,13 (2Н, s), 4,06 (2Н, t, J=7,0 Гц), 1,66 (2Н, sext, J=7,0 Гц), 0,74 (3Н, t, J=7,0 Гц).
Промежуточное соединение 4Н. 4-(бензилтио)-1-изопропил-1Н-1,2,3-триазол
[0136] Получали в качестве минорного, третьего элюируемого региоизомерного продукта. ЖХМС: RT 1,99 мин, m+Н=234; 1Н ЯМР (400 МГц, ДМСО-d6): δ 8,10 (1Н, s), 7,30-7,18 (5Н, m), 4,76 (1Н, sept, J=6,7 Гц), 4,10 (2Н, s), 1,43 (6Н, d, J=6,7 Гц).
Промежуточное соединение 5А. 2-Метил-2Н-1,2,3-триазол-4-сульфонил хлорид
[0137] N-хлорсукцинимид (3,38 г, 25,3 ммоль) добавляли к раствору 4-(бензилтио)-2-метил-2Н-1,2,3-триазола (1,3 г, 6,33 ммоль) в уксусной кислоте (32 мл) и воде (16 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли воду (40 мл) и смесь экстрагировали этилацетатом (40 мл). Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия (40 мл), солевым раствором (40 мл), высушивали (сульфат магния) и удаляли растворитель с получением 2-метил-2Н-1,2,3-триазол-4-сульфонил хлрида (1,35 г) в виде масла светло-желтого цвета. ЖХМС (гашение в морфолине): RT 1,09 мин, m+Н+морфолин-Cl=233,1; 1Н ЯМР (400 МГц, CDCl3): δ 8,11 (1Н, s), 4,36 (3Н, s).
[0138] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ:
Промежуточное соединение 5В. 1-Метил-1Н-1,2,3-триазол-4-сульфонил хлорид
[0139] ЖХМС (гашение в морфолине): RT 0,86 мин, m+Н+морфолин-Cl=233,1; 1Н ЯМР (400 МГц, CDCl3): δ 8,22 (1H, s), 4,25 (3Н, s).
Промежуточное соединение 5С. 2-Пропил-2Н-1,2,3-триазол-4-сульфонил хлорид
[0140] ЖХМС (гашение в морфолине): RT 1,62 мин, m+Н+морфолин-Cl=261,2; 1Н NMR (400 МГц, CDCl3): δ 8,11 (1Н, s), 4,53 (2Н, t, J=7,1 Гц), 2,08 (2Н, sext, J=7,1 Гц), 0,98 (3Н, t, J=7,1 Гц).
Промежуточное соединение 5D. 2-Изопропил-2Н-1,2.3-триазол-4-сульфонил хлорид
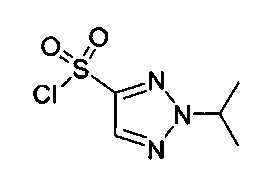
[0141] ЖХМС (гашение в морфолине): RT 1,64 мин, m+Н+морфолин-Cl=261; 1Н NMR (400 МГц, CDCl3): δ 7,62 (1H, s), 4,76 (1Н, sept., J=6,7 Гц), 1,46 (6Н, d, J=6,7 Гц).
Промежуточное соединение 5Е. 2-Этил-2Н-1,2,3-триазол-4-сульфонил хлорид
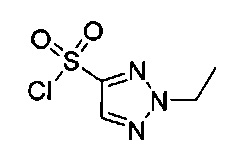
[0142] ЖХМС (гашение в морфолине): RT 1,37 мин, m+Н+морфолин-Cl=247; 1Н NMR (400 МГц, CDCl3): δ 8,11 (1H, s), 4,62 (2Н, q, J=7,4 Гц), 1,66 (3Н, t, J=7,4 Гц).
Промежуточное соединение 5F. 6-(Трифторметил)пиридин-2-сульфонил хлорид
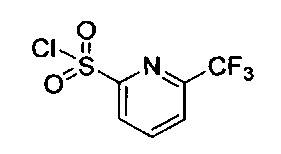
[0143] ЖХМС (гашение в морфолине): RT 1,84 мин, m+Н+морфолин-Cl=297,1. Промежуточное соединение 5G. 1-метил-1Н-1,2,3-триазол-5-сульфонил хлорид
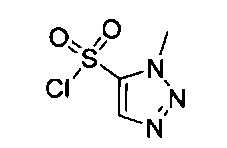
[0144] Газообразный хлор барботировали через раствор 4-(бензилтио)-1-метил-1Н-1,2,3-триазола (200 мг, 0,974 ммоль) в дихлорметане (15 мл) и воде (3 мл) в течение 2 минут при 0°C, затем реакционную смесь перемешивали при 0°С в течение дополнительных 5 минут. Добавляли воду (10 мл) и смесь экстрагировали дихлорметаном (10 мл). Органическую фазу высушивали над сульфатом магния, фильтровали и концентрировали в вакууме с получением 1-метил-1Н-1,2,3-триазол-5-сульфонил хлорида (317 мг) в виде бесцветного масла. ЖХМС (гашение в морфолине): RT 1,17 мин, m+Н+морфолин-Cl=233,1; 1Н ЯМР (400 МГц, CDCl3): δ 8,27 (1Н, s), 4,40 (3Н, s).
[0145] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ:
Промежуточное соединение 5Н. 1-пропил-1Н-1,2,3-триазол-5-сульфонил хлорид
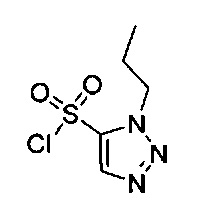
[0146] ЖХМС (гашение в морфолине): RT 1,58 мин, m+Н+морфолин-Cl=261,1; 1Н ЯМР (400 МГц, CDCl3): δ 8,27 (1H, s), 4,68-4,64 (2Н, m), 2,12 (2Н, sext, J=7,1 Гц), 1,05 (3Н, t,J=7,1 Гц).
Промежуточное соединение 5I. 3-фтор-4-(трифторметил)бензол-1-сульфонил хлорид
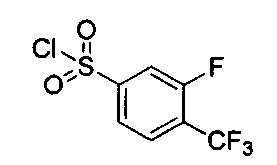
[0147] 3-Фтор-4-(трифторметил)анилин (5 г, 27,9 ммоль) растворяли в ацетонитриле (10 мл), охлаждали до 0°C, и обрабатывали тетрафторборной кислотой (48% водный раствор, 6,49 мл, 41,9 ммоль) и трет-бутил нитритом (4,98 мл, 41,9 ммоль). Реакционную смесь выдерживали при 0°C в течение 1 часа. В то же время суспензию хлорида меди (I) (4,15 г, 41,9 ммоль) в ацетонитриле (40 мл) при 0°C насыщали газообразным диоксидом серы путем барботирования указанного газа через указанную суспензию с энергичным перемешиванием в течение 30 минут.По завершении реакции диазотирования после 1 часа, указанный раствор по каплям добавляли к суспензии хлорида меди (I), вызывая интенсивное выделение газа. Реакционную смесь оставляли для нагревания до комнатной температуры и перемешивали в течение 1 часа, после чего реакционную смесь выливали в 100 мл ледяной/водной суспензии. Добавляли диэтиловый эфир (150 мл), вызывая выпадение осадка, который удаляли фильтрованием. Фильтрат промывали водой (100 мл) и солевым раствором (100 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме с получением 3-фтор-4-(трифторметил)бензол-1-сульфонил хлорида (6,62 г) в виде масла оранжевого цвета. ЖХМС (гашение в морфолине): RT 2,25 мин, m+Н+морфолин-Cl=314,1.
Промежуточное соединение 5J. 1-изопропил-1Н-1,2,3-триазол-4-сульфонил хлорид
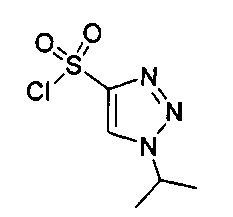
[0148] N-хлорсукцинимид (0,458 г, 3,43 ммоль) добавляли к раствору 4-(бензилтио)-1-изопропил-1Н-1,2,3-триазола (0,20 г, 0,857 ммоль) в уксусной кислоте (6 мл) и воде (3 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли воду (8 мл) и смесь экстрагировали этилацетатом (8 мл). Органическую фазу промывали насыщенным водным раствором гидрокарбоната натрия (8 мл), солевым раствором (8 мл), высушивали (сульфат магния), и удаляли растворитель с получением 1-изопропил-1Н-1,2,3-триазол-4-сульфонил хлорида (311 мг) в виде бесцветного масла. ЖХМС (гашение в морфолине): RT 1,47 мин, m+Н+морфолин-Cl=261; 1Н ЯМР (400 МГц, CDCl3): δ 8,26 (1Н, s), 4,95 (1Н, sept., J=6,7 Гц), 1,68 (6Н, d, J=6,7 Гц).
[0149] Следующие промежуточные соединения были получены аналогичным образом из соответствующих исходных веществ:
Промежуточное соединение 5K. 2Н-1,2,3-триазол-4-сульфонил хлорид
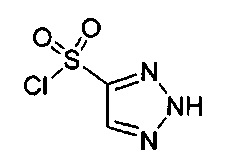
[0150] ЖХМС (гашение в морфолине): RT 1,64 мин, m+Н+морфолин-Cl=219,1; 1Н ЯМР (400 МГц, CDCl3): δ 9,06 (1Н, br s), 8,31 (1Н, s).
Промежуточное соединение 6А. (R)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-4-карбонил)-4а,5,7,8-тетрагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилат
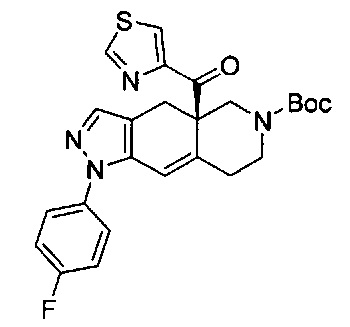
[0151] Раствор 4-бром-2-(триметилсилил)тиазола (3,00 г, 12,70 ммоль) в сухом эфире (3 мл) добавляли к раствору изопропилмагния хлорида 2М в тетрагидрофуране (6,35 мл, 12,70 ммоль) в сухом эфире (16 мл) при 0°C. Полученную в результате суспензию перемешивали при 0°C в течение 50 минут. Раствор (R)-6-трет-бутил 4а-метил 1-(4-фторфенил)-4а,5,7,8-тетрагидро-1Н-пиразоло[3,4-g]изохинолин-4а,6(4Н)-дикарбоксилата (1,81 г, 4,23 ммоль) в сухом эфире:тетрагидрофуране (4:1; общий объем 15 мл) по каплям добавляли к суспензии при 0°C, и перемешивали реакционную смесь в течение 3,5 часов при комнатной температуре. Добавляли воду (50 мл) и перемешивали реакционную смесь при комнатной температуре в течение 10 минут. Водный слой экстрагировали этилацетатом (3×50 мл). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над сульфатом магния, фильтровали и концентрировали в вакууме с получением масла оранжевого цвета. Неочищенное масло оранжевого цвета разбавляли ацетонитрилом (30 мл) и 1 М HCl (4,2 мл) и перемешивали при комнатной температуре в течение 45 минут. Реакционную смесь разбавляли этилацетатом (100 мл) и последовательно промывали солевым раствором (50 мл), насыщенным водным раствором гидрокарбоната натрия (50 мл), затем солевым раствором (50 мл). Органический слой высушивали над сульфатом магния и концентрировали в вакууме с получением масла оранжевого цвета. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (градиент: 0-45% этилацетата в изогексане) с получением (R)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-4-карбонил)-4а,5,7,8-тетрагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилата в виде вспененного твердого вещества светло-желтого цвета (932 мг). ЖХМС (Способ F, ES-API): RT 2,55 мин, m+Н=481,0.
Промежуточное соединение 7А. (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-4-карбонил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилат
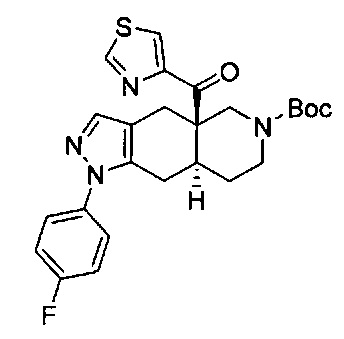
[0152] Раствор (R)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-4-карбонил)-4а,5,7,8-тетрагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилата (420 мг, 0,874 ммоль) в метаноле (40 мл) гидрогенизировали в реакторе H-Cube (10% Палладий/Углерод, 30×4 мм, атмосфера водорода, 55°C, 1 мл/мин). Растворитель удаляли с получением (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-(тиазол-4-карбонил)-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4Н)-карбоксилата в виде твердого вещества оранжевого цвета (385 мг). ЖХМС (Способ F, ES-API): RT 2,51 мин, m+Н=483,2.
Пример 1А. ((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
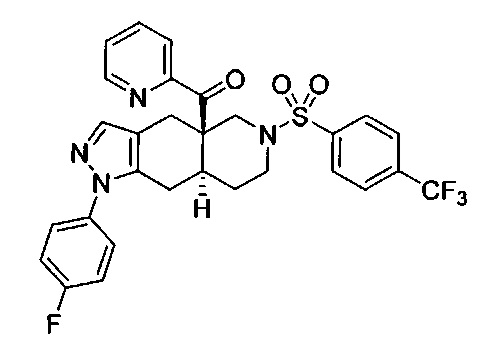
[0153] Раствор 2-бромпиридина (0,109 мл, 1,116 ммоль) в сухом тетрагидрофуране (2 мл) добавляли к раствору бутиллития (2,5М в гексанах) (0,417 мл, 1,042 ммоль) в сухом тетрагидрофуране (1,2 мл), и реакционную смесь перемешивали при -78°С в атмосфере азота в течение 45 минут. Затем по каплям добавляли раствор (4aR,8aS)-метил 1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-карбоксилата (0,2 г, 0,372 ммоль) в сухом тетрагидрофуране (2 мл). Реакционную смесь перемешивали при -78°С в течение 45 минут, затем гасили добавлением 10:1 метанол:уксусной кислоты (5 мл), и перемешивали при комнатной температуре в течение дополнительных 10 минут. Смесь разбавляли этилацетатом (200 мл), промывали насыщенным водным раствором хлорида аммония (2×50 мл) и солевым раствором (50 мл), высушивали (сульфат магния), фильтровали и выпаривали с получением бесцветной смолы. Неочищенный продукт очищали с помощью колоночной хроматографии на силикагеле (элюент: 10% этилацетата в дихлорметане) с получением ((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона (0,06 г) в виде твердого вещества белого цвета, ЖХМС: RT 2,76 мин, m+H=585,0; 1Н ЯМР (400 МГц, CDCl3): δ 8,60-8,56 (1Н, m), 7,81-7,76 (4Н, m), 7,70-7,65 (2Н, m), 7,48-7,39 (3Н, m), 7,29 (1Н, s), 7,16-7,10 (2Н, m), 5,62 (1Н, dd, J=12,3, 2,0 Гц), 4,27 (1Н, d, J=16,2 Гц), 3,99-3,94 (1Н, m), 3,40 (1Н, dd, J=16,7, 11,2 Гц), 2,69 (1H, dd, J=16,4, 5,9 Гц), 2,56-2,40 (4Н, m), 1,79-1,68 (2Н, m).
[0154] Следующие примеры были получены аналогичным образом из соответствующих исходных веществ:
Пример 1В. ((4aR,8aS)-6-((3,4-дихлорфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
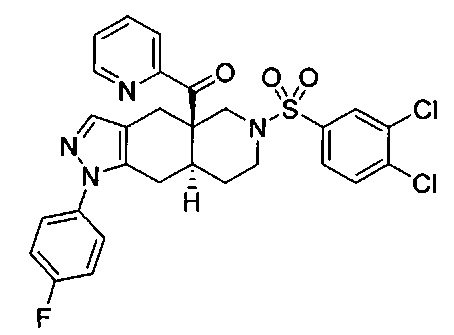
[0155] ЖХМС: RT 3,34 мин, m+H=584,8/586,8; 1Н ЯМР (400 МГц, CDCl3): δ 8,56 (1Н, dt, J=4,8, 1,3 Гц), 7,79-7,78 (2Н, m), 7,72 (1Н, d, J=1,9 Гц), 7,50-7,41 (5Н, m), 7,29 (1Н, s), 7,17-7,11 (2Н, m), 5,56 (1Н, dd, J=12,3, 1,9 Гц), 4,26 (1Н, d, J=16,9 Гц), 3,98-3,94 (1Н, m), 3,39 (1Н, dd, J=16,0, 11,8 Гц), 2,69 (1Н, dd, J=16,1, 6,0 Гц), 2,58-2,40 (4Н, m), 1,81-1,70 (2Н, m).
Пример 1С. ((4aR,8aS)-6-(3,4-дифторфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
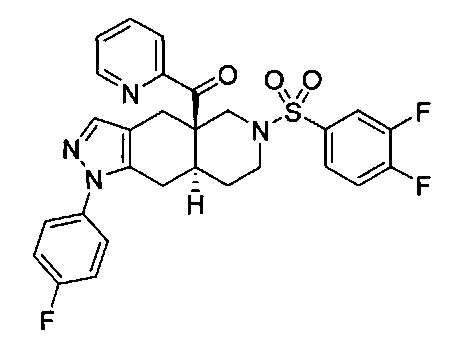
[0156] ЖХМС: RT 2,63 мин, m+Н=553,0; 1Н ЯМР (400 МГц, CDCl3): δ 8,60-8,59 (1Н, m), 7,83-7,77 (2Н, m), 7,50-7,40 (5Н, m), 7,30 (1Н, s), 7,25-7,18 (1Н, m), 7,17-7,11 (2Н, m), 5,57 (1Н, dd, J=12,3, 2,0 Гц), 4,29 (1Н, d, J=16,9 Гц), 3,95-3,92 (1Н, m), 3,40 (1H, dd, J=16,0, 11,8 Гц), 2,69 (1Н, dd, J=16,3, 6,0 Гц), 2,56-2,40 (4Н, m), 1,80-1,68 (2Н, m).
Пример 2А. ((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
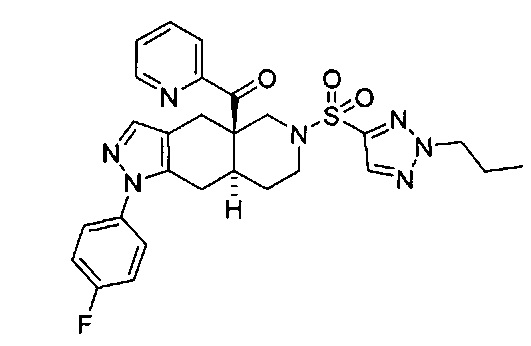
[0157] Раствор (4aR,8aS)-трет-бутил 1-(4-фторфенил)-4а-пиколиноил-4а,5,7,8,8а,9-гексагидро-1H-пиразоло[3,4-g]изохинолин-6(4H)-карбоксилата (200 мг, 0,420 ммоль) в 4М HCl/диоксане (2098 мкл, 8,39 ммоль) перемешивали при комнатной температуре в течение 45 минут. Растворитель удаляли с получением твердого вещества светло-желтого цвета, которое растворяли в дихлорметане (8 мл) и диизопропиламине (367 мкл, 2,098 ммоль) и затем добавляли 2-пропил-2Н-1,2,3-триазол-4-сульфонил хлорид (117 мг, 0,420 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 15 минут, затем растворитель удаляли с получением масла коричневого цвета. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле (градиент: 0-70% этилацетата в циклогексане) с получением ((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона (156 мг) в виде твердого вещества белого цвета, ЖХМС: RT 2,60 мин, m+Н=550,0.; 1Н ЯМР (400 МГц, CDCl3): δ 8,66 (1Н, ddd, J=4,7, 1,7, 0,9 Гц), 7,85-7,76 (3Н, m), 7,51-7,45 (2Н, m), 7,43 (1H, ddd, J=7,1, 4,7, 1,7 Гц), 7,33 (1Н, s), 7,19-7,09 (2Н, m), 5,68 (1H, dd, J=12,4, 2,1 Гц), 4,43 (2Н, t, J=7,1 Гц), 4,37 (1Н, d, J=16,2 Гц), 4,00-3,93 (1H, m), 3,46 (1Н, dd, J=16,2, 11,1 Гц), 2,70 (1Н, dd, J=16,2, 6,0 Гц), 2,64-2,36 (4Н, m), 2,02 (2Н, sextet, J=7,3 Гц), 1,79-1,71 (2Н, m), 0,94 (3Н, t, J=7,3 Гц).
[0158] Следующие примеры были получены аналогичным образом из соответствующих исходных веществ:
Пример 2В. ((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
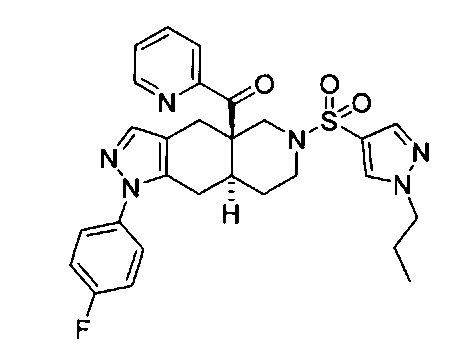
[0159] ЖХМС: RT 2,45 мин, m+Н=549,1; 1Н ЯМР (400 МГц, CDCl3): δ 8,64 (1Н, ddd, J=4,7, 1,7, 0,9 Гц), 7,85-7,82 (1Н, m), 7,79 (1Н, td, J=7,3, 1,7 Гц), 7,70-7,64 (2Н, m), 7,52-7,45 (2Н, m), 7,43 (1Н, ddd, J=7,3, 4,8, 1,5 Гц), 7,33 (1Н, s), 7,19-7,08 (2Н, m), 5,52 (1Н, dd, J=11,9, 2,1 Гц), 4,35 (1H, d, J=16,2 Гц), 4,15-4,02 (2Н, m), 3,88-3,81 (1Н, m), 3,45 (1Н, dd, J=15,5, 11,1 Гц), 2,69 (1Н, dd, J=16,2, 6,0 Гц), 2,56 (1H, d, J=16,2 Гц), 2,48-2,33 (2Н, m), 2,26 (1Н, d, J=11,9 Гц), 1,90 (2Н, sextet, J=7,3 Гц), 1,82-1,65 (2Н, m), 0,91 (3Н, t, J=7,3 Гц).
Пример 2С. ((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
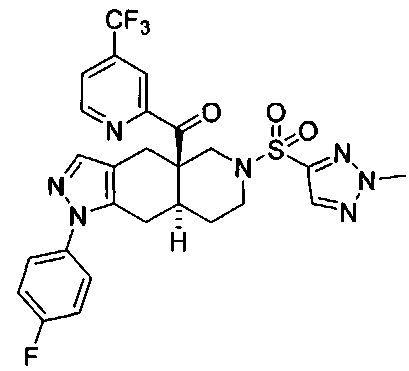
[0160] ЖХМС: RT 2,61 мин, m+Н=590,0; 1Н ЯМР (400 МГц, CDCl3): δ 8,86 (1Н, d, J=5,0 Гц), 8,10 (1Н, s), 7,81 (1Н, s), 7,70-7,62 (1H, m), 7,52-7,44 (2Н, m), 7,33 (1Н, s), 7,20-7,11 (2Н, m), 5,64 (1Н, dd, J=12,5, 2,0 Гц), 4,26 (3Н, s), 4,25 (1Н, d, J=16,2 Гц), 4,02-3,90 (1Н, m), 3,44 (1H, dd, J=16,2, 10,8 Гц), 2,73 (1Н, dd, J=16,2, 5,9 Гц), 2,67-2,53 (3Н, m), 2,43 (1Н, qd, J=13,2, 5,0 Гц), 1,88-1,75 (2Н, m).
Пример 2D. ((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октаагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
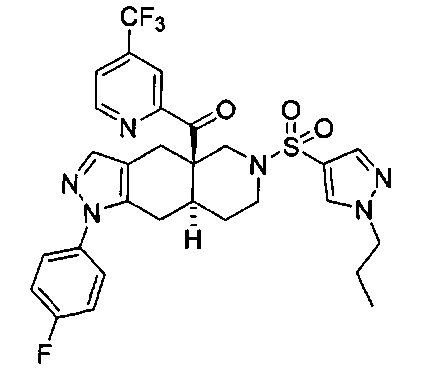
[0161] ЖХМС: RT 2,72 мин, m+Н=617,0; 1Н ЯМР (400 МГц, CDCl3): δ 8,86 (1Н, d, J=5,0 Гц), 8,13-8,08 (1Н, m), 7,70-7,62 (3Н, m), 7,51-7,42 (2Н, m), 7,33 (1Н, s), 7,20-7,10 (2Н, m), 5,49 (1H, dd, J=12,0, 2,0 Гц), 4,23 (1Н, d, J=16,1 Гц), 4,09 (2Н, t, J=7,2 Гц), 3,88-3,78 (1Н, m), 3,43 (1Н, dd, J=16,1, 11,0 Гц), 2,71 (1Н, dd, J=16,3, 6,0 Гц), 2,60 (1Н, d, J=16,3 Гц), 2,49-2,32 (2Н, m), 2,27 (1Н, d, J=12,1 Гц), 1,90 (2H, sextet, J=7,2 Гц), 1,83-1,68 (2H, m), 0,91 (3Н, t, J=7,2 Гц).
Пример 2E. ((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
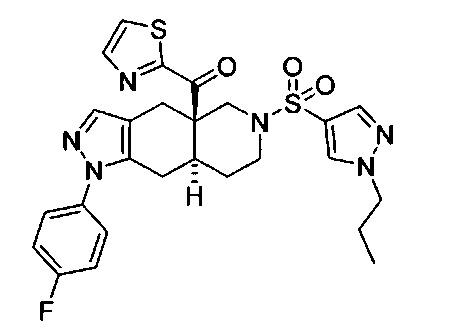
[0162] ЖХМС: RT 2,45 мин, m+Н=554,9; 1Н ЯМР (400 МГц, CDCl3): δ 8,04 (1Н, d, J=3,1 Гц), 7,74 (1Н, s), 7,69 (1Н, d, J=0,5 Гц), 7,65 (1Н, d, J=3,1 Гц), 7,53-7,46 (2Н, m), 7,40 (1H, s), 7,21-7,13 (2Н, m), 5,47 (1Н, dd, J=12,0, 2,1 Гц), 4,23 (1Н, d, J=16,2 Гц), 4,12 (2Н, t, J=7,2 Гц), 3,94-3,85 (1Н, m), 3,44 (1Н, dd, J=16,2, 11,1 Гц), 2,72 (1Н, dd, J=16,2, 6,0 Гц), 2,62 (1Н, d, J=16,2 Гц), 2,54-2,41 (2Н, m), 2,36 (1Н, d, J=12,1 Гц), 1,95 (2Н, sextet, J=7,3 Гц), 1,87-1,75 (2Н, m), 0,95 (3Н, t, J=7,3 Гц).
Пример 2F. ((4aR,8aS)-1-(4-фторфенил)-6-((3-фторфенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
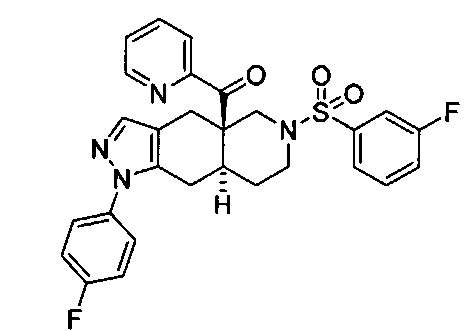
[0163] ЖХМС: RT 2,65 мин, m+Н=534,9; 1Н ЯМР (400 МГц, CDCl3): δ 8,66 (1Н, ddd, J=4,7, 1,7, 1,0 Гц), 7,88-7,77 (2Н, m), 7,53-7,43 (5Н, m), 7,41-7,35 (1Н, m), 7,35 (1Н, s), 7,29-7,22 (1Н, m), 7,22-7,12 (2Н, m), 5,62 (1Н, dd, J=12,2, 2,1 Гц), 4,35 (1Н, d, J=16,2 Гц), 3,98-3,86 (1Н, m), 3,44 (1Н, dd, J=16,2, 11,1 Гц), 2,70 (1Н, dd, J=16,2, 5,9 Гц), 2,56 (1Н, d, J=16,2 Гц), 2,51-2,41 (2Н, m), 2,39 (1H, d, J=12,2 Гц), 1,83-1,65 (2Н, m).
Пример 2G. ((4aR,8aS)-1-(4-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
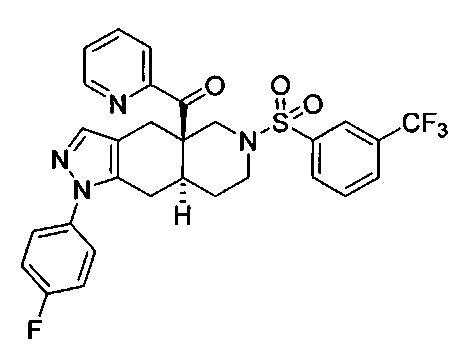
[0164] ЖХМС: RT 2,79 мин, m+H=584,9; 1Н ЯМР (400 МГц, CDCl3): δ 8,66-8,61 (1Н, m), 7,94 (1Н, s), 7,88 (1Н, br. d, J=7,9 Гц), 7,84-7,77 (3Н, m), 7,61 (1H, t, J=7,8 Гц), 7,53-7,41 (3Н, m), 7,33 (1Н, s), 7,21-7,11 (2Н, m), 5,66 (1Н, dd, J=12,2, 2,1 Гц), 4,31 (1Н, d, J=16,2 Гц), 4,03-3,91 (1Н, m), 3,43 (1Н, dd, J=16,2, 11,2 Гц), 2,71 (1Н, dd, J=16,2, 5,9 Гц), 2,62-2,35 (4Н, m), 1,85-1,68 (2Н, m).
Пример 2Н. ((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
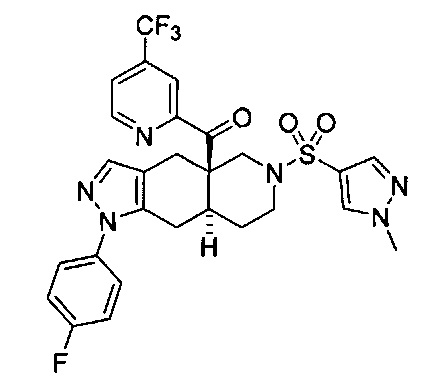
[0165] Применяли трифторуксусную кислоту/дихлорметан вместо HCl/диоксан. ЖХМС: RT 2,44 мин, m+H=589,2; 1H ЯМР (400 МГц, CDCl3): δ 8,84 (1Н, d, J=5,0 Гц), 8,10 (1Н, m), 7,66-7,65 (3Н, m), 7,50-7,45 (2Н, m), 7,33 (1Н, s), 7,18-7,12 (2Н, m), 5,47 (1Н, dd, J=11,8, 2,0 Гц), 4,22 (1H, d, J=16,2 Гц), 3,92 (3Н, s), 3,85-3,83 (1H, m), 3,42 (1Н, dd, J=16,5, 11,4 Гц), 2,71 (1Н, dd, J=16,5, 5,8 Гц), 2,60 (1Н, d, J=16,2 Гц), 2,46-2,34 (2Н, m), 2,29 (1Н, d, J=12,0 Гц), 1,84-1,70 (2Н, m).
Пример 2I. ((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-3-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
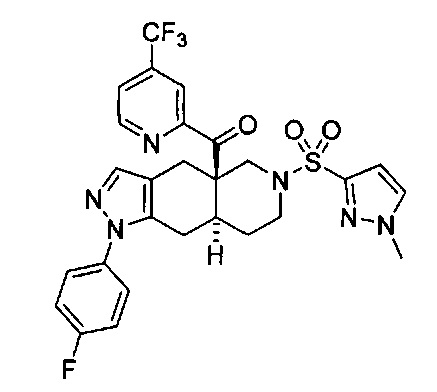
[0166] Применяли трифторуксусную кислоту/дихлорметан вместо HCl/диоксан. ЖХМС: RT 2,49 мин, m+Н=589,2; 1Н ЯМР (400 МГц, CDCl3): δ 8,85 (1Н, d, J=5,0 Гц), 8,10-8,09 (1Н, m), 7,65-7,63 (1Н, m), 7,50-7,45 (2Н, m), 7,38 (1Н, d, J=2,5 Гц), 7,34 (1Н, s), 7,18-7,12 (2Н, m), 6,55 (1Н, d, J=2,5 Гц), 5,57 (1Н, dd, J=11,8, 2,0 Гц), 4,27 (1Н, d, J=16,2 Гц), 3,97 (3Н, s), 3,93-3,89 (1Н, m), 3,44 (1Н, dd, J=16,2, 10,9 Гц), 2,71 (1Н, dd, J=16,4, 6,0 Гц), 2,63-2,55 (2Н, m), 2,54 (1Н, d, J=12,2 Гц), 2,45-2,34 (1Н, m), 1,82-1,74 (2Н, m).
Пример 2J. ((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
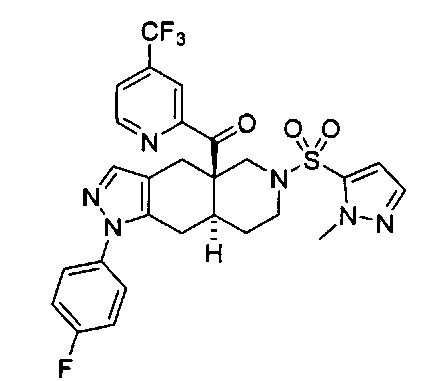
[0167] Применяли трифторуксусную кислоту/дихлорметан вместо HCl/диоксан. ЖХМС: RT 2,60 мин, m+Н=589,2; 1Н ЯМР (400 МГц, CDCl3): δ 8,77 (1Н, d, J=4,9 Гц), 8,07-8,06 (1Н, m), 7,66-7,64 (1Н, m), 7,49-7,44 (2Н, m), 7,30 (1Н, d, J=2,0 Гц), 7,29 (1Н, s), 7,18-7,12 (2Н, m), 6,60 (1Н, d, J=2,0 Гц), 5,55 (1H, dd, J=12,6, 2,2 Гц), 4,18 (1Н, d, J=16,2 Гц), 4,01-3,97 (1Н, m), 3,91 (3Н, s), 3,37 (1H, dd, J=16,4, 11,1 Гц), 2,76-2,69 (2H, m), 2,68 (1H, d, J=12,6 Гц), 2,61 (1H, d, J=16,2 Гц), 2,52-2,40 (1H, m), 1,89-1,80 (2H, m).
Пример 2K. ((4aR,8aS)-6-((1-этил-1Н-пиразол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3.4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
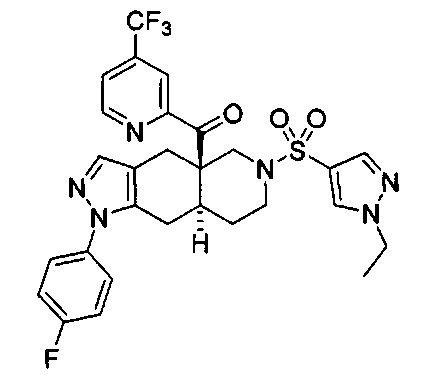
[0168] Применяли трифторуксусную кислоту/дихлорметан вместо HCl/диоксан. ЖХМС: RT 2,54 мин, m+Н=603,2; 1Н ЯМР (400 МГц, CDCl3): δ 8,85 (1Н, d, J=5,1 Гц), 8,10 (1Н, m), 7,70 (1H, s), 7,66-7,65 (2Н, m), 7,50-7,45 (2Н, m), 7,33 (1Н, s), 7,18-7,12 (2Н, m), 6,60 (1Н, d, J=2,0 Гц), 5,48 (1Н, dd, J=12,1, 2,0 Гц), 4,23 (1Н, d, J=16,4 Гц), 4,18 (2Н, q, J=7,2 Гц), 3,85-3,83 (1H, m), 3,42 (1H, dd, J=16,4, 11,1 Гц), 2,71 (1H, dd, J=16,2, 6,0 Гц), 2,60 (1H, d, J=16,2 Гц), 2,46-2,34 (1Н, m), 2,29 (1Н, d, J=12,1 Гц), 1,82-1,71 (2Н, m), 1,51 (3Н, t, J=7,2 Гц).
Пример 2L. ((4aR,8aS)-6-((1-этил-1Н-пиразол-5-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
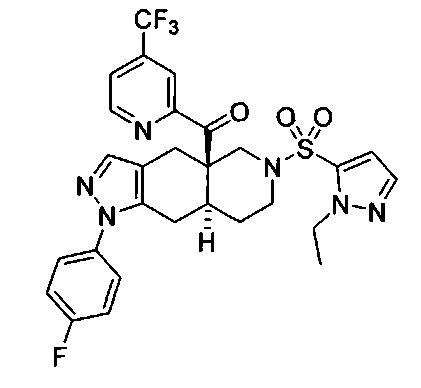
[0169] Применяли трифторуксусную кислоту/дихлорметан вместо HCl/диоксан. ЖХМС: RT 2,70 мин, m+Н=603,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,78 (1Н, d, J=5,0 Гц), 8,07 (1H, m), 7,66-7,64 (1Н, m), 7,49-7,44 (2Н, m), 7,36 (1Н, d, J=2,0 Гц), 7,29 (1Н, s), 7,18-7,12 (2Н, m), 6,58 (1H, d, J=2,0 Гц), 5,57 (1H, dd, J=12,5, 2,0 Гц), 4,32 (3Н, m), 3,98-3,94 (1Н, m), 3,38 (1H, dd, J=16,2, 10,8 Гц), 2,76-2,69 (2Н, m), 2,66 (1H, d, J=12,6 Гц), 2,61 (1Н, d, J=16,2 Гц), 2,51-2,40 (1Н, m), 1,89-1,80 (2Н, m), 1,39 (3H, t, J=7,2 Гц).
Пример 2М. ((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
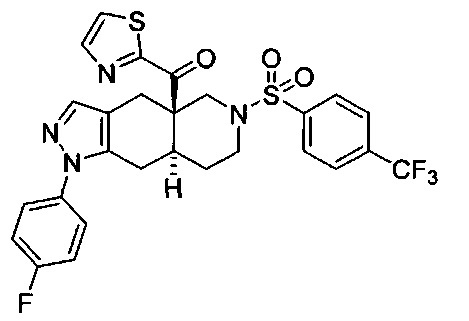
[0170] ЖХМС: RT 2,79 мин, m+Н=590,7; 1H ЯМР (400 МГц, CDCl3): δ 7,94 (1H, d, J=3,1 Гц), 7,82 (2Н, d, J=8,2 Гц), 7,71 (2Н, d, J=8,2 Гц), 7,59 (1Н, d, J=3,1 Гц), 7,48-7,42 (2Н, m), 7,34 (1Н, s), 7,17-7,10 (2Н, m), 5,43 (1Н, dd, J=12,3, 2,1 Гц), 4,16 (1Н, d, J=16,0 Гц), 4,05-3,96 (1Н, m), 3,37 (1Н, dd, J=16,0, 10,6 Гц), 2,69 (1Н, dd, J=16,4, 5,7 Гц), 2,59-2,42 (4Н, m), 1,84-1,77 (2Н, m).
Пример 2N. ((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
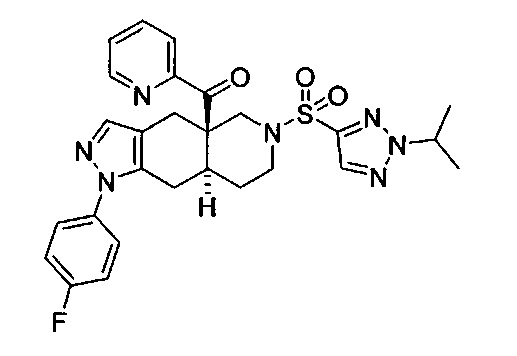
[0171] ЖХМС: RT 2,61 мин, m+H=549,9; 1H ЯМР (400 МГц, CDCl3): δ 8,68 (1Н, ddd, J=4,8, 1,7, 1,0 Гц), 7,88-7,78 (3Н, m), 7,54-7,42 (3Н, m), 7,37 (1Н, s), 7,21-7,12 (2Н, m), 5,70 (1Н, dd, J=12,4, 2,1 Гц), 4,90 (1H, sept, J=6,7 Гц), 4,40 (1Н, d, J=16,3 Гц), 4,02-3,96 (1Н, m), 3,48 (1Н, dd, J=16,3, 10,9 Гц), 2,72 (1Н, dd, J=16,3, 5,9 Гц), 2,66-2,58 (2Н, m), 2,55 (1Н, d, J=12,4 Гц), 2,46 (1Н, qd, J=13,8, 5,0 Гц), 1,83-1,75 (2Н, m), 1,62 (6Н, d, J=6,7 Гц).
Пример 2O. ((4aR,8aS)-6-((2-этил-2Н-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
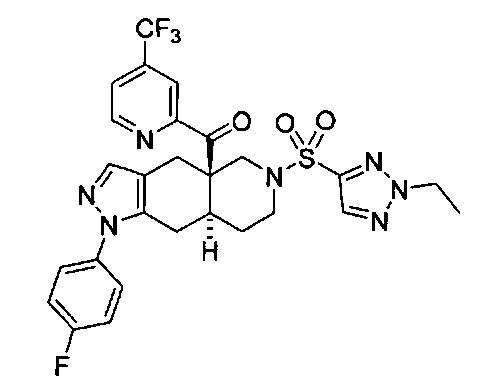
[0172] ЖХМС: RT 2,68 мин, m+H=604,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,86 (1Н, d, J=5,0 Гц), 8,10 (1Н, m), 7,81 (1H, s), 7,67-7,66 (1Н, m), 7,50-7,45 (1H, m), 7,33 (1Н, s), 7,18-7,12 (2Н, m), 5,64 (1Н, dd, J=12,4, 2,0 Гц), 4,52 (2Н, q, J=7,3 Гц), 4,25 (1Н, d, J=16,4 Гц), 3,98-3,93 (1Н, m), 3,43 (1Н, dd, J=16,4, 11,1 Гц), 2,72 (1Н, dd, J=16,2, 5,9 Гц), 2,60 (1Н, d, J=16,2 Гц), 2,64-2,58 (2Н, m), 2,56 (1Н, d, J=12,6 Гц), 2,48-2,36 (1Н, m), 1,84-1,76 (2Н, m), 1,60 (3H,t, J=7,3 Гц).
Пример 2Р. ((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
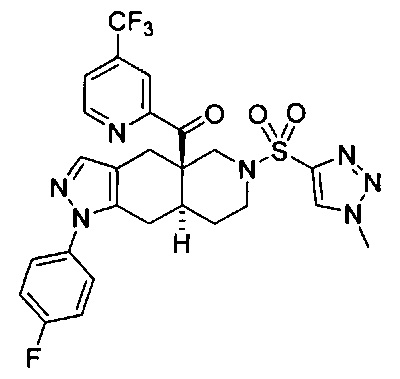
[0173] ЖХМС: RT 2,45 мин, m+H=590,2; 1Н ЯМР (400 МГц, CDCl3): δ 8,85 (1Н, d, J=5,0 Гц), 8,11-8,10 (1Н, m), 7,88 (1Н, s), 7,66-7,65 (1Н, m), 7,50-7,45 (2Н, m), 7,34 (1Н, s), 7,18-7,12 (2Н, m), 5,68 (1Н, dd, J=12,6, 2,0 Гц), 4,26 (1Н, d, J=16,4 Гц), 4,15 (3Н, s), 3,97-3,92 (1Н, m), 3,43 (1H, dd, J=16,4, 11,1 Гц), 2,78-2,70 (3Н, m), 2,63 (1Н, d, J=16,2 Гц), 2,47-2,36 (1Н, m), 1,87-1,78 (2Н, m).
Пример 2Q. ((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
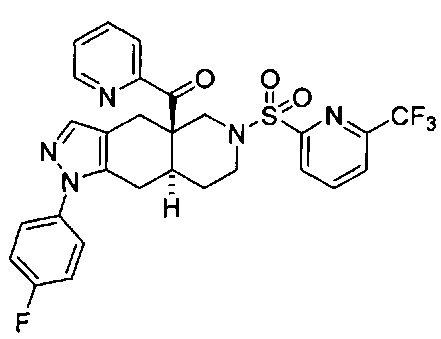
[0174] ЖХМС: RT 2,68 мин, m+H=585,6; 1Н ЯМР (400 МГц, CDCl3): δ 8,61-8,53 (1Н, m), 7,96 (1Н, t, J=7,7 Гц), 7,86 (1Н, d, J=7,7 Гц), 7,78-7,68 (3Н, m), 7,46-7,39 (2Н, m), 7,37 (1Н, ddd, J=6,9, 4,8, 2,0 Гц), 7,31 (1Н, s), 7,14-7,01 (2Н, m), 5,68 (1Н, dd, J=12,9, 2,1 Гц), 4,32 (1Н, d, J=16,3 Гц), 4,05-3,94 (1H, m), 3,46-3,33 (1Н, m), 2,93 (1Н, td, J=12,6, 3,1 Гц), 2,91 (1H, d, J=12,9 Гц), 2,65 (1H, dd, J=16,3, 6,0 Гц), 2,54 (1H, d, J=16,3 Гц), 2,37 (1H, qd, J=12,9, 5,1 Гц), 1,87-1,76 (1H, m), 1,76-1,64 (1H, m).
Пример 2R. ((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-метилпиридин-2-ил)метанон
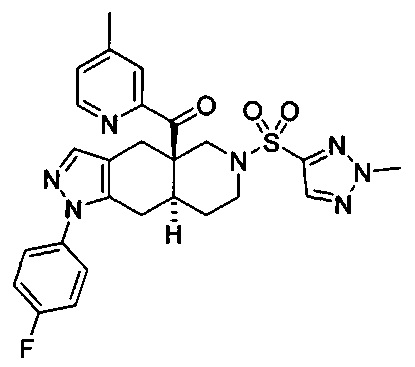
[0175] ЖХМС: RT 2,44 мин, m+Н=536,3; 1Н ЯМР (400 МГц, CDCl3): δ: 8,49 (1Н, d, J=5,0 Гц), 7,80 (1Н, s), 7,66-7,65 (1Н, m), 7,50-7,45 (2Н, m), 7,32 (1Н, s), 7,24-7,23 (1Н, m), 7,17-7,11 (2Н, m), 5,73 (1Н, dd, J=12,5, 2,2 Гц), 4,36 (1Н, d, J=16,1 Гц), 4,25 (3Н, s), 3,98-3,94 (1Н, m), 3,44 (1Н, dd, J=16,4, 11,3 Гц), 2,69 (1H, dd, J=16,1, 5,9 Гц), 2,64-2,42 (4Н, m), 2,37 (3Н, s), 1,79-1,70 (2Н, m).
Пример 2S. ((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон
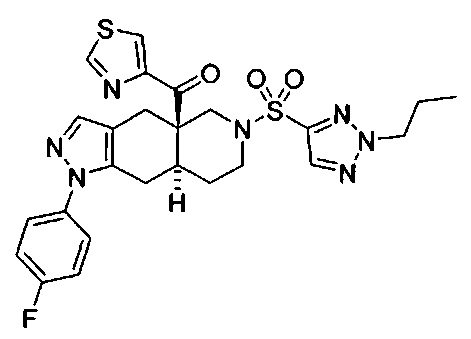
[0176] ЖХМС: RT 2,50 мин, m+Н=556,2; 1Н ЯМР (400 МГц, CDCl3): δ: 8,85 (1Н, d, J=2,2 Гц), 8,18 (1Н, d, J=2,2 Гц), 7,83 (1Н, s), 7,50-7,44 (2Н, m), 7,35 (1Н, s), 7,17-7,11 (2Н, m), 5,54 (1Н, dd, J=12,6, 2,0 Гц), 4,44 (2Н, dd, J=7,2 Гц), 4,19 (1Н, d, J=16,3 Гц), 3,99-3.95 (1Н, m), 3,46 (1Н, dd, J=16,4, 11,1 Гц), 2,68 (1Н, dd, J=16,4, 5,9 Гц), 2,62-2,48 (4Н, m), 2,02 (2Н, sext, J=7,2 Гц), 1,83-1,75 (2Н, m), 0,94 (3Н, t, J=7,2 Гц).
Пример 2Т. 3-(((4aR,8aS)-1-(4-фторфенил)-4а-пиколиноил-4а,5,7,8,8а,9-гексагидро-1Н-пиразоло[3,4-g]изохинолин-6(4H)-ил)сульфонил)бензонитрил
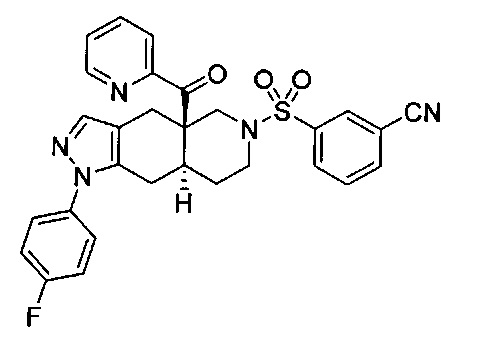
[0177] ЖХМС: RT 2,46 мин, m+Н = 542,2; 1Н ЯМР (400 МГц, CDCl3): δ: 8,63 (1Н, ddd, J=4,7, 1,3 Гц), 7,92-7,88 (2Н, m), 7,81-7,79 (2Н, m), 7,77 (1Н, ddd, J=7,7, 1,3 Гц), 7,58 (1Н, dt, J=7,7, 0,6 Гц), 7,48-7,42 (3Н, m), 7,30 (1H, s), 7,17-7,11 (2Н, m), 5,66 (1Н, dd, J=12,3, 2,1 Гц), 4,27 (1Н, d, J=16,1 Гц), 3,98-3,95 (1Н, m), 3,39 (1Н, dd, J=16,1, 11,2 Гц), 2,68 (1Н, dd, J=16,3, 6,1 Гц), 2,55-2,39 (4Н, m), 1,80-1,69 (2Н, m).
Пример 2U. ((4aR,8aS)-6-((3-фтор-4-(трифторметил)фенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
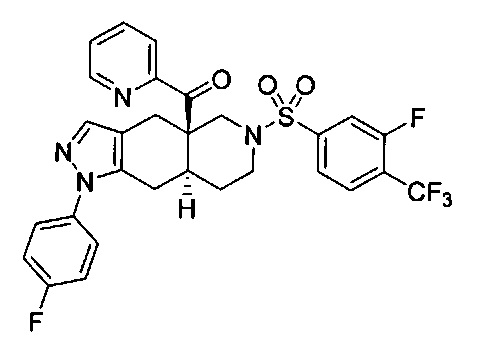
[0178] ЖХМС: RT 2,79 мин, m+Н = 603,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,63 (1Н, ddd, J=4,7, 1,3 Гц), 7,79-7,78 (2Н, m), 7,66 (1Н, dd, J=7,7 Гц), 7,54 (1Н, d, J=8,0 Гц), 7,49-7,42 (4Н, m), 7,30 (1Н, s), 7,17-7,11 (2Н, m), 5,64 (1Н, dd, J=12,4, 2,0 Гц), 4,26 (1H, d, J=16,1 Гц), 4,00-3,96 (1H, m), 3,39 (1H, dd, J=16,4, 11,2 Гц), 2,69 (1Н, dd, J=16,2, 6,0 Гц), 2,60-2,41 (4Н, m), 1,80-1,71 (2Н, m).
Пример 2V. ((4aR,8aS)-1-(4-фторфенил)-6-((4-метил-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
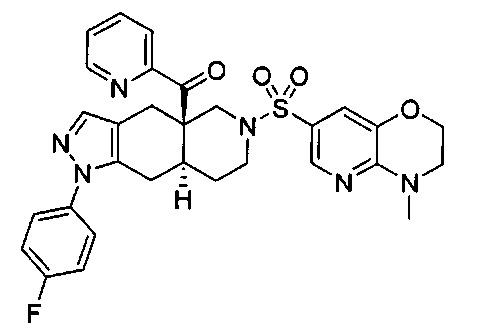
[0179] ЖХМС: RT 2,39 мин, m+Н = 589,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,61 (1Н, ddd, J=4,7, 1,6, 0,9 Гц), 8,05 (1Н, d, J=2,0 Гц), 7,83-7,81 (1Н, m), 7,77 (1Н, dd, J=7,4, 1,6 Гц), 7,49-7,44 (2Н, m), 7,40 (1Н, ddd, J=7,3, 4,7, 1,6 Гц), 7,32 (1Н, s), 7,16-7,10 (2Н, m), 7,04 (1Н, d, J=2,0 Гц), 5,51 (1Н, dd, J=12,1, 2,0 Гц), 4,31 (1Н, d, J=16,2 Гц), 4,23-4,21 (2Н, m), 3,87-3,84 (1Н, m), 3,55-3,53 (2Н, m), 3,43 (1Н, dd, J=16,4, 11,1 Гц), 3,22 (3Н, s), 2,67 (1Н, dd, J=16,3, 6,1 Гц), 2,54 (1Н, d, J=16,2 Гц), 2,47-2,36 (2Н, m), 2,32 (1H, J=12,0 Гц), 1,76-1,66 (2Н, m).
Пример 2W. ((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
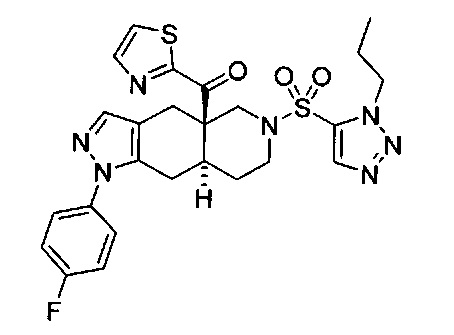
[0180] ЖХМС: RT 2,48 мин, m+Н = 556,2; 1Н ЯМР (400 МГц, CDCl3): 8 7,94 (1H, d, J=3,1 Гц), 7,87 (1Н, s), 7,62 (1Н, d, J=3,1 Гц), 7,48-7,42 (2Н, m), 7,32 (1Н, s), 7,17-7,11 (2Н, m), 5,45 (1Н, dd, J=12,7, 2,1 Гц), 4,38-4,27 (2Н, m), 4,14 (1Н, d, J=16,1 Гц), 4,06-4,01 (1Н, m), 3,37 (1Н, dd, J=16,1, 11,1 Гц), 2,86-2,70 (3Н, m), 2,61 (1Н, d, J=16,1 Гц), 2,53-2,42 (1Н, m), 1,97-1,82 (4Н, m), 0,94 (3Н, t, J=7,3 Гц).
Пример 2Х. ((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
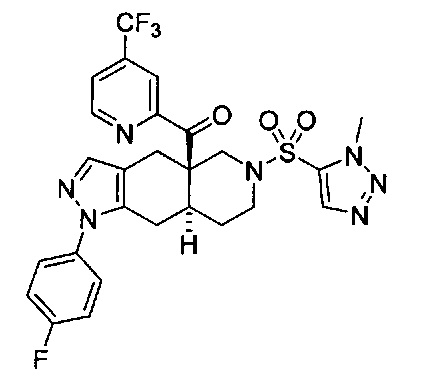
[0181] ЖХМС: RT 2,56 мин, m+Н = 590,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,77 (1H, d, J=5.0 Гц), 8,04 (1H, m), 7,89 (1H, s), 7,69-7,67 (1Н, m), 7,48-7,43 (2Н, m), 7,28 (1Н, s), 7,18-7,12 (2Н, m), 5,59 (1Н, dd, J=12,6, 2,0 Гц), 4,12 (1Н, d, J=16,3 Гц), 4,06 (3Н, s), 4,06-4,01 (1Н, m), 3,35 (1Н, dd, J=16,4, 11,2 Гц), 2,82-2,72 (3Н, m), 2,61 (1Н, d, J=16,2 Гц), 2,47-2,36 (1H, qd, J=13,0,5,2 Гц), 1,91-1,82 (2Н, m).
Пример 2Y. ((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
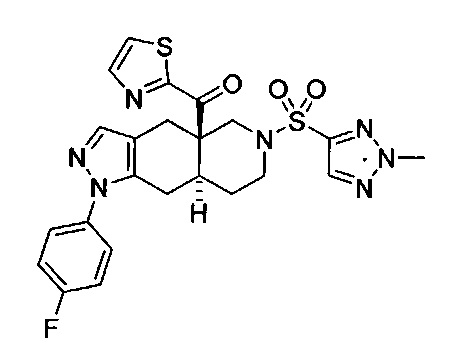
[0182] ЖХМС: RT 2,30 мин, m+Н = 528,2; 1Н NMR (400 МГц, CDCl3): δ 8,02 (1Н, d, J=3.1 Гц), 7,82 (1Н, s), 7,61 (1H, d, J=3,1 Гц), 7,49-7,44 (2Н, m), 7,35 (1Н, s), 7,17-7,10 (2Н, m), 5,58 (1Н, dd, J=12,6, 2,1 Гц), 4,26 (3Н, s), 4,22 (1Н, d, J=16,4 Гц), 4,04-3,96 (1Н, m), 3,41 (1Н, dd, J=16,4, 11,4 Гц), 2,73-2,58 (4Н, m), 2,54-2,43 (1Н, m), 1,88-1,77 (2Н, m).
Пример 2Z. ((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
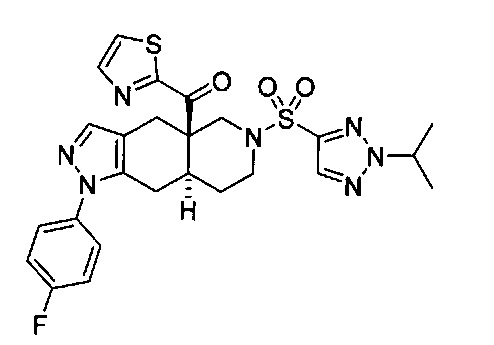
[0183] ЖХМС: RT 2,53 мин, m+Н = 556,2; 1Н ЯМР (400 МГц, CDCl3): δ 8,03 (1Н, d, J=3,1 Гц), 7,80 (1Н, s), 7,61 (1Н, d, J=3,1 Гц), 7,49-7,44 (2H, m), 7,35 (1H, s), 7,17-7,11 (2H, m), 5,60 (1H, dd, J=12,6, 2,1 Гц), 4,88 (1H, sept, J=6,7 Гц), 4,23 (1H, d, J=16,4 Гц), 4,02-3,98 (1H, m), 3,41 (1H, dd, J=16,1, 11,2 Гц), 2,73-2,58 (4H, m), 2,49 (1H, dq, J=12,5, 5,0 Гц), 1,88-1,74 (2H, m), 1,61 (6H, d, J=6,7 Гц).
Пример 2AA. ((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
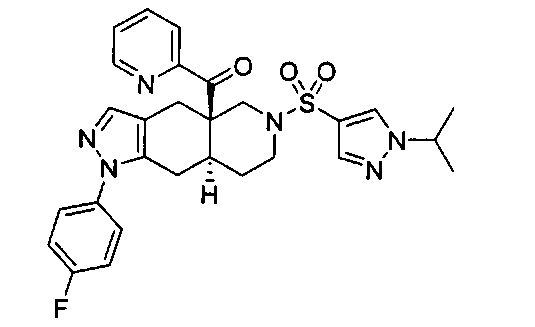
[0184] ЖХМС: RT 2,41 мин, m+Н = 549,3; 1Н ЯМР (400 МГц, CDCl3): 8,63 (1Н, ddd, J=4,7, 1,6, 0,8 Гц), 7,82 (1Н, ddd, J=7,8, 1,3, 0,8 Гц), 7,77 (1Н, dd, J=7,4, 1,6 Гц), 7,72 (1Н, s), 7,64 (1Н, d, J=0,8 Гц), 7,49-7,44 (2Н, m), 7,41 (1Н, ddd, J=7,3, 4,8, 1,6 Гц), 7,31 (1Н, s), 7,15-7,09 (2Н, m), 5,51 (1Н, dd, J=12,0, 2,0 Гц), 4,47 (1H, sept, J=6,7 Гц), 4,34 (1Н, d, J=16,1 Гц), 3,85-3,78 (1Н, m), 3,43 (1Н, dd, J=16,4, 11,2 Гц), 2,68 (1Н, dd, J=16,2, 6,0 Гц), 2,56 (1Н, d, J=16,2 Гц), 2,46-2,32 (2Н, m), 2,26 (1H, d, J=12,0 Гц), 1,82-1,64 (2Н, m), 1,49 (6H,dd, J=6,7, 1,1 Гц).
Пример 2АВ. ((4aR,8aS)-6-((2-этил-2Н-1,2,3-триазол-4-илкульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
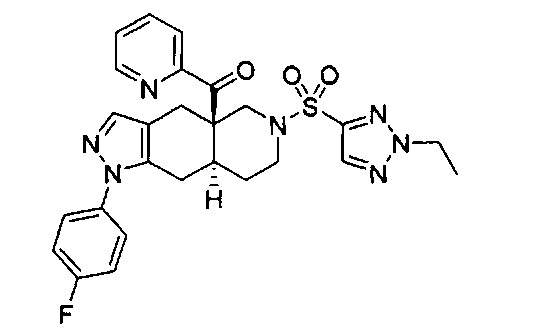
[0185] ЖХМС: RT 2,43 мин, m+Н = 536,2; 1Н ЯМР (400 МГц, CDCl3): 8,63 (1Н, ddd, J=4,7, 1,6, 0,9 Гц), 7,84-7,77 (3Н, m), 7,50-7,45 (2Н, m), 7,43 (1Н, ddd, J=7,0, 4,7, 1,6 Гц), 7,33 (1Н, s), 7,17-7,11 (2Н, m), 5,68 (1Н, dd, J=12,4, 1,9 Гц), 4,51 (2Н, q, J=7,3 Гц), 4,36 (1Н, d, J=16,2 Гц), 3,99-3,92 (1H, m), 3,45 (1H, dd, J=16,2, 11,3 Гц), 2,69 (1H, dd, J=16,2, 6,0 Гц), 2,63-2,55 (2H, m), 2,52 (1H, d, J=12,3 Гц), 2,43 (1H, dq, J=13,4, 4,8 Гц), 1,80-1,71 (2H, m), 1,59 (3H, t, J=7,3 Гц).
Пример 2AC. ((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
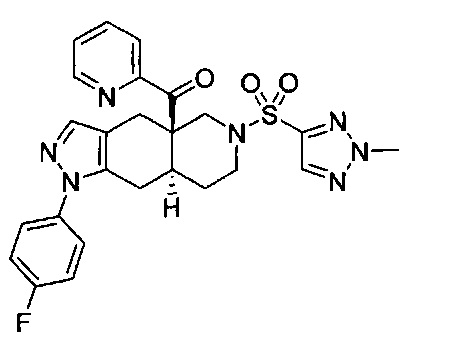
[0186] ЖХМС: RT 2,31 мин, m+Н = 522,2; 1H ЯМР (400 МГц, CDCl3): δ 8,65 (1H, ddd, J=4,7, 1,6, 0,9 Гц), 7,84-7,77 (3Н, m), 7,50-7,46 (2Н, m), 7,43 (1Н, ddd, J=7,1, 4,7, 1,6 Гц), 7,33 (1Н, s), 7,17-7,11 (2Н, m), 5,68 (1H, dd, J=12,4, 2,0 Гц), 4,36 (1Н, d, J=16,2 Гц), 3,99-3,91 (1H, m), 4,25 (3Н, s), 3,45 (1Н, dd, J=16,2, 11,3 Гц), 2,70 (1Н, dd, J=16,2, 6,0 Гц), 2,64-2,55 (2Н, m), 2,53 (1Н, d, J=12,4 Гц), 2,43 (1Н, dq, J=13,4, 4,7 Гц), 1,80-1,71 (2Н, m).
Пример 2AD. ((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
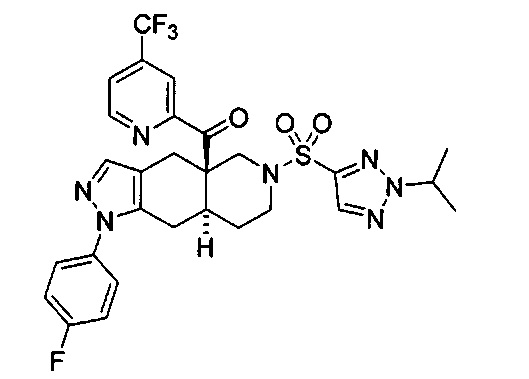
[0187] ЖХМС: RT 2,79 мин, m+Н = 618,3; 1Н ЯМР (400 МГц, CDCl3): δ 8,87 (1Н, d, J=5,0 Гц), 8,10-8,09 (1Н, m), 7,80 (1Н, s), 7,66 (1Н, dd, J=5,0, 1,0 Гц), 7,50-7,44 (2Н, m), 7,32 (1Н, s), 7,17-7,11 (2Н, m), 5,64 (1Н, dd, J=12,5, 2,0 Гц), 4,88 (1Н, sept, J=6,6 Гц), 4,25 (1Н, d, J=16,2 Гц), 3,99-3,91 (1Н, m), 3,43 (1Н, dd, J=16,2, 10,9 Гц), 2,71 (1H, dd, J=16,4, 6,0 Гц), 2,63-2,56 (2Н, m), 2,54 (1Н, d, J=12,4 Гц), 2,42 (1Н, dq, J=13,4, 4,8 Гц), 1,86-1,75 (2Н, m), 1,60 (6Н, d, J=6,6 Гц).
Пример 2АЕ. ((4aR,8aS)-6-((2Н-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанон
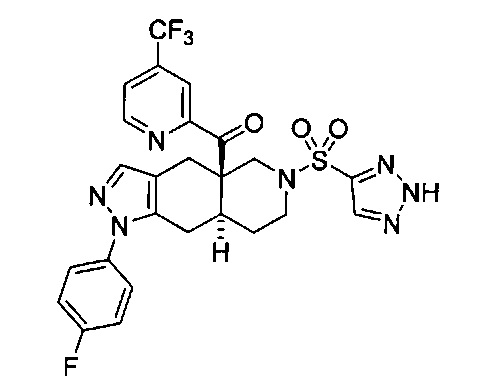
[0188] ЖХМС: RT 2,39 мин, m+Н = 576,2; 1Н NMR (400 МГц, CDCl3): δ 8,87 (1Н, d, J=5,0 Гц), 8,11-8,10 (1Н, m), 7,93 (1Н, s), 7,66 (1Н, dd, J=5,0, 1,0 Гц), 7,50-7,45 (2Н, m), 7,39 (1Н, s), 7,19-7,13 (2Н, m), 5,64 (1Н, dd, J=12,5, 1,9 Гц), 4,27 (1Н, d, J=16,2 Гц), 3,98-3,91 (1Н, m), 3,42 (1H, dd, J=16,2, 11,3 Гц), 2,71 (1H, dd, J=16,6, 6,1 Гц), 2,66-2,59 (3H, m), 2,40 (1H, dq, J=13,5, 4,7 Гц), 1,85-1,74 (2H, m).
Пример 2AF. ((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанон
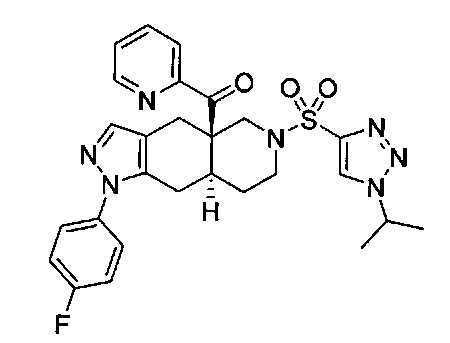
[0189] ЖХМС: RT 2,37 мин, m+Н = 550,2; 1Н ЯМР (400 МГц, CDCl3): 8,65 (1Н, ddd, J=4,7, 1,6, 0,9 Гц), 7,90 (1Н, s), 7,84 (1Н, ddd, J=8,0, 1,3, 0,9 Гц), 7,79 (1Н, dt, J=7,3, 1,6 Гц), 7,51-7,46 (2Н, m), 7,42 (1Н, ddd, J=7,3, 4,7, 1,6 Гц), 7,34 (1Н, s), 7,17-7,11 (2Н, m), 5,70 (1Н, dd, J=12,4, 2,0 Гц), 4,85 (1Н, sept, J=6,7 Гц), 4,38 (1Н, d, J=16,2 Гц), 4,01-3,92 (1H, m), 3,45 (1Н, dd, J=16,4, 11,0 Гц), 2,81-2,68 (3Н, m), 2,59 (1Н, d, J=15,9 Гц), 2,43 (1Н, dq, J=13,9, 5,0 Гц), 1,84-1,73 (2Н, m), 1,59 (6Н, dd, J=6,7, 2,0 Гц).
Пример 2AG. ((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанон
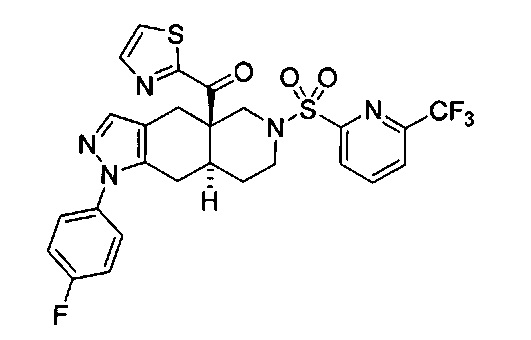
[0190] ЖХМС: RT 2,58 мин, m+Н = 592,2; 1Н ЯМР (400 МГц, CDCl3): 1Н ЯМР (400 МГц, CDCl3) δ 8,07-8,01 (2Н, m), 7,95 (1Н, d, J=7,8 Гц), 7,83 (1Н, d, J=7,8 Гц), 7,60 (1Н, d, J=3,1 Гц), 7,48-7,45 (2Н, m), 7,34 (1H, s), 7,16-7,12 (2Н, m), 5,62 (1Н, dd, J=12,9, 1,6 Гц), 4,24 (1Н, d, J=16,1 Гц), 4,13-4,09 (1H, m), 3,42 (1H, dd, J=16,1, 11,6 Гц), 3,07-3,00 (2H, m), 2,72 (1H, dd, J=16,4, 6,1 Гц), 2,63 (1H, d, J=16,2 Гц), 2,50 (1H, dq, J=12,9, 5,0 Гц), 1,99-1,90 (1H, m), 1,81-1,78 (1H, m).
Пример 2AH. ((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон
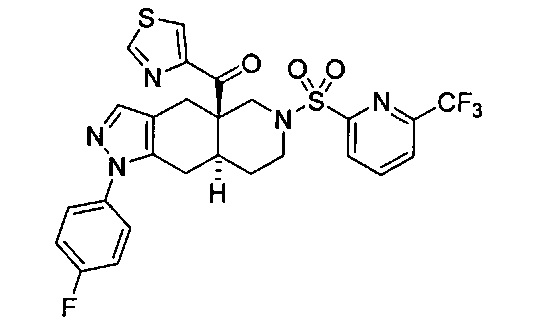
[0191] ЖХМС: RT 2,53 мин, m+Н = 592,2; 1Н ЯМР (400 МГц, CDCl3): 1Н ЯМР (400 МГц, CDCl3) δ 8,83 (1Н, d, J=2,1 Гц), 8,15 (1H, d, J=2,1 Гц), 8,07-8,03 (1Н, m), 7,96 (1Н, d, J=7,6 Гц), 7,82 (1Н, dd, J=7,6, 0,9 Гц), 7,50-7,45 (2Н, m), 7,33 (1Н, s), 7,17-7,11 (2Н, m), 5,58 (1Н, dd, J=12,9, 2,0 Гц), 4,18 (1Н, d, J=16,4 Гц), 4,10-4,06 (1Н, m), 3,47 (1Н, dd, J=16,2, 11,3 Гц), 3,04-2,97 (1Н, m), 2,95 (1Н, d, J=13,1 Гц), 2,70 (1Н, dd, J=16,2, 6,1 Гц), 2,59-2,45 (2Н, m), 1,95-1,97 (1Н, m), 1,82-1,73 (1Н, m).
Пример 2AI. ((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон
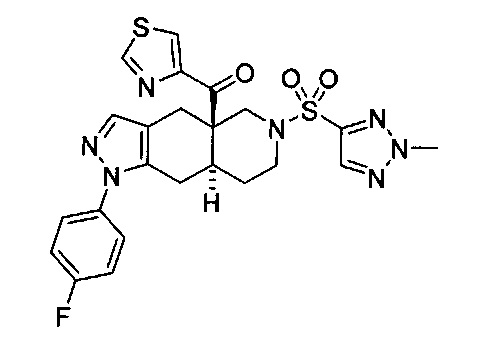
[0192] ЖХМС: RT 2,21 мин, m+Н = 528,2; 1Н ЯМР (400 МГц, CDCl3): 1Н ЯМР (400 МГц, CDCl3) δ 8,85 (1Н, d, J=2,0 Гц), 8,17 (1H, d, J=2,0 Гц), 7,82 (1Н, s), 7,50-7,45 (2Н, m), 7,34 (1H, s), 7,17-7,11 (2H, m), 5,53 (1H, dd, J=12,6, 2,1 Гц), 4,26 (3H, s), 4,19 (1H, d, J=16,4 Гц), 4,00-3,96 (1H, m), 3,46 (1H, dd, J=15,7, 10,9 Гц), 2,72-2,43 (5H, m), 1,84-1,73 (2H, m).
Пример 2AJ. ((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон
[0193] ЖХМС: RT 2,46 мин, m+Н = 556,2; 1H ЯМР (400 МГц, CDCl3): 1H ЯМР (400 МГц, CDCl3) δ 8,86 (1Н, d, J=2,1 Гц), 8,17 (1Н, d, J=2,1 Гц), 7,80 (1Н, s), 7,50-7,45 (2Н, m), 7,35 (1Н, s), 7,17-7,11 (2Н, m), 5,54 (1H, dd, J=12,6, 2,1 Гц), 4,89 (1H, sept, J=6,8 Гц), 4,19 (1Н, d, J=16,4 Гц), 4,02-3,94 (1Н, m), 3,46 (1H, dd, J=16,4, 12,0 Гц), 2,71-2,43 (5Н, m), 1,84-1,72 (2Н, m), 1,61 (6Н, d, J=6,8 Гц).
Пример 2AK. ((4aR,8aS)-6-((2-этил-2Н-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанон
[0194] ЖХМС: RT 2,33 мин, m+Н = 542,2; 1H ЯМР (400 МГц, CDCl3): 1H ЯМР (400 МГц, CDCl3) δ 8,87 (1H, d, J=2,0 Гц), 8,19 (1Н, d, J=2,0 Гц), 7,83 (1Н, s), 7,52-7,46 (2Н, m), 7,36 (1Н, s), 7,19-7,13 (2Н, m), 5,55 (1Н, dd, J=12,6, 2,2 Гц), 4,54 (2Н, q, J=7,2 Гц), 4,20 (1Н, d, J=16,4 Гц), 4,01-3,97 (1H, m), 3,48 (1H, dd, J=15,8, 11,0 Гц), 2,73-2,46 (5H, m), 1,87-1,77 (2H, m), 1,62 (3H, t, J=7,2 Гц).
Пример 3. Флуоресцентный поляризационный (ФП) анализ связывания Глюкокортикоидного рецепора человека (ГР)
[0195] Ниже представлено описание исследования ФП для определения ингибирования соединением связывания меченого глюкокортикоида с рекомбинантным ГР человека.
[0196] Аффинность связывания исследуемых соединений определяли с использованием ФП анализа связывания с применением рекомбинантного ГР человека (PanVera Р2812) и флюоресцентно-меченого глюкокортикоидного лиганда (Fluorome GS Red) (PanVera P2894). Присутствие ингибиторов предотвращает образование комплекса GS Red/ГР, снижающего замеряемое значение поляризации. Изменение значения поляризации в присутствии исследуемых соединений использовали для вычисления аффинности связывания соединения с ГР.
[0197] Исследование проводили в 384-луночных черных круглодонных полипропиленовых планшетах для микротитрования в конечном объеме, составляющем 20 мкл. Исследование включало 5 мкл 1 нМ ГР (конечная концентрация), 5 мкл 0,5 нМ Fluorome GS Red (конечная концентрация) в присутствии 10 мкл исследуемых соединений. В лунки положительного контроля (высокая поляризация) добавляли 10 мкл 2% (об.:об.) несущей среды ДМСО (1% (об./об.) конечной концентрации) + 5 мкл 1 нМ ГР и 5 мкл 0,5 нМ Fluorome GS Red. В лунки отрицательного контроля (низкая поляризация) добавляли 10 мкл 2 мкМ дексаметазона (1 мкМ конечная концентрация) + 5 мкл 1 нМ ГР и 5 мкл 0,5 нМ Fluorome GS Red. В фоновые лунки для исследования (используемые для нормализации) добавляли 15 мкл 1x GS аналитический буфер + 5 мкл ГР.
[0198] Для определения IC50 (концентрация соединения, которая вытесняет 50% связанного GS Red), соединения исследовали в восьми различных концентрациях в двух повторностях в двух независимо выполняемых экспериментах. Соединения получали в виде растворимых твердых веществ при 10 мМ в ДМСО. В день исследования готовили 8-ми точечное полулогарифмическое серийное разбавление (55 мкл ДМСО + 25 мкл раствора соединения). Для каждого соединения готовили разбавление 1:50 (1 мкл раствора соединения + 49 мкл 1x GS аналитический буфер). Соединения получали в удвоенной конечной концентрации согласно исследованию.
[0199] Реагенты добавляли в 384-луночные планшеты для микротитрования в следующем порядке: 10 мкл исследуемого соединения /носитель/1 мкМ дексаметазон, 5 мкл Fluorome GS Red и 5 мкл ГР. Планшеты объединяли и инкубировали в течение 4 часов при комнатной температуре. ФП измеряли с использованием планшет-ридера Envision Excite с интерференционными фильтрами длины волны возбуждения 535 нм и длины волны эмиссии 590 нм.
[0200] Значения миллиполяризации (mP) вычисляли с использованием приведенного ниже уравнения:
mP = 1000 * (S-G*P) / (S+G*P)
где S и Р представляют собой фоновые вычитаемые флуоресцентные единицы, G=G-фактор (1,07).
[0201] Значения IC50 для соединений вычисляли путем построения кривой зависимости [соединения] от % ингибирования и подстановки данных в логистическое уравнение с 4 параметрами. Значения Ki (равновесная константа диссоциации) для соединений определяли по экспериментальным значениям IC50 с использованием поправочного уравнения расхода лиганда (см. ниже), предполагая, что антагонисты являлись конкурентными ингибиторами по отношению к дексаметазону (Pharmacologic Analysis of Drug Receptor Interactions, 2nd Ed., p 385-410, 1993, Raven Press, New York).
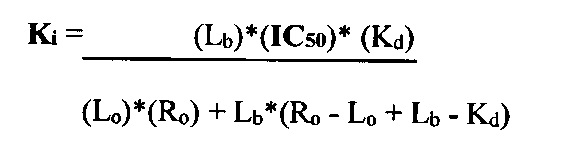
Реагенты:
[0202] 10x ГР аналитический буфер (100 мМ фосфата калия рН 7,4, 200 мМ Na2MoO4, 1 мМ ЭДТК, 20% (об./об.) ДМСО). Для приготовления 1x ГР аналитического буфера, объединяли 1 мл 10x ГР аналитического буфера (PanVera Р2814) + 1 мл стабилизирующего пептида (PanVera Р2815) + 7,95 мл 4°С MQ воды. Добавляли 50 мкл 1М DTT, встряхивали и помещали на лед до применения.
Пример 4. Исследование Тирозинаминотрансферазы (ТАТ) в клетках HepG2
[0203] Опосредованная глюкокортикоидом активация ТАТ происходит путем трансактивации глюкокортикоид-отвечающих элементов в промоторе ТАТ посредством комплекса глюкокортикоидный рецептор-агонист. Представленный ниже протокол описывает исследования для определения индукции ТАТ дексаметазоном в клетках HepG2 (клеточная линия гепатоцеллюлярной карциномы печени человекаа; ЕСАСС, UK).
[0204] Активность ТАТ измеряли как показано в документе А. Ali et al., J. Med. Chem., 2004, 47, 2441-2452. Дексаметазон индуцировал продукцию ТАТ со средним значением ЕС50 (полумаксимальный эффект), составляющим 20 нМ.
[0205] Клетки HepG2 культивировали с использованием среды МЕМЕ, обогащенной 10% (об./об.) фетальной бычьей сывороткой; 2 мМ L-глутамином и 1% (об./об.) NEAA при 37°С, 5%/95% (об./об.) СО2/воздух. Клетки HepG2 подсчитывали и доводили до получения плотности 0,125×106 кл/мл в среде RPMI 1640 без фенолового красного, 10% (об./об.) ФБС, очищенной на активированном угле, 2 мМ L-глутамина и высевали в количестве 25000 кл/лунку в 200 мкл в 96 луночные стерильные планшеты для микротитрования тканевых культур, и инкубировали при 37°С, 5% СО2 в течение 24 часов.
[0206] Культуральную среду удаляли и заменяли средой для исследования {RPMI 1640 без фенолового красного, 2 мМ L-глутамина + 10 мкМ форсколина}. Исследуемые соединения подвергали скринингу в отношении конкурирования с 100 нМ дексаметазоном. Соединения подвергали серийному полулогарифмическому разведению в 100% (об./об.) диметилсульфоксида из 10 мМ исходного раствора. Затем строили 8-ми точечную полулогарифмическую кривую разбавления, после чего разводили в аналитической среде 1:100 с получением 10x конечной пробы [соединения]: в результате чего была получена конечная проба [соединения], колеблющаяся от 10 до 0,003 мкМ в 0,1% (об./об.) диметилсульфоксиде.
[0207] Исследуемые соединения предварительно инкубировали с клетками в планшетах для микротитрования в течение 30 минут при 37°С, 5/95 (об./об.) СО2/воздух, перед добавлением 100 нМ дексаметазона, а затем последовательно в течение 20 часов для обеспечения оптимальной индукции ТАТ.
[0208] Затем клетки HepG2 подвергали лизису с 30 мкл буфера для лизиса клеток, содержащего смесь ингибиторов протеаз, в течение 15 минут при 4°С. Затем добавляли 155 мкл субстратной смеси, содержащей 5,4 мМ натриевой соли тирозина, 10,8 мМ альфа-кетоглутарата и 0,06 мМ пиридоксаль 5' фосфата в 0,1М калий-фосфатном буфере (рН 7,4). После 2 часов инкубирования при 37°С реакцию прекращали добавлением 15 мкл 10М водного раствора гидроксида калия, и планшеты инкубировали в течение дополнительных 30 минут при 37°С. Продукт активности ТАТ определяли по оптической плотности при длине волны λ 340 нм.
[0209] Значения IC50 вычисляли путем построения зависимости % ингибирования (нормированного по стимуляции ТАТ 100 нМ дексаметазоном) от [соединения] и подстановки данных в логистическое уравнение с 4 параметрами. Значения IC50 преобразовывали в Ki (равновесная константа диссоциации) с использованием уравнения Ченга-Прусоффа, предполагая, что антагонисты являлись конкурентными ингибиторами по отношению к дексаметазону.
Таблица 1. Данные активности
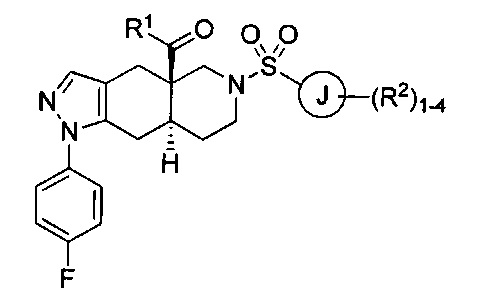
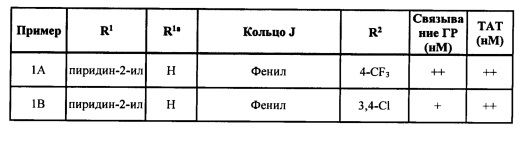
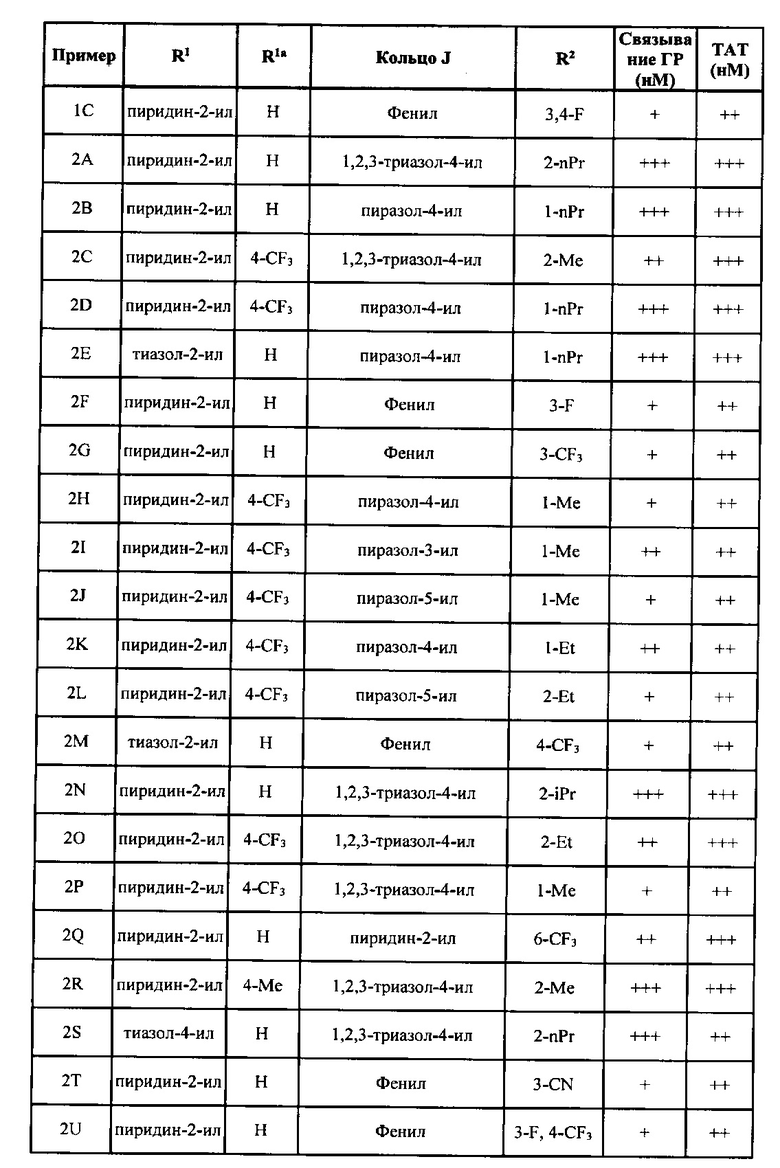
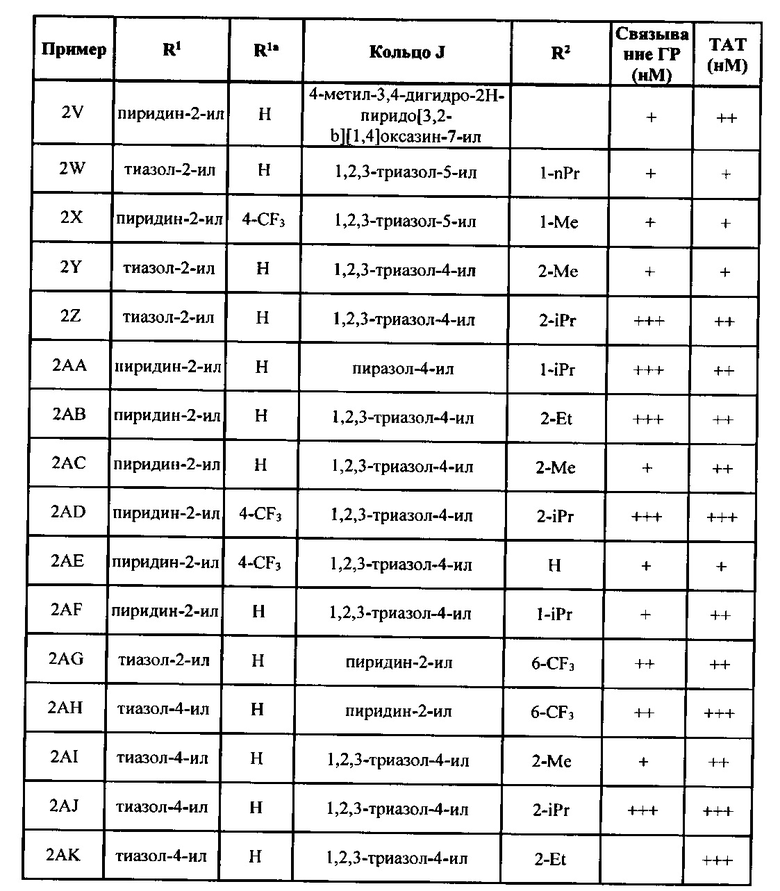
В Таблице 1 соединения, связывающие ГР со значением Ki меньшим, чем 0,5 нМ, обозначены как +++; соединения со значением Ki от 0,5 нМ до менее, чем 1,0 нМ, обозначены как ++; и соединения со значением Ki по меньшей мере 1,0 нМ обозначены как +. Активность ТАТ со значением Ki меньшим, чем 20 нМ, обозначены как +++, соединения со значением Ki от 20 нМ до менее, чем 100 нМ, обозначены как ++; и соединения со значением Ki по меньшей мере 100 нМ обозначены как +.
[0210] Хотя настоящее изобретение было подробно описано путем пояснений и примеров для целей ясности и понимания, специалисту в данной области техники будет понятно, что возможно осуществление определенных изменений и модификаций в пределах прилагаемой формулы изобретения. Кроме того, каждый справочный источник, приведенный в настоящей заявке, включен в настоящую заявку посредством ссылки во всей полноте в той же степени, как если бы каждый источник был индивидуально включен посредством ссылки. В случае, когда наблюдается противоречие между настоящей заявкой и представленной в настоящей заявке ссылкой, преобладает настоящая заявка.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ С ГЕТЕРОАРИЛКЕТОНАМИ АЗАДЕКАЛИНЫ - МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2639867C2 |
| ИНГИБИТОРЫ ОКСАЗИНМОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ (MAGL) | 2019 |
|
RU2794334C2 |
| БИЦИКЛИЧЕСКИЕ ЛАКТАМЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2827714C1 |
| ТРИЦИКЛИЧЕСКИЕ ТРИАЗОЛЬНЫЕ СОЕДИНЕНИЯ | 2014 |
|
RU2666728C2 |
| ИНГИБИТОРЫ РЕПЛИКАЦИИ ВИРУСА ИММУНОДЕФИЦИТА ЧЕЛОВЕКА | 2019 |
|
RU2812128C2 |
| ЗАМЕЩЕННЫЕ [1,2,4]ТРИАЗОЛО[1,5-a]ПИРИМИДИН-7-ИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE2 | 2015 |
|
RU2659070C9 |
| Способ получения фармацевтически приемлемых солей транс-4 @ -5 @ -пропил-4,4а,5,6,7,8,8а,9-октагидро- @ /и @ / пиразоло /3,4- @ / хинолина | 1983 |
|
SU1299506A3 |
| НОВЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ КАК ИНГИБИТОРЫ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2019 |
|
RU2769507C1 |
| НОВЫЕ СОЕДИНЕНИЯ | 2015 |
|
RU2691389C2 |
| ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ КОНДЕНСИРОВАННОЕ ЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2815814C1 |
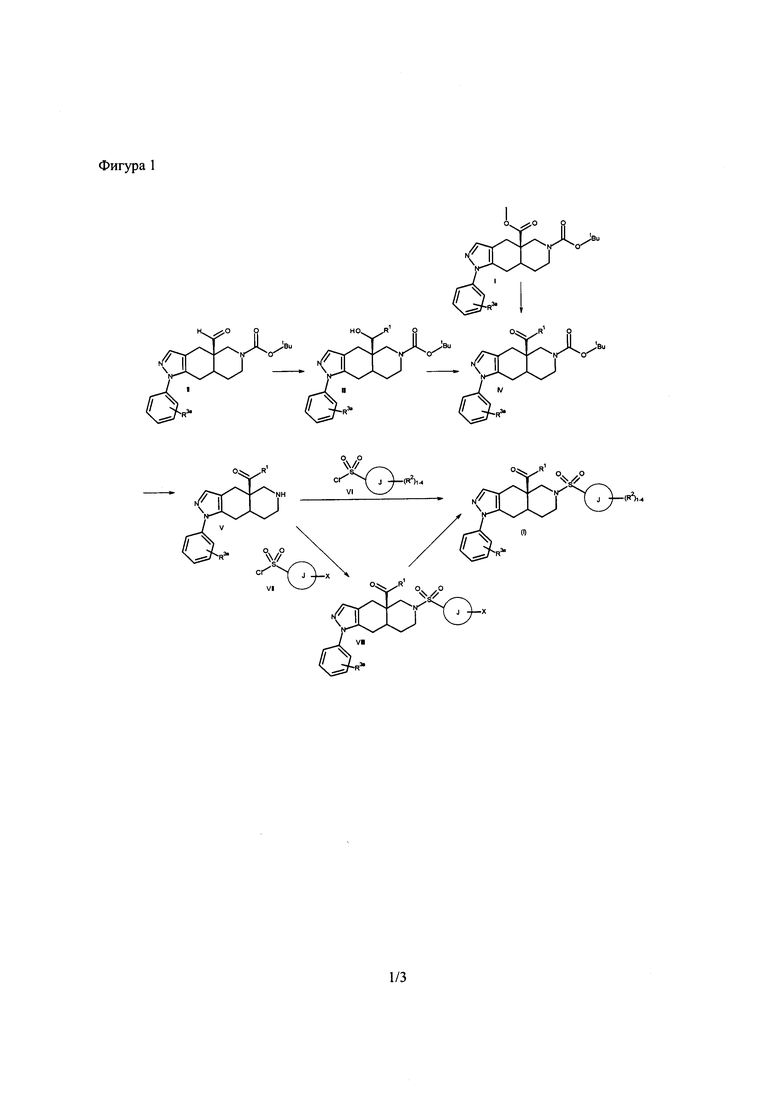
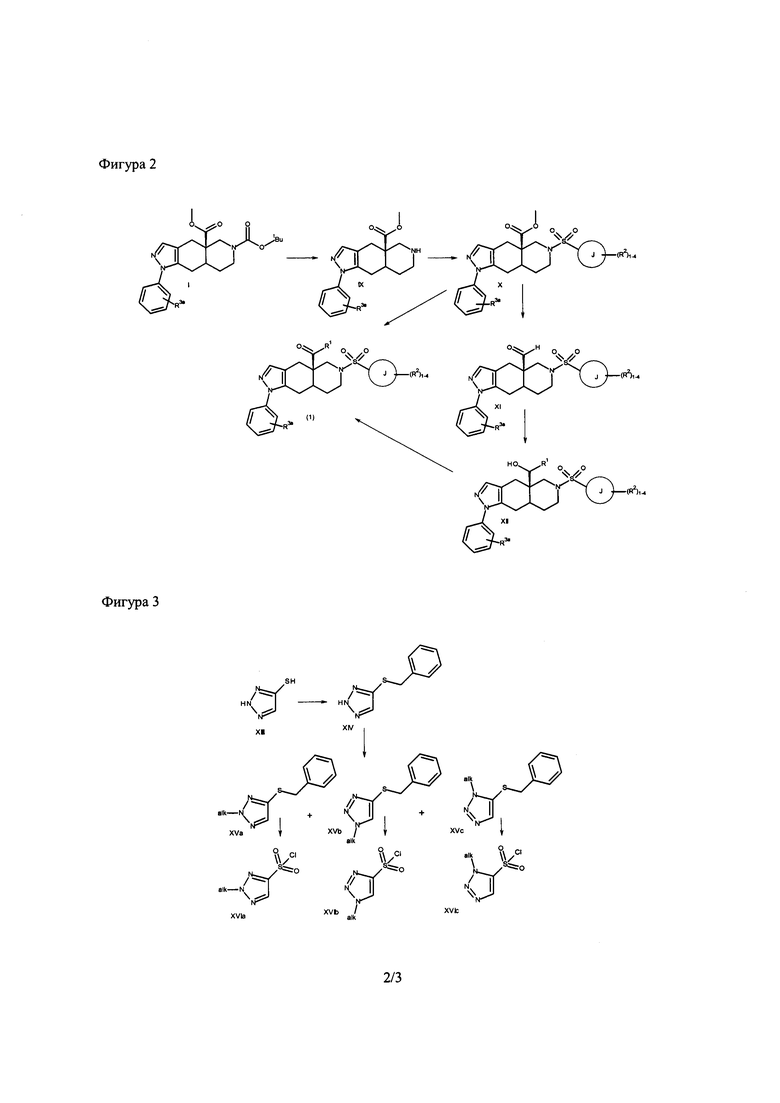

В настоящем изобретении предложены октагидро конденсированные азадекалиновые соединения общей формулы (I) или их стереоизомеры и фармацевтически приемлемые соли. В формуле (I) R1 представляет собой гетероарильное кольцо, выбранное из пиридина и тиазола, необязательно замещенное 1-4 группами, каждая из которых независимо выбрана из R1a; каждый R1a независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила; кольцо J выбрано из группы, состоящей из фенила, пиридина, пиразола и триазола; каждый из R2 независимо выбран из группы, состоящей из водорода, C1-6 алкила, галогена, C1-6 галогеналкила и -CN; или в качестве альтернативы две группы R2 на соседних атомах кольца объединены с образованием морфолинового кольца, каждый R3a независимо представляет собой галоген; нижний индекс n представляет собой целое число от 1 до 3. Данные соединения обладают аффинностью связывания с глюкокортикоидным рецептором и модуляторной активностью, пригодной для фармацевтического применения. Также предложены фармацевтическая композиция, содержащая эффективное количество соединения формулы (I), и применение указанных соединений в способах лечения нарушений, опосредованных глюкокортикоидным рецептором у субъекта. 4 н. и 12 з.п. ф-лы, 4 ил., 1 табл., 3 пр.
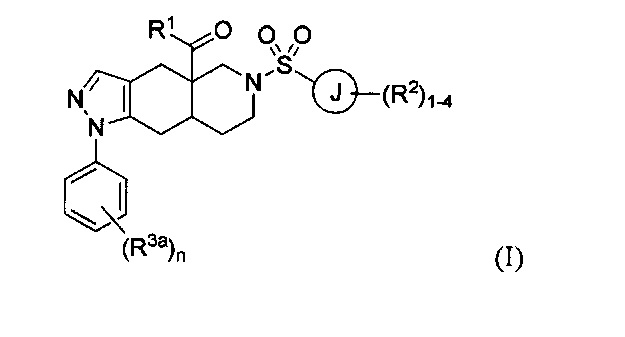
1. Соединение формулы (I):
где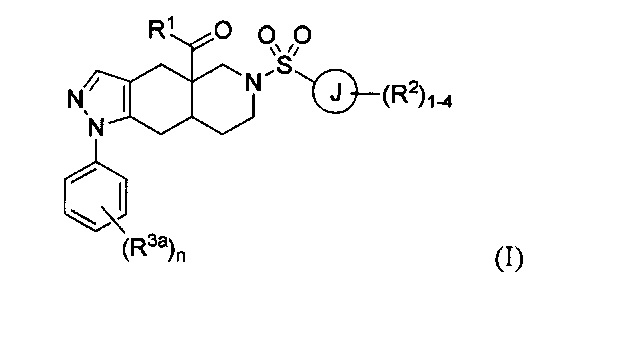
R1 представляет собой гетероарильное кольцо, выбранное из пиридина и тиазола, необязательно замещенное 1-4 группами, каждая из которых независимо выбрана из R1a;
каждый R1a независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила;
кольцо J выбрано из группы, состоящей из фенила, пиридина, пиразола и триазола; каждый из R2 независимо выбран из группы, состоящей из водорода, C1-6 алкила, галогена, C1-6 галогеналкила и -CN;
или в качестве альтернативы две группы R2 на соседних атомах кольца объединены с образованием морфолинового кольца,
каждый R3a независимо представляет собой галоген; нижний индекс n представляет собой целое число от 1 до 3; или их стереоизомеры и фармацевтически приемлемые соли.
2. Соединение по п. 1, отличающееся тем, что R1 представляет собой гетероарильное кольцо, выбранное из пиридина и тиазола, необязательно замещенных 1-3 группами, каждая из которых независимо выбрана из R1a;
каждый R1a независимо выбран из группы, состоящей из водорода, C1-6 алкила, C1-6 галогеналкила;
кольцо J выбрано из группы, состоящей из фенила, пиридина, пиразола и триазола; каждый R2 независимо выбран из группы, состоящей из водорода, C1-6 алкила, галогена, C1-6 галогеналкила и CN;
или в качестве альтернативы две группы R2 на соседних атомах кольца объединены с образованием морфолинового кольца, каждый R3a независимо представляет собой галоген; нижний индекс n представляет собой целое число от 1 до 3.
3. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 представляет собой гетероарильное кольцо, выбранное из пиридина и тиазола, необязательно замещенное 1-2 группами, каждая из которых независимо выбрана из R1a;
каждый R1a независимо выбран из группы, состоящей из водорода, C1-6 алкила и C1-6 галогеналкила;
кольцо J выбрано из группы, состоящей из фенила, пиридина, пиразола и триазола; каждый R2 независимо выбран из группы, состоящей из водорода, C1-6 алкила,
галогена, C1-6 галогеналкила и -CN; R3a представляет собой F; и нижний индекс n равен 1.
4. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 выбран из группы, состоящей из пиридина и тиазола;
кольцо J выбрано из группы, состоящей из фенила, пиридина, пиразола и триазола; каждый R2 независимо выбран из группы, состоящей из водорода, C1-6 алкила,
галогена, C1-6 галогеналкила и -CN; и
R3a представляет собой F.
5. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 выбран из группы, состоящей из 2-тиазола, 4-тиазола, 5-тиазола, 2-пиридина, 3-пиридина и 4-пиридина.
6. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 выбран из группы, состоящей из 2-тиазола, 4-тиазола и 2-пиридина.
7. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 представляет собой пиридин.
8. Соединение по любому из пп. 1, 2, отличающееся тем, что R1 представляет собой тиазол.
9. Соединение по любому из пп. 1, 2, отличающееся тем, что R1a независимо выбран из группы, состоящей из водорода, метила и трифторметила.
10. Соединение по любому из пп. 1, 2, отличающееся тем, что кольцо J выбрано из группы, состоящей из фенила, 2-пиридина, 3-пиридина, 4-пиридина, 1-пиразола, 3-пиразола, 4-пиразола, 5-пиразола, 1,2,3-триазол-4-ила, 1,2,3-триазол-5-ила, 1,2,4-триазол-3-ила и 1,2,4-триазол-5-ила.
11. Соединение по любому из пп. 1, 2, отличающееся тем, что R2 независимо выбран из группы, состоящей из водорода, метила, этила, н-пропила, изопропила, F, Cl, -CF3 и -CN.
12. Соединение по любому из пп. 1, 2, имеющее следующую структурную формулу:
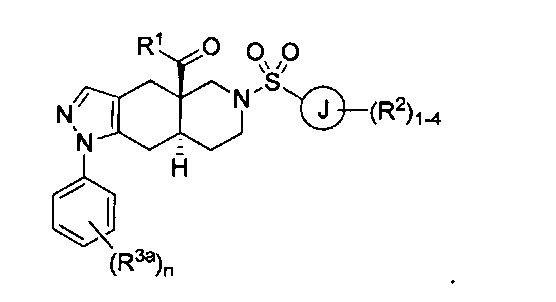
13. Соединение по п. 1, отличающееся тем, что указанное соединение выбрано из группы, состоящей из:
((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-6-((3,4-дихлорфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-6-((3,4-дифторфенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((3-фторфенил)сульфонил)-4,4a,5,6,7,8,8a,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-3-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-пиразол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-6-((1-этил-1Н-пиразол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-6-((1-этил-1Н-пиразол-5-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((4-(трифторметил)фенил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-6-((2-этил-2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-метилпиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-пропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанона,
3-(((4aR,8aS)-1-(4-фторфенил)-4a-пиколиноил-4a,5,7,8,8a,9-гексагидро-1H-пиразоло[3,4-g]изохинолин-6(4H)-ил)сульфонил)бензонитрила,
((4aR,8aS)-6-((3-фтор-4-(трифторметил)фенил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((4-метил-3,4-дигидро-2Н-пиридо[3,2-b][1,4]оксазин-7-ил)сульфонил)-4,4a,5,6,7,8,8a,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-пропил-1H-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-метил-1Н-1,2,3-триазол-5-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2H-1,2,3-триазол-4-ил)сульфонил)-4,4a5,6,7,8a,9-октагидро-1H-пиразоло[3,4-g]изохинолин-4a-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-пиразол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-6-((2-этил-2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-6-((2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4a,5,6,7,8,8a,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(4-(трифторметил)пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((1-изопропил-1Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(пиридин-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-2-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((6-(трифторметил)пиридин-2-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-метил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанона,
((4aR,8aS)-1-(4-фторфенил)-6-((2-изопропил-2Н-1,2,3-триазол-4-ил)сульфонил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанона и
((4aR,8aS)-6-((2-этил-2H-1,2,3-триазол-4-ил)сульфонил)-1-(4-фторфенил)-4,4а,5,6,7,8,8а,9-октагидро-1Н-пиразоло[3,4-g]изохинолин-4а-ил)(тиазол-4-ил)метанона.
14. Фармацевтическая композиция для лечения нарушения, связанного с глюкокортикоидом, содержащая соединение по любому из пп. 1-13 и фармацевтически приемлемое вспомогательное вещество.
15. Способ модулирования глюкокортикоидного рецептора, включающий приведение глюкокортикоидного рецептора в контакт с соединением по любому из пп. 1-13, модулируя таким образом глюкокортикоидный рецептор.
16. Способ лечения нарушения, выбранного из ожирения, диабета, сердечно-сосудистых заболеваний, гипертензии, синдрома X, депрессивного синдрома, тревожности, глаукомы, вируса иммунодефицита человека (ВИЧ) или синдрома приобретенного иммунодефицита (СПИД), нейродегенерации, болезни Альцгеймера, болезни Паркинсона, болезни Хантингтона, усиления когнитивной способности, синдрома Кушинга, болезни Аддисона, остеопороза, слабости, мышечной слабости, воспалительных заболеваний, остеоартрита, ревматоидного артрита, астмы и ринита, заболеваний, связанных с функцией надпочечников, вирусной инфекции, иммунодефицита, иммуномодуляции, аутоиммунных заболеваний, аллергии, заживления ран, компульсивного поведения, множественной лекарственной устойчивости, зависимости, психозов, анорексии, кахексии, посттравматического стрессового расстройства, послеоперационного перелома кости, медицинского катаболизма, основной психотической депрессии, умеренных когнитивных нарушений, психоза, деменции, гипергликемии, центральной серозной ретинопатии, алкогольной зависимости, стрессовых расстройств, набора веса, индуцированного нейролептиком, бреда, нарушения когнитивных функций у пациентов с депрессией, когнитивных нарушений у лиц с синдромом Дауна, психоза, связанного с терапией интерфероном-альфа, хронических болей, болей, связанных с гастроэзофагеальной рефлюксной болезнью, послеродового психоза, послеродовой депрессии, неврологических расстройств у недоношенных детей, мигрени, рака яичников, рака молочной железы и рака предстательной железы, посредством инициирования антагонизма к глюкокортикоидному рецептору, включающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп. 1-13, таким образом, обеспечивая лечение нарушения.
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| ГИДРАВЛИЧЕСКИЙ ПРЕССgf^;-г» *->&;••-,,-,*"*v-;'?—О'ч..+'!-.,/-•• -|ПАТЕНТ1Ш^;:..:.:':' bHb/i^'iOTh | 0 |
|
SU375210A1 |
| ПИРАЗОЛЫ | 2006 |
|
RU2381217C2 |
Авторы
Даты
2018-12-14—Публикация
2014-11-21—Подача