Область техники
Изобретение в общем относится к субстрату для иммобилизации функциональных веществ. Настоящее изобретение также относится к способам приготовления данного субстрата.
Предпосылки изобретения
При проведении биологических и химических анализов и процессов, аналитически или препаративно используемых в исследовательских, клинических, диагностических и производственных целях, зачастую требуется фиксация или иммобилизация функционального вещества на твердофазной подложке (или субстрате). Такая фиксация зачастую повышает устойчивость и универсальность вещества без снижения его эффективности и активности и дает возможность многократного использования вещества. Например, функциональные вещества, включающие биологические вещества, такие как ферменты, как правило, иммобилизуются на инертной подложке, такой как кремний или полиакриламидный гель, для повышения их устойчивости к изменению показателя pH или температурных условий при применении в производственных процессах катализации ферментами и упрощения последующего их отделения от продуктов реакции. Это обеспечивает повторное использование иммобилизованных ферментов и значительно упрощает очистку продукта, в результате обеспечивая более эффективные с точки зрения затрат процессы.
Иммобилизация функционального вещества, включающего биологическое вещество, может быть осуществлена путем физической или химической иммобилизации. Одной из форм физической иммобилизации является физическая адсорбция (физосорбция), при которой функциональное или биологическое вещество соединяется с субстратом посредством инкапсуляции или электростатическими, гидрофобными или ван-дер-ваальсовыми силами. Хотя физическая адсорбция и предоставляет относительно простой способ иммобилизации с широкой областью применения для целого ряда функциональных и/или биологических веществ, она часто не обеспечивает иммобилизацию с достаточной устойчивостью и подвержена выщелачиванию иммобилизованных функциональных и/или биологических веществ.
Более стабильным способом иммобилизации функциональных и/или биологических веществ является химическая иммобилизация, которая ковалентно связывает функциональное и/или биологическое вещество с субстратом в результате химической реакции. Химическая иммобилизация приводит, как правило, к повышенной активности, сниженной неспецифической адсорбции и повышенной устойчивости функционального и/или биологического вещества. Однако для химической иммобилизации в большинстве случаев требуется химическая модификация функционального и/или биологического вещества или субстрата для обеспечения эффективной связи.
Модификация поверхности материала твердофазной подложки, или «предактивация» твердофазной подложки, для улучшения ее связи с функциональным и/или биологическим веществом, как правило, приводит к включению в поверхность в целом слабо реагирующего полимерного материала реакционноспособных химических функциональных групп. Поверхностная модификация может быть достигнута физическими средствами, такими как нековалентное закрепление аффинного спейсера, или химическими средствами, такими как глутаральдегидная активация, цианогенбромидная активация, бромоацетилирование, диазотирование, вызванное ионизирующим излучением окисление и химическая прививочная сополимеризация.
Однако нековалентное закрепление аффинного спейсера сопровождается плохой воспроизводимостью и/или неустойчивой связью с поверхностью субстратов. Некоторые способы ковалентного закрепления, среди которых следует отметить имины и, в меньшей степени, сложные эфиры, могут быть гидролизованы в условиях реакции, применяемых для ферментативных реакций, приводя к частичной потере иммобилизованных ферментов и утечке ферментов в реакционную среду. Такие проблемы могут отрицательно отразиться, прежде всего, на способах иммобилизации на основе глутаральдегидной активации и бромоацетилирования. Хотя при диазотировании, циагенбромидной активации, вызванном ионизирующим излучением окислении и химической прививочной сополимеризации образуются ковалентные связи, являющиеся более устойчивыми по сравнению с нековалентными связями, данные способы подразумевают использование опасных, дорогих, сложных и/или жестких условий реакции.
Некоторые из данных способов также приводят к образованию высокого результирующего заряда на твердофазной подложке, что приводит к образованию нежелательных неспецифических электростатических связей функционального и/или биологического вещества при последующих процедурах биологического/химического процесса. Еще одной общей проблемой, связанной с применением жестких условий реакции, является неблагоприятное изменение свойств поверхности, что может затруднить закрепление функционального и/или биологического вещества, в частности, вещества с большой длиной полимерной цепочки. Это может привести к низкой концентрации функционального и/или биологического вещества на субстрате. Однако другими проблемами, характерными для некоторых коммерчески доступных твердофазных подложек, являются низкая устойчивость, ярко выраженная токсичность и недостаточная биологическая совместимость, что приводит к малому сроку годности, сложностям в обращении и ограниченному применению в медицинских целях.
Некоторые из данных способов основываются на дальнейшей модификации «предактивированных» подложек эпоксисилановым аппретом для иммобилизации гидрофильных молекул. Другие способы основываются на приготовлении субстрата путем реакции с бис-эпоксиоксирановым сшивающим агентом для иммобилизации молекулы к субстрату. Алифатические сшивающие агенты, применяемые в данных способах, вызывают снижение количества реакционноспособных групп, доступных для иммобилизации, снижение биологической совместимости и снижение воспроизводимости.
Возникает необходимость в предложении способов приготовления субстрата для иммобилизации функциональных и биологических веществ, устраняющих или, по крайней мере, смягчающих один или более из вышеописанных недостатков.
Возникает необходимость в предложении способов, которые являются подходящими, экономически эффективными, устойчивыми и надежными для приготовления субстрата для иммобилизации функциональных и биологических веществ.
Возникает также необходимость в предложении субстратов, которые являются устойчивыми, удобными в обращении, экономически эффективными, нетоксичными, биологически совместимыми и биоразлагаемыми для иммобилизации функциональных и биологически активных веществ и которые можно использовать для иммобилизации широкого диапазона веществ при высоких плотностях заполнения с улучшенной активностью и реакционной способностью.
Краткое изложение сущности изобретения
В соответствии с первым аспектом изобретения предлагается субстрат, содержащий соединения, предназначенные для иммобилизации функциональных молекул, при этом каждое соединение содержит цепочку, включающую: функциональную группу R, химически связанную с субстратом, указанная функциональная группа R выбирается из группы, включающей: эфир, сложный эфир, карбонильную группу, сложный эфир карбоната, тиоэфир, дисульфид, сульфинил, сульфонил и карбонотиоил; и эпоксидсодержащую функциональную группу, соединенную с функциональной группой R сшивающим агентом, включающим, по крайней мере, одну нуклеофильную группу.
В одном варианте осуществления субстрат содержит дополнительную эпоксидсодержащую группу, соединенную с цепочкой. В другом варианте осуществления количество дополнительных эпоксидсодержащих групп выбирается из числа 1, 2, 3, 4 и 5. В одном варианте осуществления сшивающий агент содержит дополнительные нуклеофильные группы, к которым указанные дополнительные эпоксидсодержащие группы присоединяются в указанной цепочке. Преимущество настоящего изобретения заключается в том, что плотность эпоксидсодержащих групп, способных вступать в реакцию с функциональной молекулой, увеличивается, и, следовательно, количество точек иммобилизации, доступных для иммобилизации вещества, также увеличивается.
Преимущество настоящего изобретения заключается в том, что сшивающий агент увеличивает длину связи между функциональной молекулой и субстратом и помогает укрепить связь функциональной молекулы с субстратом.
В еще одном варианте осуществления сшивающий агент содержит динуклеофильные частицы. В одном варианте осуществления динуклеофильный сшивающий агент выбирается, по крайней мере, из одного алкилдиамина и алкендиамина. Предпочтительно диаминовый сшивающий агент может предоставить дополнительные участки для эпоксиактивации. Не вдаваясь в теорию, предполагается, что до пяти молекул эпоксидсодержащего соединения (такого как эпихлоргидрин) может прореагировать с одной молекулой диаминового сшивающего агента. Это предпочтительно, поскольку обеспечивает увеличение плотности, например, эпоксидсодержащего соединения и, вследствие этого, количества точек иммобилизации, доступных для иммобилизации функциональной молекулы.
В еще одном варианте осуществления сшивающий агент содержит полинуклеофильные частицы. В еще одном варианте осуществления полинуклеофильные частицы могут являться полиаминами, такими как путресцин, спермидин, спермин, кадаверин, диэтилентриамин, триэтилентетрамин, тетраэтиленпентамин и тетрагидрофурфуриламин.
Введение аминогрупп сшивающего агента также выполняет благотворную роль внутреннего буфера рН для иммобилизируемого вещества. Дальнейшим преимуществом является то, что аминогруппы также действуют как ионообменники, обеспечивая условия стабилизации для иммобилизируемого вещества. Дальнейшим преимуществом является то, что аминогруппы являются сильно нуклеофильными, что делает более эффективным образование связи первого и второго эпоксидсодержащих соединений по сравнению с другими нуклеофильными группами, например группами ОН. Сильная нуклеофильная природа аминогрупп сшивающего агента является дальнейшим преимуществом, поскольку обеспечивает использование длинных сшивающих агентов при поддержании реакционной способности с эпоксидсодержащим соединением. Это является дальнейшим преимуществом, поскольку использование более длинных сшивающих агентов обеспечивает дальнейшее снижение стерических затруднений между субстратом и иммобилизованным веществом. Более предпочтительно, диамины, такие как гександиамин, относительно дешевые по сравнению с другими сшивающими агентами и являются коммерчески доступными материалами массового спроса. Низкая стоимость гександиамина обеспечивает массовое производство описанного в настоящем изобретении субстрата при относительно низких затратах.
Дальнейшим преимуществом является то, что связь «алкил-амин», образующаяся между эпоксидсодержащим соединением и гександиаминовым сшивающим агентом, устойчива к гидролизу при физиологических условиях, так что его можно использовать в водных системах, например, устройствах для диализа. Дальнейшим преимуществом является то, что субстрат в соответствии с сущностью изобретения является биологически инертным.
В соответствии со вторым аспектом предлагается способ иммобилизации функциональной молекулы на субстрате, содержащем этап экспонирования функциональной молекулы на субстрат в соответствии с сущностью данного изобретения.
В соответствии с третьим аспектом предлагается способ приготовления субстрата для иммобилизации на нем функциональных молекул, включающий: (i) обеспечение электрофильных соединений, соединенных с поверхностью субстрата; (ii) обеспечение участия электрофильных соединений в реакции нуклеофильного замещения для получения посредством нее нуклеофильной группы и тем самым повышения нуклеофильности поверхности субстрата; (iii) осуществление участия нуклеофильной группы в реакции нуклеофильного замещения с другим электрофильным соединением для получения электрофильной группы на поверхности субстрата и тем самым повышения электрофильности субстрата.
Преимуществом способа является то, что удлиненный спейсер, прикрепленный к электрофильным группам субстрата, обеспечивает повышенную доступность функционального соединения к электрофильной группе, и одновременно обеспечивает повышение плотности и реакционной способности электрофильной группы к функциональной молекуле, тем самым осуществляя иммобилизацию функциональной молекулы на субстрате. Дальнейшим преимуществом является то, что этап (iii) способа также обеспечивает повышенную доступность функциональной молекулы к электрофильной группе для последующей иммобилизации на субстрате.
В одном варианте осуществления этапы (ii) и (iii) повторяются n-е количество раз для образования n поколений электрофильных групп на указанном субстрате. Это предпочтительно, поскольку обеспечивает удлинение спейсера и увеличение плотности электрофильных групп и, следовательно, количества участков иммобилизации, доступных для иммобилизации функциональной молекулы к субстрату.
Дальнейшим преимуществом является то, что этап (iii) способа обеспечивает относительно более быструю реакцию между сшивающим агентом и вторым электрофильным соединением. Это приводит к снижению уровня гидролиза электрофильных соединений и увеличению количества негидролизованных электрофильных групп, включенных в субстрат. Это является дальнейшим преимуществом, поскольку также обеспечивает повышение плотности электрофильных групп на субстрате для иммобилизации функциональной молекулы.
Дальнейшим преимуществом способа является то, что электрофильные группы смещены по отношению к субстрату таким образом, что способность функциональной молекулы к иммобилизации вследствие этого увеличивается по сравнению с субстратом, обладающим только одним электрофильным соединением, непосредственно соединенным с субстратом. Дальнейшим преимуществом является то, что это относительное смещение также обеспечивает повышенную доступность функциональной молекулы к электрофильной группе для последующей иммобилизации на субстрате.
В соответствии с четвертым аспектом предлагается картридж с сорбентом для использования в устройстве диализа, картридж с сорбентом, включающий субстрат, как описано в настоящем изобретении, для иммобилизации уреазы.
В соответствии с пятым аспектом предлагается способ диализа, включающий этапы: экспонирование диализата, содержащего мочевину, на субстрате, как описано в настоящем изобретении; и удаление диализата из указанного субстрата.
В соответствии с шестым аспектом предлагается диализатор для использования в устройстве диализа, диализатор, содержащий субстрат, как описано в настоящем изобретении, для иммобилизации уреазы. Таким образом, уреаза может быть иммобилизована на диализной мембране, такой как ацетатцеллюлозный мембранный фильтр, расположенной внутри диализатора.
В соответствии с шестым аспектом предлагается способ модифицирования диализной мембраны для иммобилизации на ней функциональных молекул, состоящий из следующих шагов:
(i) соединение электрофильных соединений с поверхностью мембраны;
(ii) обеспечение участия электрофильных соединений в реакции нуклеофильного замещения для получения посредством нее нуклеофильной группы, и тем самым повышения параметра нуклеофильности поверхности мембраны; и
(iii) обеспечение участия нуклеофильной группы в реакции нуклеофильного замещения с другим электрофильным соединением для получения электрофильной группы на поверхности мембраны, и тем самым повышения параметра нуклеофильности поверхности мембраны для иммобилизации на ней функциональных молекул. В одном варианте осуществления мембрана является ацетатцеллюлозной мембраной.
Предпочтительно способ может быть использован для модифицирования стандартной диализной мембраны, такой как ацетатцеллюлозная мембрана, диализатора. Этот этап модифицирования обеспечивает повышенную способность к иммобилизации на диализной мембране функциональных молекул, таких как диализатные ферменты, при использовании в диализаторе.
В соответствии с восьмым аспектом предлагается использование субстрата, как описано в настоящем изобретении, в устройстве диализа.
В одном варианте осуществления предлагается способ приготовления субстрата для иммобилизации на нем функциональных веществ, способ, включающий: соединение первого электрофильного соединения с субстратом; и химическое соединение второго электрофильного соединения с первым электрофильным соединением, соединенным с субстратом, при котором указанное второе электрофильное соединение при соединении с указанным первым электрофильным соединением сконфигурировано для иммобилизации на нем функционального вещества.
Предпочтительно первое и второе электрофильные соединения выбираются смещенными относительно друг друга таким образом, чтобы увеличить способность к иммобилизации функционального вещества по сравнению с субстратом только с одним электрофильным соединением, непосредственно соединенным с субстратом. Более предпочтительно первое и второе электрофильные соединения выбираются смещенными друг относительно друга таким образом, чтобы эффекты стерических затруднений поблизости от второго электрофила были снижены или минимизированы для усиления связи функционального вещества со вторым используемым электрофильным соединением.
Более предпочтительно первое и/или второе электрофильное соединение может быть диэлектрофилом, который эффективно конвертирует слабо нуклеофильный субстрат в сильно электрофильный субстрат. Это определяет изменения в полярности и реакционной способности субстрата.
Более предпочтительно, способ является простым и экономичным способом получения субстрата, обладающего относительно высокой реакционной способностью для иммобилизации на нем по сравнению с субстратами, полученными известными способами. Более предпочтительно второе электрофильное соединение способно образовывать устойчивые связи с функциональным веществом, включая биологическое вещество, такое как фермент. Еще более предпочтительно, второе электрофильное соединение предоставляет участок соединения для функционального вещества, расположенный на соответствующем расстоянии от субстрата, снижая, таким образом, стерические затруднения. В одном варианте осуществления плотность электрофильных групп на грамм субстрата составляет от 0,1 до 1 ммоль/г.
Это в свою очередь снижает препятствия во время иммобилизации функционального вещества и упрощает прикрепление функционального вещества к субстрату посредством второго эпоксидсодержащего соединения. Кроме того, это увеличивает доступность и структурную гибкость связанного вещества (фермент), тем самым повышая его активность. Описанный в настоящем изобретении способ также пригоден для получения субстратов, которые способны иммобилизовывать хиральные лиганды, аффинные лиганды и/или ионообменные частицы.
В одном варианте осуществления первое и второе электрофильные соединения являются эпоксидсодержащими соединениями. В одном варианте осуществления описанный в настоящем изобретении способ включает этап использования сшивающего агента для соединения второго эпоксидсодержащего соединения с первым эпоксидсодержащим соединением. Это увеличивает длину связи между активным оксирановым участком и субстратом, и помогает укрепить связь функциональной молекулы с оксирановым участком. Это также повышает доступность, а вследствие этого и активность связанного вещества, такого как фермент. Предпочтительно сшивающий агент может содержать дополнительные функциональные группы для придания субстрату необходимых химических свойств. Например, сшивающий агент может содержать аминогруппы, обладающие буферными свойствами, которые могут быть полезны, когда субстрат используется в таких устройствах, как устройства диализа. Сшивающий агент может также содержать группы, действующие как антиоксиданты или акцепторы металлов, дополняющие функции субстрата в определенных случаях применения. Более предпочтительно сшивающий агент может также предоставить большее количество участков для присоединения второго электрофильного соединения и/или последующих эпоксидсодержащих соединений. Фактически сшивающий агент может увеличить количество эпоксидсодержащих соединений, присоединенных к субстрату, что, в свою очередь, повышает вероятность и силу иммобилизации функционального вещества. Сшивающий агент может также быть нейтральным и инертным, что не сказывается отрицательным образом на функциональных или биологических свойствах соединенного с ним функционального или биологического вещества.
В одном варианте осуществления сшивающий агент не содержит эпоксидную группу. Функциональный сшивающий агент может также содержать нуклеофильную группу. Предпочтительно нуклеофильная группа реакционноспособна и может образовывать химические связи с электрофильными (эпоксидсодержащими) соединениями. В одном варианте осуществления функциональный сшивающий агент является динуклеофильным сшивающим агентом. Присутствие двух нуклеофильных групп позволяет сшивающему агенту создавать связи как с первым, так и со вторым эпоксидсодержащими соединениями, формируя мостик между двумя эпоксидсодержащими соединениями. В одном варианте осуществления, по крайней мере, один из нуклеофилов динуклеофильного сшивающего агента выбирается из группы, включающей NH, NR, NHO, NRO, O, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONR1NR2, CNO, PH и PR,
где R, R1 и R2 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил.
Динуклеофильный сшивающий агент может также иметь общую формулу (I):
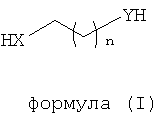
где X и Y независимо выбираются из группы, включающей NH, NR, NHO, NRO, O, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, РН и PR;
R выбирается из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил;
n является целым числом от 0 до 25.
В другом варианте осуществления динуклеофильный сшивающий агент обладает общей формулой (II):
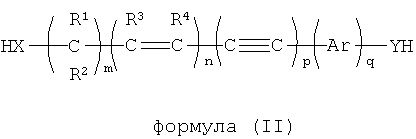
где X и Y независимо выбираются из NH, NR, NHO, NRO, О, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, PH, PR;
где R, R1, R2, R3, R4 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
m, n, p и q являются целыми числами, независимо выбираемыми от 0 до 25.
В одном варианте осуществления динуклеофильный сшивающий агент является алкилдиамином, таким как гександиамин или этилендиамин. Предпочтительно диаминовый сшивающий агент может предоставлять дополнительные участки для эпоксиактивации. Не вдаваясь в теорию, предполагается, что до пяти молекул эпоксидсодержащего соединения (такого как эпихлоргидрин) может прореагировать с одной молекулой диаминового сшивающего агента. Это предпочтительно, поскольку обеспечивает увеличение плотности, например, эпоксидсодержащего соединения и, вследствие этого, количества участков иммобилизации, доступных для иммобилизации вещества. Введение аминогрупп сшивающего агента также выполняет благотворную роль внутреннего буфера pH для иммобилизуемого вещества. Дальнейшим преимуществом является то, что аминогруппы также действуют как ионообменники, обеспечивая условия стабилизации для иммобилизуемого вещества. Дальнейшим преимуществом является то, что аминогруппы являются сильно нуклеофильными, что делает более эффективным образование связи первого и второго эпоксидсодержащих соединений по сравнению с другими нуклеофильными группами. Сильная нуклеофильная природа аминогрупп сшивающего агента является дальнейшим преимуществом, поскольку обеспечивает использование длинных сшивающих агентов при поддержании реакционной способности с эпоксидсодержащим соединением. Это является дальнейшим преимуществом, поскольку использование более длинных сшивающих агентов обеспечивает дальнейшее снижение стерических затруднений между субстратом и иммобилизованным веществом. Более предпочтительно гександиамин является относительно дешевым по сравнению с другими сшивающими агентами и коммерчески доступным материалом массового спроса. Низкая стоимость гександиамина обеспечивает массовое производство описанного в настоящем изобретении субстрата при относительно низких затратах. Дальнейшим преимуществом является то, что связь «алкил-амин», образующаяся при использовании гександиаминового сшивающего агента, устойчива к гидролизу при физиологических условиях, так что его можно использовать в водных системах, например, устройствах для диализа. Дальнейшее преимущество гександиаминового сшивающего агента заключается в том, что он является биологически совместимым и биологически разлагаемым.
В одном варианте осуществления, по крайней мере, одно электрофильное соединение и второе электрофильное соединения являются эпигалогенгидринами. Предпочтительно эпигалогенгидрин является эпихлоргидрином. Аналогично эпихлоргидрин относительно дешевый по сравнению с другими эпигалогенгидринами и легко доступен, в связи с тем, что он является коммерчески доступным материалом массового спроса. Опять же низкая стоимость эпигалогенгидрина обеспечивает массовое производство описанного в настоящем изобретении субстрата при относительно низких затратах. Для эпихлоргидрина также характерна очень быстрая и исчерпывающая реакция с образованием только нетоксичных продуктов (глицерин и аминоглицерины), вследствие чего он пригоден для использования при приготовлении субстрата, который будет в итоге применяться для медицинских целей. Кроме того, в связи с тем, что эпихлоргидрин частично смешивается с водой и полностью смешивается со спиртами, весь избыточный эпихлоргидрин можно относительно легко удалить путем промывания субстрата водой и/или спиртом. Кроме того, эпихлоргидрин и его продукты гидролиза являются летучими, вследствие чего они легко могут быть удалены испарением.
В одном варианте способ включает выбор слабо реакционноспособного субстрата. Субстрат описанного в настоящем изобретении способа может представлять собой, шарики, микроразмерные частицы, наноразмерные частицы, мембрану, сетку, каркасную структуру или любую твердофазную подложку, которую можно приготовить с использованием описанного в настоящем изобретении способа для иммобилизации на ней функционального вещества, включая биологическое вещество. В одном варианте осуществления субстрат выбирается из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, субстрат на основе эпоксидной смолы, полиакрилатный субстрат, гидрокси-функционализированный субстрат и субстрат на основе полисахарида. Субстрат на основе полисахарида может быть выбран из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы. Субстраты могут также быть биоразлагаемыми и, вследствие этого, экологически чистыми, что дает возможность их применения в экологически уязвимых областях, таких как сельскохозяйственные работы или переработка отходов. Субстрат также может быть биоразлагаемым, так что при имплантировании субстрата в тело человека или при взаимодействии с телом человека, например, при диализе он оказывает незначительное или не оказывает никакого неблагоприятного воздействия на здоровье.
Этапы химического соединения описанных в настоящем изобретении способов могут быть осуществлены в температурном диапазоне от -30°C до 100°C, предпочтительно от 0°C до 100°C. В одном варианте осуществления этап химического присоединения первого электрофильного соединения к субстрату выполняется при температуре от приблизительно 50°C до 60°C; этап химического присоединения сшивающего агента осуществляется при температуре от приблизительно 20°C до 40°C; этап химического присоединения второго электрофильного соединения к сшивающему агенту осуществляется при температуре от приблизительно 20°C до 40°C и этап химического присоединения функционального вещества к второму электрофильному соединению осуществляется при температуре от приблизительно 2°C до 6°C. Предпочтительно субстрат может быть произведен или приготовлен при мягких условиях, например, при комнатной температуре и нормальном атмосферном давлении. Это снова находит отражение в снижении затрат на производство и повышении удобства в обращении. Более предпочтительно заключительная реакция иммобилизации может быть осуществлена при очень мягких условиях, например, в водном буфере при 2-6°C и нормальном атмосферном давлении, не требуя дополнительных реагентов. Это исключает риск деактивации или денатурации биологически активного вещества в связи с экстремальными условиями или наличием сильных реагентов, что может представлять проблему в других способах иммобилизации. Еще более предпочтительно, поскольку способ может быть осуществлен при температурах окружающей среды, иммобилизация биоактивных веществ на субстрате также может осуществляться одновременно или последовательно по отношению к активации субстрата.
В одном варианте осуществления функциональные вещества являются биологически активными веществами, такими как ферменты, например, уреаза. Предпочтительно при уреазе, иммобилизованной на субстрате, субстрат, содержащий иммобилизованную уреазу, можно использовать для целей диализа, например, для регенерации перитонеального диализата или гемодилизата. Ферменты также могут являться одним из следующих: уриказа, креатининаза, липаза, эстераза, целлюлаза, амилаза, пектиназа, каталаза, ацилаза, пенициллинамидаза, протеиназа K.
В одном варианте осуществления описанный в настоящем изобретении способ далее включает этап химического присоединения одного или более дополнительных электрофильных соединений как к первому, так и ко второму электрофильным соединениям, где указанные дополнительные электрофильные соединения при присоединении к указанным как первому, так и второму электрофильным соединениям сконфигурированы для иммобилизации на них функционального вещества. Например, третье, четвертое, пятое, шестое электрофильное соединение и т.д. могут быть присоединены как к первому, так и ко второму электрофильным соединениям одновременно. Электрофильные группы, как описано в настоящем изобретении, могут содержать, по крайней мере, одну эпоксидную группу.
В другом варианте осуществления предлагается способ иммобилизации функциональной молекулы на субстрате, способ, включающий этапы приготовления субстрата, содержащего соединения, приготовленные по способу, описанному в настоящем изобретении, каждое из указанных соединений включает эфирсодержащую функциональную группу, химически соединенную с субстратом, и эпоксидсодержащую функциональную группу, соединенную с эфирной функциональной группой; и введение раствора, содержащего указанную функциональную молекулу к указанным соединениям, расположенным на указанном субстрате, при котором эпоксидсодержащая функциональная группа образует химическую связь с указанной функциональной молекулой для ее иммобилизации.
Предпочтительно эта химическая связь может быть негидролизуемой ковалентной связью, такой как аминосвязь. Соответственно функциональная молекула иммобилизуется на субстрате с достаточной устойчивостью и не может быть легко удалена с субстрата.
Способ второго аспекта может также может содержать этап нанесения на поверхность субстрата в основном гомогенной смеси стабилизирующих добавок для стабилизации указанной функциональной молекулы. В одном варианте осуществления этап нанесения в основном гомогенной смеси добавок включает испарение растворителя указанных добавок на субстрате. Стабилизирующие добавки могут быть выбраны из группы, включающей сахар, такой как глюкоза, органическую кислоту, такую как этилендиаминтетрауксусная кислота, аминокислоту, такую как цистеин, и сахарную кислоту, такую как аскорбиновая кислота, и тиолы, такие как меркаптоэтанол.
В другом варианте осуществления предлагается субстрат, содержащий соединения, расположенные на нем, для иммобилизации функциональной молекулы, каждое соединение включает эфирсодержащую функциональную группу, химически соединенную с субстратом, и эпоксидсодержащую функциональную группу, соединенную с эфирной функциональной группой посредством сшивающего агента, включающего, по крайней мере, одну нуклеофильную группу, причем указанная эпоксидсодержащая функциональная группа смещена по отношению к указанной эфирсодержащей функциональной группе для иммобилизации функциональной молекулы к указанной эпоксидсодержащей функциональной группе без существенных стерических затруднений, вызванных указанной эфирсодержащей функциональной группой или субстратом. Предпочтительно субстрат обладает повышенной устойчивостью и может быть произведен с относительно низкими затратами по сравнению с известными субстратами, которые могут эффективно иммобилизовать функциональные вещества. Более предпочтительно субстрат может быть использован повторно без существенной потери его ферментных свойств в связи с высокой устойчивостью связи между биомолекулой и эпоксидсодержащей функциональной группой. Кроме того, в связи с отсутствием выщелачивания потенциально опасных веществ субстрат доступен для применения в медицинских целях, таких как перитонеальный диализ.
В одном варианте осуществления сшивающий агент является не водородом - гидразин, гидроксиламин, аммиак, вода или сероводород.
В одном варианте осуществления сшивающий агент является насыщенной или ненасыщенной алифатической цепочкой, содержащей от 2 до 18 атомов углерода, от 2 до 16 атомов углерода, от 2 до 14 атомов углерода, от 2 до 12 атомов углерода, от 2 до 10 атомов углерода, от 2 до 8 атомов углерода, от 2 до 6 атомов углерода и от 2 до 4 атомов углерода. В одном варианте осуществления сшивающий агент является насыщенной алифатической цепочкой, содержащей от 4 до 8 атомов углерода, более предпочтительно 6 атомов углерода. Нуклеофильная группа указанного сшивающего агента может быть расположена на одном из терминальных концов алифатической цепочки или между терминальными концами алифатической цепочки. В одном варианте осуществления нуклеофильная группа указанного сшивающего агента может быть химически соединена с алифатической цепочкой с помощью протянутого от нее разветвления цепи. В одном варианте осуществления на указанном сшивающем агенте расположены две нуклеофильные группы, предпочтительно на терминальных концах алифатической цепочки. В одном варианте осуществления, по крайней мере, одна нуклеофильная группа расположена на терминальном конце алифатической цепочки и соединена с эфир- или эпоксидсодержащей функциональной группой дополнительной алифатической цепочкой сшивающего агента. Дополнительная алифатическая цепочка сшивающего агента может содержать от 1 до 3 атомов углерода.
Субстрат может также содержать покрытие, расположенное на указанном субстрате, покрытие, включающее в основном гомогенную смесь стабилизирующих добавок. Стабилизирующие добавки могут быть выбраны из группы, включающей сахар, такой как глюкоза, органическую кислоту, такую как этилендиаминтетрауксусная кислота, аминокислоту, такую как цистеин, и сахарную кислоту, такую как аскорбиновая кислота.
В другом варианте осуществления предлагается картридж с сорбентом для использования в устройстве диализа, картридж с сорбентом, включающий субстрат, содержащий описанные в настоящем изобретении соединения, которые включают иммобилизованную уреазу, каждое соединение включает эфирсодержащую функциональную группу, химически соединенную с субстратом и эпоксидсодержащей функциональной группой, которая соединена с эфирной функциональной группой сшивающим агентом, содержащим, по крайней мере, одну нуклеофильную группу, причем указанная эпоксидсодержащая функциональная группа смещена по отношению к указанной эфирсодержащей функциональной группе для иммобилизации молекулы уреазы к указанному субстрату без существенных стерических затруднений, вызванных указанной эфирсодержащей функциональной группой или субстратом.
В другом варианте осуществления предлагается способ диализа, включающий этапы экспонирования, содержащего мочевину, на субстрате, который содержит соединения, включающие иммобилизованную уреазу, каждое соединение включает эфирсодержащую функциональную группу, химически соединенную с субстратом, и эпоксидсодержащую группу, соединенную с эфирной функциональной группой посредством сшивающего агента, содержащего, по крайней мере, одну нуклеофильную группу, причем указанная эпоксидсодержащая функциональная группа смещена по отношению к эфирсодержащей функциональной группе для иммобилизации молекулы уреазы на указанный субстрат без существенных стерических затруднений, вызванных указанной эфирсодержащей функциональной группой или субстратом; и удаления диализата из указанного субстрата после разложения, по крайней мере, части указанной мочевины.
В другом варианте осуществления предлагается использование субстрата в соответствии с настоящим изобретением в устройстве диализа. Предпочтительно субстрат можно использовать для эффективного и безопасного удаления токсинов из диализата в устройстве диализа.
Определения
Следующие слова и термины, используемые в настоящем документе, будут иметь следующие значения.
Термин «эпоксид», «эпоксидная группа» или «оксиран» означает химическую функциональную группу, содержащую трехзвенное кольцо из двух атомов углерода и одного атома кислорода. Два атома углерода в трехзвенном кольце могут быть независимо замещенными. Термин «эпоксид» может также означать молекулу или соединение, содержащие в своем составе хотя бы одну эпоксидную группу.
Термин «эпоксидсодержащее соединение» означает любое соединение, являющееся эпоксидом, или соединение, содержащее эпоксидную функциональную группу. Типичными эпоксидсодержащими соединениями являются алкиленоксиды и, в частности, низшие алкиленоксиды, такие как этиленоксид, пропиленоксид, бутиленоксид, эпоксидные спирты, такие как глицидол, и эпигалогенгидрины, такие как эпихлоргидрин, эпибромгидрин, эпийодгидрин, 1,2-эпокси-4-хлорбутан, 1,2-эпокси-4-бромбутан, 1,2-эпокси-4-йодбутан, 2,3-эпокси-4-хлорбутан, 2,3-эпокси-4-бромбутан, 2,3-эпокси-4-йодбутан, 2,3-эпокси-5-хлорпентан, 2,3-эпокси-5-бромпентан, 1,2-эпокси-5-хлорпентан и т.д.; эпоксидные соединения, такие как 2,2-бис(р-1,2-эпоксипропоксифенил)-пропан, 1,4-бис(1,2-эпоксипропокси)бензол, N,N'-бис(2,3-эпоксипропил)пиперазин и т.д.
Термины «электрофильная группа», «электрофил» и т.п., используемые в настоящем документе, относятся к атому или группе атомов, которые могут принять электронную пару для образования ковалентной связи. Словосочетание «электрофильная группа», используемое в настоящем документе, включает, но не ограничивается, галогенид-, карбонил- и эпоксидсодержащие соединения. Типичными электрофилами могут быть галогениды, такие как тиофосген, дихлоргидрин глицерина, фталоилхлорид, сукцинилхлорид, хлорацетилхлорид, хлорсукцинилхлорид и т.д.; кетоны, такие как хлорацетон, бромацетон и т.д.; альдегиды, такие как глиоксаль и т.д.; изоцианаты, такие как гексаметилендиизоцианат, толилендиизоцианат, мета-ксилилендиизоцианат, циклогексилметан-4,4-диизоцианат и т.д. и производные данных соединений.
Термины «нуклеофильная группа», «нуклеофил» и т.п., используемые в настоящем документе, относятся к атому или группе атомов, обладающих электронной парой, способной образовывать ковалентную связь. Группы данного типа могут быть ионогенными группами, вступающими в реакцию как анионные группы. Словосочетание «нуклеофильная группа», используемое в настоящем соединении, включает, но не ограничивается, гидроксильные группы, первичные амины, вторичные амины, третичные амины и тиолы.
Термин «эфир» или «эфирсодержащий» относится к классу органических соединений с общей формулой R-O-R, где R является углеродом. Термин «эфир» или «эфирсодержащий», используемый в настоящем документе, предназначен для разграничения с теми соединениями, в которых R не является углеродом, например, сиалил-эфиры, Si-O-Si.
Термин «полиамин» относится к органическому соединению, содержащему, по крайней мере, две положительные аминогруппы, выбранные из группы, включающей первичные аминогруппы, вторичные аминогруппы и третичные аминогруппы. Соответственно полиамины охватывают диамины, триамины и высшие амины.
Термин «биоразлагаемый» или «биоразлагаемый полимер», используемый в настоящем документе, относится к экологически чистым материалам, которые способны к химическому и/или биологическому разложению. Такие материалы могут быть способны к химическому/биологическому разложению под воздействием различных живых организмов или света и/или кислорода. В связи с этим термин «биоразлагаемый», используемый в настоящем документе, понимается как включающий материалы, являющиеся оксибиоразлагаемыми, фотобиоразлагаемыми и микробиологически биоразлагаемыми.
Термин «биологически совместимый» или «биологически совместимый полимер» относится к полимерам, которые в используемых количествах являются нетоксичными, немигрирующими, химически инертными и существенно неиммуногенными при использовании в контакте с биологическими жидкостями, например, плазмой крови. Подходящие биологически совместимые полимеры включают, как пример, полисахариды, такие как целлюлоза или хитин.
Термин «биополимер» относится к полимерам, которые были произведены живыми организмами или были получены из живых организмов. Типичные биополимеры включают полипептиды, нуклеиновые кислоты и полисахариды, например, целлюлоза и хитин.
Термин «функциональный» при использовании для описания молекулы или вещества относится к группе атомов, расположенных в таком порядке, который определяет химические свойства вещества и молекулы, к которой они присоединены. Примеры функциональных групп включают атомы галогенов, амидные группы, гидроксильные группы, карбоксильные группы и т.п.
Термин «молекула-мишень» относится к молекуле, которая подлежит обнаружению, изоляции или испытанию и которая способна вступать в реакцию или образовывать связь с функциональным веществом, таким как биологическое вещество. Типичные молекулы-мишени включают белки, полисахариды, гликопротеины, гормоны, рецепторы, липиды, малые молекулы, лекарственные препараты, метаболиты, кофакторы, аналоги переходного состояния и токсины или любую нуклеиновую кислоту, которая не является комплементарной к родственной нуклеиновой кислоте. Молекула мишень может быть in vivo, in vitro, in sutu или ex vivo.
Термин «функциональные вещества» и т.п., используемый в настоящем документе, широко относится к усредненным молекулам или активным веществам, содержащим участки, способные вступать в реакции с образованием связей или обладающие сродством с молекулой-мишенью. Термин «функциональные вещества» и т.п.широко охватывает биологические вещества и биомолекулы.
Термины «биологические вещества» или «биомолекулы» и т.п., используемые в настоящем документе, относятся к любым веществам и соединениям в основном биологического происхождения. В связи с этим данные термины охватывают не только нативные молекулы, такие как те, которые можно изолировать из природных источников, но и полученные на их основе формы, фрагменты и производные, а также рекомбинантные формы и искусственные молекулы до тех пор, пока сохраняется, по крайней мере, одной свойство нативных молекул. В связи с этим термин охватывает органические молекулы, продуцируемые живыми организмами, включая крупные полимерные молекулы, такие как белки, полисахариды и нуклеиновые кислоты, а также малые молекулы, такие как первичные метаболиты, вторичные метаболиты и природные вещества.
Термины «биологически активные вещества», «биоактивные вещества» и т.п., используемые в настоящем документе, широко относятся к усредненным биологическим молекулам или физиологически активным веществам, содержащим участки, способные вступать в реакции с образованием связей или обладающие сродством с молекулой-мишенью. Они включают, но не ограничиваются, каталитически активные участки, такие как ферменты, вещества, содержащие участки, способные образовывать связи с определенными соединениями или специфическими классами соединений, такими как олигонуклеотиды нуклеиновых кислот, дезкосирибонуклеиновая кислота (ДНК), рибонуклеиновая кислота (РНК) или лектины, витамины, пептиды, белки, гормоны, химикаты, нарушающие работу эндокринной системы, сахара, липиды и т.п.
Термин «слабо реагирующий субстрат» означает субстрат, состоящий из материала, который в незначительной степени реагирует химически или биологически с функциональным или биологическим веществом, как было определено выше. В некоторых вариантах осуществления функциональное или биологическое вещества может содержать биомолекулу, а нереакционноспособный субстрат состоит из материала, являющегося биологически совместимым в том отношении, что материал субстрата не токсичен и не оказывает отрицательного воздействия на здоровье человека. Нереакционноспособными субстратами, которые также биологически совместимы, как правило, являются полимерные материалы, которые в большинстве случаев являются нерастворимыми, гибкими и могут принимать множество различных форм, включая криволинейные поверхности. Следует обратить внимание, что термин «полимер» используется для обозначения химического соединения с высокой молекулярной массой, содержащего большое количество структурных элементов, соединенных между собой ковалентными связями. Типичным полимерным материалом, являющимся нереакционноспособным и биологически совместимым, как определено выше, является полисахаридцеллюлоза.
Термины «сшивающий агент» и «спейсер», используемые в настоящем документе, относятся к органической функциональной группе, соединяющей два фрагмента соединения.
Используемый в настоящем документе термин «алкил» включает в себя моновалентную («алкил») и дивалентную («алкилен») неразветвленную цепочку, разветвленную цепочку или циклические насыщенные алифатические группы, содержащие от 1 до 25 атомов углерода, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 атомов углерода. Например, термин алкил включает, но не ограничивается, метил, этил, 1-пропил, изопропил, 1-бутил, 2-бутил, изобутил, третбутил, амил, 1,2-диметилпропил, 1,1-диметилпропил, пентил, изопентил, гексил, 4-метилпентил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 2,2-диметилбутил, 3,3-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 1,2,2-триметилпропил, 1,1,2-триметилпропил, 2-этилпентил, 3-этилпентил, гептил, 1-метилгексил, 2,2-диметилпентил, 3,3-диметилпентил, 4,4-диметилпентил, 1,2-диметилпентил, 1,3-диметилпентил, 1,4-диметилпентил, 1,2,3-триметилбутил, 1,1,2-триметилбутил, 1,1,3-триметилбутил, 5-метилгептил, 1-метилгептил, октил, нонил, децил и т.п. Низшие алкилы являются алкильными группами, как определено выше, содержащими от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода.
Термин «алкенил», используемый в настоящем документе, включает в себя моновалентную («алкенил») и дивалентную («алкенилен») неразветвленную или разветвленную цепочку или циклические ненасыщенные алифатические углеводородные группы, содержащие от 2 до 25 атомов углерода, например 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24 или 25 атомов углерода, содержащие, по крайней мере, одну двойную связь E, Z, цис- или транс-стереохимии, где применимо, на любом участке алкильной цепочки. Примеры алкенильных групп включают, но не ограничиваются, винил, аллил, 1-метилвинил, 1-пропенил, 2-метил-1-пропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 1,3-бутадиенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1,3-пентадиенил, 2,4-пентадиенил, 1,4-пентадиенил, 3-метил-2~бутенил, 1-гексенил, 2-гексенил, 3-гексенил, 1,3-гексадиенил, 1,4-гексадиенил, 2-метилпентенил, 1-гептенил, 2-гептенил, 3-гептенил, 1-октенил, 1-ноненил, 1-деценил и т.п. Низшие алкенилы являются алкенильными группами, как определено выше, содержащими от 2 до 6 атомов углерода, предпочтительно от 2 до 4 атомов углерода.
Термин «алкинил», используемый в настоящем документе, включает в себя моновалентную («алкинил») и дивалентную («алкинилен») неразветвленную или разветвленную цепочку или циклические ненасыщенные алифатические углеводородные группы, содержащие от 2 до 10 атомов углерода, имеющие, по крайней мере, одну тройную связь на любом участке углеродной цепочки. Примеры алкинильных групп включают, но не ограничиваются, этинил, 1-пропинил, 1-бутинил, 2-бутинил, 1-метил-2-бутинил, 3-метил-1-бутинил, 1-пентинил, 1-гексинил, метилпентинил, 1-гептинил, 2-гептинил, 1-октинил, 2-октинил, 1-нонил, 1-децинил и т.п. Низшие алкинилены являются алкинильными группами, как определено выше, содержащими от 2 до 6 атомов углерода, предпочтительно от 2 до 4 атомов углерода.
Термин «арил», используемый в настоящем документе, относится к системе моно- или многоциклических карбоциклических колец, содержащей одно или более ароматических колец, включая, но не ограничиваясь, фенил, нафтил, тетрагидронафтил, инданил, инденил и т.п. Арильные группы (включая бициклические арильные группы) могут быть незамещенными или замещенными от одного до пяти заместителями или более (как правило, от одного до пяти заместителей для моноциклического арила и более пяти заместителей для бициклического/олигоциклического арила), независимо выбираемыми из группы, включающей алкил, алкенил, алкинил, гаолгеналкил, алкоксигруппу, тиоалкоксигруппу, гидроксильную группу, меркаптогруппу, аминогруппу, алкиламиногруппу, диалкиламиногруппу, ациламиногруппу, аминоацил, алкоксикарбонил, арилоксикарбонил, азидогруппу, цианогруппу, галоген, нитрогруппу, карбоксальдегид, карбоксильную группу, карбоксамид, карбамид, карбамат, сульфат, сульфонат, сульфинат, фосфат, фосфонат, фосфинат, фосфин и защищенную гидроксильную группу. Кроме того, замещенные арильные группы включают тетрафторфенил и пентафторфенил.
Термин «гетероарил», используемый отдельно или в составе другой группы, относится к системе замещенных или незамещенных ароматических гетероциклических колец (моноциклических или бициклических). Гетероарильные группы могут содержать, например, от 3 до 50 атомов углерода. Гетероарильные группы, как правило, включают системы ароматических гетероциклических колец, имеющие от 4 до 14 атомов в кольце и содержащие атомы углерода и 1, 2, 3 или 4 гетероатома, выбранные из кислорода, азота или серы. Типичные гетероарильные группы включают, но не ограничиваются, фуран, тиофен, индол, азаиндол, оксазол, тиазол, изоксазол, изотиазол, имидазол, N-метилимидазол, пиридин, пиримидин, пиразин, пиррол, N-метилпиррол, пиразол, N-метилпиразол, 1,3,4-оксидиазол, 1,2,4-триазол, 1-метил-1,2,4-триазол, 1Н-тетразол, 1-метилтетразол, бензоксазол, бензотиазол, бензофуран, бензисоксазол, бензимидазол, N-метилбензимидазол, азабензимидазол, индазол, хиназолин, хинолин и изохинолин. Бициклические ароматические гетероарильные группы включают фенильные, пиридиновые, пиримидиновые или пиридизиновые кольца, которые: (a) конденсированы с 6-членным ароматическим (ненасыщенным) гетероциклическим кольцом, содержащим один атом азота; (b) конденсированы с 5- или 6-членным ароматическим (ненасыщенным) гетероциклическим кольцом, содержащим два атома азота; (c) конденсированы с 5-членным ароматическим (ненасыщенным) гетероциклическим кольцом, содержащим один атом азота с одним атомом кислорода или серы; (d) конденсированы с 5-членным ароматическим (ненасыщенным) гетероциклическим кольцом, содержащим один гетероатом, выбранный из O, N или S. Термин «гетероарил» также включает ароматические углеводородные кольца, которые являются замещенными, например, от 1 до 5 заместителями, независимо выбираемыми из группы, включающей алкил, алкенил, алкинил, гаолгеналкил, алкоксигруппу, тиоалкоксигруппу, гидроксильную группу, меркаптогруппу, аминогруппу, алкиламиногруппу, диалкиламиногруппу, ациламиногруппу, аминоацил, алкоксикарбонил, арилоксикарбонил, азидогруппу, цианогруппу, галоген, нитрогруппу, карбоксальдегид, карбоксильную группу, карбоксамид, карбамид, карбамат, сульфат, сульфонат, сульфинат, фосфат, фосфонат, фосфинат, фосфин и защищенную гидроксильную группу.
Термин «опционально замещенный», используемый в настоящем документе, означает то, что группа, к которой относится данный термин, может быть незамещенной или замещенной одной или более группами, независимо выбираемыми из алкила, алкенила, алкинила, арила, гетероарила, тиоалкила, циклоалкила, циклоалкенила, гетероциклоалкила, галогена, карбоксильной группы, карбоксиалкила, галогеналкила, галогеналкинила, гидроксильной группы, алкоксигруппы, тиоалкоксигруппы, меркаптогруппы, алкенилоксигруппы, галогеналкоксигруппы, галогеналкенилоксигруппы, нитрогруппы, аминогруппы, нитроалкила, нитроалкенила, нитроалкинила, нитрогетероциклила, алкиламиногруппы, диалкиламиногруппы, алкениламиногруппы, алкиниламиногруппы, ацила, алкеноила, алкиноила, ациламиногруппы, диациламиногруппы, аминоацила, ацилоксигруппы, алкилсульфонилоксигруппы, гетероциклоксигруппы, гетероциклоаминогруппы, гелогенгетероциклоалкила, алкоксикарбонила, арилоксикарбонила, азидогруппы, карбоксальдегида, карбоксильной группы, карбоксамида, карбамида, карбамата, оксима, гидроксиламина, сульфата, сульфоната, сульфината, алкилсульфенила, алкилкарбонилоксигруппы, алкилтиогруппы, ацилтиогруппы, фосфорсодержащих групп, таких как фосфат, фосфонат, фосфинат и фосфин, арила, гетероарила, алкиларила, алкилгетероарила, цианогруппы, цианата, изоцианата, -С(O)NH(алкила), -С(O)N(алкила)2 и -C(O)NR'R", где R' и R" независимо являются водородом, алкилом, арилом или гетероарилом, как определено выше.
Термины «галоген» или «галогенид» и различные его производные, используемые в настоящем документе, относятся к фтору, хлору, брому и йоду.
Термин «аминогруппа» или «амин», используемый в настоящем документе, относится к группам вида -NRaRb, где Ra и Rb по отдельности выбираются из группы, включающей, но не ограничивающейся, водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил и опционально замещенные арильные группы.
Термины «химически соединенный» и «химическая связь», а также их грамматические вариации относятся к ковалентным и нековалентным связям молекул и включают особо, но не ограничиваются, ковалентные связи, электростатические связи, водородные связи и ван-дер-ваальсовы связи. Термин охватывает как прямые, так и непрямые химические связи между молекулами. Таким образом, если первое соединение химически соединено со вторым соединением, это соединение может осуществляться посредством прямой химической связи или непрямой химической связи через другие соединения, сшивающие агенты или связи.
Используемый в настоящем документе термин «уреазная единица», или уреазная «ферментная единица», [U] относится к тому количеству фермента (уреазы), который приводит к освобождению одного микромоль аммиака в минуту при 23°C и pH 7,5.
Словосочетание «в основном» не исключает «полностью», например, соединение, которое «в основном свободно» от Y может быть полностью свободно от Y. Где необходимо, словосочетание «в основном» может быть опущено в определении изобретения.
Если не указано иное, термины «включающий» и «содержащий» и их грамматические вариации следует воспринимать в «открытом» значении, поскольку они включают перечисленные элементы, но допускают при этом также включение дополнительных, не указанных элементов.
Используемый в настоящем документе термин «приблизительно» в контексте концентраций компонентов формул, как правило, означает+/-5% от указанного значения, более типично+/-4% от указанного значения, более типично+/-3% от указанного значения, более типично+/-2% от указанного значения, еще более типично+/-1% от указанного значения и еще более типично+/-0,5% от указанного значения.
При описании настоящего изобретения определенные варианты осуществления могут быть изложены в формате диапазонов. Это следует понимать таким образом, что описание в формате диапазонов приведено только для удобства и краткости и не должно восприниматься как жесткое ограничение рамок приведенных в настоящем изобретении диапазонов. Соответственно описание диапазона должно восприниматься как особо включающее все возможные поддиапазоны, а также индивидуальные численные значения в пределах этого диапазона. Например, описание диапазона типа от 1 до 6 следует воспринимать как особо содержащее поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельные числа в рамках данного диапазона, например 1, 2, 3, 4, 5 и 6. Это применяется вне зависимости от ширины диапазона.
Подробное описание вариантов осуществления
Далее будут рассмотрены типичные, не ограничивающие примеры способа приготовления субстрата для иммобилизации на нем функциональных веществ и субстрата для иммобилизации на нем функциональных молекул.
Субстрат содержит соединения, предназначенные для иммобилизации функциональных молекул, при этом каждое соединение содержит цепочку, включающую: функциональную группу R, химически связанную с субстратом, указанная функциональная группа R выбирается из группы, включающей: эфир, сложный эфир, карбонильную группу, сложный эфир карбоната, тиоэфир, дисульфид, сульфинил, сульфонил и карбонотиоил; и эпоксидсодержащую функциональную группу, соединенную с функциональной группой R сшивающим агентом, включающим, по крайней мере, одну нуклеофильную группу.
В одном варианте осуществления функциональная группа R далее выбирается из группы, включающей амин, амид, карбамид, мочевину и гуанидин.
В одном варианте осуществления нуклеофильная группа исключает, по крайней мере, одну кислородсодержащую группу и серосодержащую группу.
В другом варианте осуществления субстрат содержит дополнительную эпоксидсодержащую группу, соединенную с цепочкой. В одном варианте осуществления количество дополнительных эпоксидсодержащих групп выбирается из числа 1, 2, 3, 4 и 5. В другом варианте осуществления, по крайней мере, одна из дополнительных эпоксидсодержащих групп соединена с указанной цепочкой нуклеофильной группой указанного сшивающего агента.
Сшивающий агент может включать дополнительные нуклеофильные группы, к которым упомянутые дополнительные эпоксидсодержащие группы соединяются с указанной цепочкой. В другом варианте осуществления дополнительные эпоксидсодержащие группы могут ответвляться от цепочки путем соединения с дополнительными нуклеофильными группами указанного сшивающего агента.
В одном варианте осуществления нуклеофильная группа указанного сшивающего агента является амином. Сшивающий агент может быть выбран из группы, содержащей насыщенные и ненасыщенные алифатические и ароматические амины, диамины и триамины. В одном варианте осуществления алифатические группы указанных аминов являются алкильными группами.
В другом варианте осуществления сшивающий агент может содержать эпоксидную группу.
В другом варианте осуществления сшивающий агент содержит динуклеофильные соединения. Динуклеофильный сшивающий агент может быть выбран, по крайней мере, из одного алкилдиамина и алкендиамина. В одном варианте осуществления динуклеофильный сшивающий агент выбирается, по крайней мере, из одного этандиамина, пропандиамина, бутандиамина, пентандиамина, гександиамина. В одном варианте осуществления динуклеофильный сшивающий агент является гександиамином.
В другом варианте осуществления эпоксидсодержащее соединение образуется путем реакции эпигалогенгидрина с нуклеофильными группами указанного сшивающего агента.
В одном варианте осуществления субстрат может быть инертным к функциональной молекуле, иммобилизуемой указанной эпоксидсодержащей группой.
В другом варианте осуществления субстрат может являться полимером. Полимер может быть биологически совместимым полимером. В другом варианте осуществления биологически совместимый полимер может быть выбран из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, полиакрилатный субстрат и субстрат на основе полисахарида. В одном варианте осуществления полимер является субстратом на основе полисахарида, который может быть выбран из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы.
В другом варианте осуществления полимер является биополимером. Биополимер может быть выбран из целлюлозы, хитозана, хитина, декстрана, агарозы и их производных.
В другом варианте осуществления субстрат может содержать покрытие, расположенное на указанном субстрате, покрытие, включающее в основном гомогенную смесь стабилизирующих добавок, выбранных для стабилизации указанной функциональной молекулы. В одном варианте осуществления стабилизирующие добавки могут быть выбраны из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
В другом варианте осуществления предлагается способ иммобилизации функциональной молекулы на субстрате. Способ содержит этап экспонирования функциональной молекулы на субстрат в соответствии с описанием данного изобретения.
В одном варианте осуществления функциональная молекула выбирается из группы, включающей аффинный лиганд, хелатор, катализатор, ионообменник, краситель, индикатор и биомолекулу. В другом варианте осуществления функциональная молекула является хиральной. В другом варианте осуществления функциональная молекула является биомолекулой. Биомолекула может быть ферментом. Фермент может быть выбран из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу К.
В другом варианте осуществления способ далее содержит этап нанесения на поверхность субстрата в основном гомогенной смеси стабилизирующих добавок для стабилизации указанной функциональной молекулы. Этап нанесения в основном гомогенной смеси добавок включает испарение растворителя указанных добавок на субстрате. В одном варианте осуществления стабилизирующие добавки выбираются из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
В другом варианте осуществления предлагается способ приготовления субстрата для иммобилизации на нем функциональных молекул. Способ включает: (i) обеспечение электрофильных соединений, соединенных с поверхностью субстрата; (ii) осуществление участия электрофильных соединений в реакции нуклеофильного замещения для получения посредством нее нуклеофильной группы, и тем самым повышения нуклеофильности поверхности субстрата; (iii) осуществление участия нуклеофильной группы в реакции нуклеофильного замещения с другим электрофильным соединением для получения электрофильной группы на поверхности субстрата и тем самым повышения электрофильности субстрата.
В одном варианте осуществления этапы (ii) и (iii) могут быть повторены n-е количество раз для образования n-го числа поколений электрофильных групп на указанном субстрате. В одном варианте осуществления этапы (ii) и (iii) повторяются 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20 или более раз.
В одном варианте осуществления указанный этап обеспечения электрофильных соединений, соединенных с поверхностью субстрата, включает образование химической связи электрофильного соединения с субстратом.
В другом варианте осуществления этап (ii) включает этап реакции нуклеофила с первым электрофильным соединением. В другом варианте осуществления этап (iii) включает химическое соединение второго электрофильного соединения с нуклеофилом.
Электрофильное соединение может быть эпоксидсодержащим соединением. В одном варианте осуществления электрофильное соединение может быть выбрано из таких эпоксидных соединений, как алкиленоксиды, эпоксидные спирты, эпигалогенгидрины и галогениды. Электрофильное соединение может также включать кетоны, альдегиды, изоцианаты и производные этих соединений.
В другом варианте осуществления эпоксидсодержащее соединение является эпигалогенгидрином. В одном варианте осуществления эпигалогенгидрин может быть выбран из группы, включающей эпихлоргидрин, эпибромгидрин, эпийодгидрин, 1,2-эпокси-4-хлорбутан, 1,2-эпокси-4-бромбутан, 1,2-эпокси-4-йодбутан, 2,3-эпокси-4-хлорбутан, 2,3-эпокси-4-бромбутан, 2,3-эпокси-4-йодбутан, 2,3-эпокси-5-хлорпентан, 2,3-эпокси-5-бромпентан, 1,2-эпокси-5-хлорпентан. В одном варианте осуществления эпигалогенгидрин является эпихлоргидрином.
В одном варианте осуществления нуклеофил является динуклеофилом или полинуклеофилом. В другом варианте осуществления нуклеофил содержит амин. Амин может быть выбран из группы, включающей насыщенные и ненасыщенные алифатические или ароматические амины, диамины, триамины и высшие полиамины. В одном варианте осуществления алифатическая группа указанных аминов выбирается из алкильной группы. В одном варианте осуществления амин может быть выбран, по крайней мере, из одного этандиамина, пропандиамина, бутандиамина, пентандиамина, гександиамина. В одном варианте осуществления амин является гександиамином.
Субстрат может содержать полимер. Полимер может являться биологически совместимым полимером. В одном варианте осуществления биологически совместимый полимер может быть выбран из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, полиакрилатный субстрат и субстрат на основе полисахарида.
В одном варианте осуществления субстрат является субстратом на основе полисахарида. Субстрат на основе полисахарида может быть выбран из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы.
В другом варианте осуществления полимер может являться биополимером. Биополимер может быть выбран из целлюлозы, хитозана, хитина, декстрана, агарозы и их производных.
В другом варианте осуществления функциональная молекула может быть выбрана из группы, включающей аффинный лиганд, хелатор, катализатор, ионообменник, краситель, индикатор и биомолекулу. В одном варианте осуществления функциональная молекула может быть хиральной. В другом варианте осуществления функциональная молекула является биомолекулой. Биомолекула может быть ферментом, выбранным из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу K.
В другом варианте осуществления способ может далее содержать этап нанесения на поверхность субстрата в основном гомогенной смеси стабилизирующих добавок, отличающийся тем, что указанные стабилизирующие добавки выбираются для стабилизации указанной функциональной молекулы. Этап нанесения в основном гомогенной смеси добавок включает испарение растворителя раствора указанных добавок на субстрате. В одном варианте осуществления стабилизирующие добавки выбираются из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
Также предлагается картридж с сорбентом для использования в устройстве диализа, картридж с сорбентом, включающий субстрат, как описано в настоящем изобретении, для иммобилизации уреазы.
Также предлагается диализатор для использования в устройстве диализа, диализатор, содержащий субстрат, как описано в настоящем изобретении, для иммобилизации уреазы.
Также предлагается способ диализа, включающий этапы: экспонирование диализата, содержащего мочевину, на субстрате, как описано в настоящем изобретении; и удаление диализата из указанного субстрата.
Также предлагается использование субстрата, как описано в настоящем изобретении, в устройстве диализа.
В другом варианте осуществления предлагается использование субстрата в соответствии с описанием настоящего изобретения в качестве твердофазного материала для хроматографии (включая хиральную хроматографию и аффинную хроматографию). В другом варианте осуществления настоящее изобретение предлагает использование субстрата в сенсорах и биосенсорах.
В другом варианте осуществления предлагается способ приготовления субстрата для иммобилизации на нем функциональных веществ, способ, включающий этапы: химического соединения первого электрофильного соединения с субстратом; и химического соединения второго электрофильного соединения с первым электрофильным соединением, соединенным с субстратом, при котором указанное второе электрофильное соединение при соединении с указанным первым электрофильным соединением сконфигурировано для иммобилизации на нем функционального вещества. В одном варианте осуществления первое электрофильное соединение является диэлектрофилом и химически связывается с субстратом вследствие реакции нуклеофильного замещения между одной электрофильной группой диэлектрофила и нуклеофильной группой на субстрате.
В результате этой первой реакции слабо реакционноспособный (нуклеофильный) субстрат конвертируется в сильно реакционноспособный (электрофильный) субстрат. Диэлектрофильный реагент может являться эпигалогенгидрином. Он может также быть одним из группы, включающей бромистый цианоген, бромуксусную кислоту, глутаровый альдегид и т.п. Второе электрофильное соединение может быть прямо химически соединено с первым электрофильным соединением, например, химической связью. Второе электрофильное соединение также может быть непрямо химически соединено с первым электрофильным соединением, например, посредством сшивающего агента. В одном варианте осуществления первое и второе электрофильные соединения являются мономерами.
Перед этапом химического соединения первого электрофильного соединения с субстратом способ может включать этап функционализации субстрата таким образом, чтобы субстрат содержал функциональные группы, способные образовывать химическую связь с первым электрофильным соединением.
В одном варианте осуществления способ, включающий этап использования сшивающего агента для соединения второго электрофильного соединения с первым электрофильным соединением. Сшивающий агент также может быть нейтрально заряжен. В одном варианте осуществления сшивающий агент также может содержать алифатическую цепочку С 1.25, насыщенную или ненасыщенную, неразветвленную или разветвленную, которая является опционально замещенной и в которой атомы углерода цепочки могут быть опционально замещены -С(О)-, C(O)C(O)-, -C(O)NR*-, -C(O)NR*NR*-, -СО2-, -ОС(О), -NR*CO2-, -O-, -NR*C(O)NR*-, -OC(O)NR*-, -NR*NR*-, -NR*C(O)-, -S-, -SO-, -SO2-, NR*-, - SO2 NR* -, - NR*SO2 -, -C(O)NRO- или -NRC(NR)NR-, где R* выбирается из водорода или алифатической цепочки C1-10 где алифатическая цепочка C1-10 может быть замещенной или незамещенной.
В одном варианте осуществления сшивающий агент не содержит эпоксидную группу. Сшивающий агент также может содержать, по крайней мере, одну нуклеофильную группу. Сшивающий агент может быть полинуклеофильным сшивающим агентом, то есть сшивающий агент может содержать более одной нуклеофильной группы. В одном варианте осуществления сшивающий агент является динуклеофильным сшивающим агентом. Когда сшивающий агент является динуклеофильным сшивающим агентом, по крайней мере, один из нуклеофилов динуклеофильного сшивающего агента может быть выбран из группы, включающей NH, NR, NHO, NRO, O, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONR1NR2, CNO, PH и PR,
где R, R1 и R2 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил.
Когда функциональный сшивающий агент не содержит эпоксидную группу и является динуклеофильным сшивающим агентом, сшивающий агент может иметь общую формулу (I):
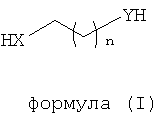
где X и Y независимо выбираются из NH, NR, O, S, COO, CONH и CONR;
R выбирается из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
n является целым числом от 0 до 25.
В другом варианте осуществления динуклеофильный сшивающий агент обладает общей формулой (II):
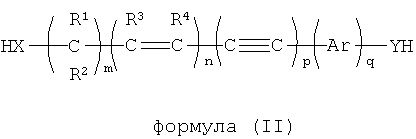
где X и Y независимо выбираются из NH, NR, NHO, NRO, О, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, PH, PR;
R, R1, R2, R3, R4 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
m, n, р и q являются целыми числами, независимо выбираемыми от 0 до 25.
Положение групп 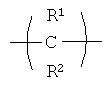 ,
, 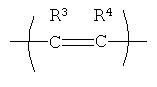 ,
, 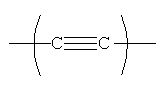
и 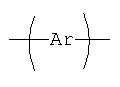 формулы (II) может чередоваться, и эти группы также могут присутствовать в более чем одном положении, что должно быть понятно опытному специалисту в данной области.
формулы (II) может чередоваться, и эти группы также могут присутствовать в более чем одном положении, что должно быть понятно опытному специалисту в данной области.
В другом варианте осуществления динуклеофильный сшивающий агент обладает общей формулой (IIa):
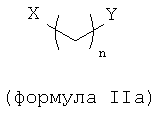
где X и Y независимо выбираются из группы, включающей NR1R2, NRO, OR, SR, SeR, COOR, CONR, CSSR, COSR, CONRO, CONRNR1R2, CNOR и PR1R2 и любые другие заместители, которые могут образовывать катионные аддукты;
R, R1 и R2 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
n является целым числом от 0 до 25.
В одном варианте осуществления переменные X и Y также могут являться любыми нуклеофильными группами, способными вступать в реакции с эпоксидной группой с образованием химической связи.
Динуклеофильный сшивающий агент может содержать алкилдиаминовую группу. В одном варианте осуществления динуклеофильный сшивающий агент является, по крайней мере, одним из этилендиамина и гександиамина. В другом варианте осуществления сшивающий агент может являться заряженным соединением, содержащим нуклеофилы, такие как NR R, где R1 и R2 определены выше. Сшивающий агент также может являться малым соединением, выбранным из группы, содержащей H2O, H2S, H2Se, РН3, PH2R, NH3, NH2R и NHR1R2, где R, R1 и R2 определены выше.
Сшивающий агент может являться или не являться эпоксидсодержащим соединением. В одном варианте осуществления, когда сшивающий агент является эпоксидсодержащим соединением, сшивающий агент может обладать общей формулой (Ia):
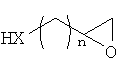
где X выбирается из NH, NR, O, S, Se, COO, CONR1NR2, CONRO, CONH и CONR; R1 и R2 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
n является целым числом от 0 до 25.
В другом варианте осуществления эпоксидсодержащий сшивающий агент обладает общей формулой (1b):
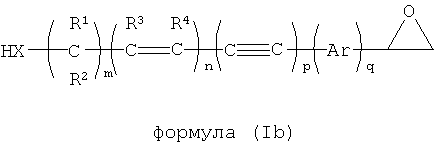
где X выбирается из NH, NR, NHO, NRO, О, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, PH, PR;
R, R1, R2, R3, R4 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
m, n, p и q являются целыми числами, независимо выбираемыми от 0 до 25.
Положение групп  ,
,  ,
,  и
и  формулы (II) может чередоваться, и эти группы также могут
формулы (II) может чередоваться, и эти группы также могут
присутствовать в более чем одном положении, что должно быть понятно опытному специалисту в данной области.
В одном варианте осуществления переменная X также может являться любой нуклеофильной группой, способной вступать в реакцию с эпоксидной группой с образованием химической связи.
Эпоксидсодержащий сшивающий агент может включать гидроксиоксираны. В одном варианте осуществления эпоксидсодержащий сшивающий агент является глицидолом.
Описанный в настоящем изобретении способ также может далее включать этапы химического присоединения дополнительного электрофильного соединения или амбифильного соединения к предшествующему электрофильному соединению прямо или непрямо посредством функционального сшивающего агента, рассмотренного выше. Эти дополнительные этапы химического присоединения дополнительных электрофильных соединений могут осуществляться неоднократно до достижения необходимой длины цепочки. Предпочтительно повторением этих этапов может быть увеличено количество электрофильных участков, таких как активные оксирановые участки, для соединения с биологическими веществами, тем самым повышая вероятность и сродство биологического вещества к субстрату. В одном варианте осуществления, когда сшивающий агент является амбифильным соединением, сшивающий агент содержит глицидол.
В одном варианте осуществления электрофильные соединения, описанные в настоящем изобретении, включают эпоксидсодержащие соединения. Например, первое электрофильное соединение и второе электрофильное соединение может являться первым эпоксидсодержащим соединением и вторым эпоксидсодержащим соединением. В одном варианте осуществления, по крайней мере, одно из первого эпоксидсодержащего соединения и второго эпоксидсодержащего соединения является эпигалогенгидрином. Эпигалогенгидрин может быть выбран из группы, включающей эпихлоргидрин, эпибромгидрин и эпийодгидрин. В одном варианте осуществления способ включает выбор слабо реакционноспособного субстрата. Субстрат может быть выбран из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, субстрат на основе эпоксидной смолы, полиакрилатный субстрат, гидрокси-функционализированный субстрат и субстрат на основе полисахарида. В одном варианте осуществления субстрат на основе полисахарида может быть выбран из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы.
В одном варианте осуществления этапы химического соединения могут быть осуществлены в температурном диапазоне от приблизительно -30°C до приблизительно 100°C, от приблизительно 0°C до приблизительно 70°C, от приблизительно 4°C до приблизительно 30°C или от приблизительно 10°C до приблизительно 27°C, от приблизительно 40°C до приблизительно 70°C, от приблизительно 23°C до приблизительно 35°C и от приблизительно 23°C до приблизительно 30°C.
Функциональные вещества могут быть биологически активными и могут содержать биологические вещества и/или биомолекулы. В одном варианте осуществления биологические вещества являются ферментами. Способ может включать этап химического соединения фермента с указанным вторым электрофильным соединением, связанным с первым электрофильным соединением. Этап химического соединения фермента с указанным вторым электрофильным соединением может включать применение стабилизирующих и активирующих добавок, таких как сахара, тиолы, антиоксиданты и хелаторы.
Ферменты могут быть выбраны из группы, включающей оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы и лигазы. Оксидоредуктазы катализируют окислительно-восстановительные реакции, и окисленный субстрат играет роль донора водорода или электронов. Трансферазы катализируют перенос функциональных групп от одной молекулы к другой. Гидролазы катализируют гидролитическое расщепление различных связей. Лиазы катализируют расщепление различных связей способами, отличными от гидролиза или окисления, например, они катализируют удаление группы из двойной связи или добавление к ней группы, либо другие виды расщепления, включая перегруппировку электронов. Изомеразы катализируют внутримолекулярную перегруппировку, т.е. изменения внутри одной молекулы. Лигазы катализируют реакции, в которых соединяются две молекулы.
В одном варианте осуществления ферменты являются оксидоредуктазами, которые могут воздействовать на различные группы доноров, такие как группа СН-ОН, альдегид или оксогруппа, группа СН-CH, группа CH-NH2, группа CH-NH, НАДН или НАДФН, азотистые соединения, серная группа, гемгруппа, дифенолы и сопутствующие вещества, водород, одиночные доноры с включением молекулярного кислорода, парные доноры с включением или восстановлением молекулярного кислорода и др. Оксидоредуктазы могут также воздействовать на группы СН2 или X-H и Y-H с образованием связи X-Y. Как правило, ферменты, принадлежащие к группе оксидоредуктаз, могут быть названы оксидазами, оксигеназами, гидрогеназами, дегидрогеназами, редуктазами или т.п. Конкретные примеры оксидоредуктаз включают оксидазы, такие как малатоксидаза, глюкозооксидаза, гексозооксидаза, оксидаза арилового спирта, спиртовая оксидаза, оксидаза длинноцепочечного спирта, глицерин-3-фосфатоксидаза, оксидаза поливинилового спирта, D-арабино-1,4-лактоноксидаза, D-маннитоксидаза, ксилитоксидаза, оксалатоксидаза, оксидаза оксида углерода, 4-гидроксифенилпируватоксидаза, дигидроурацилоксидаза, этаноламиноксидаза, L-аспартат оксидаза, саркозиноксидаза, уратоксидаза, метантиолоксидаза, оксидаза 3-гидроксиантранилата, лакказа, каталаза, пероксидаза жирной кислоты, пероксидаза, диарилпропанпероксидаза, ферроксидаза, птеридиноксидаза, колумбаминоксидаза и пр. Оксидоредуктазы могут также включать оксигеназы, такие как 1,2-диоксигеназа катехина, 1,2-диоксигеназа гентисата, 1,2-диоксигеназа гомогентисата, липоксигеназа, 2,3-диоксигеназа аскорбата, 2,3-диоксигеназа, 3-карбоксиэтил катехина, 2,3-диоксигеназа индола, 3,4-диоксигеназа каффеата, 5-липоксигеназа арахидоната, 1,2-диоксигеназа бифенил-2,3-диола, 11-липоксигеназа линолеата, ацетил-ацетон расщепляющий фермент, 2-монооксигеназа лактата, 2-монооксигеназа фенилаланина, инозитоксигеназа и т.п. Оксидоредуктазы могут также включать дегидрогеназы, такие как спиртовая дегидрогеназа, глицериновая дегидрогеназа, пропандиол-фосфатная дегидрогеназа, L-лактат-дегидрогеназа, D-лактатдегидрогеназа, глицератдегидрогеназа, 1-дегидрогеназа глюкозы, 1-дегидрогеназа галактозы, дегидрогеназа аллилового спирта, дегидрогеназа 4-карбоксибутирата, октанол-дегидрогеназа, дегидрогеназа арилового спирта, дегидрогеназа циклопентанола, дегидрогеназа длинноцепочечного 3-гидроксиацил-СоА, L-лактатдегидрогеназа, D-лактатдегидрогеназа, бутаналдегидрогеназа, 1,2-цис-дигидродиол-дегидрогеназа терефталата, сукцинатдегидрогеназа, глутамат-дегидрогеназа, глициндегидрогеназа, водороддегидрогеназа, 4-крезолдегидрогеназа, фосфонатдегидрогеназа и т.п. Редуктазы, принадлежащие к группе оксидоредуктаз, включают ферменты, такие как диэтил 2-метил-3-оксосукцинатредуктазу, тропинонредуктазу, редуктазу длинноцепочечной жирной ацил-СоА, карбоксилатредуктазу, D-пролинредуктазу, глицинредуктазу, гембелки, такие как цитохромы и т.п. В одном варианте осуществления ферменты представляют собой лиазы, которые могут входить в любую из следующих групп: углерод-углеродные лиазы, углерод-кислородные лиазы, углерод-азотные лиазы, углерод-серные лиазы, углерод-галогенные лиазы, фосфорно-кислородные лиазы и другие лиазы.
Углерод-углеродные лиазы могут также включать карбоксилиазы, альдегидлиазы, лиазы оксокислот и другие. Некоторые конкретные примеры лиаз, входящих в упомянутые группы, включают оксалатдекарбоксилазу, ацетолактатдекарбоксилазу, аспартат 4-декарбоксилазу, лизиндекарбоксилазу, декарбоксилазу ароматической L-аминокислоты, декарбоксилазу метилмалонила-СоА, карнитиндекарбоксилазу, индол-3-глицерин-фосфатсинтазу, галлат-декарбоксилазу, 2-оксокислоту с разветвленной цепочкой, декарбоксилазу, тартратдекарбоксилазу, арилмалонатдекарбоксилазу, фруктозобисфосфатную альдолазу, 2-дегидро-3-деокси-фосфоглюконатальдолазу, триметил аминоксидальдолазу, пропиоинсинтазу, лактатальдолазу, ванилинсинтазу, изоцитратлиазу, лиазу гидроксиметилглутарила-СоА, 3-гидроксиаспартатальдолазу, триптофаназу, дезоксирибодипиримидинфотолиазу, октадеканалдекарбонилазу и т.п.
Углерод-кислородные лиазы могут включать гидролиазы, действующие на полисахариды, фосфаты и пр. Некоторые их конкретные примеры включают карбонатдегидратазу, фумаратгидратазу, аконитат-гидратазу, цитратдегидратазу, арабинонатдегидратазу, галактонатдегидратазу, альтронатдегидратазу, маннонатдегидратазу, дегидратазу дигидроксики слоты, дегидратазу 3-дегидрохината, пропандиолдегидратазу, глицериндегидратазу, малеатгидратазу, олеатгидратазу, пектатлиазу, поли(β-D-маннуронат)лиазу, олигогалактуронидлиазу, поли(α-L-гулуронат)лиазу, ксантанлиазу, этаноламинфосфатфосфолиазу, карбоксиметилоксисукцинатлиазу и др.
Углерод-азотные лиазы могут включать аммиачные лиазы, лиазы, действующие на амиды, амидины и т.д., аминолиазы и др. Конкретные примеры таких групп лиаз включают аммиаклиазу аспартата, аммиаклиазу фенилаланина, аммиаклиазу этаноламина, аммиаклиазу глюкозамината, аргининосукцинатлиазу, аденилосукцинатлиазу, уреидогликолятлиазу, C-N-лиазу 3-кетовалидоксиламина.
Углерод-серные лиазы могут включать диметилпропиотетиндетиометилазу, аллиинлиазу, лактоилглютатионлиазу и цистеинлиазу.
Углерод-галогенные лиазы могут включать 3-хлор-D-аланиндегидрохлориназу или дихлорметандегалогеназу.
Фософор-кислородные лиазы могут включать аденилатциклазу, цитидилатциклазу, гликозилфосфатидилинозитолдиацилглицеринлиазу.
В другом варианте осуществления ферменты представляют собой гидролазы, выбранные из группы, включающей гликозилазы, ферменты, действующие на ангидриды кислот, и ферменты, действующие на конкретные связи, такие как связи сложных эфиров, связи простых эфиров, углерод-азотные связи, пептидные связи, углеродно-углеродные связи, галогенные связи, фосфорно-азотные связи, серно-азотные связи, углерод-фосфорные связи, серно-серные связи или углеродно-серные связи.
Гликозилазы могут являться гликозидазами, способными гидролизовать O- и S-гликозилсоединения или N-соединения. Гликолазы могут включать α-амилазу, β-амилазу, глюкан 1,4-α-глюкозидазу, целлюлазу, эндо-1,3(4)-β-глюканазу, инулиназу, эндо-1,4-β-ксиланазу, олиго-1,6-глюкозидазу, декстраназу, хитиназу, пектиназу, полигалактуроназу, лизозим, леваназу, кверцитриназу, галактуран 1,4-α-галактуронидазу, изоамилазу, глюкан 1,6-α-глюкозидазу, глюкан эндо-1,2-β-глюкозидазу, лихениназу, агаразу, эксо-поли-α-галактуронозидазу, к-каррагеназу, стерил-β-глюкозидазу, стриктозидин β-глюкозидазу, маннозил-олигосахаридглюкозидазу, лактазу, олигоксилоглюкан β-глюкозидазу, полиманнуронатгидролазу, хитозаназу, поли(ADP-рибоза)гликогидролазу, пуриннуклеозидазу, инозиннуклеозидазу, уридиннуклеозидазу, аденозиннуклеозидазу и др.
Ферменты, действующие на ангидриды кислот, включают, например, ангидриды, действующие на фосфоро- или сульфонилсодержащие ангидриды. Некоторые примеры ферментов, действующих на ангидриды кислот, включают неорганическую дифосфатазу, триметафосфатазу, аденозинтрифосфатазу, апиразу, нуклеозид-дифосфатазу, ацилфосфатазу, нуклеотид дифосфатазу, эндополифосфатазу, экзополифосфатазу, нуклеозид фосфоацилгидролазу, трифосфатазу, CDP-диацилглицериндифосфатазу, ундекапренилдифосфатазу, долихилдифосфатазу, олигосахариддифосфодолихолдифосфатазу, гетеротримерного G-протеина ГТФазу, малую мономерную ГТФазу, динамина ГТФазу, тубулина ГТФазу, дифосфоинозитол-полифосфатдифосфатазу, Н+-экспортирующую АТФазу, моносахаридтранспортирующую АТФазу, мальтозотранспортирующую АТФазу, глицерин-3-фосфатотранспортирующую АТФазу, олигопептидтранспортирующую АТФазу, полиаминтранспортирующую АТФазу, пептидтранспортирующую АТФазу, жирный ацил-СоА транспортирующую АТФазу, протеин-секретирующую АТФазу и др.
Ферменты, действующие на связи сложных эфиров, могут включать эстеразы, липазы, гидролазы сложного карбонового эфира, гидролазы сложного тиолового эфира, гидролазы сложного фосфорного эфира, гидролазы сложного серного эфира и рибонуклеазы. Конкретные ферменты, действующие на связи сложных эфиров, включают ацетил-СоА гидролазу, пальмитоил-СоА гидролазу, сукцинил-СоА гидролазу, 3-гидроксиизобутирил-СоА гидролазу, гидроксиметилглутарил-СоА гидролазу, гидроксиацил-глютатионгидролазу, глютатионтиоэстеразу, формил-СоА гидролазу, ацетоацетил-СоА гидролазу, S-формилглютатионгидролазу, S-сукцинилглютатион гидролазу, олеоил-[ацил-носитель-белок]-гидролазу, убихитинтиолэстеразу, [цитрат-(про-35)-лиаза]-тиолэстеразу, (S)-метилмалонил-СоА гидролазу, ADP-зависимую короткоцепочечную ацил-СоА гидролазу, ADP-зависимую среднецепочечную ацил-СоА гидролазу, ацил-СоА гидролазу, додеканоил-[ацил-носитель-белок] гидролазу, пальмитоил-(белок)гидролазу, 4-гидроксибензоил-СоА тиоэстеразу, 2-(2-гидроксифенил)бензолсульфинатгидролазу, щелочную фосфатазу, кислотную фосфатазу, фосфосериновую фосфатазу, фосфатидатную фосфатазу, 5'-нуклеотидазу, 3'-нуклеотидазу, 3'(2'),5'-бифосфатнуклеотидазу, 3-фитазу, глюкоза-6-фосфатазу, глицерин-2-фосфатазу, фосфоглицератфосфатазу, глицерин-1-фосфатазу, маннит-1-фосфатазу, сахар-фосфатазу, сахароза-фосфатазу, инозит-1 (или 4)-монофосфатазу, 4-фитазу, фосфатидилглицерофосфатазу, ADP-фосфоглицератфосфатазу, N-ацилнейраминат-9-фосфатазу, нуклеотидазу, полинуклеотид 3'-фосфатазу, гликоген-синтаза-О-фосфатазу, пируват-дегидрогеназа(липоамид)-фосфатазу, ацетил-СоА карбоксилаза-фосфатазу, 3-дезокси-манно-октулозонат-8-фосфатазу, полинуклеотид 5'-фосфатазу, сахар-концевую фосфатазу, алкилацетилглицерофосфатазу, 2-деоксиглюкоза-6-фосфатазу, глюкозилглицерин 3-фосфатазу, 5-фитазу, фосфодиэстеразу I, глицерофосфохолинфосфодиэстеразу, фосфолипазу C, фосфолипазу D, фосфоинозитидфосфолипазу C, сфингомиелинфосфодиэстеразу, глицерофосфохолин-холинфосфодиэстеразу, алкилглицерофосфоэтанол-аминфосфодиэстеразу, глицерофосфоинозитолглицерофосфодиэстеразу, арилсульфатазу, стерилсульфатазу, гликосульфатазу, холинсульфатазу, целлюлозополисульфатазу, монометилсульфатазу, О-лактат-2-сульфатазу, глюкуронат-2-сульфатазу, пренил-дифосфатазу, арилдиалкилфосфатазу, диизопропилфторфосфатазу, олигонуклеидазу, поли(A)-специфическую рибонуклеазу, дрожжевую рибонуклеазу, дезоксирибонуклеазу (димер пиримидина), рибонуклеазу Physarum polycephalum, альфа-рибонуклеазу, нуклеазу Aspergillus SI, нуклеазу Serratia marcescens, карбоксилэстеразу, арилэстеразу, триацилглицеринлипазу, фосфолипазу A2, лизофосфолипазу, ацетилэстеразу, ацетилхолинэстеразу, холинэстеразу, тропинэстеразу, пектинэстеразу, стеринэстеразу, хлорофиллазу, L-арабинонолактоназу, глюконолактоназу, уронолактоназу, танназу, ретинил-пальмитатэстеразу, гидроксибутират-димер гидролазу, ацилглицеринлипазу, 3-оксоадипат енол-лактоназу, 1,4-лактоназу, галактолипазу, 4-пиридоксолактоназу, ацилкарнитингидролазу, аминоацил-тРНК гидролазу, D-арабинонолактоназу, 6-фосфоглюконо-лактоназу, фосфолипазу Al, 6-ацетилглюкозодеацетилазу, липопротеинлипазу, дигидрокумарингидролазу, лимонин-D-кольцевую лактоназу, стероидлактоназу, триацетатлактоназу, актиномицин-лактоназу, орселлинатдепсид гидролазу, цефалоспорин-С деацетилазу, хлоргенатгидролазу, эстеразу α-аминокислоты, 4-метилоксало-ацетатэстеразу, карбоксиметиленбутенолидазу, дезоксилимоната А-кольцо-лактоназу, 1-алкил-2-ацетилглицерофосфохолинэстеразу, фузаринин-C орнитинэстеразу, синапинэстеразу, гидролазу воска-сложного эфира, гидролазу форбола-диэфира, фосфатидилинозитол-деацилазу, O-ацетилэстеразу, ацетоксибутинилбитиофендеацетилазу, ацетилсалицилатдеацетилазу, метилумбеллиферилацетатдеацетилазу, 2-пирон-4,6-дикарбоксилат-лактоназу, N-ацетилгалактозаминогликандеацетилазу, эстеразу ювенильного гормона, бис(2-этилгексил)фталатэстеразу, протеин-глютамат, метилэстеразу, 11 -цис-ретинил-пальмитатгидролазу, полностью транс-ретинил-пальмитат гидролазу, L-рамноно-1,4-лактоназу, 5-(3,4-диацетоксибут-1-инил)-2,2'-битиофен-деацетилазу, синтазу жирного ацила-этилового эфира, ксилоно-1,4-лактоназу, цетраксатбензилэстеразу, ацетилалкилглицеринацетилгидролазу, ацетилксиланэстеразу, ферулоилэстеразу, кутиназу, поли(3-гидроксибутират)деполимеразу, поли(3-гидроксиоктаноат), ацилоксиацилгидролазу деполимеразы, ацилоксиацилгидролазу, полинейридин-альдегидэстеразу и др.
Ферменты, действующие на связи простых эфиров, могут включать гидролазы триалкилсульфония и гидролазы простых эфиров. Ферменты, действующие на связи простых эфиров, могут воздействовать как на тиоэфирные связи, так и на кислородный эквивалент. Конкретные примеры ферментов, принадлежащих к таким группам, включают аденозилгомоцистеиназу, аденозилметионин-гидролазу, изохоризмотазу, алкенилглицерофосфохолингидролазу, эпоксидную гидролазу, транс-эпоксисукцинатгидролазу, алкенил-глицерофосфатоэтаноламингидролазу, гидролазу лейкотриена-А4, гепоксилинэпоксидгидролазу и лимонен-1,2-эпоксидгидролазу.
Ферменты, действующие на углерод-азотные связи, могут гидролизовать линейные амиды, циклические амиды, линейные амидины, циклические амидины, линейные карабамиды (мочевины), циклические карабамиды (мочевины), нитрилы и другие соединения. Конкретные примеры, принадлежащие к таким группам, включают уреазу, амидазу (ацилазу), аспарагиназу, глютаминазу, ω-амидазу, β-уреидопропионазу, арилформамидазу, биотинидазу, арил-ациламидазу, аминоацилазу, аспартоацилазу, ацетилорнитиндеацетилазу, ацил-лизиндеацилазу, сукцинил-диаминопимелатдесукцинилазу, пантотеназу, церамидазу, холоилглицингидролазу, N-ацетилглюкозамин-6-фосфатдеацетилазу, N-ацетилмурамоил-L-аланинамидазу, 2-(ацетамидометилен)сукцинатгидролазу, 5-аминопентанамидазу, формилметиониндеформилазу, гиппуратгидролазу, N-ацетилглюкозаминдеацетилазу, D-глутаминазу, N-метил-2-оксоглутараматгидролазу, глутамин(аспарагин)азу, алкиламидазу, ацилагматинамидазу, хитиндеацетилазу, пептидилглутаминазу, N-карбамоилсаркозинамидазу, N-(длинноцепочечный ацил)этаноламин-деацилазу, мимозиназу, ацетилпутресциндеацетилазу, 4-ацетамидо-бутиратдеацетилазу, теанингидролазу, 2-(гидроксиметил)-3-(ацетамидометилен)сукцинатгидролазу, 4-метиленглутаминазу, N-формилглутаматдеформилазу, гликосфинголипиддеацилазу, деацилазу акулеацина-А, пептиддеформилазу, дигидропиримидиназу, дигидрооротазу, карбоксиметилгидантоиназу, креатининазу, L-лизинлактамазу, аргиназу, гуанидиноацетазу, креатиназу, аллантоиказу, цитозиндеаминазу, рибофлавиназу, тиаминазу, 1-аминоцикло-пропан-1-карбоксилат деамин и пр.
В одном варианте осуществления иммобилизуемые ферменты являются ферментами, действующими на пептидные связи, группа которых также называется пептидазами. Пептидазы могут быть далее разделены на экзопептидазы, действующие только на концах полипептидной цепочки, и эндопептидазы, действующие внутри полипептидных цепочек. Ферменты, действующие на пептидные связи, могут включать ферменты, выбранные из группы, включающей аминопептидазы, дипептидазы, ди- или трипептидилпептидазы, пептидилдипептидазы, карбоксипептидазы типа серина, металлокарбоксипептидазы, карбоксипептидазы типа цистеина, омегапептидазы, серинэндопептидазы, цистеинэндопептидазы, аспарагиновые эндопептидазы, металлоэндопептидазы и треонин-эндопептидазы. Некоторые конкретные примеры ферментов, принадлежащих к таким группам, включают цистиниламинопептидазу, трипептидаминопептидазу, пролиламинопептидазу, аргиниламино-пептидазу, глутамиламинопептидазу, цитозолаланиламинопептидазу, лизиламинопептидазу, Met-X дипептидазу, нестереоспецифическую дипептидазу, неспецифическую дипептидазу цитозола, мембранную дипептидазу, дипептидазу E, дипептидилпептидазу I, дипептидил-дипептидазу, трипептидилпептидазу I, трипептидилпептидазу II, дипептидилпептидазу Х-Pro, пептидилдипептидазу А, лизосомальную карбоксипептидазу Х-Pro, карбоксипептидазу С, ациламиноацил-пептидазу, пептидилглицинамидазу, β-аспартилпептидазу, убихитинилгидролазу 1, химотрипсин, химотрипсин C, метридин, трипсин, тромбин, плазмин, энтеропептидазу, акрозин, α-литическую эндопептидазу, глутамилэндопептидазу, катепсин G, кукумизин, пролилолигопептидазу, брахиурин, плазменный калликреин, тканевой калликреин, панкреатическую эластазу, лейкоцитную эластазу, химазу, церевизин, гиподермин C, лизилэндопептидазу, эндопептидазу La, γ-ренин, веномбин АВ, лейцилэндопептидазу, триптазу, скутеларин, кексин, субтилизин, оризин, эндопептидазу K, термомиколин, термитазу, эндопептидазу So, t-плазминогенный активатор, протеин C (активированный), панкреатическую эндопептидазу E, панкреатическую эластазу II, IgA-специфическую серинэндопептидазу, t-плазминогенный активатор, веномбин A, фурин, миелобластин, семеногелазу, гранзим А, гранзим В, стрептогризин A, стрептогризин В, глутамилэндопептидазу II, олигопептидазу B, омптин, тогавирин, флавивирин, эндопептидазу Clp, пропротеинконвертазу 1, пропротеинконвертазу 2, лактоцепин, ассемблин, гепацивирин, спермозин, псевдомонализин, ксантомонализаин, С-терминалобрабатывающую пептидазу, физаролизин, катепсин В, папаин, фикаин, химопапаин, асклепаин, клострипаин, стрептопаин, актинидаин, катепсин L, катепсин H, катепсин T, глицил-эндопептидазу, раковый прокоагулянт, катепсин S, пикорнаин ЗС, пикорнаин 2A, карикаин, ананаин, стволовой бромелаин, фруктовый бромелаин, легумаин, гистолизаин, каспазу-1, гингипаин R, катепсин К, аденаин, блеомицингидролазу, катепсин F, катепсин О, катепсин V, включенную в ядро a эндопептитазу, протеиназу помощника-компонента, протеиназу K, L-пептидазу, гингипаин K, стафопаин, сепаразу, V-катэндопептитазу, крузипаин, калпаин-1, калпаин-2, пепсин А, пепсин В, газтриксин, химозин, катепсин D, непентезин, ренин, про-опиомеланокортинпревращающий фермент, аспергиллопепсин I, аспергиллопепсин II, пенициллопепсин, ризопуспепсин, эндотиапепсин, мукорпепсин, кандидапепсин, сахаропепсин, родоторулапепсин, акроцилиндропепсин, полипоропепсин, пикнопоро-пепсин, скиталидопепсин A, скиталидопепсин В, катепсин Е, барьерпепсин, сигнальную пептидазу II, плазмепсин I, плазмепсин II, фитепсин, япсин 1, термопсин, препилинпептидазу, нодавирус эндопептидазу, мемапсин 1, мемапсин 2, атролизин A, микробную коллагеназу, лейколизин, стромелизин 1, меприн A, проколлаген С-эндопептидазу, астацин, псевдолизин, термолизин, бациллолизин, ауреолизин, кокколизин, миколизин, желатиназу B, лейшманолизин, сахаролизин, гаметолизин, серрализин, хоррилизин, руберлизин, ботропазин, олигопептидазу A, эндотелин-превращающий фермент, эндопептитазу ADAM 10 и др.
Ферменты, действующие на углерод-углеродные связи, могут включать, но не ограничиваются, оксалоацетазу, фумарилацетоацетазу, кинурениназу, флоретин-гидролазу, ацилпируватгидролазу, ацетилпируватгидролазу, β-дикетонгидролазу, 2,6-диоксо-6-фенилгекса-3-эноатгидролазу, 2-гидроксимуконат-полуальдегидгидролазу и циклогексан-1,3-дион гидролазу.
Ферменты, действующие на галогенные связи, могут включать алкилгалоидазу, дегалогеназу 2-галокислоты, галоацетат-дегалогеназу, тироксиндеиодиназу, галоалакандегалогеназу, 4-хлорбензоатдегалогеназу, дегалогеназу 4-хлорбензоил-СоА, атразинхлоргидролазу и т.п.
Иммобилизованные ферменты, относящиеся к настоящему изобретению, могут также включать ферменты, действующие на специфические связи, такие как фосфоамидаза, N-сульфоглюкозаминсульфогидролаза, цикламатсульфогидролаза, фосфоноацетальдегидгидролаза, фосфоноацетатгидролаза, тритионатгидролаза, UDP-сульфохиновозсинтаза и т.п.
Предпочтительно ферменты являются уреазами. Фермент может быть химически соединен со вторым эпоксидсодержащим соединением, соединенным с первым эпоксидсодержащим соединением. Он также может быть соединен напрямую с первым эпоксидсодержащим соединением.
Субстрат, полученный в соответствии с описанным способом для иммобилизации на нем биологических веществ, содержит эфирсодержащее соединение, имеющее одну функциональную группу, соединенную с субстратом, и другую функциональную группу, соединенную с эпоксидсодержащим соединением. Субстрат может быть использован в устройстве диализа, таком как устройство перитонеального диализа или устройство гемодиализа. В одном варианте осуществления субстрат используется в сорбенте устройства гемодиализа.
Краткое описание чертежей
Прилагаемые чертежи иллюстрируют изложенный вариант осуществления изобретения и служат для объяснения принципов представленного варианта осуществления изобретения. Однако следует понимать, что данные чертежи представлены исключительно в иллюстративных целях, а не для определения ограничений изобретения.
Фиг.1a представляет собой схематическое изображение варианта осуществления представленного способа использования динуклеофильных сшивающих агентов.
Фиг.1b представляет собой схематическое изображение еще одного возможного модифицированного субстрата, который может быть получен из аналогичного варианта осуществления способа, показанного на Фиг.1a.
Фиг.2 представляет собой схематическое изображение еще одного варианта осуществления представленного способа использования оксиран-функционализированных сшивающих агентов.
Фиг.3 представляет собой конкретный пример способа, показанного на Фиг.1a, когда в качестве сшивающего агента используется гександиамин, а в качестве первого и второго эпоксидсодержащих соединений используется эпихлоргидрин.
Фиг.4 представляет собой конкретный пример способа, показанного на Фиг.1b, когда в качестве сшивающего агента используется глицидол.
Подробное описание чертежей
Ссылаясь на Фиг.1a, представлено схематическое изображение одного варианта осуществления представленного способа 100 с использованием динуклеофильных сшивающих агентов. Свободная (первичная) гидроксильная группа на поверхности нерастворимого полимера 110 сначала вступает в реакцию с эпигалогенгидрином, показанным на этапе A-1. Реакция приводит к освобождению галогена эпигалогенгидрина и протона гидроксильной группы, образуя эфирную связь таким образом, что полученный модифицированный субстрат 112 оказывается химически связанным с эпоксидной группой терминального конца. Затем субстрат 112, содержащий эпоксидную группу, на этапе A-2 вступает в реакцию с динуклеофильным сшивающим агентом, обладающим общей формулой (II), продуктом которой становится модифицированный сшивающим агентом субстрат 114.
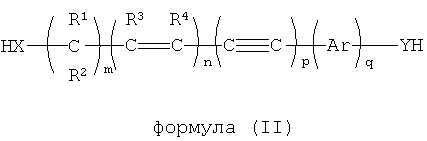
где X и Y независимо выбираются из NH, NR, NHO, NRO, О, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, PPH, PR;
R, R1, R2, R3, R4 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
m, n, р и q являются целыми числами, независимо выбираемыми от o до 25.
После реакции с группой сшивающего агента на этапе A-2 модифицированный субстрат 114 содержит нуклеофильную группу Y на терминальном конце. Затем нуклеофильная группа Y вступает в реакцию на этапе A-3 с другим эпигалогенгидрином. Вследствие нуклеофильного замещения галоген, присутствующий в эпигалогенгидрине, замещается нуклеофильной группой Y, что приводит к образованию в модифицированном субстрате 116 эфирной функциональной группы 140, терминальной эпоксидной функциональной группы 142, которые соответственно соединены сшивающим агентом 144. Затем эпоксидная терминальная группа модифицированного субстрата 116 вступает в реакцию с биологическим веществом в виде фермента 120, который содержит нуклеофильную группу Z, на этапе A-4. Фермент иммобилизуется на субстрате с образованием конечного продукта 130. Также на этапе A-4 могут быть введены стабилизаторы, например, тиолы.
Ссылаясь на Фиг.1b, представлено схематическое изображение 200, на котором показан другой продукт, который может быть получен для того же варианта осуществления способа, который показан на Фиг.1a. Этапы, выполненные на Фиг.1b, аналогичны этапам Фиг.1a. Однако на этапе В-3 в реакции нуклеофильного замещения участвует более одной молекулы эпигалогенгидрина в нуклеофильных группах X и Y, в результате чего в субстрате образуется несколько эпоксидных групп. Соответственно полученный конечный модифицированный субстрат (216) отличается от модифицированного субстрата 116 в том, что субстрат 216 содержит дополнительные эпоксидные функциональные группы 242 в нуклеофильных группах X и Y. Затем модифицированный субстрат 216 может вступить в реакции иммобилизации аналогично этапу B-4 на Фиг.1a.
Ссылаясь на Фиг.2, представлено схематическое изображение одного варианта осуществления представленного способа 300 с использованием оксиран-функционализированных сшивающих агентов. Субстрат 310, содержащий гидроксильную группу сначала вступает в реакцию с эпигалогенгидрином, как показано на этапе C-1. Реакция приводит к освобождению галогена эпигалогенгидрина и протона гидроксильной группы, образуя гидроксильную связь таким образом, что полученный модифицированный субстрат 312 оказывается связанным с эпоксидной группой терминального конца. Затем субстрат 312, содержащий эпоксидную группу, на этапе C-2 вступает в реакцию с оксиран-функционализированным сшивающим агентом, обладающим общей формулой (1b):
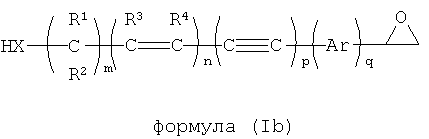
где X выбирается из NH, NR, NHO, NRO, O, S, Se, COO, CONH, CONR, CSS, COS, CONHO, CONRO, CONHNH, CONRNH, CONRNR, CNO, PH, PR;
R, R1, R2, R3, R4 независимо выбираются из группы, включающей водород, опционально замещенный алкил, опционально замещенный алкенил, опционально замещенный алкинил, опционально замещенный арил и опционально замещенный гетероарил; и
m, n, р и q являются целыми числами, независимо выбираемыми от 0 до 25.
После реакции со сшивающим агентом на этапе C-2 конечный модифицированный субстрат 314 содержит эпоксидную группу оксиран-функционализированного сшивающего агента на терминальном конце. Затем эпоксидная терминальная группа вступает в реакцию на этапе C-3 с биологическим веществом 320, содержащим нуклеофильную группу Z. В итоге биологическое вещество иммобилизуется на субстрате с получением конечного продукта 330.
Ссылаясь на Фиг.3, представлено схематическое изображение 400 конкретного примера способа, показанного на Фиг.1a, но в качестве сшивающего агента на этапе D-2 используется гександиамин, а в качестве первого и второго эпоксидсодержащих соединений на этапах D-1 и D-3 используется эпихлоргидрин. Итоговый модифицированный субстрат содержит одну эфирную функциональную группу 440 и, по крайней мере, одну эпоксидную функциональную группу 442, что продемонстрировано на субстрате 416. Он также может содержать несколько эпоксидных функциональных групп, как показано в модифицированных субстратах 450 и 452.
Ссылаясь на Фиг.4, представлено схематическое изображение 500 конкретного примера способа, показанного на Фиг.1b, в котором в качестве сшивающего агента на этапе E-2 используется глицидол. Полученный конечный продукт обозначен под позиционным обозначением 514.
Примеры
Далее будут подробно описаны варианты осуществления изобретения, не имеющие ограничительного характера, и сравнительные примеры со ссылками на конкретные Примеры, которые не следует воспринимать как каким-либо образом ограничивающие область настоящего изобретения.
Пример 1
Приготовление эпоксифункционализированного субстрата
Мерсеризацию и эпоксифункционализацию целлюлозы осуществляли посредством обработки интенсивно перемешанной суспензии 5,0 г целлюлозы в 100 мл 2,4М гидроксида натрия с 30 мл эпихлоргидрина при 55°C в течение 4 ч. Реакционную смесь фильтровали всасыванием и промывали твердый осадок («первичная эпоксицеллюлоза») водой ультравысокой чистоты (3×50 мл). Содержание эпоксидных групп в сухой первичной эпоксицеллюлозе составило 125 мкмоль/г (см. таблицу 1).
Реакцию первичной эпоксицеллюлозы (15,3 г влажного материала) осуществляли с 15 мл гександиамина (70% водный раствор) в 100 мл метанола при 23°C в течение 4 ч. Реакционную смесь фильтровали всасыванием и промывали один раз 100 мл метанола для получения 9,8 г влажной «аминоцеллюлозы». Присутствие первичных аминогрупп в продукте количественно оценивали по его реакции с нингидрином.
Затем осуществляли реакцию аминоцеллюлозы (9,6 г влажного материала) с 30 мл эпихлоргидрина в 100 мл метанола при 23°C в течение 4 ч. Реакционный продукт («вторичная эпоксицеллюлоза») получали фильтрацией всасыванием и промыванием холодной водой (3×100 мл). Содержание эпоксидных групп в сухой вторичной эпоксицеллюлозе составило 108 мкмоль/г (см. таблицу 1).
МЕТОД ДЛЯ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ ЭПОКСИДНЫХ ГРУПП
Пробу материала, содержащего эпоксидные группы (около 1 г влажного материала) суспендируют в 5 мл воды. Суспензию титруют 0,01Н HCl до нейтрального показателя pH при необходимости. Нейтральную суспензию обрабатывают 5 мл 1,ЗМ водного раствора тиосульфата натрия с последующим инкубированием в течение 15 минут с периодическим взбалтыванием. Затем суспензию титруют 0,01Н HCl бромфенолом синим. Общее количество эпоксидных групп, присутствующих в пробе, эквивалентно количеству HCl, потребленному при титровании. Содержание эпоксидных групп в сухом материале вычисляется на основании содержания воды (потеря при сушке) во влажном материале. Репрезентативные экспериментальные значения сведены в таблице 1.
Пример 2
Иммобилизация уреазы
Вторичную эпоксицеллюлозу, приготовленную в Примере 1 (12,5 г влажного материала) суспендировали в охлажденном растворе уреазы канавалии мечевидной (4,2 г) в 150 мл 1,0М буфера фосфата калия при рН 7,5. Реакцию иммобилизации осуществляли в инкубаторном шейкере при 4°C в течение 24 ч.
Затем реакционную смесь фильтровали всасыванием, и остаток («иммобилизованная уреаза») промывали 3 раза холодной ультрачистой водой (3×150 мл).
ПОСТИММОБИЛИЗАЦИОННАЯ ОБРАБОТКА ИММОБИЛИЗОВАННОЙ УРЕАЗЫ
Иммобилизованную уреазу пропитывали водным раствором цистеина (5 мг/мл), этилендиаминтетрауксусной кислоты (ЭДТА, 1,0 мМ) и глюкозы (0,2 г/мл) в течение 10 мин, после чего фильтровали всасыванием и лиофилизировали в течение 24 ч.
Сравнительные примеры
ТАБЛИЦЫ
Область применения
Представленный способ приготовления субстрата является экономичным и эффективным способом производства субстрата, на котором возможно осуществление иммобилизации функциональных веществ. Предпочтительно способ обеспечивает устойчивую иммобилизацию функциональных веществ, таких как ферменты, на субстрате, произведенном в соответствии с данным способом. Более предпочтительно, поскольку ферменты устойчиво прикрепляются к субстрату, субстрат можно в течение долгого времени использовать повторно без существенной потери его ферментных свойств.
Поскольку в представленном способе также используются низкозатратные исходные материалы, общие производственные затраты существенно снижаются при использовании способа в крупномасштабном производстве субстратов. Кроме того, химический сшивающий агент между субстратом, таким как твердая подложка, и функциональным веществом является негидролизуемым. Более предпочтительно, инертность сшивающего агента также повышает устойчивость иммобилизованного функционального вещества в связи со сниженной возможностью расщепления сшивающего агента вследствие нежелательных химических реакций.
Представленный способ также позволяет пользователю регулировать расстояние между активными оксирановыми группами и субстратом. Когда оксирановые группы находятся на подходящем расстоянии от субстрата, их реакционная способность в отношении иммобилизации функциональных веществ повышается в связи со снижением стерических затруднений. Кроме того, для обеспечения высокого содержания эпоксидных групп возможен подбор сшивающего агента, что способствует высокой нагрузке функциональных веществ. Более предпочтительно сшивающий агент может также быть выбран таким образом, чтобы он в своей основе обладал определенными желательными химическими свойствами. Например, при выборе диаминовых связывающих агентов полученный конечный субстрат может обладать внутренней характеристикой pH-буферизации. Это особенно полезно в случаях применения наподобие перитонеального диализа, при которых срок службы и эффективность сорбента может подвергаться отрицательному воздействию при высоком или низком показателе pH.
Способ также обеспечивает простую послесборочную модификацию стандартных диализных мембран, таких как диализаторы на ацетатцеллюлозной основе, для уреазы. Уреаза может быть иммобилизована после сборки, и также может быть иммобилизована только на лицевой стороне мембраны.
Субстрат, полученный в соответствии с представленным способом, также обеспечивает иммобилизацию на нем биологического вещества, осуществляемую простым, надежным и удобным способом. Например, иммобилизация биологического вещества легко может быть осуществлена на лабораторном уровне. Это связано с возможностью осуществления иммобилизации биологического вещества при температурах окружающей среды (например, при комнатных температурах) в водном/буферном растворе без необходимости использования дополнительных химикатов или реактивов. Предпочтительно отсутствие дополнительных химикатов и реактивов в значительной мере способствует очистке иммобилизованного продукта. Иммобилизованный функциональный материал, полученный в соответствии с представленным способом, также может быть нетоксичным, биоразлагаемым и биологически совместимым. Предпочтительно это обеспечивает возможность применения субстрата в медицинских целях, таких как, например, в диализе в качестве сорбента для удаления нежелательных побочных продуктов из тела человека. Кроме того, данные свойства также обеспечивают возможность применения продукта в экологических целях, таких как водоочистка, почвенная очистка сточных вод или переработка отходов.
Кроме того, представленный способ и субстрат могут также быть использованы в любой из следующих областей применения: аффинная хроматография, твердофазные материалы для хроматографии (хиральной), молекулярный импринтинг, иммобилизация красителей, сенсоры, биосенсоры, органические фильтры для селективной абсорбции токсинов, фармацевтическое применение (оболочка и наполнитель), твердофазные ионообменники, твердофазные акцепторы металлов и антиоксиданты.
Хотя эквивалентные варианты осуществления настоящего изобретения были достаточно подробно описаны выше, для специалистов в данной области техники после изучения вышеуказанной информации будет очевидно, что возможны различные модификации и адаптации изобретения, не выходящие за рамки объема и сущности настоящего изобретения, и подразумевается, что все такие модификации и адаптации находятся в рамках объема притязаний нижеследующей формулы изобретения.
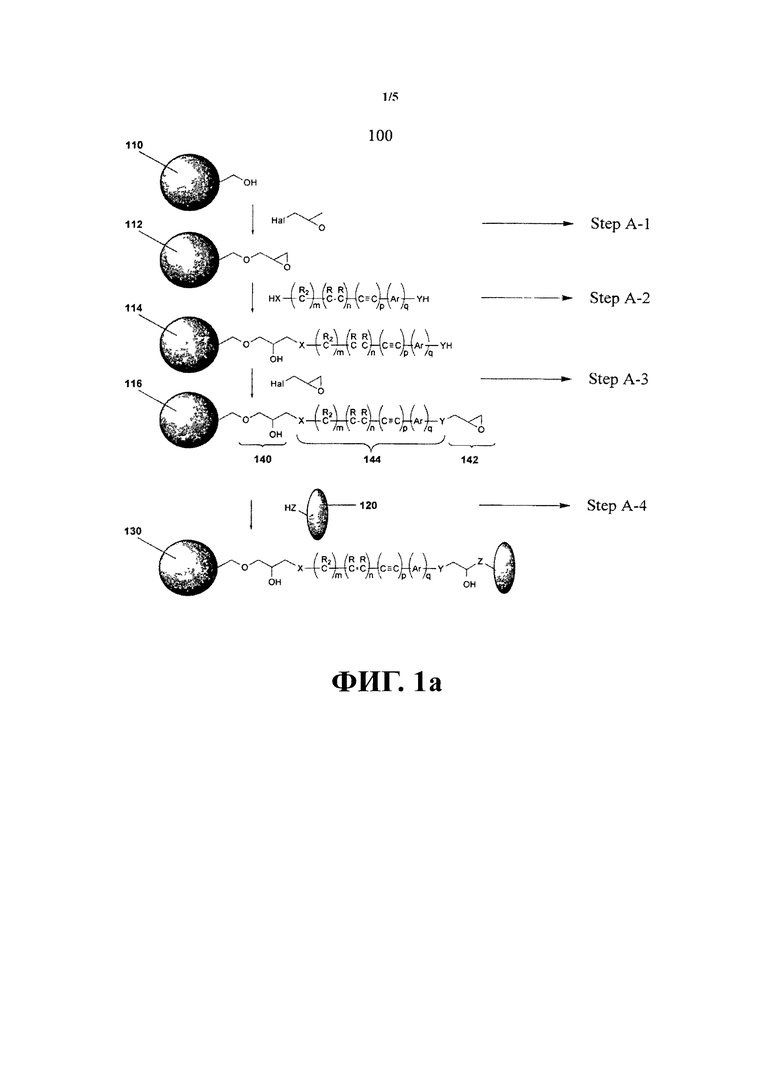
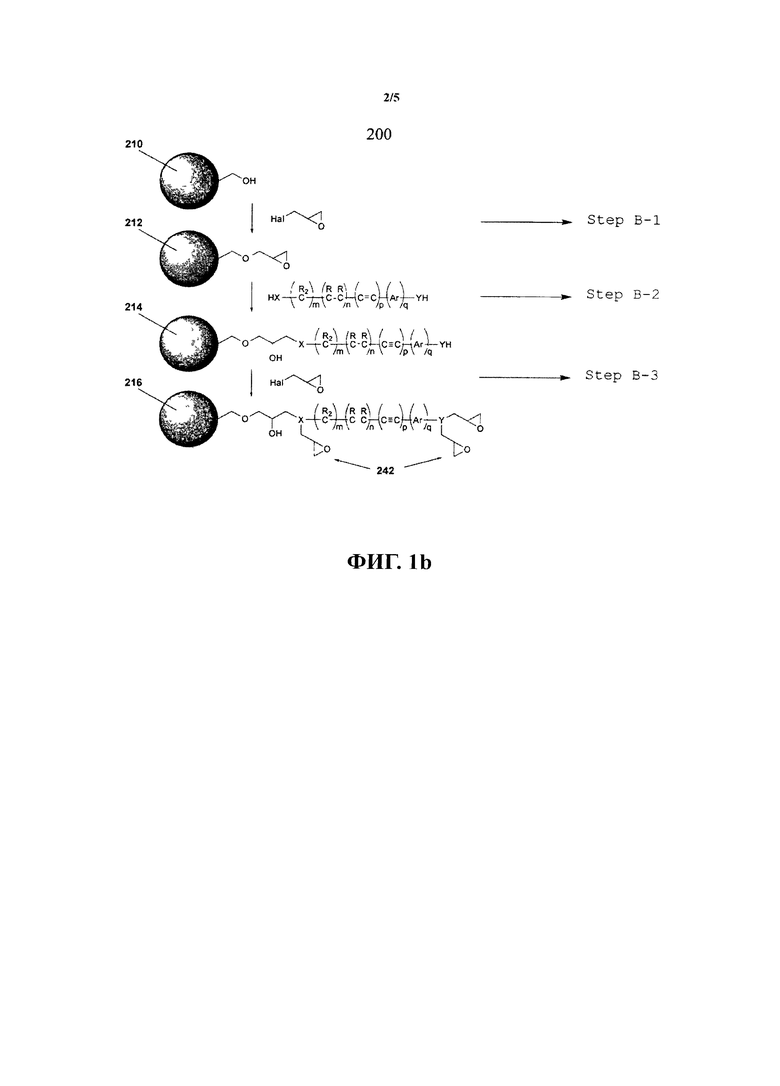
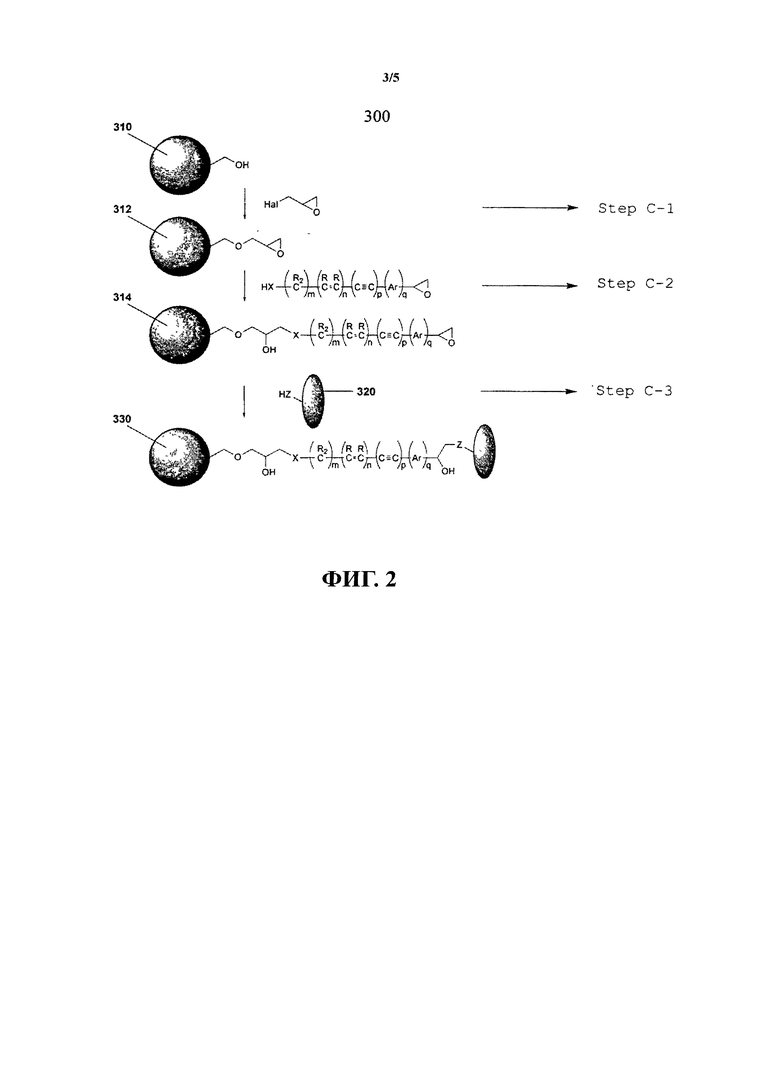
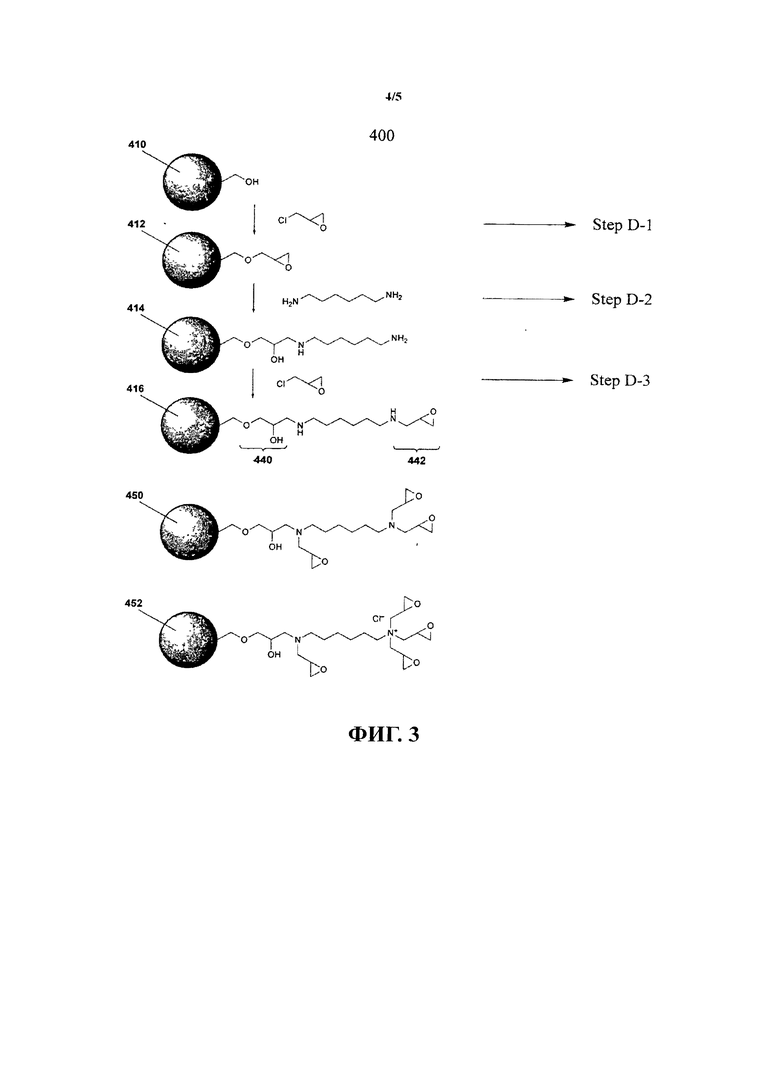
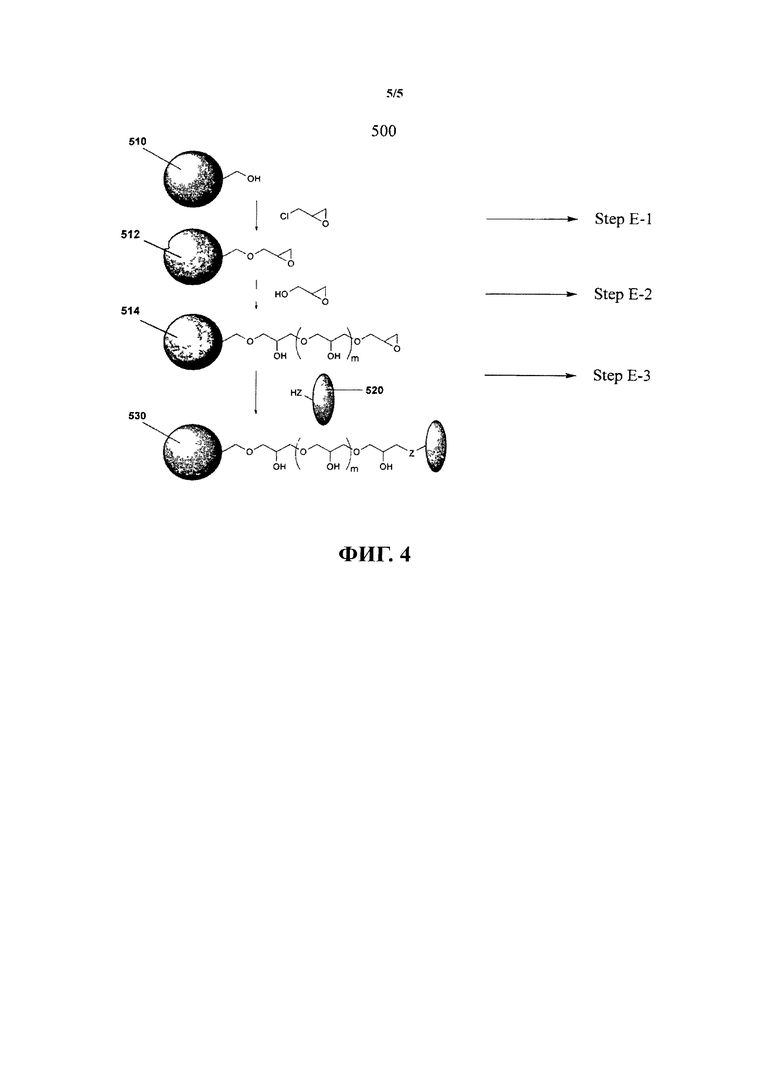
Изобретение относится к субстрату для иммобилизации функциональных групп, а также к способам приготовления данного субстрата и картриджу с сорбентом для использования в устройстве диализа. Субстрат содержит соединения, предназначенные для иммобилизации функциональных молекул, при этом каждое соединение содержит цепочку, включающую: функциональную группу R, химически связанную с субстратом, при этом указанная функциональная группа R выбирается из группы, включающей: эфир, сложный эфир, карбонильную группу, сложный эфир карбоната, тиоэфир, дисульфид, сульфинил, сульфонил и карбонотиоил, амин, амид, карбамат, мочевины и гуанидины; и эпоксидсодержащую функциональную группу, соединенную с функциональной группой R сшивающим агентом, включающим, по крайней мере, одну нуклеофильную группу, выбранную из группы включающей амин, гидроксил и тиол; при этом функциональная молекула состоит из фермента, который выбирается из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу К. 6 н. и 43 з.п. ф-лы, 4 ил., 3 табл.
1. Субстрат, содержащий соединения, предназначенные для иммобилизации функциональных молекул, при этом каждое соединение содержит цепочку, включающую:
функциональную группу R, химически связанную с субстратом, при этом указанная функциональная группа R выбирается из группы, включающей: эфир, сложный эфир, карбонильную группу, сложный эфир карбоната, тиоэфир, дисульфид, сульфинил, сульфонил и карбонотиоил, амин, амид, карбамат, мочевины и гуанидины; и
эпоксидсодержащую функциональную группу, соединенную с функциональной группой R сшивающим агентом, включающим, по крайней мере, одну нуклеофильную группу, выбранную из группы включающей амин, гидроксил и тиол;
отличающийся тем, что функциональная молекула, состоит из фермента, который выбирается из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу К.
2. Субстрат по п. 1, содержащий дополнительную эпоксидсодержащую группу, соединенную с цепочкой.
3. Субстрат по п. 2, отличающийся тем, что количество дополнительных эпоксидсодержащих групп выбирается из числа 1, 2, 3, 4 или 5.
4. Субстрат по п. 2, отличающийся тем, что, по крайней мере, одна из дополнительных эпоксидсодержащих групп соединена с указанной цепочкой нуклеофильной группой указанного сшивающего агента.
5. Субстрат по п. 3, отличающийся тем, что указанный сшивающий агент содержит дополнительные нуклеофильные группы, к которым, к указанной цепочке, присоединяются указанные дополнительные эпоксидсодержащие группы.
6. Субстрат по п. 5, отличающийся тем, что указанные дополнительные эпоксидсодержащие группы отсоединяются от цепочки, соединяясь при этом с дополнительными нуклеофильными группами указанного сшивающего агента.
7. Субстрат по п. 1, отличающийся тем, что нуклеофильная группа указанного сшивающего агента является амином.
8. Субстрат по п. 1, отличающийся тем, что сшивающий агент выбирается из группы, содержащей насыщенные и ненасыщенные алифатические и ароматические амины, диамины и триамины.
9. Субстрат по п. 8, отличающийся тем, что алифатические группы указанных аминов являются алкильными группами.
10. Субстрат по п. 1, отличающийся тем, что сшивающий агент содержит эпоксидную группу.
11. Субстрат по п. 1, отличающийся тем, что сшивающий агент содержит, по меньшей мере, одно из динуклеофильных соединений и полинуклеофильных соединений.
12. Субстрат по п. 11, отличающийся тем, что сшивающий агент выбирается, по крайней мере, из одного алкилдиамина и алкендиамина.
13. Субстрат по п. 11, отличающийся тем, что сшивающий агент выбирается, по крайней мере, из одного этандиамина, пропандиамина, бутандиамина, пентандиамина, гександиамина.
14. Субстрат по п. 1, отличающийся тем, что эпоксидсодержащее соединение образуется путем реакции эпигалогенгидрина с нуклеофильными группами указанного сшивающего агента.
15. Субстрат по п. 1, отличающийся тем, что субстрат содержит полимер.
16. Субстрат по п. 15, отличающийся тем, что полимер является биологически совместимым полимером.
17. Субстрат по п. 16, отличающийся тем, что биологически совместимый полимер выбирается из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, полиакрилатный субстрат и субстрат на основе полисахарида.
18. Субстрат по п. 16, отличающийся тем, что субстрат на основе полисахарида выбирается из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы.
19. Субстрат по п. 15, отличающийся тем, что полимер является биополимером.
20. Субстрат по п. 1, отличающийся тем, что субстрат далее содержит покрытие, расположенное на указанном субстрате, включающее в основном гомогенную смесь стабилизирующих добавок, выбранных для стабилизации указанной функциональной молекулы.
21. Субстрат по п. 20, отличающийся тем, что стабилизирующие добавки выбираются из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
22. Способ иммобилизации функциональной молекулы на субстрате, содержащий этап экспонирования функциональной молекулы на субстрат, по п. 1.
23. Способ по п. 22, содержащий этап нанесения на поверхность субстрата в основном гомогенной смеси стабилизирующих добавок, отличающийся тем, что указанные добавки выбираются для стабилизации указанной функциональной молекулы.
24. Способ по п. 23, отличающийся тем, что этап нанесения в основном гомогенной смеси добавок включает испарение растворителя раствора указанных добавок на субстрате.
25. Способ по п. 23, отличающийся тем, что стабилизирующие добавки выбираются из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
26. Способ приготовления субстрата для иммобилизации на нем функциональных молекул, включающий следующие этапы:
(i) обеспечение электрофильных соединений, соединенных с поверхностью субстрата;
(ii) обеспечение участия электрофильных соединений в реакции нуклеофильного замещения для получения посредством нее нуклеофильной группы и тем самым повышения нуклеофильности поверхности субстрата;
(iii) обеспечение участия нуклеофильной группы в реакции нуклеофильного замещения с другим электрофильным соединением для получения электрофильной группы на поверхности субстрата и тем самым повышения электрофильности субстрата;
каждое электрофильное соединение по этапу (iii) соединено с указанной функциональной молекулой, состоящей из фермента, который выбирается из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу К.
27. Способ по п. 26, отличающийся тем, что этапы (ii) и (iii) могут быть повторены n-е количество раз для образования n-го количества поколений электрофильных групп на указанном субстрате.
28. Способ по п. 26, отличающийся тем, что указанный этап обеспечения электрофильных соединений, соединенных с поверхностью субстрата, включает образование химической связи электрофильного соединения с субстратом.
29. Способ по п. 28, отличающийся тем, что указанный этап (ii) включает этап реакции нуклеофила с первым электрофильным соединением.
30. Способ по п. 29, отличающийся тем, что этап (iii) включает химическое соединение второго электрофильного соединения с нуклеофилом.
31. Способ по п. 26, отличающийся тем, что электрофильное соединение является эпоксидсодержащим соединением.
32. Способ по п. 31, отличающийся тем, что эпоксидсодержащее соединение является эпигалогенгидрином.
33. Способ по п. 26, отличающийся тем, что нуклеофил является динуклеофилом.
34. Способ по п. 33, отличающийся тем, что нуклеофил содержит амин.
35. Способ по п. 34, отличающийся тем, что амин выбирается из группы, включающей насыщенные и ненасыщенные алифатические или ароматические амины и полиамины.
36. Способ по п. 35, отличающийся тем, что алифатическая группа указанных аминов и полиаминов выбирается из алкильной группы.
37. Способ по п. 36, отличающийся тем, что полиамин выбирается, по крайней мере, из одного этандиамина, пропандиамина, бутандиамина, пентандиамина, гександиамина.
38. Способ по п. 26, отличающийся тем, что субстрат содержит полимер.
39. Способ по п. 38, отличающийся тем, что полимер является биологически совместимым полимером.
40. Способ по п. 39, отличающийся тем, что биологически совместимый полимер может быть выбран из группы, включающей субстрат на основе сложного полиэфира, полиамидный субстрат, полиакрилатный субстрат и субстрат на основе полисахарида.
41. Способ по п. 40, отличающийся тем, что субстрат на основе полисахарида выбирается из группы, включающей хлопковый пух, хлопковую целлюлозу, хлопчатобумажные ткани, целлюлозное волокно, целлюлозные шарики, целлюлозный порошок, микрокристаллическую целлюлозу, целлюлозные мембраны, вискозное волокно, целлофан, ацетатцеллюлозу, ацетатцеллюлозные мембраны, хитозан, хитин, производные декстрана и производные агарозы.
42. Способ по п. 41, отличающийся тем, что полимер является биополимером.
43. Способ по п. 26, содержащий этап нанесения на поверхность субстрата в основном гомогенной смеси стабилизирующих добавок, отличающийся тем, что указанные стабилизирующие добавки выбираются для стабилизации указанной функциональной молекулы.
44. Способ по п. 43, отличающийся тем, что этап нанесения в основном гомогенной смеси добавок включает испарение растворителя раствора указанных добавок на субстрате.
45. Способ по п. 43, отличающийся тем, что стабилизирующие добавки выбираются из группы, включающей сахар, органическую кислоту, аминокислоту, сахарную кислоту и тиол.
46. Картридж с сорбентом для использования в устройстве диализа, включающий субстрат по п.1 для иммобилизации уреазы.
47. Использование субстрата по п. 1 в устройстве диализа.
48. Способ модификации диализной мембраны для иммобилизации на ней функциональных молекул, включающий следующие этапы:
(i) соединение электрофильных соединений с поверхностью мембраны;
(ii) обеспечение участия электрофильных соединений в реакции нуклеофильного замещения для получения посредством нее нуклеофильной группы и тем самым повышения нуклеофильности поверхности мембраны; и
(iii) обеспечение участия нуклеофильной группы в реакции нуклеофильного замещения с другим электрофильным соединением для получения электрофильной группы на поверхности мембраны и тем самым повышения параметра нуклеофильности поверхности мембраны для иммобилизации на ней функциональных молекул;
каждое электрофильное соединение по этапу (iii) соединено с указанной функциональной молекулой, состоящей из фермента, который выбирается из группы, включающей уреазу, уриказу, креатининазу, липазы, эстеразы, целлюлазы, амилазы, пектиназы, каталазы, ацилазу, каталазу, эстеразу, пенициллинамидазу, протеиназу К.
49. Способ по п. 48, отличающийся тем, что мембрана является ацетатцеллюлозной мембраной.
| МЕТАЛЛИЧЕСКИЕ ПОВЕРХНОСТИ С ПОКРЫТИЕМ ИЗ ПОЛИАМИДА | 2003 |
|
RU2258006C2 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| Способ приготовления пищевого продукта сливкообразной консистенции | 1917 |
|
SU69A1 |
Авторы
Даты
2016-11-20—Публикация
2011-02-18—Подача