Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения специфических дифференцированных клеток, и к клеткам, полученным данным способом. В частности, настоящее изобретение относится к способу получения дифференцированных клеток крови, и к клеткам крови, полученным указанным способом.
Предшествующий уровень техники
Когда для лечения заболевания требуются специфические клетки, необходимо обеспечить достаточное количество клеток для достижения лечебных задач. Однако получить достаточное количество клеток, используемых для лечения, из живых организмов трудно. Поэтому были разработаны такие способы, как способ приготовления целевых клеток ex vivo путем индукции дифференцировки клеток-предшественников или подобные ему.
При лечении гематологических заболеваний или выполнении хирургических процедур, требуются клетки крови, используемые для указанного лечения. Из клеток крови особенно востребованы тромбоциты, необходимые для коагуляции крови (гемостаза), и мегакариоцитарные клетки, ответственные за продукцию протромбоцитов и последующее образование тромбоцитов. В частности, тромбоциты особенно востребованы при лечении лейкемии, при трансплантации костного мозга, терапии онкологических заболеваний, и поэтому имеется существенная потребность в стабильных поставках тромбоцитов. Способы, используемые для получения тромбоцитов, включают не только способ сбора крови от доноров, но также способ применения ТПО-миметических продуктов, способ дифференцировки мегакариоцитарных клеток из пуповинной крови или миелоидных клеток, и так далее. Кроме того, созданы такие способы, как способ приготовления клеток крови из гемопоэтических стволовых клеток или гемопоэтических клеток-предшественников после размножения этих клеток- предшественников ex vivo. Примеры описанных способов включают способ получения линии гемопоэтических клеток из эмбриональных стволовых клеток мыши (патентный документ 1), способ дифференцировки эмбриональных стволовых клеток у приматов в гемопоэтические клетки (патентный документ 2), и способ легкого и стабильного размножения С034-позитивных/С038-негативных клеток, поддерживающих отсутствие дифференцировки гемопоэтических стволовых клеток ех vivo (патентный документ 3).
При индукции дифференцировки клеток, особенно удобными являются плюрипотентные стволовые клетки. Плюрипотентные стволовые клетки, такие как ЭС (эмбриональные стволовые) клетки и ИПС (индуцированные плюрипотентные стволовые) клетки, могут применяться в качестве источника искусственно получаемых клеток крови, таких как тромбоциты. В последние годы получение ИПС клеток способствовало повышению внимания к использованию плюрипотентных стволовых клеток в качестве важного источника для клеточной терапии в регенеративной медицине. Например, Takayama и др. индуцировали дифференцировку человеческих ЭС клеток в мегакариоцитарные клетки и тромбоциты, обеспечив возможность применения тромбоцитов, дифференцированных из ЭС клеток, в качестве источника трансфузии тромбоцитов (патентный документ 4 и не патентный документ 1). Авторы указанного изобретения дополнительно разработали способ получения мегакариоцитарных клеток и тромбоцитов из ИПС клеток, что сделало возможным решение проблемы совместимости человеческого лейкоцитарного антигена (HLA), неизбежной при трансфузии тромбоцитов, полученных из ЭС клеток. Хотя стабильная поставка достаточного количества тромбоцитов из крови доноров обычно затруднена из-за таких факторов, как хронический дефицит доноров, эта проблема кажется разрешимой путем индукции дифференцировки тромбоцитов из ЭС клеток или ИПС клеток. В соответствии с предполагаемыми способами, однако, лишь небольшое количество тромбоцитов можно получить из ИПС клеток или ЭС клеток, и кроме того, каждый раз нужно проводить ряд операций для их получения. Таким образом, необходимо обеспечить усовершенствованный, эффективный способ для обеспечения стабильного количества тромбоцитов.
Проблема, которую необходимо решить для обеспечения стабильного запаса достаточного количества клеток крови, таких как мегакариоцитарные клетки и тромбоциты, также существует при получении других типов клеток.
Таким образом, даже в случае получения необходимых клеток путем индукции дифференцировки клеток, нелегко приготовить клетки-предшественники для необходимых клеток в большом количестве, так что в настоящее время трудно обеспечить достаточное количество терминально-дифференцированных необходимых клеток.
Документы из предшествующего уровня техники
Патентные документы
Патентный документ 1: Опубликованная Японская патентная заявка №2006-141356
Патентный документ 2: Опубликованная Японская патентная заявка №2004-350601
Патентный документ 3: Опубликованная Японская патентная заявка №2006-61106
Патентный документ 4: WO 2008/041370
Не патентные документы
Не патентный документ 1: Takayama et al.. Blood, 111: 5298-5306, 2008.
Изложение сущности изобретения
Проблемы, решаемые настоящим изобретением
В отношении клеток крови, авторы настоящего изобретения разработали способ получения мегакариоцитов и тромбоцитов из ИПС клеток. Однако перед клиническим применением данного способа его необходимо усовершенствовать так, чтобы было возможно получать мегакариоциты и тромбоциты в большом количестве. Также важно обеспечить быстрое и стабильное получение тромбоцитов в соответствии с потребностью для реализации будущих клинических приложений.
С учетом вышеизложенных обстоятельств, настоящее изобретение обеспечивает способ получения целевых клеток посредством индукции дифференцировки клеток путем увеличения способности клеток к росту на необходимой стадии дифференцировки и размножения клеток для получения целевых клеток из этих клеток.
Настоящее изобретение также обеспечивает необходимые дифференцированные клетки крови с применением этого способа. В частности, настоящее изобретение обеспечивает мегакариоцитарную клетку-предшественник с высокой способностью к росту, которая служит в качестве источника зрелых мегакариоцитарных клеток и тромбоцитов, и способ получения таких мегакариоцитарных клеток-предшественников.
Кроме того, настоящее изобретение имеет своей задачей обеспечение способа получения зрелых мегакариоцитарных клеток и тромбоцитов из мегакариоцитарных клеток-предшественников стабильно в больших количествах, а также обеспечение зрелых мегакариоцитарных клетков, полученных этим способом, и тромбоциты, дифференцированные при индукции из зрелых мегакариоцитарных клеток.
Настоящее изобретение также имеет своей задачей обеспечение способа получения эритроидных клеток и эритроидных клеток, полученных этим способом, поскольку стабильный запас эритроидных клеток требуется в такой же степени, как и для тромбоцитов.
Кроме того, настоящее изобретение имеет своей задачей обеспечение долговременной консервации мегакариоцитарных клеток-предшественников, т.е. мегакариоцитарных клеток в незрелом состоянии, являющихся клетками-предшественниками тромбоцитов. Средства решения проблемы В результате сравнения мегакариоцитарной и тромбоцитарной продуктивности ИПС клеток, полученных с применением четырех генов (ОСТ3/4, SOX2, K.LF-4, c-MYC), и ИПС клеток с применением трех генов (ОСТ3/4, SOX2, KLF-4), отличных от c-MYC, авторы настоящего изобретения установили, что ИПС клетки с четырьмя генами продуцируют мегакариоциты и тромбоциты значительно более эффективно. Авторы настоящего изобретения также установили, что хотя экспрессия четырех генов, введенных в ходе создании линии, подавляется в ИПС клетках, реактивация гена c-MYC индуцируется с мегакариоцитарной дифференцировкой, что связано с увеличением продукции мегакариоцитов. Авторы настоящего изобретения далее установили, что мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в которых принудительно экспрессируется ген c-MYC, приобретают высокую способность к росту.
Обычно в случае когдаонкоген, такой как c-MYC, экспрессируется в клетках в избыточном количестве, наблюдается развитие клеточного цикла и активация роста. Известно, что эти клетки воспринимают рост как стресс, и индуцируют защитный ответ (онкоген-индуцированное старение: ОИС) для подавления стресса, препятствуя таким образом избыточному клеточному росту. Авторы настоящего изобретения заметили данное явление и в дальнейшем открыли способ получения специфических дифференцированных клеток в большом количестве путем регуляции ОИС клеток на стадии дифференцировки.
Настоящее изобретение было выполнено на основе вышеупомянутых открытий.
Таким образом, настоящее изобретение относится к следующим аспектам (1)-(30).
(1) Способ получения специфических клеток путем индукции дифференцировки клеток, где онкоген принудительно экспрессируется в клетках на необходимой стадии дифференцировки для размножения клеток на необходимой стадии дифференцировки.
(2) Способ получения специфических клеток по вышеуказанному пункту (1), в котором супрессируется онкоген-индуцированное старение, которое индуцируется усиленной экспрессией онкогена в клетках на необходимой стадии дифференцировки.
(3) Способ получения специфических клеток в соответствии с вышеуказанными пунктами (1) или (2), в котором супрессия онкоген-индуцированного старения достигается путем экспрессии гена polycomb.
(4) Способ получения специфических клеток в соответствии с любым из вышеуказанных пунктов (1)-(3), где клетки на необходимой стадии дифференцировки являются клетками, полученными при индукции дифференцировки из ЭС клеток или ИПС клеток.
(5) Способ получения специфических клеток по любому из вышеуказанных пунктов (1)-(4), в котором на необходимой стадии дифференцировки в клетки вводят экзогенный онкоген, или онкоген и ген polycomb, и принудительно экспрессируют введенный онкоген или введенные онкоген и ген polycomb.
(6) Способ получения специфических клеток в соответствии с вышеупомянутым пунктом (5), в котором на необходимой стадии дифференцировки в клетки-предшественники вводят экзогенный онкоген или ген polycomb, и принудительно экспрессируют введенный онкоген или введенные онкоген и ген polycomb.
(7) Способ получения специфических клеток по любому из вышеуказанных пунктов (5) или (6), в котором онкоген и/или ген polycomb каждый функционально связан со стороной индуцируемого промотора в направлении транскрипции, и сцепленный онкоген или сцепленные онкоген и ген polycomb принудительно экспрессируются за счет индукции.
(8) Способ получения специфических клеток по любому из вышеуказанных пунктов (5)-(7), в котором на необходимой стадии дифференцировки в клетках супрессируется экспрессия онкогена или экспрессия онкогена и гена polycomb для стимулирования дифференцировки клеток на необходимой стадии дифференцировки.
(9) Способ получения специфических клеток в соответствии с вышеупомянутым пунктом (8), в котором супрессия экспрессии онкогена или экспрессии онкогена и гена polycomb достигается путем функционального связывания онкогена или онкогена и гена polycomb со стороной супрессирующего промотора в направлении транскрипции, подавленяя таким образом экспрессию онкогена или экспрессии онкогена и гена polycomb.
(10) Способ получения специфических клеток по любому из вышеуказанных пунктов (1)-(9), в котором онкогеном является ген семейства MYC.
(11) Способ получения специфических клеток по любому из вышеуказанных пунктов (3)-(10), в котором геном polycomb является BMI1.
(12) Способ получения специфических клеток по любому из вышеупомянутых пунктов (6)-(11), в котором клетками-предшественниками для клеток на необходимой стадии дифференцировки являются гемопоэтические клетки-предшественники, клетками на необходимой стадии дифференцировки являются мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, а специфическими клетками являются зрелые мегакариоцитарные клетки.
(13) Способ получения специфических клеток по любому из вышеупомянутых пунктов (6)-(11), в котором клетками-предшественниками для клеток на необходимой стадии дифференцировки являются гемопоэтические клетки-предшественники, клетками на необходимой стадии дифференцировки являются мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, а специфическими клетками являются тромбоциты.
(14) Способ получения специфических клеток по любому из вышеупомянутых пунктов (12) или (13), в котором гемопоэтические клетки-предшественники расположены в сетчатой структуре, изготовленной из ЭС клеток или ИПС клеток.
(15) Зрелая мегакариоцитарная клетка, являющаяся специфической клеткой, полученной способом по любому из вышеупомянутых пунктов (12) или (14).
(16) Тромбоцит, являющийся специфической клеткой, полученной способом по любому из вышеупомянутых пунктов (13) или (14).
(17) Продукт крови, содержащий в качестве активного ингредиента тромбоцит по вышеупомянутому пункту (16).
(18) Набор для получения зрелой мегакариоцитарной клетки по вышеупомянутому пункту (15) или тромбоцита по вышеупомянутому пункту (16).
(19) Клетка крови на необходимой стадии дифференцировки, в которой принудительно экспрессируется онкоген.
(20) Клетка крови по вышеупомянутому пункту (19), в которой также принудительно экспрессируется ген polycomb.
(21) Клетка крови по любому из вышеупомянутых пунктов (19) или (20), при этом указанная клеткой крови на необходимой стадии дифференцировки является клетка, полученная при индукции дифференцировки из ЭС клетки или ИПС клетки.
(22) Клетка крови по любому из вышеупомянутых пунктов (19)-(21), при этом в клетку крови на необходимой стадии дифференцировки введены экзогенный онкоген или онкоген и ген polycomb, и введенный онкоген или введенные онкоген и ген polycomb принудительно экспрессируются.
(23) Клетка крови по вышеупомянутому пункту (22), при этом в клетку-предшественник для клетки крови на необходимой стадии дифференцировки введены экзогенный онкоген или ген polycomb, и введенный онкоген или введенные онкоген и ген polycomb принудительно экспрессируются.
(24) Клетка крови по любому из вышеупомянутых пунктов (22) или (23), где онкоген и/или ген polycomb каждый функционально связаны со стороной индуцируемого промотора в направлении транскрипции, и связанный онкоген или связанные онкоген и ген polycomb принудительно экспрессируются за счет индукции.
(25) Клетка крови по любому из вышеупомянутых пунктов (19)-(24), в которой онкогеном является ген семейства МУС.
(26) Клетка крови по любому из вышеупомянутых пунктов (20)-(25), в которой геном polycomb является BMI 1.
(27) Клетка крови по любому из вышеупомянутых пунктов (23)-(26), в которой клеткой-предшественником для клетки крови на необходимой стадии дифференцировки является гемопоэтическая клетка-предшественник, а клеткой крови на необходимой стадии дифференцировки является мегакариоцитарная клетка-предшественник с пре-мультинуклеацией.
(28) Клетка крови по вышеупомянутому пункту (27), при этом гемопоэтическая клетка-предшественник расположена в сетчатой структуре, изготовленной из ЭС клетки или ИПС клетки.
(29) Замороженная клеточная композиция, содержащая клетку крови по любому из вышеупомянутых пунктов (19)-(28).
(30) Набор для получения мегакариоцитарной клетки-предшественника с премультинуклеацией, являющейся клеткой крови в соответствии с вышеупомянутыми пунктами (27) или (28).
Полезный эффект изобретения
В соответствии с настоящим изобретением можно размножать клетки на необходимой стадии дифференцировки, а также получать в большом количестве специфические клетки, дифференцированные из размноженных клеток.
В дополнение к этому, при применении настоящего изобретения для получения дифференцированных клеток крови, можно стабильно в большом количестве получать клетки крови, такие как мегакариоцитарные клетки и тромбоциты, из плюрипотентных стволовых клеток.
Кроме того, клетки крови, полученные в соответствии с настоящим изобретением, можно подвергать криоконсервированию. Например, когда в качестве клеток крови получают мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, указанные клетки можно подвергать криоконсервации. Следовательно, можно производить зрелые мегакариоцитарные клетки и тромбоциты, полученные из того же самого источника мегакариоцитарных клеток-предшественников.
В частности, в способе в соответствии с настоящим изобретением мегакариоцитарные клетки-предшественники без мульти-полиплоидизации (клетки-предшественники зрелых мегакариоцитарных клеток), которые можно подвергать криоконсервации, могут быть получены из ИПС клеток в большом количестве. С применением этих мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве источника, можно получать и наладить производство достаточного количества тромбоцитов для многократного переливания крови, устраняя в то же время проблему совпадения по HLA (человеческим лейкоцитарным антигенам).
Кроме того, в соответствии с настоящим изобретением обеспечивается способ стабильного получения эритроидных клеток in vitro.
Краткое описание чертежей
Фиг.1 является графиком для сравнения числа мегакариоцитарных клеток, полученных от четырехфакторных ИПС клеток и трехфакторных ИПС клеток. По вертикальной оси представлено число СD42b-положительных мегакариоцитарных клеток, полученных из каждой клетки, где число полученных из ЭС клетки CD42b-положительных мегакариоцитарных клеток на 22 день культивирования установлено равным 1. По горизонтальной оси представлено число дней после инкубации культуры ИПС клеток и ЭС клеток. «3-f» указывает на клеточную линию, полученную из треефакторной ИПС клетки, «4-f» - указывает на клеточную линию, полученную из четырехфакторной ИПС клетки, а «ЭС» указывает на ЭС клетки.
Фиг.2 является изображением для подтверждения реактивации трансгенов в мегакариоцитарных клетках человека, полученных из ИПС клетки. Экспрессию каждого трансгена (ОСТЗ/4, SOX2, KLF-4, c-MYC) в четырехфакторных ИПС клетках (TkDA3-2, TkDA3-4, и TkDA3-5) и трехфакторных ИПС клетках (TkDN4-M) оценивали для недифференцированных ИПС клеток и дифференцированных мегакариоцитарных клеток. Также оценивали экспрессию каждого гена, введенного в человеческие дермальные фибробласты (HDF) в качестве контроля введения гена. «Эндо» указывает на эндогенный ген, a «Tg» указывает на трансген. Также оценивали экспрессию REX1 и NANOG для недифференцированных ИПС клеток.
На Фиг.3 показано повышение числа мегакариоцитарных клеток за счет принудительной экспрессии c-MYC в гемопоэтических клетках-предшественниках, полученных из ЭС клеток. Клетки-предшественники крови экстрагировали из сетечатой структуры на 15 сутки культивирования ЭС клеток человека, каждый из генов (ОСТЗ/4, SOX2, KLF-4, c-MYC) по отдельности вводили в клетки-предшественники крови, и подсчитывали число мегакариоцитарных клеток, полученных со временем. По вертикальной оси представлено число С042b-положительных мегакариоцитарных клеток, полученных из каждой клетки, где число СВ42b-положительных мегакариоцитарных клеток, полученных из гемопоэтической клетки-предшественника (имитации), в которую был введен только один вирусный вектор, установлено равным 1. По горизонтальной оси представлено число дней после начала культивирования ЭС клеток.
Фиг.4 является графиком для сравнения числа тромбоцитов, полученных из четырехфакторных ИПС клеток и трехфакторных ИПС клеток. По вертикальной оси представлено число тромбоцитов, полученных из каждой клетки, где число тромбоцитов, полученных из ЭС клеток на 21 сутки культивирования, установлено равным 1. По горизонтальной оси представлено число дней после начала культивирования ИПС клеток и ЭС клеток. «3-f» указывает на клеточную линию, полученную из трехфакторной ИПС клетки, «4-f» - указывает на клеточную линию, полученную из четырехфакторной ИПС клетки, а «ЭС» указывает на ЭС клетки.
На Фиг.5 показан эксперимент по трансфузии на мышиной модели с применением тромбоцитов, полученных из ИПС клеток. Иммунодефицитные мыши с моделью тромбоцитопении были получены при предварительном облучении (А). Тромбоциты, полученные из клеточной линии TkDA3-4, вводили через хвостовую вену иммунодефицитной мыши. На Фиг.5 В показаны зависимые от времени изменения после трансфузии (30 минут, 2 часа, 24 часа). «РВ» указывает на периферическую кровь человека.
Фиг.6 является изображением для подтверждения тромбообразующей способности тромбоцитов, полученных из ИПС клеток человека, т vivo. Тромбоциты, полученные из ИПС клеток человека, окрашивали тетраметилродамин-этиловым эфиром (ТМРЭ, красный пигмент), смешанным с гематопорфирином, и вводили через хвостовую вену мыши. Состояние формирования тромба в кровеносном сосуде спустя 0 секунд, 6 секунд, 13 секунд и 20 секунд после облучения брыжеечной артерии лазером наблюдали с помощью замедленной конфокальной микроскопии. «Кровоток» указывает на кровообращение.
На Фиг.7 схематически показан протокол введения генов в гемопоэтические клетки-предшественники, полученные из ЭС клеток.
На Фиг.8 показаны результаты анализа сортировки клеток с активированной флуоресценцией (FACS) спустя 9 суток после введения гена c-MYC в гемопоэтические клетки-предшественники, полученные из ЭС клеток. «А» показывает результаты FACS анализа, «В» показывает микрофотографии клеток на 9 сутки после введения c-MYC. В качестве контроля были использованы клетки, в которые ввели только MYC вирусный вектор.
На Фиг.9 показана способность к росту мегакариоцитарных клеток-предшественников, экспрессирующих ген c-MYC. На вертикальной оси представлено число СВ42b-положительных клеток. На горизонтальной оси представлено число дней после введения гена c-MYC в клетки, «■» указывает на результаты контроля, в котором вместо c-MYC был введен только вирусный вектор.
На Фиг.10 показаны результаты FACS анализа мегакариоцитарных клеток-предшественников, в которые были введены ген c-MYC и ген BMI1. «c-MYC/BMI1» (верхнее изображение) показывает результаты FACS анализа клеток, в которые были введены как ген c-MYC, так и ген BMI1, в то время как «c-MYC» (изображение внизу) показывает результаты FACS анализа клеток, в которые был введен только ген c-MYC.
На Фиг.11 показаны результаты FACS анализа клеток, в которые были введены ген c-MYC и ген BMI1, на 35 сутки культивирования. «А» схематически показывает специфические функциональные молекулы мегакариоцитов, а «В» показывает результаты FACS анализа.
На Фиг.12 показаны результаты оценки способности к росту MYC/BMI1-экспрессирующих клеток. По вертикальной оси представлено число клеток. По горизонтальной оси представлено число дней после введения генов в клетки.
На Фиг.13 показано изображение тромбоцитов, высвобожденных из мегакариоцитарных клеток-предшественников, полученных из c-MYC/BMI1 -экспрессирующих клеток, по наблюдениям, полученным с помощью электронного микроскопа.
На Фиг.14 показаны результаты FACS анализа клеток на 105 сутки после введения гена c-MYC и гена НОХА2 в гемопоэтические клетки-предшественники, полученные из ЭС клеток (KhES), и на 27 сутки после введения гена c-MYC и гена BCLXL в гемопоэтические клетки-предшественники, полученные из ЭС клеток (KhES).
Фиг.15 является изображением для подтверждения системы регуляции экспрессии гена с помощью вектора рМХ tet-off. Конструкцию, в которой c-MYC и BMI1 были сцеплены с рМХ tet-off вектором с помощью 2А между ними, экспрессировали в клетках 293 GPG, чтобы изучить, имеются ли функции регуляции экспрессии гена. «А» показывает конструкцию вектора и механизм, а «В» показывает результаты оценки экспрессии с-MYC в клетках в состоянии, когда были добавлены или не добавлены тетрациклин и бета-эстрадиол, с применением проточного цитометра. По горизонтальной оси на «В» представлен уровень экспрессии c-MYC. «293GPG» указывает результаты для клеток 293GPG в контроле.
На Фиг.16 показаны результаты исследования способности к росту и способности к дифференцировке для регуляции гена в клеточных линиях, экспрессирующих вектор. «А» демонстрирует результаты оценки способности к росту клеток, экспрессирующих c-MYC и BMI1 с помощью различных векторов. По вертикальной оси показано число клеток, а по горизонтальной оси представлено число дней после введения генов в клетки. «В» демонстрирует результаты анализа клеток, окрашенных анти-С042b (GPIb-альфа) антителами и анти-С041а (интегрин альфа-ПЬ/бета-3 комплекс) антителами (изображение вверху), и анти-гликофорин-а антителами и анти-СВ41а антителами (изображение внизу), с применением проточного цитометра. Как на верхнем, так и на нижнем изображении на чертеже «В», показаны результаты для клеток, принудительно экспрессирующих рМХ с-MYC и Dsam BMI1 по отдельности на левой стороне, и результаты для клеток, экспрессирующих рМХ tet-offc-MYC 2A BMI1 на правой стороне.
На Фиг.17 показано исследование степени мультинуклеации мегакариоцитарной клеточной линии, экспрессирующей рМХ tet-off c-MYC 2A BMI1 в присутствии β-эстрадиола. На «А» показаны результаты контроля только с вектором (клеточной линии, не экспрессирующей гены), а на «В» показаны результаты для клеток, экспрессирующих c-MYC и BMI1.
На Фиг.18 показаны результаты выполнения анализа связывания с фибриногеном на тромбоцитах, полученных из мегакариоцитов, принудительно экспрессирующих c-MYC и BMI1. На изображении вверху (тромбоциты человека) показаны результаты для тромбоцитов, полученных из периферической крови человека, на изображении посередине (рМХ tet-off c-MYC 2A BMI1) показаны результаты для тромбоцитов, полученных из клеточной линии рМХ tet-off c-MYC 2A BMI1 в присутствии β-эстрадиола, а на изображении снизу (рМх Мус Dsam Bmil) показаны результаты для тромбоцитов, полученных из клеточной линии, принудительно экспрессирующей c-MYC и BMI1 посредством рМХ c-MYC и Dsam BMI.
На Фиг.19 показаны результаты оценки способности к активации интегрином тромбоцитов, полученных из мегакариоцитарной клеточной линии, в которой была супрессирована экспрессия c-MYC и BMI1. На изображении слева показан анализ способности к активации интегрином в отсутствие АДФ с применением проточного цитометра, а на правой стороне показан анализ способности к активации интегрином в присутствии АДФ (50 мкм) с применением проточного цитометра.
На Фиг.20 показан путь дифференцировки из ЭС клеток до мегакариоцитарной клеточной линии.
Способ осуществления изобретения
В одном варианте осуществления настоящего изобретения представлен способ получения специфических клеток путем индукции дифференцировки клеток, которые служат в качестве источника, где онкоген принудительно экспрессируется в клетках на необходимой стадии дифференцировки в процессе дифференцировки из клеток, служащих в качестве источника, в специфические клетки, для размножения (или роста) клеток на необходимой стадии дифференцировки.
Используемое здесь выражение «клетки, служащие в качестве источника» соответствует клеткам-предшественникам целевых клеток (специфических клеток), полученным путем индукции дифференцировки, и может обозначать любые клетки, сохраняющие способность к дифференцировке, отличные от окончательно дифференцированных клеток. Например, «клетки, служащие в качестве источника» могут быть полностью недифференцированными плюрипотентными стволовыми клетками, или клетками, дифференцированными до некоторой степени, но все еще сохраняющими способность к дифференцировке (например, гемопоэтические клетки-предшественники клеток крови). Далее, «специфическими клетками», полученными в данном варианте осуществления изобретения, являются клетки, отличные от полностью недифференцированных клеток (например, плюрипотентных стволовых клеотк), и могут быть клетки, имеющие до некоторой степени недифференцированное состояние. То есть, «специфическими клетками» являются клетки, которые получаются между стадией полного отсутствия дифференцировки и стадией окончательной дифференцировки, за исключением полностью недифференцированных клеток. Если в качестве примера использовать клетки крови, «специфическими клетками» в данном варианте осуществления изобретения являются зрелые мегакариоцитарные клетки, тромбоциты, эритроидные клетки или подобные им.
В данном варианте осуществления изобретения «клетками на стадии дифференцировки» для размножения (или роста) являются клетки, которые появляются между стадией полного отсутствия дифференцировки и стадией окончательной дифференцировки, т.е. клетки, отличные от клеток на стадии полного отсутствия дифференцировки (например, плюрипотентные стволовые клетки, и т.д.) и клеток на стадии окончательной дифференцировки. Если брать в качестве примера клетки крови, то «клетками на стадии дифференцировки» в данном варианте осуществления изобретения являются гемопоэтические клетки-предшественники или мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, которые являются клетками-предшественниками зрелых мегакариоцитарных клеток. Например, клетки, индуцированные из плюрипотентных стволовых клеток, таких как ЭС клетки или ИПС клетки, можно применять в качестве «клеток на стадии дифференцировки».
ЭС клетки, используемые в настоящем изобретении, не ограничиваются каким-либо образом. Обычно оплодотворенную яйцеклетку на стадии бластоцисты совместно культивируют с фидерными клетками, отделяют выросшие внутренние клетки из массы, и субкультуру воспроизводят, в итоге обеспечивая развитие ЭС клеточной линии. Таким образом, ЭС клетки обычно получают из оплодотворенной яйцеклетки. Альтернативно, можно применять ЭС-подобные клетки, полученные, например, из жировой ткани, ворсинок хориона, амниотической жидкости, плаценты, тестикулярных клеток, и тому подобных, таких как оплодотворенные яйцеклетки, обладающие характеристиками ЭС клеток и проявляющими плюрипотентность.
ИПС клетками, используемыми в настоящем изобретении, могут быть клетки любого происхождения, если они являются клетками, приобретающими плюрипотентность, эквивалентную плюрипотентности ЭС клеток, в результате введения нескольких типов генов фактора транскрипции (здесь обозначаемого как «фактор плюрипотентности») для обеспечения плюрипотнетности соматических клеток (например, фибробластов, клеток крови, и т.д.). Многие факторы уже описаны как факторы плюрипотентности. Примеры таких факторов включают семейство Oct (например, Oct3/4), семейство SOX (например, SOX2, SOX1, SOX3, SOX15, SOX 17, и т.д.), семейство Klf (например, Klf4, Kl£2, и т.д.), семейство MYC (например, c-MYC, N-MYC, L-MYC, и т.д.), NANOG, LIN28, и тому подобные, хотя настоящее изобретение не ограничивается ими. Способы получения ИПС клеток описаны во многих документах, на которые можно сослаться (см., например, Takahashi et al.. Cell 2006, 126: 663-676; Okita et al.. Nature 2007, 448: 313-317; Wemig et al.. Nature 2007, 448: 318-324; Maherali et al.. Cell Stem Cell 2007, 1: 55-70; Park et al.. Nature 2007, 451: 141-146; Nakagawa et al., Nat Biotechnol 2008, 26: 101-106; Wemig et al, Cell Stem Cell 2008, 10: 10-12; Yu et al.. Science 2007, 318: 1917-1920; Takahashi et al.. Cell 2007,131: 861-872; Stadtfeld et al.. Science 2008, 322: 945-949, и др.).
Онкогеном, используемым в настоящем изобретении, является ген, который индуцирует перерождение клетки, в которой присутствует указанный ген, в раковую клетку. Примеры указанного гена включают гены семейства MYC, гены семейства SRC, гены семейства RAS, гены семейства RAF, гены семейства протеинкиназы, такие как с-Kit, PDGFR, и Аb1, и подобные им, хотя настоящее изобретение не ограничивается ими.
В настоящем изобретении принудительная экспрессия онкогена или нижеупомянутого гена polycomb в клетках на необходимой стадии дифференцировки может достигаться способом, при котором вводят онкоген или ген polycomb в клетки на необходимой стадии дифференцировки и принудительно экспрессируют ген таким способом, чтобы ввести ген в клетки-предшественники клеток на необходимой стадии дифференцировки, принудительно экспрессировать ген, и провести дифференцировку при сохранении экспрессии таким образом, чтобы состояние принудительной экспрессии гена поддерживалось в клетках на необходимой стадии дифференцировки, или способом, при котором вводят ген в клетки-предшественники клеток на необходимой стадии дифференцировки и, когда клетки-предшественники дифференцируются в клетки на необходимой стадии дифференцировки, индуцируют принудительную экспрессию гена. Например, в случаях размножения мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве клеток на необходимой стадии дифференцировки, онкоген или ген polycomb может быть введен в гемопоэтические клетки-предшественники (описанные ниже), которые находятся на стадии предшественников для мегакариоцитарных клеток-предшественников без мульти-полиплоидизации, и принудительно экспрессирован. В случае принудительной экспрессии как онкогена, так и гена polycomb в клетках на необходимой стадии дифференцировки, онкоген и ген polycomb могут быть введены в клетки одновременно или в различное время.
Вариант осуществления настоящего изобретения также включает способ амплификации (или роста) клеток на необходимой стадии дифференцировки, в котором онкоген-индуцированное старение, индуцированное принудительной экспрессией онкогена в клетках на необходимой стадии дифференцировки, супрессируется.
Онкоген-индуцированное старение (ОИС) является старением, вызванным стрессом, индуцированным аномальными ростовыми стимулами и тому подобным посредством онкогена, такого как RAS или MYC. Когда онкогенный продукт экспрессируется в клетках в избыточном количестве, индуцируется экспрессия продукта гена супрессора опухоли, такого как р16 или р19, закодированного в локусе CDKN2a (INK4a/ARF). Это индуцирует старение клеток и апоптоз, вызывая снижение ростовой активности клеток. Таким образом, ожидается, что высокая ростовая способность клеток может поддерживаться за счет устранения ОИС, индуцированного указанным онкогеном.
Например, онкоген-индуцированное старение может супрессироваться за счет экспрессии гена polycomb в клетках, в которых экспрессирован онкоген. Ген polycomb (polycomb группа: PcG) отрицательно регулирует CDKN2a (INK4a/ARF) локус, и способствует предупреждению старения (см., например, Oguro et al., "Regulation of stem cell senescence by polycomb group protein complex". Regenerative Medicine, vol. 6, №4, pp.26-32; Jseus et al.. Nature Reviews Molecular Cell Biology, vol. 7, pp.667-677, 2006; Proc. Natl. Acad. Sci. USA, vol. 100, pp.211-216, 2003). Соответственно, за счет экспрессии гена polycomb в клетках в дополнение к онкогену, такому как ген семейства MYC, можно избежать онкоген-индуцированного старения, и можно еще больше усилить влияние продукта онкогена на рост клеток.
Примеры генов группы polycomb, используемых в настоящем изобретении, включают BMI1, Меl18, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC, Dnmtl/За/ЗЬ и подобные им. Особо предпочтительным геном группы polycomb является ген BMI1.
Онкоген-индуцированное старение можно также супрессировать посредством экспрессии гена НОХА2 или гена BCLXL.
Для принудительной экспрессии онкогена и гена polycomb в клетках можно применять любые способы, известные специалистам в данной области техники. Например, экзогенный онкоген или экзогенный ген polycomb можно ввести в клетки с помощью системы введения генов, такой как лентивирус или ретровирус, и экспрессировать. В случае экспрессии гена с помощью вирусного вектора для введения генов, ген может быть функционально связан со стороной подходящего промотора в направлении экспрессии, который затем вставляют в вектор для введения гена и вводят в клетку для экспрессии целевого гена. Указанная здесь «функциональная» связь означает, что промотор и целевой ген связаны так, что целевой ген цис-доминирован промотором, и реализуется необходимая экспрессия целевого гена. В варианте осуществления настоящего изобретения, например, целевой ген может конститутивно экспрессироваться с использованием ЦМВ промотора, EF1 промотора и подобного им. В качестве альтернативы, подходящий промотор (индуцируемый промотор) может быть помещен под контроль элемента, чья активность регулируется транс-фактором, например, элементом лекарственного ответа, таким как элемент ответа на тетрациклин, где целевой ген индуцируемо экспрессируется за счет регуляции посредством добавления лекарства или тому подобного. В качестве такой системы экспрессии гена на основе лекарства, подходящая система легко может быть выбрана специалистом в данной области техники для реализации необходимой регуляции экспрессии онкогена или гена polycomb. Любой коммерческий набор для такой системы экспрессии может быть приобретен и использован. Хотя онкоген и ген polycomb, которые являются целевыми генами для регуляции экспрессии, могут быть встроены в отдельные векторы, более предпочтительно встраивать онкоген и ген polycomb в один и тот же вектор.
Этот вариант осуществления настоящего изобретения также включает способ получения целевых специфических клеток, путем дальнейшей индукции дифференцировки клеток на необходимой стадии дифференцировки, в которых экспрессируются онкоген или онкоген и ген polycomb. Для дополнительной индукции дифференцировки клеток на необходимой стадии дифференцировки, клетки на стадии дифференцировки можно культивировать в условиях культивирования (таких условиях, как культуральная среда и температура культивирования), подходящих для индукции дифференцировки, и, кроме того, экспрессия онкогена и гена polycomb в клетках на стадии дифференцировки может супрессироваться, если необходимо. В этом случае экспрессия онкогена или гена polycomb может супрессироваться, например, путем устранения индукции экспрессии гена, индуцированной вышеупомянутой системой индуцированной экспрессии, посредством удаления лекарства или тому подобного. Альтернативно, онкоген или ген polycomb могут быть функционально связаны с супрессивным промотором, выполняющим регуляцию конститутивной экспрессии при отсутствии лекарства или тому подобного, и выполнять супрессивную регуляцию экспрессии в присутствии лекарства или тому подобного, для супрессивной регуляции экспрессии гена. Далее введенный онкоген или ген polycomb могут быть удалены с применением системы Cre/Lox или подобной ей, супрессивно регулируя таким образом экспрессию гена. Любой коммерческий набор и тому подобное можно применять для супрессивной регуляции экспрессии онкогена или гена polycomb.
Этот вариант осуществления настоящего изобретения также включает способ размножения (выращивания) мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве клеток на необходимой стадии дифференцировки, и получения, в качестве специфических клеток, зрелых мегакариоцитарных клеток из мегакариоцитарных клеток-предшественников без мульти-полиплоидизации. Здесь, в случае принудительной экспрессии онкогена или онкогена и гена polycomb в мегакариоцитарных клетках-предшественниках без мульти-полиплоидизации, предпочтительно экспрессировать онкоген или онкоген и ген polycomb в гемопоэтических клетках-предшественниках на стадии предшественников для мегакариоцитарных клеток-предшественников без мульти-полиплоидизации.
В данном описании «мегакариоцитарными клетками-предшественниками без мульти-полиплоидизации» являются мононуклеарные или бинуклеарные клетки с мегакариоцит-специфическим маркером CD41a+/CD42a+/CD42b+, не подвергшиеся полиплоидизации ядра. С другой стороны, «гемопоэтическими клетками-предшественниками» являются гемопоэтические клетки, характеризующиеся как CD34+клетки (СВ34-положительные клетки), которые могут быть клетками, полученными в качестве примера из ЭС клеток или ИПС клеток, и предпочтительно клетками, полученными из сетчатой структуры (также обозначаемыми как ES-sac или iPS-sac), приготовленными из ЭС клеток или ИПС клеток (в частности, клеток, полученных сразу после выделения из сетчатой структуры). Упомянутая здесь «сетчатая структура», приготовленная из ЭС клеток или ИПС клеток, является полученной из ЭС клеток или ИПС клеток трехмерной структурой в виде мешочка (содержащей полость внутри),, сформированной популяцией эндотелиальных клеток или подобных им клеток, и содержащей внутри гемопоэтические клетки-предшественники. Детали, относящиеся к сетчатой структуре, см., например, Takayama et al.. Blood 2008, 111: 5298-5306.
Условия культивирования клеток, пригодные для приготовления сетчатой структуры из ЭС клеток человека или ИПС клеток человека, отличаются в зависимости от типа используемых ЭС клеток или ИПС клеток. Однако, в качестве примера, культуральной средой может быть IMDM, в которую добавлен ФБС в конечной концентрации 15%. При необходимости может быть также использована другая бессывороточная среда в факторами роста, добавками, и тому подобным. Кроме того, предпочтительно добавлять 0-100 нг/мл, и более предпочтительно, примерно 20 нг/мл ФРЭС, для эффективного формирования сетчатой структуры. Условия культивирования отличаются в зависимости от типа используемых ЭС клеток или ИПС клеток. Однако, в качестве примера, могут применяться условия 5% CO2 и 36-38°С, и предпочтительно 37°С.Хотя период культивирования, за который формируется сетчатая структура, отличается в зависимости от типа ЭС клеток или ИПС клеток, присутствие сетчатой структуры можно выявить примерно на 14-16 сутки после посева на фидерные клетки.
Сформированная сетчатая структура имеет фолликулярную структуру, и содержит гемопоэтические клетки-предшественники в концентрированном состоянии. Гемопоэтические клетки-предшественники внутри сетчатой структуры можно разделить физическими средствами, такими как пропускание через стерилизованный инструмент для просеивания (например, сито для клеток). Гемопоэтические клетки-предшественники, полученные таким способом, можно применять в соответствии с настоящим изобретением.
Хотя онкоген, принудительно экспрессирующийся в гемопоэтических клетках-предшественниках, может быть любым из вышеупомянутых онкогенов, особо предпочтительным является семейство генов MYC. Примеры генов семейства MYC включают c-MYC, N-MYC, L-MYC, и подобные им. Из этих генов особо предпочтительным является c-MYC. Хотя ген polycomb, принудительно экспрессирующийся в гемопоэтических клетках-предшественниках, может быть любым из вышеупомянутых генов polycomb, особо предпочтительным геном является ген BMI1.
Гемопоэтические клетки-предшественники, экспрессирующие онкоген, такие как ген семейства MYC и ген polycomb, такой как ген BMI1, культивируются в условиях, при которых добавляют любой реагент или комбинацию по меньшей мере двух из ФСК (от 10 до 200 нг/мл, например, 100 нг/мл), ТПО (от 10 до 200 нг/мл, например, 40 нг/мл), FL (от 10 до 200 нг/мл, например, 100 нг/мл), ФРЭС (от 10 до 200 нг/мл, например, 40 нг/мл), и подобных им, и становятся мегакариоцитарными клетками-предшественниками без мульти-полиплоидизации, которые приобретают высокую способность к росту, например, приблизительно на 4-7 сутки после введения гена. Мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, полученные таким способом, поддерживают свой клеточный рост в течение по меньшей мере 30-50 суток, предпочтительно в течение 50-60 суток или более, и более предпочтительно в течение 60 суток или более, и число клеток увеличивается примерно в 1,0×104 раз или больше, предпочтительно примерно в 1,0×105 раз или больше, и более предпочтительно примерно в 1,0×106 раз или больше от числа клеток при введении гена c-MYC и гена BMI1 (см., например, Фиг.12).
Настоящее изобретение также включает в себя способ получения зрелых мегакариоцитарных клеток и дальнейшего производства тромбоцитов путем культивирования, в условиях, подходящих для индукции дифференцировки клеток крови, и мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, полученные способом в соответствии с настоящим изобретением. Условиями, подходящими для индукции дифференцировки клеток крови, являются, например, добавление любой из комбинаций по меньшей мере двух из ТПО, ИЛ-1α, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-11, ЭПО, ГМ-КСФ, ФСК, Г-КСФ, F1t3 лиганда, гепарина, и подобных им. В случае индукции дифференцировки зрелых мегакариоцитарных клеток и тромбоцитов, например, культивирование можно проводить в течение примерно 7-15 суток в присутствии ТПО (10-200 нг/мл, предпочтительно примерно 100 нг/мл), или в присутствии ТПО (10-200 нг/мл, предпочтительно примерно 100 нг/мл), ФСК (10-200 нг/мл, предпочтительно примерно 50 нг/мл), и гепарина (от 10 до 100 Ед/мл, предпочтительно примерно 25 Ед/мл). Может применяться любая культуральная среда, пригодная для индукции дифференцировки клеток крови in vitro. В качестве примера, культивирование проводят в условиях 5% СО2 и температуры 36-38°С, и предпочтительно 37°С.
В случае индукции дифференцировки мегакариоцитарных клеток-предшественников без мульти-полиплоидизации, которые приобрели высокую способность к росту в результате введения онкогена и гена polycomb, в зрелых мегакариоцитарных клетках, тромбоцитах и тому подобном экспрессия онкогена и гена polycomb может супрессивно регулироваться в соответствии с необходимостью, как упоминалось ранее.
Другим вариантом осуществления настоящего изобретения является способ получения эритроидных клеток, в котором эритроидные клеткиполучают путем принудительной экспрессии онкогена и гена НОХА2 или гена BCLXL в гемопоэтических клетках-предшественниках для размножения эритроидных клеток-предшественников. Более подробно, данный вариант осуществления настоящего изобретения относится к способу, в котором онкоген, такой как ген семейства MYC, принудительно экспрессируется в эритроидных клетках-предшественниках, которые являются клетками на необходимой стадии дифференцировки, а онкоген-индуцированное старение, развивающееся в результате, подавляется экспрессией гена НОХА2 или гена BCLXL для размножения эритроидных клеток-предшественников, с получением, таким образом, эритроидных клеток в качестве специфических клеток. Данный вариант осуществления основан на том открытии, что в результате введения множества типов гемопоэтических факторов транскрипции и анти-апоптоз-ассоциированных генов в гемопоэтические клетки-предшественники вместе с MYC в качестве онкогена и выполнения скрининга, НОХА2 или BCLXL индуцирует рост эритроидных клеток-предшественников.
Хотя, как упоминалось выше, любой онкоген можно использовать в качестве онкогена, принудительно экспрессируемого в гемопоэтических клетках-предшественниках, предпочтительным является семейство генов MYC, а особо предпочтительным геном является c-MYC.
В данном описании «эритроидными клетками-предшественниками» являются пре-энуклеированными клетками, несущими маркер эритроцит-специфической молекулы Гликофорина А.
Гемопоэтические клетки-предшественники, экспрессирующие онкоген, такой как ген семейства MYC и ген НОХА2 или ген BCLXL, культивируют в условиях при добавлении любого вещества или комбинации из по меньшей мере двух веществ из ФСК (10-200 нг/мл, например, 100 нг/мл), ТПО (10-200 нг/мл, например, 40 нг/мл), FL 910-300 нг/мл, например, 100 нг/мл), ФРЭС (10-200 нг/мл, например, 40 нг/мл), ЭПО (1-100 Ед/мл, например, 6 Ед/мл) и подобных им, и они становятся пре-энуклеированными эритроидными клетками-предшественниками, приобретшими высокую способность к росту, например, приблизительно на 4-7 сутки после введения гена.
Условиями, подходящими для индукции дифференцировки зрелых эритроидных клеток посредством эритроидных клеток-предшественников, полученных из гемопоэтических клеток-предшественников, экспрессирующих ген семейства MYC и ген BCLXL или ген НОХА2, являются, например, условия с добавлением любого агента или комбинации по меньшей мере двух из ТПО, ИЛ-1α, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-11, ЭПО, ГМ-КСФ, ФСК, Г-КСФ, Flt3 лиганда, гепарин, и подобного им. В частности, эритроидные клетки можно культивировать в течение примерно 7-15 суток в присутствии ЭПО (2-100 Ед/мл, предпочтительно примерно 10 Ед/мл), или в присутствии ЭПО (2-100 Ед/мл, предпочтительно примерно 10 Ед/мл) и ФСК (10-200 нг/мл, предпочтительно примерно 50 нг/мл). Может применяться любая культуральная среда, пригодная для индукции дифференцировки клеток крови in vitro. В качестве примера, культивирование проводят в условиях 5% СО2 и 36-38°С и предпочтительно 37°С.
Другой вариант осуществления настоящего изобретения включает клетки крови на необходимой стадии дифференцировки, в которых принудительно экспрессируется онкоген. Упомянутым здесь онкогеном может быть любой из вышеупомянутых онкогенов. Например, может применяться ген семейства MYC или подобный ему, и особо предпочтительным является ген c-MYC. Далее, «клетками крови на стадии дифференцировки» являются клетки крови, появляющиеся между стадией полного отсутствия дифференцировки и терминальной стадией дифференцировки, т.е. клетками крови, иными чем клетки на стадии полного отсутствия дифференцировки и клетки на терминальной стадии дифференцировки. Например, «клетками крови на стадии дифференцировки» в данном варианте осуществления являются мегакариоцитарные клетки-предшественники без мульти-полиплоидизации или подобные им. В качестве клеток крови на стадии дифференцировки, могут использоваться, например, клетки, индуцированные из ЭС клеток или ИСП клеток. В частности, клетки крови, полученные из сетчатой структуры (также обозначаемые как ES-sac или iPS-sac), полученные из ЭС клеток или ИПС клеток (в частности, клеток, полученных сразу после выделения из сетчатой структуры) являются предпочтительными. Данный вариант осуществления настоящего изобретния также включает клетки крови на стадии дифференцировки, в которых принудительно экспрессируется не только онкоген, но также вышеупомянутый ген polycomb. Принудительная экспрессия онкогена и гена polycomb может быть индуцирована с применением индуцируемого промотора или подобного ему, как упоминалось выше.
Принудительная экспрессия онкогена или гена polycomb в клетках на необходимой стадии дифференцировки может достигаться таким способом, который обеспечивает введение онкогена или гена polycomb в клетки крови на необходимой стадии дифференцировки и принудительную экспрессию гена; способом, обеспечивающим введение гена в клетки-предшественники клеток крови на необходимой стадии дифференцировки, принудительную экспрессию гена, и продолжение дифференцировки при поддержке экспрессии, так чтобы принудительная экспрессия гена поддерживалась в клетках крови на необходимой стадии дифференцировки, или способом, обеспечивающим введение гена в клетки-предшественники клеток крови на необходимом этапе дифференцировки и, когда клетки-предшественники дифференцируются в клетки крови на необходимой стадии дифференцировки, индуцирующим принудительную экспрессию гена. Например, в случае размножения мегакариоцитарных клеток-предшественников без мульти-полиплоидизации в качестве клеток крови на необходимой стадии дифференцировки, онкоген или ген polycomb могут быть введены в гемопоэтические клетки-предшественники, находящиеся на стадии предшественников для мегакариоцитарных клеток-предшественников без мульти-полиплоидизации, и принудительно экспрессированы.
Клетки' крови, такие как мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в данном варианте осуществления обладают устойчивостью к замораживанию-оттаиванию, и сохраняют способность к росту и дифференцировке клеток даже при криоконсервации с последующим размораживанием. Это обеспечивает возможность замораживания и последующего размораживания клеток крови при необходимости, производя таким образом клетки крови с индуцированной дифференцировкой. Применение таких клеток устраняет потребность в выполнении серии операций для производства клеток крови, таких как тромбоциты, из ЭС клеток и ИПС клеток с самого начала. То есть, при приготовлении, в качестве сырьевых материалов, большого количества клеток крови, в которых онкоген или онкоген и ген polycomb принудительно экспрессируются в соответствии с настоящим изобретением, и криоконсервации клеток крови при необходимости, можно рационализировать и повысить эффективность указанного способа получения. Таким образом, можно создать механизм, способный обеспечить быструю поставку различных клеток крови, таких как тромбоциты.
В случае получения замороженной клеточной композиции с применением клеток крови, таких как мегакариоцитарные клетки-предшественники без мульти-полиплоидизации в соответствии с настоящим изобретением, замороженная клеточная композиция может содержать клетки крови, такие как мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, и криоконсервирующий раствор. Композиция также может содержать добавки и тому подобное, если необходимо.
Например, в качестве криоконсервирующего раствора может применяться замораживающий раствор, содержащий ДМСО. Специфические примеры включают Cell Banker (Nippon Zenyaku Kogyo Co., Ltd.), Bambanker (Nippon Genetics Co., Ltd.), TC-Protector (DS Pharma Biomedical Co., Ltd.), и CP-1 с добавлением альбумина (Kyokuto Pharmaceutical Industrial Co., Ltd.).
Семейство генов MYC, ген polycomb (например, ген BMI1), ген НОХА2, и ген BCLXL, используемые в настоящем изобретении, включают не только гены, чьи последовательности кДНК уже опубликованы, но также их гомологи, идентифицированные обычными методиками на основе гомологии этих хорошо известных последовательностей кДНК. Гомологом гена c-MYC среди генов семейства MYC является ген, чья последовательность кДНК состоит, например, по существу из последовательности, идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 1. Так, кДНК, состоящей по существу из последовательности, идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 1, является либо ДНК, состоящая из последовательности, идентичной примерно на 60% или более, предпочтительно примерно на 70% или более, более предпочтительно, примерно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, или' 98%, и наиболее предпочтительно, примерно на 99% ДНК, состоящая из последовательности, приведенной в SEQ ID NO: 1, или ДНК, которая может гибридизоваться с ДНК, состоящей из последовательности, комплементарной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 1 в жестких условиях, где белок, кодируемый такой ДНК, способствует размножению клеток на стадии дифференцировки, таких как мегакариоцитарные клетки-предшественники без мульти-полиплоидизации.
Гомологом гена BMI1, используемым в соответствии с настоящим изобретением, является ген, чья последовательность кДНК состоит, например, по существу из последовательности, идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 2. Так, кДНК, состоящей по существу из последовательности, идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 2, является либо ДНК, состоящая из последовательности, идентичной примерно на 60% или более, предпочтительно примерно на 70% или более, более предпочтительно, примерно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, или 98%, и наиболее предпочтительно, примерно на 99% ДНК, состоящая из последовательности, приведенной в SEQ ID NO: 2, или ДНК, которая может гибридизоваться с ДНК, состоящей из последовательности, комплементарной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 2 в жестких условиях, где белок, кодируемый такой ДНК, супрессирует онкоген-индуцированное старение в клетках, в которых экспрессируется онкоген, такой как ген семейства MYC, облегчая таким образом размножение клеток.
Геном НОХА2 или геном BCXL, используемым в соответствии с настоящим изобретением, является ген, чья последовательность кДНК состоит, например, из последовательности, по существу идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 3 или 4. Так, кДНК, состоящей по существу из последовательности, идентичной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 3 или 4, является либо ДНК, состоящая из последовательности, идентичной примерно на 60% или более, предпочтительно примерно на 70% или более предпочтительно, примерно на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, или 98%, и наиболее предпочтительно, примерно на 99% ДНК, состоящая из последовательности, приведенной в SEQ ID NO: 3 или 4, или ДНК, которая может гибридизоваться с ДНК, состоящей из последовательности, комплементарной последовательности нуклеиновой кислоты, приведенной в SEQ ID NO: 3 или 4 в жестких условиях, где белок, кодируемый такой ДНК, индуцирует рост эритроидных клеток-предшественников.
Жесткие условия, упомянутые здесь, являются условиями гибридизации, легко определяемыми специалистами в данной области техники, и являются эмпирическими экспериментальными условиями, которые обычно зависят от длины зонда, температуры отмывки, и концентрации соли. Обычно, температура для надлежащего отжига выше, когда применяют более длинный зонд, и ниже при использовании более короткого зонда. Образование гибрида обычно зависит от способности к повторному отжигу в условиях, когда температура слегка ниже точки плавления комплементарной цепи.
Подробнее, условиями с пониженной жесткостью являются, например, условия, при которых отмывку осуществляют в растворе 0, IX стандартного солевого раствора, 0,1% ДСН при температуре от 37°С до 42°С на этапе отмывки фильтра после гибридизации. Условиями с высокой жесткостью являются, например, условия, при которых отмывку осуществляют в растворе 5Х стандартного солевого раствора, 0,1% ДСН при температуре 65°С на этапе отмывки. Полинуклеотид более высокой идентичности можно получить путем дальнейшего повышения жесткости условий.
Вариант осуществления настоящего изобретения дополнительно включает набор для получения клеток на необходимой стадии дифференцировки (например, мегакариоцитарных клеток-предшественников без мульти-полиплоидизации или эритроидных клеток-предшественников) или окончательно полученных специфических клеток (например, мегакариоцитарных клеток, тромбоцитов или эритроидных клеток). Указанный набор содержит реагенты и векторы экспрессии, и тому подобное, необходимые для экспрессии онкогена, гена polycomb, гена BCLXL, гена НОХА2 или подобного им в клетках, а также содержит культуральную среду для клеточной культуры, сыворотку, добавки, такие как факторы роста (например, ТПО, ЭПО, ФСК, гепарин, ИЛ-6, ИЛ-11, и т.д.), антибиотики, и так далее. Кроме того, например, в случае применения клеток, полученных из ЭС клеток или ИПС клеток, набор дополнительно содержит антитела для подтверждения маркеров для идентификации сетчатой структуры, приготовленной из этих клеток (например, антитела против F1k1, CD31, CD34, UEA-I пектина, и т.д.). Реагенты, антитела и тому подобное, содержащиеся в наборе, поставляются в любом типе сосуда, в котором компоненты эффективно сохраняют активность в течение длительного периода времени без адсорбции или разрушений, вызванных материалом сосуда.
Тромбоциты и эритроидные клетки, полученные в соответствии с настоящим изобретением, могут стабильно производиться в форме лекарственного продукта. Тромбоциты, полученные способом в соответствии с настоящим изобретением, могут быть приготовлены путем извлечения из культурального раствора фракции, в которой содержатся тромбоциты, высвободившиеся из мегакариоцитарных клеток, и удаления иных клеточных компонентов крови, чем тромбоциты, таких как мегакариоцитарные клетки, посредством применения фильтра, удаляющего лейкоциты (например, коммерческого фильтра от Terumo Corporation, Asahi Kasei Medical Co., Ltd., и т.д.), или подобного ему. При приготовлении продукта крови, другие компоненты, вносящие вклад в стабилизацию тромбоцитов или эритроидных клеток, могут присутствовать в продукте крови. Для таких компонентов, вносящих вклад в стабилизацию, может быть выбран способ, хорошо известный специалистам в данной области техники.
Более подробно, полученные тромбоциты могут быть изготовлены с помощью следующего способа, описанного в качестве примера.
ACD-A раствор и FFP (свежезамороженная плазма, приготовленная из цельной крови, полученной от доноров и содержащая все компоненты, за исключением таких компонентов крови, как альбумин и фактор коагуляции) готовят в отношении 1:10, и хранят при встряхивании при температуре 20-24°С после облучения от 15 до 50 Гр. Раствор ACD-A готовят путем смешивания 22 г цитрата натрия, 8 г лимонной кислоты, и 22 глюкозы с водой для инъекций в общем количестве 1 л.
В случае применения вышеупомянутого способа желательно, чтобы концентрация тромбоцитов достигала, в качестве примера, примерно 1×109 тромбоцитов/мл,.
Кроме того, добавление GM6001 (ингибитора металлопротеаз на основе гидроксамовой кислоты широкого спектра действия) (Calbiochem, Ла-Хойя, Калифорния, США) обеспечивает предотвращение инактивации, вызванной расщеплением функциональной молекулы тромбоцитов GPIb-V-IX или GPVI, возникающей во время криоконсервации или консервации при комнатной температуре. Авторы настоящего изобретения подтвердили, что инактивацию можно предотвратить у тромбоцитов мыши, полученных из ЭС клеток, с помощью этого способа. Информацию о механизме, лежащем в основе этой инактивации тромбоцитов при использовании тромбоцитов человека, см. Bergmeier, W. et al., Cir Res 95: 677-683, 2004, и Gardiner, ЕЕ. et al., J Thrombosis and Haemostasis, 5:1530-1537,2007.
Что касается материала сосуда, содержащего лекарственный продукт, включающий тромбоциты, предпочтительно не применять материал, такой как стекло, который активирует тромбоциты.
С другой стороны, эритроидные клетки могут быть приготовлены следующим образом. Более подробно, полученные эритроциты могут быть приготовлены следующим способом, приведенным в качестве примера.
Раствор MAP (чей состав описан ниже) добавляли к концентрату эритроцитов, полученному путем концентрирования культуральной надосадочной жидкости после центрифугирования, готовили и хранили при температуре 2-6°С после облучения от 15 до 50 Гр.
В случае применения вышеупомянутого способа желательно, чтобы концентрация эритроцитов достигала, в качестве примера, примерно 1х1010 эритроцитов/мл. Для полученных эритроцитов, например, можно применять загрузочный раствор для консервации эритроцитов (MAP раствор), приготовленный при растворении D-маннитола (14,57 г), аденина (0,14 г), кристаллического дигидрофосфата натрия (0,94 г), цитрата натрия (1,50 г), лимонной кислоты (0,20 г), глюкозы (7,21 г), и хлорида натрия (4,97 г) в воде для инъекций в общем количестве 1000 мл.
При необходимости специалист в данной области техники может легко выбрать любой другой хорошо известный способ, пригодный для приготовления эритроцитов, если уместно.
Настоящее изобретение дополнительно включает замороженную композицию из клеток крови в соответствии с настоящим изобретением. Композиция может содержать не только клетки крови, но также культуральную среду, необходимую для консервации клеток крови, буферный раствор, и ДМСО, глицерин, и тому подобное для защиты клеток при замораживании. Композиция может дополнительно содержать любые другие обычные вещества, необходимые при замораживании клеток. В случае, если для замораживания клеток используется коммерческий реагент, композиция может содержать вещества, содержащиеся в реагенте.
Источником «клеток», приведенных в данном описании, могут быть клетки человека или клетки животного, не являющегося человеком, (например, клетки мышей, крыс, коров, лошадей, свиней, овец, обезьян, собак, кошек, птиц, и т.д.). Хотя указанный источник не ограничивается каким-либо образом, особо предпочтительными являются клетки, полученные из человека.
Настоящее изобретение описывается более подробно посредством примеров, приведенных ниже, хотя эти примеры не предназначены для ограничения объема настоящего изобретения.
Примеры
1. Сравнение эффективности продукции мегакариоцитов из четырехфакторных ИПС клеток и трехфакторных ИПС клеток
Сравнивали число мегакариоцитарных клеток, полученных из ИПС клеток (TkDA3-2, TkDA3-4, и TkDA3-5), созданных с применением четырех генов (ОСТЗ/4, SOX2, KLF-4, c-MYC); ИПС клеток (253G1 (предоставленных проф. Шинья Яманака, Университет Киото) и TkDN4-M), созданных с применением трех генов (ОСТЗ/4, SOX2, KLF-4), отличных от c-MYC, и ЭС клеток человека (KhES-3 (предоставленных проф. Норио Накацуи, Университет Киото) (Фиг.1). На 15 сутки культивирования ИПС клеток и ЭС клеток, гемопоэтические клетки-предшественники, экстрагированные из сетчатой структуры, высевали на фидерные клетки, и культивировали в IMDM, в которую добавляли ФБС в конечной концентрации 15%, в присутствии ТПО (100 нг/мл), ФСК (50 нг/мл) и гепарина (25 Ед/мл). Подсчитывали число последовательно индуцированных С042b-положительных мегакариоцитарных клеток в зависимости от времени (Фиг.1). В результате число мегакариоцитарных клеток возрастало во всех трех клеточных линиях четырехфакторных ИПС клеток (с c-MYC), по сравнению с трехфакторными ИПС клетками (без c-MYC) и человеческими ЭС клетками.
Далее оценивали активацию экспрессии генов (ОСТЗ/4, SOX2, KLF-4, c-MYC), введенных при получении ИПС клеток, в недифференцированных ИПС клетках. Оценка показала, что экспрессия всех генов супрессировалась посредством механизма сайленсинга (Фиг.2А). С другой стороны, в полученных индукцией дифференцировки мегакариоцитарных клетках на 25 сутки культивирования была подтверждена реактивация экспрессии каждого трансгена (Фиг.2 В).
Эти результаты позволяют сделать предположение о возможности того, что реактивация экспрессии какого-либо из введенных генов при получении ИПС клеток связана с увеличением числа полученных мегакариоцитарных клеток. С учетом этого, исследовали ген, являющийся причиной повышения числа мегакариоцитарных клеток. Вызывали принудительную экспрессию каждого гена по отдельности с помощью ретровируса в гемопоэтических клетках-предшественниках, полученных из ЭС клеток человека (в которые не вводили извне ОСТЗ/4, SOX2, KLF-4, и c-MYC, в отличие от ИПС клеток), и подсчитывали число С042b-положительных мегакариоцитарных клеток. В результате было установлено, что число полученных С042b-положительных мегакариоцитарных клеток возросло примерно в 10 раз в случае введения c-MYC, по сравнению со случаями введения других генов (Фиг.3). Эти результаты указывают, что высокая эффективность индукции мегакариоцитов из четырехфакторных ИПС клеток может быть обусловлена реактивацией экспрессии гена c-MYC.
Также было подтверждено, что мегакариоцитарные клетки, индуцированные из четырехфакторных ИПС клеток, проявляли больший уровень выживания после замораживания-оттаивания, чем мегакариоцитарные клетки, индуцированные из ЭС клеток или трехфакторных ИПС клеток. Более подробно, в то время как уровень выживания после замораживания-оттаивания мегакариоцитарных клеток, индуцированных из ЭС клеток человека (KhES-3), и трехфакторных ИПС клеток человека (TkDN4-M) составил, соответственно, 56,7% и 54,5%, т.е. примерно 1/2, уровень выживания после замораживания-оттаивания мегакариоцитарных клеток, индуцированных из четырехфакторных ИПС клеток человека (TkDA3-4), составил примерно 81,0%, достигая около 4/5. Это свидетельствовало, что мегакариоцитарные клетки-предшественники, в которых произошла реактивация онкогена, такого как ген с-MYC, более пригодны для криоконсервации и более легко получаются после оттаивания.
Число полученных тромбоцитов изучали таким же способом, как и для мегакариоцитарных клеток. На 15 сутки культивирования из ИПС клеток и ЭС клеток, высевали гемопоэтические клетки-предшественники, экстрагированные из сетчатой структуры, и подсчитывали число последовательно индуцированных тромбоцитов в зависимости от времени. В результаты тромбоциты были эффективно получены из четырехфакторных ИПС клеток, как в случае мегакариоцитарных клеток (Фиг.4).
Далее проводили эксперимент по трансфузии тромбоцитов, полученных in vitro, с применением клеточной линии TkDA3-4, обладающей наивысшей способностью к продукции тромбоцитов. Иммунодефицитных мышей с моделью тромбоцитопении получали путем предварительного облучения, и тромбоциты, полученные из ИПС клеток, вводили через хвостовую вену (Фиг.5А). Спустя 30 минут после трансфузии наблюдался химеризм примерно 20% тромбоцитов. Даже спустя 2 часа после трансфузии, все еще наблюдался химеризм примерно 10% тромбоцитов. Таким образом, наблюдались те же самые характеристики, что и у свежих тромбоцитов, полученных из периферической крови человека (Фиг.5 В).
Далее оценивали способность тромбоцитов, полученных из ИПС клеток человека, к формированию тромба in vivo с помощью замедленной конфокальной микроскопии.
Тромбоциты, полученные из ИПС клеток, окрашивали тетраметилродамин этиловым эфиром (TMRE: красный пигмент), смешанным с гематопорфирином, и вводили в хвостовую вену мышей. При окрашивании кровотока (в отличие от клеточных компонентов) ФИТЦ-декстраном (зеленым), компоненты крови в кровеносном сосуде обесцвечивались, позволяя выявлять клетки крови по форме и размеру. Когда гематопорфирин вступал в реакцию под действием лазера и вызывал повреждение сосудистого эндотелия, тромбоциты формировали цельный слой и прилипали к поврежденному эндотелию или пятну обнаженного эндотелия, индуцируя формирование тромба.
Малую брыжеечную артерию мыши облучали лазером с длиной волны 488 нм при 30 мВт. Спустя 13 секунд окрашенные в красный цвет тромбоциты, полученные из ИПС клеток, прилипали к поврежденному эндотелию (эта область указана как «Полученные из ИПС» стрелками на Фиг.6). Спустя 20 секунд формирование тромба, индуцированное тромбоцитами в координации с тромбоцитами хозяина (мышиными тромбоцитами) приводило к окклюзии кровеносного сосуда. Таким образом, тромбоциты, полученные из ИПС клеток, способны к формированию тромба в кровотоке in vivo.
Эти результаты продемонстрировали, что тромбоциты, приготовленные из ИПС клеток, полученных при введении четырех генов, включая ген c-MYC, в которых ген с-MYC реактивирован, обладают те ми же самыми физиологическими характеристиками, как и тромбоциты, полученные из периферической крови человека.
Как видно из вышеуказанного анализа, для эффективной индукции мегакариоцитарных клеток и тромбоцитов из ИПС клеток важно индуцировать экспрессию гена c-MYC и поддерживать эффект продукта гена c-MYC в клетках. Таким образом, ожидается, что эффективный способ индукции мегакариоцитарных клеток и тромбоцитов из ИПС клеток состоит в экспрессии гена c-MYC в мононуклеарных мегакариоцитарных клетках-предшественниках, которые являются недифференцированными мегакариоцитарными клетками-предшественниками, а также в подавлении онкоген-индуцированного старения (ОИС) для сохранения эффекта продукта гена c-MYC. С учетом этого, ген polycomb экспрессировали одновременно с геном c-MYC для супрессии ОИС, и оценивали его эффект.
2. Эффективность продукции зрелых мегакариоцитарных клеток из мегакариоцитарных клеток-предшественников, экспрессирующих ген c-MYC и ген BMI1.
В результате сравнения эффективности продукции мегакариоцитов в линии ИПС клеток, полученных с применением четырех генов, и линии ИПС клеток, полученных с применением трех генов, было установлено, что реактивация гена c-MYC в мегакариоцитарных клетках-предшественниках влияет на число индуцированных впоследствии зрелых мегакариоцитарных клеток. Таким образом, изучали, как влияет экспрессия гена c-MYC в мегакариоцитарных клетках-предшественниках, полученных из ЭС клеток, которые являются плюрипотентными стволовыми клетками, в которых ген с-MYC не введен, на последующую индукцию мегакариоцитарных клеток.
Сетчатую структуру готовили из линии ЭС клеток человека (KhES-3) в присутствии 20 нг/мл ФРЭС.Мегакариоцитарные клетки-предшественники (на стадии пре-мультинуклеации), экстрагированные из сетчатой структуры, высевали на клетки ЮТ 1/2 в концентрации 1х10 клеток/ячейку, и спустя 0 часов, 12 часов и 24 часа после посева, инфицировали ретровирусным вектором, содержащим ген c-MYC (SEQ ID NO: 1). Спустя 36 часов, культуральную среду меняли на среду, не содержащую ретровирус, и продолжали культивирование. Введение гена с помощью ретровируса проводили спиновой инфекцией с применением 6-луночного планшета, в который добавляли 2-3 мл культуральной среды, при 900 об./мин в течение 90 минут.Культивирование проводили в культуральной среде IMDM с ФБС в конечной концентрации 15%, в которую вносили 100 нг/мл ФСК, 40 нг/мл ТПО, 100 нг/мл FL, 40 нг/мл ФРЭС, и протамин (Фиг.7).
В результате анализа FACS на 9 сутки после ретровирусной инфекции, наблюдалось, что клетки, имеющие CD41a и CD42b, преимущественно увеличивались в клетках, в которые был введен c-MYC, по сравнению в контрольным вектором (Фиг.8А). Далее, при проверке клеток цитоспином, в контроле наблюдались мультинуклеированные клетки, в то время как в клетках с введением c-MYC наблюдались мононуклеарные клетки с премультинуклеацией (Фиг.8 В). Эти результаты позволили предположить, что принудительная экспрессия c-MYC заставляет увеличиваться мононуклеарные незрелые мегакариоцитарные клетки. Результаты подобны тем, что наблюдались у трансгенных мышей, у которых c-MYC был экспрессирован в мегакариоцит-специфическим образом (см. Alexander et al.. Deregulated expression of c-MYC in megakaryocytes of transgenic mice increases megakaryopoiesis and decreases polyploidization, J. Biol. Chem., 1996 Sep 20; 271 (38): 22976-82).
Далее, оценивали способность клеток к росту в c-MYC экспрессированном состоянии. В результате наблюдалось снижение роста на 14 сутки после инфекции (Фиг.9). Этот феномен является механизмом предупреждения злокачественного перерождения клеток, вызывающим прекращение клеточного цикла, старение и апоптоз в ответ на аномальный ростовой сигнал из-за избыточной экспрессии онкогена, такого как c-MYC, и обозначается как онкоген-индуцированное старение (ОИС) (описано выше). С учетом этого, при попытке избежать ОИС, BMI1, который является одним из генов polycomb для отрицательной регуляции гена Ink4a/Arf, кодирующего продукты гена -супрессора опухоли р16 и р19, вводили в мегакариоцитарные клетки-предшественники. Ген c-MYC и ген BMI1 (SEQ Ю N0: 2) вводили в клетки с помощью вышеупомянутого способа ретровирусного введения гена и экспрессировали, после чего проводили FACS анализ. В результате были получены СВ41а-положительныеА1 В42b-положительные (мегакариоцитарный маркер) клеточные колонии, стабильно и экспоненциально растущие после введения гена (Фиг.10). Это подтвердило, что в то время как число CD41a-положительных/СВ42b-положительных клеток существенно снижалось на 20 сутки после введения гена в случае введения в клетки только гена c-MYC (результаты анализа внизу на Фиг.10), число СВ41а-положительных/СВ42b-положительных клеток возрастало с каждым днем в случае введения гена c-MYC и гена BMI1 (результаты анализа вверху на Фиг.10). Это продемонстрировало, что мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в которые ввели не только ген c-MYC, но также и ген BMI1 в качестве одного из генов polycomb, дифференцируются в мегакариоцитарные клетки при сохранении высокой способности к росту путем отмены ОИС. Таким образом, чтобы определить характеристики полученных мегакариоцитарных клеток, проводили FACS анализ того, присутствуют ли CD9 и CD42a, являющиеся другими мегакариоцит-специфическими функциональными молекулами, на поверхности клеток (см. Фиг.11А). В результате было подтверждено наличие CD9 и CD42a в клеточной линии, в которую были введены гены c-MYC и BMI1 (Фиг.11В).
Далее, оценивали способность к росту клеток, экспрессирующих c-MYC/BMI1. Мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в которые были введены ген c-MYC и ген BMI1, культивировали в культуральной среде IMDM с ФБС в конечной концентрации 15%, в которую вносили 100 нг/мл ФСК, 40 нг/мл ТПО, 100 нг/мл FL, 40 нг/мл ФРЭС, и подсчитывали число клеток в зависимости от времени. В результате было получено примерно 4х107 С041аположительных клеток на 49 сутки после введения гена (Фиг.12). Кроме того, при наблюдении тромбоцитов, высвобожденных из мегакариоцитарных клеток-предшественников, полученных из с-MYC/BMI1-экспрессирующих клеток, посредством электронного микроскопа было подтверждено наличие микротубулярных структур, систем открытых канальцев, и характеристик тромбоцитарных гранул (Фиг.13).
3. Индукция эритроцитов из гемопоэтических клеток-предшественников с введенным геном c-MYC через эритроидные клетки-предшественники.
Далее была предпринята попытка получения эритроцитов из эритроидных клеток-предшественников, полученных из гемопоэтических клеток-предшественников, в которые был введен ген c-MYC. Таким же образом, как и при введении гена c-MYC или гена BMI1, описанном в секции 2, были получены клетки, экспрессирующие C-MYC/HOXA2 (SEQ ID N0: 3) и c-MYC/BCLXL (SEQ ID NO: 4), и проведен анализ FACS. В результате, наличие эритроидного маркера CD71-положительной/GlyA-положительной клеточной колонии в клетках, экспрессирующих C-MYC/HOXA2, было также подтверждено на 105 сутки после введения гена (вид наверху справа на Фиг.14). Кроме того, наличие GlyA-позитивной клеточной колонии в клетках, экспрессирующих c-MYC/BCLXL, было также подтверждено (вид снизу справа на Фиг.14). Это показало, что гемопоэтические клетки-предшественники, в которые введен ген c-MYC, также можно дифференцировать в эритроидные путем смены комбинации введенных факторов.
4. Продукция функциональных тромбоцитов с применением системы индукции экспрессии генов.
Как видно из вышеизложенного, эффективным способом получения мегакариоцитарных клеток и тромбоцитов эффективно и в больших количествах является повышение числа мегакариоцитарных клеток-предшественников. Для этого необходимо провести одновременную со-экспрессию гена семейства c-MYC и гена polycomb в мегакариоцитарных клетках-предшественниках без мульти-полиплоидизации для повышения способности к росту мегакариоцитарных клеток-предшественников без мульти-полиплоидизации. Однако для облегчения созревания мегакариоцитарных клеток (мультинуклеации) необходимо супрессивно регулировать экспрессию гена семейства с-MYC и гена polycomb в зависимости от обстоятельств.
С учетом вышеизложенного, тромбоциты получали путем индуцированной регуляции экспрессии гена c-MYC и гена BMI1 с применением системы рМХ Tet off, и оценивали физиологическую функциональность тромбоцитов.
4.1. Подтверждение функциональности вектора регуляции гена
Готовили единый вектор, в который были встроены C-MYC-2A-BMI 1 в рМХ Tet off векторе (предоставленном проф. Хироюки Мано, Медицинский университет Дзичи) («2А» является пептидом, обладающим способностью к саморасщеплению, полученным из вируса ящура, где множество белков можно эффективно получить из одного промотора путем прослаивания этой последовательности между множеством белков (Hasegawa et al., 2007 Stem Cells)). Вектор рМХ Tet off c-MYC 2А BMI1 индуцирует экспрессию гена с-MYC и гена BMI1 в присутствии эстрадиола, и подавляет экспрессию гена c-MYC и гена BMI1 в присутствии тетрациклина и в отсутствие эстрадиола.
Приготовленный вектор рМХ Tet off c-MYC 2A BMI1 экспрессировали в клетках 293 GPG, и состояние регуляции экспрессии гена c-MYC и гена BMI1 подтверждали с помощью FACS. На Фиг.15 показаны результаты анализа FACS, в котором c-MYC белок в клетках окрашивали с помощью антитела к белку анти-c-MYC, а затем с А1еха647-меченым вторичным антителом. Как можно понять из рисунка, в клетках 293 GPG, в которые был встроен рМХ Tet off c-MYC 2A BMI1. уровень экспрессии гена c-MYC был подобен уровню в клетках 293 GPG из контрольной группы в присутствии тетрациклина (график, указанный как 293gpg и+тетрациклин на Фиг.15), но экспрессия гена c-MYC была стимулирована в присутствии эстрадиола (график, указанный как+Р-эстрадиол на Фиг.15).
Результаты показали, что экспрессию целевого гена можно регулировать с помощью вектора рМХ Tet off c-MYC 2A BMI1. используемого здесь.
4.2. Продукция мегакариоцитарной клеточной линии с помощью вектора регуляции гена.
Вектор регуляции гена, описанный в вышеприведенной секции 4.1., использовали для экспрессии гена c-MYC и гена BMI1 в мегакариоцитарных клетках-предшественниках, полученных из линии ЭС клеток человека (KAES-3), и оценивали их способность к росту и дифференцировке.
Оценку проводили на клетках, в которые вводили только вектор (Фиг.16А(b)), клеточной линии, в которой по отдельности принудительно экспрессировали рМХ c-MYC и Dsam BMI1 (Фиг.16А(b)), клеточной линии, в которой по отдельности экспрессировали рМХ tet off c-MYC и рМХ tet off BMI1 (Фиг.16А(с)), клеточной линии, в которой экспрессировали рМХ tet off c-MYC 2A BMI1 (Фиг.16A(d)), и клеточной линии, в которой экспрессировали рМХ tet off BMI1 2A c-MYC (Фиг.16А(е)). Здесь (d) и (е) являются конструкциями, различающимися по порядку размещения гена c-MYC и гена BMI1 с последовательностью 2A между ними.
На Фиг.16А показаны кривые роста CD41a+клеток для этих клеточных линий.
Каждую клеточную линию окрашивали анти-С041а антителом и анти-С042b антителом в качестве мегакариоцитарных маркеров, и анализировали с применением проточного цитометра. Клеточная линия, генерированная с применением рМХ tet off c-MYC 2A BMI1 (Фиг.16А((1)), продемонстрировала тот же самый фенотип, что клеточная линия с принудительной экспрессией рМХ c-MYC и Dsam BMI1 по отдельности (Фиг.16А(b)), где большинство клеточных популяций экспрессировали мегакариоцитарный маркер (верхняя панель на Фиг.16 В). Далее, клеточная линия, генерированная с применением рМХ tet off c-MYC 2A BMI1 (Фиг.16A(d)), проявляла более высокую способность к росту, чем клеточная линия, в которую были по отдельности введены рМХ tet off c-MYC и рМХ tet off BMI1 (Фиг.16А(с)), и клеточная линия, генерированная с применением рМХ tet off BMI1 2A c-MYC (Фиг.16А(е)).
При окрашивании анти-Гликофорин-а антителом и анти-СВ41а антителом, общий маркер клеточной популяции мегакариоцитов/эритробластов CD41a+/Gly-a+присутствовал на клеточной линии с принудительной экспрессией рМХ c-MYC и Dsam BMI1 по отдельности (нижняя панель на Фиг.16 В слева), в то время как Gly-a исчезал на клеточной линии, полученной с применением рМХ tet off c-MYC 2A BMI1 (нижняя панель на Фиг.16 В, справа). Это указывало, что клеточная линия, полученная с применением рМХ tet off c-MYC 2A BMI1. является клеточной линией, более дифференцированной в мегакариоциты, чем клеточная линия с принудительной экспрессией рМХ c-MYC и Dsam BMI1 по отдельности.
4.3. Относительно мультинуклеации мегакариоцитов.
Оценивали степень мультинуклеации клеточной линии, принудительно экспрессирующей ген c-MYC и ген BMI1 посредством рМХ tet off c-MYC 2A BMI1 вектора в присутствии Р-эстрадиола. Мегакариоциты, полученные от человека, обычно мультинуклеировались примерно до 32N (Фиг.17А). С другой стороны, клеточная линия, принудительно экспрессирующая ген c-MYC и ген В МП посредством рМХ tet off c-MYC 2А BMI1 вектора, плохо мультинуклеировалась, со степенью мультинуклеации от 2N до 4N.
4.4. Функциональный анализ тромбоцитов, полученных из мегакариоцитарной клеточной линии, экспрессирующей ген c-MYC и ген BMI1
Функциональные анализы проводили на тромбоцитах, полученных из мегакариоцитарной клеточной линии, экспрессирующей ген c-MYC и ген BMI1.
Тромбоциты, полученные из периферической крови человека из контроля, связанный с фибриногеном в присутствии АДФ (аденозин-дифосфата, внутриклеточного фактора активации тромбоцитов), проявляли нормальную способность к активации интегрина (сигнал «изнутри наружу»), необходимую для начальной стадии формировании тромба (вид сверху справа на Фиг.18). При этом ни клеточная линия рМХ tet off c-MYC 2А ВМП (в присутствии эстрадиола), ни клеточная линия, принудительно экспрессирующая рМХ c-MYC и Dsam BMI1 не связывались с фибриногеном даже при добавлении АДФ (вид в середине и снизу на Фиг.18). Таким образом, было установлено, что тромбоциты, обладающие нормальной функциональностью, не высвобождаются, когда ген MYC и ген BMI1 остаются принудительно экспрессированными.
Далее, для клеточной линии, принудительно экспрессирующей ген c-MYC и ген BMI1 посредством рМХ tet off c-MYC 2A BMI1 вектора, после выключения принудительной экспрессии в условиях добавления тетрациклина и отсутствия (3-эстрадиола анализировали способность к активации интегрина CD41a+/CD42b+тромбоцитов на 4 сутки культивирования с применением проточного цитометра (Фиг.19). В результате было установлено, что РАС1 антитела (антитела, связывающиеся с активированным интегрином αIIbβ3) связываются в присутствии АДФ, свидетельствуя о нормальной способности к активации интегрина (сигнал «изнутри наружу») (Фиг.19, Стимуляция АДФ).
Эти результаты указывают, что хотя тромбоциты, полученные из мегакариоцитарной клеточной линии, выращенной с принудительной экспрессией гена с-MYC, имеют функциональное нарушение, тромбоциты, обладающие нормальной функциональностью, в мегакариоцитарной клеточной линии можно получить путем выключения принудительной экспрессии гена c-MYC и подобным образом.
Регуляцию экспрессии гена c-MYC и гена BMI1 в мегакариоцитарных клетках-предшественниках, описанных выше, также можно применять для гена семейства MYC, гена BCLXL, и гена НОХА2, используемых для создания линии эритроидных клеток-предшественников, обеспечивая индукцию зрелых эритроцитов.
Было установлено, что MYC и BMI1 вызывают клеточный рост на стадии МЕР фракций, которые являются клетками-предшественниками, общими для мегакариоцитарных клеток и эритроидных клеток, или на стадии мегакариоцитарных клеток-предшественников, более дифференцированных, чем МЕР фракции (Фиг.20). Поскольку мегакариоцитарные клетки-предшественники без мульти-полиплоидизации, в которые введены ген c-MYC и ген BMI, можно криоконсервировать, мегакариоцитарные клетки и тромбоциты можно приготовить из замороженных запасов когда это необходимо.
Подобным образом, линию эритроидных клеток-предшественников, полученных при введении гена MYC и гена BCLXL или НОХА2, можно криоконсервировать, и оттаивать и готовить когда это необходимо.
Кроме того, путем положительной регуляции или отрицательной регуляции экспрессии введенных генов MYC и BMI1 можно приготовить тромбоциты или эритроидные клетки, сохраняющие биологическую активность, в достаточном количестве.
Промышленная применимость
Настоящее изобретение обеспечивает способ размножения клеток на стадии дифференцировки для получения более дифференцированных специфических клеток. С помощью способа в соответствии с настоящим изобретением, например, для клеток крови, можно получить клетки на необходимой стадии дифференцировки в большом количестве. Следовательно, настоящее изобретение в частности представляет значительный вклад в развитие лечения в области медицины.




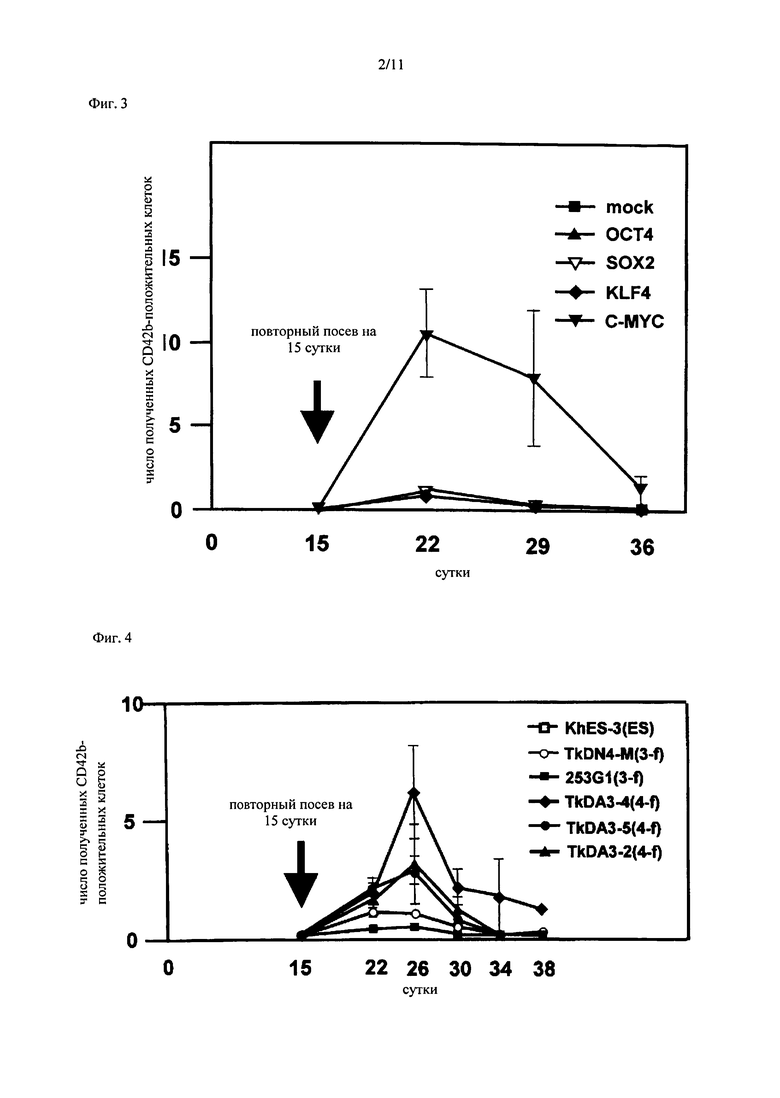

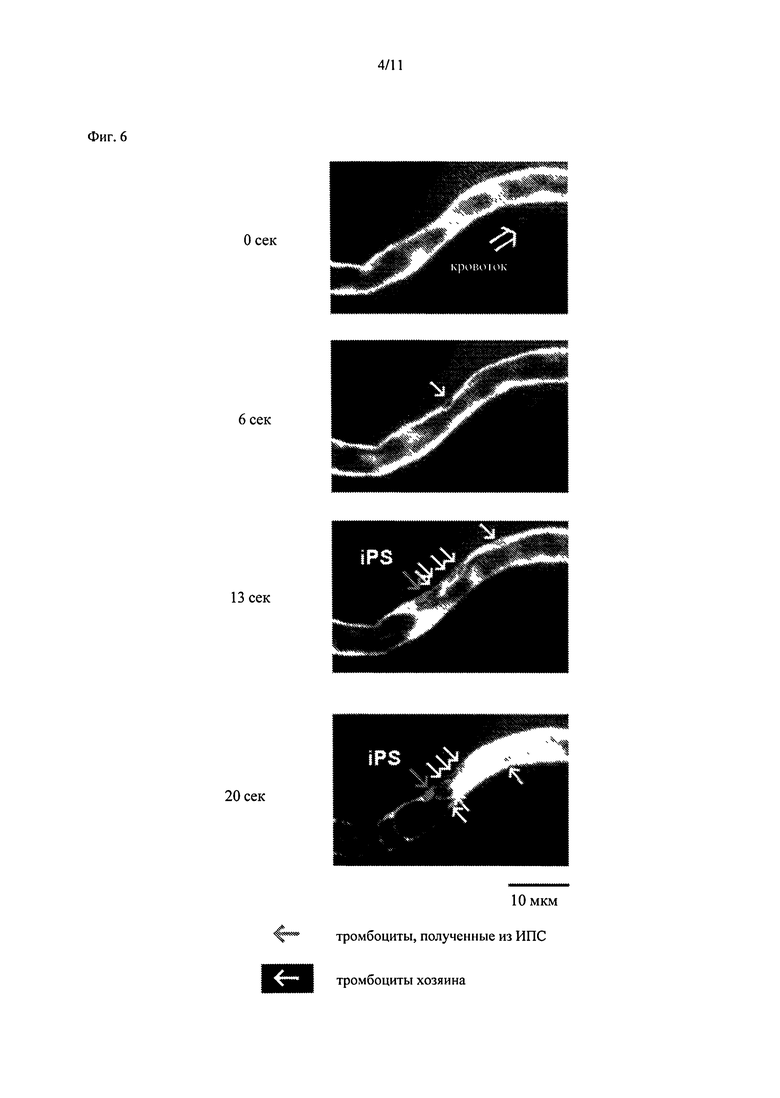



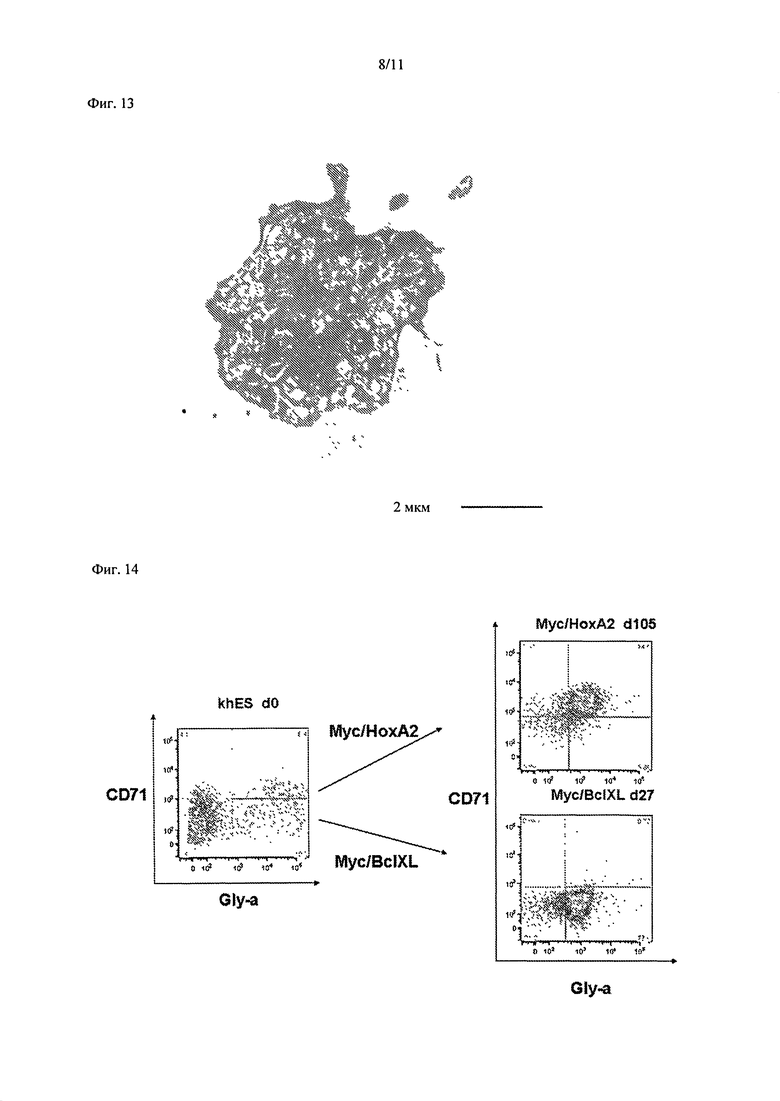

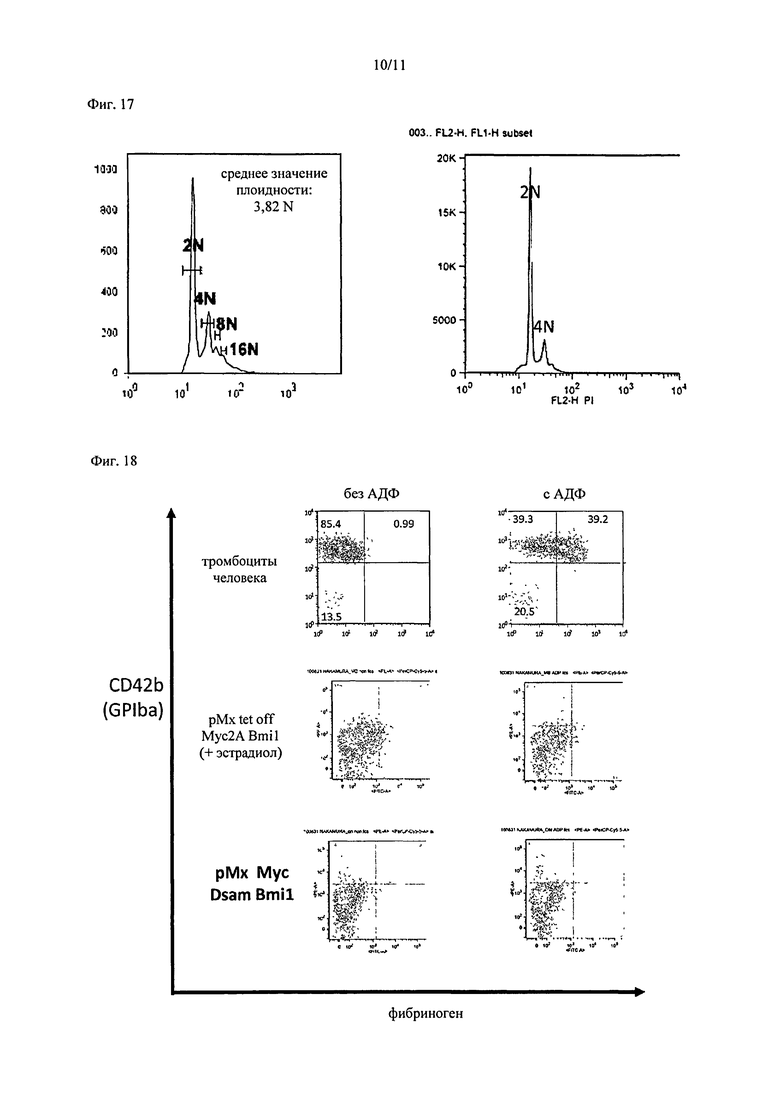

Изобретение относится к биотехнологии. Описан способ получения зрелых мегакариоцитарных клеток. Способ включает принудительную экспрессию онкогена, выбранного из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8, в гемопоэтических клетках-предшественниках, CD34-положительных клетках, или мегакариоцитарных клетках-предшественниках без мульти-полиплоидизации, и культивирование и выращивание указанных клеток; и дифференцировку выращенных клеток в зрелые мегакариоцитарные клетки. Также описан способ получения препарата тромбоцитов, включающий: получение зрелых мегакариоцитарных клеток описанным выше способом; извлечение из культуры мегакариоцитарных клеток фракции культурального раствора, которая изобилует тромбоцитами, высвобожденными из мегакариоцитарных клеток; и удаление из указанной фракции иных компонентов клеток крови, отличных от тромбоцитов. Представлены препараты клеток для получения зрелых мегакариоцитарных клеток и тромбоцитов, содержащие мегакариоцитарные клетки-предшественники без мульти-полиплоидизации или зрелые мегакариоцитарные клетки, в которые введен онкоген, выбранный из генов семейства MYC, и ген, выбранный из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8. Описаны наборы для получения мегакариоцитарных клеток-предшественников на стадии премультинуклеации, для получения зрелых мегакариоцитарных клеток, для получения тромбоцитов. 9 н. и 2 з.п. ф-лы, 20 ил., 4 пр.
1. Способ получения зрелых мегакариоцитарных клеток, включающий:
принудительную экспрессию онкогена, выбранного из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8, в гемопоэтических клетках-предшественниках, CD34-положительных клетках, или мегакариоцитарных клетках-предшественниках без мульти-полиплоидизации, и культивирование и выращивание указанных клеток; и дифференцировку выращенных клеток в зрелые мегакариоцитарные клетки.
2. Способ получения зрелых мегакариоцитарных клеток по п. 1, отличающийся тем, что указанный этап дифференцировки включает:
культивирование выращенных клеток путем супрессии экспрессии указанного онкогена и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8; или
культивирование выращенных клеток после удаления из клеток онкогена и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8.
3. Способ получения зрелых мегакариоцитарных клеток по п. 1, дополнительно включающий криоконсервацию выращенных клеток после этапа выращивания, в котором этап дифференцировки проводят после оттаивания клеток.
4. Способ получения препарата тромбоцитов, включающий: получение зрелых мегакариоцитарных клеток способом по п. 1;
извлечение из культуры мегакариоцитарных клеток фракции культурального раствора, которая изобилует тромбоцитами, высвобожденными из мегакариоцитарных клеток; и
удаление из указанной фракции иных компонентов клеток крови, отличных от тромбоцитов.
5. Препарат клеток для получения зрелых мегакариоцитарных клеток, содержащий мегакариоцитарные клетки-предшественники без мульти-полиплоидизации или зрелые мегакариоцитарные клетки, в которые введен онкоген, выбранный из генов семейства MYC, и ген, выбранный из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8.
6. Препарат клеток для получения тромбоцитов, содержащий мегакариоцитарные клетки-предшественники без мульти-полиплоидизации или зрелые мегакариоцитарные клетки, в которые введен онкоген, выбранный из генов семейства MYC, и ген, выбранный из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8.
7. Замороженный препарат композиции клеток для получения зрелых мегакариоцитарных клеток, содержащей препарат клеток по п. 5.
8. Замороженный препарат композиции клеток для получения тромбоцитов, содержащей препарат клеток по п. 6.
9. Набор для получения мегакариоцитарных клеток-предшественников на стадии премультинуклеации, содержащий векторы экспрессии для принудительной экспрессии онкогена, выбранный из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8; и питательную среду для культивирования клеток.
10. Набор для получения зрелых мегакариоцитарных клеток, содержащий векторы экспрессии для принудительной экспрессии онкогена, выбранного из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8; и питательную среду для культивирования клеток.
11. Набор для получения тромбоцитов, содержащий векторы экспрессии для принудительной экспрессии онкогена, выбранного из генов семейства MYC, и гена, выбранного из генов BMI1, Ring1a, Ring1b, Phc1, Phc2, Phc3, Cbx2, Cbx4, Cbx6, Cbx7 и Cbx8; и питательную среду для культивирования клеток.
| US 20090220465 A1, 03.09.2009 | |||
| СПОСОБ ПОЛУЧЕНИЯ НЕДИФФЕРЕНЦИРОВАННОЙ КЛЕТКИ | 1996 |
|
RU2177996C2 |
Авторы
Даты
2016-11-20—Публикация
2010-09-15—Подача