Область техники, к которой относится изобретение
Настоящее изобретение относится к способу эффективной полиплоидизации мегакариоцитов, не прошедших полиплоидизацию, к способу получения тромбоцитов из таких мегакариоцитов, и тому подобному.
Предшествующий уровень техники
Для лечения гематологических заболеваний или при хирургических вмешательствах требуется большое количество клеток крови. Среди клеток крови, одной из особо важных клеток крови является тромбоцит, незаменимый для гемокоагуляции и гемостаза. Существует большой спрос на тромбоциты при лейкемии, трансплантации костного мозга, противораковой терапии, и тому подобных состояниях, и поэтому потребность в постоянной поставке тромбоцитов является высокой. В настоящее время тромбоциты обычно получают из донорской крови, например, посредством способа их выделения из донорской крови, способа применения лекарств с ТПО(тромбопоэтин)-подобной (миметической структурой), способа дифференцировки мегакариоцитов из пуповинной крови или клеток костного мозга, или подобного способа. Недавно была разработана технология индукции дифференцировки плюрипотентных стволовых клеток in vitro, таких как ЭС (эмбриональные стволовые) клетки или ИПС (индуцированные плюрипотентные стволовые) клетки, для получения клеток крови, таких как тромбоциты.
Авторы настоящего изобретения разработали технологию индукции дифференцировки мегакариоцитов и тромбоцитов из ЭС клеток человека, и продемонстрировали эффективность ЭС клеток в качестве источника тромбоцитов (патентный документ 1 и непатентный документ 1). Кроме того, авторы настоящего изобретения разработали способ получения мегакариоцитов и тромбоцитов из ИПС клеток и обеспечили решение проблемы совместимости человеческого лейкоцитарного антигена (HLA), которая неизбежно возникает при переливании тромбоцитов, полученных из ЭС клеток (патентный документ 2).
Далее, для преодоления проблемы, связанной с количеством тромбоцитов и подобных им клеток, приготовленных из стволовых клеток, авторы настоящего изобретения разработали способ создания и, посредством этого, получения иммортализованной линии мегакариоцитарных клеток-предшественников из стволовых клеток и, таким образом, разработали важную технологию для получения большого количества тромбоцитов и подобных им клеток in vitro (патентный документ 3).
In vivo мегакариоциты из псевдоплоидной формации, называемые протромбоцитами (предшественниками тромбоцитов), фракционируют свою цитоплазму и высвобождают тромбоциты. Полиплоидизация мегакариоцитов, как полагают, осуществляется путем эндомитоза до стадии высвобождения тромбоцитов. Эндомитоз мегакариоцитов является мультиполярным митозом, не сопровождающимся образованием борозды дробления и удлинением веретена и вызванным аномальным кариокинезом и митозом цитоплазмы. В результате эндомитоза образуются клетки, содержащие несколько сегментированных ядер. Полиплоидизация мегакариоцитов индуцируется путем повторения такого эндомитоза.
К настоящему времени имеются данные о результатах многих исследований по полиплоидизации мегакариоцитов. Lodier et al. показали (непатентный документ 1), что при эндомитозе мегакариоцитов не выявлена локализация миозина II в сократительном кольце не-мышечных клеток, несмотря на образование борозды дробления и дефектов в сократительном кольце и расширение веретена. Было показано, что такие аномалии в сократительном конце или расширении веретена становятся более заметными при ингибировании активности RhoA и Rock (непатентный документ 2). RhoA накапливается в борозде дробления и вызывает активацию некоторых эффекторных факторов, включая Rho-киназу (Rock), цитрон-киназу, LIM-киназу, и mDia/формины. Эти результаты позволили предположить, что при ингибировании активности таких факторов, как RhoA и Rock, вовлеченных в формирование сократительного кольца, вызывается эндомитоз мегакариоцитов. Также сообщалось, что когда усиливается Rho сигнал, находящийся после сигнала интегрина альфа2/бета1, образование протромбоцитов из незрелых мегакариоцитов, не прошедших полиплоидизацию, подавляется.
Сообщалось, что поли-транс-ретиноевая кислота (ПТРК), некий фактор транскрипции и вальпроевая кислота, известная как ингибитор гистон-деацителазы, вовлечены в дифференцировку мегакариоцитов. Schweinfurth et al. установили, что обработка незрелых мегакариоцитов поли-транс-ретиноевой кислотой или вальпроевой кислотой стимулирует полиплоидизацию (непатентный документ 3). Далее, сообщалось, что полиплоидизация мегакариоцитов стимулируется, когда осуществляется нокдаун продукта p53, гена-супрессора рака (непатентный документ 4).
Также было показано, что, в качестве фактора, влияющего на процедуру дифференцировки мегакариоцитов, культивирование незрелых мегакариоцитов при 39°C, температуре, превышающей обычную температуру культивирования, вызывает индукцию полиплоидных зрелых мегакариоцитов и образование протромбоцитов (непатентный документ 5).
Список цитированных документов
Патентные документы.
Патентный документ 1: WO 2008/041370.
Патентный документ 2: WO 2009/122747.
Патентный документ 3: WO 2011/034073 Heпатентные документы.
Heпатентный документ 1: Takayama и др., Blood, 111: 5298-5306 2008.
Heпатентный документ 2: Lordier и др.. Blood, 112: 3164-3174 2009.
Heпатентный документ 3: Schweinfurth и др.. Platelets, 21: 648-657 2010.
Heпатентный документ 4: Fuhrken и др., J. Biol. Chem., 283: 15589-15600 2008.
Heпатентный документ 5: Proulx и др., Biotechnol. Bioeng., 88: 675-680 2004.
Краткое изложение сущности настоящего изобретения
Проблема, решаемая настоящим изобретением
При установлении того факта, что количество функциональных тромбоцитов (тромбоцитов, обладающих активностью in vivo, такой как гемостатическая активность, и характеризующихся как CD42b+), получаемых из мегакариоцитов, чья «полиплоидизация» не происходит в достаточной степени, является слишком малым для клинического применения, авторы настоящего изобретения предположили, что для эффективного получения функциональных тромбоцитов in vitro полиплоидизация мегакариоцитов должна быть усилена.
Таким образом, задачей настоящего изобретения является обеспечение способа стимуляции полиплоидизации мегакариоцитов и получение таким образом большего количества полиплоидных мегакариоцитов, способа эффективного получения тромбоцитов из полиплоидных мегакариоцитов, и тому подобное.
Средства решения указанной проблемы
С учетом вышеизложенной проблемы, авторы настоящего изобретения попытались стимулировать полиплоидизацию мегакариоцитов, приготовленных из плюрипотентных стволовых клеток (ЭС клеток, ИПС клеток, и тому подобных), чья полиплоидизация не происходит в достаточной степени. Во-первых, авторы настоящего изобретения провели исследования с иммортализованной линией мегакариоцитарных клеток-предшественников (со ссылкой на патентный документ 3), полученной ими самими из плюрипотентных стволовых клеток. Эта иммортализованная линия мегакариоцитарных клеток-предшественников обладает повышенным пролиферативным потенциалом и получена (иммортализована) путем индукции экспрессии такого онкогена, как MYC, или такого гена, как BMI1, в мегакариоцитарных клетках-предшественниках, полученных из плюрипотентных стволовых клеток.
Для стимуляции полиплоидизации этой иммортализованной линии мегакариоцитарных клеток-предшественников авторам настоящего изобретения удалось эффективно индуцировать полиплоидизацию путем принудительной экспрессии гена-супрессора апоптоза в случае подавления экспрессии онкогена и гена polycomb.
Авторы настоящего изобретения также подтвердили, что, как принудительная экспрессия гена-супрессора апоптоза, так и ингибирование экспрессии или функции продукта гена p53 дополнительно повышают эффективность полиплоидизации. Далее, они подтвердили, что обработка линии мегакариоцитарных клеток-предшественников ингибитором ROCK (Rho-ассоциированной протеинкиназы, содержащей биспиральный мотив) или ингибитором HDAC (деацетилазы гистонов) в культуре при 39°C также эффективна для индукции полиплоидизации. Более того, они установили, что обработка ингибитором функции актомиозинового комплекса (комплекса актина и миозина) сильно стимулирует полиплоидизацию.
Они установили, что полиплоидные мегакариоциты с высокой степенью полиплоидизации, полученные с помощью настоящего изобретения, содержат мегакариоциты 4N или 8N или больше в более высокой степени, чем известные к настоящему времени, и в то же самое время содержат такие клетки в соотношении, гораздо большем, чем у зрелых мегакариоцитов, полученных in vivo.
Далее, авторы настоящего изобретения установили, что в полиплоидных зрелых мегакариоцитах с достаточной степенью полиплоидизации число тромбоцитов, полученных из одного мегакариоцита, оказывается резко повышенным при принудительной экспрессии гена-супрессора апоптоза. Кроме того, они подтвердили, что эффективность получения тромбоцитов можно дополнительно повысить путем культивирования в среде с добавлением ингибитора ROCK. После изучения оптимальных условий периода культивирования, температуры культивирования и тому подобного, они завершили настоящее изобретение.
Настоящее изобретение относится к:
(1) способу получения полиплоидных мегакариоцитов, включающему стадию принудительной экспрессии гена-супрессора апоптоза в мегакариоцитах, не прошедших полиплоидизацию, и культивирование клеток;
(2) способу, описанному в пункте (1), в котором геном-супрессором апоптоза является ген BCL-XL;
(3) способу, описанному выше в пунктах (1) или (2), в котором на стадии культивирования ингибируют экспрессию или функцию продукта гена p53;
(4) способу, описанному выше в любом из пунктов (1)-(3), в котором на стадии культивирования мегакариоциты, не прошедшие полиплоидизацию, подвергают по меньшей мере одной из следующих обработок (a)-(c):
(a) обработке ингибитором функции актомиозинового комплекса;
(b) обработке ингибитором ROCK; и
(c) обработке ингибитором HDAC;
(5) способу, как описано в пункте (4), в котором ингибитором ROCK является Y27632; ингибитором HDAC является вальпроевая кислота; а ингибитором функции актомиозинового комплекса является блеббистатин;
(6) способу, описанному выше в любом из пунктов (1)-(5), в котором стадию культивирования проводят при температуре выше 37°C;
(7) способу, описанному выше в любом из пунктов (1)-(6), в котором мегакариоциты, не прошедшие полиплоидизацию, получают посредством стимуляции в клетках экспрессии онкогена и любого из следующих генов из (i)-(iii) на любой стадии дифференцировки от гемопоэтических клеток-предшественников до мегакариоцитов, не прошедших полиплоидизацию:
(i) гена, подавляющего экспрессию гена p16 или гена p19;
(ii) гена, подавляющего экспрессию гена Ink4a/Arf; и
(iii) гена polycomb;
и культивирования и пролиферации клеток;
(8) способу, описанному в пункте (7), в котором в качестве онкогена используют ген c-MYC, а в качестве любого из генов (i)-(iii) используют BMI1;
(9) способу, описанному выше в пунктах (7) или (8), в котором гемопоэтические клетки-предшественники получают из клеток, выбранных из группы, состоящей из ИПС клеток, ЭС клеток, гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга или периферической крови, и гемопоэтических стволовых клеток;
(10) композиции клеток крови, содержащей полиплоидные мегакариоциты, полученные способом, описанным выше в любом из пунктов (1)-(9);
(11) способу получения тромбоцитов, включающему:
- стадию получения полиплоидных мегакариоцитов с использованием способа, описанного выше в любом из пунктов (1)-(9), и культивирования клеток; и
- стадию сбора тромбоцитов из культуры полиплоидных мегакариоцитов;
(12) способу, описанному выше в пункте (11), в котором стадию культивирования полиплоидных мегакариоцитов проводят при подавлении экспрессии гена-супрессора апоптоза, который принудительно экспрессирован, или после удаления гена-супрессора апоптоза из клеток;
(13) способу, описанному выше в пунктах (11) или (12), в котором стадию культивирования полиплоидных мегакариоцитов проводят при отсутствии сыворотки и/или отсутствии фидерных клеток;
(14) способу, описанному в любом из пунктов (11)-(13), в котором стадию культивирования полиплоидных мегакариоцитов проводят на протяжении от 1 до 15 суток;
(15) способу, описанному в любом из пунктов (11)-(14), в котором стадию культивирования полиплоидных мегакариоцитов проводят при 37°C;
(16) способу, описанному в любом из пунктов (11)-(15), в котором на стадии культивирования полиплоидных мегакариоцитов в среду добавляют ингибитор ROCK и/или ингибитор функции актом иозинового комплекса;
(17) способу, описанному в пункте (16), в котором ингибитором ROCK является Y27632, а ингибитором функции актомиозинового комплекса является блеббистатин;
(18) тромбоцитам, полученным способом, описанным в любом из пунктов (11)-(17); и
(19) продукту крови, содержащему тромбоциты, описанные в пункте (18).
Технический результат, достигаемый настоящим изобретением
Настоящее изобретение обеспечивает возможность искусственной стимуляции полиплоидизации мегакариоцитов. В частности, настоящее изобретение также можно эффективно применять для стимуляции полиплоидизации мегакариоцитов, полученных in vitro, как сообщалось ранее, и настоящее изобретение обеспечивает возможность получения мегакариоцитов (например, популяции мегакариоцитов, содержащей в высоком соотношении мегакариоциты 4N или более), в которых достигается более высокий уровень полиплоидизации, чем у мегакариоцитов, доступных in vivo.
Далее, настоящее изобретение обеспечивает возможность существенного повышения числа тромбоцитов, производимых из одного полиплоидного мегакариоцита.
Оно обеспечивает возможность существенного уменьшения времени, необходимого для получения тромбоцитов из стволовых клеток, и, как следствие, обеспечения массовой продукции тромбоцитов путем индукции мегакариоцитов, не прошедших полиплоидизацию, из стволовых клеток; пролиферации мегакариоцитов, не прошедших полиплоидизацию, с применением, например, способа, описанного в патентном документе 3, и полиплоидизации мегакариоцитов, не прошедших полиплоидизацию, для получения тромбоцитов в соответствии со способом согласно настоящему изобретению. Тромбоциты, полученные, как описано выше, являются CD42b-позитивными клетками, и могут найти широкое клиническое применение.
Краткое описание чертежей
На Фиг.1A показана схема анализа, проведенного для изучения цитокиновой зависимости пролиферации клеток iMKPC типа I.
На Фиг.1B показано изменение числа клеток, когда клетки iMKPC типа I культивировали в среде с добавлением ФСК (фактора стволовых клеток) и ТПО (тромбопоэтина) (S+T), ФСК и ЭПО (эритропоэтина) (S+E), ФСК (S), ТПО (T), и ЭПО (E), соответственно, по схеме, показанной на Фиг.1A.
На Фиг.1C показаны полученные с помощью проточной цитометрии гистограммы экспрессии поверхностного маркера клеток iMKPC типа I на 8 сутки по схеме, показанной на Фиг.1A.
На Фиг.1D показаны результаты принудительной экспрессии c-MYC и BMI1 CD34-позитивными клетками, полученными из пуповинной крови, и стимуляции пролиферации мегакариоцитов, не прошедших полиплоидизацию.
На Фиг.2A показаны результаты изучения влияния цитокинов на пролиферацию клеток iMKPC типа II.
На Фиг.2B показаны результаты изучения экспрессии CD41a и CD42b в клетках iMKPC типа II.
На Фиг.3 показаны результаты микроскопического анализа полиплоидизации клеток iMKPC типа II при принудительной экспрессии BCL-XL и подавлении экспрессии гена p53, и полиплоидизации при добавлении в среду блеббистатина.
На Фиг.4 показаны результаты микроскопического анализа при изучении влияния BCL-XL на пролиферацию клеток iMKPC типа II.
На Фиг.5 показано влияние ингибитора ROCK на полиплоидизацию мегакариоцитов. После подавления экспрессии MYC/BMI1 в мегакариоцитах (путем культивирования в присутствии доксициклина и в отсутствие эстрадиола) добавляли ингибитор ROCK (Y27632) (10 мкМ). После культивирования в течение 7 суток изучали степень полиплоидизации. Показаны гистограммы, полученные при проточной цитометрии клеток (контроль), к которым не добавляли ингибитор ROCK, и клеток (Rock i), к которым добавляли ингибитор, при этом клетки окрашивали ядерным красителем Хехст, а затем окрашивали CD41a, мегакариоцитарный маркер, с применением антител к CD41a. На графике «В» показаны результаты с «A».
На Фиг.6 показаны результаты изучения уровня экспрессии гена, участвующего в созревании мегакариоцитов при культивировании при 39°C. После подавления в мегакариоцитах экспрессии MYC/BMI1 полученные клетки культивировали при 39°C в течение 5 суток. Уровень экспрессии группы генов (GATA1 (A), PF4 (B), NFE2 (C), и β-тубулина (D)), необходимых для созревания мегакариоцитов, изучали с помощью количественной ПНР (к-ПЦР). Уровень экспрессии, показанный на этих графиках, является отношением к уровню экспрессии GAPDH (глицеральдегид-3-фосфатдегидрогеназы).
На Фиг.7 показаны результаты изучения влияния BCL-XL, одного из генов-супрессоров апоптоза, на полиплоидизацию мегакариоцитов. Степень полиплоидизации изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), и культивирования полученных клеток в течение 7 суток. Показаны гистограммы, полученные с помощью проточной цитометрии, для каждой из клеток, экспрессирующих MYC/BMI1 (график слева), клеток, обработанных ингибитором ROCK, после подавления экспрессии MYC/BMI1 (средний график), и клеток, подвергнутых экспрессии BCL-XL, в дополнение к подавлению экспрессии MYC/BMI1 и обработке ингибитором ROCK (график справа), при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A». «C» включает микрографии клеток, имеющих ядра 2N, 4N, 8N, и 8N или больше.
На Фиг.8 показана кривая роста клеток, экспрессирующих BCL-XL. Показаны результаты изменения числа BCL-XL-экспрессирующих клеток (CD41a+) (■) и числа клеток, не экспрессирующих (CD41a+) (▲), в зависимости от суток культивирования при подавлении экспрессии MYC/BMI1 в мегакариоцитах в присутствии ингибитора ROCK (10 мкМ).
На Фиг.9 показано влияние нокдауна p53 на полиплоидизацию. Степень полиплоидизации CD41a+ клеток изучали путем подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), нокдауна гена p53 с последующим культивированием полученных клеток при 39°C в течение 7 суток. Показаны полученные с помощью проточной цитометрии гистограммы каждой из контрольных клеток (контроль), в которых не был проведен нокдаун p53, и клеток (SiP53), в которых был проведен нокдаун p53, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.10 показано влияние обработки вальпроевой кислотой на полиплоидизацию. Степень полиплоидизации клеток CD41a+ изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии ингибитора ROCK (10 мкМ), нокдауна гена p53, обработку полученных клеток вальпроевой кислотой (0,5 мМ) и культивирование при 39°C в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы каждой из клеток (SiP53), не обработанных вальпроевой кислотой, и клеток (SiP53 VLP), обработанных вальпроевой кислотой, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.11 показано влияние ингибитора АТФ-азы тяжелой цепи миозина IIA/B (ингибитора функции актомиозинового комплекса) на полиплоидизацию мегакариоцитов. Степень полимеризации изучали после подавления экспрессии MYC/BMI1 в мегакариоцитах (путем культивирования в присутствии доксициклина и в отсутствие эстрадиола), добавления блеббистатина (10 мкг/мл), ингибитора АТФ-азы тяжелой цепи миозина IIA/B, и культивирования в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы клеток (-), к которым не добавляли блеббистатин, и клеток (+), к которым добавляли блеббистатин (10 мкг/мл), при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «B» показаны результаты из «A».
На Фиг.12 показано влияние обработки блеббистатином, используемым в комбинации с другими видами обработки, на полиплоидизацию мегакариоцитов. Изучали степень полиплоидизации клеток CD41a+ после подавления экспрессии MYC/BMI1 в мегакариоцитах, включая экспрессию BCL-XL в присутствии Y27632 (10 мкМ) и вальпроевой кислоты (0,5 мМ), нокдауна гена p53, добавления блеббистатина (10 мкг/мл), и культивирования при 39°C в течение 7 суток. Показаны полученные путем проточной цитометрии гистограммы каждой из клеток (-), не обработанных блеббистатином, и клеток (+), обработанных блеббистатином, при этом эти клетки окрашивали ядерным красителем Хехст, а затем мегакариоцитарный маркер CD41a окрашивали антителами к CD41a. На графике «В» показаны результаты из «A».
На Фиг.13 показана кривая роста клеток, подвергнутых обработке блеббиетатином в комбинации с другими видами обработки. Изменение числа следующих клеток показано на графике (A) в зависимости от суток культивирования: клетки (CD41a+), обработанные блеббистатином (CD41a+) (▲), и клетки (CD41a+), не обработанные блеббистатином (■), каждые после подавления экспрессии MYC/BMI1 в мегакариоцитах; BCL-XL экспрессировали в присутствии Y27632 (10 мкМ) и вальпроевой кислоты (0,5 мМ), и нокдауна гена p53. Микрографии этих клеток показаны на «B».
На Фиг.14 показаны результаты изучения экспрессии CD41a и CD42b в мегакариоцитах и тромбоцитах в обоих случаях, когда подавлялась и не подавлялась экспрессия BL-XL во время стадии высвобождения тромбоцитов.
На Фиг.15 показано количество клеток, измеренное во время включения/выключения экспрессии BCL-XL на основе результатов, показанных на Фиг.14. На «A» показано число CD42b-позитивных тромбоцитов, на «B» показано число CD41a-позитивных/CD42b-позитивных мегакариоцитов, а на «C» показано число CD4 la-позитивных мегакариоцитов.
На Фиг.16 показаны результаты изучения влияния температуры культивирования, установленной на 35°C, 37°C и 39°C, на число тромбоцитов в случае, когда была подавлена экспрессия BCL-XL и когда она не была подавлена во время стадии высвобождения тромбоцитов.
На Фиг.17 показаны результаты изучения влияния присутствия или отсутствия сыворотки, фидерных клеток и блеббистатина на число тромбоцитов.
На Фиг.18 показаны результаты изучения влияния сыворотки, фидерных клеток и блеббистатина на соотношение CD42b тромбоцитов.
На Фиг.19 показан один пример предпочтительных условий культивирования на этапе полиплоидизации (MCB экспансии) мегакариоцитов и во время стадии высвобождения тромбоцитов (продукции тромбоцитов).
На Фиг.20 показано увеличение соотношения тромбоцитов CD42b путем подавления экспрессии BCL-XL и дополнительное увеличение соотношения тромбоцитов CD42b путем удаления сыворотки и фидерных клеток из среды и добавления блеббистатина.
На Фиг.21 показаны результаты изучения влияния функциональных ингибиторных антител HIP1 к CD42b на эффект агглютинации периферических тромбоцитов ристоцетином.
На Фиг.22 показаны результаты изучения влияния функциональных ингибиторных антител HIP1 к CD42b на образование тромба in vivo.
На Фиг.23 показаны результаты соответствующей трансплантации тромбоцитов мыши NOG, полученных из ИПС клеток, при добавлении KP-457 (S-45457), ингибитора ADAM1, и повышения уровня экспрессии GPIba (CD42b); и тромбоцитов, полученных из ИПС клеток без добавления ингибитора ADAM17; и измерения числа тромбоцитов, участвующих в образовании тромба.
На Фиг.24 показаны результаты трансплантации периферических тромбоцитов человека, ложно поврежденных путем добавления 100 мкм СССР (карбонилцианид-м-хлорфенилгидразона), агента, разрушающего тромбоциты в присутствии KP-457; тромбоцитов, к которым добавляли СССР в отсутствие KP-457; и свежих тромбоцитов, соответственно; и измерения числа тромбоцитов, участвующих в образовании тромба.
Способ осуществления настоящего изобретения
(Способ получения полиплоидных мегакариоцитов)
Настоящее изобретение обеспечивает способ стимуляции полиплоидизации мегакариоцитов, и таким образом, получения полиплоидных мегакариоцитов.
Один вариант способа получения полиплоидных мегакариоцитов в соответствии с настоящим изобретением включает этап стимуляции экспрессии гена-супрессора апоптоза в мегакариоцитах, не прошедших полиплоидизацию, и культивирование указанных клеток.
Термин «мегакариоциты, не прошедшие полиплоидизацию», применяющийся здесь, не ограничивается каким-либо образом, и может означать мегакариоциты, полученные из пуповинной крови или костномозговых клеток, чья полиплоидизация не прошла в достаточной степени, или мегакариоциты, индуктивно дифференцированные из ЭС клеток, ИПС клеток; гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга, или периферической крови; клеток-предшественников или подобных им клеток, в которых полиплоидизация не произошла в достаточной степени.
Далее, термин «мегакариоциты, не прошедшие полиплоидизацию», применяющийся в настоящей заявке, означает клетки, которые характеризуются, например, как CD41a-позитивные/CD42a-позитивные/CD42b-позитивные.
Термин «полиплоидные мегакариоциты» или «мегакариоциты, подвергнутые полиплоидизации» означает клетки или популяцию клеток, в которых число ядер повышено, по сравнению с «мегакариоцитами, не прошедшими полиплоидизацию». Например, когда мегакариоциты, к которым применяют способ согласно настоящему изобретению, имеют 2N ядер, то клетки, имеющие 4N или больше ядер, соответствуют «полиплоидным мегакариоцитам» или «мегакариоцитам, подвергнутым полиплоидизации». Даже в мегакариоцитах, не прошедших полиплоидизацию, число ядер не ограничено одним. В клеточной популяции наблюдается значительное повышение числа ядер после определенного срока; популяцию клеток до этого определенного срока можно назвать «мегакариоцитами, не прошедшими полиплоидизацию», а популяцию клеток после этого определенного срока можно назвать «мегакариоцитами, подвергшимися полиплоидизации».
Настоящее изобретение также можно применять к мегакариоцитам, не прошедшим полиплоидизацию, которые были индуктивно дифференцированы из плюрипотентных стволовых клеток (таких, как ЭС клетки и ИПС клетки); гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга, или периферической крови; и клеток-предшественников. Например, предпочтительными являются мегакариоциты, выделенные из сетчатой структуры (которые можно также называть ЭС-sac или ИПС-sac), полученной из ЭС клеток или ИПС клеток. В настоящей заявке «сетчатая структура», полученная из ЭС клеток или ИПС клеток, означает структуру, подобную трехмерному мешку (имеющему внутренне пространство), полученную из ЭС клеток или ИПС клеток. Она образована из популяции эндотелиальных клеток и подобных им и содержит гемопоэтические клетки-предшественники (см. патентный документ 1, патентный документ 2, и непатентный документ 2).
Не устанавливается никаких конкретных ограничений для ЭС клеток, используемых в настоящем изобретении, и можно использовать такие клетки, которые окончательно получены в виде линии ЭС клеток путем культивирования оплодотворенных яйцеклеток на стадии бластоцисты вместе с фидерными клетками, выделения пролиферирующих клеток, полученных из внутреннего скопления клеток в виде индивидуальных клеток, и воспроизведения субкультуры.
В случае применения ИПС клеток, можно применять клетки любого происхождения, поскольку они приобрели плюрипотентную дифференцировку, подобную ЭС клеткам, путем введения некоторых видов генов факторов транскрипции (которые далее указаны как «фактор плюрипотентной дифференцировки»), способных обеспечить плюрипотентную дифференцировку соматических клеток (например, фибробластов или клеток крови) с. В качестве факторов плюрипотентной дифференцировки уже описаны многие факторы. Примеры включают семейство Oct (например, Oct3/4), семейство SOX (например, SOX2, SOX1, SOX3, SOX 15 и SOX 17), семейство Klf (например, Klf4 и Klf2), семейство MYC (например, c-MYC, N-MYC и L-MYC), NANOG и LIN28.
Авторы настоящего изобретения сообщали, что при принудительной экспрессии онкогена, такого как MYC, и гена, такого как BMI1, в мегакариоцитах, не прошедших полиплоидизацию (включая так называемые «мегакариоцитарные клетки-предшественники» в патентном документе 3), полученных из плюрипотентных стволовых клеток, итоговые мегакариоциты обладают повышенной пролиферативной способностью (патентный документ 3, JEM, 207: 2817-2830 2010).
Мегакариоциты, не прошедшие полиплоидизацию, полученные с применением вышеупомянутого способа, пригодны для применения в способе согласно настоящему изобретению.
В способе получения полиплоидных мегакариоцитов согласно настоящему изобретению, мегакариоциты, не прошедших полиплоидизацию, которые получают на любой стадии дифференцировки от гемопоэтических клеток-предшественников до мегакариоцитов перед пролиферацией, подвергают стадиям принудительной экспрессии онкогена и любого из следующих генов (i)-(iii):
(i) гена, подавляющего экспрессию гена p16 или гена p19;
(ii) гена, подавляющего экспрессию гена Ink4a/Arf; и
(iii) гена polycomb;
и культивирования и пролиферации полученных клеток.
Примеры онкогена включают ген семейства MYC, ген семейства Src, ген семейства Ras, ген семейства Raf, и гены семейства протеинкиназ, такие как c-Kit, PDGFR и Abl. Примеры генов (i)-(iii) включают ВМП, Ме118, Ring1a/b, Phc1/2/3, Cbx2/4/6/7/8, Ezh2, Eed, Suz12, HADC и Dnmt1/3a/3b, при этом наиболее предпочтительным геном является BMI1. Контроль экспрессии онкогена и гена polycomb может быть проведен специалистом в данной области техники обычным способом. Например, можно применять способ, подробно описанный в патентном документе 3, и подобный ему. Онкоген и любой из генов (i)-(iii) можно ввести в клетки на любой стадии от гемопоэтических клеток-предшественников до мегакариоцитов, не прошедших полиплоидизацию. Однако это не ограничивается экспрессией этих генов, индуцированной в мегакариоцитах, не прошедших полиплоидизацию, используемых в настоящем изобретении.
Онкоген и гены (i)-(iii) (например, ген BMI1), использующиеся в настоящем изобретении, включают не только гены, имеющие уже известную последовательность кДНК, но также гомологи, идентифицированные с применением предшествующего уровня техники, на основе гомологии известной последовательности кДНК.
Например, среди генов семейства MYC геном c-MYC является ген, имеющий нуклеотидную последовательность SEQ ID NO: 1. Гомологами гена c-MYC являются гены, имеющие последовательность кДНК, по существу ту же самую, как последовательность нуклеиновой кислоты SEQ ID NO: 1. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 1, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 1, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 1 в жестких условиях, где белок, кодируемый такой ДНК, участвует в амплификации клеток на стадии дифференцировки, таких как мегакариоциты, не прошедшие полиплоидизацию.
Геном BMI1 является ген, имеющим последовательность нуклеиновой кислоты, например, SEQ ID NO: 2. Гомологом гена BMI1 является ген, имеющий последовательность кДНК, по существу такую же, как последовательность нуклеиновой кислоты, например, SEQ ID NO: 2. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 2, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 2, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 2 в жестких условиях, где белок, кодируемый такой ДНК, подавляет онкоген-индуцированное старение в клетках, в которых экспрессируется такой онкоген, как ген семейства MYC, таким образом, стимулируя амплификацию клеток.
Вышеупомянутый онкоген и гены (i)-(iii) необходимы для пролиферации клеток, но они могут ингибировать стимуляцию полиплоидизации или высвобождения тромбоцитов так, что экспрессия этих генов может быть подавлена перед этапом полиплоидизации. Подавление экспрессии этих генов в клетках облегчает высвобождение функциональных тромбоцитов (патентный документ 3).
Термин «ген-супрессор апоптоза», применяющийся в настоящей заявке, не ограничивается каким-либо образом при условии, что он является геном, подавляющим апоптоз. Примеры такого гена включают ген BCL2, ген BCL-XL, сурвивин и MCL1.
Авторы настоящего изобретения установили, что когда принудительная экспрессия онкогена и любого из генов (i)-(iii) подавляется, может быть индуцирована гибель пролиферирующих мегакариоцитов перед полиплоидизацией. Как показано далее в Примерах, подавление экспрессии онкогена и любого из генов (i)-(iii) перед полиплоидизацией и принудительная экспрессия гена-супрессора апоптоза в клетках стимулируют полиплоидизацию мегакариоцитов, приводя к эффективному получению тромбоцитов из мегакариоцитов, не прошедших полиплоидизацию.
Как показано далее в Примерах, мегакариоциты продолжают долговременную пролиферацию при принудительной экспрессии гена-супрессора апоптоза.
Гены-супрессоры апоптоза, такие как ген BCL-XL и ген BCL2, для применения в настоящем изобретении включают не только гены, чья последовательность кДНК уже описана, но также гомологи, идентифицированные с помощью предшествующего уровня техники на основе гомологии к известной последовательности кДНК. Например, геном BCL-XL, одним из генов-супрессоров апоптоза, является ген, имеющий последовательность нуклеиновой кислоты SEQ ID NO: 3. Гомологом гена BCL-XL является ген, имеющий последовательность кДНК, по существу эквивалентную последовательности нуклеиновой кислоты SEQ ID NO: 3. кДНК, имеющей последовательность, по существу такую же, как последовательность нуклеиновой кислоты SEQ ID NO: 3, является ДНК, имеющая примерно 60% или большую идентичность последовательности, предпочтительно примерно 70% или большую идентичность последовательности, более предпочтительно, примерно 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% или 98% идентичность последовательности, наиболее предпочтительно, примерно 99% идентичность последовательности с ДНК, имеющей последовательность SEQ ID NO: 3, или ДНК, способной к гибридизации с ДНК, имеющей последовательность, комплементарную последовательности нуклеиновой кислоты SEQ ID NO: 3 в жестких условиях, где белок, кодируемый такой ДНК, эффективен для подавления апоптоза.
Термин «жесткие условия», применяющийся в настоящей заявке, означает условия гибридизации, легко определяемые специалистом в данной области техники, и являющиеся эмпирическими экспериментальными условиями, как правило, зависящими от длины зонда, температуры отмывки и концентрации соли. Обычно температура для надлежащего отжига устанавливается выше при использовании более длинного зонда, и устанавливается ниже при использовании более короткого зонда. Образование гибрида обычно зависит от способности к повторному отжигу комплементарной цепи, помещенной в среду, где температура слегка ниже ее температуры плавления.
В условиях с низкой жесткостью, например, на стадии отмывки фильтра после гибридизации, фильтр промывают в растворе 0,1×SSC, 0,1% SDS (0,1×хлорид натрия+цитрат натрия, 0,1% ДСН) при температуре от 37°C до 42°C. В условиях с высокой жесткостью, например, на стадии отмывки, фильтр промывают в растворе 5×SSC, 0,1% SDS при 65°C. Полинуклеотид с более высокой гомологией можно получить путем создания еще более жестких условий.
Для принудительной экспрессии в клетках таких генов, как онкоген, гены (i) и (iii), ген-супрессор апоптоза, можно применять любой способ, хорошо известный специалисту в данной области техники. Например, ген можно ввести в клетки с применением системы для введения гена с использованием лентивируса или ретровируса, а затем экспрессировать. Когда проводят экспрессию гена с применением вирусного вектора для введения гена, целевой ген может быть экспрессирован путем функционального связывания гена с элементом подходящего промотора ниже по ходу транскрипции, вставки полученного гена в вектор для введения гена, и затем введения гена в клетки. В настоящей заявке термин «функциональное связывание» означает, что целевой ген связан с промотором для достижения необходимой экспрессии целевого гена. В вариантах осуществления настоящего изобретения, например, целевой ген может быть постоянно экспрессирован с применением промотора CMV, промотора EF1 или подобного им. Альтернативно, подходящий промотор (индуцибельный промотор) может быть помещен под контроль элемента, обладающего активностью, контролируемой транскрипционным фактором, например, элементом ответа на некий лекарственный препарат, такого как элемент ответа на тетрациклин, а целевой ген может быть индуктивно экспрессирован при осуществлении такого контроля, как добавление препарата. Поскольку такая система экспрессии гена с применением лекарственного препарата позволяет реализовать необходимый контроль экспрессии онкогена или генов (i)-(iii), специалист в данной области техники может легко выбрать подходящую систему. Можно использовать коммерческий набор для проведения такой экспрессии. Онкоген и гены (i)-(iii), которые являются целевыми генами при контроле экспрессии, могут быть встроены в с соответствующие векторы или один вектор.
Подавление экспрессии онкогена или любого из генов (i)-(iii) в мегакариоцитах может быть достигнуто, например, путем удаления лекарственного препарата или тому подобного, и таким образом, снятия подавления индукции экспрессии с применением вышеупомянутой системы индуктивной экспрессии. Альтернативно, введенные онкоген или любые из генов (i)-(iii) могут быть удалены с применением системы Cre/lox или подобной ей для обеспечения супрессивного контроля экспрессии этих генов. Может применяться коммерческий набор, если необходимо, для супрессивной регуляции экспрессии онкогена или гена (i)-(iii).
Один вариант способа получения полиплоидных мегакариоцитов в соответствии с настоящим изобретением включает этап принудительной экспрессии гена-супрессора апоптоза в клетках, и параллельно, подавления экспрессии или функции продукта гена p53 в клетках. Термин «экспрессия» применяют в качестве термина, охватывающего транскрипцию и трансляцию. Например, термин «подавление экспрессии» может включать значение «подавление на уровне транскрипции» или «подавление на уровне трансляции».
Продукт гена p53 широко известен в качестве гена-супрессора опухоли, и его последовательность и подобные ее последовательности у различных видов животных известны.
Способ подавления функции продукта гена p53 в мегакариоцитах можно обеспечить с помощью обычной технологии в данной области техники. Примеры указанного способа включают способ введения мутации (замену, вставку или делецию, или перестановку или модификацию) в ген p53 и ингибирование таким образом получения продукта гена, и способ непосредственного ингибирования функции продукта гена. Примеры способа непосредственного введения мутации (замены, вставки, или делеции, или перестановки или модификации) в ген включают способ разрушения цельного гена p53 посредством гомологичной рекомбинации при приготовлении подходящего вектора, нацеленного на ген, и способ введения мутации в участок, важный для активности продукта гена, путем применения системы Cre/lox или подобной ей.
В качестве способа подавления функции продукта гена p53 может применяться доминантный негативный способ. Доминантный негативный способ является способом индукции в клетках избыточной экспрессии белка p53, имеющего мутацию, введенную в него для снижения или лишения его активности, с получением чрезвычайно высокого отношения белка p53, инертного в сравнении с нормальным белком p53 в клетках, и получения таким образом клеток, демонстрирующих поведение клеток с утраченной функцией белка p53.
В качестве способа супрессии продукта гена p53 может применяться способ с использованием антисмысловых последовательностей, способ с использованием рибозимов, способ РНК-интерференции или подобные им.
Способом с использованием антисмысловых последовательностей является способ подавления супрессии гена путем применения одноцепочечной нуклеиновой кислоты, имеющей основную последовательность, комплементарную целевому гену (в основном, мРНК в качестве продукта транскрипции) и имеющей обычно длину от 10 оснований до 100 оснований, предпочтительно от 15 оснований до 30 оснований. Экспрессию генов угнетают путем введения антисмысловой нуклеиновой кислоты в клетки и ее гибридизации с целевым геном. Антисмысловая нуклеиновая кислота не является полностью комплементарной целевому гену, при условии, что с ее помощью можно получить эффект подавления экспрессии целевого гена. Антисмысловая нуклеиновая кислота при необходимости может быть сконструирована специалистом в данной области техники с применением известного программного обеспечения или тому подобного. Антисмысловой нуклеиновой кислотой может быть любая нуклеиновая кислота, выбранная из ДНК, РНК, и химерой ДНК-РНК, или может быть модифицированной последовательностью.
Рибозимом является молекула нуклеиновой кислоты, каталитически гидролизующая целевую РНК и состоящая из антисмыслового участка, имеющего последовательность, комплементарную целевой РНК, и участка каталитического центра, участвующего в реакции расщепления. Рибозим может быть при необходимости сконструирован специалистом в данной области техники известным способом. Рибозим обычно является молекулой РНК, но вместо этого может применяться химерная молекула ДНК-РНК.
Способ РНК-интерференции является механизмом подавления специфичной для последовательности экспрессии гена, индуцированного двухцепочечной нуклеиновой кислотой. Способ обладает высокой специфичностью и, кроме того, он является высоко безопасным, поскольку он использует механизм подавления экспрессии гена, оригинально присутствующий т vivo.
Примеры двухцепочечной нуклеиновой кислоты, обладающей эффектом РНК-интерференции, включают миРНК. Когда миРНК применяют в клетках млекопитающих, она представляет собой двухцепочечную РНК, обычно содержащую примерно от 19 до 30 оснований, предпочтительно, примерно от 21 до 25 оснований. Двухцепочечная нуклеиновая кислота, обладающая эффектом РНК-интерференции, обычно имеет в качестве одной из цепей последовательность, комплементарную части целевой нуклеиновой кислоты, а в качестве другой цепи последовательность, комплементарную ей.
Двухцепочечную нуклеиновую кислоту, обладающую эффектом РНК-интерференции, можно сконструировать известным способом на основе базовой последовательности целевого гена. Двухцепочечной нуклеиновой кислотой, обладающей эффектом РНК-интерференции, может быть любая нуклеиновая кислота, выбранная из двухцепочечной РНК, двухцепочечной нуклеиновой кислоты ДНК-РНК химерного типа, искусственной нуклеиновой кислоты, и нуклеиновой кислоты, подвергнутой различным модификациям.
миРНК, антисмысловая нуклеиновая кислота и рибозим могут быть экспрессированы в клетке путем введения в клетки векторов (например, лентивирусных векторов), содержащих нуклеиновые кислоты, кодирующие их, соответственно. В качестве миРНК могут применяться ДНК, кодирующие две цепи, соответственно, или ДНК, кодирующая одноцепочечную нуклеиновую кислоту, полученную путем связывания двух цепей из двухцепочечной нуклеиновой кислоты посредством петли. В последнем случае одноцепочечная РНК, полученная путем внутриклеточной транскрипции, обладает структурой шпилечного типа, поскольку ее комплементарная часть гибридизована в молекулах. Такую РНК называют РНК-шпилькой (короткой шпилечной РНК). Когда РНК-шпилька экспортируется в цитоплазму, петлевая часть расщепляется ферментом (дайсером) для получения двухцепочечной РНК, обладающей эффектом РНК-интерференции.
В качестве другого способа ингибирования функции продукта гена p53 в мегакариоцитах можно применять способ прямого или непрямого ингибирования функции продукта гена p53, способ ингибирования фосфорилирования p53 и, таким образом, непрямого ингибирования активации p53 или подобный способ.
Как описано ниже в Примерах, мегакариоциты перед принудительной экспрессией гена-супрессора апоптоза и ингибированием экспрессии или функции продукта гена p53 продолжают пролиферацию, куда включены мегакариоциты, зависимые от цитокина SCF и высвобождающие тромбоциты, не являющиеся CD42b позитивными. Когда проводят принудительную экспрессию гена-супрессора апоптоза и ингибирование экспрессии продукта гена p53, мегакариоциты являются частично полиплоидными, при продолжении пролиферации и высвобождении множества CD42-позитивных тромбоцитов. На этой стадии зависимость мегакариоцитов от цитокинов меняется с ФСК на ТПО, и пролиферация и созревание протекают параллельно друг другу.
Один вариант способа получения полиплоидных мегакариоцитов в соответствии с настоящим изобретением включает по меньшей мере одну стадию обработки клеток, в которых ген-супрессор апоптоза принудительно экспрессирован при их культивировании, с (a) ингибитором функции актомиозинового комплекса; (b) ингибитором ROCK, и (c) ингибитором HDAC. С помощью вышеупомянутой обработки достигается более стабильная пролиферация и полиплоидизация.
Термин «актомиозиновый комплекс», применяющийся в настоящей заявке, означает комплекс между актином и миозином II, состоящий, например, из сократительного кольца, появляющегося ко времени цитокинеза. В актомиозиновом комплексе миозин II функционирует как движущий белок, взаимодействующий с актином и вовлеченный в сжатие сократительного кольца и тому подобное. «Ингибитор функции актомиозинового комплекса» в настоящем изобретении может ингибировать указанную функцию посредством любого механизма. Он включает, например, ингибиторы, подавляющие формирование актомиозинового комплекса, и подавляющие таким образом функцию актомиозинового комплекса; ингибиторы, подавляющие АТФ-азу тяжелой цепи миозина (MHC) IIA/IIB, и подавляющие таким образом функцию актомиозинового комплекса; и ингибирующие киназу легкой цепи миозина (M1CK), и ингибирующие таким образом функцию актомиозинового комплекса. АТФ-аза тяжелой цепи миозина IIA/B является молекулой, играющей важную роль в сжатии сократительного кольца, в то время как киназа легкой цепи миозина фосфорилирует L2, среди легких цепей миозина, и индуцирует скользящее движение между актином и миозином.
До настоящего времени сообщалось, что ингибитор ROCK подавляет эндомитоз мегакариоцитов и стимулирует полиплоидизацию. АТФ-аза тяжелой цепи миозина IIA/B или киназа легкой цепи миозина, контролирующие образование или функцию актом иозинового комплекса, функционируют позднее сигнала ROCK и более прямо контролируют сжатие сократительного кольца через регуляцию формирования или функции актомиозинового комплекса. Таким образом, предполагается, что ингибитор функции актомиозинового комплекса более эффективно подавляет эндомитоз мегакариоцитов и стимулирует полиплоидизацию по сравнению с ингибитором ROCK.
Примеры ингибитора функций актомиозинового комплекса, пригодного в настоящем изобретении, включают блеббистатин (Science, 299: 1743-1747 2003), ингибитор АТФ-азы тяжелой цепи миозина IIA/B и ML7, ингибитор киназы легкой цепи миозина. В качестве ингибитора АТФ-азы тяжелой цепи миозина IIA/B или ингибитора киназы легкой цепи миозина можно также применять нуклеиновые кислоты (например, РНК-шпильку) или антитела, ингибирующие активность АТФ-азы тяжелой цепи миозина IIA/B или киназы легкой цепи миозина.
Необходимо отметить, что термин «обработка», применяющийся здесь, означает операцию, проводимую для получения у целевых клеток эффекта ингибитора или подобного ему, например, добавление адекватного количества ингибитора или тому подобного к среде культивирования клеток для включения в клетки. В некоторых случаях в комбинации может применяться операция, стимулирующая его включение в клетки.
Один вариант способа получения мегакариоцитов в соответствии с настоящим изобретением включает стадию обработки клеток, в которых принудительно экспрессирован ген-супрессор апоптоза, ингибитором ROCK при культивировании клеток.
Примеры ингибитора ROCK (Rho-ассоциированной протеинкиназы, содержащей биспиральный мотив) включают [(Р)-(+)-транс-N-(4-пиридил)-4-(1-аминоэтил)-циклогексанкарбоксамид-2HCl⋅H2O] (Y27632). В некоторых случаях в качестве ингибитора ROCK могут также применяться антитела или нуклеиновые кислоты (например, РНК-шпилька), ингибирующие активность Rho-киназы,.
Один вариант способа получения мегакариоцитов в соответствии с настоящим изобретением включает стадию обработки клеток, в которых был принудительно экспрессирован ген-супрессор апоптоза, ингибитором HDAC при культивировании клеток.
Ингибитор HDAC подавляет активность деацетилазы гистонов (HDAC). На сегодняшний день известны многие ингибиторы HDAC. Примеры ингибиторов включают вальпроевую кислоту, трихостатин A, SAHA (субероиланилид гидроксамовой кислоты) и APHA (ароил-пирролил-гидроксамид). В частности, предпочтительно применяются вальпроевая кислота и трихостатин A. В случае, когда препарат, который предполагается использовать, предоставлен в форме соли, ингибитор может применяться в форме соли.
Оптимальную концентрацию при обработке клеток ингибитором функции актомиозинового комплекса, ингибитором ROCK, ингибитором HDAC или тому подобным специалист в данной области техники может определить заблаговременно на основе результатов предварительного анализа. Время обработки, способ обработки или тому подобное также может быть при необходимости выбрано специалистом в данной области техники. Например, когда клетки обрабатывают блеббистатином, ингибитором АТФ-азы тяжелой цепи миозина II, его можно добавлять в количестве примерно от 2 до 15 мкг/мл или примерно от 5 до 10 мкг/мл в культуральную среду, и культивировать, например, предпочтительно примерно от 5 до 10 суток, наиболее предпочтительно примерно от 6 до 7 суток. Y27632, ингибитор ROCK, можно добавлять в количестве от 5 до 15 мкМ или от 8 до 12 мкМ, предпочтительно примерно 10 мкМ, в то время как вальпроевую кислоту, ингибитор HDAC, можно добавлять в количестве примерно от 0,1 до 1 мМ или примерно от 0,2 до 0,7 мМ, предпочтительно примерно 0,5 мМ. Время обработки Y27632 или вальпроевой кислотой может составлять примерно от 10 до 21 суток, предпочтительно примерно 14 суток.
Один вариант способа получения полиплоидных мегакариоцитов в соответствии с настоящим изобретением включает содержание мегакариоцитарных клеток, в которых принудительно экспрессируют ген-супрессор, при их культивировании при температуре 37°C или больше.
Было подтверждено, что культивирование мегакариоцитов при обычных температурах 37°C или больше стимулирует дифференцировку мегакариоцитов, подвергающихся полиплоидизации. «Температура более 37°C или выше», например, составляет примерно от 37°C до 42°C, предпочтительно, примерно от 37°C до 39°C, поскольку необходимы температуры, не приносящие вред клеткам. Хотя время культивирования при температуре 37°C или выше может определяться как необходимое для контроля числа мегакариоцитов, подвергающих полиплоидизации, оно составляет, например, от 10 суток до 28 суток, предпочтительно, от 14 суток до 21 суток.
Какие-либо конкретные ограничения в отношении других условий культивирования на стадии проведения принудительной экспрессии гена-супрессора апоптоза в мегакариоцитах, не подвергшихся полиплоидизации, а затем культивирования полученных клеток, не применяется, при условии, что достигается результат согласно настоящему изобретению, предпочтительно при указанных условиях. Могут также применяться известные условия культивирования или условия, эквивалентные им. Например, ТПО, ИЛ-1, ИЛ-3, ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-11, ЭПО, ГМ-КСФ, ФСК, Г-КСФ, Flt3 лиганд и гепарин могут применяться по отдельности или в комбинации из двух или более соединений, и могут добавляться в среду.
Альтернативно, могут добавиться фидерные клетки, если это необходимо для культивирования.
Мегакариоциты, подвергнувшиеся полиплоидизации, полученные с применением вышеупомянутого способа, эффективно продуцируют CD42b-позитивные функциональные тромбоциты. Как показано далее в Примерах, CD42b-позитивные тромбоциты обладают высокой тромбообразующей способностью как in vivo, так и in vitro. Кроме того, мегакариоциты, подвергнувшиеся полиплоидизации, могут продуцировать функциональные тромбоциты даже при оттаивании после криоконсервации.
Настоящее изобретение также обеспечивает композицию клеток крови, обладающую высоким содержанием полиплоидных мегакариоцитов. Термин «композиция клеток крови» может включать, как «полиплоидные мегакариоциты», у которых полиплоидизация стимулирована посредством способа согласно настоящему изобретению, так и мегакариоциты, приготовленные с помощью другого способа, и другие клетки крови.
Обработка мегакариоцитов, не прошедших полиплоидизацию, посредством способа согласно настоящему изобретению может стимулировать их дифференцировку в полиплоидные мегакариоциты с 4N или больше. Таким образом, применение способа согласно настоящему изобретению к популяции мегакариоцитов, дифференцированных, например, из плюрипотентных стволовых клеток или подобных им, обеспечивает получение композиции клеток крови с высоким содержанием полиплоидных мегакариоцитов с 4N или больше. Когда популяцию мегакариоцитов обрабатывают с применением способа согласно настоящему изобретению, содержание полиплоидных мегакариоцитов с 4N или больше может быть повышено по меньшей мере примерно до 20% или больше, 30% или больше, предпочтительно, 40% или больше, 50% или больше, более предпочтительно, 80% или больше (см., например. Фиг.11 В). Соответственно, настоящее изобретение обеспечивает получение популяции мегакариоцитов или популяции клеток крови с высокой долей полиплоидных мегакариоцитов.
Такая композиция клеток крови может также быть криоконсервированной. Таким образом, такая композиция клеток крови поставляется в замороженном состоянии, и способ получения тромбоцитов, подробно описанный ниже, может проводиться потребителем.
Мегакариоциты и подобные им клетки, обработанные для стимуляции полиплоидизации посредством способа согласно настоящему изобретению, эффективны также для трансплантации in vivo и для продукции функциональных тромбоцитов in vivo посредством подходящего способа.
В настоящее временя гемопоэтические стволовые клетки трансплантируют посредством трансплантации костного мозга, трансплантации пуповинной крови или тому подобного. В частности, трансплантация пуповинной крови позволяет снизить проблемы, связанные с трансплантацией костного мозга, такие как нехватка доноров и большая нагрузка для доноров, поскольку в последнее время отмечается больше возможностей для трансплантации пуповинной крови. Однако мегакариоциты, полученные in vivo путем трансплантации пуповинной крови, не подвергаются достаточной полиплоидизации, и требуется время, чтобы произвести достаточное количество тромбоцитов in vivo. Когда способность к продукции тромбоцитов необходимо быстро повысить, в настоящее время трансплантация пуповинной крови не может удовлетворить такой спрос.
Трансплантация полиплоидных мегакариоцитов, полученных с применением способа согласно настоящему изобретению, позволяет преодолеть проблемы трансплантации костного мозга, такие как нехватка доноров и большая нагрузка на доноров, и проблемы трансплантации пуповинной крови, такие как низкая способность к продукции тромбоцитов in vivo. Таким образом, способ согласно настоящему изобретению наиболее пригоден для современных способов трансплантации.
Способ получения тромбоцитов
С другой стороны, способ получения тромбоцитов в соответствии с настоящим изобретением обеспечивает тромбоциты in vitro из полиплоидных мегакариоцитов и подобных им клеток, полученные с применением способа согласно настоящему изобретению.
Способ получения тромбоцитов согласно настоящему изобретению включает стадию культивирования полиплоидных мегакариоцитов, полученных вышеупомянутым способом, и сбора тромбоцитов из продукта культивирования.
Хотя какие-либо ограничения к условиям культивирования не применяются, полиплоидные мегакариоциты можно культивировать в течение примерно от 7 до 15 суток, например, в присутствии ТПО (примерно от 10 до 200 нг/мл, предпочтительно, примерно от 50 до 100 нг/мл), или в присутствии ЭПО (примерно от 10 до 200 нг/мл, предпочтительно, примерно от 50 до 100 нг/мл), ФСК (примерно от 10 до 200 нг/мл, предпочтительно около 50 нг/мл), и гепарина (примерно от 10 до 100 Ед./мл, предпочтительно около 25 Ед./мл).
В одном варианте способа получения тромбоцитов в соответствии с настоящим изобретением на стадии культивирования полиплоидных мегакариоцитов вышеупомянутая принудительная экспрессия гена-супрессора апоптоза подавлена, или вышеупомянутый ген-супрессор апоптоза удален из полиплоидных мегакариоцитов.
Подавление экспрессии гена-супрессора апоптоза может также быть достигнуто, например, путем удаления препарата или тому подобного для обеспечения индукции экспрессии посредством вышеупомянутой индуцируемой системы экспрессии. Альтернативно, индуцированный ген-супрессор апоптоза может быть удален с применением системы Cre/lox и таким образом можно супрессивно контролировать экспрессию этого гена. Можно также применять коммерческий набор или подобный ему, если это необходимо, для супрессивной регуляции экспрессии гена-супрессора апоптоза.
Как показано далее в Примерах, принудительная экспрессия гена-супрессора апоптоза для стимуляции полиплоидизации приводит к повышению эффективности продукции CD41a-позитивных/CD42b-позитивных функциональных тромбоцитов.
Подавление экспрессии или удаление гена-супрессора апоптоза начинают за 15 суток, предпочтительно за 10 суток, более предпочтительно от 3 до 7 суток, еще более предпочтительно примерно за 3 суток до сбора тромбоцитов.
На этой стадии может быть подавлена экспрессия не только экзогенного гена-супрессора апоптоза, но также эндогенного гена-супрессора апоптоза. Подавление экспрессии или функции продукта гена p53 можно провести после настоящего этапа.
Температура культивирования не ограничивается каким-либо образом, при условии, что она обеспечивает достижение результата настоящего изобретения. Культивирование может проводиться при температуре примерно от 35°C до 40°C, предпочтительно от 37°C до 39°C, как показано в Примерах далее.
В способе получения в соответствии с настоящим изобретением, стадия культивирования полиплоидных мегакариоцитов может проводиться без сыворотки и/или без фидерных клеток. Как показано ниже в Примерах, не выявлено существенных различий в количестве полученных тромбоцитов при культивировании в среде, содержащей эмбриональную телячью сыворотку, и культивировании в среде, не содержащей сыворотки. Однако отношение CD42b-позитивных тромбоцитов было выше, когда клетки культивировали в среде, не содержащей сыворотки, или в среде, не содержащей фидерных клеток. Если стадия получения тромбоцитов проводится в среде, не содержащей сыворотки, или в среде, не содержащей фидерных клеток, то тромбоциты, полученные таким образом, могут применяться в клинических условиях без возникновения проблемы иммуногенности.
Получение тромбоцитов без использования фидерных клеток позволяет снизить затраты на производство и пригодно для массового производства, поскольку не требуется адгезия фидерных клеток и, таким образом, культивирование суспензии может проводиться во флаконе или тому подобном. Когда фидерные клетки не применяются, может использоваться кондиционированная среда. Кондиционированная среда не ограничивается каким-либо образом и может быть приготовлена специалистом в данной области техники обычным способом. Например, при необходимости ее можно получить путем культивирования фидерных клеток, а затем удаления фидерных клеток из продукта культивирования с применением фильтра или тому подобного.
В одном варианте способа получения тромбоцитов в соответствии с настоящим изобретением в среду добавляют ингибитор ROCK и/или ингибитор функции актомиозинового комплекса. Может применяться ингибитор ROCK и ингибитор функции актомиозинового комплекса, подобные тем, что применяются в вышеупомянутом способе получения полиплоидных мегакариоцитов. Примеры ингибитора ROCK включают Y27632. Примеры ингибитора функции актомиозинового комплекса включают блеббистатин, ингибитор АТФ-азы тяжелой цепи миозина II. Может быть добавлен только ингибитор ROCK, могут быть добавлены ингибитор ROCK и ингибитор функции актомиозинового комплекса по отдельности или в комбинации.
Ингибитор ROCK и/или ингибитор функции актомиозинового комплекса предпочтительно добавляют в количестве от 0,1 мкМ до 30 мкМ, например, от 0,5 мкМ до 25 мкМ, от 5 мкМ до 20 мкМ, или тому подобном.
Продолжительность культивирования после добавления ингибитора ROCK и/или ингибитора функции актомиозинового комплекса может составлять от 1 до 15 суток. Она может составлять 3 суток, 5 суток, 7 суток или тому подобное. Путем добавления ингибитора ROCK и/или ингибитора функции актомиозинового комплекса может быть дополнительно повышена доля CD42b-позитивных тромбоцитов.
Вариант осуществления настоящего изобретения включает набор для стимуляции полиплоидизации мегакариоцитов и получения зрелых мегакариоцитов и/или тромбоцитов. Набор включает также вектор экспрессии и тому подобное, необходимый для индукции внутриклеточной экспрессии онкогена, любого из вышеупомянутых генов (i)-(in), гена BCL-XL или тому подобного; и реагент, среду для культивирования клеток, сыворотку, добавку, такую как фактор роста (например, ТПО, ЭПО, ФСК, гепарин, ИЛ-6, ИЛ-11 или подобный им), антибиотик и тому подобное. Кроме того, набор включает, например, когда используют клетки, полученные из ЭС клеток или ИПС клеток, антитело (например, антитело к Flk1, CD31, CD34, UEA-I пектину или тому подобное) для подтверждения маркера для идентификации сетчатой структуры, полученной из этих клеток. Реагент, антитело и подобное им соединение, включенное в набор, поставляется в любом виде сосудов, обеспечивающих эффективное сохранение активности содержащегося ингредиента и не вызывающий ни его адсорбции на материале сосуда, ни разрушения.
Набор согласно настоящему изобретению может дополнительно включать мегакариоциты, не прошедшие полиплоидизацию, в которых принудительно экспрессирован онкоген и любой из вышеупомянутых генов (i)-(iii).
«Клетки», описанные здесь, получены из человека, или животных, не являющихся человеком (например, мышей, крыс, коров, лошадей, свиней, овец, обезьян, собак, кошек и птиц). Хотя нет никаких конкретных ограничений, особо предпочтительными являются клетки человеческого происхождения.
Настоящее изобретение далее описано более подробно с помощью следующих Примеров. Однако необходимо понимать, что настоящее изобретение не ограничивается указанными примерами.
Примеры.
1. Приготовление мегакариоцитов. не прошедших полиплоидизацию
1.1. Приготовление мегакариоцитов. не прошедших полиплоидизацию, из ЭС клеток
Для изучения полиплоидизации мегакариоцитов, мегакариоциты, не прошедшие полиплоидизацию, были получены из ЭС клеток (см. патентный документ 3 для целей подробного описания).
Линию ЭС клеток человека (KhES-3) культивировали в течение 14 суток в присутствии 20 нг/мл ФРЭС для получения сетчатой структуры. Гемопоэтические клетки-предшественники, извлеченные их полученной сетчатой структуры, собирали и высевали на 10T1/2 клетки для получения количества клеток 1×105/ячейку.
Гемопоэтические клетки-предшественники, приготовленные таким образом, инфицировали C-MYC-2A-BMI1-содержащим pMx tet off c-MYC 2A BMI1 ретровирусным вектором три раза каждые 12 часов при MOI (множественности заражения)=10 (при подтверждении с применением клеток Jurkat) для индукции экспрессии c-MYC и BMI1 (патентный документ 3). Вектор pMx tet off c-MYC 2A BMI1 обеспечивает экспрессию гена c-MYC и гена BMI1 в присутствии эстрадиола, подавляя при этом экспрессию гена с-MYC и гена BMI1 в присутствии доксициклина (Dox) и в отсутствие эстрадиола.
Одновременно с первым инфицированием добавляли 2 мМ эстрадиола и спустя 12 часов после последнего инфицирования удаляли вирус. На этом этапе количество высвобожденных CD42b-позитивных тромбоцитов было маленьким, даже если экспрессия гена c-MYC или гена BMI1 была выключена, что позволяет предположить, что указанные клетки были незрелыми мегакариоцитами. Эти незрелые клетки можно далее обозначать как клетки «iMKPC типа I».
Цитокиновую зависимость клеток iMKPC типа I изучали путем посева 2×105 iMKPC типа I на 10T1/2 фидерные клетки и культивирования их в течение 14 суток при 37°C в условиях, показанных на Фиг.1A, в присутствии 2 мкМ β-эстрадиола при использовании следующих цитокинов: ФСК (50 нг/мл), ТПО (50 нг/мл) и ЭПО (6 Ед./мл). В популяции, в которой пролиферация была подтверждена, на 4 сутки и 11 сутки подсчитывали количество клеток и повторно высевали 2×105 клеток, в то время как среду для других популяций меняли. Число клеток подсчитывали на 8 сутки и 14 сутки и повторно высевали 2×105 клеток. В то же самое время, на 8 сутки, некоторые клетки анализировали с применением проточного цитометра после окрашивания CD41 антителами, CD42b антителами и GPA антителами.
Результаты показаны на Фиг.1B и 1C. Как показано на Фиг.1B, пролиферация клеток iMKPC типа I существенно зависела от ФСК. Как показано на Фиг.1C, клетки из любой популяции были почти CD41-позитивными, но популяции без ФСК, CD41+/CD42b-популяция, показали существенное снижение пролиферации. Популяция CD41+/CD42b- является популяцией, продемонстрировавшей хорошую пролиферацию среди клеток iMKPC типа I.
Эти полученные данные, включая ФСК-зависимую пролиферацию, позволили предположить, что клетки iMKPC типа I являются незрелыми мегакариоцитами.
1.2. Получение мегакариоцитов. не прошедших полиплоидизацию, из CD34-позитивных клеток, полученных из пуповинной крови
Было подтверждено, что мегакариоциты, не прошедшие полиплоидизацию, могут быть получены из CD34-позитивных клеток, полученных из пуповинной крови, способом, схожим со способом с использованием ЭС клеток или ИПС клеток.
В частности, CD34-позитивные клетки, полученные из пуповинной крови, инфицировали три раза вирусами pMx-c-MYC и DNsam BMI1 (каждый из которых является ретровирусным вектором) при MOI=10, и подсчитывали число CD41a-позитивных (мегакариоцитарный маркер) клеток на 14 и 21 сутки с применением FACS (клеточной сортировки с активацией флуоресценции). В качестве контроля использовали Mock (пустой вектор).
Результаты показаны на Фиг.1D. По сравнению с Mock, пролиферация CD41-позитивных мегакариоцитов наблюдалась в популяции, в которой принудительно экспрессировали c-MYC и BMI1. Таким образом, было подтверждено, что мегакариоциты, не прошедшие полиплоидизацию, могут быть получены из клеток, выделенных из пуповинной крови способом, схожим с тем, что описан в 1.1.
2. Получение полиплоидных мегакариоцитов из мегакариоцитов. не прошедших полиплоидизацию
2.1. Влияние экспрессии BCL-XL на полиплоидизацию
На 23 сутки после инфицирования ретровирусным вектором pMx tet off c-MYC 2A BMI1, содержащим C-MYC-2A-BMI1 из Раздела 1.1, клетки инфицировали один раз доксициклин-индуцируемым Lv-BCL-XL-GFP (лентивирусным вектором) при М01=10. Вектор готовили путем введения ПЦР-амплифицированной кДНК из BCL-XL в Ai-Lv tet on вектор (Clontech), обработанный EcoRI и BamHI, с использованием набора для клонирования In-Fusion advance PCR cloning kit (Clontech). Спустя 24 часа после инфицирования вирус удаляли. Путем удаления эстрадиола и добавления доксициклина подавляли экспрессию c-MYC и BMI1, и в то же самое время индуцировали экспрессию BCL-XL.
2.2. Влияние нокдауна гена p53 на полиплоидизацию
Нокдаун гена p53 осуществляли путем инфицирования FG12-sh p53 лентивирусным вектором в дополнение к доксициклин-индуцируемому Lv-BCL-XL-GFP лентивирусному вектору. Клетки, полученные таким образом, далее обозначаются как клетки «iMKPC типа II».
2.3. Цитокиновая зависимость iMKPC типа II
На фидерные клетки 10T1/2 высевали 2×105 клеток iMKPC типа II с последующим культивированием в присутствии 0,5 мкг/мл доксициклина при 39°C в течение 21 суток с добавлением цитокинов, т.е. ФСК (50 нг/мл), ТПО (50 нг/мл), и ЭПО (6 Ед./мл). Результаты показаны на Фиг.2A. Было подтверждено, что в клеточной линии iMKPC типа II пролиферация происходит при отсутствии цитокинов, но пролиферация дополнительно стимулируется при добавлении ТПО. В от время как клетки iMKPC типа I были ФСК-зависимыми и ТПО не оказывал влияния на их пролиферацию, у клеток типа II наблюдалась усиленная пролиферация в присутствии ТПО, а ФСК не оказывал влияния на пролиферацию.
2.4. Анализ поверхностного маркера iMKPC типа II
На 21 сутки после добавления цитокинов клетки анализировали с помощью проточного цитометра после окрашивания CD41 антителами, CD42b антителами и GPA антителами. Результаты показаны на Фиг.2B. В популяции с добавлением ТПО показана более высокая экспрессия CD41a и CD42b по сравнению с другими популяциями, что позволяет предположить, что она является популяцией, в большей степени предрасположенной к превращению в мегакариоциты.
2.5. Морфологические изменения и влияние блеббистатина
Результаты морфологического анализа клеток iMKPC типа I и II показаны на Фиг.3. Отмечалось, что при выключении экспрессии c-MYC и BMI1, принудительной экспрессии BCL-XL и нокдауне гена p53 клетки становятся более полиплоидными. Также было подтверждено, что клетки были полиплоидизированы в большей степени при добавлении блеббистатина (5 мкг/мл).
Как показано в разделах 2.3-2.5, на стадии клеток iMKPC типа II мегакариоциты пролиферируют, отношение CD42b-позитивных тромбоцитов ко всем высвобожденным тромбоцитам повышается, некоторые из клеток становятся полиплоидными, ф цитокиновая зависимость меняется на ТПО, что позволяет предположить, что пролиферация и созревание происходят параллельно друг другу.
2.6. Влияние подавления экспрессии BCL-XL
На фидерные клетки 10Т1/2 высевали 2×105 клеток iMKPC типа II с последующим долговременным культивированием при 39°C в присутствии 0,5 мкг/мл доксициклина (BCL-XL ON) или в его отсутствие (BCL-XL OFF). Каждые 2-5 суток подсчитывали число клеток и повторно высевали 2×105 клеток.
Результаты показаны на Фиг.4. Супрессия BCL-LX в отсутствие доксициклина снижала уровень пролиферации клеток iMKPC типа II, а спустя продолжительное время (спустя 100 суток) клетки теряли способность к пролиферации, что позволяло предположить, что наличие BCL-XL является обязательным для долговременной пролиферации клеток iMKPC типа II.
2.7. Изучение влияния других видов обработки на полиплоидизацию
2.7.1. Влияние ингибитора ROCK
После введения генов MYC и MBI1, полученные мегакариоциты (около 105) культивировали в течение примерно 30 суток в отсутствие доксициклина и в присутствии эстрадиола в условиях культивирования 37°C и в присутствии 5% CO2 до достижения пролиферации примерно 1011. Далее культивирование продолжали, но меняли условия на присутствие доксициклина и отсутствие эстрадиола для подавления экспрессии гена MYC и гена BMI1 в пролиферирующей мегакариоцитарной линии, и добавляли ингибитор ROCK (Y27632; продукт Wako Pure Chemicals) в культуральную среду до концентрации 10 мкМ для определения влияния Y27632 на полиплоидизацию. На 7 сутки после начала культивирования при добавлении Y27632 в культуральную среду изучали степень полиплоидизации с применением FACS (Фиг.5). Клетки с добавлением ингибитора ROCK показали повышение числа клеток с 4N (верхний график с Фиг.5 (Rock i), светлые квадраты на нижнем графике) по сравнению с клетками без добавления ингибитора (верхний график с Фиг.5 (контроль), закрашенные квадраты). Это позволило установить, что ингибитор ROCK стимулирует полиплоидизацию мегакариоцитов перед полиплоидизацией, полученных из ЭС клеток, получивших способность к пролиферации в результате экспрессии гена C-MYC и гена BMI1.
2.7.2. Влияние ингибитора ROCK + культивирования при высокой температуре К настоящему времени было отмечено, что в результате культивирования незрелых мегакариоцитов при температуре, превышающей нормальную температуру, например, при 39°C, стимулируется созревание мегакариоцитов, включая полиплоидизацию и формирование протромбоцитов (непатентный документ 5). Для подтверждения этого в мегакариоцитах, не прошедших полиплоидизацию, полученных из ЭС клеток, с применением количественной ПЦР изучали уровень экспрессии генов (GATA1, PF4, NFE2 и β-тубулина), которые, как известно, демонстрируют повышенную экспрессию при созревании мегакариоцитов.
Была стимулирована пролиферация мегакариоцитов, не прошедших полиплоидизацию. Для подавления экспрессии гена MYC и гена BMI1 в полученных мегакариоцитах, не прошедших полиплоидизацию, культивирование проводили в течение 5 суток при изменении условий, т.е. в присутствии доксоциклина и в отсутствие эстрадиола, и при температуре культивирования 39°C. Затем проводили количественную ПЦР для измерения уровня экспрессии соответствующих генов (Фиг.6). В результате было установлено, что уровни экспрессии генов, являющихся индикаторами созревания, были выше при культивировании при 39°C, чем при культивировании при 37°C.
2.7.3. Влияние ингибитора ROCK + принудительной экспрессии гена BCL-XL
Экспрессию MYC/BMI1 в мегакариоцитах, не прошедших полиплоидизацию, подавляли, и в то же самое время лентивирусный вектор, подобный тем, что применяли в 2.1 для индукции экспрессии BCL-XL, вводили в клетки в присутствии доксоциклина.
Изучали, влияет ли на полиплоидизацию мегакариоцитарных клеток-предшественников, полученных с ингибитором ROCK, наличие или отсутствие экспрессии гена BCL-XL (Фиг.7).
Степень полиплоидизации изучали (анализ плоидности) путем подавления экспрессии MYC/BMI1 в присутствии 10 мкМ Y27632 при индукции супрессии BCL-XL и культивирования полученных клеток в течение 7 суток. Было подтверждено, что число полиплоидных клеток с 8N или больше существенно возрастало в клеточной линии, экспрессирующей BCL-XL (затененный столбец на Фиг.7B), по сравнению с клеточной линией (светлый столбец на Фиг.7B), в которой BCL-XL не экспрессировался. Кроме того, отмечалось, что число клеток, в которых экспрессировался BCL-XL, постепенно повышалось (■ на Фиг.8), в то время как число клеток, в которых BCL-XL не экспрессировался, снижается (▲ на Фиг.8).
Это позволяет предположить, что для того, чтобы избежать зависимости от онкогена в мегакариоцитах, не прошедших полиплоидизацию, которые в результате принудительной экспрессии онкогена приобрели высокую пролиферативную способность, эффективными были гены, подавляющие апоптоз, такие как ген BCL-XL.
2.7.4. Влияние ингибитора ROCK + принудительной экспрессии гена BCL-XL + супрессии гена p53
Изучали, стимулирует ли подавление экспрессии p53 полиплоидизацию мегакариоцитов, не прошедших полиплоидизацию, или нет.
Экспрессию гена p53 подавляли, как описано в 2.2, путем инфицирования лентивирусом при MOI=10 с применением лентивирусного вектора FG12, в который введены промотор H1 и shp53.
После подавления экспрессии MYC/BMI1, принудительной экспрессии BCL-XL и подавления экспрессии p53 в присутствии Y27632 проводили культивирование в течение 7 суток при 39°C. После культивирования изучали степень полиплоидизации. В результате было установлено, что по сравнению с контрольными клетками (черный столбец на Фиг.9B), в которых не был проведен нокдаун p53, среди клеток (светлый столбец на Фиг.9B), в которых был проведен нокдаун p53, было повышено число клеток с 8N и полиплоидизация была стимулирована.
2.7.5. Влияние ингибитора ROCK + принудительной экспрессии гена BCL-XL + супрессии гена p53 + вальпроевой кислоты
Влияние на полиплоидизацию изучали путем дополнительной обработки клеток, которые подвергали обработке согласно 2.7.4, вальпроевой кислотой. После подавления экспрессии MYC/BMI1, принудительной экспрессии BCL-XL, обработки ингибитором ROCK (10 мкМ) и подавления экспрессии p53 в среду добавляли вальпроевую кислоту (итоговая концентрация 0,5 мМ) и культивировали при 39°C в течение 7 суток. В результате было установлено, что клетки (светлый столбец на Фиг.10B), обработанные вальпроевой кислотой, показали усиленную полиплоидизацию по сравнению с контрольными клетками (черный столбец на Фиг.10B), не подвергавшимися обработке вальпроевой кислотой.
2.7.6. Влияние принудительной экспрессии гена BCL-XL + ингибитора АТФ-азы тяжелой цепи миозина IIA/B и влияния ингибитора ROCK + принудительной экспрессии гена BCL-XL + супрессии гена p53 + вальпроевой кислоты + ингибитора АТФ-азы тяжелой цепи миозина IIA/B.
Изучали, влияет ли обработка блеббистатином на мегакариоциты, у которых полиплоидизация не произошла в достаточной степени, т.е., оказывает ли влияние ингибитор АТФ-азы тяжелой цепи миозина IIA/B на степень полиплоидизации. После подавления экспрессии MYC/BMI1, принудительной экспрессии BCL-XL и обработки блеббистатином (10 мкг/мл) полученные клетки культивировали при 39°C в течение 7 суток. Было установлено, что число клеток с 8N или более повышалось при обработке клеток блеббистатином (светлый столбец на Фиг.11) по сравнению с клетками, не подвергавшимися обработке блеббистатином (черный столбец на Фиг.11b), демонстрируя усиление полиплоидизации.
Далее, изучали степень полиплоидизации при обработке блеббистатином в комбинации с другими видами обработки. Клетки подвергали обработке блеббистатином в дополнение к вышеупомянутым видам обработки из Раздела 2.7.5 и изучали влияние на полиплоидизацию. После подавления экспрессии MYC/BMI1, принудительной экспрессии BCL-XL, обработки ингибитором ROCK (10 мкМ), подавления экспрессии p53 и обработки вальпроевой кислотой (0,5 мМ) проводили обработку блеббистатином (10 мкг/мл), а затем полученные клетки культивировали при 39°C в течение 7 суток. Было установлено, что число клеток с 8N или более было выше для клеток, подвергавшихся обработке блеббистатином (светлый столбец на Фиг.12), чем для контрольных клеток, не подвергавшихся обработке блеббистатином (черный столбец на Фиг.12b), что свидетельствовало о том, что указанная обработка стимулирует полиплоидизацию. В дополнение, после культивирования в течение 7 суток клетки, обработанные блеббистатином, показали легкое ухудшение пролиферативной способности (верхний график на Фиг.13), но наблюдалась гипертрофия цитоплазмы. Таким образом была подтверждена индукция зрелых мегакариоцитов (нижний график на Фиг.13).
3. Получение тромбоцитов из полиплоидных мегакариоцитов
3.1. Влияние подавления экспрессии BCL-XL на продукцию тромбоцитов (1)
На фидерные клетки 10T1/2 высевали 2×105 клеток iMKPC типа II, полученных в Разделе 2.2, с последующим культивированием при 39°C в присутствии 0,5 мкг/мл доксициклина (BCL-XL ON) или после удаления доксициклина из культуральной среды (BCL-XL OFF). На 3-4 сутки мегакариоциты и тромбоциты в культуральной среде анализировали с помощью проточного цитометра после окрашивания CD41 антителами и CD42 антителами.
Результаты показаны на Фиг.14. Было установлено, что популяция (B), в которой экспрессия Bc1xL была подавлена путем удаления доксициклина, состояла главным образом из зрелых мегакариоцитов, в которых экспрессировался CD42b (B), по сравнению с мегакариоцитами (A), в которых наблюдалась экспрессия BCL-XL при воздействии доксициклина. Было установлено, что по отношению к тромбоцитам, высвободившимся из них, отношение тромбоцитов, в которых экспрессия CD42b, необходимого для проявления функции, увеличивалось (D) по сравнению с тромбоцитами (C), высвобожденными из мегакариоцитов BCL-XL ON.
3.2. Влияние подавления экспрессии BCL-XL на продукцию тромбоцитов (2)
На Фиг.15 показаны результаты определения числа клеток, в которых присутствовала или отсутствовала экспрессия BCL-XL, на основе результатов, подобных тем, что показаны в Разделе 3.1. Количество тромбоцитов существенно увеличивалось в популяции, в которой экспрессия BCL-XL была подавлена.
«A» указывает количество CD42b-позитивных тромбоцитов; «В» указывает количество CD41a-позитивных/CD42b-позитивных мегакариоцитов, а «C» указывает количество CD41a-позитивных мегакариоцитов.
Не отмечено влияния экспрессии Bc1xL на количество мегакариоцитов, в которых экспрессирован CD41 (C), но предполагалось, что отношение экспрессии CD42b к CD41+ увеличилось благодаря подавлению экспрессии Bc1xL, и количество зрелых мегакариоцитов повысилось.
3.3. Влияние температуры культивирования на продукцию тромбоцитов
На фидерные клетки 10T1/2 высевали от 2 до 3×105 клеток iMKPC типа II и культивировали в течение 3 суток при температурах культивирования 35, 37 и 39°C с добавлением или без добавления 0,5 мкг/мл доксициклина. Тромбоциты, содержащиеся в надосадочной жидкости, анализировали с применением проточного цитометра после окрашивания CD41 антителами и CD42b антителами. На Фигуре 16 показано среднее значение и среднеквадратическое отклонение количества CD41 + CD42b + тромбоцитов из каждой популяции при 37°C и при добавлении доксициклина (1).
Было установлено, что температуры культивирования 37°C или 39°C являются адекватными. При проведении анализов впоследствии температура культивирования была установлена на 37°C.
3.4. Влияние фидерных клеток, применения сыворотки для культивирования, и наличия или отсутствия блеббистатина на продукцию тромбоцитов
Эффективность продукции тромбоцитов оценивали с применением следующих условий в комбинации, как показано на Фиг.17: применение/отсутствие фидерных клеток, применение/отсутствие кондиционированной среды, применение среды с сывороткой/применение среды без сыворотки, и применение/отсутствие блеббистатина.
Кондиционированную среду готовили путем высевания 8×105 клеток 10T1/2, обработанных MMC, на 10 см чашку, покрытую желатином, с заменой на следующие сутки (после адгезии клеток) среды на 10 мл среды для дифференцировки (EBM), содержащий ФСК (50 нг/мл) и ТПО (50 нг/мл), и кроме того, содержащей 15% сыворотки или не содержащей ее,, с извлечением среды и добавлением 10 мл новой среды (содержащей ФСК и ТПО) спустя 24 часа, сбора кондиционированной среды спустя 3 суток, и фильтрации среды через 0,22 мкм фильтр для удаления клеток 10T1/2. Когда полученную среду использовали для анализа, вновь добавляли ФСК и ТПО.
В использованной популяции фидерных клеток от 2 до 3×105 iMKPC клеток типа II высевали на фидерные клетки 10T1/2, в то время как если популяцию клеток не применяли, клетки высевали подобным образом на чашки, покрытые желатином. В сывороточной среде с использованием популяции использовали среду для дифференцировки, содержащую 15% сыворотки, или кондиционированную среду, в то время как в популяции с применением блеббистатина в среду добавляли 5 мкМ блеббистатина. Культивирование проводили при 37°C в течение 3 суток.
Тромбоциты, содержащиеся в надосадочной жидкости от среды, анализировали с применением проточного цитометра после окрашивания CD41 антителами и CD42b антителами. Для клеток, полученных путем культивирования на фидерных клетках при добавлении 15% сыворотки без добавления блеббистатина, в качестве клеток, полученных в нормальных условиях культивирования, среднее значение и среднеквадратическое отклонение отношения числа CD41 + CD42b + тромбоцитов в каждой популяции к тромбоцитам, полученным в нормальных условиях, показано на графике на Фиг.17. Не отмечено существенного различия в количестве полученных тромбоцитов среди популяций.
Сравнение уровня экспрессии CD42b в CD41-позитивных тромбоцитах в каждой популяции (отношение средней интенсивности флюоресценции в каждой популяции к средней интенсивности флюоресценции в нормальных условиях) показано на Фиг.18. В условиях без сыворотки и без фидерных клеток были получены тромбоциты, показавшие наивысшую CD42b экспрессию. Влияние блеббистатина ее было выявлено.
Один пример оптимизированных условий показан на Фиг.19. Отношение CD41-позитивных и CD42b-позитивных (которые можно также назвать «GPIba-позитивными») тромбоцитов при культивировании в оптимизированных условиях показано на Фиг.20.
Как показано на Фиг.20, в тромбоцитах, полученных из полиплоидных мегакариоцитов, полученных согласно настоящему изобретению, примерно 20% были CD41-позитивными и CD42b-позитивными. Когда экспрессия BCL-XL добавлялась, отношение увеличивалось до 55%, а когда культивирование проводили при удалении фидерных клеток и сыворотки, отношение возрастало даже до 81%.
4. Необходимость экспрессии CD42b для функции тромбоцитов (ссылка)
Ингибирующий эффект антитела HIP1 в отношении реакции агглютинации ристоцетином (реакции агглютинации через vWF и рецептор (гетеро-пентамер, состоящий из GPIba, GPIX и тому подобного) тромбоцитов) измеряли с применением тромбоцитов периферической крови человека. Антитело HIP1 было антителом, ингибирующим функцию GPIba.
После того, как эффект GPIba ингибировали путем суспендирования 1×108 тромбоцитов в 50% плазме крови с добавлением HIP1 антител и предварительного культивирования при 37°C в течение 3 секунд, добавляли ристоцетин (в итоговой концентрации 2 мг/мл) для индукции реакции агглютинации и контролировали пропускание света в течение 7 минут. Максимальное светопропускание (показывающее интенсивность агглютинации) каждой популяции показано на диаграмме на Фиг.21. Антитела HPI1 полностью подавляли агглютинацию из-за ассоциации GPIb/альфа-фактора Виллебранда (vWF) при концентрации 10 мкг/мл или более.
Далее, 100 мкг антител HIP1 или контрольного антитела IgG вводили мыши NOG и трансплантировали тромбоциты, окрашенные TAMRA (тетраметилкарбоксиродамином) (красным красителем). Сосудистый эндотелий подвергали воздействию лазером, чтобы вызвать повреждение с целью индукции образования тромба. Подсчитывали число человеческих тромбоцитов (красных), участвующих в образовании тромба.
Среднее значение и среднеквадратическое отклонение количества человеческих тромбоцитов в тромбе, скорректированное на длину кровеносного сосуда, показано на диаграмме (Фиг.22). В группе с применением антител HIP1 подавлялось участие человеческих тромбоцитов в формировании тромба.
Таким образом, было установлено, что GPIba (CD42b) является молекулой, играющей важную роль в образовании тромба как in vivo, так и т vitro.
Промышленная применимость
Настоящее изобретение обеспечивает способ стимуляции полиплоидизации мегакариоцитарных клеток-предшественников, а затем эффективной индукции высвобождения тромбоцитов. В частности, способ согласно настоящему изобретению высоко эффективен для получения мегакариоцитов или тромбоцитов in vitro из различных стволовых клеток и вносит большой вклад в разработку лекарственных средств в области медицины или продуктов крови.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОФУНКЦИОНАЛЬНЫХ ТРОМБОЦИТОВ | 2016 |
|
RU2724533C2 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУРЫ, СОДЕРЖАЩЕЙ МЕГАКАРИОЦИТЫ, И СПОСОБ ПОЛУЧЕНИЯ ТРОМБОЦИТОВ С ЕЕ ПРИМЕНЕНИЕМ | 2016 |
|
RU2750740C2 |
| СПОСОБ ПРОИЗВОДСТВА ТРОМБОЦИТОВ СПОСОБОМ РОТАЦИОННОГО ПЕРЕМЕШИВАНИЯ КУЛЬТУРЫ | 2016 |
|
RU2756000C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК | 2010 |
|
RU2661107C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОЧИЩЕННЫХ ТРОМБОЦИТОВ | 2016 |
|
RU2766177C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛОНА СТВОЛОВЫХ КЛЕТОК, ПРИГОДНОГО ДЛЯ ИНДУЦИРОВАНИЯ ДИФФЕРЕНЦИРОВКИ В СОМАТИЧЕСКИЕ КЛЕТКИ | 2016 |
|
RU2730034C2 |
| НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК | 2010 |
|
RU2603094C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТРОМБОЦИТОВ С ПОМОЩЬЮ УСТРОЙСТВА ДЛЯ ВОЗВРАТНО-ПОСТУПАТЕЛЬНОГО ПЕРЕМЕШИВАНИЯ | 2016 |
|
RU2741871C2 |
| КОМПОЗИЦИЯ ДЛЯ ПОДДЕРЖАНИЯ ФУНКЦИИ ТРОМБОЦИТОВ | 2011 |
|
RU2578607C2 |
| ПРОГНОЗИРОВАНИЕ ОТВЕТА НА АЛЬВОЦИДИБ С ПОМОЩЬЮ АНАЛИЗА ПРОФИЛЯ МИТОХОНДРИЙ | 2016 |
|
RU2717829C2 |


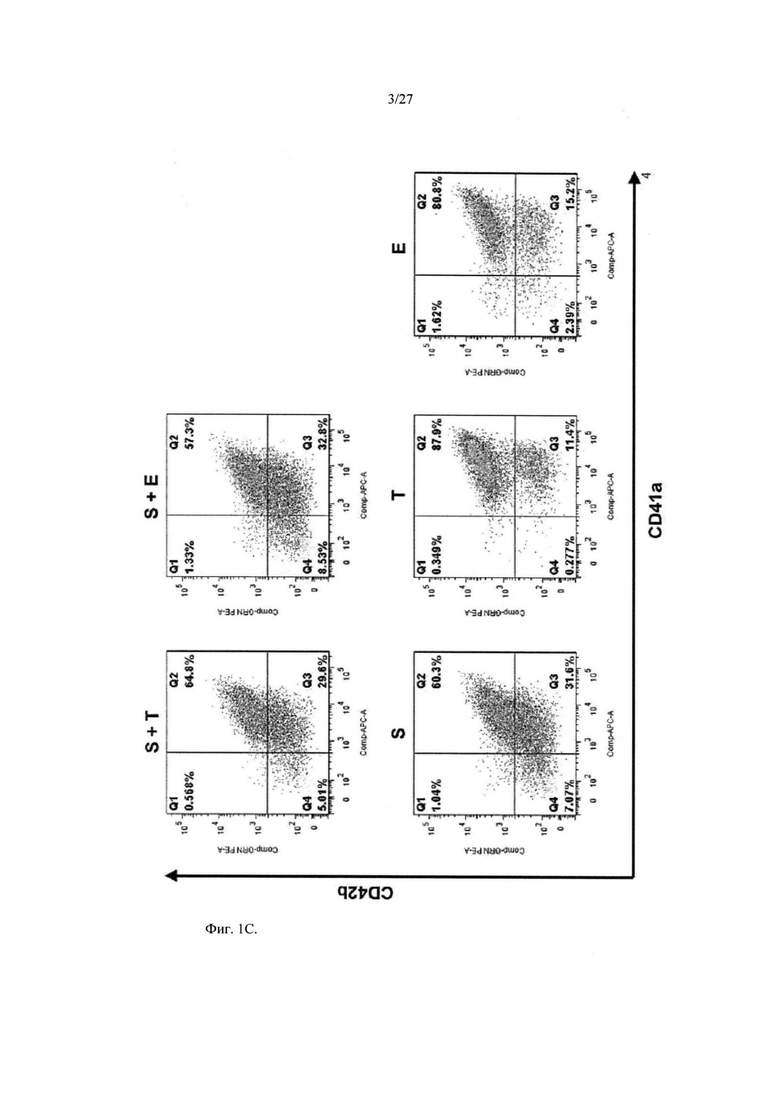




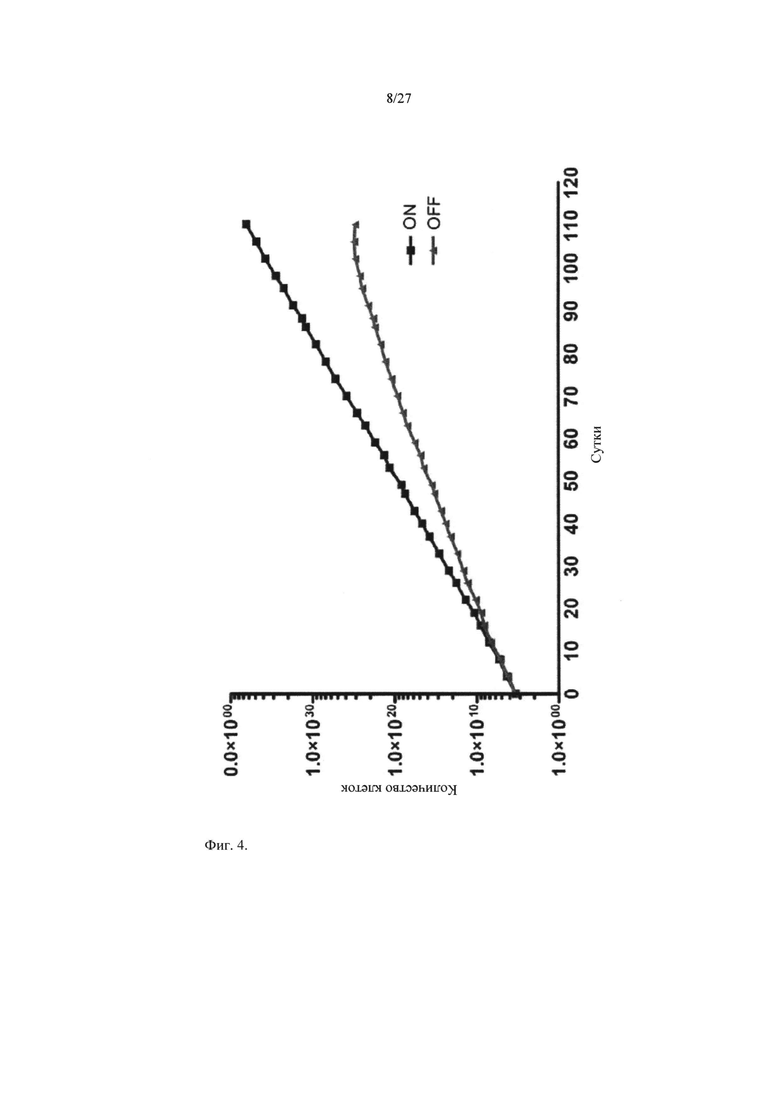

















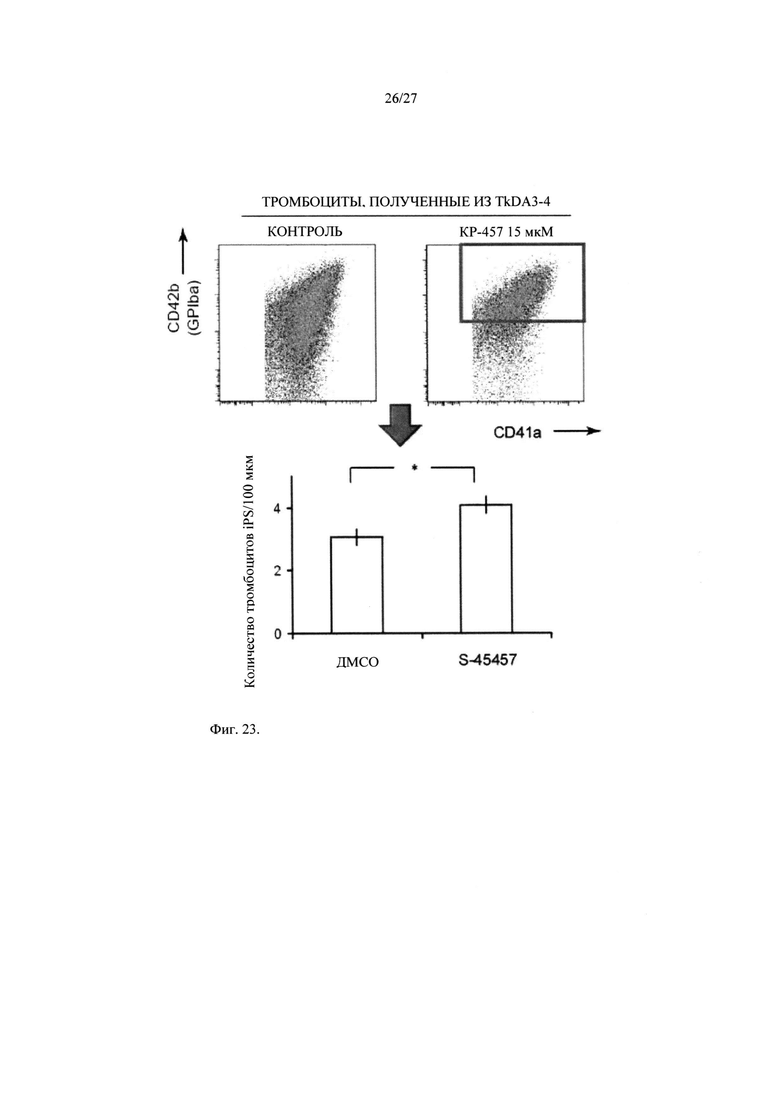

Изобретение относится к клеточной технологии. Описаны способы получения полиплоидных мегакариоцитов и тромбоцитов, включающие принудительную экспрессию гена BCL-XL в мегакариоцитах, не прошедших полиплоидизацию, при этом указанные мегакариоциты получены посредством принудительной экспрессии онкогена семейства MYC и гена ВМИ в указанных клетках на любой стадии дифференцировки из гемопоэтических клеток-предшественников, полученных не из ЭС клеток, в мегакариоциты перед полиплоидизацией и культивированием и пролиферацией полученных клеток, и культивирование указанных клеток. 2 н. и 12 з.п. ф-лы, 24 ил., 3 пр.
1. Способ получения полиплоидных мегакариоцитов, включающий следующие стадии:
принудительную экспрессию гена BCL-XL в мегакариоцитах, не прошедших полиплоидизацию, при этом указанные мегакариоциты получены посредством принудительной экспрессии онкогена семейства MYC и гена ВМИ в указанных клетках на любой стадии дифференцировки из гемопоэтических клеток-предшественников, полученных не из ЭС клеток, в мегакариоциты перед полиплоидизацией и культивированием и пролиферацией полученных клеток, и культивирование указанных клеток.
2. Способ по п. 1, в котором на стадии культивирования ингибируют экспрессию или функцию продукта гена р53.
3. Способ по п. 1, в котором на стадии культивирования мегакариоциты, не прошедшие полиплоидизацию, подвергаются по меньшей мере одной из следующих обработок (а)-(с):
(a) обработке ингибитором функции актомиозинового комплекса;
(b) обработке ингибитором ROCK; и
(c) обработке ингибитором HDAC.
4. Способ по п. 3, в котором ингибитором ROCK является Y27632; ингибитором HDAC является вальпроевая кислота; а ингибитором функции актомиозинового комплекса является блеббистатин.
5. Способ по любому из пп. 1-4, в котором стадию культивирования проводят при температуре выше 37°C.
6. Способ по п. 1, в котором гемопоэтические клетки-предшественники получены из клеток, выбранных из группы, состоящей из ИПС клеток, гемопоэтических стволовых клеток, полученных из пуповинной крови, костного мозга или периферической крови, и гемопоэтических стволовых клеток.
7. Способ по п. 1, дополнительно включающий стадию подавления принудительной экспрессии указанного онкогена, гена BMI1 и гена BCL-XL.
8. Способ получения тромбоцитов, включающий:
- получение полиплоидных мегакариоцитов способом по п. 1 и культивирование клеток; и
- сбор тромбоцитов из культуры полиплоидных мегакариоцитов.
9. Способ по п. 8, в котором стадию культивирования полиплоидных мегакариоцитов проводят при подавлении экспрессии гена-супрессора апоптоза, который принудительно экспрессирован, или после удаления гена-супрессора апоптоза из клеток.
10. Способ по п. 8, в котором стадию культивирования полиплоидных мегакариоцитов проводят в отсутствие сыворотки и/или при отсутствии фидерных клеток.
11. Способ по п. 8, в котором стадию культивирования полиплоидных мегакариоцитов проводят в течение от 1 до 15 суток.
12. Способ по п. 8, в котором стадию культивирования полиплоидных мегакариоцитов проводят при 37°C.
13. Способ по п. 8, в котором на стадии культивирования полиплоидных мегакариоцитов в среду добавляют ингибитор ROCK и/или ингибитор функции актомиозинового комплекса.
14. Способ по п. 13, в котором ингибитором ROCK является Y27632, а ингибитором функции актомиозинового комплекса является блеббистатин.
| WO 2011034073 A1, 24.03.2011 | |||
| ДВУХТАКТНЫЙ ДВИГАТЕЛЬ ВНУТРЕННЕГО ГОРЕНИЯ | 1926 |
|
SU6423A1 |
| ПОЛИПЕПТИД ТРОМБОПОЭТИН (ТРО), ДНК, КОДИРУЮЩАЯ ПОЛИПЕПТИД ТРО (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДА (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ (ВАРИАНТЫ), АНТИТЕЛО К ПОЛИПЕПТИДУ ТРО | 1995 |
|
RU2194074C2 |
| СРЕДСТВО, ИНДУЦИРУЮЩЕЕ ДИФФЕРЕНЦИРОВКУ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК В ТРОМБОЦИТЫ | 2012 |
|
RU2482870C1 |
Авторы
Даты
2017-01-10—Публикация
2012-05-11—Подача