Настоящее изобретение относится к биспецифическим четырехвалентным антигенсвязывающим белкам, способам их получения, фармацевтическим композициям, которые содержат указанные антитела, и их применению.
Предпосылки создания изобретения
В данной области известны сконструированные белки, такие как би- и мультиспецифические антитела, которые могут связываться с двумя или большим количеством антигенов. Указанные мультиспецифические связывающие белки можно создавать на основе методов клеточного слияния, химической конъюгации или рекомбинантной ДНК.
В последние годы создано широкое разнообразие форматов рекомбинантных мультиспецифических антител, например четырехвалентные биспецифические антитела, полученные путем слияния, например, антитела IgG-формата и одноцепочечных доменов (см., например, Coloma M.J. и др., Nature Biotech 15, 1997, cc.159-163; WO 001/077342 и Morrison S.L., Nature Biotech 25, 2007, cc.1233-1234).
Разработано также несколько других новых форматов, в которых уже не сохранялась основная структура антитела (IgA, IgD, IgE, IgG или IgM), таких как димерные (диабоди), тримерные (триабоди) или тетрамерные (тетрабоди) антитела, миниантитела, несколько одноцепочечных форматов (scFv, бис-scFv), которые могут связываться с двумя или большим количеством антигенов (Holliger Р. и др., Nature Biotech 23, 2005, cc.1126-1136; Fischer N., Léger О., Pathobiology 74, 2007, cc.3-14; Shen J и др., Journal of Immunological Methods 318, 2007, cc.65-74; Wu С. и др., Nature Biotech 25, 2007, cc.1290-1297).
Во всех указанных форматах используют линкеры либо для слияния основной структуры антитела (IgA, IgD, IgE, IgG или IgM) с дополнительным связывающим белком (например, scFv), либо для слияния, например, двух Fab-фрагментов или scFv (Fischer N., Léger О., Pathobiology 74, 2007, cc.3-14). Хотя очевидно, что линкеры дают преимущества при создании биспецифических антител, с ними могут быть связаны также проблемы терапевтического плана. Фактически эти чужеродные пептиды могут вызывать иммунный ответ против самого линкера или области стыка между белком и линкером. Кроме того, гибкая природа этих пептидов делает их более чувствительными к протеолитическому расщеплению, что может приводить к плохой стабильности, агрегации и повышенной иммуногенности антитела. Кроме того, может существовать необходимость в поддержании эффекторных функций, таких, например, как комплементзависимая цитотоксичность (CDC) или антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), которые опосредуются Fc-областью, путем сохранения высокой степени сходства с встречающимися в естественных условиях антителами.
Таким образом, в идеальном варианте необходимо создавать биспецифические антитела, структура которых очень сходна с общей структурой встречающихся в естественных условиях антител (типа IgA, IgD, IgE, IgG или IgM) и имеет минимальное отклонение от человеческих последовательностей.
В соответствии с одним из подходов биспецифические антитела с высокой степенью сходства со встречающимися в естественных условиях антителами создавали с помощью технологии квадром (квадрогибридом) (см. Milstein С. и А.С.Cuello, Nature, 305, 1983, cc.537-540) на основе соматического слияния двух различных клеточных линий гибридом, которые экспрессируют мышиные моноклональные антитела с требуемыми для биспецифического антитела специфичностями. В результате случайного спаривания тяжелых и легких цепей двух различных антител в образующейся линии клеток гибрида-гибридомы (или квадромы) получают вплоть до 10 различных видов антител, из которых только одно представляет собой требуемое функциональное биспецифическое антитело. Из-за присутствия полученных в результате ошибочного спаривания побочных продуктов и в значительной степени сниженного выхода продукта требуются более сложные процедуры очистки (см., например, Morrison S.L., Nature Biotech 25, 2007, cc.1233-1234). В целом эта же проблема, связанная с ошибочно спаренными побочными продуктами, сохраняется и при применении методов рекомбинантной экспрессии.
Подход, с помощью которого можно обойти проблему, связанную с полученными в результате ошибочных спариваний побочными продуктами, известный под названием «knobs-into-holes»-технология (взаимодействие по типу «выступ-впадина»), направлен на усиление спаривания тяжелых цепей двух различных антител путем интродукции мутаций в СН3-домены для модификации поверхности раздела в области контакта. На одной цепи имеющие большие размеры аминокислоты заменяли на аминокислоты с короткими боковыми цепями для создания «впадины». И, наоборот, аминокислоты с более крупными боковыми цепями интродуцировали в другой СН3-домен, создавая «выступ». Путем совместной экспрессии этих двух тяжелых цепей (и двух идентичных легких цепей, которые должны соответствовать обеим тяжелым цепям) достигали высоких выходов гетеродимерной конструкции («выступ-впадина») относительно гомодимерной конструкции («впадина-впадина» или «выступ-выступ») (Ridgway J. В. и др., Protein Eng. 9, 1996, cc.617-621; и WO 1996/027011). Процентное содержание гетеродимера можно дополнительно повышать путем ремоделирования поверхностей раздела двух СН3-доменов с помощью технологии фагового дисплея и интродукции дисульфидного мостика с целью стабилизации гетеродимеров (Merchant A.M и др., Nature Biotech 16, 1998, cc.677-681; Atwell S., Ridgway J.B., Wells J.A., Carter P., J Mol Biol 270, 1997, cc.26-35). Новые подходы к технологии «knobs-into-holes» описаны, например, в ЕР 1870459А1. Хотя указанный формат, вероятно, является очень привлекательным, в настоящее время отсутствуют данные о его усовершенствовании в направлении клинического применения. Одним из важных ограничений этой стратегии является то, что легкие цепи двух родительских антител должны быть идентичными для предупреждения ошибочного спаривания и формирования неактивных молекул. Таким образом, эта технология не пригодна в качестве основы для более легкого создания рекомбинантных биспецифических антител к двум антигенам с использованием в качестве исходных двух антител к первому и второму антигену, поскольку должны быть оптимизированы или тяжелые цепи этих антител, и/или идентичные легкие цепи. Такая же проблема, связанная с ошибочными спариваниями, сохраняется, когда вместо двухвалентных биспецифических антител экспрессируют четырехвалентные биспецифические антитела, например, посредством слияния дополнительных Fab-фрагментов (каждый из которых идентичен Fab-фрагменту соответствующего антитела, которое связывается с первым или вторым антигеном) с С-концом каждой тяжелой цепи гетеродимера (см. фиг.2).
В WO 2006/093794 описаны композиции гетеродимерных связывающих белков. В WO 99/37791 описаны многоцелевые производные антител. У Morrison и др., J. Immunolog, 160, 1998, cc.2802-2808 описано влияние замены вариабельных областей на функциональные свойства IgG.
Краткое изложение сущности изобретения
Настоящее изобретение относится к биспецифическому четырехвалентному антигенсвязывающему белку, содержащему:
а) модифицированную тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, где С-конец указанной тяжелой цепи дополнительно слит с VH-CH1-доменами указанного первого антитела посредством их N-концов;
б) две легкие цепи первого антитела, указанного в подпункте а),
в) модифицированную тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном,
в котором СН1-домен заменен на CL-домен указанного второго антитела,
и где С-конец указанной тяжелой цепи дополнительно слит с VH-CL-доменами указанного второго антитела посредством их N-концов; и
г) две модифицированные легкие цепи второго антитела, указанного в подпункте в),
в которых CL-домен заменен на СН1-домен указанного второго антитела.
Следующим вариантом осуществления изобретения является способ получения антигенсвязывающего белка, предлагаемого в изобретении, заключающийся в том, что
а) трансформируют клетку-хозяина
- векторами, которые содержат молекулы нуклеиновых кислот, кодирующие биспецифический антигенсвязывающий белок, предлагаемый в изобретении,
б) культивируют клетку-хозяина в условиях, которые позволяют синтезировать указанную молекулу антитела, и
в) выделяют молекулу антитела из культуры.
Следующим вариантом осуществления изобретения является клетка-хозяин, содержащая
- векторы, которые содержат молекулы нуклеиновых кислот, кодирующие антигенсвязывающий белок, предлагаемый в изобретении.
Следующим вариантом осуществления изобретения является фармацевтическая композиция, которая содержит антигенсвязывающий белок, предлагаемый в изобретении, и по меньшей мере один фармацевтически приемлемый эксципиент.
Следующим вариантом осуществления изобретения является способ лечения пациента, который нуждается в терапии, отличающийся тем, что вводят пациенту в терапевтически эффективном количестве антигенсвязывающий белок, предлагаемый в изобретении.
Согласно изобретению соотношение требуемого биспецифического четырехвалентного антигенсвязывающего белка и нежелательных побочных продуктов можно повышать путем замены СН1-домена на CL-домен в модифицированной тяжелой цепи, указанной в подпункте в), и в соответствующих двух модифицированных легких цепях, указанных в подпункте г). Таким путем можно снижать нежелательное ошибочное спаривание легких цепей антитела, которое специфически связывается с первым антигеном (указаны в подпункте б) с «несоответствующими» VH-CH1 -доменами модифицированных тяжелых цепей антитела (указаны в подпункте в), которое связывается со вторым антигеном. И аналогичным образом снижать ошибочное спаривание модифицированных легких цепей, указанных в подпункте г), с тяжелыми цепями, указанными в подпункте а), (см. фиг.2, на которой представлен вариант, в котором отсутствуют указанные модификации и присутствует ошибочное спаривание, и фиг.3, на которой представлен вариант, в котором присутствуют замены (или обмены) СН1-CL и отсутствует ошибочное спаривание).
Подробное описание изобретения
Настоящее изобретение относится к биспецифическому четырехвалентному антигенсвязывающему белку, содержащему:
а) модифицированную тяжелую цепь первого антитела, которое специфически связывается с первым антигеном,
где С-конец указанной тяжелой цепи дополнительно слит посредством пептида-коннектора с N-концами VH-CH1-доменов указанного первого антитела;
б) две легкие цепи первого антитела, указанного в подпункте а),
в) модифицированную тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном,
в котором СН1-домен заменен на CL-домен указанного второго антитела, и где С-конец указанной тяжелой цепи дополнительно слит посредством пептида-коннектора с N-концами VH- CL-доменов указанного второго антитела, и
г) две модифицированные легкие цепи второго антитела, указанного в подпункте в),
в которых CL-домен заменен на СН1-домен указанного второго антитела. Согласно изобретению соотношение требуемого биспецифического четырехвалентного антигенсвязывающего белка и нежелательных побочных продуктов (полученных в результате ошибочного спаривания легких цепей антитела и «несоответствующих» тяжелых цепей антитела) можно повышать путем замены СН1-домена на CL-домен в модифицированной тяжелой цепи указанной в подпункте в), и в соответствующих двух модифицированных легких цепях, указанных в подпункте г). В этом плане ошибочное спаривание означает ассоциацию I) легких цепей антитела, которое специфически связывается с первым антигеном, указанных в подпункте б), с модифицированной тяжелой цепью антитела, которое специфически связывается со вторым антигеном; или II) легких цепей антитела, которое специфически связывается со вторым антигеном, указанных в подпункте б), с модифицированной тяжелой цепью антитела, которое специфически связывается с первым антигеном (см. фиг.2), что приводит к образованию нежелательных неактивных или не полностью функциональных побочных продуктов.
Согласно дополнительному объекту изобретения такое улучшенное соотношение между требуемым биспецифическим четырехвалентным антителом и нежелательными побочными продуктами можно еще более улучшать путем осуществления модификаций СН3-доменов указанных антител, которые обладают способностью специфически связываться с первым и вторым антигенами.
Таким образом, в одном из предпочтительных вариантов осуществления изобретения СН3-домены (в модифицированных тяжелых цепях, указанных в подпунктах а) и в)) указанного биспецифического четырехвалентного антигенсвязывающего белка, предлагаемого в изобретении, можно изменять с помощью технологии «knob-into-holes», которая подробно описана на нескольких примерах, например, в WO 96/027011, у Ridgway J.B. и др., Protein Eng 9, 1996, cc.617-621; и у Merchant A.M. и др., Nat Biotechnol 16, 1998, cc.677-681. При использовании этого метода взаимодействующие поверхности двух СН3-доменов изменяют с целью повышения уровня гетеродимеризации обеих тяжелых цепей, содержащих эти два СН3-домена. Каждый из двух СН3-доменов (двух тяжелых цепей) может представлять собой «выступ», а другой представлять собой «впадину». Введение дисульфидного мостика дополнительно стабилизирует гетеродимеры (Merchant A.M, и др., Nature Biotech 16, 1998, cc.677-681; Atwell S. и др., J Mol Biol 270, 1997, cc.26-35) и повышает выход продукта.
Таким образом, согласно одному из объектов изобретения биспецифический четырехвалентный антигенсвязывающий белок дополнительно отличается тем, что
СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте а), и СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте б), каждый соприкасается друг с другом на поверхности раздела, которая представляет собой исходную поверхность раздела между СН3-доменами антитела;
- при этом поверхность раздела изменена для стимулирования формирования биспецифического четырехвалентного антигенсвязывающего белка, где изменение отличается тем, что:
I) СН3-домен одной тяжелой цепи изменен
так, что на исходной поверхности раздела СН3-домена одной тяжелой цепи, которая соприкасается с исходной поверхностью раздела СН3-домена другой тяжелой цепи в биспецифическом четырехвалентном антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет большую по объему боковую цепь, создавая тем самым «выпуклость» на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в «полость» на поверхности раздела СН3-домена другой тяжелой цепи,
и
II) СН3-домен другой тяжелой цепи изменен
так, что на исходной поверхности раздела второго СН3-домена, которая соприкасается с исходной поверхностью раздела первого СН3-домена в биспецифическом четырехвалентном антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет меньшую по объему боковую цепь, создавая тем самым «полость» на поверхности раздела второго СН3-домена, в которую может помещаться «выпуклость» на поверхности раздела первого СН3-домена.
Предпочтительно указанный аминокислотный остаток, который имеет большую по объему боковую цепь, выбирают из группы, включающей аргинин (R), фенилаланин (F), тирозин (Y), триптофан (W).
Предпочтительно указанный аминокислотный остаток, который имеет меньшую по объему боковую цепь, выбирают из группы, включающей аланин (А), серин (S), треонин (Т), валин (V).
Согласно одному из объектов изобретения оба СН3-домена дополнительно изменяют путем интродукции цистеина (С) в качестве аминокислоты в соответствующие положения каждого СН3-домена таким образом, чтобы мог образоваться дисульфидный мостик между обоими СН3-доменами.
В одном из предпочтительных вариантов осуществления изобретения биспецифический четырехвалентный антигенсвязывающий белок содержит мутацию T366W в СН3-домене имеющей «выступ» цепи («knobs-цепь») и мутации T366S, L368A, Y407V в СН3-домене имеющей «впадину» цепи («hole-цепь»), Можно применять также дополнительный связывающий цепи дисульфидный мостик между СН3-доменами (Merchant A.M. и др., Nature Biotech. 16, 1998, cc.677-681), например, путем интродукции мутации Y349C в СН3-домен имеющей «выступ» или «впадину» цепи и мутации Е356С или мутации S354C в СН3-домен другой цепи. Так, в другом предпочтительном варианте осуществления изобретения указанный биспецифический четырехвалентный антигенсвязывающий белок имеет мутации S354C, T366W в одном из двух СН3-доменов и мутации Y349C, T366S, L368A, Y407V во втором из двух СН3-доменов, или указанный биспецифический четырехвалентный антигенсвязывающий белок имеет мутации Е356С, T366W в одном из двух СН3-доменов и мутации Y349C, T366S, L368A, Y407V во втором из двух СН3-доменов, или указанный биспецифический четырехвалентный антигенсвязывающий белок имеет мутации Y349C, T366W в одном из двух СН3-доменов и мутации Е356С, T366S, L368A, Y407V во втором из двух СН3-доменов, или указанный биспецифический четырехвалентный антигенсвязывающий белок имеет мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов (дополнительная мутация Y349C в одном из СН3-доменов и дополнительная мутация Е356С или S354C во втором СН3-домене образуют расположенный между цепями дисульфидный мостик) (нумерация во всех случаях соответствует нумерации EU по Кэботу). В альтернативном варианте или дополнительно можно применять также и другие технологии «knobs-in-holes»-типа, описанные в ЕР 1870459А1. Предпочтительным примером мутаций для рассматриваемого триспецифического или тетраспецифического антитела являются мутации R409D; К370Е в СН3-домене имеющей «выпуклость» цепи и мутации D399K; Е357К в СН3-домене имеющей «впадину» цепи (нумерация во всех случаях соответствует нумерации EU по Кэботу).
В другом предпочтительном варианте осуществления изобретения триспецифическое или тетраспецифическое антитело содержит мутацию T366W в СН3-домене имеющей «выпуклость» цепи и мутации T366S, L368A, Y407V в СН3-домене имеющей «впадину» цепи и дополнительные мутации R409D; К370Е в СН3-домене имеющей «выпуклость» цепи и мутации D399K; Е357К в СН3-домене имеющей «впадину» цепи.
В следующем предпочтительном варианте осуществления изобретения триспецифическое или тетраспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов, или указанное триспецифическое или тетраспецифическое антитело содержит мутации Y349C, T366W в одном из двух СН3-доменов и мутации S354C, T366S, L368A, Y407V во втором из двух СН3-доменов и дополнительно содержит мутации R409D; К370Е в СН3-домене имеющей «выпуклость» цепи и мутации D399K; Е357К в СН3-домене имеющей «впадину» цепи.
В контексте настоящего описания понятие «антитело» относится к полноразмерному антителу, состоящему из двух тяжелых цепей антитела и двух легких цепей антитела (см. фиг.1). Тяжелая цепь полноразмерного антитела представляет собой полипептид, который содержит в направлении от N-конца к С-концу вариабельную область (домен) тяжелой цепи антитела (VH), домен 1 константной области тяжелой цепи антитела (СН1), шарнирную область антитела (HR), домен 2 константной области тяжелой цепи антитела (СН2) и домен 3 константной области тяжелой цепи антитела (СН3), что сокращенно обозначают как VH-CH1-HR-CH2-CH3; и необязательно домен 4 константной области тяжелой цепи антитела (СН4) в случае антитела подкласса IgE. Предпочтительно тяжелая цепь полноразмерного антитела представляет собой полипептид, который содержит в направлении от N-конца к С-концу VH, CH1, HR, СН2 и СН3. Легкая цепь полноразмерного антитела представляет собой полипептид, который содержит в направлении от N-конца к С-концу вариабельную область (домен) легкой цепи антитела (VL) и константную область легкой цепи антитела (CL), что сокращенно обозначают как VL-CL. Константная область легкой цепи антитела (CL) может относиться к κ-(каппа)-типу или λ-(лямбда)-типу. Цепи антитела связаны друг с другом посредством расположенных между полипептидами дисульфидных мостиков, которые находятся между CL-доменом и СН1-доменом (т.е. между легкой и тяжелой цепью) и между шарнирными областями тяжелых цепей полноразмерного антитела. Примерами типичных полноразмерных антител являются встречающиеся в естественных условиях антитела типа IgG (например, IgG1 и IgG2), IgM, IgA, IgD и IgE). Антитела, предлагаемые в изобретении, могут иметь происхождение из одного вида, например человеческие антитела, или они могут представлять собой химерные или гуманизированные антитела. Полноразмерные антитела, предлагаемые в изобретении, содержат два антигенсвязывающих центра, каждый из которых образован парой VH- и VL-областей, которые оба специфически связываются с одним и тем же (первым) антигеном. С-конец тяжелой или легкой цепи указанного полноразмерного антитела обозначает последнюю аминокислоту на С-конце указанной тяжелой или легкой цепи. Указанное антитело содержит два идентичных Fab-фрагмента, которые состоят из VH- и CH1-домена тяжелой цепи и VL- и CL-домена легкой цепи (см. фиг.1).
В антигенсвязывающем белке, предлагаемом в изобретении, СН1- и CL-домены второго антитела, которое специфически связывается со вторым антигеном, заменены друг на друга, что приводит к получению модифицированных легких цепей, указанных в подпункте г), и модифицированных тяжелых цепей, указанных в подпункте в), где С-конец указанной тяжелой цепи дополнительно слит посредством пептида-коннектора с N-концами VH-CL-доменов указанного антитела (которое специфически связывается со вторым антигеном).
Понятие «VH-CH1-домены» указанного антитела (которое специфически связывается с первым антигеном) относится к VH- и СН1-доменам антитела, расположенным в направлении от N-конца к С-концу. А понятие «VH-CL-домены» указанного антитела (которое специфически связывается со вторым антигеном) относится к VH- и СН1-доменам антитела, расположенным в направлении от N-конца к С-концу.
В контексте настоящего изобретения понятие «пептид-коннектор» обозначает пептид, аминокислотные последовательности которого предпочтительно являются синтетическими. Такие пептиды-коннекторы, предлагаемые в изобретении, применяют для слияния антигенсвязывающих пептидов с С- или N-концом цепей полноразмерного и/или модифицированного полноразмерного антитела с образованием биспецифического антигенсвязывающего белка, предлагаемого в изобретении. Предпочтительно пептиды-коннекторы, указанные в подпункте в), представляют собой пептиды, аминокислотная последовательность которых состоит по меньшей мере из 5 аминокислот, предпочтительно состоит из 5-100, более предпочтительно из 10-50 аминокислот.В одном из вариантов осуществления изобретения пептид-коннектор представляет собой конструкцию (GxS)n или (GxS)nGm, где G обозначает глицин, S обозначает серин и (х=3, n=3, 4, 5 или 6 и m=0, 1, 2 или 3) или (х=4, n=2, 3, 4 или 5 и m=0, 1, 2 или 3), предпочтительно х=4 и n=2 или 3, более предпочтительно х=4, n=2. В одном из вариантов осуществления изобретения пептид-коннектор представляет собой конструкцию (G4S)2.
В контексте настоящего описания понятия «сайт связывания» или «антигенсвязывающий центр» обозначают область(и) антигенсвязывающего белка, предлагаемого в изобретении, с которой(ыми) фактически связывается лиганд (например, антиген или фрагмент антигена) и который выведен из молекулы антитела или его фрагмента (например, Fab-фрагмента). Согласно изобретению антигенсвязывающий центр включает вариабельный домен тяжелой цепи антитела (VH) и вариабельный домен легкой цепи антитела (VL) или фрагмента антитела, который специфически связывается с требуемым антигеном.
Антигенсвязывающие центры (т.е. пары VH/VL), обладающие способностью специфически связываться с требуемым антигеном, можно выводить из а) известных антител к антигену или б) новых антител или фрагментов антител, полученных de novo с помощью методов иммунизации с использованием, среди прочего, либо белка, либо нуклеиновой кислоты антигена или его фрагментов, или с помощью метода фагового дисплея.
Антигенсвязывающий центр антигенсвязывающего белка, предлагаемого в изобретении, содержит шесть гипервариабельных участков (CDR), которые вносят различный вклад в аффинность сайта связывания с антигеном. Они представляют собой три вариабельных домена (CDR-участки) тяжелой цепи (CDRH1, CDRH2 и CDRH3) и три вариабельных домена (CDR-участки) легкой цепи (CDRL1, CDRL2 и CDRL3). Размер CDR и каркасных участков (FR) определяют путем сравнения с компилированной базой данных аминокислотных последовательностей, в которых такие участки были определены на основе вариабельности последовательностей.
Специфичность антитела характеризует избирательное распознавание антителом конкретного эпитопа антигена. Например, встречающиеся в естественных условиях антитела являются моноспецифическими. Биспецифические антитела представляют собой антитела, которые обладают специфичностью связывания с двумя различными антигенами. Когда антитело имеет более одной специфичности, то распознаваемые эпитопы могут быть ассоциированы с одним антигеном или с несколькими антигенами.
В контексте настоящего описания понятие «моноспецифическое» антитело или «моноспецифический» антигенсвязывающий белок обозначает антитело или антигенсвязывающий белок, которое/который имеет один или несколько сайтов связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена.
В контексте настоящего описания понятие «валентность» означает наличие определенного количества сайтов связывания в молекуле антитела. Например, встречающееся в естественных условиях антитело или полноразмерное антитело, предлагаемое в изобретении, имеет два сайта связывания и является двухвалентным. Таким образом, понятие «четырехвалентный» означает наличие четырех сайтов связывания в антигенсвязывающем белке. В контексте настоящего описания понятие «биспецифический четырехвалентный» обозначает антигенсвязывающий белок, предлагаемый в изобретении, который имеет четыре антигенсвязывающих центра, два из которых связываются с первым антигеном и два связываются со вторым антигеном (или другим эпитопом антигена). Антигенсвязывающие белки, предлагаемые в настоящем изобретении, имеют четыре сайта связывания и являются четырехвалентными.
Полноразмерные антитела, предлагаемые в изобретении, содержат константные области иммуноглобулина из одного или нескольких классов иммуноглобулинов. Классы иммуноглобулинов включают изотипы IgG, IgM, IgA, IgD и IgE, а в случае IgG и IgA, также их подтипы. В предпочтительном варианте осуществления изобретения полноразмерное антитело, предлагаемое в изобретении, имеет структуру константного домена, которая соответствует структуре антитела IgG-типа.
В контексте настоящего описания понятия «моноклональное антитело» или «композиция моноклонального антитела» относятся к препарату антитела или молекулам антитела или антигенсвязывающего белка одинакового аминокислотного состава.
Понятие «химерное антитело» относится к антителу, содержащему вариабельную область, т.е. связывающую область, полученную из одного и того же источника или из одних и тех же видов, и по меньшей мере часть константной области, полученную из другого источника или других видов, и его, как правило, получают с использованием методов рекомбинантной ДНК. Предпочтительными являются химерные антитела, которые содержат мышиную вариабельную область и человеческую константную область. Другими предпочтительными формами «химерных антител», подпадающих под объем настоящего изобретения, являются антитела, константная область которых модифицирована или изменена по сравнению с исходным антителом с целью получения свойств, предлагаемых в изобретении, прежде всего касательно связывания C1q и/или связывания Fc-рецептора (FcR). Такие химерные антитела обозначают также как «антитела переключенного класса». Химерные антитела являются продуктом экспрессии генов иммуноглобулинов, содержащих сегменты ДНК, которые кодируют вариабельные области иммуноглобулинов, и сегменты ДНК, которые кодируют константные области иммуноглобулинов. Методы получения химерных антител включают обычные методы рекомбинантной ДНК и генной трансфекции, которые хорошо известны в данной области (см., например, Morrison S.L. и др., Proc. Natl. Acad. Sci. USA 81, 1984, cc.6851-6855; US 5202238 и US 5204244).
Понятие «гуманизированное антитело» относится к антителам, в которых каркасные или «гипервариабельные участки» (CDR) модифицированы так, что они содержат CDR иммуноглобулина другой специфичности по сравнению со специфичностью родительского иммуноглобулина. В предпочтительном варианте осуществления изобретения для получения «гуманизированного антитела» мышиный CDR трансплантируют в каркасный участок человеческого антитела (см., например, Riechmann L. и др., Nature 332, 1988, cc.323-327; и Neuberger M.S. и др., Nature 314, 1985, cc.268-270). Наиболее предпочтительные CDR соответствуют участкам, которые имеют последовательности, распознающие антигены, указанные выше для химерных антител. Другими формами «гуманизированных антител», подпадающих под объем настоящего изобретения, являются антитела, константная область которых дополнительно модифицирована или изменена по сравнению с исходным антителом с целью получения свойств, предлагаемых в изобретении, прежде всего касательно связывания C1q и/или связывания Fc-рецептора (FcR).
Понятие «человеческое антитело» в контексте настоящего описания относится к антителам, вариабельные и константные области которых выведены из последовательностей иммуноглобулина человеческой зародышей линии. Человеческие антитела хорошо известны в данной области (van Dijk M.A. и van de Winkel J.G., Curr. Opin. Chem. Biol. 5, 2001, cc.368-374). Человеческие антитела можно получать также в трансгенных животных (например, мышах), которые в результате иммунизации могут продуцировать полный спектр или определенную часть человеческих антител при отсутствии производства эндогенного иммуноглобулина. Перенос набора генов иммуноглобулинов человеческой зародышевой линии в такую мутантную мышиную зародышевую линию должен приводить к производству человеческих антител после антигенной стимуляции (см., например, Jakobovits А., и др., Proc. Natl. Acad. Sci. USA 90, 1993, cc.2551-2555; Jakobovits А. и др., Nature 362, 1993, cc.255-258; Bruggemann M. и др., Year Immunol. 7, 1993, cc.33-40). Человеческие антитела можно получать также с помощью фаговых дисплейных библиотек (Hoogenboom H.R. и Winter G., J. Mol. Biol. 227, 1992, cc.381-388; Marks J.D. и др., J. Mol. Biol. 222, 1991, cc.581-597). Для получения человеческих моноклональных антител можно использовать также методы, разработанные Cole с соавторами и Boerner с соавторами (Cole и др., Monoclonal Antibodies and Cancer Therapy, под ред. Alan R. Liss, 1985, с.77; и Boerner Р. и др., J. Immunol. 147, 1991, cc.86-95).
Как уже было отмечено для химерных и гуманизированных антител, предлагаемых в изобретении, понятие «человеческое антитело» включает также такие антитела, константная область которых модифицирована с целью получения свойств, предлагаемых в изобретении, прежде всего касательно связывания C1q и/или связывания FcR, например, путем «переключения класса», т.е. замены или мутации Fc-областей (например, IgG1 на IgG4 и/или IgG1/IgG4-мутация).
Понятие «рекомбинантное человеческое антитело» в контексте настоящего описания относится ко всем человеческим антителам, которые получают, экспрессируют, создают или выделяют с помощью методов рекомбинации, например к антителам, выделенным из клетки-хозяина, такой как NS0- или СНО-клетка, или из животного (например, мыши), которое является трансгенным из-за присутствия человеческих генов иммуноглобулинов или антител, экспрессируемых с использованием рекомбинантного экспрессионного вектора, которым трансфектирована клетка-хозяин. Такие рекомбинантные человеческие антитела имеют вариабельную и константную области, которые находятся в преобразованной форме. Рекомбинантные человеческие антитела, предлагаемые в изобретении, подвергают соматической гипермутации in vivo. Таким образом, аминокислотные последовательности VH- и VL-областей рекомбинантных антител представляют собой последовательности, которые, хотя и выведены из последовательностей VH и VL человеческой зародышевой линии и родственных им линий, могут не существовать в естественных условиях в спектре зародышевой линии человеческих антител in vivo.
Понятие «вариабельная область (домен)» (вариабельный домен легкой цепи (VL), вариабельный домен тяжелой цепи (VH)) в контексте настоящего описания относится к областям каждой из пары легких и тяжелых цепей, которые участвуют непосредственно в связывании антитела с антигеном. Домены вариабельных человеческих легких и тяжелых цепей имеют одинаковую общую структуру, и каждый домен содержит четыре каркасных участка (FR), последовательности которых являются весьма консервативными, связанных тремя «гипервариабельными участками» (или определяющими комплементарность участками, CDR). Каркасные участки адоптированы к β-складчатой конформации, а CDR могут образовывать петли, соединяющие β-складчатую структуру. CDR в каждой цепи сохраняют их трехмерную структуру с помощью каркасных участков и образуют вместе с CDR из других цепей антигенсвязывающий центр. CDR3-участки тяжелых и легких цепей антитела играют особенно важную роль в специфичности связывания/аффинности антител, предлагаемых в изобретении, и поэтому являются дополнительным объектом изобретения.
Понятия «гипервариабельный участок» или «антигенсвязывающий центр антитела» в контексте настоящего описания относятся к аминокислотным остаткам антитела, которые ответственны за связывания антигена. Гипервариабельный участок содержит аминокислотные остатки из «определяющих комплементарность участков» или «CDR». «Каркасные» или «FR»-участки представляют собой участки вариабельной области, отличные от указанных в настоящем описании остатков гипервариабельного участка. Таким образом, легкие и тяжелые цепи антитела содержат в направлении от N- к С-концу участки FR1, CDR1, FR2, CDR2, FR3, CDR3 и FR4. CDR каждой цепи разделены аминокислотами указанного каркасного участка. В частности, CDR3 тяжелой цепи представляют собой участок, который вносит наибольший вклад в связывание с антигеном. CDR- и FR-участки определяют с помощью стандартной номенклатуры Кэбота (Kabat и др., Sequences of Proteins of Immunological Interest, 5-изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD (1991).
В контексте настоящего описания понятия «связывание», «специфическое связывание» или «который специфически связывается с» относятся к связыванию антитела с эпитопом антигена, что определяют путем анализа in vitro, предпочтительно с помощью анализа резонанса поверхностного плазмона (BIAcore-анализ, фирма GE-Healthcare, Уппсала, Швеция) с использованием очищенного антигена дикого типа. Аффинность связывания характеризуют с помощью понятий ka (константа скорости ассоциации антитела (либо антитела, либо антигенсвязывающего белка) при формировании комплекса антитело/антиген), kD (константа диссоциации) и kD (kD/ka). Наличие связывания или специфического связывания означает, что аффиность связывания (КD) составляет 10-8 моль/л или менее, предпочтительно от 10-9 до 10-13 моль/л. Так, биспецифический антигенсвязывающий белок, предлагаемый в изобретении, специфически связывается с каждым антигеном, в отношении которого он обладает специфичностью, что характеризуется аффинностью связывания (КD), составляющей 10-8 моль/л или менее, предпочтительно от 10-9 до 10-13 моль/л.
Связывание антитела с FcγRIII можно оценивать с помощью BIAcore-анализа (фирма GE-Healthcare, Уппсала, Швеция). Аффинность связывания определяют с помощью понятий ka (константа скорости ассоциации антитела при формировании комплекса антитело/антиген), kD (константа диссоциации) и КD (kD/ka).
Понятие «эпитоп» включает любую полипептидную детерминанту, обладающую способностью специфически связываться с антителом. В некоторых вариантах осуществления изобретения эпитопная детерминанта включает химически активные поверхностные группы молекул, такие как аминокислоты, боковые цепи сахаров, фосфорил или сульфонил, и в некоторых вариантах осуществления изобретения они могут иметь специфические трехмерные структурные характеристики и/или специфические характеристики заряда. Эпитоп представляет собой область антигена, с которой связывается антитело.
В некоторых вариантах осуществления изобретения считается, что антитело специфически связывается с антигеном, когда оно преимущественно распознает свой антиген-мишень в сложной смеси белков и/или макромолекул.
В другом варианте осуществления изобретения биспецифический антигенсвязывающий белок, предлагаемый в изобретении, отличается тем, что указанное полноразмерное антитело относится к подклассу человеческого IgG1 или подклассу человеческого IgG1, имеющему мутации L234A и L235A.
В другом варианте осуществления изобретения биспецифический антигенсвязывающий белок, предлагаемый в изобретении, отличается тем, что указанное полноразмерное антитело относится к подклассу человеческого IgG2.
В другом варианте осуществления изобретения биспецифический антигенсвязывающий белок, предлагаемый в изобретении, отличается тем, что указанное полноразмерное антитело относится к подклассу человеческого IgG3.
В другом варианте осуществления изобретения биспецифический антигенсвязывающий белок, предлагаемый в изобретении, отличается тем, что указанное полноразмерное антитело относится к подклассу человеческого IgG4 или подклассу человеческого IgG4, имеющему дополнительную мутацию S228P.
Предпочтительно биспецифический антигенсвязывающий белок, предлагаемый в изобретении, отличается тем, что указанное полноразмерное антитело относится к подклассу человеческого IgG1, подклассу человеческого IgG4, имеющему дополнительную мутацию S228P.
При создании настоящего изобретения было установлено, что биспецифические антигенсвязывающие белки, предлагаемые в изобретении, обладают улучшенными характеристиками, такими как биологическая или фармакологическая активность, фармакокинетические свойства или токсичность. Их можно применять, например, для лечения заболеваний, таких как рак.
В контексте настоящего описания понятие «константная область» обозначает совокупность доменов антитела, отличных от вариабельной области. Константная область не принимает непосредственного участия в связывании с антигеном, но она обладает различными эффекторными функциями. Антитела подразделяют в зависимости от аминокислотной последовательности константной области их тяжелых цепей на классы: IgA, IgD, IgE, IgG и IgM, a некоторые из них можно дополнительно подразделять на подклассы, такие как IgG1, IgG2, IgG3 и IgG4, IgA1 и IgA2. Константные области тяжелой цепи, соответствующие различным классам антител, обозначают символами α, β, ε, γ и µ соответственно. Константные области легкой цепи (CL), которые могут присутствовать во всех пяти классах антител, обозначают символами κ (каппа) и λ (лямбда).
В контексте настоящего описания понятие «константная область, выведенная из человеческого источника» обозначает константную область тяжелой цепи человеческого антитела подкласса IgG1, IgG2, IgG3 или IgG4 и/или константную область легкой каппа- или лямбда-цепи. Такие константные области хорошо известны в данной области, и они описаны, например, у Kabat Е.А. (см., например, Johnson, G. и Wu T.T., Nucleic Acids Res. 28, 2000, cc.214-218; Kabat Е.А. и др., Proc. Natl. Acad. Sci. USA 72, 1975, cc.2785-2788).
В то время как антитела подкласса IgG4 обладают небольшой способностью к связыванию с Fc-рецептором (FcγRIIIa), антитела других подклассов IgG характеризуются выраженной способностью к связыванию. Однако изменение таких остатков, как Pro238, Asp265, Asp270, Asn297 (утрата углевода Fc), Pro329, Leu234, Leu235, Gly236, Gly237, Ile253, Ser254, Lys288, Thr307, Gln311, Asn434 и His435, также приводит к снижению способности к связыванию с Fc-рецептором (Shields R.L. и др., J. Biol. Chem. 276, 2001, cc.6591-6604; Lund J. и др., FASEB J. 9, 1995, cc.115-119; Morgan А. и др., Immunology 86, 1995, cc.319-324; ЕР 0307434).
В одном из вариантов осуществления изобретения антигенсвязывающий белок, предлагаемый в изобретении, обладает более низкой способностью к связыванию с FcR по сравнению с антителом подкласса IgG1, и полноразмерное родительское антитело с точки зрения связывания с FcR относится к подклассу IgG4 или подклассу IgG1 или IgG2, имеющему мутацию в S228, L234, L235 и/или D265, и/или содержащему мутацию PVA236. В одном из вариантов осуществления изобретения мутации в полноразмерном родительском антителе представляют собой S228P, L234A, L235A, L235E и/или PVA236. В другом варианте осуществления изобретения мутации в полноразмерном родительском антителе представляют собой: S228P в случае IgG4 и L234A и L235A в случае IgG1.
Константная область антитела принимает непосредственное участие в ADCC (антитело-обусловленная клеточнозависимая цитотоксичность) и CDC (комплементзависимая цитотоксичность). Активация комплемента (CDC) инициируется в результате связывания фактора C1q системы комплемента с константной областью антител большинства из подклассов IgG. Связывание C1q с антителом происходит в результате определенных белок-белковых взаимодействий в так называемом сайте связывания. Такие сайты связывания константных областей известны в данной области, и они описаны, например, у Lukas T.J. и др., J. Immunol. 127, 1981, cc.2555-2560; Bunkhouse R. и Cobra J.J., Mol. Immunol. 16, 1979, cc.907-917; Burton D.R. и др., Nature 288, 1980, cc.338-344; Thomason J.E. и др., Mol. Immunol. 37, 2000, cc.995-1004; Idiocies E.E. и др., J. Immunol. 164, 2000, cc.4178-4184; Hearer M. и др., J. Virol. 75, 2001, cc.12161-12168; Morgan А. и др., Immunology 86, 1995, cc.319-324; и в ЕР 0307434.
Такими сайтами связывания константной области являются, например, сайты, в которых присутствуют аминокислоты L234, L235, D270, N297, Е318, K320, K322, Р331 и Р329 (нумерация согласно нумерации EU по Кэботу).
Понятие «антитело-обусловленная клеточнозависимая цитотоксичность (ADCC)» относится к лизису человеческих клеток-мишеней, опосредованному антигенсвязывающим белком, предлагаемым в изобретении, в присутствии эффекторных клеток. Уровень ADCC оценивают предпочтительно путем обработки препарата экспрессирующих антиген клеток антигенсвязывающим белком, предлагаемым в изобретении, в присутствии эффекторных клеток, таких как свежевыделенные мононуклеарные клетки периферической крови (РВМС) или очищенные эффекторные клетки из лейкоцитарных пленок, типа моноцитов или естественных клеток-киллеров (NK) или постоянно выращиваемой линии NK-клеток.
Понятие «комплементзависимая цитотоксичность (CDC)» обозначает процесс, инициируемый связыванием фактора C1q системы комплемента с Fc-фрагментом большинства подклассов антител IgG-изотипа. Связывание C1q с антителом происходит в результате определенных белок-белковых взаимодействий в так называемом сайте связывания. Такие сайты связывания Fc-фрагмента известны в данной области (см. выше). Такие сайты связывания Fc-фрагмента представляют собой сайты, в которых присутствуют аминокислоты L234, L235, D270, N297, Е318, К320, К322, Р331 и Р329 (нумерация согласно нумерации EU по Кэботу). Антитела подклассов IgG1, IgG2 и IgG3, как правило, обладают способностью к активации комплемента, включая связывание с C1q и С3, в то время как IgG4 не активирует систему комплемента и не связывается с C1q и/или С3.
Клеточно-опосредованные эффекторные функции моноклональных антител можно усиливать путем конструирования его олигосахаридного компонента, как это описано у Umana Р. и др., Nature Biotechnol. 17, 1999, cc.176-180 и в US 6602684. Антитела IgG1-типа, которые являются наиболее широко применяемыми терапевтическими антителами, представляют собой гликопротеины, которые имеют консервативный N-сцепленный сайт гликозилирования на Asn297 в каждом из доменов СН2. Два сложных биантенных олигосахарида, присоединенные к Asn297, расположены между СН2-доменами, формируя протяженные области контакта с полипептидным каркасом, и их присутствие является важным для опосредуемых антителом эффекторных функций, таких как антитело-обусловленная клеточнозависимая цитотоксичность (ADCC) (Lifely M. R. и др., Glycobiology 5, 1995, cc.813-822; Jefferis R. и др., Immunol. Rev. 163, 1998, cc.59-76; Wright А. и Morrison S.L., Trends Biotechnol. 15, 1997, cc.26-32). В статье Umana P. и др., Nature Biotechnol. 17, 1999, cc.176-180 и в WO 99/54342 продемонстрировано, что сверхэкспрессия в клетках яичника китайского хомячка (СНО) β(1,4)-N-ацетилглюкозаминилтрансферазы III («GnTIII»), которая представляет собой гликозилтрансферазу, катализирующую образование бисекционных олигосахаридов, существенно повышает ADCC-активность антител т vitro. Изменения состава присоединенного к Asn297 углевода или его элиминация оказывает влияние также на связывание с FcγR и C1q (Umana P. и др., Nature Biotechnol. 17, 1999, cc.176-180; Davies J. и др., Biotechnol. Bioeng. 74, 2001, cc.288-294; Mimura Y. и др., J. Biol. Chem. 276, 2001, cc.45539-45547; Radaev S. и др., J. Biol. Chem. 276, 2001, cc.16478-16483; Shields R.L. и др., J. Biol. Chem. 276, 2001, cc.6591-6604; Shields R.L. и др., J. Biol. Chem. 277, 2002, cc.26733-26740; Simmons L.C. и др., J. Immunol. Methods 263, 2002, cc.133-147).
Методы усиления клеточно-опосредуемых эффекторных функций моноклональных антител описаны, например, в WO 2005/018572, WO 2006/116260, WO 2006/114700, WO 2004/065540, WO 2005/011735, WO 2005/027966, WO 1997/028267, US 2006/0134709, US 2005/0054048, US 2005/0152894, WO 2003/035835, WO 2000/061739.
В одном из предпочтительных вариантов осуществления изобретения биспецифический антигенсвязывающий белок является гликозилированным (если он содержит Fc-фрагмент антитела подкласса IgG1, IgG2, IgG3 или IgG4, предпочтительно подкласса IgG1 или IgG3) с сахарной цепью на Asn297, при этом количество фукозных остатков в указанной сахарной цепи составляет 65% или менее (нумерация согласно Кэботу), В другом варианте осуществления изобретения количество фукозных остатков в указанной сахарной цепи составляет от 5 до 65%, предпочтительно от 20 до 40%. В контексте настоящего описания «Asn297» обозначает аминокислоту аспарагин, присутствующую примерно в положении 297 в Fc-фрагменте. Вследствие минорных вариаций последовательности антител Asn297 может располагаться также на несколько аминокислот (как правило, не более чем на ±3 аминокислоты) дальше или ближе в направлении к С-концу по отношению к положению 297, т.е. между положениями 294 и 300. В одном из вариантов осуществления изобретения предлагаемый в изобретении гликозилированный антигенсвязывающий белок подкласса IgG представляет собой человеческое антитело подкласса IgG1, человеческое антитело подкласса IgG1, имеющее мутации L234A и L235A, или антитело подкласса IgG3. В другом варианте осуществления изобретения количество остатков N-гликолилнейраминовой кислоты (NGNA) составляет 1% или менее и/или количество остатков N-концевой альфа-1,3-галактозы составляет 1% или менее в указанной сахарной цепи. Предпочтительно сахарная цепь обладает характеристиками N-сцепленных гликанов, присоединенных к Asn297 антитела, которое рекомбинантно экспрессируется в СНО-клетке.
Выражение «сахарная цепь обладает характеристиками N-сцепленных гликанов, присоединенных к Asn297 антитела, которое рекомбинантно экспрессируется в СНО-клетке» означает, что сахарная цепь на Asn297 полноразмерного родительского антитела, предлагаемого в изобретении, имеет такую же структуру и последовательность сахарных остатков за исключением фукозного остатка, что и антитело, экспрессируемое в немодифицированных СНО-клетках, например, как описано в WO 2006/103100.
В контексте настоящего описания понятие «NGNA» обозначает сахарный остаток N-гликолилнейраминовой кислоты.
Гликозилирование человеческого IgG1 или IgG3 имеет место на Asn297 в виде гликозилирования, осуществляемого с помощью сложного биантенного олигосахарида с коровым фукозилированием, на концах которого располагаются вплоть до 2 остатков Gal. Константные области человеческих тяжелых цепей подклассов IgG1 или IgG3 подробно описаны у Kabat E.A. и др., Sequences of Proteins oflmmunological Interest, 5-е изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991 и у Brüggemann M. и др., J. Exp.Med. 166, 1987, cc.1351-1361; Love T.W. и др., Methods Enzymol. 178, 1989, cc.515-527. Эти структуры обозначают как гликановые остатки G0, G1 (α 1,6 или α 1,3) или G2 в зависимости от количества концевых остатков Gal (Raju T.S., BioProcess Int. 1, 2003, cc.44-53). СНО-тип гликозилирования Fc-фрагментов антитела описан, например, у Routier F.H., Glycoconjugate J. 14, 1997, cc.201-207. Антитела, которые рекомбинантно экспрессируются в СНО-клетках-хозяевах с немодифицированной схемой гликозилирования, как правило, являются фукозилированными на Asn297 по меньшей мере на 85%. Модифицированные олигосахариды в полноразмерном родительском антителе могут быть гибридными или сложными. Предпочтительно бисекционные восстановленные/нефукозилированные олигосахариды являются гибридными. В другом варианте осуществления изобретения бисекционные восстановленные/нефукозилированные олигосахариды являются комплексными.
В контексте изобретения понятие «количество фукозы» означает количество указанного сахара в сахарной цепи на Asn297 по отношению к сумме всех гликоструктур, присоединенных к Asn 297 (например, комплексных, гибридных структур и структур с высоким содержанием маннозы), которое измеряют с помощью MALDI-TOF-масс-спектрометрии и рассчитывают в виде среднего значения. Относительное количество фукозы выражают в виде процента содержащих фукозу структур относительно всех гликоструктур, идентифицированных с помощью MALDI-TOF в обработанном N-гликозидазой F образце (например, комплексных, гибридных структур и структур с высоким содержанием маннозы соответственно).
Антигенсвязывающий белок, предлагаемый в изобретении, получают методами рекомбинации. Таким образом, один из объектов настоящего изобретения относится к нуклеиновой кислоте, которая кодирует антигенсвязывающий белок, предлагаемый в изобретении, а другой объект относится к клетке, содержащей указанную нуклеиновую кислоту, которая кодирует антигенсвязывающий белок, предлагаемый в изобретении. Методы рекомбинантного получения хорошо известны в данной области, и они включают осуществление экспрессии белка в прокариотических и эукариотических клетках и последующее выделение антигенсвязывающего белка и, как правило, очистку до достижения фармацевтически приемлемой степени чистоты. Для осуществления экспрессии указанных выше антител в клетке-хозяине нуклеиновые кислоты, кодирующие соответствующие модифицированные легкие и тяжелые цепи, встраивают в экспрессионные векторы с помощью стандартных методов. Экспрессию осуществляют в соответствующих прокариотических или эукариотических клетках-хозяевах, таких как СНО-клетки, NS0-клетки, SР2/0-клетки, НЕК-293-клетки, COS-клетки, PER. С6-клетки, клетки дрожжей или клетки E.coli, и антигенсвязывающий белок выделяют из клеток (из супернатанта или клеток после лизиса). Общие методы рекомбинантного получения антител хорошо известны из существующего уровня техники, и они описаны, например, в обзорных статьях Makrides S.C., Protein Expr. Purif. 17, 1999, cc.183-202; Geisse S. и др., Protein Expr. Purif. 8, 1996, cc.271-282; Kaufman R.J., Mol. Biotechnol. 16, 2000, cc.151-161; Werner R.G., Drug Res. 48, 1998, cc.870-880.
Биспецифические антигенсвязывающие белки, предлагаемые в изобретении, можно отделять от культуральной среды с помощью общепринятых методов очистки иммуноглобулинов, таких, например, как, хроматография на белок А-сефарозе, хроматография на гидроксилапатите, гель-электрофорез, диализ или аффинная хроматография. ДНК и РНК, которые кодируют моноклональные антитела, можно легко выделять и секвенировать с помощью общепринятых методов. Клетки гибридом могут служить источником таких ДНК и РНК. После выделения ДНК можно встраивать в экспрессионные векторы, которыми затем трансфектируют клетки-хозяева, такие как НЕК293-клетки, СНО-клетки или клетки миеломы, которые в ином случае не могут продуцировать белок иммуноглобулина, для обеспечения синтеза рекомбинантных моноклональных антител в клетках-хозяевах.
Варианты (или мутанты) аминокислотной последовательности биспецифического антигенсвязывающего белка создают путем внесения соответствующих нуклеотидных изменений в ДНК антигенсвязывающего белка или с помощью нуклеотидного синтеза. Однако такие модификации можно осуществлять лишь в очень ограниченном масштабе, например, как указано выше. Например, модификации не должны приводить к изменению указанных выше характеристик антитела, таких как изотип IgG и способность связываться с антигеном, но они могут повышать выход рекомбинантного продукта, стабильность белка или облегчать процесс очистки.
В контексте настоящего описания понятие «клетка-хозяин» относится к клеточной системе любого типа, которую можно сконструировать так, чтобы она продуцировала антитела, предлагаемые в настоящем изобретении. В одном из вариантов осуществления изобретения в качестве клеток-хозяев применяют НЕК293-клетки и СНО-клетки. В контексте настоящего описания понятия «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все определения, в которые входят эти понятия, включают потомство. Так, выражения «трансформанты» и «трансформированные клетки» включают, прежде всего первичные рассматриваемые клетки, а также культуры, выведенные из них, независимо от количества переносов. Следует также иметь в виду, что все потомство может не быть строго идентичным касательно содержания ДНК вследствие случайных или неумышленных мутаций. Эти понятия включают варианты потомства, которые обладают такой же функцией или биологической активностью, что и отобранная путем скрининга исходная трансформированная клетка.
Экспрессия в NS0-клетках описана, например, у Barnes L.M. и др., Cytotechnology 32, 2000, cc.109-123; Barnes L.M. и др., Biotech. Bioeng. 73, 2001, cc.261-270. Кратковременная экспрессия описана, например, у Durocher Y. и др., Nucl. Acids. Res. 30, 2002, с.Е9. Клонирование вариабельных доменов описано у Orlandi R. и др., Proc. Natl. Acad. Sci. USA 86, 1989, cc.3833-3837; Carter P. и др., Ргос.Natl. Acad. Sci. USA 89, 1992, cc.4285-4289; и Norderhaug L. и др., J. Immunol. Methods 204, 1997, cc.77-87. Предпочтительная система для кратковременной экспрессии (НЕК293) описана Schlaeger E.-J. и Christensen К. в Cytotechnology 30, 1999, cc.71-83 и у Schlaeger E.-J., J. Immunol. Methods 194, 1996, cc.191-199.
Контролирующие последовательности, которые можно применять для прокариотических организмов, представляют собой, например, промоторную последовательность, необязательно операторную последовательность и сайт связывания рибосом. Известно, что для эукариотических клеток применяют промоторы, энхансеры и сигналы полиаденилирования.
Нуклеиновая кислота «функционально связана», когда она находится в функциональной связи с другой нуклеотидной последовательностью. Например, ДНК предпоследовательности или лидерной секреторной последовательности функционально связана с ДНК полипептида, если при ее экспрессии образуется предбелок, который участвует в секреции полипептида; промотор или энхансер функционально связан с кодирующей последовательностью, если он оказывает воздействие на транскрипцию последовательности; или сайт связывания рибосом функционально связан с кодирующей последовательностью, если он расположен так, что облегчает трансляцию. Как правило, понятие «функционально связаны» означает, что последовательности ДНК, будучи связаны, являются смежными, а в случае лидерной секреторной последовательности являются смежными и находятся в рамке считывания. Однако для энхансеров не является необходимым, чтобы они были смежными. Связывание осуществляют путем лигирования в соответствующих сайтах рестрикции. Если такие сайты не существуют, то в соответствии с принятой практикой применяют синтетические олигонуклеотидные адаптеры или линкеры.
Очистку антител для удаления других клеточных компонентов или других примесей, например других клеточных нуклеиновых кислот или белков, осуществляют с помощью стандартных методов, включая обработку щелочью/ДСН, CsCl-бэндинг, хроматографию на колонках, электрофорез в агарозном геле и другие методы, хорошо известные в данной области (см. в Current Protocols in Molecular Biology, под ред. Ausubel F. и др., изд-во Greene Publishing and Wiley Interscience, New York, 1987). Для очистки белков разработаны и нашли широкое распространение различные методы, такие как аффинная хроматография с использованием белков микроорганизмов (например, аффинная хроматография на белке А или белке G), ионообменная хроматография (например, катионообменная (с использованием карбоксиметиловых смол), анионообменная (с использованием аминоэтиловых смол) хроматография и хроматография со смешанной формой разделения), тиофильная адсорбция (например, с использованием бета-меркаптоэтанола и других SH-лигандов), хроматография на основе гидрофобного взаимодействия или адсорбционная хроматография ароматических соединений (например, с использованием фенил-сефарозы, аза-аренофильных смол или мета-аминофенилбороновой кислоты), металлхелатирующая аффинная хроматография (например, с использованием материала, обладающего аффинностью к Ni(II) и Cu(II)), гель-фильтрация и электрофоретические методы (такие как гель-электрофорез, капиллярный электрофорез) (Vijayalakshmi M.A., Appl. Biochem. Biotech.75, 1998, cc.93-102).
Одним из объектов изобретения является фармацевтическая композиция, которая содержит антигенсвязывающий белок, предлагаемый в изобретении. Другим объектом изобретения является применение антигенсвязывающего белка, предлагаемого в изобретении, для приготовления фармацевтической композиции. Следующим объектом изобретения является способ приготовления фармацевтической композиции, которая содержит антигенсвязывающий белок, предлагаемый в изобретении. Еще одним объектом настоящего изобретения является композиция, например фармацевтическая композиция, которая содержит антигенсвязывающий белок, предлагаемый в настоящем изобретении, включенный в состав препаративной формы в сочетании с фармацевтически приемлемым носителем.
Другим вариантом осуществления изобретения является фармацевтическая композиция, предназначенная для лечения рака.
Другим вариантом осуществления изобретения является биспецифический антигенсвязывающий белок, предлагаемый в настоящем изобретении, предназначенный для лечения рака.
Следующим объектом изобретения является применение антигенсвязывающего белка, предлагаемого в изобретении, для приготовления лекарственного средства, предназначенного для лечения рака.
Следующим объектом изобретения является способ лечения пациента, страдающего раком, который заключается в том, что вводят антигенсвязывающий белок, предлагаемый в изобретении, пациенту, нуждающемуся в таком лечении.
В контексте настоящего описания понятие «фармацевтический носитель» включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, придающие изотоничность и замедляющие абсорбцию агенты и т.п., которые являются физиологически совместимыми. Предпочтительно носитель можно применять для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии).
Композицию, предлагаемую в настоящем изобретении, можно вводить с помощью различных методов, известных в данной области. Как должно быть очевидно специалисту в данной области, путь и/или форму введения можно варьировать в зависимости от требуемых результатов. Для введения соединения, предлагаемого в изобретении, с помощью определенных путей введения может оказаться необходимым наносить на соединение покрытие из материала, препятствующего его инактивации, или осуществлять введение соединения совместно с таким материалом. Например, соединение можно вводить индивидууму в соответствующем носителе, например в липосомах или в разбавителе. К фармацевтически приемлемым разбавителям относятся физиологический раствор и водные забуферивающие растворы. К фармацевтическим носителям относятся стерильные водные растворы или дисперсии и стерильные порошки для приготовления стерильных инъекционных растворов или дисперсий непосредственно перед введением. Применение таких сред и агентов для обладающих фармацевтической активностью субстанций известно в данной области.
В контексте настоящего описания понятия «парентеральное введение» и «введение парентеральным путем» означают пути введения, отличные от энтерального введения и местного применения, как правило, они относятся к введению путем инъекции и включают (но, не ограничиваясь только ими) внутривенную, внутримышечную, внутриартериальную, подоболочечную, внутрикапсульную, внутриглазную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и интрастернальную инъекцию и инфузию.
В контексте настоящего описания понятие «рак» относится к пролиферативным заболеваниям, таким как лимфомы, лимфолейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), альвеолярно-клеточный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркома мягких тканей, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечной лоханки, мезотелиома, печеночно-клеточный рак, билиарный рак, неоплазмы центральной нервной системы (ЦНС), опухоли позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимоны, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза и саркома Юинга, включая рефракторные варианты любого из указанных выше видов рака и комбинации одного или нескольких видов рака.
Указанные композиции могут содержать также адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Отсутствие микроорганизмов можно обеспечивать как с помощью процедур стерилизации (см. выше), так и путем включения различных антибактериальных и противогрибковых средств, таких, например, как парабен, хлорбутанол, фенол, сорбиновая кислота и т.п. Может оказаться целесообразным включать в композиции агенты для придания изотоничности, такие как сахара, хлорид натрия и т.п. Кроме того, можно пролонгировать абсорбцию инъекционной фармацевтической формы путем включения веществ, которые замедляют абсорбцию, таких как моностеарат алюминия и желатин.
Вне зависимости от выбранного пути введения соединения, предлагаемые в настоящем изобретении, которые можно применять в пригодной гидратированной форме, и/или фармацевтические композиции, предлагаемые в настоящем изобретении, приготавливают в виде фармацевтически приемлемых форм лекарственного средства с помощью общепринятых методов, известных специалистам в данной области.
Фактические уровни доз действующих веществ в фармацевтических композициях, предлагаемых в настоящем изобретении, можно варьировать для получения количества действующего вещества, которое является эффективным для достижения требуемого терапевтического ответа у конкретного пациента при использовании конкретной композиции и пути введения, но не является токсичным для пациента. Выбранный уровень доз должен зависеть от различных фармакокинетических факторов, включая активность конкретных применяемых композиций, предлагаемых в настоящем изобретении, путь введения, время введения, скорость экскреции конкретного применяемого соединения, продолжительность лечения, другие лекарственные средства, соединения и/или материалы, которые используют в сочетании с конкретными применяемыми композициями, возраст, пол, вес, состояние, общее состояние здоровья и предшествующая история болезни пациента, подлежащего лечению, и другие подобные факторы, хорошо известные в области медицины.
Композиция должна быть стерильной и текучей в той степени, чтобы композицию можно было вводить с помощью шприца. Помимо воды предпочтительным носителем является изотонический забуференный физиологический раствор.
Соответствующую текучесть можно поддерживать, например, путем использования покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и путем применения поверхностно-активных веществ. Во многих случаях предпочтительно включать в композицию агенты для придания изотоничности, например сахара, многоатомные спирты, такие как маннит или сорбит, и хлорид натрия.
В контексте настоящего описания понятия «клетка», «клеточная линия» и «клеточная культура» используются взаимозаменяемо, и все определения, в которые входят эти понятия, включают потомство. Так, выражения «трансформанты» и «трансформированные клетки» включают прежде всего первичные рассматриваемые клетки, а также культуры, выведенные из них, независимо от количества переносов. Следует также иметь в виду, что все потомство может не быть строго идентичным касательно содержания ДНК вследствие случайных или неумышленных мутаций. Эти понятия включают варианты потомства, которые обладают такой же функцией или биологической активностью, что и отобранная путем скрининга исходная трансформированная клетка. В тех случаях, когда следует применять другие обозначения, это должно быть очевидно из контекста.
В контексте настоящего описания понятие «трансформация» относится к процессу переноса векторов/нуклеиновой кислоты в клетку-хозяина. Если в качестве клеток-хозяев применяют клетки, оболочки которых не представляют собой труднопреодолимые барьеры, то трансфекцию осуществляют, например, методом, основанным на осаждении фосфатом кальция, который описан у Graham и Van der Eh, Virology 52, 1978, с.546 и далее. Однако можно применять также и другие методы интродукции ДНК в клетки, такие как инъекция в ядра или слияние протопластов. Если используют прокариотические клетки или клетки, имеющие значительные клеточные оболочки, то в качестве метода трансфекции можно применять обработку кальцием с использованием хлорида кальция, описанную у Cohen F.N. и др., PNAS 69, 1972, с.2110-2114.
В контексте настоящего описания понятие «экспрессия» относится к процессу, посредством которого осуществляется транскрипция нуклеиновой кислоты в мРНК, и/или к процессу, посредством которого транскрибированная мРНК (которую называют также транскриптом) впоследствии транслируется с образованием пептидов, полипептидов или белков. Транскрипты и кодируемые полипептиды в целом называют генным продуктом. Если полинуклеотид выводят из геномной ДНК, то экспрессия в эукариотической клетке может включать сплайсинг мРНК.
«Вектор» представляет собой молекулу нуклеиновой кислоты, в частности самореплицирующуюся, которая переносит встроенную молекулу нуклеиновой кислоты в клетки-хозяева и/или между клетками-хозяевами. Понятие включает векторы, функция которых состоит прежде всего во встраивании ДНК или РНК в клетку (например, хромосомная интеграция), в репликационные векторы, функция которых прежде всего состоит в репликации ДНК или РНК, и в экспрессионные векторы, функция которых состоит прежде всего в транскрипции и/или трансляции ДНК или РНК. Под понятие подпадают также векторы, которые обладают несколькими указанными функциями.
«Экспрессионный вектор» представляет собой полинуклеотид, который при интродукции в соответствующую клетку-хозяина может транскрибироваться и транслироваться в полипептид. Понятие «экспрессионная система» относится, как правило, к приемлемой клетке-хозяину, содержащей экспрессионный вектор, функцией которой может быть выход требуемого продукта экспрессии.
Следующие примеры, перечень последовательностей и чертежи даны с целью лучшего понимания настоящего изобретения, полный объем которого представлен в приведенной ниже формуле изобретения. Очевидно, что могут быть сделаны модификации в изложенных процедурах без отклонения от сути изобретения.
Описание перечня последовательностей
SEQ ID NO: 1 - последовательность модифицированной тяжелой цепи антитела к Ang-2 (<Ang-2>), слитая на С-конце с VH-CH1-доменами <Ang-2>,
SEQ ID NO: 2 - немодифицированная легкая цепь антитела <Ang-2>,
SEQ ID NO: 3 - модифицированная тяжелая цепь антитела к VEGF (<VEGF>) с заменой CH1-CL и слитая на С-конце с VH-CL-доменами <VEGF>,
SEQ ID NO: 4 - модифицированная легкая цепь антитела <VEGF> с заменой CH1-CL (VL-CH1-домены антитела <VEGF>).
На чертежах показано:
на фиг.1 - схематическое изображение структуры полноразмерного антитела без СН4-домена, которое обладает способностью специфически связываться с первым антигеном (1) с помощью двух пар тяжелых и легких цепей, содержащих расположенные в общепринятом порядке вариабельные и константные домены;
на фиг.2 - схематическое изображение двух (из четырех) возможных ошибочных спариваний, приводящих к образованию представленного в качестве примера нежелательного побочного продукта, что приводит к снижению выхода биспецифического четырехвалентного антитела, которое связывается с первым (1) антигеном и вторым (2) антигеном, и в котором отсутствует замена доменов;
на фиг.3 - схематическое изображение структуры биспецифического четырехвалентного антигенсвязывающего белка, предлагаемого в изобретении, - ошибочное спаривание нарушено в результате замены СН1- и CL-доменов в тяжелых и легких цепях антитела, которое специфически связывается со вторым антигеном;
на фиг.4 - схематическое изображение структуры приведенного в качестве примера биспецифического четырехвалентного антигенсвязывающего белка, предлагаемого в изобретении, с «выступами» и «впадинами».
Примеры
Материалы и общие методы
Общая информация, касающаяся нуклеотидных последовательностей легких и тяжелых цепей человеческого иммуноглобулина, представлена у: Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991. Аминокислоты цепей антител пронумерованы и на них сделаны ссылки согласно нумерации EU (Edelman G.M. и др., Proc. Natl. Acad. Sci. USA 63, 1969, cc.78-85; Kabat E.A. и др., Sequences of Proteins oflmmunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
Методы рекомбинантной ДНК
Для манипуляций с ДНК применяли стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии использовали согласно инструкциям производителей.
Синтез генов
Требуемые сегменты генов получали из олигонуклеотидов, созданных путем химического синтеза. Генные сегменты, которые фланкированы уникальными сайтами, распознаваемыми рестриктазами, собирали путем отжига и лигирования олигонуклеотидов, включая ПЦР-амплификацию и последующее клонирование через указанные сайты рестрикции, например KpnI/SacI или AscI/PacI в клонирующем векторе pGA4, основой которого является плазмида pPCRScript (фирма Stratagene). Последовательности ДНК субклонированных генных фрагментов подтверждали путем секвенирования ДНК. Синтез генных фрагментов осуществляли в порядке, представленном в спецификации фирмы Geneart (Регенсбург, Германия).
Анализ последовательностей ДНК и белков и обработка данных о последовательностях
Применяли пакет программ фирмы GCG (Genetics Computer Group, Мэдисон, шт. Висконсин), версия 10.2 и Infomax′s Vector NT1 Advance suite, версия 8.0 для создания, картирования, анализа, аннотирования и иллюстрации последовательностей.
Экспрессионные векторы
Для экспрессии описанных биспецифических четырехвалентных антител применяли варианты экспрессионных плазмид, предназначенных для кратковременной экспрессии (например, в клетках HEK293-EBNA или НЕК293-F), либо на основе кДНК-конструкции с использованием промотора CMV с интроном А или без него, либо на основе геномной конструкции с использованием промотора CMV.
Помимо кассеты экспрессии антитела векторы содержали:
- сайт инициации репликации, обеспечивающий репликацию указанной плазмиды в Е.coli, и
- ген β-лактамазы, который придает устойчивость в Е.coli к ампициллину.
Транскрипционная единица гена антитела состояла из следующих элементов:
- уникальный(ые) сайт(ы) рестрикции на 5′-конце,
- немедленно-ранний энхансер и промотор из человеческого цитомегаловируса,
- расположенная за ним последовательность интрона А в случае экспрессии на основе кДНК-конструкции,
- 5′-нетранслируемая область гена человеческого антитела,
- сигнальная последовательность тяжелой цепи иммуноглобулина,
- цепь человеческого биспецифического четырехвалентного антитела (дикого типа или с заменой доменов) либо в виде кДНК-конструкции, либо в виде геномной конструкции с экзон-интронной конструкцией иммуноглобулина,
- 3′-нетранслируемая область с сигнальной последовательностью полиаденилирования и
- уникальный(ые) сайт(ы) рестрикции на 3′-конце.
Слияние генов, содержащих описанные цепи антитела, как указано ниже, осуществляли с помощью ПЦР и/или синтеза генов и сборки с использованием известных методов и процедур рекомбинации путем соединения соответствующих сегментов нуклеиновых кислот, например с использованием уникальных сайтов рестрикции, в соответствующих векторах. Субклонированные нуклеотидные последовательности подтверждали секвенированием ДНК. Для осуществления кратковременных трансфекций плазмиды создавали в больших количествах посредством получения плазмид из трансформированных культур Е.coli (набор Nucleobond AX, фирма Macherey-Nagel).
Методики культивирования клеток
Применяли стандартные методики культивирования клеток, описанные в Current Protocols in Cell Biology, под ред. Bonifacino J.S., Dasso M., Harford J.B., Lippincott-Schwartz J. и Yamada K.M., изд-во John Wiley & Sons, Inc., 2000. Биспецифические четырехвалентные антитела экспрессировали путем кратковременной котрансфекции соответствующими тремя экспрессионными плазмидами выращенных в виде прикрепленных культур клеток HEK293-EBNA или выращенных в виде суспензионных культур клеток HEK29-F, как будет описано ниже.
Кратковременные трансфекции в системе HEK293-EBNA
Для экспрессии биспецифических четырехвалентных антител осуществляли кратковременную котрансфекцию тремя соответствующими экспрессионными плазмидами (например, кодирующими модифицированную тяжелую цепь, а также соответствующую легкую цепь и модифицированную легкую цепь) выращенных в виде прикрепленных культур клеток HEK293-EBNA (линия клеток почки человеческого эмбриона 293, экспрессирующая ядерный антиген вируса Эпштейна-Барра; Американская коллекция типовых культур, депонирована под номером АТСС № CRL-10852, партия 959 218), которые культивировали в среде DMEM (модифицированная по методу Дульбекко среда Игла, фирма Gibco), дополненной 10% FCS (фетальная телячья сыворотка, фирма Gibco) с ультра низким содержанием IgG (Ultra Low IgG FCS), 2 мМ L-глутамином (фирма Gibco) и 250 мкг/мл генетицина (фирма Gibco). Для трансфекции применяли реагент для трансфекции типа FuGENE™ 6 (фирма Roche Molecular Biochemicals), используя соотношение реагента FuGENE™ (мкл) и ДНК (мкг) 4:1 (диапазон от 3:1 до 6:1). Белки экспрессировали, применяя соответствующие плазмиды, с использованием плазмид, кодирующих (модифицированные и дикого типа) легкую цепь и модифицированную тяжелую цепь, в молярном соотношении 1:1:1 (эквимолярное соотношение), диапазон от 1: 1: 2 до 2:2:1 соответственно. Клетки подпитывали в день 3 L-глутамином до концентрации 4 мМ, глюкозой (фирма Sigma) и NAA (амид никотиновой кислоты) (фирма Gibco). В дни с 5 по 11 после трансфекции собирали путем центрифугирования супернатанты клеточных культур, содержащие биспецифическое четырехвалентное антитело, и хранили при -20°С. Общую информацию, касающуюся рекомбинантной экспрессии человеческих иммуноглобулинов, например, в НЕК293-клетках, см. у Meissner P. и др., Biotechnol. Bioeng. 75, 2001, cc.197-203.
Кратковременные трансфекции в системе HEK293-F
В альтернативном варианте биспецифические четырехвалентные антитела получали путем кратковременной трансфекции соответствующими плазмидами (например, кодирующими модифицированную тяжелую цепь, а также соответствующую легкую цепь и модифицированную легкую цепь), используя систему HEK293-F (фирма Invitrogen) согласно инструкции производителя. В целом, метод состоял в следующем: НЕК293-F-клетки (фирма Invitrogen), выращенные в виде суспензионной культуры либо во встряхиваемой колбе, либо в ферментере с мешалкой в бессывороточной среде для экспрессии типа FreeStyle™ 293 (фирма Invitrogen), трансфектировали смесью трех экспрессионных плазмид и 293-фектином или фектином (фирма Invitrogen). В 2-литровую встряхиваемую колбу (фирма Corning) высевали клетки HEK293-F с плотностью 1,0×106 клеток/мл в 600 мл и инкубировали при 120 об/мин, 8% СО2. Через 1 день клетки трансфектировали при плотности клеток примерно 1,5×106 клеток/мл с помощью примерно 42 мл смеси А), содержащей 20 мл среды Opti-МЕМ (фирма Invitrogen) с 600 мкг общей плазмидной ДНК (1 мкг/мл), которая кодирует модифицированную тяжелую цепь, соответствующую легкую цепь и соответствующую модифицированную легкую цепь, в эквимолярном соотношении, и смеси Б), содержащей 20 мл Opti-MEM + 1,2 мл 293-фектина или фектина (2 мкл/мл). В зависимости от поглощения глюкозы в процессе ферментации добавляли раствор глюкозы. Через 5-10 дней собирали супернатант, содержащий секретированное антитело, и либо очищали антитела непосредственно из супернатанта, либо супернатант замораживали и помещали на хранение.
Определение белка
Концентрацию белков очищенных биспецифических четырехвалентных антител и их производных определяли на основе оптической плотности (ОП) при 280 нм, используя коэффициент молярной экстинкции, рассчитанный на основе аминокислотной последовательности согласно методу, который описан у Расе и др., Protein Science, 4, 1995, cc.2411-1423.
Определение концентрации антител в супернатантах
Концентрацию биспецифических четырехвалентных антител в супернатантах клеточных культур определяли путем иммунопреципитации с белок А-агарозными гранулами (фирма Roche). 60 мкл белок А-агарозных гранул отмывали трижды в TBS-NP40 (50 мМ Трис, рН 7,5, 150 мМ NaCl, 1% Nonidet-Р40). Затем 1-15 мл супернатанта клеточной культуры наносили на белок А-агарозные гранулы, предварительно уравновешенные в TBS-NP40. После инкубации в течение 1 ч при комнатной температуре гранулы отмывали на фильтрующей колонке типа Ultrafree-MC (фирма Amicon), используя однократно 0,5 мл TBS-NP40, дважды 0,5 мл двукратного (2×) забуференного фосфатом физиологического раствора (2×ЗФР, фирма Roche) и быстро четыре раза, используя 0,5 мл 100 мМ Na-цитратного буфера, рН 5,0. Связанное антитело элюировали, добавляя 35 мкл буфера для образцов NuPAGE® LDS (фирма Invitrogen). Половину образца объединяли с восстановителем для образцов NuPAGE® или оставляли в невосстановленной форме соответственно и выдерживали в течение 10 мин при 70°С. Затем по 5-30 мкл применяли для осуществления ДСН-ПААГ с использованием 4-12% бис-Трис-гелей NuPAGE® (фирма Invitrogen) (применяя буфер MOPS для осуществлении ДСН-ПААГ в невосстанавливающих условиях и буфер MES в виде подвижного буфера с антиоксидантной добавкой NuPAGE® (фирма Invitrogen) для осуществлении ДСН-ПААГ в восстанавливающих условиях) и окрашивали кумасси бриллиантовым голубым.
Концентрацию биспецифических четырехвалентных антител в супернатантах клеточных культур оценивали количественно с помощью аффинной ЖХВР-хроматографии. В целом, метод состоял в следующем: супернатанты клеточных культур, содержащие антитела и их производные, которые связывались с белком А, вносили на колонку Applied Biosystems Poros А/20 в 200 мМ КН2РO4, 100 мМ натрий-цитратный буфер, рН 7,4 и элюировали из матрикса с помощью 200 мМ NaCl, 100 мМ лимонной кислоты, рН 2,5 с использованием системы Agilent HPLC 1100. Элюированный белок оценивали количественно с помощью УФ-абсорбции и интегрирования площадей пиков. Очищенное стандартное антитело в виде IgG1 служило в качестве стандарта.
В альтернативном варианте концентрацию биспецифических четырехвалентных антител в супернатантах клеточных культур оценивали с помощью «сэндвич»-IgG-ELISA. В целом, метод состоял в следующем: 96-луночные титрационные микропланшеты, обладающие высокой способностью связывать стрептавидин А (планшеты типа StreptaWell High Bind Strepatavidin A (фирма Roche)), сенсибилизировали из расчета 100 мкл/лунку биотинилированным античеловеческим IgG F(ab′)2<h-Fcγ>BI (фирма Dianova), применяемым в качестве иммобилизованной молекулы, в концентрации 0,1 мкг/мл в течение 1 ч при комнатной температуре или в другом варианте в течение ночи при 4°С и затем отмывали трижды, используя 200 мкл/лунку ЗФР, 0,05% Твин (ЗФРТ, фирма Sigma). Добавляли в лунки по 100 мкл/лунку серийных разведении в ЗФР (фирма Sigma) супернатантов клеточных культур, содержащих соответствующее антитело, и инкубировали в течение 1-2 ч на шейкере для титрационных микропланшетов при комнатной температуре. Лунки отмывали трижды, используя 200 мкл/лунку ЗФРТ, и выявляли связанное антитело с помощью 100 мкл F(ab′)2<hFcγ>POD (фирма Dianova) в концентрации 0,1 мкг/мл в качестве идентифицирующего антитела в течение 1-2 ч на шейкере для титрационных микропланшетов при комнатной температуре. Несвязанное идентифицирующее антитело отмывали трижды, используя 200 мкл/лунку ЗФРТ, а связанное идентифицирующее антитело выявляли, добавляя 100 мкл ABTS/лунку. Определение абсорбции осуществляли на спектрометре типа Tecan Fluor при длине волны 405 нм (длина референс-волны 492 нм).
Очистка белков
Белки очищали из профильтрованных супернатанов клеточных культур согласно стандартным протоколам. В целом, метод состоял в следующем: биспецифические четырехвалентные антитела вносили на колонку, заполненную белок А-сефарозой (фирма GE Healthcare), и отмывали ЗФР. Элюцию биспецифических четырехвалентных антител осуществляли при рН 2,8 с последующей немедленной нейтрализацией образца. Агрегированный белок отделяли от мономерных антител гель-фильтрацией (Superdex 200, фирма GE Healthcare) в ЗФР или в 20 мМ гистидине, 150 мМ NaCl, рН 6,0. Фракции мономерных антител объединяли, при необходимости концентрировали, используя, например, центрифужный концентратор типа MILLIPORE Amicon Ultra (30 MWCO (молекулярновесовой предел), замораживали и хранили при -20°С или -80°С. Часть образцов оставляли для последующего аналитического изучения белка и его аналитической характеризации, например, с помощью ДСН-ПААГ, гель-фильтрации (ГФ) или масс-спектрометрии.
ДСН-ПААГ
Применяли систему геля NuPAGE® Pre-Cast (фирма Invitrogen) согласно инструкции производителя. В частности использовали 10% или 4-12% бис-Трис Pre-Cast-гели NuPAGE®, Novex® (pH 6,4) и подвижные буферы, такие как NuPAGE® MES (гели, применяемые в восстанавливающих условиях, подвижный буфер с антиоксидантной добавкой NuPAGE®) или MOPS (гели, применяемые в невосстанавливающих условиях).
Аналитическая гель-фильтрация
В качестве гель-фильтрации (ГФ), предназначенной для определения агрегированного и олигомерного состояния биспецифических четырехвалентных антител, применяли ЖХВР-хроматографию. В целом, метод состоял в следующем: очищенные на белке А антитела вносили на колонку типа Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KН2РO4/K2НРO4, pH 7,5 в системе Agilent HPLC 1100, или на колонку Superdex 200 (фирма GE Healthcare) в 2×ЗФР в ЖХВР-системе Dionex. Количество элюированного белка определяли на основе УФ-абсорбции и интегрирования площадей пиков. В качестве стандарта применяли стандарт для гель-фильтрации фирмы BioRad (Gel Filtration Standard 151-1901).
Масс-спектрометрия
Общую дегликозилированную массу биспецифических четырехвалентных антител определяли и подтверждали с помощью масс-спектрометрии с ионизацией электроспреем (ESI-MC). В целом, метод состоял в следующем: 100 мкг очищенных антител дегликозилировали с помощью 50 ME N-гликозидазы F (PNGaseF, фирма ProZyme) в 100 мМ KН2РO4/K2НРO4, pH 7 при 37°С в течение 12-24 ч при концентрации белка вплоть до 2 мг/мл и затем обессоливали с помощью ЖХВР на колонке Sephadex G25 (фирма GE Healthcare). Массу соответствующих тяжелых и легких цепей определяли с помощью ESI-MC после дегликозилирования и восстановления. В целом, метод состоял в следующем: 50 мкг биспецифического четырехвалентного антитела в 115 мкл инкубировали с 60 мкл 1М ТСЕР и 50 мкл 8М гидрохлорида гуанидина после обессоливания. Общую массу и массу восстановленных тяжелых и легких цепей определяли с помощью ESI-MC с использованием МС-системы Q-Star Elite, снабженной источником NanoMate.
ELISA для оценки связывания с VEGF
Особенности связывания биспецифических четырехвалентных антител оценивали с помощью ELISA-анализа с использованием полноразмерного белка VEGF165-His (фирма R&D Systems). Для этой цели полистирольные прозрачные усовершенствованные титрационные микропланшеты типа Falcon сенсибилизировали в течение 2 ч при комнатной температуре или в течение ночи при 4°С с помощью 100 мкл (концентрация 2 мкг/мл) рекомбинантного человеческого VEGF 165 (фирма R&D Systems) в ЗФР. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и блокировали 200 мкл 2% БСА, 0,1% Твин 20 в течение 30 мин при комнатной температуре и затем отмывали трижды 300 мкл ЗФРТ. Добавляли в лунки из расчета 100 мкл/лунку серийные разведения очищенных биспецифических четырехвалентных антител в ЗФР (фирма Sigma) и инкубировали в течение 1 ч на шейкере для титрационных микропланшетов при комнатной температуре. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и связанное антитело выявляли, добавляя в качестве идентифицирующего антитела по 100 мкл/лунку (концентрация 0,1 мкг/мл) F(ab′) <hFcгамма> POD (фирма Immuno research) в 2% БСА, 0,1% Твин 20, в течение 1 ч на шейкере для титрационных микропланшетов при комнатной температуре. Несвязанное идентифицирующее антитело отмывали трижды, используя по 300 мкл/лунку ЗФРТ, а связанное идентифицирующее антитело выявляли, добавляя по 100 мкл ABTS/лунку. Определение абсорбции осуществляли на спектрометре типа Tecan Fluor при длине волны 405 нм (длина референс-волны 492 нм).
Оценка связывания VEGF: кинетические характеристики связывания VEGF при 37°С, определенные с помощью резонанса поверхностного плазмона (Biacore-анализа)
Для дополнительного подтверждения данных, полученных с помощью ELISA, связывание биспецифических четырехвалентных антител с VEGF количественно оценивали с помощью метода резонанса поверхностного плазмона, используя устройство типа Biacore Т100 согласно приведенному ниже протоколу и осуществляя анализ с помощью пакета программ Т100; в целом, метод состоял в следующем: биспецифические четырехвалентные антитела иммобилизовывали на СМ5-чипе посредством связывания с козьим антителом к человеческому IgG (JIR 109-005-098). Применяемое для «захвата» антитело иммобилизовывали путем аминового сочетания, используя следующую стандартную процедуру аминового сочетания: HBS-N-буфер применяли в качестве подвижного буфера, для активации использовали смесь ЭДХ (этилендихлорид)/NHS для получения плотности лиганда 700 RU (относительные единицы). Применяемое для «захвата» антитело разводили в буфере для сочетания NaAc, pH 5,0, концентрация 2 мкг/мл, и, наконец, все еще активированные карбоксильные группы блокировали путем инъекции 1М этаноламина. «Захват» биспецифических четырехвалентных антител к VEGF (антитела <VEGF>) осуществляли со скоростью потока 5 мкл/мин и в концентрации 10 нМ, используя для разведения подвижный буфер + 1 мг/мл БСА; необходимо достигать уровня «захвата» примерно 30 RU. В качестве анализируемой субстанции применяли rhVEGF (rhVEGF, фирма R&D-Systems, каталожный №293-VE). Получение кинетических характеристик связывания VEGF с биспецифическими четырехвалентными антителами <VEGF> осуществляли при 25°С или 37°С, используя ЗФР + 0,005 об.% Твин 20 в качестве подвижного буфера. Образец инъецировали со скоростью потока 50 мкл/мин, и при проведении анализа время ассоциации составляло 80 с и время диссоциации 1200 с, и rhVEGF использовали в серии концентраций от 300 до 0,29 нМ. Регенерацию поверхности чипа с иммобилизованным антителом для освобождения от «захваченного» антигена после каждого цикла с применением анализируемого вещества осуществляли с помощью 10 мМ глицина, pH 1,5 и, используя время контакта 60 с. Кинетические константы рассчитывали, используя общепринятый метод двух контролей (референс-контроль: связывание rhVEGF с иммобилизованной молекулой козьего антитела к человеческому IgG, контрольные пробы-«пустышки» для оценки проточной ячейки, в которой концентрация rhVEGF составляла «0», модель: модель связывания Ленгмюра при соотношении 1:1 (Rmax подбирали локально для связывания иммобилизованной молекулы)).
ELISA для оценки связывания Ang-2
Особенности связывания биспецифических четырехвалентных антител оценивали с помощью ELISA-анализа с использованием полноразмерного белка Ang-2-His (фирма R&D Systems). Для этой цели полистирольные прозрачные усовершенствованные титрационные микропланшеты типа Falcon сенсибилизировали в течение 2 ч при комнатной температуре или в течение ночи при 4°С с помощью 100 мкл (концентрация 2 мкг/мл) рекомбинантного человеческого Ang-2 (фирма R&D Systems, без носителя) в ЗФР. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и блокировали 200 мкл 2% БСА, 0,1% Твин 20 в течение 30 мин при комнатной температуре и затем отмывали трижды 300 мкл ЗФРТ. Добавляли в лунки из расчета 100 мкл/лунку серийные разведения очищенных биспецифических четырехвалентных антител в ЗФР (фирма Sigma) и инкубировали в течение 1 ч на шейкере для титрационных микропланшетов при комнатной температуре. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и связанное антитело выявляли, добавляя в качестве идентифицирующего антитела по 100 мкл/лунку (концентрация 0,1 мкг/мл) F(ab′)<hk>POD (фирма Biozol, каталожный №. 206005) в 2% БСА, 0,1% Твин 20, в течение 1 ч на шейкере для титрационных микропланшетов при комнатной температуре. Несвязанное идентифицирующее антитело отмывали трижды, используя по 300 мкл/лунку ЗФРТ, а связанное идентифицирующее антитело выявляли, добавляя по 100 мкл ABTS/лунку. Определение абсорбции осуществляли на спектрометре типа Tecan Fluor при длине волны 405 нм (длина референс-волны 492 нм).
BIACORE-анализ для оценки связывания Ang-2
Связывание биспецифических четырехвалентных антител с человеческим Ang-2 исследовали с помощью резонанса поверхностного плазмона, используя устройство типа BIACORE Т100 (фирма GE Healthcare Biosciences АВ, Уппсала, Швеция). В целом, метод состоял в следующем: для оценки аффинности козьи поликлональные антитела <hIgG-Fcg> иммобилизовывали на СМ5-чипе посредством аминового сочетания для презентации биспецифических четырехвалентных антител к человеческому Ang-2. Связывание оценивали в HBS-буфере (HBS-P (10 мМ HEPES, 150 мМ NaCl, 0,005% Твин 20, рН 7,4) при 25°С. Очищенный Ang-2-His (полученный от фирмы R&D Systems или полученный путем очистки при создании изобретения) добавляли в раствор в различных концентрациях. Ассоциацию оценивали путем инъекции Ang-2 в течение 3 мин; диссоциацию оценивали путем отмывки поверхности чипа HBS-буфером в течение 3 мин и значение KD определяли, используя модель связывания Ленгмюра при соотношении 1:1. Из-за гетерогенности препарата Ang-2 связывание при применении ингредиентов в соотношения 1:1 не было обнаружено; в результате проводили только относительную оценку значений K.D. Данные, полученные для отрицательного контроля (например, кривые, полученные только для буфера), вычитали из кривых, полученных для образца, для коррекции присущего системе сдвига основного уровня и для снижения шумовых сигналов. Применяли программу Biacore Т 100 Evaluation, версия 1.1.1 для анализа сенсограмм и для расчета данных, касающихся аффинности. В альтернативном варианте Ang-2 можно иммобилизовывать с уровнем «захвата» 2000-1700 RU посредством антитела, несущего в качестве метки 5 молекул гистидина (пентаHis-Ат, без БСА, фирма Qiagen, №34660), иммобилизованного на СМ5-чипе посредством аминового сочетания (без БСА) (см. ниже).
ELISA, позволяющий выявлять образование мостиковой связи типа Ang-2-VEGF
Особенности связывания биспецифических четырехвалентных антител оценивали с помощью ELISA-анализа с использованием иммобилизованного полноразмерного белка VEGF165-His (фирма R&D Systems) и человеческого белка Ang-2-His (фирма R&D Systems) для выявления связывания биспецифического антитела. Только биспецифическое четырехвалентное антитело к VEGF-Ang-2 (<VEGF-Ang-2>) обладало способностью связываться одновременно с VEGF и Ang-2 и связывать «мостиком» два антигена, в то время как моноспецифические «стандартные» антитела типа IgG1 не обладали способностью связываться одновременно с VEGF и Ang-2.
Для этой цели полистирольные прозрачные усовершенствованные титрационные микропланшеты типа Falcon сенсибилизировали в течение 2 ч при комнатной температуре или в течение ночи при 4°С с помощью 100 мкл (концентрация 2 мкг/мл) рекомбинантного человеческого VEGF 165 (фирма R&D Systems) в ЗФР. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и блокировали 200 мкл 2% БСА, 0,1% Твин 20 в течение 30 мин при комнатной температуре и затем отмывали трижды 300 мкл ЗФРТ. Добавляли в лунки из расчета 100 мкл/лунку серийные разведения очищенных биспецифических четырехвалентных антител в ЗФР (фирма Sigma) и инкубировали в течение 1 ч на шейкере для титрационных микропланшетов при комнатной температуре. Лунки отмывали трижды 300 мкл ЗФРТ (0,2% Твин 20) и связанное антитело выявляли, добавляя по 100 мкл/лунку (концентрация 0,5 мкг/мл) человеческого Ang-2-His (фирма R&D Systems) в ЗФР. Лунки отмывали трижды, используя 300 мкл ЗФРТ (0,2% Твин 20), а связанный Ang-2 выявляли, используя 100 мкл (0,5 мкг/мл) антитела <Ang-2>mIgG1-биотин (ВАМ0981, фирма R&D Systems), в течение 1 ч при комнатной температуре. Несвязанное идентифицирующее антитело отмывали трижды, используя 300 мкл ЗФРТ (0,2% Твин 20), и связанное антитело выявляли, добавляя в течение 1 ч при комнатной температуре 100 мкл разведенного в соотношении 1:2000 конъюгата стрептавидин-POD (фирма Roche Diagnostics GmbH, каталожный №. No. 11089153), который разводили в соотношении 1:4 блокирующим буфером. Несвязанный конъюгат стрептавидин-POD отмывали 3-6 раз, используя 300 мкл ЗФРТ (0,2% Твин 20), а связанный конъюгат стрептавидин-POD выявляли, добавляя 100 мкл ABTS/лунку. Определение абсорбции осуществляли на спектрометре Tecan Fluor при длине волны 405 нм (длина референс-волны 492 нм).
Демонстрация одновременного связывания биспецифического четырехвалентного антитела <VEGF-Ang-2> с VEGF-A и Ang-2 с помощью Biacore-анализа
Для дополнительного подтверждения данных, полученных с помощью ELISA, позволяющего выявлять образование мостиковой связи, осуществляли другой анализ с использованием технологии резонанса поверхностного плазмона и устройства типа Biacore T100 для доказательства одновременного связывания с VEGF и Ang-2 согласно приведенному ниже протоколу, и при этом данные анализировали с помощью пакета программ T100 (T100 Control (программа T100 для контроля), версия 2.01, T100 Evaluation (программа T100 для оценки), версия 2.01, T100 Kinetics Summary (программа T100 для обобщения кинетических характеристик), версия 1.01); в целом метод состоял в следующем: Ang-2 иммобилизовывали с уровнем «захвата» 2000-1700 RU в применяемом в качестве подвижного буфера ЗФР, 0,005 об.% Твин 20, через пентаHis-антитело (пентаHis-Ат, без БСА, фирма Qiagen, №34660), которое иммобилизовывали на СМ5-чипе путем аминового сочетания (без БСА). При осуществлении сочетания HBS-N-буфер применяли в качестве подвижного буфера, для активации использовали смесь ЭДХ/NHS. Применяемое для «захвата» пентаHis-Ат, без БСА разводили в буфере для сочетания NaAc, pH 4,5, концентрация 30 мкг/мл, и, наконец, все еще активированные карбоксильные группы блокировали путем инъекции 1М этаноламина; опыт осуществляли при плотности лигандов 5000 и 17000 RU. Ang-2 в концентрации 500 нМ, разведенный в подвижном буфере + 1 мг/мл БСА, «захватывался» пентаHis-Ат при скорости потока 5 мкл/мин. Затем для демонстрации связывания биспецифического антитела с Ang-2 и с VEGF осуществляли инкубацию с rhVEGF. Затем связывание биспецифического четырехвалентного антитела <Ang-2-VEGF> с Ang-2 и с VEGF определяли путем инкубации с rhVEGF и выявления образования «сэндвич»-комплекса. Для этого биспецифическое четырехвалентное антитело <VEGF-Ang-2> связывали с Ang-2 при скорости потока 50 мкл/мин и в концентрации 100 нМ, разведенным в подвижном буфере + 1 мг/мл БСА, и наличие одновременного связывания выявляли путем инкубации с VEGF (rhVEGF, фирма R&D-Systems, каталожный №293-VE) в ЗФР + подвижный буфер, включающий 0,005 об.% Твин-20, со скоростью потока 50 мкл/мин и при применении VEGF в концентрации 150нМ. При проведении анализа время ассоциации составляло 120 с, время диссоциации 1200 с. Регенерацию осуществляли после каждого цикла при скорости потока 50 мкл/мин с использованием 2×10 мМ глицинового буфера, pH 2,0 и при времени контакта 60 с. Сенсограммы корректировали, используя общепринятое применение двух контролей (референс-контроль: связывание биспецифического антитела и rhVEGF с иммобилизованной молекулой пентаHis-Ат). В качестве контрольных проб-«пустышек» для каждого Ат служили варианты, в которых концентрация rhVEGF составляла «0».
Создание клеточной линии HEK293-Tie2
Для определения воздействия биспецифических четырехвалентных антител <Ang-2-VEGF> на стимулируемое Ang-2 фосфорилирование белка Tie2 и связывание Ang-2 с Tie2 на поверхности клеток создавали рекомбинантную клеточную линию HEK293-Tie. В целом, метод состоял в следующем: плазмидой, основой которой является pcDNA3 (RB22-pcDNA3 Topo hTie2), кодирующей полноразмерный человеческий Tie2 под контролем промотора CMV и маркер устойчивости к неомицину, трансфектировали с использованием Fugene (фирма Roche Applied Science) в качестве реагента для трансфекции клетки линии НЕК293 (АТСС) и отбирали устойчивые клетки в среде DMEM, дополненной 10% FCS, 500 мкг/мл G418. Выделяли индивидуальные клоны с помощью цилиндров для клонирования и затем анализировали в отношении экспрессии Tie2 с помощью FACS. Клон 22 был идентифицирован в качестве клона, отличающегося высокой и стабильной экспрессией Tie2 даже в отсутствие G418 (клон 22 HEK293-Tie2). Затем клон 22 HEK293-Tie2 использовали для осуществления клеточных анализов, таких как: анализ индуцируемого Ang-2 фосфорилирования Tie2 и клеточный анализ связывания лиганда Ang-2.
Анализ индуцируемого Ang-2 фосфорилирования Tie2
Ингибирование биспецифическими четырехвалентными антителами <Ang-2-VEGF> индуцируемого Ang-2 фосфорилирования Tie2 оценивали количественно согласно описанному ниже принципу анализа. Клон 22 HEK293-Tie2 стимулировали Ang-2 в течение 5 мин в присутствии антитела к Ang-2 или без антитела и количественно определяли P-Tie2 с помощью «сэндвич»-ELISA. В целом, метод состоял в следующем: вносили 2×105 клеток клона 22 HEK293-Tie2 и выращивали в течение ночи в сенсибилизированном поли-D-лизином 96-луночном титрационном микропланшете в 100 мкл DMEM, 10% FCS, 500 мкг/мл генетицина. На следующий день в титрационном микропланшете создавали титрационный ряд биспецифических четырехвалентных антител <Ang-2-VEGF> (4-кратная концентрация, конечный объем 75 мкл/лунку, с дублированием) и смешивали с 75 мкл разведения Ang-2 (фирма R&D systems, №623-AN) (3,2 мкг/ мл в качестве раствора с 4-кратной концентрацией). Антитела и Ang-2 предварительно инкубировали в течение 15 мин при комнатной температуре. Добавляли 100 мкл смеси к клеткам клона 22 HEK293-Tie2 (которые предварительно инкубировали в течение 5 мин с 1 мМ NaV304, фирма Sigma, №86508) и инкубировали в течение 5 мин при 37°С. Затем клетки отмывали, используя по 200 мкл на лунку охлажденной на льду смеси ЗФР + 1 мМ NaV3O4, и лизировали, добавляя на льду в каждую лунку по 120 мкл буфера для лизиса (20 мМ Трис, рН 8,0, 137 мМ NaCl, 1% NP-40, 10% глицерина, 2 мМ ЭДТК, 1 мМ NaV3O4, 1 мМ ФМСФ (фенилметилсульфонилфторид) и 10 мкг/мл апротинина). Клетки лизировали в течение 30 мин при 4°С на шейкере для титрационных микропланшетов и 100 мкл лизата переносили непосредственно в титрационный микропланшет для осуществления p-Tie2-ELISA (фирма R&D Systems, R&D № DY990) без предварительного центрифугирования и без определения общего белка. Количество P-Tie2 определяли согласно инструкциям производителя и определяли значения IC50 для ингибирования с использованием XLfit14-анализа, представляющего собой дополнительный программный модуль для Excel (один сайт дозовой зависимости, модель 205). Значения IC50 могут являться сопоставимыми в рамках одного эксперимента, но могут варьироваться от эксперимента к эксперименту.
Анализ индуцируемой VEGF пролиферации HUVEC
Анализ индуцируемой VEGF пролиферации HUVEC (эндотелиальные клетки пупочной вены человека, фирма Promocell, № С-12200) выбирали для оценки функции в клетках биспецифических четырехвалентных антител <Ang-2-VEGF>. В целом, метод состоял в следующем: по 5000 HUVEC-клеток (полученных в результате небольшого количества пересевов, ≤5 пересевов) на 96-луночный планшет инкубировали в 100 мкл минимальной питательной среды (базальная среда 2 для эндотелиальных клеток, ЕВМ-2, фирма Promocell, № С-22211, 0,5% FCS, пенициллин/стрептомицин) в сенсибилизированном коллагеном I (BD Biocoat Collagen I) 96-луночном титрационном микропланшете (фирма BD, №354407/35640) в течение ночи. Биспецифическое четырехвалентное антитело <Ang-2-VEGF> в различных концентрациях смешивали с rhVEGF (конечная концентрация 30 нг/мл, фирма BD, №354107) и предварительно инкубировали в течение 15 мин при комнатной температуре. Затем смесь добавляли к клеткам HUVEC и их инкубировали в течение 72 ч при 37°С, 5% СО2. В день анализа планшет уравновешивали до комнатной температуры в течение 30 мин и жизнеспособность/пролиферацию клеток определяли, используя набор для люминесцентного анализа жизнеспособности клеток CellTiter-Glo согласно руководству (фирма Promega, № G7571/2/3). Люминесценцию определяли с помощью спектрофотометра.
Пример 1
Получение, экспрессия, очистка и характеризация биспецифического четырехвалентного антигенсвязываюшего белка, обладающего способностью распознавать Ang-2 и VEGF-A
В первом примере описано создание биспецифического четырехвалентного антигенсвязываюшего белка, который распознает Ang-2 и VEGF-A, путем слияния посредством (G4S)4-коннектора слияния доменов VH-CH1 антитела, распознающего Ang-2, с С-концом тяжелой цепи антитела, которое распознает Ang-2 (SEQ ID NO: 1); и путем слияния посредством (G4S)4-коннектора слияния доменов VH-CL антитела, распознающего VEGF-A, с С-концом тяжелой цепи антитела, распознающего VEGF, которая несет замену CH1-CL (SEQ ID NO: 3). Для индукции гетеродимеризации двух соответствующих тяжелых цепей последовательность, представленная в SEQ ID NO: 1, содержит, например, имеющую «выпуклость» последовательность (мутация T366W), а последовательность, представленная в SEQ ID NO: 2, содержит, например, имеющие «впадины» последовательности, обусловленные мутациями T366S, L368A и Y407V, а также два интродуцированных остатка цистеина S354C/Y349′C соответственно, что позволяет образовывать стабилизирующий дисульфидный мостик при гетеродимеризации. Для получения указанного биспецифического четырехвалентного антигенсвязывающего белка, предлагаемого в изобретении, эти конструкции тяжелых цепей экспрессировали совместно с плазмидами, которые кодируют соответствующую легкую цепь антитела к Ang-2 (SEQ ID NO: 2) и слияние доменов VL-CH1 антитела, распознающего VEGF-A (SEQ ID NO: 4). Общая схема соответствующего биспецифического четырехвалентного антигенсвязывающего белка, несущего модификации, полученные с помощью технологии «knobs-into-holes», представлена на фиг.4.
Создание биспецифического четырехвалентного антигенсвязывающего белка осуществляли с использованием описанных в разделе «Общие методы» классических методов молекулярной биологии и его кратковременно экспрессировали в НЕК293Р-клетках согласно описанному выше методу. Затем его очищали из супернатанта с помощью комбинации методов аффинной хроматографии на белке А и гель-фильтрации. Полученный продукт характеризовали с целью его идентификации с помощью масс-спектрометрии и для определения его аналитических характеристик, таких как степень чистоты (с помощью ДСН-ПААГ), а также для оценки содержания мономеров и стабильности.
Эти данные продемонстрировали, что биспецифический четырехвалентный антигенсвязывающий белок можно получать с высоким выходом и он является стабильным.
Затем оценивали связывание с Ang-2 и VEGF-A, а также одновременное связывание с помощью ELISA- и Biacore-анализов, описанных выше, и функциональные свойства, такие как ингибирование фосфорилирования Tie2 и ингибирование индуцируемой VEGF пролиферации HUVEC, при этом установлено, что созданное биспецифическое четырехвалентное антитело обладает способностью связываться с Ang-2 и VEGF-A и блокировать одновременно их активность.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ БЕЛКИ | 2010 |
|
RU2573914C2 |
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2780629C1 |
| СПОСОБ ПОЛУЧЕНИЯ МУЛЬТИСПЕЦИФИЧЕСКИХ АНТИТЕЛ | 2018 |
|
RU2750721C2 |
| НОВЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ СПЕЦИФИЧЕСКИ СВЯЗЫВАТЬСЯ С CD40 И FAP | 2018 |
|
RU2766234C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2547615C2 |
| ДВУХВАЛЕНТНЫЕ БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2008 |
|
RU2587616C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2014 |
|
RU2640253C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИ-VEGF/АНТИ-ANG-2 АНТИТЕЛА | 2009 |
|
RU2542382C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С УЛУЧШЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2698969C2 |












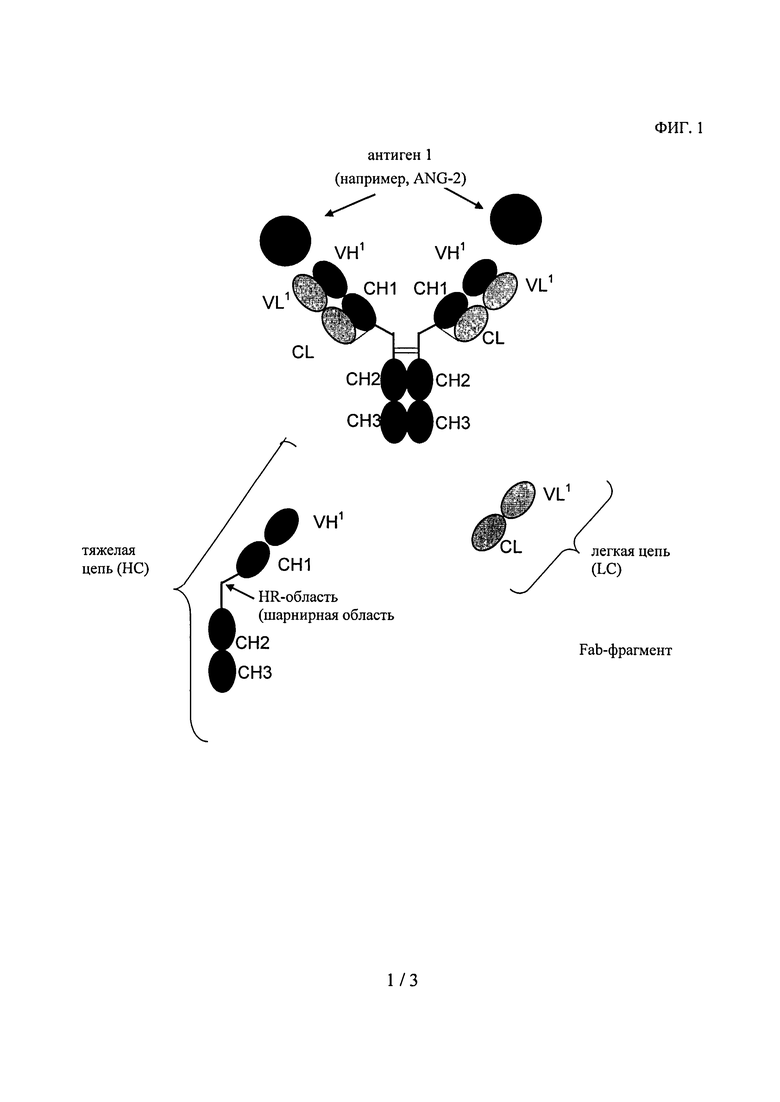


Настоящее изобретение относится к области биоинженерии и иммунологии. Предложен способ получения биспецифического антигенсвязывающего белка, включающего модифицированную тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, С-конец которой дополнительно слит с N-концом VH-CH1 доменов первого антитела через пептидный коннектор; две легкие цепи первого антитела; модифицированную тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном, в котором СН1-домен заменен на CL-домен второго антитела и С-конец дополнительно слит с N-концом VH-CL второго антитела через пептидный коннектор; и две модифицированные легкие цепи второго антитела, в которых CL-домен заменен на СН1-домен второго антитела, причем СН3-домены тяжелых цепей соприкасаются друг с другом по принципу "выступ-впадина" ("knobs-into-holes"). Также рассмотрена клетка-хозяин для получения указанного биспецифического антитела. Данное изобретение обеспечивает получение стабильных биспецифических антител с высоким выходом и может найти дальнейшее применение в разработке терапевтических тетравалентных антител. 2 н. и 2 з.п. ф-лы, 4 ил.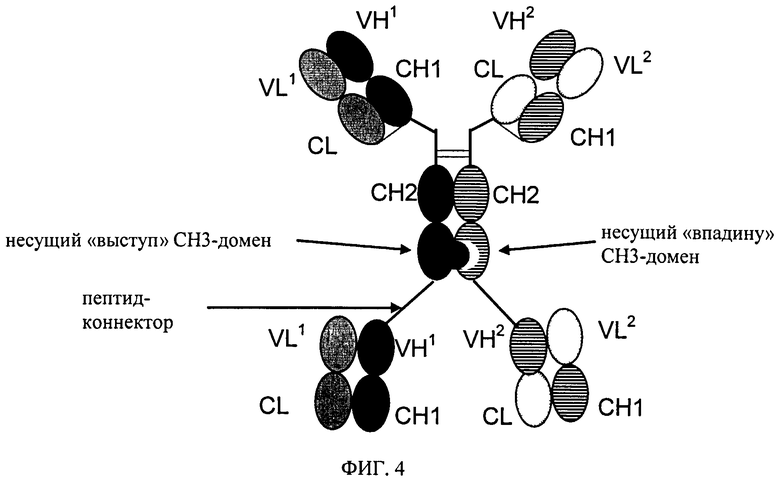
1. Способ получения биспецифического антигенсвязывающего белка, включающий следующие этапы:
- трансформацию клетки-хозяина векторами экспрессии, включающими молекулы нуклеиновой кислоты, кодирующие биспецифический антигенсвязывающий белок,
- культивирование клетки-хозяина в условиях, позволяющих синтез указанной молекулы антигенсвязывающего белка,
- выделение указанной молекулы антигенсвязывающего белка из указанной культуры,
причем антигенсвязывающий белок включает:
а) первую модифицированную тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, где
С-конец указанной тяжелой цепи дополнительно слит с VH-CH1-доменами указанного первого антитела посредством их N-концов с помощью пептидного коннектора;
б) две легкие цепи первого антитела, указанного в подпункте а);
в) вторую модифицированную тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном, в котором СН1-домен заменен на CL-домен второго антитела,
и где С-конец тяжелой цепи дополнительно слит с VH-CL-доменами указанного второго антитела посредством их N-концов с помощью пептидного коннектора; и
г) две модифицированные легкие цепи второго антитела, указанного в подпункте в),
в которых CL-домен заменен на СН1-домен второго антитела,
где СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте а), и СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте в), каждый соприкасается друг с другом на поверхности раздела, которая представляет собой исходную поверхность раздела между СН3-доменами антитела;
при этом поверхность раздела изменена для стимулирования формирования биспецифического антигенсвязывающего белка, где изменение отличается тем, что:
I) СН3-домен одной тяжелой цепи изменен
так, что на исходной поверхности раздела СН3-домена одной тяжелой цепи, которая соприкасается с исходной поверхностью раздела СН3-домена другой тяжелой цепи в биспецифическом антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет большую по объему боковую цепь, создавая тем самым «выпуклость» на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в «полость» на поверхности раздела СН3-домена другой тяжелой цепи,
и
II) СН3-домен другой тяжелой цепи изменен
так, что на исходной поверхности раздела второго СН3-домена, которая соприкасается с исходной поверхностью раздела первого СН3-домена в биспецифическом антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет меньшую по объему боковую цепь, создавая тем самым «полость» на поверхности раздела второго СН3-домена, в которую может помещаться «выпуклость» на поверхности раздела первого СН3-домена.
2. Способ по п.1, отличающийся тем, что аминокислотный остаток, который имеет большую по объему боковую цепь, выбран из группы, включающей аргинин (R), фенилаланин (F), тирозин (Y), триптофан (W), а аминокислотный остаток, который имеет меньшую по объему боковую цепь, выбран из группы, включающей аланин (А), серин (S), треонин (Т), валин (V).
3. Способ по п.1 или 2, отличающийся тем, что оба СН3-домена дополнительно изменены путем интродукции цистеина (С) в качестве аминокислоты в соответствующие положения в каждом СН3-домене, в результате чего может формироваться дисульфидный мостик между обоими СН3-доменами.
4. Клетка-хозяин для получения биспецифического антигенсвязывающего белка, где антигенсвязывающий белок включает
а) первую модифицированную тяжелую цепь первого антитела, которое специфически связывается с первым антигеном, где
С-конец указанной тяжелой цепи дополнительно слит с VH-CH1-доменами указанного первого антитела посредством их N-концов с помощью пептидного коннектора;
б) две легкие цепи первого антитела, указанного в подпункте а);
в) вторую модифицированную тяжелую цепь второго антитела, которое специфически связывается со вторым антигеном,
в котором СН1-домен заменен на CL-домен второго антитела,
и где С-конец тяжелой цепи дополнительно слит с VH-CL-доменами указанного второго антитела посредством их N-концов с помощью пептидного коннектора; и
г) две модифицированные легкие цепи второго антитела, указанного в подпункте в),
в которых CL-домен заменен на СН1-домен второго антитела,
где СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте а), и СН3-домен модифицированной тяжелой цепи антитела, указанной в подпункте в), каждый соприкасается друг с другом на поверхности раздела, которая представляет собой исходную поверхность раздела между СН3-доменами антитела;
при этом поверхность раздела изменена для стимулирования формирования биспецифического антигенсвязывающего белка, где изменение отличается тем, что:
I) СН3-домен одной тяжелой цепи изменен
так, что на исходной поверхности раздела СН3-домена одной тяжелой цепи, которая соприкасается с исходной поверхностью раздела СН3-домена другой тяжелой цепи в биспецифическом антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет большую по объему боковую цепь, создавая тем самым «выпуклость» на поверхности раздела СН3-домена одной тяжелой цепи, которая может помещаться в «полость» на поверхности раздела СН3-домена другой тяжелой цепи,
и
II) СН3-домен другой тяжелой цепи изменен
так, что на исходной поверхности раздела второго СН3-домена, которая соприкасается с исходной поверхностью раздела первого СН3-домена в биспецифическом антигенсвязывающем белке,
аминокислотный остаток заменен на аминокислотный остаток, который имеет меньшую по объему боковую цепь, создавая тем самым «полость» на поверхности раздела второго СН3-домена, в которую может помещаться «выпуклость» на поверхности раздела первого СН3-домена
и где клетка-хозяин содержит векторы экспрессии, включающие молекулы нуклеиновой кислоты, кодирующие биспецифический антигенсвязывающий белок.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ALT MARGITTA et al., "Novel tetravalent and bispecific IgG-like antibody molecules combining single-chain diabodies with the immunoglobulin γ1 Fc or CH3 region." FEBS letters, 1999, 454(1-2): 90-94 | |||
| COLOMA M | |||
| JOSEFINA, MORRISON SHERIE L., "Design and | |||
Авторы
Даты
2016-12-10—Публикация
2010-06-14—Подача