Область техники, к которой относится изобретение
Настоящее изобретение относится к новым биспецифическим антигенсвязывающим молекулам, содержащим (а) по меньшей мере один антигенсвязывающий домен, который обладает способностью специфически связываться с CD40, и (б) по меньшей мере один фрагмент, который обладает способностью специфически связываться с антигеном клетки-мишени. В частности, указанные биспецифические антигенсвязывающие молекулы дополнительно содержат (в) Fc-область, состоящую из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации. Изобретение относится также к способам получения указанных молекул и к способам их применения.
Предпосылки создания изобретения
Для создания эффективного адаптивного иммунного ответа требуется множество молекулярных сигналов. Первый сигнал включает связывание антигенного рецептора Т-клетки (TCR) с его когнатным антигеном, который презентируется на поверхности антигенпрезентирующих клеток (АРС). Второй сигнал обусловлен контактом костимуляторных рецепторов с соответствующими им лигандами между Т-клетками и АРС. Одним из наиболее хорошо изученных и наиболее важных из костимуляторных эффекторов является член семейства рецепторов фактора некроза опухоли (TNFR) CD40 и его лиганд CD40L (Elgueta R. и др., Immunol Rev. 229(1), 2009, сс. 152-172). Несколько членов семейства TNFR, включая CD40, функционируют после первоначальной активации Т-клеток для поддержания АРС и Т-клеточных ответов и тем самым играют решающую роль в организации и функции иммунной системы (Watts Т.Н. Annu. Rev. Immunol. 23, 2005, сс. 23-68). Комбинация различных обладающих костимуляторной активностью членов семейства TNFR обеспечивает последовательную и кратковременную регуляцию АРС и активацию и выживание Т-клеток, что приводит к повышенным иммунным ответам с сохранением при этом жесткого контроля функции АРС и Т-клеток. В зависимости от болезненного состояния стимуляция, обусловленная обладающими костимуляторной активностью членами семейства TNF, может обострять или облегчать заболевания. Активация или блокада костимуляторов из семейства TNFR оказалась перспективной при некоторых терапевтических применениях в нескольких областях, включая рак, инфекционное заболевание, трансплантацию и аутоиммунитет.
Среди нескольких костимуляторных молекул член семейства TNFR CD40 играет ключевую роль в запуске иммунных ответов путем индукции созревания, выживаемости, презентации антигена, производства цитокинов и экспрессии костимуляторных молекул АРС, которые затем управляют антигенспецифическими Т-клеточными ответами и активацией NK-клеток посредством провоспалительных цитокинов. CD40 регулирует иммунные ответы против инфекций, опухолей и аутоантигенов, и его экспрессия продемонстрирована на поверхности АРС, таких как В-клетки, дендритные клетки (DC), моноциты и макрофаги, а также тромбоциты и клетки негематопоэтического происхождения, такие как миофибробласты, фибробласты, эпителиальные и эндотелиальные клетки (Elgueta R. и др., Immunol Rev. 229(1), 2009, сс. 152-172). Лиганд для CD40 CD40L экспрессируется на активированных CD4+ хелперных Т-клетках, тромбоцитах, моноцитах, естественных клетках-киллерах, тучных клетках и базофилах (Carbone Е. и др., J Exp Med. 185(12), 1997, сс. 2053-2060 или Elgueta R. и др., Immunol Rev. 229(1), 2009, сс. 152-172). Экспрессия CD40 и CD40L подвергается сильной повышающей регуляции в ответ на различные иммунные стимуляторные сигналы, и взаимодействие CD40 CD40L между АРС и CD4+ Т-клетками вносит вклад в повышение активации АРС и антигенспецифических ответов CD8+ Т-клеток (Bevan M.J., Nat Rev Immunol. 4(8), 2014, сс. 595-602). Сходные ответы иммунных стимуляторов обнаружены при использовании агонистических антител к CD40 (Vonderheide R.H. и Glennie M.J., Clin Cancer Res. 19(5), 2013, сс. 1035-1043).
Взаимодействие трансмембранного рецептора типа I CD40 с его встречающимся в естественных условиях лигандом CD40L, трансмембранным белком типа II или агонистическими антителами усиливает кластеризацию CD40 и индуцирует рекрутмент адаптерных белков к цитоплазматическому домену рецептора. Рекрутмент указанных адаптерных белков, известных как ассоциированные с TNF-рецептором факторы (TRAF), приводит к синергетической активации митоген-активируемых протеинкиназ (MAPK), фосфоинозитид-3-киназы (PI3K), а также канонических и неканонических путей передачи сигналов ядерного фактора кВ (NFκB) (Elgueta R. и др., Immunol Rev. 229(1), 2009, сс. 152-172). В свою очередь, это приводит к созреванию и активации АРС, которые затем повышают до максимума антигенспецифические Т-клеточные ответы. В современных исследованиях обнаружены два различных механизма действия агонистических антител к CD40, участвующих в противоопухолевом иммунитете. Помимо их косвенного механизма действия путем опосредуемого уничтожения опухолевых клеток путем активации адаптивной иммунной системы, агонистические антитела к CD40 могут индуцировать непосредственное уничтожение опухолевых клеток посредством индукции апоптоза экспрессирующих CD40 клеток солидных опухолей (Eliopoulos A.G. и др., Mol Cell Biol. 20(15), 2000, сс. 5503-5515). Непосредственное опосредуемое антителом к CD40 уничтожение опухолевых клеток может являться источником опухолевых антигенов, которые могут процессироваться и презентироваться АРС, одновременно активированными в результате вовлечения CD40 через антитела к CD40, которые затем могут индуцировать специфические для опухолевого антигена Т-клетки, предполагаемый механизм известен как эндогенная вакцинация. С учетом того, что вовлечение CD40 может поддерживать эффективный противоопухолевый иммунный ответ, агонистические антитела к CD40 с успехом применялись на различных доклинических моделях опухолей, как в качестве индивидуального агента, так и в комбинации с химиотерапией (Vonderheide R.H. и Glennie M.J., Clin Cancer Res. 19(5), 2013, сс. 1035-1043).
К настоящему времени шесть МАт к CD40 находятся на фазе I клинических исследований: Chi Lob 7/4 (агонистическое химерное МАт к CD40 IgG1-подкласса; фирма Cancer Research UK; Chowdhury F. и др., Cancer Immunol Res. 2, 2013 cc. 229-240), ADC1013 (полностью человеческое агонистическое антитело к CD40 IgG1-подкласса; фирма Alligator Bioscience и Johnson & Johnson; Mangsbo S.M. и др., Clin Cancer Res. 21(5), 1 марта 2015 г., cc. 1115-1126), APX-005 (полностью гуманизированное агонистическое МАт к CD40 IgG1-подкласса; фирма Apexigen; Bjorck Р. и др., J Immunother Cancer. 3(дополнение 2) P198), SEA-CD40 (агонистическое химерное МАт к CD40 IgG1-подкласса; фирма Seattle Genetics; Gardai S.J. и др., 106 ежегодная конференция AACR, 18-22 апреля 2015 г., реферат 2472), а также RO7009789 (полностью человеческое супер-агонистическое МАт к CD40 IgG2-подкласса), а дацетузумаб (частично агонистическое химерное МАт к CD40 IgG1-подкласса; фирма Seattle Genetics; Khubchandani S. и др., Curr Opin Investig Drugs. 10, 2009, cc. 579 587) находится на фазе II клинического исследования. Пациенты, которые могут быть включены в эти исследования, имеют солидные опухоли, классифицированные как лимфома Ходжкина (HL), диффузная крупноклеточная В-клеточная лимфома (DLBCL) или индолентная лимфома (включая фолликулярную лимфому). Для указанных агонистических антител к CD40 продемонстрированы различные виды активности от Fc-зависимой цитотоксичности в отношении опухолевых CD40+ клеток посредством комплементзависимой цитотоксичности (CMC) или антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) до активации АРС для индукции противоопухолевых Т-клеточных ответов, а также активации макрофагов для истощения опухоли и стромы опухоли. Пока не существует окончательного объяснения указанной установленной гетерогенности. Однако в современных исследованиях установлено, что указанное разнообразие механизмов действия можно объяснить, по меньшей мере частично, различиями у антител к CD40 в специфичности в отношении эпитопов, различиями в изотипе или взаимодействии Fc:FcγR. Например, вероятно, для агонистических антител к CD40 требуется in vivo перекрестное сшивание CD40, связанного с его Fab-фрагментом на клетке-мишени, с Fcγ-рецептором, связанным с его Fc-фрагментом на клетке, отличной от клетки-мишени, что описано для агонистических антител, специфических в отношении других индуцирующих апоптоз или иммуномодуляторных членов TNFR-суперсемейства (Dahan R., Cancer Cell, 29(6), 13 июня 2016 г., cc. 820-831; Li F. и Ravetch J.V. Science, 333, 2011, cc. 1030-1034; Teng M.W. и др., J. Immunol. 183, 2009, cc. 1911-1920). Предполагаемый механизм включает опосредуемую Fcγ-рецептором кластеризацию трансмембранных молекул CD40 на клетках мишенях и последующую усиленную передачу сигналов CD40 до достижения высокой эффективности in vivo.
Разработка агонистических антител к CD40 для клинических целей дала многообещающие начальные результаты. В первом клиническом исследовании СР-870,893 установлена клиническая эффективность для пациентов с запущенным раком. У 4 из 29 пациентов с запущенным раком обнаружены частичные ответы после одной внутривенной инфузии СР-870,893 (Vonderheide R.H., J Clin Oncol. 25(7), 1 марта 2007 г., сс. 876-883). У одного из указанных 4 пациентов, получившего 9 последовательных доз СР-870,893 в течение 1,5 лет, состояние полной ремиссии сохранялось на протяжении более 5 лет. Однако наиболее часто встречающимися побочными действиями СР-870,893 являются синдром высвобождения цитокинов и случаи тромбоэмболии, поэтому объединенные данные, полученные с использованием тех режимов дозирования и путей введения, которые применяли на фазе 1 клинических исследований, на более чем 140 пациентах, продемонстрировали только ограниченную клиническую эффективность, и в результате было предложено местное применение антитела (Vonderheide R.H., Glennie М., Clin Cancer Res. 19(5), 2013, сс. 1035-1043). Отсутствие ответов на индивидуальное применение агента, по-видимому, частично является следствием не нацеленных на опухоль воздействий, что связано с широким распространением экспрессии CD40, и это приводит к ограничивающей дозу токсичности (например, синдрому высвобождения цитокинов). Создание агонистического антитела к CD40, которое специфически активирует АРС, когда CD40 перекрестно сшивается со специфической для опухоли мишенью, может снижать побочные действия и снижать ограничение дозы, обеспечивая новые терапевтические возможности, которые могут создавать эффективный длительный противораковый иммунитет.
Доступные результаты доклинических и клинических испытаний продемонстрировали, что существует высокая клиническая потребность в эффективных агонистах CD40, которые могут индуцировать и повышать эффективные эндогенные иммунные ответы на рак. Однако практически никогда не имеют место эффекты, ограниченные одним типом клеток, или действующие посредством одного механизма, и исследования, направленные на изучение межклеточных и внутриклеточных механизмов передачи сигналов, характеризуются повышенными уровнями сложности. Известные антитела к CD40 можно вводить только в относительно низких дозах из-за ограничивающей дозу токсичности, такой как синдром высвобождения цитокинов и активация тромбоцитов/эндотелиальных клеток, что приводит к недостаточной активации пути передачи сигнала на АРС-мишени и узкому терапевтическому индексу. Таким образом, существует необходимость в «нацеленных» (таргетированных) агонистах, которые предпочтительно действуют на один тип клеток.
Настоящее изобретение относится к новым биспецифическим антигенсвязывающим молекулам, обладающим способностью специфически связываться с CD40 и антигеном клетки-мишени. В антигенсвязывающих молекулах, предлагаемых в изобретении, объединен фрагмент, который обладает способностью преимущественно связываться со специфическими для опухоли или ассоциированными с опухолью мишенями, с фрагментом, который обладает способностью агонистически связываться с CD40, при этом активация АРС посредством CD40 обеспечивается перекрестным сшиванием через антиген клетки-мишени, например, FAP, который экспрессируется на опухолях из клеток стромы, и возможно также через FAP со средним уровнем экспрессии во вторичных лимфоидных тканях. Опосредуемое FAP перекрестное сшивание биспецифических антигенсвязывающих молекул ограничивает активацию экспрессирующих CD40 клеток опухолевой тканью и возможно также вторичными лимфоидными тканями, такими как дренирующие опухоль лимфатические узлы. В противоположность биспецифическим антигенсвязывающим молекулам, которые обладают способностью специфически связываться с CD40 и рецепторами иммунных контрольных точек на активированных Т-клетках, такими как CTLA-4 или PD-1, таргетинг к опухолевой мишени, такой как FAP, обеспечивает опосредуемую CD40 активацию АРС главным образом в строме опухоли и дренирующих опухоль лимфатических узлах, в которых фибробласты экспрессируют повышенные уровни FAP по сравнению с другими тканями. Таким образом, антигенсвязывающие молекулы, предлагаемые в настоящем изобретении, могут обладать способностью запускать CD40-рецептор не только эффективно, но также и очень избирательно в требуемом сайте, преодолевая тем самым необходимость в перекрестном сшивании FcγR, снижая тем самым побочные действия.
Краткое изложение сущности изобретения
Настоящее изобретение относится к биспецифическим антигенсвязывающим молекулам, в которых объединен по меньшей мере один фрагмент (антигенсвязывающий домен), обладающий способностью специфически связываться с членом семейства костимуляторных TNF-рецепторов CD40, по меньшей мере с один антигенсвязывающим участком, таргетирующим антиген клетки-мишени. Указанные биспецифические антигенсвязывающие молекулы обладают преимуществами, поскольку они предпочтительно могут активировать костимуляторные CD40-рецепторы в сайте, в котором экспрессируется антиген клетки-мишени, благодаря их способности связываться с антигеном клетки-мишени.
Одним объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и
(б) по меньшей мере один антигенсвязывающий домен обладающий способностью специфически связываться с антигеном клетки-мишени.
В конкретном объекте изобретения биспецифическая антигенсвязывающая молекула содержит (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации. Более конкретно Fc-домен, состоящий из первой и второй субъединиц, обладающих способностью к стабильной ассоциации, содержит мутации, которые снижают эффекторную функцию.
В одном из объектов изобретения антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 1.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, представляет собой антигенсвязывающий домен, обладающий способностью специфически связываться с фибробласт-активирующим белком (FAP). В частности, антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 2. Таким образом, одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит
(а) вариабельную область тяжелой цепи (VHFAP) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 3, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 4, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 5, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 6, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 7, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(б) вариабельную область тяжелой цепи (VHFAP) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 11, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 12, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 13, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 14, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 15, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 16.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит (а) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 10, или
(б) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 18.
В частности, предложена биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит (а) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или (б) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит (а) вариабельную область тяжелой цепи (VHCD40) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 19, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 20, и (III) CDR- Н3, содержащий аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, связывается с мышиным CD40 и содержит (а) вариабельную область тяжелой цепи (VHCD40) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 27, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 28, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 29, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 30, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 31, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 32.
Кроме того, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит (a) VH, которая содержит аминокислотную последовательность SEQ ID NO: 25, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 26, или (б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 33, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 34. Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой каждый из антигенсвязывающих доменов, обладающих способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 25, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 26.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 19 и SEQ ID NO: 35,
(II) CDR-H2, содержащий аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44, и
(III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 21,
и вариабельную область легкой цепи (VLCD40), которая содержит
(IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22,
(V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и
(VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
Еще одним объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), которая содержит
(I) CDR-H1, содержащий аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 19 и SEQ ID NO: 261,
(II) CDR-H2, содержащий аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 20, SEQ ID NO: 262 и SEQ ID NO: 263, и
(III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 21,
и вариабельную область легкой цепи (VLCD40), которая содержит
(IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, SEQ ID NO: 264 и SEQ ID NO: 265,
(V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и
(VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
Кроме того, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177 и SEQ ID NO: 178.
В частности, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(н) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(о) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(п) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(р) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176.
Более конкретно, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная в одном из п.п. 1-7 в формуле изобретения, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188.
В частности, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188.
Более конкретно, предложена биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64.
В частности, предложена биспецифическая антигенсвязывающая молекула, в которой каждый из фрагментов, обладающих способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 47, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 57.
Кроме того, предложена биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) по меньшей мере один антигенсвязывающ домен, обладающий способностью специфически связываться FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 25, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, которая выбрана из группы, состоящей из SEQ ID NO: 26, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64, и
(II) по меньшей мере один антигенсвязывающ домен, обладающий способностью специфически связываться FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Согласно одному объекту изобретения биспецифическая антигенсвязывающая молекула представляет собой гуманизированное или химерное антитело. В другом объекте изобретения биспецифическая антигенсвязывающая молекула содержит Fc-область IgG, в частности, Fc-область IgG1 или Fc-область IgG4. В частности, Fc-область содержит одну или несколько аминокислотную(ых) замену(н), которая(ые) снижает(ют) аффинность связывания антитела с Fc-рецептором и/или эффекторную функцию. Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой Fc-область представляет собой (I) Fc-область человеческого IgG1-подкласса с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно EU-индексу Кэбота), или
(II) Fc-область мышиного IgG1-подкласса с аминокислотными мутациями D265A и P329G (нумерация согласно EU-индексу Кэбота). В частности, Fc-область представляет собой Fc-область человеческого IgG1-подкласса с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно EU-индексу Кэбота).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, в которой первая субъединица Fc-области содержит «выступы», а вторая субъединица Fc-области содержит «впадины» согласно методу в соответствии с технологией «knob-into-hole» («выступ-во-впадину»). В частности, предложена биспецифическая антигенсвязывающая молекула, в которой (I) первая субъединица Fc-области содержит аминокислотные замены S354C и T366W (нумерация согласно EU-индексу Кэбота), а вторая субъединица Fc-области содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно EU-индексу Кэбота), или (II) первая субъединица Fc-области содержит аминокислотные замены K392D и K409D (нумерация согласно EU-индексу Кэбота), а вторая субъединица Fc-области содержит аминокислотные замены E356K и D399K (нумерация согласно EU-индексу Кэбота). Более конкретно, предложена биспецифическая антигенсвязывающая молекула, в которой первая субъединица Fc-области содержит аминокислотные замены S354C и T366W (нумерация согласно EU-индексу Кэбота), а вторая субъединица Fc-области содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно EU-индексу Кэбота).
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, которые соединены с Fc-областью, и
(б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, которые соединены с Fc-областью, и
(б) один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области.
В конкретном объекте изобретения антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области, представляет собой кросс-Fab-фрагмент. Таким образом, предложена биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, которые соединены с Fc-областью, и
(б) кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, где VH-область соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и VL-область соединена с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, в котором VH-CL-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, в котором VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Кроме того, предложена биспецифическая антигенсвязывающая молекула, которая содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) два Fab-фрагмента, которые обладают способностью специфически связываться с FAP, где один из Fab-фрагментов соединен с С концом одной из двух тяжелых цепей, указанных в подпункте (а), а другой Fab-фрагмент соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, в котором VH-область соединена с С-концом одной из двух цепей тяжелых цепей, указанных в подпункте (а), и в котором VL-область соединена с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две тяжелые цепи, при этом каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) два Fab-фрагмента, обладающих способностью специфически связываться с FAP, где один из Fab-фрагментов соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), а другой Fab-фрагмент соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) один Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
В другом объекте изобретения Fab-фрагмент или два Fab-фрагмента, обладающий(ие) способностью специфически связываться с FAP, представляют собой кроссовер-Fab-фрагменты, каждый из которых содержит VL-CH1-цепь и VH-CL-цепь, и в которых VH-CL-цепь или VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит четыре Fab-фрагмента, которые обладают способностью специфически связываться с CD40. Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой каждая из двух тяжелых цепей, указанных выше в настоящем описании в подпункте (а), содержит две VH-CH1-цепи Fab-фрагмента, обладающего способностью специфически связываться с CD40, которые соединены друг с другом, необязательно через пептидный линкер.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит две VH-CH1-цепи Fab-фрагмента, обладающего способностью специфически связываться с CD40, которые соединены друг с другом, необязательно через пептидный линкер, и субъединицу Fc-области,
(б) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, где VH-область соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и где VL-область соединена с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит две VH-CH1-цепи Fab-фрагмента, обладающего способностью специфически связываться с CD40, которые соединены друг с другом, необязательно через пептидный линкер, и субъединицу Fc-области,
(б) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) один Fab-фрагмент или кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab- или кросс-Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит две VH-CH1-цепи Fab-фрагмента, обладающего способностью специфически связываться с CD40, которые соединены друг с другом, необязательно через пептидный линкер, и субъединицу Fc-области,
(б) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, где VH-CL-цепь указанного кросс-Fab-фрагмента соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит две VH-CH1-цепи Fab-фрагмента, обладающего способностью специфически связываться с CD40, которые соединены друг с другом, необязательно через пептидный линкер, и субъединицу Fc-области,
(б) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) кросс-Fab-фрагмент, обладающий способностью специфически связываться с FAP, где VL-CH1-цепь указанного cross-Fab-фрагмента соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
Другим конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой один или несколько Fab-фрагментов, обладающий(их) способностью специфически связываться с CD40, содержит(ат) CL-домен, содержащий аргинин (R) в аминокислотном положении 123 (нумерация согласно EU-индексу Кэбота) и лизин (K) в аминокислотном положении 124 (нумерация согласно EU-индексу Кэбота), и СН1-домен, содержащий глутаминовую кислоту (Е) в аминокислотном положении 147 (нумерация согласно EU-индексу Кэбота) и глутаминовую кислоту (Е) в аминокислотном положении 213 (нумерация согласно EU-индексу Кэбота).
Другим объектом изобретения является выделенный полинуклеотид, который кодирует биспецифическую антигенсвязывающую молекулу, указанную выше в настоящем описании. Изобретение относится также к вектору, прежде всего экспрессионному вектору, который содержит выделенный полинуклеотид, предлагаемый в изобретении, и клетке-хозяину, которая содержит выделенный полинуклеотид или экспрессионный вектор, предлагаемый в изобретении. В некоторых объектах изобретения клетка-хозяин представляет собой эукариотическую клетку, прежде всего клетку млекопитающего.
Другим объектом изобретения является способ получения биспецифической антигенсвязывающей молекулы, указанной выше в настоящем описании, включающий культивирование клетки-хозяина, описанной выше, в условиях, пригодных для экспрессии биспецифической антигенсвязывающей молекулы, и выделение биспецифической антигенсвязывающей молекулы. Под объем изобретения подпадает также биспецифическая антигенсвязывающая молекула, которая специфически связывается с CD40 и с FAP, полученная способом, предлагаемым в изобретении.
Изобретение относится также к фармацевтической композиции, которая содержит биспецифическую антигенсвязывающую молекулу, указанную выше в настоящем описании, и по меньшей мере один фармацевтически приемлемый эксципиент.
Изобретение относится также к биспецифической антигенсвязывающей молекуле, указанной выше в настоящем описании, или фармацевтической композиции, которая содержит биспецифическую антигенсвязывающую молекулу, предназначенной для применения в качестве лекарственного средства.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, или фармацевтическая композиция, предлагаемая в изобретении, предназначенная для применения для
(I) индукции иммунной стимуляции посредством экспрессирующих CD40 антигенпрезентирующих клеток (АРС),
(II) стимуляции опухольспецифического Т-клеточного ответа,
(III) вызывания апоптоза опухолевых клеток,
(IV) лечения рака,
(V) замедления прогрессирования рака,
(VI) пролонгирования времени жизни пациента, страдающего раком,
(VII) лечения инфекций.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, или фармацевтическая композиция, предлагаемая в изобретении, предназначенная для применения для лечения рака. Другим конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, предназначенная для применения для лечения рака, в котором биспецифическую антигенсвязывающую молекулу вводят в комбинации с химиотерапевтическим агентом, излучением и/или другими агентами для применения в иммунотерапии рака. Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, указанная выше в настоящем описании, или фармацевтическая композиция, предлагаемая в изобретении, предназначенная для применения для повышающей регуляции или пролонгирования активности цитотоксических Т-клеток.
Следующим объектом изобретения является способ ингибирования роста опухолевых клеток у индивидуума, включающий введение индивидууму в эффективном количестве биспецифической антигенсвязывающей молекулы, указанной выше в настоящем описании, или фармацевтической композиции, предлагаемой в изобретении, для ингибирования роста опухолевых клеток. Другим объектом изобретения является способ лечения или замедления развития рака у индивидуума, включающий введение индивидууму в эффективном количестве биспецифической антигенсвязывающей молекулы, указанной выше в настоящем описании, или фармацевтической композиции, предлагаемой в изобретении.
Предложено также применение биспецифической антигенсвязывающей молекулы, указанной выше в настоящем описании, для приготовления лекарственного средства, предназначенного для лечения заболевания у индивидуума, который нуждается в этом, прежде всего для приготовления лекарственного средства, предназначенного для лечения рака, а также способ лечения заболевания у индивидуума, включающий введение указанному индивидууму в терапевтически эффективном количестве композиции, которая содержит биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, в фармацевтически приемлемой форме. В конкретном объекте изобретения заболевание представляет собой рак. В любом из указанных выше объектов изобретения индивидуум представляет собой млекопитающее, прежде всего человека.
Краткое описание чертежей
На чертежах показано:
на фиг. 1А-1Е схематические изображения биспецифических антигенсвязывающих молекул, которые специфически связываются с человеческим CD40 и FAP. На фиг. 1А - схематическое изображение биспецифического антитела к CD40-FAP в формате 4+1, которое состоит из четырех CD40-связывающих Fab-доменов, объединенных с одним FAP-связывающим фрагментом с помощью VH на С-конце одной тяжелой цепи и VL на С-конце другой тяжелой цепи (антитело, четырехвалентное в отношении CD40 и одновалентное в отношении FAP). Черной точкой обозначены модификации типа «knob-into-hole». На фиг. 1Б схематическое изображение биспецифического антитела CD40-FAP в формате 4+2, которое состоит из четырех CD40-связывающих Fab-доменов, объединенных с двумя FAP-связывающими Fab-доменами, каждый из которых слит на С-концах тяжелых цепей (антитело, четырехвалентное в отношении CD40 и двухвалентное в отношении FAP). На фиг. 1В схематическое изображение биспецифического антитела к CD40-FAP в формате 2+1, которое состоит из двух CD40-связывающих Fab-доменов, объединенных с одним FAP-связывающим фрагментом с помощью VH на С-конце одной тяжелой цепи и VL на С-конце другой тяжелой цепи (антитело, двухвалентное в отношении CD40 и одновалентное в отношении FAP). Черной точкой обозначены модификации типа «knob-into-hole». На фиг. 1Г - схематическое изображение биспецифического антитела к CD40-FAP в формате 2+2, которое состоит из двух CD40-связывающих Fab-доменов, объединенных с двумя FAP-связывающими Fab-доменами, каждый из которых слит на С-концах тяжелых цепей (антитело, двухвалентное в отношении CD40 и двухвалентное в отношении FAP). На фиг. 1Д - схематическое изображение биспецифического антитела к CD40-FAP в формате 2+1, которое состоит из двух CD40-связывающих Fab-доменов, объединенных с одним FAP-связывающим Fab-доменом, слитым на С-конце одной из тяжелых цепей (антитело, двухвалентное в отношении CD40 и одновалентное в отношении FAP). Черной точкой обозначены модификации типа «knob-into-hole». На фиг. 1E - схематическое изображение биспецифического антитела к CD40-FAP в формате 1+1, которое состоит из одного CD40-связывающего плеча, объединенного с одним FAP-связывающим плечом (антитело, одновалентное в отношении CD40 и одновалентное в отношении FAP);
на фиг. 2А и 2Б -данные о связывании человеческих четырехвалентных антител к CD40 в «нацеленном» (таргетированном) на FAP в одновалентном или двухвалентном формате с FAP-негативными опухолевыми клетками (фиг. 2А) и FAP-позитивными опухолевыми клетками (фиг. 2Б). Трансгенные модифицированные мышиные эмбриональные фибробласты NIH/3T3-huFAP клона 19 экспрессируют высокие уровни человеческого фибробласт-активирующего белка (huFAP), в то время как родительская линия клеток NIH/3T3-wt не экспрессирует huFAP. Только четырехвалентные анти-CD40 антигенсвязывающие молекулы либо с одним, либо с двумя FAP-связывающими фрагментами, в отличие от «ненацеленных» (нетаргетированных) на FAP форматов, эффективно связывались с клетками NIH/3T3-huFAP (фиг. 2Б). Двухвалентная в отношении FAP конструкция связывалась сильнее, чем одновалентная конструкция. В отличие от этого, не обнаружено связывания таргетированных на FAP антител к CD40 с клетками NIH/3T3-wt (фиг. 2А). Данные о связывании представлены в виде медианы интенсивности флоуресценции (MFI) меченного фикоэритрином (РЕ) F(ab')2-фрагмента козьего IgG против человеческого IgG, Fcγ-специфического, применяемого в качестве вторичного идентифицирующего антитела. MFI измеряли с помощью проточной цитометрии. На оси х отложена концентрация конструкций антител;
на фиг. 3А-3З данные об активации in vitro человеческих В-клеток одно - или двухвалентными таргетированными на FAP анти-CD40 конструкциями. При использовании NIH/3T3-FAP биспецифическое антитело, одновалентное в отношении FAP, индуцировало такое же повышение экспрессии маркеров В-клеточной активации (CD70, CD80, CD83 и CD86), что и двухвалентная таргетированная на FAP молекула. Кроме того, повышающая регуляция маркера В-клеточной активации под воздействием таргетированных на FAP биспецифических антигенсвязывающих молекул оказалась сопоставимой с повышающей регуляцией, индуцированной независимыми от FAP применяемыми в качестве положительного контроля антителами. В отсутствии FAP (клетки NIH/3T3-wt) не удалось обнаружить увеличения уровня маркеров В-клеточной активации с помощью биспецифических антигенсвязывающих молекул, в то время как применяемые в качестве положительно контроля антитела индуцировали повышающую регуляцию маркера активации. Данные представлены в виде процента CD70- (фиг. 3А и 3Б), CD80- (фиг. 3В и 3Г), CD83- (фиг. 3Д и 3Е) и CD86- (фиг. 3Ж и 3З) позитивных жизнеспособных В-клеток после 2 дней инкубации с указанными титрованными антителами. На оси х отложена концентрация конструкций антител. Данные о воздействии на клетки NIH/3T3-FAP представлены на фиг. 3А, 3В, 3Д и 3Ж соответственно, а данные о воздействии на клетки NIH/3T3-wt представлены на фиг. 3Б, 3Г, 3Е и 3З соответственно;
на фиг. 4А-4Е и 5А-5З данные об активации in vitro человеческих В-клеток одно- или двухвалентными таргетированными на FAP конструкциями антител к человеческому CD40 в присутствии покрытых или непокрытых FAP гранул Dynabeads® после инкубации в течение 2 дней (фиг. 4А-4Е) или 5 дней (фиг. 5А-5З). После инкубации в течение 2-дней с покрытыми FAP гранулами биспецифические антитела, одновалентные в отношении FAP, индуцировали такое же повышение экспрессии маркеров В-клеточной активации (CD70, CD83 и CD86), что и двухвалентные таргетированные на FAP молекулы. Кроме того, повышающая регуляция маркера В-клеточной активации под воздействием таргетированных на FAP биспецифических антигенсвязывающих молекул оказалась сопоставимой с повышающей регуляцией, индуцированной независимыми от FAP применяемыми в качестве положительного контроля антителами. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить увеличения уровня маркеров В-клеточной активации в присутствии биспецифических антигенсвязывающих молекул, в то время как применяемые в качестве положительного контроля антитела индуцировали повышающую регуляцию маркеров активации. После инкубации В-клеток в течение 5 дней с покрытыми FAP Dynabeads® таргетированные на FAP конструкции антител к человеческому CD40 индуцировали FAP-зависимую повышающую регуляцию экспрессии CD80 и CD86 на В-клеток. По сравнению с независимой от FAP повышающей регуляции CD86, индуцированной RO7009789 или перекрестносшитой конструкцией SGN-40, повышающая регуляция CD86, индуцированная FAP-зависимыми биспецифическими антигенсвязывающими молекулами, оказалась несколько более низкой. В случае CD70 и CD83 повышающая регуляция отсутствовала или удалось обнаружить лишь очень ограниченную повышающую регуляцию биспецифическими антителами, таргетированными на FAP и CD40, хотя для применяемых в качестве положительного контроля антител четко продемонстрировано действие на указанные маркеры В-клеточной активации. Данные представлены в виде процента CD70- (фиг. 4А, 4Б, 5А и 5Б соответственно), CD80- (фиг. 5В и 5Г соответственно), CD83- (фиг. 4В, 4Г, 5Д и 5Е соответственно) и CD86-(фиг. 4Д, 4Е, 5Ж и 5З соответственно) позитивных жизнеспособных В-клеток после инкубации в течение 2 дней или 5 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител;
на фиг. 6А и 6Б - данные о секреции IL-6 человеческими В- клетками, обработанными различными таргетированными на FAP и нетаргетированными агонистическими антителами к CD40 в присутствии покрытых FAP (фиг. 6А) или непокрытых (фиг. 6Б) гранул после инкубации в течение 5 дней. В присутствии FAP одновалентное, а также двухвалентное таргетированное на FAP антитело к CD40 индуцировало повышение секреции IL-6, сходное с независимыми от FAP применяемыми в качестве положительного контроля антителами RO7009789 и SGN40. В противоположность этому, В-клетки, обработанные применяемыми в качестве отрицательного контроля нетаргетированными антителами, экспрессировали такие же низкие уровни IL-6, что и необработанные В-клетки. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить увеличения производства IL-6 в присутствии биспецифических антигенсвязывающих молекул. Данные представлены в виде количества IL-6 в супернатанте человеческих В-клеток, которые культивировали в течение 5 дней с указанными титрованными антителами, измеренного с помощью ELISA. На оси х отложена концентрация конструкций антител;
на фиг. 7А-7З - данные об активации in vitro человеческих полученных из моноцитов DC (moDC) с помощью одно- или двухвалентных таргетированных на FAP конструкций антител к человеческому CD40 в присутствии покрытых или непокрытых FAP гранул Dynabeads® после инкубации в течение 2 дней. В присутствии покрытых FAP гранул биспецифическое антитело, одновалентное в отношении FAP, индуцировало такое же повышение уровня экспрессии маркеров активации DC (CD70, CD80 и CD83), что и двухвалентная таргетированная на FAP молекула, в то время как в отсутствии FAP (непокрытые гранулы) повышающая регуляции маркеров активации не обнаружена. Кроме того, повышающая регуляция CD80 и CD83 таргетированными на FAP биспецифическими антигенсвязывающими молекулами оказалась сопоставимой с повышающей регуляцией, индуцированной независимыми от FAP применяемыми в качестве положительного контроля антителами. Более высокая по сравнению с другими протестированными антителами повышающая регуляция CD70 на DC обнаружена при применении RO709789. В противоположность этому, экспрессии CD86 не существенно изменилась на DC, которые инкубировали с различными антителами к CD40, по сравнению с необработанными DC. Данные представлены в виде процента CD70- (фиг. 7А и 7Б), CD80- (фиг. 7В и 7Г), CD83- (фиг. 7Д и 7Е) и CD86- (фиг. 7Ж и 7З) позитивных жизнеспособных moDC после инкубации в течение 2 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител;
на фиг. 8А и 8Б - данные об активации in vitro клеток HEK-Blue™ CD40L с помощью одно- или двухвалентных таргетированных на FAP конструкций антител к человеческому CD40 в присутствии покрытых или непокрытых FAP гранул Dynabeads® после инкубации в течение 8 ч. В присутствии покрытых FAP гранул биспецифическое антитело, одновалентное в отношении FAP и двухвалентное в отношении CD40, индуцировало такое же повышение производства уровня SEAP, что и биспецифическое антитело, двухвалентное в отношении FAP и CD40, в то время как в отсутствии FAP (непокрытые гранулы) производство SEAP не обнаружено. Кроме того, в присутствии FAP обнаружена повышающая регуляция производства SEAP таргетированными на FAP антителами, четырехвалентными в отношении CD40. Однако производство SEAP обнаружено также в отсутствии FAP в супернатанте репортерных клеток, обработанных таргетированными на FAP антителами, четырехвалентными в отношении CD40. Применяемые в качестве отрицательного контроля антитела, четырехвалентные в отношении человеческого CD40, с одним или двумя DP47- доменами вместо FAP-связывающего домена индуцировали сопоставимое производство SEAP в клетках HEK-Blue™ CD40L в присутствии и в отсутствии FAP, а применяемое в качестве положительного контроля антитело SGN-40 + F(ab) индуцировало такие же уровни производства SEAP, что и таргетированные на FAP биспецифические антитела, двухвалентные или четырехвалентные в отношении человеческого CD40, в присутствии покрытых FAP гранул. Данные представлены в виде абсорбции при длине волны 650 нм, которая коррелирует с количеством гидролизированного с помощью SEAP субстрата. На оси х отложена концентрация конструкций антител;
на фиг. 9А-9З данные о Т-клеточном примировании импульсно-обработанных (импульсно-меченых) SIINFEKL DC, активированных с помощью нацеленных на FAP анти-CD40-связывающих молекул. DC, выделенные из трансгенных по huCD40 мышей (для человеческого CD40 и мышиного CD40 характерна сходная схема экспрессии), импульсно-обработанные небольшими количествами SIINFEKL и стимулированные FAP-зависимыми биспецифическими антителами к CD40, а также покрытыми FAP гранулами, индуцировали сильную пролиферацию антигенспецифических Т-клеток. В противоположность этому, в отсутствии FAP (непокрытые гранулы) Т-клеточная пролиферация не индуцировалась DC, стимулированными таргетированными на FAP антителами к CD40. Уровни Т-клеточной пролиферации, индуцированные DC, стимулированными мышиными или человеческими биспецифическими антигенсвязывающими молекулами с четырьмя CD40-связывающими и двумя FAP-связывающими фрагментами, оказались сопоставимыми. Никакой значимой повышающей регуляции маркеров Т-клеточной активации CD44 и CD25 или производства IFNγ не обнаружено для Т-клеток, которые совместно культивировали с DC, предварительно стимулированными различными агонистическими антителами к CD40. Только DC, импульсно-обработанные большими количествами SIINFEKL, индуцировали четкое повышение уровня экспрессии указанных маркеров по сравнению с состоянием без обработки. Данные представлены в виде процента пролиферирующих (CFSE-low)-, IFNγ-, CD25- и CD44- позитивных жизнеспособных меченных CFSE мышиных CD3+CD8+ ОТ-1 Т-клеток, которые совместно культивировали с huCD40 tg DC, предварительно инкубированными с указанными титрованными антителами. На оси х отложена концентрация конструкций антител;
на фиг. 9И и 9К - концентрация IL-2 и IL-12(p40), измеренная в супернатанте Т-клеток, примированных с помощью импульсно-обработанных SIINFEKL DC, активированных таргетированным на FAP антителом к CD40. При совместном культивировании ОТ-1 Т-клеток и huCD40 tg DC, импульсно-обработанных небольшими количествами SIINFEKL и стимулированных FAP-зависимыми биспецифическими антителами к CD40, а также покрытыми FAP гранулами, обнаружены повышенные уровни IL-2 и IL-12(p40) по сравнению с ОТ-1 Т-клетками, которые совместно культивировали с huCD40 tg DC, предварительно стимулированными таргетированными на FAP антителами в отсутствии FAP. Кроме того, мышиное двухвалентное таргетированное на FAP антитело к CD40 индуцировало в значительной степени более высокий уровень секреции IL-12(p40) по сравнению с эквивалентной человеческой биспецифической антигенсвязывающей молекулой. Секреция IL-2 возрастала до сходного уровня при применении как биспецифических антигенсвязывающих молекул к человеческому CD40, так и к мышиному CD40 при использовании FAP-зависимого пути. Данные представлены в виде количества IL-2 и IL-12(p40) в супернатанте мышиных CD3+CD8+ ОТ-1 Т-клеток, которые совместно культивировали с huCD40 tg DC, предварительно инкубированными с указанными титрованными антителами, измеренное с помощью ELISA. На оси х отложена концентрация конструкций антител;
на фиг. 10-12 данные о Т-клеточном примировании импульсно-обработанных OVA DC, активированных с помощью таргетированных на FAP анти-CD40-связывающих молекул. DC, выделенные из трансгенных по huCD40 мышей, обработанные конъюгатом DEC205-OVA и стимулированные FAP-зависимыми биспецифическими антителами к CD40, а также покрытыми FAP гранулами, индуцировали сильную пролиферацию антигенспецифических Т-клеток и экспрессию на них CD25, а также CD44. В противоположность этому, в отсутствии FAP (непокрытые гранулы) или OVA (только DEC) Т-клеточная пролиферация и активация не индуцировались DC, стимулированными таргетированными на FAP антителами к CD40. Уровни Т-клеточной пролиферации и экспрессии CD25, а также CD44, индуцированные DC, стимулированными мышиными или человеческими биспецифическими антигенсвязывающими молекулами с четырьмя CD40-связывающими фрагментами и двумя FAP-связывающими фрагментами, оказались сопоставимыми. DC, импульсно-обработанные высокими количествами SIINFEKL вместо конъюгата DEC205-OVA, индуцировали также сильную Т-клеточную пролиферацию и экспрессию маркеров активации CD25 и CD44. Данные представлены в виде процента пролиферирующих (CFSE-low)- (фиг. 10А-10В), CD250 (фиг. 11А-11В) и CD44- (фиг. 12А-12В)-позитивных жизнеспособных меченных CFSE мышиных CD3+CD8+ ОТ-1 Т-клеток, которые совместно культивировали с huCD40 tg DC, предварительно инкубированными с указанными титрованными антителами в присутствии или отсутствии OVA. На оси х отложена концентрация конструкций антител;
на фиг. 13А-13В - данные об уровнях IFNγ, измеренных в супернатантах Т-клеток, которые совместно культивировали с импульсно-обработанными OVA DC, активированными с помощью таргетированных на FAP анти-СО40-связывающих молекул. Уровни IFNγ повышались в условиях совместно культивирования Т-клеток с DC, обработанными таргетированным на FAP антителом к человеческому CD40, в присутствии FAP (фиг. 13А). Кроме того, секреция IFNγ повышалась до сходной степени при применении как биспецифических антигенсвязывающих молекул к человеческому CD40, так и к мышиному CD40 при использовании FAP-зависимого пути. Данные представлены в виде количества IFNγ в супернатанте мышиных CD3+CD8+ ОТ-1 Т-клеток, которые совместно культивировали с huCD40 tg DC, предварительно инкубированными с указанными титрованными антителами, измеренного с помощью ELISA. На оси х отложена концентрация конструкций антител;
на фиг. 14А-14З - данные об активации in vitro мышиных В-клеток одно - или двухвалентными таргетированными на FAP конструкциями антител к мышиному CD40 в присутствии покрытых FAP или непокрытых гранул Dynabeads после инкубации в течение 2 дней. В присутствии покрытых FAP гранул биспецифическое антитело, одновалентное в отношении FAP, индуцировало такое же повышение уровня экспрессии маркера В-клеточной активации (CD70, CD80 и CD86), что двухвалентная таргетированная на FAP молекула. Кроме того, значимая повышающая регуляция маркеров В-клеточной активации обнаружена также для В-клеток, обработанных независимыми от FAP применяемым в качестве положительного контроля антителом FGK4.5. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить увеличения уровня маркеров В-клеточной активации CD70 и CD80 при использовании биспецифических антигенсвязывающих молекул. В противоположность этому, применяемое в качестве положительного контроля антитело индуцировало повышающую регуляцию CD70 и CD80 независимо от предварительной обработки FAP. Хотя повышающая регуляция CD86 оказалась FAP-зависимой при применении четырехвалентного антитела к мышиному CD40, которое несет два FAP-связывающих фрагмента, независимое от FAP действие обнаружено для биспецифической антигенсвязывающей молекулы, которая имеет только один сайт связывания FAP. Кроме того, независимая от FAP повышающая регуляция экспрессии молекул ГКГС-II обнаружена для всех изученных биспецифических антигенсвязывающих молекул. Данные представлены в виде процента CD70-(фиг. 14А и 14Б), CD80- (фиг. 14В и 14Г), CD86- (фиг. 14Д и 14Е)- и ГКГСП-(фиг. 14Ж и 14З)-позитивных жизнеспособных В-клеток после инкубации в течение 2 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител;
на фиг. 15А-15Ж схематические изображения биспецифических антигенсвязывающих молекул, которые специфически связываются с человеческим CD40 и с FAP или DP47. На фиг. 15А - схематическое изображение биспецифического антитела к CD40-DP47 в формате 4+1, состоящего из четырех CD40-связывающих Fab-доменов, которые объединены с одним DP47-связывающим фрагментом с помощью VH на С-конце одной тяжелой цепи и VL на С-конце другой тяжелой цепи (антитело, четырехвалентное в отношении CD40 и одновалентное в отношении DP47). Черной точкой обозначены модификации типа «knob-into-hole». На фиг. 15Б схематическое изображение биспецифического антитела CD40-DP47 в формате 4+2, состоящего из четырех CD40-связывающих Fab-доменов, которые объединены с двумя DP47-связывающими Fab-доменами, каждый из которых слит на С-концах тяжелых цепей (антитело, четырехвалентное в отношении CD40 и двухвалентное в отношении DP47). На фиг. 15В схематическое изображение биспецифического антитела к CD40-FAP в формате 1+1, состоящего из одного CD40-связывающего плеча, объединенного с одним FAP-связывающим плечом (антитело, одновалентное в отношении CD40 и одновалентное в отношении FAP). На фиг. 15Г - схематическое изображение приведенного в качестве примера биспецифического антитела к CD40-FAP в формате 2+1, состоящего из двух CD40-связывающих Fab-доменов, объединенных с одним FAP-связывающим Fab-доменом, в качестве части одного из двух CD40-связывающих плечей. На фиг. 15Д - схематическое изображение биспецифического антитела к CD40-FAP в формате 4+1, состоящего из четырех CD40-связывающих Fab-доменов, которые объединены с одним FAP-связывающим Fab-доменом, слитым на С-конце одной из тяжелых цепей (антитело, четырехвалентное в отношении CD40 и одновалентное в отношении FAP). На фиг. 15Е схематическое изображение биспецифического антитела к CD40-FAP в формате 4+1, состоящего из четырех CD40-связывающих Fab-доменов, которые объединены с одним FAP-связывающим Fab-доменом, слитым на С-конце одной из тяжелых цепей. CD40-связывающие домены VH2a и VL2a получали из гуманизированного на фирме заявителей мышиного CD40-связывающего домена S2C6. На фиг. 15Ж схематическое изображение биспецифического антитела к CD40-FAP в формате 4+1, состоящего из четырех CD40-связывающих Fab-доменов, которые объединены с одним FAP-связывающим Fab-доменом, слитым на С-конце одной из тяжелых цепей. CD40-связывающие домены VH2d и VL2a получали из гуманизированного на фирме заявителей мышиного CD40-связывающего домена S2C6;
на фиг. 16А - изображение родительского мышиного антитела FGK4.5 (P1AD3449). На фиг. 16Б-16Д - схематические изображения биспецифических антигенсвязывающих молекул, которые специфически связываются с мышиным CD40 и с FAP или DP47. На фиг. 16Б - схематическое изображение биспецифического антитела к CD40-FAP в формате 4+1, состоящего из четырех связывающихся с мышиным CD40 Fab-доменов, которые объединены с одним FAP-связывающим фрагментом с помощью VH на С-конце одной тяжелой цепи и VL на С-конце другой тяжелой цепи (антитело, четырехвалентное в отношении CD40 и одновалентное в отношении FAP). Черной точкой обозначены мутации DD/KK в Fc, а связывание с Fc-рецепторами ингибируется мутациями D270A/P329G. На фиг. 16В - схематическое изображение биспецифического антитела CD40-FAP в формате 4+2, состоящего из четырех связывающихся с мышиным CD40 Fab-доменов, которые объединены с двумя FAP-связывающими Fab-доменами, каждый из которых слит на С-концах тяжелых цепей (антитело, четырехвалентное в отношении CD40 и двухвалентное в отношении FAP). Связывание с Fc-рецепторами ингибируется мутациями D270A/P329G. На фиг. 16Г - схематическое изображение биспецифического антитела к CD40-DP47 в формате 4+1, состоящего из четырех связывающихся с мышиным CD40 Fab-доменов, которые объединены с одним ОР47-связывающим фрагментом с помощью VH на С-конце одной тяжелой цепи и VL на С-конце другой тяжелой цепи (антитело, четырехвалентное в отношении CD40 и одновалентное в отношении DP47). Черной точкой обозначены мутации DD/KK в Fc и связывание с Fc-рецепторами ингибируется мутациями D270A/P329G. На фиг. 16Д -схематическое изображение биспецифического антитела к CD40-DP47 в формате 4+2, состоящего из четырех связывающихся с мышиным CD40 Fab-доменов, которые объединены с двумя DP47- связывающими Fab-доменами, каждый из которых слит на С-концах тяжелых цепей (антитело, четырехвалентное в отношении CD40 и двухвалентное в отношении DP47). Связывание с Fc-рецепторами ингибируется мутациями D270A/P329G;
на фиг. 17 данные о связывании человеческих четырехвалентных, двухвалентных или одновалентных антител к CD40 в таргетированном на FAP одновалентном или двухвалентном формате с FAP-позитивными опухолевыми клетками. Трансгенная модифицированная клеточная линия мышиных эмбриональных фибробластов NIH/3T3-mFAP экспрессирует высокие уровни мышиного фибробласт-активирующего белка (mFAP). Все указанные конструкции различались по их силе связывания (величины ЕС50, а также сила сигнала) с клетками NIH/3T3-mFAP. Только анти-CD40-антигенсвязывающие молекулы либо с одним, либо с двумя FAP-связывающими фрагментами в отличие от не таргетированных на FAP форматов (P1AD4574 и P1AD4465) эффективно связывались с клетками NIH/3T3-mFAP. Двухвалентные FAP-конструкции с С-концевыми FAP-связывающими доменами связывались сильнее, чем одновалентная конструкция с С-концевыми FAP-связывающими доменам. Наиболее сильное связывание с FAP обнаружено для формата 1+1. Данные представлены с виде медианы интенсивности флоуресценции (MFI) меченного фикоэритрином (РЕ) Е(ab')2-фрагмента козьего IgG против человеческого IgG, Fcγ-специфического, применяемого в качестве вторичного идентифицирующего антитела. MFI измеряли с помощью проточной цитометрии. На оси х отложена концентрация конструкций антител;
на фиг. 18 данные о связывании человеческих четырехвалентных, двухвалентных или одновалентных антител к CD40 в таргетированном на FAP одновалентном или двухвалентном формате с клетками Дауди, линией В-лимфобластных клеток с высокими уровнями экспрессии человеческого CD40 на поверхности. Все указанные конструкции связывались с CD40, но они различались по силе связывания (величины ЕС50, а также сила сигнала) с CD40-позитивными клетками Дауди. Для двухвалентных антител к CD40 обнаружены более высокие величины ЕС50 и достижение плато при более высоких уровнях связывания по сравнению с четырехвалентными антителами к CD40. Наиболее высокая величина ЕС50 в совокупности с достижением плато при самом низком уровне связывания обнаружено для формата 1+1. Связывание антител к CD40 с белками клеточной поверхности определяли с использованием меченного фикоэритрином (РЕ) Е(ab')2-фрагмента козьего IgG против человеческого IgG, Fcγ-специфического с помощью FACS-анализа. MFI измеряли с помощью проточной цитометрии и корректировали относительно исходного уровня путем вычитания MFI «пустого» контроля. На оси х отложена концентрация конструкций антител;
на фиг. 19А и 19Б - данные об активации in vitro клеток HEK-Blue™ CD40L с помощью одно- или двухвалентных таргетированных на FAP конструкций антител к человеческому CD40 в присутствии покрытых FAP (фиг. 19А) или непокрытых (фиг. 19Б) гранул Dynabeads® после инкубации в течение 24 ч. В присутствии покрытых FAP гранул биспецифическое антитело, одновалентное в отношении FAP и одно- или двухвалентное в отношении CD40, индуцировало такое повышение производства SEAP, что и биспецифическое антитело, двухвалентное в отношении FAP и CD40, в то время как в отсутствии FAP (непокрытые гранулы) обнаружено отсутствие производства SEAP или низкий уровень производства. Кроме того, повышающая регуляция производства SEAP таргетированными на FAP антителами, четырехвалентными в отношении CD40, обнаружено в присутствии FAP. Однако производство SEAP обнаружено также в отсутствии FAP в супернатанте репортерных клеток, обработанных таргетированными на FAP антителами, четырехвалентными в отношении CD40. Применяемое в качестве отрицательного контроля антитело, четырехвалентное в отношении человеческого CD40, с одним DP47-доменом вместо FAP-связывающего домена индуцировало сопоставимый уровень производства SEAP в клетках HEK-Blue™ CD40L в присутствии и в отсутствии FAP, а применяемое в качестве положительного контроля антитело P1AD4470 + F(ab) индуцировало уровни производства SEAP, сходные с таргетированными на FAP биспецифическими антителами, двухвалентными или четырехвалентными в отношении человеческого CD40, в присутствии покрытых FAP гранул. Данные представлены в виде абсорбции при длине волны 650 нм, которая коррелирует с количеством гидролизированного с помощью SEAP субстрата. На оси х отложена концентрация конструкций антител. Величины ЕС50, характеризующие активацию клеток HEK-Blue™ CD40L в присутствии покрытых FAP гранул, обобщены в таблице 11. Величины ЕС50 всех изученных антител, четырехвалентных в отношении CD40, оказались сопоставимыми и более низкими по сравнению с величинами ЕС50 указанных антител, двухвалентных в отношении CD40. Наиболее высокая величина ЕС50 обнаружена для формата 1+1;
на фиг. 20А и 20Б - данные об активации in vitro человеческих клеток Дауди с помощью одно- или двухвалентных таргетированных на FAP конструкций антител к человеческому CD40 в присутствии покрытых FAP (фиг. 20А) или непокрытых (фиг. 20Б) гранул Dynabeads® после инкубации в течение 2 дней. В присутствии покрытых FAP гранул биспецифические антитела, одновалентные в отношении FAP, индуцировали такое же повышение экспрессии маркера активации В-клеток CD70, что и двухвалентные нацеленные на FAP молекулы. Кроме того, повышающая регуляция маркера В-клеточной активации таргетированными на FAP биспецифическими антигенсвязывающими молекулами оказалась выше по сравнению с повышающей регуляцией, индуцированной независимыми от FAP применяемыми в качестве положительного контроля антителами. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить увеличения уровня CD70 при использовании указанных таргетированных на FAP биспецифических антител, одно- или двухвалентных в отношении CD40, в то время как четырехвалентные CD40-связывающие молекулы индуцировали повышающую регуляцию CD70, но в меньшей степени, чем в присутствии FAP. Данные представлены в виде процента CD70-позитивных жизнеспособных клеток Дауди после инкубации в течение 2 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител. Величины ЕС50, характеризующие активацию в присутствии покрытых FAP гранул, обобщены в таблице 9. Величины ЕС50 всех изученных антител, четырехвалентных в отношении CD40, оказались сопоставимыми и более низкими по сравнению с величинами ЕС50 указанных антител, двухвалентных в отношении CD40. Наиболее высокие величины ЕС50 обнаружены для применяемого в качестве положительного контроля антитела P1AD4470 и формата 1+1;
на фиг. 21А и 21Б - данные об активации in vitro человеческих В-клеток с помощью одно- или двухвалентных таргетированных на FAP конструкций антител к человеческому CD40 в присутствии покрытых FAP (фиг. 21А) или непокрытых (фиг. 21Б) гранул Dynabeads® после инкубации в течение 2 дней. В присутствии покрытых FAP гранул биспецифические антитела, одновалентные в отношении FAP, индуцировали такое повышение экспрессии маркера активации В-клеток CD70, что и двухвалентные таргетированные на FAP молекулы. В присутствии покрытых FAP гранул биспецифические антитела, одновалентные в отношении FAP, индуцировали такое повышение экспрессии маркера активации В-клеток CD86, что и двухвалентные таргетированные на FAP молекулы. По сравнению с независимой от FAP повышающей регуляции CD86, индуцированной перекрестносшитым антителом к CD40 (P1AD4470), повышающая регуляция CD86, индуцированная FAP-зависимыми биспецифическими антигенсвязывающими молекулами, оказалась несколько более низкой. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить увеличения экспрессии CD86 при использовании биспецифических антигенсвязывающих молекул, в то время как применяемые в качестве положительного контроля антитела индуцировали повышающую регуляцию маркеров активации. Данные представлены в виде процента CD86-позитивных жизнеспособных В-клеток после инкубации в течение 2 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител. Величины ЕС50 всех таргетированных на FAP антител, четырехвалентных в отношении CD40, оказались сопоставимыми и более низкими по сравнению с величинами ЕС50 указанных таргетированных на FAP антител, двухвалентных в отношении CD40. Наиболее высокие величины ЕС50 обнаружены для форматов 2+1, 2+2 и 1+1;
на фиг. 22А и 22Б - данные о Т-клеточном примировании импульсно-обработанных OVA DC, активированных с помощью таргетированных на FAP анти-CD40-связывающих молекул, в присутствии (фиг. 22А) или в отсутствии (фиг. 22Б) FAP. DC, выделенные из трансгенных по huCD40 мышей, обработанные конъюгатом DEC205-OVA и стимулированные FAP-зависимыми биспецифическими антителами к CD40, а также покрытыми FAP гранулами, индуцировали сильную пролиферацию антигенспецифических Т-клеток. В противоположность этому, в отсутствии FAP (непокрытые гранулы) Т-клеточная пролиферация и активация не индуцировались или индуцировалась в небольшой степени DC, стимулированными таргетированными на FAP антителами к CD40. Т-клеточная, индуцированная DC, стимулированными человеческими биспецифическими антигенсвязывающими молекулами с одним, двумя или четырьмя CD40-связывающими фрагментами и одним или двумя FAP-связывающими фрагментами, оказалась сопоставимой. DC, импульсно-обработанные высокими количествами SIINFEKL вместо конъюгата DEC205-OVA, индуцировали сильную Т-клеточную пролиферацию. Данные представлены в виде процента пролиферирующих (CFSE-low) жизнеспособных меченных CFSE мышиных CD3+ CD8+ ОТ-1 Т-клеток, которые совместно культивировали с huCD40 tg DC, предварительно инкубированными с указанными титрованными антителами в присутствии OVA (фиг. 22А и 22Б). На оси х отложена концентрация конструкций антител;
на фиг. 23А-23Д и 24А-24Е данные об уровнях ферментов в сыворотке, весе тела, весе селезенки, DC-активации и Т-клеточной пролиферации у мышей, которым инъецировали экспрессирующую FAP опухолевую клеточную линию мышиной аденокарциномы ободочной кишки (MC38-FAP) и обрабатывали либо FGK4.5 (P1AD3449), либо FGK4.5 × FAP 4+1 (P1AD4520), либо только наполнителем. В отличие от варианта, когда мышей обрабатывали нетаргетированным МАт к CD40 (FGK4.5), обработка FAP-CD40 (FGK4.5) 4+1 (т.е. биспецифическим антителом, четырехвалентным в отношении CD40 и одновалентным в отношении FAP), не индуцировала повреждение печени, поскольку не обнаружено увеличения в сыворотке уровня ферментов, свидетельствующих о повреждении печени. Это продемонстрировано для 3 животных на группу на фиг. 23А для аланинаминотрансферазы (ALT), на фиг. 23Б для глутаматдегидрогеназы (GDH) и на фиг. 23В для сорбитдегидрогеназы (SDH). Кроме того, не обнаружено уменьшение веса тела (фиг. 23Г) и небольшое увеличение веса селезенки (фиг. 23Д) у мышей, обработанных конструкцией FGK4.5 × FAP (P1AD4520), по сравнению с мышами, обработанными родительским нетаргетированным антителом к CD40 (P1AD3449). Активация DC в дренирующих опухоль лимфатических узлах через 3 дня после терапевтической инъекции (фиг. 24А и 24Б) и Т-клеточная пролиферация в опухолях через 8 дней после терапевтической инъекции (фиг. 24В и 24Г) существенно повышалась у обработанных FGK4.5 и FGK4.5 × FAP 4+1 животных по сравнению с обработанными наполнителем животными. На фиг. 23А-23В на оси у отложены уровни ферментов в сыворотке/л, а на оси х отложены номера отдельных мышей, обработанных FGK4.5, FGK4.5 × FAP 4+1 или только наполнителем. На фиг. 23Г на оси у отложен вес тела в г мышей, обработанных FGK4.5, FGK4.5 × FAP 4+1 или только наполнителем, а на оси х отложены дни после инъекции опухолей. На фиг. 23Д представлены данные о весе селезенки мышей, обработанных FGK4.5, FGK4.5 × FAP 4+1 или только наполнителем, через 3 дня после терапевтической инъекции. На фиг. 24А-24Г представлены данные об уровне экспрессии CD86 (фиг. 24А) и CD70 (фиг. 24Б) в DC в дренирующем опухоль лимфатическом узле, и экспрессии Ki67 в CD8+ Т-клетках (фиг. 24В), и об общем количестве CD8+ Т-клеток (фиг. 24Г) в опухолях через 3 и 8 дней после терапевтической инъекции соответственно. (*р<0,05, **р<0,01, ***р<0,001, непарный двусторонний критерий Стьюдента);
на фиг. 25А и 25Б - данные об активации in vitro человеческих В-клеток двухвалентными таргетированными на FAP конструкциями антител к человеческому CD40 в присутствии покрытых FAP (фиг. 25А и 25В) или непокрытых гранул Dynabeads® (фиг. 25Б и 25Г) после инкубации в течение 2 дней. По сравнению с независимой от FAP повышающей регуляцией CD70 и CD86, индуцированной перекрестносшитым антителом к CD40 (Р1АА5145), повышающая регуляция CD70 (фиг. 25А) и повышающая регуляция CD86 (фиг. 25В), индуцированная FAP-зависимыми биспецифическими антигенсвязывающими молекулами, оказалась несколько более низкой. В отсутствии FAP (непокрытые гранулы) не удалось обнаружить повышения уровня экспрессии CD70 (фиг. 25Б) или CD86 (фиг. 25Г) при использовании биспецифических антигенсвязывающих молекул, в то время как применяемые в качестве положительного контроля антитела индуцировали повышающую регуляцию маркеров активации. Данные представлены в виде процента CD70- или CD86-позитивных жизнеспособных В-клеток после инкубации в течение 2 дней с указанными титрованными антителами. На оси х отложена концентрация конструкций антител.
Подробное описание изобретения
Определения
Если не указано иное, то технические и научные понятия, применяемые в настоящем описании, имеют значения, которые обычно используют в области техники, к которой относится изобретение. Для целей интерпретации настоящей заявки следует применять приведенные ниже определения, и, если это возможно, то понятия, применяемые в единственном числе, включают также их применение во множественном числе и наоборот.
В контексте настоящего описания понятие «антигенсвязывающая молекула» в наиболее широком смысле относится к молекуле, которая специфически связывается с антигенной детерминантой. Примерами антигенсвязывающих молекул являются антитела, фрагменты антител и антигенсвязывающие белки-каркасы («скаффолд-белки»).
В контексте настоящего описания понятие «антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени» или «фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени» относится к полипептидной молекуле, которая специфически связывается с антигенной детерминатной. В одном из объектов изобретения антигенсвязывающий домен обладает способностью активировать передачу сигнала через антиген его клетки-мишени. В конкретном объекте изобретения антигенсвязывающий фрагмент обладает способностью направлять субстанцию, с которой он связан (например, агонист CD40), к сайту-мишени, например, к определенному типу опухолевых клеток или стромы опухоли, несущих антигенную детерминанту. Антигенсвязывающие домены, обладающие способностью специфически связываться с антигеном клетки-мишени, включают антитела и их фрагменты, более подробно представленные в настоящем описания. Кроме того, антигенсвязывающие домены, обладающие способностью специфически связываться с антигеном клетки-мишени, включают антигенсвязывающие белки-каркасы, более подробно представленные в настоящем описании, например, связывающие домены, основой который являются сконструированные повторы белков или сконструированные повторы доменов (см., например, WO 2002/020565).
Касательно антитела или его фрагмента понятие «антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени» относится к части молекулы, которая содержит область, специфически связывающуюся и комплементарную части антигена или всему антигену. Антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном, может представлять собой, например, один или несколько вариабельных доменов антитела (которые называют также вариабельными областями антитела). В частности, антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном, содержит вариабельную область легкой цепи антитела (VL) и вариабельную область тяжелой цепи антитела (VH). В другом объекте изобретения «антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени» может представлять собой также Fab-фрагмент или кросс-Fab-фрагмент.
В контексте настоящего описания понятие «антитело» используется в его наиболее широком смысле, и оно относится к различным структурам антител, включая (но, не ограничиваясь только ими) моноклональные антитела, поликлональные антитела, моноспецифические и мультиспецифические антитела (например, биспецифические антитела) и фрагменты антител, при условии, что они обладают требуемой антигенсвязывающей активностью.
Понятие «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции практически гомогенных антител, т.е. индивидуальные антитела, входящие в популяцию, идентичны и/или связываются с одним и тем же эпитопом, за исключением возможных вариантов антител, например, содержащих мутации, встречающиеся в естественных условиях или возникающие в процессе производства препарата моноклонального антитела, указанные варианты, как правило, присутствуют в минорных количествах. В отличие от препаратов поликлональных антител, которые, как правило, включают различные антитела к различным детерминантам (эпитопам), каждое моноклональное антитело из препарата моноклонального антитела направлено против одной детерминанты на антигене.
В контексте настоящего описания понятие «моноспецифическое» антитело означает антитело, которое имеет один или несколько сайтов связывания, каждый из которых связывается с одним и тем же эпитопом одного и того же антигена. Понятие «биспецифическая» означает, что антигенсвязывающая молекула обладает способностью специфически связываться по меньшей мере с двумя различными антигенными детерминантами. Как правило, биспецифическая антигенсвязывающая молекула содержит два антигенсвязывающих сайта, каждый из которых является специфическим в отношении различных антигенных детерминант. В некоторых вариантах осуществления изобретения биспецифическая антигенсвязывающая молекула обладает способностью одновременно связываться с двумя антигенными детерминантами, прежде всего с двумя антигенными детерминантами, экспрессируемыми на двух различных клетках. Биспецифическая антигенсвязывающая молекула, указанная в настоящем описании, может образовывать также часть мультиспецифического антитела.
В контексте настоящего описания понятие «валентность» означает наличие определенного количества сайтов связывания, специфических в отношении одной конкретной антигенной детерминанты в антигенсвязывающей молекуле, которая является специфической в отношении одной конкретной антигенной детерминанты. Таким образом, понятия «двухвалентная», «четырехвалентная» и «шестивалентная» означает присутствие двух сайтов связывания, четырех сайтов связывания и шести сайтов связывания, специфических в отношении определенной антигенной детерминанты соответственно в антигенсвязывающей молекуле. В конкретных объектах изобретения биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, могут являться одновалентными в отношении определенной антигенной детерминанты, это означает, что они имеют только один сайт связывания с указанной антигенной детерминантой, или они могут являться двухвалентными или четырехвалентными в отношении определенной антигенной детерминанты, это означает, что они имеют два сайта связывания или четыре сайта связывания с указанной антигенной детерминантой соответственно.
Понятия «полноразмерное антитело», «интактное антитело» и «цельное антитело» в контексте настоящего описания используют взаимозаменяемо для обозначения антитела, имеющего структуру, практически сходную с нативной структурой антитела. Понятие «нативные антитела» относится к встречающимся в естественных условиях молекулам иммуноглобулинов с различными структурами. Например, нативные антитела IgG-класса представляют собой гетеротетрамерные гликопротеины с молекулярной массой примерно 150000 Да, состоящие из двух идентичных легких цепей и двух идентичных тяжелых цепей, связанных дисульфидными мостиками. Начиная с N-конца к С-концу, каждая тяжелая цепь имеет вариабельную область (VH), которую называют также вариабельным тяжелым доменом или вариабельным доменом тяжелой цепи, за которой следует три константных домена (CH1, СН2 и CH3), которые называют также константной областью тяжелой цепи. Аналогично этому, начиная с N-конца к С-концу, каждая легкая цепь имеет вариабельную область (VL), которую называют также вариабельным легким доменом или вариабельным доменом легкой цепи, за которой следует константный домен легкой цепи (CL), который называют также константной областью легкой цепи. Тяжелая цепь антитела может относиться к одному из пяти типов, которые обозначают как α (IgA), δ (IgD), ε (IgE), γ (IgG) или μ (IgM), некоторые из которых можно дополнительно подразделять на подтипы, например, γ1 (IgG1), γ2 (IgG2), γ3 (IgG3), γ4 (IgG4), α1 (IgA1) и α2 (IgA2). Легкая цепь антитела может принадлежать к одному из двух типов, называемых каппа (κ) и лямбда (λ), в зависимости от аминокислотной последовательности ее константного домена.
Понятие «фрагмент антитела» относится к молекуле, отличной от интактного антитела, которая содержит часть интактного антитела, обладающую способностью связываться с антигеном, с которым связывается интактное антитело. Примерами фрагментов антител являются (но, не ограничиваясь только ими) Fv, Fab, Fab', Fab'-SH, F(ab')2, димерные антитела (диабоди), тримерные антитела (триабоди), тетрамерные антитела (тетрабоди), кросс-Fab-фрагменты; линейные антитела: одноцепочечные молекулы антител (например, scFv); и однодоменные антитела. Обзор некоторых фрагментов антител см., например, у Hudson и др., Nat Med 9, 2003, сс. 129-134. Обзор scFv-фрагментов см., например, у  в: The Pharmacology of Monoclonal Antibodies, т. 113, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, 1994, cc. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение Fab- и F(ab')2-фрагментов, содержащих остатки эпитопа, связывающегося с рецептором спасения, и обладающих удлиненным временем полужизни in vivo, см. в US №5869046. Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 404097; WO 1993/01161; Hudson и др., Nat Med 9, 2003, сс. 129-134; и Hollinger и др., Proc Natl Acad Sci USA 90, 1993, cc. 6444-6448. Тримерные и тетрамерные антитела описаны также у Hudson и др., Nat Med 9, 2003, сс. 129-134. Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Валтам, шт. Массачусетс; см., например, US №6248516 В1). Фрагменты антител можно создавать с помощью различных методик, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с использованием рекомбинантных клеток-хозяев (например, Е. coli или фага), как указано в настоящем описании.
в: The Pharmacology of Monoclonal Antibodies, т. 113, под ред. Rosenburg и Moore, изд-во Springer-Verlag, New York, 1994, cc. 269-315; см. также WO 93/16185; и US №№5571894 и 5587458. Обсуждение Fab- и F(ab')2-фрагментов, содержащих остатки эпитопа, связывающегося с рецептором спасения, и обладающих удлиненным временем полужизни in vivo, см. в US №5869046. Димерные антитела представляют собой фрагменты антител с двумя антигенсвязывающими сайтами, которые могут быть двухвалентными или биспецифическими (см., например, ЕР 404097; WO 1993/01161; Hudson и др., Nat Med 9, 2003, сс. 129-134; и Hollinger и др., Proc Natl Acad Sci USA 90, 1993, cc. 6444-6448. Тримерные и тетрамерные антитела описаны также у Hudson и др., Nat Med 9, 2003, сс. 129-134. Однодоменные антитела представляют собой фрагменты антител, содержащие весь вариабельный домен тяжелой цепи или его часть или весь вариабельный домен легкой цепи антитела или его часть. В некоторых вариантах осуществления изобретения однодоменное антитело представляет собой человеческое однодоменное антитело (фирма Domantis, Inc., Валтам, шт. Массачусетс; см., например, US №6248516 В1). Фрагменты антител можно создавать с помощью различных методик, включая (но, не ограничиваясь только ими) протеолитическое расщепление интактного антитела, а также получать с использованием рекомбинантных клеток-хозяев (например, Е. coli или фага), как указано в настоящем описании.
Расщепление интактных антител папаином приводит к образованию двух идентичных антигенсвязывающих фрагментов, которые называют «Fab»-фрагментами, каждый из которых содержит вариабельные домены тяжелой и легкой цепей, а также константный домен легкой цепи и первый константный домен (CH1) тяжелой цепи. В контексте настоящего описания понятие «Fab-фрагмент» относится к фрагменту антитела, содержащему фрагмент легкой цепи, который содержит VL-домен и константный домен легкой цепи (CL), и VH-домен и первый константный домен (СН1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксильный конец СН1-домена тяжелой цепи, включая один или несколько остатков цистеина из шарнирной области антитела. Fab'-SH обозначает Fab'-фрагменты, в которых остаток(ки) цистеина константных доменов несет(ут) свободную тиольную группу. Обработка пепсином позволяет получать F(ab')2-фрагменты, которые имеют два антигенсвязывающих сайта (два Fab-фрагмента) и часть Fc-области. Согласно настоящему изобретению понятие «Fab-фрагмент» включает также «кросс-Fab-фрагменты» или «кроссовер-Fab-фрагменты», описанные ниже.
Понятие «кросс-Fab-фрагмент» или «xFab-фрагмент» или «кроссовер-Fab-фрагмент» относится к Fab-фрагменту, в котором обменены либо вариабельные области, либо константные области тяжелой цепи и легкой цепи. Возможны две различные композиции цепи молекулы кросс-Fab, и они могут входить в биспецифические антитела, предлагаемые в изобретении: с одной стороны, имеет место обмен вариабельными областями тяжелой и легкой цепи Fab, т.е. кроссовер-молекула Fab содержит пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1), и пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL). Указанную кроссовер-молекулу Fab обозначают также как CrossFab(VLVH). С другой стороны, когда друг на друга обменены константные области тяжелой и легкой цепей Fab, то кроссовер-молекула Fab содержит пептидную цепь, состоящую из вариабельной области тяжелой цепи (VH) и константной области легкой цепи (CL), и пептидную цепь, состоящую из вариабельной области легкой цепи (VL) и константной области тяжелой цепи (СН1). Указанную кроссовер-молекулу Fab обозначают также как CrossFab(CLCH1).
«Одноцепочечный Fab-фрагмент» или «scFab» представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи (VH) антитела, константного домена 1 (СН1) антитела, вариабельного домена легкой цепи (VL) антитела, константного домена легкой цепи (CL) антитела и линкера, в котором указанные домены антитела и указанный линкер имеют один из следующих порядков расположения в направлении от N-конца к С-концу: a) VH-CH1-линкер-VL-CL, б) VL-CL-линкер-VH-СН1, в) VH-CL-линкер-VL-CH1 или г) VL-СН1-линкер-VH-CL; и в котором указанный линкер представляет собой полипептид, состоящий по меньшей мере из 30 аминокислот, предпочтительно примерно от 32 до 50 аминокислот. Указанные одноцепочечные Fab-фрагменты стабилизируют с помощью встречающейся в естественных условиях дисульфидной связи между CL-доменом и CH1-доменом. Кроме того, указанные одноцепочечные молекулы Fab можно дополнительно стабилизировать посредством создания межцепочечных дисульфидных связей путем встраивания остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи согласно нумерации Кэбота).
«Одноцепочечный кроссовер-Fab-фрагмент» или «х-scFab» представляет собой полипептид, состоящий из вариабельного домена тяжелой цепи антитела (VH), константного домена 1 (СН1) антитела, вариабельного домена легкой цепи (VL) антитела, константного домена легкой цепи (CL) антитела и линкера, в котором указанные домены антитела и указанный линкер имеют один из следующих порядков расположения в направлении от N-конца к С-концу: a) VH-CL-линкер-VL-СН1 и б) VL-СН1-линкер-VH-CL; в котором VH и VL образуют вместе антигенсвязывающий сайт, который связывается специфически с антигеном, и в котором указанный линкер представляет собой полипептид, состоящий по меньшей мере из 30 аминокислот. Кроме того, указанные молекулы x-scFab можно дополнительно стабилизировать путем создания внутрицепочечных дисульфидных связей путем инсерции остатков цистеина (например, в положение 44 в вариабельной тяжелой цепи и в положение 100 в вариабельной легкой цепи согласно нумерации Кэбота).
«Одноцепочечный вариабельный фрагмент (scFv)» представляет собой слитый белок вариабельных областей тяжелой (VH) и легкой (VL) цепей антитела, соединенных коротким линкерным пептидом, который содержит от 10 до примерно 25 аминокислот. Линкер, как правило, представляет собой богатый глицином линкер для придания гибкости, а также богатый серином или треонином линкер для обеспечения растворимости, и он может соединять либо N-конец VH с С-концом VL, либо наоборот. Указанный белок сохраняет специфичность исходного антитела, несмотря на удаление константных областей и интродукцию линкера. Антитела в виде scFv описаны, например, у Houston J.S., Methods in Enzymol. 203, 1991, cc. 46-96. Кроме того, фрагменты антител содержат одноцепочечные полипептиды, которые имеют характеристики VH-домена, а именно, обладают способностью к сборке с VL-доменом, или характеристики VL, а именно, обладают способностью к сборке с VH-доменом с образованием антигенсвязывающего сайта, и тем самым обладают антигенсвязывающим свойством полноразмерных антител.
«Антигенсвязывающие белки-каркасы (скаффолд-белки)») известны в данной области, например, фибронектин и созданные содержащие анкириновые повторы белки (DARPin), применяли в качестве альтернативных каркасов для антигенсвязывающих доменов (см. Gebauer и Skerra, Engineered protein scaffolds as next-generation antibody Therapeutics. Curr Opin Chem Biol 13, 2009, cc. 245-255 и Stumpp и др., Darpins: A new generation of protein Therapeutics. Drug Discov Today 13, 2008, cc. 695-701). В одном из объектов изобретения антигенсвязывающий белок-каркас выбран из группы, включающей CTLA-4 (эвибоди (Evibody)), липокалины (антикалин (Anticalin)), полученную из белка А молекулу, такую как Z-домен белка A (Affibody, SpA), А-домен (авимер/максибоди (Avimer/Maxibody)), сывороточный трансферрин (транс-боди), сконструированный белок, содержащий анкириновые повторы (DARPin), вариабельный домен легкой цепи или тяжелой цепи антитела (однодоменное антитело, sdAb), вариабельный домен тяжелой цепи антитела (нанободи, aVH), VNAR-фрагменты, фибронектин (аднектин (AdNectin)), лектиновый домен С-типа (тетранектин), вариабельный домен нового антигенного рецептора бета-лактамазы (VNAR-фрагменты), человеческий гамма-кристаллин или убиквитин (молекулы-аффилины (Affilin), домен Кунитц-типа человеческих ингибиторов протеаз, микрободи, такие как белки из семейства knottin (кноттины, ингибиторы цистеинового узла), пептидные аптамеры и фибронектин (аднектин). CTLA-4 (ассоциированный с цитотоксическими Т-лимфоцитами антиген 4) относится к CD28-семейству рецепторов, которые главным образом экспрессируются на CD4+ Т-клетках. Его внеклеточный домен имеет укладку, напоминающую укладку вариабельного домена Ig. Петли, соответствующие CDR антител, можно заменять на гетерологичную последовательность для придания различных связывающих свойств. Молекулы CTLA-4, сконструированные таким образом, что они обладают различными связывающими специфичностями, известны также как эвибоди (см., например, US №7166697 В1). Эвибоди имеют примерно такой же размер, что и выделенная вариабельная область антитела (например, доменного антитела. Дополнительные сведения см. в Journal of Immunological Methods 248 (1-2), 2001, cc. 31-45. Липокалины относятся к семейству внеклеточных белков, которые транспортируют малые гидрофобные молекулы, такие как стероиды, билины, ретиноиды и липиды. Они имеют жесткую вторичную структуру в виде бета-складки с рядом петель на открытом конце конической структуры, их можно создавать для связывания с различными антигенами-мишенями. Антикалины состоят из 160-180 аминокислот и их получают из липокалинов. Дополнительные сведения см. в Biochim Biophys Acta 1482, 2000, cc. 337-350, в US №7250297 B1 и US №2007/0224633. Аффибоди представляет собой каркас, полученный из белка A Staphylococcus aureus, который можно создавать для связывания с антигеном. Домен состоит из трехспирального пучка, содержащего примерно 58 аминокислот. Их библиотеки были созданы путем рандомизации поверхностных остатков. Дополнительные сведения см. в Protein Eng. Des. SeI. 17, 2004, cc. 455-462 и ЕР 1641818 A1. Авимеры представляют собой мультидоменные белки, полученные из А-домена семейства белков-каркасов. Нативные домены, состоящие примерно из 35 аминокислот, адаптируют определенную связанную дисульфидами структуру. Разнообразие создают путем «перестановки» встречающихся в естественных условиях вариаций, характерных для семейства А-доменов. Дополнительные сведения см. в Nature Biotechnology 23(12), 2005, cc. 1556-1561 и Expert Opinion on Investigational Drugs 16(6), июнь 2007, cc. 909-917. Трансферрин представляет собой мономерный сывороточный транспортный гликопротеин. Трансферрины можно создавать для связывания с различными антигенами-мишенями путем встраивания пептидных последовательностей в приемлемую поверхностную петлю. Примеры сконструированных трансферинновых каркасов включают транс-боди. Дополнительные сведения см. в J. Biol. Chem 274, 1999, cc. 24066-24073. Сконструированные белки, содержащие анкириновые повторы (DARPin), получают из анкирина, который относится к семейству белков, опосредующих присоединение интегральных мембранных белков к цитоскелету. Один анкириновый повтор представляет собой состоящий из 33 остатков мотив, включающий две альфа-спирали и бета-изгиб. Их можно создавать для связывания с различными антигенами-мишенями путем рандомизации остатков в первой альфа-спирали и бета-изгибе каждого повтора. Их связывающую поверхность раздела можно увеличивать путем увеличения количества модулей (метод созревания аффинности). Дополнительные сведения см. в J. MoI. Biol. 332, 2003, сс. 489-503, PNAS 100(4), 2003, сс. 1700-1705 и J. MoI. Biol. 369, 2007, сс. 1015-1028, а также в US №2004/0132028 А1. Однодоменное антитело представляет собой фрагмент антитела, состоящий из единичного мономерного вариабельного домена антитела. Впервые единичный домен был получен из вариабельного домена тяжелой цепи антитела верблюдов (нанабоди или VHH-фрагменты). Кроме того, понятие «однодоменное антитело» включает автономный вариабельный домен человеческой тяжелой цепи (aVH) или VNAR-фрагменты, полученные из акул. Фибронектин представляет собой каркас, который можно создавать для связывания антигена. Аднектины состоят из каркаса из встречающейся в естественных условиях аминокислотной последовательности 10-го домена из 15 повторяющихся единиц человеческого фибронектина типа III (FN3). Можно создавать три петли на одном конце «бета-сэндвича», что позволяет аднектину специфически распознавать представляющую интерес терапевтическую мишень. Дополнительные сведения см. в Protein Eng. Des. SeI. 18, 2005, cc. 435-444, US №2008/0139791, WO 2005/056764 и US №6818418 B1. Пептидные аптамеры представляют собой комбинаторные распознающие молекулы, которые состоят из константного белка-каркаса, как правило, тиоредоксина (TrxA), который содержит ограниченную вариабельную пептидную петлю, встроенную в активный сайт. Дополнительные сведения см. в Expert Opin. Biol. THER. 5, 2005, cc. 783-797. Микрободи получают из встречающихся в естественных условиях микробелков, состоящих из 25-50 аминокислот, которые содержат 3-4 цистеиновых мостика - примеры микробелков включают KalataBI и конотоксин и кноттины. Микробелки имеют петлю, которую можно подвергать инженерии таким образом, чтобы она включала вплоть до 25 аминокислот, без воздействия на общую укладку микробелка. Дополнительные сведения о создании кноттин-доменов см. в WO 2008/098796.
Понятие «антигенсвязывающая молекула, которая связывается с таким же эпитопом», что и референс-молекула, относится к антигенсвязывающей молекуле, которая блокирует связывание референс-молекулы с ее антигеном на 50% или более при оценке в условиях конкуренции, и, наоборот, референс-молекула блокирует связывание антигенсвязывающей молекулы с ее антигеном на 50% или более при оценке в условиях конкуренции.
Понятие «антигенсвязывающий домен» или «антигенсвязывающий сайт» относится к части антигенсвязывающей молекулы, которая содержит область, специфически связывающуюся и являющуюся комплементарной части антигена или полному антигену. Если антиген является крупным, то антигенсвязывающая молекула может связываться только с конкретной частью антигена, которую называют эпитопом. Антигенсвязывающий домен может представлять собой, например, один или несколько вариабельных доменов антитела (которые называют также вариабельными областями). Предпочтительно антигенсвязывающий домен содержит вариабельную область легкой цепи (VL) антитела и вариабельную область тяжелой цепи (VH) антитела.
В контексте настоящего описания понятие «антигенная детерминанта» является синонимом понятий «антиген» и «эпитоп» и относится к сайту (например, участку, состоящему из смежных аминокислот, или конформационной конфигурации, состоящей из различных областей несмежных аминокислот) на полипептидной макромолекуле, с которой связывается антигенсвязывающий фрагмент с образованием комплекса антигенсвязывающий фрагмент-антиген. Пригодные антигенные детерминанты могут присутствовать, например, на поверхности опухолевых клеток, на поверхности инфицированных вирусом клеток, на поверхности других больных клеток, на поверхности иммунных клеток, клеток, находящихся в свободном состоянии в сыворотке крови и/или во внеклеточном матриксе (ЕСМ). Белки, которые можно применять в качестве антигенов в настоящем изобретении, если не указано иное, могут представлять собой любые нативные формы белков из любого применяемого в качестве источника позвоночного животного, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). В конкретном варианте осуществления изобретения антиген представляет собой человеческий белок. В контексте настоящего описания при ссылке на конкретный белок подразумевается «полноразмерный», непроцессированный белок, а также любая форма белка, полученная в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты белка, например, сплайсинговые варианты или аллельные варианты.
Понятие «специфически связывается» означает, что связывание является избирательным в отношении антигена и его можно отличать от нежелательных или неспецифических взаимодействий. Способность антигенсвязывающей молекулы связываться со специфическим антигеном можно определять с помощью твердофазного иммуноферментного анализа (ELISA) или других методик, известных специалисту в данной области, например, с помощью методики на основе поверхностного плазмонного резонанса (осуществляя анализ с помощью устройства BIAcore) (Liljeblad и др., Glyco J 17, 2000, сс. 323-329), и традиционных анализов связывания (Heeley, Endocr Res 28, 2002, сс. 217-229). В одном из вариантов осуществления изобретения уровень связывания антигенсвязывающей молекулы с неродственным белком составляет менее чем примерно 10% от уровня связывания антигенсвязывающей молекулы с антигеном, при измерении, например, с помощью SPR. В некоторых вариантах осуществления изобретения молекула, которая связывается с антигеном, характеризуется величиной константы диссоциации (KD), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-8 М или менее, например, от 10-8 М до 10-13 М, например, от 10-9 М до 10-13 М).
Понятие «аффинность» или «аффинность связывания» относится к суммарной силе всех нековалентных взаимодействий между индивидуальным сайтом связывания молекулы (например, антитела) и ее партнера по связыванию (например, антигена). Если не указано иное, то в контексте настоящего описания понятие «аффинность связывания» относится к присущей компонентам связывающейся пары (например, антителу и антигену) аффинности связывания, отражающей взаимодействие по типу 1:1. Аффинность молекулы X к ее партнеру Y можно, как правило, характеризовать с помощью константы диссоциации (KD), которая представляет собой отношение констант скорости реакции диссоциации и ассоциации (koff и kon соответственно). Таким образом, эквивалентные аффинности могут соответствовать различным константам скорости, если соотношение констант скорости остается таким же. Аффинность можно оценивать общепринятыми методами, известными в данной области, включая представленные в настоящем описании методы. Конкретным методом измерения аффинности является метод поверхностного плазмонного резонанса (SPR).
Антитело «с созревшей аффинностью» относится к антителу с одним или несколькими изменения в одном или нескольких гиперварибельных участках (HVR) по сравнению с родительским антителом, которое не несет указанных изменений, указанные изменения приводят к повышению аффинности антитела к антигену.
В контексте настоящего описания понятие «антиген клетки-мишени» относится к антигенной детерминанте, присутствующей на поверхности клетки-мишени, прежде всего клетки-мишени в опухоли, такой как раковая клетка или клетка стромы опухоли. Таким образом, антиген клетки-мишени представляет собой ассоциированный с опухолью антиген. В частности, антиген клетки-мишени не включает рецепторы иммунных контрольных точек на активированных Т-клетках, такие как CTLA-4, PD-1 или PD-L1. В некоторых вариантах осуществления изобретения антиген клетки-мишени представляет собой антиген на поверхности опухолевой клетки. В одном из объектов изобретения антиген клетки-мишени выбирают из группы, включающей фибробласт-активирующий белок (FAP), карциноэмбриональный антиген (CEA), ассоциированный с меланомой хондроитинсульфат-протеогликан (MCSP), рецептор эпидермального фактора роста (EGFR), CD19, CD20 и CD33. В частности, антиген клетки-мишени представляет собой фибробласт-активирующий белок (FAP).
Понятие «фибробласт-активирующий белок (FAP)», известный также как пролилэндопептидаза FAP или сепраза (КФ 3.4.21), если не указано иное, относится к любой нативной форме FAP из любого применяемого в качестве источника позвоночного животного, включая млекопитающих, таких как приматы (например, люди), приматы кроме человека (например, обезьяны циномолгус (яванский макак-крабоед) и грызуны (например, мыши и крысы). Понятие относится к полноразмерному непроцессированному FAP, а также к любой форме FAP, полученной в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты FAP, например, сплайсинговые варианты или аллельные варианты. В одном из вариантов осуществления изобретения антигенсвязывающая молекула, предлагаемая в изобретении, обладает способностью специфически связываться с FAP человека, мышей и/или обезьян циномолгус. Аминокислотная последовательность человеческого FAP представлена в UniProt (www.uniprot.org), код доступа № Q12884 (версия 149, SEQ ID NO: 2) или в NCBI (www.ncbi.nlm.nih.gov/) RefSeq NP_004451.2. Внеклеточный домен (ECD) человеческого FAP простирается от аминокислотного положения 26 до 760. Аминокислотная последовательности меченного His человеческого FAP-ECD представлена в SEQ ID NO: 142. Аминокислотная последовательность мышиного FAP представлена в UniProt, код доступа № Р97321 (версия 126, SEQ ID NO: 143) или NCBI RefSeq NP_032012.1. Внеклеточный домен (ECD) мышиного FAP простирается от аминокислотного положения 26 до 761. В SEQ ID NO: 144 представлена аминокислотная последовательности меченного His мышиного FAP-ECD. В SEQ ID NO: 145 представлена аминокислотная последовательность меченного His FAP-ECD обезьян циномолгус. Предпочтительно анти-FAP-связывающая молекула, предлагаемая в изобретении, связывается с внеклеточным доменом FAP.
Понятие «вариабельная область» или «вариабельный домен» относится к домену тяжелой или легкой цепи антитела, который участвует в связывании антигенсвязывающей молекулы с антигеном. Вариабельные домены тяжелой цепи и легкой цепи (VH и VL соответственно) нативного антитела, как правило, имеют сходные структуры, при этом каждый домен содержит четыре консервативных каркасных участка (FR) и три гипервариабельных участка (HVR) (см., например, Kindt и др., Kuby Immunology, 6-ое изд., изд-во W.H. Freeman and Co., 2007, с. 91). Одного VH- или VL-домена может быть достаточно для обеспечения специфичности связывания антигена.
Понятие «гипервариабельный участок» или «HVR» в контексте настоящего описания относится к каждому из участков вариабельного домена антитела, последовательности которых являются гипервариабельными, и/или которые образуют структуры в виде петель («гипервариабельные петли»). Как правило, нативные четырехцепочечные антитела содержат шесть HVR; три в VH (H1, Н2, Н3) и три в VL (L1, L2, L3). HVR, как правило, содержат аминокислотные остатки из гипервариабельных петель и/или из «определяющих комплементарность участков» (CDR), последние отличаются наиболее выраженной вариабельностью последовательности и/или участвуют в распознавании антигенов. Приведенные в качестве примера гипервариабельные петли включают аминокислотные остатки 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (Н2), и 96-101 (Н3) (Chothia и Lesk, J. Mol. Biol. 196, 1987, cc. 901-917). Приведенные в качестве примера CDR (CDR-L1, CDR-L2, CDR-L3, CDR-H1, CDR-H2 и CDR-H3) включают аминокислотные остатки 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35В (H1), 50-65 (Н2) и 95-102 (Н3) (Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991). Гипервариабельные участки (HVR) часто обозначают как «определяющие комплементарность участки» (CDR), и эти понятия в контексте настоящего описания используют взаимозаменяемо, и они относятся к участкам вариабельной области, которые образуют антигенсвязывающие области. Эта конкретная область описана у Kabat и др., U.S. Dept. of Health and Human Services, «Sequences of Proteins of Immunological Interest», 1983 и у Chothia и др., J. Mol. Biol. 196, 1987, cc. 901-917, причем эти определения относятся к перекрывающимся аминокислотным остаткам или поднаборам аминокислотных остатков при их сравнении друг с другом. Однако в контексте настоящего описания подразумевается возможность применения любого определения CDR антитела или его вариантов. Соответствующие аминокислотные остатки, из которых состоят CDR, как они определены в каждой из процитированных выше ссылок, представлены в сравнении ниже в таблице А. Точные номера остатков, которые образуют конкретный CDR, должны варьироваться в зависимости от последовательности и размера CDR. Специалисты в данной области на основе данных об аминокислотной последовательности вариабельной области антитела легко могут определять, какие остатки входят в конкретный CDR.
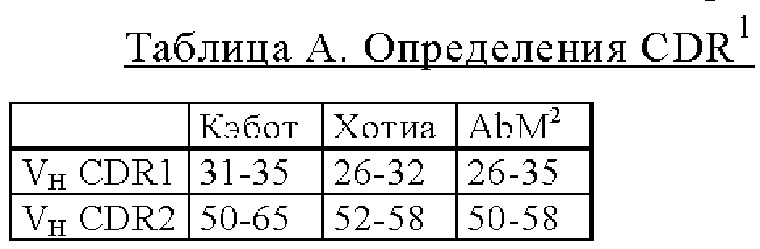

Кэбот с соавторами предложили также систему нумерации (номенклатуру) последовательностей вариабельных областей, которую можно применять для любого антитела. Обычный специалист в данной области может однозначно применять эту систему «нумерации по Кэботу» к любой последовательности вариабельной области, не имея никаких экспериментальных данных, кроме сведений о самой последовательности. В контексте настоящего описания понятие «нумерация по Кэботу» относится к системе нумерации, описанной у Kabat и др., «Sequence of Proteins of Immunological Interest», изд-во U.S. Dept. of Health and Human Services, 1983. Если не указано иное, то ссылки на нумерацию положений конкретных аминокислотных остатков в вариабельной области антитела даны в соответствии с системой нумерации по Кэботу.
За исключением CDR1 в VH, CDR, как правило, содержат аминокислотные остатки, которые образуют гипервариабельные петли. CDR содержат также «определяющие специфичность остатки» или «SDR», которые представляют собой остатки, контактирующие с антигеном. SDR, содержащиеся в областях CDR, обозначают как укороченные -CDR или a-CDR. Приведенные в качестве примера a-CDR (a-CDR-L1, a-CDR-L2, a-CDR-L3, a-CDR-H1, a-CDR-H2 и a-CDR-H3) содержат аминокислотные остатки 31-34 (L1), 50-55 (L2), 89-96 (L3), 31-35B (H1), 50-58 (H2) и 95-102 (Н3) (см. Almagro и Fransson, Front. Biosci. 13, 2008, cc. 1619-1633). Если не указано иное, остатки HVR и другие остатки в вариабельном домене (например, остатки FR) в настоящем описании нумеруют согласно Kabat и др., выше.
«Каркасные участки» или «FR» представляют собой участки вариабельных доменов, отличные от остатков гипервариабельных участков (HVR). FR вариабельного домена, как правило, представлены четырьмя FR-доменами: FR1, FR2, FR3 и FR4. Таким образом, последовательности HVR и FR, как правило, расположены в VH (или VL) в следующем порядке: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
Понятие «химерное» антитело относится к антителу, в котором часть тяжелой и/или легкой цепи происходит из конкретного источника или конкретного вида, а остальная часть тяжелой и/или легкой цепи происходит из другого источника или другого вида.
Понятие «класс» антитела относится к типу константного домена или константной области, входящего/входящей в тяжелую цепь. Существует пять основных классов антител: IgA, IgD, IgE, IgG и IgM, а некоторые из них можно дополнительно подразделять на подклассы (изотипы), например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Константные домены тяжелых цепей, соответствующие различным классам иммуноглобулинов, обозначают как α, δ, ε, γ и μ соответственно.
Понятие «гуманизированное» антитело относится к химерному антителу, которое содержит аминокислотные остатки из нечеловеческих HVR и аминокислотные остатки из человеческих FR. В некоторых вариантах осуществления изобретения гуманизированное антитело может содержать практически все из по меньшей мере одного и, как правило, двух вариабельных доменов, в которых все или практически все HVR (например, CDR) соответствуют участкам нечеловеческого антитела, а все или практически все FR соответствуют участкам человеческого антитела. Гуманизированное антитело необязательно может содержать по меньшей мере часть константной области антитела, происходящей из человеческого антитела. Понятие «гуманизированная форма» антитела, например, нечеловеческого антитела, относится к антителу, которое подвергали гуманизации. Другие формы «гуманизированных антител», подпадающие под объем настоящего изобретения, представляют собой антитела, в которых константная область дополнительно модифицирована или изменена по сравнению с исходным антителом для создания свойств, которые требуются согласно изобретению, прежде всего касательно связывания с C1q и/или связывания с Fc-рецептором (FcR).
«Человеческое антитело» представляет собой антитело, которое имеет аминокислотную последовательность, соответствующую последовательности антитела, продуцируемого человеком или человеческой клеткой, или полученную из источника, отличного от человека, с использованием спектра человеческих антител или других кодирующих человеческое антитело последовательностей. Из указанного определения человеческого антитела специально исключено гуманизированное антитело, содержащее нечеловеческие антигенсвязывающие остатки.
В контексте настоящего описания понятие «Fc-домен» или «Fc-область» относится к С-концевой области тяжелой цепи антитела, которая содержит по меньшей мере часть константной области. Понятие относится к нативной последовательности Fc-областей и вариантам Fc-областей. Fc-область IgG содержит СН2-домен IgG и СН3-домен IgG. «СН2-домен» Fc-области человеческого IgG, как правило, простирается от аминокислотного остатка, находящегося примерно в положении 231, до аминокислотного остатка, находящегося примерно в положении 340. В одном из вариантов осуществления изобретения к СН2-домену присоединена углеводная цепь. В контексте настоящего описания СН2-домен может иметь нативную последовательность СН2-домена или последовательность варианта СН2-домена. «СН3-домен» содержит сегмент С-концевых остатков до СН2-домена в Fc-области (т.е. от аминокислотного остатка, находящегося примерно в положении 341, до аминокислотного остатка, находящегося примерно в положении 447 IgG). В контексте настоящего описания СН3-домен может иметь нативную последовательность СН3-домена или последовательность варианта СН3-домена (например, СН3-домен с интродуцированной «выпуклостью» («выступ») в одной его цепи и с соответствующей интродуцированной «полостью» («впадина») в другой его цепи; см. US №5821333, специально включенный в настоящее описание в качестве ссылки). Указанные варианты СН3-доменов можно применять для усиления гетеродимеризации двух неидентичных тяжелых цепей антитела, согласно методу, указанному в настоящем описании. В одном из вариантов осуществления изобретения Fc-область тяжелой цепи человеческого IgG простирается от Cys226 или от Pro230 до карбоксильного конца тяжелой цепи. Однако С-концевой лизин (Lys447) Fc-области может либо присутствовать, либо отсутствовать. Если специально не указано иное, то нумерация аминокислотных остатков в Fc-области или константном участке соответствует системе EU-нумерации, которую называют также EU-индексом, описанной у Kabat и др., Sequences of Proteins of Immunological Interest, 5-oe изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
Технология «knob-into-hole» описана, например, в US №5731168; US №7695936; у Ridgway и др., Prot Eng 9, 1996, cc. 617-621 и Carter, J Immunol Meth 248, 2001, cc. 7-15. В целом, метод включает интродукцию выпуклости («выступ») на поверхности раздела первого полипептида и соответствующей полости («впадина») в поверхности раздела второго полипептида, в результате выпуклость может помещаться в полость, усиливая тем самым образование гетеродимера и препятствуя образованию гомодимера. Выпуклости конструируют путем замены аминокислот с небольшими боковыми цепями на поверхности раздела первого полипептида на аминокислоты с более крупными боковыми цепями (например, на тирозин или триптофан). Компенсирующие полости идентичного или сходного с выпуклостями размера конструируют в поверхности раздела второго полипептида путем замены аминокислот с крупными боковыми цепями на аминокислоты с менее крупными боковыми цепями (например, аланин или треонин). Выпуклость и полость можно создавать, изменяя нуклеиновую кислоту, которая кодирует полипептиды, например, с помощью сайтспецфического мутагенеза или с использованием пептидного синтеза. В конкретном варианте осуществления изобретения модификация, приводящая к образованию «выступа», включает аминокислотную замену T366W в одной из двух субъединиц Fc-домена, и модификация, приводящая к образованию «впадины», включает аминокислотные замены T366S, L368A и Y407V в другой одной из двух субъединиц Fc-домена. В другом конкретном варианте осуществления изобретения субъединица Fc-домена, которая содержит модификацию, приводящую к образованию «выступа», дополнительно содержит аминокислотную замену S354C, а субъединица Fc-домена, которая содержит модификацию, приводящую к образованию «впадины», дополнительно содержит аминокислотную замену Y349C. Интродукция этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-домена, дополнительно стабилизирующего димер (Carter, J Immunol Methods 248, 2001, cc. 7-15).
Подразумевается, что «область, эквивалентная Fc-области иммуноглобулина» включает встречающиеся в естественных условиях аллельные варианты Fc-области иммуноглобулина, а также варианты, имеющие изменения, приводящие к заменам, добавлениям или делециям, которые не снижают существенно способность иммуноглобулина опосредовать эффекторные функции (такие как антитело-обусловленная клеточнозависимая цитотоксичность). Например, одну или несколько аминокислот можно изымать путем делеции из N-конца или С-конца Fc-области иммуноглобулина без существенного снижения биологической функции. Указанные варианты можно выбирать согласно общим правилам, известным в данной области, так, чтобы оказывать минимальное воздействие на активность (см., например Bowie J.U. и др., Science 247, 1990, cc. 1306-1310).
Понятие «эффекторные функции» относится к видам биологической активности, присущим Fc-области антитела, которые варьируются в зависимости от изотипа антитела. Примерами эффекторных функций антитела являются: способность связываться с C1q и комплементзависимая цитотоксичность (CDC), способность связываться с Fc-рецептором, антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), секреция цитокинов, опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, понижающая регуляция рецепторов клеточной поверхности (например, В-клеточного рецептора) и активация В-клеток.
Зависящие от связывания Fc-рецептора эффекторные функции могут опосредоваться взаимодействием Fc-области антитела с Fc-рецепторами (FcR), которые представляют собой специализированные рецепторы клеточной поверхности гематопоэтических клеток. Fc-рецепторы принадлежат к суперсемейству иммуноглобулинов и, как установлено, опосредуют как удаление «покрытых» антителом патогенов путем фагоцитоза иммунных комплексов, так и лизис эритроцитов и различных других клеточных мишеней (например, опухолевых клеток), «покрытых» соответствующим антителом посредством антитело-обусловленной клеточнозависимой цитотоксичности (ADCC) (см., например, Van de Winkel J.G. и Anderson C.L., J. Leukoc. Biol. 49, 1991, cc. 511-524). FcR классифицируют на основе их специфичности в отношении изотипов иммуноглобулинов: Fc-рецепторы для антител IgG-тип обозначают как FcγR. Связывание с Fc-рецепторами описано, например, у Ravetch J.V. и Kinet J.P., Annu. Rev. Immunol. 9, 1991, cc. 457-492; Capel P.J. и др., Immunomethods 4, 1994, cc. 25-34; de Haas M. и др., J. Lab. Clin. Med. 126, 1995, cc. 330-341; и Gessner J.E. и др., Ann. Hematol. 76, 1998, cc. 231-248.
Перекрестное сшивание рецепторов для Fc-области антител IgG-класса (FcγR) запускает широкое разнообразие эффекторных функций, включая фагоцитоз, антитело-обусловленную клеточнозависимую цитотоксичность и высвобождение медиаторов воспаления, а также клиренс иммунного комплекса и регуляцию производства антител. У человека охарактеризовано три следующих класса FcγR:
- FcγRI (CD64) связывается с мономерным IgG с высокой аффинностью и экспрессируется на макрофагах, моноцитах, нейтрофилах и эозинофилах. Модификация в Fc-области IgG по меньшей мере одного из аминокислотных остатков E233-G236, Р238, D265, N297, А327 и Р329 (нумерация согласно EU-индексу Кэбота) снижает связывание с FcγRI. Остатки в IgG2 в положениях 233-236, замененные на остатки, присутствующие в IgG1 и IgG4, снижают связывание с FcγRI в 103 раз и элиминируют ответ человеческих моноцитов на сенсибилизированные антителом эритроциты (Armour K.L. и др., Eur. J. Immunol. 29, 1999, сс. 2613-2624).
- FcγRII (CD32) связывается с входящим в комплекс IgG с аффинностью от средней до низкой и характеризуется широким спектром экспрессии. Этот рецептор можно подразделять на два подтипа, FcγRIIA и FcγRIIB. FcγRIIA обнаружен на многих клетках, участвующих в цитолизе (например, макрофаги, макроциты, нейтрофилы) и, вероятно, может активировать процесс цитолиза. FcγRIIB, вероятно, играет роль в процессах ингибирования и обнаружен на В-клетках, макрофагах и тучных клетках и эозинофилах. На В-клетках его функцией, вероятно, является подавление дополнительного производства иммуноглобулинов и переключение изотипа, например, на IgE-класс. На макрофагах действие FcγRIIB заключается в ингибировании фагоцитоза, опосредуемого FcγRIIA. На эозинофилах и тучных клетках В-форма может способствовать подавлению активации этих клеток через IgE-связывание с его отдельным рецептором. Пониженное связывание FcγRIIA обнаружено, например, у антител, содержащих Fc-область IgG с мутациями по меньшей мере одного из аминокислотных остатков E233-G236, Р238, D265, N297, А327, Р329, D270, Q295, А327, R292 и K414 (нумерация согласно EU-индексу Кэбота).
- FcγRIII (CD16) связывается с IgG с аффинностью от средней до низкой и существует в виде двух типов. FcγRIIIA обнаружен на NK-клетках, макрофагах, эозинофилах и некоторых моноцитах и на Т-клетках и опосредует ADCC. Для FcγRIIIB характерен высокий уровень экспрессии на нейтрофилах. Пониженное связывание с FcγRIIIA обнаружено, например, у антител, которые содержат Fc-область IgG с мутацией по меньшей мере одного из аминокислотных остатков E233-G236, Р238, D265, N297, А327, Р329, D270, Q295, А327, S239, Е269, Е293, Y296, V303, А327, K338 и D376 (нумерация согласно EU-индексу Кэбота).
Картирование сайтов связывания на человеческом IgG1 для Fc-рецепторов, указанные выше сайты мутации и методы измерения связывания с FcγRI и FcγRIIA описаны у Shields R.L. и др., J. Biol. Chem. 276, 2001, cc. 6591-6604.
Понятие «ADCC» или «антитело-обусловленная клеточнозависимая цитотоксичность» относится к функции, опосредуемой связыванием с Fc-рецептором, и относится к лизису клеток-мишеней антителом, указанным в настоящем описании, в присутствии эффекторных клеток. Способность антитела индуцировать начальные стадии, опосредующие ADCC, изучают путем измерения их связывания с экспрессирующими Fcγ-рецепторы клетками, такими как клетки, рекомбинантно экспрессирующие FcγRI и/или FcγRIIA, или NK-клетки (экспрессирующие в основном FcγRIIIA). В частности, измеряют связывание с FcγR на NK-клетках.
«Активирующий Fc-рецептор» представляет собой Fc-рецептор, который после взаимодействия с Fc-областью антитела осуществляет процесс передачи сигналов, которые стимулируют осуществление несущей рецептор клеткой эффекторных функций. Активирующие Fc-рецепторы включают FcγRIIIa (CD16a), FcγRI (CD64), FcγRIIa (CD32) и FcαRI (CD89). Конкретный активирующий Fc-рецептор представляет собой человеческий FcγRIIIa (см. UniProt, код доступа № Р08637, версия 141).
В контексте настоящего описания понятие «CD40», если не указано иное, относится к любой нативной форме CD40 из любого применяемого в качестве источника позвоночного животного, включая млекопитающих, таких как приматы (например, люди) и грызуны (например, мыши и крысы). Понятие относится к полноразмерному непроцессированному CD40, а также к любой форме CD40, полученной в результате процессинга в клетке. Под понятие подпадают также встречающиеся в естественных условиях варианты CD40, например, сплайсинговые варианты или аллельные варианты. Приведенная в качестве примера аминокислотная последовательности человеческого CD40 представлена в SEQ ID NO: 1 (Uniprot Р25942, версия 200), а приведенная в качестве примера аминокислотная последовательности мышиного CD40 представлена в SEQ ID NO: 146 (Uniprot Р27512, версия 160). Антиген CD40 представляет собой имеющий молекулярную массу 50 кДа гликопротеин клеточной поверхности, который принадлежит к семейству рецепторов фактора некроза опухолей (TNF-R) (Stamenkovic и др., EMBO J. 8, 1989, сс. 1403-1410). CD40 экспрессируется на многих типах здоровых и опухолевых клеток, включая В-лимфоциты, дендритные клетки, моноциты, макрофаги, эпителий тимуса, эндотелиальные клетки, фибробласты и клетки гладких мышц. CD40 экспрессируется при всех В-лимфомах и в 70% всех случаев солидных опухолей и для него характерна повышающаяся регуляция в антигенпрезентирующих клетках (АРС) под действием сигналов созревания, таких как IFN-гамма и GM-CSF. Активация CD40 индуцирует также дифференцировку моноцитов в функциональные дендритные клетки (DC) и усиливает цитолитическую активность NK-клеток через индуцированные APC-CD40 цитокины. Таким образом, CD40 имеет решающее значение для инициации и повышения иммунных ответов путем индукции созревания АРС, секреции хелперных цитокинов, повышающей регуляции костимуляторных молекул и повышения эффекторных функций.
В контексте настоящего описания понятие «агонист CD40» включает любую субстанцию, которая является агонистом взаимодействия CD40/CD40L. При использовании в данном контексте CD40 предпочтительно относится к человеческому CD40, таким образом, агонист CD40 предпочтительно является агонистом человеческого CD40. Как правило, субстанция может представлять собой агонистическое антитело к CD40 или фрагмент антитела.
Понятия «анти-CD40 антитело», «анти-CD40», «антитело к CD40» и «антитело, которое специфически связывается с CD40» относится к антителу, которое обладает способностью связываться с CD40 с аффинностью, достаточной для применения антитела к качестве диагностического и/или терапевтического агента, мишенью которого является CD40. В одном из вариантов осуществления изобретения уровень связывания антитела к CD40 с неродственным белком, не представляющим собой белок CD40, составляет менее чем примерно 10% от уровня связывания антитела к CD40 при измерении, например, с помощью радиоиммуноанализа (РИА) или проточной цитометрии (FACS). В некоторых вариантах осуществления изобретения антитело, которое связывается с CD40, характеризуется величиной константы диссоциации (KD), составляющей ≤1 мкМ, ≤100 нМ, ≤10 нМ, ≤1 нМ, ≤0,1 нМ, ≤0,01 нМ или ≤0,001 нМ (например, 10-6 М или менее, например, от 10-8 М до 10-13 М, например, от 10-8 М до 10-10 М).
Понятие «пептидный линкер» относится к пептиду, содержащему одну или несколько аминокислот, как правило, примерно 2-20 аминокислот. Пептидные линкеры известны в данной области и указаны в настоящем описании. Приемлемыми неиммуногенными линкерными пептидами являются, например, пептидные линкеры (G4S)n, (SG4)n или G4(SG4)n, в которых «n», как правило, обозначает число от 1 до 10, как правило, от 1 до 4, в частности 2, т.е. пептиды, выбранные из группы, состоящей из GGGGS (SEQ ID NO: 147) GGGGSGGGGS (SEQ ID NO: 148), SGGGGSGGGG (SEQ ID NO: 149) и GGGGSGGGGSGGGG (SEQ ID NO: 150), но также включают последовательности GSPGSSSSGS (SEQ ID NO: 151), (G4S)3 (SEQ ID NO: 152), (G4S)4 (SEQ ID NO: 153), GSGSGSGS (SEQ ID NO: 154), GSGSGNGS (SEQ ID NO: 155), GGSGSGSG (SEQ ID NO: 156), GGSGSG (SEQ ID NO: 157), GGSG (SEQ ID NO: 158), GGSGNGSG (SEQ ID NO: 159), GGNGSGSG (SEQ ID NO: 160) и GGNGSG (SEQ ID NO: 161). Наибольший интерес представляют пептидные линкеры (G4S) (SEQ ID NO: 147), (G4S)2 or GGGGSGGGGS (SEQ ID NO: 148), (G4S)3 (SEQ ID NO: 152) и (G4S)4 (SEQ ID NO: 153).
Понятие «аминокислота» в контексте настоящего описания обозначает группу встречающихся в естественных условиях карбокси-α-аминокислот, таких как аланин (трехбуквенный код: ala, однобуквенный код: А), аргинин (arg, R), аспарагин (asn, N), аспарагиновая кислота (asp, D), цистеин (cys, С), глутамин (gln, Q), глутаминовая кислота (glu, E), глицин (gly, G), гистидин (his, H), изолейцин (ile, I), лейцин (leu, L), лизин (lys, K), метионин (met, M), фенилаланин (phe, F), пролин (pro, P), серин (ser, S), треонин (thr, T), триптофан (trp, W), тирозин (tyr, Y) и валин (val, V).
Понятие «слитый» или «соединенный» подразумевает, что компоненты (например, тяжелая цепь антитела и Fab-фрагмент) сцеплены пептидными связями либо непосредственно, либо через один или несколько пептидных линкеров.
«Процент (%) идентичности аминокислотной последовательности» относительно полипептидной (белковой) референс-последовательности определяют как процент аминокислотных остатков в последовательности-кандидате, которые идентичны аминокислотным остаткам в полипептидной референс-последовательности, после выравнивания последовательностей и интродукции при необходимости брешей для достижения максимального процента идентичности последовательностей, и при этом какие-либо консервативные замены не учитываются при оценке идентичности последовательностей. Сравнительный анализ для определения процента идентичности аминокислотных последовательностей можно осуществлять различными путями, которые находятся в компетенции специалиста в данной области, например, с использованием публично доступных компьютерных программ, таких как программа BLAST, BLAST-2, ALIGN. SAWI или Megalign (DNASTAR). Специалисты в данной области могут определять соответствующие параметры для выравнивания последовательностей, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Однако для целей настоящего изобретения величину % идентичности аминокислотных последовательностей получают с использованием предназначенной для сравнения последовательностей компьютерной программы ALIGN-2. Предназначенная для сравнения последовательностей компьютерная программа ALIGN-2 разработана фирмой Genentech, Inc., и исходный код помещен на хранение вместе с документацией для пользователя в U.S. Copyright Office, Washington D.C., 20559, где он зарегистрирован под регистрационным номером U.S. Copyright Registration, № TXU510087. Программа ALIGN-2 представляет собой публично доступную программу фирмы Genentech, Inc., Южный Сан-Франциско, шт. Калифорния, или ее можно компилировать из исходного кода. Программу ALIGN-2 можно компилировать для применения в операционной системе UNIX, включая цифровую версию UNIX V4.0D. В программе ALIGN-2 все параметры для сравнения последовательностей являются заданными и не должны изменяться. В ситуациях, когда ALIGN-2 применяют для сравнения аминокислотных последовательностей, % идентичности аминокислотных последовательностей данной аминокислотной последовательности А относительно или по сравнению с данной аминокислотной последовательностью Б (которую другими словами можно обозначать как данная аминокислотная последовательность А, которая имеет или отличается определенным % идентичности аминокислотной последовательности относительно или по сравнению с данной аминокислотной последовательностью Б), рассчитывают следующим образом:
100 × частное X/Y,
где X обозначает количество аминокислотных остатков, оцененных программой сравнительного анализа последовательностей ALIGN-2 как идентичные совпадения при сравнительном анализе последовательностей А и Б с помощью указанной программы, и где Y обозначает общее количество аминокислотных остатков в Б. Должно быть очевидно, что, когда длина аминокислотной последовательности А не равна длине аминокислотной последовательности Б, то % идентичности аминокислотной последовательности А относительно аминокислотной последовательности Б не должен быть равен % идентичности аминокислотной последовательности Б относительно аминокислотной последовательности А. Если специально не указано иное, то в контексте настоящего описания все величины % идентичности аминокислотных последовательностей получают согласно процедуре, описанной в последнем из предшествующих параграфов, с помощью компьютерной программы ALIGN-2.
Некоторыми вариантами осуществления изобретения являются «варианты аминокислотных последовательностей» биспецифических антигенсвязывающих молекул, представленных в настоящем описании. Например, может оказаться желательным повышать аффинность связывания и/или другие биологические свойства содержащих тримерный лиганд TNF антигенсвязывающих молекул. Варианты аминокислотных последовательностей содержащих тримерный лиганд TNF антигенсвязывающих молекул можно получать путем интродукции соответствующих модификаций в нуклеотидную последовательность, кодирующую молекулы, или путем пептидного синтеза. Указанные модификации включают, например, делеции и/или инсерции, и/или замены остатков в аминокислотных последовательностях антитела. Для получения конечной конструкции можно использовать любую комбинацию делеций, инсерций и замен, при условии, что конечная конструкция обладает требуемыми характеристиками, например, способностью связываться с антигеном. Представляющие интерес сайты для замещающего мутагенеза включают HVR и каркасные участки (FR). Консервативные замены представлены в таблице Б под заголовком «предпочтительные замены» и дополнительно описаны ниже со ссылкой на классы (1)-(6) боковых цепей аминокислот. Аминокислотные замены можно интродуцировать в представляющую интерес молекулу и продукты подвергать скринингу в отношении требуемой активности, например, сохранения/повышения способности к связыванию антигена, пониженной иммуногенности или улучшенной ADCC или CDC.
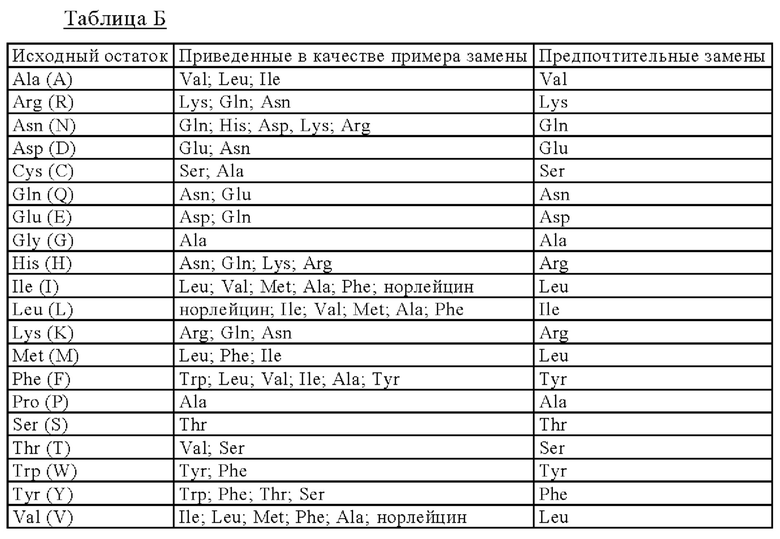
Аминокислоты можно группировать на основе общих свойств боковых цепей следующим образом:
(1) гидрофобные: норлейцин, Met, Ala, Val, Leu, Ile;
(2) нейтральные гидрофильные: Cys, Ser, Thr, Asn, Gln;
(3) кислотные: Asp, Glu;
(4)  : His, Lys, Arg;
: His, Lys, Arg;
(5) остатки, которые влияют на ориентацию цепи: Gly, Pro;
(6) ароматические: Trp, Tyr, Phe.
Под неконсервативными заменами подразумевают замену представителя одного из указанных классов на представителя из другого класса.
Понятие «варианты аминокислотной последовательности» включает полученные в результате замены варианты, в которых имеют место аминокислотные замены одного или нескольких остатков в гипервариабельном участке родительской антигенсвязывающей молекулы (например, гуманизированного или человеческого антитела). Как правило, образовавшийся(еся) вариант(ы), выбранный(ые) для дальнейшего изучения, должен(ны) иметь модификации (например, улучшения) определенных биологических свойств (например, повышенная аффинность, пониженная иммуногенность) относительно родительской антигенсвязывающей молекулы и/или должен(ны) практически сохранять определенные биологические свойства родительской антигенсвязывающей молекулы. Примером полученного в результате замены варианта является антитело с созревшей аффинностью, которое можно легко получать, например, с помощью методов созревания аффинности на основе фагового дисплея, которые указаны в настоящем описании. В целом, метод состоит в следующем: один или несколько остатков HVR подвергают мутации и вариант антигенсвязывающих молекул экспонируют на фаге и подвергают скринингу в отношении конкретной биологической активности (например, аффинности связывания). В некоторых вариантах осуществления изобретения замены, инсерции или делеции могут затрагивать один или несколько HVR, если указанные изменения не снижают существенно способность антигенсвязывающей молекулы связываться с антигеном. Например, в HVR могут быть сделаны консервативные изменения (например, консервативные замены, указанные в настоящем описании), которые не снижают существенно аффинность связывания. Ценным методом идентификации остатков или областей антитела, которые можно подвергать мутагенезу, является так называемый «аланин-сканирующий мутагенез», описанный у Cunningham B.C. и Wells J.A., Science 244, 1989, cc. 1081-1085. При осуществлении этого метода остаток или группу остатков-мишеней (например, заряженные остатки, такие как Arg, Asp, His, Lys и Glu) идентифицируют и заменяют на нейтральную или отрицательно заряженную аминокислоту (например, аланин или полиаланин) для решения вопроса о том, будет ли это влиять на взаимодействие антитела с антигеном. Дополнительные замены можно интродуцировать в те положения аминокислот, для которых продемонстрирована функциональная чувствительность к начальным заменам. В альтернативном или дополнительном варианте изучают кристаллическую структуру комплекса антиген-антигенсвязывающая молекула для идентификации точек контакта между антителом и антигеном. Указанные контактирующие остатки и соседние остатки можно рассматривать в качестве мишеней или исключать из рассмотрения в качестве кандидатов для замены. Варианты можно подвергать скринингу для решения вопроса о том, обладают ли они требуемыми свойствами.
Аминокислотные инсерции включают амино- и/или карбоксиконцевые слияния, варьирующие по длине от одного остатка до полипептидов, содержащих сто или большее количество остатков, а также инсерции одного или нескольких аминокислотных остатков внутрь последовательности. Примерами результата осуществления концевых инсерций являются биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, с N-концевым метионильным остатком. Другие инсерционные варианты молекулы включают слияние N- или С-концов с полипептидом, который удлиняет время полужизни в сыворотке биспецифических антигенсвязывающих молекул.
В некоторых вариантах осуществления изобретения биспецифические антигенсвязывающие молекулы, представленные в настоящем описании, изменяют с целью повышения или понижения степени гликозилирования антитела. Варианты гликозилирования молекул легко можно получать путем такого изменения аминокислотной последовательности, которое позволяет создавать или удалять один или несколько сайтов гликозилирования. Если содержащая тримерный лиганд TNF антигенсвязывающая молекула содержит Fc-область, то можно изменять присоединенный к ней углевод. Нативные антитела, которые продуцируются клетками млекопитающих, как правило, содержат разветвленный биантенный олигосахарид, который, как правило, присоединен с помощью N-связи к Asn297 СН2-домена Fc-области (см., например, Wright А. и Morrison S.L., TIBTECH 15, 1997, cc. 26-32). Олигосахарид может включать различные углеводы, например, маннозу, N-ацетилглюкозамин (GlcNAc), галактозу и сиаловую кислоту, а также фукозу, присоединенную к GlcNAc в «стебле» биантенной олигосахаридной структуры. В некоторых вариантах осуществления изобретения модификации олигосахарида в содержащей тримерный лиганд семейства TNF антигенсвязывающей молекуле, предлагаемой в изобретении, можно осуществлять для создания вариантов с определенными улучшенными свойствами. Одним из объектов изобретения являются содержащие тримерный лиганд семейства TNF антигенсвязывающие молекулы, имеющие углеводную структуру, в которой снижено содержание фукозы, присоединенной (прямо или косвенно) к Fc-области. Указанные фукозилированные варианты могут обладать улучшенной ADCC-функцией (см., например, US №2003/0157108 (Presta L.) или US №2004/0093621 (фирма Kyowa Hakko Kogyo Co., Ltd). Другим объектом изобретения являются варианты биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, содержащие двурассекающие олигосахариды, например, в которых биантенный олигосахарид, присоединенный к Fc-области, двурассекается с помощью GlcNAc. Указанные варианты могут обладать пониженным уровнем фукозилирования и/или улучшенной ADCC-функцией, см., например, WO 2003/011878 (Jean-Mairet и др.); US №6602684 (Umana и др.) и US 2005/0123546 (Umana и др.). Предложены также варианты по меньшей мере с одним остатком галактозы в олигосахариде, присоединенном к Fc-области. Такие варианты антител могут обладать повышенной CDC-функцией, и они описаны, например, WO 1997/30087 (Patel и др.); WO 1998/58964 (Raju S.) и WO 1999/22764 (Raju S.).
В некоторых вариантах осуществления изобретения может оказаться желательным создавать «сконструированные с помощью цистеина варианты» биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, например, «тиоМАт», в которых один или несколько остатков в молекуле заменены на остатки цистеина. В конкретных вариантах осуществления изобретения замененные остатки находятся в доступных сайтах молекулы. Путем замены этих остатков на цистеин реакционноспособные тиольные группы помещаются в доступные сайты антитела, их можно использовать для конъюгации антитела с другими фрагментами, такими как фрагменты, представляющие собой лекарственное средство, или фрагменты, представляющие собой линкер, связанный с лекарственным средством, с созданием иммуноконъюгата, указанного ниже в настоящем описании. В некоторых вариантах осуществления изобретения любой(ые) один или несколько следующих остатков может(гут) быть заменен(ы) на цистеин: V205 (нумерация по Кэботу) легкой цепи; А118 (EU-нумерация) тяжелой цепи и S400 (EU-нумерация) Fc-области тяжелой цепи. Сконструированные с помощью цистеина антигенсвязывающие молекулы можно получать согласно методу, например, описанному в US №7521541.
Понятие «полинуклеотид» относится к выделенной молекуле нуклеиновой кислоты или конструкции, например, матричной РНК (мРНК), РНК вирусного происхождения или плазмидной ДНК (пДНК). Полинуклеотид может содержать обычную фосфодиэфирную связь или нетрадиционную связь (например, амидную связь, такую, которая присутствует в пептидных нуклеиновых кислотах (ПНК)). Понятие «молекула нуклеиновой кислоты» относится к любому одному или нескольким сегментам нуклеиновой кислоты, например, фрагментам ДНК или РНК, присутствующим в полинуклеотиде.
Под «выделенной» молекулой нуклеиновой кислоты или полинуклеотидом подразумевается молекула нуклеиновой кислоты, т.е. ДНК или РНК, которая отделена от ее нативного окружения. Например, рекомбинантный полинуклеотид, кодирующий входящий в вектор полипептид, рассматривается как выделенный для целей настоящего изобретения. Другими примерами выделенного полинуклеотида являются рекомбинантные полинуклеотиды, присутствующие в гетерологичных клетках-хозяевах, или очищенные (частично или полностью) полинуклеотиды, находящиеся в растворе. Выделенный полинуклеотид включает молекулу полинуклеотида, входящую в клетки, которые в норме содержат молекулу полинуклеотида, но молекула полинуклеотида присутствует вне хромосомы или имеет локализацию в хромосоме, отличную от ее локализации в хромосоме в естественных условиях. Выделенные молекулы РНК включают полученные in vivo или in vitro РНК-транскрипты, предлагаемые в настоящем изобретении, а также формы с позитивной и негативной цепью и двухцепочечные формы. Выделенные полинуклеотиды или нуклеиновые кислоты, предлагаемые в настоящем изобретении, включают также указанные молекулы, полученные с помощью синтеза. Кроме того, полинуклеотид или нуклеиновая кислота может представлять собой или может включать регуляторный элемент, такой как промотор, сайт связывания рибосом или терминатор транскрипции.
Под нуклеиновой кислотой или полинуклеотидом, имеющей/имеющим нуклеотидную последовательность, которая, например, на 95% «идентична» нуклеотидной референс-последовательности, предлагаемой в настоящем изобретении, подразумевается, что нуклеотидная последовательность полинуклеотида идентична референс-последовательности за исключением того, что полинуклеотидная последовательность может включать вплоть до 5 точечных мутаций на каждые 100 нуклеотидов нуклеотидной референс-последовательности. Другими словами, для получения полинуклеотида, имеющего нуклеотидную последовательность, которая идентична по меньшей мере на 95% нуклеотидной референс-последовательности, вплоть до 5% нуклеотидов в референс-последовательности можно изымать путем делеции или заменять на другой нуклеотид, или вплоть до 5% нуклеотидов от общего количества нуклеотидов в референс-последовательности можно встраивать в референс-последовательность. Эти изменения референс-последовательности могут иметь место в положениях на 5'- или 3'-конце нуклеотидной референс-последовательности или в ином положении между этими концевыми положениями, и их встраивают либо индивидуально между остатками в референс-последовательности, либо их встраивают в референс-последовательность в виде одной или нескольких смежных групп. На практике решение вопроса о том, идентична ли конкретная полинуклеотидная последовательность по меньшей мере на 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99% нуклеотидной последовательности, предлагаемой в настоящем изобретении, можно решать, как правило, с использованием известных компьютерных программ, например, указанных выше для полипептидов (например, ALIGN-2).
Понятие «кассета экспрессии» относится к полинуклеотиду, полученному с помощью рекомбинации или синтеза, который содержит серию специфических нуклеотидных элементов, обеспечивающих транскрипцию конкретной нуклеиновой кислоты в клетке-мишени. Рекомбинантную кассету экспрессии можно встраивать в плазмиду, хромосому, митохондриальную ДНК, пластидную ДНК, вирус или фрагмент нуклеиновой кислоты. Как правило, рекомбинантная кассета экспрессии, представляющая собой часть экспрессионного вектора, включает среди прочих последовательностей подлежащую транскрипции нуклеотидную последовательность и промотор. В некоторых вариантах осуществления изобретения кассета экспрессии, предлагаемая в изобретении, содержит полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, или их фрагменты.
Понятие «вектор» или «экспрессионный вектор» является синонимом понятия «экспрессионная конструкция» и относится к молекуле ДНК, которую применяют для интродукции и обеспечения экспрессии конкретного гена, с которой он функционально связан в клетке-мишени. Понятие включает вектор, представляющий собой самореплицирующуюся структуру нуклеиновой кислоты, а также вектор, встроенный в геном клетки-хозяина, в которую он интродуцирован. Экспрессионный вектор, предлагаемый в настоящем изобретении, содержит кассету экспрессии. Экспрессионные векторы позволяют осуществлять транскрипцию стабильной мРНК в больших количествах. Когда экспрессионный вектор находится внутри клетки-мишени, то молекула рибонуклеиновой кислоты или белок, который кодируется геном, продуцируется в результате клеточного механизма транскрипции и/или трансляции. В одном из вариантов осуществления изобретения экспрессионный вектор, предлагаемый в изобретении, содержит кассету экспрессии, которая включает полинуклеотидные последовательности, которые кодируют биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, или их фрагменты.
В контексте настоящего описания понятия «клетка-хозяин», «линия клеток-хозяев» и «культура клеток-хозяев» используются взаимозаменяемо, и они относятся к клеткам, в которые интродуцирована экзогенная нуклеиновая кислота, включая потомство указанных клеток. К клеткам-хозяевам относятся «трансформанты» и «трансформированные клетки», которые включают первичные трансформированные клетки, а также потомство, выведенное из них, независимо от количества пересевов. Потомство может не быть строго идентичным родительской клетке по составу нуклеиновых кислот, а может нести мутации. Под данное понятие подпадает мутантное потомство, которое обладает такой же функцией или биологической активностью, что и отобранная путем скрининга или селекции исходная трансформированная клетка. Клетка-хозяин представляет собой любой тип клеточной системы, которую можно применять для создания биспецифических антигенсвязывающих молекул, предлагаемых в настоящем изобретении. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, такие как (но, не ограничиваясь только ими) СНО-клетки, BHK-клетки, NS0-клетки, SP2/0-клетки, клетки миеломы линии YO, клетки мышиной миеломы линии Р3Х63, PER-клетки, PER.C6-клетки или клетки гибридомы, клетки дрожжей, клетки насекомых и клетки растений, но также клетки, находящиеся в трансгенном животном, трансгенном растении или в культивируемой растительной или животной ткани.
Понятие «эффективное количество» агента относится к количеству, необходимому для обеспечения физиологического изменения в клетке или ткани, в которую его вводят.
Понятие «терапевтически эффективное количество» агента, например, фармацевтической композиции, относится к количеству, эффективному при применении в дозах и в течение периодов времени, необходимых для достижения требуемого терапевтического или профилактического результата. Терапевтически эффективное количество агента, например, элиминирует, снижает, замедляет, минимизирует или предупреждает нежелательные явления заболевания.
«Индивидуум» или «субъект» представляет собой млекопитающее. Млекопитающие представляют собой (но, не ограничиваясь только ими) одомашненных животных (например, коровы, овцы, кошки, собаки и лошади), приматов (например, люди и приматы кроме человека, такие как мартышки), кроликов и грызунов (например, мыши и крысы). Предпочтительно индивидуум или субъект представляет собой человека.
Понятие «фармацевтическая композиция» относится к препарату, который находится в такой форме, что он обеспечивает биологическую активность входящего в его состав действующего вещества, которое должно обладать эффективностью, и который не содержит дополнительных компонентов, которые обладают неприемлемой токсичностью для индивидуума, которому следует вводить композицию.
«Фармацевтически приемлемый эксципиент» относится к ингредиенту в фармацевтической композиции, отличному от действующего вещества, который является нетоксичным для индивидуума. Фармацевтически приемлемый эксципиент включает (но, не ограничиваясь только ими) буфер, стабилизатор или консервант.
Понятие «листовка-вкладыш в упаковку» в контексте настоящего описания относится к инструкциям, которые обычно помещают в поступающие в продажу упаковки терапевтических продуктов, которые содержат информацию о показаниях, применении, дозе, пути введения, комбинированной терапии, противопоказаниях и/или мерах предосторожности при применении указанных терапевтических продуктов.
В контексте настоящего описания понятие «лечение» (и его грамматические варианты, такие как «лечить» или «процесс лечения») относится к клиническому вмешательству с целью изменения естественного течения болезни у индивидуума, подлежащего лечению, и его можно осуществлять либо для профилактики или в процессе развития клинической патологии. Требуемыми действиями лечения являются (но, не ограничиваясь только ими) предупреждение возникновения или рецидива болезни, облегчение симптомов, уменьшение любых прямых или косвенных патологических последствий болезни, предупреждение метастазов, снижение скорости развития болезни, облегчение или временное ослабление болезненного состояния и ремиссия или улучшение прогноза. В некоторых вариантах осуществления изобретения молекулы, предлагаемые в изобретении, применяют для задержки развития болезни или замедления прогрессирования болезни.
В контексте настоящего описания понятие «рак» относится к пролиферативным заболеваниям, таким как лимфомы, лимфолейкозы, рак легкого, немелкоклеточный рак легкого (NSCL), альвеолярно-клеточный рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожная или внутриглазная меланома, рак матки, рак яичника, ректальный рак, рак анальной области, рак желудка, гастральный рак, рак ободочной кишки, рак молочной железы, карцинома фаллопиевых труб, карцинома эндометрия, карцинома шейки матки, карцинома влагалища, карцинома вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечников, саркома мягких тканей, рак мочеиспускательного канала, рак пениса, рак предстательной железы, рак мочевого пузыря, рак почки или мочеточника, почечно-клеточная карцинома, карцинома почечной лоханки, мезотелиома, печеночно-клеточный рак, билиарный рак, неоплазмы центральной нервной системы (ЦНС), опухоли позвоночника, глиома ствола головного мозга, мультиформная глиобластома, астроцитомы, шванномы, эпендимомы, медуллобластомы, менингиомы, плоскоклеточные карциномы, аденома гипофиза и саркома Юинга, включая рефрактерные варианты любого из указанных выше видов рака и комбинации одного или нескольких из указанных выше видов рака.
В контексте настоящего описания понятие «химиотерапевтический агент» относится к химическому соединению, которое можно применять для лечения рака. В одном из объектов изобретения химиотерапевтический агент представляет собой антиметаболит. В одном из объектов изобретения антиметаболит выбирают из группы, состоящей из аминоптерина, метотрексата, пеметрекседа, ралтитрекседа, кладрибина, клофарабина, флударабина, меркаптопурина, пентостатина, тиогуанина, капецитабина, цитарабина, фторурацила, флоксуридина и гемцитабина. В одном из объектов изобретения антиметаболит представляет собой капецитабин или гемцитабин. В другом объекте изобретения антиметаболит представляет собой фторурацил. В одном из объектов изобретения химиотерапевтический агент представляет собой агент, влияющий на образование микротрубочек. В одном из объектов изобретения агент, влияющий на образование микротрубочек, выбирают из группы, состоящей из: паклитаксела, доцетаксела, винкристина, винбластина, виндезина, винорелбина, таксотера, этопозида и тенипозида. В другом объекте изобретения химиотерапевтический агент представляет собой алкилирующий агент, такой как циклофосфамид. В одном из объектов изобретения химиотерапевтический агент представляет собой цитотоксический антибиотик, такой как ингибитор топоизомеразы II. В одном из объектов изобретения ингибитор топоизомеразы II представляет собой доксорубицин.
Биспецифические антитела, предлагаемые в изобретении
В изобретении предложены новые биспецифические антигенсвязывающие молекулы с наиболее предпочтительными свойствами, такими как технологичность, стабильность, аффинность связывания, биологическая активность, эффективность таргетинга, пониженная токсичность, расширенный диапазон доз, которыми можно обрабатывать пациента, и при этом возможная повышенная эффективность.
Примеры биспецифических антигенсвязывающих молекул
Одним из объектов изобретения являются биспецифические антигенсвязывающие молекулы, содержащие
(а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40,
(б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и
(в) Fc-область, состоящую из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
В конкретном объекте изобретения указанные биспецифические антигенсвязывающие молекулы характеризуются таргетированным агонистическим связыванием с CD40. В частности, биспецифическая антигенсвязывающая молекула является агонистом CD40, который таргетирован против ассоциированного с опухолью антигена клетки-мишени.
В другом конкретном объекте изобретения биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержат Fc-область, которая состоит из первой и второй субъединиц, обладающих способностью в стабильной ассоциации, которая содержит мутации, снижающие эффекторную функцию. Применение Fc-области, содержащей мутации, которые снижают или аннулируют эффекторную функцию, должно предупреждать неспецифический агонизм путем перекрестного сшивания через Fc-рецепторы и должно предупреждать ADCC CD40+ клеток.
Биспецифические антигенсвязывающие молекулы, представленные в настоящем описании, обладают преимуществом по сравнению с каноническими антителами, обладающими способностью специфически связываться с CD40, которое состоит в том, что они избирательно индуцируют иммунный ответ в клетках-мишенях, которые, как правило, представляют собой раковые клетки или клетки стромы опухоли. В одном из объектов изобретения ассоциированный с опухолью антиген клетки-мишени выбирают из группы, состоящей из фибробласт-активирующего белка (FAP), ассоциированного с меланомой хондроитинсульфат-протеогликана (MCSP), рецептора эпидермального фактора роста (EGFR), карциноэмбрионального антигена (СЕА), CD19, CD20 и CD33.
В конкретном объекте изобретения ассоциированный с опухолью антиген клетки-мишени представляет собой FAP.
Указанные биспецифические антигенсвязывающие молекулы характеризуются таргетированным на FAP агонистическим связыванием с CD40. В присутствии экспрессирующих FAP клеток биспецифические антигенсвязывающие молекулы обладают способностью активировать антигенпрезентирующие клетки (АРС, пример 2.1), активировать человеческие В-клетки (примеры 2.1.1 и 2.1.3), человеческие клетки Дауди (пример 2.1.2) и полученные из человеческих моноцитов дендритные клетки (moDC, пример 2.1.4).
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 19, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 20, и (III) CDR-Н3, содержащий аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 27, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 28, и (III) CDR-Н3, содержащий аминокислотную последовательность SEQ ID NO: 29, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 30, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 31, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 32.
В одном объекте изобретения биспецифическая антигенсвязывающая молекула содержит антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 25, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 26.
В другом объекте изобретения биспецифическая антигенсвязывающая молекула содержит антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 33, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 34.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и
(II) вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64.
Одним объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 47, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 57.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174, и
(II) вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177 и SEQ ID NO: 178.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(н) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(о) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(п) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(р) VH, которая содержит аминокислотную последовательность SEQ ID NO 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит,
(I) вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO 183 и SEQ ID NO: 184, и
(II) вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185.
Биспецифические антигенсвязывающие молекулы, для которых антиген клетки-мишени представляет собой FAP
В конкретном объекте изобретения антиген клетки-мишени представляет собой фибробласт-активирующий белок (FAP). Связывающие FAP фрагменты описаны в WO 2012/02006, которая полностью включена в настоящее описание в качестве ссылки. Ниже описаны представляющие наибольший интерес FAP-связывающие фрагменты.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 2.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с фибробласт-активирующим белком (FAP), содержит
(а) вариабельную область тяжелой цепи (VHFAP), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 3, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 4, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 5, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 6, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 7, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(б) вариабельную область тяжелой цепи (VHFAP), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 11, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 12, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 13, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 14, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 15, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 16.
В частности, предложена биспецифическая антигенсвязывающая молекула, в которой вариабельная область тяжелой цепи (VHFAP) содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 3, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 4, и (III) CDR-НЗ, содержащий аминокислотную последовательность SEQ ID NO: 5, и вариабельная область легкой цепи (VLFAP) содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 6, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 7, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 8. В другом объекте изобретения антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи (VHFAP), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 11, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 12, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 13, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 14, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 15, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 16.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит
(а) вариабельную область тяжелой цепи (VHFAP), которая содержит аминокислотную последовательность, идентичную по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), которая содержит аминокислотную последовательность, идентичную по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 10, или (б) вариабельную область тяжелой цепи (VHFAP), которая содержит аминокислотную последовательность, идентичную по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), которая содержит аминокислотную последовательность, идентичную по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% аминокислотной последовательности SEQ ID NO: 18.
В одном из объектов изобретения антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи VH, которая содержит аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 10, или антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи VH, которая содержит аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи, которая содержит аминокислотную последовательность SEQ ID NO: 18.
Биспецифические антигенсвязывающие молекулы, связывающиеся с CD40 и FAP
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 171, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 175, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 179 или SEQ ID NO: 182, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 185, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит
(I) антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 25, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 26, и
(II) антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 10.
Кроме того, предложена биспецифическая антигенсвязывающая молекула, в которой
(I) антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 25, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 26, и
(II) антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой
(I) антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 47, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 57, и
(II) антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой
(I) антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи, содержащую аминокислотную последовательность SEQ ID NO: 18.
Биспецифические одновалентные антигенсвязывающие молекулы (формат 1+1)
Одним из объектов изобретения являются биспецифические антигенсвязывающие молекулы, содержащие (а) один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, (б) один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит (а) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, (б) второй Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации. В одном из объектов изобретения антиген клетки-мишени представляет собой FAP.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит
(I) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64, и
(II) второй Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая первую тяжелую цепь (НС1), которая содержит аминокислотную последовательность SEQ ID NO: 141, вторую тяжелую цепь (НС2), которая содержит аминокислотную последовательность SEQ ID NO: 140, первую легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 138, и вторую легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 137.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит
(I) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 33, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 34, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) второй Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Одним из конкретных объектов изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит
(I) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) второй Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит (I) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 171, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 175, и (II) второй Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Другим конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, где указанная молекула содержит (I) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность SEQ ID NO: 179 или SEQ ID NO: 182, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность SEQ ID NO: 185, и (II) второй Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая первую тяжелую цепь (НС1), которая содержит аминокислотную последовательность SEQ ID NO: 163, вторую тяжелую цепь (НС2), которая содержит аминокислотную последовательность SEQ ID NO: 164, первую легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 165, и вторую легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 162.
Биспецифические антигенсвязывающие молекулы с двухвалентным связыванием с CD40 и одновалентным связыванием с антигеном клетки-мишени (формат 2+1)
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) два антигенсвязывающих домена, обладающих способностью специфически связываться с CD40,
(б) один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и
(в) Fc-домен, состоящий из первой и второй субъединиц, обладающих способностью к стабильной ассоциации.
Таким образом, предложена биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула является двухвалентной в отношении CD40 и одновалентной в отношении антигена клетки-мишени.
Согласно одному из объектов изобретения биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и
(б) VH - и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VH-домен и VL-домен каждый соединен через пептидный линкер с одним из С-концов двух тяжелых цепей.
В конкретном объекте изобретения пептидный линкер содержит аминокислотную последовательность, выбранную из SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 152 и SEQ ID NO: 153. Более конкретно пептидный линкер содержит SEQ ID NO: 153.
Согласно конкретному объекту изобретения биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и
(б) VH - и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VH-домен соединен через пептидный линкер с С-концом одной из тяжелых цепей и где VL-домен соединен через пептидный линкер с С-концом второй тяжелой цепи.
В другом конкретном объекте изобретения биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и
(б) VH - и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VH-домен соединен через пептидный линкер с С-концом Fc с «выступом» тяжелой цепи и где VL-домен соединен через пептидный линкер с С-концом с Fc с «впадиной» тяжелой цепи.
В одном из объектов изобретения биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и
(б) VH - и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VL-домен соединен через пептидный линкер с С-концом Fc с «выступом» тяжелой цепи и где VH-домен соединен через пептидный линкер с С-концом Fc с «впадиной» тяжелой цепи.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, соединенные с Fc-областью, и
(б) один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, соединенный с С-концом Fc-области.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) VH - и VL-домены, обладающие способностью специфически связываться с FAP, где VH соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и где VL соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, где VH соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и где VL соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
В частности, VH-домен представляет собой вариабельную область тяжелой цепи (VHFAP), которая содержит аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 17, a VL-домен представляет собой вариабельную область легкой цепи (VLFAP), которая содержит аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 18. Более конкретно, VH-домен представляет собой вариабельную область тяжелой цепи (VHFAP), которая содержит аминокислотную последовательность SEQ ID NO: 17, а VL-домен представляет собой вариабельную область легкой цепи (VLFAP), которая содержит аминокислотную последовательность SEQ ID NO: 18.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 82, первую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 88, и вторую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 89, или
(б) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 133, первую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 134, и вторую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 135.
В другом конкретном объекте изобретения биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и
(б) Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, где Fab-фрагмент соединен через пептидный линкер с С-концом одной из тяжелых цепей.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) один Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
В частности, Fab-фрагмент, обладающий способностью специфически связываться, представляет собой кроссовер-Fab-фрагмент.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 137, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 138, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 139, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 136.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) кроссовер-Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит VL-CH1-цепь и VH-CL-цепь, где VH-CL цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
В одном из объектов изобретения VH-CL-цепь соединена с С-концом Fc с «выступом» тяжелой цепи.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) кроссовер-Fab-фрагмент, обладающий способностью специфически связываться с FAP, содержащий VL-CH1-цепь и VH-CL-цепь, где VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
В одном из объектов изобретения VL-CH1-цепь соединена с С-концом Fc с «выступом» тяжелой цепи.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 165, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 167, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 168, или
(б) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 248, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 251, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 252, или
(в) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 248, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 138, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 253, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 252, или
(г) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 248, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 254, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 255, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 252, или
(д) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 256, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 254, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 257, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 258.
Биспецифические антигенсвязывающие молекулы в формате «голова-к-хвосту» (2+1)
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) тяжелую цепь, содержащую VH и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) тяжелую цепь, содержащую VH и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, VL и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с FAP, и субъединицу Fc-области,
(в) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, и
(г) легкую цепь, содержащую VH и CL-домен Fab-фрагмента, который обладает способностью специфически связываться с FAP.
В частности, предложена биспецифическая антигенсвязывающая молекула, содержащая первую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 164, вторую тяжелую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 166, две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 165, и легкую цепь, которая содержит аминокислотную последовательность SEQ ID NO: 162.
Биспецифические антигенсвязывающие молекулы с двухвалентным связыванием с CD40 и двухвалентным связыванием с антигеном клетки-мишени (формат 2+2)
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) два антигенсвязывающих домена, которые обладают способностью специфически связываться с CD40,
(б) два антигенсвязывающих домена, которые обладают способностью специфически связываться с антигеном клетки-мишени,
и
(в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
Таким образом, предложена биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула является двухвалентной в отношении CD40 и двухвалентной в отношении антигена клетки-мишени.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, и
(в) два Fab-фрагмента, которые обладают способностью специфически связываться с FAP, где один из Fab-фрагментов соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и другой Fab-фрагмент соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 86,
две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 87, и
две тяжелые цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 90, или
(б) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 137,
две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 138, и
две тяжелые цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 136.
Биспецифические антигенсвязывающие молекулы с четырехвалентным связыванием с CD40 и одновалентным связыванием с антигеном клетки-мишени (формат 4+1)
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре антигенсвязывающих домена, которые обладают способностью специфически связываться с CD40,
(б) один антигенсвязывающий домен, который обладает способностью специфически связываться с антигеном клетки-мишени,
и
(в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
Таким образом, предложена биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула является четырехвалентной в отношении CD40 и одновалентной в отношении антигена клетки-мишени.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой четыре антигенсвязывающих домена, обладающих способностью специфически связываться с CD40, представляют собой Fab-фрагменты и каждые два из них слиты с другим на тяжелой цепи, необязательно через пептидный линкер. В конкретном объекте изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 148. Более конкретно, антигенсвязывающая молекула содержит две тяжелые цепи, каждая из которых содержит фрагмент VHCH1-пептидный линкер-VHCH1. В конкретном объекте изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 148.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающих домен, обладающий способностью специфически связываться с антигеном клетки-мишени, содержит VH- и VL-домены и в которой VH-домен соединен через пептидный линкер с С-концом первой субъединицы Fc-домена, а VL-домен соединен через пептидный линкер с С-концом второй субъединицы Fc-домена.
В конкретном объекте изобретения биспецифическая антигенсвязывающая молекула содержит
(а) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab- фрагмента, который обладает способностью специфически связываться с CD40,
(б) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, который обладает способностью специфически связываться с CD40, слитые с VH и СН1-доменом второго Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области, и
(в) VH- и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VH-домен соединен через пептидный линкер с С-концом одной из тяжелых цепей и где VL-домен соединен через пептидный линкер с С-концом второй тяжелой цепи.
В конкретном объекте изобретения пептидный линкер содержит аминокислотную последовательность, выбранную из SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 152 и SEQ ID NO: 153. Более конкретно, пептидный линкер содержит SEQ ID NO: 153.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре легкие цепи, где каждая легкая цепь содержит вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 34, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188,
(б) две тяжелые цепи, где каждая тяжелая цепь содержит VH-CH1-VH-CH1 и субъединицу Fc-области, и где оба VH-домена содержат вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 33, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и
(в) VH- и VL-домены, обладающие способностью специфически связываться с антигеном клетки-мишени, где VH-домен соединен через пептидный линкер с С-концом одной из тяжелых цепей и где VL-домен соединен через пептидный линкер с С-концом второй тяжелой цепи.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре Fab-фрагмента, которые обладают способностью специфически связываться с CD40, (б) VH- и VL-домены, которые обладают способностью специфически связываться с FAP, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
В частности, VH-домен представляет собой вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9 или SEQ ID NO: 17, a VL-домен представляет собой вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10 или SEQ ID NO: 18. Более конкретно, VH-домен представляет собой вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, а VL-домен представляет собой вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 82, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 83, и вторую тяжелую цепь, содержащую аминокислотная последовательность SEQ ID NO: 84, или
(б) четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 133, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 131, и вторую тяжелую цепь, содержащую аминокислотная последовательность SEQ ID NO: 132.
Другим конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, обладающая способностью специфически связываться с мышиным CD40, которая содержит
(а) четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 97, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 95, и вторую тяжелую цепь, содержащую аминокислотная последовательность SEQ ID NO: 96.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40,
(б) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab- фрагмента обладающего способностью специфически связываться с CD40, слитые с VH и СН1-доменом второго Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области, и
(в) один Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (б).
В частности, Fab-фрагмент, обладающий способностью специфически связываться, представляет собой кроссовер-Fab-фрагмент.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) один Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
В частности, Fab-фрагмент, обладающий способностью специфически связываться, представляет собой кроссовер-Fab-фрагмент.
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab- фрагмента, обладающего способностью специфически связываться с CD40, где VL содержит вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 34, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(б) две тяжелые цепи, где каждая тяжелая цепь содержит VH-CH1-VH-CH1-цепь и субъединицу Fc-области, при этом оба VH-домена содержат вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 33, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и
(в) кроссовер-Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит VL-CH1-цепь и VH-CL-цепь, где VH-CL-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (б).
В одном из объектов изобретения VH-CL-цепь соединена с С-концом тяжелой цепи Fc с «выступом».
Следующим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, где VL содержит вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 34, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(б) две тяжелые цепи, где каждая тяжелая цепь содержит VH-CH1-VH-CH1-цепь и субъединицу Fc-области, при этом оба VH-домена содержат вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 33, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и
(в) кроссовер-Fab-фрагмент, обладающий способностью специфически связываться с FAP, который содержит VL-CH1-цепь и VH-CL-цепь, где VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (б).
В одном из объектов изобретения VL-CH1-цепь соединена с С-концом тяжелой цепи Fc с «выступом».
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 165, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 169, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 170, или
(б) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 243, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 244, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 245, или
(в) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 243, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 246, и вторую тяжелую цепь, содержащую аминокислотную последовательность NO: 247, или
(г) две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 248, одну легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 162, первую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 249, и вторую тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 250.
Биспецифические антигенсвязывающие молекулы с четырехвалентным связыванием с CD40 и двухвалентным связыванием с антигеном клетки-мишени (формат 4+2)
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая
(а) четыре антигенсвязывающих домена, которые обладают способностью специфически связываться с CD40,
(б) два антигенсвязывающих домена, которые обладают способностью специфически связываться с антигеном клетки-мишени,
и
(в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
Таким образом, предложена биспецифическая антигенсвязывающая молекула, где биспецифическая антигенсвязывающая молекула является четырехвалентной в отношении CD40 и двухвалентной в отношении антигена клетки-мишени.
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, в которой четыре антигенсвязывающих домена, обладающих способностью специфически связываться с CD40, представляют собой Fab-фрагменты и каждый из двух из них слит с другим, необязательно через пептидный линкер. В конкретном объекте изобретения пептидный линкер содержит аминокислотную последовательность SEQ ID NO: 148. Более конкретно, антигенсвязывающая молекула содержит две тяжелые цепи, каждая из которых содержит фрагмент VHCH1-пептидный линкер-VHCH1. В конкретном объекте изобретения пептидный линкер имеет аминокислотную последовательность SEQ ID NO: 148.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой антигенсвязывающие домены, обладающие способностью специфически связываться с антигеном клетки-мишени, представляют собой Fab-фрагменты и в которой первый Fab-фрагмент соединен через пептидный линкер с С-концом первой субъединицы Fc-домена, а второй Fab-фрагмент соединен через пептидный линкер с С-концом второй субъединицы Fc-домена. В одном из объектов изобретения два Fab-фрагмента, которые обладают способностью специфически связываться с антигеном клетки-мишени, представляют собой кроссовер-Fab-фрагменты, каждый из которых содержит VL-CH1-цепь и VH-CL-цепь, и в которых VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 86, две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 87, и две тяжелые цепи, содержащие аминокислотную последовательность SEQ ID NO: 85.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, обладающая способностью специфически связываться с мышиным CD40, которая содержит четыре легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 100, две легкие цепи, каждая из которых содержит аминокислотную последовательность SEQ ID NO: 99, и две тяжелые цепи, содержащие аминокислотную последовательность SEQ ID NO: 98.
Модификации Fc-домена. приводящие к снижению связывания с Fc-рецептором и/или эффекторной функции
Биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержат также Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
В некоторых объектах изобретения одну или несколько аминокислотных модификаций можно интродуцировать в Fc-область антитела, представленного в настоящем описании, создавая тем самым вариант Fc-области. Вариант Fc-области может сдержать последовательность человеческой Fc-области (например, Fc-области человеческого IgG1, IgG2, IgG3 или IgG4), содержащую аминокислотную модификацию (например, замену) в одном или нескольких аминокислотных положениях.
Fc-домен придает биспецифическим антителам, предлагаемым в изобретении, предпочтительные фармакокинетические свойства, включая продолжительное время полужизни в сыворотке, что обеспечивает хорошее накопление в ткани-мишени и предпочтительное соотношение распределения в ткани-крови. Однако в то же время он может приводить к нежелательному таргетингу биспецифических антител, предлагаемых в изобретении, к клеткам, которые экспрессируют Fc-рецепторы, а не к предпочтительным несущим антиген клеткам. Таким образом, согласно конкретным вариантам осуществления изобретения Fc-домен биспецифических антител, предлагаемых в изобретении, обладает пониженной аффинностью связывания с Fc-рецептором и/или пониженной эффекторной функцией по сравнению с нативным Fc-доменом IgG, в частности Fc-доменом IgG1 или Fc-доменом IgG4. Более предпочтительно Fc-домен представляет собой Fc-домен IgG1.
В одном из объектов изобретения Fc-домен (или биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержащая указанный Fc-домен) характеризуется аффинностью связывания, составляющей менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% от аффинности связывания с Fc-рецептором нативного Fc-домена IgG1 (или биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержащей указанный нативный Fc-домен IgG1) и/или эффекторной функцией, составляющей менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 10% и наиболее предпочтительно менее чем 5% от эффекторной функции нативного Fc-домена IgG1 (или биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержащей указанный нативный Fc-домен IgG1). В одном из объектов изобретения Fc-домен (или биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержащая указанный Fc-домен) практически не связывается с Fc-рецептором и/или не индуцирует эффекторную функцию. В конкретном объекте изобретения Fc-рецептор представляет собой Fcγ-рецептор. В одном из объектов изобретения Fc-рецептор представляет собой человеческий Fc-рецептор. В одном из объектов изобретения Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном объекте изобретения Fc-рецептор представляет собой активирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее предпочтительно человеческий FcγRIIIa. В одном из объектов изобретения Fc-рецептор представляет собой ингибирующий Fc-рецептор. В конкретном объекте изобретения Fc-рецептор представляет собой ингибирующий человеческий Fcγ-рецептор, более конкретно человеческий FcγRIIB. В конкретном объекте изобретения эффекторная функция представляет собой одну или несколько функций, выбранных из группы, включающей CDC, ADCC, ADCP и секрецию цитокинов. В одном из объектов изобретения эффекторная функция представляет собой ADCC. В одном из объектов изобретения Fc-домен характеризуется практически такой же аффинностью связывания с неонатальным Fc-рецептором (FcRn), что и нативный Fc-домен IgG1. Практически такое же связывание с FcRn достигается, когда Fc-домен (или биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержащая указанный Fc-домен), характеризуется аффинностью связывания с FcRn, составляющей более чем примерно 70%, предпочтительно более чем примерно 80%, более предпочтительно более чем примерно 90%, от аффинности связывания нативного Fc-домена IgG1 (или биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержащей нативный Fc домен IgG1).
Согласно конкретному объекту изобретения Fc-домен конструируют так, чтобы он обладал пониженной аффинностью связывания с Fc-рецептором и/или пониженной эффекторной функцией по сравнению с не подвергнутым инженерии Fc-доменом. В конкретном объекте изобретения Fc-домен биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержит одну или несколько аминокислотных мутаций, которые снижают аффинность связывания Fc-домена с Fc-рецептором и/или эффекторную функцию. Как правило, в каждой из двух субъединиц Fc-домена присутствует(ют) одна или несколько одинаковых аминокислотных мутаций. В одном из объектов изобретения аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором. В другом объекте изобретения аминокислотная мутация снижает аффинность связывания Fc-домена с Fc-рецептором по меньшей мере в 2 раза, по меньшей мере в 5 раз или по меньшей мере в 10 раз. В одном из объектов изобретения биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержащая сконструированный Fc-домен, характеризуется аффинностью связывания, составляющей менее чем 20%, в частности, менее чем 10%, более предпочтительно менее чем 5% от аффинности связывания с Fc-рецептором, характерной для биспецифических антител, предлагаемых в изобретении, содержащих не подвергнутый инженерии Fc-домен. В конкретном объекте изобретения Fc-рецептор представляет собой Fcγ-рецептор. В других объектах изобретения Fc-рецептор представляет собой человеческий Fc-рецептор. В одном из объектов изобретения Fc-рецептор представляет собой ингибирующий Fc-рецептор. В конкретном объекте изобретения Fc-рецептор представляет собой ингибирующий человеческий Fc-рецептор, более конкретно человеческий FcγRIIB. В некоторых объектах изобретения Fc-рецептор представляет собой активирующий Fc-рецептор. В конкретном объекте изобретения Fc-рецептор представляет собой активирующий человеческий Fc-рецептор, более конкретно человеческий FcγRIIIa, FcγRI или FcγRIIa, наиболее предпочтительно человеческий FcγRIIIa. Предпочтительно уменьшается связывание с каждым из этих рецепторов. Согласно некоторым объектам изобретения снижается также аффинность связывания с компонентом системы комплемента, в частности, аффинность связывания с C1q. Согласно одному из объектов изобретения не снижается аффинность связывания с неонатальным Fc-рецептором (FcRn). Практически такое же связывание с FcRn, т.е. сохранение аффинности связывания Fc-домена с указанным рецептором, достигается, когда Fc-домен (или биспецифическая антигенсвязывающая молекула, предлагаемая в изобретении, содержащая указанный Fc-домен) характеризуется аффинностью связывания с FcRn, составляющей более чем примерно 70% от аффинности связывания с FcRn не подвергнутой инженерии формы Fc-домена (или биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, содержащей указанную не подвергнутую инженерии форму Fc-домена). Fc-домен или биспецифическая антигенсвязывающая молекула, предлагаемый/предлагаемая в изобретении, который/которая содержит указанный Fc-домен, может характеризоваться аффинностью, составляющей более чем примерно 80% и даже более чем примерно 90% от указанной выше аффинности. В некоторых вариантах осуществления изобретения Fc-домен биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, создают так, чтобы он обладал пониженной эффекторной функцией по сравнению с не подвергнутым инженерии Fc-доменом Пониженная эффекторная функция может представлять собой (но, не ограничиваясь только ими) пониженную(ые) одну или несколько из следующих функций: пониженная комплементзависимая цитотоксичность (CDC), пониженная антитело-обусловленная клеточнозависимая цитотоксичность (ADCC), пониженный антитело-обусловленный клеточнозависимый фагоцитоз (ADCP), пониженная секреция цитокинов, пониженное опосредованное иммунным комплексом поглощение антигена антигенпрезентирующими клетками, пониженное связывание с NK-клетками, пониженное связывание с макрофагами, пониженное связывание с моноцитами, пониженное связывание с полиморфноядерными клетками, пониженная непосредственная передача сигнала, индуцирующего апоптоз, пониженное созревание дендритных клеток или пониженное Т-клеточное примирование.
Антитела с пониженной эффекторной функцией включают также антитела с заменой одного или нескольких остатков 238, 265, 269, 270, 297, 327 и 329 (US №637056). К указанным мутантам Fc относятся мутанты Fc с заменами в двух или большем количестве из аминокислотных положений 265, 269, 270, 297 и 327, включая так называемый мутант Fc-домена «DANA» с заменой остатков 265 и 297 на аланин (US №7332581). Описаны некоторые варианты антител с повышенной или сниженной способностью связываться с FcR (например, в US №6737056; WO 2004/056312 и у Shields R.L. и др., J. Biol. Chem. 276, 2001, сс. 6591-6604).
В одном из объектов изобретения Fc-домен содержит аминокислотную замену в положении Е233, L234, L235, N297, Р331 и Р329. В некоторых объектах Fc-домен содержит аминокислотные замены L234A и L235A («LALA»). В одном из указанных вариантов осуществления изобретения Fc-домен представляет собой Fc-домен IgG1, в частности Fc-домен человеческого IgG1. В одном из объектов изобретения Fc-домен содержит аминокислотную замену в положении Р329. В более конкретном объекте изобретения аминокислотная замена представляет собой Р329А или P329G, в частности P329G. В одном из вариантов осуществления изобретения Fc-домен содержит аминокислотную замену в положении Р329 и дополнительно аминокислотную замену, выбранную из группы, которая состоит из Е233Р, L234A, L235A, L235E, N297A, N297D или P331S. В более конкретных вариантах осуществления изобретения Fc-домен содержит аминокислотные мутации L234A, L235A и P329G («P329G LALA»). Комбинация аминокислотных замен «P329G LALA» практически полностью элиминирует связывание с Fcγ-рецептором Fc-домена человеческого IgG1, и она описана в опубликованной заявке на патент РСТ WO 2012/130831 А1. В указанном документе описаны методы получения указанных мутантных Fc-доменов и методы определения их свойства, таких как связывание с Fc-рецептором или эффекторные функции. Указанное антитело представляет собой IgG1 с мутациями L234A и L235A или мутациями L234A, L235A и P329G (согласно EU-нумерации Кэбота, описанной у Kabat и др., Sequences of Proteins of Immunological Interest, 5-ое изд., изд-во Public Health Service, National Institutes of Health, Bethesda, MD, 1991).
В одном из объектов изобретения Fc-домен представляет собой Fc-домен IgG4. В более конкретном варианте осуществления изобретения Fc-домен представляет собой Fc-домен IgG4, который содержит аминокислотные замены в положении S228 (нумерация по Кэботу), конкретно аминокислотную замену S228P. В более конкретном варианте осуществления изобретения Fc-домен представляет собой Fc-домен IgG4, который содержит аминокислотные замены в положениях L235E и S228P, и P329G. Указанная аминокислотная замена снижает in vivo обмен в Fab-плече антител IgC4-подкласса (см. Stubenrauch и др., Drug Metabolism and Disposition 38, 2010, cc. 84-91).
Антитела с удлиненным временем полужизни и повышенной способностью к связыванию с неонатальным Fc-рецептором (FcRn), который ответствен за перенос материнских IgG эмбриону (Guyer R.L. и др., J. Immunol. 117, 1976, сс. 587-593 и Kim J.K. и др., J. Immunol. 24, 1994, сс. 2429-2434), описаны в US 2005/0014934. Эти антитела содержат Fc-область с одной или несколькими заменами, которые повышают связывание Fc-области с FcRn. Указанные варианты Fc-области включают варианты с заменами одного или нескольких следующих остатков Fc-области: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 или 434, например, замену остатка 434 в Fc-области (US №7371826). Дополнительные примеры, касающиеся других вариантов Fc-области, описаны также у Duncan A.R. и Winter G., Nature 322, 1988, сс.738-740; в US №5648260; US №5624821 и WO 94/29351.
Связывание с Fc-рецепторами можно легко определять, например, с помощью ELISA или поверхностного плазмонного резонанса (SPR), используя стандартный инструментарий, такой как устройство BIAcore (фирма GE Healthcare), и Fc-рецепторы, например, которые можно получать с помощью рекомбинантной экспрессии. В настоящем описании представлен приемлемый такой анализ связывания. Альтернативно этому, аффинность связывания Fc-доменов или клеток с активирующими биспецифическими антигенсвязывающими молекулами, которые содержат Fc-домен для Fc-рецепторов, можно оценивать, используя клеточные линии, для которых известно, что они экспрессируют конкретные Fc-рецепторы, такие как человеческие NK-клетки, экспрессирующие FcγIII-рецептор. Эффекторную функцию Fc-домена или биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, которые содержат Fc-домен, можно оценивать методами, известными в данной области. Приемлемый анализ для оценки ADCC представлен в настоящем описании. Другие примеры анализов in vitro, предназначенных для оценки ADCC-активности представляющей интерес молекулы, описаны в US №5500362; у Hellstrom и др., Proc Natl Acad Sci USA 83, 1986, cc. 7059-7063 и Hellstrom и др., Proc Natl Acad Sci USA 82, 1985, cc. 1499-1502; US №5821337; у Bruggemann и др., J Exp Med 166, 1987, cc. 1351-1361. Альтернативно этому, можно применять методы, основанные на нерадиоактивном анализе (см., например, ACTI™ - нерадиоактивный анализ цитотоксичности с помощью проточной цитометрии (фирма CellTechnology, Inc. Маунтин-Вью, шт. Калифорния); и CytoTox 96® - нерадиоактивный анализ цитотоксичности (фирма Promega, Мэдисон, шт. Висконсин)). Приемлемыми эффекторными клетками для таких анализов являются мононуклеарные клетки периферической крови (РВМС) и естественные клетки-киллеры (NK). В альтернативном или дополнительном варианте ADCC-активность представляющей интерес молекулы можно оценивать in vivo, например, с использованием созданных на животных моделей, описанных у Clynes и др., Proc Natl Acad Sci USA 95, 1998, cc. 652-656.
В следующем разделе описаны предпочтительные аспекты биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, которые содержат модификации Fc-домена, снижающие связывание Fc-рецептора и/или эффекторную функцию. Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, содержащая (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в которой Fc-домен содержит одну или несколько аминокислотную(ых) замену(н), которая(ые) снижает(ют) аффинность связывания антитела с Fc-рецептором, в частности, Fcγ-рецептором. Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, содержащая (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в которой Fc-домен содержит одну или несколько аминокислотную(ых) замену(н), которая(ые) снижает(ют) эффекторную функцию. В конкретном объекте изобретения Fc-домен представляет собой Fc-домен человеческого IgG1-подкласса с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно EU-индексу Кэбота).
Модификации Fc-домена. способствующие гетеродимеризации
Биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, содержат различные антигенсвязывающие сайты, слитые с одной или другой из двух субъединиц Fc-домена, при этом две субъединицы Fc-домена, как правило, могут содержаться в двух неидентичных полипептидных цепях. Рекомбинантная совместная экспрессия этих полипептидов и последующая димеризация приводят к нескольким возможным комбинациям двух полипептидов. Для повышения выхода и чистоты биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, при их получении методами рекомбинации целесообразно интродуцировать в Fc-домен биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, модификацию, которая способствует ассоциации требуемых полипептидов.
Таким образом, конкретные объекты изобретения относятся к биспецифической антигенсвязывающей молекуле, содержащей (а) по меньшей мере один антигенсвязывающий домен, который обладает способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающий домен, который обладает способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в которой Fc-домен содержит модификацию, которая способствует ассоциации первой и второй субъединиц Fc-домена. Сайт наиболее сильного белок-белкового взаимодействия двух субъединиц Fc-домена человеческого IgG находится в СН3-домене Fc-домена. Таким образом, в одном из объектов изобретения указанная модификация находится в СН3-домене Fc-домена.
В конкретном объекте изобретения указанная модификация представляет собой так называемую модификацию типа «knob-in-hole», которая включает модификацию, приводящую к образованию «выступа» на одной из двух субъединиц Fc-домена, и модификацию, приводящую к образованию «впадины» в другой одной из двух субъединиц Fc-домена. Таким образом, изобретение относится к биспецифической антигенсвязывающей молекуле, содержащей (а) по меньшей мере один антигенсвязывающи домен, обладающий способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающи домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в котором первая субъединица Fc-домена содержит «выступы», а вторая субъединица Fc-домена содержит «впадины» в соответствии с методом «knobs-into-holes». В конкретном объекте изобретения первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (EU-нумерация), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно EU-индексу Кэбота).
Технология «knob-into-hole» описана, например, в US №5731168; US №7695936; у Ridgway и др., Prot Eng 9, 1996, сс. 617-621 и Carter, J Immunol Meth 248, 2001, сс. 7-15. В целом, метод включает интродукцию выпуклости («выступ») на поверхности раздела первого полипептида и соответствующей полости («впадина») в поверхности раздела второго полипептида, в результате чего выпуклость может помещаться в полость, способствуя тем самым образованию гетеродимера и препятствуя образованию гомодимера. Выпуклости конструируют путем замены аминокислот с небольшими боковыми цепями на поверхности раздела первого полипептида на аминокислоты с более крупными боковыми цепями (например, на тирозин или триптофан). Компенсирующие полости идентичного или сходного с выпуклостями размера создают в поверхности раздела второго полипептида путем замены аминокислот с крупными боковыми цепями на аминокислоты с менее крупными боковыми цепями (например, аланин или треонин).
Согласно одному из объектов изобретения в СН3-домене первой субъединицы Fc-домена биспецифических антигенсвязывающих молекул, предлагаемых в изобретении, аминокислотный остаток заменен аминокислотным остатком, который имеет больший объем боковой цепи, что приводит к образованию выпуклости в СН3-домене первой субъединицы, которая может помещаться в полость в СН3-домене второй субъединицы, и в СН3-домене второй субъединицы Fc-домена аминокислотный остаток заменен аминокислотным остатком, который имеет меньший объем боковой цепи, что приводит к образованию полости в СН3-домене второй субъединицы, в которую может помещаться выпуклость в СН3-домене первой субъединицы. Выпуклость и полость можно создавать путем изменения нуклеиновых кислот, кодирующих полипептиды, например, с помощью сайтнаправленного мутагенеза или путем пептидного синтеза. В конкретном объекте изобретения в СН3-домене первой субъединицы Fc-домена остаток треонина в положении 366 заменен остатком триптофана (T366W), и в СН3-домене второй субъединицы Fc-домена остаток тирозина в положении 407 заменен остатком валина (Y407V). В одном из объектов изобретения во второй субъединице Fc-домена дополнительно остаток треонина в положении 366 заменен остатком серина (T366S) и остаток лейцина в положении 368 заменен остатком аланина (L368A).
В следующем объекте изобретения в первой субъединице Fc-домена дополнительно остаток серина в положении 354 заменен остатком цистеина (S354C) и во второй субъединице Fc-домена дополнительно остаток тирозина в положении 349 заменен остатком цистеина (Y349C). Интродукция этих двух остатков цистеина приводит к образованию дисульфидного мостика между двумя субъединицами Fc-домена, дополнительно стабилизирующего димер (Carter, J Immunol Methods 248, 2001, сс. 7-15). В конкретном объекте изобретения первая субъединица Fc-домена содержит аминокислотные замены S354C и T366W (EU-нумерация), а вторая субъединица Fc-домена содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно EU-индексу Кэбота).
В альтернативном объекте изобретения модификация, способствующая ассоциации первой и второй субъединиц Fc-домена, представляет собой модификацию, которая опосредует определяемые электростатическими силами воздействия, например, описанные в публикации РСТ WO 2009/089004. В целом, указанный метод включает замену одного или нескольких аминокислотных остатков на поверхности раздела двух субъединиц Fc-домена на заряженные аминокислотные остатки, в результате чего образование гомодимера становится электростатически невыгодным, а гетеродимеризация становится электростатически выгодной.
С-конец тяжелой цепи биспецифического антитела, представленного в настоящем описании, может представлять собой полный С-конец, заканчивающийся аминокислотными остатками PGK. С-конец тяжелой цепи может представлять собой укороченный С-конец, в котором один или два С-концевой(ых) аминокислотный(ых) остаток(ка) удален(ы). В одном из предпочтительных объектов изобретения С-конец тяжелой цепи представляет собой укороченный С-конец, заканчивающийся PG. В одном из вариантов всех указанных в настоящем описании объектов изобретения биспецифическое антитело, содержащее тяжелую цепь, которая включает С-концевой СН3-домен, указанный в настоящем описании, содержит С-концевой глицин-лизиновый дипептид (G446 и K447, нумерация согласно EU-индексу Кэбота). В одном из вариантов осуществления всех объектов изобретения, указанных в настоящем описании, биспецифическое антитело, содержащее тяжелую цепь, которая включает С-концевой СН3-домен, указанный в настоящем описании, содержит С-концевой остаток глицина (G446, нумерация согласно EU-индексу Кэбота).
Модификации в Fab-доменах
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, (б) второй Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, где в одном из Fab-фрагментов либо вариабельные домены VH и VL, либо константные домены СН1 и CL обменены. Биспецифические антитела получают согласно Crossmab-технологии.
Мультиспецифические антитела с заменой/обменом доменов в одном связывающем плече (CrossMabVH-VL или CrossMabCH-CL) подробно описаны в WO 2009/080252 и у Schaefer W. и др., Proc. Natl. Acad. Sci. USA, 108, 2011, cc. 11187-11191. При их применении значительно снижается образование побочных продуктов, связанное с ошибочным спариванием легкой цепи, которая связывается с первым антигеном, с «неправильной» тяжелой цепью, которая связывается со вторым антигеном (по сравнению с подходами, в которых не использован указанный обмен доменами).
Одним из объектов изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, (б) второй Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в которой в одном из Fab-фрагментов константные домены CL и СН1 заменены друг на друга, в результате чего СН1-домен является частью легкой цепи, а CL-домен является частью тяжелой цепи. Более конкретно, во втором Fab-фрагменте, который обладает способностью специфически связываться с антигеном клетки-мишени, константные домены CL и СН1 заменены друг на друга, в результате чего СН1-домен является частью легкой цепи, а CL-домен является частью тяжелой цепи.
Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, (б) второй Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, в которой константные домены CL и СН1 заменены друг на друга, в результате чего СН1-домен является часть легкой цепи, а CL-домен является частью тяжелой цепи. Указанную молекулу называют одновалентной биспецифической антигенсвязывающей молекулой.
Другим объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и (б) два дополнительных Fab-фрагмента, которые обладают способностью специфически связываться с антигеном клетки-мишени, в которой каждый из указанных дополнительных Fab-фрагментов соединен через пептидный линкер с С-концом тяжелых цепей, указанных в подпункте (а). В конкретном объекте изобретения дополнительные Fab-фрагменты представляют собой Fab-фрагменты, в которых вариабельные домены VL и VH заменены друг на друга, в результате чего VH-домен является частью легкой цепи, а VL-домен является частью тяжелой цепи.
Таким образом, конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, которая содержит (а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-домен, и (б) два дополнительных Fab-фрагмента, которые обладают способностью специфически связываться с антигеном клетки-мишени, в которой указанные два дополнительных Fab-фрагмента, которые обладают способностью специфически связываться с антигеном клетки-мишени, представляют собой кроссовер-Fab-фрагменты, в которых вариабельные домены VL и VH заменены друг на друга и каждая из VL-CH-цепей соединена через пептидный линкер с С-концом тяжелых цепей, указанных в подпункте (а).
В другом объекте изобретения и для дальнейшего улучшения правильного спаривания биспецифическая антигенсвязывающая молекула, содержащая (а) первый Fab-фрагмент, обладающий способностью специфически связываться с CD40, (б) второй Fab-фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации, может содержать различные замены заряженных аминокислот (так называемые «заряженные остатки»). Эти модификации интродуцируют в скрещенные или нескрещенные СН1- и CL-домены. Конкретным объектом изобретения является биспецифическая антигенсвязывающая молекула, в которой в одном из CL-доменов аминокислота в положении 123 (EU-нумерация) заменена на аргинин (R) и аминокислота в положении 124 (EU-нумерация) заменена на лизин (K) и в которой в одном из CL-доменов аминокислоты в положении 147 (EU-нумерация) и положении 213 (EU-нумерация) заменены на глутаминовую кислоту (Е).
Примеры антител, предлагаемых в изобретении
Одним из объектов изобретения являются новые антитела и фрагменты антител, которые специфически связываются с CD40. Эти антитела обладают улучшенными свойствами по сравнению с известными антителами к CD40, что делает их особенно предпочтительными для включения в биспецифические антигенсвязывающими молекулами, которые содержат другой антигенсвязывающий фрагмент, обладающий способностью специфически связываться с антигеном клетки-мишени. Новые антитела отличаются также тем, что их можно получать в больших количества и с высокими титрами, тем, что они обладают высокой термостабильностью (по данным измерений температуры агрегации Tagg), или тем, что они обладают более высокой степенью гуманизации и поэтому могут обладать меньшей иммуногенностью в организме человека. Процент гуманизации VH- и VL-последовательностей по сравнению с последовательностями человеческих зародышевых линий можно определять с помощью методов, описанных у Abhinandan К.R. и Martin Andrew С.R.J. Mol. Biol. 369, 2007, cc. 852-862. Соответствующие данные представлены в таблицах 24 и 25.
Одним из объектов изобретения является антитело, которое специфически связывается с CD40, где указанное антитело содержит
(I) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 171, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 175,
(II) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 173, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 177,
(III) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 174, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 178,
(IV) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 171, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 177,
(V) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 171, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 178,
(VI) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 173, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 175, или
(VII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 173, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 178, или
(VIII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 174, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 175, или
(VIII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 174, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 177, или
(IX) а тяжелая цепь вариабельная область VH содержит аминокислотную последовательность SEQ ID NO: 171, а легкая цепь вариабельную область VL содержит аминокислотную последовательность SEQ ID NO: 176, или
(X) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 172, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 175, или
(XI) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 172, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 176, или
(XII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 172, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 177, или
(XIII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 172, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 178, или
(XIV) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 173, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 176, или
(XV) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 174, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 176.
Другим объектом изобретения является антитело, которое конкурирует за связывание с антителом, которое специфически связывается с CD40, где указанное антитело содержит любую из вариабельных областей тяжелых цепей VH и вариабельных областей легких цепей VL, указанных выше в подпунктах (I)-(XV).
Одним из объектов изобретения является антитело, которое конкурирует за связывание с антителом, которое специфически связывается с CD40, где указанное антитело содержит вариабельную область тяжелой цепи VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, вариабельную область легкой цепи VL, которая содержит аминокислотную последовательность SEQ ID NO: 175.
Следующим объектом изобретения является антитело, которое специфически связывается с CD40, где указанное антитело содержит
(I) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 179, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 185,
(II) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 180, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 185,
(III) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 181, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 185,
(IV) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 182, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 185,
(V) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 179, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 186,
(VI) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 180, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 186, или
(VII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 181, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 186, или
(VIII) вариабельную область тяжелой цепи VH, содержащую аминокислотную последовательность SEQ ID NO: 182, и вариабельную область легкой цепи VL, содержащую аминокислотную последовательность SEQ ID NO: 186.
Другим объектом изобретения является антитело, которое конкурирует за связывание с антителом, которое специфически связывается с CD40, где указанное антитело содержит любую из вариабельных областей тяжелых цепей VH и вариабельных областей легких цепей VL, указанных выше в подпунктах (I)-(VIII).
Одним из объектов изобретения является антитело, которое конкурирует за связывание с антителом, которое специфически связывается с CD40, где указанное антитело содержит вариабельную область тяжелой цепи VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, вариабельную область легкой цепи VL, которая содержит аминокислотную последовательность SEQ ID NO: 185. В частности, предложено антитело, которое специфически связывается с CD40, где указанное антитело содержит вариабельную область тяжелой цепи VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, вариабельную область легкой цепи VL, которая содержит аминокислотную последовательность SEQ ID NO: 185.
Полинуклеотиды
Изобретение относится также к выделенным полинуклеотидам, которые кодируют биспецифическую антигенсвязывающую молекулу, указанную в настоящем описании, или ее фрагмент, или к полинуклеотидам, которые кодируют антитело, указанное в настоящем описании.
Выделенные полинуклеотиды, кодирующие биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, можно экспрессировать в виде индивидуального полинуклеотида, который кодирует полную антигенсвязывающую молекулу, или в виде нескольких (например, двух или большего количества) совместно экспрессируемых полинуклеотидов. Полипептиды, кодируемые совместно экспрессируемыми полинуклеотидами, можно объединять путем ассоциации, например, через дисульфидные связи или другими путями с получением функциональной антигенсвязывающей молекулы. Например, часть иммуноглобулина, представляющая собой легкую цепь, может кодироваться полинуклеотидом, отличным от полинуклеотида, кодирующего часть иммуноглобулина, представляющую собой тяжелую цепь. При совместной экспрессии полипептиды тяжелой цепи должны связываться с полипептидами легкой цепи с образованием иммуноглобулина.
В некоторых объектах изобретения выделенный полинуклеотид кодирует полипептид, который содержится в биспецифической молекуле, предлагаемой в изобретении, которая указана в настоящем описании.
Одним из объектов настоящего изобретения является выделенный полинуклеотид, который кодирует биспецифическую антигенсвязывающую молекулу, содержащую (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, и (в) Fc-домен, состоящий из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
В некоторых вариантах осуществления изобретения полинуклеотид или нуклеиновая кислота представляет собой ДНК. В других вариантах осуществления изобретения полинуклеотид, предлагаемый в настоящем изобретении, представляет собой РНК, например, в форме матричной РНК (мРНК). РНК, предлагаемая в настоящем изобретении, может быть одноцепочечной или двухцепочечной.
Методы рекомбинации
Биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, можно получать, например, методом рекомбинации. Для рекомбинантного получения применяют один или несколько полинуклеотидов, кодирующих биспецифическую антигенсвязывающую молекулу или ее полипептидные фрагменты. Один или несколько полинуклеотидов, кодирующих биспецифическую антигенсвязывающую молекулу, выделяют и встраивают в один или несколько векторов для дополнительного клонирования и/или экспрессии в клетке-хозяине. Указанный полинуклеотид можно легко выделять и секвенировать с помощью общепринятых процедур. Одним из объектов изобретения является вектор, предпочтительно экспрессионный вектор, содержащий один или несколько полинуклеотидов, предлагаемых в изобретении. Методы, хорошо известные специалистам в данной области, можно применять для конструирования экспрессионных векторов, содержащих кодирующую последовательность биспецифической антигенсвязывающей молекулы (фрагмента) наряду с приемлемыми контролирующими транскрипцию/трансляцию сигналами. Эти методы включают технологии рекомбинантной ДНК, методы синтеза и рекомбинации/генетической рекомбинации in vivo (см., например, методы, описанные у Maniatis и др., Maniatis и др., Molecular Cloning A Laboratory Manual, изд-во Cold Spring Harbor Laboratory, N.Y., 1989; и Ausubel и др., Current Protocols in Molecular Biology, изд-во Greene Publishing Associates and Wiley Interscience, N.Y., 1989). Экспрессионный вектор может представлять собой часть плазмиды, вируса или может представлять собой фрагмент нуклеиновой кислоты. Экспрессионный вектор включает кассету экспрессии, в которой полинуклеотид, кодирующий биспецифическую антигенсвязывающую молекулу или ее полипептидные фрагменты (т.е. кодирующую область), клонируют с обеспечением функциональной связи с промотором и/или другими элементами, контролирующими транскрипцию или трансляцию. В контексте настоящего описания «кодирующая область» представляет собой часть нуклеиновой кислоты, которая состоит из кодонов, транслируемых в аминокислоты. Хотя «стоп-кодон» (TAG, TGA или ТАА) не транслируется в аминокислоту, он, в случае его присутствия, может рассматриваться как часть кодирующей области, однако любые фланкирующие последовательности, например, промоторы, сайты связывания рибосом, терминаторы транскрипции, интроны, 5'- и 3'-нетранслируемые области и т.п., не являются частью кодирующей области. Две или большее количество кодирующих областей может присутствовать в индивидуальной полинуклеотидной конструкции, например, в индивидуальном векторе, или в отдельных полинуклеотидных конструкциях, например, в отдельных (различных) векторах. Кроме того, любой вектор может содержать одну кодирующую область или может содержать две или большее количество кодирующих областей, например, вектор, предлагаемый в настоящем изобретении, может кодировать один или несколько полипептидов, которые пост- или котранляционно разделяются на конечные белки посредством протеолитического расщепления. Кроме того, вектор, полинуклеотид или нуклеиновая кислота, предлагаемый/предлагаемая в изобретении, может кодировать гетерологичные кодирующие области, либо слитые, либо не слитые с полинуклеотидом, который кодирует биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, или ее полипептидные фрагменты или варианты, или производные. Гетерологичные кодирующие области включают (но не ограничиваясь только ими) специализированные элементы или мотивы, такие как секреторный сигнальный пептид или гетерологичный функциональный домен. Функциональная связь имеет место, когда кодирующая область генного продукта, например полипептида, ассоциирована с одной или несколькими регуляторными последовательностями таким образом, чтобы экспрессия генного продукта находилась под воздействием или контролем регуляторной(ых) последовательности(ей). Два ДНК-фрагмента (такие как кодирующая область полипептида и ассоциированный с ней промотор) являются «функционально связанными», если индукция промоторной функции приводит к транскрипции мРНК, кодирующей требуемый генный продукт, и если природа связи между двумя ДНК-фрагментами не оказывает воздействия на способность регулирующих экспрессию последовательностей направлять экспрессию генного продукта, или не оказывает воздействия на способность ДНК-матрицы к транскрипции. Таким образом, промоторная область должна быть функционально связана с нуклеиновой кислотой, кодирующей полипептид, если промотор обладает способностью осуществлять транскрипцию нуклеиновой кислоты. Промотор может представлять собой специфический для клетки промотор, который обеспечивает значительную транскрипцию ДНК только в предварительно отобранных клетках. Другие контролирующие транскрипцию элементы, помимо промотора, например, энхансеры, операторы, репрессоры и сигналы терминации транскрипции, можно функционально связывать с полинуклеотидом для обеспечения специфической для клетки транскрипции.
Приемлемые промоторы и другие контролирующие транскрипцию области представлены в настоящем описании. Специалистам в данной области известно широкое разнообразие контролирующих транскрипцию областей. Они включают (но не ограничиваясь только ими) контролирующие транскрипцию области, которые функционируют в клетках позвоночных животных, такие как (но не ограничиваясь только ими) сегменты промоторов и энхансеров из цитомегаловирусов (например, немедленно-ранний промотор в сочетании с интроном-А), обезьяньего вируса 40 (например, ранний промотор) и ретровирусов (таких как вирус саркомы Рауса). Другие контролирующие транскрипцию области включают области, выведенные из генов позвоночных животных, таких как ген актина, белка теплового шока, бычьего гормона роста и кроличьего β-глобина, а также другие последовательности, которые могут контролировать экспрессию генов в эукариотических клетках. Дополнительные приемлемые контролирующие транскрипцию области включают тканеспецифические промоторы и энхансеры, а также индуцибельные промоторы (например, промоторы, индуцируемые тетрациклинами). Аналогично этому, обычным специалистам в данной области известно широкое разнообразие контролирующих трансляцию элементов. Они включают (но не ограничиваясь только ими) сайты связывания рибосом, кодоны инициации трансляции и терминирующие кодоны и элементы, выведенные из вирусных систем (в частности внутренний сайт связывания (посадки) рибосом или IRES, который обозначают также как CITE-последовательность). Кассета экспрессии может включать также другие характерные структуры, такие как сайт инициации репликации и/или интегрированные в хромосому элементы, такие как длинные концевые повторы (LTR) ретровирусов, или инвертированные концевые повторы (ITR) аденоассоциированного вируса (AAV).
Кодирующие области полинуклеотида и нуклеиновой кислоты, предлагаемые в настоящем изобретении, могут быть ассоциированы с дополнительными кодирующими областями, которые кодируют секреторные или сигнальные пептиды, которые направляют секрецию полипептида, кодируемого полинуклеотидом, предлагаемым в настоящем изобретении. Например, если требуется секреция биспецифической антигенсвязывающей молекулы или ее полипептидных фрагментов, то ДНК, кодирующую сигнальную последовательность, можно помещать против хода транскрипции относительно нуклеиновой кислоты, кодирующей биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, или ее полипептидные фрагменты. Согласно гипотезе, касающейся сигналов, белки, секретируемые клетками млекопитающих, имеют сигнальный пептид или секреторную лидерную последовательность, который/которая отщепляется от зрелого белка после инициации экспорта растущей белковой цепи через шероховатый эндоплазматический ретикулум. Обычным специалистам в данной области должно быть очевидно, что полипептиды, секретируемые клетками позвоночных животных, как правило, имеют сигнальный пептид, слитый с N-концом полипептида, который отщепляется от транслируемого полипептида с образованием секретируемой или «зрелой» формы полипептида. В некоторых вариантах осуществления изобретения используют нативный сигнальный пептид, например, сигнальный пептид тяжелой цепи или легкой цепи иммуноглобулина или функциональное производное указанной последовательности, которое сохраняет способность обеспечивать секрецию полипептида, функционально связанного с ним. Альтернативно этому, можно применять гетерологичный сигнальный пептид млекопитающих или его функциональное производное. Например, лидерную последовательность дикого типа можно заменять на лидерную последовательность человеческого тканевого активатора плазминогена (ТРА) или мышиной β-глюкуронидазы.
ДНК, кодирующую короткую белковую последовательность, которую можно применять для облегчения дальнейшей очистки (например, гистидиновую метку), или предназначенную для мечения слитого белка, можно включать внутрь или на концы полинуклеотида, кодирующего биспецифическую антигенсвязывающую молекулу или ее полипептидные фрагменты.
Другим объектом изобретения является клетка-хозяин, содержащая один или несколько полинуклеотидов, предлагаемых в изобретении. Некоторыми объектами изобретения является клетка-хозяин, содержащая один или несколько векторов, предлагаемых в изобретении. Полинуклеотиды и векторы могут обладать любыми особенностями, индивидуально или в сочетании, указанными в настоящем описании касательно полинуклеотидов и векторов соответственно. В одном из объектов изобретения клетка-хозяин содержит вектор (например, трансформирована или трансфектирована вектором), содержащий полинуклеотид, который кодирует биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении (или ее часть). В контексте настоящего описания понятие «клетка-хозяин» относится к любому типу клеточной системы, которую можно конструировать для получения слитых белков, предлагаемых в изобретении, или их фрагментов. Клетки-хозяева, пригодные для репликации и для поддержания экспрессии антигенсвязывающих молекул, хорошо известны в данной области. Такие клетки можно трансфектировать или трансдуцировать соответствующим образом конкретным экспрессионным вектором и можно выращивать большее количество содержащих вектор клеток с целью внесения в ферментеры для крупномасштабных процессов получения антигенсвязывающей молекулы в достаточных для клинических применений количествах. Приемлемыми клетками-хозяевами являются прокариотические микроорганизмы, такие как Е. coli, или различные эукариотические клетки, такие как клетки яичника китайского хомячка (СНО), клетки насекомых или т.п. Например, полипептиды можно получать в бактериях, в частности, когда отсутствует потребность в гликозилировании. После экспрессии полипептид можно выделять из пасты бактериальных клеток в растворимую фракцию и можно дополнительно очищать. Помимо прокариот, в качестве хозяев для клонирования или экспрессии векторов, которые кодируют полипептид, можно использовать эукариотические микроорганизмы, такие как нитчатые грибы или дрожжи, включая штаммы грибов и дрожжей, пути гликозилирования которых были «гуманизированы», что позволяет получать полипептид с частично или полностью человеческой схемой гликозилирования (см. Gerngross, Nat. Biotech. 22, 2004, сс. 1409-1414 и Li и др., Nat. Biotech. 24, 2006, сс. 210-215).
Клетки-хозяева, которые можно использовать для экспрессии (гликозилированных) полипептидов, получают также из многоклеточных организмов (беспозвоночных и позвоночных животных). Примерами клеток беспозвоночных являются клетки насекомых, а также можно применять клетки растений. Были выявлены многочисленные бакуловирусные штаммы и соответствующие пригодные для них в качестве хозяев клетки насекомых, прежде всего для трансфекции клеток Spodoptera frugiperda. В качестве хозяев можно применять также культуры растительных клеток (см., например, US №№5959177, 6040498, 6420548, 7125978 и 6417429 (описание технологии PLANTIBODIES™ для получения антител в трансгенных растениях). В качестве хозяев можно применять также клетки позвоночных животных. Например, можно использовать клеточные линии млекопитающих, которые адаптированы к росту в суспензии. Другими примерами приемлемых линий клеток-хозяев млекопитающих являются линия клеток почки обезьяны CV1, трансформированная с помощью SV40 (COS-7); линия клеток почки эмбриона человека (293 или клетки линии 293, субклонированные с целью выращивания в суспензионной культуре, Graham и др., J. Gen. Virol., 36, 1977, с. 59); клетки почки детеныша хомяка (ВНК); клетки Сертоли мыши (ТМ4-клетки, описанные, например, у Mather, Biol. Reprod., 23, 1980, сс. 243-251); клетки почки обезьяны (CV1); клетки почки африканской зеленой мартышки (VERO-76,); клетки карциномы шейки матки человека (HELA); клетки почки собаки (MDCK); клетки печени бычьей крысы (BRL 3А); клетки легкого человека (W138); клетки печени человека (Hep G2); клетки опухоли молочной железы мыши (ММТ 060562); клетки TRI, описанные, например, у Mather и др., Annals N.Y. Acad. Sci., 383, 1982, сс. 44-68); клетки MRC 5 и клетки FS4. Другими ценными линиями клеток-хозяев млекопитающих являются клетки яичника китайского хомячка (СНО), включая dhfr--CHO-клетки (Urlaub и др., Proc. Natl. Acad. Sci. USA, 77, 1980, с. 4216); и клеточные линии миеломы, такие как Y0, NS0 и Sp2/0. Обзор конкретных линий клеток-хозяев млекопитающих, которые можно применять для производства белка, см., например, у Yazaki и Wu, в: Methods in Molecular Biology под ред. В.K.С. Lo, изд-во Humana Press, Totowa, NJ, т. 248, 2003, сс. 255-268. Клетки-хозяева включают культивируемые клетки, например, культивируемые клетки млекопитающих, клетки дрожжей, клетки насекомых, клетки бактерий и клетки растений (но не ограничиваясь только ими), а также клетки, находящиеся в организме трансгенного животного, трансгенного растения или культивируемой растительной или животной ткани. В одном из вариантов осуществления изобретения клетка-хозяин представляет собой эукариотическую клетку, предпочтительно клетку млекопитающего, такую как клетка яичника китайского хомячка (СНО), клетка почки человеческого эмбриона (HEK) или лимфоидная клетка (например, клетка Y0, NS0, Sp20). В данной области известны стандартные технологии для экспрессии чужеродных генов в этих системах. Клетки, экспрессирующие полипептид, содержащий либо тяжелую, либо легкую цепь иммуноглобулина, можно конструировать таким образом, чтобы в них происходила экспрессия других цепей иммуноглобулина, например, таким образом, чтобы экспрессируемый продукт представлял собой иммуноглобулин, который имеет как тяжелую, так и легкую цепь.
Одним из объектов изобретения является способ получения биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, или ее полипептидных фрагментов, где способ включает культивирование клетки-хозяина, содержащей полинуклеотиды, которые кодируют биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, или ее полипептидные фрагменты, представленные в настоящем описании, в условиях, пригодных для экспрессии биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, или ее полипептидных фрагментов, и выделение биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, или ее полипептидных фрагментов из клетки-хозяина (или культуральной среды клетки-хозяина).
Биспецифические молекулы, предлагаемые в изобретении, полученные с помощью представленных в настоящем описании методов, можно очищать с использованием известных в данной области методик, таких как жидкостная хроматография высокого разрешения, ионообменная хроматография, гель-электрофорез, аффинная хроматография, гель-фильтрация и т.п. Фактические условия, применяемые для очистки конкретного белка, зависят, в частности, от таких факторов, как чистый заряд, гидрофобность, гидрофильность и т.д., и они должны быть очевидны специалисту в данной области. Для очистки с помощью аффинной хроматографии можно использовать антитело, лиганд, рецептор или антиген, с которым связывается биспецифическая антигенсвязывающая молекула. Например, для очистки с помощью аффинной хроматографии слитых белков, предлагаемых в изобретении, можно использовать матрикс с белком А или белком G. Например, последовательное применение аффинной хроматографии на белке А или G и гель-фильтрации можно применять для выделения антигенсвязывающей молекулы практически согласно методу, описанному в разделе «Примеры». Чистоту биспецифической антигенсвязывающей молекулы или ее фрагментов можно определять с помощью любого из широкого разнообразия хорошо известных аналитических методов, включая гель-электрофорез, жидкостную хроматографию высокого давления и т.п. Например, установлено, что биспецифические антигенсвязывающие молекулы, экспрессия которых описана в разделе «Примеры», являются интактными и правильно собранными, что продемонстрировано с помощью ДСН-ПААГ в восстанавливающих и невосстанавливающих условиях.
Анализы
Антигенсвязывающие молекулы, представленные в настоящем описании, можно идентифицировать, подвергать скринингу или характеризовать их физические/химические свойства и/или виды биологической активности с помощью различных анализов, известных в данной области.
1. Анализ связывания
Связывание биспецифической антигенсвязывающей молекулы, представленной в настоящем описании, с соответствующими клетками, экспрессирующими мишень, можно оценивать, например, используя клеточную линию мышиных фибробластов, которая экспрессирует человеческий фибробласт-активирующий белок (FAP), и анализ методом проточной цитометрии (FACS). Связывание биспецифических антигенсвязывающих молекул, представленных в настоящем описании, с CD40, можно определять, используя клетки Raji, как описано в примере 4.2.8.
2. Анализы активности
Биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, тестировали в отношении биологической активности. Биологическая активность может включать эффективность и специфичность биспецифических антигенсвязывающих молекул. Эффективность и специфичность изучали с помощью анализов, демонстрирующих агонистическую передачу сигналов через CD40-рецептор после связывания с антигеном-мишенью. Кроме того, осуществляли анализы Т-клеточного примирования in vitro с использованием дендритных клеток (DC), которые инкубировали с биспецифическими антигенсвязывающими молекулами.
Фармацевтические композиции, препаративные формы и пути введения
Следующим объектом изобретения являются фармацевтические композиции, содержащие любую из биспецифических антигенсвязывающих молекул, представленных в настоящем описании, например, предназначенные для применения в любом из указанных ниже терапевтических способов. В одном из вариантов осуществления изобретения фармацевтическая композиция содержит любую из биспецифических антигенсвязывающих молекул, представленных в настоящем описании, и по меньшей мере один фармацевтически приемлемый носитель. В другом варианте осуществления изобретения фармацевтическая композиция содержит любую из биспецифических антигенсвязывающих молекул, представленных в настоящем описании, и по меньшей мере один дополнительный терапевтический агент, например, указанный ниже.
Фармацевтические композиции, предлагаемые в настоящем изобретении, содержат в терапевтически эффективном количестве одну или несколько биспецифических антигенсвязывающих молекул, которая(ые) растворена(ы) или диспергирована(ы) в фармацевтически приемлемом эксципиенте. Понятия «фармацевтически или фармакологически приемлемый» относится к молекулярным субстанциям и композициям, которые, в целом, нетоксичны для реципиентов в применяемых дозах и концентрациях, т.е. не вызывают вредные, аллергические или другие нежелательные реакции при введении при необходимости животному, такому, например, как человек. Приготовление фармацевтической композиции, которая содержит по меньшей мере одну биспецифическую антигенсвязывающую молекулу и необязательно дополнительное действующее вещество, должно быть очевидно специалистам в данной области в свете настоящего описания, например, из справочника Remington's Pharmaceutical Sciences, 18-ое изд., изд-во Mack Printing Company, 1990, включенного в настоящее описание в качестве ссылки. В частности, композиции представляют собой лиофилизированные препаративные формы или водные растворы. В контексте настоящего описания «фармацевтически приемлемый эксципиент» включает любые и все растворители, буферы, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактерильные агенты, противогрибные агенты), агенты для придания изотоничности, соли, стабилизаторы и их комбинации, которые должны быть известны обычному специалисту в данной области.
Парентеральные композиции включают композиции, созданные для введения путем инъекции, например, подкожной, внутрикожной, внутрь повреждения, внутривенной, внутриартериальной, внутримышечной, подоболочечной или внутрибрюшинной инъекции. Для инъекции биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, можно включать в препаративные формы в виде водных растворов, предпочтительно в физиологически совместимых буферах, таких как раствор Хэнкса, раствор Рингера или физиологический соляной буфер. Раствор может содержать предназначенные для получения препаративной формы агенты, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно этому, биспецифические антигенсвязывающие молекулы могут находиться в порошкообразной форме, предназначенной для восстановления перед применением приемлемым наполнителем, например, стерильной не содержащей пирогенов водой. Стерильные инъецируемые растворы приготавливают путем включения антигенсвязывающих молекул, предлагаемых в изобретении, в требуемом количестве в соответствующий растворитель при необходимости в сочетании с различными другими ингредиентами, перечисленными ниже. Стерильность можно легко обеспечивать, например, путем фильтрации через стерильные фильтрующие мембраны. Как правило, дисперсии получают путем включения различных стерилизованных действующих веществ в стерильный наполнитель, который содержит основную дисперсионную среду и/или другие ингредиенты. В случае стерильных порошков для получения стерильных инъецируемых растворов, суспензий или эмульсий предпочтительными методами получения являются вакуумная сушка или сушка вымораживанием, которые позволяют получать порошок действующего вещества в сочетании с любым дополнительным требуемым ингредиентом из предварительно стерилизованной фильтрацией жидкой среды. При необходимости жидкая среда перед осуществлением инъекции может быть соответствующим образом забуферена и жидкому разбавителю сначала придана изотоничность с помощью достаточного количества соляного раствора или глюкозы. Композиция должны быть стабильной в условиях приготовления и хранения и защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Принято поддерживать загрязнение эндотоксинами на минимальном безопасном уровне, например, менее 0,5 нг/мг белка. Пригодные фармацевтически приемлемые эксципиенты включают (но не ограничиваясь только ими): буферы, такие как фосфатный, цитратный и буферы на основе других органических кислот; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид; бензетонийхлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехол, резорцинол; циклогексанол; 3-пентанол и мета-крезол); низкомолекулярные (содержащие менее примерно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатирующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы с металлами (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как полиэтиленгликоль (ПЭГ). Водные суспензии для инъекций могут содержать соединения, которые повышают вязкость суспензии, такие как натриевая соль карбоксиметилцеллюлозы, сорбит, декстран или т.п. Необязательно суспензия может содержать также стабилизаторы или агенты, которые повышают растворимость соединений, что позволяет получать высококонцентрированные растворы. Кроме того, суспензии действующих веществ можно получать в виде соответствующих масляных предназначенных для инъекции суспензий. Приемлемые липофильные растворители или наполнители включают жирные нелетучие масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеаты или триглицериды, или липосомы.
Действующие вещества можно заключать в микрокапсулы, например, полученные с помощью методов коацервации или межфазной полимеризации, например в гидроксипропилметилцеллюлозные или желатиновые микрокапсулы и поли(метилметакрилатные) микрокапсулы соответственно, в коллоидные системы введения лекарственного средства (например, в липосомы, альбуминовые микросферы, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Такие методы описаны в Remington's Pharmaceutical Sciences (18-е изд., изд-во Mack Printing Company, 1990). Приемлемыми примерами препаратов с замедленным высвобождением являются полупроницаемые матрицы из твердых гидрофобных полимеров, включающие полипептид, такие матрицы представляют собой изделия определенной формы, например, пленки или микрокапсулы. В конкретном варианте осуществления изобретения для достижения пролонгированной абсорбции инъецируемой композиции можно применять в композиции агенты, замедляющие абсорбцию, такие, например, как моностеарат алюминия, желатин или их комбинации.
В контексте настоящего описания примеры фармацевтически приемлемых эксципиентов включают также диспергирующие агенты интерстициальных лекарственных средств, такие как растворимые активные в нейтральной среде гликопротеины гиалуронидаз (sHASEGP), например, человеческие растворимые гликопротеины гиалуронидазы РН-20, такие как rHuPH20 (HYLENEX®, фирма Baxter International, Inc.). Некоторые примеры sHASEGP и методы их применения, в том числе rHuPH20, описаны в публикациях патентов США 2005/0260186 и 2006/0104968. Согласно одному из объектов изобретения sHASEGP объединяют с одним или несколькими дополнительными гликозаминогликаназами, такими как хондроитиназы.
Примеры лиофилизированных композиций антител описаны в US №6267958. Водные композиции антител включают композиции, описанные в № US 6171586 и WO 2006/044908, последние композиции включают гистидин-ацетатный буфер.
Помимо описанных выше композиций, антигенсвязывающие молекулы можно приготавливать также в виде препарата в форме депо. Указанные препаративные формы длительного действия можно применять путем имплантации (например, подкожной или внутримышечной) или внутримышечной инъекции. Так, например, слитые белки можно включать в препаративные формы в сочетании с приемлемыми полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, умеренно растворимой соли.
Фармацевтические композиции, содержащие биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, можно приготавливать с помощью общепринятых процессов смешения, растворения, эмульгирования, капсулирования, захвата или лиофилизации. Фармацевтические композиции можно включать в препаративные формы с помощью общепринятого метода с использованием одного или нескольких физиологически приемлемых носителей, разбавителей, эксципиентов или вспомогательных веществ, которые облегчают обработку белков, с получением препаратов, которые можно применять в фармацевтических целях. Соответствующая форма зависит от выбранного пути введения.
Биспецифические антигенсвязывающие молекулы можно включать в композицию в виде свободной кислоты или свободного основания, в нейтральной форме или в форме соли. Фармацевтически приемлемые соли представляют собой соли, которые практически сохраняют биологическую активность свободной кислоты или свободного основания. Они включают кислотно-аддитивные соли, например, соли, образованные со свободными аминогруппами белковой композиции, или образованные с неорганическими кислотами, такими, например, как соляная или фосфорная кислота, или такими органическими кислотами, как уксусная, щавелевая, винная или миндальная кислота. Соли, образованные со свободной карбоксильной группой, можно получать также из неорганических оснований, таких, например, как гидроксиды натрия, калия, аммония, кальция или железа; или таких органических оснований как изопропиламин, триметиламин, гистидин или прокаин. Фармацевтические соли имеют тенденцию к более высокой растворимости в водных и других протонных растворителях по сравнению с соответствующими формами в виде свободных оснований.
Композиция, представленная в настоящем описании, может содержать также более одного действующего вещества, если это необходимо для конкретного подлежащего лечению показания, предпочтительно вещества с дополнительными видами активности, которые не оказывают отрицательного воздействия друг на друга. Такие действующие вещества должны присутствовать в комбинации в количествах, эффективных для решения поставленной задачи.
Композиции, предназначенные для применения in vivo, как правило, должны быть стерильными. Это легко можно осуществлять путем фильтрации через стерильные фильтрующие мембраны.
Способы и композиции для терапевтического применения
Любую из биспецифических антигенсвязывающих молекул, представленных в настоящем описании, можно применять в терапевтических способах. Для применения в терапевтических способах биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, можно включать в состав препаративных форм, дозировать и вводить в соответствии с надлежащей клинической практикой. Рассматриваемые в этом контексте факторы включают конкретное нарушение, подлежащее лечению, конкретное млекопитающее, подлежащее лечению, клиническое состояние индивидуального пациента, причину заболевания, область введения агента, метод введения, схему введения и другие факторы, известные практикующим медикам.
Одним из объектов изобретения являются биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, предназначенные для применения в качестве лекарственного средства.
В других объектах изобретения биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, предназначены для применения для
(I) индукции иммунной стимуляции посредством CD40+ антигенпрезентирующих клеток (АРС), (II) стимуляции опухольспецифического Т-клеточного ответа, (III) вызывания апоптоза опухолевых клеток, (IV) лечения рака, (V) замедления прогрессирования рака, (VI) пролонгирования времени жизни пациента, страдающего раком, (VII) лечения инфекций.
В некоторых объектах изобретения биспецифические антигенсвязывающие молекулы, предлагаемые в изобретении, предназначены для применения в способе лечения. Одним из объектов изобретения являются биспецифические антигенсвязывающие молекулы, представленные в настоящем описании, для применения для лечения заболевания у индивидуума, который нуждается в этом. Некоторыми объектами изобретения являются биспецифические антигенсвязывающие молекулы для применения в способе лечения индивидуума, который имеет заболевание, включающем введение индивидууму в терапевтически эффективном количестве биспецифической антигенсвязывающей молекулы. В некоторых объектах изобретения заболевание, подлежащее лечению, представляет собой рак. Субъект, пациент или «индивидуум», нуждающийся в лечении, представляет собой млекопитающее, более конкретно человека.
Одним из объектов изобретения является способ (I) индукции иммунной стимуляции посредством CD40+ антигенпрезентирующих клеток (АРС), (II) стимуляции опухольспецифического Т-клеточного ответа, (III) вызывания апоптоза опухолевых клеток, (IV) лечения рака, (V) замедления прогрессирования рака, (VI) пролонгирования времени жизни пациента, страдающего раком, (VII) лечения инфекций, где способ включает введение в терапевтически эффективном количестве биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, индивидууму, который нуждается в этом.
Следующим объектом изобретения является применение биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, для получения или производства лекарственного средства, предназначенного для лечения заболевания у индивидуума, который нуждается в этом. В одном из объектов изобретения лекарственное средство предназначено для применения в способе лечения заболевания, включающем введение индивидууму, имеющему заболевание, лекарственного средства в терапевтически эффективном количестве. В некоторых объектах изобретения заболевание, подлежащее лечению, представляет собой пролиферативное нарушение, в частности рак. Примеры видов рака включают (но не ограничиваясь только ими) рак мочевого пузыря, рак головного мозга, рак головы и шеи, рак поджелудочной железы, рак легкого, рак молочной железы, рак яичника, рак матки, рак шейки матки, рак эндометрия, рак пищевода, рак ободочной кишки, колоректальный рак, ректальный рак, рак желудка, рак предстательной железы, рак крови, рак кожи, плоскоклеточную карциному, рак кости и рак почки. Другие примеры рака включают карциному, лимфому (например, лимфому Ходжкина и неходжкинскую лимфому), бластому, саркому и лейкоз. Другие связанные с пролиферацией клеток нарушения, которые можно лечить с помощью биспецифической антигенсвязывающей молекулы или антитела, предлагаемой/предлагаемого в изобретении, включают (но не ограничиваясь только ими) неоплазмы, локализованные в: брюшном отделе, кости, молочной железе, пищеварительной системе, печени, поджелудочной железе, брюшной полости, эндокринных железах (надпочечники, паращитовидная, гипофиз, яички, яичник, тимус, щитовидная железа), глазах, голове и шеи, нервной системе (центральной и периферической), лимфатической системе, тазовой области, коже, мягкой ткани, селезенке, грудной области и мочеполовой системе. Также они включают предраковые состояния или повреждения и метастазы рака. В некоторых вариантах осуществления изобретения рак выбирают из группы, состоящей из почечно-клеточного рака, рака кожи, рака легкого, колоректального рака, рака молочной железы, рака головного мозга, рака головы и шеи. Специалисту в данной области должно быть очевидно, что во многих случаях биспецифическая антигенсвязывающая молекула или антитело, предлагаемая/предлагаемое в изобретении, не может обеспечивать исцеление, а может только оказывать благоприятное воздействие. В некоторых объектах изобретения физиологические изменения, характеризующиеся некоторым благоприятным воздействием, рассматриваются также как терапевтически ценные. Таким образом, в некоторых объектах изобретения количество биспецифической антигенсвязывающей молекулы или антитела, предлагаемой/предлагаемого в изобретении, которое обеспечивает физиологическое изменение, рассматривается как «эффективное количество» или «терапевтически эффективное количество».
Для предупреждения или лечения заболевания соответствующая доза биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении (при применении индивидуально или в комбинации с одним или несколькими другими дополнительными терапевтическими агентами) должна зависеть от типа заболевания, подлежащего лечению, пути введения, веса тела пациента, специфической молекулы, серьезности и течения заболевания, от того, вводят ли биспецифическую антигенсвязывающую молекулу в профилактических или терапевтических целях, предшествующих или осуществляемых одновременно терапевтических вмешательств, истории болезни пациента и ответа на слитый белок, и от предписания лечащего врача. Практикующий специалист, ответственный за введение, в любом случае, должен определять концентрацию действующего(их) вещества(в) в композиции и соответствующую(ие) дозу(ы) для индивидуального пациента. Различные схемы введения доз включают (но не ограничиваясь только ими) однократное введение или несколько введений в различные моменты времени, болюсное введение и пульсирующую инфузию.
Биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, можно вводить пациенту в виде одной обработки или серий обработок. В зависимости от типа и серьезности заболевания возможная начальная доза биспецифической антигенсвязывающей молекулы для введения пациенту, например, с использованием одного или нескольких индивидуальных введений или с помощью непрерывной инфузии, может составлять примерно от 1 мкг/кг до 15 мг/кг (например, 0,1-10 мг/кг). Типичная суточная доза может составлять от примерно 1 мкг/кг до 100 мг/кг или более в зависимости от отмеченных выше факторов. Для повторных введений в течение нескольких дней или более продолжительного периода в зависимости от состояния лечение, как правило, должно продолжаться до достижения требуемого подавления имеющихся симптомов заболевания. В качестве одного примера, доза биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, может составлять от примерно 0,005 до примерно 10 мг/кг.В других примерах доза на одно введение может составлять также от примерно 1, примерно 5, примерно 10, примерно 50, примерно 100, примерно 200, примерно 350, примерно 500 мкг/кг веса тела, от примерно 1, примерно 5, примерно 10, примерно 50, примерно 100, примерно 200, примерно 350, примерно 500 до примерно 1000 мг/кг веса тела или более, и находиться в любом из указанных диапазонов. Примерами диапазона, полученного на основе указанных значений, может служить диапазон от примерно 0,1 мг/кг веса тела до примерно 20 мг/кг веса тела, от примерно 5 мкг/кг веса тела до примерно 1 мг/кг веса тела и т.д. Так, пациенту можно вводить одну или несколько доз, составляющих примерно 0,5, 2,0, 5,0 или 10 мг/кг (или любую их комбинацию). Указанные дозы можно вводить прерывисто, например, каждую неделю или каждые три недели (например, таким образом, чтобы пациент получал от примерно двух до примерно двадцати или, например, примерно шесть доз слитого белка). Согласно конкретному объекту изобретения биспецифическую антигенсвязывающую молекулу можно вводить каждые три недели. Можно вводить начальную более высокую ударную дозу, после которой применять одну или несколько более низких доз. Однако можно использовать другие схемы введения доз. Успех такой терапии легко оценивать с помощью общепринятых методик и анализов.
Биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, как правило, следует применять в количестве, эффективном для достижения поставленной цели. При применении для лечения или предупреждения болезненного состояния биспецифическую антигенсвязывающую молекулу, предлагаемое в изобретении, или ее фармацевтические композиции вводят или применяют в терапевтически эффективном количестве. Определение терапевтически эффективного количества находится в компетенции специалистов в данной области, прежде всего в свете представленного подробного описания изобретения. Для системного введения терапевтически эффективную дозу можно сначала определять с помощью анализов in vitro, например, анализов с использованием клеточных культур. Затем дозу можно включать в форму для изучения на животных моделях для достижения концентрации в кровотоке, находящейся в диапазоне, включающем значение IC50, определенное на клеточной культуре. Указанную информацию можно использовать для более точного определения доз, которые можно применять на людях. Начальные дозы можно оценивать также, исходя из данных, полученных in vivo, например, на животных моделях, используя методики, хорошо известные в данной области. Обычный специалист в данной области легко может оптимизировать применение на людях на основе данных, полученных на животных.
Уровень доз и интервал можно регулировать индивидуально для получения уровней биспецифической антигенсвязывающей молекулы в плазме, которые являются достаточными для поддержания терапевтического действия. Обычные дозы, предназначенные для введения пациенту путем инъекции, составляют от примерно 0,1 до 50 мг/кг/день, как правило, от примерно 0,1 до 1 мг/кг/день. Для достижения терапевтически эффективных уровней в плазме можно вводить несколько доз каждый день. Уровни в плазме можно оценивать, например, с помощью ЖХВР. В случаях местного применения или избирательного поглощения эффективная местная концентрация биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, может не соответствовать концентрации в плазме. Специалист в данной области может оптимизировать терапевтически эффективные местные дозы без чрезмерных экспериментов.
Применение в терапевтически эффективной дозе биспецифической антигенсвязывающей молекулы, предлагаемой в изобретении, которая представлена в настоящем описании, должно, как правило, обеспечивать терапевтическую пользу, не вызывая существенной токсичности. Токсичность и терапевтическую эффективность слитого белка можно определять с помощью стандартных фармацевтических процедур на культурах клеток или экспериментальных животных. Анализы на клеточных культурах или опыты на животных можно применять для определения значений LD50 (доза, смертельная для 50% популяции) и ED50 (доза, терапевтически эффективная для 50% популяции). Соотношение доз, характеризующих токсические и терапевтические действия, обозначают как терапевтический индекс, который можно выражать в виде соотношения LD50/ED50. Биспецифические антигенсвязывающие молекулы, имеющие высокие терапевтические индексы, являются предпочтительными. В одном из вариантов осуществления изобретения биспецифическая антигенсвязывающая молекула или антитело, предлагаемая/предлагаемое в изобретении, характеризуется высоким терапевтическим индексом. Данные, полученные в анализах с использованием клеточных культур и в опытах на животных, можно использовать для определения диапазона доз, которые можно применять на людях. Доза лежит предпочтительно в диапазоне концентраций в кровотоке, которые включают ED50, обладающих невысокой токсичностью или не обладающих токсичностью. Доза может варьироваться в указанном диапазоне в зависимости от различных факторов, например, от применяемой лекарственной формы, применяемого пути введения, состояния индивидуума и т.п. Точную препаративную форму, путь введения и дозу может выбирать индивидуально врач в зависимости от состояния пациента (см., например, Fingl и др. в: The Pharmacological Basis of Therapeutics, глава 1, 1975, с. 1, публикация полностью включена в настоящее описание в качестве ссылки).
Лечащему врачу пациентов, которым вводят слитые белки, предлагаемые в изобретении, должно быть очевидно, как и когда заканчивать, прерывать или регулировать введение из-за токсичности, дисфункции органов и т.п. И, наоборот, лечащему врачу должно быть известно, как регулировать лечение в сторону применения более высоких доз, если клинический ответ является неадекватным (предотвращая токсичность). Величина вводимой дозы при лечении представляющего интерес нарушения должна варьироваться в зависимости от серьезности состояния, подлежащего лечению, пути введения и т.п. Серьезность состояния можно, например, оценивать среди прочего с помощью стандартных прогностических методов оценки. Кроме того, доза и предполагаемая частота введения дозы должны также варьироваться в зависимости от возраста, веса тела и ответа индивидуального пациента.
Другие средства и варианты лечения
Биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении, можно вводить в комбинации с одним или несколькими другими агентами для осуществления терапии. Например, биспецифическую антигенсвязывающую молекулу или антитело, предлагаемую/предлагаемое в изобретении, можно вводить совместно по меньшей мере с одним дополнительным терапевтическим агентом. Понятие «терапевтический агент» включает любое средство, которое вводят для лечения симптома или заболевания у индивидуума, который нуждается в таком лечении. Указанный дополнительный терапевтический агент может представлять собой любое действующее вещество, которое можно применять при конкретном показании, подлежащем лечению, предпочтительно с дополнительными видами активности, которые не оказывают отрицательное действие друг на друга. В некоторых вариантах осуществления изобретения дополнительный терапевтический агент представляет собой другой противораковый агент, например, агент, разрушающий микротрубочки, антиметаболит, ингибитор топоизомеразы, ДНК-интеркалятор, алкилирующий агент, средство гормональной терапии, ингибитор киназ, антагонист рецептора, активатор апоптоза опухолевых клеток или антиангиогенный агент. В некоторых объектах изобретения дополнительный терапевтический агент представляет собой иммуномодулятор, цитостатический агент, ингибитор клеточной адгезии, цитотоксический или цитостатический агент, активатор апоптоза клеток или агент, который повышает чувствительность клеток к индукторам апоптоза.
Таким образом, изобретение относится к биспецифическим антигенсвязывающим молекулам, предлагаемым в изобретении, или фармацевтическим композициям, содержим их, предназначенным для применения для лечения рака, где биспецифическую антигенсвязывающую молекулу вводят в комбинации с химиотерапевтическим агентом, лучевой терапией и/или другими агентами, применяемыми в иммунотерапии рака.
Указанные другие агенты могут присутствовать в комбинации в количествах, эффективных для указанных целей. Эффективное количество указанных других средств зависит от количества применяемого слитого белка, типа нарушения или лечения, и других указанных выше факторов. Биспецифическую антигенсвязывающую молекулу или антитело, предлагаемую/предлагаемое в изобретении, как правило, применяют в таких же дозах и с использованием указанных в настоящем описании путей введения, или в дозах, составляющих примерно от 1 до 99% от указанных в настоящем описании доз, или в любой дозе и с использованием любого пути введения, которые согласно эмпирическим/клиническим данным рассматриваются как приемлемые.
Отмеченные выше комбинированные терапии предусматривают совместное введение (когда два или большее количество терапевтических агентов включают в одну и ту же или в отдельные композиции) и раздельное введение, в этом случае введение биспецифической антигенсвязывающей молекулы или антитела, предлагаемой/предлагаемого в изобретении, можно осуществлять до, одновременно и/или после введения дополнительного терапевтического агента и/или адъюванта.
Изделия
Другим объектом изобретения является изделие, которое содержит продукты, применяемые для лечения, предупреждения и/или диагностирования указанных выше нарушений. Изделие представляет собой контейнер и этикетку или листовку-вкладыш в упаковку, которые размещены на контейнере или прилагаются к нему. Приемлемыми контейнерами являются, например банки, пузырьки, шприцы, пакеты для внутривенного (IV) раствора и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластмасса. Контейнер содержит композицию, которая сама по себе или в сочетании с другой композицией является эффективной для лечения, предупреждения и/или диагностирования состояния, и может иметь стерильный порт доступа (например, контейнер может представлять собой пакет для внутривенного раствора или пузырек, снабженный пробкой, которую можно прокалывать с помощью иглы для подкожных инъекций). По меньшей мере одно действующее вещество в композиции представляет собой биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении.
На этикетке или листовке-вкладыше в упаковку указано, что композицию применяют для лечения выбранного состояния. Кроме того, изделие может включать (а) первый контейнер с находящейся в нем композицией, где композиция содержит биспецифическую антигенсвязывающую молекулу, предлагаемую в изобретении; и (б) второй контейнер с находящейся в нем композицией, где композиция содержит дополнительный цитотоксический или иной терапевтический агент. Согласно этому варианту осуществления изобретения изделие может содержать также листовку-вкладыш в упаковку, которая содержит информацию о том, что композиции можно использовать для лечения конкретного состояния.
В альтернативном или дополнительном варианте изделие может дополнительно включать второй (или третий) контейнер с фармацевтически приемлемым буфером, таким как бактериостатическая вода для инъекций (БСВИ), забуференный фосфатом физиологический раствор, раствор Рингера и раствор декстрозы. Кроме того, оно может включать другие материалы, необходимые с коммерческой точки зрения и с точки зрения потребителя, в частности, другие буферы, разбавители, фильтры, иглы и шприцы.
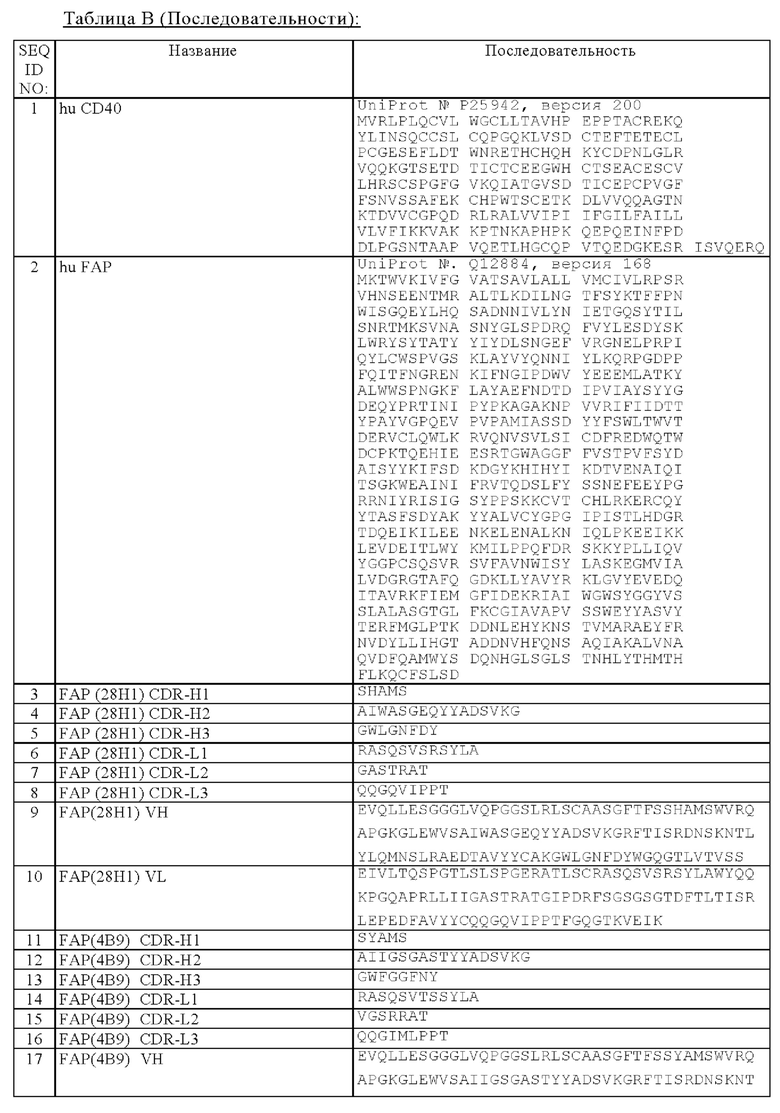
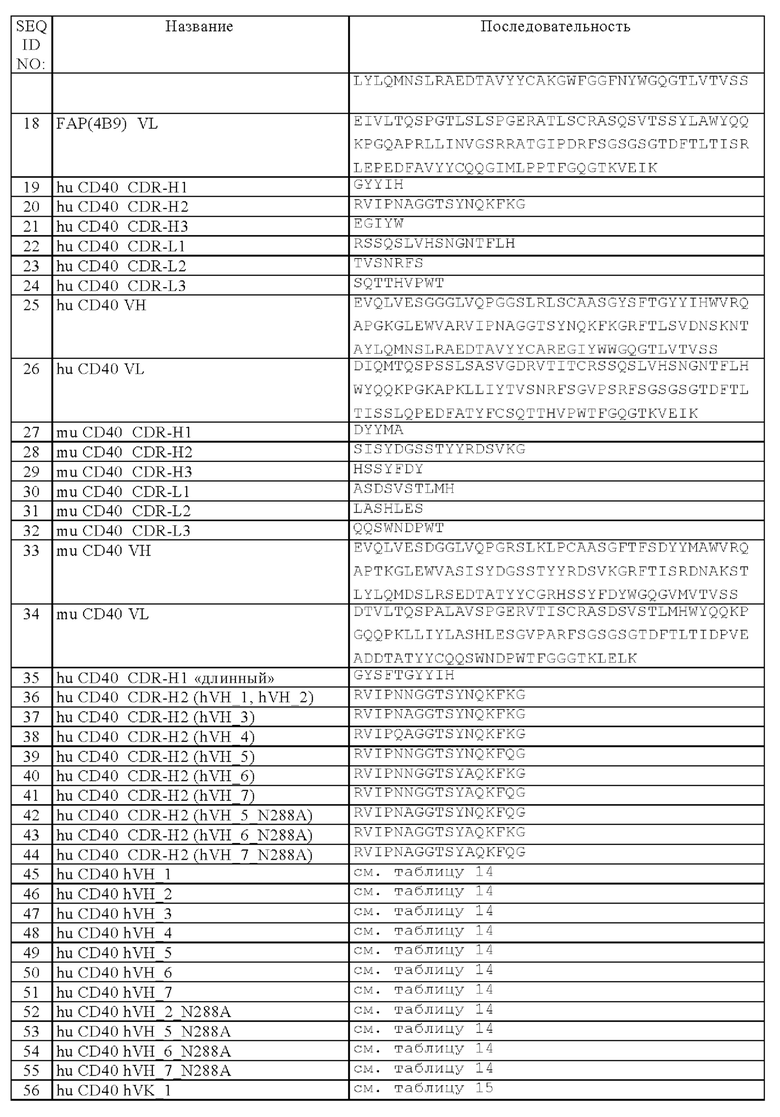
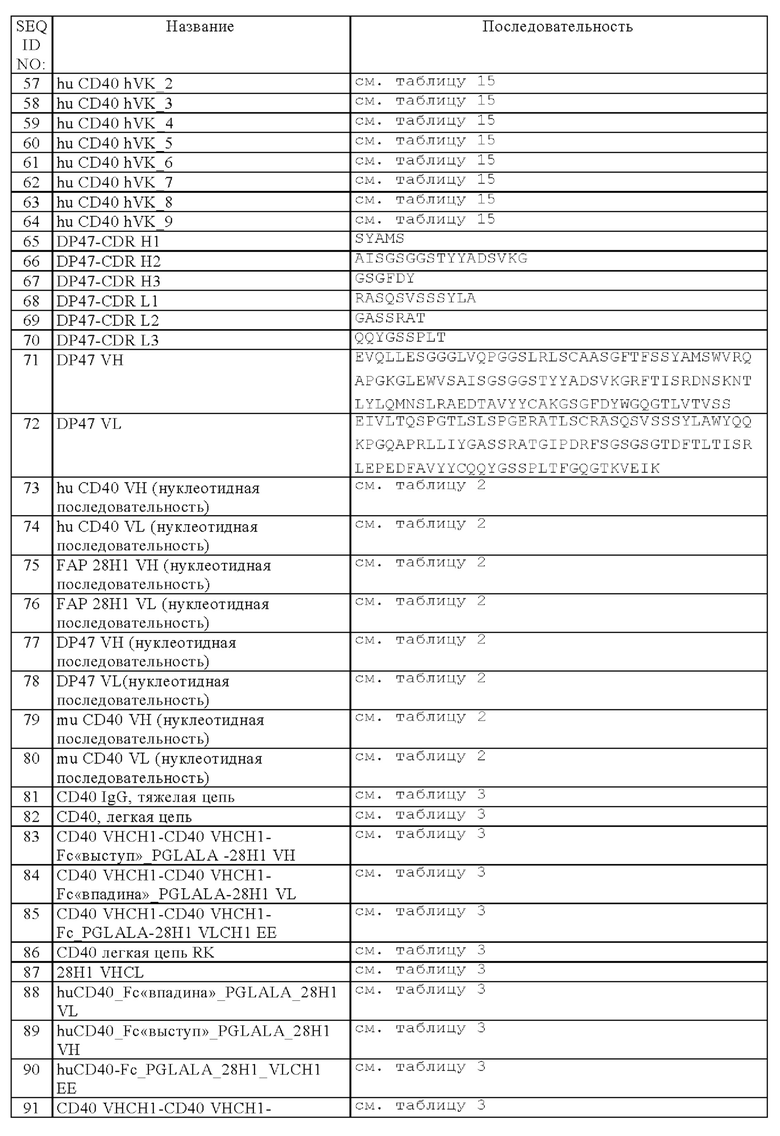
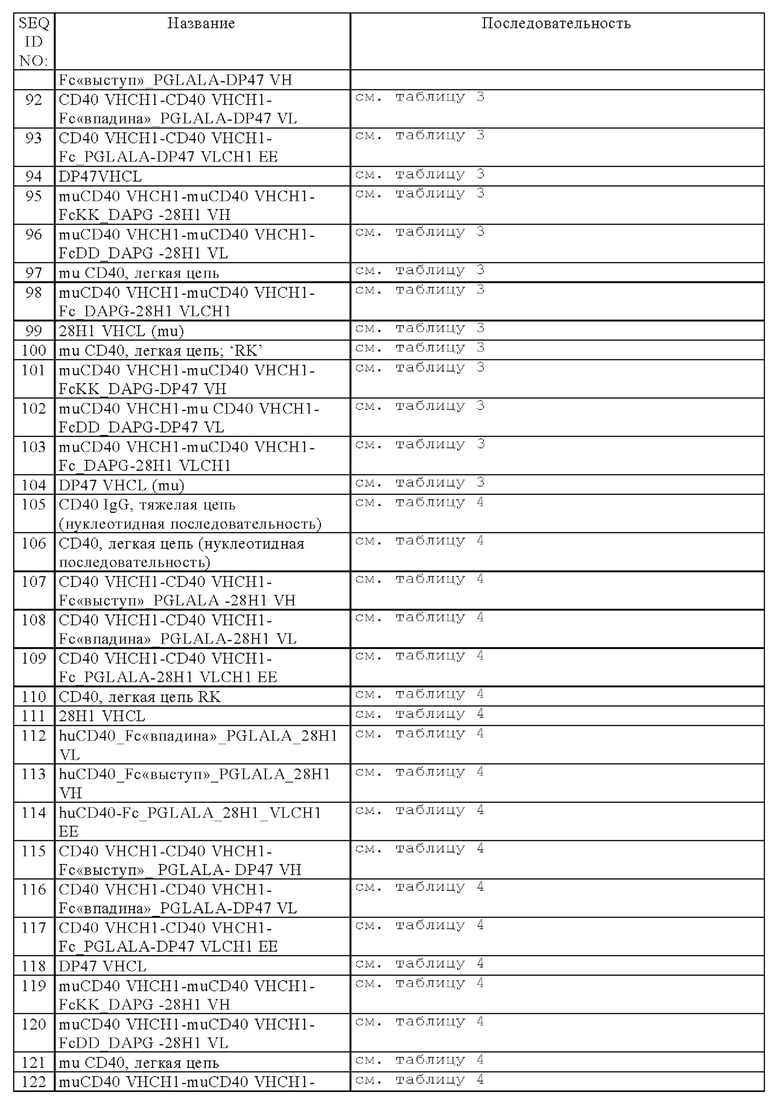
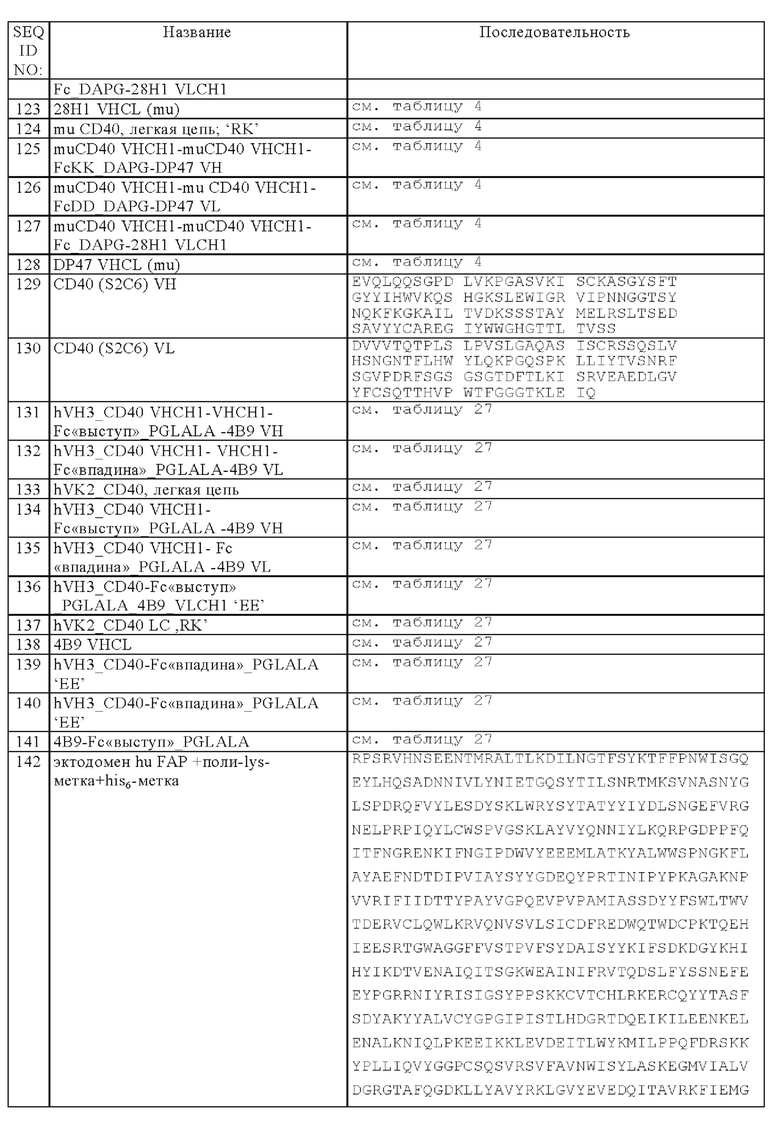

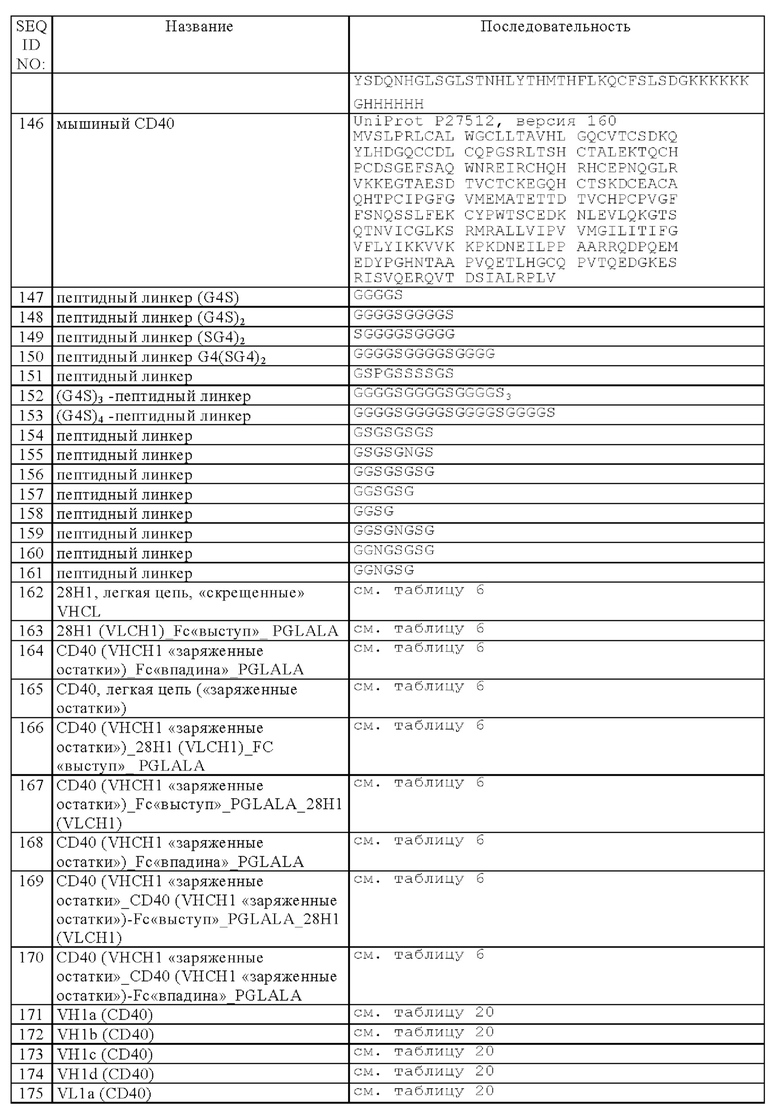

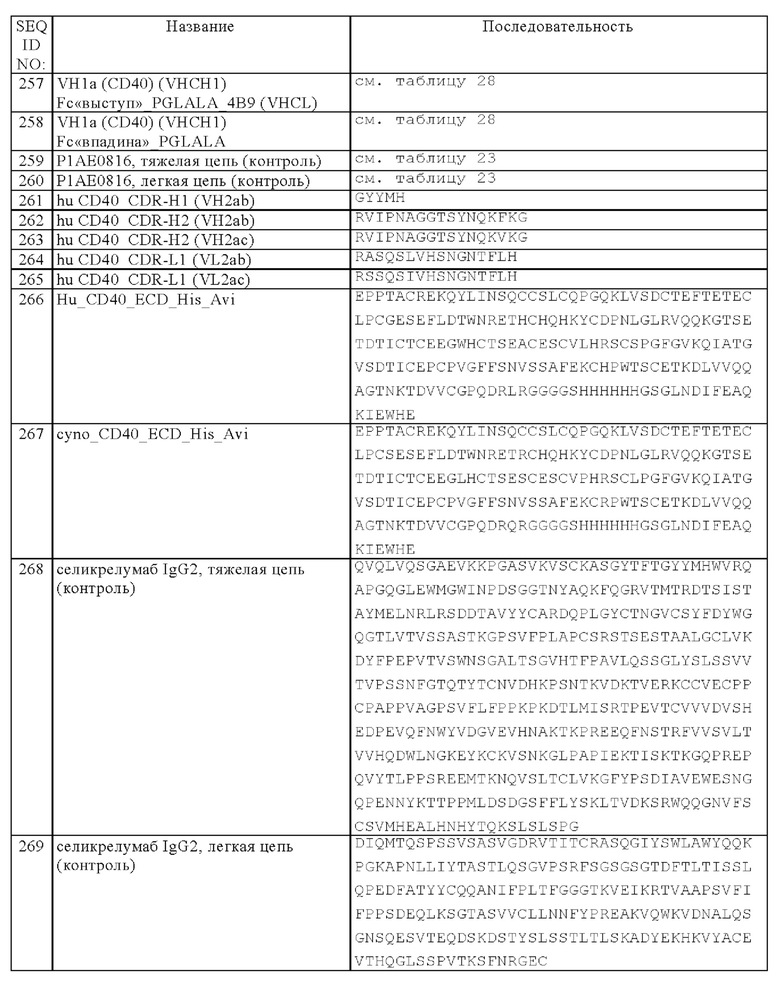
Ниже в пронумерованных параграфах (пунктах) перечислены объекты настоящего изобретения согласно первой приоритетной заявке:
1. Биспецифическая антигенсвязывающая молекула, содержащая
(а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и
(б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени.
2. Биспецифическая антигенсвязывающая молекула по п. 1, дополнительно содержащая
(в) Fc-область, состоящую из первой и второй субъединиц, которые обладают способностью к стабильной ассоциации.
3. Биспецифическая антигенсвязывающая молекула по п. 1 или п. 2, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 1.
4. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-3, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с антигеном клетки-мишени, представляет собой антигенсвязывающий домен, обладающий способностью специфически связываться с фибробласт-активирующим белком (FAP).
5. Биспецифическая антигенсвязывающая молекула по п. 1 или п. 2, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 2.
6. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-5, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит
(а) вариабельную область тяжелой цепи (VHFAP) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 3, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 4, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 5, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 6, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 7, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 8, или
(б) вариабельную область тяжелой цепи (VHFAP) которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 11, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 12, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 13, и вариабельную область легкой цепи (VLFAP), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 14, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 15, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 16.
7. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-6, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP содержит
(а) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 10, или
(б) вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность, которая по меньшей мере примерно на 95%, 96%, 97%, 98%, 99% или 100% идентична аминокислотной последовательности SEQ ID NO: 18.
8. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-7, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит (а) вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 19, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 20, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
9. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-7, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит (а) вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 27, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 28, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 29, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 30, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 31, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 32.
10. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-9, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 25, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 26, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 33, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 34.
11. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-8, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64.
12. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-8 или 11, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, содержит VH, которая содержит аминокислотную последовательность SEQ ID NO: 47, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 57.
13. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-8, содержащая
(I) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, который содержит вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 25, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54 и SEQ ID NO: 55, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 26, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 9, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 10, или вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
14. Биспецифическая антигенсвязывающая молекула по одному из п.п. 2-13, в которой Fc-область представляет собой Fc-область IgG, в частности, Fc-область IgG1 или Fc-область IgG4.
15. Биспецифическая антигенсвязывающая молекула по одному из п.п. 2-14, в которой Fc-область содержит одну или несколько аминокислотную(ых) замену(н), которая(ые) снижает(ют) аффинность связывания антитела с Fc-рецептором и/или эффекторную функцию.
16. Биспецифическая антигенсвязывающая молекула по одному из п.п. 2-15, в которой Fc-область представляет собой (I) Fc-область человеческого IgG1-подкласса с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно EU-индексу Кэбота), или (II) Fc-область мышиного IgG1-подкласса с аминокислотными мутациями D265A и P329G (нумерация согласно EU-индексу Кэбота).
17. Биспецифическая антигенсвязывающ молекула по одному из п.п. 2-16, в которой Fc-область содержит модификацию, способствующую ассоциации первой и второй субъединиц Fc-области.
18. Биспецифическая антигенсвязывающая молекула по одному из п.п. 2-17, в которой первая субъединица Fc-области содержит «выступы», а вторая субъединица Fc-области содержит «впадины» в соответствии с методом «knobs into holes».
19. Биспецифическое антитело по одному из п.п. 2-18, в котором
(I) первая субъединица Fc-области содержит аминокислотные замены S354C и T366W (нумерация согласно EU-индексу Кэбота), а вторая субъединица Fc-области содержит аминокислотные замены Y349C, T366S и Y407V (нумерация согласно EU-индексу Кэбота), или
(II) первая субъединица Fc-области содержит аминокислотные замены K392D и K409D (нумерация согласно EU-индексу Кэбота), а вторая субъединица Fc-области содержит аминокислотные замены E356K и D399K (нумерация согласно EU-индексу Кэбота).
20. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, которые соединены с Fc-областью, и
(б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области.
21. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, где VH-область соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и VL-область соединена с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
22. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) две легкие цепи и две тяжелые цепи антитела, содержащего два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, и Fc-область, и
(б) два Fab-фрагмента, обладающих способностью специфически связываться с FAP, где один из Fab-фрагментов соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), а другой Fab-фрагмент соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
23. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) VH и VL антигенсвязывающего домена, обладающего способностью специфически связываться с FAP, где VH соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), и где VL соединена с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
24. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) два Fab-фрагмента, обладающих способностью специфически связываться с FAP, где один из Fab-фрагментов соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а), а другой Fab-фрагмент соединен с С-концом другой из двух тяжелых цепей, указанных в подпункте (а).
25. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-19, где биспецифическая антигенсвязывающая молекула содержит
(а) две тяжелые цепи, где каждая тяжелая цепь содержит VH и СН1-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и субъединицу Fc-области,
(б) две легкие цепи, где каждая легкая цепь содержит VL и CL-домен Fab-фрагмента, обладающего способностью специфически связываться с CD40, и
(в) один Fab-фрагмент, обладающий способностью специфически связываться с FAP, где Fab-фрагмент соединен с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
26. Биспецифическая антигенсвязывающая молекула по одному из п.п. 22-25, в которой Fab-фрагмент или два Fab-фрагмента, обладающий(их) способностью специфически связываться с FAP, представляет(ют) собой кроссовер-Fab-фрагменты, каждый из которых содержит VL-CH1-цепь и VH-CL-цепь, и в которых VL-CH1-цепь соединена с С-концом одной из двух тяжелых цепей, указанных в подпункте (а).
27. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-26, где биспецифическая антигенсвязывающая молекула содержит четыре Fab-фрагмента, которые обладают способностью специфически связываться с CD40.
28. Биспецифическая антигенсвязывающая молекула по одному из п.п. 23-27, в которой каждая из двух тяжелых цепей, указанных в подпункте (а), содержит две VH-области и два СН1-домена Fab-фрагмента, обладающего способностью специфически связываться с CD40.
29. Биспецифическая антигенсвязывающая молекула по одному из п.п. 23-28, в которой один или несколько Fab-фрагментов, обладающий(их) способностью специфически связываться с CD40, содержит(ат) CL-домен, содержащий аргинин (R) в аминокислотном положении 123 (нумерация согласно EU-индексу Кэбота) и лизин (K) в аминокислотном положении 124 (нумерация согласно EU-индексу Кэбота), и СН1-домен, содержащий глутаминовую кислоту (Е) в аминокислотном положении 147 (нумерация согласно EU-индексу Кэбота) и глутаминовую кислоту (Е) в аминокислотном положении 213 (нумерация согласно EU-индексу Кэбота).
30. Полинуклеотид, кодирующий биспецифическую антигенсвязывающую молекулу по одному из п.п. 1-29.
31. Экспрессионный вектор, содержащий полинуклеотид по п. 30.
32. Клетка-хозяин, содержащая полинуклеотид по п. 30 или экспрессионный вектор по п. 31.
33. Способ получения биспецифической антигенсвязывающей молекулы, включающий культивирование клетки-хозяина по п. 32 в условиях, пригодных для экспрессии биспецифической антигенсвязывающей молекула, и выделение биспецифической антигенсвязывающей молекулы.
34. Фармацевтическая композиция, содержащая биспецифическую антигенсвязывающую молекулу по одному из п.п. 1-29 и по меньшей мере один фармацевтически приемлемый эксципиент.
35. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-29, или фармацевтическая композиция по п. 34, предназначенная для применения в качестве лекарственного средства.
36. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-29 или фармацевтическая композиция по п. 34, предназначенная для применения для
(I) индукции иммунной стимуляции посредством CD40+ антигенпрезентирующих клеток (АРС),
(II) стимуляции опухольспецифического Т-клеточного ответа,
(III) вызывания апоптоза опухолевых клеток,
(IV) лечения рака,
(V) замедления прогрессирования рака,
(VI) пролонгирования времени жизни пациента, страдающего раком,
(VII) лечения инфекций.
37. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-29 или фармацевтическая композиция по п. 34, предназначенная для применения для лечения рака.
38. Применение биспецифической антигенсвязывающей молекулы по одному из п.п. 1-29 или фармацевтической композиции по п. 34 для приготовления лекарственного средства, предназначенного для лечения рака.
39. Способ лечения индивидуума, который имеет рак, включающий введение индивидууму в эффективном количестве биспецифической антигенсвязывающей молекулы по одному из п.п. 1-29 или фармацевтической композиции по п. 34.
40. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-29 или фармацевтическая композиция по п. 34, предназначенная для применения для повышающей регуляции или пролонгирования активности цитотоксической Т-клетки.
41. Биспецифическая антигенсвязывающая молекула по одному из п.п. 1-29 или фармацевтическая композиция по п. 34, предназначенная для применения для лечения рака, где биспецифическую антигенсвязывающую молекулу вводят в комбинации с химиотерапевтическим агентом, лучевой терапией и/или другими агентами, предназначенными для применения в иммунотерапии рака.
Примеры
Ниже представлены примеры способов и композиций, предлагаемых в изобретении. Как должно быть очевидно, можно воплощать на практике различные другие варианты осуществления изобретения в целом с учетом представленного выше описания изобретения.
Методы рекомбинантной ДНК
Для манипуляций с ДНК использовали стандартные методы, описанные у Sambrook J. и др., Molecular cloning: A laboratory manual; изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 1989. Реагенты для молекулярной биологии применяли согласно инструкциям производителей. Общую информацию, касающуюся нуклеотидных последовательностей легких и тяжелых цепей человеческих иммуноглобулинов, см. у: Kabat Е.А. и др., Sequences of Proteins of Immunological Interest, 5-ое изд., NIH, публикация N 91-3242, 1991.
Секвенирование ДНК
Последовательности ДНК определяли путем секвенирования двух цепей.
Синтез генов
Требуемые сегменты генов либо создавали с помощью ПЦР с использованием соответствующих матриц, либо синтезировали на фирме Geneart AG (Регенсбург, Германия) из синтетических олигонуклеотидов и ПЦР-продуктов посредством автоматического синтеза генов. В тех случаях, когда точная генная последовательность не была доступна, создавали олигонуклеотидные праймеры на основе последовательностей ближайших гомологов и гены выделяли с помощью ОТ-ПЦР из РНК, полученной из соответствующей ткани. Сегменты генов, фланкированные единичными сайтами, распознаваемыми рестрикционными эндонуклеазами, клонировали в стандартных клонирующих/секвенирующих векторах. Плазмидную ДНК очищали из трансформированных бактерий и определяли концентрацию с помощью УФ-спектроскопии. Последовательность ДНК субклонированных фрагментов генов подтверждали ДНК-секвенированием. Создавали сегменты генов с требуемыми сайтами рестрикции, позволяющими субклонировать их в соответствующих экспрессионных векторах. Все конструкции создавали с 5'-концевой последовательностью ДНК, кодирующей лидерный пептид, который направляет секрецию белков в эукариотических клетках.
Очистка белков
Белки очищали из профильтрованных супернатантов клеточных культур согласно стандартному протоколу. В целом, метод состоял в следующем: антитела вносили в колонку с белок А-Сефарозой (фирма GE Healthcare) и промывали с помощью ЗФР. Элюцию антител осуществляли при значении рН 2,8, после чего немедленно проводили нейтрализацию образца. Агрегированный белок отделяли от мономерных антител с помощью гель-фильтрации (Супердекс 200, фирма GE Healthcare) в ЗФР или в буфере, содержащем 20 мМ гистидин, 150 мМ NaCl, рН 6,0. Фракции мономерных антител объединяли, концентрировали (при необходимости), используя, например, центрифужный концентратор MILLIPORE Amicon Ultra (30 MWCO), замораживали и хранили при температуре -20°С или -80°С. Часть образцов использовали для последующего аналитического анализа белков и аналитической характеризации, например, с помощью ДСН-ПААГ, гель-фильтрации (SEC) или масс-спектрометрии.
ДСН-ПААГ
Гелевую систему NuPAGE® Pre-Cast (фирма Invitrogen) применяли согласно инструкции производителя. В частности, применяли 10% или 4-12% гели NuPAGE® Novex® Bis-TRIS Pre-Cast (pH 6,4) и подвижный буфер NuPAGE® MES (восстановленные гели с антиоксидантной добавкой для подвижного буфера NuPAGE®) или MOPS (невосстановленные гели).
КЭ-ДСН (капиллярный электрофорез в присутствии додецилсульфата натрия)
Чистоту, целостность антител и молекулярную массу биспецифических и контрольных антител анализировали с помощью КЭ-ДСН, используя микрофлюидную технологию Labchip (фирма Caliper Life Science, США). 5 мкл белкового раствора подготавливали для КЭ-ДСН-анализа, используя набор НТ Protein Express Reagent согласно инструкциям производителя, и анализировали с помощью системы LabChip GXII, применяя чип НТ Protein Express. Данные анализировали с помощью программного обеспечения LabChip GX, версия 3.0.618.0.
Аналитическая гель-фильтрация
Гель-фильтрацию (SEC) для определения агрегированного и олигомерного состояния антител осуществляли с помощью ЖХВР-хроматографии. В целом, метод состоял в следующем: очищенные на белке А антитела вносили в колонку Tosoh TSKgel G3000SW в 300 мМ NaCl, 50 мМ KH2PO4/K2HPO4, рН 7,5, при использовании ЖХВР-системы Agilent 1100 или в колонку Супердекс 200 (фирма GE Healthcare) в 2×ЗФР при использовании ЖХВР-системы Dionex. Элюированные белки оценивали количественно с помощью УФ-абсорбции и интегрирования площадей пиков. В качестве стандарта служил BioRad Gel Filtration Standard 151-1901.
Масс-спектрометрия
В этом разделе описана характеризация мультиспецифических антител с VH/VL-обменом или CH/CL-обменом (CrossMab) в отношении их правильной сборки. Ожидаемые первичные структуры анализировали с помощью масс-спектрометрии с использованием ионизация электроспреем (ESI-MC) дегликозилированных интактных CrossMab и дегликозилированных/FabALACTICA или в альтернативном варианте дегликозилированных/расщепленных GingisKHAN CrossMab.
CrossMab дегликозилировали с помощью N-гликозидазы F в фосфатном или Трис-буфере при 37°С в течение вплоть до 17 ч с использованием белка в концентрации 1 мг/мл. Расщепления FabALACTICA или GingisKHAN (фирма Genovis АВ; Швеция) осуществляли в буферах, поставляемых продавцом, с использованием 100 мкг дегликозилированных CrossMab. Перед осуществлением масс-спектрометрии образцы обессоливали посредством ЖХВР на колонке Сефадекс G25 (фирма GE Healthcare). Общую массу определяли с помощью ESI-MC с использованием МС-системы maXis 4G UHR-QTOF (фирма Bruker Daltonik), снабженной источником TriVersa NanoMate (фирма Advion).
Пример 1
Создание и получение биспецифических конструкций, таргетирующих CD40 и фибробласт-активирующий белок (FAP)
1.1 Создание биспецифических антигенсвязывающих молекул, таргетирующих CD40 и фибробласт-активирующий белок (FAP)
кДНК, кодирующие вариабельные домены тяжелых и легких цепей анти-CD40-связывающего агента (SEQ ID NO: 10 и SEQ ID NO: 16 в WO 2006/128103), клонировали в рамке считывания с соответствующими константными доменами тяжелых или легких цепей человеческого IgG1 в пригодных экспрессионных плазмидах. Экспрессия тяжелых и легких цепей находилась под контролем химерного промотора MPSV, состоящего из корового промотора MPSV и эехансерного элемента CMV. Кассета экспрессии содержала также синтетический поли(А)-сигнал на 3'-конце кДНК. Кроме того, плазмидные векторы несли сайт инициации репликации (EBV OriP) для поддержания плазмид в эписомах. Аминокислотные и нуклеотидные последовательности вариабельных доменов МАт к CD40 и МАт к FAP представлены в таблицах 1 и 2 соответственно.
Различные биспецифические антитела к CD40-FAP получали в форматах 4+1 и 4+2, которые состояли из четырех CD40-связывающих фрагментов, объединенных либо с одним, либо с двумя FAP-связывающими плечами на С-конце Fc, или в форматах 2+1 и 2+2, которые состояли из двух CD40-связывающих фрагментов, объединенных либо с одним, либо с двумя FAP-связывающими плечами на С-конце Fc (фиг. 1А-1Г). Создание и получение FAP-связывающего агента 28Н1 описано в WO 2012/020006 А2, которая включена в настоящее описание в качестве ссылки. Для создания молекул в форматах 4+1 и 2+1 применяли технологию «knob-into-hole» для достижения гетеродимеризации. Мутации S354C/T366W интродуцировали в первую тяжелую цепь HC1 (тяжелая цепь с Fc с «выступом»), а мутации Y349C/T366S/L368A/Y407V интродуцировали во вторую тяжелую цепь НС2 (тяжелая цепь с Fc с «впадиной»). При создании молекул в формате 4+2 и 2+2 CrossMab-технология, описанная в WO 2010/145792 А1, гарантировала правильное спаривание легкой цепи. Вне зависимости от биспецифического формата во всех случаях применяли Fc с «молчащей» эффекторной функцией (P329G; L234, L235A) для аннулирования способности связываться с Fcγ-рецепторами согласно методу, описанному в WO 2012/130831 А1. Последовательности биспецифических молекул представлены в таблицах 3 и 4.
Помимо молекул, таргетирующих человеческие рецепторы, создавали также суррогатные (являющиеся аналогами) молекулы в таком же формате, которые распознавали мышиные антигены. В этих случаях гетеродимеризация молекул в формате 4+1 достигалась с помощью мутаций DD/KK (интродукция мутаций Lys392Asp и Lys409Asp в первую тяжелую цепь и интродукция мутаций Glu356Lys и Asp399Lys во вторую тяжелую цепь) в Fc-область согласно методу, описанному у Gunasekaran и др., J. Biol. Chem. 2010, сс. 19637-19646, а способность связываться с Fc-рецепторами ингибировали с помощью мутаций D270A/P329G согласно методу, описанному у Baudino и др., J. Immunol. 181, 2008, сс. 6664-6669 или в WO 2016/030350 А1.
Все гены кратковременно экспрессировали под контролем химерного промотора MPSV, состоящего из корового промотора MPSV и энхансерного фрагмента промотора CMV. Экспрессионный вектор содержал также OriP-область для эписомальной репликации в содержащих EBNA (ядерный антиген вируса Эпштейна-Барра) в клетках-хозяевах.






















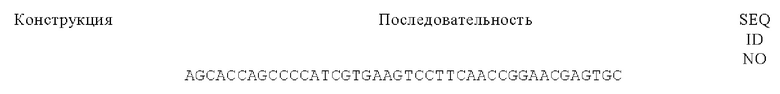
1.2 Получение биспецифических антигенсвязывающих молекул, таргетирующих CD40 и фибробласт-активирующий белок (FAP)
Молекулы получали путем котрансфекции либо растущих в суспензии клеток HEK293-EBNA экспрессионными векторами для клеток млекопитающих, используя полиэтиленимин (ПЭИ), либо котрансфекции растущих в суспензии клеток СНО K1 экспрессионными векторами для клеток млекопитающих, используя eviFECT. Клетки трансфектировали соответствующими экспрессионными векторами.
Для получения в клетках HEK293 EBNA клетки HEK293 EBNA культивировали в суспензии бессывороточной культуральной среды Excell, содержащей 6 мМ L-глутамин и 250 мг/л G418. Для получения в 600-миллилитровые колбы TubeSpin (максимальный рабочий объем 400 мл) засевали 600 млн клеток HEK293-EBNA за 24 ч до трансфекции. Для трансфекции 800 млн клеток центрифугировали в течение 5 мин при 210×g и супернатант заменяли 20 мл предварительно нагретой среды CD СНО. Экспрессионные векторы смешивали в 20 мл среды CD СНО до достижения конечного количества ДНК 400 мкг. После добавления 1080 мкл раствора ПЭИ (2,7 мкг/мл) смесь интенсивно перемешивали в течение 15 с и затем инкубировали в течение 10 мин при комнатной температуре. Затем клетки смешивали с раствором ДНК/ПЭИ, переносили в 600-миллилитровую колбу TubeSpin и инкубировали в течение 3 ч при 37°С в инкубаторе в атмосфере с 5% CO2. После инкубации добавляли 360 мл среды Excell, дополненной 6 мМ L-глутамином, 5 г/л соевого пептида (PEPSOY) и 1,0 мМ VPA (вальпроевая кислота), и клетки культивировали в течение 24 ч. Через 1 день после трансфекции добавляли 12% Feed 7 и 3 г/л глюкозы. После культивирования в течение 7 дней супернатант собирали для очистки центрифугированием в течение 60 мин при 2500×g (центрифуга Sigma 8K). Раствор стерилизовали фильтрацией (0,22 мкм-фильтр) и добавляли азид натрия до конечной концентрации 0,01% (мас./об.) и выдерживали при 4°С.
Для получения в клетках HEK293 EBNA клетки HEK293 EBNA в виде адаптированных для роста в суспензии клеток СНО K1 (адаптированные к росту в бессывороточной среде в суспензионной культуре) выращивали в среде eviGrow (фирма evitria AG, Швейцария), бессывороточной среде определенного химического состава, свободной от полученных из животных компонентов, и трансфектировали с помощью eviFect (фирма evitria AG, Швейцария). После трансфекции клетки выдерживали в среде eviMake (фирма evitria AG, Швейцария), бессывороточной среде определенного химического состава, свободной от полученных из животных компонентов, при 37°С и 5% СО2 в течение 7 дней.
Через 7 дней супернатант культуры собирали и очищали центрифугированием в течение 45 мин при максимальной скорости в устройстве Rotanta 460 RC. Раствор стерилизовали фильтрацией (0,22 мкм-фильтр) и выдерживали при 4°С. Концентрацию молекул в культуральной среде определяли либо с помощью белок А-ЖХВР, либо с помощью белок А-биослойной интерферометрии (BLI).
Секретированный белок очищали из супернатантов клеточных культур с помощью аффинной хроматографии на белке А с последующей хроматографической стадией гель-фильтрации. Для осуществления аффинной хроматографии супернатант вносили в колонку HiTrap MabSelect SuRe (объем колонки (CV)=5 мл, фирма GE Healthcare), уравновешенную 25 мл буфера, содержащего 20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5. Несвязанный белок удаляли путем промывки буфером, содержащим 20 мМ фосфат натрия, 20 мМ цитрат натрия, рН 7,5, используя его в объеме, кратном по меньшей 10 объемам колонки, а требуемый белок элюировали с использованием буфера, содержащего 20 мМ цитрат натрия, 100 мМ хлорид натрия, 100 мМ глицин, рН 3, используя его в объеме, кратном 6 объемам колонки. Белковый раствор нейтрализовали путем добавления 1/10 0,5М раствора фосфата натрия, рН 8,0. Требуемый белок концентрировали и фильтровали перед внесением в колонку HiLoad XK16/60 Супердекс 200 (фирма GE Healthcare), уравновешенную буфером, содержащим 20 мМ гистидин, 140 мМ хлорид натрия, рН 6,0, 0,01% Твин20. Концентрацию белка очищенного белкового образца определяли на основе измерения оптической плотности (ОП) при 280 нм с использованием коэффициента молярной экстинкции, рассчитанного на основе аминокислотной последовательности.
Чистоту и молекулярную массу молекулы после окончательной стадии очистки анализировали с помощью КЭ-ДСН в присутствии восстановителя и без него. Применяли систему Caliper LabChip GXII (фирма Caliper Lifescience) согласно инструкции производителя.
Содержание агрегатов молекул анализировали, используя колонку для аналитической гель-фильтрации TSKgel G3000 SW XL (фирма Tosoh), уравновешенную подвижным буфером, содержащим 25 мМ фосфат калия, 125 мМ хлорид натрия, 200 мМ моногидрохлорид L-аргинина, 0,02% (мас./об.) NaN3, рН 6,7, при 25°С.
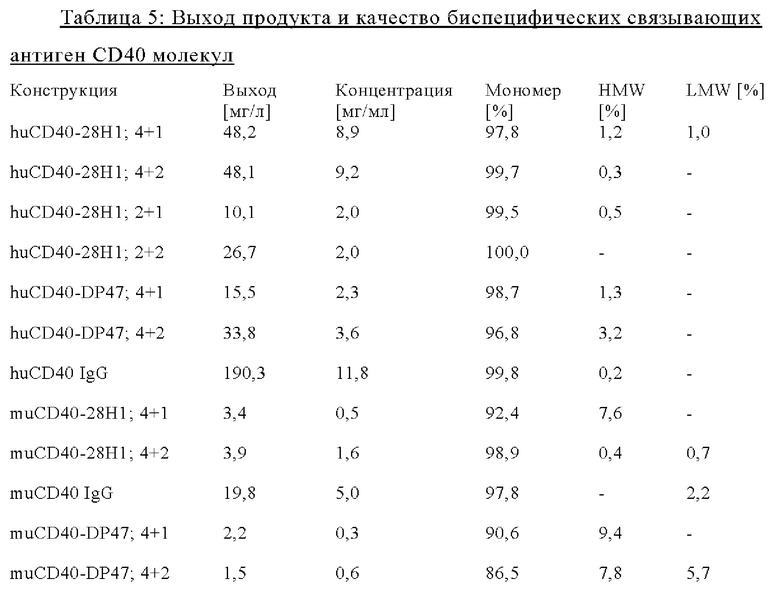
1.3 Создание дополнительных биспецифических антигенсвязывающих молекул, таргетирующих CD40 и фибробласт-активирующий белок (FAP)
По аналогии с примером 1.1 получали различные типы конструкций биспецифических антител к CD40-FAP. Например, получали биспецифическое антитело, состоящее из одного CD40-связывающего фрагмента, объединенного с одним FAP-связывающим фрагментом (фиг. 15А). Поскольку применяли CrossMab-технологию, описанную в WO 2010/145792 А1, для гарантии правильного спаривания легкой цепи, формат обозначали как 1+1-crossMab. Получали другой формат 2+1, обозначенный как «голова-к-хвосту», в котором CD40-связывающий Fab сливали с N-концом FAP-связывающего Fab (фиг. 15Б), а также создавали формат 2+1, состоящий из двух CD40-связывающих фрагментов, объединенных либо с одним FAP-связывающим crossFab на С-конце Fc (фиг. 1Д). Кроме того, получали формат 4+1, состоящий из четырех CD40-связывающих фрагментов, объединенных с одним FAP-связывающим crossFab на С-конце Fc (фиг. 14В). Во всех этих конструкциях вариабельные домены тяжелых и легких цепей анти-CD40-связывающего агента соответствовали CD40-связывающему агенту, описанному в WO 2006/128103 (SEQ ID NO: 10 и SEQ ID NO: 16 указанного документа). Создание и получение FAP-связывающего агента 28Н1 описано в WO 2012/020006 А2, которая включена в настоящее описание в качестве ссылки. Для создания молекул в форматах 1+1, 2+1 и 4+1 использовали технологию «knob-into-hole» для достижения гетеродимеризации. Мутации S354C/T366W интродуцировали в первую тяжелую цепь НС1 (тяжелая цепь с Fc с «выступом»), а мутации Y349C/T366S/L368A/Y407V интродуцировали во вторую тяжелую цепь НС2 (тяжелая цепь с Fc с «впадиной»). Кроме того, применяли CrossMab-технологию, описанную в WO 2010/145792 А1, для гарантии правильного спаривания легкой цепи. Вне зависимости от биспецифического формата во всех случаях применяли Fc с «молчащей» эффекторной функцией (P329G; L234, L235A) для аннулирования способности связываться с Fcy-рецепторами согласно методу, описанному в WO 2012/130831 А1. Аминокислотные последовательности биспецифических молекул представлены в таблице 6.
Все гены кратковременно экспрессировали под контролем химерного промотора MPSV, состоящего из корового промотора MPSV и энхансерного фрагмента промотора CMV. Экспрессионный вектор содержал также OriP-область для эписомальной репликации в содержащих EBNA (ядерный антиген вируса Эпштейна-Барра) клетках-хозяевах.
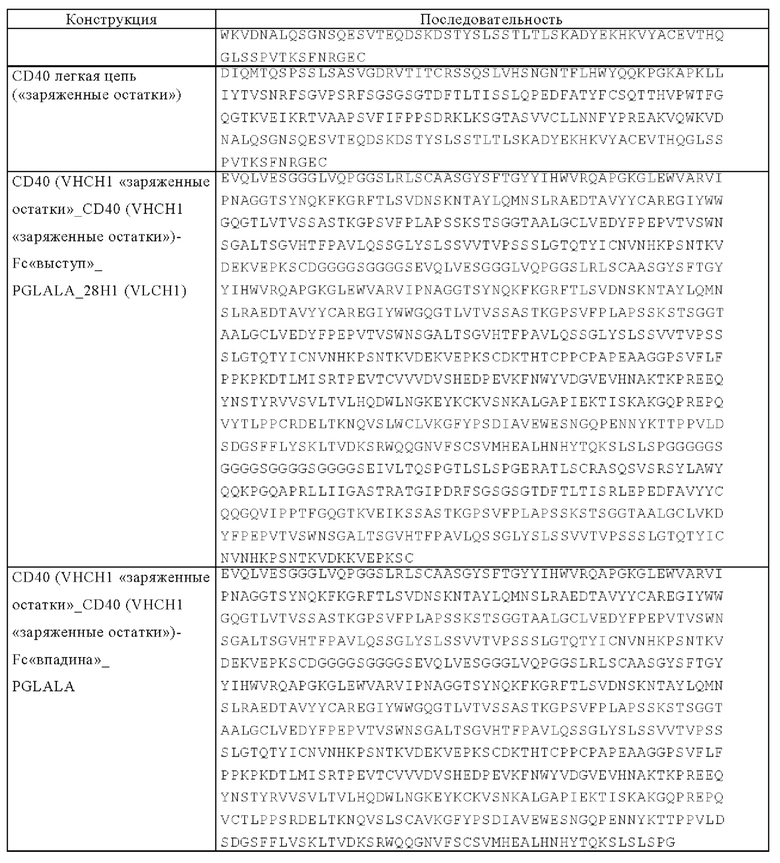
Экспрессия биспецифических антител
Антитела экспрессировали путем кратковременной трансфекции HEK-клеток, растущих в суспензии, экспрессионными векторами, кодирующими 4 различных пептидных цепи. Трансфекцию клеток HEK293-F (фирма Invitrogen) осуществляли согласно инструкциям поставщика клеток, используя препараты Maxiprep (фирма Qiagen) векторов для антител, среду F17 (фирма Invitrogen, США), Peipro (фирма Polyscience Europe GmbH) и начальную клеточную плотность 1-2 млн жизнеспособных клеток/мл бессывороточной среды для экспрессии FreeStyle 293 (фирма Invitrogen). Супернатанты клеточных культур собирали после 7 дней культивирования во встряхиваемых колбах или ферментерах с перемешивающими устройствами путем центрифугирования при 14000 g в течение 30 мин и фильтровали через 0,22-микрометровый фильтр.
Очистка биспецифических антител
Антитела очищали из супернатантов клеточных культур с помощью аффинной хроматографии, используя MabSelectSure-Sepharose™ (фирма GE Healthcare, Швеция). В целом, метод состоял в следующем: стерильные профильтрованные супернатанты клеточных культур осаждали на смолу MabSelect SuRe, уравновешенную ЗФР-буфером (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4), промывали буфером для уравновешивания и элюировали 25 мМ цитратным буфером, рН 3,0. После нейтрализации с помощью 1М Трис, рН 9,0 агрегированный белок отделяли от мономерных видов антител с помощью гель-фильтрации (Супердекс 200, фирма GE Healthcare) в буфере, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Фракции мономерных белков объединяли, при необходимости концентрировали, используя, например, центрифужный концентратор MILLIPORE Amicon Ultra (MWCO 30 кДА), и хранили при температуре -80°С. Аликвоты образцов использовали для последующего аналитического анализа белков и аналитической характеризации, например, с помощью КЭ-ДСН, гель-фильтрации, масс-спектрометрии и определения эндотоксинов.
1.4 Характеризация биспецифических конструкций, таргетирующих CD40 и FAP
1.4.1 Связывание с клетками мышиных фибробластов, экспрессирующих человеческий или мышиный FAP
Связывание с находящимся на клеточной поверхности FAP тестировали с использованием экспрессирующих человеческий фибробласт-активирующий белок (huFAP) клеток NIH/3T3-huFAP клона 19, или клеток, экспрессирующих мышиный фибробласт-активирующий белок (mFAP) NIH/3T3-mFAP клона 26. Клон 19 NIH/3T3-huFAP и клон 26 NIH/3T3-mFAP создавали путем трансфекции клеточной линии мышиных эмбриональных фибробластов NIH/3T3 (АТСС CRL-1658) экспрессионным вектором pETR4921 с целью экспрессии в условиях селекции пуромицином в концентрации 1,5 мкг/мл huFAP или mFAP соответственно. Клетки NIH/3T3 дикого типа (wt), которых не трансфектировали FAP и которые не экспрессировали FAP, применяли в качестве отрицательного контроля.
Клетки NIH/3T3-huFAP, NIH/3T3-mFAP или NIH/3T3-wt культивировали с использованием 1-кратной модифицированной по методу Дульбекко среды Игла (DMEM) (фирма gibco, каталожный №42430-025), дополненной 10% фетальной бычьей сыворотки (FBS) (фирма life technologies, каталожный №.16140, партия №1797306А). При использовании клеток NIH/3T3-huFAP и NIH/3T3-mFAP в среду добавляли пуромицин в концентрации 1,5 мкг/мл (фирма gibco, каталожный № A11138-03) для селекции экспрессирующих FAP клеток. Клетки NIH/3T3 удаляли из планшета с помощью не содержащего ферментов буфера для диссоциации клеток (фирма gibco, каталожный №13151014). Добавляли по 0,3×105 клеток NIH/3T3-huFAP клона 19, NIH/3T3-mFAP клона 26 или NIH/3T3-wt в 200 мкл 1×DMEM, дополненной 10% FBS, в каждую лунку круглодонного 96-луночного планшета (фирма greiner bio-one, cellstar, каталожный №650185). Планшеты центрифугировали в течение 5 мин при 1700 об/мин и супернатанты отбирали. Клетки промывали однократно 200 мкл холодного (4°С) FACS-буфера (фирма eBioscience, каталожный №00-4222-26). Все образцы ресуспендировали в 50 мкл/лунку холодного (4°С) FACS-буфера, содержащего биспецифические антигенсвязывающие молекулы (первичное антитело) или применяемое в качестве контроля изотипа антитело DP47 в указанном диапазоне концентраций (с дублированием), и инкубировали в течение 120 мин при 4°С. Затем клетки промывали трижды 200 мкл холодного (4°С) FACS-буфера. Клетки дополнительно окрашивали, используя 25 мкл/лунку холодного (4°С) раствора вторичного антитела (разведение вторичного антитела в соотношении 1:50), содержащего конъюгированный с R-фикоэритрином (РЕ) Р(ab')2-фрагмент козьего IgG к человеческому IgG, Fcγ-фрагмент-специфического AffiniPure (фирма Jackson ImmunoResearch, каталожный №109-116-098), и инкубировали в течение 60 мин при 4°С в темноте. Клетки промывали 200 мкл FACS-буфера и ресуспендировали, используя 85 мкл/лунку FACS-буфера, содержащего 0,2 мкг/мл DAPI (фирма Roche, каталожный №10236276001), и получали данные в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa (фирма BD Bioscience, снабженного программным обеспечением DIVA).
Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10 (фирма FlowJo LLC).
Как продемонстрировано на фиг. 2А, 2Б и на фиг. 17, биспецифические антитела, одновалентные или двухвалентные в отношении FAP, связывались с экспрессирущими человеческий и мышиный FAP клетками-мишенями. При этом, только таргетированные на FAP анти-CD40-антигенсвязывающие молекулы обладали непосредственными таргетирующими опухоль свойствами. Двухвалентные FAP-конструкции с С-концевыми FAP-связывающими доменами связывались сильнее, чем одновалентная конструкция с С-концевыми FAP-связывающим доменом, что объясняется повышением авидности у двухвалентного формата по сравнению с одновалентным FAP-связывающим форматом. Наиболее сильное связывание FAP обнаружено для формата 1+1 (Р1АЕ0192). Не обнаружено связывание таргетированных на FAP антител с клетками NIH/3T3-wt. Измеренные величины ЕС50, характеризующие связывание различных биспецифических антител, представлены ниже в таблице 7.

1.4.2 Связывание с экспрессирующими человеческий CD40 клетками Дауди
Связывание с находящимся на клеточной поверхности CD40 тестировали с использованием клеток Дауди, человеческой В-лимфобластной клеточной линии с высокими уровнями экспрессии человеческого CD40 (АТСС CCL-213). Клетки Дауди культивировали с использованием 1-кратной модифицированной по методу Дульбекко среды Игла (DMEM) (фирма gibco, каталожный №42430-025), дополненной 10% фетальной бычьей сыворотки (FBS) (фирма life technologies, каталожный №.16140, партия №1797306А). Добавляли по 0,3×105 клеток Дауди в 200 мкл 1×DMEM, дополненной 10% FBS, в каждую лунку круглодонного 96-луночного планшета (фирма greiner bio-one, cellstar, каталожный №650185). Планшеты центрифугировали в течение 5 мин при 1700 об/мин и супернатанты отбирали. Клетки промывали однократно 200 мкл холодного (4°С) FACS-буфера (фирма eBioscience, каталожный №00-4222-26). Все образцы ресуспендировали в 50 мкл/лунку холодного (4°С) FACS-буфера, содержащего биспецифические антигенсвязывающие молекулы (первичное антитело) или применяемое в качестве контроля изотипа антитело DP47 в указанном диапазоне концентраций (с дублированием), и инкубировали в течение 120 мин при 4°С. Затем клетки промывали трижды 200 мкл холодного (4°С) FACS-буфера. Клетки дополнительно окрашивали, используя 25 мкл/лунку холодного (4°С) раствора вторичного антитела (разведение вторичного антитела в соотношении 1:50), содержащего конъюгированный с R-фикоэритрином (РЕ) F(ab')2-фрагмент козьего IgG к человеческому IgG, Fcγ-фрагмент-специфического AffiniPure (фирма Jackson ImmunoResearch, каталожный №109-116-098), и инкубировали в течение 60 мин при 4°С в темноте. Клетки промывали 200 мкл FACS-буфера и ресуспендировали, используя 85 мкл/лунку FACS-буфера, содержащего 0,2 мкг/мл DAPI (фирма Roche, каталожный №10236276001), и получали данные в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa (фирма BD Bioscience, снабженного программным обеспечением DIVA). Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10 (фирма FlowJo LLC).
Как продемонстрировано на фиг. 18, все указанные клоны связывались с CD40, но с различной силой связывания (величины ЕС50, а также сила сигнала) с CD40-позитивными клетками Дауди. Для двухвалентных антител к CD40 обнаружены более высокие величины ЕС50 и достижение плато при более высоких уровнях связывания по сравнению с четырехвалентными антителами к CD40, что объяснялось большим количеством оккупированных сайтов связывания CD40 на антитело и увеличением авидности четырехвалентного формата по сравнению с двухвалентным CD40-связывающим форматом. Наиболее высокая величина ЕС50 в совокупности с достижением плато при самом низком уровне связывания обнаружено для формата 1+1 (Р1АЕ0192). Не обнаружено связывания с клетками Дауди антитела, применяемого в качестве отрицательного контроля. Измеренные величины ЕС50, характеризующие связывание различных биспецифических антител, представлены ниже в таблице 8.

Пример 2
Функциональные свойства таргетированных на FAP связывающихся с человеческим CD40 молекул
2.1 Опосредуемая CD40 активация антигенпрезентирующих клеток (АРС) с помощью таргетированных на FAP связывающихся с человеческим CD40 молекул
Связывание путем лигирования CD40 индуцирует созревание, а также активацию В-клеток и дендритных клеток (DC) и повышает выживаемость этих типов клеток. Под воздействием сигналов CD40 повышается производство цитокинов и экспрессия костимуляторных молекул на поверхности В-клеток и DC (S. Quezada и др., Annu RevImmunol. 22, 2004, сс. 307-328; S. Danese и др., Gut. 53, 2004, сс. 1035-1043; G. Bishop и др., Adv Exp Med Biol. 597, 2007, сс. 131-151).
Для тестирования агонистических свойств и специфичности в отношении FAP различных FAP-зависимых антител к CD40 АРС, полученные из человеческих лейкоцитарных пленок, инкубировали с FAP-зависимыми агонистическими антителами к человеческому CD40 и либо с покрытыми FAP гранулами, либо с экспрессирующими человеческий FAP клетками NIH/3T3. Активацию АРС измеряли с помощью FACS и супернатант клеток анализировали в отношении цитокинов с помощью твердофазного иммуноферментного анализа (ELISA).
2.1.1 Активация человеческих В-клеток с помощью таргетированных на FAP связывающих человеческий CD40 молекул при использовании клеток NIH/3T3-huFAP в качестве источника антигена
Клетки NIH/3T3, экспрессирующие FAP, применяли в качестве источника антигена для биспецифических антигенсвязывающих молекул. Клетки NIH/3T3-huFAP создавали путем трансфекции клеточной линии мышиных эмбриональных фибробластов NIH/3T3 (АТСС CRL-1658) экспрессионной плазмидой pETR4921, кодирующей человеческий FAP под контролем CMV-промотора. Клетки NIH/3T3-huFAP или клетки NIH/3T3-wt облучали 27 Гр, используя облучатель RS 2000 (фирма Rad Source Technologies), для предупреждения пролиферации клеток. Высевали 0,2×105 облученных NIH/3T3 клеток в 100 мкл среды R10, состоящей из среды Мемориального института Розуэлла (Roswell Park Memorial Institute) (RPMI) 1640 (фирма Gibco, каталожный №31870-025), дополненной 10% FBS, 1 об. % пенициллина-стрептомицина (фирма Gibco, каталожный №15070-063), 1 об. % L-глутамина (фирма Gibco, каталожный №25030-024), 1 об. % пирувата натрия (фирма Gibco, каталожный №11360-039), 1 об. % содержащей заменимые аминокислоты среды MEM (фирма Gibco, каталожный №11140-035) и 50 мкМ β-меркаптоэтанолом (фирма Gibco, каталожный №31350-010), на лунку 96-луночного плоскодонного планшета (фирма ТРР, каталожный №92696).
На следующий день получали лейкоцитарную пленку из Stiftung  Blutspendedienst SRK. Для выделения мононуклеарных клеток периферической крови (РВМС) 50 мл лейкоцитарной пленки разводили таким же объемом ЗФР (фирма Gibco, каталожный №10010023). В 50-миллитровые полипропиленовые центрифужные пробирки (фирма ТРР, каталожный №91050) вносили из расчета на 1 пробирку 15 мл Lymphoprep™ (фирма STEMCELL Technologies, каталожный №07851) и осторожно наслаивали на Lymphoprep™ 25 мл раствора лейкоцитарной пленки /ЗФР. Пробирки центрифугировали при 2000 об/мин в течение 24 мин при комнатной температуре с небольшим ускорением и без перерыва. Затем РВМС собирали с поверхности раздела, промывали три раза ЗФР, ресуспендировали в 10 мл ЗФР и клетки анализировали в отношении типа и количества клеток с помощью устройства для подсчета клеток Beckman Coulter cell r Ас⋅Т™ 5diff OV (фирма Beckman Coulter, каталожный №6605580). Перед выделением В-клеток из РВМС фракцию CD14-позитивных клеток удаляли путем магнитного мечения CD14-позитивных клеток с помощью CD14-микрогранул (фирма Miltenyi, каталожный №130-050-201) и последующего выделения с помощью сепаратора autoMACS® Pro (фирма Miltenyi, каталожный №130-092-545). CD14-негативную фракцию применяли для последующего выделения В-клеток с помощью набора для выделения В-клеток Miltenyi II (каталожный №130-091-151) и сепарации с помощью autoMACS®. Добавляли 1×105 В-клеток в 50 мкл среды R10 на лунку к клеткам NIH/3T3. Таргетированные на FAP антитела к человеческому CD40 добавляли в 50 мкл среды R10 к В-клеткам в концентрации от 1 мкл/мл до 0,3 нг/мл (3-кратные серийные разведения). В качестве положительного контроля применяли независимые от FAP агонистические антитела к человеческому CD40 RO7009789 (IgG2, INN: селикрелумаб) и SGN-40 (IgG1, INN: дацетузумаб). Оба антитела являются двухвалентными в отношении CD40. Поскольку в литературе описано, что для антитела SGN-40 для проявления биологической активности требуется перекрестное сшивание с Fc-рецептором (С. Law и др., Cancer Res 65, 2005, сс. 8331-8338), механизм, который обсуждается также и для RO7009789 (R. Dahan и др., Cancer Cell 29, 2016, сс. 1-12), то эти два антитела инкубировали с перекрестносшивающим F(ab')2-фрагментом козьего антитела к человеческому IgG, Fcγ-фрагмент-специфическим (фирма Jackson ImmunoResearch, каталожный №109-006-008) за 30 мин до добавления к В-клеткам. Через 48 ч клетки переносили в 96-луночный круглодонный планшет, промывали однократно ЗФР и инкубировали с 50 мкл блокирующего Fc-рецептор применяемого в качестве контроля мышиного IgG-изотипа антитела в концентрации 3 мкг/мл (фирма ThermoFisher Scientific, каталожный №10400C) в ЗФР. После инкубации в течение 15 мин при 4°С клетки промывали ЗФР и к клеткам добавляли 50 мкл смеси флуоресцентномеченных антител в ЗФР. Применяли следующие флуоресцентномеченые антитела: антитело к человеческому CD83 BV421 (фирма Biolegend, клон НВ15е, каталожный №305324), в человеческому CD80 BV605 (фирма BD Biosciences, клон L307.4, каталожный №563315), кHLA-ABC ФИТЦ (фирма BD Biosciences, клон G46-2.6, каталожный №555552), к человеческому CD14 PerCP-Су5.5 (фирма Biolegend, клон HCD14, каталожный №325622), к человеческому CD3 PerCP-Су5.5 (фирма Biolegend, клон UCHT1, каталожный №300430), к человеческому CD70 РЕ (фирма Biolegend, клон 113-16, каталожный №355104), к человеческому CD86 PE-CF594 (фирма BD Biosciences, клон FUN-1, каталожный №562390), к HLA-DR АРС (фирма BD Biosciences, клон G46-6, каталожный №559866) и к человеческому CD19 АРС-Н7 (фирма BD Biosciences, клон SJ25C1, каталожный №560177). Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™ (фирма Biolegend, каталожный №423102). После инкубации в течение 30 мин при 4°С клетки промывали дважды ЗФР и затем ресуспендировали в 200 мкл ЗФР. Клетки анализировали в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa (фирма BD Bioscience, снабженного программным обеспечением DIVA). Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10 (фирма FlowJo LLC). У живых клеток (Aqua™-негативных), негативных в отношении CD14 и CD3 и позитивных в отношении CD19, анализировали экспрессию CD70, CD80, CD83 и CD86.
Blutspendedienst SRK. Для выделения мононуклеарных клеток периферической крови (РВМС) 50 мл лейкоцитарной пленки разводили таким же объемом ЗФР (фирма Gibco, каталожный №10010023). В 50-миллитровые полипропиленовые центрифужные пробирки (фирма ТРР, каталожный №91050) вносили из расчета на 1 пробирку 15 мл Lymphoprep™ (фирма STEMCELL Technologies, каталожный №07851) и осторожно наслаивали на Lymphoprep™ 25 мл раствора лейкоцитарной пленки /ЗФР. Пробирки центрифугировали при 2000 об/мин в течение 24 мин при комнатной температуре с небольшим ускорением и без перерыва. Затем РВМС собирали с поверхности раздела, промывали три раза ЗФР, ресуспендировали в 10 мл ЗФР и клетки анализировали в отношении типа и количества клеток с помощью устройства для подсчета клеток Beckman Coulter cell r Ас⋅Т™ 5diff OV (фирма Beckman Coulter, каталожный №6605580). Перед выделением В-клеток из РВМС фракцию CD14-позитивных клеток удаляли путем магнитного мечения CD14-позитивных клеток с помощью CD14-микрогранул (фирма Miltenyi, каталожный №130-050-201) и последующего выделения с помощью сепаратора autoMACS® Pro (фирма Miltenyi, каталожный №130-092-545). CD14-негативную фракцию применяли для последующего выделения В-клеток с помощью набора для выделения В-клеток Miltenyi II (каталожный №130-091-151) и сепарации с помощью autoMACS®. Добавляли 1×105 В-клеток в 50 мкл среды R10 на лунку к клеткам NIH/3T3. Таргетированные на FAP антитела к человеческому CD40 добавляли в 50 мкл среды R10 к В-клеткам в концентрации от 1 мкл/мл до 0,3 нг/мл (3-кратные серийные разведения). В качестве положительного контроля применяли независимые от FAP агонистические антитела к человеческому CD40 RO7009789 (IgG2, INN: селикрелумаб) и SGN-40 (IgG1, INN: дацетузумаб). Оба антитела являются двухвалентными в отношении CD40. Поскольку в литературе описано, что для антитела SGN-40 для проявления биологической активности требуется перекрестное сшивание с Fc-рецептором (С. Law и др., Cancer Res 65, 2005, сс. 8331-8338), механизм, который обсуждается также и для RO7009789 (R. Dahan и др., Cancer Cell 29, 2016, сс. 1-12), то эти два антитела инкубировали с перекрестносшивающим F(ab')2-фрагментом козьего антитела к человеческому IgG, Fcγ-фрагмент-специфическим (фирма Jackson ImmunoResearch, каталожный №109-006-008) за 30 мин до добавления к В-клеткам. Через 48 ч клетки переносили в 96-луночный круглодонный планшет, промывали однократно ЗФР и инкубировали с 50 мкл блокирующего Fc-рецептор применяемого в качестве контроля мышиного IgG-изотипа антитела в концентрации 3 мкг/мл (фирма ThermoFisher Scientific, каталожный №10400C) в ЗФР. После инкубации в течение 15 мин при 4°С клетки промывали ЗФР и к клеткам добавляли 50 мкл смеси флуоресцентномеченных антител в ЗФР. Применяли следующие флуоресцентномеченые антитела: антитело к человеческому CD83 BV421 (фирма Biolegend, клон НВ15е, каталожный №305324), в человеческому CD80 BV605 (фирма BD Biosciences, клон L307.4, каталожный №563315), кHLA-ABC ФИТЦ (фирма BD Biosciences, клон G46-2.6, каталожный №555552), к человеческому CD14 PerCP-Су5.5 (фирма Biolegend, клон HCD14, каталожный №325622), к человеческому CD3 PerCP-Су5.5 (фирма Biolegend, клон UCHT1, каталожный №300430), к человеческому CD70 РЕ (фирма Biolegend, клон 113-16, каталожный №355104), к человеческому CD86 PE-CF594 (фирма BD Biosciences, клон FUN-1, каталожный №562390), к HLA-DR АРС (фирма BD Biosciences, клон G46-6, каталожный №559866) и к человеческому CD19 АРС-Н7 (фирма BD Biosciences, клон SJ25C1, каталожный №560177). Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™ (фирма Biolegend, каталожный №423102). После инкубации в течение 30 мин при 4°С клетки промывали дважды ЗФР и затем ресуспендировали в 200 мкл ЗФР. Клетки анализировали в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa (фирма BD Bioscience, снабженного программным обеспечением DIVA). Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10 (фирма FlowJo LLC). У живых клеток (Aqua™-негативных), негативных в отношении CD14 и CD3 и позитивных в отношении CD19, анализировали экспрессию CD70, CD80, CD83 и CD86.
На фиг. 3А-3З представлены данные о FAP-зависимой повышающей регуляции маркеров В-клеточной активации CD70 (фиг. 3А и 3Б), CD80 (фиг. 3В и 3Г), CD83 (фиг. 3Д и 3Е) и CD86 (фиг. 3Ж и 3З) при использовании биспецифических антигенсвязывающих молекул, четырехвалентных в отношении человеческого CD40 и либо одно-, либо двухвалентных в отношении FAP. Биспецифическое антитело, одновалентное в отношении FAP, индуцировало такое же повышение экспрессии маркера активации, что и молекула с двумя FAP-связывающими фрагментами. При применении клеток NIH/3T3-FAP повышающая регуляция маркеров В-клеточной активации биспецифическими антигенсвязывающими молекулами оказалась сопоставимой с повышающей регуляцией, индуцированной независимыми от FAP применяемыми в качестве положительного контроля антителами. В отсутствии FAP (клетки NIH/3T3-wt) не обнаружено повышения уровня маркеров В-клеточной активации с помощью биспецифических антигенсвязывающих молекул, в то время как применяемые в качестве положительного контроля антитела индуцировали повышающую регуляцию экспрессии этих маркеров.
2.1.2 Активация человеческих клеток Дауди с помощью таргетированных на FAP связывающих человеческий CD40 молекул при использовании покрытых FAP Dynabeads® в качестве источника антигена
1×105 клеток Дауди в 100 мкл 1×DMEM плюс 10% FBS добавляли на лунку 96-луночного плоскодонного планшета. Вместо применения клеток, экспрессирующих FAP, в качестве источника антигена, стрептавидиновые гранулы Dynabeads® (фирма ThermoFisher Scientific, каталожный №: 11205D) покрывали биотинилированным мышиным FAP (полученным в лаборатории заявителей) (связывающая способность 6,5×104 гранул: 0,01 мкг белка) согласно инструкциям производителя и добавляли к клеткам Дауди в соотношении гранулы : клетки 2:1 в 50 мкл среды R10. Применение гранул, покрытых FAP, вместо экспрессирующих FAP клеток представляет собой более стабильную и воспроизводимую систему, поскольку изменение качества клеток и секреция клеточных продуктов, которые могут влиять на статус активации АРС, представляют собой факторы, которые потенциально могут искажать результаты. В качестве контроля непокрытые гранулы добавляли к клеткам Дауди. К клеткам Дауди добавляли таргетированные на FAP антитела к человеческому CD40 или применяемые в качестве положительного контроля антитела (описанные в разделе 2.1.1) в 50 мкл среды R10. Через 2 дня клетки Дауди анализировали с помощью FACS, используя процедуры окрашивания и анализа, описанные в разделе 2.1.1.
Анализ В-клеток после 2 дней инкубации с агонистическими антителами к CD40 продемонстрировал повышение уровня экспрессии CD70 при применении всех антител (см. фиг. 20А и 20Б). Величины ЕС50 для конкретных молекул обобщены ниже в таблице 9. Повышающая регуляция указанных маркеров экспрессии зависела от FAP в случае различных таргетированных на FAP антител, и повышение экспрессии, индуцированной указанными FAP-зависимыми антителами, было выше по сравнению с повышением, индуцированным перекрестносшитым антителом к CD40 (P1AD4470). В отсутствии FAP (непокрытые гранулы) повышения уровня CD70 не обнаружено при применении указанных биспецифических антител, одно- или двухвалентных в отношении CD40, в то время как четырехвалентные CD40-связывающие молекулы индуцировали повышающую регуляцию CD70, но в меньшей степени, чем в присутствии FAP, что свидетельствует о низкой, но поддающейся обнаружению независимой от FAP активации CD40 четырехвалентным CD40-связывающим агентом в клетках Дауди.

2.1.2 Активация человеческих В-клеток с помощью таргетированных на FAP связывающих человеческий CD40 молекул с использованием покрытых FAP Dynabeads® в качестве источника антигена
В-клетки выделяли из лейкоцитарных пленок согласно методу, описанному в разделе 2.1.2, и 1×105 В-клеток в 100 мкл среды R10 добавляли на лунку 96-луночного плоскодонного планшета. Стрептавидиновые гранулы Dynabeads® (фирма ThermoFisher Scientific, каталожный №: 11205D) покрывали биотинилированным мышиным FAP (полученным в лаборатории заявителей) (связывающая способность 6,5×104 гранул: 0,01 мкг белка) согласно инструкциям производителя и добавляли к В-клеткам в соотношении гранулы:клетки 2:1 в 50 мкл среды R10. В качестве контроля к В-клеткам добавляли непокрытые гранулы. К В-клеткам добавляли таргетированные на FAP антитела к человеческому CD40 или применяемые в качестве положительного контроля антитела (описанные в разделе 2.1.1) в 50 мкл среды R10. Через 2 дня В-клетки анализировали с помощью FACS, используя процедуры окрашивания и анализа, описанные в разделе 2.1.1. В альтернативном варианте В-клетки культивировали в течение 5 дней в присутствии агонистических антител к CD40 и отбирали 110 мкл супернатанта для измерения IL-6, используя набор для ELISA для человеческого IL-6 DuoSet (фирма R&D, каталожный № DY206-05). Известно, что В-клетки продуцируют повышенные количества IL-6 после стимуляции лигандом CD40 без необходимости в дополнительных стимулах В-клеточных рецепторов (М. Duddy и др., J. Immunol. 172, 2004, сс. 3422-3427). ELISA осуществляли согласно протоколу производителя с единственным отличием, состоящим в том, что применяли половину от рекомендованных количеств на каждой стадии анализа. В-клетки анализировали с помощью FACS, используя процедуры окрашивания и анализа, описанные в разделе 2.1.1.
Анализ В-клеток после 2 дней инкубации с агонистическими антителами к CD40 продемонстрировал повышение уровня экспрессии CD70, CD83 и CD86 при применении всех антител (см. фиг. 4А-4Е, фиг. 21А и 21Б и фиг. 25А-Г). Величины ЕС50, отражающие повышение уровня экспрессии CD86 при использовании конкретных молекул, обобщены ниже в таблице 10. Повышающая регуляция указанных маркеров экспрессии зависела от FAP в случае различных таргетированных на FAP антител, и повышение экспрессии, индуцированной указанными FAP-зависимыми антителами, было сопоставимо или несколько более низким по сравнению с повышением, индуцированным перекрестносшитым антителом к CD40 P1AD4470.


После инкубации в течение 5 дней В-клеток с покрытыми FAP Dynabeads® антигенсвязывающие молекулы, таргетирующие человеческий CD40 и FAP, индуцировали FAP-зависимую повышающую регуляцию экспрессии CD80 на В-клетках. Уровни экспрессии CD80, индуцированной антителами к человеческому CD40 либо с одним, либо с двумя FAP-связывающими сайтами, оказались сопоставимыми. Обработка В-клеток применяемыми в качестве положительного контроля антителами к CD40 приводила к такому же уровню повышающей регуляции CD80. При использовании биспецифических антигенсвязывающих молекул удалось обнаружить также повышенную FAP-зависимую экспрессию CD86. И в этом случае присутствие одного или двух FAP-связывающих сайтов не оказывало значительного воздействия на уровни экспрессии указанного маркера активации. По сравнению с независимой от FAP повышающей регуляции CD86, индуцированной перекрестносшитым SGN-40 (дацетузумаб) или агонистическим антителом к CD40 селикрелумабом (RO 7009789), повышающая регуляция CD86, индуцированная FAP-зависимыми биспецифическими антигенсвязывающими молекулами, оказалась несколько более низкой. Касательно CD70 и CD83 отсутствие или лишь очень ограниченная повышающая регуляция обнаружена при применении биспецифических антител, таргетирующих FAP и CD40, в то время как для применяемых в качестве положительного контроля антител четко установлено воздействие на указанные маркеры В-клеточной активации (фиг. 5А-5З).
На фиг. 6А и 6Б представлены данные о воздействии различных агонистических антител к CD40 на производство В-клетками IL-6. В присутствии FAP концентрация IL-6 в супернатантах повышалась в сходной степени при использовании всех изученных агонистических антител к человеческому CD40 (примерно 6-кратное повышение по сравнению с условиями без обработки (UT)). После инкубации В-клеток с непокрытыми Dynabeads® не обнаружено повышения производства IL-6 с помощью биспецифических антигенсвязывающих молекул, что демонстрирует зависимость этих молекул от FAP.
2.1.4 Активация полученных из человеческих моноцитов DC (moDC) таргетированными на FAP связывающими человеческий CD40 молекулами при использовании покрытых человеческим FAP Dynabeads® в качестве источника антигена
РВМС выделяли из лейкоцитарных пленок с помощью центрифугирования в градиенте плотности Lymphoprep™. Затем моноциты выделяли с помощью покрытых CD 14 микрогранул и сепарации с использованием устройства autoMACS® согласно методу, описанному в разделе 2.1.1. Для создания полученных из моноцитов DC (moDC) 3×106 моноцитов высевали на лунку 6-луночного планшета (фирма ТРР, каталожный №92006) с плотностью 1×106 клеток на мл. Для созревания DC применяли среду для moDC, которая состояла из RPMI 1640, дополненной 1 об. % пенициллина-стрептомицина, 2 об. % человеческой сыворотки (инактивированной тепловой обработкой при 56°С в течение 30 мин) (фирма Sigma-Aldrich, каталожный № Н4522, партия № SLBP1687V), 20 нг/мл свежедобавленного рекомбинантного человеческого колониестимулирующего фактора гранулоцитов и макрофагов (GM-CSF) (фирма Peprotech, каталожный №300-03-20UG, партия №081230Н1213) и 20 нг/мл свежедобавленного рекомбинантного человеческого IL-4 (фирма Peprotech, каталожный №200-04-100UG, партия №091514С3116). Через 5 дней moDC собирали из 6-луночных планшетов путем осторожного удаления суспензионных и полуприкрепленных клеток и ресуспендировали в свежей среде для moDC, содержащей человеческие IL-4 и GM-CSF. Высевали 2×105 moDC в 100 мкл среды для moDC на лунку 96-луночного плоскодонного планшета. Стрептавидиновые гранулы Dynabeads® покрывали биотинилированным человеческим FAP и добавляли в 50 мкл, используя соотношение гранулы/DC 2:1 (как описано в разделе 2.1.3). В качестве контроля к moDC добавляли непокрытые гранулы. Нацеленные на FAP антитела к человеческому CD40 добавляли к DC в 50 мкл в концентрациях, составляющих от 1 мкг/мл до 0,3 нг/мл (3-кратные серийные разведения). В качестве положительных независимых от FAP контролей применяли агонистическое антитело к человеческому CD40 RO7009789 и перекрестносшитое антитело к CD40. Через 2 дня после добавления Dynabeads® и различных агонистических антител к человеческому CD40 активацию moDC оценивали с помощью FACS. FACS-окрашивание осуществляли согласно методу, описанному в разделе 2.1.1, используя смесь флуоресцентномеченых антител, таких как антитело к человеческому CD86 BV421 (фирма BD Biosciences, клон FUN-1, каталожный №562432), к человеческому CD80 BV605 (фирма BD Biosciences, клон L307.4, каталожный №563315), анти-HLA-ABC ФИТЦ (фирма BD Biosciences, клон G46-2.6, каталожный №555552), к человеческому CD1c PerCp-Су5.5 (фирма BD Biosciences, клон F10/21 A3, каталожный №565424), к человеческому CD70 РЕ (фирма Biolegend, клон 113-16, каталожный №355104), к человеческому CD11c PE-eF610 (фирма eBioscience, клон 3.9, каталожный №61-0116-42), к человеческому CD83 РЕ-Су7 (фирма BD Biosciences, клон НВ15е, каталожный №561132), к человеческому CD209 АРС (фирма BD Biosciences, клон DCN46, каталожный №551545), к человеческому CD3 Alexa Fluor 700 (фирма eBioscience, клон ОКТ3, каталожный №56-0037-42), к человеческому CD14 АРС-Н7 (фирма BD Biosciences, клон М5Е2, каталожный №561384), и краситель для определения жизнеспособности Zombie Aqua™ (фирма Biolegend, каталожный №423102). Клетки анализировали в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa. Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10. Единичные живые клетки разделяли на CD3-негативные и CD14-негативные клетки. На основе этого популяцию CD1c- и CD11c-позитивных клеток анализировали в отношении маркеров активации CD70, CD80, CD83 и CD86.
При применении всех агонистических антител к человеческому CD40 удалось обнаружить выраженную и сходную повышающую регуляцию CD83 на moDC (фиг. 7Д-7Е). В случае FAP-зависимых антител к CD40 установлено, что указанная повышающая регуляция являлась FAP-зависимой. При использовании биспецифических антигенсвязывающих молекул, таргетирующих CD40 и FAP, экспрессия CD80 лишь слегка возрастала, однако это повышение зависело от FAP и оказалось сопоставимым с повышающей регуляцией CD80, индуцированной применяемым в качестве положительного контроля антителом RO7009789 на DC (фиг. 7В и 7Г). В то время как экспрессия CD86 не существенно изменялась на DC, которые инкубировали с различными антителами к CD40, по сравнению с необработанными DC (фиг. 7Ж и 7З), экспрессия CD70 повышалась в результате агонистических действий этих антител (фиг. 7А и 7Б). И в этом случае оба FAP-зависимых антитела проявляли свои активирующие свойства только в присутствии FAP, и их действия на CD70 оказались сходными. Однако количество moDC с повышающей регуляцией экспрессии CD70 оказалось небольшим (максимум 8% от количества CD11c- и CD1c-позитивных клеток). При такой схеме эксперимента для RO7009789 продемонстрирована более высокая способность к повышающей регуляции CD70 на DC по сравнению с биспецифическими молекулами.
2.1.5 Активация клеток HEK-Blue™ CD40L таргетированными на FAP связывающими человеческий CD40 молекулами при использовании покрытых мышиным FAP Dynabeads® в качестве источника антигена
Клетки HEK-Blue™ CD40L (фирма InvivoGen, каталожный № hkb-cd40) применяли в качестве репортерной линии клеток для анализа стимуляции человеческого CD40, опосредуемого таргетированными на FAP связывающими человеческий CD40 молекулами. Клетки HEK-Blue™ CD40L стабильно экспрессируют человеческий CD40-рецептор и отличаются индуцируемой NFκB-секрецией эмбриональной щелочной фосфатазы (SEAP). Связывание CD40L или агонистического антитела к CD40 с CD40-рецептором, который экспрессируется на клетках HEK-Blue™ CD40L, запускает каскад сигналов, приводящий к опосредуемому NFκB производству SEAP. Количество продуцируемой SEAP прямо коррелирует со степенью активации CD40-рецептора. Уровни секретируемой SEAP в супернатанте можно измерять с помощью спектрофотометра при 620-655 нм. Высевали 0,5×105 клеток HEK-Blue™ CD40L в 160 мкл предварительно нагретой среды для детекции HEK-Blue™ (фирма InvivoGen, каталожный № hb-det2) на лунку 96-луночного плоскодонного планшета (фирма ТРР, Каталожный №92696). Стрептавидиновые гранулы Dynabeads® покрывали биотинилированным мышиным FAP и добавляли в 20 мкл ЗФР, используя соотношение гранулы : клетки 2:1 (согласно методу, описанному в разделе 2.1.3). В качестве контроля к репортерным клеткам добавляли непокрытые гранулы. Таргетированные на FAP антитела к человеческому CD40 добавляли к клеткам в 20 мкл ЗФР в концентрациях от 6,89нМ до 0,0032нМ (3-кратные серийные разведения). В качестве контрольных молекул применяли антитела, четырехвалентные в отношении человеческого CD40, с одним или двумя ОР47-доменами вместо FAP-связывающего домена и независимое от FAP перекрестносшитое антитело к CD40 (P1AD4470). После инкубации в течение 8 ч при 37°С уровни SEAP в супернатанте оценивали с помощью спектрофотометра при 650 нм.
При применении всех агонистических таргетированных на FAP антител к человеческому CD40 обнаружено выраженное и сопоставимое производство SEAP. В случае таргетированных на FAP биспецифических антител, одно- или двухвалентных в отношении человеческого CD40, производство SEAP обнаружено только в присутствии FAP. В противоположность этому, репортерные клетки, обработанные таргетированными на FAP биспецифическими антителами, четырехвалентными в отношении человеческого CD40, секретировали SEAP вне зависимости от доступности FAP. Однако в присутствии FAP в супернатанте репортерных клеток, обработанных указанными антителами, обнаружены более высокие уровни SEAP Кроме того, применяемые в качестве отрицательного контроля антитела, четырехвалентные в отношении человеческого CD40, с одним или двумя DP47-доменами вместо FAP-связывающего домена индуцировали сопоставимое производство SEAP в клетках HEK-Blue™ CD40L в присутствии FAP и без него. Применяемое в качестве положительного контроля антитело CD40 IgG (P1AD4470)+F(ab) индуцировало уровни производства SEAP, сходные с уровнями, индуцированными таргетированными на FAP биспецифическими антителами, двухвалентными или четырехвалентными в отношении человеческого CD40, в присутствии покрытых FAP гранул (фиг. 8А, 8Б, 19А и 19Б). Величины ЕС50, измеренные для антитела к CD40, а также для различных биспецифических антител, представлены ниже в таблице 11.
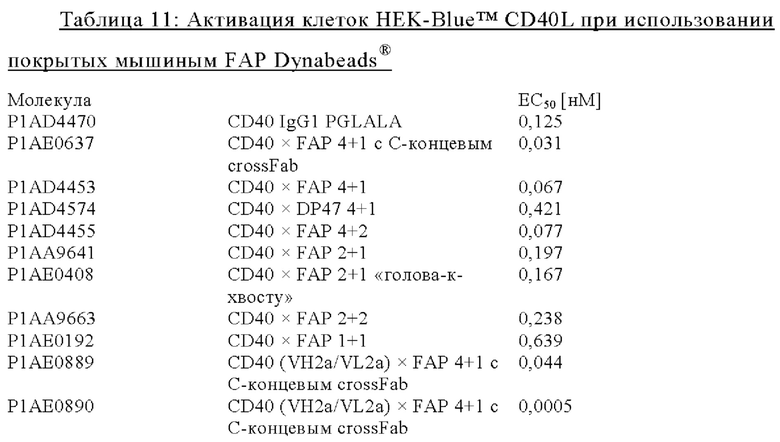
2.2 Опосредуемая CD40 активация DC таргетированными на FAP связывающими CD40 молекулами и последующее примирование Т-клеток
Для демонстрации способности DC, активированных FAP-зависимыми антителами к человеческому CD40, эффективно примировать Т-клетки создавали анализы in vitro Т-клеточного примирования. Для осуществления указанных анализов DC выделяли из селезенок трансгенных мышей, экспрессирующих человеческий CD40-рецептор (мыши huCD40tg) (мыши со сходной схемой экспрессии человеческого и мышиного CD40-рецептора; фон C57BL/6; созданы на фирме Taconic), импульсно обрабатывали либо пептидом SIINFEKL, либо овальбумином (OVA) (опосредуемое рецептором DEC-205 поглощение антигена) и инкубировали с различными агонистическими антителами к человеческому CD40. В качестве источника FAP использовали покрытые FAP гранулы Dynabeads® для демонстрации зависимости от FAP биспецифических антигенсвязывающих молекул. Через 24 ч выделяли CD8-позитивные Т-клетки из селезенок OT1-мышей (позитивные по CD8 Т-клетки этих мышей все несли трансгенный TCR, распознающий SIINFEKL в контексте H2-Kb; C57BL/6-Tg(TcraTcrb)1100Mjb/Crl, фирма Charles River), метили сложным сукцинимидиловым эфиром карбоксифлуоресцеина (CFSE) и добавляли к импульсно-обработанным DC. В день 5 эксперимента DC и Т-клеточные цитокины анализировали в супернатантах культивированных клеток и Т-клетки анализировали в отношении способности к активации и пролиферации.
2.2.1 Т-клеточное примирование посредством импульсно-обработанных SIINFEKL DC, активированных таргетированными на FAP связывающими CD40 молекулами
DC выделяли из селезенок мышей линии huCD40tg. Для выделения селезеночных DC селезенки из мышей линии huCD40tg помещали в одну лунку 6-луночного планшета, содержащего 2,25 мл сбалансированного солевого раствора Хэнкса (HBSS), дополненного кальцием2+ (фирма Gibco, каталожный №14025-05), 250 мкл раствора коллагеназы D в концентрации 10 мг/мл (конечная концентрация 1 мг/мл) (фирма Sigma-Aldrich, каталожный №11088866001) и 12,5 мкл раствора ДНКазы в концентрации 10 мг/мл (конечная концентрация 0,05 мг/мл) (фирма Sigma-Aldrich, D5025-150KU, партия № SLBR0535V). С помощью 3-миллилитрового шприца (фирма BD, каталожный №309658) с иглой 21G (фирма Braun, каталожный №4657527) селезенку баллонировали и затем с помощью ножниц нарезали на мелкие кусочки. После инкубации в течение 25 мин при 37°С добавляли 50 мкл 0,5М этилендиаминотетрауксусной кислоты (ЭДТК) (фирма Applichem, каталожный № А4892.1000), после чего осуществляли вторую стадию инкубации при 37°С в течение 5 мин. Раствор, содержащий спленоциты и маленькие кусочки ткани селезенки, фильтровали через 40-микрометровый фильтр (фирма Corning, каталожный №352340) в 50-миллилитровую полипропиленовую центрифужную пробирку. Кусочки ткани селезенки продавливали через фильтр с помощью конца поршня 3-миллилитрового шприца. На следующей стадии 50-миллилитровую пробирку центрифугировали при 1500 об/мин в течение 5 мин при комнатной температуре, супернатант отбрасывали и добавляли к спленоцитам 1 мл 1-кратного буфера для лизиса клеток (разведенного в соотношении 1:10 дистиллированной водой) (фирма BD, каталожный №555899) для лизиса эритроцитов. После инкубации в течение 4 мин при комнатной температуре добавляли 20 мл среды R10 с последующей стадией центрифугирования при 1500 об/мин в течение 5 мин при комнатной температуре. Супернатант удаляли, спленоциты ресуспендировали в 30 мл R10 и клетки подсчитывали, а также определяли их жизнеспособность с помощью автоматического счетчика клеток EVE (фирма VWR, каталожный №734-2675). Микрогранулы UltraPure с мышиным CD11c (фирма Miltenyi, каталожный №130-108-338) применяли согласно инструкции производителя для выделения DC с помощью сепарации с использованием устройства autoMACS®. Затем высевали 0,25×105 DC в 50 мкл R10 на лунку 96-луночного плоскодонного планшета. Затем DC импульсно обрабатывали пептидом SIINFEKL (остатки 257-264 овальбумина) (фирма Eurogentec, каталожный № AS-60193-5, партия №.1360618) в субоптимальной концентрации 1 пг/мл. Указанное ограниченное количество антигена позволяло определять вариации в Т-клеточной активации в зависимости от по-разному активированных DC. В качестве положительного контроля для индукции высокой Т-клеточной активации, независимой от дополнительных активирующих DC стимулов, SIINFEKL добавляли к DC в концентрации 1 нг/мл. DC, которых не подвергали импульсной обработке антигеном SIINFEKL, служили в качестве отрицательного контроля. Покрытые человеческим FAP или непокрытые Dynabeads® добавляли в 50 мкл R10 к DC, используя соотношение гранулы : клетки 2:1. На следующей стадии добавляли различные агонистические антитела к CD40 в 50 мкл R10 в концентрациях, составляющих от 1 мкг/мл до 1 нг/мл (10-кратные серийные разведения). При такой схеме эксперимента биспецифическое антитело к человеческому CD40, содержащее два FAP-связывающих сайта, сравнивали с его эквивалентом с двумя DP47-доменами вместо FAP-связывающих доменов, с независимым от FAP антителом RO7009789 и перекрестносшитым антителом SGN-40 и с зависимым от мышиного FAP биспецифическим антителом, четырехвалентным в отношении мышиного CD40 и двухвалентным в отношении FAP (FAP-связывающий агент 28Н1). Через 24 ч выделяли селезеночные CD8-позитивные клетки из мышей линии ОТ1. Для этой цели селезенку мыши линии ОТ1 продавливали через 40-микрометровый фильтр с помощью конца поршня 3-миллилитрового шприца в 50-миллилитровую пробирку. Фильтр промывали R10 и спленоциты центрифугировали при 1500 об/мин в течение 5 мин при комнатной температуре. К клеткам добавляли 1 мл 1-кратного буфера для лизиса клеток (разведенного в соотношении 1:10 дистиллированной водой) и после инкубации в течение 4 мин при комнатной температуре добавляли 20 мл R10. Пробирку центрифугировали при 1500 об/мин в течение 5 мин при комнатной температуре и супернатант отбрасывали. Спленоциты ресуспендировали в 30 мл R10 и клетки подсчитывали, а также определяли их жизнеспособность с помощью автоматического счетчика клеток EVE. CD8-позитивные клетки выделяли с помощью процесса отрицательной селекции, используя набор для выделения мышиных CD8a+ Т-клеток (фирма Miltenyi, каталожный №130-104-075) и осуществляя сепарацию с помощью autoMACS® согласно инструкциям производителя. Затем CD8-позитивные клетки, обнаруженные в негативной фракции после сепарации, промывали предварительно нагретым ЗФР, подсчитывали с помощью счетчика клеток EVE и количество клеток доводили до 2×107 клеток/мл в предварительно нагретой среде ЗФР. 10мМ раствор CFSE (набор для пролиферации клеток CellTrace™ CFSE, фирма ThermoFisher, каталожный № С34554) разводили в 5000 раз в предварительно нагретом ЗФР и добавляли к клеткам, ресуспендированным в ЗФР, в соотношении 1:1 (конечная концентрация CFSE 1 мкМ). После кратковременного интенсивного перемешивания клетки инкубировали в течение 5 мин при комнатной температуре. Реакцию мечения прекращали, добавляя к клеткам 40 мл предварительно нагретой среды R10. После двух стадий промывки ЗФР CD8-позитивные клетки ресуспендировали в R10 и 0,5×105 клеток добавляли в 100 мкл R10 для импульсной обработки DC. В день 5 эксперимента Т-клетки повторно стимулировали для внутриклеточного окрашивания цитокинов (ICS) с помощью 0,5 мкг/мл SIINFEKL и 2 мкг/мл антитела к мышиному CD28 (фирма eBioscience, клон 37.51, каталожный №16-0281-86). Через 1 ч после добавления SIINFEKL и антитела к CD28 к клеткам добавляли брефелдин A (BFA) (фирма BD, каталожный №51-2301KZ) (1:1000) для блокады внутриклеточного транспорта белков. После еще одной 4-часовой стадии инкубации 150 мкл супернатанта отбирали для основанной на применении Luminex™ мультиплексной оценки цитокинов. Для оценки набора из 23 цитокинов применяли набор Bio-Plex Pro™ Mouse Cytokine GrpI Panel 23-Plex (фирма BioRad, каталожный № M60009RDPD) согласно инструкциям производителя. Для анализа Т-клеток с помощью проточной цитометрии клетки в 96-луночных плоскодонных планшетах переносили в 96-луночные круглодонные планшеты, промывали однократно ЗФР и инкубировали с 50 мкл применяемого в концентрации 3 мкг/мл блокирующего Fc-рецептор используемого в качестве контроля изотипа мышиного IgG в ЗФР. После инкубации в течение 15 мин при 4°С клетки промывали ЗФР и к клеткам добавляли 50 мкл смеси флуоресцентномеченых антител в ЗФР. Применяли следующие антитела: антитело к мышиному CD86 BV785 (фирма Biolegend, клон GL-1, каталожный №105043), анти-I-A/I-E PerCp-Су5.5 (фирма Biolegend, клон М5/114.15.2, каталожный №107626), к мышиному CD70 РЕ (фирма eBioscience, клон FR70, каталожный №12-0701-82), к мышиному CD3 PE-CF594 (фирма BD Biosciences, клон 145-2С11, каталожный №562286), к мышиному CD25 РЕ-Су7 (фирма eBioscience, клон РС61.5, каталожный №25-0251-82), к мышиному CD11c АРС (фирма BD Biosciences, клон HL3, каталожный №561119), к мышиному CD44 Alexa Fluor 700 (фирма BD Biosciences, клон IM7, каталожный №560567) и к мышиному CD8 АРС-Су7 (Biolegend, клон 53-6.7, каталожный №100714). Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™. Клетки инкубировали в течение 30 мин при 4°С с раствором для внеклеточного окрашивания антител. Затем клетки промывали два раза ЗФР, пермеабилизировали и окрашивали внутриклеточно в отношении IFNγ, используя антитело к мышиному IFNγ BV421 (фирма Biolegend, клон XMG1.2, каталожный №505830) в сочетании с набором, содержащим буфер для окрашивания Foxp3/фактора транскрипции (фирма eBioscience, каталожный №00-5523-00), согласно протоколу производителя. Клетки ресуспендировали в 200 мкл ЗФР и анализировали в этот же день с использованием снабженного 5 лазерами анализатора LSR-Fortessa. Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10. Популяцию живых клеток, характеризующихся экспрессией CD8 и CD3, анализировали в отношении разведения CFSE-красителя, производства IFNγ, экспрессии CD44 и CD25.
На фиг. 9А-9З представлены данные, демонстрирующие, что DC, импульсно-обработанные небольшими количествами SIINFEKL и стимулированные различными агонистическими антителами к CD40, обладают способностью индуцировать пролиферацию Т-клеток. В случае FAP-зависимых биспецифических антител к CD40 пролиферация индуцировалась только, когда в анализе присутствовал FAP. Уровни пролиферации, которая индуцировалась DC, стимулированными мышиной или человеческой версией биспецифических антигенсвязывающих молекул с четырьмя CD40-связывающими фрагментами и двумя FAP-связывающими фрагментами, оказались сопоставимыми. Это убедительно подтверждает предположение о том, что передача в прямом направлении сигналов человеческого CD40-peuenTopa, который экспрессируется на DC, не нарушалась у мышей линии huCD40tg. Никакой выраженной повышающей регуляции маркеров Т-клеточной активации CD44 и CD25 или производства IFNγ не обнаружено для Т-клеток, которые совместно культивировали с DC, стимулированными различными агонистическими антителами к CD40. Только DC, импульсно-обработанные большими количествами SIINFEKL, индуцировали четкое повышение уровня экспрессии указанных маркеров по сравнению с состоянием без обработки.
Данные, полученные при измерении концентрации цитокинов в супернатанте, продемонстрировали воздействие агонистических антител к CD40 на экспрессию IL-2 (фиг. 9И) и IL-12(p40) (фиг. 9К). При применении FAP-зависимого антитела к человеческому CD40 повышенные уровни IL-12(p40) обнаружены только в присутствии FAP. Однако мышиная эквивалентная биспецифическая антигенсвязывающая молекула индуцировала существенно более высокий уровень секреции IL-12(p40). Секреция IL-2 возрастала до сходного уровня при применении как биспецифических антигенсвязывающих молекул к человеческому CD40, так и к мышиному CD40 при использовании FAP-зависимого пути.
2.2.2 Т-клеточное примирование посредством импульсно-обработанных OVA DC, активированных таргетированными на FAP CD40-связывающими молекулами
DC выделяли из селезенок мышей huCD40tg и покрытые или непокрытые FAP гранулы Dynabeads®, а также различные агонистические антитела к CD40 добавляли к селезеночным DC согласно методу, описанному в разделе 2.2.1. Вместо импульсной обработки DC с помощью SIINFEKL, для которого требуется отсутствие проникновения в DC и процессинга в них, в качестве антигена использовали белок OVA. Для усиления проникновения OVA в Толл-подобный рецептор (TLR) независимым от стимулов путем (дополнительные стимулы TLR могут приводить к высокой общей активации DC, делая невозможным детекцию различных статусов активации в результате стимуляции агонистическими антителами к CD40), применяли реагент для доставки антигена Ova (фирма Miltenyi, каталожный №130-094-663) в комбинации с биотинилированным антителом к мышиному DEC205 (фирма Miltenyi, клон NLDC-145, каталожный №130-101-854) согласно протоколу производителя. В целом, метод состоял в следующем: DC инкубировали с биотинилированным антителом, которое связывается с рецептором DEC205, отличающимся высоким уровнем экспрессии на CD8-позитивных осуществляющих кросс-презентацию DC (М. Lahoud и др., Int Immunol. 12(5), 2000, сс. 731-735). После реагента для доставки Ova к клеткам добавляли антитело к биотину, сцепленное с ФИТЦ, и OVA, что приводило к опосредуемому рецептором DEC205 поглощению OVA. Для создания отрицательного контроля DC метили только антителом к DEC205 без добавления OVA. На следующий день CD8-позитивные Т-клетки выделяли из мышей линии ОТ1, метили с помощью CFSE и добавляли к DC согласно методу, описанному в разделе 2.2.1. В день 5 эксперимента отбирали 150 мкл супернатанта для измерения IFNγ, используя набор для ELISA для мышиного IFN-гамма DuoSet (фирма R&D, каталожный № DY485-05). ELISA осуществляли согласно протоколу производителя. Для FACS-анализа Т-клеток клетки из 96-луночных плоскодонных планшетов переносили в 96-луночные круглодонные планшеты, промывали однократно ЗФР и инкубировали с 50 мкл применяемого в концентрации 3 мкг/мл блокирующего Fc-рецептор используемого в качестве контроля изотипа мышиного IgG в ЗФР. После инкубации в течение 15 мин при 4°С клетки промывали ЗФР и к клеткам добавляли 50 мкл смеси флуоресцентномеченых антител в ЗФР. Применяли следующие антитела: антитело к мышиному CD4 BV421 (фирма Biolegend, клон GK1.5, каталожный №100438), к мышиному CD86 BV785 (фирма Biolegend, клон GL-1, каталожный №105043), анти-I-A/I-E PerCp-Су5.5 (фирма Biolegend, клон М5/114.15.2, каталожный №107626), к мышиному CD70 РЕ (фирма eBioscience, клон FR70, каталожный №12-0701-82), к мышиному CD3 PE-CF594 (фирма BD Biosciences, клон 145-2С11, каталожный №562286), к мышиному CD25 РЕ-Су7 (фирма eBioscience, клон РС61.5, каталожный №25-0251-82), к мышиному CD11c АРС (фирма BD Biosciences, клон HL3, каталожный №561119), к мышиному CD44 Alexa Fluor 700 (фирма BD Biosciences, клон IM7, каталожный №560567) и к мышиному CD8 АРС-Су7 (фирма Biolegend, клон 53-6.7, каталожный №100714). Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™. Клетки инкубировали в течение 30 мин при 4°С с 50 мкл смеси для окрашивания антител. Затем клетки промывали два раза ЗФР, ресуспендировали в 200 мкл ЗФР и анализировали с использованием снабженного 5 лазерами анализатора LSR-Fortessa. Анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10. Жизнеспособные CD3- и CD8-позитивные клетки анализировали в отношении сигнала CFSE, экспрессии CD25 и CD44.
На фиг. 10А-10В, 11А-11В, 12А-12В и 22А-22Б продемонстрировано, что DC, которые инкубировали с реагентом для доставки OVA и стимулировали биспецифической антигенсвязывающей молекулой, таргетирующей человеческий CD40 и FAP, обладали способностью существенно повышать пролиферацию CD8-позитивных Т-клеток мышей линии ОТ1 (фиг. 10А-10В и 22А-22Б), а также экспрессию маркеров Т-клеточной активации CD25 (фиг. 11А-11В) и CD44 (фиг. 12А-12В). Эти эффекты оказались FAP-зависимыми. Результаты, полученные с помощью IFNγ-ELISA, подтвердили повышенную Т-клеточную активацию при воздействии таргетированного на FAP антитела к человеческому CD40: уровни IFNγ повышались в условиях совместного культивирования Т-клеток с DC, обработанными таргетирующим FAP антителом к человеческому CD40 (фиг. 13А-13В). Воздействие таргетированного на FAP антитела к мышиному CD40 оказалось сопоставимым, что подтверждает гипотезу о том, что мышиная модель huCD40tg представляет собой приемлемую систему для оценки воздействий агонистических антител к человеческому CD40.
Пример 3
Функциональные свойства таргетированных на FAP связывающих мышиный CD40 молекул
Опосредуемая CD40 активация in vitro мышиных В-клеток таргетированными на FAP связывающими мышиный CD40 молекулами
Селезенки мышей линии C57BL/6J обрабатывали согласно методу, описанному в разделе 2.2.1. Мышиные В-клетки выделяли из спленоцитов, используя набор для выделения мышиных В-клеток (фирма Miltenyi, каталожный №130-090-862) согласно инструкциям производителя. Высевали 1×105 В-клеток в 100 мкл среды R10 на лунку в 96-луночный плоскодонный планшет. Dynabeads®, покрытые мышиным биотинилированным FAP (полученным в лаборатории заявителей) (см. подробное описание в разделе 2.1.3), или непокрытые Dynabeads в качестве контроля добавляли в 50 мкл R10 в соотношении гранулы : клетки 2:1. Агонистические антитела к мышиному CD40 добавляли к В-клеткам в 50 мкл R10. Концентрации антител составляли от 1 мкг/мл до 0,3 нг/мл (3-кратные серийные разведения). При такой схеме эксперимента осуществляли сравнение биспецифических антигенсвязывающих молекул, несущих четыре сайта связывания с мышиным CD40 и либо один, либо два сайта связывания с FAP ((FAP-связывающий агент 28Н1, который эквивалентен FAP-связывающему домену в биспецифических антигенсвязывающих молекулам к человеческому CD40), с независимым от FAP антителом FGK4.5 (крысиный IgG2a, фирма BioXcell, каталожный номер № ВЕ0016-2), которое является двухвалентным в отношении мышиного CD40. Биологическая активность FGK4.5 является зависимой от перекрестного сшивания с Fc-рецептором (L. Richman и др., Cancer Immunol Res. 2(1), 2014), поэтому FGK4.5 предварительно инкубировали в течение 30 мин при комнатной температуре с козьим антикрысиным IgG (H+L) перекрестносшивающим антителом (фирма Jackson ImmunoResearch, каталожный №112-005-003, партия №123801). Через 48 ч в В-клетках анализировали экспрессию маркеров активации с помощью FACS. Для этой цели В-клетки переносили в 96-луночные плоскодонные планшеты, промывали ЗФР и инкубировали с 50 мкл применяемого в концентрации 3 мкг/мл блокирующего Fc-рецептор используемого в качестве контроля изотипа мышиного IgG в ЗФР. После инкубации в течение 15 мин при 4°С клетки промывали ЗФР и к клеткам добавляли 50 мкл смеси флуоресцентномеченых антител в ЗФР. Применяли следующие антитела: антитело к мышиному CD19 BV605 (фирма BD Biosciences, клон 1D3, каталожный №563148), к мышиному CD86 BV785 (фирма Biolegend, клон GL-1, каталожный №105043), анти-I-A/I-E PerCp-Су5.5 (фирма Biolegend, клон М5/114.15.2, каталожный №107626), к мышиному CD70 РЕ (фирма eBioscience, клон FR70, каталожный №12-0701-82), к мышиному CD80 PE-CF594 (фирма BD Biosciences, клон 16-10А1, каталожный №562504), к мышиному CD3 РЕ-Су7 (фирма BD Biosciences, клон 145-2С11, каталожный №552774), к мышиному NK1.1 РЕ-Су7 (фирма Biolegend, клон PK136, каталожный №108714), к мышиному CD11c АРС (фирма BD Biosciences, клон HL3, каталожный №561119), к мышиному CD45 Alexa Fluor 700 (фирма eBioscience, клон 30-F11, каталожный №56-0451-82), к мышиному CD8 АРС-Су7 (фирма Biolegend, клон 53-6.7, каталожный №100714). Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™. Клетки инкубировали в течение 30 мин при 4°С со смесью для окрашивания антител, промывали два раза ЗФР и ресуспендировали в 200 мкл ЗФР и анализировали с использованием снабженного 5 лазерами анализатора LSR-Fortessa и анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10. Единичные живые клетки разделяли на CD11c-негативные, CD3-негативные и NK1.1-негативные клетки для того, чтобы исключить не-В-клетки. CD8-негативные, CD19-позитивные клетки анализировали в отношении экспрессии маркеров В-клеточной активации CD70, CD80, CD83 и CD86.
Инкубация мышиных В-клеток с таргетированными на FAP антителами к мышиному CD40 либо с одним, либо с двумя FAP-связывающими фрагментами повышала экспрессию маркеров В-клеточной активации. Экспрессия CD70 лишь слегка повышалась при использовании биспецифических антигенсвязывающих молекул по сравнению с вариантом, в котором использовалось перекрестносшитое антитело FGK4.5 (фиг. 14А и 14Б). Однако общее количество клеток, экспрессирующих высокие уровни CD70, было довольно низким. Обнаружена повышающая регуляция экспрессии CD80 FAP-зависимым образом после обработки В-клеток биспецифическими молекулами, таргетирующими мышиный CD40 и FAP (фиг. 14В и 14Г). Биспецифические молекулы характеризовались более высокой эффективностью, чем двухвалентное независимое от FAP антитело FGK4.5, в отношении повышающей регуляции CD80. Экспрессия CD86 также заметно индуцировалась всеми изученными агонистическими антителами к CD40, и уровни экспрессии оказались сопоставимыми для всех антител (фиг. 14Д и 14Е). Хотя повышающая регуляция CD86 зависела от FAP при использовании четырехвалентного антитела к мышиному CD40, несущего два FAP-связывающих фрагмента, независимое от FAP действие обнаружено для биспецифической антигенсвязывающей молекулы, имеющей только один сайт связывания FAP. Кроме того, независимая от FAP повышающая регуляция экспрессии молекул ГКГС-II обнаружена для всех изученных биспецифических антигенсвязывающих молекул (фиг. 14Ж и 14З).
3.2 Опосредуемая CD40 активация in vivo мышиных DC и Т-клеток с помощью таргетированных на FAP связывающихся с мышиным CD40 молекул
Линию опухолевых клеток, предназначенную для трансфекции мышиной аденокарциномой ободочной кишки МС38_FAP, которая экспрессирует мышиный FAP, получали с помощью in-vivo-пассажа на фирме Roche Glycart AG и после размножения депонировали во внутреннем банке клеток фирмы Glycart. Клетки линии МС38_muFAP_invipa культивировали в среде DMEM, содержащей 10% FCS (фирма РАА Laboratories, Австрия), 1 мМ пируват, 1× NEAA и 6 мкг/мл пуромицина. Клетки культивировали при 37°С в насыщенной водяным паром атмосфере с 5% СО2 и инъецировали полученный in vitro пассаж 14, жизнеспособность которого составляла 95%. 2×106 опухолевых клеток инъецировали подкожно в 100 мкл клеточной суспензии (50% среды RPMI и 50% матригеля). 33 самки мышей линии С57В1/6, возраст которых в начале эксперимента составлял 8-9 недель (которых покупали на фирме Charles Rivers, Германия), содержали в свободных от специфических патогенов условиях с суточным циклом 12 ч света/12 ч темноты согласно принятым руководствам (GV-Solas; Felasa; TierschG). Протокол экспериментального исследования был рассмотрен и одобрен местными органами управления (Р 2011-128), и после доставки животных выдерживали одну неделю для акклиматизации к новому окружению и для обследования. После этого им имплантировали транспордер подкожно в правую часть спины для идентификации и выдерживали в течение еще одной недели для восстановления. На регулярной основе осуществляли постоянный мониторинг состояния здоровья. Для изучения таргетируемой FAP активации CD40 in vivo мышам инъецировали подкожно в день 0 опыта 2×106 MC38-FAP. В день х, когда опухоли достигали 200 мм3, 9 мышам на группу инъецировали i.p. 200 мкл различных соединений. Мышам в обработанной наполнителем группе инъецировали гистидиновый буфер, а животным из групп обработки (тестируемыми агентами) инъецировали либо 10 мкг/кг FGK4.5, либо 15 мг/кг FGK4.5 4+1. У животных контролировали ежедневно клинические симптомы и определяли наличие нежелательных воздействий, таких как потеря веса. Критериями терминации для животных являлись клиническое проявление заболевания, нарушение локомоции и грязная шерсть. В моменты времени 72 ч и 8 дней после терапевтической инъекции изымали опухоли, селезенки, дренирующие опухоль и недренирующие опухоль лимфатические узлы у трех мышей на группу и анализировали с помощью проточной цитометрии. Кроме того, собирали сыворотку всех умерщвленных животных для анализа сывороточных ферментов, свидетельствующих о повреждении печени.
Для анализа методом проточной цитометрии получали суспензии единичных клеток всех собранных органов и окрашивали флуоресцентномечеными антителами, указанными в разделе 2.1.1 и разделе 3.1 соответственно. Для того, чтобы отличать живые клетки от мертвых, к смеси антител добавляли краситель для определения жизнеспособности Zombie Aqua™. Клетки инкубировали в течение 30 мин при 4°С со смесью для окрашивания антител, промывали два раза ЗФР и ресуспендировали в 200 мкл ЗФР. FACS-анализ осуществляли с использованием снабженного 5 лазерами анализатора LSR-Fortessa и анализ данных осуществляли с помощью программного обеспечения FlowJo, версия 10. DC идентифицировали как жизнеспособные единичные клетки, высоко позитивные по CD11c и молекулам ГКГС класса II и негативные по CD3, NK1.1 и CD19. Экспрессию обоих маркеров активации DC CD70 и CD86 анализировали на DC через 3 дня после терапевтической инъекции. Жизнеспособные CD45-, CD3- и CD8-позитивные единичные клетки идентифицировали как CD8+ Т-клетки. CD8+ Т-клетки анализировали в отношении экспрессии Ki67 ФИТЦ (фирма eBioscience, клон SolA15, каталожный №11-5698-82) и общее количество CD8+ Т-клеток в опухолях определяли с использованием гранул для подсчета абсолютного количества клеток (фирма Invitrogen, каталожный №01-1234).
Как продемонстрировано на фиг. 23А-23В, в день 3 уровень ферментов, позволяющих предположить наличие гепатоцеллюлярного повреждения, возрастал у мышей, которым инъецировали однократную i.р.-дозу (антитела к) CD40, но не у мышей, которым инъецировали (антитело к) FAP-CD40 или только наполнитель. Кроме того, вес тела снижался, а масса селезенки увеличивалась у обработанных (антителом к) CD40 мышей через 3 дня после обработки по сравнению с мышами, которым инъецировали конструкцию FAP-CD40 4+1 или только наполнитель (фиг. 23Г и 23Е соответственно), это свидетельствует о менее серьезных побочных действиях у животных, обработанных таргетированными на FAP антителами к CD40, по сравнению с животными, обработанными родительским антителом к CD40. Хотя и в меньшей степени, чем антитело FGK4.5, таргетированные на FAP антитела к CD40 индуцировали существенное увеличение активации DC (экспрессия CD86 и CD70) в дренирующих опухоль лимфатических узлах через 3 дня после обработки (фиг. 24А и 24Б) и увеличение пролиферации CD8+ Т-клеток (экспрессия Ki68 и количество клеток) в опухолях через 8 дней после обработки (фиг. 24В и 24Г) по сравнению с обработанными наполнителем мышами. В целом, установлено, что таргетированная на FAP анти-CD40 молекула с FAP-зависимой активацией CD40 в формате 4+1 индуцировала эффективную активацию DC и Т-клеток у несущих опухоли мышей с пониженной системной токсичностью по сравнению с «нетаргетированным» родительским антителом к CD40 FGK4.5.
Пример 4
Создание и получение гуманизированных вариантов антитела к CD40 S2C6
4.1 Первое поколение гуманизированных вариантов антитела к CD40 S2C6
4.1.1 Методология
Антитело к CD40 S2C6 описано в WO 2000/075348, и оно содержит VH-домен, имеющий SEQ ID NO: 129, и VL-домен, имеющий SEQ ID NO: 130. Его варианты создавали следующим образом. Для идентификации приемлемого человеческого акцепторного каркасного участка в процессе гуманизации анти-CD40-связывающего агента S2C6 применяли комбинацию двух методологий. С одной стороны, использовали классический подход, состоящий в поиске акцепторного каркасного участка с высокой гомологией последовательности, трансплантации CDR в этот каркасный участок и оценке того, какие обратные мутации можно рассматривать. Более точно, каждое аминокислотное отличие идентифицированных каркасных участков от родительского антитела рассматривалось как нарушающее структурную целостность связывающего агента, и при необходимости интродуцировали обратные мутации в родительскую последовательность. Структурная оценка основывалась на моделях гомологии Fv-областей родительского антитела и его гуманизированных версий, созданных с использованием разработанного в лаборатории заявителей инструмента моделирования структурной гомологии антител, реализованного с использованием операционной среды Biovia Discovery Studio, версия 4.5.
С другой стороны, разработанный в лаборатории заявителей инструмент in silico применяли для предсказания ориентации относительно друг друга VH- и VL-доменов гуманизированных версий (см. WO 2016062734, которая включена в настоящее описание в качестве ссылки). Результаты сравнивали с предсказанной ориентацией VH-VL-доменов родительского связывающего агента для выбора комбинаций каркасных участков, которые близки по геометрии к исходному антителу. Целью являлось определение возможного аминокислотного обмена в поверхности раздела VH-VL-области, который может приводить к деструктивным изменениям спаривания двух доменов.
4.1.2 Выбор акцепторного каркасного участка и его адаптации
Выбирали акцепторный каркасный участок, указанный ниже в таблице 12:

Пост-CDR3 каркасные области адаптировали из человеческой зародышевой линии IGHJ IGHJ6*01/02 (YYYYYGMDVWGQGTTVTVSS) и человеческой зародышевой линии IGKJ IGKJ1*01 (WTFGQGTKVEIK). Часть, необходимая для акцепторного каркасного участка, подчеркнута.
С учетом структурных особенностей обратные мутации из человеческого акцепторного каркасного участка в аминокислотную последовательность родительского связывающего агента интродуцировали в положения Н48 (М>I) и Н71 (R>V) VH-области и в положения L36 (F>Y), L46 (R>L) и L87 (Y>F) VL-области (нумерация Кэбота). Кроме того, два положения в CDR-H2 идентифицировали в качестве перспективных кандидатов для прямых мутаций, т.е. аминокислотных замен из родительского связывающего агента в человеческую акцепторную зародышевую линию для повышения общих свойственных человеческому антителу особенностей, а именно Н60 (N>A) и Н64 (K>Q).
С целью предполагаемой возможности создания «горячих точек» (дезаминирование аспарагина) дополнительные изменения относительно родительского связывающего агента интродуцировали в положения H52b (N>Q) и Н54 (N>A) в VH и в L27f (N>Q), L28 (G>P), L29 (N>Q) и L30 (Т>I) в VL (нумерация Кэбота).
Ниже в таблице 13 представлена матрица спаривания VH-VL:

4.1.3 VH- и VL-домены полученных в результате гуманизированных антител к CD40
Полученные в результате VH-домены гуманизированных антител к CD40 представлены ниже в таблице 14, полученные в результате VL-домены гуманизированных антител к CD40 представлены ниже в таблице 15.



Осуществляли обратную трансляцию гуманизированных аминокислотных последовательностей вариабельных областей тяжелых и легких цепей вариантов S2C6 в ДНК и образовавшуюся кДНК синтезировали (фирма GenArt) и затем клонировали в экспрессионных векторах для тяжелых цепей в виде слитых белков с человеческими IgG1-каркасами/человеческой последовательностью СН1-шарнир-СН2-СН3 с мутациями LALA и PG (замена лейцина 234 на аланин, лейцина 235 на аланин, пролина 329 на глицин), элиминирующими эффекторные функции, или в экспрессионных векторах для легких цепей в виде слитых белков с человеческой С-каппа. Затем плазмидами для LC и НС совместно трансфектировали HEK293 и очищали через 7 дней из супернатантов стандартными методами очистки антител.
4.2 Второе поколение гуманизированных вариантов антитела к CD40 S2C6
4.2.1 Методология
Также как и в примере 4.1, для идентификации приемлемого человеческого акцепторного каркасного участка в процессе гуманизации анти-CD40-связывающего агента S2C6 применяли комбинацию двух методологий. С одной стороны, использовали классический подход, состоящий в поиске акцепторного каркасного участка с высокой гомологией последовательности, трансплантации CDR в этот каркасный участок и оценке того, какие обратные мутации можно рассматривать. Более точно, каждое аминокислотное отличие идентифицированных каркасных участков от родительского антитела рассматривалось как нарушающее структурную целостность связывающего агента, и при необходимости интродуцировали обратные мутации в родительскую последовательность. Структурная оценка основывалась на моделях гомологии Fv-областей родительского антитела и его гуманизированных версий, созданных с использованием разработанного в лаборатории заявителей инструмента моделирования структурной гомологии антител, реализованного с использованием операционной среды Biovia Discovery Studio, версия 4.5.
С другой стороны, разработанный в лаборатории заявителей инструмент in silico применяли для предсказания ориентации относительно друг друга VH- и VL-доменов гуманизированных версий (см. WO 2016062734, которая включена в настоящее описание в качестве ссылки). Результаты сравнивали с предсказанной ориентацией VH-VL-доменов родительского связывающего агента для выбора комбинаций каркасных участков, которые близки по геометрии к исходному антителу. Целью являлось определение возможного аминокислотного обмена в поверхности раздела VH-VL-области, который может приводить к деструктивным изменениям спаривания двух доменов.
4.2.2 Выбор акцепторного каркасного участка и его адаптации Выбирали два акцепторных каркасных участка, указанные ниже в таблице 16 и таблице 18.

Пост-CDR3 каркасные области адаптировали из человеческой зародышевой линии IGHJ IGHJ6*01/02 (YYYYYGMDVWGQGTTVTVSS) и человеческой зародышевой линии IGKJ IGKJ4*01/02 (LTFGGGTKVEIK). Часть, необходимая для акцепторного каркасного участка, выделена жирным шрифтом.
С учетом структурных особенностей обратные мутации из человеческого акцепторного каркасного участка в аминокислотную последовательность родительского связывающего агента интродуцировали в положения Н43 (Q>K), Н44 (G>S), Н69 (M>L), Н71 (R>V), H73 (Т>K), H88 (V>A) и H105 (Q>H) VH-области и в положения L2 (I>V), L4 (M>V), L87 (Y>F) и L104 (V>L) VL-области. В одном варианте включали мутацию T70S (VH) для изучения влияния несколько более гидрофильного остатка в этом положении.
Все варианты включали мутацию N54A (VH) с целью предполагаемой возможности создания «горячих точек» (дезаминирование аспарагина). Все положения пронумерованы согласно системе EU-нумерации Кэбота.
Ниже в таблице 17 представлена матрица спаривания VH-VL гуманизированных вариантов:
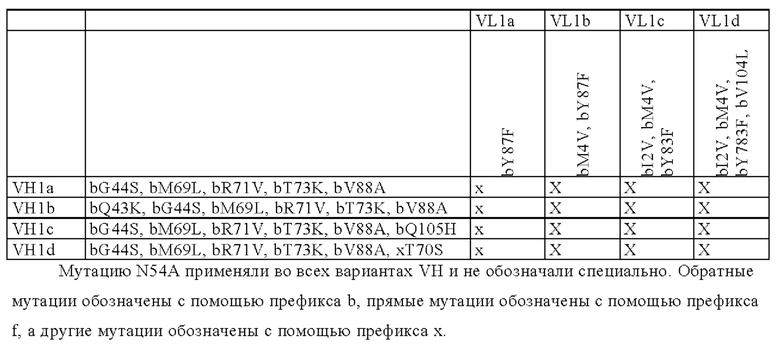

Пост-CDR3 каркасные области адаптировали из человеческой зародышевой линии IGHJ IGHJ6*01/02 (YYYYYGMDVWGQGTTVTVSS) и человеческой зародышевой линии IGKJ IGHJ6*01/02 IGHJ6*01/02 (LTFGGGTKVEIK). Часть, необходимая для акцепторного каркасного участка, выделена жирным шрифтом.
С учетом структурных особенностей обратные мутации из человеческого акцепторного каркасного участка в аминокислотную последовательность родительского связывающего агента интродуцировали в положения Н44 (G>S), Н49 (S>G), Н71 (R>V), Н78 (L>A), H94 (K>R) и H105 (Q>H) VH-области и в положения L42 (K>Q), L43 (A>S) и L87 (Y>F) VL-области. Кроме того, четыре положения в CDR-H2 идентифицировали в качестве перспективных кандидатов для прямых мутаций, т.е. аминокислотных замен из родительского связывающего агента в человеческую акцепторную зародышевую линию для повышения общих свойственных человеческому антителу особенностей, а именно Н60 (N>G), Н61 (Q>D), Н62 (K>S) и Н63 (F>V).
Все варианты включали мутацию N54A (VH) с целью предполагаемой возможности создания «горячих точек» (дезаминирование аспарагина). Все положения пронумерованы согласно системе EU-нумерации Кэбота.
Ниже в таблице 19 представлена матрица спаривания VH-VL гуманизированных вариантов:

4.2.3 VH- и VL-домены полученных в результате гуманизированных антител к CD40
Полученные в результате VH- и VL-домены гуманизированных антител к CD40 на основе акцепторного каркасного участка 1 представлены ниже в таблице 20, а полученные в результате VH- и VL-домены гуманизированных антител к CD40 на основе акцепторного каркасного участка 2 представлены ниже в таблице 21.



4.2.4 Новые гуманизированные антитела к CD40 в формате huIgG1_LALA_PG
На основе новых гуманизированных вариантов VH и VL экспрессировали новые антитела к CD40 в виде антител huIgG1 с «молчащей» эффекторной функцией Fc (P329G; L234, L235A) для аннулирования способности связываться с Fcγ-рецепторами согласно методу, описанному в WO 2012/130831 А1.

Полноразмерные последовательности гуманизированных антител к CD40 в виде человеческих антител типа IgG1_LALAPG представлены в таблице 23.
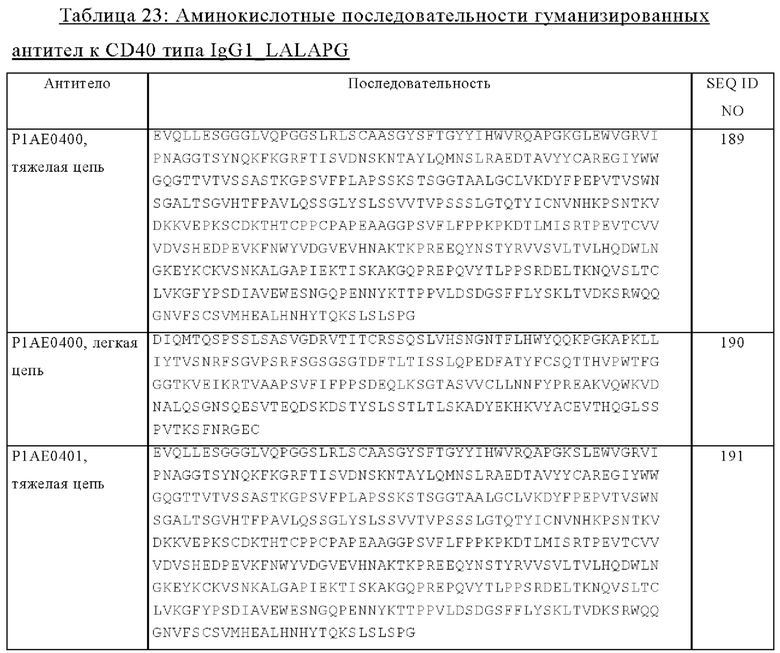
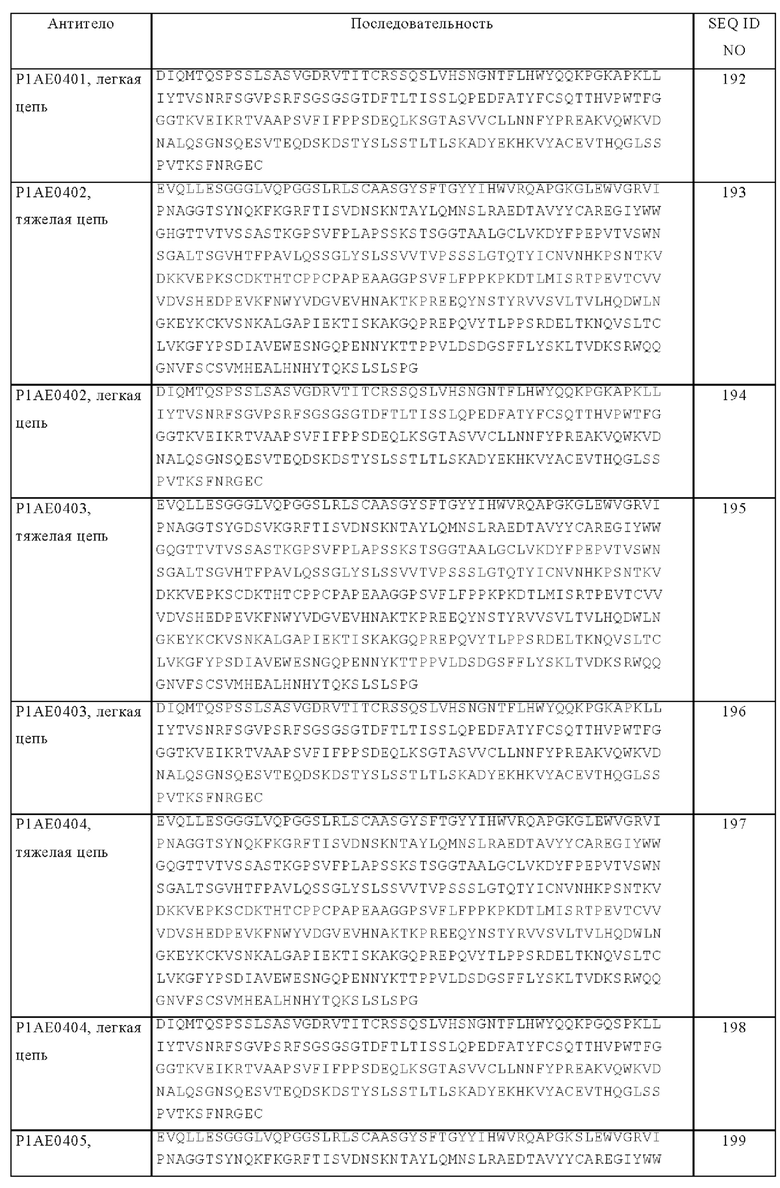
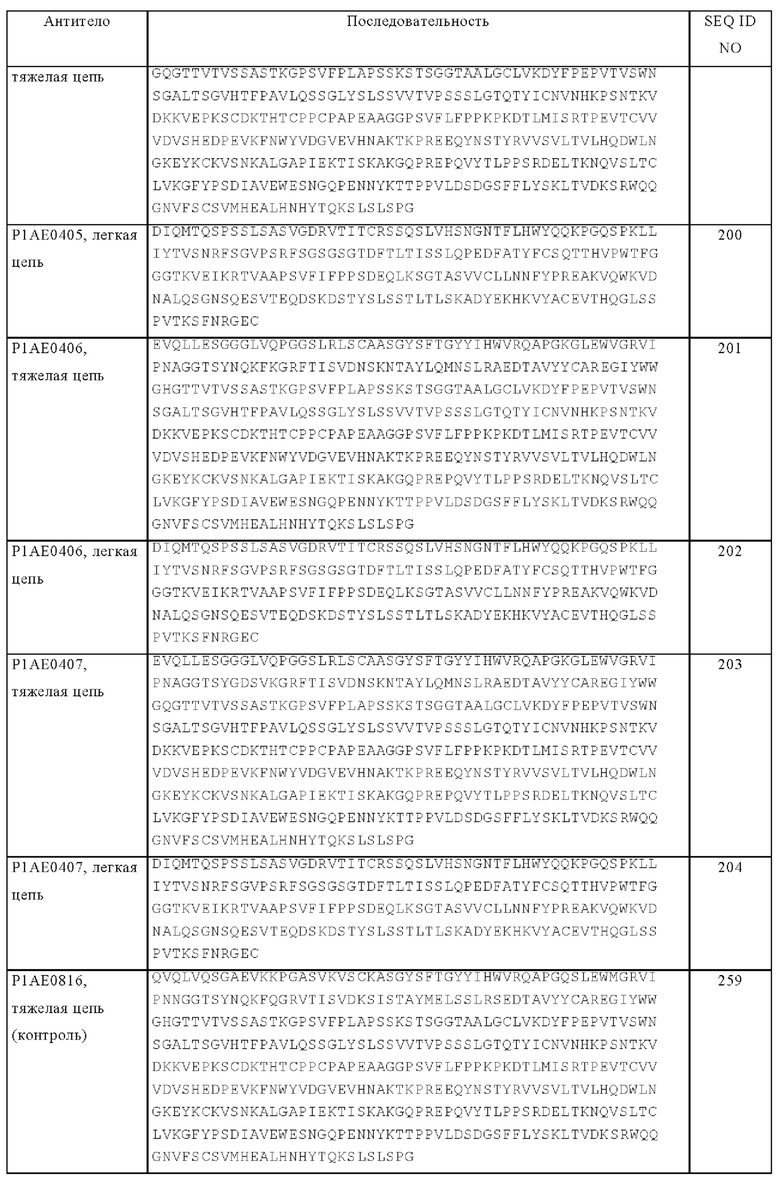
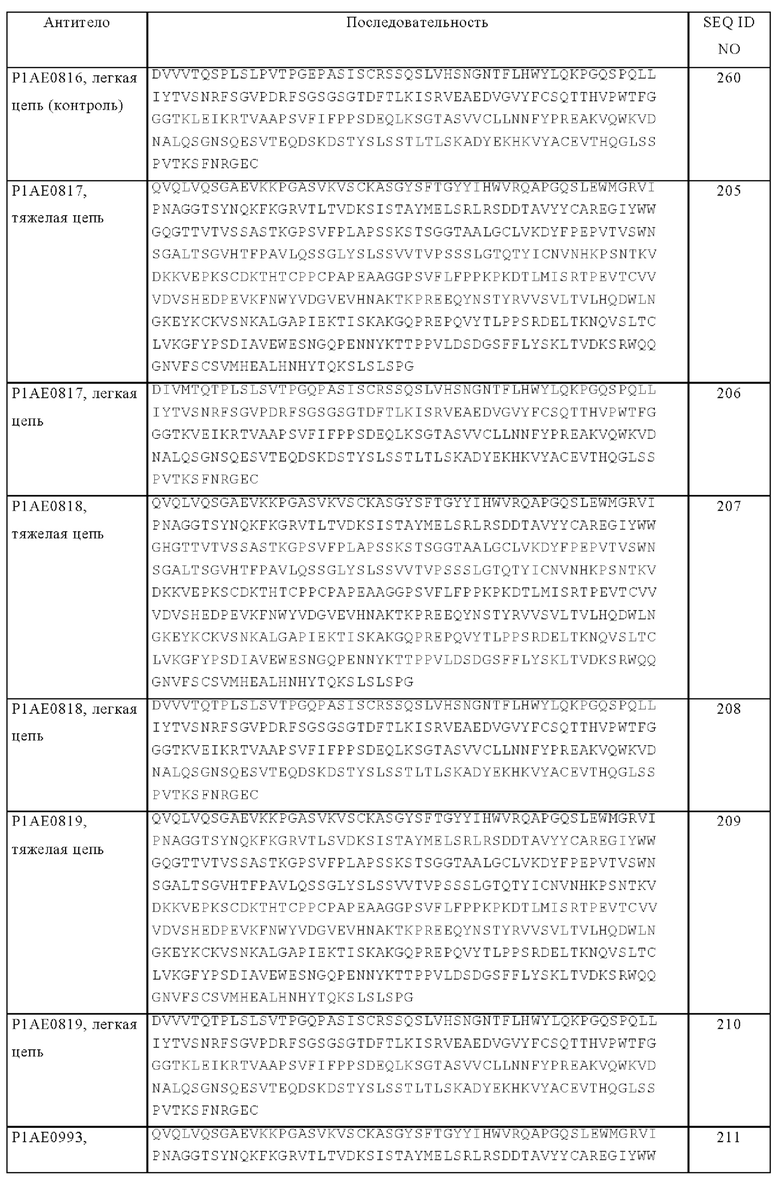
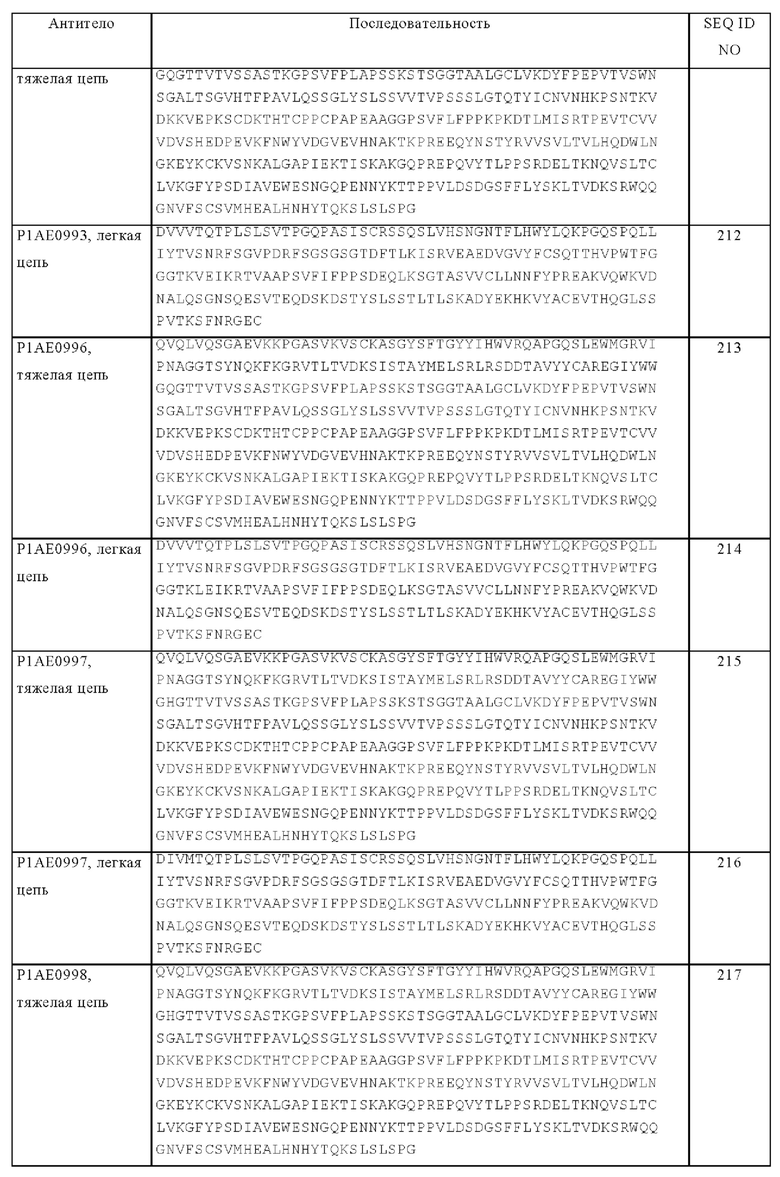
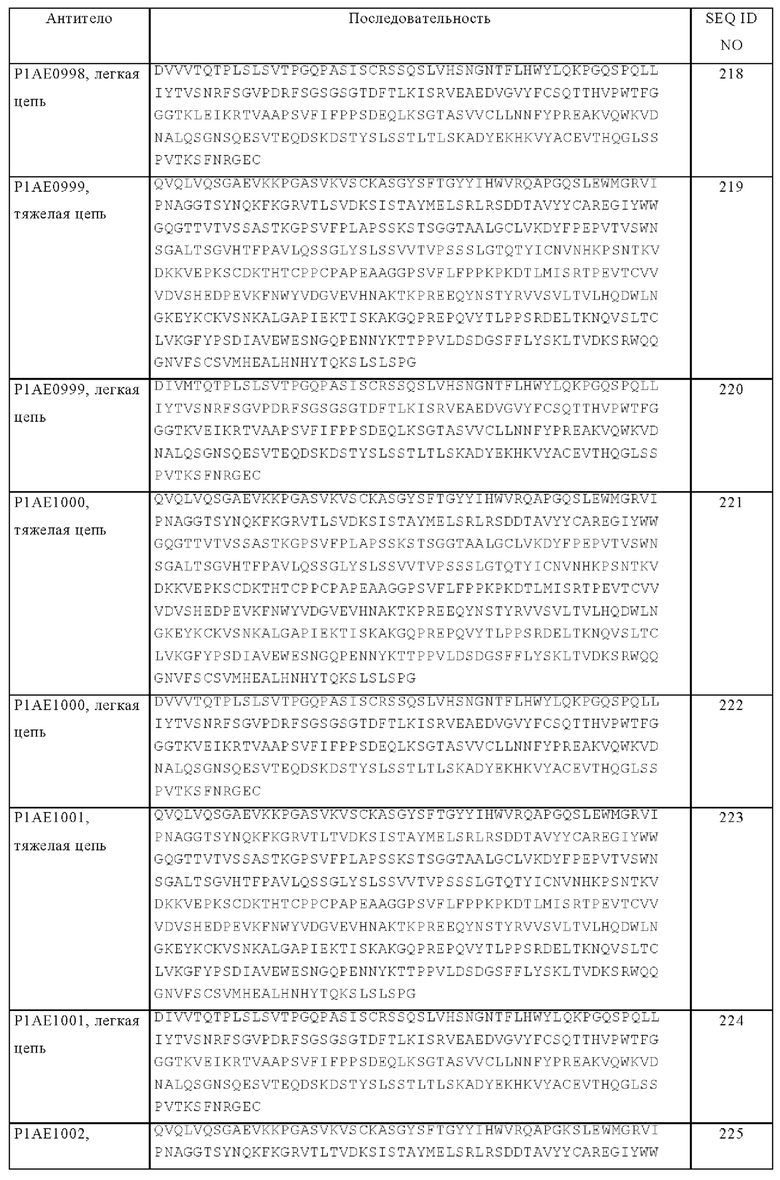
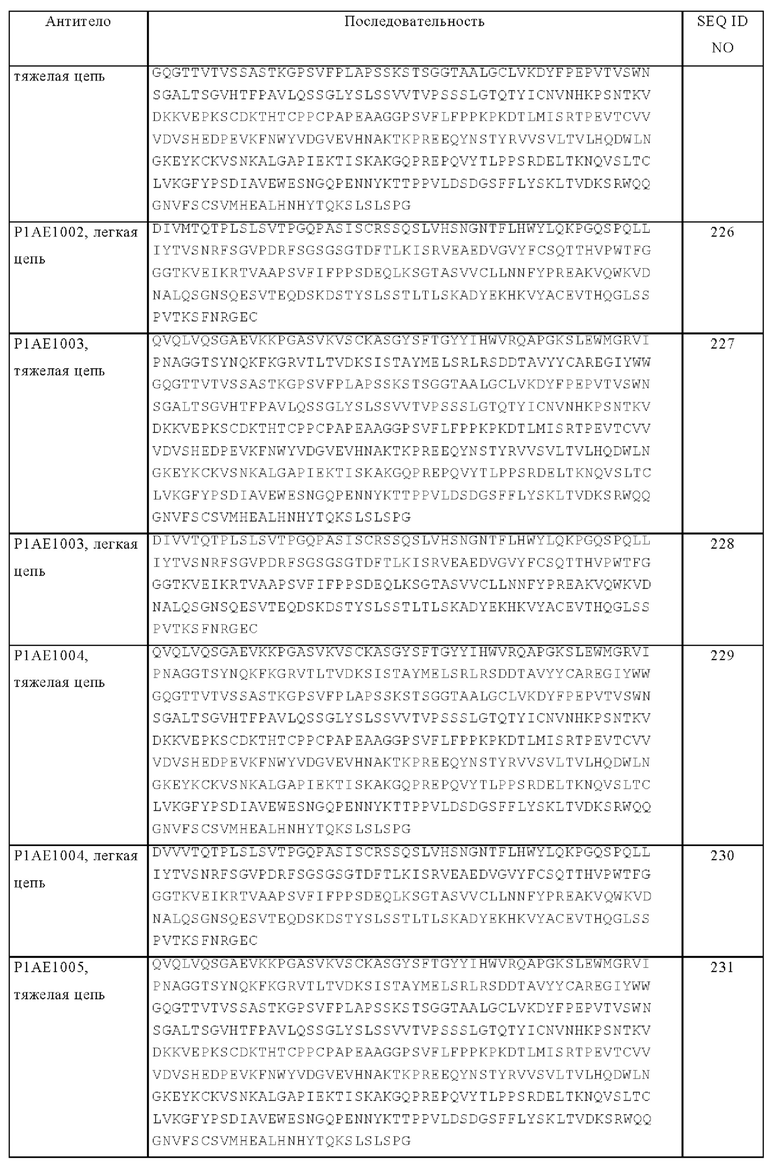

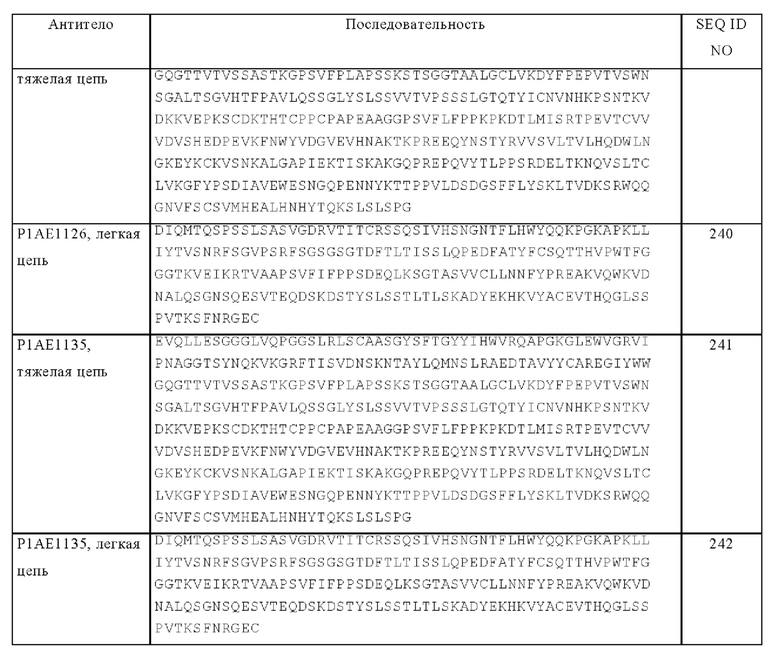
4.2.5 Получение новых гуманизированных антител к CD40 в формате huIgG1_LALA_PG
Антитела экспрессировали путем кратковременной трансфекции растущих в суспензии клеток HEK293-F экспрессионными векторами, кодирующими различные пептидные цепи. Трансфекцию клеток HEK293-F (фирма Invitrogen, США) осуществляли согласно инструкциям поставщика клеток с использованием препаратов векторов антител Maxiprep (фирма Qiagen, Германия), среды на основе F17 (фирма Invitrogen, США), PEIpro (фирма Polyscience Europe GmbH) и начальной клеточной плотности 1-2 млн жизнеспособных клеток/мл бессывороточной среды для экспрессии FreeStyle 293 (фирма Invitrogen). Супернатанты клеточных культур собирали после 7 дней культивирования во встряхиваемых колбах или ферментерах с перемешивающими устройствами путем центрифугирования при 14000 g в течение 30 мин и фильтровали через 0,22-микрометровый фильтр.
Антитела очищали из супернатантов клеточных культур с помощью аффинной хроматографии, используя MabSelectSure-Sepharose™ (фирма GE Healthcare, Швеция). В целом, метод состоял в следующем: стерильные профильтрованные супернатанты клеточных культур осаждали на смолу MabSelect SuRe, уравновешенную ЗФР-буфером (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4), промывали буфером для уравновешивания и элюировали 25 мМ цитратным буфером, рН 3,0. После нейтрализации с помощью 1М Трис, рН 9,0 агрегированный белок отделяли от мономерных образцов антител с помощью гель-фильтрации (Супердекс 200, фирма GE Healthcare) в буфере, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Фракции мономерных белков объединяли, при необходимости концентрировали, используя, например, центрифужный концентратор MILLIPORE Amicon Ultra (MWCO 30 кДа), и хранили при температуре -80°С. Аликвоты образцов использовали для последующего анализа белков и аналитической характеризации, например, с помощью КЭ-ДСН, гель-фильтрации, масс-спектрометрии и определения эндотоксинов.
Данные о выходе продукта различных гуманизированных антител к CD40 представлены в таблице 24 в виде уровней титров, рассчитанных по выходу после препаративной аффинной хроматографии, проведенной с использованием MabSelectSure-Sepharose™.
Чистоту и молекулярную массу молекулы после окончательной стадии очистки анализировали с помощью КЭ-ДСН в присутствии восстановителя и без него. Применяли систему Caliper LabChip GXII (фирма Caliper Lifescience) согласно инструкции производителя.
Содержание агрегатов молекул анализировали, используя колонку для аналитической гель-фильтрации TSKgel G3000 SW XL (фирма Tosoh), уравновешенную подвижным буфером, содержащим 25 мМ фосфат калия, 125 мМ хлорид натрия, 200 мМ моногидрохлорид L-аргинина, 0,02% (мас./об.) NaN3, рН 6,7, при 25°С.
Для непосредственного сравнения всех антител осуществляли мониторинг термостабильности на основе статического рассеяния света (SLS) и путем измерения присущей белку флуоресценции в ответ на воздействие температурного стресса. Для изучения 30 мкг профильтрованного белкового образца с концентрацией белка 1 мг/мл вносили с дублированием в устройство Optim 2 (фирма Avacta Analytical Ltd). Температуру повышали с 25 до 85°С со скоростью 0,1°С/мин, получая данные о радиусе и общей интенсивности рассеяния. Для определения присущей белку флуоресценции осуществляли возбуждение образца при 266 нм и данные об испускании собирали при длине волны от 275 до 460 нм. Для всех антител температура агрегации (Tagg) составляла от 64 до 69°С, и эти данные представлены ниже в таблице 24 или таблице 25.
Данные о выходе продукта гуманизированных антител к CD40 с различными каркасными участками представлены ниже в таблице 24 или таблице 25.
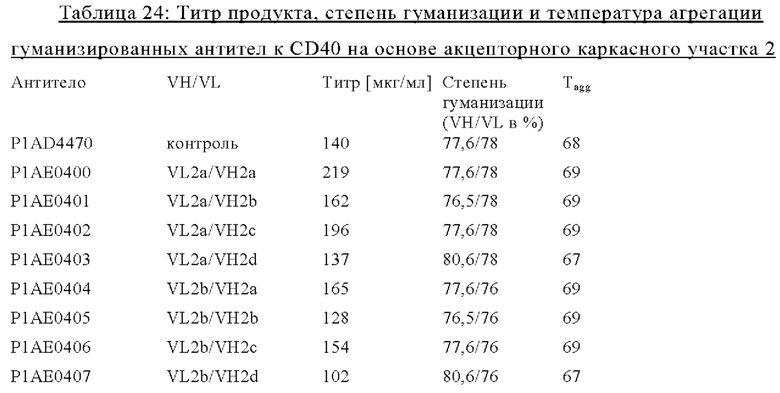
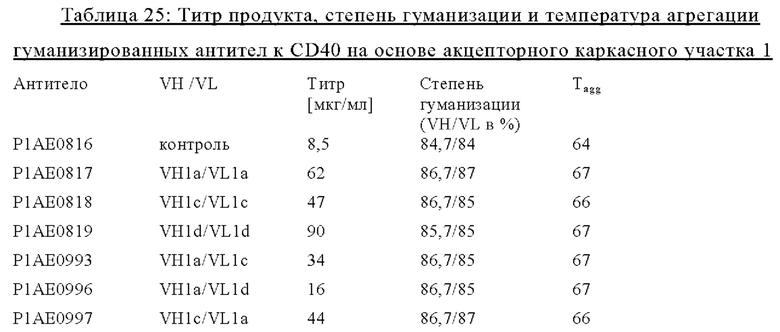
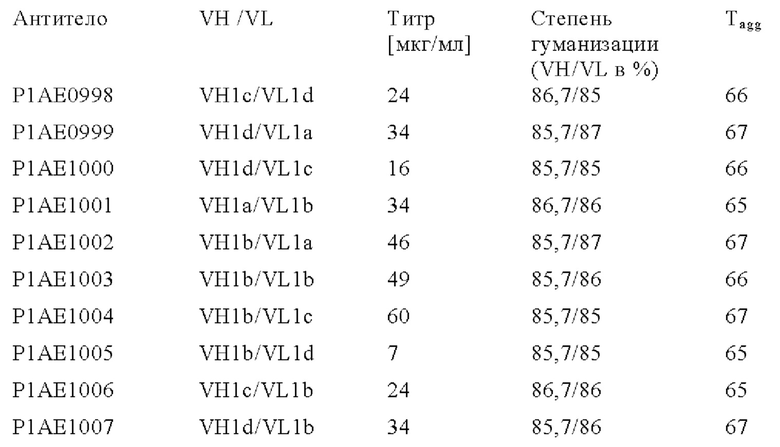
4.2.6 Создание рекомбинантного белка внеклеточного домена CD40 человека и обезьян циномолгус
Следующие конструкции клонировали и экспрессировали путем кратковременной экспрессии в клетках HEK293:
1) Внеклеточный домен человеческого CD40 (аминокислоты 21-193 SEQ ID NO: 1, NCBI регистрационный номер NP_001241) с C-концевой меткой His-AviTag™ (SEQ ID NO: 266).
2) Внеклеточный домен CD40 обезьян циномолгус (Масаса fascicularis) (аминокислоты 21-193, последовательность внеклеточного домена CD40 обезьян циномогус получены из базы данных кДНК обезьян циномолгус фирмы Roche, неопубликованные данные) с C-концевой меткой Tag™ (SEQ ID NO: 267).
Внеклеточные домены CD40 в качестве антигенов для анализов связывания создавали путем синтеза генов (фирма Eurofins Genomics GmbH service, Германия), клонирования через уникальные сайты рестрикции в созданном на фирме Roche экспрессионном векторе с использованием стандартных процедур клонирования. Клонирование всех конструкций подтверждали секвенированием. Все антигены экспрессировали под контролем CMV-промотора. Для кратковременной экспрессии конструкций внеклеточного домена CD40 адаптированные для роста в суспензии клетки HEK293-F (фирма Life Technologies, США) трансфектировали соответствующими плазмидами: в целом метод состоял в следующем: 1 л клеток HEK293-F с плотностью примерно 2×106 клеток/мл трансфектировали, используя в общей сложности 500 мкг плазмидной ДНК в комплексе с реагентом для трансфекции PEIpro (фирма Polysciences Europe GmbH, Германия) согласно инструкциям производителя. После трансфекции клетки HEK293-F инкубировали в течение 6 дней. Затем клетки собирали центрифугированием и содержащий белок супернатант фильтровали, используя систему для вакуумной фильтрации с размером пор 0,22 мкм (фирма Millipore). Меченные His-AviTag™ белки очищали с помощью металл-хелатной аффинной хроматографии (IMAC), используя полную смолу His-Tag (фирма Roche Diagnostics). После промывки с помощью 50 мМ Na2PO4, 300 мМ NaCl, pH 8,0, слитые белки His- AviTag™ элюировали, используя буфер для промывки, дополненный 500 мМ имидазолом, с pH 7,0. Агрегированный белок отделяли от мономерных слитых белков с помощью гель-фильтрации (Супердекс 75, фирма GE Healthcare) в буфере, содержащем 20 мМ Трис, 150 мМ NaCl, pH 7,4. Фракции мономерных белков объединяли, при необходимости концентрировали, используя, например, центрифужный концентратор MILLIPORE Amicon Ultra (10 кДа MWCO), и хранили при температуре -80°С. Аликвоты образцов использовали для последующей аналитической характеризации, например, с помощью КЭ-ДСН, гель-фильтрации и масс-спектрометрии.
Биотинилирование внеклеточного домена CD40:
Ферментативное сайтспецифическое биотинилирование конструкций внеклеточного домена CD40 человека и обезьян циномолгус, содержащих C-концевую AviTag™, осуществляли с использованием набора биотин-белковой лигазы BirA (фирма Avidity LLC, США) согласно инструкции производителя. В целом, метод состоял в следующем: 1/10 объема BiomixA (10-кратная концентрация: 0,5М бициновый буфер, pH 8,3) и BiomixB (10-кратная концентрация: 100 мМ АТФ, 100 мМ MgOAc, 500 мкМ d-биотин) добавляли к содержащему AviTag™ белку с последующим добавлением 2,5 мкг BirA-лигазы на 10 нмолей белка. Реакционную смесь инкубировали при 30°С в течение 1 ч и очищали гель-фильтрацией на предварительной упакованной Супердекс75 prep grade колонке HiLoad (фирма GE Healthcare, Швеция).
4.2.7 Анализ на основе спектроскопии поверхностного плазмонного резонанса связывания CD40 человека/обезьян циномолгус
Примерно 12000 резонансных единиц (RU) системы для захвата (10 мкг/мл козьего античеловеческого F(ab)'2; код доступа: 28958325; фирма GE Healthcare Bio-Sciences АВ, Швеция) связывали с СМ5-чипом (фирма GE Healthcare, BR-1005-30) при рН 5,0, используя набор для аминного сочетания, поставляемый фирмой GE Healthcare. Буфер для образца и для системы представляя собой ЗФР-Т (10 мМ забуференный фосфатом физиологический раствор, включающий 0,05% Твин 20), рН 7,4. Температуру проточной ячейки устанавливали на 25°С, а температуру блока для образца устанавливали на 12°С, и примировали дважды подвижным буфером. Антитело захватывали путем инъекции 50 нМ раствора в течение 30 с при скорости потока 5 мкл/мин. Для измерения ассоциации инъецировали внеклеточный домен человеческого CD40 или внеклеточный домен CD40 обезьян циномолгус в различных концентрациях в растворе в течение 300 с при скорости потока 30 мкл/мин, начиная с 300 нМ, используя разведения 1:3. Осуществляли мониторинг фазы диссоциации в течение вплоть до 1200 с и запускали путем замены раствора для образца на подвижный буфер. Поверхность регенерировали путем промывки в течение 60 с раствором глицина, рН 2,1 при скорости потока 30 мкл/мин. Различия всех показателей преломления корректировали путем вычитания ответа, полученного на поверхности с козьим античеловеческим F(ab')2. Вычитали также результаты, полученные с использованием «пустых» инъекций (= двойной контроль). Для расчета кажущейся величины KD и других кинетических параметров использовали модель связывания 1:1 Ленгмюра. Кажущуюся величину KD рассчитывали с помощью программного обеспечения Biacore™ B4000 evaluation (версия 1.1).
4.2.8 Анализ клеточного связывания для характеризации CD40-специфических гуманизированных антител
CD40-позитивные клеток (клетки Raji) отделяли от (стенок) культурального флакона с помощью трипсина и подсчитывали количество с помощью счетчика клеток Casy. После пеллетирования при 4°С клетки ресуспендировали в FACS-буфере (2,5% FCS в ЗФР), доводили количество до 2.0Е+06 клеток /мл и вносили в 96-луночные РР-планшеты с V-образным дном (25 мкл/лунку соответствует 5,0Е+04 клеток/лунку).
Концентрацию CD40-специфических антител доводили до 20 мкг/мл в FACS-буфере, получая конечную концентрацию 10 мкг/мл. Добавляли 20 мкл к 25 мкл клеточной суспензии и инкубировали в течение 1 ч при 4°С. Затем клетки промывали дважды в FACS-буфере. После промывки клетки ресуспендировали в 50 мкл FACS-буфера, содержащего вторичное антитело (<huIgG>-Alexa488, c=10 мкг/мл), и инкубировали в течение 1 ч при 4°С. Затем клетки промывали дважды FACS-буфером и ресуспендировали, используя по 70 мкл/лунку FACS-буфера, для измерений с помощью устройства FACS Canto (фирма BD, Pharmingen).
В таблице 26 представлены данные об аффинности гуманизированных антител к CD40 (полученные с помощью Biacore) и о клеточном связывании с экспрессирующими CD40 клетками (клетки Raji).
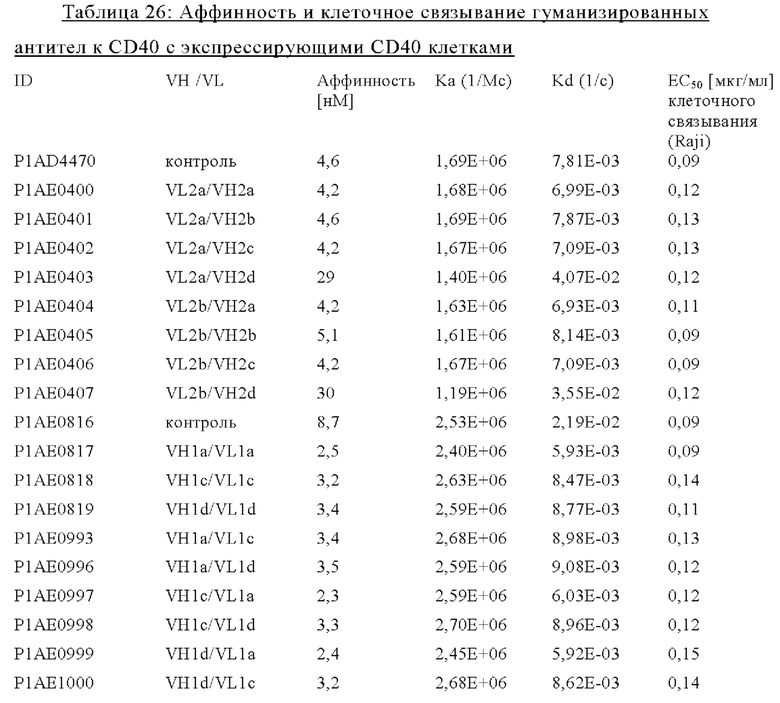
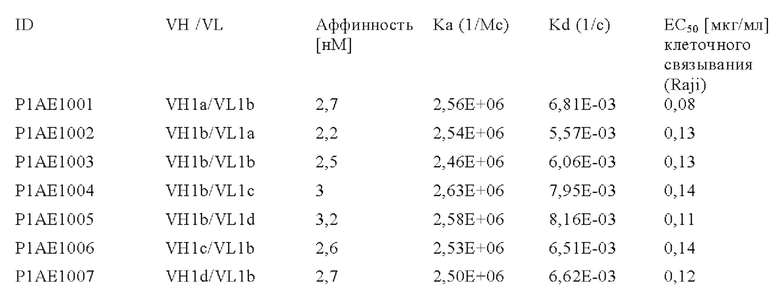
4.2.9 Характеризация антител с помощью масс-спектрометрии UHR-ESI-QTOF
Образцы обессоливали посредством ЖХВР на колонке Сефадекс G25 5×250 мм (фирма Amersham Biosciences, Фрейбург, Германия), используя 40% ацетонитрила с 2% муравьиной кислоты (об./об.) Общую массу определяли с помощью UHR-ESI-QTOF МС с использованием системы для МС maXis 4G UHR-QTOF (фирма Bruker Daltonik, Бремен, Германия), снабженной источником TriVersa NanoM (фирма Advion, Итака, шт. Нью-Йорк). Сбор данных осуществляли при 900-4000 m/z (ISCID: 0.0 eV). Необработанные масс-спектры оценивали и переводили в индивидуальные относительные молярные массы, используя разработанное на фирме-заявителе программное обеспечение.
4.2.10 Оценка термостабильности антител
Образцы приготавливали в концентрации 1 мг/мл в буфере, содержащем 20 мМ гистидин/хлорид гистидина, 140 мМ NaCl, pH 6,0, переносили в оптический 384-луночный планшет путем центрифугирования через 0,4-микрометровый фильтрующий планшет и покрывали парафиновым маслом. Повторно измеряли гидродинамический радиус с помощью динамического рассеяния света с использованием планшет-ридера DynaPro (фирма Wyatt) при нагревании образцов со скоростью 0,05°С/мин от 25°С до 80°С. Альтернативно этому, образцы переносили в устройство, включающее 10-микролитровую кювету, и получали данные о статическом рассеянии света, а также данные о флуоресценции при возбуждении лазером при длине волны 266 нм с помощью устройства Optim 1000 (фирма Avacta Inc.), при их нагревании со скоростью 0,1°С/мин от 25°С до 90°С. Температуру начала агрегации определяли как температуру, при которой гидродинамический радиус (DLS) или интенсивность рассеяния света (устройство Optim 1000) начинали увеличиваться. Температуру плавления определяли как точку перегиба на графике зависимости интенсивности флуоресценции от длины волны.
Пример 5
Создание и получение биспецифических конструкций с новыми гуманизированными вариантами антител с CD40
5.1 Создание биспецифических антигенсвязывающих молекул, таргетирующих CD40 и фибробласт-активирующий белок (FAP)
кДНК, кодирующие VH-домен и VL-домен, описанные в примере 4, клонировали в рамке считывания с соответствующими константными доменами тяжелых или легких цепей человеческого IgG1 в пригодных экспрессионных плазмидах. Экспрессия тяжелых и легких цепей находилась под контролем химерного промотора MPSV, состоящего из корового промотора MPSV и эехансерного элемента CMV. Кассета экспрессии содержала также синтетический поли(А)-сигнал на 3'-конце кДНК. Кроме того, плазмидные векторы несли сайт инициации репликации (EBV OriP) для поддержания плазмид в эписомах.
По аналогии с примером 1, различные биспецифические антитела к CD40-FAP получали в формате 4+1, и они состояли из четырех CD40-связывающих фрагментов, объединенных с одним FAP-связывающим фрагментом на С-конце Fc (фиг. 1А), или в форматах 2+1 и 2+2, в этом случае они состояли из двух CD40-связывающих фрагментов, объединенных либо с одним FAP-связывающим фрагментом на С-конце Fc (фиг. 1В и 1Д), либо с двумя FAP-связывающими фрагментам на С-конце Fc (фиг. 1Г). Кроме того, получали биспецифическое антитело, состоящее из одного CD40-связывающего фрагмента, объединенного с одним FAP-связывающим фрагментом (фиг. 1Е). Создание и получение FAP-связывающих агентов 28Н1 и 4В9 описано в WO 2012/020006 А2, которая включена в настоящее описание в качестве ссылки. Для создания молекул в формате 4+1 и 2+1 применяли технологию «knob-into-hole» для достижения гетеродимеризации. Мутации S354C/T366W интродуцировали в первую тяжелую цепь HCl (тяжелая цепь с Fc с «выступом») и мутации Y349C/T366S/L368A/Y407V интродуцировали во вторую тяжелую цепь НС2 (тяжелая цепь с Fc с «впадиной»). В молекуле в формате 2+2 технология CrossMab, описанная в WO 2010/145792 A1, гарантировала правильное спаривание легких цепей. Вне зависимости от биспецифического формата, во всех случаях применяли Fc с «молчащей» эффекторной функцией (P329G; L234, 234А) для аннулирования связывания с Fcγ- рецепторами согласно методу, описанному в WO 2012/130831 А1. Последовательности биспецифических молекул представлены в таблице 27.
Все гены кратковременно экспрессировали под контролем химерного промотора MPSV, состоящего из корового промотора MPSV и энхансерного фрагмента промотора CMV. Экспрессионный вектор содержал также OriP-область для эписомальной репликации в содержащих EBNA (ядерный антиген вируса Эпштейна-Барра) клетках-хозяевах.
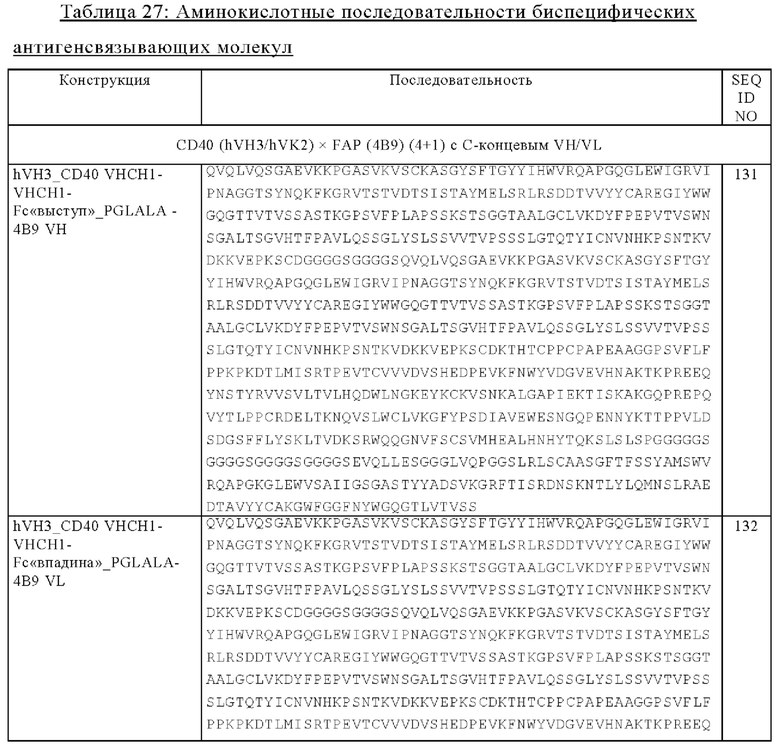
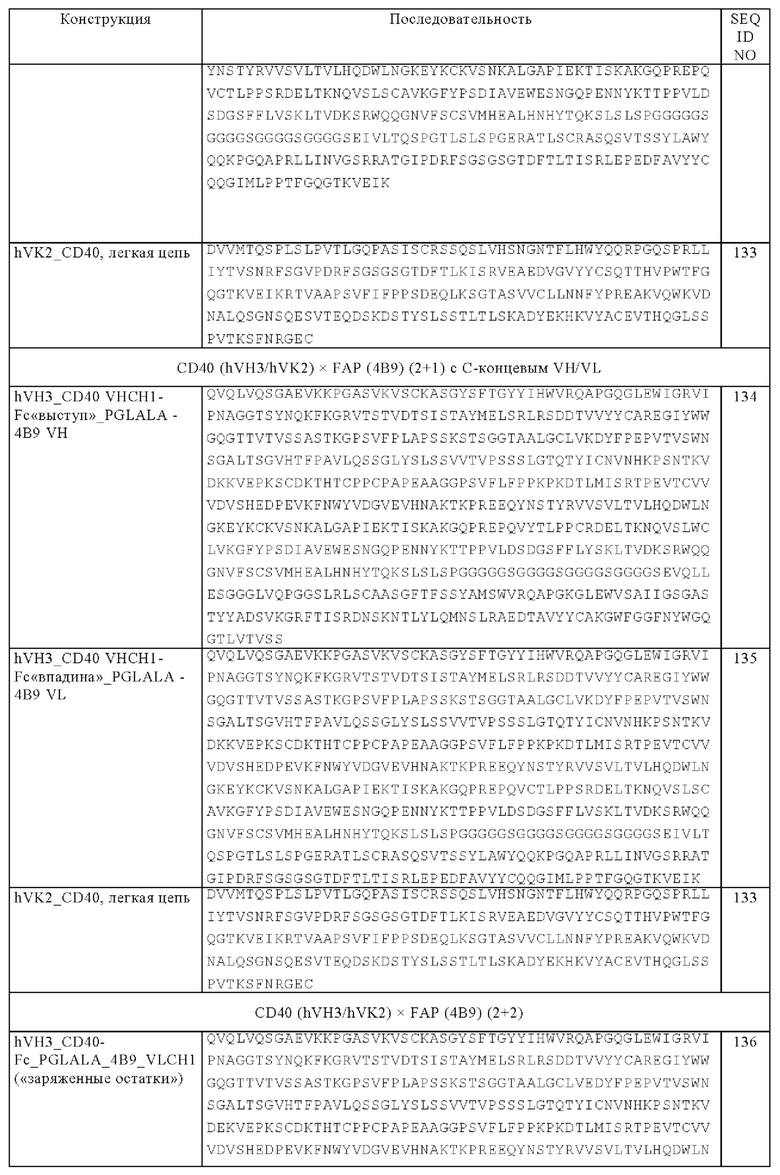
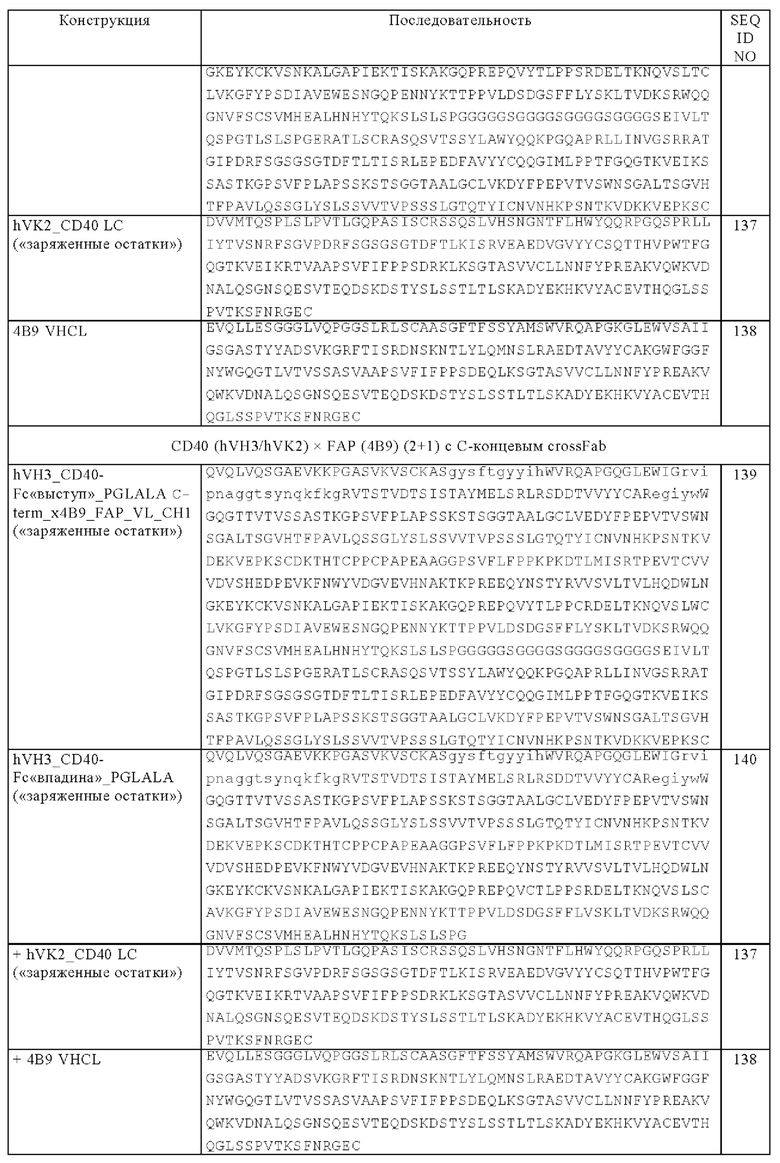
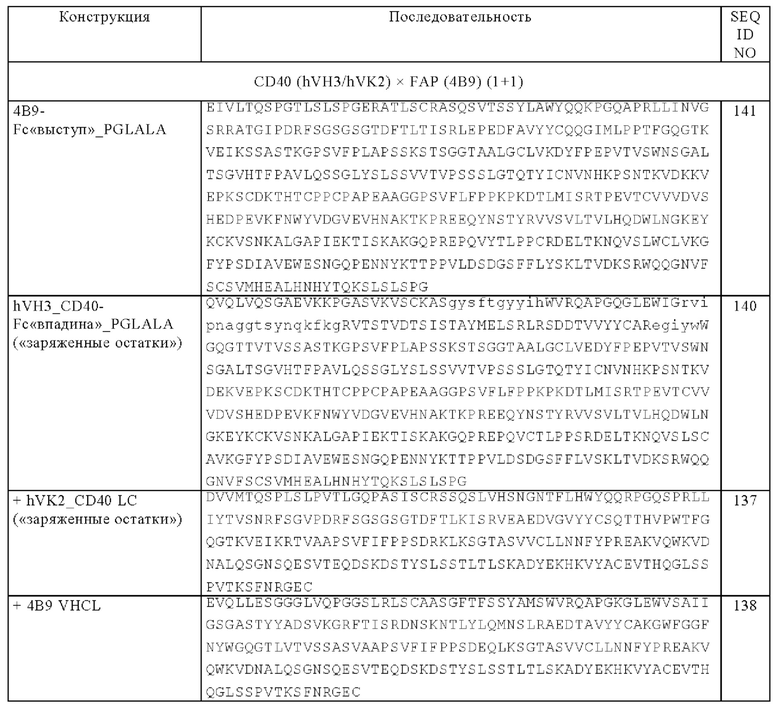
Дополнительные биспецифические антитела получали с использованием новых гуманизированных вариантов антител к CD40, описанных в примере 4.2. Конкретные последовательности указанных биспецифических антител представлены ниже в таблице 28. В частности, различные биспецифические антитела к CD40-FAP получали в формате 4+1, и они состояли из четырех CD40-связывающих фрагментов, объединенных с одним FAP-связывающим фрагментом в виде кроссовер-Fab-фрагмента, слитого с С-концом Fc-цепи с «выступом» (фиг. 15Е и 15Ж), или в формате 2+1, и они состояли из двух CD40-связывающих фрагментов, объединенных либо с одним FAP-связывающим фрагментом в виде кроссовер-Fab-фрагмента, в котором VL-CH1-цепи слита с С-концом Fc-цепи с «выступом» (фиг. 15З), либо с одним FAP-связывающим фрагментом в виде кроссовер-Fab-фрагмента, в котором VH-CL-цепь слита на С-конце Fc-цепи с «выступом» (фиг. 15И).
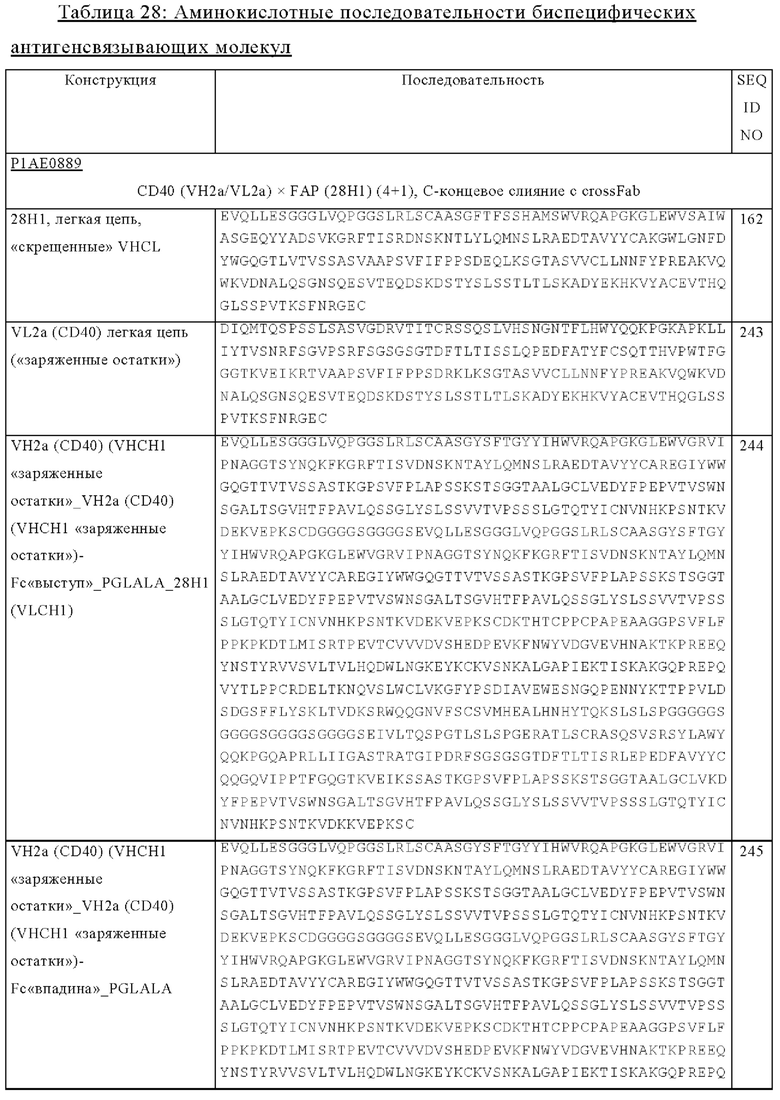
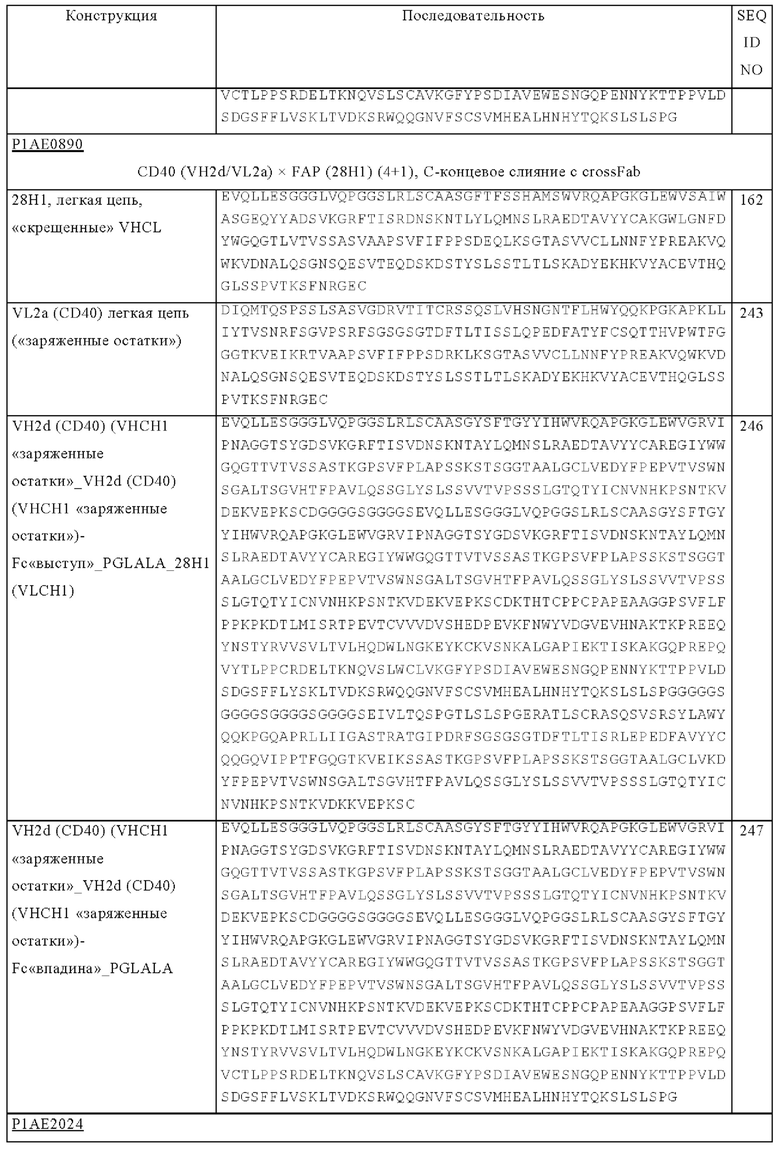
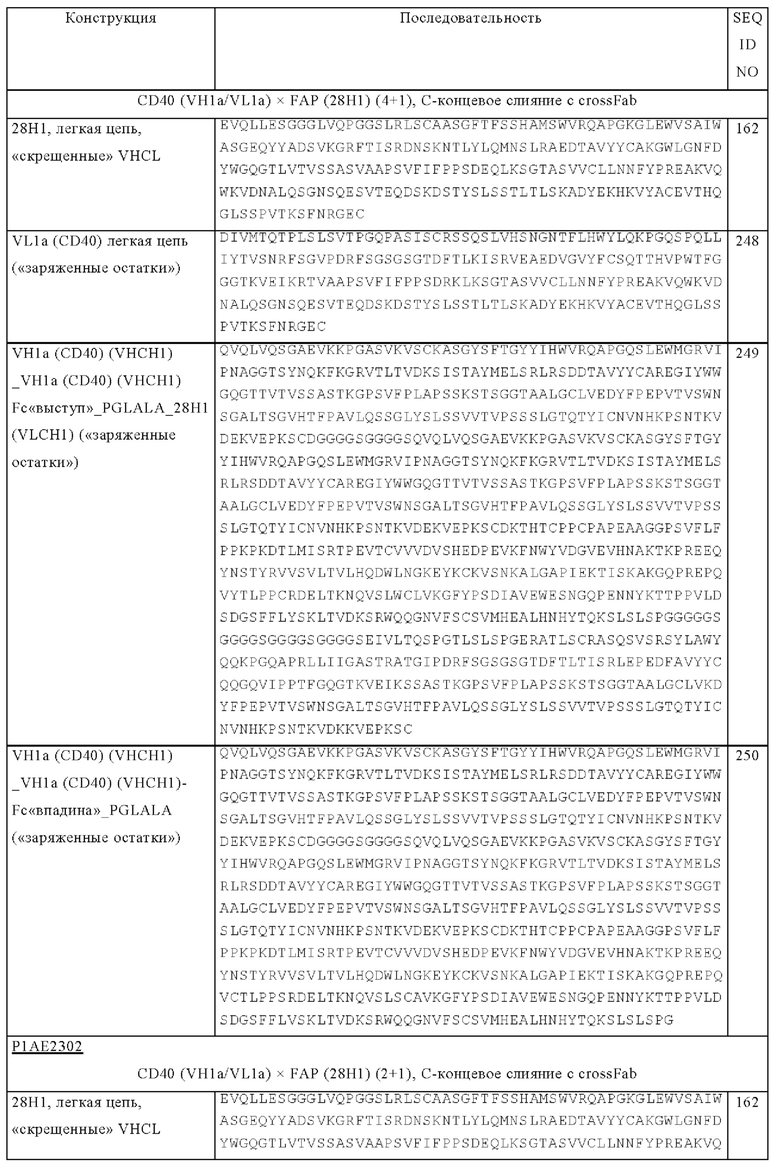
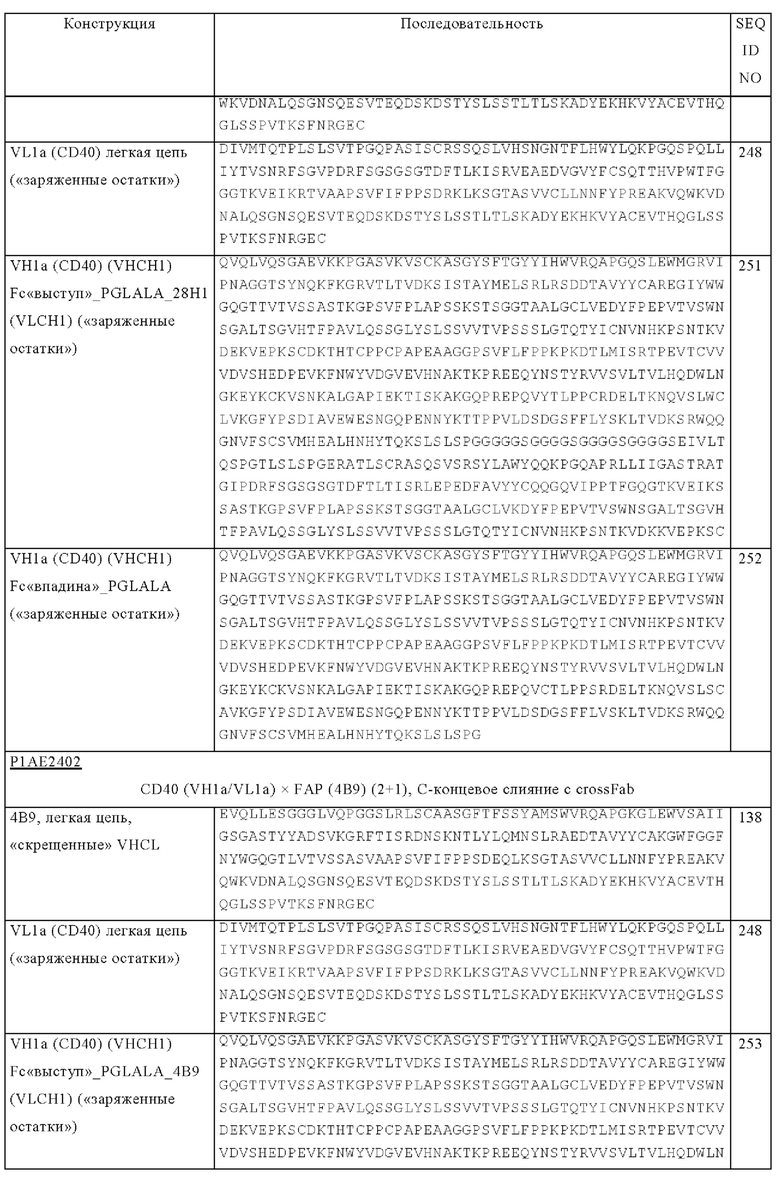
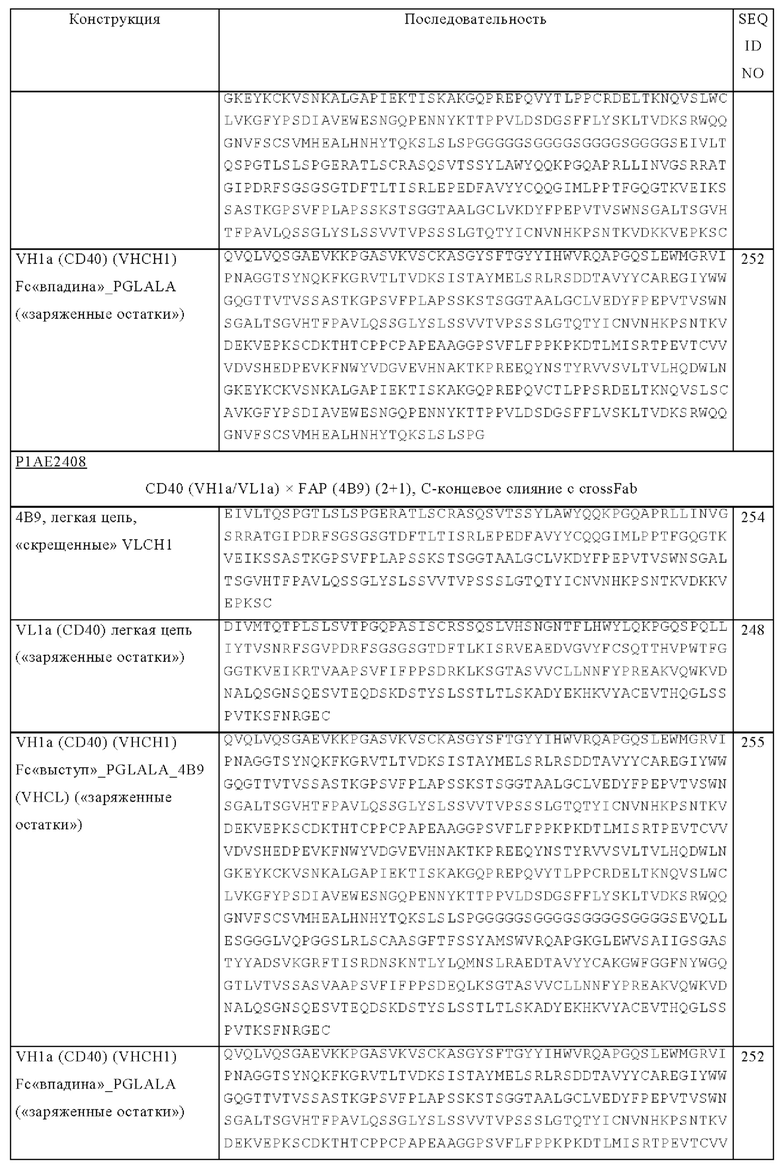
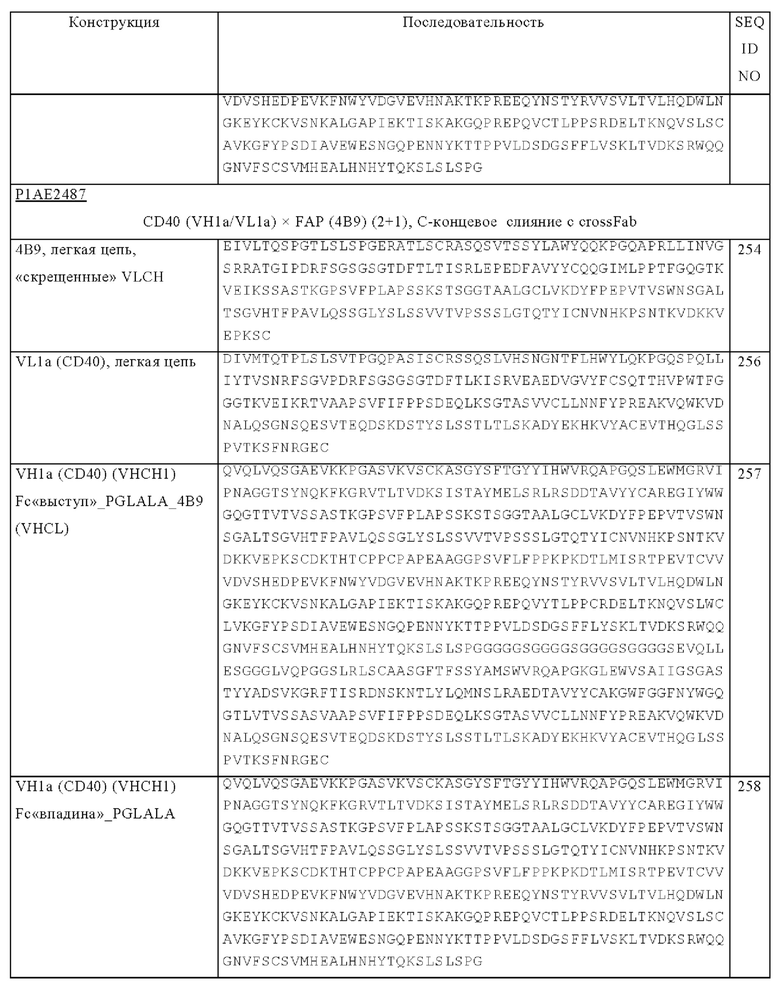
5.2 Получение биспецифических антигенсвязывающих молекул, таргетирующих CD40 и фибробласт-активирующий белок (ТАР)
Биспецифические антигенсвязывающие молекулы, таргетирующие CD40 и фибробласт-активирующий белок (FAP); экспрессировали путем кратковременной трансфекции растущих в суспензии клеток HEK293-F экспрессионными векторами, кодирующими 4 различные пептидные цепи. Трансфекцию клеток HEK293-F (фирма Invitrogen) осуществляли согласно инструкциям поставщика клеток с использованием препаратов векторов антител Maxiprep (фирма Qiagen, Германия), среды на основе F17 (фирма Invitrogen, США), Peipro (фирма Polyscience Europe GmbH) и начальной клеточной плотности 1-2 млн жизнеспособных клеток/мл бессывороточной среды для экспрессии FreeStyle 293 (фирма Invitrogen). Супернатанты клеточных культур собирали после 7 дней культивирования во встряхиваемых колбах или ферментерах с перемешивающими устройствами путем центрифугирования при 14000 g в течение 30 мин и фильтровали через 0,22-микрометровый фильтр.
Биспецифические антитела очищали из супернатантов клеточных культур с помощью аффинной хроматографии, используя MabSelectSure-Sepharose™ (фирма GE Healthcare, Швеция). В целом, метод состоял в следующем: стерильные профильтрованные супернатанты клеточных культур осаждали на смолу MabSelect SuRe, уравновешенную ЗФР-буфером (10 мМ Na2HPO4, 1 мМ KH2PO4, 137 мМ NaCl и 2,7 мМ KCl, рН 7,4), промывали буфером для уравновешивания и элюировали 25 мМ цитратным буфером, рН 3,0. После нейтрализации с помощью 1М Трис, рН 9,0 агрегированный белок отделяли от мономерных образцов антител с помощью гель-фильтрации (Супердекс 200, фирма GE Healthcare) в буфере, содержащем 20 мМ гистидин, 140 мМ NaCl, рН 6,0. Фракции мономерных белков объединяли, при необходимости концентрировали, используя, например, центрифужный концентратор MILLIPORE Amicon Ultra (30 кДа MWCO), и хранили при температуре -80°С. Аликвоты образцов использовали для последующего анализа и аналитической характеризации белков, например, с помощью КЭ-ДСН, гель-фильтрации, масс-спектрометрии и определения эндотоксинов.

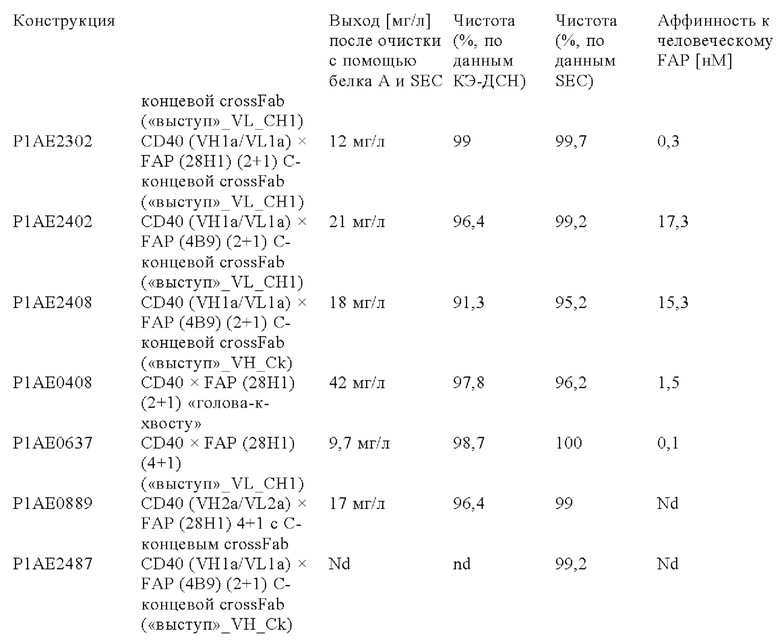
5.3 Характеризация биспецифических антител, содержащих гуманизированные варианты антител к CD40 и FAP
5.3.1 Связывание с экспрессирующими человеческий или мышиный FAP клетками мышиных фибробластов
Связывание с находящимся на клеточной поверхности FAP тестировали с использованием экспрессирующих человеческий фибробласт-активирующий белок (huFAP) клеток NIH/3T3-huFAP клона 19, или клеток, экспрессирующих мышиный фибробласт-активирующий белок (mFAP) NIH/3T3-mFAP клона 26, оценивали с помощью метода, описанного в примере 1.4.1. Величины ЕС50, определенные для некоторых из биспецифических антигенсвязывающих молекул, которые содержали гуманизированные варианты антител к CD40, представлены в таблице 7.
5.3.2 Связывание с FAP (оценка методом поверхностного плазмонного резонанса)
Способность биспецифических конструкций связываться с человеческим FAP оценивали с помощью поверхностного плазменного резонанса (SPR). Все эксперименты на основе SPR осуществляли с помощью устройства Biacore T200 при 25°C с использованием HBS-EP в качестве подвижного буфера (0.01 М HEPES, рН 7,4, 0.15 М NaCl, 3 мМ ЭДТА, 0,005% сурфактанта Р20 (фирма Biacore).
Меченный His человеческий димерный FAP (рекомбинантный FAP_ECD) захватывали на СМ5-чипе (фирма GE Healthcare) иммобилизованным антителом к His (фирма Qiagen, каталожный №34660) путем инъекции 500 нМ huFAP в течение 60 с при скорости потока 10 мкл/мин, 10 нМ мышиного FAP в течение 20 с при скорости потока 20 мкл/мин и 10 нМ cynoFAP в течение 20 с при скорости потока 20 мкл/мин. Использовали уровни иммобилизации для антитела к His, составляющие вплоть до 18000 резонансных единиц (RU). После стадии захвата биспецифические антитела, а также применяемые в качестве контроля молекулы немедленно пропускали по поверхности чипа в концентрациях, составляющих от 0,78 до 100 нМ, со скоростью потока 30 мкл/мин в течение 280 с, при этом фаза диссоциации составляла 180 с. Различия всех показателей преломления корректировали путем вычитания ответа, полученного в проточной референс-ячейке, в которой не иммобилизовывали FAP. Авидность определяли с использованием аппроксимации кривой связывания 1:1 Ленгмюра. Для двухвалентного связывания использовали такую же аппроксимацию с использованием модели связывания 1:1, получая кажущуюся величину KD.

5.3.3 Связывание с CD40 (поверхностный плазмонный резонанс)
Способность биспецифических конструкций связываться с человеческим CD40 оценивали с помощью поверхностного плазмонного резонанса (SPR). Все эксперименты на основе SPR осуществляли с помощью устройства Biacore T200 при 25°C с использованием HBS-EP в качестве подвижного буфера (0,01 М HEPES, рН 7,4, 0.15 М NaCl, 3 мМ ЭДТА, 0,005% сурфактанта Р20 (фирма Biacore).
Аналогично методу, описанному в примере 4.2.7, ассоциацию измеряли путем инъекции внеклеточного домена человеческого CD40 в различных концентрациях в растворе в течение 300 с при скорости потока 30 мкл/мин, начиная с 300 нМ с последующими разведениями 1:3. Мониторинг фазы диссоциации осуществляли в течение вплоть до 1200 с и запускали путем замены раствора для образца на подвижный буфер. Поверхность регенерировали путем промывки в течение 60 с раствором глицина, рН 2,1 при скорости потока 30 мкл/мин. Различия всех показателей преломления корректировали путем вычитания ответа, полученного на поверхности с козьим античеловеческим F(ab')2. Вычитали также результаты, полученные с использованием «пустых» инъекций (= двойной контроль). Для расчета кажущейся величины KD и других кинетических параметров использовали модель связывания 1:1 Ленгмюра. Кажущуюся величину KD рассчитывали с помощью программного обеспечения Biacore™ B4000 evaluation (версия 1.1).

5.3.4 Связывание с экспрессирующими человеческий CD40 клетками Дауди
Связывание с находящимся на клеточной поверхности CD40 тестировали с использованием клеток Дауди, человеческой В-лимфобластной клеточной линии с высокими уровнями экспрессии человеческого CD40 (АТСС CCL-213), согласно методу, описанному в примере 1.4.2. Приведенные в качестве примера величины ЕС50, определенные для некоторых из биспецифических антигенсвязывающих молекул, которые содержали гуманизированные варианты антител к CD40, представлены в таблице 8.
5.3.5 Функциональные свойства биспецифических антигенсвязывающих молекул, содержащих гуманизированные варианты антител к CD40
Функциональные свойства биспецифических антигенсвязывающих молекул, содержащих гуманизированные варианты антител к CD40, анализировали в соответствии с экспериментами, которые описаны в примере 2. Приведенные в качестве примера данные представлены выше в настоящем описании таблицах 9, 10 или 11.
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СОДЕРЖАЩИЕ АНТИ-FAP КЛОН 212 | 2019 |
|
RU2799429C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| АНТИТЕЛА ПРОТИВ CD40 И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2796413C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ КОСТИМУЛЯТОРНОГО TNF-РЕЦЕПТОРА | 2016 |
|
RU2761115C1 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С GPRC5D | 2020 |
|
RU2841523C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С HLA-A2/WT1 | 2018 |
|
RU2815176C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2012 |
|
RU2650775C2 |
| БИСПЕЦИФИЧЕСКИЕ 2+1 КОНТОРСТЕЛА | 2018 |
|
RU2797305C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С CD3 | 2019 |
|
RU2810924C2 |













































































































































































































































































































































































































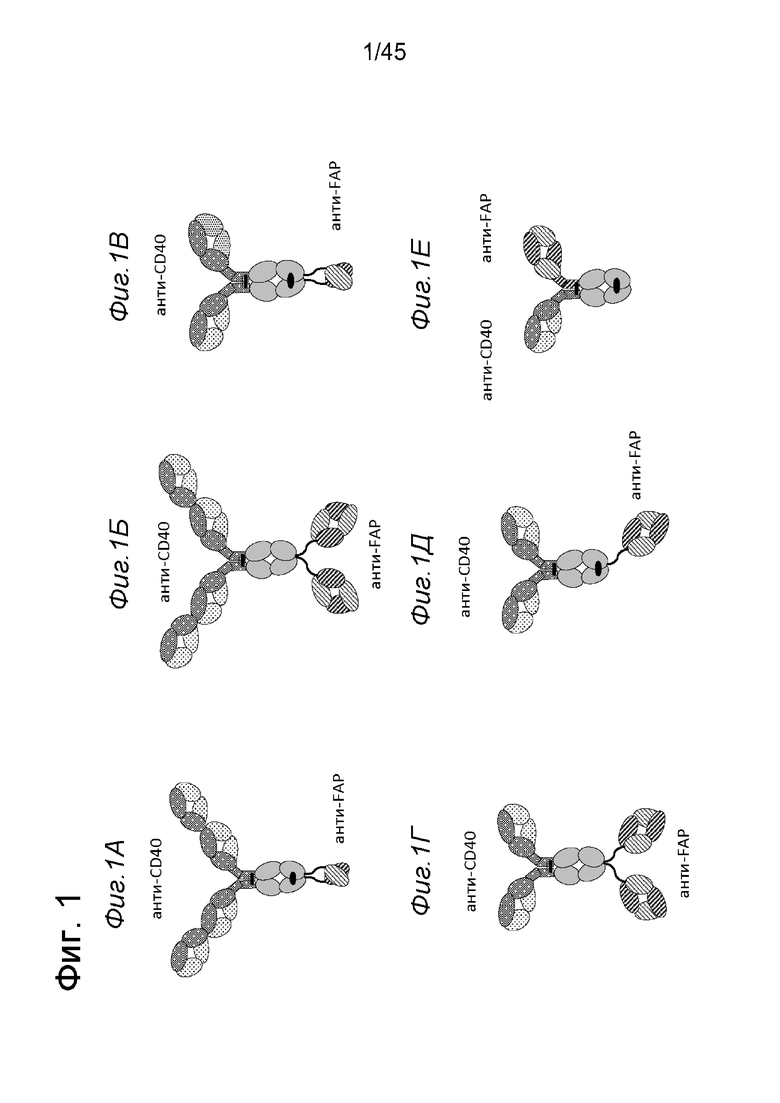

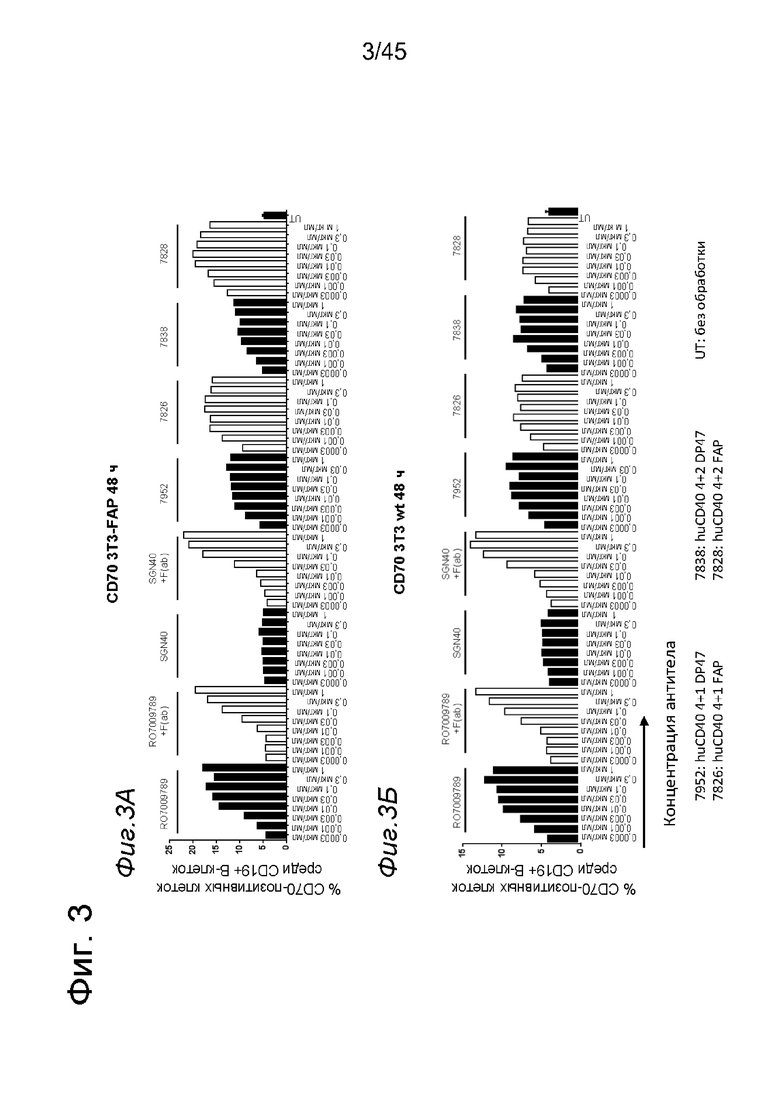
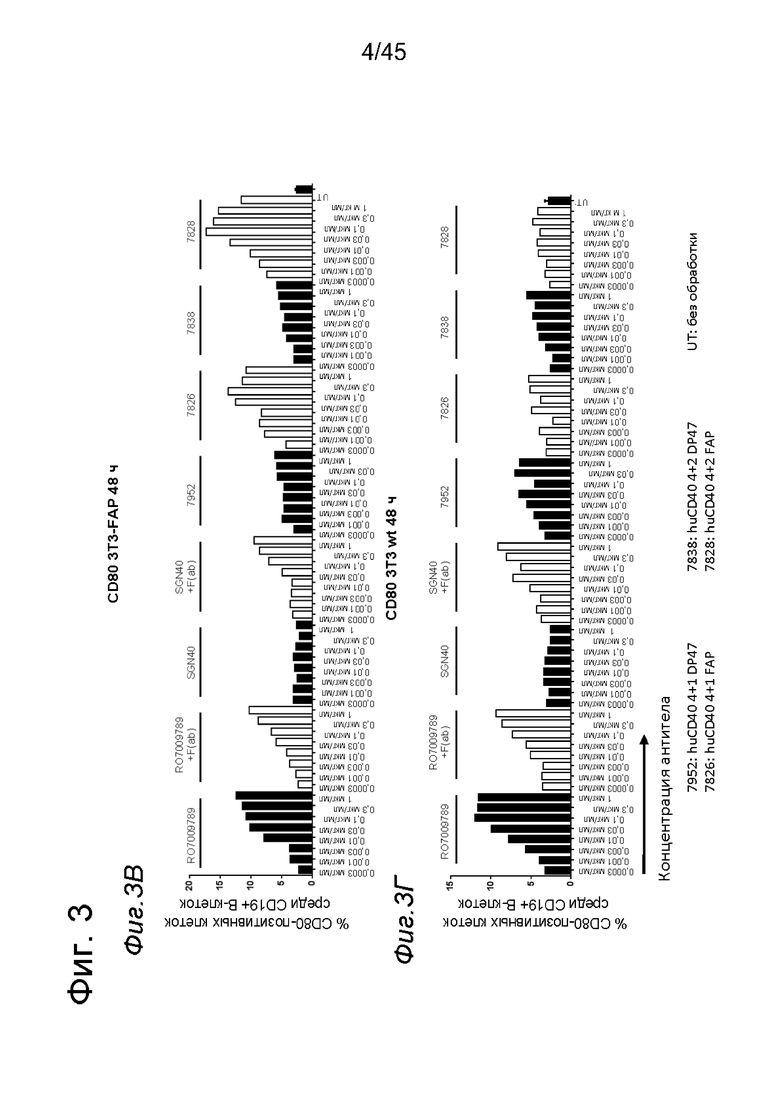

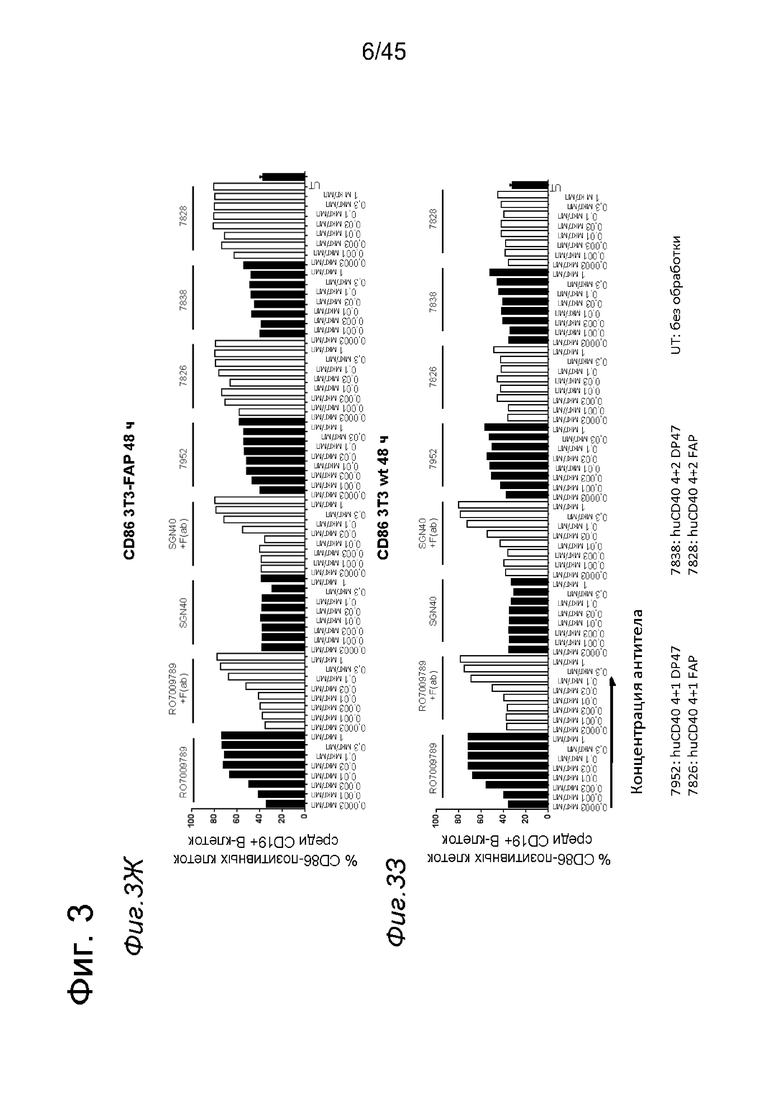
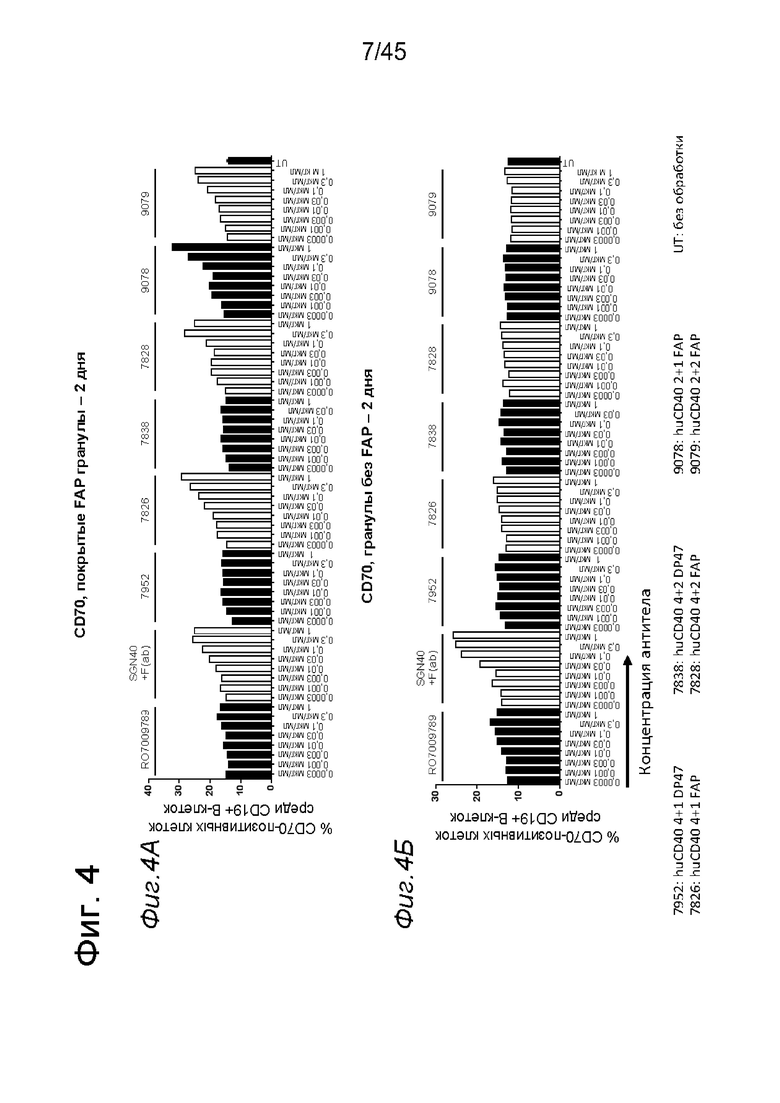
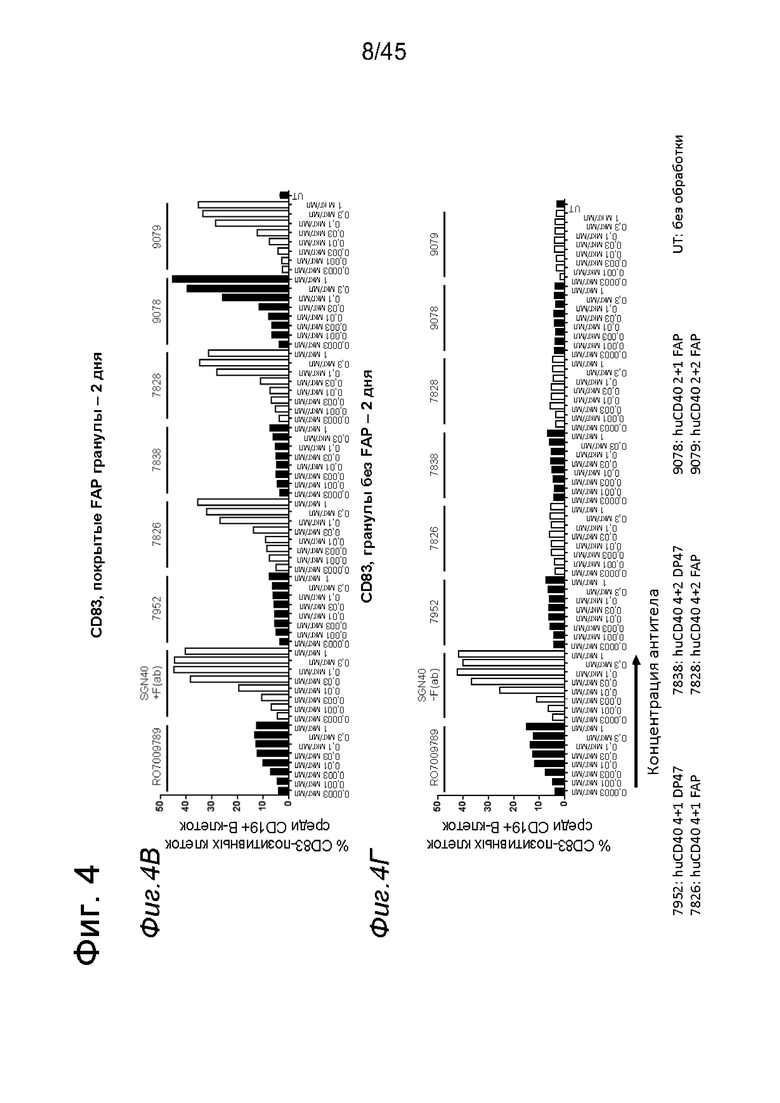
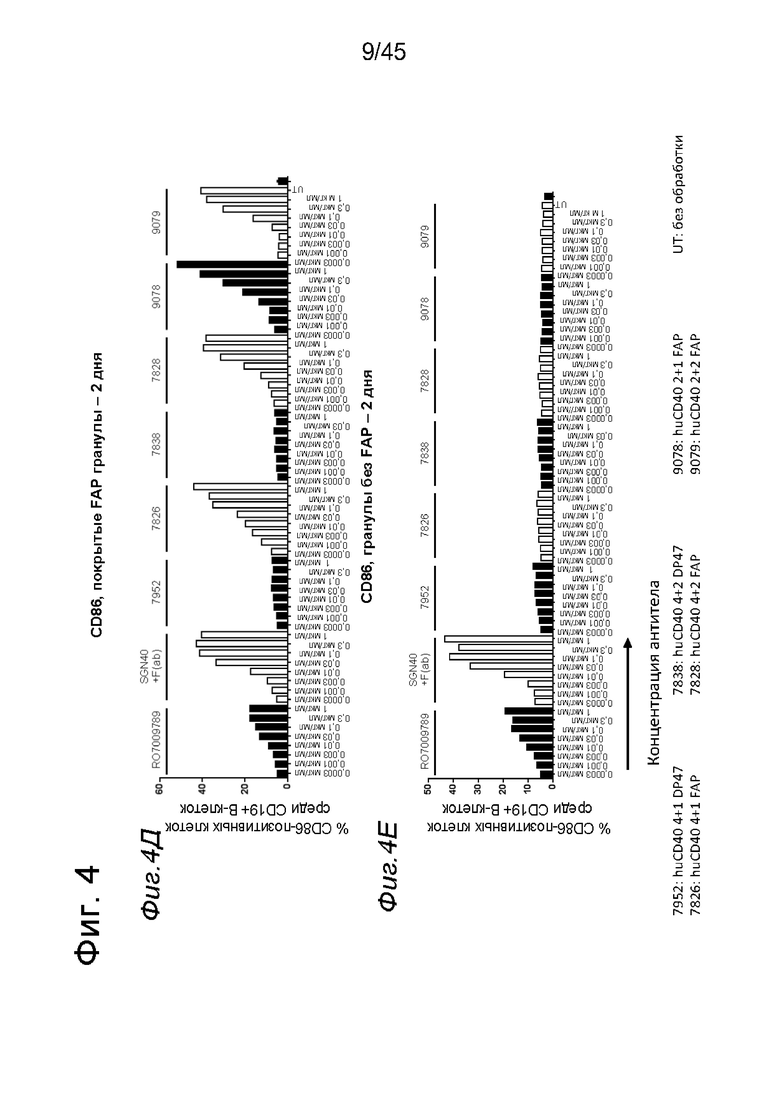

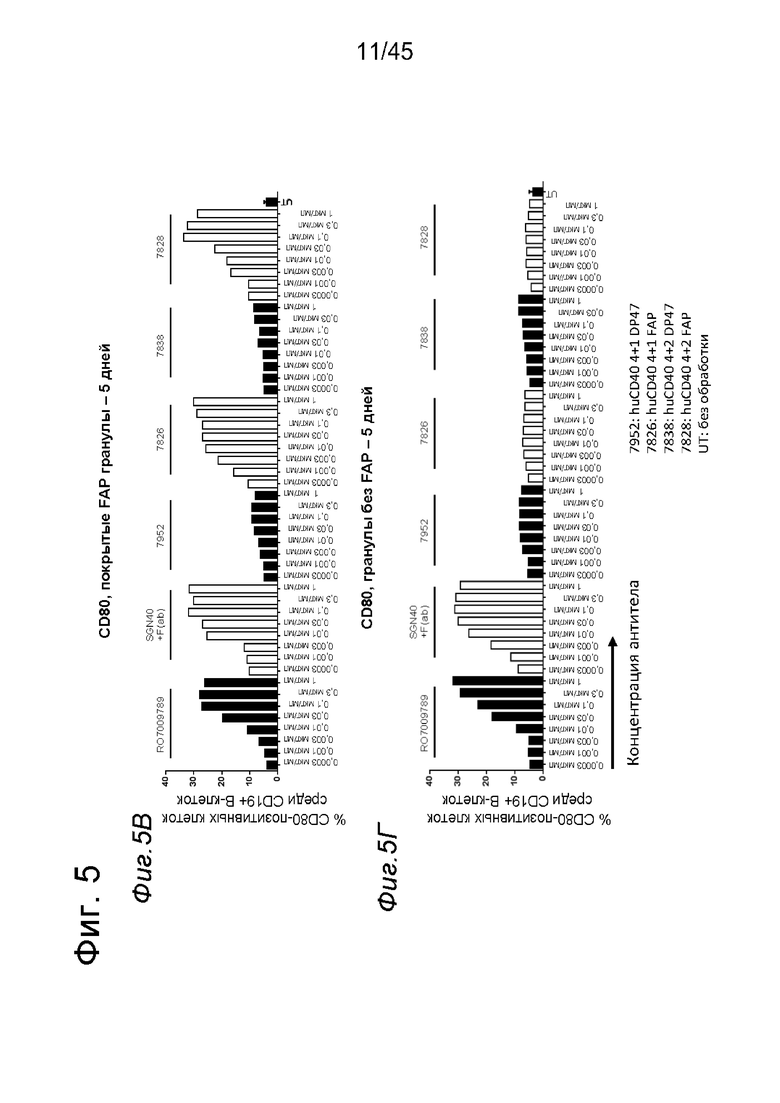
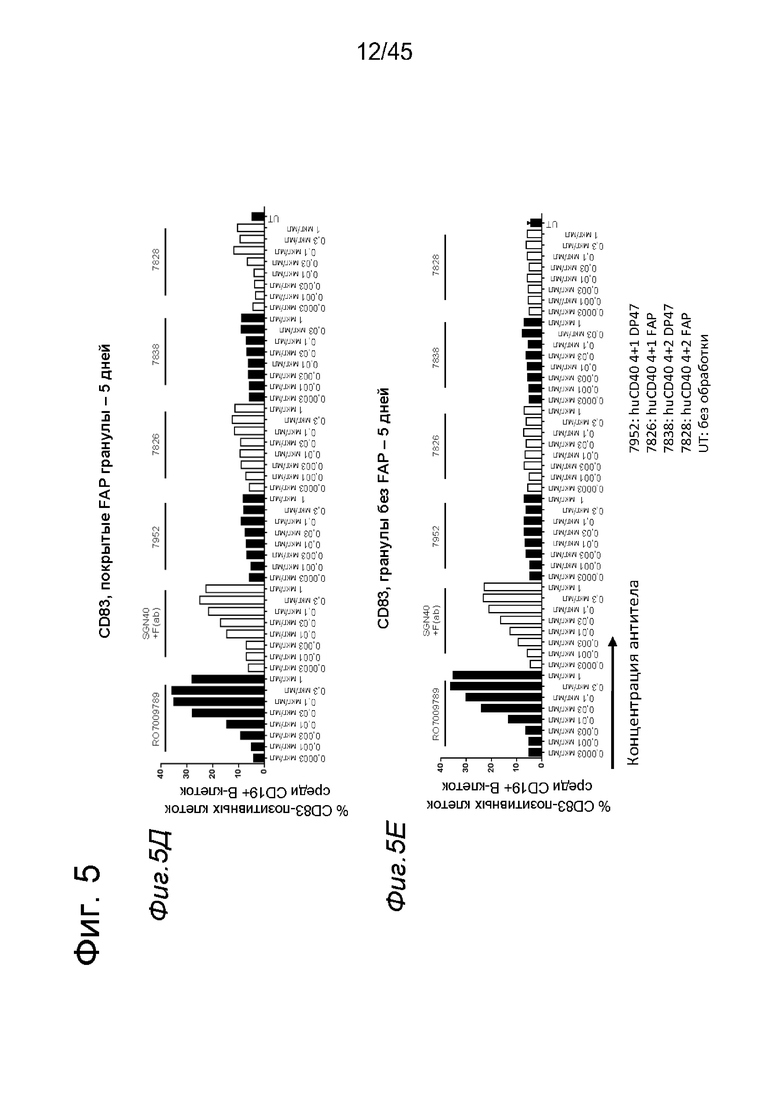
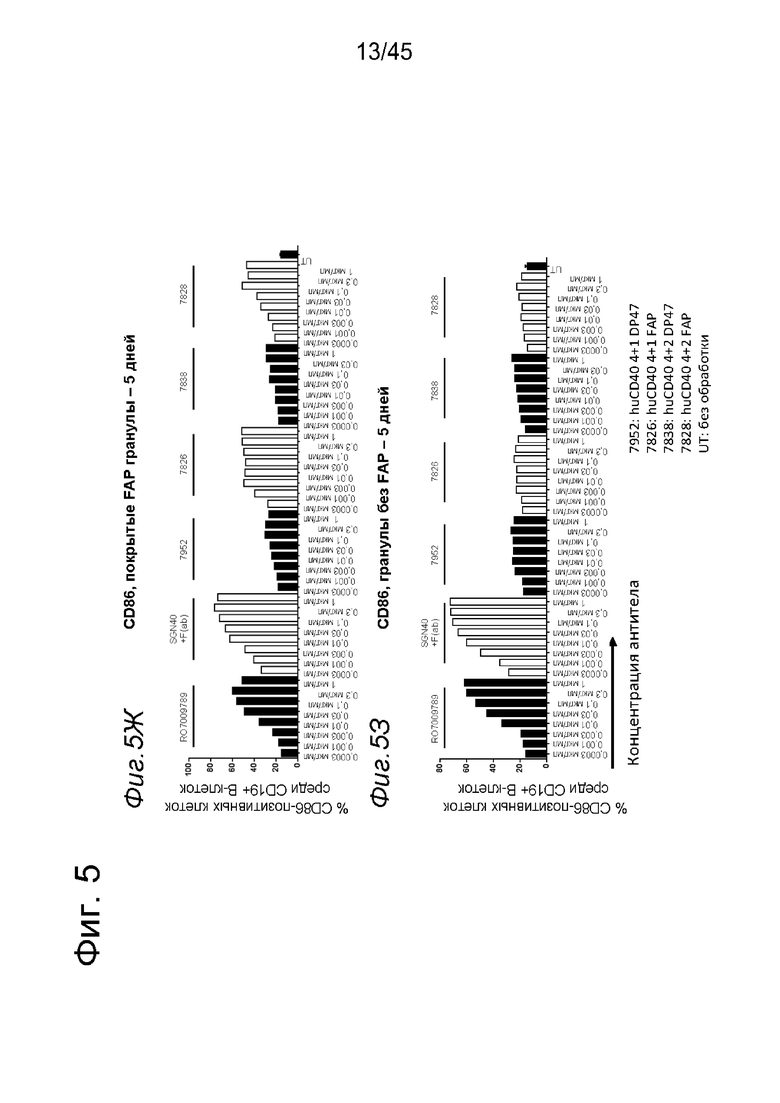
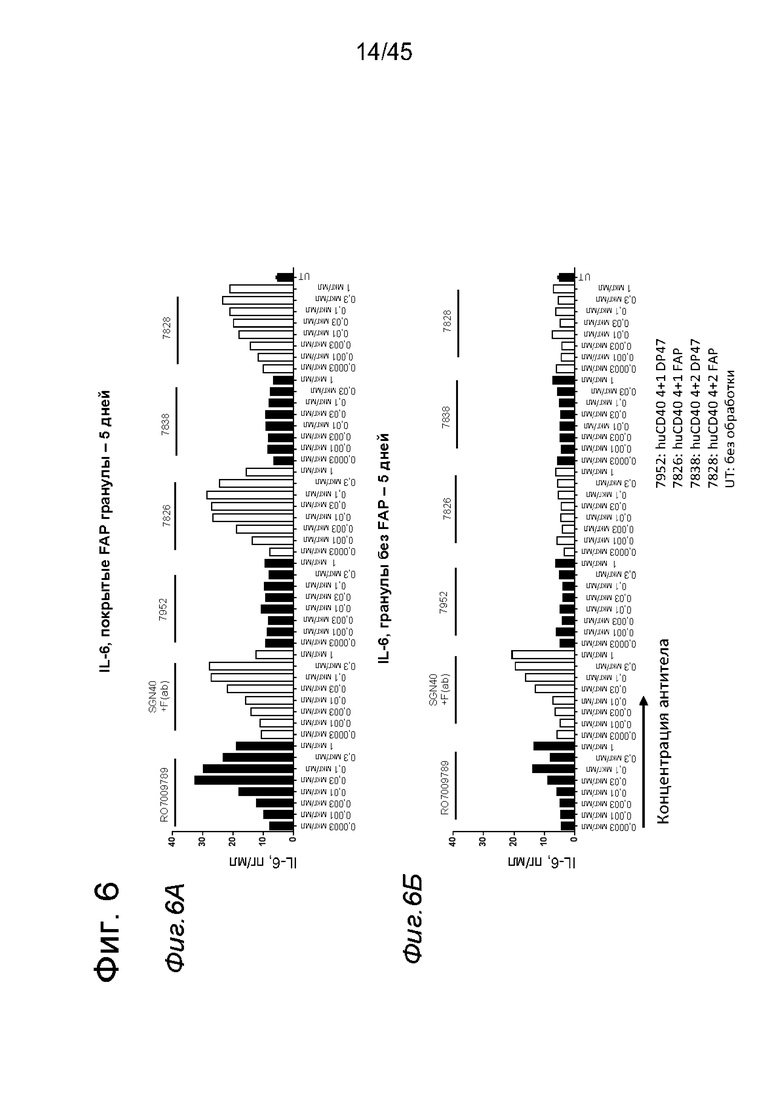


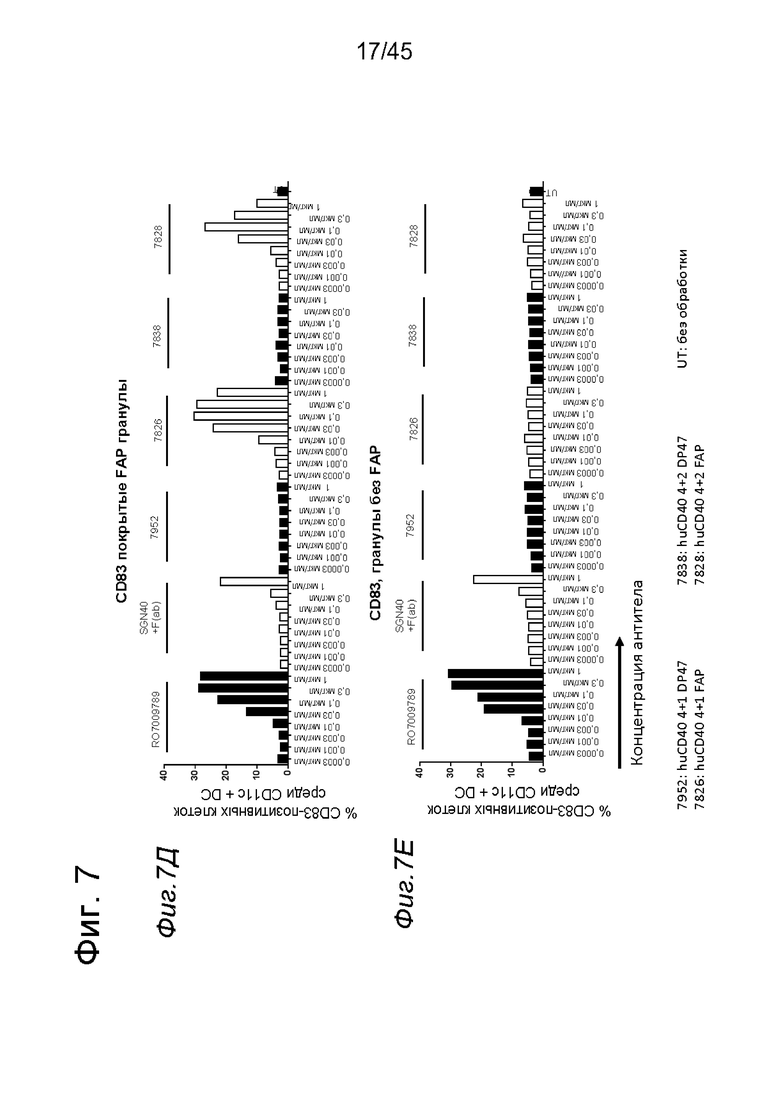
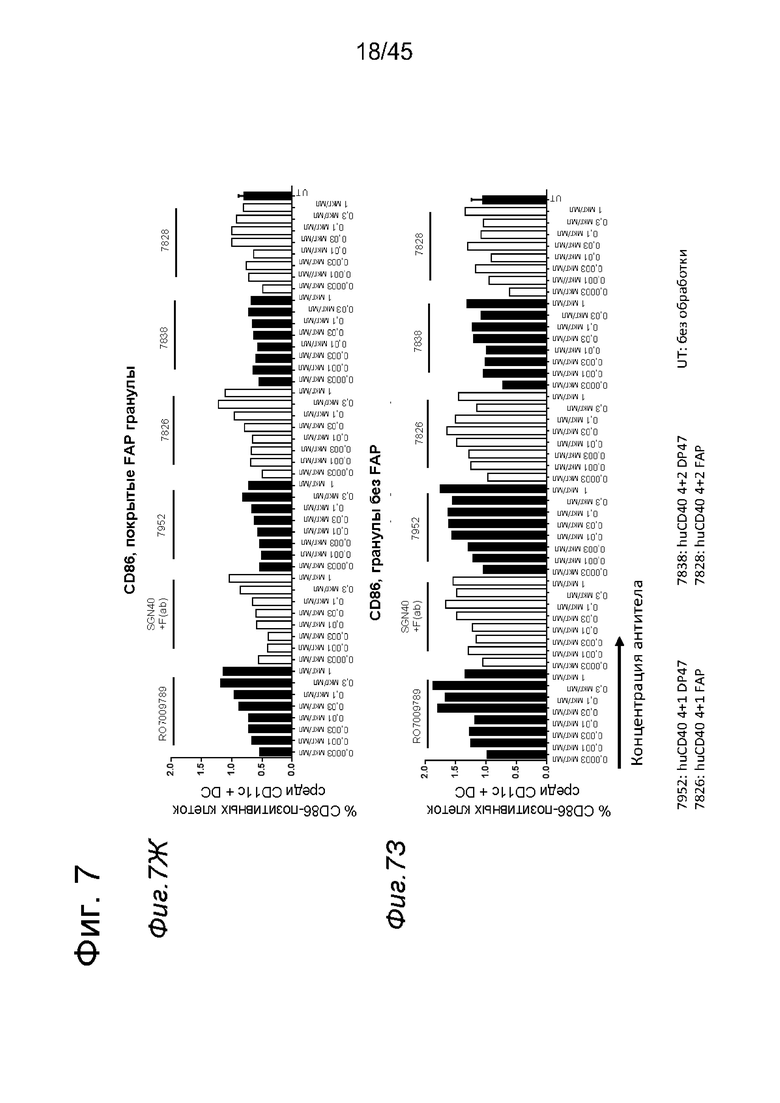
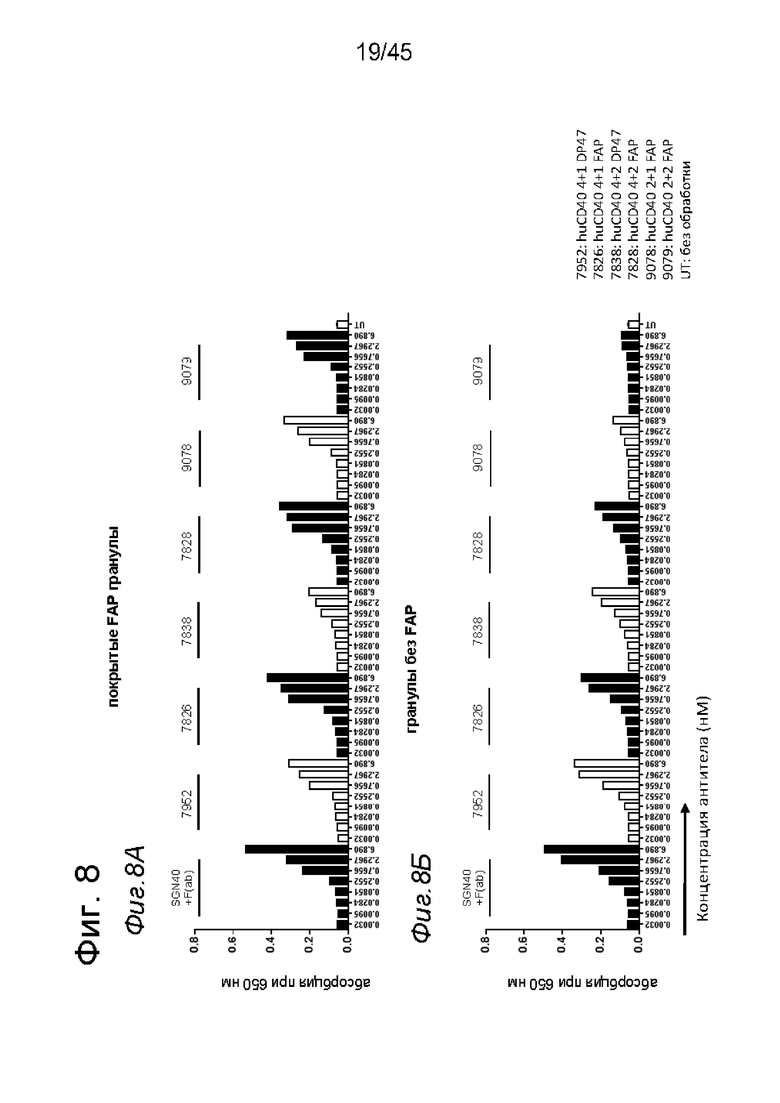
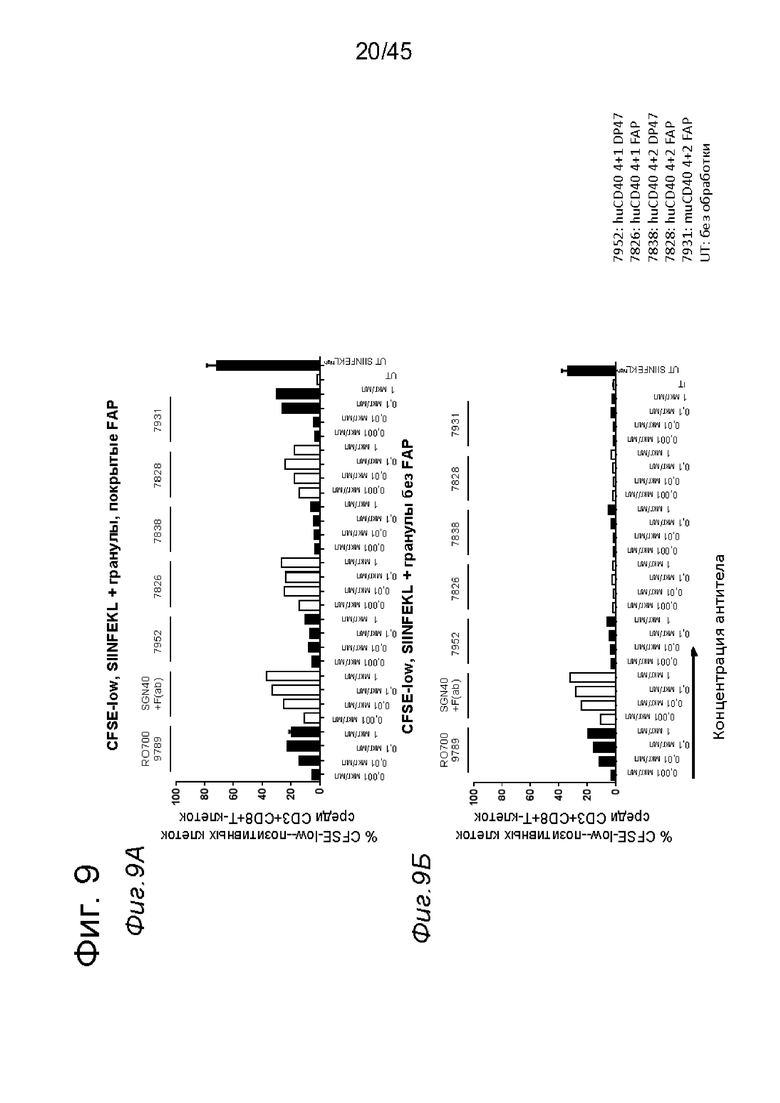

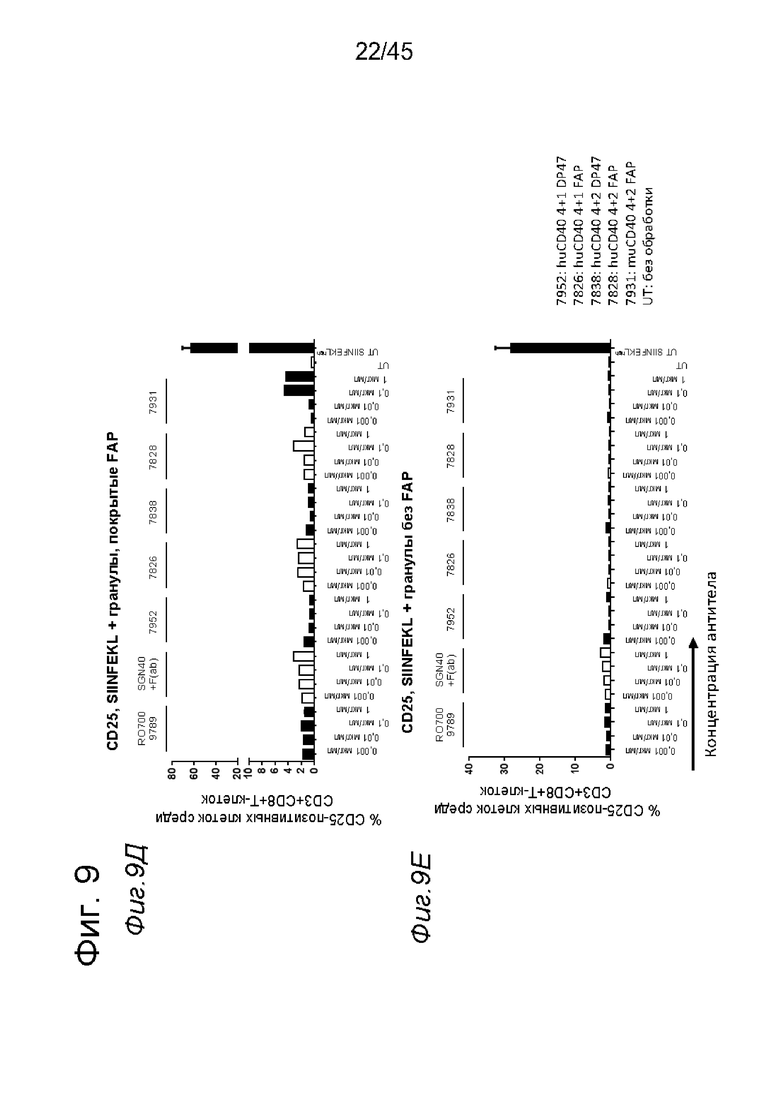
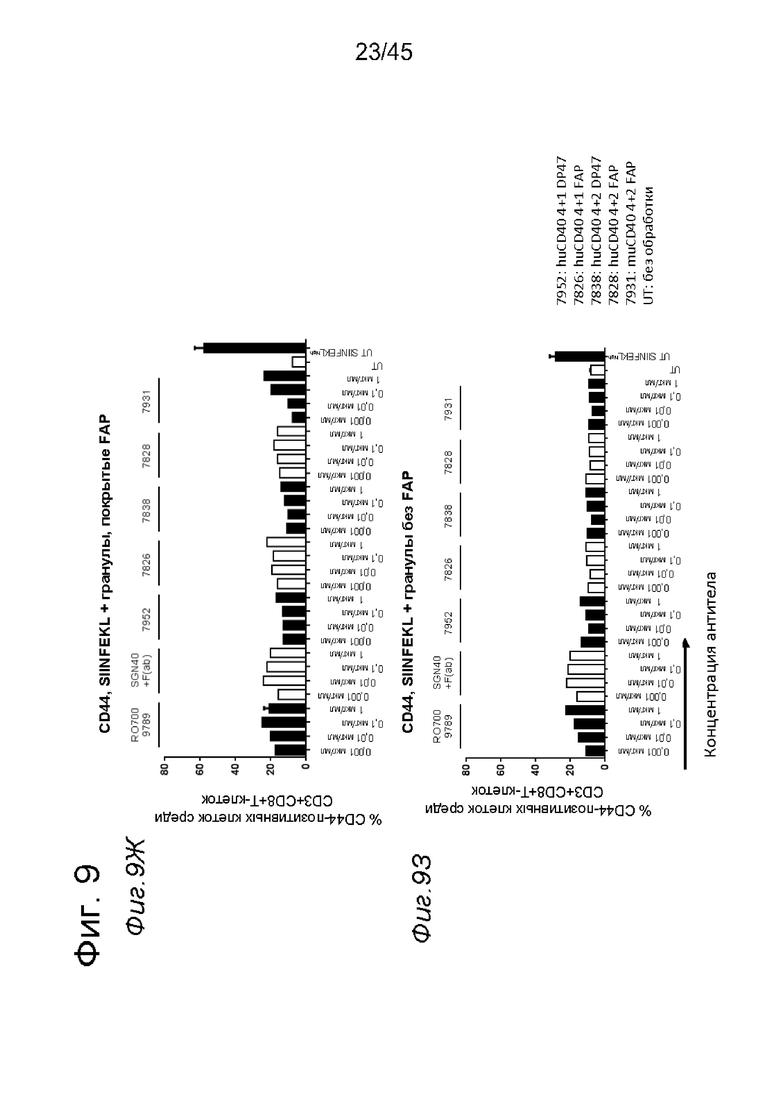
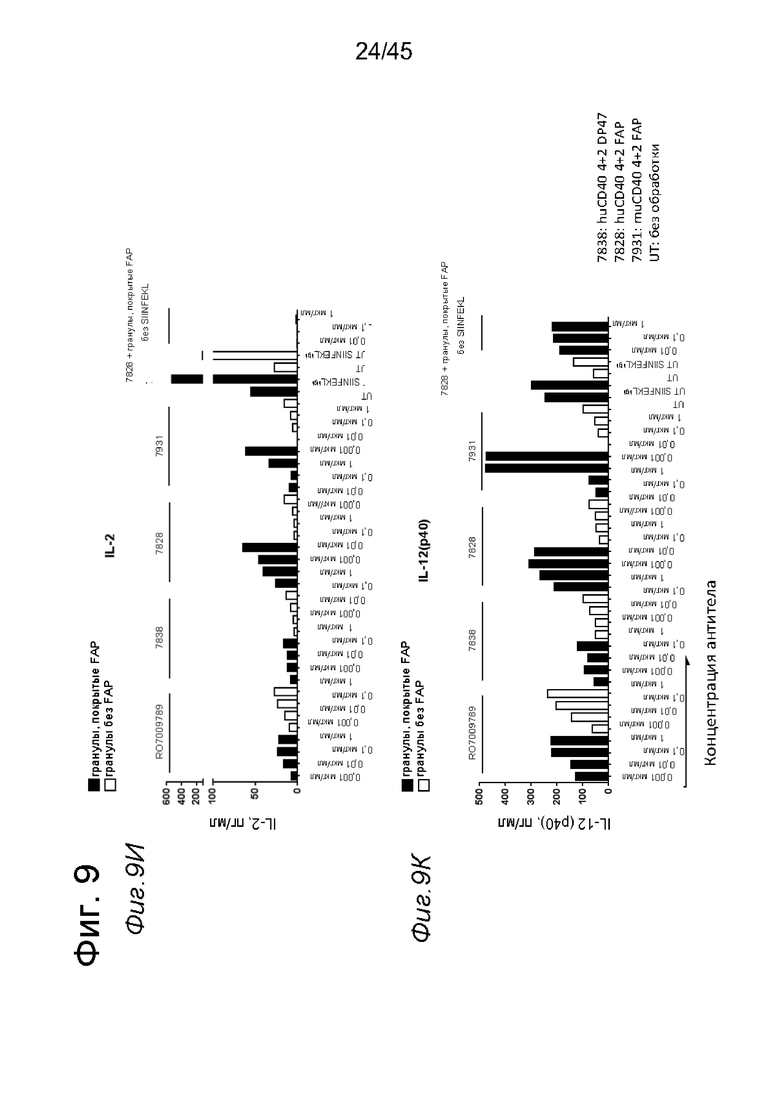
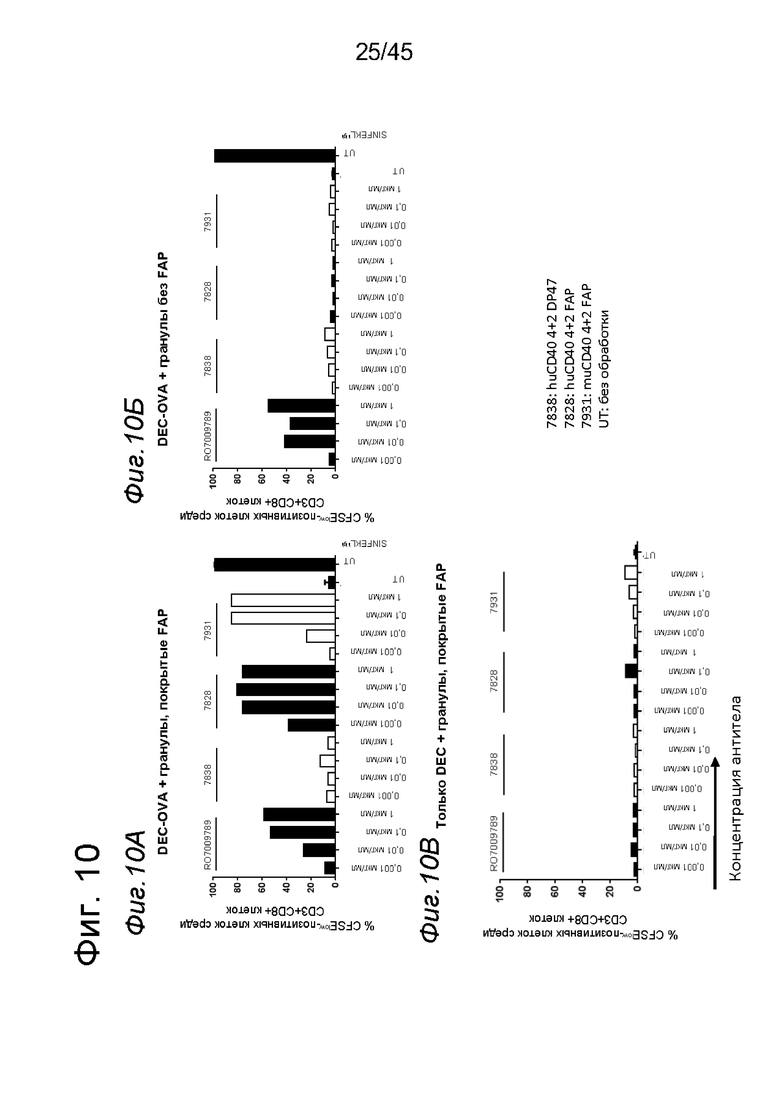

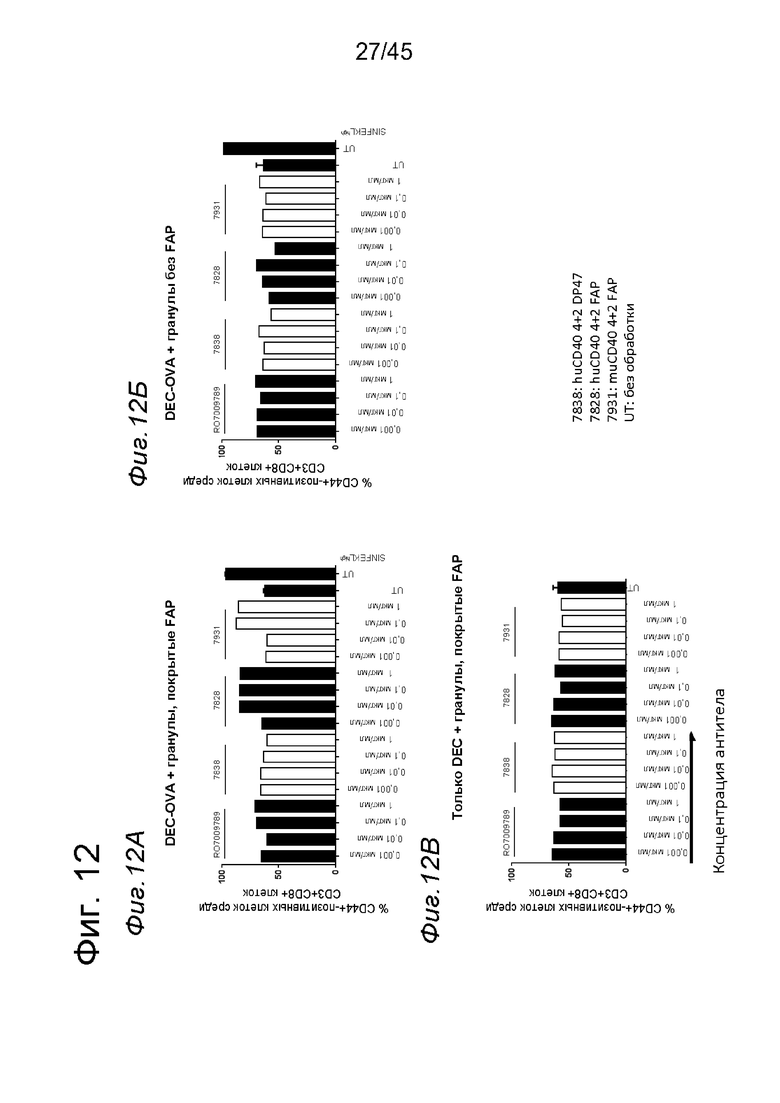

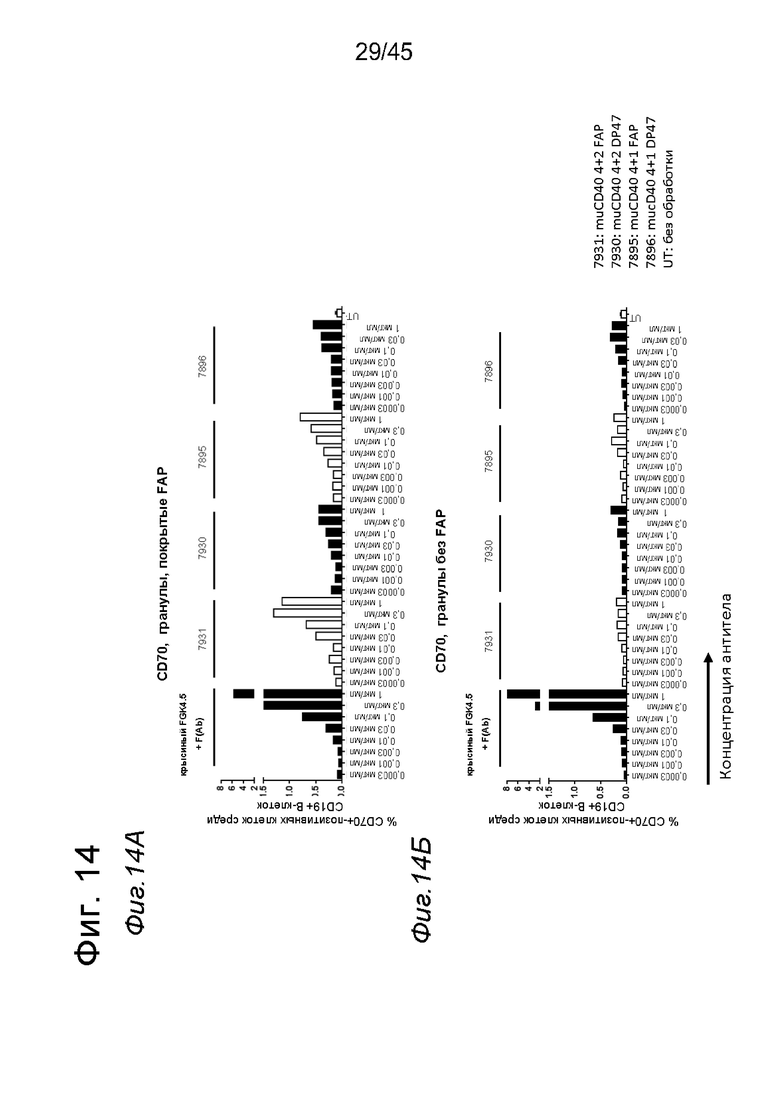

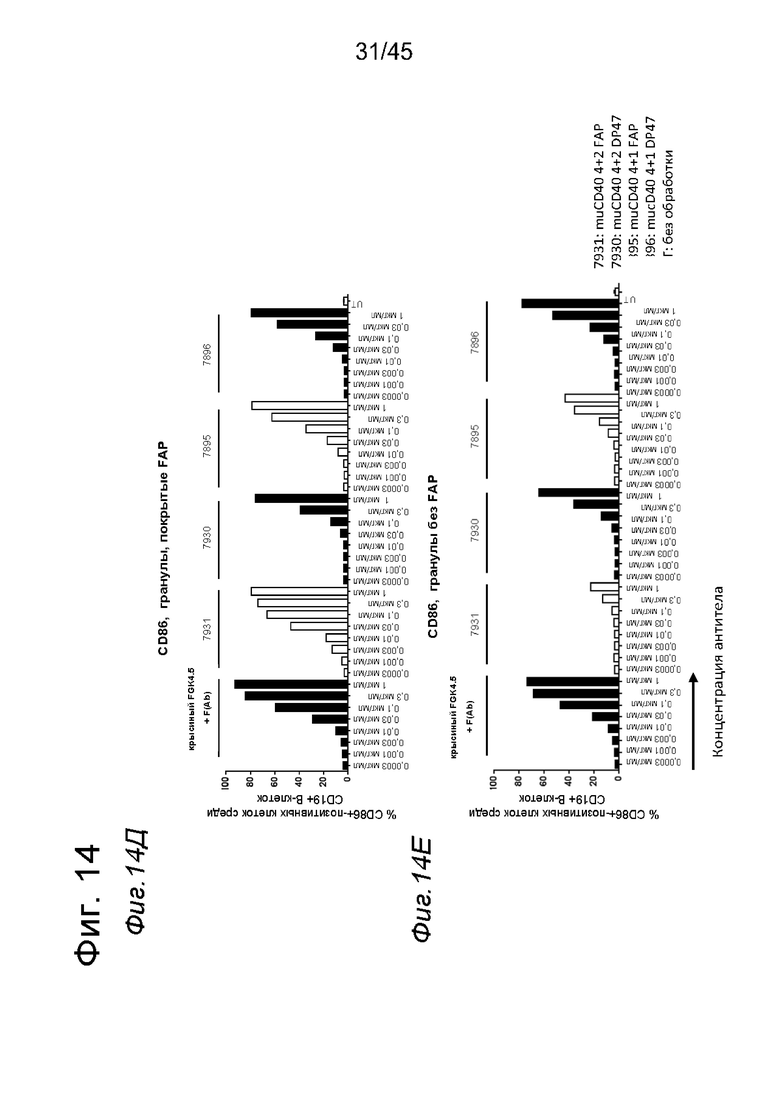
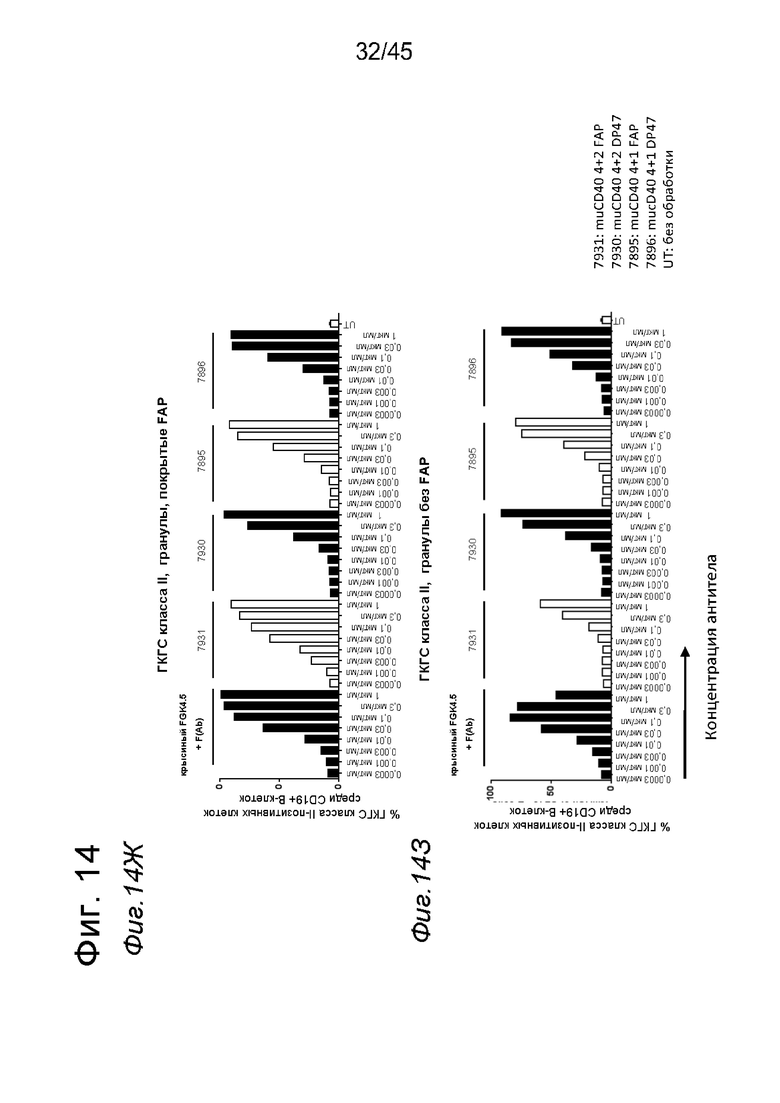
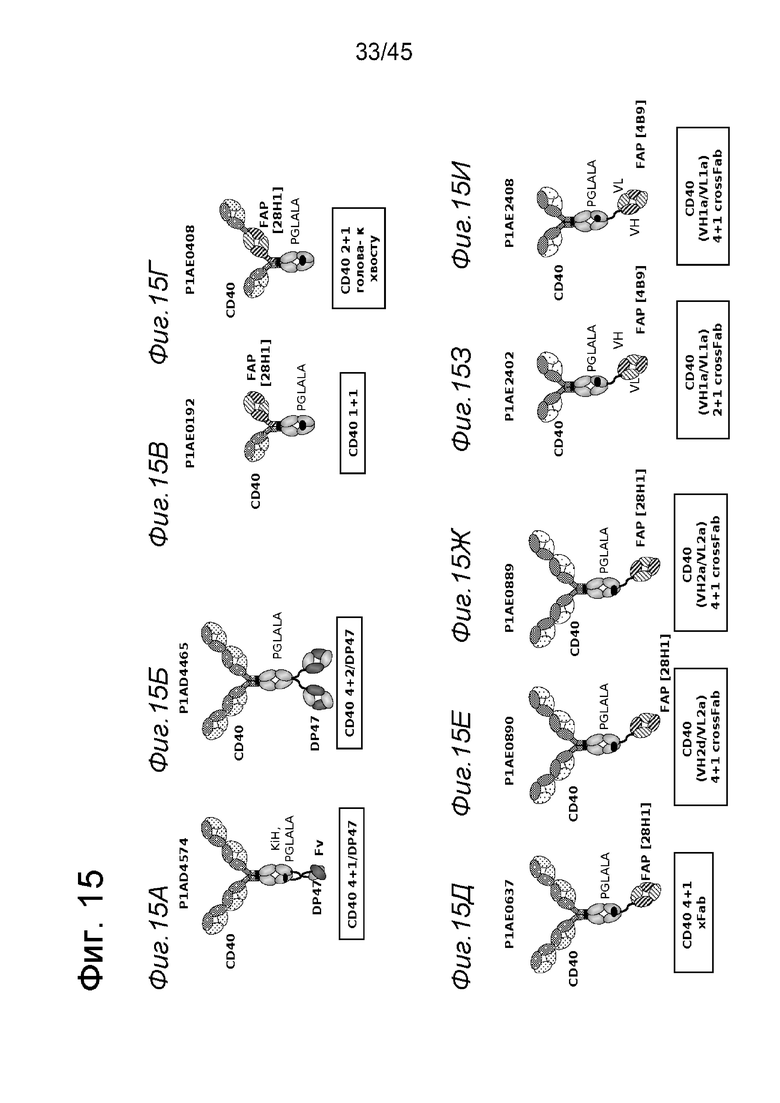
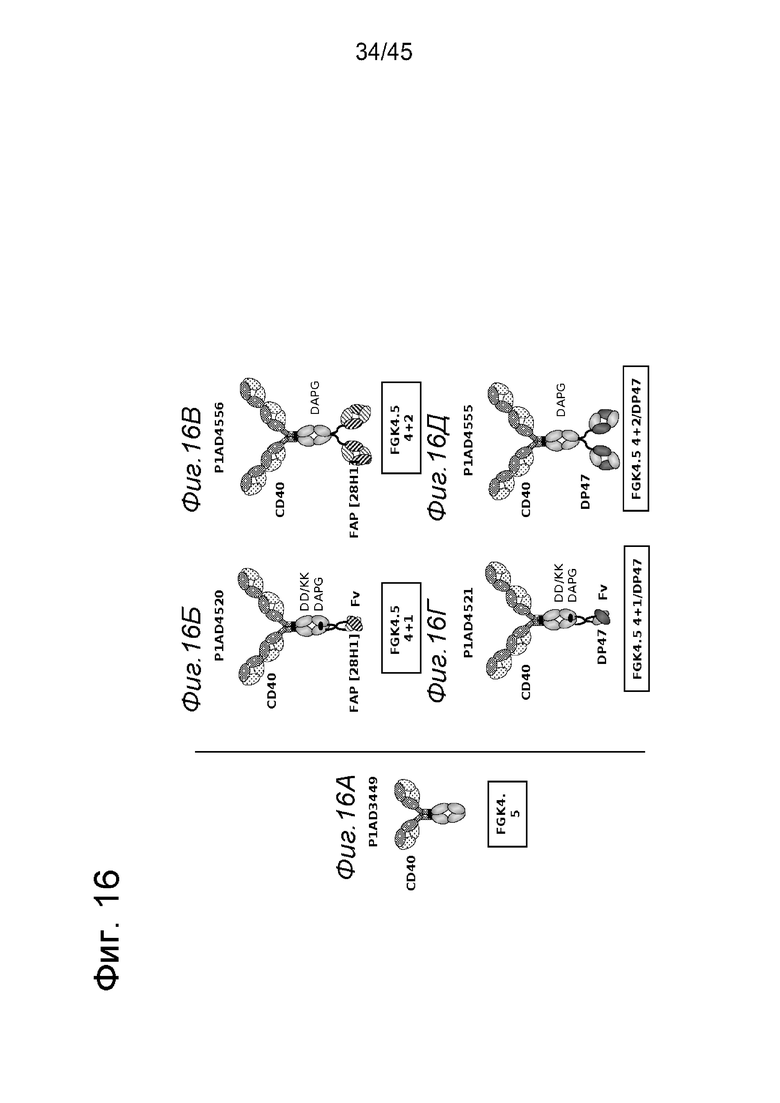
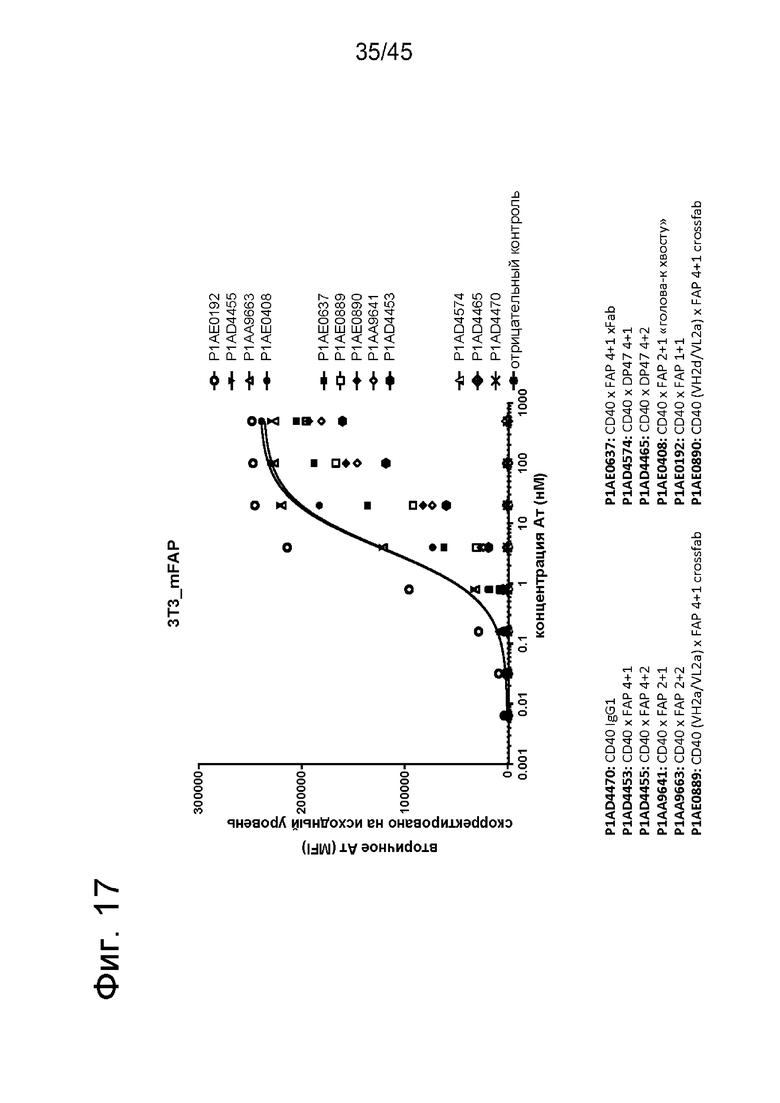
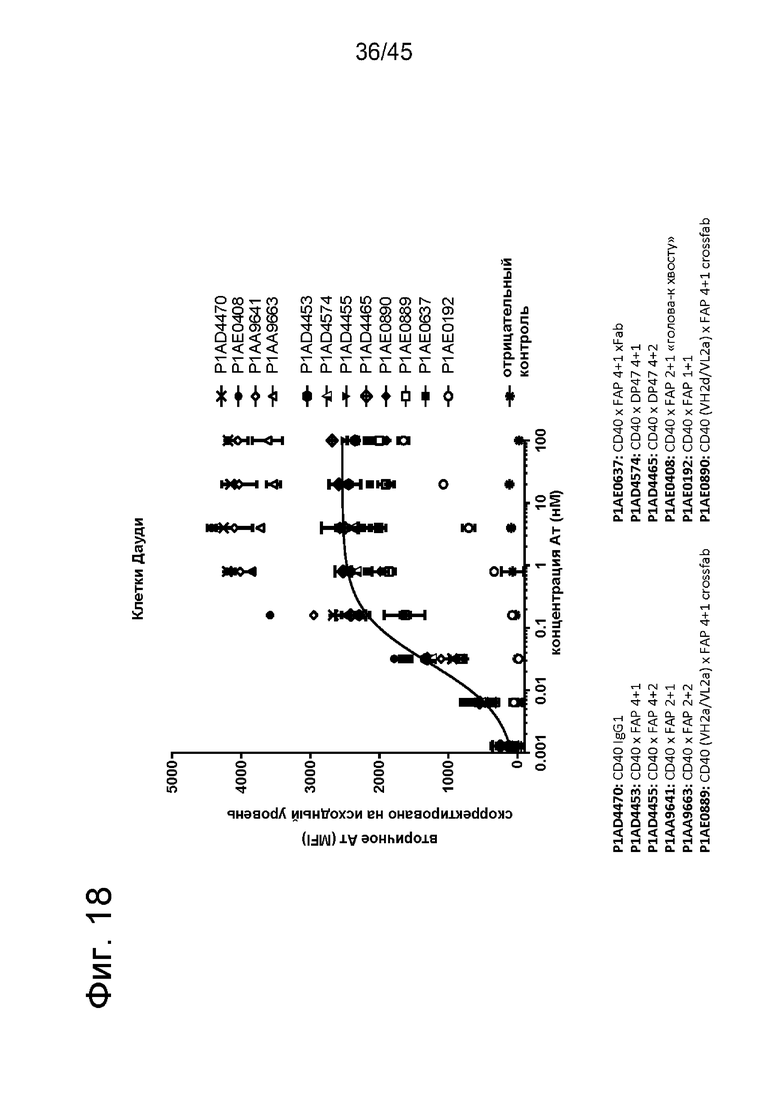
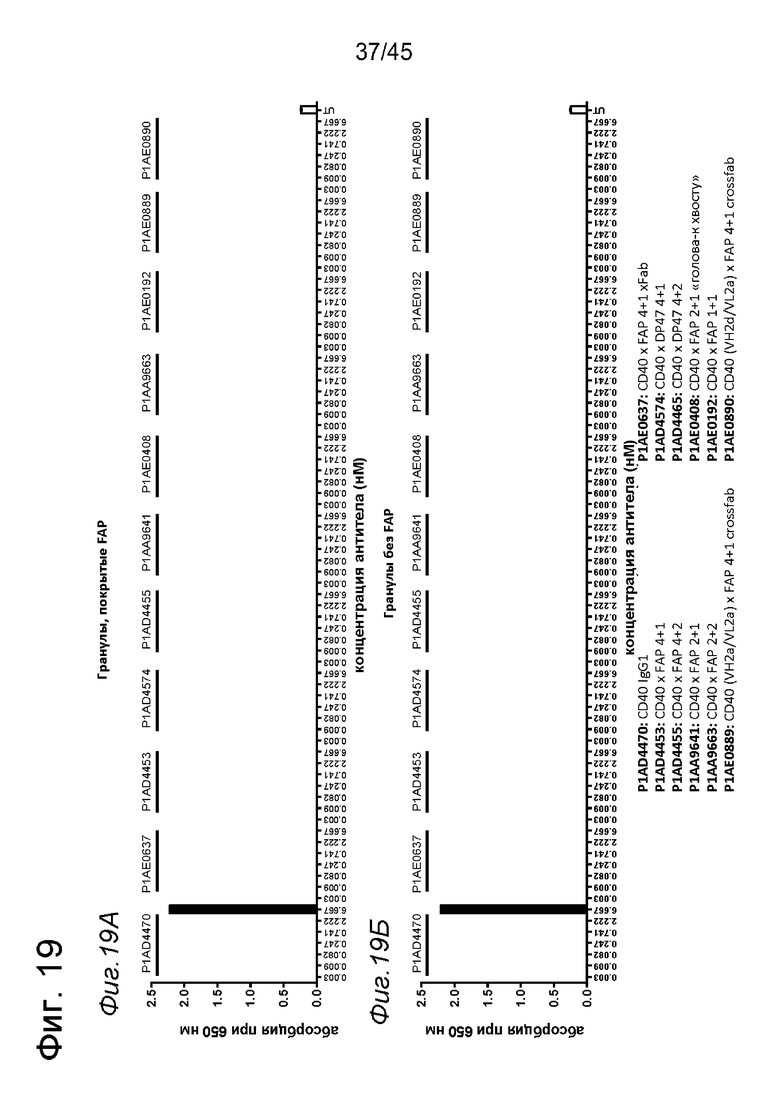
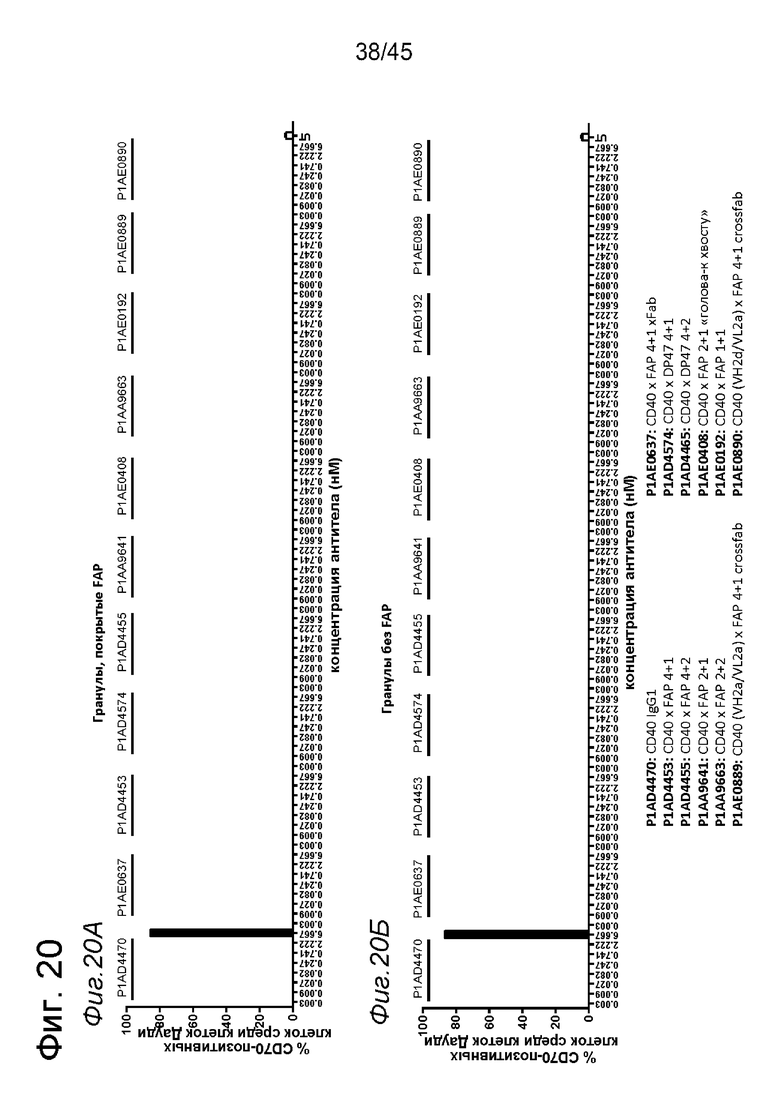
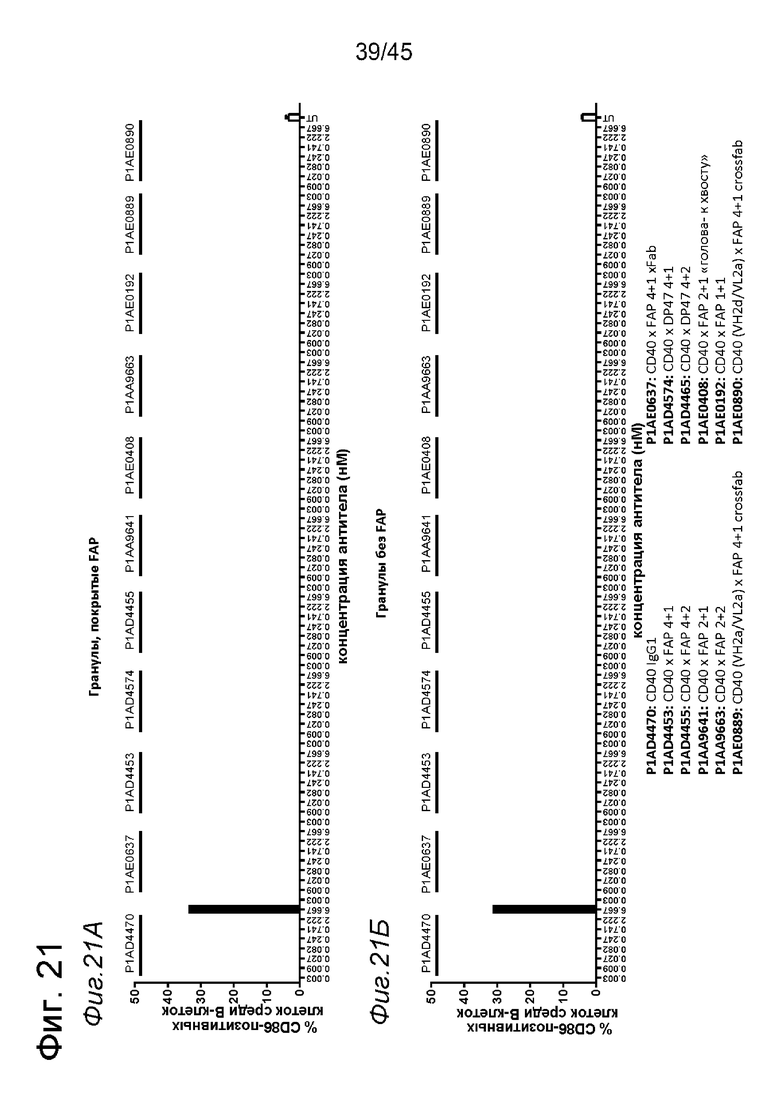
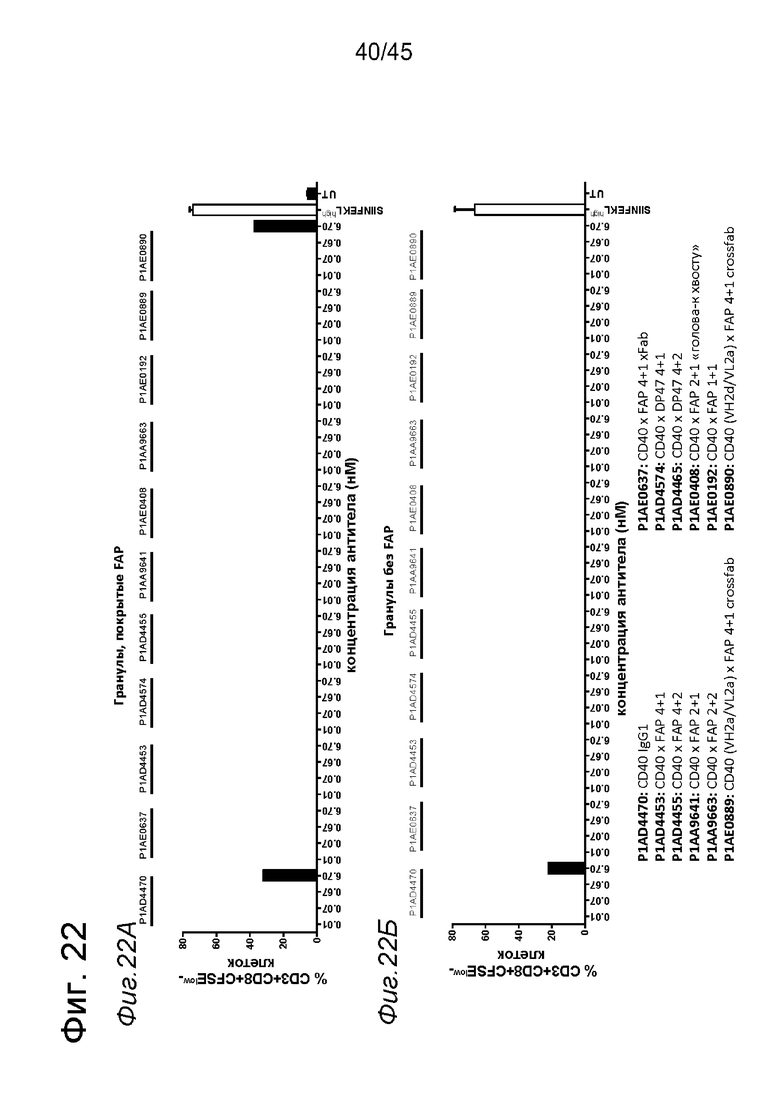
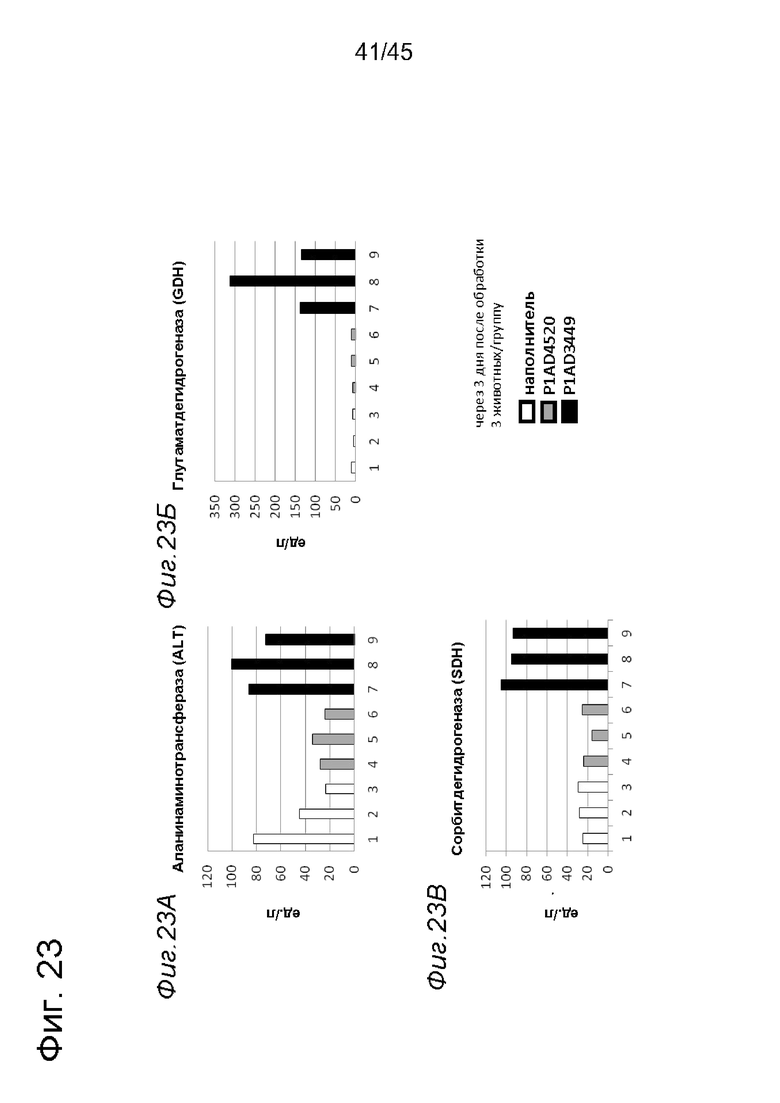
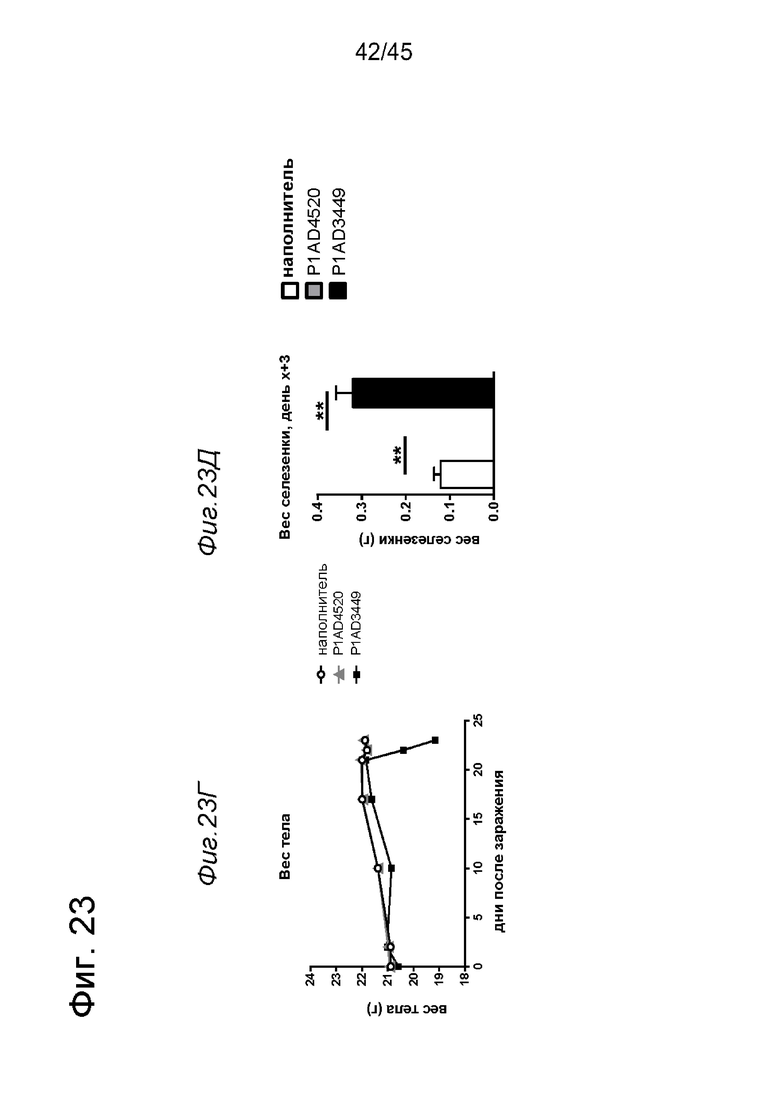
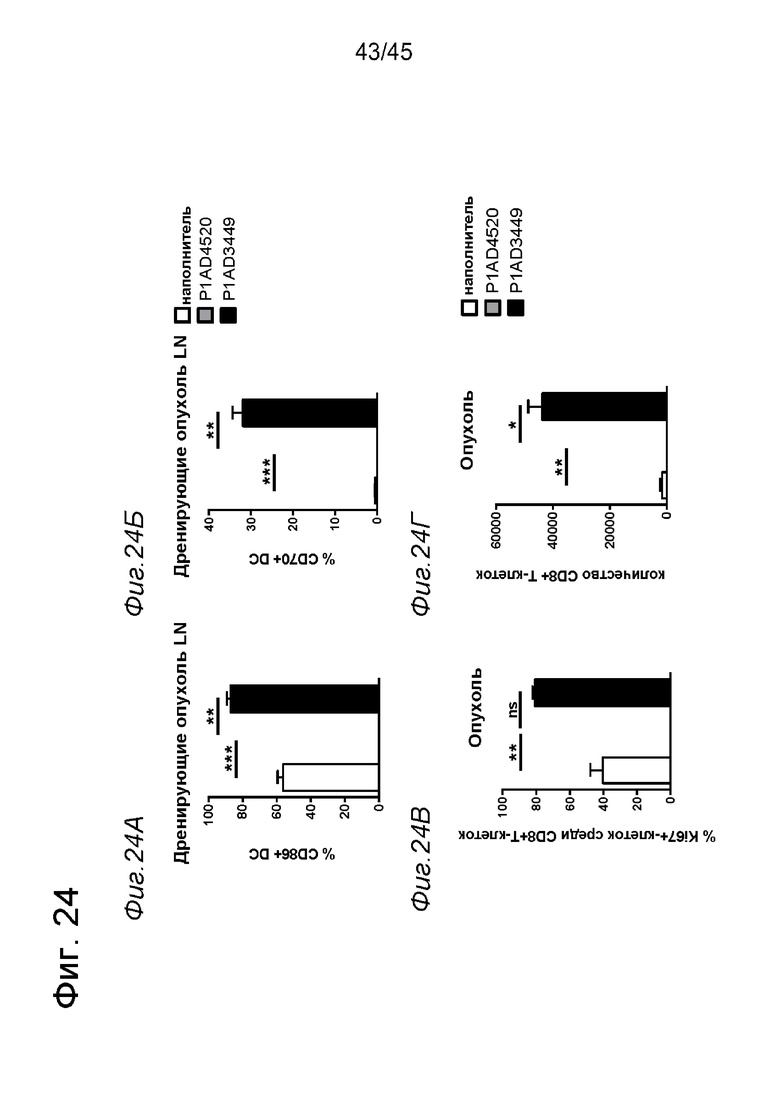
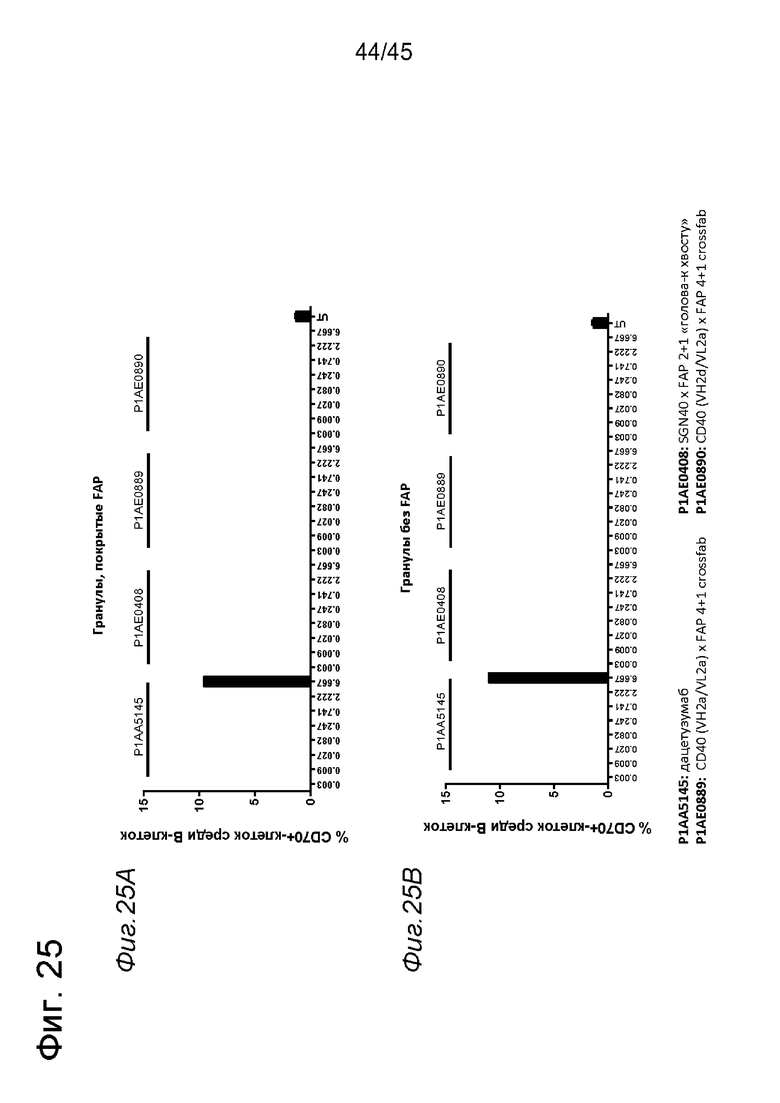
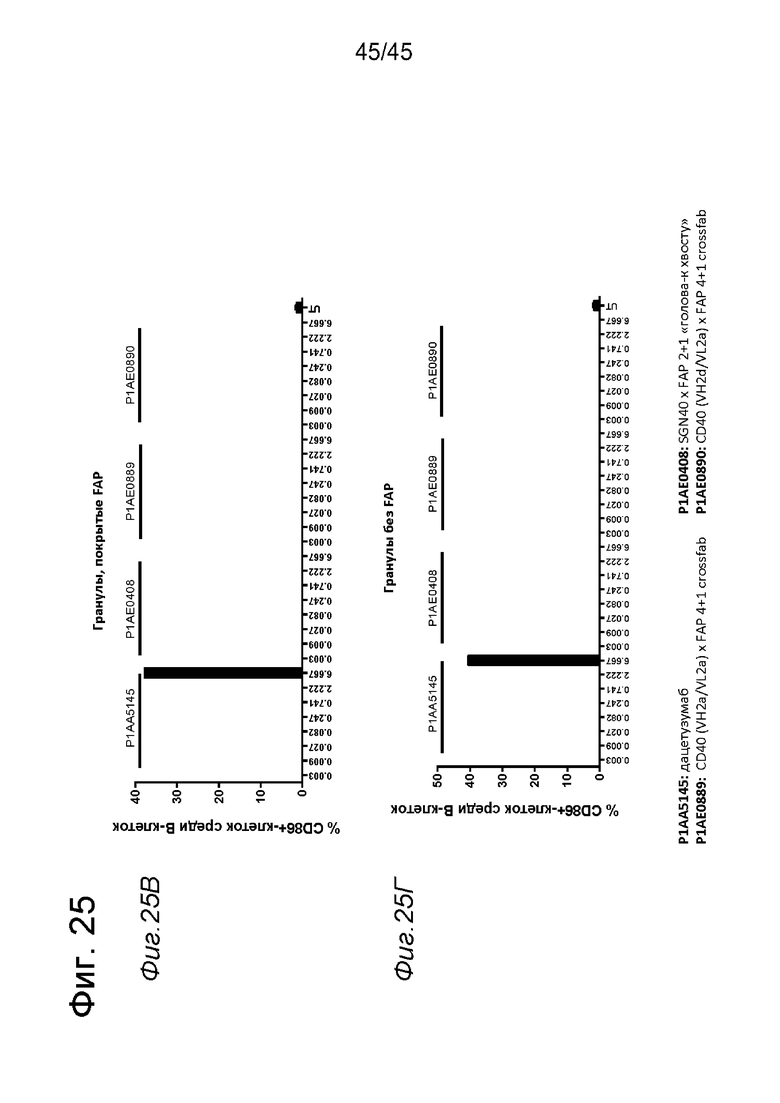
Изобретение относится к биотехнологии и представляет собой новые биспецифические антигенсвязывающие молекулы, содержащие (а) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, и (б) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с фибробласт-активирующим белком (FAP), и способы получения указанных молекул и способы их применения. Изобретение позволяет расширить спектр биспецифических антител с заданной активностью. 8 н. и 15 з.п. ф-лы, 25 ил., 31 табл., 5 пр.
1. Биспецифическая антигенсвязывающая молекула, обладающая способностью специфически связываться с CD40 и с фибробласт-активирующим белком (FAP), содержащая
(а) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, связанных с Fc-областью, содержащей
(1) вариабельную область тяжелой цепи (VHCD40), содержащую (i) CDR-Н1, содержащий аминокислотную последовательность SEQ ID NO: 19, (ii) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 20, и (iii) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи (VLCD40), содержащую (iv) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, (v) CDR- L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и (vi) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24; или
(2) вариабельную область тяжелой цепи (VHCD40), содержащую (i) CDR-Н1, содержащий аминокислотную последовательность SEQ ID NO: 27, (ii) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 28, и (iii) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 29, и вариабельную область легкой цепи (VLCD40), содержащую (iv) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 30, (v) CDR- L2, содержащий аминокислотную последовательность SEQ ID NO: 31, и (vi) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 32, и
(б) один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержащий вариабельную область тяжелой цепи (VHFAP), содержащую (i) CDR-H1, содержащую аминокислотную последовательность SEQ ID NO: 11, (ii) CDR-H2, содержащую аминокислотную последовательность SEQ ID NO: 12, и (iii) CDR-H3, содержащую аминокислотную последовательность SEQ ID NO: 13, и вариабельную область легкой цепи (VLFAP), содержащую (iv) CDR-L1, содержащую аминокислотную последовательность SEQ ID NO: 14, (v) CDR-L2 содержащий аминокислотную последовательность SEQ ID NO: 15, и (vi) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 16, соединенную с С-концом Fc-области,
где Fc-область представляет собой Fc-область IgG1 или Fc-область IgG4 и где Fc-область содержит одну или несколько аминокислотных замен, которые снижают аффинность связывания антитела с рецептором Fc и/или эффекторную функцию.
2. Биспецифическая антигенсвязывающая молекула по п. 1, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с CD40, связывается с полипептидом, который содержит или состоит из аминокислотной последовательности SEQ ID NO: 1.
3. Биспецифическая антигенсвязывающая молекула по п. 1 или 2, в которой антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
4. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-3, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 19, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 20, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 21, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 22, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 23, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 24.
5. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат вариабельную область тяжелой цепи (VHCD40), которая содержит (I) CDR-H1, содержащий аминокислотную последовательность SEQ ID NO: 27, (II) CDR-H2, содержащий аминокислотную последовательность SEQ ID NO: 28, и (III) CDR-H3, содержащий аминокислотную последовательность SEQ ID NO: 29, и вариабельную область легкой цепи (VLCD40), которая содержит (IV) CDR-L1, содержащий аминокислотную последовательность SEQ ID NO: 30, (V) CDR-L2, содержащий аминокислотную последовательность SEQ ID NO: 31, и (VI) CDR-L3, содержащий аминокислотную последовательность SEQ ID NO: 32.
6. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-5, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 25, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 26, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 33, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 34.
7. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173 и SEQ ID NO: 174, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177 и SEQ ID NO: 178.
8. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат
(I) вариабельную область тяжелой цепи (VHCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и
(II) вариабельную область легкой цепи (VLCD40), которая содержит аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188.
9. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4 или 7, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(н) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 177, или
(о) VH, которая содержит аминокислотную последовательность SEQ ID NO: 172, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 178, или
(п) VH, которая содержит аминокислотную последовательность SEQ ID NO: 173, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176, или
(р) VH, которая содержит аминокислотную последовательность SEQ ID NO: 174, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 176.
10. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, или 7, или 9, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат VH, которая содержит аминокислотную последовательность SEQ ID NO: 171, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 175.
11. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4 или 8, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат
(а) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(б) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(в) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(г) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или
(д) VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(е) VH, которая содержит аминокислотную последовательность SEQ ID NO: 180, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(ж) VH, которая содержит аминокислотную последовательность SEQ ID NO: 181, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(з) VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 186, или
(и) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(к) VH, которая содержит аминокислотную последовательность SEQ ID NO: 183, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188, или
(л) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 187, или
(м) VH, которая содержит аминокислотную последовательность SEQ ID NO: 184, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 188.
12. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, или 8, или 11, в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат VH, которая содержит аминокислотную последовательность SEQ ID NO: 179, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185, или в которой Fab-фрагменты, обладающие способностью специфически связываться с CD40, содержат VH, которая содержит аминокислотную последовательность SEQ ID NO: 182, и VL, которая содержит аминокислотную последовательность SEQ ID NO: 185.
13. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-4, содержащая
(I) по меньшей мере два Fab-фрагмента, обладающих способностью специфически связываться с CD40, которые содержат вариабельную область тяжелой цепи (VHCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183 и SEQ ID NO: 184, и вариабельную область легкой цепи (VLCD40), содержащую аминокислотную последовательность, выбранную из группы, которая состоит из SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187 и SEQ ID NO: 188, и
(II) по меньшей мере один антигенсвязывающий домен, обладающий способностью специфически связываться с FAP, который содержит вариабельную область тяжелой цепи (VHFAP), содержащую аминокислотную последовательность SEQ ID NO: 17, и вариабельную область легкой цепи (VLFAP), содержащую аминокислотную последовательность SEQ ID NO: 18.
14. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-13, в которой Fc-область представляет собой (I) Fc-область человеческого IgG1-подкласса с аминокислотными мутациями L234A, L235A и P329G (нумерация согласно EU-индексу Кэбота), или (II) Fc-область мышиного IgG1-подкласса с аминокислотными мутациями D265A и P329G (нумерация согласно EU-индексу Кэбота).
15. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-14, где биспецифическая антигенсвязывающая молекула содержит
(а) по меньшей мере два Fab-фрагмента, которые обладают способностью специфически связываться с CD40, соединенные с Fc-областью, и
(б) Kpocc-Fab-фрагмент, обладающий способностью специфически связываться с FAP, который соединен с С-концом Fc-области.
16. Биспецифическая антигенсвязывающая молекула по одному из пп. 1-14, где биспецифическая антигенсвязывающая молекула содержит четыре Fab-фрагмента, которые обладают способностью специфически связываться с CD40.
17. Полинуклеотид, кодирующий биспецифическую антигенсвязывающую молекулу по одному из пп. 1-16.
18. Экспрессионный вектор, содержащий полинуклеотид по п. 17.
19. Клетка-хозяин, содержащая полинуклеотид по п. 17 или экспрессионный вектор по п. 18 для получения биспецифической антигенсвязывающей молекулы по одному из пп. 1-16.
20. Способ получения биспецифической антигенсвязывающей молекулы, включающий культивирование клетки-хозяина по п. 19 в условиях, пригодных для экспрессии биспецифической антигенсвязывающей молекулы, и выделение биспецифической антигенсвязывающей молекулы.
21. Фармацевтическая композиция для лечения CD40 опосредованного рака, содержащая биспецифическую антигенсвязывающую молекулу по одному из пп. 1-16 в эффективном количестве и по меньшей мере один фармацевтически приемлемый эксципиент.
22. Применение биспецифической антигенсвязывающей молекулы по одному из пп. 1-16 или фармацевтической композиции по п. 21 для приготовления лекарственного средства, предназначенного для лечения CD40 опосредованного рака.
23. Способ лечения индивидуума, который имеет CD40 опосредованный рак, включающий введение индивидууму в эффективном количестве биспецифической антигенсвязывающей молекулы по одному из пп. 1-16 или фармацевтической композиции по п. 21.
| WO 2014207064 A1, 31.12.2014 | |||
| WO 2014180754 A1, 13.11.2014 | |||
| ГУМАНИЗИРОВАННЫЕ АНТИ-CD40-АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2006 |
|
RU2407544C2 |
| Прибор для определения вязкости жидкости | 1928 |
|
SU11449A1 |
Авторы
Даты
2022-02-10—Публикация
2018-04-03—Подача