Изобретение относится к области молекулярной биологии и биотехнологии и может быть использовано для проведения параллельного генетического анализа. Наиболее перспективными областями использования изобретения являются анализ полиморфизма, исследование генетических мутаций, параллельная диагностика патогенов в образцах пациентов и др.
Известно, что для проведения параллельного генетического анализа используется традиционная мультиплексная амплификация ДНК в растворе. В этом случае используют более одной пары праймеров для получения гетерогенного набора двухцепочечных фрагментов ДНК. Анализ генетического материала может быть осуществлен в ходе амплификации, т.е. в режиме реального времени или после проведения амплификации с использованием отдельных процедур. Недостатками такого метода анализа являются: взаимодействие праймеров в растворе, ограниченное число красителей и каналов детекции при проведении анализа в режиме реального времени, необходимость разделения цепей ДНК или проведения асимметричной амплификации при выполнении анализа с использованием отдельной процедуры.
Известны методы получения гетерогенного набора одноцепочечных фрагментов ДНК для проведения генетического анализа с использованием твердофазной амплификации. В частности, известен ряд способов проведения твердофазной ПЦР, например, с использованием одного иммобилизованного праймера и другого праймера в растворе (WO 1996013609 A1, 09.05.1996, US 9034580, 19.05.2015, US 8986931, 24.03.2015). В результате амплификации может быть получен ДНК-фрагмент, одна цепь которого связана с твердым носителем, тогда как другая находится в растворе. Недостатком данного способа является необходимость тщательного подбора пар праймеров при выполнении параллельного мультиплексного анализа.
Наиболее близким к заявленному изобретению является способ проведения твердофазной ПЦР с использованием двух иммобилизованных праймеров (US 8143008, 27.03.2012, US 8476044, 02.06.2013, US 8541172, 24.09.2013, US 8728764, 20.05.2014, US 9017945, 28.04.2015). В этом случае ни один из праймеров не находится в растворе. Достраивание любого из праймеров приводит к образованию иммобилизованной цепи ДНК, которая, в свою очередь, может служить матрицей для другого иммобилизованного праймера. Один из праймеров может быть отщепляемым. Этот метод амплификации предпочтительно используется либо для формирования на плоской поверхности матрицы микроколоний ДНК с целью проведения процедуры высокопроизводительного секвенирования, либо для наработки одноцепочечных фрагментов. Получаемые таким образом одноцепочечные фрагменты находятся в растворе или иммобилизованы на поверхности и могут быть использованы для проведения анализа. Недостатками данного способа являются: низкая емкость плоского носителя, необходимость пространственного разделения зон амплификации для параллельного анализа иммобилизованных индивидуальных фрагментов, сильное разбавление образца при анализе на разделенных зонах, преимущественное использование для анализа иммобилизованного набора одноцепочечных фрагментов ДНК, использование одинакового набора иммобилизованных праймеров при амплификации на частицах, необходимость использования дополнительных универсальных праймеров при получении колоний иммобилизованных фрагментов ДНК.
Задачей, на решение которой направлено заявляемое изобретение, является создание способа получения гетерогенного набора одноцепочечных флуоресцентно-меченых фрагментов ДНК с помощью твердофазной амплификации на микрочастицах для мультиплексного генетического анализа на олигонуклеотидных микрочипах.
Данная задача решается за счет того, что для мультиплексной амплификации используется смесь частиц пористого носителя с высокой емкостью, каждая из которых содержит лишь одну пару праймеров, специфичную к одному анализируемому фрагменту ДНК в образце. Частицы твердого носителя представляют собой сшитый трехмерный полимер, например, на основе полисахарида. В качестве материала частиц пористого носителя могут быть также использованы такие полимеры, как полистирол, поливиниловый спирт, полиакриламид и другие акриловые полимеры. Емкость пористого носителя существенно выше емкости плоской поверхности и составляет не менее 0,5 наномоль функциональных групп на 1 микролитр влажных частиц. Это позволяет получать ампликоны в количестве, достаточном для проведения гибридизационного анализа. Один из праймеров в каждой паре является отщепляемым. Это позволяет получать набор одноцепочечных фрагментов для последующего анализа. Метод отщепления праймера может быть ферментативным, химическим или фотохимическим. Число различных наборов частиц с иммобилизованными праймерами определяет степень мультиплексности анализа и может варьировать от двух до нескольких десятков или сотен. Твердофазная амплификация может быть выполнена в виде суспензии частиц в водном растворе, содержащем необходимые компоненты. Также амплификация может быть проведена в виде эмульсии вышеуказанной суспензии в масле. Температурный режим амплификации может быть организован в виде циклов нагрева и охлаждения, а также в изотермическом виде. В состав отщепляемого праймера вводится соответствующая последовательность оснований, либо химически или фотохимически отщепляемый линкер. Например, в качестве отщепляемой последовательности могут быть использованы сайты узнавания эндонуклеаз рестрикции или рибонуклеотиды. Введение репортерной группы проводится на стадии проведения амплификации с использованием флуоресцентно меченых нуклеозидтрифосфатов, например, производных Cy3 или Cy5. Как правило, такие производные представляют собой 2′-дезксиуридинтрифосфаты и 2′-дезоксицитидинтрифосфаты, модифицированные по 5 положению цианиновыми флуоресцентными красителями. Последующий параллельный генетический анализ проводится с использованием олигонуклеотидных микрочипов, набор проб на которых определяется характером выполняемой задачи. Для этой цели могут быть использованы, например, гидрогелевые олигонуклеотидные чипы. Сущность изобретения поясняется на Фиг. 1, а также примерами 1-4. Примеры 1 и 2 иллюстрируют способ получения частиц пористого носителя высокой емкости с иммобилизованными праймерами. Пример 3 иллюстрирует способ проведения твердофазной мультиплексной ПЦР на агарозных частицах. Пример 4 иллюстрирует способ отщепления набора одноцепочечных фрагментов ДНК от носителя для проведения генетического анализа на олигонуклеотидных микрочипах.
Пример 1. Активация агарозных частиц.
Водную суспензию Sepharose CL-6B (300 µL) промывали дважды 300 мкл дистиллированной воды, затем последовательно порциями по 300 мкл 30%, 60%, 100% изопропиловым спиртом и ацетонитрилом. Промытые частицы суспендировали в 1 мл холодного (0°C) 0.1M раствора EDC и N-гидроксисукцинимида в Ν,Ν-диметилформамиде. Суспензию встряхивали при 25°C в течение 1 часа. После активации частицы промывали дважды Ν,Ν-диметилформамидом порциями по 500 мкл. Активированные частицы хранили при 4°C в Ν,Ν-диметилформамиде.
Пример 2. Иммобилизация праймеров.
К раствору праймеров с 5 ′аминогруппой (50 мкл, 10-100 мкМ) в 0,2 M натрий-карбонатном буфере (pH 9,5) добавляли активированные агарозные частицы (50 мкл) при 0°C. Реакцию проводили в течение 16 ч. Затем агарозные частицы промывали дистиллированной водой порциями по 300 мкл три раза при температуре 25°C и один раз при 90°C. Суспензию частиц в воде хранили при 4°C.
Пример 3. Твердофазная мультиплексная ПЦР на агарозных частицах.
Амплификацию проводили с использованием 10 мкл смеси частиц и 25 мкл смеси, содержащей 0.2 мМ каждого dNTP, 20 нг ДНК, 1.5 мМ MgCl2, 5 ед. Taq полимеразы и 5% диметилсульфоксида в 1×ПЦР буфере (pH 8.5). Cy5-dUTP добавляли к ПЦР смеси в концентрации 7 мкМ. В ходе ПЦР осуществляли 180 циклов.
Пример 4. Отщепление одноцепочечного продукта ПЦР.
Отщепляемый праймер содержал два уридиновых остатка или фотолабильный линкер. При отщеплении с помощью РНК-азы частицы после амплификации промывали 5 раз водой milliQ порциями по 100 мкл и суспендировали в 15 мкл 0.1 M ацетата натрия. Расщепление проводили при 60°C в течение 1 ч в присутствии РНК-азы A. После этого суспензию смешивали с 10 мкл формамида и нагревали при 95°C в течение 1 мин. Затем частицы отделяли фильтрованием. ДНК выделяли осаждением смесью (1:2) этилового спирта и 2% перхлората лития в ацетоне. При УФ-отщеплении частицы промывали и суспендировали в 50 мкл воды milliQ. Смесь облучали 5 мин под УФ-лампами (четыре лампы 15W Sylvania F15T8/350BL, 356 nm). Суспензию смешивали с 20 мкл формамида и нагревали при 95°C в течение 1 мин. Затем частицы отделяли фильтрованием. Для анализа на микрочипах 35 мкл раствора ДНК смешивали с 15 мкл 20×SSPE.
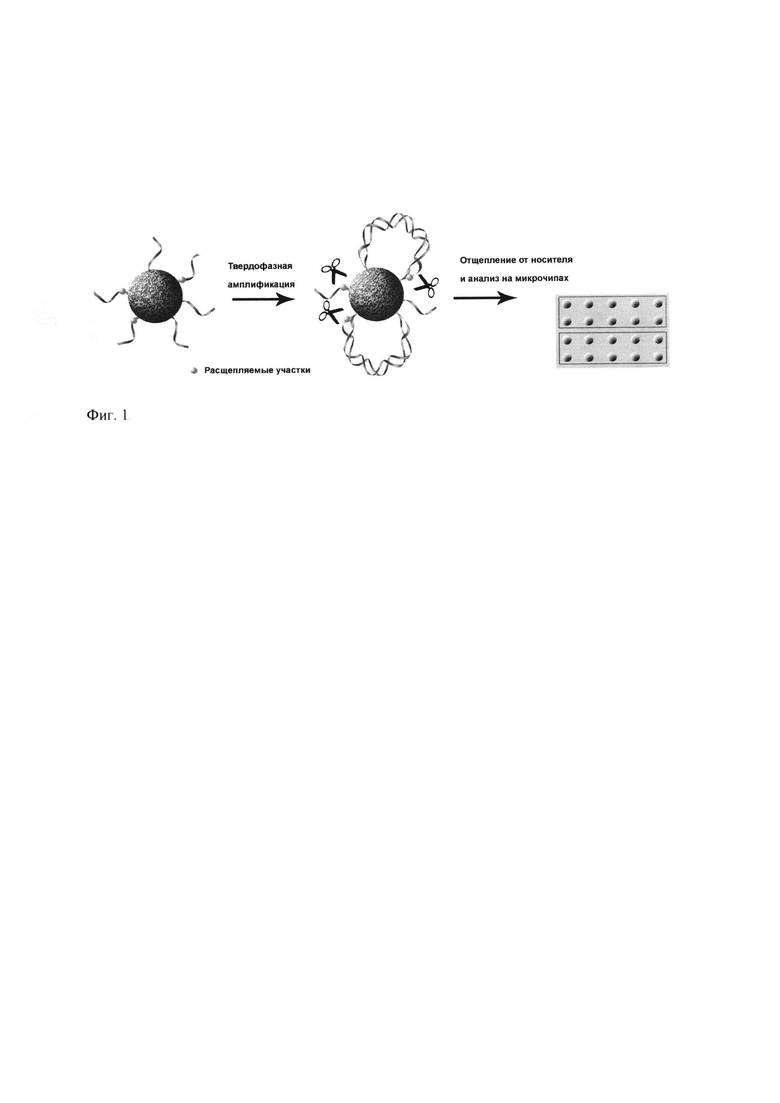
Изобретение относится к биохимии. Описан способ получения гетерогенного набора одноцепочечных фрагментов ДНК для мультиплексного генетического анализа. Сущность изобретения заключается в проведении мультиплексной твердофазной полимеразной цепной реакции (ПЦР) на полисахаридном носителе и последующем отщеплении одной из синтезированных цепей для целей анализа на олигонуклеотидном микрочипе. Мультиплексный характер твердофазной амплификации достигается за счет использования смеси частиц полисахаридного носителя, на каждой из которых иммобилизована индивидуальная пара праймеров для амплификации. Один из праймеров в каждой паре иммобилизованных праймеров содержит отщепляемую группу. Для введения репортерных групп в ДНК-цепь в ходе проведения ПЦР в реакционную смесь добавляется флуоресцентно меченый нуклеозидтрифосфат. Изобретение позволяет проводить параллельный генетический анализ. 9 з.п. ф-лы, 1 ил., 4 пр.
1. Способ получения гетерогенного набора одноцепочечных флуоресцентно-меченых фрагментов ДНК для мультиплексного генетического анализа на олигонуклеотидных микрочипах, отличающийся тем, что анализируемые фрагменты ДНК получают с помощью твердофазной амплификации на смеси частиц сшитого пористого трехмерного полимера, содержащих разные пары иммобилизованных праймеров в количестве не менее 0,5 нмоль на 1 мкл влажных частиц.
2. Способ по п. 1, отличающийся тем, что один из праймеров в каждой паре является отщепляемым.
3. Способ по п. 1, отличающийся тем, что отщепление праймеров может быть выполнено ферментативным, химическим или фотохимическим методом.
4. Способ по п. 1, отличающийся тем, что каждый набор частиц в их смеси содержит индивидуальную пару праймеров.
5. Способ по п. 1, отличающийся тем, что число различных типов частиц может варьировать от двух до нескольких десятков или сотен.
6. Способ по п. 1, отличающийся тем, что для флуоресцентного маркирования цепей ДНК используют флуоресцентно меченые нуклеозидтрифосфаты.
7. Способ по п. 1, отличающийся тем, что одним из способов проведения твердофазной амплификации является амплификация на частицах в эмульсии типа вода в масле.
8. Способ по п. 1, отличающийся тем, что материал частиц представлен полисахаридами, полистиролом, поливиниловым спиртом, полиакриламидом, другими акриловыми полимерами.
9. Способ по п. 1, отличающийся тем, что для флуоресцентного маркирования цепей ДНК используют 2′-дезксиуридинтрифосфаты и 2′-дезоксицитидинтрифосфаты, модифицированные по 5 положению цианиновыми флуоресцентными красителями.
10. Способ по п. 1, отличающийся тем, что одним из способов проведения твердофазной амплификации является изотермическая амплификация.
| RU 2013118722 A, 27.10.2014 | |||
| ГАРАФУТДИНОВ Р.Р | |||
| и др., Твердофазная полимеразная цепная реакция, Вестник Башкирского Университета, 2012, Т.17, N4, стр | |||
| Обтюратор для киноаппарата | 1923 |
|
SU1745A1 |
| US 2011045541 A1, 24.02.2011. | |||
Авторы
Даты
2016-12-10—Публикация
2015-06-22—Подача