Изобретение относится к области гигиенической безопасности объектов пищевого назначения и может быть использовано в биотехнологии для доклинической оценки токсичности биологически активных веществ и продуктов микробного синтеза, в пищевой промышленности для текущего контроля качества сырья, пищевых ингредиентов, добавок и получаемой продукции, а также в научно-исследовательских работах.
Обеспечение безопасности пищевых продуктов является важной частью санитарно-эпидемиологического благополучия населения, поскольку некачественные продукты питания могут приводить к заболеваниям различной этиологии. Для предотвращения этого необходимо тщательно проводить испытания токсичности объектов пищевого назначения, в том числе на этапе доклиники.
Биологическую оценку безопасности пищевых продуктов и ингредиентов проводят с использованием одноклеточных протистов, насекомых, мелких ракообразных, водорослей и семян высших растений.
Известны способы биотестирования продуктов питания с использованием в качестве тест-организма инфузории Tetrahymena pyriformis, в том числе способ определения безопасности растительных масел [6] и экспресс-метод токсико-биологической оценки мяса, мясных продуктов и молока [2]. В обоих методах токсичность определяют по числу инфузорий, размножившихся на испытуемых пробах за 72-96 ч культивирования, характеру движения инфузорий, наличию измененных форм и мертвых клеток в культуре. Количество простейших подсчитывают под малым увеличением микроскопа в камере Горяева. Полученные данные сравнивают с числом инфузорий на контроле, а результат - безопасность (Б) - выражают в процентах по формуле (1) следующим образом:

где Ки - количество микроорганизмов в исследуемом образце масла;
Кк - количество микроорганизмов в контрольном образце масла.
Известны экспресс-методы определения общей токсичности кормов и сырья для их производства, в том числе продуктов микробиологического синтеза, сухого молока, концентрированных кормовых добавок по ГОСТ 31674-2012 [1]. Биотестирование проводят на инфузориях стилонихиях (Stylonychia mytilus) или колподах (Colpoda steinii). Метод основан на извлечении из исследуемых кормов различных фракций токсических веществ параллельно ацетоном и водой с последующим воздействием этих экстрактов на стилонихий или на колподы. Оценку результату биотеста дают по реакции гибели инфузорий. Безопасным считается корм, определенный как нетоксичный (выживаемость стилонихий более 70%; около 90% колпод остались подвижными) при одновременном параллельном исследовании как ацетонового, так и водного экстракта. Выживаемость стилонихий N, % вычисляют по формуле (2) следующим образом:

где N2 - среднеарифметическое (из пяти испытаний) значение количества стилонихий в конце опыта через 1 ч экспозиции, шт.;
N1 - среднеарифметическое (из пяти испытаний) значение количества стилонихий в начале опыта, шт.
Известен способ комплексной оценки токсичности кормовых и пищевых продуктов, заключающийся в использовании инфузорий Paramecium caudatum, культивируемых на зернах длиннозерного риса. Оценку токсичности проводят по проценту выживших инфузорий в водном растворе ацетонового экстракта исследуемого продукта, рассчитанному по формуле, аналогичной формуле (2). Степень токсичности продукта при тестировании его водного раствора определяют по времени, за которое происходит гибель инфузорий [5].
Недостатком данных методов является то, что тест-организмы относятся к царству Простейших (Protozoa) и имеют значительно более простую клеточную организацию, чем высшие позвоночные, организмы которых состоят из различных типов тканей и клеток.
В качестве модельной системы организма человека при определении безопасности пищевых добавок и ингредиентов обычно используются высшие животные (молодые особи крыс, мышей, кроликов, кошек и др.), в том числе сельскохозяйственные (например, цыплята).
Известны методы определения общей токсичности кормов, комбикормов и кормовых добавок биотестированием параллельно на кроликах (кожная проба) и на мышах (острый опыт) по ГОСТ 31674-2012 [1].
Результат определяют по совокупности реакций в обоих методах: корм нетоксичный (нетоксичен в обоих тестах), корм токсичный (токсичен хотя бы в одном тесте).
Первый метод основан на дермонекротическом воздействии на кожу кролика токсичных веществ, в основном микогенного происхождения, извлекаемых из кормов ацетоном. Токсичность исследуемых кормов определяют по наличию воспалительного процесса на участке кожи с нанесенным экстрактом: корм нетоксичный, если воспаление отсутствует.
Второй метод основан на введении водного или ацетонового экстракта корма однократно в желудок белым мышам. Учет реакции ведут на основании анализа состояния внутренних органов (ЖКТ, печени, селезенки, почек) при вскрытии мышей. Корм нетоксичный, если все мыши живы, а при вскрытии убитых мышей патологоанатомических изменений не обнаружено.
Известны способы определения безопасности и эффективности БАД к пище [4] и оценки безвредности пробиотических микроорганизмов [3] на моделях конвенциональных линейных лабораторных животных обоего пола - мышах, крысах, морских свинках, кроликах, с пероральным введением стандартных и аггравированных доз веществ.
При определении безвредности штаммов пробиотических микроорганизмов колонии 24-часовой культуры бифидобактерий или лактобацилл, выращенных на агаризованной МРС-среде, снимают с агара петлей, суспендируют в 0,5 мл 0,9% раствора натрия хлорида до концентрации 108 клеток/мл и выдерживают 30 мин при температуре (37±1)°С. По 0,5 мл полученной взвеси вводят с помощью специальной насадки на шприц в желудок 5 белым мышам массой (15±1) г. Наблюдения за мышами осуществляют в течение 5 суток. В случае гибели хотя бы одной мыши, опыт повторяют на удвоенном количестве животных. Если в повторном опыте ни одна из мышей не погибнет, штамм считают безвредным, в противном случае штамм бракуется [3].
Недостатками методов с использованием высших млекопитающих являются высокая стоимость, громоздкость, длительность анализа и этические проблемы. Поэтому необходим простой, доступный и достоверный метод оценки воздействия различных пищевых ингредиентов на живой организм и его системы.
Вышеперечисленных недостатков лишен предлагаемый метод биологической оценки с использованием в качестве тест-систем культур клеток животных и человека. Клетки in vitro реагируют на воздействие химических и биологических факторов адекватно исходному организму.
Задачей изобретения является разработка эффективного способа определения безопасности пищевых ингредиентов для человека.
Техническим результатом заявляемого способа является расширение технологических возможностей способа, заключающихся в определении не только токсичности, но и в целом безопасности и функционального потенциала пищевых ингредиентов, а также повышение точности и достоверности результатов и их количественное определение.
Преимущества предлагаемого способа с применением культур клеток перед методами с использованием высших животных и простейших в следующем:
- возможна одновременная постановка большого количества опытов;
- возможность оценить динамику поведения клеточной системы в зависимости от времени, т.е. помимо острой токсичности объекта оценить хроническую токсичность;
- возможность в течение 24 ч сделать предварительное заключение о безвредности продукта;
- использование нескольких типов тканей и клеток человека дает основание для экстраполяции результатов на организм человека в целом;
- способ культивирования в монослое и прижизненное наблюдение клеток человека с помощью микроскопа позволяют определить их жизнеспособность и соответственно степень воздействия тестируемого объекта с большей точностью.
Предложенный способ определения безопасности пищевых ингредиентов, в котором в качестве тест-систем используются культуры клеток млекопитающих и человека, включает три этапа:
1) подготовку исследуемого объекта: из исходной концентрации препарата готовят ряд двукратных серийных разведений убывающих концентраций; для приготовления разведений из каждой пробы ингредиента или продукта весовым или объемным методом отбирают навеску; масса (объем) навески индивидуальна для каждого конкретного ингредиента; для приготовления разведений водорастворимых объектов используют физраствор, для растворимых в органических растворителях - этиловый спирт, масла, при необходимости - растворители (ДМСО и др.), не обладающие цитотоксической активностью;
2) подготовку тест-системы: выращивают монослой клеток в культуральном флаконе площадью 25 см2 на соответствующей питательной среде ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС, 0,05% антибиотика гентамицина или пенициллина-стрептомицина; удаляют со сформировавшегося монослоя питательную среду; промывают монослой клеток дважды фосфатно-солевым буфером, или раствором Версена, или физраствором;
3) определение безопасности объекта для тест-системы: во флакон со сформировавшимся монослоем клеток вносят 0,5 мл раствора тестируемого объекта и 10 мл питательной среды ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС; культивируют в течение 1 ч в CO2-инкубаторе при температуре 37°С и концентрации газа 5,0%; удаляют питательную среду и промывают монослой клеток дважды фосфатно-солевым буфером, или раствором Версена, или физраствором; вносят 10 мл свежей питательной среды ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС; флакон помещают на 24 ч в СО2-инкубатор при температуре 37°С и концентрации газа 5,0%; удаляют питательную среду; снятие монослоя осуществляют 1 мл смеси растворов Версена 0,02% и трипсина 0,25% в соотношении 3:1; клетки окрашивают раствором красителя трипанового синего; производят подсчет живых и мертвых клеток с помощью камеры Горяева и определяют жизнеспособность и цитопатическую активность.
В качестве контроля используют флакон с клетками, выросшими на питательной среде без добавления тестируемого вещества. Испытания повторяют минимум трехкратно. Полученные данные сравнивают с контролем, а результат - жизнеспособность (Ж) - выражают в процентах по формуле (3) как отношение количества живых клеток, выросших на среде с добавлением исследуемого ингредиента, к общему числу клеток:

где Кж - среднеарифметическое значение количества живых клеток в конце опыта, шт.;
Ко - среднеарифметическое значение общего количества клеток в начале опыта, шт.;
100 - коэффициент пересчета в проценты.
Для диапазона концентраций тестируемого ингредиента определяют ТС50 - показатель, характеризующий концентрацию испытуемого объекта в питательной среде, которая приводит к уничтожению клеточной популяции на 50%, т.е. соответствует жизнеспособности 50%.
Объект обладает низкой цитотоксичностью и безопасен для применения в составе пищевых продуктов, если в пересчете на содержание чистого вещества его концентрация, которая приводит к 50%-ному уничтожению клеточной системы, превышает 0,03% (ТС50/10).
В противном случае объект обладает высокой цитотоксичностью (в пересчете на чистое вещество его концентрация, которая приводит к 50%-ному уничтожению клеточной системы, не превышает 0,03% (ТС50/10)), не безопасен в качестве пищевого ингредиента и не рекомендуется к применению в производстве пищевых продуктов.
Определение безопасности пищевых ингредиентов проводят на монослойных постоянных (перевиваемых) клеточных линиях различного происхождения, морфологии, типа ткани, например HEK 293 - почка эмбриона человека; FLECH (ФЛЭЧ) - фибробласты легкого эмбриона человека; Нер-2 - эпидермоидная карцинома гортани человека; СаСо-2 - аденокарцинома ободочной кишки человека; Girardi Heart - клетки предсердия человека; VERO - линия клеток почки африканской зеленой мартышки.
Для ведения культур клеток используют стандартные синтетические жидкие питательные среды: Игла MEM (minimal essential medium), DMEM (Dulbecco′s modified Eagle′s medium), 199, альфа MEM, F12, основой которых являются солевые растворы Эрла и Хенкса. В качестве источника факторов роста применяют сыворотку крови КРС или эмбриональную бычью в количестве 10-15%. Питательную среду готовят согласно паспортам клеточных линий Российской коллекции клеточных культур позвоночных (РККК П). Для предупреждения контаминации используют антибиотики пенициллин-стрептомицин или гентамицин. Во избежание инактивации при хранении раствор антибиотика готовят непосредственно перед заменой среды: в стерильных условиях навеску антибиотика растворяют в физрастворе и вносят в среду для культивирования клеток из расчета 100-200 ЕД на 1 мл среды или 0,05%. По мере истощения эссенциальных веществ и изменения рН системы, каждые 2-3 дня производят замену среды в культуральных флаконах.
Подготовку монослоя (снятие и рассев) осуществляют следующим образом. Со сформировавшегося монослоя лабораторным аспиратором удаляют питательную среду; промывают монослой клеток дважды фосфатно-солевым буфером, или раствором Версена, или физраствором; дезагрегируют клетки в суспензию: во флаконы вносят 1 мл раствора Версена 0,02% и трипсина 0,25% в соотношении 3:1, для лучшего открепления клеток от субстрата флаконы помещают на горизонтальный термостатируемый шейкер при 37°С со скоростью вращения 40-50 об/мин на 10 мин; степень дезагрегации клеточного монослоя контролируют визуально, при недостаточном переходе в суспензию используют стерильные скребки лифтеры или скрейперы; по достижении открепления 90-100% клеток клетки хорошо ресуспендируют пипетированием и рассевают; в новый флакон вносят суспензию клеток плотностью около 6000-7000 клеток/см2 и 10 мл питательной среды ЕМЕМ, DMEM или 199, включающей 10-15% сыворотки эмбриональной бычьей или КРС и 0,05% антибиотика гентамицина или пенициллина-стрептомицина; флаконы помещают в СО2-инкубатор при температуре 37°С и концентрации газа 5,0%.
В процессе пересева после трипсинизации оценивают состояние клеточной культуры методом исключения красителя и подсчета общего количества клеток, а также выявления в их числе мертвых и живых клеток: аликвоту суспензии клеток (~40 мкл) смешивают с равным количеством 0,4% раствора красителя трипанового синего, отбирают пипеткой 3 мкл суспензии, вносят под покровное стекло камеры Горяева и под малым увеличением микроскопа производят подсчет клеток.
Предложенный способ иллюстрируется следующими примерами.
Пример 1.
Исследование влияния натурального растительного красителя шиконина на состояние клеточных линий HEK 293 - почка эмбриона человека, FLECH - фибробласты легкого эмбриона человека, НЕр-2 - эпидермоидная карцинома гортани человека, МН-22а (МГ-22а) - гепатома мыши линии С3НА, NCTC - подкожная соединительная ткань, мышь, клон 929.
Навеску пигмента вносят в стерильную пробирку и стерилизуют в течение 1 ч 96% этиловым спиртом из расчета 0,1 мл спирта на 5 мг порошка шиконина. При плохой растворимости вносят несколько капель ДМСО. Используют метод двойных последовательных разведений: из данной пробирки готовят ряд двукратных серийных разведений убывающих концентраций препарата от исходной концентрации шиконина 16 мкг/мл до 0,5 мкг/мл.
Для подготовки тест-системы выращивают клетки на соответствующих питательных средах согласно таблице 1 с добавлением 0,05% антибиотика гентамицина в течение 10-14 суток в зависимости от линии; со сформировавшегося монослоя удаляют питательную среду лабораторным аспиратором; промывают монослой клеток дважды фосфатно-солевым буфером.
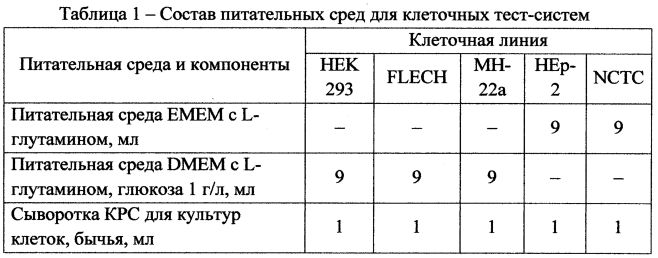
Питательные среды согласно таблице 1 со спиртовыми растворами шиконина убывающих концентраций вносят во флаконы с образовавшимся монослоем, выдерживают 1 ч в СО2-инкубаторе при 37°С и концентрации газа 5,0%, после чего удаляют из флаконов питательную среду, промывают дважды фосфатно-солевым буфером, вносят 10 мл свежей питательной среды, флаконы помещают в CO2-инкубатор на 24 ч. Спустя сутки сливают питательную среду, производят дезагрегацию клеток растворами Версена 0,02% и трипсина 0,25% в соотношении 3:1 на качалке в течение 10 мин, снятие монослоя клеток, окрашивание и подсчет живых и мертвых клеток с помощью камеры Горяева, по результатам подсчетов определяют ТС50 шиконина для каждой линии.
Полученные данные сравнивают с контролем - количеством клеток монослоя, выросших на питательной среде без использования экстрактов шиконина. Фоновое воздействие 96%-го этилового спирта в интервале применяемых концентраций незначительно. Результаты по определению жизнеспособности клеточных линий при воздействии спиртовых экстрактов шиконина представлены в таблице 2.
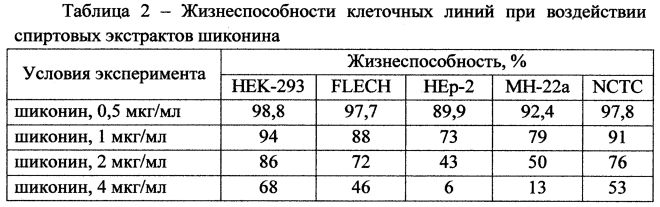

В отношении выбранных клеточных линий проявляется дозозависимое действие нафтохиноновых экстрактов. Влияние шиконина значительно более выражено в отношении опухолевых клеток гепатомы мыши и карциномы гортани человека. Цитопатические концентрации нафтохинона в отношении различных клеточных тест-систем составили, мкг/мл: HEK-293 - около 8, NCTC и FLECH - около 4, МН-22а и НЕр-2 - менее 2. Следовательно, показатель ТС50/10 составил, %: HEK-293 - около 0,8, NCTC и FLECH - около 0,4, МН-22а и НЕр-2 - менее 0,2. Таким образом, шиконин обладает низкой цитотоксичностью, т.к. в пересчете на чистое вещество цитопатическая активность превышает 0,03%, и можно полагать, что препарат безопасен для применения в производстве пищевых продуктов.
Пример 2.
Определение влияния пряных трав майорана, укропа, петрушки, черного перца (горошком), кинзы (кориандра), тмина на состояние клеточных линий и выбор среди них объекта с наиболее щадящим действием.
Формула приготовления спиртовых экстрактов: мелко измельчают травы, заливают 96% этиловым спиртом в соотношении 1:1,5 по весу и помещают в посуду из темного стекла, плотно закупоренную во избежание выветривания спирта. Для интенсификации процесса экстрагирования применяют ультразвуковую обработку экстрактов на ультразвуковой ванне 5,7 л «Сапфир» ТТЦ в течение 30 мин при комнатной температуре для каждого экстракта; напряжение питания - 220 В/50-60 Гц, рабочая частота - 35 кГц. Приготовленные растворы помещают в темное теплое место на 2 недели, периодически встряхивая. Полученный спиртовой экстракт отфильтровывают через бумажный фильтр и центрифугируют 5 мин при 12000 об/мин.
В качестве клеточных тест-систем выбирают клеточные линии VERO - линия клеток почки африканской зеленой мартышки, НЕр-2 - эпидермоидная карцинома гортани человека, FLECH - фибробласты легкого эмбриона человека.
Клетки культивируют на соответствующих питательных средах согласно таблице 3 с добавлением 0,05% антибиотика пенициллина-стрептомицина в течение 10-14 суток в зависимости от линии; со сформировавшегося монослоя удаляют питательную среду лабораторным аспиратором; промывают монослой клеток дважды фосфатно-солевым буфером; вносят 10 мл соответствующей питательной среды, включающей 10% сыворотки согласно таблице 3.
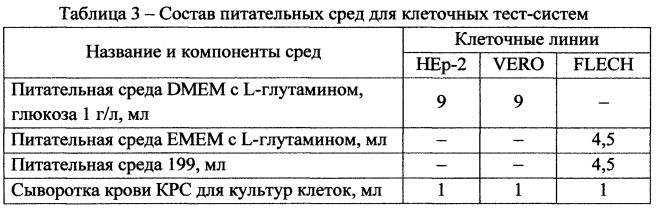
Спиртовые экстракты пряных трав в количестве 0,5 мл добавляют в среду с образовавшимся монослоем, выдерживают в течение 1 ч в СО2-инкубаторе при 37°С и концентрации газа 5,0%. Затем производят замену питательный среды и через 24 ч подсчитывают количество живых и мертвых клеток и показатель жизнеспособности. В качестве контроля - количество живых и мертвых клеток монослоя, выросших без использования растительных экстрактов и спирта.
Результаты по определению жизнеспособности клеточных линий при воздействии 5% спиртовых экстрактов пряных трав представлены в таблице 4. В качестве фонового воздействия принимают результаты, полученные при использовании 0,4 мл 96%-го этилового спирта. Полученные данные сравнивают с контролем, в качестве которого используют количество живых и мертвых клеток монослоя, выросших без использования растительных экстрактов и спирта.
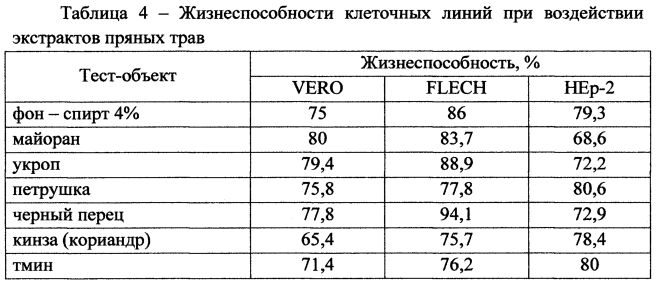
Наиболее щадящее действие на клеточные тест-культуры оказывали спиртовые экстракты майорана, укропа и черного перца. На клеточную линию карциномы гортани человека НЕр-2 растительные экстракты влияют отрицательно, в особенности майоран, что важно при угнетении онкологических клеток и в борьбе с раковыми заболеваниями.
Поскольку при обработке клеточных тест-систем 5% экстрактами пряных трав ни в одном случае не произошло гибели 50% популяции, можно сделать вывод, что настойки растений данных концентраций обладают низкой цитотоксичностью, и можно полагать, что данные препараты безопасны для применения в производстве пищевых продуктов.
Список использованных источников
1. ГОСТ 31674-2012 Корма, комбикорма, комбикормовое сырье. Методы определения общей токсичности. - М.: Стандартинформ, 2013. - 33 с.
2. Методические указания по токсико-биологической оценке мяса, мясных продуктов и молока с использованием инфузорий Тетрахимена пириформис (экспресс-метод): утв. ГУВ Минсельхозпрода РБ 20.10.1997. - Витебск. - 1997. - 13 с.
3. МУ 2.3.2.2789-10 Методические указания по санитарно-эпидемиологической оценке безопасности и функционального потенциала пробиотических микроорганизмов, используемых для производства пищевых продуктов. - М.: Федеральный Центр гигиены и эпидемиологии Роспотребнадзора, 2010. - 93 с.
4. МУК 2.3.2.721-98 Определение безопасности и эффективности биологически активных добавок к пище. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 1999. - 47 с.
5. Патент РФ № 2266015, МПК A23K, G01N. Способ комплексной оценки токсичности кормовых и пищевых продуктов / Гроздов А.О. (РФ). - заявл. 16.08.01.; опубл. 20.08.03.
6. Патент РФ № 2415417, МПК G01N 33/03. Способ определения безопасности растительных масел / Францева Т.П., Прудникова Т.Н., Широкорядова О.В. (РФ), - заявл. 03.08.09.; опубл. 27.03.11.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ БЕЗОПАСНОСТИ ПРОБИОТИЧЕСКИХ МИКРООРГАНИЗМОВ С ПОМОЩЬЮ КЛЕТОЧНЫХ ТЕСТ-СИСТЕМ | 2015 |
|
RU2604804C1 |
| СПОСОБ ОЦЕНКИ КАЧЕСТВА КОРМОВЫХ И ПИЩЕВЫХ ПРОДУКТОВ | 1992 |
|
RU2049994C1 |
| Способ получения средства на основе экстрактов из базидиальных грибов, обладающего противовирусным действием | 2023 |
|
RU2830096C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ПОЧВЫ МЕТОДОМ БИОТЕСТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ РАВНОРЕСНИЧНЫХ ИНФУЗОРИЙ PARAMECIUM CAUDATUM EHRENBERG | 2011 |
|
RU2482478C2 |
| СПОСОБ БИОТЕСТИРОВАНИЯ ТОКСИГЕННОСТИ КИШЕЧНОЙ ПАЛОЧКИ | 2003 |
|
RU2262529C1 |
| ПРОТИВОВИРУСНОЕ СРЕДСТВО НА ОСНОВЕ МЕЛАНИНА | 2011 |
|
RU2480227C2 |
| МЕТОД ПОДБОРА АДСОРБЕНТА | 2022 |
|
RU2791740C1 |
| Способ обработки несеменного зерна, пораженного микроскопическими грибами и микотоксинами | 2017 |
|
RU2650792C1 |
| Водорастворимый пигмент меланин из базидиального гриба Inonotus obliquus, обладающий противовирусной активностью | 2022 |
|
RU2800446C1 |
| СПОСОБ КОМПЛЕКСНОЙ ОЦЕНКИ ТОКСИЧНОСТИ КОРМОВЫХ И ПИЩЕВЫХ ПРОДУКТОВ | 2001 |
|
RU2266015C2 |
Изобретение относится к биотехнологии, в частности к области гигиенической безопасности объектов пищевого назначения. Предложен способ определения безопасности пищевых ингредиентов, в котором в качестве тест-систем используются культуры клеток млекопитающих и человека. Способ включает три этапа: подготовку исследуемого объекта, подготовку тест-системы и определение безопасности объекта для тест-системы. Безопасность пищевых ингредиентов оценивают на основании определения жизнеспособности культуры клеток с использованием камеры Горяева и цитопатической активности изучаемых объектов. Изобретение обеспечивает повышение точности и достоверности результатов определения безопасности пищевых ингредиентов для человека. 4 табл., 2 пр.
Способ определения безопасности пищевых ингредиентов, в котором в качестве тест-систем используются культуры клеток млекопитающих и человека, включающий три этапа:
подготовку исследуемого объекта: подготовку из исходной концентрации препарата ряда двукратных серийных разведений убывающих концентраций; отбор навески весовым или объемным методом для приготовления разведений из каждой пробы ингредиента или продукта; масса (объем) навески индивидуальна для каждого конкретного ингредиента; приготовление разведений водорастворимых объектов в физрастворе, растворимых в органических растворителях - в этиловом спирте, маслах, при необходимости - в растворителях (ДМСО и др.), не обладающих цитотоксической активностью;
подготовку тест-системы: выращивание монослоя клеток в культуральном флаконе площадью 25 см2 на соответствующей питательной среде ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС, 0,05% антибиотика гентамицина или пенициллина-стрептомицина; удаление со сформировавшегося монослоя питательной среды; промывка монослоя клеток дважды фосфатно-солевым буфером, или раствором Версена, или физраствором;
определение безопасности объекта для тест-системы: внесение во флакон со сформировавшимся монослоем клеток 0,5 мл раствора тестируемого объекта и 10 мл питательной среды ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС; культивирование в течение 1 ч в CO2-инкубаторе при температуре 37°С и концентрации газа 5,0%; удаление питательной среды и промывку монослоя клеток дважды фосфатно-солевым буфером, или раствором Версена, или физраствором; внесение 10 мл свежей питательной среды ЕМЕМ, DMEM или 199, включающей 10% сыворотки эмбриональной бычьей или КРС; культивирование в течение 24 ч в СО2-инкубаторе при температуре 37°С и концентрации газа 5,0%; удаление питательной среды; снятие монослоя 1 мл смеси растворов Версена 0,02% и трипсина 0,25% в соотношении 3:1; окрашивание клеток раствором красителя трипанового синего; подсчет живых и мертвых клеток с помощью камеры Горяева; определение жизнеспособности и ТС50, где
жизнеспособность (Ж) выражают в процентах по формуле (3) как отношение количества живых клеток, выросших на среде с добавлением исследуемого ингредиента, к общему числу клеток:

где Кж - среднеарифметическое значение количества живых клеток в конце опыта, шт.;
Ко - среднеарифметическое значение общего количества клеток в начале опыта, шт.;
100 - коэффициент пересчета в проценты,
ТС50 - цитопатическая активность, характеризующая концентрацию испытуемого образца в питательной среде, которая приводит к уничтожению клеточной популяции на 50%, причем объект обладает низкой цитотоксичностью и считается безопасным для применения в составе пищевых продуктов, если в пересчете на содержание чистого вещества концентрация, которая приводит к 50%-ному уничтожению клеточной системы, превышает 0,03% (ТС50/10); в противном случае объект обладает высокой цитотоксичностью (в пересчете на чистое вещество его концентрация, которая приводит к 50%-ному уничтожению клеточной системы, не превышает 0,03% (ТС50/10)), не безопасен в качестве пищевого ингредиента и не рекомендуется к применению в производстве пищевых продуктов.
| СПОСОБ ОЦЕНКИ КАЧЕСТВА КОРМОВЫХ И ПИЩЕВЫХ ПРОДУКТОВ | 1992 |
|
RU2049994C1 |
| Картофелеуборочная машина | 1933 |
|
SU35469A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ БЕЗОПАСНОСТИ РАСТИТЕЛЬНЫХ МАСЕЛ | 2009 |
|
RU2415417C1 |
Авторы
Даты
2016-12-10—Публикация
2015-12-25—Подача