Изобретение относится к медицине и фармации и касается нового анальгезирующего и противовоспалительного средства на основе производного дигидроксипиримидина, а именно 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она (C9H14N2O2) формулы I:
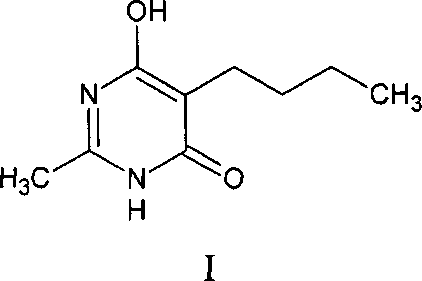
2,5-дизамещенные 6-гидроксипиримидин-4(3H)-оны, их строение, свойства и способы получения широко известны [Livingston P. Ferris II, Anthony R. Ronzio // Contribution from the Chemistry Department of the University of Colorado. 1940. P. 606-607; Kaushik S. / Patel, Kishor N. Raval, Shivani P. Patel, Aswin G. Patel, Snehal V. Patel // AvailableOnlinethrough. 2012. P. 170-182]. Однако про их биологическую активность, а, в частности, про анальгетические и противовоспалительные свойства ничего не известно.
Известна противовоспалительная активность таких соединений, относящихся к классу дигидроксипиримидинов, как оксиметилурацил [Д.Н. Лазарева, В.А. Давыдова // Экспериментальная и клиническая фармакология. 2005. С. 53-55], а так же ряда 1,3-алкил-5-гидрокси-6-метилпиримидин-2,4(1H,3H)-дионов [Патент 2051150 РФ, C07D 413/06, C07D 211/22, А61K 31/505. Пиримидиновые ациклонуклеозиды, проявляющие иммунотропную и противовоспалительную активность].
Наиболее близким по структуре и фармакологическим свойствам к заявляемому средству является оксиметилурацил формулы II (прототип)
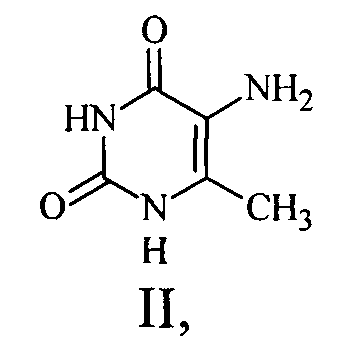
обладающий противовоспалительной активностью в отношении гистаминового (64,8%), серотонинового (75,0%), брадикардинового (65,7%), каррагенового (50,0%) и трипсинового (97,8%) отеков.
К недостаткам данного соединения можно отнести достаточно высокую токсичность, а так же отсутствие каких-либо данных по его анальгетической активности.
Задачей предлагаемого изобретения является расширение арсенала анальгезирующих и противовоспалительных средств, поиск нового средства на основе дигидроксипиримидина, имеющего низкую токсичность, обладающего анальгетической и противовоспалительной активностью, превышающих по своим показаниям указанные активности применяющихся в медицинской практике раздельно препаратов.
Указанная задача достигается созданием анальгетического и противовоспалительного средства на основе 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она.
Изобретение иллюстрируется примерами синтеза и исследования фармакологических свойств.
Пример 1. Методика синтеза 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она.
В круглодонную трехгорлую колбу на 250 мл, снабженную обратным холодильником, капельной воронкой и термометром, загружают 9,86 г (0,17 моль) ацетамидина (ацетамидин в силу своей высокой цены может быть получен по известной методике из ацетимидоэфира и спиртового раствора аммиака [Е.В. Куваева, Е.В. Федорова, В.В. Зайцев, И.П. Яковлев, В.И. Захаров, Т.Л. Семакова. - Журнал органической химии СПб, 2011. Т. 48. С. 221-225] и выделен из ацетамидина гидрохлорида путем взаимодействия с водным раствором поташа в среде абсолютного эфира), и приливают 50 мл бензола (ГОСТ 5955-75) абсолютного. Включают мешалку и прикапывают 43,34 г (0,22 моль) свежеприготовленного [Organic Syntheses, Coll. Vol. 4, p. 261 (1963); Vol. 34, p. 26 (1954)] 2-бутилмалонилдихлорида. Реакционную массу нагревают при температуре 50°C в течение 60 минут. По мере протекания реакции наблюдается выпадение осадка целевого пиримидина. Полученный 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-он очищают переосаждением. Осадок растворяют в 100 мл 15% раствора гидроксида натрия, а затем подкисляют 26% соляной кислотой до рН 4. Выпавший осадок отфильтровывают и сушат в сушильном шкафу при температуре 70°C. Получают мелкодисперсный порошок кремового цвета. Выход продукта составил 87% из расчета на ацетамидин.
Хроматографическая однородность целевого продукта подтверждалась посредством хроматографирования раствора его в ДМСО в системе ацетон: ледяная уксусная кислота 4:1 (Rf=0,61). Состав синтезированного соединения подтвержден элементным анализом. Брутто-формула: C9H14O2N2. Найдено %: С - 61,04; Н - 7,09%; N - 14,17%. Вычислено %: С - 59,35%; Н - 7,69%; N - 15,38%.
Строение синтезированного вещества было доказано физико-химическими методами идентификации органических соединений: ЯМР 1Н и 13С, УФ- и ИК-спектроскопией.
В ИК-спектрах вещества (таблетки KBr) наиболее характеристичными являются полосы поглощения в области 3500-3080 см-1, характеризующие наличие ОН и NH групп, 1670-1680 см-1, характерные для C=O группы, и 1550-1558 см-1, характерные для связи C=N.
УФ-спектр 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она в 99,6%-ном ацетонитриле имеет 1 максимум поглощения в области 262 нм.
Спектр ЯМР 1Н полученного соединения в ДМСО-d6 характеризуется наличием сигналов протонов (0,83 3H, с; 1,20 4Н, м; 2,11 2Н, т) бутильного заместителя, (2,66 3H, с) протонов метильной группы, а так же пиков в области (8,96 1Н, с; 9,11 1H, с) протонов NH и ОН-групп, соответственно.
Спектр ЯМР 13С этого соединения характеризуется сигналами ядер атомов углерода бутильного заместителя (δ 14,06; 22,38; 28,80; 48,91 м.д), сигналом атома углерода метильной группы (δ 29,93 м.д.), а так же атомов углерода С5 (δ 99,04 м.д.), С2 (δ 155,83 м.д.), С4 (δ 164,42 м.д.) и С6 (δ 175,04 м.д.).
Строение полученного вещества было установлено с помощью масс-спектрометрии. Расчетная молекулярная масса полностью совпала с экспериментально полученной (М+=244).
Пример 2. Определение острой токсичности.
Острую токсичность синтезированного соединения определяли на нелинейных белых мышах-самцах массой тела 18-20 г. Животных распределяли на равные по численности и массе тела группы, по 10 животных в каждой. Суспензии соединения в воде, стабилизированные твином 80, вводили однократно внутрибрюшинно в интервале доз 50 мг/кг - 2000 мг/кг. Выживаемость животных определяли, наблюдая через 24 часа и через 48 часов от момента введения исследуемого соединения. Наблюдение за животными осуществляли в течение 72 часов. Регистрировали развитие основных симптомов и время гибели животных.
Расчет среднесмертельной дозы (LD50) проводили с помощью экспресс-метода В.Б. Прозоровского [Прозоровский В.Б., Прозоровская М.П., Демченко В.И. // Фармакология и токсикология. - 1978. - №4. - С. 497-502] и пробит-анализа по методу Миллера-Тейнтера [М.Л. Беленький. Элементы количественной оценки фармакологического эффекта. (2-е издание, переработанное и дополненное). Государственное издательство Медицинской Литературы. Ленинград. 1963. с. 412]. Токсичность заявляемой субстанции составляет 1873 мг/кг. Согласно классификации токсичности препаратов, соединение I относится к классу малотоксичных веществ [Измеров И.Ф., Саноцкий И.В., Сидоров К.К. Параметры токсикометрии промышленных ядов. М.: Медицина, 1977. С. 196-197]. Оно более чем в 20 раз менее токсично, чем диклофенак натрия - препарата сравнения по противовоспалительной активности.
Пример 3. Определение анальгетической активности.
Для экспериментальной оценки анальгезирующей активности использовали модель генерации уксуснокислых «корчей» у мышей-самцов. Судороги у животных вызывали при помощи внутрибрюшинного введения 3% раствора уксусной кислоты. Эксперимент проводили на белых нелинейных мышах-самцах массой тела 15-22 г. Для эксперимента использовали 3 группы животных по 7 особей в каждой. Суспензию 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она в смеси ДМСО с водой (1:5) (стабилизатор твин 80) вводили однократно, внутрибрюшинно в дозах 1/10 LD50 за 40 минут до внутрибрюшинного введения 3% раствора уксусной кислоты. Животным контрольной группы вводили смесь ДМСО: вода (1:5). В качестве препарата сравнения использовали метамезол натрия в дозе 100 мг/мл. Регистрировали время начала судорог и их количество в течение 20 минут [Харкевич Д.А. Фармакология Учебник. - 10-е изд. - М.: ГЭОТАР-Медиа, 2009. - С. 628-640]. Анальгетическая активность заявленной субстанции составляет 48%, что немного ниже препарата сравнения метамезола натрия, однако исследуемая субстанция более чем в 20 раз менее токсична.
Пример 4. Определение противовоспалительной активности.
Противовоспалительную активность исследовали на скрининговой модели - формалиновый отек лапы у крыс.
В опыте использовали белых беспородных крыс-самцов массой 200-240 г в количестве 40 штук. Из них были сформированы 4 группы по 10 особей в каждой. Особям контрольной группы вводили только флогогенный агент. Животные опытных групп получали исследуемый препарат в дозах 1/10 LD50, 1/50 LD50 и препарат сравнения, которые вводили внутрибрюшинно за 1 час до создания отека.
Водный 2%-ный раствор формалина вводили субплантарно в количестве 0,1 мл каждому животному.
Исследуемый нативный раствор (5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она) вводили крысам внутрибрюшинно в дозах 190 и 40 мг/кг. Препарат сравнения - диклофенак вводили в дозе 25 мг/кг.
На каждом животном исполнялись экспериментальные процедуры в следующей последовательности:
- внутрибрюшинное введение исследуемого образца: в остром опыте однократно за 1 час до введения флогогенного вещества;
- измерение объема стопы правой задней лапы животного (исходные данные);
- субплантарное введение формалина (0,1 мл 2%-ного раствора) в правую заднюю лапу животного через один час после последнего приема исследуемого образца;
- измерение объема стопы правой задней лапы крысы через определенные промежутки времени после введения флогогенного агента (1 и 24 часа).
Измерение объема лапы проводили при помощи стеклянного онкометра по объему вытесненной воды после погружения лапы в специальный резервуар.
Полученные от каждого животного результаты усредняли в пределах группы и рассчитывали процент угнетения воспаления в опытной группе относительно контрольной.
Внутрибрюшинное однократное превентивное введение 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она в дозе 1/10 LD50 способствует сдерживанию развития воспалительной реакции спустя 1 час на 11,0% (1/10 LD50) и 15,1% (1/50 LD50), что уступает препарату сравнения с показанием 25%, спустя сутки на 97,4% (1/10 LD50) и 96,1% (1/50 LD50), что значительно превышает показания широко используемого на практике диклофенака натрия (60,8%) при значительно меньшей токсичности заявляемого средства. А так же достоверно показано, что снижение дозы не приводит к снижению биологической активности исследуемого соединения, а в первые часы даже незначительно повышает эффективность заявленной субстанции.
Таким образом, заявляемое средство является малотоксичным, проявляет значительно большую противовоспалительную активность чем препарат сравнения, широко применяемый в медицине. Кроме того, заявленная субстанция обладает заметным анальгетическим эффектом при значительно более низкой токсичности, чем широко применимый на практике препарат сравнения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Анальгезирующее и противовоспалительное средство с противомикробной активностью | 2019 |
|
RU2693475C1 |
| АНТИМИКРОБНОЕ, ПРОТИВОВОСПАЛИТЕЛЬНОЕ И АНАЛЬГЕЗИРУЮЩЕЕ СРЕДСТВО НА ОСНОВЕ N-4-НИТРОФЕНИЛБЕНЗАМИДИНА | 2012 |
|
RU2481104C1 |
| Анальгезирующее и противовоспалительное средство с противомикробной активностью | 2019 |
|
RU2694263C1 |
| Способ получения N-(нафталин-2-ил)бензамидина | 2018 |
|
RU2684117C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,5-ДИЗАМЕЩЕННЫХ 6-ГИДРОКСИПИРИМИДИН-4(3Н)-ОНОВ | 2015 |
|
RU2604060C1 |
| 1-ГЕКСАДЕЦИЛ-4,6-ДИМЕТИЛ-2-ОКСОНИКОТИНАМИД, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И АНАЛЬГЕТИЧЕСКУЮ АКТИВНОСТЬ | 2008 |
|
RU2396258C2 |
| Этил 4-(5-бензоил-6-(4-(диэтиламино)фенил)-4-гидрокси-2-тиоксогексагидропиримидин-4-карбоксамино)бензоат, проявляющий анальгетическое и противовоспалительное действие | 2019 |
|
RU2717246C1 |
| ПРОТИВОВОСПАЛИТЕЛЬНОЕ И АНАЛЬГЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ИЗОПРОПИЛАМИДА 1,2-ДИГИДРО-1Н-2-ОКСОЦИНХОНИНОВОЙ КИСЛОТЫ | 2012 |
|
RU2545056C2 |
| ПРИМЕНЕНИЕ МЕТИЛ 5-БЕНЗОИЛ-4-ГИДРОКСИ-6-(4-ХЛОРФЕНИЛ)-2-ТИОКСОГЕКСАГИДРОПИРИМИДИН-4-КАРБОКСИЛАТА В КАЧЕСТВЕ СРЕДСТВА, ОБЛАДАЮЩЕГО АНАЛЬГЕТИЧЕСКИМ И ПРОТИВОВОСПАЛИТЕЛЬНЫМ ДЕЙСТВИЕМ | 2024 |
|
RU2835600C1 |
| Анальгезирующее средство на основе замещённой 2,2'-[(6-метилпиримидин-2,4-диил)бис(3-фенил-1Н-1,2,4-триазол-1,5-диил)]дипропановой кислоты | 2017 |
|
RU2676092C1 |
Изобретение относится к медицине и фармации и представляет собой анальгезирующее и противовоспалительное средство, включающее 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она в качестве активного вещества. Средство является малотоксичным, проявляет значительно большую противовоспалительную и анальгезирующую активность, чем препараты сравнения, широко применяемые в медицине. 4 пр.
Анальгезирующее и противовоспалительное средство, включающее 5-бутил-6-гидрокси-2-метилпиримидин-4(3H)-она в качестве активного вещества.
| Livingston P | |||
| Ferris II, Anthony R | |||
| Ronzio // Contribution from the Chemistry Department of the University of Colorado | |||
| Способ изготовления алюминиевого экрана для кинематографа | 1925 |
|
SU1940A1 |
| - P | |||
| РАСПРЕДЕЛИТЕЛЬНЫЙ МЕХАНИЗМ ДЛЯ ДВИГАТЕЛЕЙ ВНУТРЕННЕГО ГОРЕНИЯ | 1922 |
|
SU606A1 |
| Kaushik S | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - P | |||
| Аппарат для передачи фотографических изображений на расстояние | 1920 |
|
SU170A1 |
| ПИРИМИДИНОВЫЕ АЦИКЛОНУКЛЕОЗИДЫ, ПРОЯВЛЯЮЩИЕ ИММУНОТРОПНУЮ И ПРОТИВОВОСПАЛИТЕЛЬНУЮ АКТИВНОСТЬ | 1992 |
|
RU2051150C1 |
| Д.Н, Лазарева, В.А | |||
| Давыдова // | |||
Авторы
Даты
2016-12-20—Публикация
2015-10-06—Подача