Изобретение относится к органической химии, конкретно к новым химическим соединениям, общей формулы: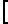
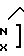
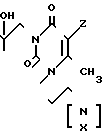



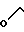
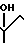
 в частности к 1,3-бис(2'-гидрокси-3'-морфолинопропил)-6-метилурацилу(a); 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-6-метилу-рацилу (б); 3-бис(2'-гидрокси-3'-морфолинопропил)-5-гидрокси-6-метилурацилу (в); 1,3-бис(2'-гидрокси-3'-пиперидинопропил)- 5-гидрокси-6-метилурацилу (г); 1,3-бис(2'-гидрокси-3'-морфолинопропил)-5-(2'-гидро- кси-3'-морфолинопропокси)-6- метилурацилу (д) и 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-5-(2'-гидрокси-3'-пиперидинопро- покси)- 6-метилурацилу (Е), проявляющих иммунотропную и противовоспалительную активность.
в частности к 1,3-бис(2'-гидрокси-3'-морфолинопропил)-6-метилурацилу(a); 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-6-метилу-рацилу (б); 3-бис(2'-гидрокси-3'-морфолинопропил)-5-гидрокси-6-метилурацилу (в); 1,3-бис(2'-гидрокси-3'-пиперидинопропил)- 5-гидрокси-6-метилурацилу (г); 1,3-бис(2'-гидрокси-3'-морфолинопропил)-5-(2'-гидро- кси-3'-морфолинопропокси)-6- метилурацилу (д) и 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-5-(2'-гидрокси-3'-пиперидинопро- покси)- 6-метилурацилу (Е), проявляющих иммунотропную и противовоспалительную активность.
Название соединения, номер государственной регистрации даны в табл. 1.
Указанные соединения, их свойства в литературе не описаны.
Аналогом по строению и назначению выбран оксиметилурацил, формулы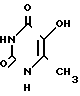 синтез и свойства которого описаны в литературе [1-4] Оксиметилурацил является более активным иммуностимулятором, чем метилурацил, поэтому взят в качестве эталона.
синтез и свойства которого описаны в литературе [1-4] Оксиметилурацил является более активным иммуностимулятором, чем метилурацил, поэтому взят в качестве эталона.
Недостаток оксиметилурацила в том, что он очень плохо растворим в воде (0,1%).
Предлагаемые пиримидиновые ациклонуклеозиды имеют растворимость 5-33% что превышает растворимость ОМУ в 50-330 раза и способствует более выраженной биодоступности.
Изысканы новые соединения пиримидиновые ациклонуклеозиды более эффективные в части проявления иммунотропной и противовоспалительной активности и биодоступности.
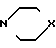
Синтез соединений ведут из 6-метилурацила (1а) или 5-гидрокси-6-метилурацила (1б) путем взаимодействия с эпихлоргидрином (II) в присутствии каталитического количества поташа в растворе ДМФА при 70-80оС по методам [5-10] с последующей обработкой полученных 1,3-бис(2'-гидрокси-3'-хлорпропил)-6-метилурацила (IIIа); 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилурацила (IIIб); 1,3-бис-(2'-гидрокси-3'-хлорпропил)-5-(2'-гидрокси-3'-хлорпропокси)-6- метилурацила (IIIв) морфолином или пиперидином при 120-150оС по методу [II]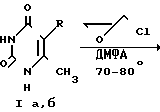
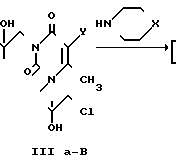
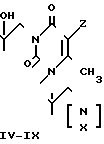
I R=H(Ia), OH (Iб);
III y H(III a), OH (III б), 
 Cl (III в)
Cl (III в)
IV X= 0, Z=H; V X CH2, Z=H;
VI X=0, Z= OH; VII X=CH2, Z=OH;
VIII X O, Z O
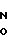
 IX X CH2, Z O
IX X CH2, Z O
Исследования иммунотропной активности проводили на белых беспородных мышах массой 18-20 г, полученных из питомника лабораторных животных "Рапполово" АМН СССР.
Острая токсичность определялась на беспородных мышах обоего пола при однократном внутрибрюшинном введении. Параметры токсичности вычислялись по методу Кербера. Вводились дозы от 50 до 1600 мг/кг. После введения токсических доз через 5-10 мин у животных наблюдалась вялость, вытягивание конечностей, снижение подвижности. Смерть наступала от остановки дыхания. LD50 при внутрибрюшинном введении дано в табл. 1. Из табл. 1 видно, что острая токсичность данных соединений колеблется от 175 до 1500 мг/кг [12-14]
Влияние соединений на иммунную систему изучали на моделях гиперчувствительности замедленного типа (ГЗТ) и первичного иммунного ответа к эритроцитам барана (ЭБ): определение количества антителообразующих клеток селезенки мышей (АОК).
Влияние соединений на гуморальное звено иммунного ответа определяли по методу N. K. Jerne, A. A. Nordin 1963 [15] в модификации A.J. Cunningham (1965) [16]
Гиперчувствительность замедленного типа (ГЗТ) к 2,4-динитрофторбензолу (ДНФБ) воспроизводят сенсибилизацией животных нанесением на кожу живота 25 мкл 0,5% -ного раствора ДНФБ в смеси ацетона с оливковым маслом 4:1 [13-14] Через 4 сут. после сенсибилизации на интактные уши мышей наносят по 20 мкл 0,25% -ного раствора ДНФБ. Реакцию оценивают по отеку уха через 24 ч после нанесения разрешающей дозы ДНФБ. Соединения вводили в дозе 1/10 LD50 в течение 4-х сут, начиная с первого дня после сенсибилизации. Структурный аналог соединения оксиметилурацил вводили в дозе 50 мг/кг по той же схеме. Полученные данные сведены в табл. 2.
На модели ГЗТ к динитрофторбензолу соединения 49-91-2; 36-2-2; 50-91-2 в дозе 1/10 LD50 показали иммуносупрессивную активность. Но их эффект аналогичен оксиметилурацилу. Остальные соединения были не активны.
Влияние аналогов ациклонуклеозидов на первичный иммунный ответ изучали на белых беспородных мышах массой 18-20 г. Животных иммунизировали 5%-ной взвесью эритроцитов барана по 0,5 мл внутрибрюшинно. На пятые сутки определяли число АОК в селезенке. Полученные результаты даны в табл. 3.
В качестве референс-препарата использовали оксиметилурацил. Исследуемые вещества вводили животным peros (через рот) четырехкратно, начиная вводить одновременно с иммунизацией в 1/10 LD50.
Соединение 50-91-2 достоверно стимулирует продукцию антителообразующих клеток, причем его эффект более выражен, чем при введении ОМУ.
Таким образом, ряд новых аналогов ациклонуклеозидов обладает иммунотропными свойствами.
Противовоспалительное действие аналогов ациклонуклеозидов
Противовоспалительное действие аналогов ациклонуклеозидов и оксиметилурацила изучалось на двух моделях воспаления, вызванных каррагенином и формалином. Противовоспалительное действие данных соединений сравнивали с эффектом ортофена высокоэффективного и широко применяемого антифлогистика.
Изучаемые соединения на модели воспаления, вызванного инъекцией в апоневроз стопы 1%-ного раствора каррагенина в дозе 0,05 мл, вводились в желудок в дозах 1/10 и 1/30 LD50 за 1 ч до воспроизведения воспаления и через 1 и 2 ч после введения флогогена. О противовоспалительном действии изучаемых соединений судили по проценту увеличения отека по сравнению со здоровой лапкой и контролем (для опытов брали 6 животных).
Полученные данные сведены в табл. 4.
На данной модели воспаления все изучаемые соединения в указанных дозах статистически значимо задерживают развитие воспалительного отека (р<0,05 0,015 по сравнению с контролем).
Соединение 37-91-2 задерживает развитие воспалительного отека аналогично ортофену.
На модели каррагенинового воспаления была вычислена средняя эффективная доза (ED50) для активного соединения по Литчфильду и Уилкоксону [17]
Соединение 37-91-2 вводили животным в желудок в дозах 20, 10 и 5 мг/кг. В указанных дозах данное соединение оказывает выраженное противовоспалительное действие, причем в дозе 10 мг/кг эффект аналогичен эффекту ортофена. ED50 соединения N 37-91-2 составляет ED50=18(13-24,8) мг/кг.
В следующих сериях изучалось действие данных соединений, взятых в равных дозах, за исключением соединения 37, взятого в дозе ED50, на воспаление, вызванное каррагенином и формалином. В качестве препарата сравнения использовался оксиметилурацил (ОМУ) (для опытов взято 6 животных). Результаты исследований приведены в табл. 5.
Все изучаемые соединения на моделях воспаления, вызванного каррагенином, оказывают статистически значимое противовоспалительное действие. Соединения 49-91-2 и 57-91-2 оказывают противовоспалительное действие аналогично эффекту оксиметилурацила и ортофена.
На моделях воспаления, вызванного формалином (соединение 37-91-2) в дозах, указанных в таблице 5, задерживает развитие воспалительного отека аналогично оксиметилурацилу и ортофену.
Таким образом, соединения-аналоги ациклонуклеозидов являются умеренно опасными соединениями, проявляющими выраженное противовоспалительное и иммунотропное действие (на модели ГЗТ) и стимулирующее антителогенез.
П р и м е р 1. 1,3-Бис(2'-гидрокси-3'-хлорпропил)-6-метилурацил
В трехгорлую колбу емкостью 3000 мл, снабженную механической мешалкой, обратным холодильником, термометром, загружают 252 г (2 моль) 6-метилурацила, приливают 1,9 л ДМФА и 214,2 г (2,27 моль) ЭХГ и 30 г (0,22 моль) К2СО3. Реакционную смесь нагревают на водяной бане при 70-80оС в течение 20 ч. Нерастворившиеся кристаллы отфильтровывают и получают 126,4 г (≈ 50%). Полученные кристаллы перекристаллизовывают из кипящей воды и фильтруют горячий раствор через шоттовскую воронку. При охлаждении из маточника выпадают кристаллы, их отфильтровывают, а воду из маточника отгоняют и получают 20 г (8%) кристаллов с т.пл. 239-240оС, представляющих собой 1(2'-гидрокси-3'-хлорпропил)-6-метилурацил с примесью хлористого калия. Rf=0,25.
Найдено, С 24,94; Н 2,94; N 7,46; Cl 24,80; зола 56,39.
Вычислено для С8Н11N2O3Cl ˙2 KCl С 26,13; Н 3,01; N 7,62; О 13,05; Cl 28,92; К 21,26. М.в. 367,7433, зола КСl 50,18.
ИК-спектр (δ см-1): 560, 616, 690 (VССl); 1248, 1288 (  ); 1624; 1656 (
); 1624; 1656 (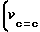 , νc=o,
, νc=o,  N-C O) 1100, 1200 (νок,νс=о); 2420; 2444 (
N-C O) 1100, 1200 (νок,νс=о); 2420; 2444 (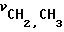 )); 3200 (ОН).
)); 3200 (ОН).
ЯМР1Н ( δ, м.д. D2О): 2,57 (с, 3Н, С6-СН3); 3,17 (с, 1Н, С2'-Н); 4,14 (с, 1Н, С2'-ОН); 4,25 (д, 2Н, СН2Cl); 4,53 (с, 2Н, С1); 5,52 (с, 1Н, N, H); 6,29 (с, 1Н, С5-Н).
ЯМР13С (δ, м. д. D2O): 178,22 (С4=0); 164,09 (С2=0); 154,63 (С6-СН3); 108,06 (С5); 82,17 (С1'); 64,01 (С2'); 48,65 (С3'); 19,63 (CH3-C6).
Наличие метильной группы в положении 6 пиримидинового цикла значительно снижало скорость N(1)-алкилирования, что вероятно, может быть обусловлено стерическими факторами. По этой причине в ходе реакции образуются как моно-, так и дизамещенные 6-метилурацилы.
Из маточника реакционной смеси отгоняют в вакууме масляного насоса ДМФ, выпавшие кристаллы отфильтровывают и получают 340 г (54,6%) жидкости темно-коричневого цвета, представляющего собой 1,3-бис(2'-гидрокси-3'-хлорпропил)-6-мети- лурацила.
Найдено, С 36,15; Н 6,33; N 8,09; Сl 18,56.
Вычислено для С11Н16N2Cl2O4, С 42,46; Н 5,18; N 9,00; О 20,57; Сl 22,79.
Вещество содержит 3 молекулы воды.
Вычислено для С11Н16N2Cl2O4 ˙3H2O, С 36,18; Н 6,07; N 7,67; Сl 19,41; О 30,67.
П р и м е р 2. 1,3-Бис(2'-гидрокси-3-морфолинопропил)-6-метилурацил (IV)
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, термометром, помещают 33,0 г (0,15 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-6-метилурацила, приливают 360 мл морфолина, реакционную смесь нагревают до 120оС (температура бани 130-150оС) и перемешивают при этой температуре 7 ч и оставляют на ночь. На следующий день из реакционной смеси отгоняют избыток морфолина, охлаждают, вливают 22 мл воды для растворения кристаллов, экстрагируют хлороформом (3х100 мл), хлороформ отгоняют, остаток растворителя подтягивают вакуум-насосом при 100о/5 мм рт. ст. и получают 38 г (61,42%) 1,3-бис(2'-гидрокси-3'-морфолинопропил)-6-метилурацила в виде густой непереливающейся жидкости.
Найдено, С 48,79; Н 7,30; N 13,09
Вычислено для С19Н32N4О6, С 55,32; Н 7,82; N 13,58; О 23,27
Вычислено для С19Н32N4O6 ˙3H2O, С 48,92; Н 8,21; N 12,00; О 30,87. М.в. 466,5402.
Хорошо растворим в воде (33%), хлороформе, бензоле, спирте, ацетоне, нерастворим в гексане.
ИК-спектр (ν, см-1): 790, 840, 880, 940, 960, 1020, 1040, 1060, 1080, 1120, 1160, 1200; 1220, 1240, 1280, 1300, 1370, 1410, 1460, 1620, 1660, 1710, 2830, 2870, 2940, 2970, 3400 (Н2О).
ЯМР 1Н (δ, м.д. СDCl3): 2,36 (м, 3Н, С6-СН3); 2,4-2,65 (м, 8Н, O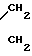 ); 3,40-3,56 (м, 8Н, N
); 3,40-3,56 (м, 8Н, N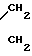 ); 3,6-3,8 (м, 10Н, CH2-
); 3,6-3,8 (м, 10Н, CH2-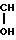 -CH2); 4,0-4,15 (м, 2Н, С2'-OH); 8,046 (с, 1Н, С5-Н).
-CH2); 4,0-4,15 (м, 2Н, С2'-OH); 8,046 (с, 1Н, С5-Н).
П р и м е р 3. 1,3-Бис(2'-гидрокси-3'-пиперидинопропил)-6-метилурацил (V)
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, термометром, помещают 33,0 г (0,15 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-6-метилурацила, приливают при охлаждении холодной водой 350 мл пиперидина, охлаждение убирают и нагревают реакционную смесь на масляной бане до температуры бани 100-130оС (температура реакционной смеси 88-90оС) и при этой температуре перемешивают 7 ч, охлаждают, отфильтровывают выпавшие кристаллы, промывают свежим пиперидином, соединяют с основным маточником, из маточника отгоняют избыток пиперидина при 80оС/120 мм рт. ст. на роторном испарителе UP-1М, остаток охлаждают, обрабатывают водой (20 мл), экстрагируют хлороформом (100 млх2), хлороформный экстракт промывают водой (20 мл), отгоняют хлороформ на роторном испарителе UP-1М в вакууме водоструйного насоса и получают 36,4 г (59,4%) 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-6-метилурацил в виде непереливающейся жидкости, nD20 1,5250.
Найдено, С 56,88; Н 8,55; N 12,63.
Вычислено для С21Н36N4О4 C 61,74; Н 8,88; N 13,71; О 15,62; М.в. 408,5422.
Вычислено для С21Н36N4О4 ˙2Н2О С 56,74; Н 9,07; N 12,60; О 21,59; М.в. 444,5738.
ИК-спектр (ν см-1): 790, 810, 830, 880, 920, 980, 1010, 1050, 1105, 1144, 1170, 1230, 1250, 1270, 1290, 1310, 1340, 1360, 1380, 1405, 1450, 1560, 1580, 1670, 1715, 2820, 2860, 2960, 3400.
Хорошо растворим в воде (6%), в спирте, ацетоне, хлороформе, бензоле, нерастворим в гексане.
ЯМР 1Н (δ, м.д. СDCl3): 1,4-1,75 (м, 12Н4д,2е); 2,266 (м, 3Н, С6-СН3); 2,3-2,6 (м, 8Н4г); 3,29 (т, J=5,60, 4Н2а); 3,48 (т, J=5,66, 2Н2б); 3,7-3,95 (м, 4Н2в); 3,95-4,15 (м, 2Н2б ОН); 8,0 (с, 1Н, С5-Н).
П р и м е р 4. 1,3-Бис(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилурацил
В трехгорлую колбу емкостью 3000 мл, снабженную механической мешалкой, обратным холодильником, термометром, загружают 163,4 г (1,15 моль) 5-гидрокси-6-метилурацила, приливают 1000 мл ДМФА и 289,0 г (3,12 моль) эпихлоргидрина, а затем присыпают 8,0 г прокаленного К2СО3. Реакционную смесь нагревают на водяной бане до 60-70оС и перемешивают при этой температуре 20 ч, охлаждают, нерастворившиеся кристаллы 5-гидрокси-6-метилурацила отфильтровывают, промывают ацетоном и получают 95,0 г (0,67 моль). От маточного раствора отгоняют ДМФА в вакууме масляного насоса на роторном испарителе, остаток обрабатывают смесью толуол-спирт 4:1 (1,25 л х 3), после отгонки растворителей получают 1,86,0 г остатка, который растворяют в 2 л спирта. Выпавшие кристаллы отфильтровывают, промывают ацетоном и получают 20 г (17% ) 1-(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилурацила с т.пл. 238-240оС, хорошо растворимого в ДМФА и нерастворимого в спирте, бензоле.
Найдено, С 40,99; Н 4,78; N 11,83; Cl 15,24.
Вычислено для С8Н11N2О4Сl С 40,95; Н 4,73; N 11,94; Cl 15,11; О 27,28; м.в. 234,6413.
ИК-спектр (ν, см-1): 504, 600, 760, 852, 1092, 1208, 1252, 1328, 1376, 1400, 1464, 1608, 1716, 2880, 2928, 3072, 3352, 3552.
ЯМР 1Н ( δ, м.д. СDCl3): 1,76 (пентил, м, 3Н, С5ОН, С2'Н, С2'-ОН), 2,15 (с, 3Н, С6-СН3); 2,9 (т, J=7,9; 2Н, С1'); 4,25 (с, 2Н, С3').
После отгонки спирта получают 120 г (76%) от прореагировавшего 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилу- рацила в виде густой светло-желтой жидкости, которая при стоянии кристаллизуется.
Найдено, С 39,81; Н 5,33; N 8,23; Сl 21,00.
Вычислено для С11Н16N2Cl2O5 С 40,38; Н 4,93; N 8,56; Сl 21, 67; О 24,45.
ИК-спектр (ν, см-1): 768, 976, 1100, 1168, 1208, 1252, 1302, 1380, 1448, 1544, 1632, 1640, 2928, 2960, 3344, 3360.
1240-1300 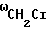 ; 1100 см-1 насыщенные спирты с неразветвленной цепью, 1380 см-1 (
; 1100 см-1 насыщенные спирты с неразветвленной цепью, 1380 см-1 ( 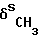 ): 1640, 1632 (С= О,
): 1640, 1632 (С= О,  N-C O ); 3630 (νOH).
N-C O ); 3630 (νOH).
ЯМР 1Н ( δ, м.д. СDCl3): 2,32 (с, 3Н, С6-СН3); 2,84 (с, 2Н, С1'-Н); 2,93 (с, 2Н, С1'-Н); 3,56-3,67 (м, 4Н, С2-ОН, С2'-Н); 4,0 (т, J=5,3; 4Н, С3-Н); 7,89 (с, 1Н, С5-ОН). Остаток в колбе после обработки смесью толуол-спирт растворяют в ДМФА, добавляют воду, выпавшие кристаллы отфильтровывают и получают 14,4 г
П р и м е р 5. 1,3-Бис(2'-гидрокси-3'-пиперидинопропил)-5-гидрокси-6-метилура-цил (VII)
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, загружают 17,0 г (0,052 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилурацила, приливают 150 мл пиперидина. Реакционную смесь нагревают на масляной бане до температуры бани 150оС и при этой температуре перемешивают 5 ч, охлаждают, вливают 55 мл воды, экстрагируют бензолом (4х200 мл), бензольный экстракт промывают водой (10 мл), бензол отгоняют в вакууме водоструйного насоса и получают 19,5 г (87,52%) 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-5-гидрок-си-6-метилурацила в виде густой непереливающейся жидкости, хорошо растворимой в воде (11%), бензоле, хлороформе, нерастворимой в гексане.
Найдено, С 59,60; Н 8,37; N 12,90
Вычислено для С21Н36N4O5 С 59,41; Н 8,55; N 13,20; О 18,84; м.в. 424,5422.
ИК спектр ( ν, см-1): 670, 800, 880, 920, 960, 980, 1010, 1050, 1130, 1170, 1230, 1280, 1320, 1450, 1660, 1710, 2820, 2870, 2950, 3420.
1010-1230 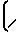 N-
N-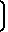 ; 1380 (
; 1380 (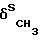 ); 1660 (VC=O,
); 1660 (VC=O,  N-C=0); 2870, 2950 (Vс=с, VOHa); 3420 (OH).
N-C=0); 2870, 2950 (Vс=с, VOHa); 3420 (OH).
ЯМР 1Н (δ м.д. СDCl3): 1,34-1,51 (м, 12Н 4g,2е); 2,17 (м, 3Н, С6-СН3); 2,2-2,56 (м, 8Н42); 3,19 (т, J=5,4, 4Н2а); 3,36 (м, 2Н2б); 3,65-3,8 (м, 4Н2в); 4,13 (уш. с, 1Н; С2'ОН); 7,88 (с, 1Н, С5-ОН).
П р и м е р 6. 1,3-Бис(2'-гидрокси-3'-морфолинопропил)-5-гидрокси-6-метилурацил (VI)
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, загружают 17,2 г (0,0526 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-гидрокси-6-метилурацила, приливают 140 мл морфолина и реакционную смесь нагревают до кипения (температура масляной бани 152оС), кипятят 7 ч и оставляют на ночь. На следующий день выпавшие кристаллы отфильтровывают на шоттовской воронке (18,7 г), промывают свежим морфолином, соединяют с маточником, из маточного раствора отгоняют морфолин в вакууме водоструйного насоса на роторном испарителе UP-1М при температуре бани 90о/100 мм рт.ст. и получают 27,0 г густой непереливающейся жидкости, вливают в нее 30 мл воды, экстрагируют бензолом (3х100 мл) и хлороформом (3х150 мл), экстракты объединяют, растворитель отгоняют в вакууме водоструйного насоса, а остаток подтягивают в вакууме масляного насоса и получают 20,7 г (93%) 1,3-бис-(2'-гидрокси-3'-морфолинопропил)-5-гидрокси-6-метилурацила в виде густой непереливающейся жидкости, хорошо растворимой в воде (18%), спирте, ацетоне, бензоле, хлороформе, нерастворимой в гексане.
Найдено, C 51,55; Н 7,86; N 17,76.
Вычислено для С19Н32N4О7 С 53,26; Н 7,53; N 13,08; О 26,14; м.в. 428,4886.
Вычислено для С19Н32N4О7 ˙Н2О С 51,11; Н 7,67; N 12,55; О 28,67; м.в. 446,5044.
ИК-спектр (ν, см-1): 680, 790, 825, 880, 930, 960, 1020, 1080, 1130, 1160, 1250, 1290, 1380, 1450, 1470, 1640, 1660, 1715, 2840, 2870, 2940, 3460 [1020-1250 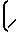 N-
N-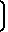 ; 1075-1080, 1120 (Vс-о-са); 1380 (
; 1075-1080, 1120 (Vс-о-са); 1380 (  ); 1640, 1660 (Vс=0,
); 1640, 1660 (Vс=0,  N-C=O); 2870, 2940 (Vс=с, Vca); 3460 (Н2О).
N-C=O); 2870, 2940 (Vс=с, Vca); 3460 (Н2О).
ЯМР 1Н (δ, м.д. СDCl3): 2,04 (д, 3Н, С6-СН3); 2,05-2,30 (м, 8Н4д); 3,10 (т, J=5,0; 4Н2а); 3,25 (т, J=5,0; 2Н2б); 3,3-3,45 (м, 12Н4r,2в); 3,9 (уш.с. 2Н2б, ОН); 7,71 (с, 1Н, С5-ОН).
П р и м е р 7. 1,3-Бис(2'-гидрокси-3'-хлорпропил)-5-(2'-гидрокси-3'-хлорпропок-си)-6- метилурацил
В трехгорлую колбу емкостью 3000 мл, снабженную механической мешалкой, обратным холодильником с х/к трубкой, термометром, загружают 284,2 г (2 моль) 5-гидрокси-6-метилурацила, приливают 1900 мл ДМФА, засыпают 20,0 г К2СО3 и приливают 463 г (5 моль) эпихлоргидрина. Реакционную смесь нагревают до 50оС, перемешивают при этой температуре 8 ч, оставляют на ночь. На следующий день реакционную смесь перемешивают при 60-70оС 16 ч и оставляют на ночь. Нерастворившиеся кристаллы отфильтровывают на шоттовской воронке, промывают спиртом и получают 60 г (21%) исходного вещества. Из маточного раствора отгоняют ДМФА в вакууме масляного насоса, остаток обрабатывают 1,25 л смесью бензол-спирт (4: 1), кристаллы отфильтровывают, маточник пропускают через колонку с SiO2 (100 г), собирают 2,3,4,5 фракций после отгонки растворителей и еще 6-9 фракций после отгонки растворителей, получают 255,6 г (82,53%), представляющего собой 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-(2'-гидро- кси-3'-хлорпропокси)-6- метилурацил в виде густой светло-желтой жидкости. По данным ТСХ продукт имеет одно пятно Rf=0,71, хорошо растворим в воде, ТСХ, растворитель вода, элюент-спирт-аммиак 4:1, проявитель УФ свет.
Найдено, С 31,48; Н 6,00; N 6,07; Сl 24,92.
Вычислено для С14Н21N2O6Cl3 C 40,07; Н 5,04; N 6,67; О 22,87; Cl 25,34.
Продукт имеет 6 молекул воды.
Вычислено для С14Н21N2O6Cl3 ˙6Н2О С 31,86; Н 6,30; 5,31; О 36,38; Сl 20.15; м.в. 527,7871.
ИК спектр (ν, см-1): 780, 850, 910, 1040, 1080, 1120, 1180, 1270, 1320, 1400, 1450, 1660, 1800, 2945, 2980, 3360.
П р и м е р 8. 1,3-Бис(2'-гидрокси-3'-пиперидинопропил)-5-(2'-гидрокси-3'- пиперидинопропокси)-6-метилурацил (IX)
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, загружают 26,4 г (0,05 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-(2'-гидрокси-3'-хлорпропокси)-6- метилурацила, приливают 300 мл (258,66 г или 3,04 моль) пиперидина. Реакционную смесь нагревают в течение 2 ч до температуры бани 130-140оС (температура реакционной смеси 100-103оС) и перемешивают при этой температуре 7 ч, оставляют на ночь. На следующий день отфильтровывают выпавшие кристаллы на шоттовской воронке, промывают их свежим пиперидином, соединяют с маточным раствором, отгоняют на роторном испарителе UP-1М в вакууме водоструйного насоса избыток пиперидина, промывают 20 мл воды, экстрагируют хлороформом (3х100 мл). После отгонки хлороформа получают 37,0 г. Полученный продукт растворяют в 200 мл хлороформа, заливают в колонку с окисью алюминия 2-ой степени активности и вымывают хлороформом и получают после отгонки хлороформа 25 г (88,4%) 1,3-бис(2'-гидрокси-3'-пиперидинопропил)-5-(2'-гидрокси-3'- пиперидинопропокси)-6-метилурацил в виде густой жидкости светло-желтого цвета, хорошо растворимой в хлороформе, бензоле, спирте, эфире, хуже в воде (5%), нерастворимой в гексане.
Найдено, С 61,40; Н 9,00; N 12,40; м.в. 565,7554.
Вычислено для С29Н51N5О6 C 61,57; Н 9,09; N 12,38; О 16,97.
ИК-спектр (ν, см-1): 800, 880, 1020, 1060, 1080, 1110, 1140, 1170, 1230, 1250, 1280, 1320, 1340, 1380, 1400, 1460, 1660, 1710, 2820, 2870, 2950, 3440.
ЯМР 1Н (δ, м.д. CDCl3): 1,12-1,5 м (18Н6б,3в); 2,014 (д, 3Н, С6-СН3); 2,1-2,38 (м, 12Н6а); 3,095 (т, J=5,4; 6Н2C1'); 3,15-3,30 (м, 3Н, С2'-Н); 3,62 (сикст. J=5,39; 6Н3C3); 4,06 (м, 3Н, С2'-OH).
П р и м е р 9. 1,3-Бис(2'-гидрокси-3'-морфолинопропил)-5-(2'-гидрокси-3'- морфолинопропокси)-6-метилурацил (VIII).
В трехгорлую колбу емкостью 500 мл, снабженную механической мешалкой, обратным холодильником, термометром, загружают 26,4 г (0,05 моль) 1,3-бис(2'-гидрокси-3'-хлорпропил)-5-(2'-гидрокси-3'-хлор-пропокси)-6- метилурацила, приливают 300 мл (300 г или 3,44 моль) морфолина и реакционную смесь нагревают в течение 2 ч до температуры бани 160-170оС (температура реакционной смеси до 125оС), перемешивают при этой температуре 7 ч и оставляют на ночь. На следующий день отфильтровывают выпавшие кристаллы, промывают свежим морфолином (2х30 мл), соединяют с маточным раствором, промывают водой (1х25 мл), экстрагируют хлороформом (3х100 мл), хлороформ отгоняют в вакууме водоструйного насоса, а избыток морфолина и воду в вакууме масляного насоса на испарителе UP-1М при 90о/10-30 мм рт.ст. и получают 35,7 г светло-коричневой жидкости, которую растворяют в 200 мл хлороформа и пропускают через колонку с Аl2О3 II-ой степени активности, вымывая хлороформом, и получают 27 г (94,5% ) 1,3-бис(2'-гидрокси-3'-морфолинопропил)-5-(2'-гидрокси-3'- морфолинопропокси)-6-метилурацила, хорошо растворимого в хлороформе, бензоле, спирте, ацетоне, эфире, в воде (26%) и нерастворимого в гексане.
Найдено, С 54,51; Н 8,01; N 12,41; м.в. 571,675.
Вычислено для С26Н45N5О9, С 54,63; Н 7,93; N 12,25; О 25,19.
ИК-спектр (ν, см-1): 780, 820, 880, 940, 960, 1020, 1080, 1140, 1200, 1250, 1280, 1320, 1380, 1460, 1540, 1670, 1730, 2830, 2880, 2940, 2980, 3460.
ЯМР 1Н (δ м.д. СDCl3): 2,17 (д, J=6,7; 3Н, С6-СН3); 2,23-2,5 (м, 12Н6б); 3,2-3,5 (м, 12Н6а); 3,5-3,6 (м, 13Н2с, 3С2'-Н; 3С3'); 3,75 (пентил, J=6,2; 3Н, 3С2'-ОН); 7,90 (с, 2Н, С5-О-СН2)
П р и м е р 10. В качестве модели клеточного иммунитета использовали реакцию гиперчувствительности замедленного типа (ГЗТ) у беспородных мышей. Реакцию ГЗТ воспроизводили обычным способом, сенсибилизируя мышей нанесением на выстриженный живот 25 мкл 0,5% -ного раствора 2,4-динитрофторбензола (ДНФБ) в смеси ацетона с оливковым маслом (4:1).
Разрешающую дозу (20 мкл 0,25%-ного раствора ДНФБ) наносили на 4-е сутки после сенсибилизации на интактные уши мышей. Соединения вводили внутрибрюшинно в дозе 1/10 LD50 с + 1 по + 4 день. Всего 4 введения. Аналог по назначению оксиметилурацил вводили по той же схеме в дозе 50 мг/кг. Полученные данные сведены в табл. 2.
П р и м е р 11. В качестве модели первичного иммунного ответа использовали метод локального гемолиза в геле N.K. Jerne, A.A. Nordin (1963) [15] в модификации А.J. Сunningham (1965) [16]
Беспородных мышей иммунизировали внутрибрюшинным введением нормиммунной дозы (2х108) эритроцитов барана за 4 полных суток до эксперимента. Количество антителообразующих клеток (АОК) определяли по числу зон гемолиза в камерах. Проводили пересчет АОК на 106 спленоцитов. Полученные данные сведены в табл. 3.
В качестве референс-препарата использовали оксиметилурацил. Исследуемые вещества вводили животным peros четырехкратно, начиная вводить одновременно с иммунизацией в 1/10 LD50.
П р и м е р 12. Изучение острой токсичности соединений
Острая токсичность данных соединений изучалась на белых беспородных мышах обоего пола при однократном внутрибрюшинном способе введения.
Параметры токсичности вычислялись по методу Кербера на десятый день наблюдения. Величины приведены в табл. 1.
П р и м е р 13. Изучение противовоспалительной активности соединений на каррагениновой модели воспаления
Противовоспалительная активность соединений изучена у мышей по 6 в группе на модели острого отека, вызванного введением 0,05 мл 1%-ного водного раствора каррагенина субилантарно в заднюю лапку, за исходную величину принималась масса второй (здоровой) лапки.
Изученные соединения вводились также животным в желудок через зонд в дозах 1/10 и 1/30 от LD50 за 1 ч до воспроизведения воспаления и через 1 и 2 ч после введения флогогена. О противовоспалительном действии изучаемых соединений судили по проценту увеличения отека по сравнению со здоровой лапкой и контролем.
На данной модели воспаления все изученные соединения в указанных дозах статистически значимо задерживало нарастание воспалительного отека во все сроки измерения. Результаты онкометрического измерения представлены в табл. 4.
П р и м е р 14. Измерение ED50 для соединения 37
Соединение 37, как наиболее активное, вводили животным в желудок в дозах 20, 10, 5 мг/кг. В указанных дозах данное соединение оказывает выраженное противовоспалительное действие. Данное соединение в дозе 10 мг/кг оказывает противовоспалительное действие аналогично эффекту ортофена. ЕD50 для этого соединения составляет 18 (13-24,8) мг/кг.
П р и м е р 15. Аналогичен примеру 13 за исключением того, что данные соединения брались в равных дозах, кроме соединения 37, которое брали в дозе ЕD50, на воспаление, вызванное каррагенином. Результаты даны в табл. 5. Все изучаемые соединения на моделях воспаления, вызванного каррагенином в дозах 50 мг/кг (соединение 37 18 мг/кг), оказывают статистически значимое противовоспалительное действие. Соединения 49 и 57 оказывают противовоспалительное действие аналогично эффекту оксиметилурацила и ортофена.
П р и м е р 16. Изучение противовоспалительной активности соединений на формалиновой модели воспаления
Опыты проводились на мышах (по 6 в группе). Все соединения вводились в дозах 50 мг/кг животным за исключением соединения 37, которое вводилось 18 мг/кг, в желудок через зонд за 2 ч до введения флогогена и через 1 и 2 ч после него. Острое воспаление задних лапок мышей воспроизводилось субилантарной инъекцией 0,1 мл 2%-ного водного раствора формалина.
Измерение объема лапок проводилось онкометрически через 6 ч и 1 сут после воспроизведения воспаления. За исходную величину принимался объем лапки до введения флогогена.
На моделях воспаления, вызванного формалином, данные соединения в дозах, указанных в табл. 5, задерживают развитие воспалительного отека аналогично оксиметилурацилу и ортофену.
Таким образом, соединения аналогичен ациклонуклеозидов являются умеренно опасными соединениями, проявляющими выраженное противовоспалительное, имуносупрессивное (на модели ГЗТ) и иммунотропное действия.
| название | год | авторы | номер документа |
|---|---|---|---|
| 1,3-(2,6-ДИГИДРОКСИ-4-ТИАГЕПТАМЕТИЛЕН)-6-МЕТИЛУРАЦИЛ, ПРОЯВЛЯЮЩИЙ ИММУНОТРОПНУЮ, ПРОТИВОВОСПАЛИТЕЛЬНУЮ АКТИВНОСТЬ | 1992 |
|
RU2034839C1 |
| 1,3-БИС(ИЗОБУТИЛТИОЭТИЛ)-5-ИЗОБУТИЛТИОЭТИЛОКСИ-6-МЕТИЛ-УРАЦИЛ, ПРОЯВЛЯЮЩИЙ ИММУНОТРОПНУЮ АКТИВНОСТЬ | 1991 |
|
RU2027710C1 |
| 1,3-БИС(ИЗОБУТИЛТИОЭТИЛ)-5-ГИДРОКСИ-6-МЕТИЛУРАЦИЛ, ОБЛАДАЮЩИЙ ИММУНОТРОПНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2028296C1 |
| 1,3- ДИ(3-ПИПЕРИДИНО-2-ГИДРОКСИПРОПИЛ)-6-МЕТИЛУРАЦИЛ ДЛЯ ПОВЫШЕНИЯ СОХРАННОСТИ И ПРОДУКТИВНОСТИ ПТИЦ | 2006 |
|
RU2334745C1 |
| [2,4-ДИОКСО -1,3- БИС (5-МЕТИЛ -3-ТИАГЕКСИЛ) -6-МЕТИЛ-1,2,3,4- ТЕТРАГИДРОПИРИМИДИН-S,S] ЦИC-ДИXЛOPПЛATИHA , ПPOЯBЛЯЮЩAЯ ИMMУHOTPOПHУЮ AKTИBHOCTЬ | 1991 |
|
RU2028300C1 |
| БИС[2,4-ДИОКСО-6-МЕТИЛ-1,2,3,4 -ТЕТРАГИДРОПИРИМИДИН-3-(5-МЕТИЛ-3- ТИАГЕКСИЛ)-S]ЦИС-ДИХЛОРПЛАТИНА, ПРОЯВЛЯЮЩАЯ ИММУНОТРОПНУЮ АКТИВНОСТЬ | 1991 |
|
RU2035467C1 |
| 1,3-БИС(ИЗОБУТИЛТИОЭТИЛ)-6-МЕТИЛУРАЦИЛ, ПРОЯВЛЯЮЩИЙ ИММУНОТРОПНУЮ АКТИВНОСТЬ | 1991 |
|
RU2028295C1 |
| АМИД β -ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ С ФЕНИЛБОРОНОВОЙ КИСЛОТОЙ, ПРОЯВЛЯЮЩИЙ ПРОТИВОВОСПАЛИТЕЛЬНУЮ И ПРОТИВОЯЗВЕННУЮ АКТИВНОСТЬ | 1991 |
|
RU2032694C1 |
| 3-ИЗОБУТИЛТИОЭТИЛ-6-МЕТИЛУРАЦИЛ, ОБЛАДАЮЩИЙ ИММУНОТРОПНОЙ АКТИВНОСТЬЮ | 1991 |
|
RU2035456C1 |
| 5-ГИДРОКСИ-3,6-ДИМЕТИЛУРАЦИЛ, ПРОЯВЛЯЮЩИЙ ИММУНОТРОПНУЮ АКТИВНОСТЬ | 1991 |
|
RU2035455C1 |
Использование: в качестве иммунотропных и противовоспалительных средств в медицине. Сущность продукт-пиримидиновые ациклонуклеозиды ф-лы I, в частности 1,3-бис 2′ гидрокси 3′ морфолинопропил)-6-метилурацил (а): 1,3-бис 2′ гидрокси 3′ пиперидинопропил)-6-метилурацил (б): 3-бис 2′ гидрокси 3′ морфолинопопил-5-гидрокси-6-метилурацил (в): 1,3-бис 2′ гидрокси 3′ пиперидинопропил)-5-гидрокси-6-метилурацил (г): 1,3-бис 2′ гидрокси 3′ морфолинопропил)-5- 2′ гидрокси 3′ морфолинопропокси)-6-метилурацил (д) и 1,3-бис 2′ гидрокси 3′ пиперидинопропил)-5- 2′ гидрокси 3′ пиперидинопропокси)-6-метилурацил (е). Выход 54-93% Реагент 1: 6-метилурацил или 5-гидрокси-6-метилурацил. Реагент 2: эпихлоргидрин в присутствии каталитического количества поташа в растворе диметилформамиде. Структура соединения ф-лы I указано в тексте описания. 5 табл.
Пиримидиновые ациклонуклеозиды общей формулы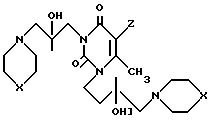
где Х O, СН2;
Z Н, ОН,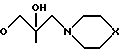
проявляющие иммунотропную и противовоспалительную активность.
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Литчфильд, Уилкоксон и др | |||
| Элементы количественной оценки фармакологического эффекта | |||
| Рига, 1959, с.171. | |||
Авторы
Даты
1995-12-27—Публикация
1992-10-05—Подача