ПРИТЯЗАНИЕ НА ПРИОРИТЕТ
По настоящей заявке испрашивается приоритет по дате подачи предварительной патентной заявки Соединенных Штатов серии № 61/428142, поданной 29 декабря 2010 года, в отношении «Способов определения зиготности в объемной пробе».
УРОВЕНЬ ТЕХНИКИ
Проведение контроля качества в отношении какой-либо примеси в окончательной линии крайне важно для успешной продукции гибридных семян и сохранения и укрепления хороших деловых отношений с покупателями. Загрязнение при всхождении семян окончательной линии может происходить из-за опыления не предусмотренных трансгенных или нетрансгенных растений, выросших вблизи участка продукции, или в процессе обработки семян и, самое важное, примесь может возникать вследствие рассеивания пыльцы стерильных растений. Для достижения полной гомозиготности окончательной линии и освобождения от любых гемизиготных, нулевых или непредусмотренных трансгенных линий на сегодняшний день предлагается способ tester-row. В способе tester-row для оценки статуса зиготности на основе уровней белков отдельного растения используется технология ELISA. Поскольку анализ базируется на основе одного растения, он занимает очень много времени, а также является дорогостоящим. Кроме того, осуществление способа tester-row в полевых условиях создает дополнительные затраты. Способ ELISA используется для определения сайленсинга экспрессии трансгена путем определения уровня белка. Он является нечувствительным и ненадежным для идентификации любой гемизиготной, нулевой или любой другой непредусмотренной примеси в окончательной партии семян. Кроме того, при использовании способа ELISA для испытания на наличие малых примесей необходима раздельная обработка тканей.
ОПИСАНИЕ
Конкретные варианты осуществления изобретения включают способы определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки в нуклеиновой кислоте. Варианты осуществления могут содержать: выделение нуклеиновой кислоты из объемной пробы; приведение нуклеиновой кислоты в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки, и обратным праймером, способным связываться с нуклеиновой кислотой ниже сайта вставки. Праймеры могут быть использованы для репликации нуклеиновых кислот между праймерами. Реплицированные нуклеиновые кислоты могут быть проанализированы для идентификации наличия или отсутствия в объемной пробе вставленной нуклеотидной последовательности.
Варианты осуществления могут содержать: выделение нуклеиновой кислоты из образца; приведение нуклеиновой кислоты в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки, и обратным праймером, способным связываться с нуклеиновой кислотой ниже сайта вставки. Праймеры могут быть использованы для репликации нуклеиновых кислот между праймерами в первой порции и второй порции. Реплицированные нуклеиновые кислоты могут быть проанализированы для идентификации наличия или отсутствия в образце вставленной нуклеотидной последовательности. Вторая реакция, либо объединенная с вышеуказанной реакцией, либо самостоятельная, может быть осуществлена, используя прямой праймер и обратный праймер, эта реакция идентифицирует эндогенный ген или последовательность. Эта вторая реакция может быть использована в качестве внутреннего контроля для определения качества и количества использованных ДНК и/или условий проведения ПЦР.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
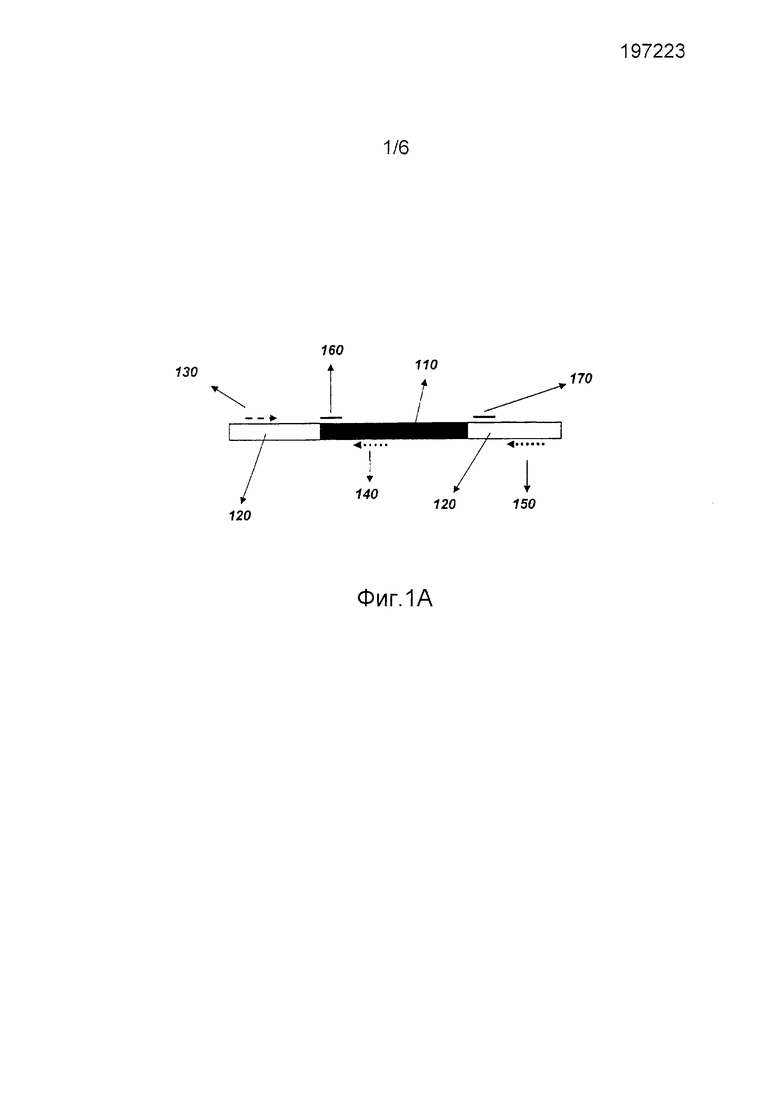
На фиг.1А представлено схематическое изображение компонентов способа определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки согласно варианту осуществления изобретения. На этой фигуре вероятно вставленная нуклеотидная последовательность (110) показана темным блоком, в то время как окружающий геном (120) указан открытыми сегментами. Также показаны прямой праймер (130), первый обратный праймер (140) и второй обратный праймер (150). Дополнительно представлены необязательные специфический зонд вставки (160) и специфический зонд дикого типа (170).
На фиг.1В иллюстрируется модифицированный анализ, который включает создание стандартного протокола определения зиготности в двух отдельных реакциях: реакции 1, включающей общий праймер и специфический праймер дикого типа и специфический зонд дикого типа (FAM); и реакции 2, включающей внутренний контроль (ген инвертазы 1) с зондом VIC.
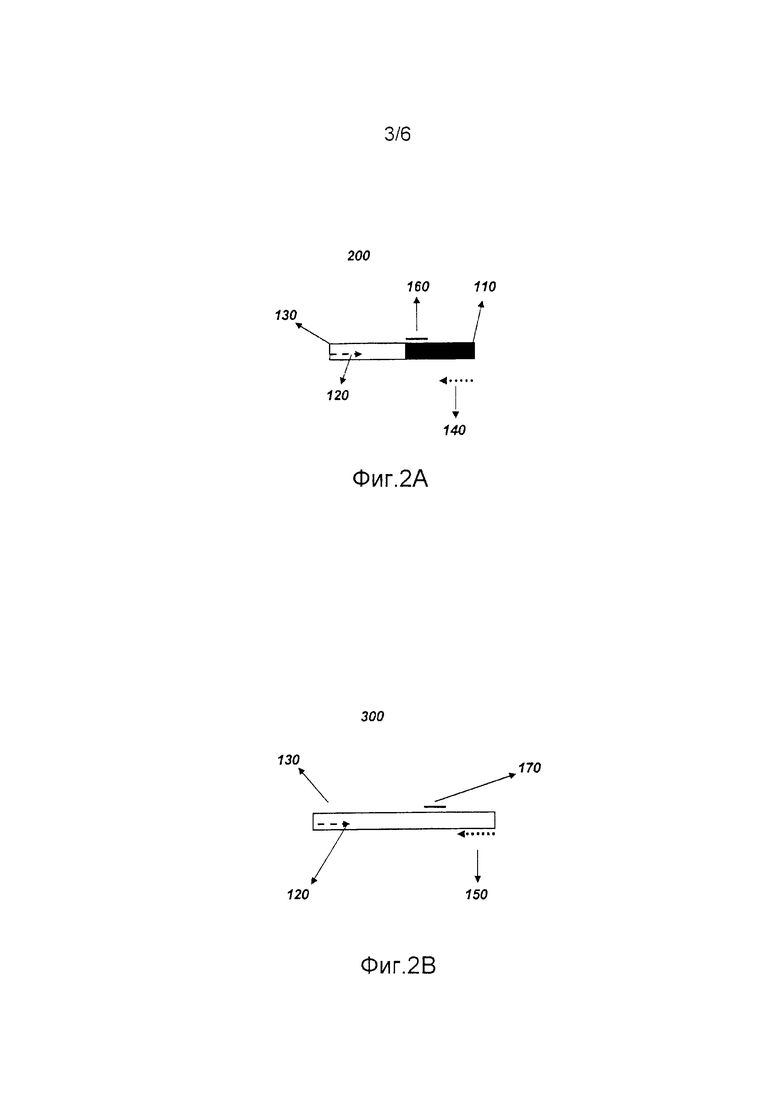
На фиг.2А представлено схематическое изображение первого реплицированного продукта (200) согласно варианту осуществления изобретения. Также представлены прямой праймер (130), первый обратный праймер (140) и необязательный специфический зонд вставки (160).
На фиг.2В представлено схематическое изображение первого реплицированного продукта (200) согласно варианту осуществления изобретения. Также представлены прямой праймер (130), второй обратный праймер (150) и необязательный специфический зонд дикого типа (170).
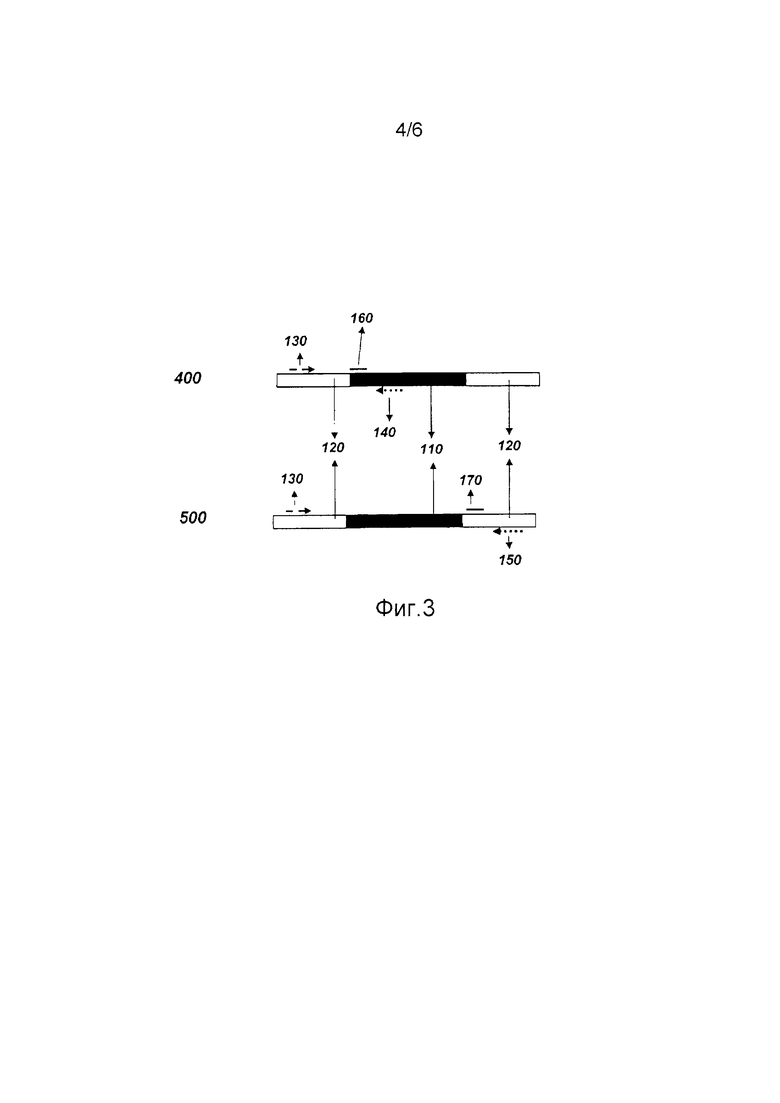
На фиг.3 представлено схематическое изображение компонентов способа определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки согласно варианту осуществления изобретения. Первая реакция (400) включает вероятно вставленную нуклеотидную последовательность (110), которая представлена темным блоком, в то время как окружающий геном (120) указан открытыми сегментами. Также показаны прямой праймер (130), первый обратный праймер (140) и необязательный специфический зонд вставки (160).
Вторая реакция (500) включает вероятно вставленную нуклеотидную последовательность (110), которая представлена темным блоком, в то время как окружающий геном (120) указан открытыми сегментами. Также показаны прямой праймер (130), второй обратный праймер (150) и необязательный специфический зонд дикого типа (170).
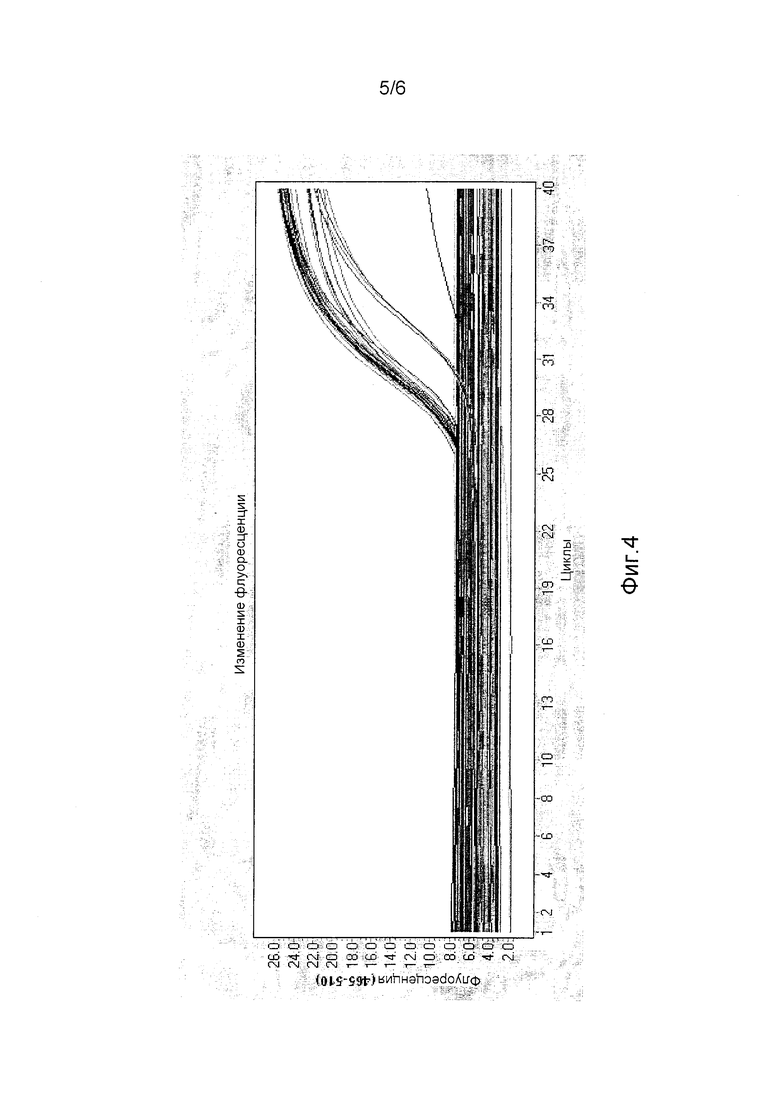
На фиг.4 представлено графическое отображение результатов флуоресценции FAM в системе LightCycler 480 фирмы Roche.
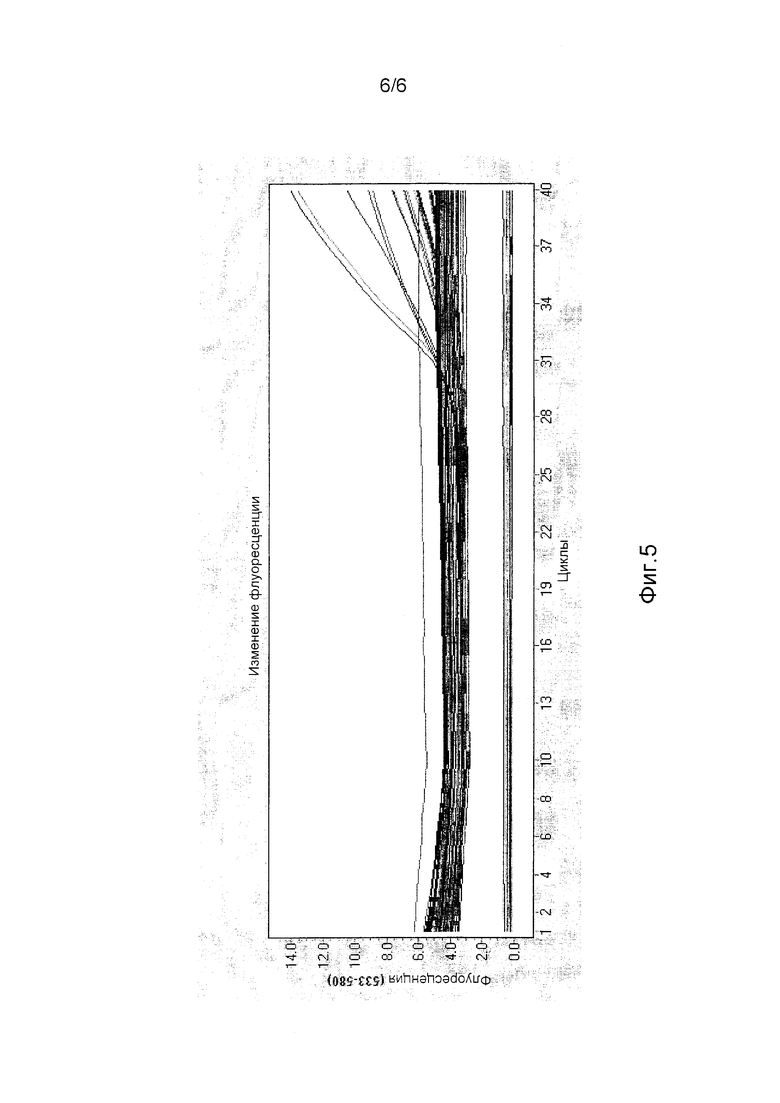
На фиг.5 представлено графическое отображение результатов флуоресценции VIC в системе LightCycler 480 фирмы Roche.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления изобретения включают способы определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки в образце нуклеиновых кислот. В некоторых вариантах осуществления нуклеиновые кислоты могут быть выделены и/или очищены из одного источника или совокупности источников, причем совокупность может включать один или несколько отдельных источников, каждый из которых может или не может иметь отличные нуклеиновые кислоты. В других вариантах осуществления источник нуклеиновых кислот может представлять собой, но ими не ограничиваясь, животное, растение, бактерий, архебактерий, простейших, грибы, хромистов, эукариот, прокариот, in vivo, in vitro, клетку, семя, гамету, кукурузу, сою, пшеницу, рапс, рис и созданные источники.
В определенных вариантах осуществления способ может содержать получение, выделение, очистку и/или частичную очистку нуклеиновой кислоты. Согласно фиг.1, выделенные нуклеиновые кислоты могут быть приведены в контакт с прямым праймером (130), способным связываться с нуклеиновой кислотой выше сайта вставки (120), и первым обратным праймером (140), способным специфически связываться с последовательностью внутри вставленной нуклеотидной последовательности (110) (при наличии), и вторым обратным праймером (150), способным специфически связываться с последовательностью ниже (120) сайта вставки, оставляя праймеры для отжига с выделенными нуклеиновыми кислотами. Последовательности, находящиеся между праймерами, затем по возможности могут быть реплицированы, используя праймеры для репликации между праймерами посредством техник, хорошо известных в данной области, таких как, но ею не ограничиваясь, полимеразная цепная реакция (ПЦР). В отношении сайтов вставки, где вставленная нуклеотидная последовательность (110) присутствует и больше чем фрагмент, реплицируемый стандартными способами (например, > 5 т.н.), продукты репликации могут включать первый реплицированный продукт (фиг.2А (200)), содержащий такие последовательности между прямым праймером (130) и первым обратным праймером (140), но, как правило, может отсутствовать второй реплицированный продукт (фиг.2В (300)), праймированный со второго обратного праймера (150). В отношении сайтов вставки, где вставленная нуклеотидная последовательность отсутствует, продукты репродукции могут включать второй реплицированный продукт (фиг.2В (300)), содержащий такие последовательности между прямым праймером (130) и вторым обратным праймером (150). При наличии вставленной нуклеотидной последовательности (110) в некоторых, но не во всех сайтах вставки в нуклеиновой кислоте, будет получаться смесь двух продуктов. Результаты репликации затем анализируют для определения наличия и/или относительных уровней первого реплицированного продукта (200) и/или второго реплицированного продукта (300).
В отношении сайтов вставки при наличии вставленной нуклеотидной последовательности, продукты репликации нуклеиновой кислоты могут включать первый реплицированный продукт (фиг.2А (200)), содержащий такие последовательности между прямым праймером (130) и первым обратным праймером (150). В отношении сайтов вставки при отсутствии вставленной нуклеотидной последовательности, продукты репликации могут включать второй реплицированный продукт (фиг.2В (300)), содержащий такие последовательности между прямым праймером (130) и вторым обратным праймером (150). При наличии вставленной нуклеотидной последовательности (110) в некоторых, но не во всех сайтах вставки в нуклеиновой кислоте, будет получаться смесь двух продуктов. Результаты репликации затем анализируют для определения наличия и/или относительных уровней первого реплицированного продукта (200) и/или второго реплицированного продукта (300).
В некоторых вариантах осуществления при наличии вставленной нуклеотидной последовательности в сайте вставки прямой праймер и первый обратный праймер должны отстоять друг от друга меньше чем приблизительно на 5 т.н., и прямой праймер и второй обратный праймер должны отстоять друг от друга больше чем приблизительно на 5 т.н. В дополнительных вариантах осуществления, в которых в сайте вставки отсутствует вставленная нуклеотидная последовательность, прямой праймер и второй обратный праймер должны отстоять друг от друга меньше чем приблизительно на 5 т.н.
В определенных вариантах осуществления согласно фиг.3 выделенная нуклеиновая кислота может быть разделена на несколько порций. Первая порция нуклеиновой кислоты может быть приведена в контакт с прямым праймером (130), способным связываться с нуклеиновой кислотой выше сайта вставки (120), и первым обратным праймером (140), способным специфически связываться с последовательностью внутри вставленной нуклеотидной последовательности (110) (при наличии), оставляя праймеры для отжига с выделенными нуклеиновыми кислотами. Последовательности, расположенные между праймерами, затем по возможности могут быть реплицированы, используя праймеры для репликации между праймерами посредством техник, хорошо известных в данной области, таких как, но ею не ограничиваясь, ПЦР. В отношении сайтов вставки, когда вставленная нуклеотидная последовательность (110) присутствует, продукты репликации могут включать первый реплицированный продукт (фиг.2А (200)), содержащий такие последовательности между прямым праймером (130) и первым обратным праймером (140).
Вторая порция нуклеиновой кислоты может быть приведена в контакт с прямым праймером (130), способным связываться с нуклеиновой кислотой выше сайта вставки (120), и вторым обратным праймером (150), способным специфически связываться с последовательностью ниже (120) сайта вставки, оставляя праймеры для отжига с выделенной нуклеиновой кислотой. Последовательности, расположенные между праймерами, затем по возможности могут быть реплицированы, используя праймеры для репликации между праймерами посредством техник, хорошо известных в данной области, таких как, но ею не ограничиваясь, ПЦР. В отношении сайтов вставки, когда вставленная нуклеотидная последовательность (110) отсутствует, продукты репликации могут включать второй реплицированный продукт (фиг.2В (300)), содержащий такие последовательности между прямым праймером (130) и вторым обратным праймером (150).
В отношении сайтов вставки, когда вставленная нуклеотидная последовательность присутствует, продукты репликации первой порции нуклеиновой кислоты могут включать первый реплицированный продукт (фиг.2А (200)), содержащий такие последовательности между прямым праймером (130) и первым обратным праймером (150). В отношении сайтов вставки, когда вставленная нуклеотидная последовательность (110) отсутствует, продукты репликации второй порции нуклеиновой кислоты могут включать второй реплицированный продукт (фиг.2В (300)), содержащий такие последовательности между прямым праймером (130) и вторым обратным праймером (150).
В других вариантах осуществления способы могут быть использованы для определения наличия вставки в нуклеиновой кислоте при наличии вставки меньше чем в 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% сайтов вставки в нуклеиновых кислотах. В вариантах осуществления способы могут быть использованы для определения отсутствия вставки в нуклеиновой кислоте при отсутствии вставки меньше чем в 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% сайтов вставки в нуклеиновых кислотах.
В некоторых вариантах осуществления нуклеиновая кислота, содержащая сайт вставки, может представлять собой любой вид нуклеиновой кислоты, к которым относятся, но ими не ограничиваясь, ДНК, РНК, PNA или другие модифицированные формы нуклеиновых кислот.
В дополнительных вариантах осуществления наличие и/или количество первого и/или второго продукта репликации может быть определено любыми средствами, известными в данной области, такими как, но ими не ограничиваясь, специфические зонды вставки (160) и специфические зонды дикого типа (170), соответственно. В определенных вариантах осуществления зонд может представлять собой нуклеотидную последовательность, способную связываться в специфическом сайте в первом и/или втором продукте репликации. Отжиг зонда может происходить в процессе или после репликации.
Посредством, не имеющих ограничительного характера, примеров наличие и/или количество первого и/или второго продукта репликации может быть определено, используя хроматографию, гели, метки, фрагменты, саузерн-блот и нозерн-блот.
В некоторых вариантах осуществления для облегчения детекции к одному или нескольким зондам может быть присоединен флуорофор. Кроме того, к зонду также может быть присоединена молекула, гасящая флуорофор. К примерам таких зондов, содержащих флуорофор и молекулу, гасящую флуорофор, относятся система TaqMan® и реагенты, доступные у фирм Roche Molecular Diagnostics и/или Applied Biosystems. В других вариантах осуществления продукция и уровни первого и/или второго продуктов репликации могут отслеживаться в режиме реального времени.
В некоторых вариантах осуществления способы, описанные в настоящем документе, могут быть использованы для определения зиготности нуклеиновых кислот (например, генома(ов)) в определенном сайте вставки. Результаты анализов при наличии первого реплицированного продукта (200) и отсутствии второго реплицированного продукта (300) указывают на то, что нуклеиновые кислоты гомозиготны в отношении наличия вставки. Результаты анализов с отсутствием первого реплицированного продукта (200) и наличием второго реплицированного продукта (300) указывают на то, что нуклеиновые кислоты гомозиготны в отношении отсутствия вставки. Результаты таких анализов, в которых присутствуют и первый реплицированный продукт (200) и второй реплицированный продукт (300), указывают на то, что нуклеиновые кислоты гетерозиготны в отношении вставки (например, по меньшей мере один сайт вставки содержит вставку и по меньшей мере один сайт вставки не содержит вставку).
В определенных вариантах осуществления наборы праймеров и/или зондов могут быть объединены с одним или несколькими другими наборами праймеров и зондов таким образом, чтобы возможно было определить наличие или отсутствие одной или нескольких вставок в одном или нескольких определенных сайтах вставки в нуклеиновой кислоте образца. Используемое в настоящем документе выражение «набор праймеров и/или зондов» включает по меньшей мере один прямой праймер, способный связываться с сайтом выше определенного сайта вставки, и по меньшей мере один обратный праймер, способный связываться с сайтом ниже определенного сайта вставки или внутри определенной вставки. В других вариантах осуществления для идентификации конкретной вставки в одном или нескольких определенных сайтах вставки и/или большого числа вставок в большом числе определенных сайтов вставки может быть использовано большое число наборов праймеров и/или зондов.
В некоторых вариантах осуществления способы, описанные в настоящем документе, могут быть использованы для скрининга популяции на наличие или отсутствие вставки в определенном сайте вставки. В дополнительных вариантах осуществления наличие определенного сайта вставки может быть определено для каждого члена популяции.
Под используемым в настоящем документе выражением «определенный сайт вставки» понимают известное расположение или консервативную последовательность в нуклеиновой кислоте, куда вставка может быть вставлена воспроизводимым образом. В некоторых вариантах осуществления наличие конкретного сайта вставки может быть определено для каждой нуклеиновой кислоты в образце, в качестве не имеющего ограничительного характера примера, путем продукции первого (200) или второго (300) реплицированного продукта способами, описанными в настоящем документе. В других вариантах осуществления последовательности, фланкирующие конкретный сайт вставки, или последовательности внутри вставки могут быть консервативными. В дополнительных вариантах осуществления такой консерватизм последовательностей, фланкирующих определенный сайт вставки, или последовательностей во вставке может быть ограничен сайтами связывания праймеров и/или зондов. Под используемым в данном контексте термином «консервативный» понимают, что специфический праймер и/или зонд способен специфически связываться с областью, которая является «консервативной». В определенных вариантах осуществления специфический праймер и/или зонд останется связанным с «консервативной» областью при условиях повышенной жесткости.
Используемые в настоящем документе термины «выше» и «ниже» являются относительными и означают противоположные стороны сайта вставки в нуклеиновой кислоте. Термины не обозначают, какое из направлений располагается «выше» и «ниже» сайта вставки, а лишь что они лежат на противоположных сторонах сайта вставки.
Используемые в настоящем документе «прямой праймер» и «обратный праймер» представляют собой относительные термины, означающие праймеры, связывающиеся с различными местоположениями на нуклеиновой кислоте таким образом, чтобы дать возможность репликации нуклеиновых кислот между ними способами, доступными в данной области, такими как, но ею не ограничиваясь, ПЦР. Термины «прямой» и «обратный» не обозначают, где именно конкретный праймер свяжется с сайтом последовательности нуклеиновой кислоты, а лишь что они лежат на противоположных сторонах реплицируемой последовательности и могут действовать при репликации в качестве праймеров для полимеразы.
Используемые в настоящем документе «содержащий», «включающий», «отличающийся» и их грамматические эквиваленты представляют собой охватывающие и неограничивающие термины, которые не исключают дополнительных, неперечисленных элементов или стадий способа, но также включают более узкие термины «состоящий из» и «состоящий по существу из».
Настоящее изобретение дополнительно описывается в следующих примерах, которые предлагаются в качестве иллюстрации и не предназначены для того, чтобы каким-либо образом ограничить изобретение.
ПРИМЕРЫ
ПРИМЕР 1: Материал растений:
Скрининг родительских линий: Для определения, является ли краевая последовательность в сайте вставки трансгена высоко консервативной и могут ли трансформант-специфические праймеры быть использованы для различного генетического окружения, скринировали в общем 92 различных инбредных линии, которые представляли различные гетерозисные группы и имели различное происхождение, такие как североамериканские, южноамериканские, европейские, stiff stalk, отличные от stiff stalk, из публичных и личных источников (Таблица 1).
Скрининг объемных проб семян: Для демонстрации применения тестирования на основе ДНК на объемных пробах семян и для определения чувствительности детекции пулы семян, указанные ниже, создавали, используя известные строго гомозиготные DAS-59122, гемизиготные DAS-59122 и нулевые (обычные) семена. Их отсчитывали в шесть различных пробирок типа фалькон объемом 50 мл:
1. 100 гомозиготных семян DAS-59122, репликация-1
2. 100 гомозиготных семян DAS-59122, репликация-2
3. 99 гомозиготных семян DAS-59122 и одно гемизиготное семя DAS-59122, репликация-1
4. 99 гомозиготных семян DAS-59122 и одно гемизиготное семя DAS-59122, репликация-2
5. 99 гомозиготных семян DAS-59122 и одно нулевое (обычное) семя, репликация-1
6. 99 гомозиготных семян DAS-59122 и одно нулевое (обычное) семя, репликация-2.
ПРИМЕР 2: Обмолот семян и экстракция ДНК
Семена мелко измельчали и геномную ДНК выделяли, используя набор DNEasy фирмы Qiagen (Valencia, CA). Из каждой партии семян осуществляли пять отдельных экстракций геномной ДНК. Очищенную геномную ДНК количественно оценивали, используя набор с красителем ДНК Picogreen фирмы QuantIt, и разводили до стандартизованных концентраций.
ПРИМЕР 3: Анализы зиготности на основе TaqMan
Анализ зиготности осуществляли, используя различные наборы реагентов, которые состояли из отличных последовательностей праймеров и зондов. Способ и реагенты создавали конкретно для трансформанта DAS-59122. Схема анализа зиготности предложена на фиг.1. В способе помимо двух зондов использовались ген-специфический праймер, праймер дикого типа и ген-специфический/дикого типа (общий) праймер. Зонды состояли из специфического зонда дикого типа и трансгенного специфического зонда. В первом способе все праймеры и зонды объединялись в одной реакции («способ в одну реакцию»). Для повышения чувствительности определения зиготности также испытывали дополнительный способ, в котором осуществляли две отдельных независимых реакции (фиг.3) («способ с большим числом реакций»). Один ряд лунок содержал специфический праймер дикого типа, общий праймер и специфический зонд дикого типа. Другой ряд лунок содержал специфический праймер трансгена, общий праймер и специфический зонд трансгена. Например, в этом способе использовали лишь два праймера и один зонд в формате 384-луночного планшета, в котором один квадрат содержал специфический праймер дикого типа + общий праймер + специфический зонд дикого типа, другой квадрат содержал специфический праймер трансгена + общий праймер + специфический зонд трансгена.
Модифицированный анализ Taqman с детекцией по конечной точке: получали реакционную смесь, содержавшую следующие компоненты: вода, 15,35 мкл; 10-кратный буфер для проведения ПЦР, 2,50 мкл; MgCl2 в концентрации 25 мМ, 1,50 мкл; dNTP в концентрации 10 мМ (по 2,5 мМ каждого), 2,0 мкл; общий прямой праймер в концентрации 20 мкМ (SEQ ID NO:1), 0,25 мкл; обратный праймер дикого типа в концентрации 20 мкМ (SEQ ID NO:2), 0,25 мкл; дважды меченый зонд дикого типа (SEQ ID NO:3) в концентрации 10 мкМ, на 3' конце меченый с помощью VIC и на 5' конце меченный с помощью BHQ2, 0,20 мкл; Taq-полимераза HotStar (5 Ед/мкл), 0,20 мкл; геномная ДНК в концентрации 10 нг/мкл, 3,0 мкл.
Получали вторую реакционную смесь, содержавшую следующие компоненты: вода, 15,35 мкл; 10-кратный буфер для проведения ПЦР, 2,50 мкл; MgCl2 в концентрации 25 мМ, 1,50 мкл; dNTP в концентрации 10 мМ (по 2,5 мМ каждого), 2,0 мкл; общий прямой праймер в концентрации 20 мкМ (SEQ ID NO:1), 0,25 мкл; обратный праймер 591227 в концентрации 20 мкМ (SEQ ID NO:4), 0,25 мкл; дважды меченый зонд 591227 (SEQ ID NO:5) в концентрации 10 мкМ, меченый на 3' конце с помощью FAM и на 5' конце с помощью BHQ1, 0,20 мкл; Taq-полимераза HotStar (5 Ед/мкл), 0,20 мкл; геномная ДНК в концентрации 10 нг/мкл, 3,0 мкл.
Обе смеси раскапывали в отдельные лунки и амплифицировали, используя систему для проведения ПЦР GenAmp 9700 при следующих условиях: 95°С в течение 15 минут (1 цикл); 95°С в течение 15 секунд, 60°С в течение 60 секунд (35 циклов). Считывание флуоресцентного сигнала анализировали и зиготность определяли, исходя из возбуждения флуорофора VIC или FAM.
Результаты: после определения консервативности краевых последовательностей в сайте связывания праймеров праймеры создавали и испытывали на объемных пулах семян, используя стандартный анализ определения зиготности Taqman. Результаты указали на то, что способ с одной реакцией оказался чувствительным при определении примеси нулевого семени среди строго гомозиготных семян, взятых в большом количестве, с чувствительностью детекции 1%. Тем не менее, способ с одной реакцией оказался неудовлетворительным в определении примеси какого-либо гемизиготного семени при уровне наличия 1%. Низкая чувствительность могла быть следствием преимущественной амплификации реакции-1 (см. фиг.1) из-за избыточной доступности матрицы. Для решения этой проблемы конкуренции за ресурсы в процессе реакции ПЦР способ с одной реакцией модифицировали в большое число отдельных реакций (фиг.3). Эта модификация привела к избирательной амплификации лишь нацеленного региона в отсутствие какой-либо конкуренции за ресурсы. Применение способа с большим числом реакций (тестирование на зиготность родительного семени) на родительских «пулах семян» показало достоверность определения примеси как гемизиготных, так и обычных (нулевых) семян в большом количестве строго гомозиготных семян с чувствительностью детекции 1% (Таблица 2). Результаты также подтверждали посредством ПЦР в режиме реального времени, используя прибор Light Cycler 480 фирмы Roche, для обеспечения отсутствия артефактов в реакции ПЦР или установления их.
Скрининг родительских линий: Поскольку трансформант-специфические праймеры могут быть использованы для различного генетического окружения, для испытания способа с большим числом реакций использовали 92 отличных инбредных линии (Таблица 1), которые представляют различные гетерозисные группы, произрастающие в местностях, таких как Северная Америка, Южная Америка и Европа. Эти линии испытывали и подтверждали, что они свободны от контаминации трансгеном, используя протокол, описанный выше.
Анализ, используя термоциклер в режиме реального времени Roche 480 (фиг.4 и 5), а также анализы на основе TaqMan по конечной точке показали, что все протестированные инбредные линии имеют консервативную краевую последовательность, фланкирующую вставку трансгена. Их успешно амплифицировали с участием специфического праймера/зонда WT, подтверждая, что праймеры и зонды для анализа трансформанта DAS-59122 могут быть использованы для программ интрогрессии при испытании зиготности родительского семени на окончательных линиях.
К некоторым из преимуществ способа с большим числом реакций относятся все преимущества простоты и надежности тестирования ДНК над тестом ELISA. Самое важное, это позволяет тестировать зиготность, используя объемные пулы семян, в отличие от тестирования ELISA, которое может идентифицировать лишь отдельные растения. Кроме того, этот способ может снизить стоимость процедуры tester-row и ELISA в десять раз. Этот способ также может повысить чувствительность анализа и будет идентифицировать и другие примеси. Способ с большим числом реакций также может быть использован в качестве «индикатора» при испытании на наличие малых примесей (АР), что может быть использовано для тестирования на присутствие непредусмотренного трансформанта, а также должно показать статус строгой гомозиготности объемной пробы.
Тестирование способом с большим числом реакций доказало высокую чувствительность в определении наличия примеси какого-либо гемизиготного или нулевого семени в партии семян строго гомозиготных окончательных линий. Было показано, что способ с большим числом реакций может идентифицировать примесь при уровне контаминации 1% (1 в 100 семенах). Эта новая методология привела к установлению нового направления применения высокопроизводительного молекулярного анализа (НТМА), лучше тестирующего степень чистоты у окончательных линий, а также может обеспечить десятикратную экономию при проведении процедур в полевых условиях.
Несмотря на то, что настоящее изобретение было описано в нескольких вариантах осуществления, настоящее изобретение может быть дополнительно модифицировано в пределах сущности и объема настоящего описания. Эта заявка, поэтому, охватывает любые варианты, применения или адаптации изобретения, использующие его основные принципы. Кроме того, настоящая заявка охватывает такие отклонения от настоящего описания, которые согласуются с известной или обычной практикой в данной области, к которой настоящее изобретение относится и которая находится в рамках прилагаемой формулы изобретения.


| название | год | авторы | номер документа |
|---|---|---|---|
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ КУКУРУЗЫ MON95275 И СПОСОБЫ ЕГО ОБНАРУЖЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2836053C1 |
| ОБЪЕКТ КУКУРУЗЫ MON 87411 | 2013 |
|
RU2648155C2 |
| ГЕН-СПЕЦИФИЧЕСКИЙ АНАЛИЗ НА FLUORY2 В МАИСЕ ДЛЯ ИНТРОГРЕССИИ МУЧНИСТОГО ПРИЗНАКА (FL2) | 2013 |
|
RU2661110C2 |
| ГЕНЫ, КОНСТРУКЦИИ И ОБЪЕКТ DP-202216-6 МАИСА | 2019 |
|
RU2833371C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ТРАНСФОРМАНТА СОИ рDAB9582.814.19.1 | 2012 |
|
RU2622079C2 |
| ЛИНИИ ТРАНСГЕННОЙ СОИ, ГЕНЕТИЧЕСКОЕ СОБЫТИЕ 8264.42.32.1, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ С ПАКЕТИРОВАННЫМИ ГЕНАМИ НА ЕГО ОСНОВЕ, И ИХ ДЕТЕКТИРОВАНИЕ | 2012 |
|
RU2636021C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЗИГОТНОСТИ ГЕНА FAD3 В КАНОЛЕ | 2012 |
|
RU2630998C2 |
| ПАКЕТИРОВАННОЕ СОБЫТИЕ 8264.44.06.1 С УСТОЙЧИВОСТЬЮ К ГЕРБИЦИДАМ, СВЯЗАННЫЕ ТРАНСГЕННЫЕ ЛИНИИ СОИ И ИХ ДЕТЕКТИРОВАНИЕ | 2011 |
|
RU2608650C2 |
| ОБЪЕКТ СОИ 9582.814.19.1, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К НАСЕКОМЫМ И УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ | 2012 |
|
RU2628099C2 |

Группа изобретений относится к области биотехнологии. Способы определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки в нуклеиновой кислоте включают: выделение нуклеиновой кислоты из одного образца или порций; приведение нуклеиновой кислоты в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки; первым обратным праймером, специфичным для вставленной нуклеотидной последовательности, и вторым обратным праймером, способным связываться с нуклеиновой кислотой ниже сайта вставки. Реплицированные нуклеиновые кислоты анализируют для определения наличия или отсутствия в образце вставленной нуклеотидной последовательности. Использование способов позволяет с высокой чувствительностью определять зиготность в исследуемой пробе. 2 н. и 4 з.п. ф-лы, 5 ил., 2 табл., 3 пр.
1. Способ определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки в образце нуклеиновых кислот, причем способ содержит:
приведение указанного образца нуклеиновых кислот в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки, и первым обратным праймером, способным специфически связываться с последовательностью внутри вставленной нуклеотидной последовательности, и вторым обратным праймером, способным специфически связываться с последовательностью ниже сайта вставки, осуществляя тем самым отжиг праймеров с выделенными нуклеиновыми кислотами;
где продукт репликации, включающий первый реплицированный продукт, содержащий последовательности между прямым и первым обратным праймером, и не включающий второй реплицированный продукт, праймированный со второго обратного праймера, указывает на наличие вставленной нуклеотидной последовательности в указанном определенном сайте вставки в образце нуклеиновых кислот и продукт репликации, включающий второй реплицированный продукт, содержащий последовательности между прямым праймером и вторым обратным праймером, указывает на отсутствие вставленной нуклеотидной последовательности в указанном определенном сайте вставки в образце нуклеиновых кислот.
2. Способ по п. 1, где смесь указанных двух продуктов указывает на наличие вставленной нуклеотидной последовательности в некоторых сайтах вставки в образце нуклеиновых кислот.
3. Способ по п. 1, дополнительно содержащий приведение нуклеиновой кислоты в контакт во время или после репликации с зондом, специфичным для фрагмента, амплифицированного при наличии вставленной нуклеотидной последовательности.
4. Способ по п. 1, в котором способ используют для определения примеси любых непредусмотренных трансгенов.
5. Способ по п. 1, в котором способ используют для определения примеси каких-либо нетрансгенных линий.
6. Способ определения наличия или отсутствия вставленной нуклеотидной последовательности в определенном сайте вставки в образце нуклеиновых кислот, причем способ содержит:
разделение указанного образца нуклеиновых кислот на первую порцию и вторую порцию, где указанную первую порцию приводят в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки, и первым обратным праймером, способным специфически связываться с последовательностью внутри вставленной нуклеотидной последовательности, осуществляя тем самым отжиг праймеров с выделенными нуклеиновыми кислотами, и указанную вторую порцию приводят в контакт с прямым праймером, способным связываться с нуклеиновой кислотой выше сайта вставки, и вторым обратным праймером, способным специфически связываться с последовательностью ниже сайта вставки, осуществляя тем самым отжиг праймеров с выделенными нуклеиновыми кислотами;
где продукт репликации указанной первой порции, включающий первый реплицированный продукт, содержащий последовательности между прямым и первым обратным праймером, указывает на наличие вставленной нуклеотидной последовательности в указанном определенном сайте вставки в образце нуклеиновых кислот, и
продукт репликации второй указанной порции, включающий второй реплицированный продукт, содержащий последовательности между прямым праймером и вторым обратным праймером, указывает на отсутствие вставленной нуклеотидной последовательности в указанном определенном сайте вставки в образце нуклеиновых кислот.
| TZU-MING PAN, TSUNG-WEI SHIH, Detection of genetically modified soybeans in miso by polymerase chain reactuin and nested polymerase chain reaction, Journal of food and drug analysis, vol.11, n.2, 2003, pages 154-158 | |||
| CN 1873010 A 06.12.2006 | |||
| WO 2005059103 A2 30.06.2005. |
Авторы
Даты
2016-12-20—Публикация
2011-12-28—Подача