Изобретение относится к биотехнологии, а именно к генетической инженерии, и может быть использовано в ветеринарной вирусологии для диагностики инфекционных заболеваний сельскохозяйственных животных, в частности, респираторно-синцитиальной инфекции крупного рогатого скота, а также для оценки концентрации вируса в органах и тканях больных животных.
Респираторно-синцитиальный вирус крупного рогатого скота (Bovine respiratory syncytial virus, BRSV), является одним из этиологических агентов респираторных болезней крупного рогатого скота (КРС). Данный вирус вызывает респираторно-синцитиальную инфекцию (РСИ) КРС, которая регистрируется во всех странах мира, где развит интенсивный тип ведения животноводства.
У восприимчивых животных вирус вызывает бронхиолиты, бронхиты, интерстициальную пневмонию и эмфизему легких. РСИ КРС может выступать в качестве модели РСИ человека, протекающей со сходной симптоматикой, и в отличие от остальных лабораторных моделей (хлопковых крыс или обезьян), РСИ КРС может применяться для оценки динамики изменения клинических симптомов и концентрации вируса на каждой стадии болезни.
До настоящего времени основным способом выявления вируса и оценки его концентрации является выделение вируса в культурах клеток. Выделение BRSV затруднено ввиду его чрезвычайной лабильности и возможно только на ранней стадии инфекции, а вероятность выделения вируса снижается с появлением признаков заболевания. Лучшие результаты получают, проводя заражение культур клеток в максимально короткие сроки после взятия материала, избегая его замораживание (Сюрин В.Н., Самуйленко А.Я., Соловьев Б.В., Фомина Н.В. Вирусные болезни животных. - М.: ВНИ-ТИБП. - 1998. - 928 с.). Количественная оценка вируса возможна только в специально поставленных опытах на телятах-гнотобионтах с применением адаптированного для культур клеток высоко патогенного штамма вируса BRSV (Kimman T.G., Zimmer G.M., Straver P.J., de Leeuw P.W. Diagnosis of bovine respiratory syncytial virus infections improved by virus detection in lung lavage samples. American Journal of Veterinary Research. 1986; 47 (1): 143-147).
Таким образом, основным недостатком выделения вируса респираторно-синцитиальной инфекции крупного рогатого скота в культуре клеток является длительность процедуры до одного и более месяцев, а также отсутствие возможности для количественной оценки вируса у естественно инфицированных животных.
Перспективным в этом направлении может быть использование ПЦР в режиме реального времени.
Известен способ выявления BRSV методом ПЦР в режиме реального времени с использованием коммерческих наборов, где в качестве внутреннего контроля амплификации применяется выявление РНК гена glyceraldehyde-3-phosphate dehydrogenase (GAPDH) крупного рогатого скота (Timsit Ε., Le Drean Ε., Maingourd С.et al. Detection by real-time RT-PCR of a bovine respiratory syncytial virus vaccine in calves vaccinated intrana-sally. Veterinary Record. 2009; 165: 230-233).
Недостатком данного способа является невозможность количественной оценки вируса.
Известен способ выявления и оценки концентрации РНК вируса ре-спираторно-синцитиальной инфекции человека (HRSV) в пробах биоматериала от лабораторных животных и культурах клеток, в котором амплификация гена β-actin применялась для стандартизации расчета количества копий РНК вируса BRSV в пробах биоматериала. При этом концентрацию вируса определяли как количество копий на 105 копий РНК гена β-actin (Boukhvalova M.S., Prince G.A., Blanco J.C. The cotton rat model of respiratory viral infections. Biologicals. 2009; 37: 152-159).
К недостаткам данного способа следует отнести то, что для его постановки применяется набор с алкилирующим красителем SYBR Green и необходима постановка двух независимых реакций, что может отрицательно сказаться на точности оценки концентрации.
Наиболее приемлемым с точки зрения описанных недостатков и принятым за прототип является способ, основанный на применении Taq Man ПЦР с меченым зондом для выявления вируса BRSV, а для выявление РНК гена β-actin КРС применяется ПЦР с алкилирующим красителем (Boxus Μ., Letellier С, Kerkhofs, P. Real Time RT-PCR for the detection and quantitation of bovine respiratory syncytial virus. Journal of Virological Methods. 2005; 125(2): 125-130.). При этом для расчета концентрации двух меток проводится амплификация с калибровочными контролями, которые представляют из себя 10-кратные разведения плазмиды с клонированными в них фрагментами генов BRSV и β-actin КРС с известной концентрацией. Количественная оценка концентрации вирусной РНК в пробе проводится относительно концентрации РНК гена β-актина и определяется как количество копий на 105 копий РНК гена β-actin.
К недостаткам данного способа можно отнести то, что для определения концентрации РНК BRSV и РНК β-актина КРС применяются разные анализы и он не лишен недостатков выше приведенного способа.
Технической задачей изобретения являлась разработка высокоспецифичного и чувствительного способа на основе полимеразной цепной реакции (ПЦР) с использованием гибридизационно-флуоресцентной детекции в режиме реального времени, позволяющего выявлять концентрацию вируса BRSV в образцах проб биологического материала от больных животных.
Сущность изобретения заключается в том, что предложен набор синтетических олигонуклеотидных праймеров и зондов для выявления вируса респираторно-синцитиальной инфекции крупного рогатого скота (BRSV) и гена GAPDH крупного рогатого скота, согласно изобретению, синтетические олигонуклеотидные праймеры и зонды имеют нуклеотидные последовательности: SEQ ID NO: 1-6.
Сущность изобретения заключается также в том, что в способе выявления РНК вируса респираторно-синцитиальной инфекции крупного рогатого скота, включающий выделение РНК из образцов проб биологического материала от крупного рогатого скота, проведение обратной транскрипции и ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени с применением панели положительных контрольных образцов с известной концентрацией, согласно изобретению, используют набор синтетических олигонуклеотидных праймеров и зондов с нуклео-тидными последовательностями SEQ ID ΝΟ:1-6, исследование каждой пробы проводят методом мультиплексной ПЦР для одновременного выявления РНК гена вируса респираторно-синцитиальной инфекции крупного рогатого скота и гена GAPDH.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение синтетических олигонуклеотидных праймеров. Поиск новых синтетических олигонуклеотидных праймеров и зондов осуществляют на основе полного генома штамма вируса респираторно-синцитиальной инфекции крупного рогатого скота (BRSV) «А51908», представленного в базе данных GenBank (http://www.ncbi.nlm.nih.gov/GenBank/GenBankSearch.html), при помощи пакета программного обеспечения «Lasergen». Полученные последовательности нескольких пар праймеров и зондов дополнительно тестируют на специфичность с помощью моделирования ПЦР в программе "Vector NTI Suite" с последовательностями генома вируса парагриппа-3 крупного рогатого скота и других близкородственных вирусов.
Окончательный выбор праймеров и зондов основывается на следующих критериях: высокий индекс сходства фрагмента и РНК различных штаммов вируса BRSV, высокая температура отжига (GC-метод), большая длина консенсусов.
Химический синтез праймеров и зондов осуществляют амидофосфитным методом на автоматическом синтезаторе ASM-102U. Концентрацию синтетических олигонуклеотидных праймеров и зондов в маточном растворе определяют спектрометрическим методом.
Аналогичным образом проводят подбор праймеров и зондов для выявления гена GAPDH крупного рогатого скота.
Характеристики выбранных праймеров и зондов представлены в таблице 1.

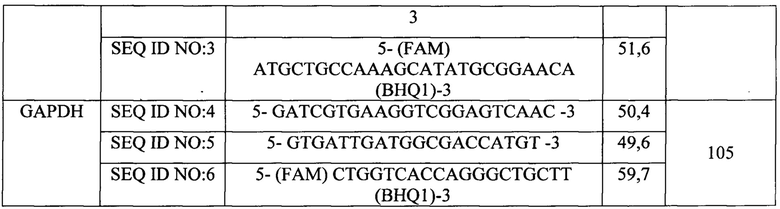
Таким образом, были выбраны синтетические олигонуклеотидные праймеры, комплементарные высоко консервативной области генома вируса BRSV района гена гликопротеина N и гена GAPDH крупного рогатого скота.
Пример 2. Способ выявления РНК вируса респираторно-синцитиальной инфекции и гена GAPDH крупного рогатого скота. Способ осуществляется в несколько этапов.
Этап 1. Выделение РНК вируса и гена КРС
Выделение РНК осуществляют стандартным способом с использованием коммерческого набора «Рибо - сорб» производства ФГУН «Центральный НИИ эпидемиологии» Роспотребнадзора.
Этап 2. Проведение реакции обратной транскрипции для получения кДНК.
Осуществляют стандартным способом с использованием коммерческого набора «Реверта-L» производства того же института.
В пробирку, содержащую 9,5 мкл реакционной смеси: буфер для ОТ (50 mM Tris-HCl [рН 8.3], 3 мМ MgC12, 75 mМ КСl, 10 мМ DTT), 0,1 мМ. dNTP, 0,1 мкг праймера для ОТ) и 0,5 мкл ревертазы из набора «Реверта-L», добавляют 10 мкл РНК-пробы, осторожно перемешивают и помещают в термостат 37°С на 30 минут. Затем добавляют 20 мкл ДНК-буфера, тщательно перемешивают и используют для постановки ПЦР.
Этап 3. Постановка полимеразной цепной реакции
Полимеразная цепная реакция. Состав реакционной смеси: ПЦР-буфер (60 mМ Tris-HCl [рН 8.5], 1,5 мМ MgCl2, 25 mМ KСl, 10 мМ 2-меркаптэтанола, 0,1% Тритон Х-100), 0,2 мМ dNTP, по 0,2 мкг каждого праймера, по 0,1 мкг каждого зонда, 1.25 U Taq-ДНК-полимеразы, 5 мкл кДНК.
Температурный режим проведения ПЦР: 95°С - 5 мин - 1 цикл; 95°С - 10 сек., 57°С - 15 сек., 72°С - 30 сек. - 55 циклов.
Измерение флуоресценции осуществляют при температуре 57°С на канале FAM и ROX. При этом на канале FAM учитывают реакцию по выявлению РНК гена нуклеопротеида N вируса BRSV, а на канале ROX -РНК гена GAPDH КРС.
Положительными считают образцы со значением Ct не превышающим 45.
Пример 3. Определение концентрации вируса РСИ КРС в пробах биоматериала
Методом молекулярной трансформации компетентных бактериальных клеток Escherichia coli плазмидой pDrive, содержащей специфические ДНК вставки, для контроля амплификации получают положительные контрольные образцы (ПКО) отдельно для каждого анализа.
Концентрацию плазмидной ДНК определяют с использованием набора реагентов Quant-iT dsDNA, HS (Invitrogen, США) и флуориметра QUBIT (Invitrogen, США).
Для определения концентрации каждого аналита в образце готовят 10-кратные разведения ПКО.
В 96-луночную планшету для исследования вносят ПЦР смесь и отдельными пипетками добавляют в соответствующие лунки разведения положительных контролей или кДНК исследуемых образцов проб биоматериала. Запечатывают планшету пленкой и помещают в амплификатор для прохождения реакции.
После прохождения реакции учитываются пороговые циклы Ct для каждой пробы.
Далее строят стандартную кривую средних значений Ct для 10-кратных разведений ПКО индивидуально для каждого анализируемого гена. Используя стандартную кривую пересчитывают значения Ct каждой пробы в относительные единицы (log10) для каждого анализируемого гена и нормализуют эти значения относительно гена GAPDH. Для этого 5 (средняя концентрация РНК гена GAPDH в пробе) делят на значение GAPDH для каждой пробы и умножают на значение единиц для гена гли-копротеина N вируса РСИ. Таким образом, концентрацию вируса BRSV выражают в N log10 PCИ КРС /5 log10 GAPDH в пробе.
Пример 4. Оценка чувствительности и выявление РНК вируса BRSV в пробах биологического материала, полученного от больных животных и референтных штаммах.
Для оценки чувствительности реакции положительные контрольные образцы (ПКО) с известной концентрацией титруют методом 10-кратных разведений. Исследование проводят в трех повторах. Разведения ПКО вносят по 5 мкл на реакцию.
Контрольный штамм вируса BRSV «РСВ №3» с титром 104 ТЦД50/мл титруют методом 10-кратных разведений на физиологическом растворе до разведения 10-7 степени, каждое разведение подвергают исследованию в ПЦР.
Для исследования на наличие РНК вируса BRSV используют пробы носовых и глазных выделений, смывы со слизистой носа, соскобы со слизистой трахеи, трахеальную и бронхиальную слизь, пробы легких и бронхов.
Жидкости и пробы слизистых выделений отбирают в объеме не менее 1 мл, из легочной ткани вырезают кусочки размером 1×1×1 см3.
Культуральную жидкость, пробы штаммов и изолятов вируса BRSV, пробы носовых и глазных выделений, трахеальной и бронхиальной слизи используют для выделения РНК без предварительной подготовки.
Из проб органов и тканей предварительно готовят 10% суспензии на стерильном физиологическом растворе, смесь переносят в пластиковые пробирки емкостью 1,5 мл, центрифугируют на центрифуге при 10×103 об/мин в течение 5 минут. Для выделения РНК используют 100 мкл осветленной надосадочной жидкости, полученной после центрифугирования.
Густые пробы носовых выделений и слизи разводят стерильным физиологическим раствором (примерно 1:5), тщательно перемешивают, центрифугируют при 10×103 об/мин в течение 5 минут и 100 мкл осветленной надосадочной жидкости используют для выделения РНК. Дальнейшая процедура согласно примеру 2 и 3.
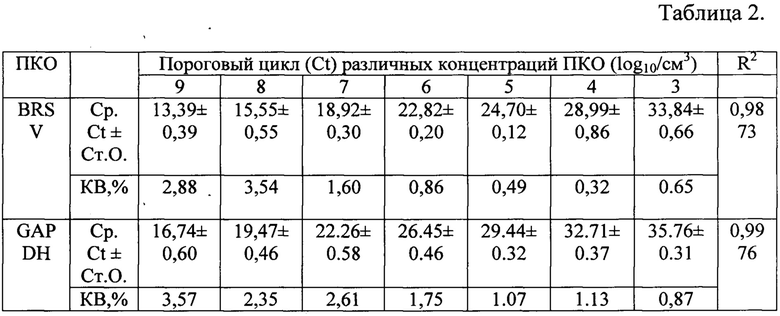
Примечание: Начальная концентрация положительных образцов составила 2,5×1010 ГЭ/мл для BRSV, и 1,2×1010 ГЭ/мл для GAPDH. Среднее Ct ± стандартное отклонение (Ст.О). Коэффициент вариации (KB).
Чувствительность реакции для выявления гена нуклеопротеина N BRSV составила 2,5×103 геномных эквивалентов на 1 см3, а гена GAPDH -1,2×103 геномных эквивалентов на 1 см3 с сильной линейной зависимостью (R2) 0,9873 и 0,9976, соответственно. Коэффициент воспроизводимости для разных разведений колебался от 0,32 до 3,57%, что свидетельствует о высокой эффективности реакции (таблица 2).
С помощью тестирования десятикратных разведений контрольного штамма BRSV «РС-Б» с заранее определенной концентрацией, равной 103,5 ТЦД50/см3, была оценена эффективность реакции для количественной оценки концентрации вирусной РНК. Предел чувствительности реакции составил 100,5 ТЦЦ50/см3 (рисунок 1), что соответствовало 3 log10 ПКО/см3.
С использованием разработанного набора исследовали 273 пробы биоматериала от животных. Вирус выявили в 53 пробах, что составило 19,4% (Таблица 3).

Из данных таблицы 3 видно, что геном вируса чаще выявляли в легких - 10,61% положительных проб, в пробах трахеального и бронхиального экссудатов - 4,03%, носовых выделениях - 2,2% и в бронхах - 1,1%. Реже вирус обнаруживали в слизистой оболочке трахеи и бронхов, а также в легочных лимфатических узлах - по 0,73% положительных проб. Концентрация вируса в пробах биоматериала различалась, что возможно свидетельствует о различных стадиях развития инфекции у животных, при которых они были отобраны. Максимальные концентрации генома вируса определяли в легких (1,3±0,5 - 4,8±0,47 log10 копий РНК BRSV/GAPDH), носовых выделениях (1,5±0,75 - 2,1±0,25 log10 копий РНК BRSV/GAPDH) и экссудате трахеи, бронхов и носовых синусов (0,3±0,21 - 2,8±0,15 log10 копий РНК BRSV/GAPDH).
Полученные результаты в 100% случаев совпадали с данными, полученными при исследовании этих же образцов биоматериала при помощи ранее разработанной тест-системы с электрофоретической детекцией продуктов амплификации.
Таким образом, предлагаемый способ позволяет эффективно выявлять РНК вируса BRSV в пробах различного биоматериала от больных животных.
Перечень последовательностей
| название | год | авторы | номер документа |
|---|---|---|---|
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР) | 2009 |
|
RU2405039C1 |
| Способ выявления возбудителей респираторных инфекций крупного рогатого скота: BPIV, BRSV, BHV-4, BCoV, BVDV-1, BVDV-2, BVDV-3, на основе мультиплексной полимеразной цепной реакции (ПЦР) | 2022 |
|
RU2798286C1 |
| Набор олигонуклеотидных праймеров и зондов и способ выявления пестивируса Н крупного рогатого скота | 2019 |
|
RU2728342C1 |
| МЕТОД ПЕРВИЧНОЙ ИЗОЛЯЦИИ ШТАММОВ ВИРУСА РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА, ШТАММ ВИРУСА BOVINE RESPIRATORY SYNCITIAL VIRUS ДЛЯ ИЗГОТОВЛЕНИЯ ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ | 2010 |
|
RU2451073C2 |
| Способ выявления и идентификации коронавирусов у крупного рогатого скота | 2021 |
|
RU2766344C1 |
| Набор олигонуклеотидных праймеров и зонда для выявления вируса герпеса крупного рогатого скота 4-го типа (BHV-4) в пробах биоматериала | 2018 |
|
RU2700750C1 |
| Способ выявления генома возбудителя вируса парагриппа 3 типа у крупного рогатого скота | 2018 |
|
RU2696069C2 |
| Тест-система для выявления ДНК возбудителя контагиозной плевропневмонии крупного рогатого скота методом полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2821042C1 |
| Олигонуклеотидные праймеры для выявления РНК вируса энзоотического лейкоза крупного рогатого скота полимеразно-цепной реакцией | 2024 |
|
RU2824666C1 |
| Синтетические олигонуклеотидные праймеры и способ выявления РНК атипичного пестивируса крупного рогатого скота | 2016 |
|
RU2607025C1 |

Группа изобретений относится к биотехнологии. Раскрыт набор синтетических олигонуклеотидных праймеров и зондов для выявления вируса респираторно-синцитиальной инфекции крупного рогатого скота (BRSV) и гена GAPDH крупного рогатого скота, отличающийся тем, что синтетические олигонуклеотидные праймеры и зонды имеют нуклеотидные последовательности: SEQ ID NO: 1-6. Также раскрыт способ выявления РНК вируса респираторно-синцитиальной инфекции крупного рогатого скота с использованием указанного набора. Группа изобретений обеспечивает высокоспецифичный и чувствительный способ на основе полимеразной цепной реакции (ПЦР) с использованием гибридизационно-флуоресцентной детекции в режиме реального времени, позволяющий выявлять и оценивать концентрацию вируса РСИ КРС в пробах биоматериала. 2 н.п. ф-лы, 1 ил., 3 табл., 4 пр.
1. Набор синтетических олигонуклеотидных праймеров и зондов для выявления вируса респираторно-синцитиальной инфекции крупного рогатого скота (BRSV) и гена GAPDH крупного рогатого скота, отличающийся тем, что синтетические олигонуклеотидные праймеры и зонды имеют нуклеотидные последовательности: SEQ ID NO: 1-6.
2. Способ выявления РНК вируса респираторно-синцитиальной инфекции крупного рогатого скота, включающий выделение РНК из образцов проб биологического материала от крупного рогатого скота, проведение обратной транскрипции и ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени с применением панели положительных контрольных образцов с известной концентрацией, отличающийся тем, что используют набор синтетических олигонуклеотидных праймеров и зондов по п. 1, исследование каждой пробы проводят методом мультиплексной ПЦР для одновременного выявления РНК гена вируса респираторно-синцитиальной инфекции крупного рогатого скота и гена GAPDH.
| СИНТЕТИЧЕСКИЕ ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА РЕСПИРАТОРНО-СИНЦИТИАЛЬНОЙ ИНФЕКЦИИ КРУПНОГО РОГАТОГО СКОТА С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ (ПЦР) | 2009 |
|
RU2405039C1 |
| CN 103498009 B, 21.01.2015 | |||
| CN 107058619 A, 18.08.2017 | |||
| BOUKHVALOVA M.S | |||
| et al | |||
| The Cotton Rat Model of Respiratory Viral Infections Pathogenesis and Immunity // Biologicals, 2009, V.37, pp.152-159. | |||
Авторы
Даты
2022-03-24—Публикация
2020-07-22—Подача