ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение относится к области молекулярной биологии и может быть использовано для подавления экспрессии гена C-KIT в клетках нейробластом с использованием лентивирусных конструкций, направляющих синтез коротких siPHK, специфичных в отношении данного гена.
Нейробластома представляет собой наиболее часто встречающуюся солидную злокачественную опухоль, выявляемую у детей, и составляет 8-10% от общего числа детских онкологических заболеваний. Нейробластома является злокачественной опухолью симпатической нервной системы и развивается из эмбриональных клеток, формирующих нервный гребень (Megison M.L., Gillory L.A., Beierle Е.А. 2013. Cell survival signaling in neuroblastoma. Anti-cancer agents in medicinal chemistry. 13, 563-575).
Чаще всего первичная опухоль локализована в надпочечниках, а метастазы выявляются в костном мозге, лимфоузлах, костной ткани, печени и в головном мозге. Медиана возраста больных нейробластомой составляет 18 месяцев, при этом у детей старше 18 месяцев опухоль часто бывает неоперабельной, со множеством метастазов, и требует интенсивной терапии, при этом долгосрочная выживаемость составляет не более 40-50% (Schleiermacher G., Janoueix-Lerosey I., Delattre О. 2014. Recent insights into the biology of neuroblastoma. International journal of cancer Journal international du cancer. 135, 2249-2261). У больных до года опухоль может развиваться совершенно по-другому, например, большинство новорожденных, даже при наличии у них метастазов, может быть вылечено щадящим курсом химиотерапии, а в некоторых случаях опухоль может спонтанно регрессировать или дифференцироваться в доброкачественную опухоль (Brodeur G.M., Bagatell R. 2014. Mechanisms of neuroblastoma regression. Nature reviews Clinical oncology. 11, 704-713). Таким образом, особенностью нейробластом является их крайняя гетерогенность: опухоль может как спонтанно регрессировать, независимо от размеров и количества метастазов, так и развиваться очень агрессивно и быстро. В связи с высокой гетерогенностью нейробластом возникает ряд трудностей, связанных с диагностикой и выбором тактики лечения этого заболевания.
Одним из прогностических факторов является экспрессия гена c-kit, кодирующего рецепторную тирозинкиназу KIT (Vitali R., Cesi V., Nicotra M.R., McDowell H.P., Donfrancesco A., Mannarino O., Natali P.G., Raschella G., Dominici C. 2003. c-Kit is preferentially expressed in MYCN-amplified neuroblastoma and its effect on cell proliferation is inhibited in vitro by STI-571. International journal of cancer Journal international du cancer. 106, 147-152, Ootsuka S., Asami S., Sasaki Т., Yoshida Y., Nemoto N., Shichino H., Chin M., Mugishima H., Suzuki T. 2007. Analyses of novel prognostic factors in neuroblastoma patients. Biological & pharmaceutical bulletin. 30, 2294-2299). Тирозинкиназа KIT активируется своим лигандом, фактором роста стволовых клеток SCF, и участвует в гемопоэзе, процессах пигментации, стимулирует пролиферацию и выживание нейральных стволовых клеток (Lennartsson J., Ronnstrand L. 2012. Stem cell factor receptor/c-Kit: from basic science to clinical implications. Physiological reviews. 92, 1619-1649, Spirin P.V., Lebedev T.D., Orlova N.N., Gornostaeva A.S., Prokofjeva M.M., Nikitenko N.A., Dmitriev S.E., Buzdin A.A., Borisov N.M., Aliper A.M., Garazha A.V., Rubtsov P.M., Stocking C, Prassolov V.S. 2014. Silencing AML1-ETO gene expression leads to simultaneous activation of both pro-apoptotic and proliferation signaling. Leukemia. 28, 2222-2228). Нарушения в функционировании белка KIT часто встречаются при мелкоклеточном раке легких, опухолях желудочно-кишечного тракта, колоректальном раке, меланоме и лейкозах (Lennartsson J., Ronnstrand L. 2012. Stem cell factor receptor/c-Kit: from basic science to clinical implications. Physiological reviews. 92, 1619-1649, Heinrich M.C., Blanke CD., Druker B.J., Corless C.L. 2002. Inhibition of KIT tyrosine kinase activity: a novel molecular approach to the treatment of KIT-positive malignancies. Journal of clinical oncology: official journal of the American Society of Clinical Oncology. 20, 1692-1703, Liang J., Wu Y.L., Chen B.J., Zhang W., Tanaka Y., Sugiyama H. 2013. The C-kit receptor-mediated signal transduction and tumor-related diseases. International journal of biological sciences 9, 435-443, Лебедев Т.Д., Спирин П.В., Орлова H.H., Кудрявцева А.В., Мельникова Н.В., Сперанская А.С., Прасолов B.C. 2013. Поиск генов, участвующих в развитии лейкозов, с помощью РНК-интерференции и глубокого секвенирования. Доклады Академии Наук. 5, 606-609 (Lebedev T.D., Spirin P.V., Orlova N.N., Kudryavtseva A.V., Melnikova N.V., Speranskaya A.S., Prasolov V.S. 2013. RNA interference and deep sequencing as tools for identifying new genes involved in leukemogenesis. 448, 49-51). Причиной нарушений функции белка KIT могут быть как мутации в активационных доменах белка, так и его гиперэкспрессия. В ряде случаев у больных нейробластомой обнаруживается одновременная гиперэкспрессия генов, кодирующих KIT, и его лиганд SCF. В результате образуется аутокринная петля, которая может стимулировать активную пролиферацию клеток и защищать клетки от индукции апоптоза. Повышенная экспрессия KIT рассматривается как неблагоприятный прогностический фактор развития заболевания при наличии амплификации гена MYCN (Vitali R., Cesi V., Nicotra M.R., McDowell H.P., Donfrancesco A., Marmarino O., Natali P.G., Raschella G., Dominici C. 2003. c-Kit is preferentially expressed in MYCN-amplified neuroblastoma and its effect on cell proliferation is inhibited in vitro by STI-571. International journal of cancer Journal international du cancer. 106, 147-152). Известно, что KIT может активировать экспрессию васкулярно-эндотелиального фактора роста VEGFA (Litz J., Krystal G.W. 2006. Imatinib inhibits c-Kit-induced hypoxia-inducible factor-1 alpha activity and vascular endothelial growth factor expression in small cell lung cancer cells. Molecular cancer therapeutics. 5, 1415-1422). Этот фактор роста стимулирует ангиогенез, и полагают, что его активация сопряжена с повышенной способностью злокачественных клеток к метастазированию, выживанию злокачественных клеток в условиях гипоксии, а также приводит к изменениям в микроокружении опухоли. На данный момент экспрессия VEGFA является одним из основных прогностических факторов, а сам VEGFA является одной из потенциальных мишеней для терапии нейробластом и других опухолей. Экспрессия генов c-kit и VEGFA может контролироваться белком MYC, часть функций которого совпадает с белком MYCN, амплификации которого наиболее часто выявляются при нейробластомах. На настоящий момент неизвестно, как взаимосвязана экспрессия этих генов в клетках нейробластомы.
УРОВЕНЬ ТЕХНИКИ
Перспективным современным подходом к лечению опухолей является РНК-интерференция, основанная на подавлении экспрессии генов на посттранскрипционном уровне с использованием коротких олигорибонуклеотидов. РНК-интерференция является наиболее популярным методом нокдауна генов - он прост в исполнении, недорог, малотоксичен и высокоспецифичен. РНК-интерференция может стать основой новых биомедицинских подходов, направленных на борьбу с заболеваниями различной природы, в том числе и с онкологическими. Основным препятствием использования интерферирующих РНК в терапевтических целях является несовершенство методов их доставки в клетки-мишени. В настоящее время большое распространение получили системы переноса и экспрессии генов в клетках высших животных и человека in vitro и in vivo с помощью лентивирусных векторов. В качестве целевого гена такие векторы кодируют предшественники малых интерферирующих РНК (shPHK), которые в результате внутриклеточного процессинга становятся siPHK.
В данном изобретении предлагается рекомбинантная генетическая конструкция для подавления экспрессии гена C-KIT в клетках нейробластом методом РНК-интерференции. В частности, были созданы лентивирусные конструкции, направляющие синтез shPHK предшественников малых интерферирующих РНК (siPHK), специфичных в отношении данного гена.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Получение леитивирусных конструкций
Для клонирования в лентивирусный вектор были использованы следующие последовательности:
1. SCR-смысловая 5'-р-
aacgCAAGTCTCGTATGTAGTGGcttcctgcaaCCACTACATACGAGACTTGttttt
с-3'
2. SCR-антисмысловая 5'-р-
tcgagaaaaaCAAGTCTCGTATGTAGTGGttgcaggaagCCACTACATACGAGACT
TGcgtt-3'
3. KIT-2-смысловая 5'-р-
aacgCGGTTGAATGTAAGGCTTActtcctgcaaTAAGCCTTACATTCAACCGTGt
ttttc-3'
4. KIT-2-антисмысловая 5'-р-
tcgagaaaaaCACGGTTGAATGTAAGGCTTAttgcaggaagTAAGCCTTACATTCA
ACCGcgtt-3'
Данные последовательности предназначены для клонирования в ленти- или ретровирусный вектор по сайтам рестрикции XpaI и XhoI. В настоящем изобретении используют для клонирования лентивирусный вектор семейства Lego (Lego С), в котором экспрессия последовательностей, направляющих синтез shPHK, осуществляется под контролем U6 промотора полимеразы III. Данный вектор также направляет синтез маркерного гена флуоресцирующего белка mCherry, который позволяет осуществлять детекцию конструкции в клетках-мишенях. Клонирование осуществляют с помощью стандартных методов генной инженерии. В результате были получены генетические конструкции shKIT-Cherry и shSCR-Cherry.
Для наработки препаратов экспрессирующих векторов, необходимых для конструирования препаратов лентивирусных частиц, направляющих синтез shPHK, используют метод трансформации компетентных клеток E.coli.
Для этого сначала осуществляют приготовление компетентных клеток с использованием MnCl2. После этого культивируют клетки в жидкой среде LB в течение ночи при 37°C. Высевают на LB-агар и выращивают в течение ночи при 37°C. Отбирают 10-12 колоний или собирают все клетки так, чтобы их количество было приблизительно равно небольшой горошине, в 30 мл SOB выращивают в течение ночи (8 ч) при 18°C с хорошей аэрацией до А600=0,3-0,6. Выросшие клетки охлаждают в течение 10 мин во льду, потом центрифугируют 10 мин 3000 об/мин 4°С, ресуспендируют в 10 мл ТВ (0°C). Далее инкубируют 10 мин во льду, центрифугируют 10 мин 3000 об/мин при 4°C. Опять ресуспендируют 2,5 мл ТВ (0°C), медленно добавляют ДМСО до 7% с мягким перемешиванием, инкубируют 10 мин во льду, после чего переносят в криопробирки по 200 мкл и быстро замораживают в жидком азоте.
Трансформацию клеток E.coli и высев на селективную среду осуществляют согласно стандартному протоколу. Для этого к 0,1 мл суспензии компетентных клеток E.coli добавляют 10 мкл лигазной смеси, содержащей последовательность, направляющую синтез shPHK C-KIT или shPHK SCR и инкубируют 30 мин при 0°C. Затем клетки выдерживают 30 секунд при 42°C. Далее к суспензии клеток добавляют 0,8 мл среды LB и инкубируют 1 час при 37°C, после чего клетки высевают на твердую среду (LB-агар), содержащую ампициллин (100 мкг/мл), и инкубируют в течение ночи в термостате при 37°C. Выросшие колонии пересевают в жидкую среду LB с ампициллином и выращивают в течение ночи при 37°C.
Выделение чистой плазмидной ДНК в больших количествах осуществляют с использованием набора колонок и реактивов фирмы Qiagen (Plasmid extraction kit) по методике производителя.
Используемые реактивы
Раствор А: 50 мМ глюкоза, 25 мМ трис-HCl рН 8,0, 10 мМ EDTA.
Раствор В: 0,2 MNaOH, 1% SDS.
Последовательность выполнения
1,5 мл ночной культуры трансформированных клеток E.coli центрифугируют 2 мин при 3300 g, осадок клеток суспендируют в 100 мкл раствора «А» и тщательно перемешивают. Затем добавляют 200 мкл свежеприготовленного раствора «В» и осторожно перемешивают. Далее прибавляют 150 мкл 8 М ацетата натрия (рН 4,8), тщательно перемешивают и инкубируют смесь 15 мин на льду. Появляющийся хлопьевидный осадок удаляют центрифугированием при 16,1 тыс. g в течение 5 мин. Супернатант переносят в новую пробирку, добавляют 300 мкл изопропанола и перемешивают. Полученную смесь центрифугируют 5 мин при 16,1 тыс. g. К осадку прибавляют 300 мкл 70% этанола и повторяют процедуры осаждения и удаления супернатанта. Осадок растворяют в 30 мкл буфера ТЕ.
Для конструирования препаратов лентивирусных частиц в качестве упаковывающих клеток, в которых осуществляется сборка лентивирусных частиц, используют клетки линии НЕК293, которые за 12-14 часов до начала трансфекции высевают на чашки Петри диаметром 60 мм в количестве 3,0-3,5×105 клеток на чашку. Данные клетки могут быть трансфецированы с высокой эффективностью, что обеспечивает наиболее высокий уровень продукции рекомбинантных ретровирусов (векторов).
Процедура включает несколько стадий.
1. В первый день клетки линии НЕК 293 высевают на 10 см чашки Петри по 1,500 тыс. кл/чашка.
2. На следующий день проводят транзиентную ко-трансфекцию тремя плазмидами: Векторная плазмида Lego С с клонированной shPHK: 10-20 мкг на чашку - Gag/Pol-плазмида: 10 мкг на чашку pMDLg/pRRE - Rev-плазмида: 5 мкг на чашку pRSV-Rev - Оболочечная плазмида: 2 мкг на чашку phCMV-VSV-G. Процедура трансфекции проводится в несколько этапов согласно протоколу производителя Lipofectamine 2000 (Invitrogen).
3. Для липофекции на каждую чашку Петри берут по 60 мкл реагента Lipofectamine 2000 (Invitrogen). Спустя 4 часа после трансфекции меняют среду.
4. Через 24 часа после трансфекции собирают вируссодержащую среду, пропускают через фильтр с диаметром пор 0,22 мкм для удаления клеточного дебриса, фасуют по 1 мл и хранят при температуре -70°C.
Лентивирусную трансдукцию осуществляют следующим образом.
В 24-луночные планшеты высевают по 50 тыс. клеток на лунку. Клетки выращивают на стандартной среде RPMI 1640, содержащей 10% эмбриональной сыворотки, 4 мМ L-глутамина, стрептомицин/пенициллин в концентрации 100 мкг/мл и 100 ед/мл, соответственно, рН 6,8-7,0 при температуре 37°C в атмосфере 5% CO2.
На следующий день в культуру клеток вносят по 0,3 мл вируссодержащей среды на лунку. Заражение культуры клеток осуществляют в среде, содержащей полибрен, в концентрации 8 мкг/мл для повышения эффективности заражения. Через 48 часов после трансдукции в каждую лунку добавляют пуромицин до концентрации 0,5 мкг/мл.
Поскольку помимо шпилечной структуры сконструированные лентивирусные векторы направляют также синтез флуоресцентного белка mCherry, эффективность трансфекции оценивают методом проточной цитофлуориметрии или с помощью флюоресцентного микроскопа (цитофлуориметр Beckman Coulter Epics XL или флюоресцентный микроскоп Leica DMI 4000). В данном случае эффективность трансдукции составляет 85-90%.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
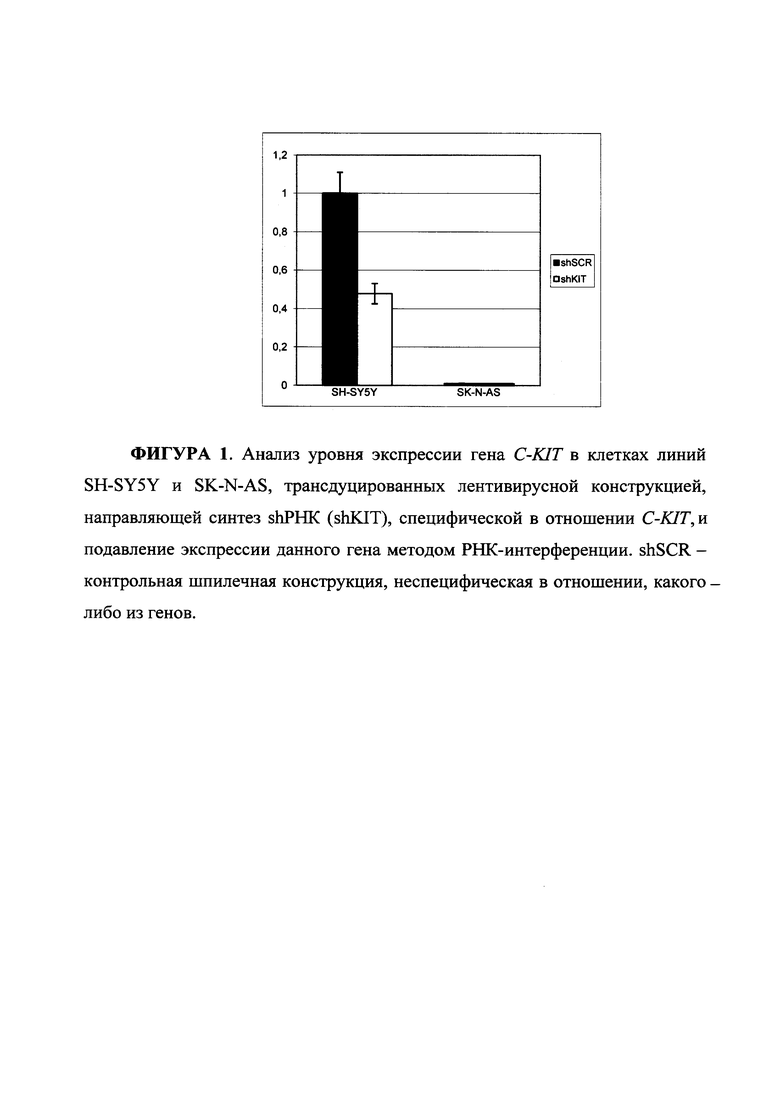
На ФИГУРЕ 1 представлен анализ уровня экспрессии гена C-KIT в клетках линий SH-SY5Y и SK-N-AS, трансдуцированных лентивирусной конструкцией, направляющей синтез shPHK (shKIT), специфической в отношении C-KIT, и подавление экспрессии данного гена методом РНК-интерференции. shSCR - контрольная шпилечная конструкция, неспецифическая в отношении какого-либо из генов.
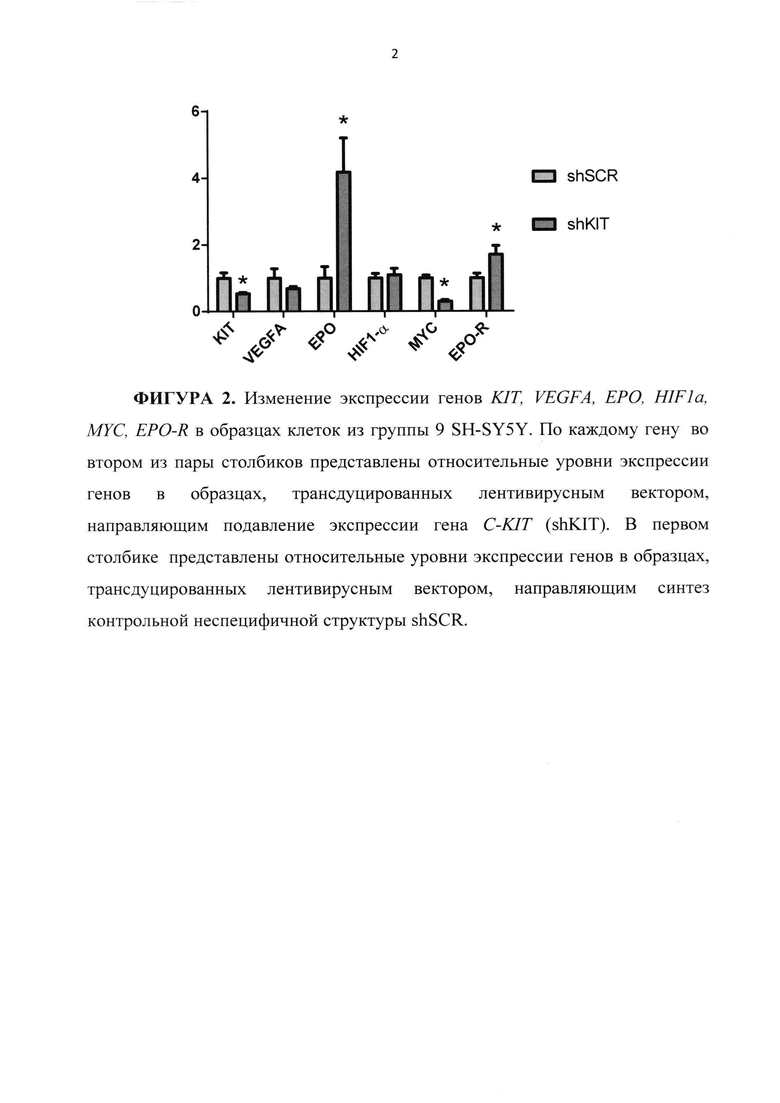
На ФИГУРЕ 2 показано изменение экспрессии генов KIT, VEGFA, ЕРО, HIF1a, МYС, EPO-R в образцах клеток SH-SY5Y с подавленной экспрессией C-KIT. Экспрессия генов представлена двумя столбиками. Первые (для каждого из генов) соответствуют относительным уровням экспрессии генов в образцах, трансдуцированных лентивирусным вектором, направляющим подавление экспрессии гена C-KIT (shKIT). Вторые соответсвуют относительным уровням экспрессии генов в образцах, трансдуцированных лентивирусным вектором, направляющим синтез контрольной неспецифичной структуры shSCR.
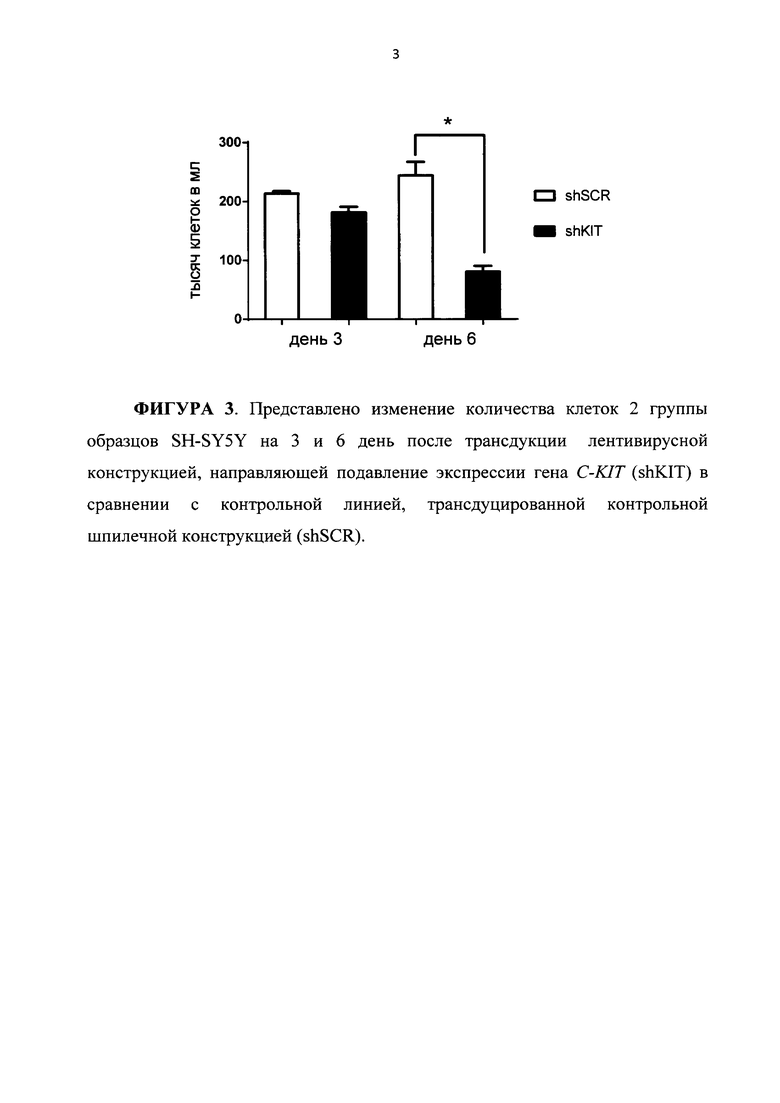
На ФИГУРЕ 3 представлено изменение количества клеток 2 группы образцов SH-SY5Y на 3 и 6 день после трансдукции лентивирусной конструкцией, направляющей подавление экспрессии гена C-KIT (shKIT), в сравнении с контрольной линией, трансдуцированной контрольной шпилечной конструкцией (shSCR).
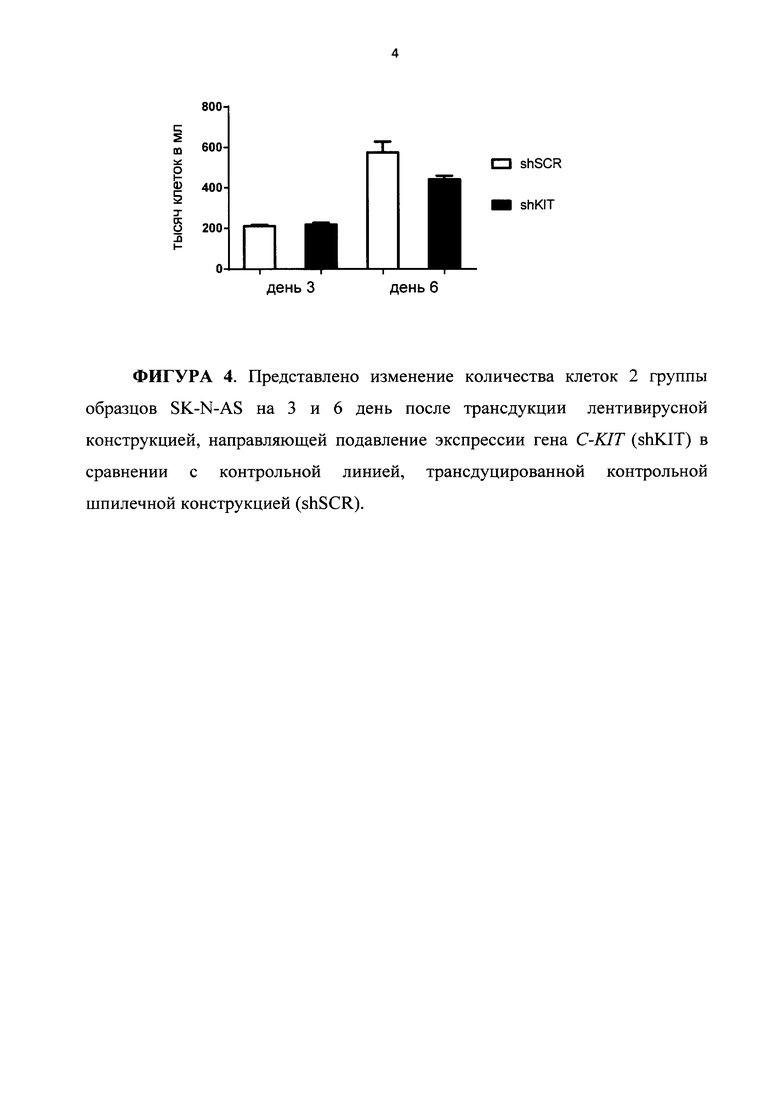
На ФИГУРЕ 4 представлено изменение количества клеток 2 группы образцов SK-N-AS на 3 и 6 день после трансдукции лентивирусной конструкцией, направляющей подавление экспрессии гена C-KIT (shKIT) в сравнении с контрольной линией, трансдуцированной контрольной шпилечной конструкцией (shSCR).
ПРИМЕРЫ
Анализ экспрессии C-KIT
Для проведения анализа экспрессии генов в клетках в сформированных группах сначала проводят выделение тотальной РНК из исследуемых клеток, получение кДНК.
Выделение РНК из клеточных культур осуществляют с помощью Тризола (Invitrogen). Количество и чистоту определяют с помощью спектрофотометра Nano Drop, измеряют поглощение при 230, 260, 280 нм. Количество РНК оценивают по значению А260, т.к. 1 А260=40 мкг РНК/мл. Чистоту образца оценивают по отношению А260/А280 (должно быть в пределах 1,8-2,0), степень загрязнения низкомолекулярными органическими соединениями - по А260/А230 (в пределах 1,5-2,0). Качество выделенной РНК определяют методом электрофореза в 1% агарозном геле. Оценивают присутствие двух полос, соответствующих 28S и 18S рибосомальных РНК, а также отсутствие неспецифических полос и продуктов деградации ДНК.
Для синтеза кДНК используют суммарную РНК клеток. Выделенную РНК переосаждают и растворяют в воде до концентрации 1 мкг/мл. Построение кДНК осуществляют с помощью обратной транскриптазы MLV (Promega). Далее пробы доводят водой mQ до конечного объема 50 мкл. Пробы кДНК хранят при -20°C.
Для идентификации в полученной тотальной кДНК интересующих генов (с-KIT и β-аюпин) используют метод ПЦР со специфичными к данным генам праймерами. ПЦР проводят в реакционной смеси объемом 10 мкл, содержащей 1,5 мМ MgCl2, 0,2 мМ dNTP, 2 е.а. Taq-ДНК-полимеразы в однократном буфере ПЦР IQ SYBR Green Supermix производства BIO-RAD, 0,1 мкМ прямого и обратного праймеров и кДНК, полученную при синтезе с 900 нг выделенной из клеток РНК.
Амплификацию проводят в следующих условиях. Каждый цикл: денатурация 94°C-30 секунд, отжиг - 30 секунд, синтез - 72°C, 1 минута. Температуру отжига определяют для каждой пары праймеров. Амплификацию и детекцию проводят с помощью прибора для амплификации MJ Mini производства BIO-RAD. Обсчет данных проводят по методу дельта-дельта Ct. Нормировку проводят по уровню экспрессии гена домашнего хозяйства β-актин.
Введение в клетки экспрессирующей кассеты, направляющей подавление экспрессии C-KIT, приводит к двукратному снижению количества мРНК, кодирующей C-KIT, в клетках линии SH-SY5Y, по сравнению с линией SK-N-AS, где экспрессия C-KIT практически отсутствовала (Фигура 1). Полученный результат демонстрирует специфичность используемой генетической конструкции в отношении данного гена.
Анализ экспрессии генов для образцов SH-SY5Y shSCR 6days-контроль и SH-SY5Y shKIT 6days проводят методом ПЦР в реальном времени. Показано, что в ответ на подавление экспрессии гена C-KIT в клетках SH-SY5Y происходит изменение экспрессии целого ряда генов, отвечающих за поддержание злокачественного статуса нейробластом (Фигура 2).
Подавление экспрессии гена C-KIT в клетках линии SH-SY5Y приводит к снижению экспрессии гена, кодирующего фактор роста эндотелия сосудов VEGF, а также к снижению экспрессии гена MYC. Подавление экспрессии C-KIT приводит к значительному, почти к четырехкратному повышению уровня экспрессии гена ЕРО, кодирующего эритропоэтин - одного из важнейших факторов, активность которого также связана с развитием и поддержанием злокачественного статуса нейробластом.
Анализ скорости роста клеток с подавленной экспрессией C-KIT
В качестве модельной системы были выбраны две линии клеток нейробластом: SH-SY5Y, SK-N-AS. Линии отличаются тем, что первая из них характеризуется высоким уровнем экспрессии гена C-KIT, а во второй данный ген практически не экспрессируется. Методом лентивирусной трансдукции в данные клетки была внесена рекомбинантная генетическая конструкция, shKIT-Cherry, направляющая синтез shPHK (шпилечной РНК) и осуществляющая специфическое подавление экспрессии гена C-KIT - одного из ключевых факторов, участвующих в злокачественной трансформации клеток, методом РНК-интерференции.
Наблюдение за клетками осуществляют в течение трех, шести и тридцати дней после трансдукции. Уже через три дня клетки линии SH-SY5Y с подавленной экспрессией C-KIT отличались от контрольных образцов, трансдуцированных лентивирусной конструкцией, направляющей синтез неспецифической последовательности shSCR, снижением скорости роста культуры. Полученные образцы были использованы для формирования двух групп образцов 1 и 2:
Группа 1:
1 SK-N-AS shSCR 3days - контроль
2 SK-N-AS shKIT 3days
5 SK-N-AS shSCR 6days - контроль
6 SK-N-AS shKIT 6days
9 SK-N-AS shSCR 1month - контроль
10 SK-N-AS shKIT 1month
Группа 2:
3 SH-SY5Y shSCR 3days - контроль
4 SH-SY5Y shKIT 3days
7 SH-SY5Y shSCR 6days - контроль
8 SH-SY5Y shKIT 6days
11 SH-SY5Y shSCR 1month - контроль
12 SH-SY5Y shKIT 1month
Две группы образцов, сформированных на базе линий клеток, указаны выше. Их можно рассматривать в качестве условной модели клеток нейробластомы после терапевтического воздействия на ген, кодирующий рецептор с тирозинкиназной активностью - C-KIT, который является мишенью для распространенного в клинике препарата - иматиниб (Гливек).
Анализ скорости роста клеток групп 1 и 2, в которых осуществлялось подавление экспрессии C-KIT, проводят на 3 и 6 день после трансдукции лентивируснй конструкцией, направляющей синтез shPHK, специфичной в отношении гена C-KIT. В качестве контроля были использованы образцы, в которых осуществлялся синтез неспецифичной конструкции shSCR.
На Фигуре 3 приведена диаграмма, иллюстрирующая изменение количества клеток образцов из группы 2, отражающая функциональное состояние образцов в момент выделения РНК: SH-SY5Y shSCR 3days - контроль, SH-SY5Y shKIT 3days, SH-SY5Y shSCR 6days - контроль, SH-SY5Y shKIT 6days.
На Фигуре 4 приведена диаграмма, иллюстрирующая изменение количества клеток образцов из группы 1, отражающая функциональное состояние образцов в момент выделения РНК: SK-N-AS shSCR 3days - контроль, SK-N-AS shSCR shKIT 3days, SK-N-AS shSCR 6days - контроль, SK-N-AS shKIT 6days.
Было показано, что подавление экспрессии гена C-KIT в клетках группы образцов 2 - SH-SY5Y приводит к существенному изменению скорости роста клеток нейробластомы по сравнению с клетками группы 1 - SK-N-AS. В этой связи группа 2 может рассматриваться в качестве варианта нейробластомы, которая отвечает на ингибирование C-KIT, а группа 1 - в качестве варианта, который на такой вариант «терапевтического» воздействия не отвечает.
Таким образом, сконструированные рекомбинантные генетические конструкции при введении в клетки нейробластомы, которые экспрессируют C-KIT, приводят не только к существенному снижению экспрессии данного онкогена, но и к значительному замедлению скорости роста злокачественных клеток.
Изобретение относится к области молекулярной биологии. Предложены рекомбинантная генетическая конструкция, клонированная в лентивирусный или ретровирусный вектор по сайтам рестрикции XpaI и XhoI и направленная на подавление экспрессии онкогена C-KIT в клетках нейробластом, и применение указанной конструкции для регуляции активности гена C-KIT и его белкового продукта. Рекомбинантная генетическая конструкция представляет собой
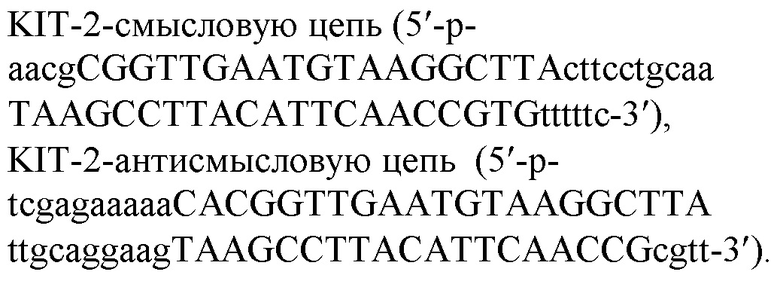
Указанная генетическая конструкция приводит к снижению экспрессии онкогена C-KIT при введении ее в клетки нейробластомы, экспрессирующие C-KIT, и к замедлению скорости роста злокачественных клеток. Рекомбинантная генетическая конструкция может быть использована для подавления экспрессии гена C-KIT в клетках нейробластом и регуляции активности гена C-KIT и его белкового продукта. 2 н.п. ф-лы, 4 ил., 2 пр.
1. Рекомбинантная генетическая конструкция для подавления экспрессии онкогена C-KIT в клетках нейробластом, клонированная в лентивирусный или ретровирусный вектор по сайтам рестрикции XpaI и XhoI, представляющая собой:
KIT-2-смысловую цепь
5'-р-aacgCGGTTGAATGTAAGGCTTActtcctgcaaTAAGCCTTACATTCAACCGTGtttttc-3',
KIT-2-антисмысловую цепь
5'-р-tcgagaaaaaCACGGTTGAATGTAAGGCTTAttgcaggaagTAAGCCTTACATTCAACCGcgtt-3'.
2. Применение рекомбинантной генетической конструкции по п. 1 для регуляции активности гена C-KIT и его белкового продукта.
| СПИРИН П.В | |||
| и др | |||
| Модуляция экспрессии активированного онкогена с-kit с помощью РНК-интерференции | |||
| Молекулярная биология | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| ВИСЯЧИЙ СЕКРЕТНЫЙ БУКВЕННЫЙ ЗАМОК БЕЗ ДУЖКИ, ОТКРЫВАЕМЫЙ С КЛЮЧЕМ И БЕЗ КЛЮЧА | 1923 |
|
SU1036A1 |
| СПИРИН П.В | |||
| и др | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Молекулярная биология | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| RUANO I | |||
| et al | |||
| Selective RNAi-mediated inhibition of mutated c-kit | |||
| Journal of RNAi and Gene Silencing | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| P | |||
| Ручной ткацкий станок | 1922 |
|
SU339A1 |
| WO 2004013310 A2, 12.02.2004 | |||
| ЛЕБЕДЕВ Т.Д | |||
| и др | |||
| Перенос и экспрессия малых интерферирующих РНК в клетках млекопитающих с помощью лентивирусных векторов | |||
| Acta naturae | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| WO 2013059496 A1, 25.04.2013. | |||
Авторы
Даты
2017-01-30—Публикация
2015-12-16—Подача