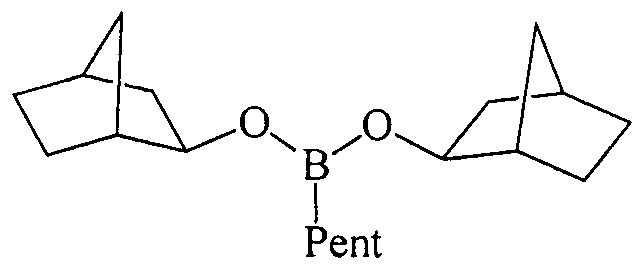
Предлагаемое изобретение относится к области борорганического синтеза, конкретно, к способу получения дицикло-алкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов общей формулы (1):
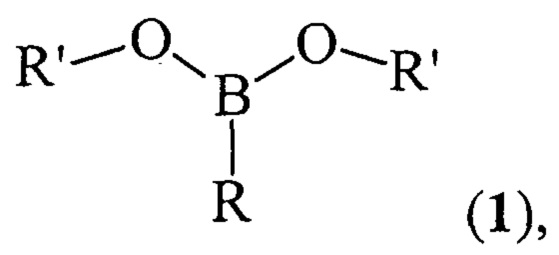 где (a) R=Et, R'=Cyclohept, (б), R=н-Pent, R'=Cyclohept, (в) R=Et, R'=Cyclooct, (г), R=н-Pent, R'=Cyclooct, (д) R=Et, R'=Cyclododec, (e) R=Et, R'=Norbomyl, (ж), R=н-Pent, R'=Norbornyl.
где (a) R=Et, R'=Cyclohept, (б), R=н-Pent, R'=Cyclohept, (в) R=Et, R'=Cyclooct, (г), R=н-Pent, R'=Cyclooct, (д) R=Et, R'=Cyclododec, (e) R=Et, R'=Norbomyl, (ж), R=н-Pent, R'=Norbornyl.
Предлагаемые соединения могут найти применение в органической химии в качестве основных субстратов в реакциях кросс-сочетания ([1] N. Miyaura, A. Suzuki. Palladium-catalyzed cross-coupling reactions of organoboron compounds // Chem. Rev., 1995, Vol. 95, №7, 2457-2483).
Известен способ ([2], H.С. Brown, S.K. Gupta. Catecholborane (1,3,2-benzodioxaborole) as a new, general monohydroboration reagent for alkynes. A Convenient Synthesis of alkeneboronic esters and acids from alkynes via hydroboration // J. Am. Chem. Soc., 1972, Vol. 94, №12, 4370-4371) получения дициклогексилалкенилборонатов (2) по реакции гидроборирования терминальных алкинов с помощью дициклогексилборана с последующим окислением триметиламиноксидом.
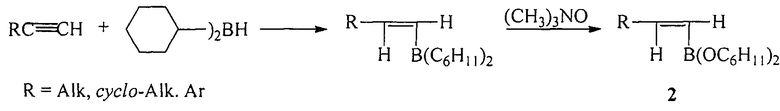
Известен способ ([3], Н.С. Brown, Т.Е. Cole. Organoboranes. 31. А simple preparation of boronic esters from organolithium reagents and selected trialkoxyboranes // Organometallics, 1983, Vol. 2, №10, 1316-1319) получения диалкоксиалкил(арил)боронатов (3) взаимодействием литийорганических реагентов с триалкоксиборанами при охлаждении до -78°С в диэтиловом эфире с последующей обработкой безводным HCl по схеме:
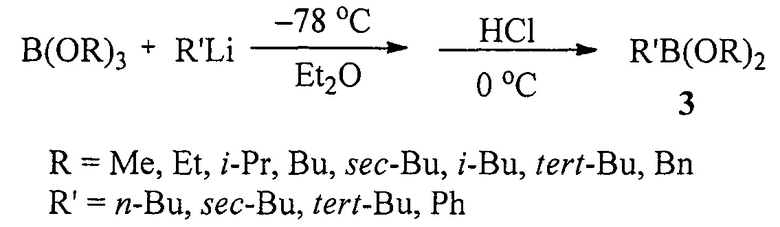
Недостатком данного способа является необходимость проведения реакции при очень низкой температуре (-78°С).
Известен способ ([4], Б.М. Михайлов, Т.К. Козминская. О действии аминов и аммиака на изоамилбордихлорид // Докл. АН СССР, 1958, Том 121, №4, 656-659) получения эфиров изоамилборной кислоты (4) действием изоамилмагнийхлорида на триметилборат с последующей этерификацией изоамилборной кислоты соответствующими спиртами по схеме:
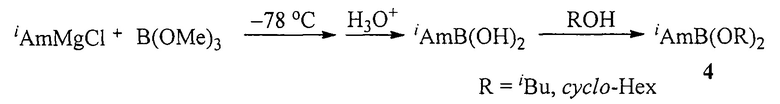
Недостатком данного способа является необходимость проведения первой стадии реакции реакции при очень низкой температуре (-78°С).
Известен способ ([5], Н. Kamogawa, S. Shiraki. Effect of pendant functional alcohol residues of (p-vinylphenyl)borate copolymers on hydrolysis // Macromolecules, 1991, Vol. 24, №14, 4224-4226) получения боронатов (5) действием (пара-винилфенил)магний бромида на триметилборат с последующей этерификацией (пара-винилфенил)борной кислоты со спиртами по схеме:
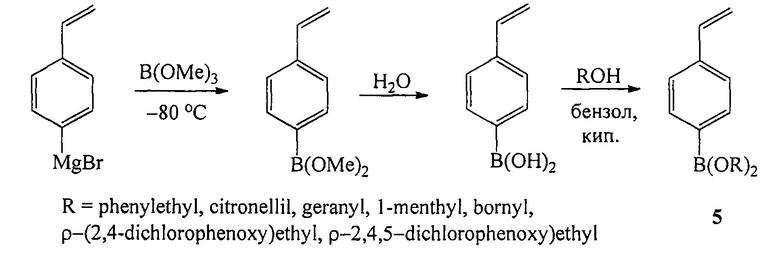
Недостатком данного способа является необходимость проведения первой стадии реакции реакции при очень низкой температуре (-80°С).
Известен способ ([6], Н.С. Brown, N.G. Bhat, V. Somayaji. Organo-boranes. 30. Convenient procedure for the synthesis of alkyl- and alkenyl-boronic acids and esters // Organometallics, 1983, Vol. 2, №10, 1311-1316) получения боронатов (6) алкоголизом комплексов алкил- и алкенилдихлор(бром)боранов с SMe2 при -10°С в пентане по схеме:
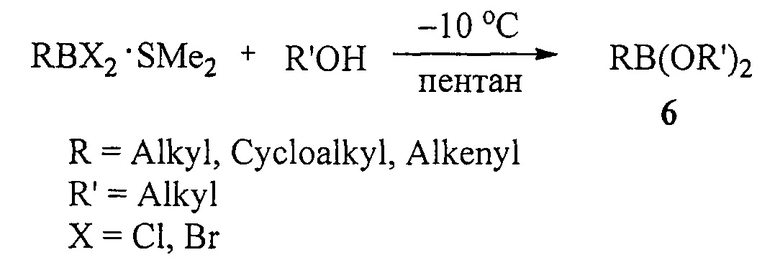
Для получения данным способом дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов в качестве исходных реагентов наряду с RBX2⋅SMe2 необходимо использовать циклоалканол или норборнанол.
Предлагается новый альтернативный способ получения дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов (1).
Сущность способа заключается во взаимодействии циклоолефина (циклогептен, цис-циклооктен или циклододецен) с RBCl2 (R=Et, н-Pent) в присутствии Mg (порошок) и катализатора титанацендихлорида (Cp2TiCl2) в тетрагидрофуране в инертной атмосфере, взятыми в мольном соотношении [RBCl2 : циклоалкен : Mg : Cp2TiCl2=(10÷14) : 10 : (10÷30) : (1.8÷2.2)], предпочтительно 12:10:20:2.0.
EtBCl2 был получен взаимодействием Et3B с BCl3 по методу ([7] Н.С. Brown, А.В. Levy. Organoboranes. XV. A simple convenient procedure for the preparation of alkyldichloroboranes via hydroboration-redistribution // J. Organomet. Chem. 1972, V. 44, P. 233-236). н-C5H11BCl2⋅был получен взаимодействием пент-1-ена с HBCl2⋅SMe2 по методу ([8], Brown Н.С, Ravindran N., Kulkarni S.U. Hydroboration. 54. New general synthesis of alkyldihaloboranes via hydroboration of alkenes with dihaloborane-dimethyl sulfide complexes. Unusial trends in the reactivities and directed effects. // J. Org. Chem., 1976, V. 45, №3, 384-389). Реакцию проводят при перемешивании и нагревании до 50°С в течение 4-6 ч, предпочтительно 5 ч. Затем реакционную массу охлаждают до комнатной температуры и перемешивают в течение 16 ч, после чего гидролизуют водой. Выход дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов (1), выделенных с помощью ректификации, составляет 52-96%. Реакция протекает по схеме:
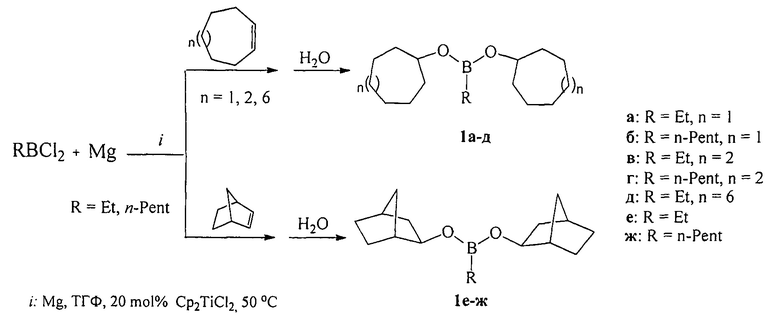
Дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонаты (1) образуются только лишь с участием циклоалкенов, алкилдихлорборана (RBCl2), порошка магния, катализатора титанацендихлорида и растворителя ТГФ. В присутствии других соединений бора (BCl3⋅SMe2, BBr3, BCl3, BI3 или BF3⋅Et2O), других непредельных соединений (например, аллены, ацетилены) или другого катализатора (например, Pd(acac)2, NiCl2, Ni(асас)2, CoCl2) целевые продукты (1) не образуются.
Проведение указанной реакции в присутствии титанового катализатора Cp2TiCl2 больше 2.2 мол % по отношению к циклоалкену не приводит к существенному увеличению выхода целевых продуктов (1). Использование катализатора Cp2TiCl2 менее 1.8 мол % по отношению к циклоалкену снижает выход дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов (1), что связано, возможно, со снижением каталитически активных центров в реакционной массе. Изменение соотношений исходных реагентов в сторону уменьшения содержания RBCl2 по отношению к исходному циклоалкену приводит к снижению выхода дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов (1). Увеличение содержания RBCl2 по отношению к исходному циклоалкену приводит к образованию побочных продуктов, образующихся в путем взаимодействия избытка RBCl2 с молекулой тетрагидрофурана.
Существенные отличия предлагаемого способа:
В известном способе в качестве исходных реагентов используются RBX2⋅SMe2 (R = алкил, циклоалкил, X = Cl, Br) и алканолы. Предлагаемый способ синтеза дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов базируется на использовании в качестве исходных реагентов RBCl2 (R = Et, н-Pent), циклоалкенов, магния (порошок) и катализатора Cp2TiCi2.
Способ поясняется следующими примерами:
ПРИМЕР 1. В стеклянный реактор объемом 50 мл в атмосфере аргона при 0°С и перемешивании на магнитной мешалке последовательно загружали Cp2TiCl2 (2 ммоль, 0.498 г), магний (порошок) (20 ммоль, 0.486 г), THF (30 мл), циклогептен 0.962 г (10.0 ммоль), EtBCl2 (12 mmol). Температуру поднимали до 50°С и перемешивали 5 ч. Затем реакционную массу охлаждали до комнатной температуры (~ 22-25°С) и перемешивали еще 16 ч. После чего реакционную смесь гидролизовали. Органический слой отделяли, водный слой экстрагировали диэтиловым эфиром (2×10 мл). Экстракты объединяли с органическим слоем. Растворитель упаривали и остаток перегоняли в вакууме. Получили дицклогептилэтилборонат 1а с выходом 94%.

Дициклогептилэтилборонат (1а). Маслообразная жидкость желтого цвета, т. кип. 150°С (5 мм рт.ст). Выход: 94% (1.25 г, 4.7 ммоль). ИК-спектр, ν, см-1: 2927, 2858, 2687, 1655, 1608, 1461, 1336, 1221, 1172, 1108, 1025, 913, 834, 821, 762. 1Н ЯМР (CDCl3, м.д., 400.13 МГц): δ=0.72 (кв, 2Н, В-СН2-СН3, J=7.9 Гц), 0.93 (т, 3Н, В-СН2-СН3, J=7.6 Гц), 1.35-1.45 (м, 4Н, cycloheptyl), 1.52-1.73 (м, 16Н, cycloheptyl), 1.75-1.85 (м, 4Н, cycloheptyl), 4.22-4.28 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=5.77 (уш* В-СН2-СН3), 8.27 (В-СН2-СН3), 22.83, 28.18, 36.67, 72.67. 11В ЯМР (CDCl3, м.д., 128.33 MHz): δ=30.65.
ПРИМЕР 2. В стеклянный реактор объемом 50 мл в атмосфере аргона при 0°С и перемешивании на магнитной мешалке последовательно загружают Cp2TiCl2 (2 ммоль, 0.498 г), магний (порошок) (20 ммоль, 0.486 г), THF (30 мл), циклогептен 0.962 г (10.0 ммоль), PentBCl2 (12 mmol). Температуру поднимали до 50°С и перемешивали 5 ч. Затем реакционную массу охлаждали до комнатной температуры (~ 22-25°С) и перемешивали еще 16 ч. После чего реакционную смесь гидролизовали. Органический слой отделяли, водный слой экстрагировали диэтиловым эфиром (2×10 мл). Экстракты объединяли с органическим слоем. Растворитель упаривали и остаток перегоняли в вакууме. Получили дицклогептилпентилборонат 1б с выходом 90%.
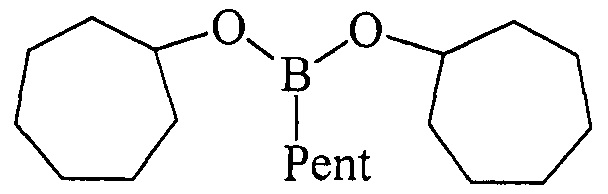
Дициклогептилпентилборонат (1б). Маслообразная жидкость желтого цвета, т. кип. 152°С (1 мм). Выход: 90% (1.39 г, 4.5 ммоль). ИК спектр, ν, см-1: 2911, 2830, 2718, 1428, 1380, 1300, 1210, 1195, 1170, 1107, 1005, 955, 830, 797, 720, 685. 1Н ЯМР (CDCl3, м.д., 400.13 МГц): δ=0.71 (т, 2Н, В-СН2, J=7.8 Гц), 0.90 (т, 3Н, СН3, J=6.9 Гц), 1.23-1.42 (м, 6Н, 3СН2, alkyl), 1.42-1.52 (м, 4Н, 4СН, cycloheptyl), 1.55-1.84 (м, 20Н, 12СН, 4СН2, cycloheptyl), 4.20-4.30 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=13.90 (уш*, В-СН2, alkyl), 14.18 (alkyl), 22.64 (alkyl), 23.05 (cycloheptyl), 24.20 (alkyl), 28.27 (cycloheptyl), 34.97 (alkyl), 36.73 (cycloheptyl), 72.65 (O-CH). 11В ЯМР (CDCl3, м.д, 128.33 МГц): δ=31.99.
ПРИМЕР 3. Аналогично пр. 1, но вместо циклогептена использовали цис-циклооктен.
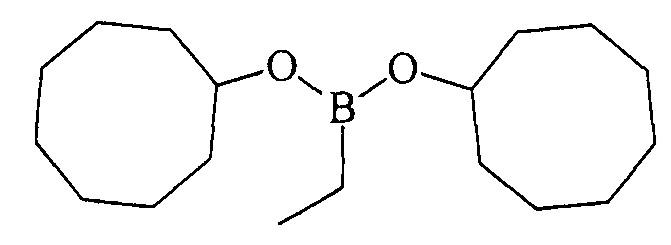
Дициклооктилэтилборонат (1в). Маслообразная жидкость желтого цвета, т. кип. 160°С (5 мм рт.ст). Выход: 96% (1.41 г, 4.8 ммоль). ИК-спектр, ν, см-1: 2923, 2854, 2695, 1712, 1466, 1447, 1390, 1342, 1311, 1263, 1216, 1181, 1117, 1053, 991, 908, 845, 805, 762, 736, 706, 677, 648. 1Н ЯМР (CDCl3, м.д, 400.13 МГц): δ=0.72 (к, 2Н, В-СН2-СН3, J=7.6 Гц), 0.93 (т, 3Н, В-СН2-СН3, J=7.8 Гц), 1.45-1.60 (м, 16Н, cyclooctyl), 1.60-1.80 (м, 12Н, cyclooctyl), 4.22-4.27 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=5.92 (уш*, В-СН2-СН3), 8.27 (В-СН2-СН3), 22.81, 25.38, 27.41, 34.15, 72.23. 11В ЯМР (CDCl3, м.д., 128.33 МГц): δ=30.76.
ПРИМЕР 4. Аналогично пр. 2, но вместо циклогептена использовали цис-циклооктен.
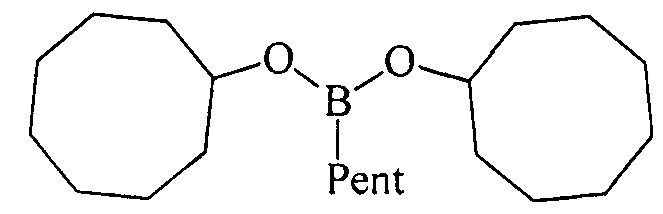
Дициклооктилпентилборонат (1 г). Маслообразная жидкость желтого цвета, т. кип. 171°С (1 мм). Выход: 92% (1.55 г, 4.6 ммоль). ИК спектр, ν см-1: 2902, 2838, 2704, 1455, 1400, 1385, 1312, 1260, 1205, 1171, 1125, 998, 975, 831, 800, 766, 727, 680, 650. 1Н ЯМР (CDCl3, м.д., 400.13 МГц): δ=0.70 (т, 2Н, В-СН2, J=7.8 Гц), 0.89 (т, 3Н, СН3, J=6.8 Гц), 1.24-1.42 (м, 6Н, 3СН2, alkyl), 1.42-1.62 (м, 16Н, 4СН, 6СН2, cyclooctyl), 1.65-1.78 (м, 12Н, 4СН, 4СН2, cyclooctyl), 4.17-4.32 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=13.50 (уш*, В-СН2, alkyl), 14.09 (alkyl), 22.58 (alkyl), 22.80 (cyclooctyl), 24.16 (alkyl), 25.39 (cyclooctyl), 27.43 (cyclooctyl), 34.13 (cyclooctyl), 34.90 (alkyl), 72.23 (O-CH). 11 В ЯМР (CDCl3, м.д, 128.33 МГц): δ=31.36.
ПРИМЕР 5. Аналогично пр. 1, но вместо циклогептена использовали цис/транс-циклододецен. Выход (1д) 52%.
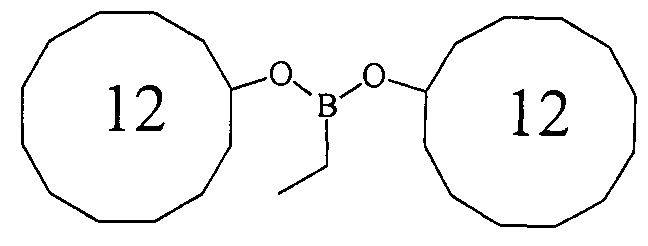
Дициклододецилэтилборонат (1е). Маслообразная жидкость желтого цвета, т. кип. 178°С (0.1 мм рт.ст.). Выход: 52% (1.06 г, 2.6 ммоль). ИК-спектр, ν, см-1: 2927, 2863, 1694, 1577, 1543, 1482, 1415, 1333, 1222, 1076, 1049, 906, 797, 763, 717, 600. 1Н ЯМР (CDCl3, м.д, 400.13 МГц): δ=0.75 (кв, 2Н, В-СН2-СН3, J=6.7 Гц), 0.92 (т, 3Н, В-СН2-СН3, J=8.0 Гц), 1.25-1.50 (м, 28Н, cyclododecyl), 1.51-1.75 (м, 16Н, cyclododecyl), 3.97-4.08 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д., 100.62 МГц): δ=5.34 (уш*, В-СН2-СН3), 7.90 (В-СН2-СН3), 20.91, 23.22, 23.40, 23.76, 24.16, 32.38, 69.38. 11В ЯМР (CDCl3, м.д, 128.33 МГц): δ=30.64.
ПРИМЕР 6. Аналогично пр. 1, но вместо циклогептена использовали норборнен.
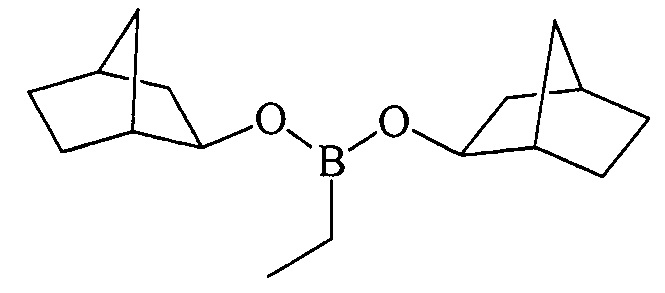
Дибицикло[2.2.1]гепт-2-илэтилборонат (1е). Маслообразная жидкость желтого цвета, т. кип. 140°С (5 мм рт.ст.). Выход: 90% (1.18 г, 4.5 ммоль). ИК спектр, ν см-1: 2916, 2900, 2859, 2831, 2189, 1470, 1430, 1388, 1335, 1263, 1233, 1201, 1150, 1113, 1063, 980, 855, 790, 760, 726, 695, 670. 1Н ЯМР (CDCl3, м.д, 400.13 МГц): δ=0.73 (к, 2Н, В-СН2, J=8.1 Гц), 0.87-0.95 (м, 3Н, В-СН2-СН3), 1.00-1.12 (м, 4Н, 4СН), 1.25-1.52 (м, 8Н, 4СН, 2СН2), 1.57-1.67 (м, 4Н, 4СН), 2.12 (уш.с, 2Н, 2СН), 2.23 (уш.с, 2Н, 2СН), 3.85-4.15 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=5.43 (уш*, В-СН2), 7.94 (8.00) (В-СН2-СН3), 24.33, 28.41, 34.78, 35.38, 42.23 (42.30), 43.70 (43.75), 75.25 [В спектрах ЯМР 13С 1е наблюдается диастереомерное расщепление ряда сигналов за счет взаимодействия двух ассиметрических центров в структуре бороната]. 11В ЯМР (CDCl3, м.д, 128.33 МГц): δ=30.94.
ПРИМЕР 7. Аналогично пр. 2, но вместо циклогептена использовали норборнен.
Дибицикло[2.2.1]гепт-2-илпентилборонат (1ж). Маслообразная жидкость желтого цвета, т. кип. 145°С (1 мм). Выход: 86% (1.31 г, 4.3 ммоль). ИК спектр, ν, см-1: 2910, 2850, 2828, 2190, 1450, 1425, 1398, 1359, 1300, 1269, 1235, 1160, 1107, 1065, 970, 875, 795, 750, 699, 660, 637. 1Н ЯМР (CDCl3, м.д., 400.13 МГц): δ=0.65-1.00 (м, 5Н, В-СН2, СН3), 1.04-1.21 (м, 22Н, 5СН2, 12СН), 2.05-2.25 (м, 4Н, 4СН), 3.70-3.85 (м, 2Н, 2СН-O). 13С ЯМР (CDCl3, м.д, 100.62 МГц): δ=14.03 (alkyl), 15.89 (уш*, В-СН2, alkyl), 22.42 (22.52) (alkyl), 23.72 (23.83) (alkyl), 24.28, 28.36, 34.78, 34.83 (alkyl), 35.35, 42.25 (42.32), 43.73 (43.77), 75.24 (75.30) [В спектрах ЯМР 13С 1ж наблюдается диастереомерное расщепление ряда сигналов за счет взаимодействия двух ассиметрических центров в структуре бороната]. 11В ЯМР (CDCl3, м.д, 128.33 МГц): δ=30.96.
Другие примеры, подтверждающие способ, приведены в табл. 1.
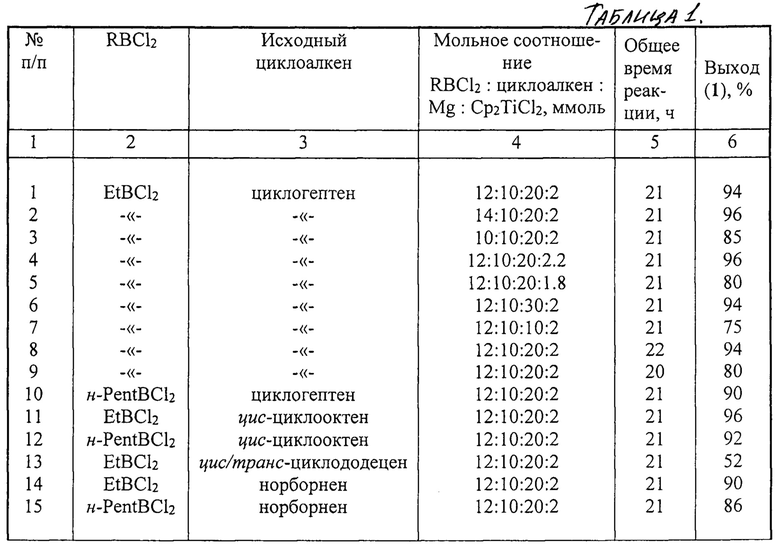
Реакции проводили при перемешивании и нагревании до 50°С в течение 5 ч, затем при комнатной температуре 16 ч.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СПИРО[АДАМАНТАН-2,2'-БОРИРАНОВ] | 2022 |
|
RU2789126C1 |
| СПОСОБ ПОЛУЧЕНИЯ ТРАНС-1-АЛКЕНИЛ(ХЛОРДИИЗОПРОПИЛАМИНО)БОРАНОВ | 2019 |
|
RU2734345C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ФЕНИЛ-1-БОРАСПИРОАЛКАНОВ | 2022 |
|
RU2800048C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2,7-ДИЦИКЛОАЛКИЛ-4,9-ДИМЕТИЛ-2,3а,5а,7,8а,10а-ГЕКСААЗАПЕРГИДРОПИРЕНОВ | 2017 |
|
RU2688221C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ЦИКЛОАЛКИЛ-1,11-ДИОКСА-4,8-ДИТИА-6-АЗАЦИКЛОТРИДЕКАНОВ | 2017 |
|
RU2664659C2 |
| Способ получения 2,7-дициклоалкил-2,3а,5а,7,8а,10а-гексаазапергидропиренов | 2016 |
|
RU2632669C2 |
| СПОСОБ ПОЛУЧЕНИЯ N-ЦИКЛОАЛКИЛЗАМЕЩЕННЫХ 1,5,3-ДИТИАЗЕПАНОВ | 2017 |
|
RU2664654C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,2-ДИАЛКИЛБОРИРАНОВ | 2017 |
|
RU2688195C2 |
| O-Ациламидоксимы и 1,2,4-оксадиазолы, содержащие фрагмент бицикло[2.2.1]гептанона-2, в качестве ингибиторов репродукции филогенетически различных вирусов гриппа А: штаммы A/Puerto Rico/8/34 (H1N1), A/Anhui/1/2013 (H7N9) | 2022 |
|
RU2798171C1 |
| СПОСОБ ПОЛУЧЕНИЯ 3-ЦИКЛОАЛКИЛ-1,5,8-ТРИТИА-3-АЗАЦИКЛОДЕКАНОВ | 2017 |
|
RU2664655C2 |
Изобретение относится к способу получения дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов общей формулы (1)
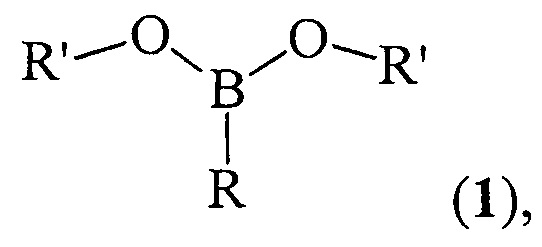
где (a) R=Et, R'=Cyclohept, (б) R=н-Pent, R'=Cyclohept, (в) R=Et, R'=Cyclooct, (г) R=н-Pent, R'=Cyclooct, (д) R=Et, R'=Cyclododec, (e) R=Et, R'=Norbornyl, (ж) R=н-Pent, R'=Norbornyl. Способ включает взаимодействие циклоалкена (циклогептен, или цис-циклооктен, или цис/транс-циклододецен, или норборнен) с предварительно полученным алкилдихлорбораном RBCl2, где R - указаны выше, при нагревании до 50°С в течение 4-6 ч в присутствии Mg (порошок) и катализатора Cp2TiCl2. Мольное соотношении RBCl2 : циклоалкен : Mg : Cp2TiCl2 составляет (10÷14) : 10 : (10÷30) : (1.8÷2.2). Способ проводят в тетрагидрофуране в инертной атмосфере и дальнейшем перемешивании при комнатной температуре (~ 20-22°С) в течение 16 ч с последующим гидролизом реакционной массы. Полученные новые эфиры бороновой кислоты могут найти применение в органической химии в качестве основных субстратов в реакциях кросс-сочетания. 1 табл., 7 пр.
Способ получения дициклоалкил(бицикло[2.2.1]гепт-2-ил)алкилборонатов общей формулы (1)
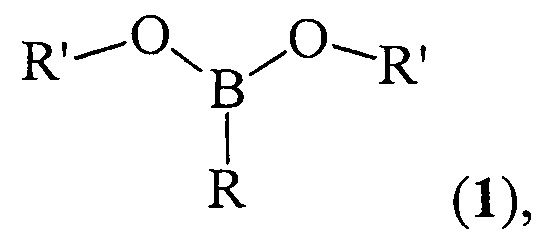
где (a) R=Et, R'=Cyclohept, (б) R=н-Pent, R'=Cyclohept, (в) R=Et, R'=Cyclooct, (г) R=н-Pent, R'=Cyclooct, (д) R=Et, R'=Cyclododec, (e) R=Et, R'=Norbornyl, (ж) R=н-Pent, R'=Norbornyl, характеризующийся тем, что циклоалкен (циклогептен, или цис-циклооктен, или цис/транс-циклододецен, или норборнен) взаимодействует с предварительно полученным алкилдихлорбораном RBCl2 (где R - указаны выше) при нагревании до 50°С в течение 4-6 ч в присутствии Mg (порошок) и катализатора Cp2TiCl2 при мольном соотношении RBCl2 : циклоалкен : Mg : Cp2TiCl2=(10÷14) : 10 : (10÷30) : (1.8÷2.2) в тетрагидрофуране в инертной атмосфере и дальнейшем перемешивании при комнатной температуре (~ 20-22°С) в течение 16 ч с последующим гидролизом реакционной массы.
| BROWN H.C | |||
| et al | |||
| Organoboranes | |||
| Способ обработки медных солей нафтеновых кислот | 1923 |
|
SU30A1 |
| Convenient procedure for the synthesis of alkyl- and alkenylboronic acids and ester, Organometallics, 1983, v | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Устройство для выемки отдельных труб в экономайзерах | 1925 |
|
SU1311A1 |
| US 20130184484 A1, 18.07.2013 | |||
| Способ получения эфиров монозамещенных борных кислот | 1983 |
|
SU1220317A1 |
| BROWN H.C | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| A | |||
Авторы
Даты
2019-12-30—Публикация
2019-02-21—Подача