Предлагаемое изобретение относится к молекулярной биологии и медицине, а именно к онкологии, и может быть использовано в лабораторной диагностике рака толстой кишки (РТК).
Злокачественные опухоли толстой кишки, как правило, возникают в результате трансформации доброкачественной опухоли (аденомы) в злокачественную (аденокарциному) [1]. Дифференциальная диагностика этих двух состояний при помощи рутинного гистологического исследования нередко затруднена, в особенности на ранней стадии малигнизации аденомы. Таким образом, дополнительное тестирование ранних молекулярных маркеров в тканях опухоли увеличит эффективность диагностики РТК на ранней стадии.
Одним из основных генетических событий, необходимых для развития любого типа опухоли, является изменение экспрессии онкогенов и генов-супрессоров опухолевого роста. Распространенным механизмом регуляции экспрессии специфичных для опухоли генов является аномальное метилирование CpG-островков промоторных областей этих генов. Гипо- и гиперметилирование генов, вовлеченных в канцерогенез, является одним из наиболее ранних событий опухолеобразования и часто обнаруживается во многих предраковых состояниях. В тоже время, изменения уровня метилирования не наблюдаются при острых и хронических воспалительных заболеваниях. Гипо- и гиперметилирование промоторных регионов специфичных для опухоли генов может служить молекулярным маркером ранней диагностики опухолей.
Наиболее близким к заявленному способу прототипом является способ-тестирование, предложенный Yan Z. и соавт. [2]. Известно, что ген COL1A2 кодирует α2-цепь коллагена I-ого типа. Избыточная экспрессия COL1A2 является специфичным признаком некоторых опухолевых заболеваний, в том числе злокачественных опухолей желудочно-кишечного тракта Увеличение уровня экспрессии продукта хотя бы одного из генов COL11A1, COL10A1, COL5A1, COL5A2, COL1A1 и COL1A2 в тканях опухоли указывает на наличие у пациента инвазивной формы рака [WO 2011130435]. В указанном исследовании тестирования уровня экспрессии вышеперечисленных генов, в том числе, гена COL1A2 осуществляется при помощи анализа количества соответствующей мРНК методом ОТ-ПЦР. Данный тип анализа обладает рядом недостатков, связанных, в первую очередь, с нестабильностью молекул мРНК. Быстрая деградация мРНК в образцах требует специфической подготовки пробы ткани, что не всегда осуществимо в формате клинической лабораторной диагностики. Нарушение подготовки пробы приводит к недостоверным результатам анализа. Кроме того, изменение уровня экспрессии мРНК может регулироваться на постранскрипционном уровне и быть обусловлено различными событиями, не связанными с опухолевым процессом.
Задачей предлагаемого изобретения является повышение точности ранней диагностики РТК за счет оценки активности гена COL1A2 при помощи определения метилирования CpG динуклеотидов в промоторной области гена COL1A2 (далее SEQ1) в ткани предполагаемой опухоли и в прилегающей к ней ткани. Нуклеотидная последовательность SEQ1 и ее позиция в промоторной области гена COL1A2 представлена в Таблице 1.
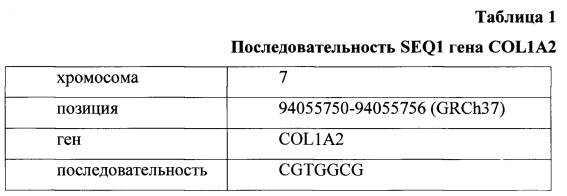
В предложенном способе при помощи пиросеквенирования оценивается уровень метилирования геномной ДНК, выделенной из образцов фиксированной для гистологического исследования ткани, таким образом, выполнение данного анализа не требует дополнительной подготовки пробы и может быть легко интегрировано в существующую процедуру диагностики РТК. Уровень метилирования промоторной области гена является более стабильным и более специфичным для опухоли признаком, чем уровень экспрессии гена. Способ основан на патогенетическом факторе канцерогенеза - изменении метилирования регуляторных районов генов, вовлеченных в злокачественный процесс. В частности, деметилирование CpG динуклеотидов в промоторной последовательности гена COL1A2 приводит к избыточной экспрессии продукта гена в клетках опухоли. Данное изобретение стало возможным в результате проведенного авторами сравнительного анализа уровня метилирования промоторных областей более чем 20000 генов в нормальных и опухолевых тканях толстой кишки и открытия того факта, что уже ранние стадии развития злокачественной трансформации сопровождаются гипометилированием CpG динуклеотидов в последовательности SEQ1 гена COL1A2.
Способ заключается в следующем.
Образцы опухоли и прилегающей к опухоли ткани фиксируются в нейтральном формалине и заключаются в парафиновые блоки (можно использовать образцы биопсии толстого кишечника, приготовленные для гистологического исследования).
При помощи микротома с каждого блока срезается по три среза толщиной 5 мкм и переносится в две пробирки типа «Eppendorf» 1.5 мл.
Выделение геномной ДНК из срезов парафинизированной ткани проводится по следующему протоколу:
1. Депарафинизация. Добавить 400 мкл раствора А (0.1 М NaOH, Tween-20 0,5%). Раствор А готовить непосредственно перед выделением ДНК. Нагреть при температуре 99°С в течение 10 мин. Центрифугировать 10 мин при 14 тыс. об/мин. Содержимое пробирки разделится на 3 фазы: 1 - парафин, 2 - водная фаза, 3 - осадок, содержащий ткань. ДНК содержится как в водной фазе, так и в 3-ей фазе (в осадке). Для последующего выделения использовать водную фазу (перенести в чистую пробирку) и осадок (перенести в чистую пробирку).
2. Выделение ДНК из водной фазы. К полученной водной фазе (150-300 мкл) добавить 150 мкл фенола, уравновешенного ТЕ и 150 мкл хлороформа, тщательно перемешать до образования эмульсии. Центрифугировать 10 мин при 14 тыс. об/мин. Верхнюю фазу перенести в чистые пробирки, добавить 5 мкл соосадителя (линейного полиакриламида, ЛПАА), 30 мкл 3 М натрия ацетата (рН 5.4), 300 мкл изопропанола. Инкубировать 15-20 мин при комнатной температуре, либо при -20°С. Центрифугировать 10 мин при 14 тыс. об/мин. Супернатант осторожно слить, осадок промыть 75% этиловым спиртом. Пробирки с осадком высушить при 37°С не менее 15 мин. После чего добавить 50 мкл ТЕ буфера (10 мМ Tris-HCl рН 8,0). Хранить полученный раствор ДНК при -20°С.
3. Выделение ДНК из осадка. К осадку, полученному после депарафинизации, добавить 300 мкл буфера (10 мМ Трис-HCl рН 8,0, 100 mM NaCl, 10 mM ЭДТА), 40 мкл 10% додецил сульфата натрия (SDS) и 10 мкл протеиназы К (10 мг/мл). Инкубировать при 62°С 12-24 ч. Затем отобрать водную фазу, перенести в чистые пробирки. Добавить 150 мкл фенола, уравновешенного ТЕ, 150 мкл хлороформа, тщательно перемешать до образования эмульсии. Центрифугировать 10 мин при 14 тыс. об/мин. Верхнюю фазу перенести в чистые пробирки, добавить 5 мкл ЛПАА, 30 мкл 3 М натрия ацетата (рН 5.4), 300 мкл изопропанола. Инкубировать 15-20 мин при комнатной температуре, либо на -20°С. Центрифугировать 10 мин при 14 тыс. об/мин. Супернатант осторожно отобрать, осадок промыть 75% этиловым спиртом. Пробирки с осадком высушить при 37°С не менее 15 мин. После чего добавить 50 мкл ТЕ буфера (10 мМ Трис-HCl рН 8.0). Хранить полученный раствор ДНК при -20°С.
4. Образцы ДНК, выделенные из осадка и водной фазы, объединить.
Далее проводится бисульфитная конверсия геномной ДНК, в процессе которой происходит конвертирование неметилированного цитозина в урацил.
Для бисульфитной конверсии геномной ДНК используют следующий метод:
1. Бисульфитная модификация. Смешать 20 мкл раствора ДНК и 2.2 мкл 3 М NaOH. Инкубировать при 37°С в течение 15 мин.
Добавить 208 мкл 2 М метабисульфита, 12 мкл 10 мМ гидрохинона. Оба раствора приготовить непосредственно перед добавлением к раствору ДНК. Инкубировать при 50°С в течение 12 ч.
2. Очистка от бисульфита. Добавить к раствору ДНК 160 мкл 5 М гуанидин изотиоционата, 400 мкл 75% EtOH, смешать, перенести в спин-колонку («Qiagen», Германия). Центрифугировать 2 мин при 6 тыс. об/мин. Перенести колонку в новый адаптер. Добавить в колонку 400 мкл 75% EtOH и центрифугировать 2 мин при 6 тыс. об/мин.
Перенести колонку в новую пробирку. Добавить в колонку 60 мкл 10 мМ TriHCl (рН 8.0). Инкубировать 5 мин, центрифугировать 2 мин при 6 тыс. об/мин.
3. Очистка от сульфоната. Добавить к раствору ДНК 6 мкл 3 М NaOH. Инкубировать при 37°С в течение 15 мин. Добавить 20 мкл 10 М Аммония ацетата, 5 мкл ЛПАА. Инкубировать 15-20 мин при комнатной температуре, либо на -20°С. Центрифугировать 10 мин при 14 тыс. об/мин. Супернатант осторожно отобрать, осадок промыть 75% этиловым спиртом. Пробирки с осадком высушить при 37°С не менее 15 мин. После чего добавить 50 мкл ТЕ буфера (10 мМ Tris-HCl рН 8,0). Хранить полученный раствор ДНК при -20°С.
Определение уровня метилирования CpG динуклеотидов в последовательности SEQ1 гена COL1A2
Для определения метилирования CpG динуклеотидов в последовательности SEQ1 гена COL1A2 применяют метод пиросеквенирования. Метод включает в себя: (1) амплификацию участка ДНК, включающего последовательность SEQ1 методом ПЦР и биотинилирование цепи, которая послужит матрицей для пиросеквенирования; (2) денатурацию ПЦР-ампликона, изоляцию биотинилированной цепи и ее гибридизацию с праймером для секвенирования; (3) определение последовательности продукта ПЦР при помощи реакции пиросеквенирования; (4) количественную оценку метилирования.
В качестве матрицы для ПЦР используют ДНК, полученную из опухолевой ткани и ткани, прилегающей к опухоли после предварительной бисульфитной конверсии. Амплификацию осуществляют при помощи пары олигонуклеотидных праймеров, подобранных с учетом последовательности SEQ1 (таблица 2):

Реакцию пиросеквенирования осуществляют при помощи набора реагентов «PyroMark Gold Q24 Reagents» или «PyroMark Gold Q96 Reagents» (Qiagen), на приборе пиросеквенаторе «PyroMark Q24» или «PyroMark Q96 ID» или «PyroMark Q96 MD» (Qiagen). Для осуществления реакции необходимо указать анализируемую последовательность нуклеотидов (Sequence to analyze). Эта последовательность соответствует последовательности ампликона; первый нуклеотид последовательности - нуклеотид, следующий за праймером для секвенирования (таблица 2); CpG-динуклеотиды обозначаются как C/TG. На основании запуска модуля «Sequence to analyze» программное обеспечение прибора автоматически рассчитает последовательность добавления dNTP в реакционную смесь («Dispensation orders»). В ходе пиросеквенирования в реакционную смесь последовательно будут добавляться dNTP (в соответствии с «Dispensation orders»), присоединение dNTP к секвенирующему праймеру сопровождается освобождением пирофосфата в количестве эквимолярном количеству включившихся нуклеотидов. Благодаря ряду ферментативных реакций освобождение пирофосфата сопровождается образованием видимого света, регистрируемого прибора в виде пика. При этом высота пика пропорциональна количеству нуклеотидов включившихся в матрицу. Итоговая последовательность определяется согласно пикам на пирограмме.
Количественную оценку метилирования выполняют автоматически при помощи программного обеспечения «PyroMark Q24 Software» или «PyroMark CpG SW1.0» для «PyroMark Q96 ID» или «PyroMark Q96 MD» (Qiagen). В случае, когда имеет место метилирование, цитозины в составе CpG динуклеотидов заменены на 5-метилцитозины. В результате бисульфитной конверсии цитозины в последовательности ДНК преобразуются в урацил, в то время как 5-метилцитозины остаются неизмененными. В случае 100% метилирования CpG-динуклеотид на пирограмме будет определяться как CG, в случае 0% метилирования - как TG. Во всех остальных промежуточных вариантах будут присутствовать обе последовательности, т.е TCG, при этом высота пиков Т и С будет пропорциональна исходному количеству неметилированного и метилированного цитозина, соответственно. Исходя из соотношения высоты пиков Т и С, программное обеспечение «PyroMark Q24 Analysis Software» автоматически рассчитает уровень метилирования CpG.
Интерпретация результатов исследования.
В результате анализа определяются уровни метилирования CpG-динуклеотидов последовательности SEQ1 гена Col1A2 в образцах, выделенных из предположительно опухолевой ткани и нормальной ткани прилегающей к опухоли. В случае, когда уровень метилирования CpG в ДНК опухолевой ткани будет на 10% и более ниже, чем в ДНК нормальной ткани, делают вывод о высокой вероятности РТК у пациента.
Далее настоящее изобретение будет подробно проиллюстрировано на конкретных примерах.
Пример 1. Определение набора олигонуклеотидных праймеров для амплификации и секвенирования.
При выборе олигонуклеотидных праймеров для ПЦР учитывали следующие требования: (1) олигонуклеотидные праймеры должны фланкировать последовательность SEQ1; (2) амплифицируемый фрагмент должен быть как можно меньшей длины; (3) один из праймеров должен нести биотин на 5'-конце. Первоначальные пары праймеров были экспериментально проверены на образование праймер-димеров и длинных неспецифичных продуктов ПЦР. В результате выбрана пара праймеров обеспечивающая наиболее специфичную и эффективную амплификацию.
При выборе олигонуклеотидного праймера для секвенирования учитывают следующие требования: (1) температура плавления праймера составляет 30-40°С, длина праймера 12-15 н.о.; (2) последовательность праймера для секвенирования должна быть «вложенной» относительно последовательности праймеров для ПЦР; (3) 3'-конец праймера для секвенирования должен гибридизоваться как можно ближе к анализируемому CpG динуклеотиду.
Последовательности олигонуклеотидных праймеров приведены в таблице 2. Использование предложенных праймеров для амплификации и секвенирования позволяет получить пирограмму с высокой амплитудой сигнала и отсутствием неспецифичных пиков.
Пример 2. Определение уровня метилирования CpG динуклеотидов последовательности SEQ1 в образцах опухолевой ткани по сравнению с метилированием в образцах нормальной ткани.
Анализировали 20 пар образцов тканей толстого кишечника (опухоль/норма) пациентов с РТК. Все опухолевые образцы охарактеризованы согласно международной системе клинико-морфологической классификации опухолей TNM, где Т (tumor) - Т0-Т4 - категории, отражающие нарастание размера и/или местного распространения первичной опухоли, N (nodulus) - N0-N3 - категории, отражающие различную степень поражения метастазами регионарных лимфатических узлов; М (metastasis) - М0-М1 - характеризует отдаленные метастазы. Все возможные комбинации TNM объединяют в более крупные группы - стадии, отражающие течение опухолевого процесса. I-я стадия заболевания установлена у двух больных, II-я - у четырнадцати, III-я - у четырех.
Образцы были фиксированы в нейтральном формалине и залиты в парафиновые блоки. С каждого образца приготовили по три среза. Геномную ДНК для анализа метилирования выделяли в соответствии с описанным способом. Амплификацию фрагмента для пиросеквенирования осуществляли при помощи пары праймеров (таблица 2). Реакцию пиросеквенирования осуществляли при помощи набора реагентов «PyroMark Gold Q96 Reagents» на приборе «PyroMark Q96 ID». Анализируемая последовательность нуклеотидов («Sequence to analyze») была: TTC/TGTGGC/TGATAAGG. Анализ статуса метилирования производили при помощи программного обеспечения «PyroMark CpG SW1.0».
В результате определили средний уровень метилирования в образцах опухоли, составивший 67,2±3,1%, средний уровень метилирования в образцах нормальной ткани был достоверно выше и составил 87,2±5,6%.
Результаты исследования метилирования CpG динуклеотидов последовательности SEQ1 гена COL1A2 получены впервые.
Представленное выше подробное описание изобретения и примеров его использования предназначено для более полного уяснения сущности заявленного изобретения, но не для его ограничения. Сущность и объем настоящего изобретения определяются прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2770928C1 |
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2775177C1 |
| СПОСОБ IN VITRO ДИАГНОСТИКИ ИЛИ ПРОГНОЗИРОВАНИЯ КОЛОРЕКТАЛЬНОГО РАКА ИЛИ ЕГО ПРЕДРАКОВОЙ СТАДИИ | 2020 |
|
RU2831090C2 |
| Способ прогнозирования клинического течения нейроэндокринных новообразований толстой кишки | 2021 |
|
RU2771421C1 |
| Способы скрининга рака | 2012 |
|
RU2700088C2 |
| ДИАГНОСТИЧЕСКИЕ МАРКЕРЫ | 2012 |
|
RU2614254C2 |
| Способ диагностики метастазов рака толстой кишки | 2016 |
|
RU2647470C2 |
| Набор олигонуклеотидных праймеров для определения метилирования промотора гена человека CXCR4 в образах биологического материала, подвергшегося предварительной бисульфитной конверсии, методом пиросеквенирования | 2022 |
|
RU2804112C1 |
| СПОСОБ АНАЛИЗА НАРУШЕНИЙ, СВЯЗАННЫХ С РАКОМ ЯИЧНИКОВ | 2008 |
|
RU2511408C2 |
| СПОСОБ ФОРМИРОВАНИЯ СИСТЕМ МАРКЕРОВ МЕТИЛИРОВАНИЯ ДНК | 2011 |
|
RU2472859C1 |
Изобретение относится к биохимии. Описан способ диагностики рака толстой кишки путем определения уровня метилирования промоторной области гена COL1A2, посредством проведения пиросеквенирования, отличающийся тем, что исследуют уровень метилирования CpG динуклеотидов в промоторной области гена COL1A2, и при обнаружении снижения метилирования в опухолевой ткани на 10% и более по сравнению с нормальной тканью, делают вывод о высокой вероятности рака толстой кишки. При этом могут быть использованы следующие праймеры: ПЦР праймер (F): 5'-GTATTTGTGGTGAAGTGAGTGTTA-3', ПЦР праймер (R): 5'-biotin-CCTTTAAACCAAAAAAACCTCTAAAC-3', праймер для секвенирования: 5'-TAGGGTTTATAAGGTA-3'. Изобретение позволяет с высокой достоверностью диагностировать РТК, в том числе на ранней стадии опухолевого заболевания. 1 з.п. ф-лы, 2 табл., 2 пр.
1. Способ диагностики рака толстой кишки путем определения уровня метилирования промоторной области гена COL1A2, посредством проведения пиросеквенирования, отличающийся тем, что исследуют уровень метилирования CpG динуклеотидов в промоторной области гена COL1A2, и при обнаружении снижения метилирования в опухолевой ткани на 10% и более по сравнению с нормальной тканью, делают вывод о высокой вероятности рака толстой кишки.
2. Способ по п. 1, отличающийся тем, что используются следующие праймеры:
ПЦР праймер (F): 5'-GTATTTGTGGTGAAGTGAGTGTTA-3'
ПЦР праймер (R): 5'-biotin-CCTTTAAACCAAAAAAACCTCTAAAC-3'
праймер для секвенирования: 5'-TAGGGTTTATAAGGTA-3',
в образцах ДНК, выделенных из предположительно пораженной раком ткани и нормальной ткани, прилегающей к опухоли.
| KIYOSHI MISAWA et al, Hypermethylation of collagen α2 (I) gene (COL1A2) is an independent predictor of survival in head and neck cancer, Cancer Biomarkers, 10, 2012, p.135-144 | |||
| СПОСОБ АНАЛИЗА НАРУШЕНИЙ, СВЯЗАННЫХ С РАКОМ ЯИЧНИКОВ | 2008 |
|
RU2511408C2 |
Авторы
Даты
2017-03-13—Публикация
2015-12-11—Подача