Перекрестные ссылки на родственные заявки
[0001] Настоящая заявка испрашивает приоритет в соответствии с 35 U.S.С. 119(e) США по предварительной заявке на патент №61/447,540, поданной 28 февраля 2011, содержание которой включено посредством ссылки в полном объеме.
Государственная поддержка
[0002] Настоящее изобретение создано при поддержке Правительства США в соответствии с грантом ES 016665-01 A1 Национального Института гигиены окружающей среды. Правительство США имеет некоторые права на это изобретение.
Область техники
[0003] Системы и способы изобретения, описанные здесь, относятся к культивированию и поддержанию in vitro кишечных органоидов.
Уровень техники
[0004] Разработка лекарственных препаратов была затруднена, поскольку опиралась на использование животных моделей, которые являются дорогостоящими, трудоемкими, времязатратными и сомнительны с точки зрения этики.1 Еще больше беспокоит то, что животные модели часто не предсказывают результаты, получаемые на людях,2-3 это является особой проблемой при решении проблем, связанных с метаболизмом, транспортом и пероральным поглощением лекарственных препаратов и питательных веществ.4-5 По этим причинам все больше возрастает интерес к развитию in vitro моделей функции кишечника человека, в том числе к системах культивирования клеток, использующих вставки Transwell фильтра6-7, которые позволяют исследовать транс-эпителиальный барьер и транспорт, и миниатюрных микрожидкостных моделей, которые также поддерживают долгосрочное культивирование.10-14 Другие исследователи ранее пытались воссоздать нормальную трехмерную (3D) архитектуру слизистой оболочки кишечника in vitro при культивировании человеческих кишечных эпителиальных (например, Caco-2) клеток на гидрогелевых субстратах, которые были сконструированы на микроуровне, имитируя форму, размер и плотность ворсинок кишечника человека.11 Тем не менее, ни одна из существующих in vitro моделей кишечника механически не воспроизводит активную микросреду живого кишечника (перистальтические движения и поток жидкости внутри просвета), что является критическим для нормальной физиологии органа,15 а также для развития болезни Крона и других кишечных заболеваний.16-17 Другим недостатком существующих in vitro моделей кишечника является то, что ранее не удавалось вырастить живых микробов на поверхности просвета культивированного кишечного эпителия в течение длительного периода, как обычно происходит в живом кишечнике. Это ключевая проблема, поскольку микробные симбионты обычно вносят значительный вклад в функцию кишечного барьера, метаболизм и всасывание лекарственных препаратов и химических веществ, а также многие заболевания.18-22 Развитие in vitro модели на основе живой клетки, которая имитирует механические, структурные, поглощающие, транспортные и патофизиологические свойства кишечника человека вместе с его важными микробными симбионтами, могло бы ускорить фармацевтическое развитие и, вероятно, заменить тестирование на животных.
Сущность изобретения
[0005] Здесь описаны системы и способы, относящиеся к клеточно-культуральным системам для поддержания и/или культивирования кишечных органоидов и/или эпителиальных клеток кишечника in vitro. Варианты осуществления изобретения, описанные здесь, основаны на открытии авторов данного изобретения того, что обеспечение потока жидкости, напряжения сдвига и/или механического напряжения позволяет более физиологически значимое воспроизведение кишечной среды. Системы и способы, описанные здесь, могут быть использованы в целях исследования или тестирования в фармакологии, токсикологии, разработки лекарственного средства, доставки лекарственного средства, метаболизма лекарственного средства, взаимодействий лекарственных средств, биодоступности лекарственного средства, клиренса лекарственного средства, полиорганных взаимодействий, диагностике, терапии, применении различных режимов питания, физиологии кишечного барьера, моделей желудочно-кишечных (ЖК) заболеваний и их механизма, этиологии заболевания в ЖК тракте, заживления ран, регенерации тканей, тканевой инженерии, кишечного гомеостаза, исследований кишечных стволовых клеток, взаимодействий хозяин-микробы, микробных сообществ в ЖК тракте, микробной биопленки в слизистом слое и пробиотической терапии.
[0006] В одном из аспектов изобретение, описанное здесь, относится к системе культивирования клеток, содержащей (i) жидкостное устройство, имеющее жидкостной канал, соединенный с источником жидкости, где источник жидкости подает жидкость в жидкостной канал; (ii) мембрану, расположенную внутри канала между опорными элементами мембраны, где по меньшей мере часть мембраны является гибкой, (iii) механизм деформации мембраны, соединенный с опорными элементами мембраны, способный перемещать опорные элементы мембраны и вызывать растяжение мембраны вдоль по меньшей мере одного измерения мембраны, и (iv) по меньшей мере один слой эпителиальных клеток кишечника, прикрепленный по меньшей мере к одной поверхности мембраны; в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет менее 1,0 дин/см2.
[0007] В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет от 0,008 до 0,08 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет приблизительно 0,018 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени от 0 до 1000 дин/см2. В некоторых вариантах осуществления напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться с течением времени от 0,008 до 0,08 дин/см2.
[0008] В некоторых вариантах осуществления вызывают растяжение мембраны от 0% до 50%. В некоторых вариантах осуществления вызывают растяжение мембраны от 5% до 15%. В некоторых вариантах осуществления вызывают растяжение мембраны примерно на 10%. В некоторых вариантах осуществления вызывают растяжение мембраны более чем на 15%, для создания аномального условия/состояния эпителиальных клеток кишечника.
[0009] В некоторых вариантах вызывают растяжение мембраны циклическим образом с частотой в диапазоне от 0,01 Гц до 2 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой в диапазоне от 0,05 Гц до 0,25 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой 0,15 Гц. В некоторых вариантах осуществления вызывают растяжение мембраны циклическим образом с частотой более чем 0,2 Гц, для создания аномального условия/состояния эпителиальных клеток кишечника. В некоторых вариантах осуществления вызывают растяжение мембраны нерегулярным или прерывистым образом.
[0010] В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока менее чем 500 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока менее чем 100 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока от 0 до 50 мкл/ч. В некоторых вариантах осуществления жидкость протекает через жидкостной канал при скорости потока примерно 30 мкл/ч.
[0011] В некоторых вариантах осуществления система дополнительно содержит по меньшей мере один тип молекулы прикрепления, которая способствует адгезии множества живых клеток, покрывающих по меньшей мере одну сторону мембраны. В некоторых вариантах осуществления по меньшей мере одна молекула прикрепления выбрана из группы, состоящей из: коллагена, коллагена I типа; MATRIGEL™; внеклеточного матрикса; ламинина; протеогликана; витронектина; фибронектина; поли-D-лизина; полипептидов; олигонуклеотидов; ДНК и полисахарида.
[0012] В некоторых вариантах эпителиальные клетки кишечника представляют собой клетки млекопитающего или человека. В некоторых вариантах осуществления эпителиальные клетки кишечника выбраны из группы, состоящей из: Caco2 клеток; HT-29 клеток; первичных эпителиальных клеток тонкого кишечника; первичных эпителиальных клеток толстого кишечника; iPS клеток; ESC клеток; стволовых клеток; клеток Панета; клеток крипт и секретирующих слизь клеток. В некоторых вариантах осуществления эпителиальные клетки кишечника системы дополнительно составляют структуры ворсинок. В некоторых вариантах осуществления система дополнительно содержит по меньшей мере один слой эндотелиальных клеток по меньшей мере на второй поверхности мембраны.
[0013] В некоторых вариантах осуществления мембрана расположена так, что она разделяет жидкостной канал на первый клеточно-культуральный канал и второй клеточно-культуральный канал. В некоторых вариантах осуществления первый клеточно-культуральный канал содержит эпителиальные клетки кишечника. В некоторых вариантах осуществления второй клеточно-культуральный канал содержит клетки, выбранные из группы, состоящей из: эндотелиальных клеток, иммунных клеток и клеток соединительной ткани.
[0014] В некоторых вариантах осуществления система дополнительно содержит микробные клетки или патогены. В некоторых вариантах осуществления микробные клетки поддерживаются в системе по меньшей мере в течение 1 дня. В некоторых вариантах осуществления микробные клетки выбраны из группы, состоящей из: Lactobacillus; Bactericides; Ruminococcus; Peptococcus; Peptostreptococcus; Bifidobacterium; Escherichia; Achromobacter; Acidaminococcus fermentans; Acinetobacter cacoaceticus; Aeromonas; Alcaligenes faecalis; Bacillus; Butyriviberio fibrosolvens; Camplyobacter; Campylobacter coli; Clostridium difficile; Clostridium sordelli; Enterobacter cloacae; Enterococcus faecalis; Enterococcus faecium; Escherichia coli; Flavobacterium; Mycobacterium; Mycoplasma; Plesiomonas shigelloides; Propionibacterium acnes; Pseudomonas aeruginosa; Ruminococcus bromii; Sarcina; Staphylococcus aureus; Streptococcus anginosus; Veillonella; Vibrio; Yersinia enterocolitica; Lactobacillus rhamnosus; Lactobacillus rhamnosus GG; Bifidobacterium breve; Bifidobacterium longum; Bifidobacter ium infantis; Lactobacillus acidophilus; Lactobacillus plantarum; Lactobacillus paracasei; Lactobacillus bulgaricus и Streptococcus thermophilus. В некоторых вариантах осуществления микробные клетки являются патогенными. В некоторых вариантах осуществления патогены выбраны из группы, состоящей из: энтеротоксигенной Escherichia coli; Bilophila wadsworthia; Shigella; Yersinia; Pleisiomonas; Vibrio; Aeromonas; Campylobacter; Crytosporidia; Coccidosis; Salmonella; Helicobacter pylori; Clostridium difficile; Salmonella kedougou; Bacteroides; Clostridium; Firmicutes; Shigellia dysenteriae; Salmonella enterica; Salmonella typhi; Listeria; Listeria monocytogenes; Vibrio parahaemolyticus; Proteus; Vibrio cholerae; Enterococcus faecalis; Yersinia enterocolitica и Campylobacter jejuni; ротавируса; норуолк-подобных вирусов; аденовирусов; астровирусов; саппоро-подобных вирусов; торовирусов; коронавирусов; пикорнавирусов; вирусов герпеса; норовирусов; Candida; Aspergillus; Candida albicans; одноклеточных паразитов; многоклеточных паразитов; амеб; червей; ленточных червей; простейших; трематод; круглых червей; остриц; анкилостоматид; Giradia lamblia; криптоспоридия; и Entamoeba histolytica. В некоторых вариантах осуществления микробные клетки являются аэробными. В некоторых вариантах осуществления микробные клетки являются анаэробными. В некоторых вариантах осуществления система содержит аэробные и анаэробные микробные клетки. В некоторых вариантах осуществления микробные клетки находятся в первом клеточно-культуральном канале.
[0015] В некоторых вариантах система дополнительно содержит анаэробную газовую камеру, связанную по меньшей мере с частью первого клеточно-культурального канала. В некоторых вариантах осуществления в жидкости, протекающей через первый клеточно-культуральный канал, устанавливается градиент кислорода.
[0016] В некоторых вариантах осуществления мембрана является по меньшей мере частично пористой. В некоторых вариантах осуществления по меньшей мере одно отверстие поры в мембране составляет от 0,5 до 10 мкм по ширине. В некоторых вариантах осуществления мембрана содержит PDMS. В некоторых вариантах осуществления мембрана подвергается растяжению посредством вакуумного давления.
[0017] В некоторых вариантах осуществления система дополнительно содержит: (i) первую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где мембрана прикреплена к первой стенке камеры; (ii) первый рабочий канал, смежный по меньшей мере с одним жидкостным каналом на противоположной стороне первой стенки камеры, где перепад давления, приложенный между первым рабочим каналом и по меньшей мере одним жидкостным каналом, вызывает сгибание первой стенки камеры в первом требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной; и (iii) вакуумную систему, обеспечивающую перепад давления между по меньшей мере одним жидкостным каналом и по меньшей мере одним из рабочих каналов, где мембрана растягивается вдоль плоскости в ответ на перепад давления. В некоторых вариантах осуществления система дополнительно содержит вторую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где противоположный край мембраны прикреплен ко второй стенке камеры, и второй рабочий канал, расположенный смежно по меньшей мере с одним жидкостным каналом на противоположной стороне второй стенки камеры, при этом перепад давления между вторым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание второй стенки камеры во втором требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной.
[0018] В некоторых вариантах осуществления гидродинамическое устройство содержит микрожидкостной чип.
[0019] В некоторых вариантах осуществления система подключена или соединена со второй системой культивирования клеток, содержащей клетки или ткани не-кишечного происхождения. В некоторых вариантах осуществления вторая система культивирования клеток содержит клетки или ткани печени.
[0020] В одном из аспектов изобретение, описанное здесь, относится к способу получения кишечного органоида, включающему: предоставление жидкости для поддержания эпителиальных клеток кишечника в системе культивирования клеток, как описано здесь, таким образом, что жидкость контактирует с эпителиальными клетками кишечника; и культивирование эпителиальных клеток кишечника in vitro. В некоторых вариантах осуществления способ дополнительно включает культивирование клеток по меньшей мере до тех пор, пока обнаруживаются структуры ворсинок.
[0021] В одном из аспектов изобретение, описанное здесь, относится к системе оценки эффекторных агентов кишечника, содержащей систему культивирования клеток, описанную здесь.
[0022] В одном из аспектов изобретение, описанное здесь, относится к способу оценки лечения кишечника, включающий контактирование клетки в системе культивирования клеток, как описано здесь, по меньшей мере с одним предполагаемым эффектором лечения кишечника; и измерение ответа клеток в системе для определения эффекта по меньшей мере одного предполагаемого эффекторного агента кишечника.
Краткое описание чертежей
[0023] На фиг.1 изображена структурная схема ворсинок кишечника человека. Пористая мембрана окружена кишечным эпителием и капиллярным эндотелием.
[0024] На фиг.2 изображена схема структуры одного из вариантов системы 'Gut-on-a-Chip' ('Кишка-на-чипе'), на которой выделены двухслойный клеточно-культуральный микроканал в верхней части (фиолетовый) и нижней части (розовый), разделенных пористой PDMS мембраной, и две вакуумные камеры (небесно-голубой) рядом с двухслойным клеточно-культуральным каналом.
[0025] На фиг.3A-3D изображен ряд схем, демонстрирующих механическое растяжение в одном варианте системы 'Gut-on-a-Chip' с изменениями в течение времени от фиг.3A до фиг.3D. В 'Gut-on-a-Chip' было применено циклическое растяжение, обеспечивающее определенное механическое напряжение клеточного монослоя, методом вакуум-управляемого негативного давления на вакуумные каналы.
[0026] На фиг.4A-4B изображены увеличенные изображения образования Caco-2 монослоя в микроканале. После инокуляции Caco-2 клеток в микроканале (фиг.4A) клетки оставляли для прикрепления на поверхности пористой мембраны в микроканале в течение 1,5 часов (фиг.4B), затем культуральную среду перфузировали при постоянной скорости потока 30 мкл/ч в течение 48 часов. Слитый монослой образуется в микроканале примерно через 48 часов (фиг.4C). Увеличенное изображение Caco-2 монослоя на пористой мембране показано на фиг.4D. Повторяющиеся поры составляют 10 мкм в диаметре с 30 мкм интервалом.
[0027] На фиг.5 изображена схема одного варианта осуществления устройства 'Gut-on-a-Chip' для совместного культивирования кишечного эпителия на одной стороне и капиллярного или лимфатического эндотелия на другой стороне гибкой пористой мембраны (поры 10 мкм в диаметре с 30 мкм интервалом, толщиной 30 мкм).
[0028] На фиг.6A-6C изображены схемы для эксперимента по анализу транспорта в 'Gut-on-a-Chip'. На фиг.6A изображена схема "динамического состояния", представляющего механические деформации с постоянным потоком. На фиг.6B изображена схема "жидкостного состояния", без механических деформаций с постоянным потоком. На Фиг.6C изображена схема "статического состояния", показывающая обычную Transwell систему, без механических деформаций и потока.
[0029] На фиг.7 изображен график коэффициента кажущейся проницаемости (Papp) параклеточного маркера, FITC-декстрана (FD20, 20 кДа), в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале. Экспериментальные схемы для статических, динамических и жидкостных состояний разъяснены на фиг.6A-6C. В динамическом состоянии (N=4) применяли циклическое растяжение с 20% удлинением при постоянной скорости перфузнойного потока 30 мкл/ч в течение 12 часов до эксперимента FD20 транспорта. В жидкостном состоянии (N=4) постоянный перфузионный поток 30 мкл/ч применяли без каких-либо растягивающих движений (т.е. только напряжения сдвига). Как в динамическом, так и жидкостном состоянии образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от FD20 концентрации. В статическом состоянии (N=4) эксперимент по анализу транспорта проводили в системе Transwell. Отметки ошибок указывают стандартные ошибки.
[0030] На фиг.8 изображен график коэффициента кажущейся проницаемости (Papp) параклеточного маркера, Lucifer желтого (LY), в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале. Экспериментальные схемы для статических, жидкостных и динамических состояний описаны на фиг.6A-6C. В динамическом состоянии применяли циклическое растяжения либо с 5% (N=1), либо с 15% (N=1) относительным удлинением при постоянной перфузии 30 мкл/ч в течение 12 часов до эксперимента LY транспорта. В жидкостном состоянии (N=2) постоянный перфузионный поток при 30 мкл/ч применяли без растягивания (т.е. только напряжений сдвига). В обоих динамических и жидкостных состояниях образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от LY концентрации. В статическом состоянии (N=4) эксперименты по анализу транспорта проводились в системе Transwell. Отметки ошибок указывают стандартные ошибки. Y - ось имеет разрыв шкалы для возобновления полного диапазона гистограммы на графике.
[0031] На фиг.9 изображен график коэффициента кажущейся проницаемости (Papp) FD20 в устройстве 'Gut-on-a-Chip', содержащем Caco-2 монослой на поверхности пористой мембраны в верхнем микроканале и HMVEC монослой на противоположной поверхности пористой мембраны в нижнем микроканале. Экспериментальные схемы для статических, жидкостных и динамических состояний показаны на фиг.6A-6C. В динамическом состоянии применяли циклическое растяжения с 15% (N=1) удлинением при постоянном перфузионном потоке 30 мкл/ч в течение 12 часов до эксперимента FD20 транспорта. В жидкостном состоянии (N=5) постоянный перфузионный поток при 30 мкл/ч использовали без растягивающих движений (т.е. только напряжений сдвига). В обоих динамических и жидкостных состояниях образцы были собраны примерно в течение 1 часа с выхода нижнего микроканала, а затем аликвоту (10 мкл) разводили для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от FD20 концентрации. В статическом состоянии (N=3) эксперимент по анализу транспорта проводился в системе Transwell. Отметки ошибок указывают стандартные ошибки. Y-ось имеет разрыв шкалы для возобновления полного диапазона гистограммы на графике.
[0032] На фиг.10 изображен график коэффициента кажущейся проницаемости (Papp) родамина 123 (Rho123), субстрата гликопротеинов проницаемости (P-gp) в Caco-2 клетках, полученный в Transwell, содержащей 21-дневный культивированный Caco-2 монослой на поверхности пористой мембраны (размер пор 0,4 мкм). Для ингибирования оттока в клетки Caco-2 в некоторых экспериментальных установках был применен верапамил, ингибитор P-gp. Схема эксперимента для этого статического анализа транспорта описана в фиг.6C. Для эксперимента по анализу транспорта Rho123 с апикальной стороны (AP) к базолатеральной стороне (BL) (N=6) на AP стороне Transwell заменяли Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация, 200 мкл), тогда как на сторону BL Transwell добавляли свежую культуральную среду (700 мкл). Для эксперимента оттока Rho123 от BL стороны на AP сторону (N=6) Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация, 700 мкл), заменяли на BL стороне Transwell и свежую культуральную среду (200 мкл) помещали на AP сторону Transwell. Чтобы протестировать влияние ингибирования P-gp, верапамил, растворенный в культуральной среде (300 мкМ, конечная концентрация), наносили на обе AP и BL стороны Transwell, а затем выполняли эксперименты по анализу транспорта в направлении либо с AP на BL (N=6), либо с BL на AP (N=6). Отметки ошибок указывают стандартные ошибки.
[0033] На фиг.11 изображен график коэффициента кажущейся проницаемости (Papp) Rho123, субстрата P-gp в Caco-2 клетках, в микрожидкостном 'Gut-on-a-Chip' устройстве. Экспериментальные схемы для жидкостных и динамических условий показаны на фиг.6A и 6B. Для эксперимента по анализу транспорта Rho123 от АР стороны на BL сторону либо в жидкостном (N=1), либо в динамическом (N=1,15% удлинение) состоянии пропускали при 30 мкл/ч в верхний микроканал Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация), тогда как в нижний микроканал перфузировали свежую культуральную среду при 30 мкл/ч. Для эксперимента транспорта Rho123 от BL стороны на AP сторону либо в жидкостном (N=1), либо в динамическом (N=1,15% удлинение) состоянии Rho123, растворенный в культуральной среде (100 мкМ, конечная концентрация), подавали при 30 мкл/ч в нижний микроканал, тогда как в верхней микроканал перфузировали свежую культуральную среду при 30 мкл/ч. В обоих динамическом и жидкостном состояниях образцы собирали на выходе из верхнего и нижнего микроканалов примерно в течение 1 часа, а затем аликвоту (10 мкл) разбавляли для измерения флуоресценции, которая была представлена в линейном режиме зависимости интенсивности флуоресценции от Rho123 концентрации. Для динамического состояния до экспериментов было применено механическое напряжение с 15%-ным удлинением.
[0034] На фиг.12A-12E изображен один вариант осуществления человеческого 'Gut-on-a-Chip' устройства. На фиг.12A изображена схема 'Gut-on-a-Chip' устройства, показывающая гибкую пористую ECM-покрытую мембрану, выстланную эпителиальными клетками кишечника, пересекающую горизонтально центральный микроканал по середине, и вакуумные камеры по всей высоте с обеих сторон. На фиг.12B изображено фотографическое изображение 'Gut-on-a-Chip' устройства, состоящего из прозрачного PDMS эластомера. Шприцевой насос был использован для перфузии (направление, указанное стрелками) синего и красного красителей через систему трубок к верхнему и нижнему микроканалам, соответственно, для визуализации этих каналов. На фиг.12C изображено поперечное сечение верхнего и нижнего каналов (оба 150 мкм высотой) устройства 'Gut-on-a-Chip'; вставка показывает вид сверху участка пористой мембраны (поры 10 мкм; отметка, 20 мкм). На фиг.12D изображена схема (наверху) и фазово-контрастное изображение (внизу) кишечных монослоев, культивированных в 'Gut-on-a-Chip' в отсутствии (слева) или в присутствии (справа) механического напряжения (30%; стрелкой указано направление), оказанного путем применения всасывания в вакуумных камерах. Красные и синие контуры показывают форму одной Сасо-2 клетки до (красный) и после (синий) применения механического напряжения (отметка, 20 мкм). Следует отметить, что клетки деформируются в направлении приложенного напряжения. На фиг.12E изображен график количественного определения механического напряжения, производимого в ECM-покрытой гибкой пористой PDMS мембране (полые кружки) и в прилипших кишечных эпителиальных клетках (закрашенные кружки) в зависимости от давления, прикладываемого вакуумным регулятором.
[0035] На фиг.13 изображена схема микротехнологического процесса одного из вариантов осуществления устройства, описанного в настоящем документе. 'Gut-on-a-Chip' микроустройство может быть изготовлено из трех PDMS слоев (верхний слой, пористая мембрана и нижний слой), которые последовательно соединялись и модифицировались для создания центрального клеточно-культурального канала с верхним (синий) и нижним (оранжевый) каналами и двух боковых вакуумных камер. Области пористой PDMS мембраны, которая натянута вакуумными камерами (серый), могут быть физически отделены при создании камер по всей высоте.
[0036] На фиг.14A-14D изображена морфология Caco-2 эпителиальных клеток в различных клеточно-культуральных устройствах. На фиг.14A изображена морфология Caco-2 эпителиальных клеток, культивированных в статической Transwell системе в течение 21 дней. На фиг.14B-14C изображена морфология Caco-2 эпителиальных клеток в 'Gut-on-a-Chip' с микрожидкостным потоком (30 мкл/ч; μF) без (фиг.14B) или с (фиг.14C) применением циклического механического напряжения (10%; 0,15 Гц; μF+St) в течение 3 дней. Схемы (слева) показывают модель системы; флуоресцентные изображения (в центре) показывают распределение белка плотного контакта, окклюдина, в эпителиальных слоях, а конфокально-флуоресцентное изображение (справа) показывает вертикальное сечение эпителия с обозначенными формами и полярностью клеток (ядра синим и F-актин зеленым). Регулярная сетка небольших белых кругов (фиг.14B) и (рис.14C) представляет поры, видимые под эпителиальным монослоем; пунктирная белая линия указывает верхнюю часть прикрепления подложки (отметка, 20 мкм). На фиг.14D изображен график средней высоты Caco-2 клеток, выращенных в статических Transwell культурах или микрожидкостном 'Gut-on-а-Chip' без (μF) или с (μF+St) механическим напряжением (*p<0,001).
[0037] На фиг.15A-15B показано спонтанное образование кишечных ворсинок Caco-2 клетками, культивированных в 'Gut-on-a-Chip'. На фиг.15A показано фазово-контрастное изображение Caco-2 клеточного монослоя после 58, 132 и 170 часов культивирования в присутствии потока и циклических деформаций (30 мкл/ч, 10% деформации, 0,15 Гц). Следует отметить, что плоский вид эпителиального монослоя на ранних этапах приобретает волнообразный характер с областями в и вне фокуса на более поздних этапах, что позволяет предположить образование ворсинок. На фиг.15B изображен конфокально-флуоресцентный вид вертикального сечения области волнообразного эпителия после 170 ч, подтверждающий наличие кишечных ворсинок, выстланных последовательно поляризованными столбчатыми эпителиальными клетками, меченными F-актином (зеленый) с базальными ядрами (синий) и апикальной экспрессией муцина (пурпурный), разделенных криптой. Регулярная сетка маленьких белые кругов представляет поры, видимые под эпителиальным монослоем; отметка, 20 мкм.
[0038] На фиг.16A-16C изображена оценка функций кишечного барьера и дифференцировки Caco-2 монослоя, культивированного в Transwell (статический) или микрожидкостной 'Gut-on-a-Chip' в отсутствие (μF) или в присутствии (μF+St) циклического напряжения. На фиг.16А изображена целостность плотного соединения эпителия, количественно измеренная по ТЭЭС Caco-2 монослоя. На фиг.16B изображена кажущаяся параклеточная проницаемость (Papp), измеренная количественно по транспорту флуоресцентного декстрана через Caco-2 монослой, культивированный в статических условиях в течение 5 или 21 дней, или в микрожидкостном 'Gut-on-a-Chip' в отсутствии (μF) или присутствии (μF+St) циклического напряжения в течение 5 дней (*** p<0,05). На фиг.16C изображена дифференцировка кишечных клеток, которую оценивали путем измерения активности аминопептидазы в щеточной каемке в Caco-2 клетках, культивированных в статических условиях в течение 5 или 21 дней или в микрожидкостном 'Gut-on-a-Chip' в отсутствии (μF) или в присутствии (μF+St) циклического напряжения в течение 5 дней (* p<0,001, ** p<0,01).
[0039] На фиг.17A-17E приведены результаты долгосрочного совместного культивирования с микробами на монослое кишечного эпителия человека в 'Gut-on-a-Chip'. Бактерию, исходно выделенную из кишечника человека, Lactobacillus Rhamnosus GG (LGG), культивировали на поверхности Caco-2 монослоя, выращенного в 'Gut-on-a-Chip'. На фиг.17A изображен фазо-контрастный вид сверху на LGG и Caco-2 клетки, совместно культивированные в течение 96 часов и показанных при малом (слева) и большом (справа) увеличении, который показывает микроколонии LGG клеток (белые стрелки), которые остаются плотно соединенными с апикальной поверхностью Caco-2 клеточного монослоя после воздействия непрерывного жидкостного потока (отметка, 20 мкм во всех изображениях). На фиг.17B показано одновременное окрашивание живых/мертвых клеток Caco-2 монослоя, совместно культивированного с LGG в течение 96 часов, демонстрирующее, что практически все эпителиальные клетки остаются жизнеспособными (зеленый). На фиг.17C изображены барьерные функции Caco-2 клеточного монослоя, выращенного в отсутствие (полые кружки) или в присутствии (закрашенные кружки) LGG клеток в Transwell (статическом) или микрожидкостном 'Gut-on-a-Chip' устройстве с циклической деформацией (μF+St; 40 мкл/ч, 10% клеточного штамма, 0,15 Гц). Следует отметить, что отметки ошибок были меньше, чем размеры символов (* p<0,01, ** p<0,05). На фиг.17D показана оценка функциональности жизнеспособных LGG клеток, совместно культивированных с Caco-2 клетками в течение 96 часов, проведенная путем измерения каталитической активности β-галактозидазы в LGG клетках, совместно культивированных с Caco-2 клетками в 'Gut-on-a-Chip' с механической деформацией (+LGG; 40 мкл/ч, 10% клеточного штамма, 0,15 Гц), либо в Caco-2 клетках, культивированных отдельно в качестве контроля (* p<0,01). На фиг.17E представлен график количества флуоресценции, меры расщепления кальцеина AM, обнаруживаемой в различных условиях, показывая, что флуоресцентное окрашивание на фиг.17B обеспечивается жизнеспособными Caco-2 клетками, а не является артефактом жизнеспособных LGG клеток.
[0040] На фиг.18A-18C показано, что поток жидкости является критическим фактором для контроля клеточной формы и полярности в Caco-2 клетках. Конфокально-флуоресцентное изображение в вертикальном разрезе Caco-2 монослоя, культивированного в 'Gut-on-a-Chip' с использованием скорости потока 10 мкл/ч (фиг.18A) или 100 мкл/ч (фиг.18B) в течение 20 часов в отсутствии циклического напряжения, подтверждает, что более высокие скорости потока (30-100 мкл/ч) специфично индуцируют поляризацию и формирование эпителия. На фиг.18C показано количественное определение средней высоты Caco-2 клеток, культивированных при скорости 10 мкл/ч или 100 мкл/час без механического напряжения (* p<0,0001; отметка, 20 мкм).
[0041] На фиг.19 показана оценка активности β-галактозидазы в живых LGG клетках и Caco-2 клетки, культивированных раздельно. Живые LGG клетки активно расщепляли субстрат β-галактозидазы, ONPG, и обеспечивали продолжительное увеличение оптической плотности O-нитрофенол продукта (заштрихованные кружки), тогда как человеческие Caco-2 эпителиальные клетки не показали какой-либо специфической β-галактозидазы (закрашенные квадраты). Различия в активности, проявляемой LGG клетками в сравнении с Caco-2, были значимыми (p<0,001) во всех временных точках.
[0042] На фиг.20 показана схема компьютерных систем для автоматизированного управления систем, описанных в данном документе.
[0043] На фиг.21 показан схематический вид одного варианта осуществления системы, описанной здесь.
[0044] На фиг.22A-22D показаны некоторые примеры альтернативных механизмов, которые могут быть использованы для применения напряжения на мембране системы, описанной в данном документе.
[0045] На фиг.23 показана схема одного варианта осуществления системы, описанной здесь. Числа в пунктирных кружках, представляют собой измерения указанных характеристик в мкм.
Подробное описание изобретения
[0046] Для удобства некоторые термины, используемые в данном документе, в описании, примерах и формуле изобретения, собраны здесь. Если иное не указано или явно не следует из контекста, следующие термины и фразы имеют значения, приведенные ниже. Если явно не указано иное или не следует из контекста, термины и фразы, указанные ниже, не исключают, что значение термина или фразы приобретает значение из области, к которой он относится. Определения приведены для того, чтобы помочь в описании конкретных вариантов осуществления и не предназначены для ограничения заявленного изобретения, так как объем настоящего изобретения ограничен только формулой. Если не определено иное, все технические и научные термины, используемые здесь, имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится данное изобретение.
[0047] При использовании здесь термин "содержащий" или "содержит" используется по отношению к композициям, способам и соответствующему(им) им компоненту(ам), который(ые) является(ются) необходимым(и) для способа или композиции, допускающим включение неуказанных элементов, как необходимых, так и нет.
[0048] При использовании здесь термин "состоящий по существу из" означает элементы, необходимые для данного варианта осуществления. Этот термин допускает присутствие элементов, которые существенно не влияют на основные и новые или функциональную(ые) характеристику(и) этого варианта осуществления.
[0049] Термин "состоящий из" относится к композициям, способам и соответствующим им компонентам, как описано здесь, которые исключают любые элементы, не перечисленные в этом описании варианта осуществления.
[0050] Как использовано в данном описании и прилагаемой формуле изобретения, формы единственного числа включают указания множественного числа, если из контекста явно не следует иное. Таким образом, например, указание на "способ" включает один или более способов и/или этапов этого типа способа, описанного здесь и/или которые станут очевидными для специалистов в данной области техники после прочтения данного раскрытия и т.д. Кроме того, слово "или" предназначено для включения "и", если из контекста явно не следует иное. Хотя способы и материалы, подобные или эквивалентные описанным здесь, можно использовать в практике или при проверке данного раскрытия, подходящие способы и материалы описаны ниже. Аббревиатура "e.g. является производной от латинского exempli gratia и используется здесь для указания неограничивающего примера. Таким образом, аббревиатура "e.g. является синонимом термина "например".
[0051] Определения терминов, общепринятых в клеточной биологии и молекулярной биологии, могут быть найдены в "The Merck Manual of Diagnosis and Therapy", 19-oe издание, опубликовано Merck Research Laboratories, 2006 (ISBN 0-911910-19-0); Robert S. Porter et al. (eds.), "The Encyclopedia of Molecular Biology", опубликована Blackwell Science Ltd., 1994 (ISBN 0-632-02182-9); "The ELISA guidebook" (Methods in molecular biology 149) Crowther J.R. (2000). Определения общепринятых терминов в молекулярной биологии могут быть также найдены в Benjamin Lewin, "Genes X", опубликовано Jones & Bartlett Publishing, 2009 (ISBN-10:0763766321); Kendrew et al. (eds.), "Molecular Biology and Biotechnology: a Comprehensive Desk Reference", опубликовано VCH Publishers, Inc., 1995 (ISBN 1-56081-569-8).
[0052] Если не указано иное, настоящее изобретение было выполнено с использованием стандартных процедур, как описано, например, в патентах США №№4,965,343, и 5,849,954; Sambrook et al., Molecular Cloning: A Laboratory Manual (3ed.), Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., USA (2001); Davis et al., Basic Methods in Molecular Biology, Elsevier Science Publishing, Inc., New York, USA (1995); Current Protocols in Cell Biology (CPCB) (Juan S. Bonifacino et. al. ed., John Wiley and Sons, Inc.); Culture of Animal Cells: A Manual of Basic Technique by R. Ian Freshney, Publisher: Wiley-Liss; 5th edition (2005); и Animal Cell Culture Methods (Methods in Cell Biology, Vol.57, Jennie P. Mather and David Barnes editors, Academic Press, 1 st edition, 1998), все из которых включены сюда посредством ссылки в их полном объеме.
[0053] Термины "уменьшать", "сокращать", "сократилось" и "сокращение" все используются здесь в общепринятом смысле для обозначения уменьшения на статистически значимое количество по отношению к контрольному. Тем не менее, во избежание сомнений, "сокращать", "сокращение " или " уменьшать" обычно означает снижение по меньшей мере на 10% по сравнению с отсутствием данной обработки и может включать, например, уменьшение по меньшей мере приблизительно на 20%, по меньшей мере приблизительно на 25%, по меньшей мере приблизительно на 30%, по меньшей мере приблизительно на 35%, по меньшей мере приблизительно на 40%, по меньшей мере приблизительно на 45%, по меньшей мере приблизительно на 50%, по меньшей мере приблизительно на 55%, по меньшей мере приблизительно на 60%, по меньшей мере приблизительно на 65%, по меньшей мере приблизительно на 70%, по меньшей мере приблизительно на 75%, по меньшей мере приблизительно на 80%, по меньшей мере приблизительно на 85%, по меньшей мере приблизительно на 90%, по меньшей мере приблизительно на 95%, по меньшей мере приблизительно на 98%, по меньшей мере приблизительно на 99%, вплоть до и включая, например, полное отсутствие данного объекта или параметра по сравнению с отсутствием данной обработки или любое снижение между 10-99% по сравнению с отсутствием данной обработки.
[0054] Термины "увеличилось", "увеличивать" или "повышать" все используются здесь в общепринятом смысле для обозначения увеличения на статически значимое количество; во избежание каких-либо сомнений, термины "увеличилось", "увеличение", или "повышать" означают увеличение по меньшей мере приблизительно на 10% по сравнению с контрольным уровнем, например, увеличение по меньшей мере приблизительно на 20% или по меньшей мере приблизительно на 30%, или по меньшей мере приблизительно на 40%, или по меньшей мере приблизительно на 50%, или по меньшей мере приблизительно на 60%, или по меньшей мере 70%, или по меньшей мере приблизительно на 80%, или по меньшей мере приблизительно на 90%, или вплоть до 100% увеличения, или любое увеличение в пределах 10-100%) по сравнению с контрольным уровнем или по меньшей мере приблизительно 2-кратное, или по меньшей мере приблизительно 3-кратное, или по меньшей мере приблизительно 4-кратное, или по меньшей мере приблизительно 5-кратное, или по меньшей мере приблизительно 10-кратное увеличение, или любое увеличение между 2-кратным и 10-кратным, или более по сравнению с контрольным уровнем.
[0055] При использовании здесь "поддержание" или " культивирование" относится к продлению жизнеспособности ткани или популяции клеток. Поддерживаемая ткань будет иметь популяцию метаболически активных клеток. Количество этих клеток может быть приблизительно стабильным в течение по меньшей мере 3 дней или может увеличиваться.
[0056] При использовании здесь термины "микрожидкостное устройство" и "микрожидкостной чип" используются взаимозаменяемо и относятся к структуре или подложке, имеющей микрожидкостные структуры, содержащиеся в нем или на нем. В некоторых вариантах осуществления чип может быть соединен с микрожидкостной системой с возможностью разъединения.
[0057] При использовании здесь термин "стволовая клетка" относится к клеткам, которые являются недифференцированными и обладают способностью к дифференцировке в нужный тип клеток, т.е. в эндотелиальные клетки или эпителиальные клетки кишечника.
[0058] При использовании здесь термин "эмбриональная стволовая клетка" относится к клеткам, которые являются тотипотентными и получены из ткани, сформированной после оплодотворения, но до окончания беременности, в том числе пре-эмбриональной ткани (такой как, например, бластоцист), эмбриональной ткани или ткани плода, взятой в любое время в течение беременности, обычно, но необязательно, до примерно 10-12 недель беременности. Эмбриональные стволовые клетки могут быть получены непосредственно из соответствующих тканей, включая, но не ограничиваясь ими, ткани человека, или из устоявшихся линий эмбриональных клеток. В одном варианте осуществления эмбриональные стволовые клетки получены так, как описано Thomson et al. (патенты США №№5,843,780 и 6,200,806; Science 282:1145, 1998; Curr. Top. Dev. Biol. 38:133 ff, 1998; Proc. Natl. Acad. Sci. U.S.A. 92:7844, 1995, которые включены сюда посредством ссылки в их полном объеме).
[0059] При использовании здесь термины "индуцированные плюрипотентные стволовые клетки" или "iPSC", которые используются здесь взаимозаменяемо, относятся к плюрипотентным клеткам, полученным из дифференцированных клеток. Например, iPSC могут быть получены с помощью избыточной экспрессии факторов транскрипции, таких как Oct4, Sox2, c-Myc и Klf4, в соответствии с методами, описанными Takahashi et al. (Cell, 126: 663-676, 2006). Другие способы получения iPSC описаны, например, в Takahashi et al. Cell, 131: 861-872, 2007 и Nakagawa et al. Nat. Biotechnol. 26: 101-106, 2008; которые включены сюда посредством ссылки в их полном объеме.
[0060] Термин "статистически значимый" или "значительно" относится к статистической значимости и обычно означает два стандартных отклонения (2SD) ниже нормы, или ниже, концентрации маркера. Этот термин относится к статистическому доказательству того, что разница существует. Он определяется как вероятность принятия решения об отклонении нулевой гипотезы, когда нулевая гипотеза на самом деле является истинной. Решение часто делаются с помощью p-значения.
[0061] За исключением рабочих примеров или если не указано иное, все числа, выражающие количества ингредиентов или условия реакции, используемые здесь, следует понимать как приведенные во всех случаях с термином "приблизительно". Термин "приблизительно" при использовании в связи с процентами может означать ±1%.
[0062] Термины в единственном числе включают термины во множественном числе, если из контекста явно не следует иное. Кроме того, слово "или" подразумевает включение "и", если из контекста явно не следует иное. Хотя способы и материалы, подобные или эквивалентные описанным здесь, можно использовать в практике или при проверке данного описания, подходящие способы и материалы описаны ниже.
[0063] Другие термины определены здесь в описании различных аспектов настоящего изобретения.
[0064] Везде в описании и чертежах клеточные культуральные системы, описанные здесь, упоминаются как взаимозаменяемые 'Gut-on-a-Chip'. На фиг.5 изображен один вариант осуществления системы культивирования клеток, описанная здесь. В соответствии с некоторыми вариантами осуществления изобретения, описанными здесь, клеточная культуральная система может содержать жидкостное устройство, имеющее жидкостной канал 10, соединенный с источником жидкости, который подает жидкость в жидкостной канал 10. Размер и форма жидкостного канала 10 могут быть изменены в зависимости от требуемых размеров и формы органоида и/или объема и потока предоставляемой жидкости.
[0065] При использовании здесь "жидкостное устройство" относится к устройству любого размера и расположения, которое содержит один или более жидкостных каналов и подходит для культивирования живых клеток. Жидкостное устройство может быть способно к перемещению любого количества жидкости в пределах диапазонов потока жидкости, описанных ниже в данном документе, например, жидкостное устройство может быть микрожидкостным устройством или другим устройством, способным перемещать большие объемы жидкости. При использовании здесь термин "канал" относится к любому капилляру, каналу, трубке или желобу, который расположен внутри или на подложке. Канал может быть микроканалом, то есть таким каналом, который имеет размеры для прохождения микрообъемов жидкости.
[0066] Источник жидкости может представлять собой резервуар или другой контейнер, содержащий объем жидкости таким образом, чтобы можно было вызвать движение жидкости от источника жидкости и через один или более каналов жидкостного устройства. Источник жидкости может быть соединен с одним или несколькими каналами жидкостного устройства с помощью любых средств проведения жидкости, например, трубки, системы трубок, каналов или т.п. Жидкостное устройство и/или источник жидкости может включать порты. При использовании здесь термин "порт" относится к блоку системы клеточной культуры, описанной здесь, которая обеспечивает средства для жидкости и/или клеток для ввода и/или вывода из системы и/или для ввода и/или вывода из блоков системы. Порт может быть такого размера и формы, чтобы принимать и/или обеспечивать соединение трубок, соединений или адаптеров жидкостной или микрожидкостной системы и обеспечивать прохождение жидкости и/или клеток в случае прикрепления к жидкостной или микрожидкостной системе.
[0067] В соответствии с различными вариантами осуществления изобретения жидкость протекает от источника жидкости через жидкостный канал 10 устройства по направлению к резервуару для сбора жидкости (не показан). Положительное или отрицательное давление жидкости, или оба, могут быть использованы для того, чтобы вызвать поток жидкости через жидкостной канал 10. В соответствии с некоторыми вариантами осуществления изобретения жидкость в источнике жидкости может находиться под давлением и для контролирования потока жидкости в канале может быть предусмотрен клапан между источником жидкости и жидкостным каналом 10. В соответствии с некоторыми вариантами осуществления изобретения вакуумный источник может быть соединен с выходном портом жидкостного канала 10 для прогона жидкости через жидкостной канал 10. В соответствии с некоторыми вариантами осуществления изобретения для того, чтобы обеспечить поток жидкости через жидкостной канал 10, может быть применена сила тяжести. Например, источник жидкости может быть поднят выше устройства, а резервуар для сбора жидкости может быть расположен ниже устройства, обеспечивая давление жидкости для того, чтобы вызвать поток жидкости через жидкостной канал 10. Для контроля скорости потока жидкости может быть использован клапан на источнике жидкости или на пути потока жидкости. В соответствии с некоторыми вариантами осуществления изобретения могут быть использованы один или несколько насосов для того, чтобы вызывать поток жидкости от источника жидкости через жидкостный канал 10.
[0068] На фиг.21 показан, в целях иллюстрации, схематический вид системы 100 в соответствии с одним вариантом осуществления настоящего изобретения. Система 100 может включать один или более источников жидкости (например, 32, 34), подключенных к микрожидкостному устройству 5 (например, такому как показанные на фиг.3, 5, 6 и 12), где микрожидкостное устройство 5 включает один или более жидкостных каналов 10, которые могут быть подключены к одному или более резервуарам для сбора жидкости (например, 36, 38). В некоторых вариантах осуществления источник жидкости 32, 34 может быть простым пластиковым контейнером, хранящим и подающим жидкость, или контейнером с двумя или более отдельными отсеками для хранения и подачи различных жидкостей. В некоторых вариантах осуществления источник жидкости 34 может находиться под давлением при подключении контейнера источника для подачи газа под давлением 52 (например, воздуха или другого инертного газа) или другой жидкости (например, воды, среды), в результате полученного давление обеспечивается поток жидкости из источника 34 в устройство 5 и через жидкостной канал 10. В этом варианте осуществления контейнер источника может быть герметичным металлическим или пластиковым контейнером, пригодным для поддержания давления. В некоторых вариантах осуществления резервуар для сбора жидкости 38 может быть соединен с источником вакуума 54, где вакуум вызывает поток жидкости в устройство 5 и через жидкостной канал 10 по направлению к резервуару для сбора жидкости 38. В дополнение или в качестве альтернативы давления или вакуума, источник жидкости 32, 34, контейнеры могут быть приподняты для того, чтобы обеспечить положительное давление в микрожидкостном устройстве 5. В некоторых вариантах осуществления изобретения для контролирования потока жидкости через устройство 5 могут быть предоставлены клапаны 44, 48. Клапаны 44, 48 могут быть подключены к системе управления, такой как компьютерная система 700, для того, чтобы обеспечить автоматическое управление клапанами и потоком жидкости.
[0069] В некоторых вариантах осуществления настоящего изобретения система может включать один или насосы 42, 46 для перекачки жидкости из источника жидкости 32 к микрожидкостному устройству 5 и через жидкостной канал 10 в резервуар для сбора жидкости 36. В некоторых вариантах осуществления настоящего изобретения может быть использован один насос (например, 42 или 46). В других вариантах осуществления изобретения могут быть использованы два или несколько насосов 42, 46. Насосы 42, 46 могут быть соединены с системой управления, такой как компьютерная система 700, для того, чтобы обеспечить автоматическое управление насосами и потоком жидкости. Насосы 42, 46 могут быть представлены любым динамическим или поршневым насосом, например, шприцевым насосом, перистальтическим насосом или поршневым насосом с избыточным давлением.
[0070] В соответствии с некоторыми вариантами осуществления изобретения, описанными здесь, и как показано на фиг.5, система культивирования клеток может дополнительно содержать мембрану 20, расположенную внутри канала и прикрепленную к одному или более опорным элементам мембраны 22, 24. В некоторых вариантах осуществления мембрана 20 может разделять жидкостной канал 10 на первый клеточно-культуральный канал 12 и второй клеточно-культуральный канал 14. Первый и второй клеточно-культуральные каналы могут быть расположены любым образом. В качестве неограничивающего примера мембрана 20, разделяющая клеточно-культуральные каналы, может быть протянута вдоль одной плоскости горизонтально, например, как показано на фиг.5, таким образом, чтобы один клеточно-культуральный канал располагался непосредственно над другим клеточно-культуральным каналом. Альтернативно, мембрана 20, разделяющая клеточно-культуральные каналы, может быть протянута вдоль одной плоскости вертикально, таким образом, чтобы два клеточно-культуральных канала располагались бок о бок, но не один над другим. Альтернативно, мембрана 20, разделяющая клеточно-культуральные каналы, может быть трубчатой и/или цилиндрической мембраной, таким образом, чтобы первый клеточно-культуральный канал располагался внутри трубки, образованной мембраной, а второй клеточно-культуральный канал включал в себя пространство между мембраной и стенкой жидкостного канала 10. В соответствии с некоторыми вариантами осуществления системы культивирования клеток, описанной здесь, опорные элементы мембраны могут быть соединены с механизмами деформации мембраны 26, способными перемещать опорные элементы мембраны и вызывать растяжение мембраны по меньшей мере в одном измерении мембраны.
[0071] В некоторых вариантах осуществления мембрана по меньшей мере частично гибкая. В некоторых вариантах осуществления мембрана является гибкой по меньшей мере в одном измерении, например, мембрана может растягиваться в одном направлении или в двух измерениях, или в трех направлениях. Мембрана может быть изготовлена из любого частично гибкого биосовместимого материала. В некоторых вариантах осуществления мембрана может быть изготовлена из PDMS. Другие примеры биосовместимых материалов описаны ниже в данном документе.
[0072] В некоторых вариантах осуществления мембрана по меньшей мере частично пористая. В некоторых вариантах осуществления поры мембраны составляют от 0,5 до 10 мкм в диаметре. В некоторых вариантах осуществления поры мембраны составляют приблизительно 10 мкм в диаметре. В некоторых вариантах осуществления поры мембраны составляют приблизительно 5 мкм в диаметре. В вариантах осуществления, когда требуется трансмиграция клеток через мембрану (например, иммунных клеток), особенно полезны поры приблизительно 5 мкм в диаметре. В некоторых вариантах осуществления поры могут быть расположены неравномерно. В некоторых вариантах осуществления поры могут быть расположены равномерно. В некоторых вариантах осуществления поры могут быть на расстоянии 5 мкм или дальше друг от друга, например, 5 мкм друг от друга, 10 мкм друг от друга, 25 мкм друг от друга, 50 мкм друг от друга, 100 мкм друг от друга, 1000 мкм друг от друга, 5 мм друг от друга, или дальше друг от друга.
[0073] В некоторых вариантах осуществления мембрана может быть плоской. В некоторых вариантах осуществления мембрана может быть цилиндрической. В некоторых вариантах осуществления толщина мембраны составляет от 15 мкм или более, например, 15 мкм или более, 20 мкм или более, 25 мкм или более, 30 мкм или более, 35 мкм или более, или 40 мкм или более. В некоторых вариантах осуществления мембрана может быть от 15 до 40 мкм толщиной. В некоторых вариантах осуществления мембрана может быть от 25 до 30 мкм толщиной. В некоторых вариантах осуществления мембрана может быть приблизительно 30 мкм толщиной.
[0074] В некоторых вариантах осуществления мембрана 20 прикреплена по меньшей мере к двум опорным элементам мембраны 22, 24 в жидкостном канале. При использовании здесь термин "опорный элемент мембраны" относится к части системы культивирования клеток, к которой прикреплена мембрана. Опорный элемент мембраны может быть стенкой жидкостного канала или отдельной структурой, такой как стойка, ряд стоек, зажим или порт, входящий в состав жидкостного канала. В некоторых вариантах осуществления опорный элемент мембраны 22, 24 может менять положение, менять ориентацию и/или сгибаться, что придает напряжение или движение мембране 20. В некоторых вариантах осуществления по меньшей мере один опорный элемент мембраны соединен с механизмом деформации мембраны. В некоторых вариантах осуществления первый опорный элемент мембраны соединен с механизмом деформации мембраны, а второй опорный элемент мембраны не соединен с механизмом деформации мембраны. В некоторых вариантах осуществления два или более опорных элементов мембраны соединены с механизмом деформации мембраны. При использовании здесь термин "механизм деформации мембраны" означает средства, которые вызывают изменение положения, изменение ориентации и/или сгибание опорного элемента мембраны 22, 24, в результате чего мембрана растягиваться по меньшей мере в одном направлении. Механизм деформации мембраны может обеспечить растягивание мембраны посредством перемещения или сгибания опорного элемента мембраны. Неограничивающие примеры механизмов деформации мембраны включают вакуумные камеры, жидкостные камеры, соединенные с насосами, плунжерами и т.п.
[0075] Как показано на фиг.3, 5, 6 и 12, механизм деформации мембраны может включать одну или несколько вакуумных камер 26, которые вызывают выгибание стенок 22, 24 жидкостного канала 10 наружу, в результате чего мембрана 20, прикрепленная к стенкам, натягивается между стенками 22, 24 жидкостного канала 10. В альтернативном варианте осуществления мембрана 20 может быть натянута между стенками 22, 24 жидкостного канала 10 в исходном состоянии, а положительное давление может быть приложено к камерам 26 для того, чтобы вызвать выгибание стенок 22, 24 внутрь для уменьшения и/или исключения напряжения на мембране 20. Для обеспечения напряжения на мембране 20 могут быть использованы другие механизмы. В соответствии с изобретением могут быть обеспечены дополнительные пневматические камеры вокруг жидкостного канала 10 для того, чтобы обеспечить локализованное напряжение на мембране 20 или напряжение на мембране 20 по различным направлениям.
[0076] На фиг.22A-22D показаны некоторые примеры альтернативных механизмов, которые могут быть использованы для применения напряжения на мембране 20. На фиг.22A показан один вариант осуществления изобретения, в котором мембрана 20 прикреплена к стенкам 22, 24 устройства 5 и одна или обе стенки 22, 24 гибкие и прикреплены к двигателю M, который позволяет стенкам сгибаться, обеспечивая напряжение на мембране 20. В соответствии с изобретением двигатель M может быть любым устройством, способным прикладывать силу к стенкам 22, 24, включая, например, пневматический или гидравлический цилиндр, электродвигатель и ходовой винт или трос и шкив, или соленоид. В случае, если требуется дополнительная сила, могут быть использованы механизмы, которые используют рычаги и/или передаточное отношение, такой как надцентровой механизм.
[0077] В соответствии с одним альтернативным вариантом осуществления настоящего изобретения двигатель M может быть непосредственно соединен с мембраной 20, которая может свободно растягиваться, например, через щель или другое отверстие в жидкостном канале 10, как показано на фиг.22B. Для предотвращения вытекания жидкости из жидкостного канала 10 могут быть обеспечены затворы. В некоторых вариантах осуществления мембрана может быть соединена с кабелем или шнуром, который может натягиваться, обеспечивая напряжение на мембране, и могут быть обеспечены один или более шкивов для того, чтобы легко затягивать кабель или шнур. Кабель или шнур можно затянуть, например, путем намотки кабеля или шнура вокруг шкива с помощью электромотора. В альтернативном варианте осуществления мембрана 20 может быть напряжена путем наматывания ее на вал, проходящий параллельно одного края мембраны 20.
[0078] В соответствии с одним альтернативным вариантом осуществления настоящего изобретения жидкостной канал 10 может быть образован из двух жестких элементов 22, 24, где один элемент 22 скользит внутри другого элемента 24, как показано на фиг.22C. Как описано выше, двигатель М может быть использован для перемещения элемента 22 относительно элемента 24 и обеспечения напряжения на мембране 20, которая соединена или прикреплена с противоположных краев к элементам 22 и 24. В некоторых вариантах осуществления изобретения затворы вдоль перекрывающихся поверхностей или сильфон могут быть использованы для герметизации жидкостного канала 10.
[0079] В соответствии с одним альтернативным вариантом осуществления настоящего изобретения жидкостной канал 10 может быть выполнен из гибкого корпуса, в котором мембрана 20 проходит между двумя боковыми стенками 22, 24. В этом варианте осуществления сила может быть приложена к верхней и/или нижней части жидкостного канала 10, в результате чего боковые стенки 22 и 24 выгибаются наружу, вызывая напряжение на мембране 20. Силы, вызывающие напряжение, может поддерживаться жидкостью, протекающей через жидкостной канал 10, которая будет расширяться по направлению к верхней и нижней стенками совместно. В этом варианте осуществления, как показано на фиг.22D, боковые стенки 22 и 24 могут быть сконструированы так, чтобы сгибаться вдоль предопределенной части боковых стенок, например, когда боковые стенки 22, 24 соприкасаются с верхней и нижней стенками жидкостного канала 10, и когда мембрана 20 соединена или прикреплена к боковыми стенкам 22, 24. В этом варианте осуществления давление на верхней и/или нижней части жидкостного канала может быть применено последовательно вдоль продольной оси жидкостного канала 10, который проходит от входного порта к выходному порту, например, для имитации перистальтического движения.
[0080] В варианте, показанном на фиг.5, опорные элементы мембраны 22, 24 содержат первую и вторую стенки жидкостного канала 10 и механизмы деформации мембраны 26 представляют собой вакуумные камеры. Мембрана крепится к первой стенке камеры (первый опорный элемент мембраны) 22 и второй стенке камеры (второй опорный элемент мембраны) 24. Каждый рабочий канал 26 расположен рядом с соответствующим опорным элементом мембраны 22, 24 таким образом, что рабочий канал 26 расположен на противоположной стороне другого опорного элемента мембраны 22, 24 по отношению к жидкостному каналу 10 и другому рабочему каналу 26. Перепад давления (по сравнению с жидкостным каналом 10) обеспечивается с помощью вакуума в каждом рабочем канале 26, в результате чего опорный элемент мембраны изгибает в нужном направлении и, таким образом, мембрана 20 либо расширяется, либо сжимается в соответствующем направлении. Каждый рабочий канал 26 соединен с вакуумной системой, способной обеспечить перепад давления. Рабочий канал 26 может быть присоединен к той же вакуумной системе или к отдельным вакуумным системам. Рабочий канал 26 может быть присоединен к вакуумной системе через отверстие в рабочем канале и трубкой.
[0081] В некоторых вариантах мембрану растягивают на от 0 до 50%. В некоторых вариантах осуществления мембрану растягивают на от 5% до 15%. В некоторых вариантах осуществления мембрану растягивают приблизительно на 10%. В некоторых вариантах осуществления мембрана может растягиваться более чем на 15%, для того, чтобы создать аномальное условие и/или состояние эпителиальных клеток кишечника. В некоторых вариантах осуществления мембрана способна растягиваться более чем на 20%. В некоторых вариантах осуществления растяжение мембраны может быть вызвано нерегулярным или прерывистым образом. В некоторых вариантах осуществления растяжение мембраны может быть вызвано циклическим образом. В некоторых вариантах осуществления растяжение мембраны может быть вызвано циклически при частоте от 0,01 Гц до 2 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте от 0,05 Гц до 0,25 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте менее 0,2 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте от 0,01 Гц до 0,18 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте примерно 0,15 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте 0,15 Гц. В некоторых вариантах осуществления растяжение мембраны может быть вызвано при циклической частоте более 0,2 Гц для создания аномального условия и/или состояния кишечных эпителиальных клеток, например, в случае моделирования гиперсократимости кишечника.
[0082] В некоторых вариантах осуществления система культивирования клеток может быть микрожидкостной системой. При использовании здесь термин "микрожидкостная система" относится к машине, способной манипулировать микролитровыми и/или нанолитровыми объемами жидкости. Как показано в варианте осуществления системы культивирования клеток, представленном на фиг.12B, микрожидкостная система может содержать микрожидкостной чип 50, который может содержать по меньшей мере канал(ы) и мембранные элементы системы культивирования клеток в соответствии с описанным здесь. В некоторых вариантах осуществления изобретения для использования в конкретной микрожидкостной системе могут быть подобраны размер и форма чипа 50. В некоторых вариантах осуществления размер, форма и конфигурация чипа 50 могут быть выбраны таким образом, чтобы чип мог быть использован в качестве замены для других чипов, предоставляемых производителями или поставщиками для конкретной микрожидкостной системы. В некоторых вариантах осуществления чип 50 может включать один или несколько впускных портов 60, соединенных с одним или более выпускными отверстиями 62 одним или несколькими микрожидкостными каналами 10. Порты 60, 62 могут быть предусмотрены соответствующих размеров и формы, необходимых для принятия трубок и/или разъемов конкретной микрожидкостной системы. В некоторых вариантах осуществления могут быть подключены впускной(ые) порт(ы) 60 и выпускной(ые) порт(ы) 62 для того, чтобы позволить жидкости, поступающей от входного(ых) порта(ов) 60 пройти через некоторые или все жидкостные каналы 10 перед достижением выпускного(ых) порта(ов) 62. В некоторых вариантах осуществления с жидкостным каналом могут быть соединены несколько портов. В варианте, изображенном на фиг.12B, каждый из двух каналов культивирования клеток составляет 1000 мкм в ширину, 10000 мкм в длину и 150 мкм в высоту. Рабочие каналы 44, 46 составляют 330 мкм в высоту, 1684 мкм в ширину и 9089 мкм в длину. Мембрана 20 представляет собой мембрану PDMS толщиной 30 мкм с диаметром пор 10 мкм, расположенных на расстоянии 25 мкм друг от друга при измерении от центра до центра. В некоторых вариантах осуществления чип 50 может составлять 15000 мкм в ширину, 25000 мкм в длину и 5000 мкм в высоту.
[0083] На фиг.23 изображен один вариант осуществления системы, описанной здесь. В этом варианте осуществления жидкостной канал 10 составляет 1000 мкм в ширину, 10000 мкм в длину и 330 мкм в высоту; два клеточно-культуральных канала каждый шириной 1000 мкм, длиной 10000 мкм и высотой 150 мкм. Вакуумные камеры 26 составляют 1684 мкм в ширину, 9089 мкм в длину и 330 мкм в высоту. Мембрана 20 представляет собой мембрану PDMS 30 мкм в толщину с диаметром пор 10 мкм, расположенных на расстоянии 25 мкм друг от друга при измерении от центра до центра.
[0084] Размеры жидкостного канала 10 и клеточно-культуральных каналов 12 и 14 могут быть определены как соотношения. В некоторых вариантах осуществления соотношение высота : ширина жидкостного канала 10 может составлять 1:2 или более, например, 1:2 или более, 1:2,5 или более, 1:3 или более, или 1:35 или более. В некоторых вариантах осуществления соотношение высота : ширина жидкостного канала 10 составляет примерно 1:3. В некоторых вариантах осуществления соотношение высота : ширина жидкостного канала 10 может составлять 1:5 или более, например, 1:5 или более, 1:10 или более, 1:20 или более, или 1:30 или более. В некоторых вариантах осуществления соотношение высота: ширина жидкостного канала 10 может составлять примерно 1:30. В некоторых вариантах осуществления соотношение ширины жидкостного канала 10 к ширине вакуумной камеры 26 может составлять 1:0,75 или более, например, 1:0,75 или более, 1:1 или более, 1:1,25 или более, 1:1,5 или более, или 1:1,75 или более. В некоторых вариантах осуществления соотношение ширины жидкостного канала 10 к ширине вакуумной камеры 26 может составлять от 1:1 до 1:2. В некоторых вариантах осуществления соотношение ширины жидкостного канала 10 к ширине вакуумной камеры 26 может составлять примерно 1:1,68.
[0085] В некоторых вариантах осуществления соотношение ширина:длина клеточно-культурального канала 12, 14 может составлять 1:5 или более, например, 1:6 или более, 1:7 или более, 1:10 или более, 1:15 или более, 1:20 или более или 1:30 или более. В некоторых вариантах осуществления соотношение ширина : длина клеточно-культурального канала 12, 14 может составлять от 1:6 до 1:20. В некоторых вариантах осуществления соотношение ширина: длина клеточно-культурального канала 12, 14 может составлять примерно 1:10. В некоторых вариантах осуществления соотношение высота : ширина клеточно-культурального канала 12, 14 может составлять 1:5 или более, например, 1:5 или более, 1:6 или более, 1:7 или более, 1:8 или более, 1:10 или более или 1:15 или более. В некоторых вариантах осуществления соотношение высота : ширина клеточно-культурального канала 12, 14 может составлять от 1:5 до 1:10. В некоторых вариантах осуществления соотношение высота : ширина клеточно-культурального канала 12, 14 может составлять примерно 1:6,67. В некоторых вариантах осуществления соотношение высота : длина клеточно-культурального канала 12, 14 может составлять 1:20 или более, например, 1:20 или более, 1:25 или более, 1:30 или более, 1:40 или более, 1:50 или более, 1:60 или более, 1:70 или более, 1:80 или более, или 1:100 или более. В некоторых вариантах осуществления соотношение высота : длина клеточно-культурального канала 12, 14 может составлять от 1:20 до 1:100. В некоторых вариантах осуществления соотношение высота : длина клеточно-культурального канала 12, 14 может составлять примерно 1:66,67.
[0086] Структуры системы культивирования клеток, описанные здесь (например, мембраны, порты и/или опорные структуры мембраны) может быть сформированы, например, путем травления, 3-D печати, механической обработки или микрообработки. В некоторых вариантах осуществления система культивирования клеток, описанные здесь, производится без травления. В одном варианте воплощения система культивирования клеток, изображенная на фиг.12B, может быть сформирована следующим образом. Система культивирования клеток может быть изготовлена из гибкого прозрачного полимера полидиметилсилоксана (PDMS; Sylgard, Dow Corning). Выровненные верхний и нижний микроканалы могут быть одного и того же размера (высотой 150 мкм × шириной 1000 мкм) и разделены PDMS мембраной шириной 30 мкм, содержащей округлые поры диаметром 10 мкм с расстоянием 25 мкм (от центра до центра) (фиг.12A-12C). Как показано на фиг.13, верхний и нижний слои микроканалов могут быть подготовлены индивидуально путем литья форполимера PDMS (15:1 вес. соотношение PDMS к отвердителю) на микроизготовленный шаблон обратной конструкция канала, выполненном из фоторезиста (SU-8 100, Microchem, Ньютон, Массачусетс). Пористая мембрана (фиг.12C, справа) может быть получена путем литья форполимера PDMS на микроизготовленную кремниевую пластину, содержащую столбчатые матрицы с округлыми столбиками (диаметр 10 мкм × высота 30 мкм с шагом 25 мкм; MEMS and Nanotechnology Exchange, Рестон, Вирджиния), наложения форполимера с отвержденным плоским силанизированным PDMS слоем подложки, размещения 3 кг веса на установке и отверждения полимера при 60°C в течение 12 часов. После отслаивания пористой мембраны PDMS и слоя подложки от пластины поверхность пористой мембраны могут подвергать воздействию плазмы, генерируемой лабораторной установкой для коронирования (BD-20АС, Electro-Technic Products, Inc, Чикаго, Иллинойс), также как и верхний слой микроканала. Обработанные плазмой поверхности пористой мембраны PDMS и верхнего слоя микроканала могут быть затем немедленно помещены в конформной контакт. Инкубация всей установки при 80°C в течение ночи приводит к необратимому соединению двух слоев PDMS. Слой PDMS подложки может быть затем отделен от нижней части PDMS пористой мембраны и часть этой мембраны, расположенная над боковыми вакуумными камерами, может быть оторвана с помощью щипцов для создания полых по всей высоте вакуумных камер. Открытая поверхность оторванной мембраны PDMS и верхняя поверхность нижнего слоя PDMS микроканала с такой же формой к верхнему слою могут затем подвергаться воздействию плазмы, выравниванию, прессованию вместе под стереоскопом (Zeiss Discovery V20 Stereo Microscope, Carl Zeiss MicroImaging Gmb, Германия) и отвердеванию при 80°C в течение ночи с получением полностью соединенного устройства, содержащего полые вакуумные камеры по обе стороны от основного микроканала (фиг.12A и фиг.13). Система трубок (Tygon 3350 silicone tubing, ID 1/32", OD 3/32", Бивертон, Мичиган) может соединять жидкую среду и источники вакуума с верхним и нижним микроканалами, соответственно, с использованием тупых игл из нержавеющей стали без сердечника (18G; Kimble Chase, Вайнленд, Нью-Джерси). Это позволяет управлять потоком культуральной среды в центральном микроканале и регулированием применения вакуума к боковым камерам под управлением компьютера для воздействия циклического механического напряжения для имитирования перистальтических движений (фиг.12D).
[0087] Система культивирования клеток, описанная здесь, может быть изготовлена из биосовместимого гибкого материала или биосовместимого негибкого материала в соответствии с конструкцией и требуемыми параметрами. Следует отметить, что конструкции, изображенные на чертежах по настоящему изобретению, приведены только для примеров и система культивирования клеток, описанная здесь, не ограничивается конфигурациями, показанными на этих чертежах. Система культивирования клеток и/или ее части могут быть изготовлены из гибкого материала, включая, но не ограничиваясь этим, биосовместимый материал, такой как полидиметилсилоксан (PDMS), полиуретан или полиимид. Система культивирования клеток и/или ее части могут быть изготовлены из негибких материалов, таких как стекло, кремний, полисульфон, твердый пластик и т.п., а также комбинаций этих материалов.
[0088] Биосовместимый полимер относится к материалам, которые не имеют токсичных или вредных воздействий на биологические функции. Биосовместимые полимеры включают природные или синтетические полимеры. Примеры биосовместимых полимеров включают, но не ограничиваются ими, коллаген, поли(альфа-эфиры), такие как поли(молочная кислота), поли(гликолевая кислота), полиортоэфиры и полиангидриды, и их сополимеры, полигликолевая кислота и полиглактин, простой эфир целлюлозы, целлюлоза, целлюлозный сложный эфир, фторированный полиэтилен, фенольные соединения, поли-4-метилпентен, полиакрилонитрил, полиамид, полиамидимид, полиакрилат, полибензоксазол, поликарбонат, полицианоарил простой эфир, полиэстер, полиэстеркарбонат, полиэфир, полиэфирсульфон, полиэфирэфиркетон, полиэфиримид, полиэфиркетон, полиэфирсульфон, полиэтилен, полифторолефин, полиимид, полиолефин, полиоксадиазол, полифениленоксид, полифениленсульфид, полипропилен, полистирол, полисульфид, полисульфон, политетрафторэтилен, политиоэфир, политриазол, полиуретан, поливинил, поливинилиденфторид, регенерированная целлюлоза, силикон, мочевина-формальдегид, полиглактин или сополимеры, или физические смеси этих материалов.
[0089] Биосовместимым материалом также может быть, например, керамические покрытия на металлической подложке. Но любой тип покрывающего материала и покрытия могут быть изготовлены из различных типов материалов: металлов, керамики, полимеров, гидрогелей или комбинаций любых из этих материалов. Биосовместимые материалы включают, но не ограничиваются ими, оксид, фосфат, карбонат, нитрид или карбонитрид. Среди оксидов следующие более предпочтительны: оксид тантала, оксид алюминия, оксид иридия, оксид циркония или оксид титана. Подложки изготавливают из таких материалов, как металлы, керамика, полимеры или комбинаций любых из них. Металлы, такие как нержавеющая сталь, нитинол, титан, титановые сплавы или алюминий, и керамика, такая как диоксид циркония, оксид алюминия или фосфат кальция, представляют особый интерес.
[0090] Биосовместимый полимер может подвергаться формованию с использованием таких методов, как, например, окунание в раствор, компрессионное формование, вытягивание нитей, плетение, выщелачивание, связывание и покрытие. При формовании окунанием в раствор, в раствор одного или более полимеров в соответствующем растворителе, таком как метиленхлорид, окунают рельефную структуру в виде разветвленного шаблона. После выпаривания растворителя получают тонкую пленку. При компрессионном формовании полимер прессуют под давлением до 30000 фунтов на квадратный дюйм по подходящему шаблону. Вытягивание нитей заключается в вытягивании из расплавленного полимера, и плетение включает формирование сетки путем сжатия волокон в войлокообразный материал. При выщелачивании раствор, содержащий два материала, распределяют в форму, близкую к окончательной форме RUG. Далее, используют растворитель для растворения одного из компонентов, в результате чего образуются поры (см. Mikos, патент США №5,514,378, включенный сюда посредством ссылки). При нуклеации тонкие пленки в форме RUG подвергают воздействию продуктов радиоактивного распада, которые создают отпечатки поврежденного излучением материала. Далее, поликарбонатные листы подвергают травлению кислотой или основанием, превращая отпечатки радиационно-поврежденного материала в поры. Наконец, может быть использован лазер для формирования и выжигания отдельных отверстий через различные материалы для формирования RUG структуры с одинаковым размером пор. Покрытие относится к покрытию или взаимному проникновению полимерной структуры с таким материалом, как, например, сжиженные сополимеры (поли -DL-лактид со-гликолид 50:50 80 мг/мл метиленхлорид), для изменения его механических свойств. Покрытие может быть выполнено в один слой или несколько слоев, в зависимости от требуемых механических свойств. Эти методики формообразования могут быть использованы в сочетании, например, полимерная матрица может быть создана связыванием, прессованием и склеиванием совместно. Кроме того, различные полимерные материалы, сформированные различными процессами, могут быть соединены вместе для образования составной формы. Составные формы могут иметь слоистую структуру. Например, полимерная матрица может быть прикреплена к одной или более полимерным матрицам для формирования многослойной полимерной структуры матрицы. Прикрепление может быть выполнено путем приклеивания с помощью жидкого полимера или путем пришивания. Кроме того, полимерная матрица может быть выполнена в виде твердотельного блока и сформирована с помощью лазера или других общепринятых методов обработки в требуемую конечную форму. Лазерное формирование относится к процессу удаления материала с помощью лазера.
[0091] Жидкость, которая вызывает поток через один или несколько жидкостных каналов в системе культивирования клеток, описанной здесь, может быть любой жидкостью, необходимой для поддержания или культивирования кишечных клеток. В некоторых вариантах осуществления жидкостной канал разделяется на первый клеточно-культуральный канал и второй клеточно-культуральный канал, и либо одна и та же жидкость, либо различные жидкости могут вызвать поток через каждый канал. Если первый клеточно-культуральный канал содержит эпителиальные клетки кишечника, то жидкость, протекающая через первый клеточно-культуральный канал, может быть жидкостью, необходимой для поддержания или культивирования эпителиальных клеток кишечника. Если второй клеточно-культуральный канал содержит эндотелиальные клетки, иммунные клетки и/или клетки соединительной ткани, то жидкость, протекающая через второй клеточно-культуральный канал, может быть жидкостью, необходимой для поддержания или культивирования эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани. Если в системе культивирования клеток присутствуют микробные клетки, то жидкость должна быть подходящей для поддержания или культивирования микробных клеток, e.g., она не должна содержать антибиотики, к которым чувствительны микробные клетки. Жидкости могут содержать среду для культивирования клеток, растворы, буферы, питательные вещества, индикаторные соединения, красители, противомикробные препараты или другие соединения, нетоксичные для клеток, которые культивируются в системе культивирования клеток, описанной здесь. Специалисту в данной области техники хорошо известны подходящие жидкости для культивирования или поддержания кишечных клеток, кишечных эпителиальных клеток, эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани, а также микробных клеток. В качестве неограничивающего примера, жидкости для поддержания или культивирования эпителиальных клеток кишечника могут включать: измененную по способу Дульбекко среду Игла, содержащую 4,5 г/л глюкозы (DMEM, Gibco, Гранд Айленд, Нью-Йорк) с добавлением 20% фетальной бычьей сыворотки (FBS; Gibco), 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина (Gibco), 100 мкг/мл Нормоцина (Invivogen, Сан-Диего, Калифорния) и 25 мМ HEPES, или измененную по способу Дульбекко среду Игла, содержащую 4,5 г/л глюкозы (DMEM; Gibco, Гранд Айленд, Нью-Йорк) с добавлением 20% фетальной бычьей сыворотки (FBS; Gibco) и 25 мМ HEPES.
[0092] В некоторых вариантах осуществления жидкость, протекающая через одну или несколько камер системы культивирования клеток, подвергается напряжению сдвига. В некоторых вариантах поток жидкости и/или конструкция системы могут быть изменены для достижения требуемого напряжения сдвига. В некоторых вариантах осуществления напряжение сдвига, испытываемое жидкостью в одной или нескольких камерах системы культивирования клеток, может быть эквивалентным напряжению сдвига, которое наблюдается в кишечнике млекопитающих. В некоторых вариантах осуществления напряжение сдвига, испытываемое жидкостью в одной или нескольких камерах системы культивирования клеток, может быть эквивалентным напряжению сдвига, которое наблюдается в кишечнике млекопитающих, страдающих кишечными расстройствами. В качестве неограничивающего примера кишечным расстройством может быть заболевание или блокировка. В некоторых вариантах осуществления напряжение сдвига может быть меньшим или равным 0,3 дин/см2. В некоторых вариантах осуществления напряжение сдвига может быть меньше 0,1 дин/см2. В некоторых вариантах осуществления напряжение сдвига может составлять от 0,0008 до 0,08 дин/см2. В некоторых вариантах осуществления напряжение сдвига может составлять от 0,010 до 0,026 дин/см2. В некоторых вариантах осуществления напряжение сдвига может составлять примерно 0,018 дин/см2. В некоторых вариантах осуществления напряжение сдвига и/или скорость потока жидкости могут модулировать, создавая аномальное условие и/или состояние эпителиальных клеток кишечника, например, моделируя "промывание" люминальных компонентов кишечника.
[0093] В некоторых вариантах осуществления напряжение сдвига может быть примерно таким же по продолжительности времени, в течение которого эпителиальные клетки кишечника культивируют в системе культивирования клеток. В некоторых вариантах осуществления напряжение сдвига может быть увеличено и/или уменьшено в течение времени, на протяжении которого эпителиальные клетки кишечника культивируют в системе культивирования клеток, например, напряжение сдвига может быть уменьшено в течение времени, позволяя вновь добавленным клеткам прикрепляться к мембране и/или уже существующим клеткам. В некоторых вариантах осуществления напряжение сдвига может быть изменено регулярным, циклическим образом. В некоторых вариантах осуществления напряжение сдвига может быть изменено нерегулярным образом. В некоторых вариантах осуществления напряжение сдвига может изменяться с течением времени от 0 до 1000 дин/см2. В некоторых вариантах осуществления напряжение сдвига может изменяться с течением времени от 0,0008 до 0,08 дин/см2.
[0094] В некоторых вариантах осуществления скорость потока жидкости через один или несколько каналов системы культивирования клеток, описанной здесь, может быть эквивалентной скорости потока жидкости, встречающейся в кишечнике млекопитающих. В некоторых вариантах осуществления скорость потока жидкости в одной или нескольких камерах системы культивирования клеток может быть эквивалентной скорости потока жидкости, встречающейся в кишечнике млекопитающих, страдающих от кишечных расстройств. В качестве неограничивающего примера кишечным расстройством может быть заболевание или блокировка. В некоторых вариантах осуществления скорость потока жидкости может быть меньшей или равной 500 мкл/ч, например, она может составлять 500 мкл/ч, 400 мкл/ч, 300 мкл/ч, 200 мкл/ч, 100 мкл/час, 50 мкл/ч, 10 мкл/ч или менее. В некоторых вариантах осуществления скорость потока жидкости может быть меньшей или равной 100 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может быть меньшей или равной 50 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять от 0 до 50 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять менее 40 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять менее 35 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять от 0 до 39 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять от 0 до 35 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять от 0 до 30 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может составлять примерно 30 мкл/ч. В некоторых вариантах осуществления скорость потока жидкости может быть примерно такой же на протяжении времени, в течение которого эпителиальные клетки кишечника культивируют в системе культивирования клеток. В некоторых вариантах осуществления скорость потока жидкости может быть увеличена и/или уменьшены на протяжении времени, в течение которого эпителиальные клетки кишечника культивируют в системе культивирования клеток, например, скорость потока жидкости может быть уменьшена в течение времени, позволяя вновь добавленным клеткам прикрепляться к мембране и/или уже существующим клеткам. В некоторых вариантах осуществления скорость потока жидкости может изменяться регулярным, цикличным образом. В некоторых вариантах осуществления скорость потока жидкости может изменяться нерегулярным образом.
[0095] В некоторых вариантах осуществления регулирование потока жидкости из источника жидкости через жидкостной канал 10 или механизм деформации мембраны 26 может быть автоматизировано. В варианте осуществления, в котором регулирование потока раствора из источника жидкости или механизма деформации мембраны автоматизированы, может быть использован шприцевой насос или соленоид. В других вариантах осуществления для регулирования потока жидкости или механизма деформации мембраны 26 может быть использовано одно или более вычислительных устройств или систем. Альтернативно или дополнительно, вычислительное устройство может быть соединено с источником жидкости или портом 60 для того, чтобы регулировать поток жидкости из источника жидкости. Альтернативно или дополнительно, вычислительное устройство может быть соединено с механизмом деформации мембраны для автоматизирования движение опорного элемента мембраны 22, 24 и растяжения мембраны 20. Например, вычислительное устройство может быть использовано для регулирования давления в вакуумном рабочем канале.
[0096] На фиг.20 показано схематическое изображение машины в иллюстративной форме компьютерной системы 700, в которой может быть выполнен набор команд, приводящий к выполнению такого контроля потока жидкости или растяжения мембрана, как описано здесь. В альтернативных вариантах осуществления, машина работает в качестве автономного устройства или может быть соединена (например, через сеть) с другими машинами. Машина может содержать персональный компьютер (ПК), планшет, карманный персональный компьютер (PDA), сотовый телефон, веб-устройство, сетевой маршрутизатор, коммутатор или мост, или любую машину, способную выполнять набор инструкций (последовательным или иным образом), которые определяют действия, которые будут приняты этой машиной. Кроме того, хотя проиллюстрирована только одна машина, термин "машина" также должен приниматься как включающий любую совокупность машин, которые по отдельности или совместно выполняют набор (или несколько наборов) инструкций для исполнения любой одной или более из описанных здесь методик.
[0097] Согласно некоторым вариантам, компьютерная система 700 включает процессор 750 (например, центральный процессор (CPU), графический процессор (GPU) или оба), оперативную память 760 (например, постоянное запоминающее устройство (ROM), флэш-память, динамическую оперативную память (DRAM), такую как синхронная DRAM (SDRAM) или Rambus DRAM (RDRAM) и т.д.) и/или статическую память 770 (например, флэш-память, статическая оперативная память (SRAM) и т.д.), которые сообщаются друг с другом через шину 795.
[0098] Согласно некоторым вариантам, компьютерная система 700 может дополнительно содержать видеодисплей 710 (например, жидкокристаллический дисплей (LCD), светодиодный дисплей (LED), электролюминесцентный дисплей (ELD), плазменные панели дисплея (PDP), органический светодиодный дисплей (OLED), дисплей с электронной эмиссией за счет поверхностной проводимости (SED), нанокристаллический дисплей, 3D-дисплей или электронно-лучевую трубку (CRT)). Согласно некоторым вариантам осуществления, компьютерная система 700 может также содержать устройство буквенно-цифрового ввода 715 (например, клавиатуру), устройство управления курсором 720 (например, мышь или контроллер), дисковод 730, устройство генерации сигнала 740 (например, динамик) и/или устройство сетевого интерфейса 780.
[0099] Дисковод 730 включает считываемый компьютером носитель 734, на котором хранится один или более наборов инструкций (например, программное обеспечение 736), отражающих одну или несколько из методик или функций, описанных здесь. Программное обеспечение 736 может также находиться, полностью или по меньшей мере частично, в основной памяти 760 и/или в процессоре 750 при его исполнении компьютерной системой 700, оперативной памятью 760 и процессором 750. Процессор 750 и оперативная память 760 могут также вводить в действие машиночитаемый носитель, содержащий команды 754 и 764, соответственно. Программное обеспечение 736 можно быть дополнительно передающим или принимающим по сети 790 через устройство сетевого интерфейса 780.
[00100] Хотя считываемый компьютером носитель 734 показан в примерном варианте осуществления как один носитель, термин "машиночитаемый носитель" следует понимать как охватывающий один носитель или несколько носителей (например, централизованная или распределенная база данных и/или объединенные кэши и серверы), которые хранят один или более наборов инструкций. Термин "машиночитаемый носитель" также должен приниматься как включающий любой носитель, который способен хранить, кодировать или поставлять набор инструкций для исполнения машиной и который вызывает выполнение машиной любой одной или нескольких методик раскрытых вариантов осуществления. Термин "машиночитаемый носитель" следует, соответственно, принимать как включающий, но не ограничивающийся ими, твердотельные запоминающие устройства, а также оптические и магнитные носители.
[00101] Следует понимать, что процессы и технологии, описанные здесь в отношении автоматизированного управления потоком жидкости и механизмов деформации мембраны, по существу, не связаны с каким-либо конкретным устройством и могут быть реализованы с помощью любой подходящей комбинации компонентов. Кроме того, различные типы устройств общей цели могут быть использованы в соответствии с принципами, описанными здесь. Также может оказаться выгодным сконструировать специализированное устройство для выполнения функций, описанных здесь. Специалистам в данной области техники будет понятно, что различные комбинации аппаратных средств, программного обеспечения и программно-аппаратного обеспечения будут пригодны для практической реализации раскрытых вариантов осуществления.
[00102] В некоторых вариантах осуществления по меньшей мере одна сторона мембраны покрыта по меньшей мере одним типом молекулы прикрепления, которая поддерживает адгезию множества живых клеток. В некоторых вариантах осуществления одна сторона мембраны покрыта по меньшей мере одним типом молекулы прикрепления, которая поддерживает адгезию множества живых клеток. В некоторых вариантах осуществления две стороны мембраны покрыты по меньшей мере одним типом молекулы прикрепления, которая поддерживает адгезию множества живых клеток. В некоторых вариантах осуществления один или более типов молекул прикрепления покрывают мембрану, например, одним типом молекулы прикрепления, двумя типами молекул прикрепления, тремя типами молекул прикрепления, четырьмя типами молекул прикрепления или более типами молекул прикрепления. В некоторых вариантах осуществления молекула прикрепления применяется к мембране в виде геля, раствора, гидрогеля или другой композиции, которая будет прикрепляться к мембране без химического связывания мембраны. В некоторых вариантах осуществления молекула прикрепления химически связана с мембраной, например, ковалентной связью или перекрестно сшита. В некоторых вариантах осуществления мембрана создается (например, полимеризуется) с молекулами прикрепления, встроенных в мембрану. В некоторых вариантах осуществления молекула прикрепления может быть компонентом внеклеточного матрикса. В некоторых вариантах осуществления молекула прикрепления может быть молекулой, связанной с молекулой на поверхности кишечной эпителиальной клеткой. В некоторых вариантах осуществления молекула прикрепления может быть молекулой, которая связывается с молекулой на поверхности кишечной эпителиальной клеткой. Неограничивающие примеры типов молекул присоединения включают коллаген, коллаген I типа, коллагена II типа; коллаген III типа; коллаген IV типа; коллаген V типа; коллаген VI типа; коллаген VII типа; коллаген VIII типа; коллаген IX типа; коллаген X типа; коллаген XI типа; коллаген XII типа; коллаген XIII типа; коллаген XIV типа; внеклеточный матрикс, MATRIGEL™; ламинин; протеогликан; витронектин; фибронектин; поли-D-лизин; эластин; гиалуроновую кислоту; глукозаминогликаны; интегрин; полипептиды, олигонуклеотиды, ДНК и/или полисахарид. В некоторых вариантах осуществления молекулы прикрепления получены от млекопитающего. В некоторых вариантах осуществления молекулы прикрепления синтезированы или получены от трансгенного организма. В некоторых вариантах осуществления молекула прикрепления человеческого происхождения. В некоторых вариантах осуществления молекула прикрепления получена от млекопитающих, например, мыши или приматов. Специалисту в данной области техники хорошо известны способы синтеза или производства углеводных и пептидных последовательностей молекул прикрепления. Молекулы прикрепления также коммерчески доступны, например, MATRIGEL™ (номер в каталоге 356234; BD Biosciences, Франклин Лейке, Нью-Джерси) или ламинин (номер в каталоге 354232; BD Biosciences, Франклин Лейке, Нью-Джерси). В некоторых вариантах осуществления концентрация молекулы прикрепления может составлять от 10 мкг/мл до 1000 мкг/мл, например, от 10 мкг/мл, 50 мкг/мл, 100 мкг/мл, 200 мкг/мл, 300 мкг/мл, 500 мкг/мл, 1000 мкг/мл или любое значение между указанными. В некоторых вариантах осуществления мембрана покрыта смесью, содержащей коллаген I типа и MATRIGEL™. В некоторых вариантах осуществления мембрана покрыта смесью, содержащей 50 мкг/мл коллагена I типа и 300 мкг/мл MATRIGEL™. В некоторых вариантах осуществления мембрана покрыта смесью (1:1 по объему), содержащей 50 мкг/мл коллагена I типа и 300 мкг/мл MATRIGEL™. В некоторых вариантах осуществления мембрана покрыта смесью (1:1 по объему), содержащей 50 мкг/мл коллагена I типа и 300 мкг/мл MATRIGEL™, растворенной в бессывороточном DMEM. В некоторых вариантах осуществления мембрана покрыта смесью (1:1 по объему), содержащей 50 мкг/мл коллагена I типа крысы и 300 мкг/мл MATRIGEL™, растворенной в бессывороточном DMEM.
[00103] В некоторых вариантах осуществления системы культивирования клеток, описанной здесь, по меньшей мере один слой эпителиальных клеток кишечника прикреплен по меньшей мере к одной поверхности мембраны. В некоторых вариантах осуществления один или более слоев эпителиальных клеток кишечника прикреплены к мембране, e.g., один слой, два слоя, три слоя, или более слоев эпителиальных клеток кишечника. В некоторых вариантах осуществления эпителиальные клетки кишечника прикреплены к одной стороне мембраны. В некоторых вариантах осуществления эпителиальные клетки кишечника прикреплены к двум сторонам мембраны. В некоторых вариантах осуществления эпителиальные клетки кишечника являются клетками млекопитающих. В некоторых вариантах осуществления эпителиальные клетки кишечника являются клетками человека. В некоторых вариантах осуществления эпителиальные клетки кишечника представляют собой первичные клетки, первичные клетки тонкого кишечника, первичные клетки толстого кишечника, клетки тонкого кишечника, клетки толстого кишечника, культивированные клетки, пересеваемые клетки, иммортализованные клетки, трансгенные клетки, генетически модифицированные клетки, раковые клетки или клетки от животного с раком кишечника, клетки от животного с кишечным заболеванием или расстройством, стволовые клетки, эмбриональные стволовые клетки (ESC), индуцированные плюрипотентные стволовые клетки (iPSC), клетки Панета, клетки крипты, секретирующие слизь клетки, клетки Caco2 или клетки НТ-29. В некоторых вариантах осуществления эпителиальные клетки кишечника в системе культивирования клеток, описанной здесь, содержат структуры ворсинок.
[00104] В некоторых вариантах осуществления система культивирования клеток, описанная здесь, содержит первый клеточно-культуральный канал и второй клеточно-культуральный канал, где первый клеточно-культуральный канал содержит эпителиальные клетки кишечника. В некоторых вариантах осуществления система культивирования клеток, описанная здесь, содержит первый клеточно-культуральный канал и второй клеточно-культуральный канал, где первый клеточно-культуральный канал содержит эпителиальные клетки кишечника и второй клеточно-культуральный канал содержит эндотелиальные клетки, иммунные клетки, мышечные клетки и/или клетки соединительной ткани. В некоторых вариантах осуществления клетки в клеточно-культуральном канале прикреплены к поверхности мембраны, открытой этому клеточно-культуральному каналу.
[00105] В некоторых вариантах осуществления один или более слоев эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани прикреплены к мембране, например, один слой, два слоя, три слоя или более слоев эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани. В некоторых вариантах осуществления эндотелиальные клетки представляют собой эндотелиальные клетки кишечника. В некоторых вариантах осуществления эндотелиальные клетки представляют собой эндотелиальные клетки капилляров. В некоторых вариантах осуществления эндотелиальные клетки представляют собой лимфатические эндотелиальные клетки. В некоторых вариантах осуществления эндотелиальные клетки, иммунные клетки и/или клетки соединительной ткани представляют собой клетки млекопитающих. В некоторых вариантах осуществления эндотелиальные клетки, иммунные клетки и/или клетки соединительной ткани представляют собой клетки человека. В некоторых вариантах осуществления эндотелиальные клетки, иммунные клетки и/или клетки соединительной ткани представляют собой первичные клетки, первичные клетки тонкого кишечника, первичные клетки толстого кишечника, фибробласты, клетки тонкого кишечника, клетки толстого кишечника, культивируемые клетки, пересеваемые клетки, иммортализованные клетки, трансгенные клетки, генетически модифицированные клетки, раковые клетки или клетки от животных с кишечным и/или эндотелиальным раком, клетки от животных с кишечным заболеванием или расстройством, стволовые клетки, эмбриональные стволовые клетки (ESC) или индуцированные плюрипотентные стволовые клетки (iPSC).
[00106] При использовании здесь "иммунная клетка" представляет собой любую клетку иммунной системы, участвующую в адаптивном или гуморальном иммунитете. Неограничивающие примеры иммунных клеток включают мононуклеарные клетки периферической крови (РВМС), плазмоцитоидные дендритные клетки (PDC), миелоидные дендритные клетки (MDC), B-клетки, макрофаги, моноциты, естественные клетки-киллеры, NKT клетки, CD4+ T-клетки, CD8+ T-клетки, гранулоциты или их предшественники.
[00107] При использовании здесь "клетки соединительной ткани" относятся к клеткам тканей животных, которые поддерживают органы, заполняют пространство между ними или выполняют механические функции, такие как присоединение мышцы к кости (сухожилиям и связкам) или обеспечивающие низкое трение имеющей вес поверхности, как в суставном хряще. Соединительные ткани характеризуются относительно лишенным сосудов матриксом и низко-клеточной плотностью. Наиболее распространенные соединительные ткани представляют ретикулярную строму, мышцы, жировую ткань, хрящ и кость. Другие примеры соединительной ткани включают, но не ограничиваются ими, мезенхиму, соединительную ткань слизистой, рыхлую (свободную), эластичную ткань или кровь. Включенные в определение "соединительной ткани" являются терминально дифференцированными клетками, а также клетками-предшественниками, которые могут дифференцироваться в соединительно-тканные клетки и ткань.
[00108] В некоторых вариантах осуществления система культивирования клеток, описанная здесь, содержит микробные клетки и/или патогены. В некоторых вариантах осуществления микробные клетки и/или патогены могут присутствовать в том же клеточно-культуральном канале как эпителиальные клетки кишечника. В некоторых вариантах осуществления микробные клетки и/или патогены могут присутствовать в первом клеточно-культуральном канале. В некоторых вариантах осуществления микробные клетки могут быть микробными клетками, обнаруживаемыми в кишечнике или кишке здорового животного. В некоторых вариантах осуществления микробные клетки и/или патогены могут быть организмами, обнаруживаемыми в кишечнике или кишке нездорового животного, например, имеющего кишечное заболевание или расстройство. В некоторых вариантах осуществления микробные клетки и/или патогены могут быть организмами, которые вызывают или способствуют заболеванию или расстройству кишечника.
[00109] В некоторых вариантах осуществления микробные клетки являются аэробными. В некоторых вариантах осуществления микробные клетки являются анаэробными. В некоторых вариантах осуществления система культивирования клеток, описанная здесь, включает как аэробные, так и анаэробные микробные клетки. В некоторых вариантах осуществления микробные клетки культивируют в системе культивирования клеток, описанной здесь, по меньшей мере 1 день. Культуры микробных клеток в системах культивирования клеток, описанных здесь, могут быть использованы для моделирования и/или воспроизведения среды микрофлоры кишечника. В некоторых вариантах культуры микробных клеток в системах культивирования клеток, описанных здесь, не сокращают жизнеспособность эпителиальных клеток кишечника, например, жизнеспособность эпителиальных клеток кишечника сокращается не более чем на 10%, после введения микробных клеток в систему культивирования клеток.
[00110] Микробные клетки могут быть бактериальными клетками, включая грамположительные и грамотрицательные бактерии. Неограничивающие примеры бактериальных клеток, используемых в системе культивирования клеток, описанной здесь, включают Lactobacillus; Bacterioides; Ruminococcus; Peptococcus; Peptostreptococcus; Bifidobacterium; Escherichia; Achromobacter; Acidaminococcus fermentans; Acinetobacter cacoaceticus; Aeromonas; Alcaligenes faecalis; Bacillus; Butyriviberio flbrosolvens; Camplyobacter; Campylobacter coli; Clostridium difficile; Clostridium sordelli; Enterobacter cloacae; Enterococcus faecalis; Enterococcus faecium; Escherichia coli; Flavobacterium; Mycobacterium; Mycoplasma; Plesiomonas shigelloides; Propionibacterium acnes; Pseudomonas aeruginosa; Ruminococcus bromii; Sarcina; Staphylococcus aureus; Streptococcus anginosus; Veillonella; Vibrio; Yersinia enterocolitica; Lactobacillus rhamnosus; Lactobacillus rhamnosus GG; Bifidobacterium breve; Bifidobacterium longum; Bifidobacter ium infantis; Lactobacillus acidophilus; Lactobacillus plantarum; Lactobacillus paracasei; Lactobacillus bulgaricus; и Streptococcus thermophilus.
[00111] В некоторых вариантах осуществления микробные клетки являются патогенными. В некоторых вариантах микробные клетки являются кишечными патогенами. Неограничивающие примеры патогенных микробных клеток включают энтеротоксигенную Escherichia coli; Bilophila wadsworthia; Shigella; Yersinia; Pleisiomonas; Vibrio; Aeromonas; Campylobacter; Crytosporidia; Coccidosis; Salmonella; Helicobacter pylori; Clostridium difficile; Salmonella kedougou; Bacteroides; Clostridium; Firmicutes; Shigellia dysenteriae; Salmonella enterica; Salmonella typhi; Listeria; Listeria monocytogenes; Vibrio parahaemolyticus; Proteus; Vibrio cholerae; Enterococcus faecalis; Yersinia enterocolitica; и Campylobacter jejuni. Кишечные патогены хорошо изучены и описаны (см., например, Microbial Pathogenesis and the Intestinal Epithelial Cell-Gail A. Hecht-2003-ASM press). Кишечных патогены, описанные в этой книге, включены в настоящее описание посредством ссылки.
[00112] В некоторых вариантах осуществления система культивирования клеток содержит патогены. Используемый здесь термин "патогены" может включать вирусы, бактерии, грибы и паразиты, которые, как известно, вызывают или связаны с каким-либо расстройством или заболеванием кишечника. Микробные патогены обсуждались выше в данном документе. Неограничивающие примеры вирусных кишечных патогенов включают ротавирус; норуолк-подобные вирусы; аденовирусы; астровирусы; саппоро-подобные вирусы; торовирусы; коронавирусы; пикорнавирусы, вирусы герпеса и норовирусы. Неограничивающие примеры грибковых кишечных патогенов включают Candida, Aspergillus и Candida Albicans. Неограничивающие примеры кишечных паразитов включают одноклеточных паразитов, многоклеточных паразитов, амеб, червей, ленточных червей, простейших, трематод (плоских червей), круглых червей, остриц, анкилостоматид, Giradia lamblia, криптоспоридий и Entamoeba histolytica.
[00113] В некоторых вариантах осуществления систем культивирования клеток, описанных здесь, система может содержать анаэробную газовую камеру, контактирующую по меньшей мере с частью первого клеточно-культурального канала. В некоторых вариантах осуществления анаэробная газовая камера содержит часть первой клеточной культуры, которая не занята жидкостью. В ряде вариантов осуществления анаэробная газовая камера представляет собой пустоту или пространство в системе культивирования клеток над первым клеточно-культуральным каналом и имеющим по меньшей мере один порт, щель или другие средства контактирования верхней поверхности жидкости в первом клеточно-культуральном канале. В некоторых вариантах осуществления в жидкости, протекающей через первый клеточно-культуральный канал, устанавливается градиент кислорода. В некоторых вариантах осуществления в первом клеточно-культуральном канале могут быть созданы анаэробные и/или гипоксические условия путем герметизации первого клеточно-культурального канала после того, как были введены кишечные эпителиальные и, возможно, микробные клетки, так что точками входа или выхода первого клеточно-культурального канала являются только поры в мембране. Жидкость может быть обеспечена во втором клеточно-культуральном канале. Жидкость, поступающая во второй клеточно-культуральный канал, может быть насыщенной кислородом или бескислородной.
[00114] В некоторых вариантах воплощения жидкость, поступающая по меньшей мере в первый клеточно-культуральный канал является бескислородной перед входом в первый клеточно-культуральный канал. Дезоксигенирование может быть достигнуто, в качестве не ограничивающего примера, посредством вакуумной дегазации, мембранной дегазацией, заменой инертным газом или контактированием раствора с восстановителем. В некоторых вариантах осуществления первый клеточно-культуральный канал B некоторых вариантах осуществления уровень кислорода в жидкости, протекающей через первый клеточно-культуральный канал 8×10-2 моль/л или менее; например, 4×10-2 моль/л или менее; 8×10-3 моль/л или менее, либо 4×10-3 моль/л или менее. В некоторых вариантах осуществления уровень кислорода одинаков в каждом клеточно-культуральном канале. В некоторых вариантах осуществления, анаэробный, инертный газ вызывает поток через один или более клеточно-культуральных каналов. В некоторых вариантах осуществления совместное культивирование аэробных и анаэробных микроорганизмов может сократить локальную концентрацию кислорода в клеточно-культуральном канале.
[00115] Клеточно-культуральные системы, описанные здесь, могут быть использованы для исследования влияния не-кишечных клеток, тканей и/или факторов на клетки, содержащиеся в системе культивирования клеток, как описано здесь. В некоторых вариантах осуществления первая клеточно-культуральная система, содержащая систему культивирования клеток, как описано здесь, соединена или связана со второй клеточно-культуральной системой любой конструкции, содержащей клетки или ткани, которые не являются эпителиальными клетками кишечника. В некоторых вариантах осуществления клетки или ткани, входящие в состав второй клеточно-культуральной системы, являются клетками и/или тканью печени. В некоторых вариантах осуществления некоторую часть выходящего потока второй клеточно-культуральной системы и/или факторов, полученных из клеток, которые не являются эпителиальными клетками кишечника (например, сигнальные молекулы, факторы роста и гормоны), вводят в жидкость, протекающую через жидкостной канал системы культивирования клеток, как описано здесь, содержащей эпителиальные клетки кишечника. Может быть определен ответ эпителиальных клеток кишечника, эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани и/или микробных клеток в первой системе культивирования клеток, как описано здесь. Ответные реакции эпителиальных клеток кишечника, эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани и/или микробных клеток, а также способы их определения и/или измерения описаны ниже в данном документе.
[00116] В некоторых вариантах осуществления клетки вводят в систему культивирования клеток, описанную здесь, добавлением клеток к жидкости и приведением жидкости в движение через жидкостной канал и/или клеточно-культуральный канал, в которые должны быть введены клетки. В некоторых вариантах осуществления в целях повышения прикрепления клеток вызывают поток клеток в канале и затем поток жидкости временно приостанавливают для того, чтобы позволить клеткам прикрепится к мембране, молекулы присоединения и/или другие клетки уже присутствует в канале. В некоторых вариантах осуществления в целях повышения присоединение клеток клеточно-культуральная система может быть временно повернута или переориентирована таким образом, чтобы поверхность, на которую требуется прикрепить клетки, была нижней поверхностью канала. В некоторых вариантах осуществления изменения потока жидкости или ориентации системы культивирования клеток длятся в течение 2 минут или более, например, 2 минуты, 5 минут, 15 минут, 30 минут, 60 минут, 120 минут или более. В некоторых вариантах осуществления изменения потока жидкости или ориентации системы культивирования клеток длятся в течение приблизительно 1 часа. В некоторых вариантах осуществления изменения потока жидкости или ориентации системы культивирования клеток длятся в течение приблизительно 90 минут.
[00117] В некоторых вариантах осуществления здесь описан способ получения кишечного органоида, включающий предоставление жидкости, пригодной для культивирования и/или поддержания эпителиальных клеток кишечника, в системе культивирования клеток, описанной здесь, таким образом, чтобы жидкость контактировала с эпителиальными клетками кишечника, и культивирование клеток кишечника in vitro. Примеры растворов, пригодных для культивирования и/или поддержания эпителиальных клеток кишечника, были описаны выше в данном документе. В некоторых вариантах осуществления способ получения кишечного органоида дополнительно включает культивирование эпителиальных клеток кишечника в первом клеточно-культуральном канале и эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани во втором клеточно-культуральном канале. В некоторых вариантах осуществления мембрану, разделяющую два клеточно-культуральных каналов, растягивают. В некоторых вариантах скорость потока жидкости через клеточно-культуральные каналы составляет примерно 30 мкл/ч. В некоторых вариантах осуществления напряжение сдвига составляет приблизительно 0,02 дин/см2. В некоторых вариантах осуществления мембрана растягивается приблизительно на 10% в одной плоскости приблизительно при 0,15 Гц. В некоторых вариантах осуществления кишечные эпителиальные клетки представляют собой Caco-2 клетки. В некоторых вариантах осуществления микробные клетки представляют собой Lactobacillus rhamnosus GG (LGG). В некоторых вариантах осуществления эпителиальные клетки кишечника культивируют по меньшей мере до тех пор, пока обнаруживаются структуры ворсинок.
[00118] В некоторых вариантах системы культивирования клеток, описанные здесь, могут быть использованы для исследования дифференцировки стволовых клеток в зрелые клетки кишечника путем введения стволовых клеток, например, iPSC, взрослых стволовых клеток или эмбриональных клеток в систему культивирования клеток, как описано здесь. В систему культивирования клеток могут быть добавлены факторы дифференцировки и/или предполагаемые факторы дифференцировки и определено их влияние на дифференцировку стволовых клеток.
[00119] В некоторых вариантах системы культивирования клеток, описанные здесь, содержат систему оценки лечения, функции и/или патологий кишечника. В некоторых вариантах осуществления клетки в системе культивирования клеток могут быть получены от субъекта, страдающего кишечным расстройством, например, целиакией, болезнью Крона, язвенным колитом или синдромом раздраженного кишечника. В некоторых вариантах условия в системе культивирования клеток могут быть изменены для имитирования кишечных расстройств. В качестве неограничивающего примера кишечные расстройства могут быть смоделированы и/или имитированы посредством введения патогенных микробных клеток в систему культивирования клеток; введения высоких уровней микробных клеток в систему культивирования клеток; или увеличения скорости потока жидкости для имитации диареи.
[00120] В некоторых вариантах системы культивирования клеток, описанные здесь, содержат систему оценки эффекторных агентов кишечника. В некоторых вариантах осуществления здесь описан способ оценки эффекторных агентов кишечника, включающий контактирование кишечных эпителиальных клеток системы культивирования клеток, как описано здесь, по меньшей мере с одним предполагаемым эффекторным агентом кишечника и измерение ответа клеток в системе культивирования клеток для определения воздействия по меньшей мере одного предполагаемого эффекторного агента кишечника.
[00121] В некоторых вариантах осуществления эффекторный агент кишечника может представлять собой соединение, смесь или организм. Предполагаемым эффекторным агентом может быть агент, известный как модулирующий поведение эпителиальных клеток кишечника и/или микробов, которые могут быть найдены в кишечнике, или он может быть агентом, который должен быть проверен для того, чтобы увидеть, может ли он модулировать поведение эпителиальных клеток кишечника и/или микробов, которые могут быть найдены в кишечнике. В некоторых вариантах осуществления эффекторным агентом кишечника является лечение или лекарственный препарат. В некоторых вариантах осуществления эффекторным агентом кишечника является возбудитель и/или токсин. Неограничивающими примерами эффекторных агентов кишечника являются терапевтические препараты, малые молекулы, нутрицевтики, противодиарейные препараты, пробиотики, естественная микрофлора кишечника и/или микроорганизмы, пищевые продукты, витамины, патогены и токсины. В некоторых вариантах осуществления кишечный эффекторный агент представляет собой агент, который можно вводить субъекту или пациенту перорально.
[00122] В некоторых вариантах осуществления клетки системы культивирования клеток, как описано здесь, можно вводить в контакт с одним или несколькими эффекторными агентами кишечника, например, одним эффекторным агентом, двумя эффекторными агентами, тремя эффекторными агентами или более эффекторными агентами. В некоторых вариантах осуществления кишечные эпителиальные клетки системы культивирования клеток, как описано здесь, контактируют с одним или более эффекторными агентами кишечника. В некоторых вариантах осуществления микробные или патогенные клетки системы культивирования клеток, как описано здесь, контактируют с одним или более эффекторными агентами кишечника. В некоторых вариантах осуществления эндотелиальные, иммунные или соединительнотканные клетки системы культивирования клеток, как описано здесь, контактируют с одним или более эффекторными агентами кишечника. В качестве неограничивающего примера эпителиальные клетки кишечника системы культивирования клеток, как описано здесь, могут контактировать с двумя или более эффекторными агентами кишечника для того, чтобы определить, взаимодействуют ли между собой два препарата, или модулирует ли препарат естественную микрофлору кишечника.
[00123] В некоторых вариантах осуществления ответ клеток в системе культивирования клеток, как описано здесь, может быть измерен для того, чтобы определить влияние по меньшей мере одного предполагаемого кишечного эффекторного агента. В некоторых вариантах осуществления измеряется ответ эпителиальных клеток кишечника. В некоторых вариантах осуществления измеряется ответ микробных клеток. В некоторых вариантах осуществления измеряются ответы эндотелиальных клеток, иммунных клеток и/или клеток соединительной ткани. Измерение ответа клеток может включать, но не ограничивается этим, определение изменений в морфологии, выживаемости, числа клеток, метаболизма, транскрипции, трансляции, экспрессия гена-маркера, уровней гена-репортера, транспорта, барьерной функции, морфологии плотных контактов и/или проницаемости клеточной слоя. Измерение ответа клеток может включать, но не ограничивается этим, определение того, как эффекторный агент кишечника поглощается клетками, метаболизируется клетками, секретируется клетками или проходит через один или более слоев клеток. Измерение ответа клеток может включать, но не ограничивается этим, определение того, как клетки метаболизируют эффекторный агент кишечника. Функции клеток метаболизировать лекарственные препараты также могут быть проанализированы до или после формирования ворсинок путем измерения активности CYP3A4 фермента с использованием химического или люминогенного субстрата, который преобразуется в люминесцентную форму активным ферментом CYP3A4. Анализ на активность CYP3A4 хорошо известен в данной области, и субстраты для обнаружения активности CYP3A4 являются коммерчески доступными, например, Luciferin-IPA (номер в каталоге V9001; Promega, Мэдисон, Висконсин). Неограничивающие примеры измерения ответа клеток могут включать определение клеточной морфологии с помощью конфокальной микроскопии; определение уровней белков с использованием иммунофлуоресцентной микроскопии и/или определение целостности монослоя клеток кишечного эпителия в результате создания апикальных плотных контактов путем измерения транс-эпителиального электрического сопротивления (ТЭЭС) с использованием напряжение-омметра (87V Industrial Multimeter, Fluke Corporation, Эверетт, Вашингтон), соединенного с проводами Ag/AgCl электрода (0,008'' в диаметре; А-М systems, Inc., Секим, Вашингтон).
[00124] Способы и системы культивирования клеток, описанные здесь, могут быть использованы для изучения или проверки эффекторных агентов кишечника для целей фармакологии, токсикологии, разработки лекарственных препаратов, доставки лекарственных препаратов, доставки белков или пептидов, метаболизма лекарственных препаратов, действия антибиотиков, пригодности и деградации покрытий лекарственных препаратов, IgA транспорта, скрининга генетически модифицированных организмов на аллергенность и токсичность, влияния взаимодействий лекарственных препаратов на биодоступность, клиренс лекарственного препарата, полиорганных взаимодействий, нанотоксикологии, диагностики, терапии, применения диет, физиологии кишечного барьера, моделей желудочно-кишечных (ЖК) болезней и их механизма, этиологии заболевания в ЖК тракте, заживлении ран, регенерации тканей, тканевой инженерии, кишечного гомеостаза, исследований кишечных стволовых клеток, взаимодействий хозяин-микробы, микробных сообществ в ЖК тракте, микробной биопленки в слое слизи и пробиотической терапии.
[00125] В некоторых вариантах осуществления способы и системы культивирования клеток здесь могут быть использованы с клетками, содержащими полиморфизмы переносчиков лекарственных препаратов, для целей разработки лекарственных препаратов, исследований доставки лекарственных препаратов, метаболизма лекарственных препаратов и клиренса лекарственных препаратов.
[00126] Описание вариантов осуществления изобретение не предназначено быть исчерпывающим или ограничивать изобретение конкретной раскрытой формой. В то время как конкретные варианты осуществления и примеры описаны здесь в целях иллюстрации, различные эквивалентные модификации возможны в пределах объема изобретения, как будет понятно специалистам в данной области. Например, в то время как этапы способа или функции, представленные в данном порядке, альтернативные варианты осуществления могут выполнять функции в другом порядке, или функции могут быть выполнены, по существу, одновременно. Идеи раскрытия, представленные здесь, могут быть применены к другим процедурам или способам в соответствии с потребностями. Различные варианты осуществления, описанные здесь, могут быть объединены для того, чтобы обеспечить дополнительные варианты осуществления. Аспекты настоящего изобретения могут быть модифицированы, если это требуется, для использования композиций, функций и концепций одной из вышеуказанных ссылок и приложений, чтобы обеспечить других дополнительные варианты осуществления настоящего изобретения. Эти и другие изменения могут быть сделаны в раскрытии в свете подробного описания.
[00127] Конкретные элементы любого из вышеуказанных вариантов осуществления могут быть скомбинированы или замещены для элементов в других вариантах осуществления. Кроме того, хотя преимущества, связанные с некоторыми вариантами осуществления данного раскрытия, были описаны в контексте этих вариантов осуществления, другие варианты осуществления также могут проявлять такие преимущества, и не все варианты обязательно нуждаются в проявлении таких преимуществ для того, чтобы подпадать под объем настоящего изобретения.
[00128] Все патенты и другие определенные публикации специально включены сюда посредством ссылки с целью описания и раскрытия, например, способов, описанных в таких публикациях, которые могут быть использованы в связи с настоящим изобретением. Эти публикации предназначены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в этом отношении не должно быть истолковано как признание того, что изобретатели не имеют право предшествовать такому раскрытию в силу предшествующего изобретения или по любой другой причине. Все заявления относительно даты или представлений относительно содержания этих документов основаны на информации, доступной для заявителей, и не представляют какого-либо допущения в качестве в правильности дат или содержания этих документов.
[00129] Настоящее изобретение дополнительно проиллюстрировано следующими примерами, которые не следует рассматривать как ограничивающие.
[00130] Некоторые варианты воплощения настоящего изобретения могут быть определены как любой из нижеприведенных пунктов
1. Система культивирования клеток, содержащая:
жидкостное устройство, имеющее жидкостной канал, соединенный с источником жидкости, снабжающим жидкостной канал жидкостью;
мембрану, расположенную в канале между опорными элементам мембраны, где по меньшей мере часть мембраны является гибкой;
механизм деформации мембраны, соединенный с опорными элементами мембраны, способный передвигать опорные элементы мембраны и вызывать растяжение мембраны вдоль по меньшей мере одного измерения мембраны; и
по меньшей мере один слой эпителиальных клеток кишечника, прикрепленных по меньшей мере к одной поверхности мембраны.
в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет менее чем 1,0 дин/см2.
2. Система по п.1, в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет от 0,008 до 0,08 дин/см2.
3. Система по любому из пп.1-2, в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, составляет приблизительно 0,018 дин/см2.
4. Система по любому из пп.1-3, в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться в течение времени.
5. Система по п.4, в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться в течение времени от 0 до 1000 дин/см2.
6. Система по любому из пп.4-5, в которой напряжение сдвига в жидкости, протекающей через жидкостной канал, может изменяться в течение времени от 0,008 до 0,08 дин/см2.
7. Система по любому из пп.1-6, в которой вызывают растяжение мембраны на от 0% до 50%.
8. Система по любому из пп.1-6, в которой вызывают растяжение мембраны на от 5% до 15%.
9. Система по любому из пп.1-8, в которой вызывают растяжение мембраны приблизительно на 10%.
10. Система по любому из пп.1-9, в которой вызывают растяжение мембраны более чем на 15%, создавая аномальное условие/состояние эпителиальных клеток кишечника.
11. Система по любому из пп.1-10, в которой вызывают растяжение мембраны циклическим образом при частоте в диапазоне от 0,01 Гц до 2 Гц.
12. Система по любому из пп.1-11, в которой вызывают растяжение мембраны циклическим образом при частоте в диапазоне от 0,05 Гц до 0,25 Гц.
13. Система по любому из пп.1-12, в которой вызывают растяжение мембраны циклическим образом при частоте 0,15 Гц.
14. Система по любому из пп.1-12, в которой вызывают растяжение мембраны циклическим образом при частоте более чем 0,2 Гц, создавая аномальное условие/состояние эпителиальных клеток кишечника.
15. Система по любому из пп.1-14, в которой вызывают растягивание мембраны нерегулярным или прерывистым образом.
16. Система по любому из пп.1-15, в которой жидкость протекает через жидкостной канал со скоростью потока менее чем 500 мкл/ч.
17. Система по любому из пп.1-16, в которой жидкость протекает через жидкостной канал со скоростью потока менее чем 100 мкл/ч.
18. Система по любому из пп.1-17, в которой жидкость протекает через жидкостной канал со скоростью потока от 0 до 50 мкл/ч.
19. Система по любому из пп.1-18, в которой жидкость протекает через жидкостной канал со скоростью потока приблизительно 30 мкл/ч.
20. Система по любому из пп.1-19, дополнительно содержащая по меньшей мере один тип молекулы присоединения, которая способствует адгезии множества живых клеток, покрывающих по меньшей мере одну сторону мембраны.
21. Система по п.20, в которой по меньшей мере одна молекула присоединения выбрана из группы, состоящей из:
коллагена; коллагена I типа; MATRIGEL™; внеклеточного матрикса; ламинина; протеогликана; витронектина; фибронектина; поли-D-лизина; полипептидов; олигонуклеотидов; ДНК и полисахарида.
22. Система по любому из пп.1-21, в которой эпителиальные клетки кишечника являются клетками млекопитающего или человека.
23. Система по любому из пп.1-22, в которой эпителиальные клетки кишечника выбраны из группы, состоящей из:
Caco-2 клеток; HT-29 клеток; первичных эпителиальных клеток тонкого кишечника; первичных эпителиальных клеток толстого кишечника; iPS клеток; ESC клеток; стволовых клеток; клеток Панета; клеток крипты и секретирующих слизь клеток.
24. Система по любому из пп.1-23, в которой эпителиальные клетки кишечника системы дополнительно содержат структуры ворсинок.
25. Система по любому из пп.1-24, где система дополнительно содержит по меньшей мере один слой эндотелиальных клеток по меньшей мере на второй поверхности мембраны.
26. Система по любому из пп.1-25, в которой мембрана расположена так, что она разделяет жидкостной канал на первый клеточно-культуральный канал и второй клеточно-культуральный канал.
27. Система по п.26, в которой первый клеточно-культуральный канал содержит эпителиальные клетки кишечника.
28. Система по любому из пп.26-27, в которой второй клеточно-жидкостной канал содержит клетки, выбранные из группы, состоящей из:
эндотелиальных клеток, иммунных клеток и клеток соединительной ткани.
29. Система по любому из пп.1-27, система дополнительно содержит микробные клетки или патогены.
30. Система по п.29, в которой микробные клетки поддерживаются в системе по меньшей мере 1 день.
31. Система по любому из пп.29-30, в которой микробные клетки выбраны из группы, состоящей из:
Lactobacillus; Bacterioides; Ruminococcus; Peptococcus; Peptostreptococcus; Bifidobacterium; Escherichia; Achromobacter; Acidaminococcus fermentans; Acinetobacter cacoaceticus; Aeromonas; Alcaligenes faecalis; Bacillus; Butyriviberio fibrosolvens; Camplyobacter; Campylobacter coli; Clostridium difficile; Clostridium sordelli; Enterobacter cloacae; Enterococcus faecalis; Enterococcus faecium; Escherichia coli; Flavobacterium; Mycoba cterium; Mycoplasma; Plesiomonas shigelloides; Propionibacterium acnes; Pseudomonas aeruginosa; Ruminococcus bromii; Sarcina; Staphylococcus aureus; Streptococcus anginosus; Veillonella; Vibrio; Yersinia enterocolitica; Lactobacillus rhamnosus; Lactobacillus rhamnosus GG; Bifidobacterium breve; Bifidobacterium longum; Bifidobacterium infantis; Lactobacillus acidophilus; Lactobacillus plantarum; Lactobacillus paracasei; Lactobacillus bulgaricus и Streptococcus thermophilus.
32. Система по любому из пп.29-30, в которой микробные клетки являются патогенными.
33. Система по п.29 или п.32, в которой патогены выбраны из группы, состоящей из:
энтеротоксигенной Escherichia coli; Bilophila wadsworthia; Shigella; Yersinia; Pleisiomonas; Vibrio; Aeromonas; Campylobacter; Crytosporidia; Coccidosis; Salmonella; Helicobact er pylori; Clostr idium difficile; Salmonella kedougou; Bacteroides; Clostridium; Firmicutes; Shigellia dysenteriae; Salmonella enterica; Salmonella typhi; Listeria; Listeria monocytogenes; Vibrio parahaemolyticus; Proteus; Vibrio cholerae; Enterococcus faecalis; Yersinia enterocolitica и Campylobacter jejuni; ротавируса; норуолк-подобных вирусов; аденовирусов; астровирусов; саппоро-подобных вирусов; торовирусов; коронавирусов; пикорнавирусов; вирусов герпеса; норовирусов; Candida; Aspergillus; Candida albicans; одноклеточных паразитов; многоклеточных паразитов; амеб; червей; ленточных червей; простейших; трематод; круглых червей; остриц; анкилостоматид; Giradia lamblia; криптоспоридий; и Entamoeba histolytica.
34. Система по любому из пп.29-33, в которой микробные клетки являются аэробными.
35. Система по любому из пп.29-33, в которой микробные клетки являются анаэробными.
36. Система по любому из пп.29-35, где система содержит как аэробные, так и анаэробные микробные клетки.
37. Система по любому из пп.29-36, в которой микробные клетки находятся в первом клеточно-культуральном канале.
38. Система по любому из пп.29-37, где система содержит анаэробную газовую камеру, контактирующую по меньшей мере с частью первого клеточно-культурального канала.
39. Система по п.38, в которой в жидкости, протекающей через первый клеточно-культуральный канал, установлен градиент кислорода.
40. Система по любому из пп.1-39, в которой мембрана по меньшей мере частично пористая.
41. Система по п.40, в которой по меньшей мере одно отверстие поры в мембране составляет от 0,5 мкм до 10 мкм в ширину.
42. Система по любому из пп.1-41, в которой мембрана содержит PDMS.
43. Система по любому из пп.1-42, в которой растягивание мембраны вызвано вакуумным давлением.
44. Система по п.43, где система дополнительно содержит:
первую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где мембрана прикреплена к первой стенки камеры;
первый рабочий канал, смежный по меньшей мере с одним жидкостным каналом на противоположенной стороне первой стенки камеры, где перепад давления между первым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание первой стенки камеры в первом требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемом мембраной; и
вакуумную систему, обеспечивающую перепад давления между по меньшей мере одним жидкостным каналом и по меньшей мере одним из рабочих каналов, где мембрана растягивается вдоль плоскости в ответ на перепад давления.
45. Система по п.44, дополнительно содержащая:
вторую стенку камеры устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где противоположный край мембраны прикреплен ко второй стенки камеры; и
второй рабочий канал, расположенный смежно по меньшей мере с одним жидкостным каналом на противоположенной стороне второй стенки камеры, где перепад давления между вторым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание второй стенки камеры во втором требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной.
46. Система по любому из пп.1-45, в которой жидкостное устройство содержит микрожидкостной чип.
47. Система по любому из пп.1-46, в которой система прикреплена или соединена со второй системой культивирования клеток, содержащей клетки или ткань некишечного происхождения.
48. Система по п.47, где вторая система культивирования клеток содержит клетки или ткань печени.
49. Способ получения кишечного органоида, включающий:
предоставление жидкости, подходящей для поддержания эпителиальных клеток кишечника, в систему культивирования клеток по любому из пп.1-48 таким образом, что жидкость соприкасается с эпителиальными клетками кишечника; и
культивирование эпителиальных клеток кишечника in vitro.
50. Способ по п.49, дополнительно включающий культивирование клеток по меньшей мере до тех пор, пока обнаруживаются структуры ворсинок.
51. Система для оценки эффекторных агентов кишечника, содержащая систему культивирования клеток по любому из пп.1-48.
Примеры
Пример 1
[00131] 'Gut-on-a-Chip' может быть микрожидкостной системой, содержащей монослои культивированных эпителиальных клеток кишечника человека и эндотелиальных клеток из человеческих капиллярных кровеносных сосудов и/или лимфатических млечных сосудов, разделенными пористой гибкой мембраной, покрытой внеклеточным матриксом (ECM), которая может испытывать ритмические механические деформации, напоминающие моторику кишечника (например, перистальтику и сегментарные движения), которая предназначена для воспроизведения межтканевых взаимодействий и микроструктуры кишечника человека (фиг.1). Целью проекта 'Gut-on-a-Chip' является обеспечение надежной, воспроизводимой и предсказывающей in vitro платформы для анализа ответа человека на соединения, введенные перорально, терапевтические агенты, нутрицевтики, функциональные пищевые продукты, патогены и токсины. 'Gut-on-a-Chip' должна быть полезной для широкого спектра применений в области фармакологии, токсикологии, разработки лекарственных препаратов, доставки лекарственных препаратов, метаболизма лекарственных препаратов, взаимодействий лекарственных препаратов, биодоступности лекарственных препаратов, клиренса лекарственных препаратов, полиорганных взаимодействий (например, кишечника и печени), диагностики, терапии, применения диет, физиологии кишечного барьера, моделей желудочно-кишечных (ЖК) заболеваний и их механизма, этиологии заболевания в ЖК тракте, заживления ран, регенерации тканей, тканевой инженерии, кишечного гомеостаза, исследований кишечных стволовых клеток, взаимодействий хозяин-микроб, микробных сообществ в ЖК тракте, микробной биопленки в слое слизи, пробиотической терапии и потенциально охватывающей все остальные исследования, связанные с ЖК трактом.
[00132] Здесь описано изготовление 'Gut-on-a-Chip' прототипа микрожидкостного устройства с помощью силиконового эластомерного полимера (полидиметилсилоксана; PDMS) с 3D структурой, содержащего двойной слой близко расположенных соединенных параллельных микроканалов (1000×10000×150 мкм = Ш×Д×В). Один микроканал представляет просвет кишечника, а другой микроканал имитирует капиллярную микрососудистую сеть. Эти микроканалы разделены гибкой пористой PDMS мембраной толщиной 30 мкм, имеющей отверстия 10 мкм в диаметре (фиг.2). Рядом с микроканалом размещены две вакуумные камеры для применения вакуум-управляемого механического напряжения в микроканале (фиг.3A-3D). Устройство 'Gut-on-a-Chip' было оптимизировано по геометрии для того, чтобы минимизировать напряжение сдвига на эпителиальных клетках кишечника и проблемы, обнаруженные при отслаивании эпителиального монослоя из-за различий в силе адгезии клетки с субстратом. Процесс конструирования, по сравнению с ранее использовавшимися процессами, также был успешно улучшен путем разработки процесса без травления для создания полых вакуумных камер, поскольку процесс травления PDMS является проблематичным с точки зрения эффективности несовместимого травления от устройства к устройству, использованием токсичных химических веществ и вопросами времени/трудовых затрат.
[00133] Описанные здесь эксперименты проводились с Caco-2 клетками аденокарциномы толстой кишки человека, которые обычно используются для моделирования поглощающего кишечного эпителия человека в существующих коммерческих тест-системах лекарственных препаратов. Хотя клетки Caco-2, как сообщается, лишены некоторых молекулярных переносчиков и ферментов метаболизма лекарственных препаратов [2] и не выделяют слой слизи [3], это хорошо охарактеризованная клеточная линия, которая может восстанавливать высокие барьерные функции, экспрессию белка плотного контакта, селективную проницаемость и активность ферментов щеточной каемки, что хорошо коррелирует с функциями тонкого кишечника человека [4]. Человеческие эндотелиальные клетки микрососудов (HMVEC) были использованы для образования эндотелия капилляров на противоположной стороне пористой ECM-покрытой мембраны при совместном культивировании с клетками Caco-2, как показано на фиг.1.
[00134] Для развития этой модели для in vitro анализа функции кишечника человека внутри микрожидкостного устройства были изготовлены пористые PDMS мембраны и затем покрыты ЕСМ путем инфузии смеси коллагена I и матригеля, растворенных в DMEM (содержащей 4,5 г/л глюкозы, антибиотики, но без сыворотки), в микроканалы и инкубации устройства в увлажняющем инкубаторе с 5% CO2 при 37°C в течение ночи. На следующий день DMEM (содержащий 4,5 г/л глюкозы, антибиотики с 20% сывороткой, FBS) перфузировали через каналы (30 мкл/час), и затем Caco-2 клетки (~5×106 клеток/мл) пропускали в один канал в среде в течение 6 ч (фиг.4A). После того, как клетки Caco-2 были введены в верхний микроканал, все трубки, подключенные к устройству, зажимали и клетки инкубировали в увлажняющем инкубаторе с 5% CO2 при 37°C в течение 1,5 часов, что способствовало прикреплению клеток (фиг.4B).
[00135] После того, как клетки Caco-2 прикреплялись к поверхности пористой PDMS мембраны, культуральную среду (DMEM, содержащий 4,5 г/л глюкозы, антибиотики и 20% FBS) перфузировали в верхний микроканал при 30 мкл/ч в течение 48 часов для установления слитого и дифференцированного клеточного Caco-2 монослоя (фиг.4С и 4D), тогда как нижний микроканал был зажат (т.е. перфузии потока не было). Когда Caco-2 монослой был хорошо сформирован (фиг.4C и 4D), в верхний и нижний микроканалы одновременно перфузировали культуральную среду (DMEM, содержащий 4,5 г/л глюкозы, антибиотики и 20% FBS) со скоростью 30 мкл/ч. Перед инокуляции HMVE клеток на другой стороне пористой PDMS мембраны DMEM (содержащий 4,5 г/л глюкозы, антибиотики и 5% сыворотку): EGM2-MV, 1:4, об./об.) перфузировали через второй канал в течение 24 часов. HMVE клетки (~5×106 клеток/мл) затем высевали в нижний микроканал и устройство переворачивали сверху вниз в течение 1,5 часов, что способствовало прикреплению HMVE клеток на противоположной стороне Caco-2 монослоя. После того, как HMVEC были хорошо прикреплены, среду перфузировали при 30 мкл/ч через верхний и нижний микроканалы для поддержания совместного культивирования Caco-2 и HMVE клеток (фиг.5). Культуральную среду перфузировали через трубки с помощью шприцевого насоса с постоянной скоростью в диапазоне 20-40 мкл/час, что соответствует диапазону напряжения сдвига от 0,012-0,024 дин/см2. Напряжения сдвига наблюдается in vivo в тонком кишечнике, как сообщается, в диапазоне 0,008-0,08 дин/см2, что хорошо согласуется с диапазоном напряжения сдвига в этом варианте устройства 'Gut-on-a-Chip' [5-6].
[00136] После того, как клеточные монослои были полностью слиты и стабилизированы при определенных жидкостных условиях, проводили эксперименты по анализ у транспорта. Механическое напряжение было применено с циклическим растяжением, обусловленным применением отрицательного давления в вакуумных камерах при постоянной частоте 0,15 Гц с различным процентами удлинения до ~26% (~85 кПа) (фиг.3A-3D). Совместно культивированные монослои Caco-2 и HMVE клеток тестировали с применением циклических деформаций в течение 12 часов или более до начала экспериментов по анализу транспортных или барьерных функций. Циклическое механическое напряжение, применяемое к этому 'Gut-on-a-Chip' устройству, как было обнаружено, имитирует физиологическую перистальтику кишечника со значительно улучшенной функцией кишечного эпителиального барьера, как было оценено по сильному увеличению трансэпителиального электрического сопротивления (ТЭЭС) (данные не показаны). Электрическое сопротивление между верхним и нижним микроканалами контролировалось с помощью Ag/AgCl электрода, оснащенного омметром, и сопротивление было преобразовано в значение ТЭЭС путем умножения значений на площадь поверхности клеточного монослоя. Когда к клеточным монослоям применялась механическое напряжение при удлинении от 0% до 25% с использованием 5% прироста напряжения с течением времени за период 24 часа, наблюдаемые значения ТЭЭС резко возрастали, затем достигали более высоких значений плато, с постепенным увеличением в течение времени как % удлинения увеличенного межтканевого взаимодействия.
[00137] Для измерения молекулярной проницаемости клеточного монослоя молекула-мишень, растворенная в культуральной среде, была введена в верхний микроканал (т.е. со стороны просвета), в то время как через нижний канал одновременно пропускали свежую культуральную среду (т.е. с капиллярной стороны). Образцы периодически отбирали из нижнего канала и анализированы для того, чтобы оценить общий молекулярный транспорт через клеточный монослой (фиг.6A-6C). Эти исследования показали, что механическое напряжение увеличило параклеточный транспорт флуоресцентных молекул, в том числе FITC-декстрана (фиг.7 и 9) и Lucifer желтого (фиг.8), как при тестировании только монослоя Caco-2 клеток, так и в комбинации с монослоем HMVE клеток. Кажущаяся проницаемость, полученная в этой функциональной модели ткань-тканевого барьера, (Papp) рассчитывали по уравнению Papp=(dQ/dt)/(A⋅Co), где Q представляет собой накопленное количество транспортируемого соединения на принимающей стороне (vg), t представляет собой время (сек), A - доступную площадь поверхности клеточного монослоя, через которую происходит транспорт (см2), а Co - начальную концентрацию соединения на донорной стороне (14/мл) [7]. В это время остается неясным, почему механическое растяжение увеличивает параклеточный транспорт как большой молекулы (FD20), так и малой молекулы (LY), учитывая, что ТЭЭС возрастает, свидетельствуя о наличии более высокого соединительного барьера. Тем не менее, это может быть результатом физиологически значимого трансцитозного ответа, как это наблюдалось в исследованиях транспорта квантовых точек, обнаруженного ранее в 'Lung-on-a-Chip' [1].
[00138] Для измерения транспортер-опосредованной проницаемости, Родамин 123 (Rho123) использовали в качестве субстрата для хорошо известного транс портного пути через гликопротеин проницаемости (P-gp), который, как известно, экспрессируется Caco-2 клетками. В статических условиях с использованием коммерческой Transwell фильтровальной структуры наблюдался транспорт Rho123, как показано по оттоку Rho123 через P-gp, что соответствует наивысшему значению Papp в 'BL>AP' транспорте, чем на 'AP>BL' транспорте (фиг.10). Кроме того, при добавлении ингибитора P-gp Верапамила в оба канала отток от BL стороны на AP сторону резко снизился (фиг.10). После того, как было подтверждено, что Rho123 хорошо работает в Caco-2 монослое путем анализа P-gp, Rho123 был применен в 'Gut-on-a-Chip' устройстве. В этом предварительном эксперименте Rho123, растворенный в культуральной среде, применялся либо с AP стороны, либо с BL стороны в присутствии или в отсутствие механического напряжения. При наличии механического напряжения полученные значения Papp показали повышенную проницаемость, которая была выше, чем значения Papp оттока Rho123.
[00139] Как следует из приведенных результатов, такое 'Gut-on-a-Chip' микрожидкостное устройство имеет потенциальные применения в качестве новой in vitro кишечной модели для тестирования всасывания питательных веществ, ионного транспорта и транспорта наночастиц/конъюгатов наночастиц в присутствии или в отсутствие механического напряжения для оценки физиологической значимости. 'Gut-on-a-Chip' также может быть использован для исследований при разработке лекарственных препаратов, включая их транспорт (поглощение и отток), фармакокинетику, фармакодинамику, метаболизм, взаимодействия лекарственных препаратов, влияние препаратов на абсорбцию, а также эффективность, токсичность и клиренс в присутствии или в отсутствие механического напряжения для максимизации актуальности in vivo. Оно может быть применено для исследования взаимодействий между кишечным эпителием и другими типами клеток (например, капиллярным или лимфатическим эндотелием, иммунными клетками, соединительной тканью и т.д.) при топологическом сходстве со структурой кишечных ворсинок (фиг.1).
[00140] 'Gut-on-a-Chip' также может быть применен для оценки токсикологии традиционных лекарственных препаратов и наноразмерных материалов (т.е. в нанотоксикологии) в присутствии или в отсутствие механического напряжения. Кроме того, оно может быть использовано для моделирования заболеваний ЖК тракта, таких как воспалительное заболевание кишечника (например, болезнь Крона и неспецифический язвенный колит), непроходимость кишечника и синдром раздраженного кишечника, посредством повторения наиболее важных компонентов и этиологических факторов, включая соответствующих микробов. Описанные здесь системы также позволяют исследовать инициирование, распространение, терминацию, центральные механизмы, вакцинацию и развитие потенциальных лекарственных препаратов для кишечных заболеваний и продемонстрировать взаимодействия хозяин-микробы, совместное культивирование клеток хозяина с микробами, взаимодействие между патогенами и пробиотическими штаммами, образование биопленки в ЖК тракте и положительное/отрицательное влияние пробиотических штаммов на кишечный эпителий и другие типы клеток. Кроме того, инженерный человеческий микробном на платформе 'Gut-on-a-Chip' может быть использован для того, что показать то, что генно-инженерные микробиомы могут играть определенную роль в микробных сообществах и тканях хозяина, потенциально улучшая здоровье кишечника. 'Gut-on-a-Chip' также может быть использовано для изучения кишечных стволовых клеток. Ниша кишечных стволовых клеток и их судьба могут модулироваться различными пространственными структурами в микроинженерном устройстве.
[00141] Кроме того, системы, описанные здесь, могут быть использованы с неплоскими пористыми мембранами, которые более точно имитируют микроархитектуру ворсинок кишечника человека, что может обеспечить еще более реалистические модели функции кишечника. Это может быть особенно важно для исследований, посвященных анализу взаимодействий микробной флоры и эпителия и усвоению пищи.
[00142] Механическое напряжение, применяемое в 'Gut-on-a-Chip', показывает физиологическое значение in vivo физической микросреды, где перистальтика и сегментарные движения имеют место в живом человеческом кишечнике. Например, описанные здесь результаты показывают, что циклические деформации (например, 0,15 Гц по частоте с 0-25% удлинения) кишечного эпителиального монослоя вызывают значительное увеличение соединительной барьерной функции при увеличении кажущейся проницаемости специфических молекул по отношению к статическим Transwell культурах или при использовании обычной микрожидкостной системы без механического растяжения (фиг.7, 8 и 9). Этот результат транспорта с физиологическим механическим напряжением может быть золотым стандартом для оценки кандидатов лекарственных препаратов in vitro.
[00143] Эффекты, полученные механическим напряжением, обеспечивают несколько критических преимуществ. Во-первых, 'Gut-on-a-Chip' показывает физиологические реакции, которые более точно имитируют в целом физиологию кишечника в организме человека за счет интеграции клеток человеческого происхождения (например, клеточных линий кишечника человека, человеческих первичных кишечных клеток или человеческих кишечных стволовых клеток). Это физиологическое значение будет ценным в области разработки процессов скрининга лекарственных препаратов на промежуточных стадиях разработки и также воспроизведению фармакокинетики. Во-вторых, 'Gut-on-a-Chip' может обеспечить функционирование на уровне органа для того, чтобы показать, как близость различных типов клеток влияет на синергию поглощения и транспорта питательных веществ и лекарственных соединений. В-третьих, 'Gut-on-a-Chip' может сильно сократить информационный разрыв между in vitro моделями, in situ животными моделями и человеческим телом in vivo, которое до сих пор не изучено полностью. Применяя кишечных микробов человека или потенциальных патогенных микробов, 'Gut-on-a-Chip может быть использован для реконструирования ситуаций в кишечнике человека с критическими клетками-хозяевами. Поскольку результаты на животных моделях часто не предсказывают транспорт и метаболизм лекарственных препаратов, наблюдаемые у людей, из-за явных видовых различий, 'Gut-on-a-Chip' может предоставить альтернативную in vitro модель с сильным in vivo соответствием по интеграции нескольких человеческих орган-специфических типов клеток в 3D структуре при механическом напряжении, имитирующем физиологические или патологические перистальтические движения кишечника.
Ссылки
1. Huh, D., et al., Reconstituting organ-level lung functions on a chip. Science, 2010. 328(5986): p.1662-8.
2. Artursson, P. and R.T. Borchardt, Intestinal drug absorption and metabolism in cell cultures: Caco-2 and beyond. Pharm Res, 1997. 14(12): p.1655-8.
3. Pontier, C., et al., HT29-M TX and Caco-2/TC7 monolayers as predictive models for human intestinal absorption: role of the mucus layer. J Pharm Sci, 2001. 90(10): p.1608-19.
4. Le Ferrec, E., et al., In vitro models of the intestinal barrier. The report and recommendations of ECVAM Workshop 46. European Centre for the Validation of Alternative methods. Altern Lab Anim, 2001. 29(6): p.649-68.
5. Lentle, R.G. and P.W.M. Janssen, Physical characteristics of digesta and their influence on flow and mixing in the mammalian intestine: a review. Journal of Comparative Physiology B-Biochemical Systemic and Environmental Physiology, 2008. 178(6): p.673-690.
6. Olesen, S.P., D.E. Clapham, and P.F. Davies, HEMODYNAM IC SHEAR-STRESS ACTIVATES A K+CURRENT IN VASCULAR ENDOTHELIAL-CELLS. Nature, 1988. 331(6152): p.168-170.
7. Artursson, P., K. Palm, and K. Luthman, Caco-2 monolayers in experimental and theoretical predictions of drug transport. Advanced Drug Delivery Reviews, 2001. 46(1-3): p.27-43.
8. Sung, J.H., et al., Microscale 3-D hydrogel scaffold for biomimetic gastrointestinal (GI) tract model. Lab Chip, 2011.11(3): p.389-92.
Пример 2
[00144] Развитие in vitro модели на основе живой клетки кишечника, которая имитирует механические, структурные, поглощающие, транспортные и патофизиологические свойства кишечника человека вместе с его важным микробными симбионтами, могло бы ускорить фармацевтическое развитие и, возможно, заменить тестирование на животных. В настоящем документе описан один вариант осуществления биомиметического человеческого 'Gut-on-a-Chip' микроустройства, состоящего из двух микроканалов, разделенных пористой гибкой мембраной, покрытой внеклеточным матриксом (ECM) и выстланной человеческими кишечными эпителиальными (Caco-2) клетками, которые имитирует сложную структуру и физиологию живого кишечника. Кишечная микросреда воссоздана с помощью потока жидкости с низкой скоростью (30 мкл/ч), обеспечивающего низкое напряжение сдвига (0,02 дин/см2) в микроканалах, и оказанием циклического напряжения (10%; 0,15 Гц), которое имитирует физиологические перистальтические движения. В этих условиях столбчатый эпителий развивается, быстро поляризуется, спонтанно разрастается в складки, которые воспроизводят структуру кишечных ворсинок, и формирует высоко интегрированный барьер для малых молекул, который лучше имитируют кишечник в целом, чем клетки в культуре в статических Transwell моделях. Кроме того, обычный кишечный микроб (Lactobacillus rhamnosus GG) может быть успешно совместно культивирован в течение длительных периодов (>1 недели) на поверхности просвета культивированного эпителия без ущерба для жизнеспособности эпителиальных клеток, и это действительно улучшает барьерную функцию, как ранее наблюдалось у людей. Таким образом, это 'Gut-on-a-Chip' устройство повторяет множество динамических физических и функциональных особенностей человеческого кишечника, которые являются критическими для его функции в контролируемой микрожидкостной среде, которая пригодна для исследований транспорта, поглощения и токсичности, и, следовательно, оно должно иметь большое значение для тестирования лекарственных препаратов, а также для разработки новых моделей кишечных заболеваний.
[00145] Процесс разработки лекарственных препаратов сильно осложнялся необходимостью животных моделей, которые являются дорогостоящими, трудоемкими, времязатратными и сомнительны с точки зрения этики1. Еще больше беспокоит то, что животные модели часто не предсказывают результаты, получаемые на людях,2-3 и это является особой проблемой при решении вопросов, связанных с метаболизмом, транспортом и пероральной абсорбцией лекарственных препаратов и питательных веществ.4-5 По этим причинам все больше возрастает интерес к развитию in vitro моделей функции человеческого кишечника, в том числе в системах культивирования клеток, которые используют вставки Transwell фильтра6-7, что позволяет исследовать транс-эпителиальный барьер и транспорт,8-9 и миниатюрных микрожидкостных моделей, которые также поддерживают долгосрочное культивирование.10-14 Другие исследователи пытались ранее воссоздать нормальную трехмерную (3D) архитектуру слизистой оболочки кишечника in vitro путем культивирования клеток человеческого эпителия кишечника (например, Caco-2) на подложках гидрогеля, которые были сконструированы на микроуровне для имитирования формы, размера и плотности ворсинок кишечника человека.11 Тем не менее, ни одна из существующих in vitro кишечных моделей механически не воспроизводит активную микросреду живого кишечника (перистальтические движения и поток жидкости внутри просвета), что является критическим для нормальной физиологии органа,15 а также для развития болезни Крона и другие кишечных заболеваний.16-17 Другим недостатком существующих in vitro кишечных моделей является то, что ранее не удавалось вырастить живых микробов на поверхности просвета культивируемого кишечного эпителия в течение длительного периода, как обычно происходит в живом кишечника. Это ключевая проблема, потому что микробные симбионты обычно вносят значительный вклад в функцию кишечного барьера, метаболизм и абсорбцию лекарственных препаратов и химических веществ, а также многих заболеваний18-22. Таким образом, здесь описана более физиологически значимая in vitro модель человеческого кишечника в форме человеческого 'Gut-on-a-Chip', который подвергается перистальтике, воздействию потока жидкости, а также поддерживает рост микробной флоры без ущерба для жизнеспособности клеток человека.
[00146] Конструирование и производство микроустройства. Устройство 'Gut-on-a-Chip' было изготовлено из гибкого прозрачного полимера полидиметилсилоксана (PDMS; Sylgard, Dow Corning) путем адаптации по технологии мягкой литографии, которая ранее использовалась при создании устройства 'Lung-on-a-Chip' ("легкое-на-чипе")23. Выровненные верхний и нижний микроканалы имели одинаковый размер (150 мкм в высоту×1000 мкм в ширину) и были отделены друг от друга толстой 30 мкм PDMS мембраной, содержащей круглые поры диаметром 10 мкм на расстоянии 25 мкм (от центра до центра) (фиг.12A-12C). Как показано на фиг.13, верхний и нижний слои микроканалов изготовлены отдельно путем литья PDMS форполимера (15:1 вес. соотношение PDMS к отвердителю) на микроизготовленную форму обратной конструкции канала, выполненной из фоторезиста (SU-8 100, Microchem, Ньютон, Массачусетс). Пористую мембрану (фиг.12, справа) получали посредством литья PDMS форполимера на микроизготовленную кремниевую пластину, содержащую столбчатые матрицы с округлыми столбиками (10 мкм в диаметре×30 мкм по высоте с шагом 25 мкм; MEMS and Nanotechnology Exchange, Рестон, Вирджиния), наложения форполимера с отвержденным, плоским, силанизированным PDMS слоем подложки, размещения 3 кг веса на установке и отверждения полимера при 60°C в течение 12 часов. После отслаивания пористой мембраны PDMS и слоя подложки от пластины поверхность пористой мембраны подвергали воздействию плазмы, генерируемой лабораторной установкой для коронирования (BD-20AC, Electro-Technic Products, Inc, Чикаго, Иллинойс), также как и верхний слой микроканала. Обработанные плазмой поверхности пористой мембраны PDMS и верхнего слоя микроканала были затем немедленно помещены в конформный контакт. Инкубация всей установки при 80°C в течение ночи привела к необратимому соединению двух PDMS слоев. Слой PDMS подложки затем был отделен от нижней части пористой PDMS мембраны и части этой мембраны, расположенные над боковыми вакуумными камерами, были оторваны с помощью щипцов, обеспечив создание полых по всей высоте вакуумных камер. Открытая поверхность оторванной PDMS мембраны и верхняя поверхность нижнего слоя PDMS микроканала с такой же формой к верхнему слою затем подвергались воздействию плазмы, выравнивались, спрессовывались вместе под стереоскопом (Zeiss Discovery V20 Stereo Microscope, Carl Zeiss MicroImaging Gmb, Германия) и отверждались при 80°C в течение ночи, обеспечивая получение полностью соединенного устройства, содержащего полые вакуумные камеры по обе стороны от основного микроканала (фиг.12A и фиг.13). Система трубок (Tygon 3350 silicone tubing, ID 1/32", OD 3/32", Бивертон, Мичиган) соединяла жидкую среду и источники вакуума с верхним и нижним микрожидкостными каналами, соответственно, с использованием тупых игл из нержавеющей стали без сердцевин (18G; Kimble Chase, Вайнленд, Нью-Джерси). Это позволило контролировать поток культуральной среды в центральном микроканале и регулировать применение вакуума к боковым камерам под управлением компьютера для воздействия циклического механического напряжения с целью имитирования перистальтических движений (фиг.12D).
[00147] Клеточная культура. Человеческие Caco-2 эпителиальные клетки кишечника (линии Caco-2BBE колоректальной карциномы человека24) получили из Гарвардского Центра болезней пищеварительной системы и выращивали в модифицированной по способу Дульбекко среде Игла, содержащей 4,5 г/л глюкозы (DMEM; Gibco, Гранд Айленд, Нью-Йорк) с добавлением 20% фетальной бычьей сыворотки (FBS; Gibco), 100 единиц/мл пенициллина, 100 мкг/мл стрептомицина (Gibco), 100 мкг/мл Нормоцина (Invivogen, Сан Диего, Калифорния) и 25 мМ HEPES. Антибиотики были удалены из культуральной среды для совместного культивирования клеток Caco-2 с живыми кишечными микробами.
[00148] После изготовления и сборки микроустройства система трубок и микроканалы были простерилизованы путем пропускания 70% (об.) этанола через устройство и сушки всей системы в 60°C печи. Высушенные устройства затем подвергали воздействию ультрафиолетового света и озона (UVO Cleaner 342, Jelight Company Inc., Ирвайн, Калифорния) одновременно в течение 30 мин. ECM раствор25-27, содержащий коллаген крысы типа I (50 мкг/мл; Gibco) и Матригель (300 мкг/мл; BD Biosciences, Бедфорд, Массачусетс) в бессывороточном DMEM, вводили в микроканалы и инкубировали при 37°C в течение 2 часов, после чего микроканалы перфузировали культуральной средой. Caco-2 клетки, собранные с помощью раствора трипсин/EDTA (0,05%; Gibco), высевали на верхней поверхности пористой мембраны, покрытой ЕСМ (1,5×105 клеток/см2), слегка подтягивая раствор клеток в верхний микроканал с помощью стерильного шприца (1 мл Tuberculin slip tip; BD, Франклин Лейкс, Нью-Джерси) и иглы (25G 5/8; BD). При этой плотности клеток ни агрегация, ни суперпозиция клеток в микроканале не наблюдалось после посева в устройство 'Gut-on-a-Chip'. Клетки Caco-2 прикреплялись к PDMS поверхности, покрытой ECM, в течение ~30 мин и образовывали соединения клетка-клетка в течение 1 часа (не показано). Через 1 час использовали шприцевой насос (BS-8000; Braintree Scientific Inc., Брейнтри, Массачусетс) для заливки культуральной среды непрерывно через верхний канал при постоянной скорости потока (30 мкл/ч, которая обеспечивала напряжение сдвига 0,02 дин/см2) в течение первого дня культивирования для того, чтобы убедиться, что клетки Caco-2 образовали цельный монослой, а затем пропускали через верхний и нижний каналы среду с той же скоростью.
[00149] Для того, чтобы механически деформировать Caco-2 монослой циклическим образом, что имитирует перистальтические движения кишечника, к трубке, присоединенной к вакуумной камере, применяли циклические всасывания (фиг.12A, 12B) с помощью управляемого компьютером инструмента FX5K Tension (Flexcell International Corporation, Хиллсборо, Северная Каролина). Это устройство способно к однонаправленному удлинению пористой мембраны в 'Gut-on-a-Chip' до ~50%; однако в этих исследованиях был применен циклический режим растяжения (10% основного клеточного растяжения, частота 0,15 Гц), который более точно имитирует механическую микросреду, которую эпителиальные клетки испытывают в кишечнике живого человека in vivo16, 28. Соотношение между приложенным давлением, искривлением пористой подложки мембраны и деформации клеток было вначале рассчитано в широком диапазоне (от 0 до ~30% деформации) для того, чтобы охарактеризовать контрольные параметры устройства (фиг.12E).
[00150] Контрольные исследования проводились с использованием статических культур Caco-2 клеток на Transwell пластинах (Corning In с, Лоуэлл, Массачусетс), содержащих вставки пористой полиэфирной мембраны (0,33 см2, 0,4 мкм поры), которые были предварительно покрыты той же ECM смесью коллагена I типа и Матригеля, что и в устройстве 'Gut-on-a-Chip'. Caco-2 клетки также высевали с той же плотностью (1,5×105 клеток/см2) при обновлении среды через день как с апикальной, так и базолатеральной стороны Transwell камеры.
[00151] Измерения эпителиального барьера. Целостность монослоя эпителиальных клеток кишечника человека, полученного в результате образования апикальных плотных контактов, оценивали путем окрашивания белка плотного контакта, окклюдина, 29 с помощью конфокальной иммунофлуоресцентной микроскопии и путем измерения транс-эпителиального электрического сопротивления (ТЭЭС). В Transwell культурах ТЭЭС измеряли с помощью Millicell ERS измерителя (Millipore, Бедфорд, Массачусетс), соединенного с палочко-подобным электродом, и значения ТЭЭС (Ω, см2) определяли путем вычитания базового значения сопротивления, измеренного в отсутствии клеток, и затем умножения оставшихся значений 'удельного' значения сопротивления (Ω) на площадь поверхности клеточной культуры (см2). ТЭЭС Caco-2 монослоя, культивированного в 'Gut-on-a-Chip', измеряли с помощью напряжение-омметра (87 V Industrial Multimeter, Fluke Corporation, Эверетт, Вашингтон), соединенного с проводами Ag/AgCl электрода (0,008'' в диаметре; A-M systems, Inc., Секим, Вашингтон); контрольные исследования подтвердили, что обоими методами были получены сходные ТЭЭС результаты. Опять же, базовое значение сопротивления, измеренное в отсутствие клеток, вычитали из результатов, полученных от Caco-2 монослоя, и удельные ТЭЭС значения были определены путем умножения конкретных значений сопротивления на общую площадь поверхности клеточной культуры на PDMS мембране (Таблица 1).
[00152] Измерение активности аминопептидазы. Функциональность эпителиальных клеток кишечника человека была количественно измерена по удельной активности апикального аминопептидазного фермента щеточной каемки, который экспрессируется монослоем дифференцированных Caco-2 клеток кишечника человека30, с использованием L-аланин-4-нитроанилид гидрохлорида (A4N; Sigma, Сент-Луис, Миссури) в качестве субстрата. В Transwell исследованиях A4N раствор субстрата (1,5 мМ в среде) наносили в верхнюю камеру клеток, культивированных в течение 5 или 21 дня, и после инкубации при 37°C в течение 2 часов раствор (70 мкл) в верхней камере перемещали на 96-луночный планшет (Black/clear flat bottom, BD Falcon, Франклин Лейкс, Нью-Джерси), где продукт расщепления (т.е. 4-нитроанилин) определяли количественно в микропланшет-ридере (SpectraMax М5, Molecular Devices, Саннивейл, Калифорния) при 405 нм с использованием культуральной среды в качестве эталона. Удельная активность аминопептидазы была получена путем деления общей активности на общее число клеток. Действительное количество расщепленного продукта было рассчитано по калибровочной кривой 4-нитроанилина.
[00153] Для измерения удельной активности аминопептидазы в 'Gut-on-a-Chip' A4N раствор пропускали при скорости 30 мкл/ч через верхний микроканал устройства, содержащий Caco-2 монослой, культивированный в присутствии или отсутствии циклического механического напряжения (10%-ной деформации, при частоте 0,15 Гц) в течение 5 дней. Образцы (30 мкл), собирали каждый час на выходе верхнего микроканала, разбавляли до такого же объема (70 мкл), который был использован для анализа Transwell образцов, и переносили в 96-луночный планшет (Black/clear flat bottom, BD Falcon), где измеряли оптическую плотность, как описано выше.
[00154] Измерения параклеточной проницаемости. Коэффициент кажущейся проницаемости (Papp, см/сек) монослоя клеток кишечника определяли после того, как была установлена целостность плотных контактов (ТЭЭС≥600 Ω⋅см2) путем измерения транспорта флуоресцеин изотиоцианат-меченного декстрана (FD20; 20 КДа; Sigma, Сент-Луис, Миссури) с течением времени. В Transwell исследованиях применяли FD20 (200 мкл; 1 мг/мл) к апикальной поверхности эпителия в верхней камере, и отбирали аликвоты (70 мкл) из нижней камеры через каждые 15 мин (общим объемом 700 мкл) с одновременным пополнением таким же объемом свежей культуральной среды. Интенсивность флуоресценции (возбуждение 490 нм/испускание 520 нм) в образцах, отобранных из нижней камеры, сразу же была измерена для количественного определения FD20, транспортируемого от апикальной к базолатеральной поверхности клетки. После вычитания значения базовой флуоресценции, измеренной в одной культуральной среде, коэффициент кажущейся проницаемости (Papp) был рассчитан в соответствии с Papp (см/сек)=(dQ/dt)(1/ACo), где dQ/dt представляет собой стационарный поток (г/с), A - площадь культуральной поверхности (см2) и Co - начальную концентрацию (г/л) FD20 раствора, наносимого на апикальную клеточную поверхность.31
[00155] В исследованиях, проводимых с использованием 'Gut-on-a-Chip', FD20 раствор перфузировали через верхний канал и аликвоты образцов (30 мкл), которые собирали каждый час на выходе нижнего канала, анализировали для определения количества FD20, который транспортировался через Caco-2 параклеточный барьер. Caco-2 монослой в микроканале культивировали в присутствии потока среды (30 мкл/ч), с или без воздействия циклического механического напряжения (10% деформация, при частоте 0,15 Гц) в течение 5 дней.
[00156] Микробные исследования. Для изучения физиологически значимых взаимодействий микробов на эпителиальные клетки кишечника человека из Американской коллекции типовых культур получили штамм Lactobacillus rhamnosus GG (LGG) (АТСС 53103; Манассас, Вирджиния), который был первоначально выделен из кишечника человека.32 Клетки LGG выращивали в автоклавированном Lactobacilli MRS бульоне (BD Diagnostic, Спаркс, Мэриленд) в увлажняющем инкубаторе (37°C, 5% CO2) без встряхивания в течение ночи перед переносом на апикальную поверхность Caco-2 клеточного монослоя, который был предварительно культивирован в течение ~4-5 дней для развития соответствующей целостности кишечного барьера (ТЭЭС≥600 Q⋅см2). Клеточно-культуральная среда заменялась свободной от антибиотиков средой на протяжении 12 часов перед посевом из LGG клеток (~1,0×107 КОЕ/мл, конечная плотность клеток). LGG клетки, помещенные на апикальную поверхность Caco-2 клеток в Transwell культурах, инкубировали в течение 1,5 ч, аккуратно промывали от неприкрепившихся клеток с двумя заменами свободной от антибиотиков культуральной среды и инкубировали в аналогичной среде при продолжительном культивировании, как было указано. Тот же метод был использован для исследований в 'Gut-on-a-Chip', за исключением того, что после периода прикрепления, свободную от антибиотиков среду перфузировали через верхний и нижний микроканалы при 40 мкл/ч с циклическим растяжением (10% деформации, при частоте 0,15 Гц).
[00157] Измерения активности микробной β-галактозидазы. Для анализа жизнеспособности и функции LGG клеток в исследованиях совместного культивирования каталитическую активность LGG β-галактозидазы определяли путем измерения способности культивированных микробов расщеплять ферментный субстрат, O-нитрофенил β-D-галактопиранозид (ONPG; Sigma, Сент-Луис, Миссури). Для этих исследований LGG и Caco-2 клетки совместно культивировали в 'Gut-on-Chip' и перфузировали свободную от антибиотиков среду (40 мкл/ч) в течение 48 ч перед добавлением ONPG к среде (30 мкг/мл). Образцы (30 мкл), которые собирали каждый час на выходе из верхнего микроканала, анализировали путем измерения оптической плотности (420 нм) с использованием инструмента SpectraMax М5 (Molecular Devices, Саннивеэл, Калифорния) для определения количества продукта (например, O-нитрофенол), высвобождаемого β-галактозидазой в LGG клетках. Количество расщепленного продукта было определено по калибровочной кривой Онитрофенола.
[00158] Морфологические исследования. Изображения клеток были записаны во время культивирования с помощью камеры Moticam 2500 (Motic China Group Co., Ltd.) с помощью программного обеспечения для обработки изображений (Motic images plus 2.0; Motic China Group Co., Ltd.) на Zeiss Axiovert 40CFL фазово-контрастном микроскопе. Для визуализации формы и полярности клеток F-актин, ядра и муцин окрашивали в Caco-2 клеточных монослоях, которые были зафиксированы в 4% параформальдегиде и пермиабилизированы в 0,3% Triton-X-100 (Sigma, Сент-Луис, Миссури), с использованием флуоресцеин изотиоцианата (FITC) - фаллоидина (Sigma, Сент-Луис, Миссури), 4',6-диамидино-2-фенилиндола, дигидрохлорида (DAPI; Molecular Probe, Юджин, Орегон), и Муцин 2 антител (мышиное моноклональное антитело; Abcam, Кембридж, Массачусетс), соответственно. После флуоресцентного окрашивания клетки сканировали с использованием инвертированного лазерного сканирующего конфокального микроскопа (Leica SP5 X MP, Германия), оснащенного фотоумножителем и соединенного с 405 нм лазером и лазером белого света (489-670 нм). Для визуализации эпителиальных плотных контактов иммунофлюоресцентное окрашивание проводили с использованием анти-окклюдин антитела (мышиное моноклональное антитело Alexa Fluor 594; Molecular Probe, Юджин, Орегон), и образцы визуализировали на Zeiss Axio Observer Z1 эпи-флуоресцентном микроскопе, соединенным с CCD камерой (CoolSNAP HQ2, разрешение 1392×1040; Photometries, Тусон, Аризона); компьютерный анализ записанных изображений проводили с использованием MetaMorph программного обеспечения для обработки изображений (Molecular Devices).
[00159] Статистический анализ. Все результаты выражены в виде среднего значения ± стандартная ошибка (SEM). Для статистической оценки количественных данных осуществляли однофакторный дисперсионный анализ (ANOVA) с процедурой множественного сравнения Тьюки-Крамера, используя GraphPad InStat версии 3.10 (GraphPad Software Inc., Сан Диего, Калифорния). Различия считали статистически значимым при p<0,05.
[00160] Расчет напряжения сдвига. Напряжение сдвига (τ, дин/см2) рассчитывали на основе следующего уравнения,63 τ=6μQ/h2w, где μ представляет собой вязкость культуральной среды (г/см⋅с), Q - объемную скорость потока (см3/с), a w (см) и h (см) - ширину и высоту микроканала, соответственно.
[00161] Измерение активности β-галактозидазы. Для измерения каталитической активности β-галактозидаз использовали O-нитрофенил-β-D-галактопиранозид (ONPG; Sigma, Сент-Луис, Миссури), как описано выше. Культивирование LGG клеток проводили в среде MRS, затем собирали LGG клетки в экспоненциальной фазе. После того, как L GG клетки дважды промывали в свободной от антибиотиков клеточно-культуральной среды, плотность клеток доводили до ~1.0×108 КОЕ/мл в ONPG-содержащей свободной от антибиотиков среде для культивирования клеток (30 мг/мл, конечная ONPG концентрация), затем образцы немедленно инкубировали при 37°C при 5% CO2 во влажной атмосфере. Образцы периодически в 12 ч центрифугировали, и оптическую плотность супернатанта измеряли при 420 нм (SpectraMax М5, Molecular Devices); свежая культуральная среда была использована в качестве эталона. Caco-2 клетки культивировали в ECM-покрытых 24-луночных планшетах (Falcon, BD) в течение 2 недель, и культуральную среду затем заменяли на свободную от антибиотиков среду в течение 12 часов перед проведением ONPG анализа. После того, как ONPG раствор (30 мг/мл) наносили на Caco-2 культуральный планшет, аликвоты образца периодически брали из культуральной среде и измеряли оптическую плотность при 420 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
[00162] Конструкция микросистемы 'Gut-on-a-Chip'. Вариант осуществления микроустройства 'Gut-on-a-Chip' был разработан для имитирования динамической механической микросреды кишечника, поддерживаемого основанное на перфузии долгосрочное культивирование клеток с микробными симбионтам, и предоставления возможности анализа функций кишечного эпителиального барьера in vitro. Для достижения этих целей конструкция микросистемы включала два слоя близко расположенных микроканалов, разделенных тонкой пористой мембраной, покрытой ЕСМ и выстланной Caco-2 эпителиальными клетками кишечника человека (фиг.12A). Культуральную среду перфузировали через оба микроканала (10-100 мкл/мин) для того, чтобы имитировать поток жидкости и напряжения сдвига, обычно наблюдаемое в кишечнике человека.34-36 Для создания ритмических механических деформаций эпителиального монослоя клеток, подобных вызванным перистальтическими движениями кишечника человека, циклическое всасывание, регулируемого вакуумным коллектором под управлением компьютера, было применено к полым по всей высоте вакуумным камерам, расположенным по обе стороны от микроканалов для многократного растяжения и упругого сокращения ECM-покрытой пористой мембраны (фиг.12D). Фазово-контрастный микроскопический анализ формы клеток в эпителиальных монослоях кишечника человека, выращенных в этих условиях, подтвердил, что и искривление подложки, и клеточные деформации линейно возрастали от 0 до ~30% при повышении уровня всасывающего давления от 0 до 45 кПа (фиг.12A-12E).
[00163] Влияние имитации микросреды кишечника на эпителиальную организацию. Для того, чтобы исследовать физиологическое значение имитирования физической микросреды кишечника, клетки Caco-2 выращивали либо в статической Transwell камере без потока жидкости и механического напряжения (фиг.14A), либо в микрожидкостном устройстве 'Gut-on-a-Chip' только с потоком (фиг.14B) или с потоком и циклическим механическим напряжением (фиг.14C). Клетки Сасо-2 в Transwell системе обычно должны выращиваться в течение 3 недель для проявления функций дифференцированного кишечного барьера, и, таким образом, мы провели анализ клеток на 21 день в этих статических культурах. В предварительных исследованиях было замечено, что четко определенные эпителиальные монослои формируются гораздо быстрее в микрожидкостных устройствах, и, следовательно, эти исследования, сравнивающие функции эпителиального монослоя с Transwell культурами, смогли осуществляться уже после 3 дней культивирования в микрожидкостной системе.
[00164] Фазово-контрастные и иммунофлуоресцентные микроскопические исследования с использованием антител, связывающих белок плотного контакта, окклюдин, подтвердил, что клетки Caco-2 образовывали слитые многоугольные эпителиальные слои с хорошо развитыми плотными контактами во всех трех условиях культивирования, хотя клетки культивировали в микроустройстве гораздо более короткие сроки (фиг.14A-14C). Тем не менее, анализ конфокальной флуоресцентной микроскопией распределения F-актина и положения ядра показал, что эпителиальные клетки, выращенные в статических условиях в Transwell, были сильно плоскими и практически чешуйчатыми по форме (фиг.14A). Напротив, клетки, выращенные в присутствии потока жидкости со скоростью (30 мкл/ч; напряжение сдвига 0,02 дин/см2), аналогичной испытываемой кишечником человека34, 36, с или без сопровождающей циклической деформации, были почти в 6 раз выше по размерам (фиг.14D) и, таким образом, выражали поляризованные эпителиальные клеточные формы с базальными ядрами (фиг.14B-14C). В самом деле, клетки в условиях потока жидкости, были примерно одинаковой столбчатой формы и размера (30-40 мкм высотой), что отмечалось для клеток здорового неповрежденного эпителия кишечника человека in vivo.37
[00165] Возможно, что это влияние на морфологию клеток может быть артефактом размещения в микроканальном устройстве по сравнению с Transwell камерой. Однако, когда скорость потока жидкости была снижена в микрожидкостном канале до минимального уровня (10 мкл/ч), клеткам не удалось увеличиться по высоте и они больше напоминали выращенные в статической Transwell системе38 (фиг.14A), в то время как увеличение скорости до 100 мкл/ч не привело какому-либо дополнительному эффекту, таким образом, далее мы проводили исследования при 30 мкл/ч (фиг.18A-18C). Таким образом, применение физиологического потока жидкости и напряжения сдвига на апикальной поверхности кишечного эпителия ускоряет клеточную дифференцировку, как было установлено по увеличению высоты и поляризации этих клеток в течение 3 дней культивирования в условиях, когда клетки в Transwell системе оставались плоскими даже через 3 недели. Кроме того, поток или напряжение сдвига были важнейшими факторами, определяющими этот ответ, так как циклическое напряжение не оказывает существенных дополнительных эффектов (фиг.14B).
[00166] Интересно, что когда клетки Caco-2 культивировали в 'Gut-on-a-Chip' микроустройстве с потоком и циклическим напряжением более длительное время, было обнаружено, что исходно плоский столбчатый эпителий спонтанно вырос, образовав неровности и складки (фиг.15A). При анализе вертикального среза с помощью иммунофлуоресцентной конфокальной микроскопии, были найдены складки, проявляющие морфологию нормальных ворсинок кишечника, выстланных поляризованными клетками столбчатого эпителия с базальными ядрами и разделенных криптами (фиг.15B). Апикальные поверхности эпителиальных клеток в этих структурах ворсинок окрашивали положительно на муцин 2, в которых этот мукопротеин находится in vivo.39 Время образования ворсинок, наблюдаемых в этой in vitro модели (порядка нескольких недель), также соответствует скорости обновления ворсинок, наблюдаемой in vivo.40-41 Считается, что спонтанное образование кишечных ворсинок клетками Caco-2 никогда не сообщалось ранее, и это ответ, который происходит после посева на плоские ECM подложки, по-видимому, зависит непосредственно от повторения механической микросреды нормального кишечника, который претерпевает низкие уровни потока жидкости (и напряжение сдвига), а также циклические перистальтические движения.
[00167] Реконструирование барьерных функций кишечника in vitro. Модель барьерной функции Transwell кишечного эпителия, которая часто используется в качестве инструмента для скрининга применений лекарственных препаратов, а также биологических исследований клеток,8, 42 включает культивирование Caco-2 клеток на пористой мембране и целостность плотных соединений измеряется количественно по ТЭЭС. Таким образом, ТЭЭС Caco-2 монослоев, выращенных в статических Transwell условиях, были сопоставлены в сравнение с теми, которые образуются в устройстве 'Gut-on-a-Chip' с потоком (30 мкл/ч) в присутствии или отсутствии физиологического циклического напряжения (10%; 0,15 Гц). Эти исследования показали, что ТЭЭС клеток, выращенных во всех трех условиях культивирования, увеличилась за первые 6 дней после посева и затем поддерживалась на таком же высоком уровне еще как минимум от 4 до 5 дней культивирования. Однако клетки в микрожидкостном устройстве с или без деформации показали пиковые уровни ТЭЭС, которые были в 3-4 раза выше, чем у клеток в статической Transwell культуре (фиг.16A).
[00168] Коэффициент кажущейся проницаемости (Papp) кишечного эпителия измеряли с использованием флуоресцентного декстрана (FD20), который характеризует функцию параклеточного барьера кишечного эпителия благодаря порам, связанным с плотными соединениями.31 Было обнаружено, что Papp клеток был такой же (~4×10-8 см/сек), что и для Caco-2 клеток, культивированных в течение 5 или 21 дней в Transwell камерах (фиг.16B). Клетки, культивированные в течение 5 дней в микрожидкостном устройстве только с потоком жидкости (30 мкл/ч), также показали аналогичный Papp; однако дополнительное применение циклического механического напряжения (10%-ной деформации, 0,15 Гц + поток 30 мкл/ч) вызвало более чем 4-кратное увеличение параклеточной проницаемости (фиг.16B).
[00169] Эти результаты согласуются с опубликованными исследованиями, которые показывают, что монослои Caco-2 клеток в Transwell культурах показывают более низкие значения параклеточной проницаемости, чем наблюдаемые в кишечнике человека или животного in vivo.43-45 Было предположено, что такой низкий уровень проницаемости может быть вызван наличием толстого неперемешиваемого слоя жидкости в статической Transwell культуре, что может ограничивать диффузию.46 Можно затем ожидать, что поток жидкости приведет к увеличению параклеточной проницаемости путем образования напряжения сдвига жидкости, которое уменьшает толщину неперемешиваемого диффузионного слоя43-44, 47, но поток жидкости сам по себе не изменял параклеточную проницаемость в системе, описанной в данном документе. Вместо этого, как описано здесь, циклические деформации увеличивали параклеточную проницаемость, и это происходило в условиях, которые не изменяли ТЭЭС в этих клеточных монослоях (фиг.16B по сравнению с фиг.16A), предполагая, что механическое искривление может непосредственно изменять параклеточные механизмы транспорта. Циклическое механическое напряжение может увеличивать транспорт наночастиц через эпителиальные и эндотелиальные клеточные монослои в результате повышенного трансцитоза, 23 и, следовательно, возможно, что здесь имеет место подобный механизм.
[00170] Далее, каталитическая активность аминопептидазы эпителиальных клеток была проанализирована для того, чтобы определить, изменяет ли поток жидкости и механическое напряжение цитодифференцировку в эпителиальных клетках кишечника человека. Дифференцировку Caco-2 клеток измеряли по активности экспрессируемой аминопептидазы, увеличенной свыше 7 раз в клетках, культивированных в течение 21 дня по сравнению с 5 днями в статической Transwell системе (фиг.16C), что согласуется с ранее опубликованными данными.48 Важно, что культивирование клеток в потоке жидкости (30 мкл/ч) в микрожидкостном устройстве значительно ускорило их ответ, обеспечив почти 9-кратное увеличение активности аминопептидазы всего за 5 дней культивирования, и еще большее увеличение было получено, когда клетки выращивали в 'Gut-on-a-Chip', где одновременно применялся такой же поток жидкости и циклическое механическое напряжение (10% деформации, 0,15 Гц). Эти результаты согласуются с предшествующим исследованием, которое показало, что циклическая деформация может аналогично повышать активность ферментов, специфичных для кишечной дифференцировки, в Caco-2 клетках.25
[00171] Совместное культивирование хозяин-микрофлора. Один из наиболее важных компонентов физиологии кишечника человека, который никогда не был эффективно моделирован in vitro, заключается в естественном присутствии микробных сообществ в просвете кишечника.49 Чтобы выяснить, может ли высоко дифференцированный эпителий кишечника, полученный в 'Gut-on-a-Chip', поддерживать совместное культивирование с микробной флорой, естественный кишечный микроб, Lactobacillus rhamnosus GG (LGG) культивировали на апикальной поверхности монослоя Caco-2 клеток, и клетки, культивированные в Transwell камере в статических условиях, использовали в качестве контролей. После микрожидкостного совместного культивирования с непрерывным потоком (40 мкл/ч) и циклической деформаций (10%, 0,15 Гц) в течение 96 часов, микроколонии LGG клеток оставались плотно прилегающими к поверхности Caco-2 монослоя (фиг.17A). Окрашивание живых/мертвых клеток культуры с помощью кальцеин-AM и этидия гомодимера-1, соответственно, подтвердило, что Caco-2 эпителиальные клетки оставались полностью (>95%) жизнеспособными после совместного культивирования с LGG в этих условиях (фиг.17B). LGG проявляли β-галактозидазную активность, специфичную для бактерий, при выращивании только этой культуры, в то время как эпителиальные клетки кишечника не проявляли такой активности (фиг.19). Когда мы измерили β-галактозидазную активность в верхней камере совместных культур, она тоже оставалась высокой, подтвердив тем самым, что LGG клетки также остаются жизнеспособными при этих условиях культивирования (фиг.17D).
[00172] Важно, что не только монослой кишечных клеток был в состоянии поддерживать нормальные барьерные функции в этих условиях совместного культивирования с живыми микробами, растущими на их апикальной поверхности, целостность барьера, которую измеряли количественно по ТЭЭС, в самом деле, улучшилась с течением времени (фиг.17C). Этот результат согласуется с выводом, что пробиотические штаммы бактерий, включая LGG, были отмечены в увеличении целостности эпителия кишечника in vitro50 и повышении барьерной функции кишечника у человека.51 Напротив, ТЭЭС рассеивалась за первый день совместного культивирования в статической Transwell системе и не могла быть измерена вовсе после 48 часов (фиг.17C) вследствие смерти и полного отделения эпителиального монослоя.
[00173] Микробном человека играет центральную роль в здоровье и болезнях кишечника,18, 52-53 и, таким образом, развитие in vitro платформы для изучения взаимодействия хозяин-микроб должно представлять большой интерес для клеточных биологов и физиологов, а также фармацевтических исследователей.54-55 Предшествующие исследования проводились при краткосрочном совместном культивировании эпителиальных клеток кишечника с живыми бактериями для изучения микробной адгезии,56 инвазии,57 транслокации58 и образовании биопленки.59 Но долгосрочное совместное культивирование микробов с клетками-хозяевами не удавались из-за разрастание микробов и потери жизнеспособности эпителия. Это, вероятно, связано с трудностями в соответствии между условиями роста клетки-хозяина и микроба,59 контролированием плотности популяции микробов в свободных от антибиотиков условиях культивирования60 или ограничением продукции метаболитов (например, органических кислот) микробными клетками.61-62 В описанных здесь экспериментах LGG клетки росли без ограничений в стоячей апикальной камере Transwell системы, вызывая резкое снижение pH среды (pH 2,5-3,0), что не согласуется с выживанием клеток кишечного эпителия (не показано). Важно, однако, что микрожидкостная природа 'Gut-on-a-Chip' обеспечивает способ преодоления этой проблемы, поскольку он эффективно функционирует в качестве биореактора непрерывного потока. В частности, скорость разбавления культуральной среды в 'Gut-on-a-Chip' (~8,0 ч-1) значительно выше, чем удельная скорость роста LGG в культуральной среде (~0,2 ч-1), что позволяет очистку от органических кислот и несвязанных LGG клеток. LGG клетки, которые плотно прилипли к поверхности Сасо-2 монослоя, оставались в устройстве 'Gut-on-a-Chip, в то время как все неприлипшие клетки LGG отмывали, что предотвращало неограниченное разрастание этих культур. Учитывая, что целостность кишечного эпителия значительно увеличена при совместном присутствии LGG культур, наличие микробов, видимо, обеспечивает сигналы нормальной микросреды, которые улучшают функции эпителиальных клеток (например, секрецию муцина), что необходимо для поддержания таких динамических взаимодействий, которые соответствует клиническим исследованиям на человеке.51
[00174] Воплощение человеческого 'Gut-on-a-Chip' микроустройства, описанное в этом примере, обеспечивает контролируемую микроплатформу для изучения и изменения наиболее важных функций кишечника в присутствии соответствующих физиологических сигналов, в том числе циклического механического напряжения, потока жидкости и сосуществования микробной флоры. Характеристика этого устройства показала, что реконструирование низкого уровня потока жидкости и напряжения сдвига, которые испытываются в живом кишечнике, является достаточным для содействия ускоренной дифференцировки эпителиальных клеток кишечника, формирования 3D ворсинкоподобных структур и повышения барьерной функции кишечника, и что добавление циклического механического напряжения, которое имитирует нормальные перистальтические движения, еще больше усиливает эти ответы. Более того, дифференцированный в устройстве 'Gut-on-a-Chip' кишечный эпителий может поддерживать рост микробной флоры, которая обычно живет в кишечнике человека. Человеческий перистальтический 'Gut-on-a-Chip' может, таким образом, способствовать изучению механорегуляции функции кишечника, а также симбиоза хозяин-микроб и эволюции. Учитывая, что он эффективно повторяет многие сложные функции нормального кишечника человека, он также может стать значимой платформой для скрининга лекарственных препаратов и токсикологического тестирования.
Ссылки для разделов Пример 2 и Уровень техники
1. J.С. Davila, R.J. Rodriguez, R.В. Melchert and D. Acosta, Jr., Annu Rev Pharmacol Toxicol, 1998, 38, 63-96.
2. J.A. Kramer, J.E. Sagartz and D.L. Morris, Nature Reviews Drug Discovery, 2007, 6, 636-649.
3. H. Olson, G. Betton, D. Robinson, K. Thomas, A. Monro, G. Kolaja, P. Lilly, J. Sanders, G. Sipes, W. Bracken, M. Dorato, K. Van Deun, P. Smith, B. Berger and A. Heller, Regulatory Toxicology and Pharmacology, 2000, 32, 56-67.
4. К.М. Giacomini, S.М. Huang, D.J. Tweedie, L.Z. Benet, K.L.R. Brouwer, X.Y. Chu, A. Dahlin, R. Evers, V. Fischer, К.M. Hillgren, K.A. Hoffmaster, T. Ishikawa, D. Keppler, R.B. Kim, C.A. Lee, M. Niemi, J.W. Polli, Y. Sugiyama, P.W. Swaan, J.A. Ware, S.H. Wright, S.W. Yee, M.J. Zamek-Gliszczynski, L. Zhang and T. International, Nature Reviews Drug Discovery, 2010, 9, 215-236.
5. J. Hodgson, Nat Biotechnol, 2001, 19, 722-726.
6. E. Le Ferrec, C. Chesne, P. Artusson, D. Brayden, G. Fabre, P. Gires, F. Guillou, M. Rousset, W. Rubas and M. L. Scarino, Atla-Alternatives to Laboratory Animals, 2001, 29, 649-668.
7. I.D. Angelis and L. Turco, Current protocols in toxicology / editorial board, Mahin D. Maines (editor-in-chief)… [et al.], 2011, Chapter 20.
8. K.-J. Kim, in Cell Culture Models of Biological Barriers, ed. C.-M. Lehr, Taylor & Francis, New York, 1 st edn., 2002, ch. 3, pp.41-51.
9. I.J. Hidalgo, T.J. Raub and R.T. Borchardt, Gastroenterology, 1989, 96, 736-749.
10. G.J. Mahler, M.B. Esch, R.P. Glahn and M.L. Shuler, Biotechnology and Bioengineering, 2009, 104, 193-205.
11. J.H. Sung, J.J. Yu, D.Luo, M.L. Shuler and J.C. March, Lab on a Chip, 2011, 11, 389-392.
12. J.H. Sung, C. Kam and M.L. Shuler, Lab on a Chip, 2010, 10, 446-455.
13. H. Kimura, T. Yamamoto, H. Sakai, Y. Sakai and T. Fujii, Lab on a Chip, 2008, 8, 741-746.
14. Y. Imura, Y. Asano, K. Sato and E. Yoshimura, Analytical Sciences, 2009, 25, 1403-1407.
15. I.R. Sanderson, American Journal of Clinical Nutrition, 1999, 69, 1028S-1034S.
16. C.P. Ga yer and M.D. Basson, Cell Signal, 2009, 21, 1237-1244.
17. M.D. Basson and C.P. Coppola, Metabolism-Clinical and Experimental, 2002, 51, 1525-1527.
18. L.V. Hooper, Trends in Microbiology, 2004, 12, 129-134.
19. J.C. Arthur and C. Jobin, Inflammatory Bowel Diseases, 2011, 17, 396-409.
20. H. Sokol and P. Seksik, Current Opinion in Gastroenterology, 2010, 26, 327-331.
21. J.L. Round and S.K. Ma zmanian, Nature Reviews Immunology, 2009, 9, 313-323.
22. J.R. Turner, Nature Revi ews Immunology, 2009, 9, 799-809.
23. D. Huh, B.D. Matthews, A. Mammoto, M. Montoya-Zavala, H. Y. Hsin and D.E. Ingber, Science, 2010, 328, 1662-1668.
24. M.D. Peterson and M.S. Mooseker, J Cell Sci, 1992, 102 (Pt 3), 581-600.
25. M.D. Basson, G.D. Li, F. Hong, O. Han and В.E. Sumpio, Journal of Cellular Physiology, 1996, 168, 476-488.
26. J.H. Zhang, W. Li, M.A. Sanders, В.E. Sumpio, A. Panja and M.D. Basson, Faseb Journal, 2003, 17, 926-+.
27. M.D. Basson, G. Turowski and N.J. Emenaker, Experimental Cell Research, 1996, 225, 301-305.
28. M.D. Basson, Di gestion, 2003, 68, 217-225.
29. M. Furuse, T. Hirase, M. Itoh, A. Nagafuchi, S. Yonemura and S. Tsukita, Journal of Cell Biology, 1993, 123, 1777-1788.
30. C. Piana, I. Gull, S. Gerbes, R. Gerdes, C. Mills, J. Samitier, M. Wirth and F. Gabor, Differentiation, 2007, 75, 308-317.
31. I. Hubatsch, E. G. Ragnarsson and P. Artursson, Nat Protoc, 2007, 2, 2111-2119.
32. M. Saxelin, Food Reviews International, 1997, 13, 293-313.
33. L.G. Durrant, E. Jacobs and M.R. Price, European Journal of Cancer, 1994, 30A, 355-363.
34. R.G. Lentle and P.W.M. Janssen, Journal of Comparative Physiology B-Biochemical Systemic and Environmental Physiology, 2008, 178, 673-690.
35. S.P. Olesen, D.E. Clapham and P.F. Davi es, Nature, 1988, 331, 168-170.
36. T. Ishikawa, T. Sato, G. Mohit, Y. Imai and T. Yamaguchi, Journal of Theoretical Biology, 2011, 279, 63-73.
37. T.F. Bullen, S. Forrest, F. Campbell, A.R. Dodson, M.J. Hershman, D.M. Pritchard, J.R. Turner, M.H. Montrose and A.J. Watson, Lab Invest, 2006, 86, 1052-1063.
38. G. Wilson, I.F. Hassan, C. . Dix, I. Williamson, R. Shah, M. Mackay and P. Artursson, Journal of Controlled Release, 1990, 11, 25-40.
39. S.В. Ho, G.A. Niehans, C. Lyftogt, P.S. Yan, D.L. Cherwitz, E.T. Gum, R. Dahiya and Y.S. Kim, Cancer Research, 1993, 53, 641-651.
40. E. Marshman, C. Booth and C.S. Potten, Bioessays, 2002, 24, 91-98.
41. F. Radtke and H. Clevers, Science, 2005, 307, 1904-1909.
42. P. Shah, V. Jogani, T. Ba gchi and A. Misra, Biotechnol Prog, 2006, 22, 186-198.
43. A. Avdee f and K. Y. Tarn, Journal of Medicinal Chemistry, 2010, 53, 3566-3584.
44. H. Lennernas, K. Palm, U. Fagerholm and P. Artursson, International Journal of Pharmaceutics, 1996, 127, 103-107.
45. S.Y. Yee, Pharma ceutical Research, 1997, 14, 763-766.
46. I.J. Hidalgo, К.M. Hillgren, G.M. Grass and R.T. Borchardt, Pharmaceutical Research, 1991, 8, 222-227.
47. H. Lennernas, Xenobiotica, 2007, 37, 1015-1051.
48. S. Howell, A.J. Kenn у and A.J. Turner, Biochemical Journal, 1992, 284, 595-601.
49. F. Shanahan, Best Practice & Research in Clinical Gastroenterology, 2002, 16, 915-931.
50. H.W. Fang, S.B. Fang, J.S.C. Chiau, C.Y. Yeung, W.T. Chan, C.B. Jiang, M.L. Cheng and H.C. Lee, Journal of Medical Microbiology, 2010, 59, 573-579.
51. C. Dai, D.-H. Zhao and M. Jiang, International journal of molecular medicine, 2012, 29, 202-208.
52. P.J. Turnbaugh, R.E. Ley, M. Hamady, C.M. Fraser-Liggett, R. Knight and J.I. Gordon, Nature, 2007, 449, 804-810.
53. F.H. Karlsson, I. Nookaew, D. Petranovic and J. Nielsen, Trends in Biotechnology, 2011, 29, 251-258.
54. J.K. Nicholson, E. Holmes and I.D. Wilson, Nat Rev Microbiol, 2005, 3, 431-438.
55. P.W. Lin, T.R. Nasr, A.J. Berardinelli, A. Kumar and A.S. Neish, Pediatric Research, 2008, 64,511-516.
56. G. Chauviere, M.H. Coconnier, S. Kerneis, J. Fourniat and A.L. Servin, Journal of General Microbiology, 1992, 138, 1689-1696.
57. M.H. Coconnier, M.F. Bernet, S. Kerneis, G. Chauviere, J. Fourniat and A.L. Servin, Ferns Microbiology Letters, 1993, 110, 299-305.
58. P. Harve y, T. Battle and S. Leach, Journal of Medical Microbiology, 1999, 48, 461-469.
59. J. Kim, M. Hegde and A. Jayaraman, Lab on a Chip, 2010, 10, 43-50.
60. G. Zoumpopoulou, E. Tsakalidou, J. Dewulf, B. Pot and C. Grangette, International Journal of Food Microbiology, 2009, 131, 40-51.
61. M. Moussavi and M.C. Adams, Current Microbiology, 2010, 60, 327-335.
62. H. Annuk, J. Shchepetova, T. Kullisaar, E. Songisepp, M. Zilmer and M. Mikelsaar, Journal of Applied Microbiology, 2003, 94, 403-412.
63. J. Shao, L. Wu, J. Wu, Y. Zheng, H. Zhao, Q. Jin and J. Zhao, Lab Chip, 2009, 9, 3118-3125.
64. E.S. Kaneshiro, M.A. Wyder, Y.P. Wu and M.T. Cushion, Journal of Microbiological Methods, 1993, 17, 1-16.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДВОЙНЫЕ ТРУБЧАТЫЕ СТРУКТУРЫ | 2017 |
|
RU2756404C1 |
| ТЕРАПЕВТИЧЕСКИЕ МИКРОВЕЗИКУЛЫ, ПОЛУЧЕННЫЕ ИЗ ПРОБИОТИЧЕСКИХ БАКТЕРИЙ | 2020 |
|
RU2836904C2 |
| МУЛЬТИОРГАННЫЙ ЧИП С УЛУЧШЕННОЙ ДОЛГОВЕЧНОСТЬЮ И ГОМЕОСТАЗОМ | 2013 |
|
RU2630667C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОЧНОЙ МОДЕЛИ ДЛЯ ИССЛЕДОВАНИЯ ВИРУСА SARS-CoV-2 | 2020 |
|
RU2730250C2 |
| ИЗМЕРЕНИЯ БАРЬЕРНОЙ ФУНКЦИИ | 2016 |
|
RU2752085C2 |
| УСТРОЙСТВО ДЛЯ ФОРМИРОВАНИЯ ДВУХСЛОЙНОЙ КЛЕТОЧНОЙ МОДЕЛИ | 2017 |
|
RU2668157C1 |
| Искусственный эквивалент мембраны круглого окна человека (варианты) | 2023 |
|
RU2823351C1 |
| Способ создания искусственного эквивалента мембраны круглого окна человека | 2023 |
|
RU2808599C1 |
| ВЕЩЕСТВА И СПОСОБЫ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ОПОСРЕДОВАННЫХ МИКРООРГАНИЗМАМИ ЭПИТЕЛИАЛЬНЫХ НАРУШЕНИЙ | 2002 |
|
RU2346694C2 |
| СПОСОБ ПРИГОТОВЛЕНИЯ БИОМАССЫ, СОДЕРЖАЩЕЙ ПЛАНТАРИЦИН, И ЕЕ ПРИМЕНЕНИЕ В МЕДИЦИНСКИХ ЦЕЛЯХ | 2011 |
|
RU2566999C2 |
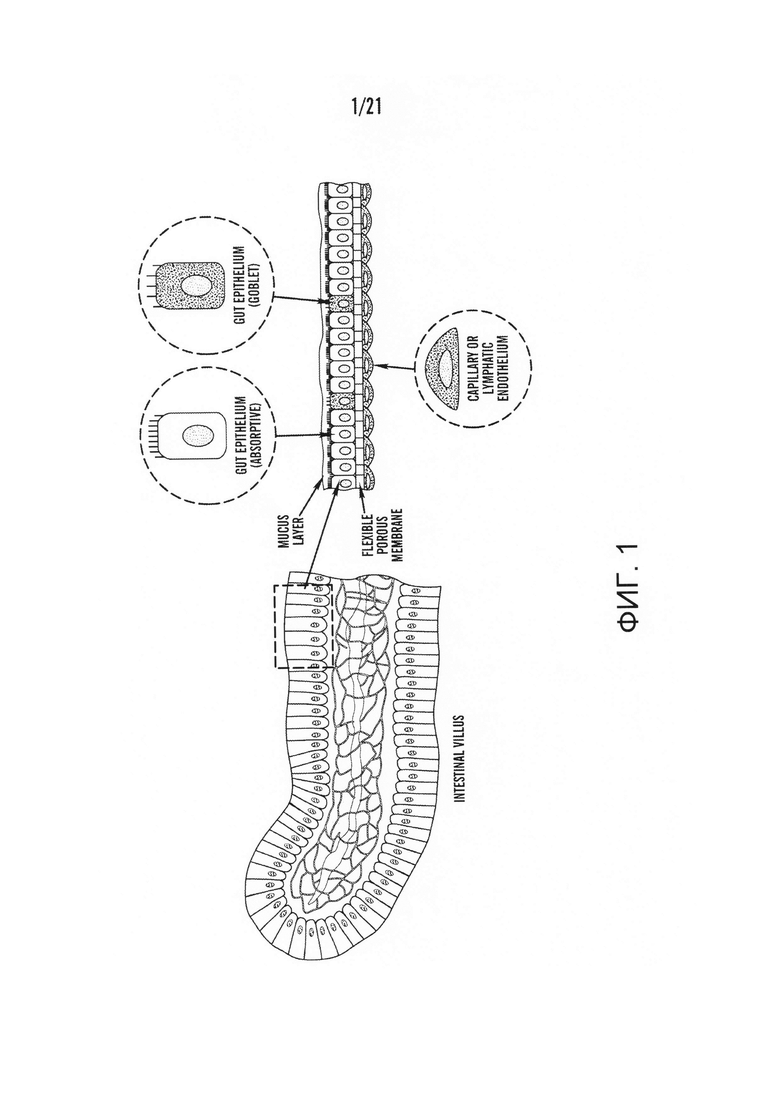
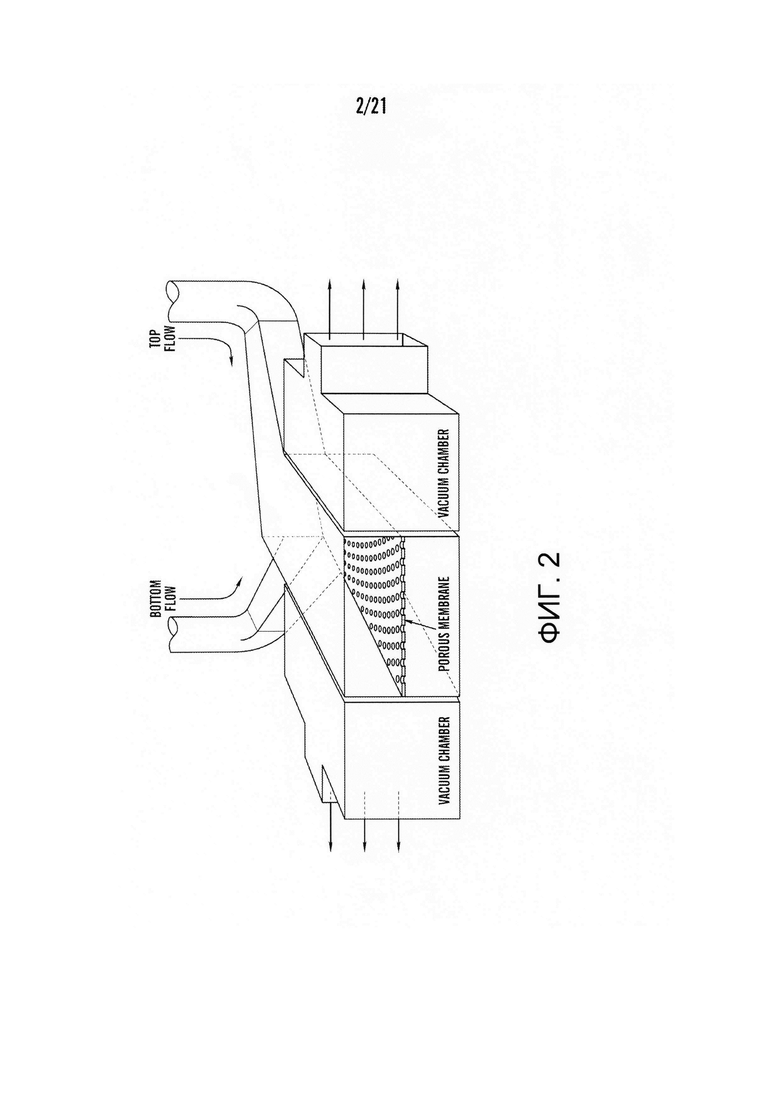
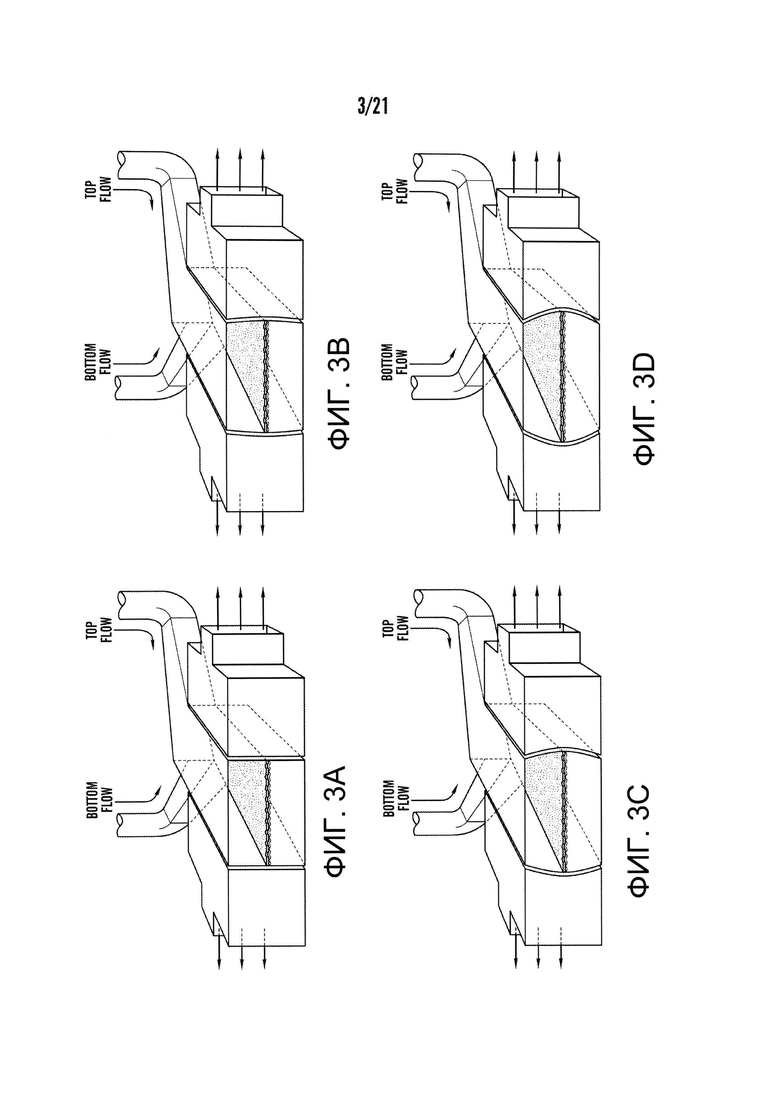

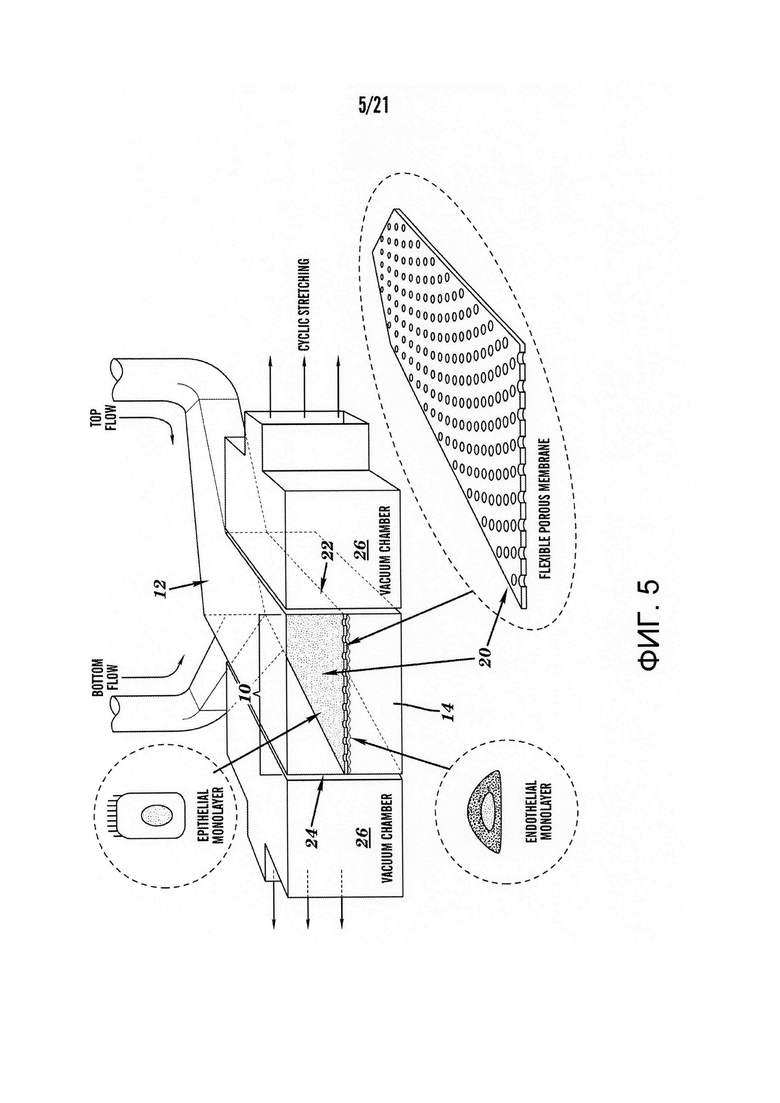
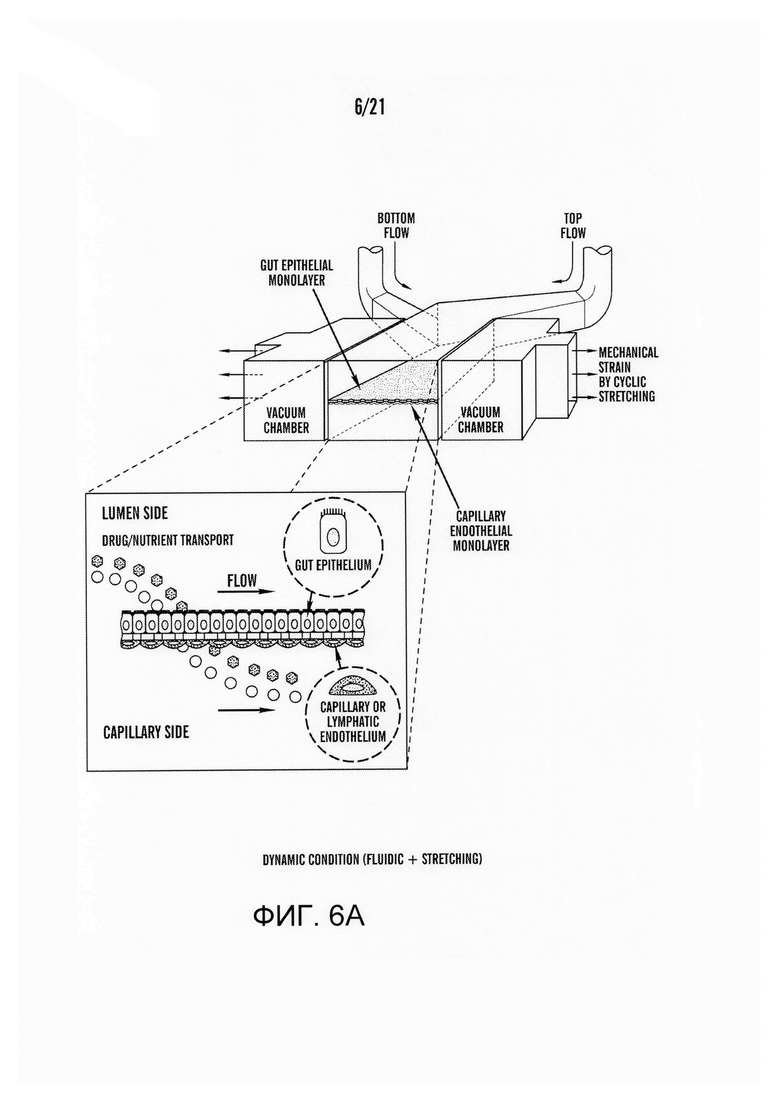

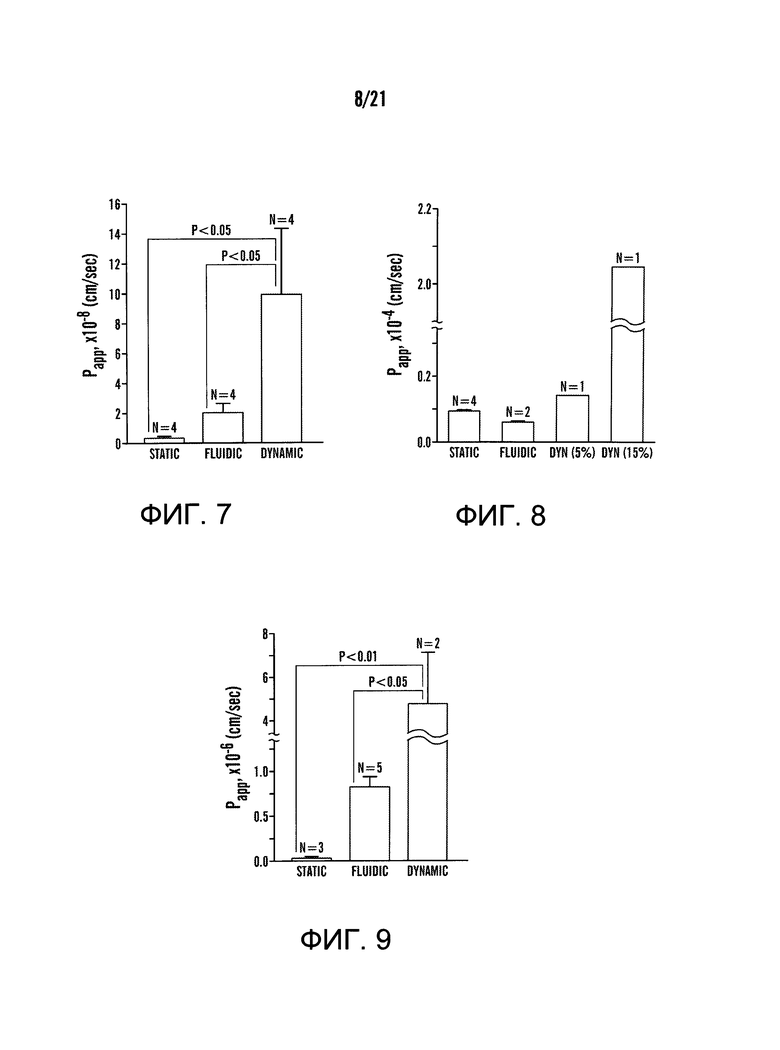
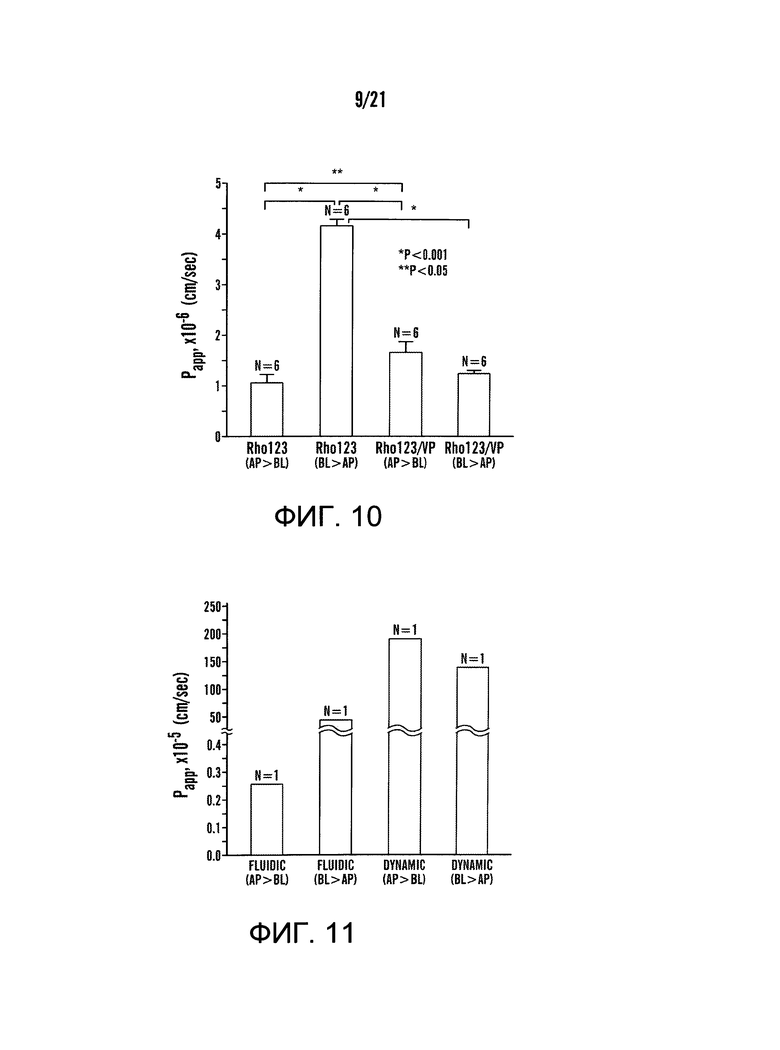
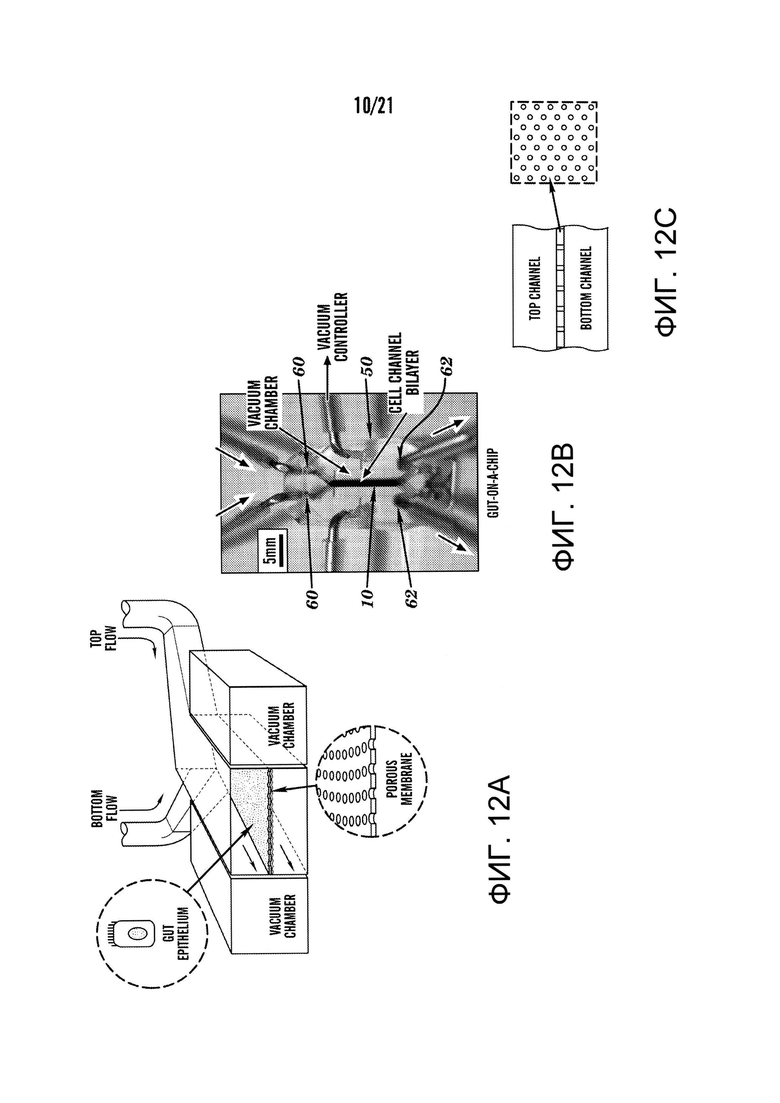
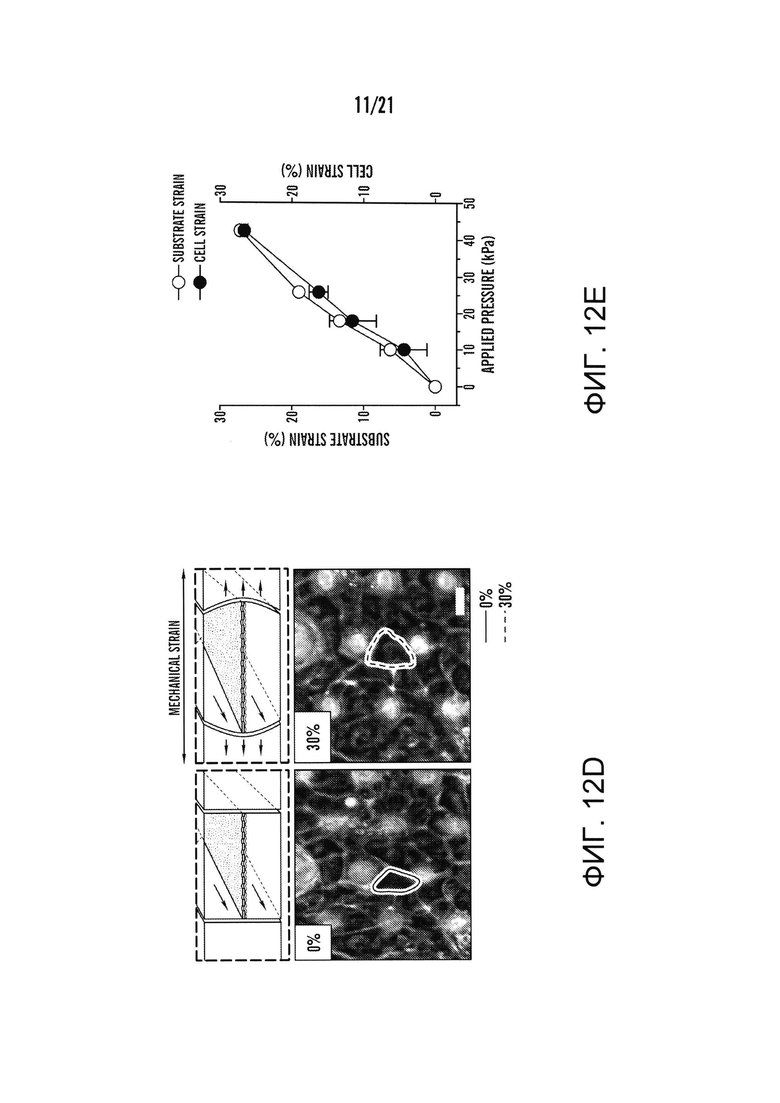
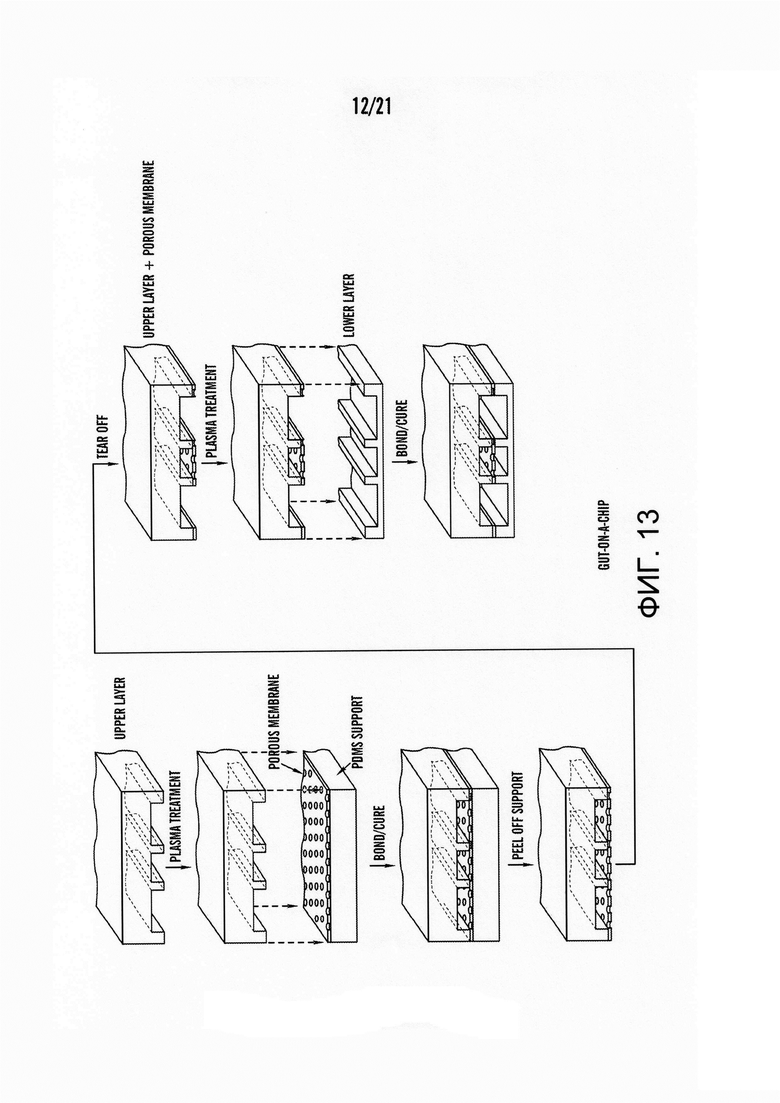


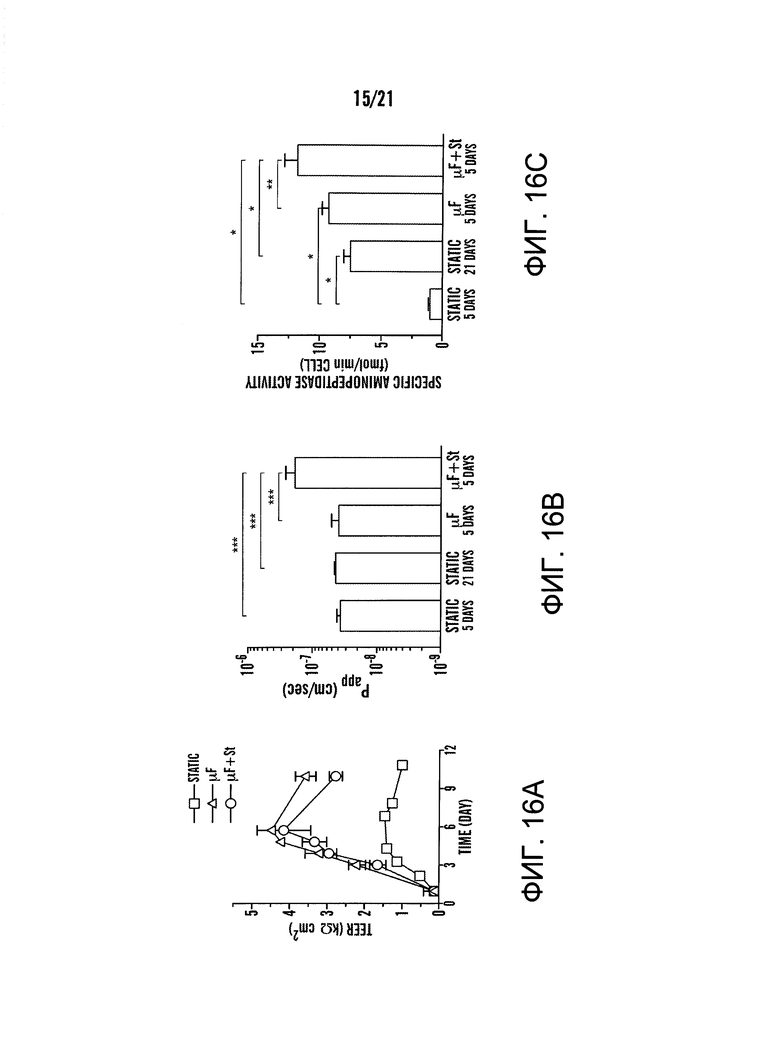
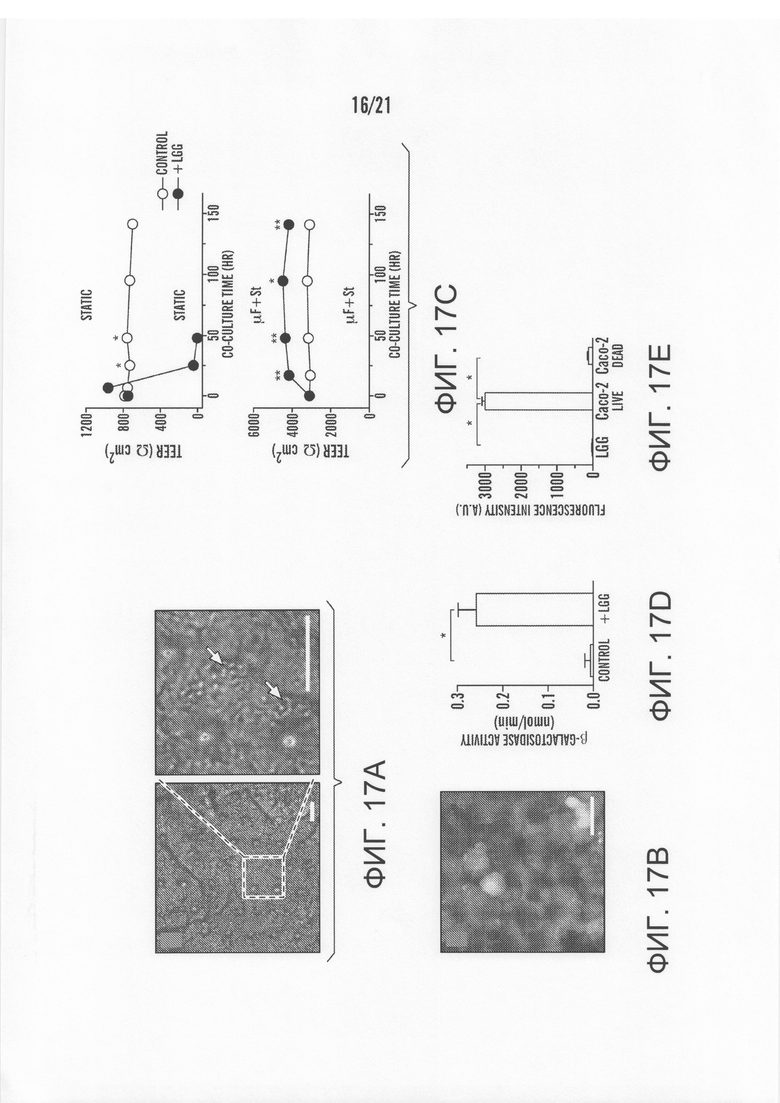

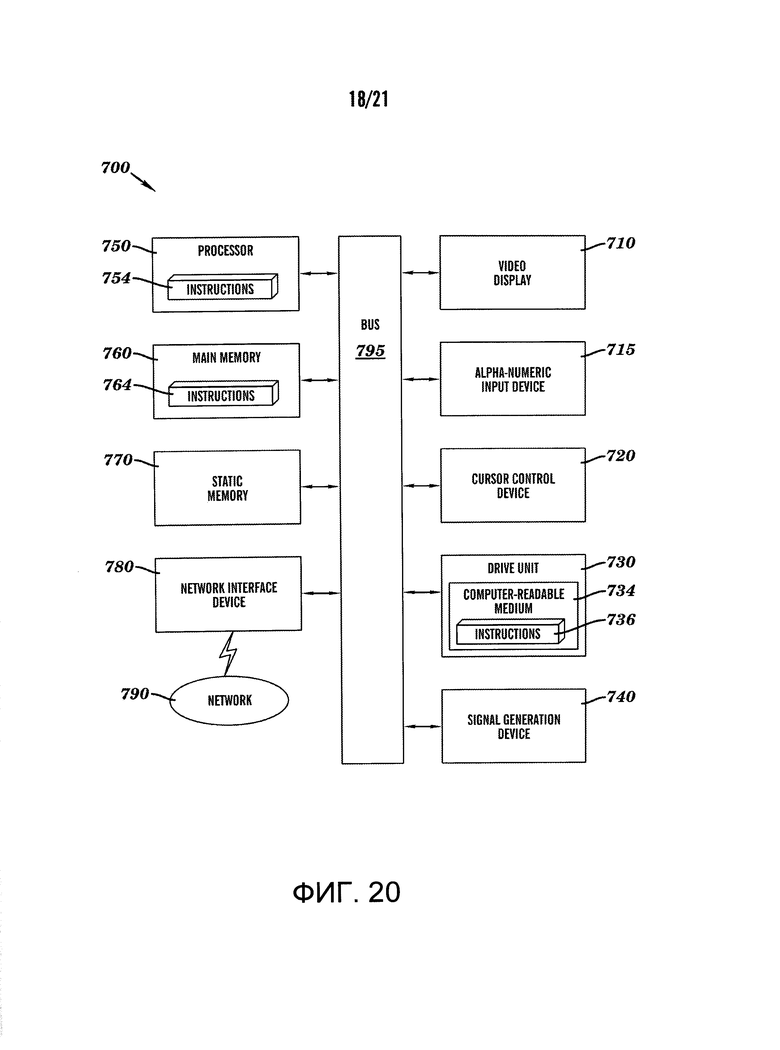
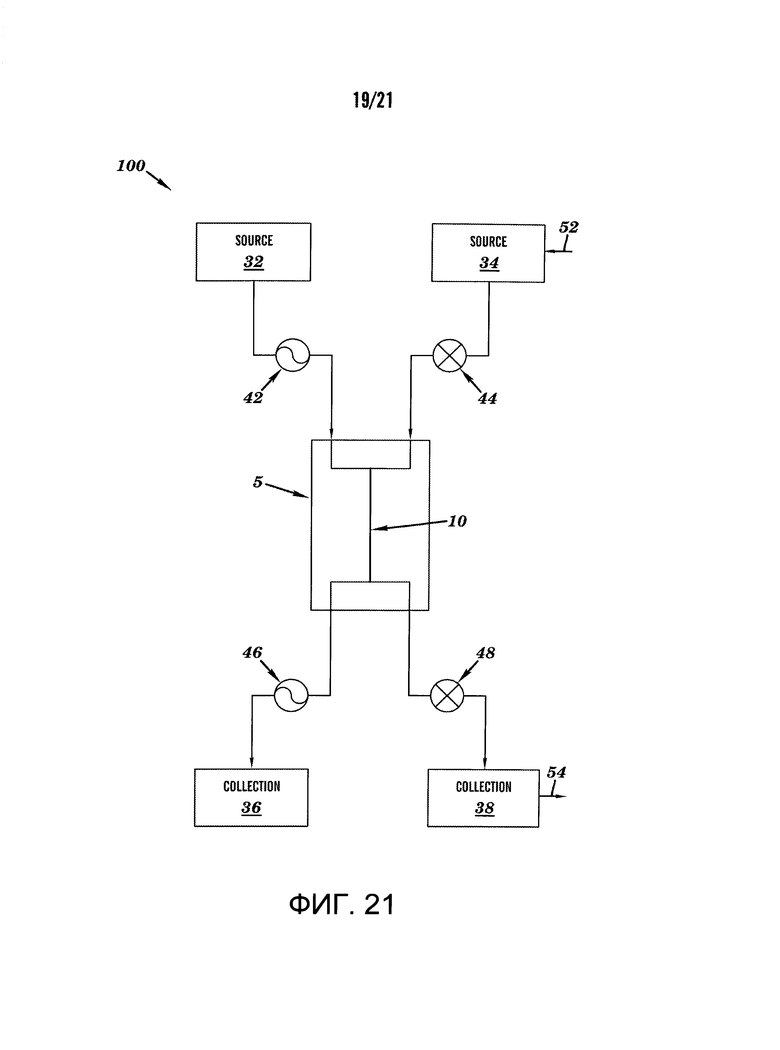

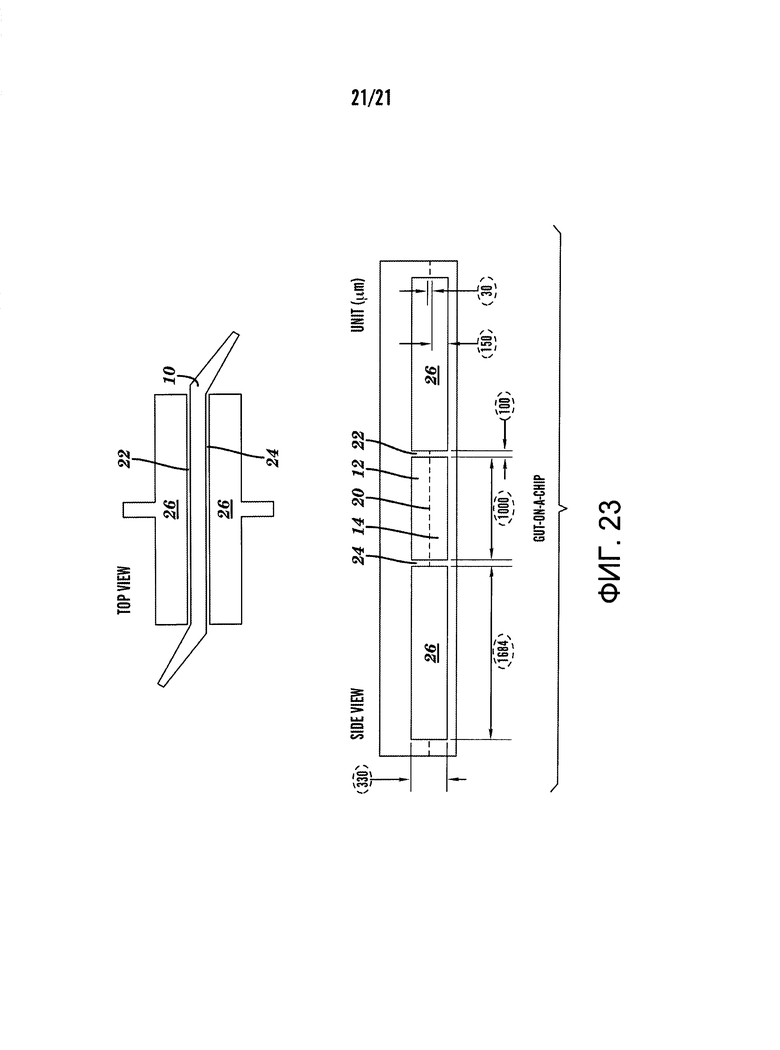
Группа изобретений относится к области биохимии. Предложена система культивирования клеток, система для оценки эффекторных агентов кишечника, содержащая систему культивирования клеток, также предложены способы культивирования клеток, получения кишечного органоида и оценки лечения эффекторных агентов кишечника. Система культивирования клеток содержит устройство с жидкостным каналом, источник жидкости, мембрану в канале, эпителиальные клетки кишечника на поверхности мембраны и прилипшие к клеткам кишечника бактериальные клетки. Способ культивирования клеток включает обеспечение устройства эпителиальными клетками кишечника и бактериальными клетками, снабжение его культуральной средой при скорости потока, достаточной для очистки от органических кислот и несвязанных бактериальных клеток. Способ получения кишечного органоида включает подачу культуральной среды в систему и культивирование эпителиальных клеток кишечника и бактериальных клеток in vitro. Способ оценки лечения кишечника включает контактирование эпителиальных клеток кишечника или бактериальных клеток в системе с предполагаемым эффекторным агентом кишечника и измерение отклика клеток. Изобретение обеспечивает развитие in vitro модели, имитирующей механические, структурные, поглощающие, транспортные и патофизиологические свойства кишечника. 5 н. и 36 з.п. ф-лы, 23 ил., 1 табл.
1. Система культивирования клеток, содержащая:
жидкостное устройство, имеющее жидкостной канал, соединенный с источником жидкости, снабжающим жидкостной канал культуральной средой;
мембрану, расположенную в жидкостном канале между опорными элементами мембраны;
эпителиальные клетки кишечника, прикрепленные по меньшей мере к одной поверхности мембраны, и
жизнеспособные бактериальные клетки, по меньшей мере часть которых прилипает к указанным жизнеспособным эпителиальным клеткам так, чтобы создавалась совместная культура, где более 95% эпителиальных клеток кишечника являются жизнеспособными после по меньшей мере 48 часов совместного культивирования с бактериальными клетками; и
где культуральная среда подается при скорости потока, достаточной для того, чтобы вызвать очистку от органических кислот и несвязанных бактериальных клеток.
2. Система по п. 1, где
по меньшей мере часть мембраны является гибкой; и
где система дополнительно содержит механизм деформации мембраны, где механизм деформации мембраны:
соединен с опорными элементами мембраны и
выполнен с возможностью растяжения мембраны вдоль по меньшей мере одного измерения мембраны путем перемещения или изгибания опорных элементов мембраны с помощью:
вакуумного давления, жидкостного давления, связанного с насосом или плунжером, или действием соленоида.
3. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны на от 0% до 50%.
4. Система по п. 2, механизм деформации мембраны выполнен с возможностью растяжения мембраны на от 5% до 15%.
5. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны приблизительно на 10%.
6. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны более чем на 15%, создавая аномальное состояние эпителиальных клеток кишечника.
7. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны циклическим образом при частоте в диапазоне от 0,01 Гц до 2 Гц.
8. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны циклическим образом при частоте в диапазоне от 0,05 Гц до 0,25 Гц.
9. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны циклическим образом при частоте 0,15 Гц.
10. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны циклическим образом при частоте более чем 0,2 Гц, создавая аномальное состояние эпителиальных клеток кишечника.
11. Система по п. 2, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны нерегулярным или прерывистым образом.
12. Система по любому из пп. 1, 2, в которой культуральная среда протекает через жидкостной канал со скоростью потока менее чем 500 мкл/ч.
13. Система по любому из пп. 1, 2, в которой культуральная среда протекает через жидкостной канал со скоростью потока менее чем 100 мкл/ч.
14. Система по любому из пп. 1, 2, в которой культуральная среда протекает через жидкостной канал со скоростью потока от 0 до 50 мкл/ч.
15. Система по любому из пп. 1, 2, в которой культуральная среда протекает через жидкостной канал со скоростью потока приблизительно 30 мкл/ч.
16. Система по любому из пп. 1, 2, дополнительно содержащая по меньшей мере один тип молекулы присоединения, которая способствует адгезии эпителиальных клеток кишечника, покрывающих по меньшей мере одну сторону мембраны.
17. Система по п. 16, в которой по меньшей мере одна молекула присоединения выбрана из группы, состоящей из:
коллагена; коллагена I типа; MATRIGEL™; внеклеточного матрикса; ламинина; протеогликана; витронектина; фибронектина; поли-D-лизина; полипептидов; олигонуклеотидов; ДНК и полисахарида.
18. Система по любому из пп. 1, 2, 17, в которой эпителиальные клетки кишечника являются клетками млекопитающего или человека.
19. Система по любому из пп. 1, 2, 17, в которой эпителиальные клетки кишечника выбраны из группы, состоящей из:
Сасо-2 клеток; НТ-29 клеток; первичных эпителиальных клеток тонкого кишечника; первичных эпителиальных клеток толстого кишечника; IPS клеток; ESC клеток; стволовых клеток; клеток Панета; клеток крипты и секретирующих слизь клеток.
20. Система по любому из пп. 1, 2, 17, где система дополнительно содержит по меньшей мере один слой эндотелиальных клеток по меньшей мере на второй поверхности мембраны.
21. Система по любому из пп. 1, 2, 17, в которой мембрана расположена так, что она разделяет жидкостной канал на первый клеточно-культуральный канал и второй клеточно-культуральный канал.
22. Система по п. 21, в которой первый клеточно-культуральный канал содержит эпителиальные клетки кишечника и указанные бактериальные клетки.
23. Система по п. 21, в которой второй клеточно-жидкостной канал содержит клетки, выбранные из группы, состоящей из:
эндотелиальных клеток, иммунных клеток и клеток соединительной ткани.
24. Система по любому из пп. 1, 2, 17, 22, 23, в которой бактериальные клетки выбраны из группы, состоящей из:
Lactobacillus; Bactericides; Ruminococcus; Peptococcus; Peptostreptococcus; Bifidobacterium; Escherichia; Achromobacter; Acidaminococcus fermentans; Acinetobacter cacoaceticus; Aeromonas; Alcaligenes faecalis; Bacillus; Butyriviberio fibrosolvens; Camplyobacter; Campylobacter coli; Clostridium difficile; Clostridium sordelli; Enterobacter cloacae; Enterococcus faecalis; Enterococcus faecium; Escherichia coli; Flavobacterium; Mycobacterium; Mycoplasma; Plesiomonas shigelloides; Propionibacterium acnes; Pseudomonas aeruginosa; Ruminococcus bromii; Sarcina; Staphylococcus aureus; Streptococcus anginosus; Veillonella; Vibrio; Yersinia enterocolitica; Lactobacillus rhamnosus; Lactobacillus rhamnosus GG; Bifidobacterium breve; Bifidobacterium longum; Bifidobacterium infantis; Lactobacillus acidophilus; Lactobacillus plantarum; Lactobacillus paracasei; Lactobacillus bulgaricus и Streptococcus thermophilus.
25. Система по любому из пп. 1, 2, 17, 22, 23, в которой бактериальные клетки являются аэробными.
26. Система по любому из пп. 1, 2, 17, 22, 23, в которой бактериальные клетки являются анаэробными.
27. Система по любому из пп. 1, 2, 17, 22, 23, где система содержит как аэробные, так и анаэробные бактериальные клетки.
28. Система по любому из пп. 1, 2, 17, 22, 23, в которой мембрана по меньшей мере частично пористая.
29. Система по п. 28, в которой по меньшей мере одно отверстие поры в мембране составляет от 0,5 мкм до 10 мкм в ширину.
30. Система по любому из пп. 1, 2, 17, 22, 23, 29, в которой мембрана изготовлена из полидиметилсилоксана.
31. Система по любому из пп. 2, 17, 22, 23, 29, в которой механизм деформации мембраны выполнен с возможностью растяжения мембраны с помощью вакуумного давления.
32. Система по п. 31, где система дополнительно содержит:
первую стенку камеры жидкостного устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где мембрана прикреплена к первой стенке камеры;
первый рабочий канал, смежный по меньшей мере с одним жидкостным каналом на противоположенной стороне первой стенки камеры, где перепад давления между первым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание первой стенки камеры в первом требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной; и
вакуумную систему, обеспечивающую перепад давления между по меньшей мере одним жидкостным каналом и по меньшей мере одним из рабочих каналов, где мембрана растягивается вдоль плоскости в ответ на перепад давления.
33. Система по п. 32, дополнительно содержащая:
вторую стенку камеры жидкостного устройства, расположенную смежно по меньшей мере с одним жидкостным каналом, где противоположный край мембраны прикреплен ко второй стенке камеры; и
второй рабочий канал, расположенный смежно по меньшей мере с одним жидкостным каналом на противоположенной стороне второй стенки камеры, где перепад давления между вторым рабочим каналом и по меньшей мере одним жидкостным каналом вызывает сгибание второй стенки камеры во втором требуемом направлении, обеспечивая растяжение или сокращение вдоль плоскости, определяемой мембраной.
34. Система по любому из пп. 1, 2, 17, 22, 23, 32, 33, в которой жидкостное устройство содержит микрожидкостное устройство.
35. Система по любому из пп. 1, 2, 17, 22, 23, 32, 33, в которой система прикреплена или соединена со второй системой культивирования клеток, содержащей клетки или ткань некишечного происхождения.
36. Система по п. 35, где вторая система культивирования клеток содержит клетки или ткань печени.
37. Способ получения кишечного органоида, включающий:
предоставление культуральной среды для поддержания эпителиальных клеток кишечника и бактериальных клеток в систему культивирования клеток по любому из пп. 1-36 таким образом, что культуральная среда соприкасается с эпителиальными клетками кишечника и бактериальными клетками;
и культивирование эпителиальных клеток кишечника и бактериальных клеток in vitro в течение по меньшей мере 48 часов.
38. Способ по п. 37, дополнительно включающий культивирование клеток по меньшей мере до тех пор, пока обнаруживаются структуры ворсинок.
39. Система для оценки эффекторных агентов кишечника, содержащая систему культивирования клеток по любому из пп. 1-36.
40. Способ оценки лечения кишечника, включающий контактирование эпителиальных клеток кишечника или бактериальных клеток системы по любому из пп. 1-36 по меньшей мере с одним предполагаемым эффекторным агентом кишечника; и измерение отклика клеток в системе для определения эффекта по меньшей мере одного предполагаемого эффекторного агента кишечника.
41. Способ культивирования клеток, содержащий:
а) обеспечение жидкостного устройства, имеющего жидкостной канал, соединенный с источником жидкости, источник жидкости снабжает жидкостной канал культуральной средой; указанное жидкостное устройство содержит более 95% жизнеспособных эпителиальных клеток кишечника и жизнеспособных бактериальных клеток после по меньшей мере 48 часов совместного культивирования, где по меньшей мере часть бактериальных клеток прилипает к указанным жизнеспособным эпителиальным клеткам кишечника так, чтобы создавалась совместная культура; и
b) снабжение культуральной средой при скорости потока, достаточной для того, чтобы вызвать очистку от органических кислот и несвязанных бактериальных клеток.
| WO 2010009307 A2, 21.01.2010 | |||
| Kim J., Hegde M., Jayaraman A | |||
| AND ET AL., Microfluidic Co-culture of Epithelial Cells and Bacteria for Investigating Soluble Signal-mediated Interactions // Journal of Visualized Experiments, 2010, реферат | |||
| US 20100041128 A1, 18.02.2010 | |||
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК БЕЗ КОМПОНЕНТОВ ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2004 |
|
RU2369634C2 |
Авторы
Даты
2017-03-13—Публикация
2012-02-28—Подача