Изобретение относится к биомедицине, может применяться при тестировании физиотерапевтических вмешательств, проведении доклинических испытаний, сокращая при этом использование животных. Изобретение может быть использовано в фундаментальных биологических и биомедицинских исследованиях, в том числе: при создании полупроницаемых мембран, содержащих в своем составе живые клетки и используемых для изучения проницаемости для различных растворенных веществ через полупроницаемые биологические мембраны, а также для изучения жизнеспособности клеток, включаемых в состав таких эквивалентов.
Мембрана круглого окна (далее МКО) служит барьером между полостью среднего уха и улиткой и играет важную роль в механике среднего уха и улитки в нормальных и больных ушах (Paparella, 1983; Nordang, 2001). Мембрана круглого окна считается основным путем проникновения потенциально ототоксичных веществ из полости среднего уха во внутреннее ухо.
У человека и большинства животных МКО состоит из трех слоев: наружного эпителия, обращенного к среднему уху, слоя соединительной ткани и внутреннего эпителия, примыкающего к внутреннему уху. Слой соединительной ткани содержит коллагеновые волокна, другие эластические волокна и фибробласты, все это обеспечивает основную структурную поддержку мембраны. Средняя толщина МКО человека составляет примерно 70-100 мкм (Goycoolea and Lundman, 1997).
Известны способы создания модели МКО человека изолированные участки улитки уха с круглым окном некоторых модельных животных: МКО монгольской песчанки (Lundman LA, 1987); морской свинки (Gan RZ, 2013); шиншиллы (Keskin Yilmaz N.,2021); овцы (Han S., 2021). Способы заключаются в том, что у лабораторных животных, после их умертвления хирургическими методами изымают участки улитки уха вместе с МКО, которую впоследствии используют в качестве модели человеческой мембраны и проверяют на них способы доставки лекарственных средств через мембрану. Недостатком всех этих перечисленных способов является то, что в качестве модели берут убитую ткань животных и такая модель не будет соответствовать критерию жизнеспособности входящих в ее состав клеток. Также, к недостаткам следует отнести тот факт, что ни одна из МКО животных не соответствует по своему строению МКО человека: они отличаются по толщине и плотности, например, МКО грызунов, таких как крыса, шиншилла, морская свинка, намного тоньше, чем у человека, средняя их толщина составляет 11,5 мкм.
Известно устройство для проверки проницаемости разделительной мембраны круглого окна (CN 201373874Y, S.J. Liu Ya, 2009), которое представляет собой устройство, состоящее из двух камер (подающей и принимающей) изготовленных из стекломатериалов и полистирола, между которыми специальным образом зажимается фрагмент биологической ткани, изъятой хирургическим путем у животных или у человека, и призванное собирать для анализа в принимающей камере прошедшие через ткань из подающей камеры растворы различных веществ. Недостатками устройства являются отсутствие возможности использовать его в испытаниях электрофизических установок, разрабатываемых для лечения заболеваний среднего уха, отсутствие в его конструкции биологической мембраны с заданными свойствами и с живыми клетками в своем составе, которую можно охарактеризовать после проведения эксперимента и выявлять в ее составе процент живых клеток.
Задачей настоящего изобретения было создать эквивалент мембраны круглого окна, морфологически близкий к оригиналу мембраны круглого окна человека.
Технический результат - создан живой эквивалент мембраны круглого окна (варианты), который соответствует человеческой мембране круглого окна по толщине клеточного слоя, структуре и проницаемости.
Технический результат достигается тем, что в качестве матрицы-основы была использована коллагеновая мембрана с повышенными прочностными характеристиками коллагенового биоматериала. Для ее изготовления используют высокие концентрации коллагена, получая в результате стабильные и прочные коллагеновые мембраны. В основе подхода лежит запатентованная масштабируемая технология получения стерильного концентрированного раствора биосовместимого коллагена (коллаген Viscoll®). Данная мембрана не цитотоксична, что позволяет выращивать на ней живые клетки. Использованная в описываемом способе мембрана имеет толщину 100±20 мкм, что соответствует толщине нативной МКО человека. Это позволяет создавать модели, близкие по своим физическим и биологическим свойствам к нативным МКО человека.
Технический результат достигается тем, что для воссоздания живого эпителиального барьера МКО использовали культивирование на поверхности мембраны эпителиальных клеток человека линии НаСаТ иммортализованные кератиноциты человека. Эпителиальные клетки имеют плотные контакты, как с базальной мембраной, так и между собой. Использование указанной линии эпителиальных клеток в качестве компонента эквивалента МКО позволяет не только получить структуру морфологически близкую к оригиналу, но еще обладает такими преимуществами, как легкодоступность, относительная дешевизна и простота в выращивании. Эта линия, несмотря на ее «бессмертность», сохранила все основные признаки нормального эпидермиса, способно образовывать эпителиальные пласты из клеток, соединенных плотными контактами, полную способность к дифференцировке и отсутствие канцерогенности. Также технический результат достигается тем, что были использованы стромальные клетки - фибробласты человека. Данные клетки играют поддерживающую роль в формировании эпителиальными клетками плотного эпителиального слоя на поверхности мембраны с плотными межклеточными контактами, препятствующими свободной диффузии через МКО растворенных лекарственных и токсических веществ. Кроме того, данные клетки активно секретируют элементы внеклеточного матрикса, обеспечивая гистотипический рост эпителия в составе разрабатываемой модели.
Изобретение поясняется иллюстрациями.
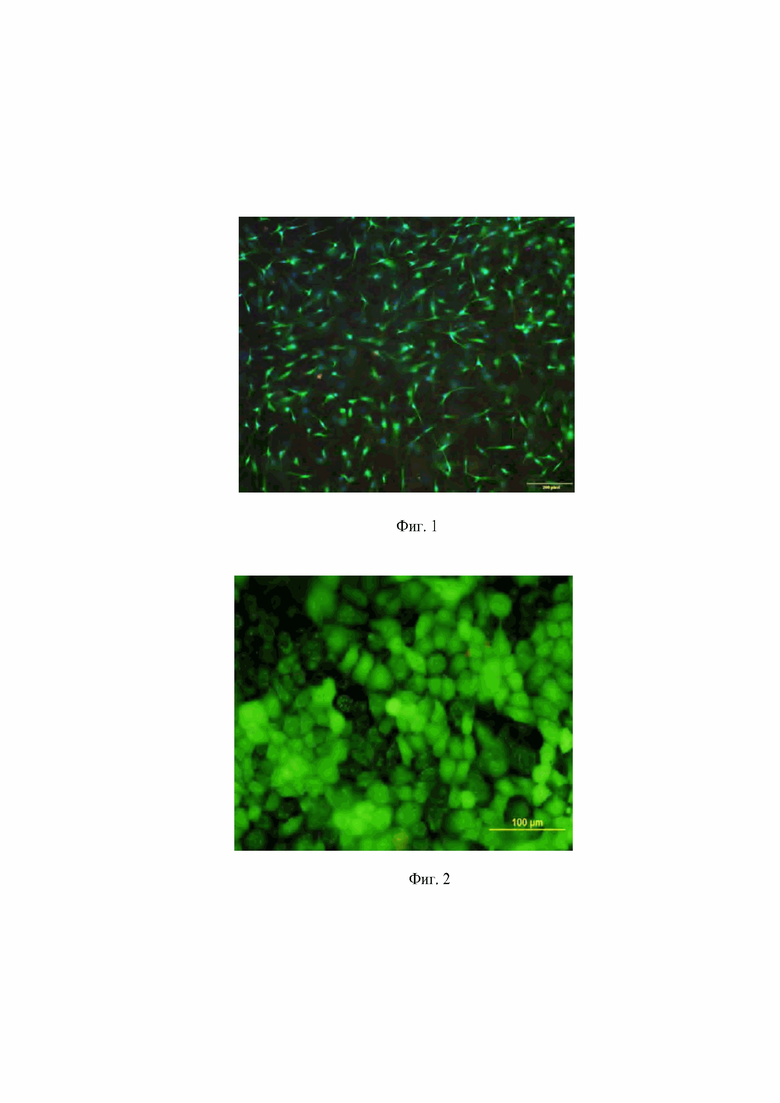
Фигура 1. Фибробласты человека после 3 суток культивирования на поверхности коллагеновой мембраны. Окраска - витальным флуоресцентным красителем кальцеином (CalceinAM, зеленое окрашивание).
Фигура 2. Клетки человека (кератиноциты линии НаСаТ) после 3 суток культивирования на поверхности коллагеновой мембраны. Окраска - витальным флуоресцентным красителем кальцеином (CalceinAM, зеленое окрашивание).
Фигура 3. Гистологический препарат, поперечный срез эквивалента МКО. Окраска гематоксилин-эозином. 1 - слой клеток, 2 - коллагеновая мембрана, 3-100 мкм.
Фигура 4. Схема экспериментов по выявлению функциональной активности эквивалента МКО.
А - вариант 1: 4 - уровень среды, 5 - вставка системы Transwell с мембраной, 6 - коллагеновая мембрана, 7 - клетки HaCat.
Б - вариант 2: 4 - уровень среды, 5 - вставка системы Transwell с мембраной, 6 - коллагеновая мембрана, 7 - клетки HaCat, 8 - клетки фибробластов человека.
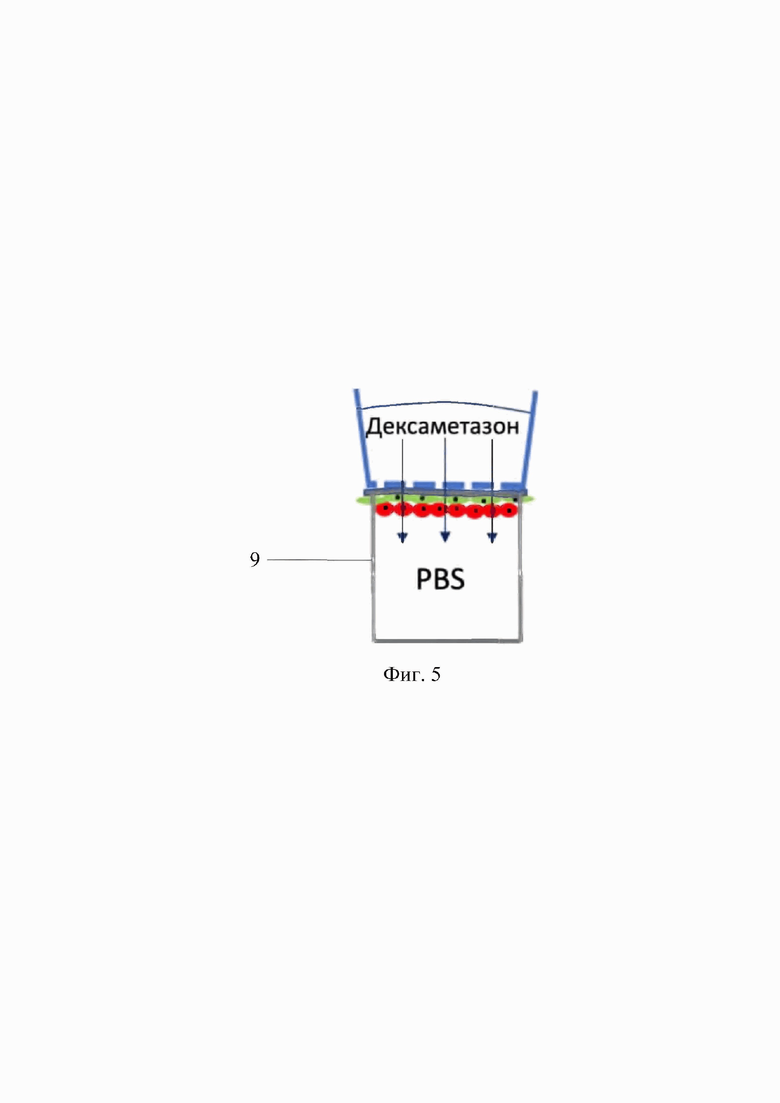
Фигура 5. Схема эксперимента с пассивной диффузией дексаметазона через эквивалент МКО. 9 - лунка 96-луночного планшета.
Фигура 6. Гистограмма, демонстрирующая остаточную концентрацию дексаметазона после прохождения через эквивалент МКО путем пассивной диффузии (мембрана - контроль без клеточного материала).
Осуществление изобретения.
Способ создания искусственного эквивалента мембраны круглого окна, который по толщине клеточного слоя, структуре и проницаемости соответствует мембране круглого окна человека, включает следующие этапы:
Этап 1. Коллагеновую мембрану в форме диска диаметром 1,6±0,1 см и толщиной 100±20 мкм (Viscoll ИМТЕК, Россия или аналогичные по свойствам и составу) в условиях стерильного бокса помещают в лунки 6-луночного планшета (пр-во Costar или аналогичный). Мембраны заливают 2 мл питательной среды DMEM/F12 (пр-во ПанЭко или аналогичной) и оставляют на 20 минут для набухания, после чего среду удаляют пипеткой.
Этап 2. Дермальные фибробласты человека, культивируемые стандартным способом, снимают с поверхности культуральных флаконов растворами Версена и трипсина (ПанЭко или аналогичными), тщательно ресуспендируют для получения однородной одноклеточной суспензии, после чего клетки высевают в количестве 30000-50000 клеток на поверхность мембраны, подготовленной на этапе 1, в 100 мкл питательной среды следующего состава: среда DMEM/F12 - 89%, эмбриональная бычья сыворотка (Hyclon, США или аналогичная) 10%, Glutamax (Gibco, США или аналогичный) - 1%.
Этап 3. Клетки линии НаСаТ, культивируемые стандартным способом, снимают с поверхности культуральных флаконов растворами Версена и трипсина (ПанЭко или аналогичными), тщательно ресуспендируют для получения однородной одноклеточной суспензии, после чего клетки высевают в количестве 100000 клеток на подготовленную мембрану на этапе 1 (вариант 1) или на подготовленную мембрану с фибробластами на этапе 2 (вариант 2).
Этап 4. Полученную на этапе 3 мембрану культивируют на среде DMEM/F12 (ПанЭко или аналогичной) - 89%, эмбриональная бычья сыворотка (Hyclon, США или аналогичная) 10% Glutamax (Gibco, США или аналогичный) - 1%, в условиях СО2-инкубатора. Замену питательной среды осуществляют каждые 2-3 суток. Через 5-7 суток культивирования на поверхности мембран клетки формируют плотный эпителиальный слой. После его формирования эквивалент МКО (вариант 1 или вариант 2) считают готовым к проведению тестирований.
В результате осуществления способа получен искусственный эквивалент мембраны круглого окна, который по толщине клеточного слоя, структуре и проницаемости соответствует мембране круглого окна человека, и представляет собой коллагеновую мембрану в виде диска диаметром 1,6±0,1 см и толщиной 100±20 мкм с живым эпителиальным слоем на ее поверхности, который образован или клетками-кератиноцитами человека линии НаСаТ (вариант 1), или клетками-кератиноцитами человека линии НаСаТ и стромальным компонентом - дермальными фибробластами человека (вариант 2).
Полученные эквиваленты МКО (вариант 1 и 2) необходимо использовать в течение двух недель, пока клетки в их составе остаются живыми. В течение указанного срока эквиваленты МКО находятся в условиях СО2-инкубатора при 37°С в культуральной среде.
Примеры осуществления способа.
Пример 1. Проверка на цитотоксичность и адгезивность коллагеновой мембраны по отношению к культуре клеток человека и жизнеспособность клеточного материала.
Для оценки токсичности и адгезивности коллагеновой мембраны в культуральные лунки диаметром 3 см, содержащие: среда DMEM/F12 - 89%, эмбриональная бычья сыворотка (Hyclon, США) 1%, Glutamax (Gibco, США) и образец мембраны - Viscoll (ИМТЕК, Россия) - диск диаметром 1,6±0,1 см и толщиной 100±20 мкм, размещенный на дне лунок, были посеяны фибробласты кожи человека (Fb d75) в количестве 100 тыс. клеток на лунку. Клетки в присутствии мембраны культивировали в условиях СО2-инкубатора в течение 3 суток.
При визуальном осмотре было выявлено, что клетки в присутствии мембраны нормально прикреплялись к дну культуральной лунки в течение 4 часов после посева и проявляли нормальный физиологический фенотип - веретенообразную форму. К поверхности мембраны клетки активно прикреплялись.
Через 3 суток культивирования клетки фибробласты образовали конфлуентный слой (фиг. 1). Окраска - витальным флуоресцентным красителем кальцеином (CalceinAM, зеленое окрашивание).
Исходя из полученных результатов, мы оценили цитотоксичность мембраны Viscoll как низкую - фибробласты выживают и активно пролифирируют в непосредственном контакте с мембраной. Адгезивные свойства высокие.
Так же мы протестировали мембрану в культурах иммортализованных клеток человека линии HaCat. Было выявлено, что данная клеточная линия хорошо адгезирует к мембране и образует на ней конфлуентный слой (фиг. 2). Окраска - витальным флуоресцентным красителем кальцеином (CalceinAM, зеленое окрашивание).
Пример 2. Оценка гистологической структуры эквивалента МКО.
Мембрану с выращенными на ее поверхности эпителиальными слоями из клеток НаСаТ зафиксировали параформальдегидом, залили парафином и подготовили гистологические срезы. Результат представлен на фиг. 3. Было выявлено, толщина мембраны на срезе не превышает 200 микрон и сопоставима с толщиной МКО человека, структура на срезе выглядит однородно.
Пример 3. Проверка проницаемости эквивалентов МКО при пассивной диффузии раствора дексаметазона.
В целях проверки проницаемости изготовленных согласно заявленному способу эквивалентов МКО при пассивной диффузии дексаметазона была проведена серия экспериментов. Было подготовлено 2 варианта эквивалентов МКО по заявленному способу. Модели готовили на специальных вставках в системе типа Transwell, представляющих собой стерильные пластиковые полые цилиндры с одной стороны закрытые мембраной с порами 0.4 мкм. Цилиндры находились в лунках 24-х луночного планшета (SPL, Китай). На вставки были помещены эквиваленты МКО: в первом варианте модель представляла собой коллагеновую мембрану Viscoll на поверхности которой были посеяны эпителиальные клетки линии НаСаТ, во втором варианте на коллагеновую мембрану сначала сажали фибробласты, а затем эпителиальные клетки линии НаСаТ (фиг. 4А, 4Б).
После того, как на мембранах сформировывался клеточный слой, эквиваленты МКО считали готовыми и приступали к эксперименту по диффузии раствора дексаметазона в концентрации 2 мг/мл, по следующему методу:
мембраны, не отделяя от дна вставки Transwell, изымали из системы культивирования в 24-х планшетах и перемещали на 96-луночный планшет для исследования проницаемости мембран. Для этого нижние лунки 96-луночного планшета заполняли PBS (ПанЭко) - по 300 мкл на лунку, так, чтобы жидкость касалась мембраны, размещенной на поверхности лунок. Сверху каждой такой лунки помещали вставку с эквивалентом МКО таким образом, чтобы образец соприкасался с жидкостью в лунке 96-луночного планшета (фиг. 5). После разведения раствора для инъекций дексаметазона (ООО Эллара, Россия) с концентрацией 4 мг/мл в PBS (ПанЭко) 1:1, полученный раствор заливали во вставки, по 300 мкл на вставку с эквивалентом МКО, обеспечивая таким образом пассивную диффузию через эквивалент МКО (фиг. 4), прижимали вставки к плато крышкой от плато и оставляли на час в инкубаторе. Через час из нижних лунок раствор отбирали и определяли относительную концентрацию дексаметазона. Для определения количества дексаметазона, прошедшего через экспериментальные образцы мембран, использовали высокоточный метод ВЭЖХ (использовали жидкостной хроматограф Agilent 1100, используя аналитическую колонку Thermo GOLD С18 (150×4.6 мм, 5 мкм), элюент состава 35/65 ацетонитрил/вода (HPLC grade), с расходом 1 мл/мин, температура термостата была установлена 25°С, длина волны УФ-детектора установлена на 240 нм). После получения числовых значений с 3 повторов эксперимента высчитывали среднее арифметическое и стандартное отклонение среднего. Оценка значимости при сравнении выборок из значений остаточной относительной концентрации дексаметазона в экспериментальных группах и в 2-х контролях (пустая мембрана без клеток и исходный раствор дексаметазона) (фиг. 6).
После сбора и анализа проб было выявлено, что все варианты эквивалентов МКО являются полупроницаемыми для раствора дексметазона, но при этом выполняют барьерную функцию и пропускают лишь часть вещества: дексаметазон был обнаружен во всех пробах, при этом его концентрация значительно снижалась. Результирующая концентрация дексаметазона составила 13,5% в модели с одной коллагеновой мембраной без клеточного материала (контроль), 5% в эквиваленте МКО с использованием только эпителиальных клеток (вариант 1), 4,5% в эквиваленте МКО с использованием фибробластов и эпителиальных клеток (вариант 2) (фиг. 6). Таким образом, концентрация дексаметазона при прохождении его через полученные эквиваленты МКО вариант 1 и вариант 2 упала в 10-20 раз относительно контроля. Полученные данные соответствуют проницаемости МКО человека (Philip А, 2011), то есть созданный эквивалент МКО (варианты) соответствует принципам биологического подобия с МКО человека.
Таким образом, заявленный способ позволяет создать искусственный эквивалент мембраны круглого окна человека: живые эквиваленты МКО соответствуют толщине клеточного слоя, структуре и проницаемости человеческой МКО.
Литература
• Nordang L, Anniko М. Hearing loss in relation to round window membrane morphology in experimental chronic otitis media. ORL J Otorhinolaryngol Relat Spec. 2001;63(6):333-340.
• Paparella M.M., Schachern P.A., Choo Y.B. The round window membrane: otological observations. Ann Otol Rhinol Laryngol. 1983;92(6 Pt l):629-634.
• Goycoolea M.V., Lundman L. Round window membrane. Structure function and permeability: A review, Microsc Res Tech. 1997;36(3):201-211.
• Lundman L.A., Holmquist L., Bagger-Sjoback D. Round window membrane permeability. An in vitro model. Acta Otolaryngol. 1987 Nov-Dec;l 04(5-6):472-80.
• Gan R.Z., Nakmali D., Zhang X. Dynamic properties of round window membrane in guinea pig otitis media model measured with electromagnetic stimulation. Hear Res. 2013 Jul;301:125-36.
• Keskin Yilmaz N., Albasan H., Borkii M.K., Paparella M.M., Cureoglu S. Three-Dimensional Analysis of Round Window Membrane in the Chinchilla Model with Acute Otitis Media Induced with Streptococcus Pneumoniae 7F. Turk Arch Otorhinolaryngol. 2021 Mar;59(l):43-48.
• Philip A. Bird, Daran P. Murray, Mei Zhang, and Evan J. Begglntratympanic Versus Intravenous Delivery of Dexamethasone and Dexamethasone Sodium Phosphate to Cochlear Perilymph. Otol Neurotol. 2011 Aug; 32(6):933-6. doi: 10.1097/MAO.0b013e3182255933.
| название | год | авторы | номер документа |
|---|---|---|---|
| Искусственный эквивалент мембраны круглого окна человека (варианты) | 2023 |
|
RU2823351C1 |
| Способ пролонгации действия лекарственного препарата при интратимпанальном введении на структуры внутреннего уха | 2020 |
|
RU2749692C1 |
| Хирургический способ лечения хронического полипозного синусита | 2020 |
|
RU2733478C1 |
| Способ получения лимбальных стволовых клеток в коллагеновом гидрогеле | 2023 |
|
RU2809076C1 |
| КЛЕТОЧНЫЙ ПРОДУКТ ИНСУЛИН-ПРОДУЦИРУЮЩИХ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ТЕРАПИИ САХАРНОГО ДИАБЕТА | 2017 |
|
RU2663118C1 |
| Способ лечения узелков голосовых складок у профессиональных вокалистов | 2020 |
|
RU2730940C1 |
| Силиконовый протектор для формирования барабанной полости | 2019 |
|
RU2729433C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С ВЫСОКОАДГЕЗИВНЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2813132C1 |
| КОСТНО-ПЛАСТИЧЕСКИЙ МАТЕРИАЛ С УПРАВЛЯЕМЫМИ СВОЙСТВАМИ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2023 |
|
RU2812733C1 |
| ВНУТРИНОСОВОЙ ТАМПОН ДЛЯ ОСТАНОВКИ НОСОВЫХ КРОВОТЕЧЕНИЙ ПОСЛЕ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ, СПОНТАННЫХ НОСОВЫХ КРОВОТЕЧЕНИЙ В СТАЦИОНАРНЫХ УСЛОВИЯХ | 2019 |
|
RU2722819C1 |



Изобретение относится к биотехнологии, а именно к способу создания искусственного эквивалента мембраны круглого окна, включает следующие этапы: этап 1 - на котором коллагеновую мембрану помещают в лунки 6-луночного планшета, заливают 2 мл питательной среды DMEM/F12 и оставляют на 20 минут для набухания, после чего среду удаляют пипеткой, этап 2 - на котором дермальные фибробласты человека снимают с поверхности культуральных флаконов, ресуспендируют и высевают в количестве 30000-50000 клеток на поверхность мембраны, подготовленной на этапе 1, этап 3 - на котором клетки линии НаСаТ снимают с поверхности культуральных флаконов, ресуспендируют и высевают в количестве 100000 клеток на подготовленную мембрану на этапе 1 или на подготовленную мембрану с фибробластами на этапе 2, этап 4 - на котором мембрану, полученную на этапе 3, культивируют на среде DMEM/F12 - 89%, эмбриональная бычья сыворотка - 10%, Glutamax - 1%, в условиях СО2-инкубатора 5-7 суток. Изобретение может быть использовано для создания живого эквивалента мембраны круглого окна, которое соответствует человеческой мембране круглого окна по толщине клеточного слоя, структуре и проницаемости. 6 ил., 3 пр.
Способ создания искусственного эквивалента мембраны круглого окна, который по толщине клеточного слоя, структуре и проницаемости соответствует мембране круглого окна человека, включающий следующие этапы:
этап 1 - на котором коллагеновую мембрану в форме диска диаметром 1,6±0,1 см и толщиной 100±20 мкм в условиях стерильного бокса помещают в лунки 6-луночного планшета, заливают 2 мл питательной среды DMEM/F12 и оставляют на 20 минут для набухания, после чего среду удаляют пипеткой,
этап 2 - на котором дермальные фибробласты человека, культивируемые стандартным способом, снимают с поверхности культуральных флаконов растворами Версена и трипсина, тщательно ресуспендируют для получения однородной одноклеточной суспензии и высевают в количестве 30000-50000 клеток на поверхность мембраны, подготовленной на этапе 1, в 100 мкл питательной среды следующего состава: среда DMEM/F12 - 89%, эмбриональная бычья сыворотка -10%, Glutamax - 1%,
этап 3 - на котором клетки линии НаСаТ, культивируемые стандартным способом, снимают с поверхности культуральных флаконов растворами Версена и трипсина, тщательно ресуспендируют для получения однородной одноклеточной суспензии и высевают в количестве 100000 клеток на подготовленную мембрану на этапе 1 или на подготовленную мембрану с фибробластами на этапе 2,
этап 4 - на котором мембрану, полученную на этапе 3, культивируют на среде DMEM/F12 - 89%, эмбриональная бычья сыворотка - 10%, Glutamax - 1%, в условиях СО2-инкубатора 5-7 суток.
| Шторный затвор | 1930 |
|
SU19914A1 |
| Заводная пружина | 1922 |
|
SU5028A1 |
| WO 2004066975 A1, 12.08.2004 | |||
| CN 203089456 U, 31.07.2013 | |||
| US 4969900 A1, 13.11.1990 | |||
| ПЛАТФОРМА ДЛЯ ИНЖЕНЕРИИ ИМПЛАНТИРУЕМЫХ ТКАНЕЙ И ОРГАНОВ И СПОСОБЫ СОЗДАНИЯ (БИОФАБРИКАЦИИ) ЭТИХ ТКАНЕЙ И ОРГАНОВ | 2012 |
|
RU2623303C2 |
Авторы
Даты
2023-11-30—Публикация
2023-05-11—Подача