ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Изобретение касается системы доставки и соответствующих способов для доставки молекул через биологические мембраны в клетки, необязательно с последующим внутриклеточным захватом.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Белок патология представляет собой общий знаменатель в этиологии или патогенеза многих медицинских расстройств, начиная с нарушения функции мутантного белка до патологического усиления функции, при которой специфический белок приобретает новое свойство, которое делает его токсичным. Концептуально, ингибирование синтеза этих белков с помощью генной терапии может быть многообещающим для пациентов, имеющих такую белковую аномалию.
Одним из главных достижений последних лет является концепция подавления экспрессии специфического гена с помощью РНК-интерференции, с использованием малых интерферирующих РНК (миРНК). РНК-интерференция основывается на коротких (≈19-27 пар оснований) двухцепочечных последовательностях РНК, способный действовать, совместно с клеточными биологическими системами (в частности, дайсером - белковым комплексом, который расщепляет двухцепочечную РНК для продуцирования миРНК и индуцированного РНК комплекса подавления экспрессии (RISC)), для того, чтобы ингибировать трансляцию и отметить для деградации специфические последовательности мРНК, таким образом, ингибируя экспрессию генов на стадии трансляции. Использование антисмыслового олигонуклеотида (АСО) с короткой последовательностью (обычно 13-25 нуклеотидов) немодифицированных или химически модифицированных молекул ДНК, комплементарных к специфической мРНК, также было предложено для ингибирования экспрессии и блокирования выработки соответствующего конкретного белка-мишени.
Тем не менее, несмотря на огромные потенциальные выгоды от таких подходов к медицинской помощи, трансмембранная доставка таких макромолекул остается существенной проблемой, из-за относительно больших и высоко заряженных структур миРНК (средняя МВт 13 «Да, около 40 отрицательно заряженных групп фосфатов). Таким образом, доставка трансмембранного миРНК требует преодоления очень большого энергетического барьера.
Мембранный дипольный потенциал представляет собой электрический потенциал, который существует в какой-либо фосфолипидной мембране, между границей раздела вода/мембрана и мембранным центром (положительным внутри). Предполагается генерирование глицерильных сложноэфирных связей за счет высокоупорядоченных карбонильных групп фосфолипидов. Его амплитуда составляет приблизительно 220-280 мВ. Поскольку находится в очень гидрофобной среде, с диэлектрической проницаемостью 2-4, это приводит к очень сильному электрическому полю 108-109 В/м. Предположительно, мембранный дипольный потенциал и связанное с ними внутри мембраны электрическое поле являются очень важными для функции мембранных белков. Дипольный потенциал, вероятно, играет важную физиологическую роль в определении конформации и активности мембранных белков. Тем не менее, на сегодняшний день, дипольный потенциал не привлекался к участию в медицинских использованиях.
Различные способы были разработаны для доставки олигонуклеотидов через биологические мембраны. Эти способы включают использование вирусных векторов, а также невирусных систем доставки, таких как катионные липиды или липосомы. Тем не менее, на сегодняшний день, использование этих способов в значительной степени ограничивается применениями in vitro, или для фокального введения in vivo, например, путем прямой инъекции в глаз или прямого введения в легкие. Например, электропорация представляет собой эффективный и широко используемый способ доставки макромолекул через биологические барьеры. В соответствии с этим способом, внешнее электрическое поле прикладывается к суспензии клеток, что приводит к столкновению заряженных молекул-мишеней с мембраной, с последующим временной и фокусной мембранной дестабилизацией и последующим прохождением макромолекул в клетку. Тем не менее, на сегодняшний день, электропорация используется в основном in vitro. Электропорация in vivo встретила ограниченный успех, и была сделана попытка только для определенных органов (например, мышцы, легкого), когда внешние электроды могут быть вставлены в орган-мишень.
В заключение, доставка макромолекул, таких как олигонуклеотиды, и других терапевтических агентов, через клеточные мембраны и другие биологические барьеры, такие как гематоэнцефалический барьер, по-прежнему представляет значительную неудовлетворенную потребность, и системная доставка (а именно доставка за счет внутривенного или перорального введения) таких макромолекул, по-прежнему остается огромным, не устраненной проблемой.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Варианты осуществления представленного изобретения предусматривают системы доставки, которые основываются на новом, рационально сконструированном "молекулярном двигателе". "Молекулярный двигатель" в соответствии с вариантами осуществления изобретения может использоваться для трансмембранной доставки лекарственных средств, которые могут включать низкомолекулярные лекарственные средства или макромолекулы, такие как пептиды, белки или олигонуклеотиды (например, одноцепочечная или двухцепочечная, РНК или ДНК). В конкретном варианте осуществления макромолекулы могут включать РНК цепи для подавления экспрессии гена, то есть, миРНК (малые интерферирующие РНК), или последовательностей ДНК предназначенные для использования в качестве антисмысловых олигонуклеотидов (ASO).
Конъюгаты лекарственных средств (например, низкомолекулярные лекарственных средств или макромолекулы) с "молекулярным двигателем" в соответствии с вариантами осуществления изобретения может быть использованным в медицинской практике, среди прочего, для лечения заболеваний, в которых аберрантные белки или белковая дисфункция играет роль, и в которых подавление экспрессии генов, кодирующих данные белки, может быть благоприятным; например, при лечении дегенеративных заболеваний, рака, токсического или ишемического инсультов, инфекций, или иммуноопосредованных расстройств.
В одном варианте осуществления предусматривается соединение для трансмембранной доставки лекарственного средства, где соединение соответствует Формуле II
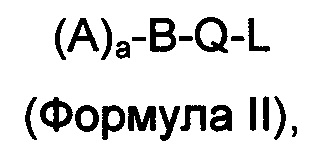
в которой a представляет собой целое число 1, 2, 3 или 4, и в которой A выбирают из структур, которые представлены формулами III, IV и V
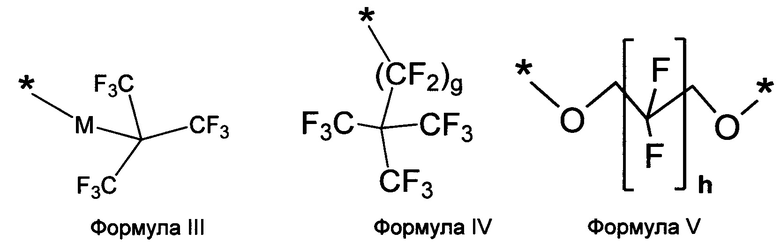
в которой М выбирают из -O- или -CH2-; и g и h независимо представляют собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16; и в которой
B представляет собой насыщенный или частично насыщенный линейный, разветвленный или циклический C1, C2, С3, C4, С5, C6, C7, C8, C9, C10, C11, С12, С13, С14, C15, С16, С17, С18, С19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42 алкил, алкилен, гетероалкилен, арил, гетероарил; стероид или их комбинацию; Q или отсутствует, или выбирают из сложного эфира, тио-сложного эфира, амида, карбамата, дисульфида [-(S-S)-], простого эфира [-O-], pH-чувствительного фрагмента, и чувствительного к окислению-восстановлению фрагмента;
L отсутствует или представляет собой необязательно замещенный линейный, циклический или разветвленный, насыщенный, ненасыщенный или частично насыщенный C1, C2, C3, C4, C5, C6, C7, C8, C9, C10, C11, C12, С13, С14, С15, C16, C17, C18, C19, С20, С21, С22, С23, С24, С25, С26, С27, С28, C29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42 алкил, алкилен, гетероалкилен, арил, гетероарил; стероид или -(O-СН2-СН2)u-, где u представляет собой целое число 1, 2, 3, 4, 5, 6, 7, 8, 9, 10; или их комбинации; упомянутое соединение способно связываться с лекарственным средством.
В одном варианте осуществления предусматривается конъюгат, содержащий соединение, как описано выше, присоединенное к лекарственному средству. Некоторые варианты осуществления изобретения касаются способа доставки лекарственного средства через биологическую мембрану, где способ включает инкубирование клеток с конъюгатом, как описано выше.
Другой вариант осуществления касается способа лечения заболевания где указанный способ включает введение пациенту, который нуждается в этом, соответствующего количества фармацевтической композиции, содержащей конъюгат, как описано выше.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Изобретение далее будет описано с использованием некоторых примеров и вариантов осуществления, неограничивающим способом, со ссылкой на следующие иллюстративные фигуры, таким образом, что изобретение может быть более понятным с использованием чертежей:
Фиг. 1А представляет собой схематическое представление принципа асимметричной полярности, лежащего в основе активности соединений в соответствии с вариантами осуществления настоящего изобретения;
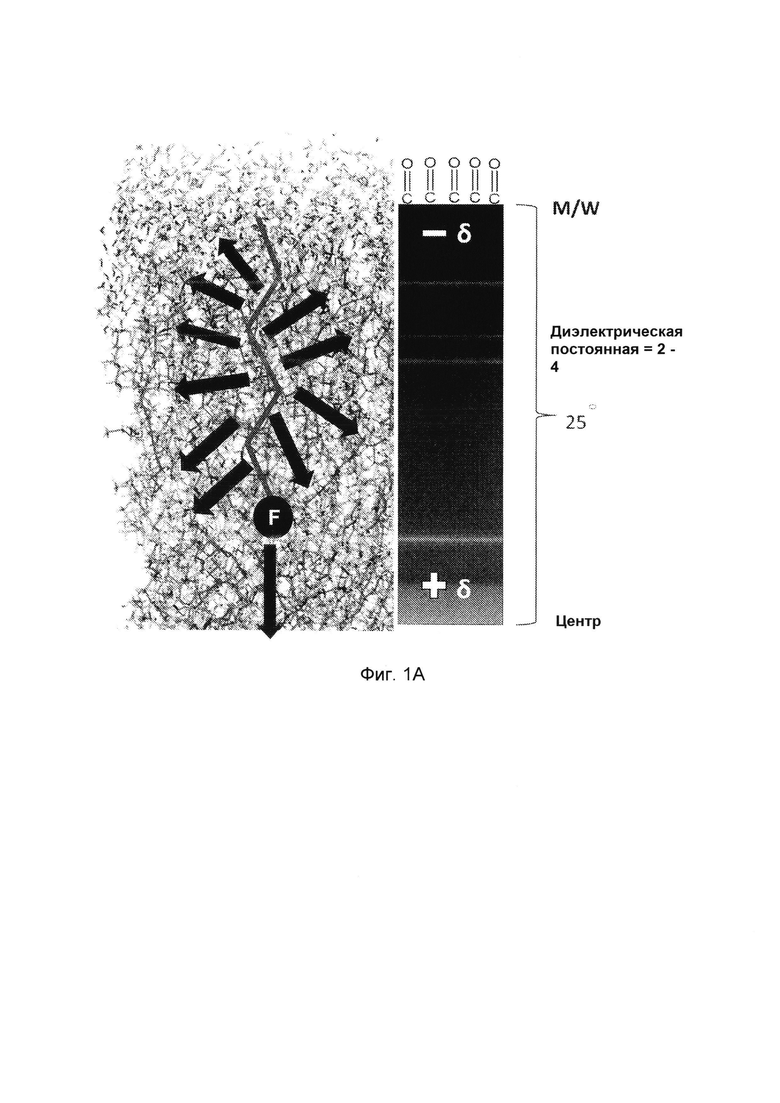
Фиг. 1B схематически изображает структурные фрагменты молекул согласно изобретению, как продемонстрировано соединением в соответствии с Формулой IX;
Фиг. 2 схематически иллюстрирует потенциальный механизм действия конъюгата в соответствии с вариантами осуществления изобретения;
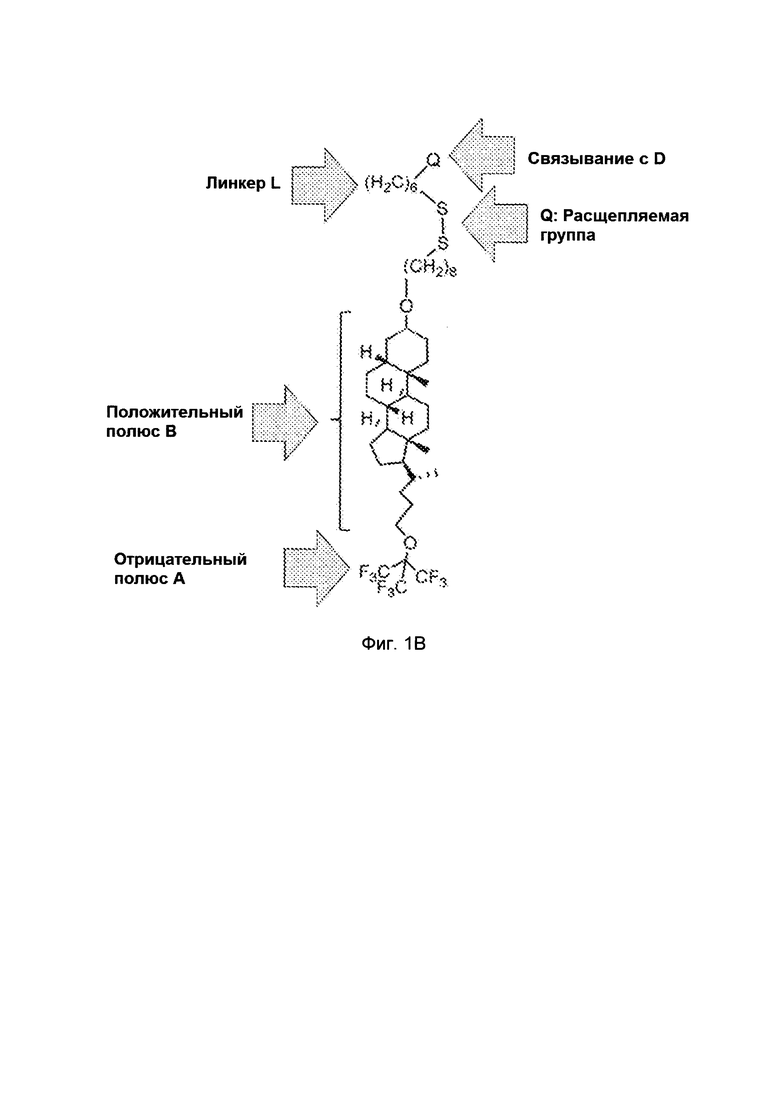
Фиг. 3 схематически иллюстрирует механизм захвата миРНК в пределах цитоплазмы, используя дайсер фермент;
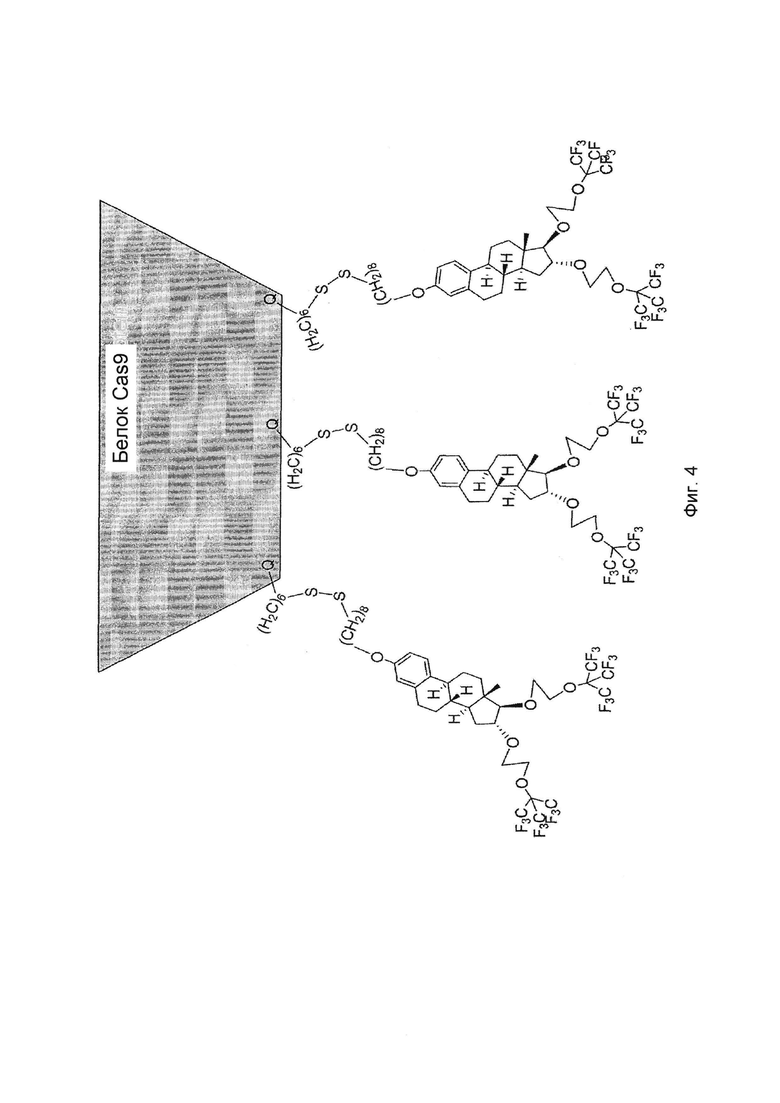
Фиг. 4 показывает иллюстративную структуру конъюгата, содержащего "молекулярный двигатель" согласно изобретению, конъюгированный с Cas9 белком; и
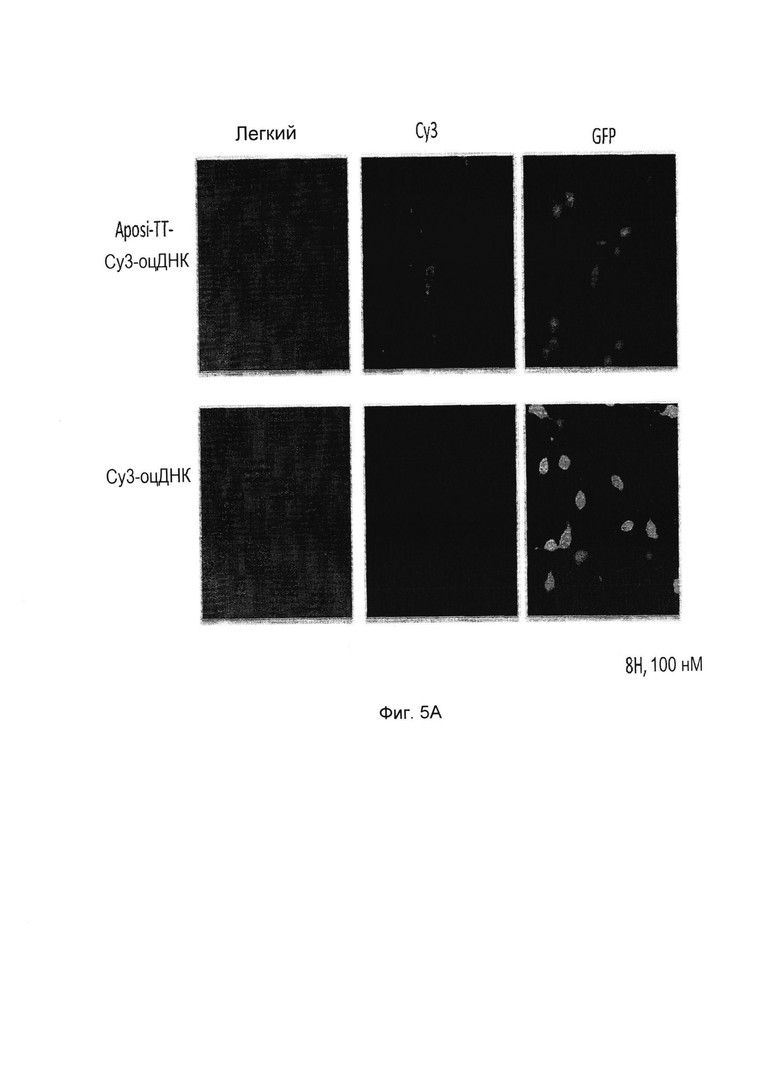
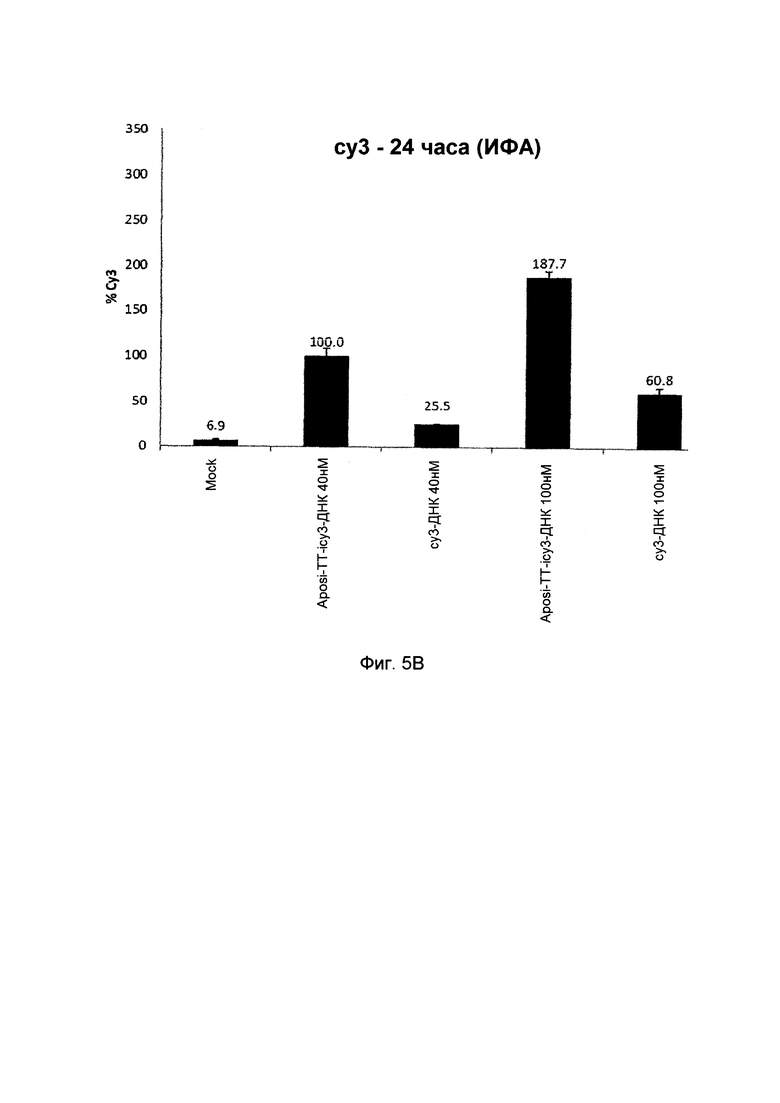
Фиг. 5А и 5B показывают результаты биологической активности соединений в соответствии с вариантами осуществления изобретения; фиг.5А показывает результаты флуоресцентной микроскопии и фиг.5B показывает результаты количественного анализа по ИФА ридеру после 24 часов инкубирования.
ДЕТАЛЬНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Варианты осуществления представленного изобретения касаются новых соединений, которые могут действовать в качестве систем доставки лекарственных средств через биологические мембраны, такие как фосфолипидные клеточные мембраны, в цитоплазму. Соединения в соответствии с вариантами осуществления изобретения содержат новые, рационально сконструированные "молекулярные двигатели" предназначенные для движения в пределах фосфолипидных мембран, из раздела фаз мембрана/вода к мембранному ядру, используя внутримембранное электрическое поле, которое связано с мембранным дипольным потенциалом. Когда присоединенная к лекарственному средству, указанная система доставки действует, чтобы тянуть лекарственное средство по направлению к мембранному ядру, и способствовать его трансмембранному движению. Среди прочего, данная система доставки предназначается для доставки терапевтических макромолекул: белков или олигонуклеотидов, причем последний с одной или двумя цепями ДНК или РНК. Среди прочего, указанная система доставки предназначается для доставки антисмысловых олигонуклеотидов (ASO), миРНК и терапевтических белков, таких как белок Cas9.
Одним из принципов, лежащих в основе структуры соединений в соответствии с вариантами осуществления настоящего изобретения, является принцип "асимметричной полярности", относительно гидрофобных, незаряженных молекул, которые в соответствии со своим 1одР, распределены в биологических мембранах (смотрите Фиг. 1А). Молекулы являются полярными, с их частичными зарядами, распределенными неравномерно: частичный отрицательный заряд является сильно локализованным и целенаправленным, в то время как частичный положительный заряд рассредоточен вдоль углеводородных цепей внутри молекулы. Кроме того, частичный положительный заряд также замаскирован, посредством взаимодействий дисперсионного типа с соседними углеводородными цепями внутри мембраны липидной среды (дисперсионные взаимодействия). Следовательно, как это схематически показано на Фиг. 1А, молекула в соответствии с вариантами осуществления изобретения перемещается в мембранной среде как отрицательно заряженная молекула. Поскольку внутреннее электрическое поле мембраны имеет отрицательный полюс на границе раздела мембрана/вода, и положительный полюс в мембранном центре, молекула движется в соответствующем электрическом поле в направлении мембранного центра, и при присоединении к грузу (например, миРНК или ASO, терапевтическому белку или другому лекарственному препарату), он тянет груз к мембранному центру.
Кроме того, когда необязательно расщепляемая группа (например, дисульфидная группа или олигонуклеотидная последовательность, расщепляемая дайсер ферментом) включена в молекулу в соответствии с вариантами осуществления изобретения, она может действовать как ловушка для груза (например, миРНК или ASO или другого лекарственного средства) в цитоплазме клетки-мишени, и также помогает в поддержании градиента концентрации конъюгата через клеточную мембрану. Термин "расщепляемая группа" в контексте представленного изобретения, таким образом, касается химического фрагмента, способного претерпевать спонтанное или фермент-направленное расщепление в определенных физиологических условиях, таких как изменения pH или изменения в окислительно-восстановительном состоянии. Примеры расщепляемых групп включают сложный эфир, тио-сложный эфир, амид, карбамат, дисульфид [-(S-S)-] простой эфир (-O-) или тио-простой эфир (-S-). Концептуально, расщепляемая группа может помочь в захвате лекарственного средства в его клетки-мишени после ее трансмембранного прохода, или помочь в поддержании градиента концентрации через биологические мембраны.
Например, в случае конъюгата в соответствии с вариантом осуществления настоящего изобретения, который включает миРНК, ASO или терапевтические белки, и дисульфидную группу; оказавшись внутри цитоплазмы, преобладающая окружающая восстановительная среда будет действовать так, чтобы восстановить дисульфидную связь до -SH группы, с высвобождением груза из части доставки. Лишенная "молекулярных двигателей" (фрагмента доставки), макромолекула груза затем будет захвачена в цитоплазме, где, например, в случае миРНК, будет готова к взаимодействию с РНК-индуцированным комплексом подавления экспрессии (RISC) для того, чтобы заглушить экспрессию определенного гена. В соответствии с вариантами осуществления изобретения, указанный ген может кодировать белок, принимающий участие в этиологии или патогенеза конкретного заболевания.
В соответствии с одним вариантом осуществления изобретения, груз представляет собой терапевтический белок, который доставляется через клеточные мембраны клеток для того, чтобы оказать благотворные терапевтические эффекты на внутриклеточные белки-мишени.
Область белковых лекарственных средств для внутриклеточных мишеней (PDIT) представляет собой новую область производных в части от завершения проекта секвенирования генома человека, что позволяет идентифицировать огромное количество внутриклеточных мишеней для потенциальных медицинских вмешательств путем введения белковых лекарственных средств, средств подавления экспрессии гена, РНК или ДНК компилирования или белок замещающей терапии. По своему характеру такие терапевтические стратегии могут быть полезны для какого-либо заболевания. Конкретным, весьма привлекательным кандидатом белком в области PDIT является CRISPR (короткие полиндромные повторы, регулярно расположенные группами) - связанный белок, и, в частности, белок Cas9. Совсем недавно обнаруженный белок, первоначально представляет собой бактериальный белок, естественно, используемый бактериями в качестве противовирусного механизма. Практически, этот белок может быть загружен с помощью какой-либо последовательности РНК, влекущие за собой специфичность в направленности белка, специфически к какому-либо локусу в геноме. Потенциально, такой локус может представлять собой сайт укрывательства мутантного дефектного гена. В этом сайте, белок Cas9 затем будет индуцировать точное рассечение, то есть, будет вызывать двухцепочечный разрыв ДНК. Затем активируются встречающиеся в природе механизмы репарации ДНК для того, чтобы восстановить этот участок аномально функционирующего гена. Таким образом, этот белок обеспечивает высокую эффективность редактирования гена (добавление, разрыв или изменение последовательности специфических генов) и регулирования и репарации гена, применимые к видам по всему дереву жизни. Предоставляя белок Cas9 и соответствующую направляющую РНК в клетку, геном организма может быть разрезан в каком-либо желаемом месте, и подвергнут редактированию и репарации.
Как проиллюстрировано ниже, вариант осуществления изобретения включает конъюгаты, содержащие один или несколько "молекулярных двигателей" и Cas9 белок или соответствующие белки, которые играют роль в редактировании ДНК или РНК. Другой вариант осуществления изобретения включает терапевтических белок, введенный в качестве заместительной терапии для лечения заболевания, которое ассоциируется с относительно сниженными уровнями специфического, физиологически-важного белка.
Соединения в соответствии с вариантами осуществления изобретения, как правило, включают гидрофобный (коэффициент распределения октанол к воде (logP>1)), дипольный, незаряженный химический фрагмент, сконструированный в соответствии с принципом асимметричной полярности (объясненным выше). Как обсуждалось, уникальная структура молекулы, будучи гидрофобной, нейтральной, но содержащей сосредоточенные частичные отрицательные заряды и рассредоточенные частичные положительные заряды, создает векторную систему, когда приложить силовом поле мембраны, при котором молекула движется в пределах фосфолипидной мембраны, от границы раздела мембрана/вода к мембранному ядру. При присоединении к лекарственному средству данная молекула будет соответственно тянуть лекарственное средство к мембранному ядру.
Как схематически проиллюстрировано на Фиг. 1B соединения в соответствии с вариантами осуществления изобретения (продемонстрированные, например, в виде соединений в соответствии с Формулой IX), как правило, включают "молекулярный двигатель", который, как правило, представляет собой комбинацию следующих структурных элементов:
(i). Отрицательный полюс (A): как правило, содержащий по меньшей мере 1 электроотрицательный атом, выбранный из галогена (например, атома(ов) фтора) и кислорода; где в случае, когда полюс содержит несколько электроотрицательных атомов, они расположены в пространстве в сфокусированном, сферическом (или близком к сферическому) расположении. Из-за электроноакцепторных свойств указанных атомов и их расположения в пространстве, отрицательный полюс соединения является обогащенным электронами фокусом.
(ii). Положительный полюс (B): содержащий относительно электроположительные атомы, выбранные из углерода, кремния, бора, фосфора и серы; расположенные таким образом, чтобы обеспечить максимальное взаимодействие с соседними углеводородными цепями, когда вводить в фосфолипидную мембрану, предпочтительно за счет расположения в виде алифатической или ароматической структуры линейных, разветвленных или циклических цепей, или их комбинаций. В одном варианте осуществления изобретения, положительный полюс содержит линейную насыщенную углеводородную цепь, или стероидный фрагмент, такой как холестерин, желчные кислоты, эстрадиол, эстриол или их комбинации.
Кроме того, соединение "молекулярный двигатель" в соответствии с вариантами осуществления изобретения может включать один или несколько линкеров (L) и расщепляемых групп (Q), дополнительно описанные ниже. Соединение может быть конъюгированным с или связанным с лекарственным средством (D) посредством линкера или расщепляемой группы.
Варианты осуществления изобретения, кроме того, касаются применения соединений в соответствии с вариантами осуществления изобретения, конъюгированные с лекарственными средствами, такими как белки или олигонуклеотиды (например, миРНК или ASO) в лечении заболеваний, таких как дегенеративные заболевания, рак, токсический или ишемический инсульты, инфекции или иммуноопосредованные расстройства, в которых специфические белки могут играть роль в этиологии заболеваний или патогенезе, и в которых подавление экспрессии соответствующего(их) гена(ов) посредством миРНК или антисмысловых механизмов может иметь благоприятные эффекты в ингибировании процессов, связанных с заболеванием. Например, конъюгаты в соответствии с вариантами осуществления изобретения может использоваться как антисмысловую терапию, которая является формой медицинского лечения, включающего введение цепи или двойной цепи нуклеиновой кислоты (ДНК, РНК или химического аналога), которая будет связываться с ДНК, кодирующей специфический белок, или с соответствующей информационной РНК (мРНК). Данное лечение действует так, чтобы ингибировать экспрессию гена и предотвращать продуцирование соответствующего белка. Альтернативно, конъюгаты согласно изобретению, могут содержать терапевтические белки, такие как белок Cas9.
Термины "лекарственное средство" или "медикамент" в контексте представленного изобретения касаются химического вещества, которое при введении пациенту, страдающему от заболевания, являются способными оказывать благоприятные эффекты на пациента. Указанные благоприятные эффекты могут улучшать симптомы, или противодействовать эффекту агента или вещества, которое играет роль в процессе заболевания. Лекарственное средство может содержать низкомолекулярное соединение или макромолекулу, такие как белок или цепи РНК или ДНК, введенные для того, чтобы ингибировать экспрессию гена. Среди прочего, лекарственное средство может включать миРНК или ASO. В некоторых вариантах осуществления, лекарственное средство направлено на лечение дегенеративных заболеваний, рака, ишемического, инфекционного или токсического инсультов, или иммуноопосредованных расстройств.
Варианты осуществления изобретения предусматривают новые конъюгаты, содержащие соединения в соответствии с вариантами осуществления изобретения, и лекарственное средство. Варианты осуществления изобретения, кроме того, предусматривают новые фармацевтические композиции, содержащие указанные конъюгаты, и новые способы лечения заболеваний, не основании данных фармацевтических композиций.
В соответствии с некоторыми вариантами осуществления, соединения и фармацевтические композиции изобретения могут использоваться для того, чтобы достигнуть более эффективного действия заместительной белковой терапии или генной терапии, такой как миРНК или антисмысловая терапия (ASO) in vivo.
Конъюгат в соответствии с вариантами осуществления изобретения может давать преимущества в улучшение доставки миРНК, ASO или терапевтических белков через клеточные мембраны или через гематоэнцефалический барьер, таким образом, улучшая эффективность миРНК или ASO в одном или нескольких аспектах, такую как, например, эффективность, токсичность или фармакокинетику.
Как описано выше, в качестве не ограничивающего потенциального механизма действия (МОА), конъюгаты в соответствии с вариантами осуществления изобретения, содержащие лекарственное средство, такое как миРНК или терапевтический белок, когда он расположен в пределах фосфолипидной мембраны, "молекулярный двигатель" (например, как это описано выше) действует, чтобы тянуть лекарственное средство к сердцевине мембраны. Следовательно, фокальная дестабилизация мембраны может происходить с латеральным движением фосфолипидных головных групп и генерации переходных мембранных пор, через которые может иметь место трансмембранное прохождение препарата. Данный потенциальный МОА схематически представлен на Фиг. 2.
В примере, схематически представлена на Фиг. 2, конъюгат содержит груз, который представляет собой миРНК, ASO или терапевтический белок, а также дисульфидные группы, для захвата груза в цитоплазме. На первой стадии (А) "двигатель" перемещается от поверхности мембраны к мембранному ядру, в соответствии с принципом асимметричной полярности, приводимый в действие электрическим полем внутренней мембраны.
На второй стадии (В) макромолекула, связанная с "двигателем" вынужден подойти к поверхности мембраны, таким образом, возмущая гидратные оболочки. Следовательно, имеется латеральное перемещение фосфолипидных головных групп, и формирование переходных мембранных пор, через которую макромолекула доставляется в клетку. Последующее замыкание переходной поры является термодинамически благоприятным (С).
В другом варианте осуществления захват миРНК в цитоплазме может включать способ, включающий: (i). введение дайсер субстрата, содержащего двухцепочечную РНК из 25-30 нуклеотидов, который включает последовательность для подавление экспрессии гена-мишени, в котором "молекулярный(ые) двигатель(и)" присоединен(ы) к 3'-концу нетранскрибируемой (клонированной) цепи и/или к 5'-концу антисмысловой (направляющей) цепи; (ii), введение конъюгата в соответствии с вариантами осуществления настоящего изобретения, которые будут вызывать транс-мембранную доставку лекарственного средства (например, миРНК) и расщепление дсРНК дайсер-ферментом, таким образом, удаляя "молекулярный(ые) двигатель(и)" из конъюгата, и высвобождая миРНК. миРНК, из-за его многочисленных отрицательных зарядов, будет захвачен в цитоплазме и будет иметь возможность взаимодействовать с комплексом RISC для подавления экспрессии гена-мишени.
В одном варианте осуществления показано схематически проиллюстрированный на Фиг. 3 механизм для захвата миРНК в пределах цитоплазмы, используя дайсер-фермент. Показан дайсер-субстрат, содержащий двухцепочечную РНК из 25-30 нуклеотидов, которая включает последовательность для подавления экспрессии гена-мишени. "Молекулярный двигатель" (стрелка) присоединяется к 3'-концу нетранскрибируемой (клонированной) цепи и/или к 5'-концу антисмысловой (направляющей) цепи миРНК, предназначенной для того, чтобы заглушить ген-мишень. После трансмембранной доставки, происходит расщепление дсРНК дайсер-ферментом, удаление "молекулярных двигателей" из конъюгата, и высвобождение миРНК для того, чтобы взаимодействовать с комплексом RISC, для подавления экспрессии гена-мишени. По этому механизму, миРНК, из-за ее многочисленных отрицательных зарядов, таким образом, захватывается в цитоплазме.
Конъюгаты в соответствии с вариантами осуществления изобретения могут быть описаны общей формулой (I):
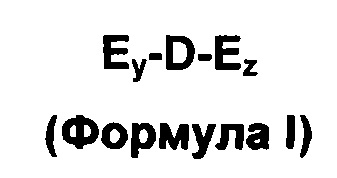
включая фармацевтически приемлемые соли, гидраты, сольваты и метало-хелаты соединения, представленного структурой, как показано Формулой (I), и сольваты и гидраты солей, в которой:
D представляет собой лекарственное средство, которое доставляется через биологические мембраны. D может представлять собой низкомолекулярное лекарственное средство, пептид, белок, или нативный или модифицированный, одноцепочечную или двухцепочечную ДНК или РНК, такую как миРНК или ASO;
E представляет собой соединение в соответствии с вариантами осуществления изобретения; y и z каждый представляет собой целое число, независимо выбранное из 0, 1, 2, 3, 4, 5, 6; по меньшей мере один из y или z является отличным от нуля. В одном варианте осуществления, y=1 и z=o; в другом варианте осуществления y=1 и z=1. Е может быть описанным общей формулой (II):
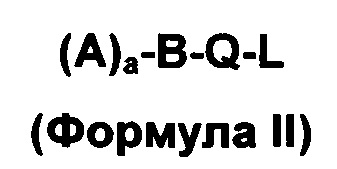
в которой a представляет собой целое число, выбранное из 1, 2, 3 или 4 и A выбирают из структур, которые представлены формулами III, IV и V - такой, как описано ниже;
B представляет собой химическую группу насыщенного или частично насыщенного линейного, разветвленного или циклического C1, С2, С3, С4, С5, С6, С7, С8, С9, C10, C11, С12, С13, С14, C15, C16, C17, C18, C19, C20, C21, C22, C23, C24, C25, C26, C27, C28, C29, C30, C31, C32, C33, C34, C35, C36, C37, C38, C39, C40, C41, C42 алкила, алкилена, гетероалкилена, арила, гетероарила; стероидный фрагмент, такой как холестерин, желчная кислота, эстроген, или их комбинацию;
Q отсутствует или выбирают из сложного эфира, тио-сложного эфира, амида, карбамата, дисульфида [-(S-S)-], простого эфира [-O-], pH-чувствительного фрагмента, и чувствительного к окислению-восстановлению фрагмента;
L может отсутствовать или быть таким же B как определено выше, и могут включать необязательно замещенный (кислородом, гидроксилом, азотом, фосфатом или серой) линейный, циклический или разветвленный, насыщенный, ненасыщенный или частично насыщенный C1, С2, С3, С4, С5, C6, С7, С8, C9, C10, C11, C12, С13, С14, C15, C16, С17, C18, C19, С20, С21, С22, С23, С24, С25, С26, С27, С28, С29, С30, С31, С32, С33, С34, С35, С36, С37, С38, С39, С40, С41, С42 алкил, алкилен, гетероалкилен, арил, гетероарил; стероид такой как холестерин, желчная кислота; эстроген, химический фрагмент структуры -(O-СН2-CH2)u-, в которой и представляет собой целое число 1, 2, 3, 4, 5, 6, 7, 8, 9, 10; или их комбинации. Как обсуждалось выше, А выбирают из структур как представлено в следующих формулах III, IV, V, в которых * представляет собой точку присоединения к B, Q, L или D:
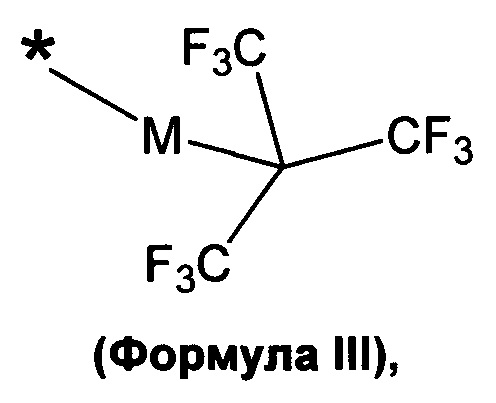
в которой M выбирают из -O- или -CH2-;
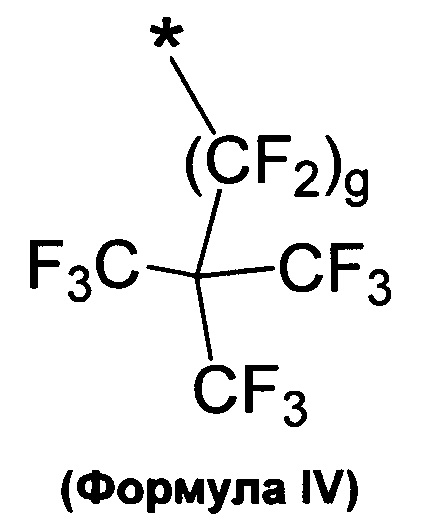
в которой g представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16;
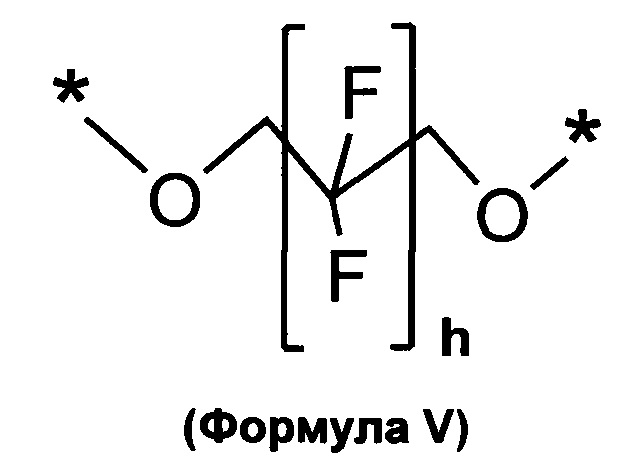
в которой h представляет собой целое число, выбранное из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 и 16.
Связывание D с фрагментами молекулы может происходить через эфирную, сложноэфирную, амидную, тиосложноэфирную, тиоэфирную или карбаматную группы. В случае, когда D представляет собой олигонуклеотид, связывание может происходить с нуклеиновым основанием, с рибозным фрагментом (например, через 2', 3' или 5' положения), или с фосфатным фрагмент нуклеотида; связывание может происходить или с терминальным или с нетерминальным нуклеотидом олигонуклеотидной цепи; в случае, когда D представляет собой белок, его связывание с другими фрагментами молекулы может происходить через связывание с боковой(ыми) цепью(ями) аминокислот белка, таких как лизин, глутамат или аспартат.
Термин "олигонуклеотид", в контексте изобретения, может включать ДНК или РНК молекулы, где каждая представляет собой одноцепочечную или двухцепочечную последовательность из одного или нескольких нуклеотидов. Каждый нуклеотид содержит азотистое основание (нуклеиновое основание), пятиуглеродный сахар (рибозу или дезоксирибозу), и фосфатную группу. Нуклеиновые основания выбирают из пуринов (аденина, гуанина) и пиримидинов (тимина, цитозина, урацила). Кроме того, термин может касаться модифицированных форм нуклеотидов, в которых модифицирование может быть в скелете молекулы (например, фосфоротиоат) или в нуклеиновом основании (например, метилирование в 2' положении рибозной группы в РНК). Данные модификации могут давать свойства, такие как улучшенная стабильность или улучшенная фармакокинетика олигонуклеотида, и использование таких модифицированных также олигонуклеотидов находится в пределах объема изобретения.
Связывание может происходить с нуклеиновым основанием, с рибозным фрагментом (например, через 2', 3' или 5' положениях), или связывание с фосфатным фрагментом нуклеотида. Связывание может происходить или с терминальным или нетерминальным нуклеотидом олигонуклеотидной цепи.
В одном варианте осуществления, раскрывается способ специфического ингибирования генной экспрессии, или in vitro, или in vivo; где указанный способ включает применение конъюгата изобретения, или соответствующей фармацевтической композиции, где D представляет собой миРНК или ASO, предназначенной подавлять экспрессию специфического гена, который кодирует патогенный белок, который принимает участие в этиологии или патогенезе заболевания.
Соответственно, конъюгаты в соответствии с вариантами осуществления изобретения могут использоваться для лечения заболевания. Варианты осуществления изобретения также раскрывают способ медицинского лечения, включающий введение пациенту, который нуждается в этом, соответствующего количества фармацевтической композиции в соответствии с вариантами осуществления изобретения. В одном варианте осуществления, введенная фармацевтическая композиция может включать миРНК или антисмысловой олигонуклеотид, активный в ингибировании экспрессии гена, который кодирует специфический патогенный (то есть, связанный с заболеванием) белок.
В одном варианте осуществления, молекула в соответствии с общей Формулой I, включает E, который имеет структуру, как представлено Формулой (VI)
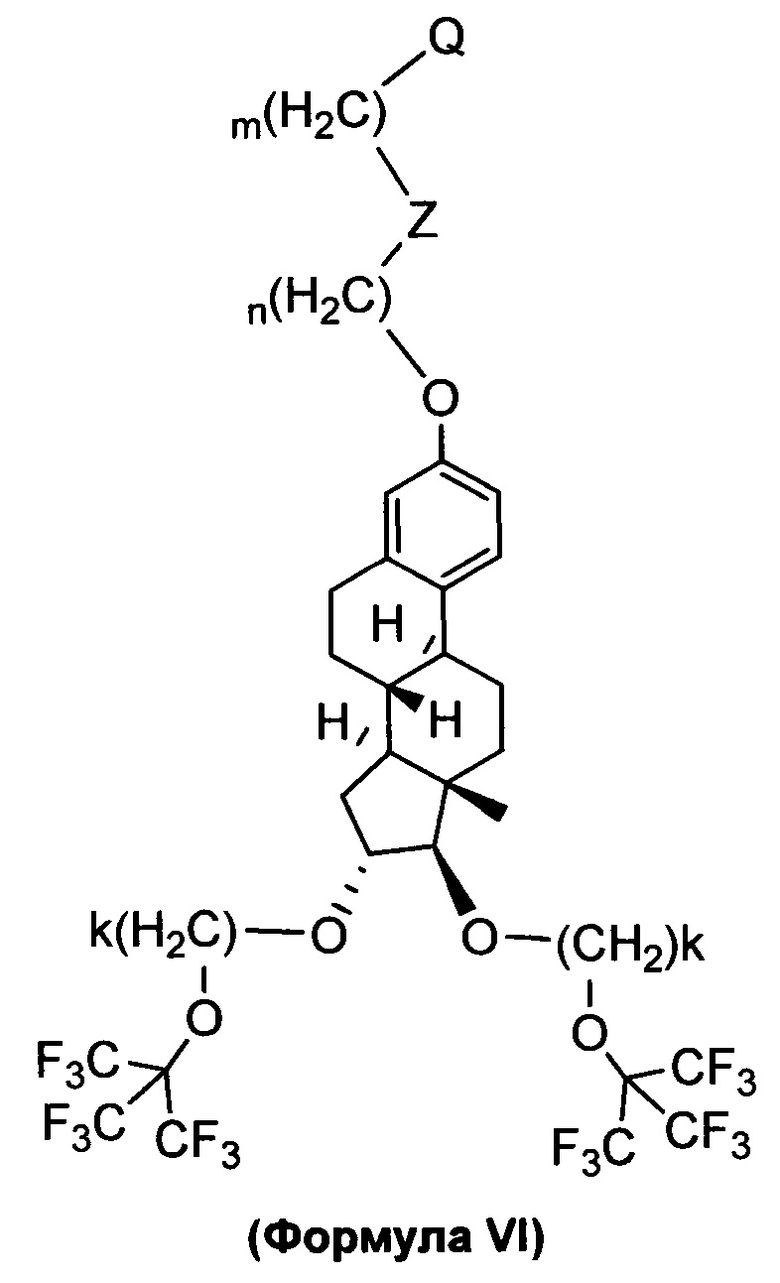
в которой n и m представляют собой целые числа, каждый независимо выбранный из нуля и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20; k представляет собой целое число, выбранное из 2, 3, 4, 5, 6, 7. В одном варианте осуществления k=2; Z отсутствует или представляет собой -S-S-, и Q является таким, как описано выше и представляет собой связывание с D.
В другом варианте осуществления, молекула в соответствии с общей Формулой I, включает E, который имеет структуру, которые представлены формулами VII или VIIa:
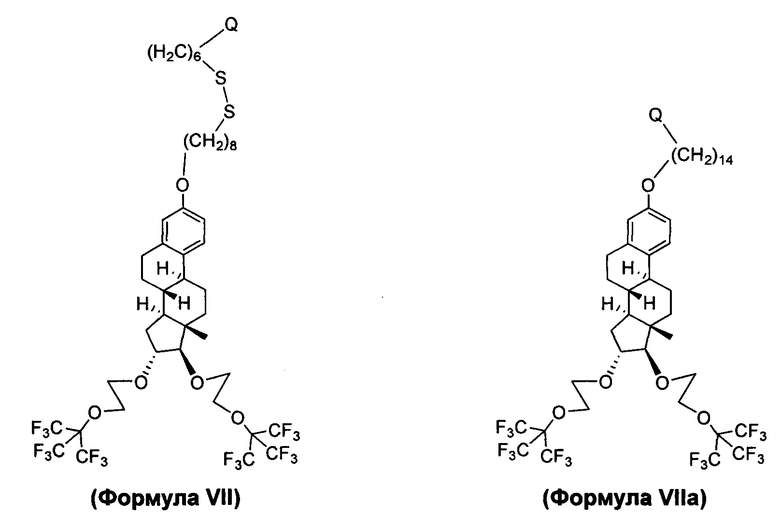
В другом варианте осуществления, молекула в соответствии с общей Формулой I, включает E, который имеет структуру, как представлено Формулой VIII:
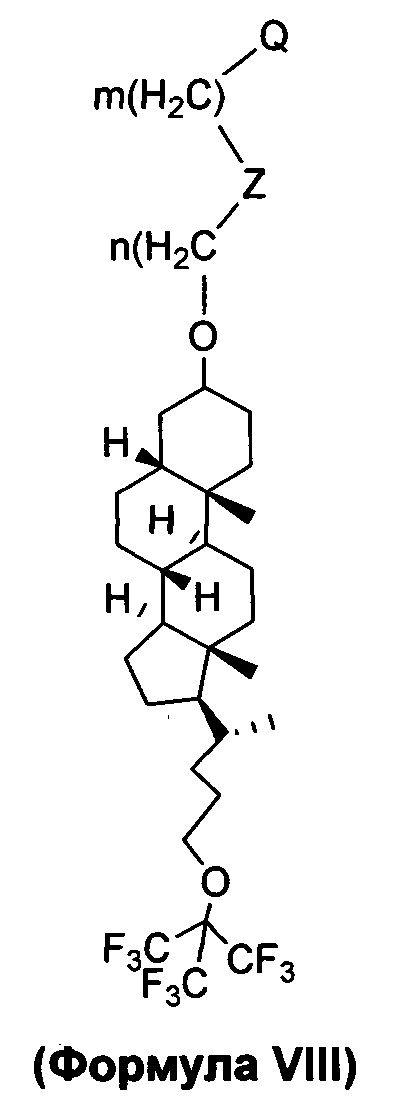
в которой n и m представляют собой целые числа, каждый независимо выбранный из нуля и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20; Z отсутствует или представляет собой -S-S-; и Q (как описано выше) представляет собой связывание с D.
В еще другом вариант осуществления, молекула в соответствии с общей Формулой I, включает E, который имеет структуру, которые представлены формулами IX или IXa:
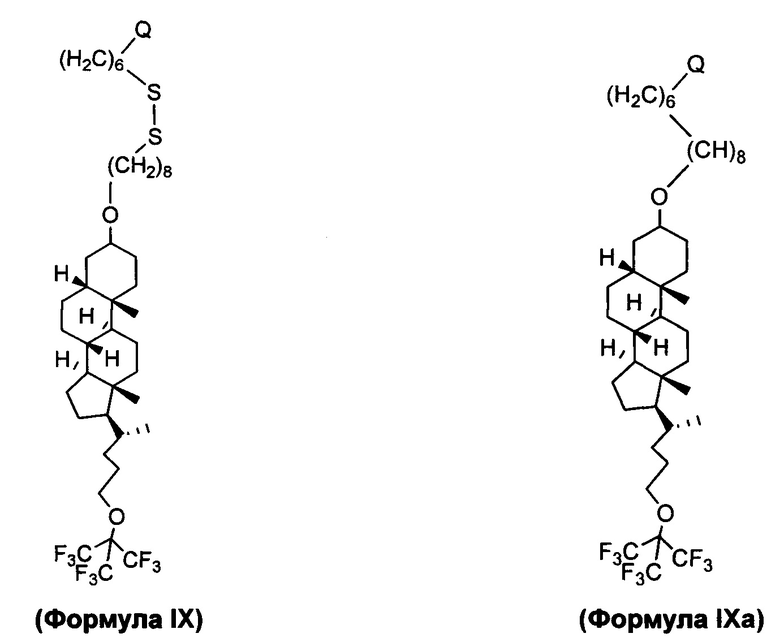
Кроме того, в пределах объема изобретения являются молекулы (также называемые "предшественниками"), используемыми в синтезе конъюгатов в соответствии с вариантами осуществления изобретения.
В одном варианте осуществления такая молекула имеет структуру, представленную Формулой X:
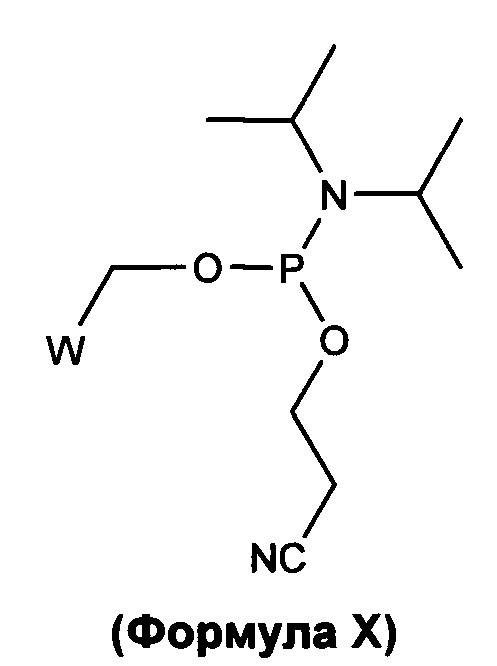
в которой W представляет собой соединение в соответствии с какой-либо из Формул II, III, IV, V, VI, VII, VIIa, VIII, IX или IXa. Данный предшественник может быть используемым, среди прочего, для присоединения к 5'-концу олигонуклеотида.
Другой предшественник изобретения имеет структуру в соответствии с Формулой (XI):
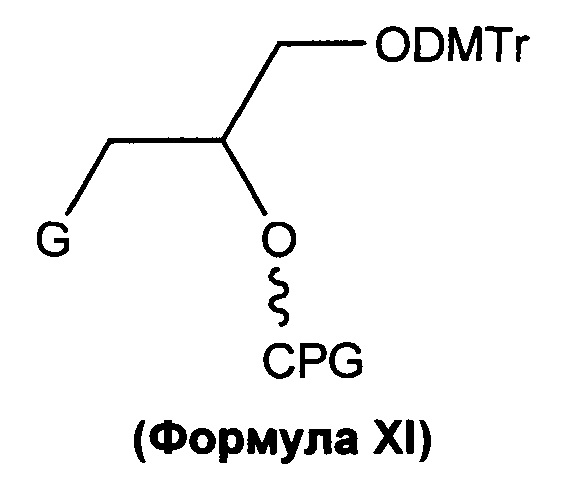
в которой G представляет собой соединение в соответствии с какой-либо из Формул II, III, IV, V, VI, VII, VIIa, VIII, IX или IXa. Данный предшественник может быть используемым, среди прочего, для присоединения к 3'-концу олигонуклеотида.
Варианты осуществления изобретения могут дополнительно включать фармацевтические композиции, содержащие конъюгат, который включает молекулу в соответствии с какой-либо из I, II, III, IV, V, VI, VII, VIIa, VIII, IX или IXa, и фармацевтически-приемлемую соль или носитель.
Изобретение также включает способы специфического ингибирования экспрессии гена, in vitro или in vivo. В одном варианте осуществления, способ может включать применение конъюгата в соответствии с Формулой I или соответствующей фармацевтической композиции, в которой D представляет собой миРНК или ASO, предназначенный для того, чтобы подавлять экспрессию специфического гена, где указанный ген кодирует патогенный белок, который принимает участие в этиологии или патогенезе заболевания; или терапевтический белок.
Конъюгаты в соответствии с вариантами осуществления изобретения, может использоваться для лечения заболевания. Варианты осуществления изобретения включают способы медицинского лечения, включающие введение пациенту, который нуждается в этом, соответствующего количества фармацевтической композиции, содержащей конъюгат в соответствии с Формулой I, где D представляет собой лекарственное средство, используемое для лечения соответствующего заболевания. В одном варианте осуществления, способ является для генетического лечения миРНК или ASO, где указанный способ включает введение пациенту, который нуждается в этом, соответствующего количества фармацевтической композиции, содержащей конъюгат согласно изобретению в соответствии с Формулой I, где D представляет собой миРНК, ASO или терапевтический белок, используемый в ингибировании генной экспрессии, который принимает участие в заболевании конкретного пациента.
В другом варианте осуществления изобретения, D представляет собой белок, который доставляется через биологические фосфолипидные мембраны в клетки, или через биологические барьеры, такие как гематоэнцефалический барьер.
В другом варианте осуществления изобретения, D представляет собой нормальный белок, вводимый как заместительная терапия, например, для того, чтобы заменить мутированное нарушение функционирующего белка.
В другом варианте осуществления, D представляет собой белок, который принимает участие в генном регулировании, включая, среди прочего, белки, которые принимают участие в ДНК или РНК редактировании (добавлении, разрыве или изменении последовательности специфических генов). В одном варианте осуществления, указанный белок может быть членом CRISPR (короткие полиндромные повторы с регулярно расположенными группами) - связанных белков. Специфически, указанный белок может представлять собой или может содержать Cas9 белок (CRISPR ассоциированный белок 9), РНК-направляющую ДНК нуклеазного фермента, или его аналога.
В одном варианте осуществления, изобретение описывает способ генетического лечения заболевания, где указанный способ включает введение пациенту, который нуждается в этом, соответствующего количества фармацевтической композиции, содержащей конъюгат в соответствии с Формулой I, где D представляет собой CRISPR белок, такой как Cas9, вводимый вместе с соответствующим направляющим олигонуклеотидом, таким образом, достигая доставку указанного белка, загруженного соответствующим направляющим олигонуклеотидом в клетках, где они могут влиять на активность своего генома редактирования. Направляющий олигонуклеотид, в данном контексте, представляет собой последовательность РНК или ДНК, который направляет Cas-9 белок со специфическим локусом (местом) на ДНК, для того, чтобы восстановить дефект генетического материала. В случае Cas9 белка, направляющий олигонуклеотид представляет собой РНК.
Таким образом, конъюгаты в соответствии с вариантами осуществления изобретения, и соответствующие фармацевтические композиции и способы, могут быть благоприятными, среди прочего, для лечения заболеваний, выбранных, среди прочего, из рака, токсических инсультов, ишемического заболевание, инфекционного заболевание, болезни депонирования белка, травмы, иммуноопосредованного заболевания, или дегенеративного заболевания.
В области неврологических расстройств, конъюгаты в соответствии с вариантами осуществления изобретения может быть используемыми, среди прочего, для лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и болезнь Крейтцфельда-Якоба.
ПРИМЕРЫ
Пример 1: Общий способ для синтеза конъюгатов содержащих олигонуклеотиды. в соответствии с вариантами осуществления изобретения:
Вначале, ген, который подавляется D, выбирается на основании их роли в заболевании в этиологии или патогенезе. Затем, на основании биоинформационных методик, известных в данной области, определяют нуклеотидную последовательность (как правило, из 19-21 пар оснований для RISC субстрата, и 25-29 для дайсер-субстрата) соответствующей миРНК ДНК деквенса ASO.
Синтез проводят в 3'-5' направлении. Твердофазный синтез применяется, с использованием имидофосфитных структурных блоков, полученных из защищенных 2'-дезоксинуклеозидов (dA, dC, dG и T), рибонуклеозидов (А, С, G и U), или химически модифицированных нуклеозидов, например, LNA (закрытая нуклеиновая кислота) или BNA (мостиковые нуклеиновые кислоты). Структурные блоки последовательно соединены с возрастанием цепи олигонуклеотида, в порядке, предусмотренном последовательностью желаемого миРНК или ASO.
После конструирования олигонуклеотида, соединение в соответствии с вариантами осуществления настоящего изобретения (Е, как определено выше), добавляют в качестве одного из структурных блоков олигонуклеотида. Необязательно, соединение может быть добавлено в форме предшественника, как описано выше. Для добавления соединения к 5'-концу олигонуклеотида, соединение в форме предшественника, может включать имидофосфитную группировку. Для добавления соединения к 3'-концу олигонуклеотида, соединение в форме предшественника, может включать ацетиленовый или азидные фрагменты. Как правило, процесс полностью автоматизирован. После завершения сборки цепи, продукт высвобождается из твердой фазы в раствор, снимается защита и собирается. Нужный конъюгат затем собирают и выделяют с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ), для получения желаемых олигонуклеотиды с высокой степенью чистоты. В случае миРНК, каждая из комплементарной нити РНК синтезируется отдельно, а затем отжиг двух нитей выполняется, с получением желаемой миРНК, двухцепочечной РНК.
Пример 2: Способ синтеза конкретного иллюстративного соединения в соответствии с вариантом осуществления изобретения:
Синтез иллюстративного соединения в соответствии с вариантами осуществления изобретения инициируется из литохолевой кислоты желчных кислот, (которая может служить в качестве примера фрагмента B, как описано выше).
Перфтор-трет-бутанол является коммерчески доступным, и может служить в качестве примера фрагмента A, как описано выше.
Синтез протекает, как описано на схеме I ниже. В данном примере, Е фрагмент предназначен для того, чтобы быть связанным с 5-концом олигонуклеотида, и, следовательно, имидофосфитный фрагмент добавляется на последней стадии синтеза.
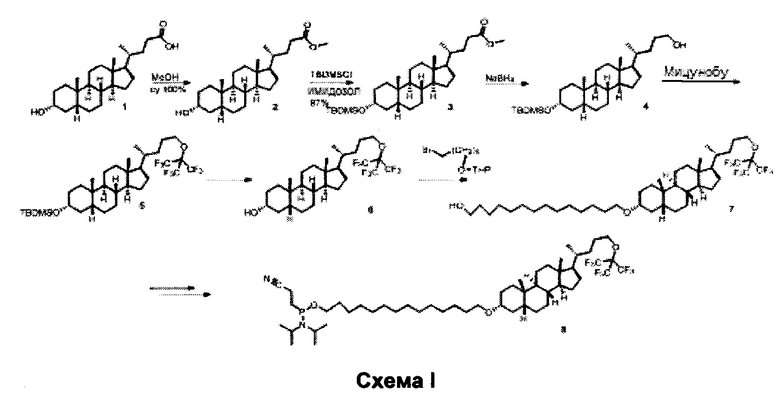
25 г материала 1 превращали в 26 г (количественно) метилового сложного эфира (материал 2). 26 г материала 2 подвергали взаимодействию с TBDMSCI NS получали 29 г (87%) ЯМР чистого материала 3. Восстановление материала 3 (29 г) до материала 4 с NaBH4 ТГФ/МеОН давало, после обработки и очистки, 25 г материала 4 (85%) по ЯМР с все еще некоторыми следовыми количествами материала 3. Реакция Мицунобу материала 4 с перфтор-трет-бутанолом давала, после обработки с использованием колоночной хроматографии и растирания с MeOH, 33,5 г (92%) материала 5, с которого после этого снимали защиту, чтобы получить стероид 6. Стероид 6 (2,5 г) затем сочетали с THP-защищенным бромтетрадеканолом. Сочетание занимало 3 дня, и 4 эквивалента THP-защищенного бромтетрадеканола было необходимо для того, чтобы достичь полного превращения. Продукт чистили с использованием колоночной хроматографии. После удаления защитной группы (ТНР) с МеОН/1,4-диоксаном (HCl, 4 N)/TTO, продукт 7 чистили с использованием колоночной хроматографии для того, чтобы удалить примеси. Продукт 7 (1,5 г, 48%) получали в виде белого твердого вещества. Продукт 7 затем превращали в требуемое соединение 8, путем присоединения имидофосфитной группы.
Пример 3: Структуры предшественников и соответствующих соединений, присоединенных к олигонуклеотидам
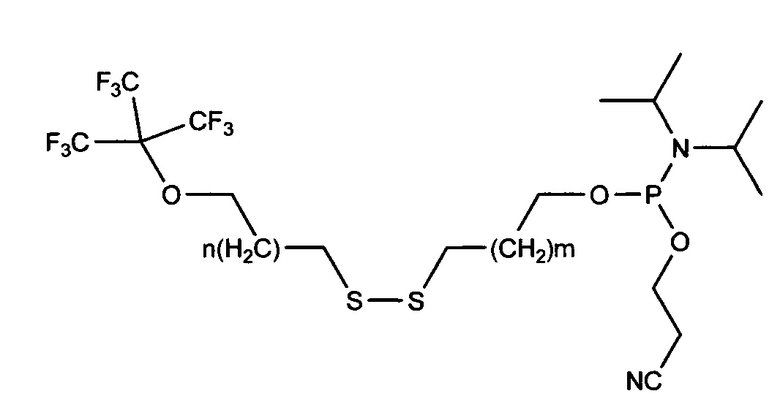
5' модификация:
Предшественник:
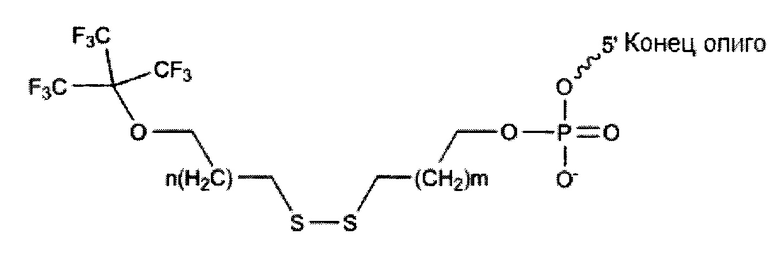
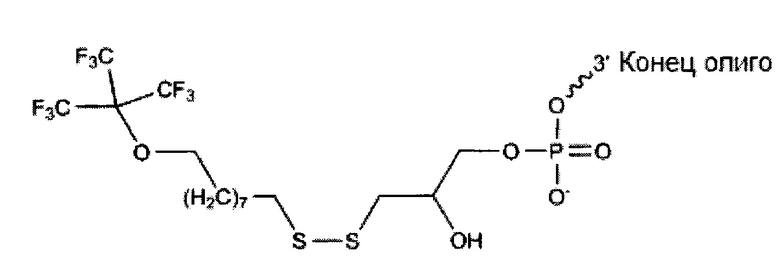
В качестве присоединенного к олигонуклеотиду:
3' модификация:
Предшественник:
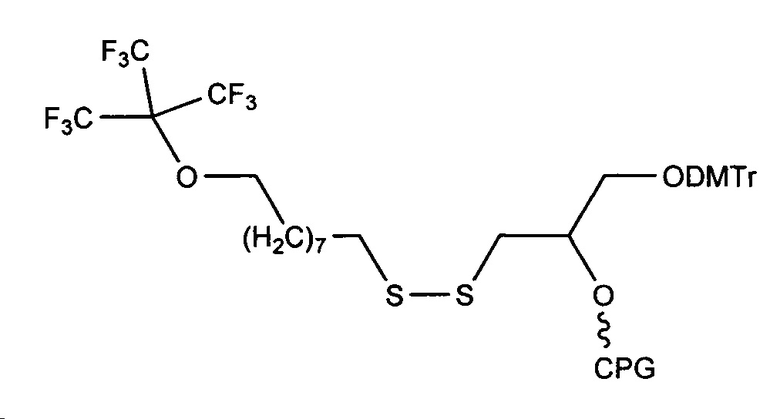
DMT = Диметокситритил;
CPG = Стекло с контролируемым размером пор (CPG) в качестве твердой подложки для синтеза олигонуклеотида.
В качестве присоединенного к олигонуклеотиду:
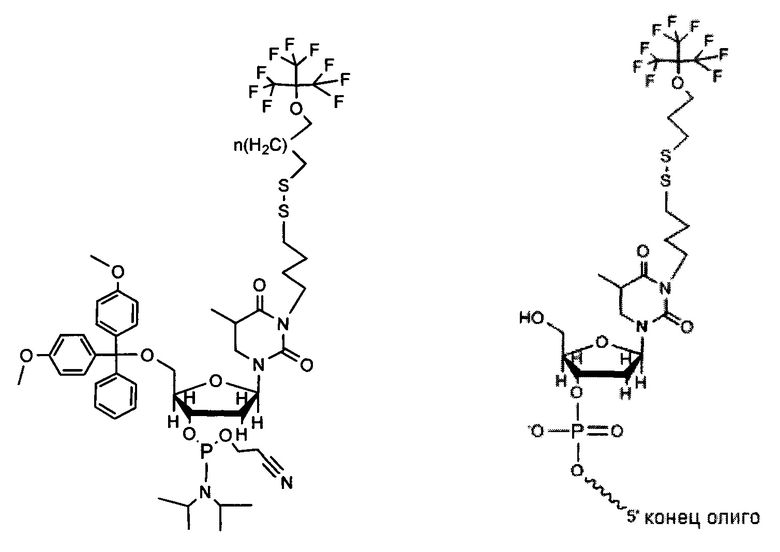
5' модификация; присоединение соединения к нуклеиновому основанию (например, тимин):
Предшественник, присоединенный к олигонуклеотиду
Пример 4; Иллюстративная структура соединения, конъюгированного с белком Cas9 в соответствии с вариантами осуществления изобретения
Структура "молекулярного двигателя" согласно изобретению, конъюгированного с белком Cas9 схематически проиллюстрирована на Фиг. 4. Структура основывается на кристаллографическом исследовании структуры белка Cas9 (Nishimazu FG, et al., Cell 156: 935-949, 2014). Соединения E в соответствии с вариантами осуществления изобретения будут присоединяться через их Q группу к белку, связываясь с лизиновыми боковыми-цепями на поверхности белка. Для присоединения будут использоваться активные сложные эфиры. Спирт будет превращен в карбонатный активный сложный эфир, который предпочтительно взаимодействует с азотом (боковые цепи лизина белка) в связи с кислородом (вода). Реакцию будут проводить в соответствии со следующей схемой II:
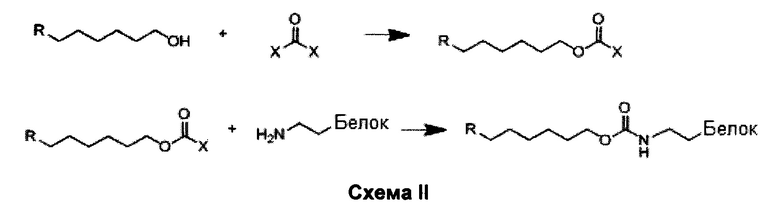
Возможные дериватизирующие агенты:
Фосген: связывание происходит посредством хлорформиатного сложного эфира.
Дисукцинимидилкарбонат (X = N-гидроксисукцинимид): связывание происходит посредством сукцинимидилкарбоната.
Карбонилдиимидазол (CDI, X = Имидазол): связывание происходит посредством имидазолилкарбамата.
Введение метки в белок с какой-либо из данных групп происходит в свободную аминогруппы (не Трис), слабощелочной буфер (pH=8-9). Точка связи является гидрофобной, таким образом, требует сопутствующий растворитель (обычно ДМФ или ДМСО) для реакции с белками. Высокая реакционная способность означает сокращение времени реакции, но также более низкую селективность к азоту по отношению к кислороду и более короткое время жизни в водном буфере. Со всеми активными сложными эфирами, продукт представляет собой карбамат, который может быть восприимчивым к ферментативному расщеплению. Из этих трех приведенных выше вариантов, карбонилдиимидазол имеет самую высокую селективность к азоту по отношению к кислороду, а также наиболее простой синтез. С другой стороны, дериватизация белка может занять больше времени (возможно, в течение ночи). Число E фрагментов на молекулу белка определяется, предварительно установив требуемые молярные соотношения.
Пример 5: Клеточный захват и локализация меченной Cy3 SS 29-звенной ДНК-последовательности in vitro в соответствии с вариантами осуществления настоящего изобретения.
Клеточная культура:
NIH-3T3 клеточные линии стабильно трансфицированные с GFP получали от Cell Biolabs, San-Diago, USA (cat-AKR214).
Клетки выращивали в среде Игла, модифицированной по способу Дульбекко (DMEM; Gibco cat-41965), дополненной 10% фетальной бычьей сывороткой (FBS; Biological Industries cat-04-011-1A), 2 мМ L-глутамина (Biological Industries cat-03-020-1B), 1% пенициллин-стрептомицин (Biological Industries cat-03-031-1 В) и 10 мкг/мл бластицидин (Enzo cat-ALX-380-089) при 37°C во влажном инкубаторе, содержащем 5% CO2.
Оценка доставки 29-мерной ДНК в клетки; In-vitro анализ:
За один день до эксперимента NIH-3T3-GFP клетки в экспоненциальной фазе роста высевали в 24-луночные планшеты с плотностью 4,5×104 клеток/лунку с DMEM плюс среда для роста с добавками (500 мкл/лунка) без антибиотиков. Каждый из меченных Cy3 олигонуклеотидов разбавляли 100 мкл/лунка Opti-Mem (Life technologies-Cat. 31985062) и добавляли к клеткам с конечной концентрацией, которая варьирует от 40 до 100 нМ. Накопление меченной Cy3 олигонуклеотидной системы доставки в пределах клеток оценивали через 2, 4, 8 и 24 часа после инкубирования. После периода инкубирования клетки промывали сбалансированным солевым раствором Хенкса (HBSS буфер; Biological Industries) и подвергали анализу.
Обнаружение и количественное определение Cy3-положительной популяции проводили с использованием многомодового ридера Tecan Infinite® 200 PRO (длина волны возбуждения 548±4,5 нм и эмиссии 580±10 нм).
Транс-мембранную доставку соединения в соответствии с вариантами осуществления изобретения, присоединенное к Cy3-оцДНК олигонуклеотид (29 нуклеотидов) (Syncom, the Netherlands; IDT, USA) сравнивали с контрольным Cy3-оцДНК олигонуклеотидом (IDТ, USA) и выражали в процентах от Cy3-положительных клеток по сравнению с необработанными клетками.
Флуоресцентная микроскопия:
NIH-3T3 GFP клетки с плотностью 4,5×104/лунку высевали за 24 ч до экспериментов. Среду для роста заменяли на свежую среду, содержащую соединение в соответствии с вариантами осуществления изобретения, присоединенного к Cy3-оцДНК олигонуклеотиду (29 нуклеотидов) (40-100 нМ растворенного в воде без дезоксирибонуклеазы/рибонуклеазы) или контрольной Cy3-оцДНК (IDT, USA) и инкубировали 2, 4, 8 и 24 ч при 37°С.
После инкубирования, клетки промывали HBSS и визуализировали с использованием флуоресцентного микроскопа Olympus (BX51TF; Olympus Optical, U.K.), с УФ излучением от ртутной лампы. Cy3-флуорофор визуализировали с длиной волны возбуждения 470-495 нм и эмиссии на 590 нм. GFP-флуорофор визуализировали с длиной волны возбуждения 530-550 нм и эмиссии на 510-550 нм.
Биологическая активность конъюгата в соответствии с вариантами осуществления изобретения, при доставке через фосфолипидные мембраны, в клетки, ASO оц (одноцепочечной) 29-мерной ДНК, связанной с его 5'-концом, посредством фосфатной связи с E фрагментом (в данном примере соединение Формулы VIIa) в соответствии с вариантами осуществления изобретения, описывается на фигурах 5A и 5B Конструкт также имел iCy3-флуорофор на 5'-конце. Оценивали доставку в NIH-3T3 клетки, стабильно трансфицированных с GFP белком.
Фиг. 5А показывает результаты 3T3-GFP клеток, которые инкубировали с соединением в соответствии с вариантами осуществления изобретения, присоединенными к Cy3-оцДНК ("E-конъюгат") или Cy3-оцДНК в концентрации 100 нМ в течение периода времени 8 часов. Клетки впоследствии анализировали с использованием флуоресцентной микроскопии (×20 величина).
E-конъюгат показан на верхней панели, тогда как нижняя панель представляет собой контрольный ASO, не содержащий соединение в соответствии с вариантами осуществления изобретения ("E фрагмент").
Как показано, в то время как контрольный конструкт, не содержащий E фрагмент, не проявлял какой-либо значительной доставки в клетки, E-конъюгат проявлял захват в почти во всех клетках. Изображения были получены после 8 часов инкубирования при 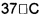 . Показано инкубирование со 100 нМ E-конъюгата.
. Показано инкубирование со 100 нМ E-конъюгата.
Количественный анализ согласно ИФА
3T3-GFP клетки инкубировали с E-конъюгатом или Cy3-оцДНК при варьировании концентрациями (40 нМ и 100 нМ) в течение 24 часов. Клетки промывали и определяли с помощью ИФА флуориметра. Cy3 флуоресцентные уровни сравнивали с 3T3-GFP необработанными клетками.
Как показано на Фиг. 5B, при дозах 40 нМ и 100 нМ, конъюгат проявлял 4-кратную и 3-кратную повышенную доставку в клетках, по сравнению с контролями.
Пример 6: Нокдаун мРНК с использованием миРНК in vitro
Оценивают ингибиторную активность 25-27 пар оснований дсРНК в клетках стабильно экспрессирующих GFP (зеленый флуоресцентный белок) ген-репортер. Для данной цели, стабильно трансфицированные NIH 3T3 клетки, экспрессирующие GFP являются трансфицированными с 25-27-мерными дсРНК дуплексами (каждый при 10-40 нМ). Для того, чтобы получить количественную оценку продолжительности нокдаун GFP гена, будут проводить эксперимент по определению зависимости от времени, наблюдая GFP экспрессию после трансфекции.
За один день до эксперимента NIH-3T3-GFP клетки в экспоненциальной фазе роста будут высевать в 24-луночные планшеты с плотностью 4,5×104 клеток/лунку с DMEM плюс среда для роста с добавками (500 мкл/лунка) без антибиотиков. Каждый из меченных Cy3 олигонуклеотидов разбавляли 100 мкл/лунка Opti-Mem (Life technologies-Cat. 31985062) и добавляли к клеткам с конечной концентрацией, которая варьирует от 40 до 100 нМ. Нокдаун мРНК GFP в пределах клеток будут оценивать через 24, 48 и 72 ч после инкубирования. После периода инкубирования клетки промывали сбалансированным солевым раствором Хенкса (HBSS буфер; Biological Industries) и подвергали анализу. Обнаружение и количественное определение GFP-положительной популяции проводили с использованием многомодового ридера Tecan Infinite® 200 PRO (длина волны возбуждения 488±4,5 нм и эмиссии 535±10 нм).
Активность нокдауна соединения в соответствии с вариантами осуществления изобретения, присоединенного к дсРНК с 25-27 парами основ (Syncom, the Netherlands; IDT, USA) будут сравнивать с контрольными дсРНК с 25-27 парами основ (IDT, USA) и выражали как процент от GFP-положительных клеток по сравнению с необработанными клетками.
Пример 7: Механизм внутриклеточного захвата миРНК. включающий введение дайсер-субстрата
В варианте осуществления изобретения способ захвата миРНК в цитоплазме основывается на активности дайсер-фермента, при обработке двухцепочечной РНК, разрезая его на размер 19-21 пар оснований, приемлемой для взаимодействия с комплексом RISC для подавления экспрессии гена. Указанный способ включает: (i). введение дайсер-субстрата, содержащего двухцепочечную РНК из 25-30 нуклеотидов, которая включает последовательность для подавления экспрессии гена-мишени, где соединения в соответствии с вариантами осуществления изобретения присоединяются к 3'-концу нетранскрибируемой (клонированной) цепи и/или к 5'-концу антисмысловой (направляющей) цепи; (ii), транс-мембранную доставку миРНК; и (iii), расщепление дсРНК с использованием дайсер-фермента, таким образом высвобождая миРНК для взаимодействия с комплексом RISC, для подавления экспрессии гена-мишени.
Для анализа дайсер-расщепления in vitro, миРНК дуплексы (100 пиоль) могут быть инкубированными в 20 мл 20 мМ Tris pH 8,0, 200 мМ NaCl, 2,5 мМ MgCl2, с 1 единицей рекомбинантного человеческого дайсера (Stratagene) в течение 24 ч. Аликвоту в 3 мл от каждой реакционной смеси (15 пмоль РНК) будут отбирать в 15% неденатурирующий полиакриламидный гель, окрашенный GelStar (Ambrex) и визуализировать с использованием УФ возбуждения. Жидкостная хроматография с ионизацией электрораспылением масс-спектроскопия (ESILCMS) дуплексных РНК перед и после обработки дайсером будет выполняться с использованием системы Oligo HTCS (Novatia), которая состоит из ThermoFinniganTSQ7000, системы данных Xcalibur, система программного обеспечения обработки данных ProMass и Paradigm MS4 ВЭЖХ (Michrom BioResources).

Изобретение относится к биохимии и медицине. Предложено соединение для применения в трансмембранной доставке лекарственного средства, имеющее структуру (VI), (VII), (VIIa), (VIII), (IX) или (IXa), как указано в формуле. Структура молекулы создает векторную систему, способствующую движению молекулы в пределах фосфолипидной мембраны от границы раздела мембрана/вода к мембранному ядру. Соединения могут использоваться в медицинской практике, например в доставке природной или модифицированной РНК или ДНК, малой интерферирующей РНК (миРНК), антисмыслового олигонуклеотида (ASO) или терапевтического белка, CRISPR белка, дайсер-субстрата, содержащего двухцепочечную РНК из 25-30 нуклеотидов, которая включает последовательность гена-мишени для сайлесинга, или какой-либо их комбинации через биологические мембраны для лечения заболеваний. 2 з.п. ф-лы, 5 ил., 7 пр.
1. Соединение для применения в трансмембранной доставке лекарственного средства, имеющее структуру, представленную формулой (VI)
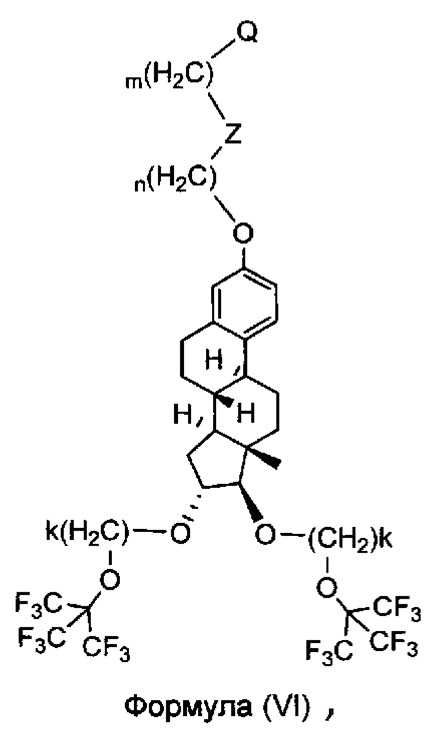
в которой n и m представляют собой целые числа, каждый независимо выбранный из нуля и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20;
k представляет собой целое число, выбранное из 2, 3, 4, 5, 6 или 7; и
Z отсутствует или представляет собой карбамат или представляет собой -S-S- и
Q представляет собой точку связывания с лекарственным средством;
или имеющее структуру, представленную формулой (VII)
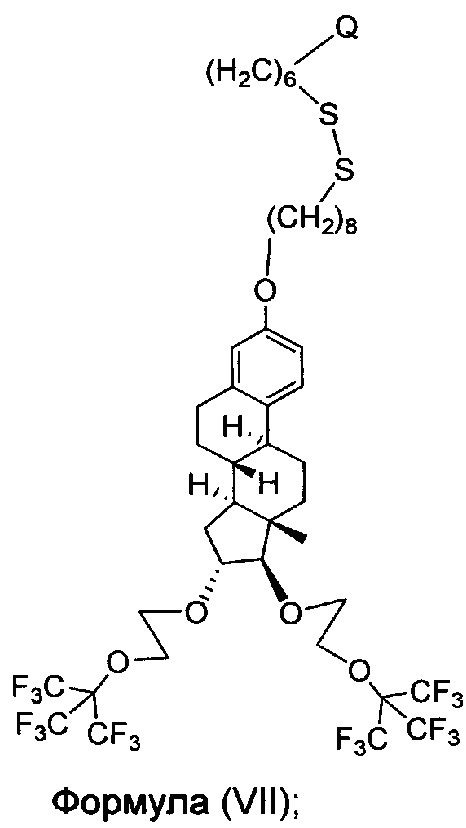
или имеющее структуру, представленную формулой (VIIa)
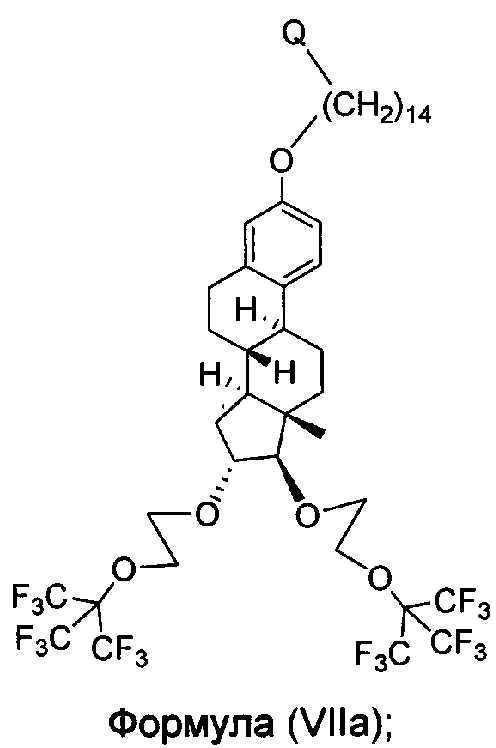
или имеющее структуру, представленную формулой (VIII)
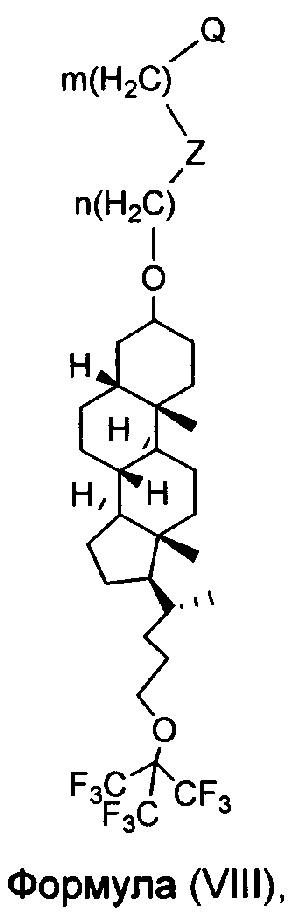
в которой n и m представляют собой целые числа, каждый независимо выбранный из нуля и 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19 или 20;
Z отсутствует или представляет собой -S-S- или карбамат и
Q представляет собой точку связывания с лекарственным средством;
или имеющее структуру, представленную формулой (IX)

или имеющее структуру, представленную формулой (IXa)
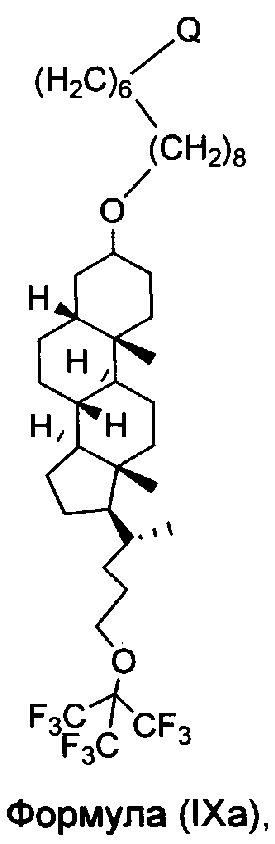
или его фармацевтически приемлемая соль, гидрат или сольват.
2. Соединение по п.1, где указанное лекарственное средство выбирают из природной или модифицированной РНК или ДНК, малой интерферирующей РНК (миРНК), антисмыслового олигонуклеотида (ASO) или терапевтического белка, CRISPR белка, дайсер-субстрата, содержащего двухцепочечную РНК из 25-30 нуклеотидов, которая включает последовательность гена-мишени для сайлесинга, или какой-либо их комбинации.
3. Соединение по п.1, где указанное лекарственное средство применяют для лечения по меньшей мере одного заболевания, выбранного из рака, токсического инсульта, ишемического заболевания, инфекционного заболевание, болезни депонирования белка, травмы, иммуноопосредованного заболевания, или дегенеративного заболевания, такого как болезнь Альцгеймера, болезнь двигательных нейронов, болезнь Паркинсона, болезнь Хантингтона, рассеянный склероз и болезнь Крейтцфельда-Якоба.
| US 2006167223 A1, 27.07.2006 | |||
| YUE XUYI et al | |||
| "Synthesis and characterization of fluorinated conjugates of albumin", JOURNAL OF FLUORINE CHEMISTRY, 2013, v.152, p.173-181, DOI: 10.1016/J.JFLUCHEM.2013.01.026 | |||
| Дорожная спиртовая кухня | 1918 |
|
SU98A1 |
| US 6028066 A, 22.02.2000 | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| US 2011123457 A1, 26.05.2011 | |||
| BELLUCCI M.C | |||
| et al | |||
| "Multicomponent Synthesis of Peptide-Sugar Conjugates Incorporating Hexafluorovaline", ADVANCED SYNTHESIS & CATALYSIS, 2010, v.352, no.16, p.2791-2798, doi: 10.1002/adsc.201000489 | |||
| ZHONG-XING JIANG et al | |||
| "The Design and Synthesis of Highly Branched and Spherically Symmetric Fluorinated Macrocyclic Chelators", SYNTHESIS, 2008, v.2008, no.2, p.215-220, doi: 10.1055/S-2007-1000857 | |||
| BLAZEJEWSKI J | |||
| et al | |||
| "Synthesis, Characterization and Biological Evaluation of 7[alpha]-Perfluoroalkylestradiol Derivatives", BIOORGANIC & MEDICINAL CHEMISTRY, 2003, v.11, no.3, p.335-345, doi: 10.1016/S0968-0896(02)00457-1 | |||
| VIERLING P | |||
| et al | |||
| "Highly fluorinated amphiphiles as drug and gene carrier and delivery systems" | |||
| Journal of Fluorine Chemistry, 2001, v.107, no.2, p.337-354 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ПОЛИПЕПТИД, СПОСОБНЫЙ ПРЕОДОЛЕВАТЬ ГЕМАТОЭНЦЕФАЛИЧЕСКИЙ БАРЬЕР, И ЕГО КОНЪЮГАТ | 2005 |
|
RU2408605C2 |
Авторы
Даты
2019-10-16—Публикация
2015-03-29—Подача