Настоящая заявка испрашивает приоритет в соответствии с §119(e) Федерального закона США №35 согласно предварительной заявке на патент США №61/522009, поданной 10 августа 2011 г. Вышеуказанная заявка включена в настоящую заявку посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение в целом относится к области аутоиммунных и воспалительных заболеваний. В частности, в настоящем изобретении предложены новые композиции и способы лечения заболеваний, в патологии которых присутствует аутоиммунный и/или воспалительный компонент.
УРОВЕНЬ ТЕХНИКИ
Аутоиммунное заболевание возникает в том случае, когда организм не способен распознавать свои составляющие части как «собственные», в результате чего развивается иммунный ответ против собственных клеток и тканей. Другими словами, организм фактически атакует свои собственные клетки. Иммунная система ошибочно принимает некоторую часть организма за патоген и атакует ее. Существующие способы лечения аутоиммунных заболеваний, как правило, включают подавление иммунитета и/или симптоматическое лечение не модифицирующими заболевание противовоспалительными средствами для уменьшения вреда, наносимого таким аберрантным иммунным ответом. Вместе с тем, в данной области техники существует потребность в способах и композициях для подавления и/или задержки возникновения патологии, связанной с аутоиммунными расстройствами.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В соответствии с одним аспектом настоящего изобретения предложены способы подавления, лечения и/или предотвращения возникновения аутоиммунного и/или воспалительного заболевания и/или заболеваний, в патологии которых присутствует аутоиммунный и/или воспалительный компонент, у нуждающихся в этом пациентов. Указанные способы включают введение по меньшей мере одного ингибитора RhoB. Согласно конкретному варианту реализации указанный ингибитор RhoB представляет собой антитело или фрагмент антитела, иммунологически специфичные по отношению к RhoB или его пептидному фрагменту. Согласно конкретному варианту реализации указанный ингибитор RhoB представляет собой структурно родственную или полученную из указанного антитела малую молекулу, фрагмент антитела, пептидный фрагмент или химический или биологический миметик CDR-областей антител и эпитопов, распознаваемых указанными CDR. Согласно конкретному варианту реализации указанный ингибитор RhoB представляет собой пептид RhoB. Согласно конкретному варианту реализации указанные способы включают введение композиции, содержащей по меньшей мере один пептид RhoB и/или антитело или фрагмент антитела, иммунологически специфичные по отношению к RhoB или его пептидному фрагменту, и по меньшей мере один фармацевтически приемлемый носитель. Согласно конкретному варианту реализации указанные способы дополнительно включают введение по меньшей мере одного противовоспалительного агента и/или иммунодепрессанта одновременно и/или последовательно с по меньшей мере одним ингибитором RhoB (например, антителом или фрагментом антитела, иммунологически специфичным по отношению к RhoB или его пептидному фрагменту).
Также предложены композиции для подавления, лечения и/или предотвращения воспалительного или аутоиммунного заболевания. Указанные композиции содержат по меньшей мере один ингибитор RhoB и по меньшей мере один фармацевтически приемлемый носитель. Согласно конкретному варианту реализации указанный ингибитор RhoB представляет собой антитело или фрагмент антитела, иммунологически специфичные по отношению к RhoB или его пептидному фрагменту. Согласно конкретному варианту реализации указанный ингибитор RhoB представляет собой пептид RhoB. Согласно другому варианту реализации указанная композиция дополнительно содержит по меньшей мере одно противовоспалительное соединение и/или по меньшей мере один иммуносупрессивный агент.
В соответствии с настоящим изобретением также предложены антитела против RhoB, RhoB-пептид (например, для получения антител) или структурно родственные или полученные из указанного антитела малые молекулы, фрагмент антитела, пептидный фрагмент или химический или биологический миметик областей CDR антител и эпитопов, распознаваемых указанными CDR, и содержащие их композиции.
В соответствии с одним из аспектов настоящего изобретения предложены способы подавления, лечения и/или предотвращения состояния или расстройства, связанного с повышенными уровнями иммуноглобулина в сыворотке крови (например, гипергаммаглобулинемии или моноклональной гаммапатии неясного значения) у нуждающихся в этом пациентов. Указанные способы включают введение по меньшей мере одного ингибитора RhoB согласно настоящей заявке.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
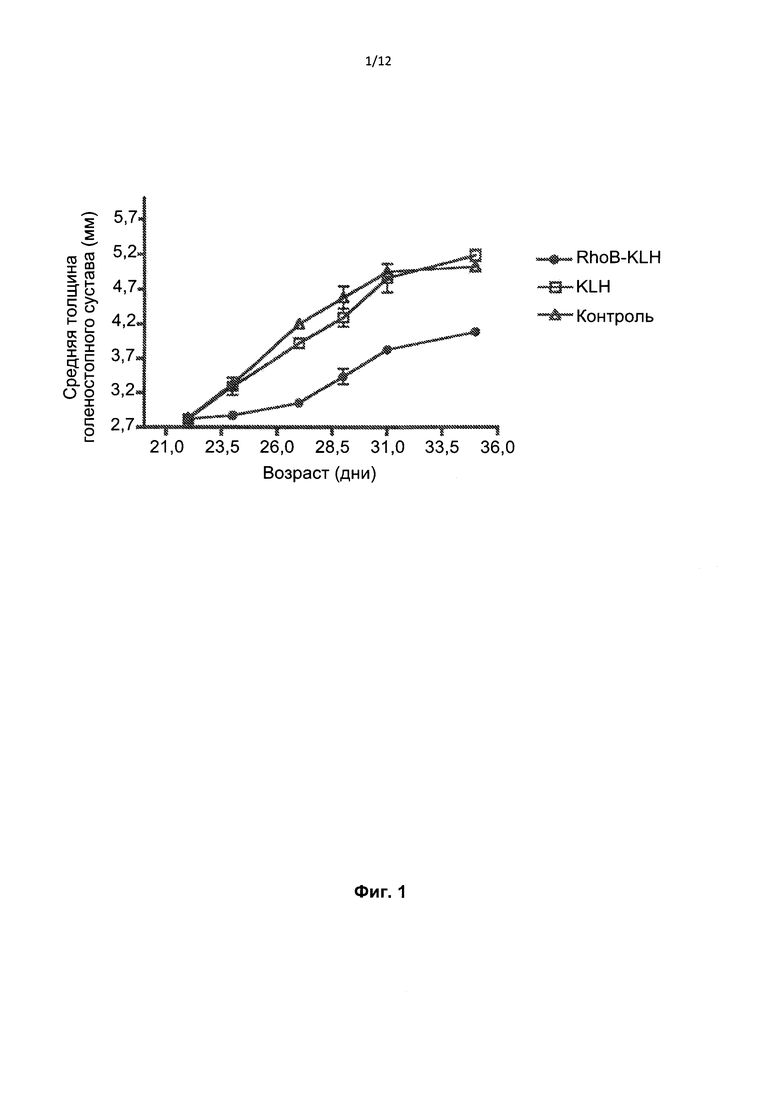
Фиг. 1 представляет собой график изменения средней толщины голеностопного сустава от времени у мышей K/BxN, которые получали лечение антисывороткой к пептиду RhoB, антисывороткой к KLH или только носителем.
Фиг. 2А представляет собой график титра Ig против глюкоза-6-фосфат-изомеразы (GPI, ГФИ) в сыворотке мышей K/B×N, получавших лечение антисывороткой к RhoB-пептиду, антисывороткой к KLH или только носителем. Фиг. 2В представляет собой график количества секретирующих анти-ГФИ клеток на 105 клеток мышей K/B×N, получавших лечение антисывороткой RhoB-пептиду, антисывороткой к KLH или только носителем.
На Фиг. 3 приведена аминокислотная последовательность RhoB человека (SEQ ID NO: 3). Подчеркнутая последовательность представляет собой Пептид 1 (SEQ ID NO: 1).
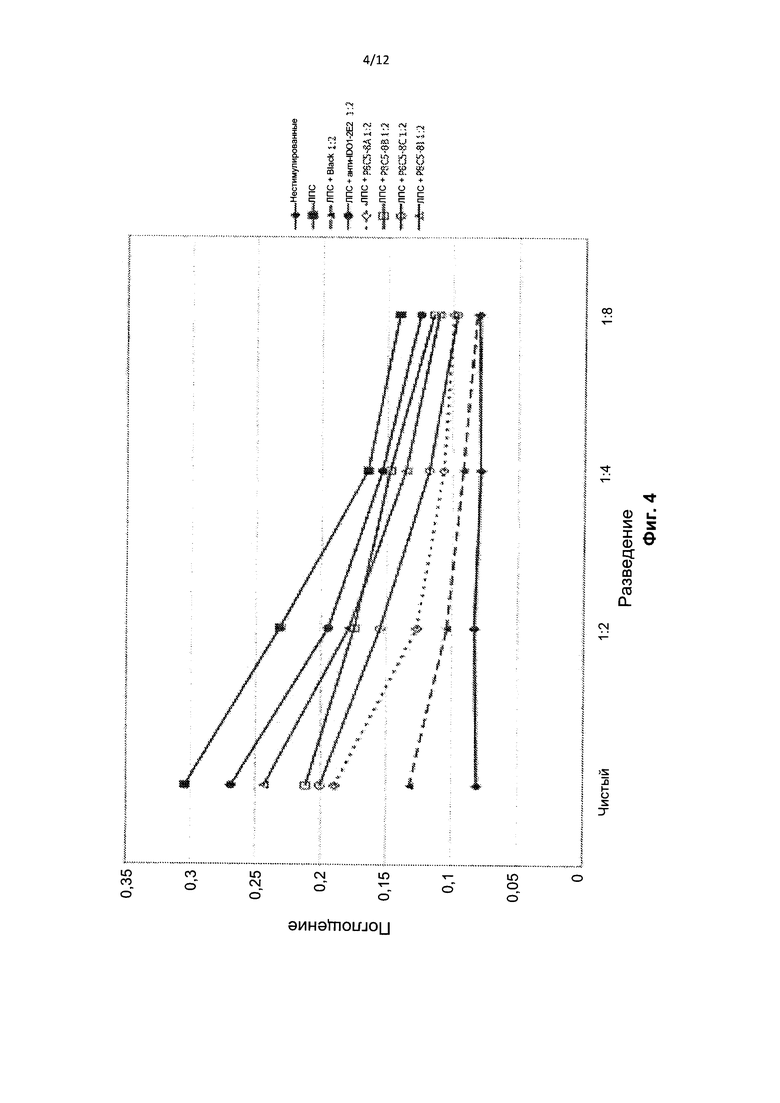
На Фиг. 4 представлен график секреции IgM со стимуляцией или без стимуляции липополисахаридами (ЛПС) в присутствии или в отсутствие контрольного антитела или антител против RhoB из гибридомы или ее субклона.
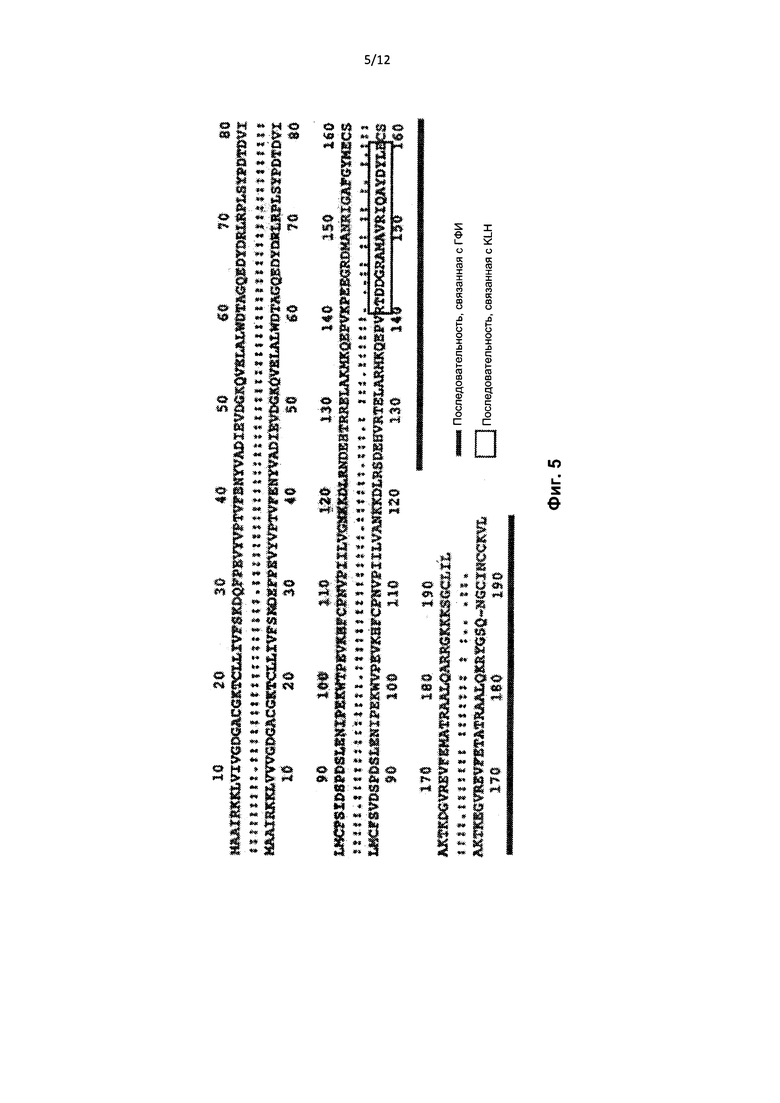
На Фиг. 5 представлено выравнивание последовательностей RhoA (SEQ ID NO:4) и RhoB (SEQ ID NO:3). Подчеркнутые последовательности и обведенные последовательности представляют собой антигены, соответствующие антителам к RhoB.
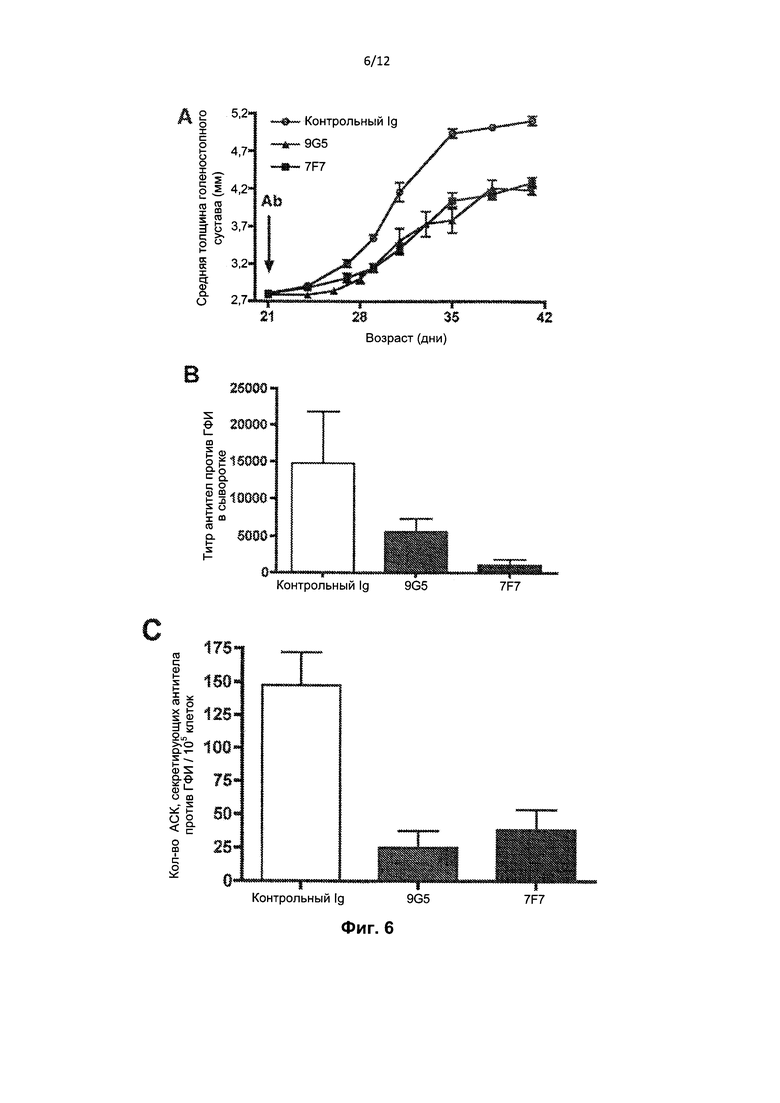
На Фиг. 6А представлен график толщины голеностопного сустава задней лапы ±SEM у мышей K/B×N, получавших лечение моноклональным антителом 9G5 или 7F7 против RhoB или контрольным Ig до начала артрита (возраст 21 день). На Фиг. 6В и 6С представлены графики титров аутоантитела против ГФИ и количества секретирующих антитело против ГФИ клеток (ACK) у указанных мышей, соответственно.
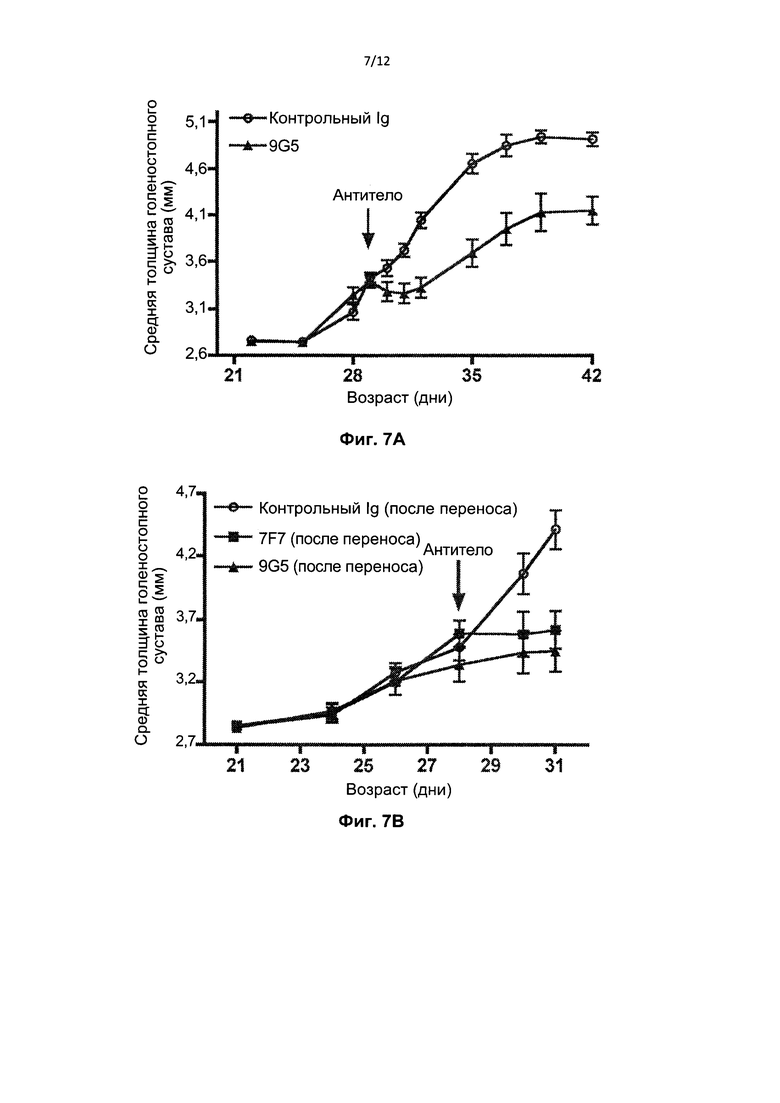
На Фиг. 7А представлен график толщины голеностопного сустава задней лапы ±SEM на протяжении длительного периода времени у мышей K/B×N, получавших лечение моноклональным антителом 9G5 против RhoB или контрольным Ig после возникновения артрита в возрасте 4 недель. На Фиг. 7В представлен график толщины голеностопного сустава задней лапы ±SEM на протяжении более короткого периода времени у мышей K/B×N, получавших лечение моноклональным антителом 9G5 или 7F7 против RhoB, или контрольным Ig после возникновения артрита в возрасте 4 недель.
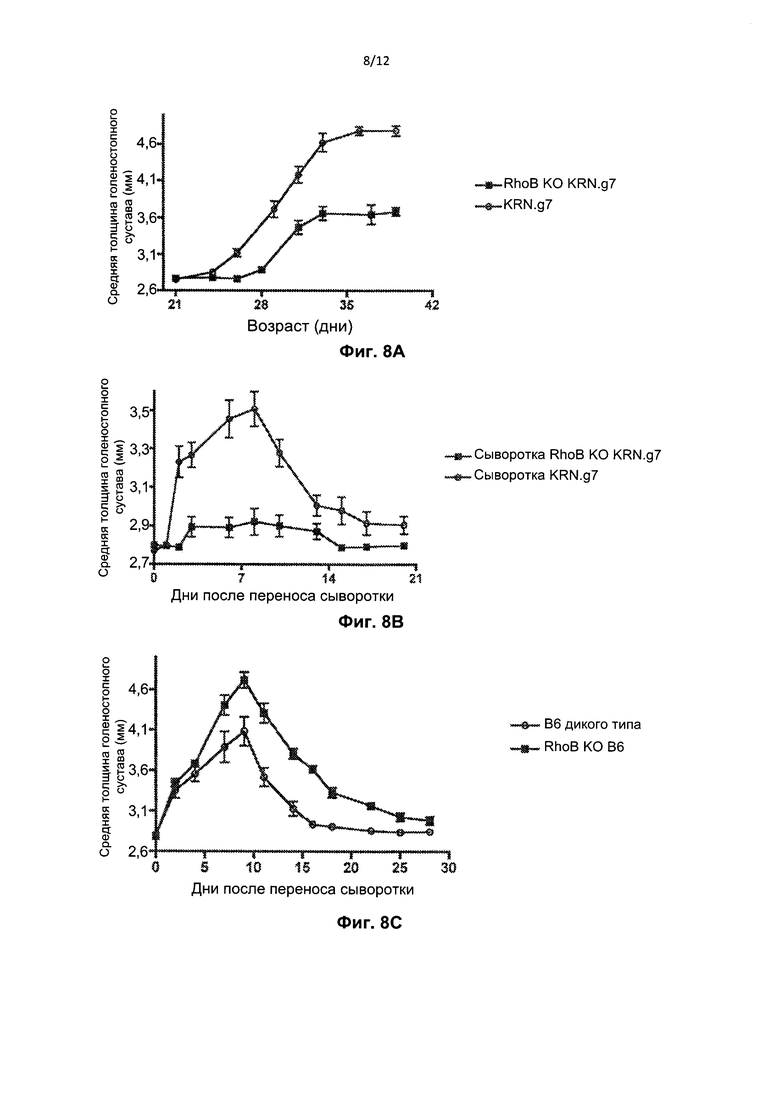
На Фиг. 8А представлен график толщины голеностопного сустава задней лапы ±SEM у мышей RhoB КО с артритом (RhoB KO KRN.g7). На Фиг. 8В представлен график толщины голеностопного сустава задней лапы ±SEM у не получавших предварительного лечения мышей C57B L/6, которым переливали сыворотку от мышей KRN В6.g7 или RhoB KO KRN В6.g7 на 0 день. На Фиг. 8С представлен график толщины голеностопного сустава задней лапы ±SEM у не получавших предварительного лечения мышей дикого типа или мышей RhoB KO C57BL/6, которым переливали сыворотку от мышей с артритом K/B×N на 0 день.
На Фиг. 9А приведены нуклеотидная (SEQ ID NO: 9) и аминокислотная (SEQ ID NO:10) последовательности легкой цепи 7F7. На Фиг. 9В приведены нуклеотидная (SEQ ID NO: 11) и аминокислотная (SEQ ID NO: 12) последовательности тяжелой цепи 7F7. Вертикальными линиями обозначены границы между доменами. Жирным шрифтом - вариабельная область (V); подчеркиванием - J-область (J); курсивом - D-область (D); FWR - каркасная область; CDR - определяющая комплементарность область.
На Фиг. 10А приведены нуклеотидная (SEQ ID NO: 13) и аминокислотная (SEQ ID NO: 14) последовательности легкой цепи 9G5. На Фиг. 10В приведены нуклеотидная (SEQ ID NO: 15) и аминокислотная (SEQ ID NO: 16) последовательности тяжелой цепи 9G5. Вертикальными линиями обозначены границы между доменами. Жирным шрифтом - вариабельная область (V); подчеркиванием - J-область (J); курсивом - D-область (D); FWR - каркасная область; CDR - определяющая комплементарность область.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Стабильные гибридомы, синтезирующие моноклональное антитело против RhoB, было трудно получать и поддерживать. При попытках получить гибридому наблюдали гибель большинства гибридом, либо прекращение секреции ими антитела против RhoB. Указанное наблюдение привело к возникновению гипотезы о возможном подавлении синтеза антител в В-клетках антителом против RhoB. В настоящем документе показано, что антитела против RhoB могут подавлять секрецию иммуноглобулинов стимулированных В-клеток мыши. Также в настоящем документе показано, что антитела против RhoB задерживают наступление и облегчают протекание артрита в модели опосредованного аутоантителами ревматоидного артрита (РА) на животных. При заболеваниях или при симптомах заболеваний, представляющих собой результат синтеза аутоантитела, благоприятной была бы терапия, блокирующая или снижающая синтез антител.
Введение антитела против RhoB можно осуществлять аналогично введению других терапевтических средств на основе антител, переносимых, несмотря на ненаправленный характер воздействия при лечении заболеваний. Примеры включают, не ограничиваясь перечисленными, терапевтические средства на основе антител против TNF (инфликсимаб, адалимумаб, этанерцепт), против CD20 (ритуксимаб) и против BLyS (белимумаб). Указанные терапевтические средства обычно ослабляют воспаление или полностью уничтожают В-клетки или функции В-клеток. Антитело против RhoB представляет собой возможный подход к лечению пациентов, которые плохо переносят указанные терапевтические средства.
При введении антител к RhoB токсичность или побочные эффекты предположительно будут незначительными или будут отсутствовать. Примечательно, что мыши с генетически обусловленным дефицитом RhoB являются нормальными и для них не характерна очевидная иммунологическая недостаточность, в том числе недостаточность В-клеточного ответа на стимуляцию антигенами или формирования IgG-памяти. Хотя у дефицитных по RhoB мышей генерируется нормальный ответ с антителами IgG, вторичный IgM-ответ у них действительно несколько ослаблен. Соответственно, технология, направленная против RhoB, как представляется, позволяет сдерживать аномальную активность В-клеток при синтезе аутоиммунных антител, но не нарушает нормальную функцию В-клеток при классической антигенной стимуляции. Примечательно, что RhoB представляет собой белок ответа на стресс с коротким периодом полужизни, так что, скорее всего, он быстро истощается, а также функционально подавляется при блокаде специфичным антителом.
RhoB представляет собой внутриклеточный белок. Без связи с конкретной теорией антитело против RhoB может проникать в клетки через Fc-рецептор. Это, соответственно, приводит к снижению токсичности или уменьшению побочных эффектов, поскольку только клетки, экспрессирующие Fc-рецептор, чувствительны к терапии антителом против RhoB. Аналогично, токсичность также должна быть ниже, чем у ненаправленных иммуномодулирующих агентов, таких как дексаметазон, преднизон или талидомид, которые в настоящее время применяются в клинической практике.
Хотя в настоящем изобретении описана терапия антителом против RhoB, вместо антител против RhoB или в сочетании с ними можно применять другие ингибиторы RhoB (например, активности и/или экспрессии RhoB). Так, можно применять молекулы нуклеиновой кислоты, подавляющие экспрессию RhoB, такие как миРНК и антисмысловые молекулы. Было показано, что микро-РНК-21 снижает экспрессию RhoB (Sabatel et al. PLoS One (2011) 6:e16979). Кроме того, определенные в настоящей заявке пептидные последовательности RhoB или структурно родственные малые молекулы на основе указанных пептидных последовательностей, или CDR, взаимодействующие с соответствующими эпитопами на RhoB, могут также служить в качестве ингибиторов активности RhoB, в частности, в сочетании с подходящими системами доставки.
Опосредованное антителом разрушение RhoB задерживает, подавляет и/или ослабляет воспалительный клеточный ответ, в который вовлечены В-клетки. Как упоминалось выше, антитела против RhoB можно применять для облегчения заболевания или симптомов заболевания, являющихся результатом синтеза и/или секреции аутоантител. Тем не менее, могут быть разработаны специфические нацеленные на RhoB терапевтические средства (например, доставляемые при помощи системы внутриклеточной доставки макромолекул (например, вариабельная область молекулы IgG)), которые останавливают или перенаправляют внутриклеточные воспалительные сигналы, обеспечиваемые В-клетками. Таким образом, терапия, направленная против RhoB, будет работать в вовлекаемых в хроническое воспаление типах клеток, таких как мезенхимальные клетки (эндотелиальные клетки, миофибробласты, гладкомышечные клетки, моноциты/макрофаги), которые, как полагают, вовлечены в развитие сердечнососудистых заболеваний (ССД), рака, диабета или других серьезных заболеваний, которые могут прямо или непрямо поддерживаться воспалительным тканевым окружением.
Доклинические исследования показали, что при ССД RhoB регулируется статинами, и имеются клинические доказательства того, что действие статинов «не связанное с снижением холестерина» может быть обусловлено противовоспалительным действием. Соответственно, способы анти-RhoB терапии можно применять для сдерживания атеросклероза или сочетать со статинами или другими противовоспалительными терапевтическими средствами в качестве вариантов терапии. При других характеристиках воспалительных тканей анти-RhoB может также подавлять воспалительный ответ фибробластов. Соответственно, анти-RhoB терапия может ослаблять фиброзный ответ, который способствует формированию рубцовой ткани, например, в коже, печени или сердце.
Относительно диабета было показано, что аутоантитела необходимы для активации обуславливающих заболевание Т-клеток (Harbers et al. (2007) J. Clin. Invest., 117:1361-1369). Соответственно, разработка подходов к предотвращению активации аутоантителами Т-клеток (например, снижения количества или ингибирования аутоантител) позволит предотвращать или лечить аутоиммунное заболевание. Примечательно, что, как было показано, антитела, специфичные в отношении CD20, могут облегчать начало диабета за счет сокращения субпопуляции В-клеток (Hu et al. (2007) J. Clin. Invest., 117:3857-3867). Помимо диабета, демонстрировалось опосредованное антителами лечение других аутоиммунных заболеваний. Например, было показано, что антитела против сфингозин-1-фосфатного рецептора облегчает колит в модели на мышах (Liao et al. (2009) FASEB J., 23:1786-96).
Как указывалось выше, настоящее изобретение обеспечивает композиции и способы для подавления, лечения и/или предотвращения аутоиммунных заболеваний и/или воспалительных заболеваний. Согласно конкретному варианту реализации указанные аутоиммунные заболевания или воспалительные заболевания, для лечения которых подходят способы согласно настоящему изобретению, представляют собой такие заболевания, при которых В-клетки вовлечены в патофизиологию и/или симптомы болезни. Такие аутоиммунные заболевания и воспалительные заболевания могут также называться опосредованными В-клетками аутоиммунными заболеваниями или воспалительными заболеваниями. Отмечалось, что В-клетки играют определенную роль в патофизиологии разнообразных аутоиммунных или воспалительных заболеваний (см., например, Browning, J.L. (2006) Nat. Rev. Drug Discov., 5:564-576).
В настоящей заявке термин «аутоиммунное заболевание» относится к наличию у субъекта аутоиммунного ответа (иммунного ответа, направленного против аутоантигена (собственного антигена)). Аутоиммунные заболевания включают заболевания, вызванные разрушением аутотолерантности, в результате которого адаптивная иммунная система реагирует на аутоантигены и опосредует повреждение клеток и тканей. Согласно конкретному варианту реализации аутоиммунные заболевания характеризуются как являющиеся результатом, по меньшей мере частичным, гуморального иммунного ответа.
Примеры аутоиммунных заболеваний включают, без ограничения, острый рассеянный энцефаломиелит (ОРЭМ), острый некротизирующий геморрагический лейкоэнцефалит, болезнь Аддисона, агаммаглобулинемию, аллергическую астму, аллергический ринит, очаговую алопецию, амилоидоз, анкилозирующий спондилит, опосредованное антителами отторжение трансплантата, анти-ГБМ/анти-ТВМ нефрит, антифосфолипидный синдром (АФС), аутоиммунный ангиоотек, аутоиммунную апластическую анемию, аутоиммунную дисавтономию, аутоиммунный гепатит, аутоиммунную гиперлипидемию, аутоиммунный иммунодефицит, аутоиммунное заболевание внутреннего уха (АЗВУ), аутоиммунный миокардит, аутоиммунный панкреатит, аутоиммунную ретинопатию, аутоиммунную тромбоцитопеническую пурпуру (АТП), аутоиммунное заболевание щитовидной железы, аутоиммунную уртикарию, аксональные и нейрональные нейропатии, болезнь Бало, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, болезнь Кастлемена, глютеновую болезнь, болезнь Шагаса, синдром хронической усталости, хроническую воспалительную демиелинизирующую полинейропатию (ХВДП), хронический рецидивирующий мультифокальный остеомиелит (ХРМО), синдром Черджа-Стросс, рубцовый пемфигоид/доброкачественный пемфигоид слизистых оболочек, болезнь Крона, синдром Когана, болезнь холодовых агглютининов, врожденную блокаду сердца, миокардит Коксаки, CREST-синдром, эссенциальную криоглобулинемию смешанного типа, демиелинизирующие нейропатии, герпетиформный дерматит, дерматомиозит, болезнь Девика (оптикомиелит), дискоидную волчанку, синдром Дресслера, эндометриоз, эозинофильный фасциит, узелковую эритему, экспериментальный аллергический энцефаломиелит, синдром Эванса, фибромиалгию, фиброзирующий альвеолит, гигантоклеточный артериит (темпоральный артериит), гломерулонефрит, синдром Гудпасчера, гранулематоз с полиангиитом (ГПА), болезнь Грейвса, синдром Гийена-Барре, энцефалит Хашимото, тиреоидит Хашимото, гемолитическую анемию, пурпуру Геноха-Шенлейна, гестационный герпес, гипогаммаглобулинемию, гипергаммаглобулинемию, идиопатическую тромбоцитопеническую пурпуру (ИДП), IgA-нефропатию, 1gG4-связанное склерозирующее заболевание, иммунорегуляторные липопротеины, миозит с включенными тельцами, воспалительное заболевание кишечника, инсулинозависимый диабет (тип 1), интерстициальный цистит, ювенильный артрит, ювенильный диабет, синдром Кавасаки, синдром Ламберта-Итона, лейкоцитокластический васкулит, красный плоский лишай, склеротический лишай, деревянистый конъюнктивит, линейное IgA-зависимое заболевание (LAD), волчанку (СКВ), болезнь Лайма, болезнь Меньера, микроскопический полиангиит, смешанное заболевание соединительной ткани (СЗСТ), моноклональную гаммапатию неясного значения (МГНЗ), язву Мурена, болезнь Мухи-Габерманна, рассеянный склероз, миастению гравис, миозит, нарколепсию, оптикомиелит (болезнь Девика), нейтропению, глазной рубцующийся пемфигоид, неврит зрительного нерва, палиндромный ревматизм, PANDAS (педиатрические аутоиммунные психоневрологические расстройства, связанные со Streptococcus), паранеопластическую дегенерацию мозжечка, пароксизмальную ночную гемоглобинурию (ПНГ), синдром Парри-Ромберга, синдром Персонейджа-Тернера, парспланит (периферический увеит), пузырчатку, периферическую нейропатию, перивенозный энцефаломиелит, пернициозную анемию, POEMS-синдром, узелковый полиартериит, аутоиммунные полигландулярные синдромы I, II, и III типа, ревматическую полимиалгию, полимиозит, постинфарктный синдром, посткардиотомный синдром, прогестероновый дерматит, первичный биллиарный цирроз, первичный склерозирующий холангит, псориаз, псориатический артрит, идиопатический легочный фиброз, гангренозную приодермию, истинную эритроцитарную аплазию, феномен Рейно, рефлекторную симпатическую дистрофию, синдром Рейтера, возвратный полихондрит, синдром беспокойных ног, ретроперитонеальный фиброз, ревматическую лихорадку, ревматоидный артрит, саркоидоз, синдром Шмидта, склерит, склеродермию, синдром Шегрена, аутоиммунитет к сперме и тестикулярный аутоиммунитет, синдром скованного человека, подострый бактериальный эндокардит (SBE), синдром Сусака, симпатическую офтальмию, артериит Такаясу, темпоральный артериит/гигантоклеточный артериит, тромбоцитопеническую пурпуру (ТЦП), синдром Толоса-Ханта, поперечный миелит, язвенный колит, недифференцированное заболевание соединительной ткани (НЗСТ), увеит, васкулит, везикулобуллезный дерматоз, витилиго, макроглобулинемию Вальденстрема (WM, МГВ) и гранулематоз Вегенера (Гранулематоз с полиангиитом (ГПА)).
Согласно конкретному варианту реализации указанное аутоиммунное заболевание выбрано из группы, состоящей из ревматоидного артрита, диабета I типа, системной красной волчанки (волчанки или СКВ), миастении гравис, рассеянного склероза, склеродермии, болезни Аддисона, буллезного пемфигоида, обыкновенной пузырчатки, синдрома Гийена-Барре, синдрома Шегрена, дерматомиозита, тромботической тромбоцитопенической пурпуры, гипергаммаглобулинемии, моноклональной гаммапатии неясного значения (МГНЗ), макроглобулинемии Вальденстрема (WM, МГВ), хронической воспалительной демиелинизирующей полирадикулонейропатии (ХВДП), энцефалопатии Хашимото (НЕ, ЭХ), тиреоидита Хашимото, болезни Грейвса, гранулематоза Вегенера и опосредованного антителами отторжения трансплантата (в частности, при трансплантации тканей, например, трансплантата почки). Согласно конкретному варианту реализации указанное аутоиммунное заболевание представляет собой диабет I типа, волчанку или ревматоидный артрит.
В настоящей заявке «воспалительное заболевание» относится к заболеванию, вызванному воспалением, являющемуся результатом воспаления или приводящему к воспалению. Термин «воспалительное заболевание» может также относиться к разрегулированной воспалительной реакции, которая вызывает гипертрофированный ответ макрофагов, гранулоцитов и/или Т-лимфоцитов, что приводит к аномальному повреждению тканей и гибели клеток. Согласно конкретному варианту реализации указанное воспалительное заболевание включает опосредованный антителами воспалительный процесс. «Воспалительное заболевание» может представлять собой острое или хроническое воспалительное состояние и может быть результатом инфекций или быть обусловлено неинфекционными причинами. Воспалительные заболевания включают, без ограничения, атеросклероз, артериосклероз, аутоиммунные расстройства, рассеянный склероз, системную красную волчанку, ревматическую полимиалгию (РПМ), подагрический артрит, дегенеративный артрит, тендинит, бурсит, псориаз, кистозный фиброз, артроостеит, ревматоидный артрит, воспалительный артрит, синдром Шегрена, гигантоклеточный артериит, прогрессирующий системный склероз (склеродермию), анкилозирующий спондилит, полимиозит, дерматомиозит, пузырчатку, пемфигоид, диабет (например, I типа), миастению гравис, тиреоидит Хашимото, болезнь Грейвса, болезнь Гудпасчера, смешанное заболевание соединительной ткани, склерозирующий холангит, воспалительное заболевание кишечника, болезнь Крона, язвенный колит, пернициозную анемию, воспалительные дерматозы, обычный интерстициальный пневмонит (UIP), асбестоз, силикоз, бронхоэктазы, бериллиоз, талькоз, пневмокониоз, саркоидоз, десквамативную интерстициальную пневмонию, лимфоидную интерстициальную пневмонию, гигантоклеточную интерстициальную пневмонию, клеточную интерстициальную пневмонию, экзогенный аллергический альвеолит, гранулематоз Вегенера и связанные с ним формы ангиита (темпоральный артериит и узелковый полиартериит), воспалительные дерматозы, гепатит, реакции гиперчувствительности замедленного типа (например, дерматит при контакте с сумахом), пневмонию, воспаление дыхательных путей, респираторный дистресс-синдром взрослых (ОРДС), энцефалит, реакции гиперчувствительности немедленного типа, астму, сенную лихорадку, аллергии, анафилактический шок, ревматическую лихорадку, гломерулонефрит, пиелонефрит, целлюлит, цистит, хронический холецистит, ишемию (ишемическое повреждение), отторжение аллотрансплантата, отторжение типа «хозяин против трансплантата», аппендицит, артрит, блефарит, бронхиолит, бронхит, цервицит, холангит, хориоамнионит, конъюнктивит, дакриоаденит, дерматомиозит, эндокардит, эндометрит, энтерит, энтероколит, эпикондилит, эпидидимит, фасциит, фиброзит, гастрит, гастроэнтерит, гингивит, илеит, ирит, ларингит, миелит, миокардит, нефрит, омфалит, оофорит, орхит, остит, отит, панкреатит, паротит, перикардит, фарингит, плеврит, флебит, пневмония, проктит, простатит, ринит, сальпингит, синусит, стоматит, синовит, тестит, тонзиллит, уретрит, цистит, увеит, вагинит, васкулит, вульвит и вульвовагинит, ангиит, хронический бронхит, остеомиелит, неврит зрительного нерва, височный артериит, поперечный миелит, некротический фасцилит и некротический энтероколит. Согласно конкретному варианту реализации указанное воспалительное заболевание выбирают из группы, состоящей из атеросклероза, артериосклероза, аутоиммунных расстройств, рассеянного склероза, системной красной волчанки, ревматоидного артрита, воспалительного артрита и миокардита.
Настоящим изобретением также охвачены композиции и способы для подавления, лечения и/или предотвращения состояний или расстройств, связанных с повышенными уровнями определенного иммуноглобулина в сыворотке крови, таких как гипергаммаглобулинемия или моноклональная гаммапатия неясного значения.
Согласно другому варианту реализации настоящего изобретения ингибиторы RhoB, например, антитело против RhoB, вводят субъекту для лечения раковых заболеваний, поддерживаемых секрецией антител. Согласно конкретному варианту реализации указанное раковое заболевание представляет собой опухоль крови, такую как множественная миелома. Согласно другому варианту реализации раковое заболевание представляет собой солидную опухоль. Без связи с конкретной теорией секреция антител может вносить вклад в поддерживающие воспалительные процессы. Доклинические исследования показывают, что RhoB поддерживает ангиогенез в опухоли и лимфо-ангиогенез, жизненно необходимые для прогрессирования злокачественного новообразования, которое, как было продемонстрировано, зависит от накопления антител в воспалительном микроокружении опухоли. Соответственно, анти-RhoB терапию можно применять для ограничения прогрессирования первичных опухолей после лечения, чтобы предотвратить рецидивы и продлить ремиссию. Анти-RhoB терапию можно также проводить у субъекта для лечения опосредованных антителами паранеопластических синдромов, связанных с определенными типами раковых заболеваний. Примеры включают, без ограничения, синдром скованного человека, опсоклонус-миоклонус (например, при раке молочной железы), периферический энцефаломиелит и ретинопатию (например, при раке легкого).
Способы согласно настоящему изобретению также включают введение по меньшей мере одного другого агента для лечения аутоиммунного и/или воспалительного заболевания. Без связи с конкретной теорией введение антител против RhoB снижает синтез аутоиммунных антител. Соответственно, указанная технология не заменяет основанного на дифференцированном подходе лечения аутоиммунного заболевания.
Согласно конкретному варианту реализации указанный способ включает введение по меньшей мере одного иммунодепрессанта. Термины «иммунодепрессант» и «иммуносупрессивный агент» в настоящей заявке включают соединения или композиции, подавляющие иммунный ответ или связанные с ним симптомы. Иммунодепрессанты включают, без ограничения, аналоги пуринов (например, азатиоприн), метотрексат, циклоспорин (например, циклоспорин А), циклофосфамид, лефлуномид, микофенолат (мофетила микофенолат), стероиды (например, глюкокортикоид, кортикостероид), метилпреднизон, преднизон, нестероидный противовоспалительный препарат (НПВП), хлорохин, гидроксихлорохин, хлорамбуцил, антагонист CD20 (например, ритуксимаб, окрелизумаб, велтузумаб или офатумумаб), абатасепт, антагонист TNF (например, инфликсимаб, адалимумаб, этанерцепт), макролиды (например, пимекролимус, такролимус (FK506) и сиролимус), дегидроэпиандростерон, леналидомид, антагонист CD40 (например, антитела против CD40L), абетимус натрия, антагонисты BLys (например, анти-BLyS (например, белимумаб), дактиномицин, буцилламин, пеницилламин, лефлуномид, меркаптопурин, аналоги пиримидина (например, цитозина арабинозид), мизорибин, алкилирующие агенты (например, азотистый иприт, фенилаланин мустард, бусульфан и циклофосфамид), антагонисты фолиевой кислоты (например, аминоптерин и метотрексат), антибиотики (например, рапамицин, актиномицин D, митомицин С, пуромицин и хлорамфеникол), IgG человека, антилимфоцитарный глобулин (АЛГ), антитела (например, анти-CD3 (OKT3), анти-CD4 (OKT4), анти-CD6, анти-CD7, рецептор анти-ИЛ-2 (например, даклизумаб и базиликсимаб), анти-альфа/бета ТКР, анти-MKMA-1, муромонаб-CD3, анти-ИЛ-12, алемтузумаб и антитела к иммунотоксинам), 1-метилтриптофан и их производные и аналоги. Согласно конкретному варианту реализации указанный иммунодепрессант выбран из группы, состоящей из метотрексата, гидроксихлорохина, антагониста CD20 (например, ритуксимаба, окрелизумаба, велтузумаба или офатумумаба), абатасепта, антагониста TNF (например, инфликсимаба, адалимумаба, этанерцепта), сиролимуса и антагониста BLyS (например, анти-BLyS (например, белимумаба)). Согласно конкретному варианту реализации указанный иммунодепрессант представляет собой антагонист CD20, антагонист TNF или антагонист BLyS.
Согласно конкретному варианту реализации указанные способы согласно настоящему изобретению включают введение по меньшей мере одного противовоспалительного агента. В настоящей заявке «противовоспалительный агент» относится к соединениям для лечения воспалительного заболевания или связанных с ним симптомов. Противовоспалительные агенты включают, без ограничения, нестероидные противовоспалительные препараты (НПВП; например, аспирин, ибупрофен, напроксен, метилсалицилат, дифлунизал, индометацин, сулиндак, диклофенак, кетопрофен, кеторолак, карпрофен, фенопрофен, мефенамовую кислоту, пироксикам, мелоксикам, метотрексат, целекоксиб, валдекоксиб, парекоксиб, эторикоксиб и нимесулид), кортикостероиды (например, преднизон, бетаметазон, будесонид, кортизон, дексаметазон, гидрокортизон, метилпреднизолон, преднизолон, триамцинолон и флутиказон), рапамицин (см., например, Migita et al., Clin. Exp. Immunol. (1997) 108:199-203; Migita et al., Clin. Exp. Immunol. (1996) 104:86-91; Foroncewicz et al., Transpl. Int. (2005) 18:366-368), липопротеины высокой плотности (ЛПВП) и повышающие уровень ЛПВП-холестерина соединения (см., например, Birjmohun et al. (2007) Arterioscler. Thromb. Vase. Biol., 27:1153-1158; Nieland et al. (2007) J. Lipid Res., 48:1832-1845; Bloedon et al. (2008) J. Lipid Res., Samaha et al. (2006) Arterioscler. Thromb. Vase. Biol., 26:1413-1414, где описано применение росиглитазона в качестве противовоспалительного средства, Duffy et al. (2005) Curr. Opin. Cardiol., 20:301-306), ингибиторы Rho-киназы (см., например, Нu, Е. (2006) Rec. Patents Cardiovasc. Drug Discov., 1:249-263), противомалярийные агенты (например, гидроксихлорохин и хлорохин), ацетаминофен, глюкокортикоиды, стероиды, бета-агонисты, антихолинергические средства, метилксантины, инъекции золота (например, ауротиомалата натрия), сульфасалазин, пеницилламин, антиангиогенные агенты, дапсон, псоралены, противовирусные агенты, статины (см., например, Paraskevas et al. (2007) Curr. Pharm. Des., 13:3622-36; Paraskevas, K.I. (2008) Clin. Rheumatol. 27:281-287) и антибиотики (например, тетрациклины). Согласно конкретному варианту реализации указанный противовоспалительный агент представляет собой статин или липопротеины высокой плотности (ЛПВП) и повышающее уровень ЛПВП-холестерина соединение.
В соответствии с другим аспектом настоящего изобретения предложены пептиды RhoB. Согласно конкретному варианту реализации указанный пептид RhoB содержит по меньшей мере 10 последовательных аминокислот последовательности SEQ ID NO: 3. Согласно конкретному варианту реализации указанный пептид RhoB содержит С-концевую половину (98 аминокислот) RhoB. Согласно конкретному варианту реализации указанный пептид RhoB выбирают из группы, состоящей из VANKKDLRSDEHVRTELARMKQEPVRTDDGRAMAVRIQAYDYLECSAKTKEGVREVF ETATRAALQKRYGSQNGCINCCKVL (SEQ ID NO: 5), KDLRSDEHVRTELARMKQEPVRTDDGRAMAVRIQAYDYLECSAKTKEGVREVFETAT RAAL (SEQ ID NO: 6), SDEHVRTELARMKQEPVRTDDGRAMAVRIQAYDYLECSAKTKEGVREVFETATRAAL QKRYGSQNGCINCCKVL (SEQ ID NO: 7), DDGRAMAVRIQAY (SEQ ID NO: 2), RTDDGRAMAVRIQAYDYLE (SEQ ID NO: 1), и AVRIQAYDYLE (SEQ ID NO: 8) (см., например, Фиг. 5). RhoB-пептиды могут быть более длинными или более короткими, чем вышеперечисленные последовательности, на 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислот, в частности на 1, 2, 3, 4 или 5 аминокислот, со стороны N-конца и/или С-конца пептида. Согласно другому варианту реализации пептиды согласно настоящему изобретению гомологичны или идентичны последовательности SEQ ID NO: 3 (или последовательностям SEQ ID NO: 1, 2, 5-8) по меньшей мере на 90%, 95%, 97%, 99% или 100%.
Пептиды согласно настоящему изобретению могут быть получены различными путями, в соответствии с известными способами. Пептиды согласно настоящему изобретению могут быть получены путем химического синтеза пептидов (например, твердофазного синтеза). Доступность молекул нуклеиновой кислоты, кодирующих указанный пептид, также позволяет проводить синтез белка с применением способов экспрессирования in vitro и бесклеточных экспрессионных систем, известных в данной области техники. Системы in vitro транскрипции и трансляции коммерчески доступны, например, от Promega Biotech (Мэдисон, Висконсин) или Gibco-BRL (Гейтерсберг, Мэриленд). Указанные пептиды могут также быть получены путем экспрессии в подходящей прокариотической или эукариотической системе. Например, часть молекулы ДНК или полная молекула ДНК, кодирующая указанный пептид, может быть встроена в плазмидный вектор, адаптированный для экспрессии в бактериальной клетке, такой как Е. coli. Такие векторы содержат регуляторные элементы, необходимые для экспрессии ДНК в клетке-хозяине, расположенные таким образом, чтобы обеспечивать экспрессию указанной ДНК в указанной клетке-хозяине. Такие необходимые для экспрессии регуляторные элементы включают промоторные последовательности, последовательности инициации транскрипции и, необязательно, энхансерные последовательности. Пептиды, полученные экспрессированием генов в рекомбинантной прокариотической или эукариотической системе, могут быть очищены в соответствии со способами, известными в данной области техники.
Пептиды согласно настоящему изобретению, полученные с применением вышеуказанных способов, могут быть проанализированы в соответствии со стандартными процедурами. Например, может быть проведен анализ аминокислотной последовательности такого белка в соответствии с известными способами.
Пептиды согласно настоящему изобретению могут быть конъюгированы с белком-носителем (например, макромолекулярным носителем). Например, указанные пептиды можно применять для in vivo иммунизации. Хотя животные могут быть иммунизированы свободным пептидом, титр антитела против пептида можно повысить, присоединив указанный пептид к носителю. Примеры носителей включают, без ограничения, KLH (гемоцианин фиссуреллы), GST (ГСТ, глутатион-S-трансферазу), BSA (БСА, альбумин бычьей сыворотки), cBSA (катионизированный альбумин бычьей сыворотки), OVA (овальбумин), LPH (гемоцианин мечехвоста) и ТТ (столбнячный токсин).
Настоящее изобретение также охватывает антитела или фрагменты антител, иммунологически специфичные по отношению к RhoB (например, SEQ ID NO: 3). Настоящее изобретение охватывает также антитела или фрагменты антител, иммунологически специфичные в отношении последовательностей аминокислот согласно описанию выше. Согласно конкретному варианту реализации указанный пептид гомологичен или идентичен последовательностям SEQ ID NO: 1, 2, 5, 6, 7 или 8 по меньшей мере на 90%, 95%, 97%, 99% или 100%. Указанные пептиды могут быть длиннее или короче, чем вышеуказанные последовательности, на 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или более аминокислот, в частности на 1, 2, 3, 4 или 5 аминокислот, со стороны N-конца и/или С-конца пептида. Согласно другому варианту реализации пептиды согласно настоящему изобретению гомологичны или идентичны последовательности SEQ ID NO: 3 по меньшей мере на 90%, 95%, 97%, 99% или 100%.
Молекулы антител согласно настоящему изобретению могут быть получены с применением разнообразных известных в данной области техники способов. Поликлональные и моноклональные антитела можно получить в соответствии с описанием в пособии: Current Protocols in Molecular Biology, Ausubel et al. eds. Антитела могут быть получены путем химического сшивания, с помощью методик на основе межвидовых гибридом и путем осуществления экспрессии фрагментов рекомбинантных антител в клетках-хозяевах, например бактериальных или дрожжевых.
Согласно конкретному варианту реализации указанные антитело или фрагмент антитела иммунологически специфичны по отношению к SEQ ID NO: 1 или SEQ ID NO: 8. Согласно конкретному варианту реализации указанное антитело представляет собой моноклональное антитело, пару антител или группу антител. Согласно конкретному варианту реализации указанное антитело представляет собой моноклональное антитело, содержащее SEQ ID NO: 10 и 12. Согласно конкретному варианту реализации указанное антитело представляет собой моноклональное антитело, содержащее SEQ ID NO: 14 и 16.
Указанное антитело может представлять собой встречающееся в природе антитело или может представлять собой синтетическое или модифицированное антитело (например, полученное рекомбинантным путем антитело; гибридное антитело; биспецифическое антитело; гуманизированное антитело; антитело камелидов и т.п.). Указанное антитело может содержать по меньшей мере одну метку очистки. Согласно конкретному варианту реализации указанное каркасное антитело представляет собой фрагмент антитела. Фрагменты антител включают, без ограничения, фрагменты иммуноглобулинов, в том числе, без ограничения: одиночный домен (Dab; например, одиночный вариабельный домен легкой или тяжелой цепи), Fab, Fab', F(ab')2 и F(v); и продукты слияния (например, с применением линкера) указанных фрагментов иммуноглобулинов, включая, без ограничения: scFv, scFv2, scFv-Fc, миниантитело, диатело, триатело и тетратело. Указанное антитело может также представлять собой белок (например, гибридный белок), содержащий по меньшей мере одно антитело или фрагмент антитела. Согласно конкретному варианту реализации настоящего изобретения указанное антитело содержит Fc-область.
Антитело и фрагмент антитела согласно настоящему изобретению может содержать по меньшей мере один домен моноклональных антител 9G5 или 7F7 против RhoB. Например, указанное антитело или фрагмент антитела может содержать по меньшей мере один, два, три, четыре, пять или все шесть доменов CDR моноклональных антител 7F7 и 9G5, направленных против RhoB (см. Фиг. 9 и 10). Согласно конкретному варианту реализации указанное антитело или фрагмент антитела содержит по меньшей мере один или оба CDR3-домена. Согласно конкретному варианту реализации указанные домены антитела или фрагмента антитела гомологичны или идентичны доменам, присутствующим в моноклональном антителе 9G5 или 7F7 против RhoB, по меньшей мере на 90%, 95%, 97%, 99% или 100%. Указанные домены могут быть длиннее или короче изображенных на Фиг. 9 и 10 доменов приблизительно на 1, 2, 3, 4 или 5 аминокислот, в частности на 1 или 2 аминокислоты, со стороны N-конца и/или С-конца указанного домена.
Указанное антитело может также представлять собой синтетический белок, имитирующий иммуноглобулин. Примеры включают, без ограничения, молекулы Affibody® (Affibody, Бромма, Швеция), дарпины (сконструированные белки с анкириновым повтором; Kawe et al. (2006) J. Biol. Chem., 281:40252-40263) и пептатела (Terskikh et al. (1997) PNAS 94:1663-1668).
Антитела согласно настоящему изобретению могут быть дополнительно модифицированы. Например, указанные антитела могут быть гуманизированы. Согласно конкретному варианту реализации указанные гибридные антитела (или их часть) встраивают в остов конструкции на основе антитела или фрагмента антитела. Например, вариабельный домен легкой цепи и/или вариабельный домен тяжелой цепи антител согласно настоящему изобретению могут быть встроены в другую конструкцию на основе антитела. Способы рекомбинантного получения антител хорошо известны в данной области техники. Действительно, существуют коммерчески доступные векторы для некоторых конструкций на основе антител и фрагментов антител.
Антитела согласно настоящему изобретению могут также быть конъюгированы/соединены с другими компонентами. Например, указанные антитела могут быть функционально связаны (например, ковалентно связаны, необязательно, через линкер) с по меньшей мере одним детектируемым агентом, визуализирующим агентом, контрастирующим агентом, иммунодепрессантом или противовоспалительным агентом. Антитела согласно настоящему изобретению могут также содержать по меньшей мере одну метку очистки (например, гистидиновую метку).
Композиции, содержащие ингибиторы RhoB или антитела к RhoB, также охвачены настоящим изобретением. Согласно конкретному варианту реализации композиция содержит по меньшей мере одно антитело или фрагмент антитела согласно настоящему изобретению и по меньшей мере один фармацевтически приемлемый носитель.
Молекулы антител согласно настоящему изобретению могут быть получены с применением разнообразных известных в данной области техники способов. Антитела могут быть получены химическим сшиванием, с помощью методик на основе межвидовых гибридом и экспрессией рекомбинантного антитела или фрагментов антител, экспрессируемых в клетках-хозяевах, таких как клетки млекопитающих, бактериальные или дрожжевые клетки. Согласно одному из вариантов реализации изобретения молекулы антител получают за счет экспрессии рекомбинантного антитела или фрагментов антител в клетках-хозяевах. Молекулы нуклеиновой кислоты, кодирующие указанное антитело, могут быть встроены в экспрессионные векторы и введены в клетку-хозяин. Полученные молекулы антител затем выделяют из экспрессионной системы и очищают. Указанные антитела необязательно содержат метку очистки, с помощью которой антитело может быть очищено.
Чистота молекул антител согласно настоящему изобретению может быть оценена с применением стандартных способов, известных специалистам в данной области техники, включая, но не ограничиваясь перечисленными, ИФА ELISA, иммуногистохимию, ионообменную хроматографию, аффинную хроматографию, аффинную хроматографию с использованием иммобилизованных металлов (IMAC, или МАХ), эксклюзионную хроматографию, электрофорез в полиакриламидном геле (ПААГ), вестерн-блоттинг, поверхностный плазмонный резонанс и масс-спектроскопию.
Настоящим изобретением охвачены также гибридомы, секретирующие моноклональные антитела против RhoB. В настоящее время RhoB-гибридомы - в среднем - растут медленно и синтезируют меньшие количества антитела по сравнению с другими гибридомами. Для преодоления этого возможного ограничения может быть использован ряд подходов. Например, нуклеотидную последовательность антитела против RhoB можно клонировать из гибридомы, а затем антитела против RhoB можно получить с помощью молекулярно-биологических подходов. Согласно другому варианту реализации могут быть получены RhoB-независимые секретирующие гибридомы или условия культивирования гибридом могут быть модифицированы для максимального повышения синтеза антител.
Настоящим изобретением охвачены также способы идентифицирования малой молекулы или других молекулярных соединений, таких как малые нуклеиновые кислоты, пептиды, углеводы и т.п., представляющие собой ингибиторы RhoB. Согласно конкретному варианту реализации указанные RhoB-антитела согласно настоящему изобретению или их фрагменты (в частности, области CDR) или соответствующие эпитопы можно применять для конструирования ингибиторов RhoB с аналогичной биологической активностью.
Определения
«Терапевтически эффективное количество» соединения или фармацевтической композиции относится к количеству, эффективному для предотвращения, подавления, лечения или ослабления симптомов конкретного расстройства или заболевания. Лечение воспалительного расстройства согласно настоящей заявке может относиться к излечению, облегчению и/или предотвращению воспалительного расстройства, его симптома или предрасположенности к нему.
Термин «фармацевтически приемлемый» указывает на одобрение регулирующим органом федерального или государственного управления или на перечисление в Фармакопее США или другой общепризнанной фармакопее для применения у животных, и, более конкретно, у человека.
Термин «носитель» относится, например, к разбавителю, адъюванту, эксципиенту, вспомогательному агенту или основе, с которым вводят активный агент согласно настоящему изобретению. Фармацевтически приемлемые носители могут представлять собой стерильные жидкости, такие как вода и масла, включая получаемые из нефтепродуктов, животного, растительного или синтетического происхождения, такие как масло земляного ореха, соевое масло, минеральное масло, кунжутное масло и т.п. Предпочтительно в качестве носителей используется вода или водные солевые растворы и водные растворы декстрозы или глицерина, в частности, для инъекционных растворов. Подходящие фармацевтические носители описаны, например, в пособии «Remington's Pharmaceutical Sciences», E.W. Martin.
«Антитело» или «молекула антитела» представляет собой любой иммуноглобулин, включая антитела и их фрагменты, связывающийся со специфическим антигеном. В настоящей заявке под антителом или молекулой антитела имеются в виду интактные молекулы иммуноглобулина, иммунологически активные участки молекулы иммуноглобулина, и гибриды иммунологически активных участков молекул иммуноглобулина.
В настоящей заявке термин «иммунологически специфичный» относится к белкам/полипептидам, в частности, антителам, которые связываются с одним или более эпитопом белка или представляющего интерес соединения, но по существу не распознают и не связывают и другие молекулы в образце, содержащем смешанную совокупность антигенных биологических молекул.
В настоящей заявке термин «предотвращать» относится к профилактическому лечению субъекта, у которого имеется риск развития состояния, приводящего к заболеванию, при наличии вероятности развития такого состояния у указанного субъекта.
Термин «лечить» в настоящей заявке относится к любому типу лечения, благоприятного для пациента, страдающего заболеванием, в том числе обеспечивающего улучшение состояния указанного пациента (например, облегчение одного или более симптома), задержку прогрессирования указанного состояния, и так далее.
В настоящей заявке термины «хозяин», «субъект» и «пациент» относится к любому животному, включая человека.
Выражение «малая интерферирующая РНК (миРНК)» относится к короткой (как правило, длиной менее чем 30 нуклеотидов, в частности, длиной 12-30 или 20-25 нуклеотидов) двуцепочечной молекуле РНК. Как правило, миРНК модулирует экспрессию гена, на который нацелена указанная миРНК. Способы идентификации синтеза молекул миРНК известны в данной области техники (см., например, Ausubel et al. (2006) Current Protocols in Molecular Biology, John Wiley and Sons, Inc). В настоящей заявке термин «миРНК» может включать молекулы короткой шпилечной РНК (кшРНК). Как правило, молекулы кшРНК состоят из коротких комплементарных последовательностей, разделенных небольшой петлевой последовательностью, при этом одна из указанных последовательностей комплементарна целевому гену. Процессинг молекул кшРНК с образованием миРНК, как правило, осуществляется внутри клетки с помощью эндонуклеаз. Типовые модификации молекул миРНК предложены в опубликованной заявке на патент США №20050032733. В экспрессионных векторах для экспрессии молекул миРНК предпочтительно используется сильный промотор, который может быть конститутивным или регулируемым. Такие промоторы хорошо известны в данной области техники и включают, не ограничиваясь перечисленными, промоторы РНК-полимеразы II, промотор РНК-полимеразы Т7 и промоторы РНК-полимеразы III U6 и Н1 (см., например, Myslinski et al. (2001) Nucl. Acids Res., 29:2502 09).
«Антисмысловые молекулы нуклеиновой кислоты» или «антисмысловые олигонуклеотиды» включают молекулы нуклеиновой кислоты (например, одноцепочечные молекулы), нацеленные (комплементарные) на выбранную последовательность (например, на участки инициации трансляции и/или сайты сплайсинга) для подавления экспрессии представляющего интерес белка. Длина таких антисмысловых молекул составляет, как правило, от приблизительно 15 до приблизительно 50 нуклеотидов, в более частном случае - от приблизительно 15 до приблизительно 30 нуклеотидов, и часто захватывают сайт старта трансляции молекул мРНК. Могут также быть получены антисмысловые конструкции, содержащие полную последовательность целевой молекулы нуклеиновой кислоты в обратной ориентации. Антисмысловые олигонуклеотиды, нацеленные на любую известную нуклеотидную последовательность, могут быть получены путем олигонуклеотидного синтеза в соответствии со стандартными способами.
Способы терапии и композиции для лечения аутоиммунных и воспалительных заболеваний
Как указывалось выше, настоящее изобретение охватывает композиции, содержащие по меньшей мере одно антитело против RhoB (в том числе фрагменты антител) и по меньшей мере один фармацевтически приемлемый носитель. Композиция может также содержать по меньшей мере один другой противовоспалительный агент и/или по меньшей мере один иммуносупрессивный агент. Как вариант, по меньшей мере один другой противовоспалительный агент и/или по меньшей мере один иммуносупрессивный агент могут входить в состав отдельной(ых) композиции(ий) с по меньшей мере одним фармацевтически приемлемым носителем. Указанная(ые) композиция(ии), содержащая(ие) по меньшей мере одно антитело против RhoB, и композиция(ии), содержащая(ие) по меньшей мере один другой противовоспалительный агент и/или по меньшей мере один иммуносупрессивный агент, могут быть входить в состав набора. Такая(ие) композиция(ии) может(гут) вводиться, в терапевтически эффективном количестве, нуждающемуся в этом пациенту для лечения воспалительного или аутоиммунного заболевания. Согласно конкретному варианту реализации у указанного пациента по меньшей мере один раз проводят мониторинг на воспалительное или аутоиммунное заболевание после введения композиций согласно настоящему изобретению для контроля лечения указанного воспалительного или аутоиммунного заболевания (например, при ревматоидном артрите, болях и/или скованности в суставах (например, суставах рук); присутствии ревматоидных узелков; и/или присутствии ревматоидного фактора или антител к ревматоидному фактору в крови).
Композиции согласно настоящему изобретению могут вводиться любым подходящим способом, например, инъекционным (например, для местного или системного введения), внутривенным, пероральным, легочным, назальным или другим способом введения. В общем случае, фармацевтически приемлемый носитель для композиции выбирают из группы разбавителей, консервантов, солюбилизаторов, эмульгаторов, адъювантов и/или носителей. Указанные композиции могут включать разбавители с разным содержанием буфера (например, Tris-HCl, ацетатного, фосфатного), разными значениями рН и ионной силы; и добавки, такие как детергенты и солюбилизирующие агенты (например, Твин 80, Полисорбат 80), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия), консерванты (например, тимеросал, бензиловый спирт) и объемообразующие вещества (например, лактозу, маннит). Указанные композиции могут также входить в дисперсные составы с полимерными соединениями, такими как полимолочная кислота, полигликолевая кислота и т.д., или с липосомами или наночастицами. Такие композиции могут воздействовать на физическое состояние, стабильность, скорость высвобождения in vivo и скорость выведения in vivo компонентов фармацевтической композиции согласно настоящему изобретению. См., например, Remington's Pharmaceutical Sciences, 18th Ed. (1990, Mack Publishing Co., Easton, PA 18042), стр. 1435-1712, включенные в настоящую заявку посредством ссылки. Фармацевтическая композиция согласно настоящему изобретению может быть получена, например, в жидкой форме, или может быть представлена твердой порошковой формой (например, лиофилизирована).
Согласно еще одному варианту реализации фармацевтические композиции согласно настоящему изобретению могут быть доставлены с помощью системы контролируемого высвобождения, например, с применением внутривенной инфузии, имплантируемого осмотического насоса, трансдермального пластыря, липосом или других способов введения. Согласно конкретному варианту реализации может применяться насос (см. Langer, выше; Sefton, CRC Crit. Ref. Biomed. Eng. (1987) 14:201; Buchwald et al., Surgery (1980) 88:507; Saudek et al., N. Engl. J. Med. (1989) 321:574). Согласно другому варианту реализации можно применять полимерные материалы (см. источник: Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Press: Boca Raton, Florida (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley: New York (1984); Ranger and Peppas, J. Macromol. Sci. Rev. Macromol. Chem. (1983) 23:61; см. также Levy et al., Science (1985) 228:190; During et al., Ann. Neurol. (1989) 25:351; Howard et al., J. Neurosurg. (1989) 71:105). Согласно еще одному варианту реализации система контролируемого высвобождения может быть размещена вблизи тканей-мишеней животного, соответственно, требуется только часть системной дозы (см., например, у Goodson, в источнике: Medical Applications of Controlled Release («Медицинское применение контролируемого высвобождения»), выше, (1984) vol. 2, pp. 115-138). В частности, устройство для контролируемого высвобождения может быть установлено животному вблизи участка неадекватного воспаления. Другие системы контролируемого высвобождения обсуждаются в обзоре Langer (Science (1990) 249:1527-1533).
Способы согласно настоящему изобретению могут дополнительно включать применение по меньшей мере одного другого терапевтического способа для лечения аутоиммунного заболевания или воспалительного заболевания. Например, при лечении аутоиммунного заболевания может вводиться антитело против RhoB в сочетании с облучением лимфатических узлов пациента или с плазмаферезом.
Согласно еще одному варианту реализации настоящее изобретение охватывает композиции, содержащие по меньшей мере один пептид с RhoB-последовательностью (включая его последовательности) и по меньшей мере один фармацевтически приемлемый носитель. Указанная композиция может также содержать другие агенты (например, по меньшей мере один другой противовоспалительный агент и/или по меньшей мере один иммуносупрессивный агент) или входить в набор с другой композицией, согласно приведенному выше в настоящей заявке описанию для антител против RhoB. Указанные композиции могут быть доставлены субъекту (например, терапевтическими способами) согласно приведенному выше в настоящей заявке описанию для антител против RhoB.
Нижеследующие примеры приведены для иллюстрации различных вариантов реализации настоящего изобретения. Указанные примеры не предназначены для какого-либо ограничения настоящего изобретения.
ПРИМЕР 1
RhoB-нокаутных мышей иммунизировали конъюгатом RhoB-пептида с -KLH или KLH (гемоцианином фиссуреллы). В частности, в день 0 RhoB-KO мышам инъецировали RhoB-пептид-KLH или KLH в полном адъюванте Фрейнда (CFA). На 14 день проводили бустер-инъекции RhoB-пептидом-KLH или KLH в неполном адъюванте Фрейнда (IFA). В заключение, на 29 день проводили вторую бустер-инъекцию RhoB-пептидом-KLH или KLH в фосфатно-солевом буферном растворе (ФСБ). Кровь получали на 10 день и 24 день; сыворотку собирали на 32 день.
Трансгенные мыши K/B×N TCR экспрессируют TCR (ТКР), реакционноспособный в отношении собственного пептида, происходящего из глюкозо-6-фосфатизомеразы (ГФИ), представляемый молекулой МНС класса II Аg7 (Korganow et al. (1999) Immunity, 10:451-461; Kouskoff et al. (1996) Cell, 87:811-822; Matsumoto et al. (1999) Science, 286:1732-1735). У мышей K/B×N самопроизвольно развивается очень агрессивная форма артрита в возрасте 4-5 недель. Артрит у мышей K/B×N имитирует артрит у человека, являясь хроническим, прогрессирующим, симметричным и проявляя те же гистологические особенности, что и артрит человека. Артрит, поражающий мышей K/B×N, суставо-специфичен, и оценка его тяжести может быть произведена путем измерения толщины голеностопного сустава с помощью калипера (Korganow et al. (1999) Immunity, 10:451-461; Ji et al. (2001) J. Exp.Med., 194:321-330).
Мыши K/B×N (5 мышей на группу) получали лечение 1) солевым раствором, 2) антисывороткой против KLH или 3) антисывороткой против RhoB-пептида. В частности, сыворотку (200 мкл) вводили и/п мышам возрастом 21 день. Измеряли изменение средней толщины голеностопного сустава со временем в качестве показателя артрита. Как видно из Фиг.1, антисыворотка к RhoB подавляет артрит.
У мышей K/B×N синтезируются артритогенные антитела, направленные против ГФИ, высокие титры которых достигаются благодаря селективной поддержке, которую В-клетки, экспрессирующие ГФИ-специфичные иммуноглобулины, получают от ГФИ-реактивных Т-клеток, экспонирующих кодируемый трансгеном ТКР. Как и выше, мыши K/B×N (5 мыши на группу) получали лечение в общем объеме 200 мкл (100 мкл сыворотки, смешанной с 100 мкл солевого раствора) (и/п) 1) солевого раствора, 2) антисыворотки против KLH или 3) антисыворотки против пептида RhoB. Как видно из Фиг. 2А и 2В, сыворотка мышей K/B×N при введении совместно с RhoB-антисывороткой снижала уровни анти-ГФИ Ig в сыворотке (согласно оценке с применением твердофазного иммуноферментного анализа (ELISA)) по сравнению с мышами K/B×N, которым вводили KLH-антисыворотку или только носитель, и пониженное количество секретирующих антитело против ГФИ клеток (согласно оценке с применением твердофазного иммуноферментного спот-анализа (ELISPOT)) по сравнению с мышами K/B×N, которым вводили KLH- антисыворотку или только носитель.
В дополнение к вышесказанному, определяли также, оказывала ли RhoB-антисыворотка влияние на другие цитокины у мышей K/B×N. Введение антисыворотки против RhoB мышам K/BxN существенно не модулирует уровни ИФН-γ, ФНО-α, ИЛ-6, ИЛ-10, МХБ-1, МБВ-1α, МБВ-1β или RANTES, по сравнению с мышами K/B×N, которым вводили KLH-антисыворотку или только носитель.
У мышей забирали спленоциты и В-клетки сливали с иммортализированными клетками миеломы (Sp2/0) для получения гибридом. Было протестировано 48 образцов. 7 давали выраженную положительную реакцию на Пептид 1 (RTDDGRAMAVRIQAYDYLE; SEQ ID NO: 1; аминокислоты 140-158 RhoB человека (№ доступа в GenBank: САА29968)), и 5 давали положительную реакцию на Пептид 1 и Пептид 2 (DDGRAMAVRIQAY; SEQ ID NO: 2; аминокислоты 142-154 RhoB человека (№ доступа в GenBank: САА29968)).
На Фиг. 3 приведена аминокислотная последовательность RhoB человека. Пептид 1 выделен подчеркиванием. Мыши, вакцинированные пептидным антигеном, содержащим указанную последовательность, подразделялись на две группы антител. Указанные две группы определены несколько отличающимися, но частично совпадающими эпитопами: связывание одной группы антител может нарушаться при фосфорилировании Y156, тогда как другая группа антител, вероятно, не затрагивается (см. результаты выше, где описаны отличия Пептида 1 и Пептида 2, в котором отсутствует тирозин в положении 156). Обе группы антител специфически распознают полноразмерный RhoB-белок, но только один блокировал секрецию антител В-клетками в культуре клеток или у животных.
На Фиг. 4 приведены результаты эксперимента с применением ELISA, в ходе которого было показано, что супернатант анти-RhoB гибридомы (Black) подавляет секрецию антител обработанными ЛПС В-клетками мышей: сравнение исходных (неактивированных; ромб), активированных, красная линия (квадрат), и супрессированных (треугольник). Х-линия представляет собой неспецифический контроль (антитело к IDO), который не подавляет активацию. Другими линиями представлены супернатанты, полученные из анти-RhoB субклонов исходной гибридомы, демонстрирующие средние уровни супрессии. С помощью окрашивания пропидиумом иодидом (PI) было показано, что В-клетки не пролиферировали в ответ на ЛПС. Анализ на IL6 с применением способа Bead Array показал, что анти-RhoB гибридомы не секретировали IL6.
ПРИМЕР 2
Мыши K/B×N получали лечение 500 мкг моноклональных антител 9G5 или 7F7 против RhoB или контрольным Ig до начала артрита (в возрасте 21 день). На Фиг. 6А видно, что оба моноклональных антитела против RhoB 9G5 и 7F7 подавляли артрит согласно оценке толщины голеностопного сустава задних лап. На Фиг. 6В и 6С видно, что моноклональные антитела против RhoB также подавляют синтез аутоантител, исходя из титров аутоантител против ГФИ, измеренных с применением ИФА ELISA (Фиг. 6В) и секретирующих антитело против ГФИ (АСК) клеток, измеренных с применением анализа ELISpot (Фиг. 6С).
Мыши K/B×N также получали лечение 500 мкг моноклональных антител 9G5 или 7F7 против RhoB или контрольным Ig после возникновения артрита (в возрасте 4 недели). Как видно из Фиг.7, моноклональные антитела 9G5 или 7F7 против RhoB подавляли прогрессирование артрита, согласно оценке толщины голеностопного сустава задних лап.
В дополнение к вышесказанному, определяли также, влияют ли моноклональные антитела против RhoB на другие цитокины у мышей K/B×N. Мыши K/BxN получали лечение 500 мкг 7F7 или контрольным Ig в возрасте 21 день. Извлекали клетки дренирующих лимфатические узлы суставов в возрасте 6 недель и культивировали в течение ночи в ФМА (50 нг/мл) с иономицином (500 нг/мл). Цитокины определяли в культуральных супернатантах с применением способа Cytometric Bead Array. Введение моноклонального антитела 7F7 против RhoB мышам K/B×N существенно не модулировало уровни воспалительных цитокинов ИФН-γ, ФНО-α, ИЛ-17, ИЛ-10, МХБ-1, МБВ-1α, МБВ-1β и RANTES, или связанных с В-клетками цитокинов ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13, по сравнению с мышами K/B×N, которым вводили контрольный Ig.
RhoB-нокаутных (KO) (RhoB КО KRN.g7) мышей с артритом получали путем скрещивания с генотипом KRN.g7. Мыши KRN В6.g7 представляют собой мышей C57BL/6, у которых экспрессируется и трансген KRN TCR, и молекула IAg7 МНС класса II, необходимая для Т-клеточной активации KRN, но отсутствуют остальные NOD-ассоциированные гены (Kouskoff et al. (1996) Cell 87:811-822). На Фиг. 8А видно, что у мышей RhoB КО наблюдается менее выраженный артрит по сравнению с мышами KRN.g7, согласно оценке толщины голеностопного сустава задних лап. На Фиг. 8В видно, что сыворотка от мышей RhoB КО KRN.g7 также была неспособна индуцировать артрит при перенесении не получавшим предварительного лечения реципиентам. В частности, сыворотку от мышей KRN В6.д7 или RhoB КО KRN В6.g7 адоптивно переносили в организм не получавших предварительного лечения мышей C57B L/6 на 0 день. Тем не менее, на Фиг. 8С видно, что артрит у мышей RhoB КО может быть индуцирован, если адоптивно переносится артритогенная K/B×N-сыворотка. Сыворотку от мышей K/BxN с артритом адоптивно переносили не получавшим предварительного лечения мышам дикого типа (wt) или RhoB KO C57B L/6 на 0 день. Примечательно, что наблюдавшийся артрит был более тяжелым и продолжительным у мышей с RhoB KO. Без связи с конкретной теорией наблюдавшаяся повышенная тяжесть артрита у мышей с RhoB KO может быть обусловлена неспособностью указанных мышей к выведению аутоантитела. Действительно, титры аутоантител против ГФИ были несколько повышены у мышей с RhoB КО KRN.g7 по сравнению с мышами KRN.g7, однако количества клеток, секретирующих антитело против ГФИ (АСК), были одинаковы у мышей обоих типов.
Кроме того, определяли, имеется ли влияние на цитокины у мышей с RhoB KO. Извлекали клетки дренирующих лимфатические узлы суставов в возрасте 6 недель и культивировали в течение ночи в ФМА (50 нг/мл) с иономицином (500 нг/мл). Цитокины измеряли в культуральных супернатантах с применением способа Cytometric Bead Array. По сравнению с мышами KRN.g7 RhoB у мышей с КО KRN.g7 существенно не изменялись уровни воспалительных цитокинов ИФН-γ, ФНО-α, ИЛ-17, ИЛ-10 и МХБ-1 (хотя и наблюдалась незначительная тенденция к снижению RANTES, МБВ-1α и МБВ-1β у мышей с RhoB КО KRN.g7) или связанных с В-клетками цитокинов ИЛ-4, ИЛ-5, ИЛ-6, ИЛ-9, ИЛ-10 и ИЛ-13. Без связи с конкретной теорией сходство фенотипов мышей RhoB KO и мышей, которым вводили антитело против RhoB, еще раз подтверждает, что антитела против RhoB проявляют активность при взаимодействи с RhoB.
У мышей с RhoB KO C57B L/6 также имелись нормальные лимфоидные популяции. В частности, процент лимфоидных популяций в костном мозге, вилочковой железе, селезенке, лимфатических узлах и перитонеальной полости мышей дикого типа и RhoB КО C57BL/6 измеряли с помощью проточной цитометрии. Уровни Ig в сыворотке мышей дикого типа и мышей RhoB KO C57B L/6 также измеряли с помощью ELISA. Примечательно, что не наблюдалось значимых отличий лимфоидных популяций или уровней Ig в сыворотке (IgM, IgG1, IgG2b, IgG2c и IgG3) между мышами дикого типа и RhoB КО C57B L/6. RhoB-/-, RhoB+/- или RhoB+/+ мышей C57BL/6 также иммунизировали 100 мкг NP-KLH в квасцах на 0 день. Образцы сыворотки получали на 0, 5, 14 и 21 день и анализировали на наличие анти-NP IgM или IgG с применением ELISA. У мышей RhoB КО наблюдался нормальный ответ на иммунизацию.
В вышеприведенном описании процитированы некоторые публикации и патентные документы для более полного описания существующего уровня техники, к которому относится данное изобретение. Содержание каждого из цитируемых источников включено в настоящую заявку посредством ссылки.
Хотя некоторые из предпочтительных вариантов реализации настоящего изобретения были описаны и проиллюстрированы конкретными примерами выше, это не означает, что изобретение ограничивается такими вариантами реализации. Различные модификации изобретения могут быть осуществлены без отступления от существа и объема настоящего изобретения, соответствующих приводимой ниже формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА ПРОТИВ ЧЕЛОВЕЧЕСКОГО VISTA И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2746994C2 |
| ПРИМЕНЕНИЕ АНТИ-CD40-АНТИТЕЛ | 2006 |
|
RU2442606C2 |
| Антитела против эотаксина 2, которые распознают дополнительные связывающие CCR3 хемокины | 2015 |
|
RU2705255C2 |
| СВЯЗЫВАЮЩИЕ KIR3DL2 АГЕНТЫ | 2013 |
|
RU2682449C2 |
| АНТИТЕЛА ПРОТИВ ОХ40 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2562874C1 |
| СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПЕЦИФИЧНЫЕ К ИЛ-21, И ОБЛАСТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2708336C2 |
| ВЕЩЕСТВА И СПОСОБЫ ДЛЯ ПРИМЕНЕНИЯ ПРИ ПРЕДУПРЕЖДЕНИИ И/ИЛИ ЛЕЧЕНИИ БОЛЕЗНИ ГЕНТИНГТОНА | 2015 |
|
RU2742493C2 |
| ЧЕЛОВЕЧЕСКОЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО ПРОТИВ AILIM, КОСТИМУЛИРУЮЩЕЙ МОЛЕКУЛЫ ПЕРЕДАЧИ СИГНАЛА, И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2001 |
|
RU2262511C2 |
| ТЕРАПЕВТИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2002 |
|
RU2328506C2 |
| АКТИВНАЯ ИММУНОТЕРАПИЯ ПРОТИВ АНГИОГЕНЕЗА | 2003 |
|
RU2329824C2 |














Изобретение относится к области биохимии, в частности к выделенному антителу против RhoB, его фрагменту, композиции, его содержащей, а также к способу подавления воспалительного и/или аутоиммунного заболевания, опосредованного В-клетками и к способу лечения состояния или расстройства, связанного с повышенными уровнями иммуноглобулина в сыворотке крови у нуждающегося в этом субъекта с его использованием. Также раскрыты выделенный пептид для получения вышеуказанного антитела, а также конъюгат и композиция, его содержащие. Изобретение позволяет эффективно осуществлять подавление воспалительного и/или аутоиммунного заболевания, опосредованного B-клетками. 7 н. и 12 з.п. ф-лы, 10 ил., 2 пр.
1. Способ подавления воспалительного и/или аутоиммунного заболевания, опосредованного В-клетками, у нуждающегося в этом субъекта, включающий введение указанному субъекту антитела против RhoB, иммунологически специфичного в отношении SEQ ID NO: 1, или антигенсвязывающего фрагмента указанного антитела.
2. Способ по п. 1, отличающийся тем, что указанное антитело против RhoB или антигенсвязывающий фрагмент указанного антитела входит в состав композиции, содержащей по меньшей мере один фармацевтически приемлемый носитель.
3. Способ по п. 1, отличающийся тем, что указанное антитело против RhoB или антигенсвязывающий фрагмент указанного антитела содержат все шесть доменов CDR моноклонального антитела, содержащего SEQ ID NO: 10 и 12, или моноклонального антитела, содержащего SEQ ID NO: 14 и 16.
4. Способ по п. 1, отличающийся тем, что указанное антитело против RhoB представляет собой моноклональное антитело, содержащее SEQ ID NO: 10 и 12, или моноклональное антитело, содержащее SEQ ID NO: 14 и 16.
5. Способ по п. 1, отличающийся тем, что указанное аутоиммунное или воспалительное заболевание представляет собой ревматоидный артрит.
6. Способ по п. 1, отличающийся тем, что указанное аутоиммунное или воспалительное заболевание представляет собой диабет I типа, волчанку или миастению гравис.
7. Способ по п. 1, отличающийся тем, что указанный способ дополнительно включает введение по меньшей мере одного противовоспалительного агента.
8. Способ по п. 1, отличающийся тем, что указанный способ дополнительно включает введение по меньшей мере иммунодепрессанта.
9. Способ по п. 1, отличающийся тем, что указанное воспалительное или аутоиммунное заболевание по меньшей мере частично опосредовано ауто-антителами.
10. Выделенное антитело против RhoB, иммунологически специфичное в отношении SEQ ID NO: 1, или антигенсвязывающий фрагмент указанного антитела, при этом указанное антитело против RhoB или антигенсвязывающий фрагмент указанного антитела содержат все шесть доменов CDR моноклонального антитела, содержащего SEQ ID NO: 10 и 12, или моноклонального антитела, содержащего SEQ ID NO: 14 и 16.
11. Выделенное антитело по п. 10, отличающееся тем, что указанное антитело против RhoB или антигенсвязывающий фрагмент указанного антитела представляют собой моноклональное антитело, содержащее SEQ ID NO: 10 и 12, или моноклональное антитело, содержащее SEQ ID NO: 14 и 16.
12. Композиция для подавления воспалительного и/или аутоиммунного заболевания, опосредованного В-клетками, содержащая эффективное количество по меньшей мере одного антитела по п. 10 и по меньшей мере один фармацевтически приемлемый носитель.
13. Композиция по п. 12, отличающаяся тем, что указанная композиция дополнительно содержит по меньшей мере один противовоспалительный агент.
14. Композиция по п. 12, отличающаяся тем, что указанная композиция дополнительно содержит по меньшей мере один иммунодепрессант.
15. Выделенный пептид для получения антитела по п. 10, имеющий последовательность SEQ ID NO: 1.
16. Конъюгат для получения антитела по п. 10, содержащий пептид по п. 15, функционально связанный с белком-носителем.
17. Композиция для получения антитела по п. 10, содержащая по меньшей мере один пептид по п. 15 в эффективном количестве и по меньшей мере один фармацевтически приемлемый носитель.
18. Способ лечения состояния или расстройства, связанного с повышенными уровнями иммуноглобулина в сыворотке крови у нуждающегося в этом субъекта, включающий введение указанному субъекту по меньшей мере одного антитела против RhoB, иммунологически специфичного в отношении SEQ ID NO: 1, или антигенсвязывающего фрагмента указанного антитела.
19. Способ по п. 18, отличающийся тем, что указанное состояние или расстройство представляет собой гипергаммаглобулинемию или моноклональную гаммапатию неясного значения.
| US 5962672 A, 05.10.1999 | |||
| HAQUE S | |||
| et al | |||
| Atherosclerosis in rheumatoid arthritis and systemic lupus erythematosus, Curr Opin Lipidol, 2008, Vol.19, N.4, pp.338-343 | |||
| WANG L | |||
| et al | |||
| A Novel Strategy for Specifically Down-regulating Individual Rho GTPase Activity in Tumor Cells, The Journal of Biological Chemistry, 2003, Vol.278, p.44617-44625 | |||
| US 2005142103 A1, 30.06.2005 | |||
| RU 2008140661 A, 20.04.2010. |
Авторы
Даты
2017-12-21—Публикация
2012-08-09—Подача