Область изобретения
Данное изобретение относится к лечению эрозии кости и разрушения хряща. В частности, к лечению заболеваний с разрушением костной и хрящевой ткани с использованием биологических препаратов, таких как, например, антитела.
Уровень техники
Натуральные киллеры (NK) представляют собой лимфоциты, происходящие из костного мозга, которые необходимы для защиты организма хозяина от некоторых инфекций и опухолей. После активации они быстро продуцируют ряд цитокинов и могут опосредовать цитотоксические ответы против инфицированных, поврежденных или онкогенных клеток. Роль NK-клеток в хронических воспалительных заболеваниях исследуется, и становится все более понятным, что NK-клетки могут играть важную роль в модуляции Т и В-клеточных ответов через их способность содействовать дифференцировке и созреванию дендритных клеток (DC) и последующей поляризации Т-клеточных ответов (см., например, Cooper et al. (2004) Trends Immunol. 25: 47-52; Zhang et al. (2007) Blood Oct 1; 110(7):2484-93). Кроме того, исследования показали, что NK-клетки обладают способностью непосредственно элиминировать субпопуляции активированных Т-клеток с помощью клеточно-опосредованных цитотоксических реакций (Lu et al. (2007) Immunity. 26: 593-604). Активность NK-клеток регулируется сложным механизмом, в который вовлечены и активирующие, и ингибиторные сигналы (см., например, Moretta et al. (2001) Annu Rev Immunol 19:197-223; Moretta et al. (2003) EMBOj EPub Dec 18; Ravetch et al. (2000) Science 290:84-89; Zambello et al. (2003) Blood 102:1797-805; Moretta et al: (1997) Curr Opin Immunol 9:694-
Было идентифицировано несколько различных NK-специфических рецепторов, которые участвуют в опосредованном NK-клетками распознавании и уничтожении клеток-мишеней, дефицитных по HLA класса I. Одним важным ингибиторным рецептором NK-клеток является CD94/NKG2A, который взаимодействуете неклассической МНС-молекулой класса I HLA-E (см., например, Braud et al. (1998) Nature 391:795-799; Lee et al. (1998) PNAS 95:5199-5204; Vance et al. (2002) PNAS 99:868-873; Brooks et al. (199) J Immunol 162:305-313; Miller et al. (2003) J Immunol 171:1369-75; Brooks et al. (1997) J Esp Med 185:795-800; Van Beneden et al. (2001) 4302-4311; патентные заявки US 20030095965).
CD94/NKG2A является ингибиторным рецептором, который находится на субпопуляциях NK-, NKT- и Т-клеток, что ограничивает уничтожение ими клеток, экспрессирующих С094/ NKG2A-лиганд HLA-E, несущий небольшие пептиды, обычно полученные из лидерной последовательности других молекул МНС класса 1 (см., например, Braud et al. (1998) Nature 391:795-799).
В данной области были описаны различные антитела против NKG2A. Например, Sivori et al. (Eur j Immunol 1996:26:2487) относится к мышиному анти-NKG2A-антителу Z270; Carretero et al. (J Exp Med 1999:190:1801-12) относится к крысиному противомышиному NKG2A-aHTHTeny 20D5; патентная заявка США, опубликованная как US20030095965, описывает мышиное антитело 3S9, которое связывается с NKG2A, NKG2C и NKG2E, патентная заявка WO 06070286 раскрывает моноклональные антитела против NKG2A, а патентная заявка WO 2008/009545 описывает гуманизированное антитело humZ270 и другие анти-NKG2A-aHTHTena с вариабельной тяжелой цепью и/или вариабельной легкой цепью, практически идентичной таковым в Z270.
Краткое описание
Ревматоидный артрит (RA) является хроническим воспалительным заболеванием, при котором активация медиаторов воспаления, производимых несколькими клеточными субпопуляциями, в конечном итоге приводит к разрушению суставного хряща и кости. Принято считать, что основными клеточными субпопуляциями, ответственными за деструкцию хрящевой и костной ткани при RA, являются фибробластоподобные синовиоциты (FLS) и остеокласты, соответственно. Экспрессирующие CD94-NKG2A Т-клетки и NK-клетки могут подавлять воспаление, уничтожая активированные провоспалительные клетки. Активацию этих клеток можно получить с помощью ряда различных клеток и молекул, включая макрофаги, активированные CD4+-T-клетки и В-клетки/плазматические клетки. Тем не менее, эта регуляторная противовоспалительная активность подавляется, когда CD94-NKG2A-penenTopbi заняты их HLA-E-лигандом на поверхности провоспалительных клеток. Блокируя CD94-NKG2A-penenTopbi и предотвращая их ингибиторный сигналинг, NNC141-0100 усиливает противовоспалительные активности регуляторных CD94-NKG2A+-Т-клеток и NK-клеток, повышая их способность элиминировать, например, активированные провоспалительные CD4+-T-клетки и фибробластоподобные синовиоциты (FLS). Терапия, которая специфически элиминирует агрессивные эрозирующие хрящ FLS и подавляет образование костных эрозийных остеокластов, не влияя при этом на остальные клетки, может иметь существенное преимущество по сравнению с текущей терапией RA и потенциально также может использоваться для лечения пациентов с остеоартритом (ОА) и псориатическим артритом (PsA).
Это изобретение описывает, как анти-NKG2A-антитело ослабляет два основных патогенных пути при RA, т.е. эрозию кости и хряща, благодаря его способности уменьшать образование разрушающих кость остеокластов и благодаря селективно повышенной элиминации разрушающих хрящ FLS, соответственно.
Существующие терапевтические средства, направленные на RA, воздействуют непосредственно на отдельные компоненты воспалительного каскада, и их эффективность в отношении костной эрозии вторична по отношению к их противовоспалительному эффекту. Анти-NKG2A-МКА способны ингибировать связывание HLA-E или неконкурентно могут блокировать функцию CD94/NKG2A и стимулировать эндогенный иммунно-регуляторный механизм NK-клеток, вызывая селективную элиминацию клеток, которые способствуют деградации хряща, эрозии кости и сокращению цитокина IL-6, который, как известно, способствует воспалению. Таким образом, терапевтическое лечение анти-NKG2A-МКА может напрямую влиять на патогенез в заболеваниях, характеризующихся костной эрозией или деструкцией хряща.
Данное изобретение раскрывает применение анти-NKG2A-антитела или его фрагмента, способного лечить разрушение хряща и/или эрозию кости.
Данное изобретение раскрывает применение анти-NKG2A-антитела для лечения заболевания или нарушения, которое характеризуется разрушением хряща и/или эрозией кости.
Данное изобретение раскрывает применение анти-NKG2A-антитела для лечения деструкции хряща и/или эрозии кости, где анти-NKG2A-антитело стимулирует селективное удаление активированных клеток, которые способствуют разрушению хряща или эрозии кости. В одном воплощении данного изобретения клетки, разрушающие хрящ, являются фибробластоподобными синовиоцитами (FLS). В одном воплощении клетки, вызывающие эрозию кости, являются эрозийными остеокластами.
Данное изобретение раскрывает применение анти-NKG2A-антитела для лечения заболевания или нарушения, которое характеризуется разрушением хряща и/или эрозией кости, где анти-NKG2A-антитело стимулирует селективное удаление активированных клеток, которые способствуют разрушению хряща или эрозии кости. В одном воплощении данного изобретения клетки, разрушающие хрящ, являются фибробластоподобными синовиоцитами (FLS). В одном воплощении клетки, вызывающие эрозию кости, являются эрозийными остеокластами.
NKG2A-антитела, используемые в данном изобретении, могут быть любыми подходящими анти-NKG2A-антителами. В одном воплощении антитело представляет собой моноклональное анти-NKG2A-антитело. В одном воплощении антитело является гуманизированным анти-NKG2A-антителом. В одном воплощении антитело представляет собой полностью человеческое анти-NKG2A-антитело. В одном воплощении антитело представляет собой анти-NKG2A-антитело, описанное в WO 2008/009545. В одном воплощении моноклональное анти-NKG2A-антитело представляет собой humZ270, описанное в патентной публикации WO 2008/009545. В одном воплощении анти-NKG2A-антитело представляет собой моноклональное анти-NKG2A-антитело, описанное в патентной публикации WO 09092805. В одном воплощении анти-NKG2A-антитело представляет собой humZ199, описанное в патентной публикации WO 09092805.
(Краткое описание графических материалов)
Фиг.1 показывает профиль экспрессии группы молекул клеточной поверхности, экспрессированных созданными in vitro фибробластоподобными синовиоцитами, полученными из синовиальной ткани пациентов с ревматоидным артритом (RA).
- Фиг.1А. показывает, что фибробластоподобные синовиоциты (FLS), полученные от пациентов RA, экспрессируют CD55 (правая накладывающаяся гистограмма), но не имеют CD68 (левая накладывающаяся гистограмма).
- Фиг.1 В. показывает, что клеточная поверхность RA-FLS экспрессирует несколько лигандов для активации NK-клеточных рецепторов (например, MICA, ULBP1, ULBP2, ULBP3, ICAM1, CD155, CD48), как указывает ниже каждая накладывающаяся гистограмма. Как показано, RA-FLS эффективно красятся гибридным NKp44-FC, подтверждая, что RA-FLS экспрессируют предполагаемый лиганд для МКр44.
- - Фиг.1C. показывает, что антитело против МКр44 дозозависимым образом предотвращает связывание растворимого гибридного МКр44-Рс-белка на RA-FLS, подтверждая, что RA-FLS экспрессируют лиганд, способный взаимодействовать с МКр44-рецептором.
- Фиг.1D. показывает, что RA-FLS экспрессируют лиганды МНС класса I HLA-E и HLA-G, которые, как известно, распознаются NK-клеточными рецепторами (например CD94/NKG2A и LIR-1, соответственно).
- Фиг.1Е. показывает, что RA-FLS экспрессируют рецептор смерти 5 (DR5), но не DR4, которые известны как рецепторы, которые связывают TRAIL.
Фиг.2 показывает,.что NKG2A-экспрессирующие NK-клетки присутствуют в синовиальной оболочке RA и могут быть найдены в областях, содержащих RA-FLS, экспрессирующие HLA-E.
- Фиг.2А показывает синовиальные ткани RA, окрашенные антителом против человеческого NKp46. Темные окрашенные области являются NKp46-экспрессирующими клетками.
- Фиг.2В показывает прилегающий срез той же ткани, окрашенный антителом против человеческого NKG2A. Темные окрашенные области являются МКС2А-экспрессирующими клетками.
- Фиг.2С показывает срез прилегающей ткани, окрашенный изотипическим контрольным антителом.
- Фиг.2D показывает частоту NKG2A+-клеток/мм2 синовиальной ткани на графике против частоты NKp46+-клеток/мм2 синовиальной ткани при оценке путем количественного цифрового анализа изображений. Данные показывают, что большинство NKG2A+-клеток являются NK-клетками в воспаленной синовиальной ткани RA.
- Фиг.2Е показывает синовиальную ткань RA, окрашенную анти-HLA-E-антителом. Клетки в синовиальной оболочке, в том числе RA-FLS, экспрессируют HLA-E. Стрелка указывает на область темно окрашенных FLS-подобных клеток синовиальной оболочки, экспрессирующих HLA-E.
- Фиг.2F показывает, что инфильтрирующие иммунные клетки в синовиальной подложке экспрессируют HLA-E.
- Фиг.2G показывает синовиальную ткань RA, окрашенную изотипическим контрольным антителом.
- Фиг.2Н показывает, что эндотелиальные клетки сосудов экспрессируют HLA-E.
- Фиг.3 показывает, что NK-клетки, в том числе синовиальные NK-клетки, полученные от пациентов с RA, экспрессируют панель активирующих рецепторов, которые, как известно, связываются с лигандами, которые экспрессированы на RA-FLS.
Фиг.3А:
- Фиг.3А (i) показывает экспрессию NK-клеточного рецептора на гейтированных NK-клетках, полученных из SFMC репрезентативного пациента с RA. Синовиальные NK-клетки экспрессируют NKG2D, MKp30, NKp44, NKp46, DNAM1, 2 В4, LFA-1 и TRAIL, но не экспрессируют или экспрессируют на очень низком уровне NKG2C, как указано в незаштрихованных накладывающаяся гистограммах.
- Фиг.3А (ii) показывает оставшиеся CD56-яркие NK-клетки полученные из РВМС репрезентативного здорового донора. CD56 яркие NK-клетки экспрессируют NKG2D, NKp30, NKp44, NKp46, DNAM1, 2 В4, LFA-1, и TRAIL, но не экспрессируют или экспрессируют на очень низком уровне NKG2C, как указано в незаштрихованных накладывающаяся гистограммах.
- Фиг.3А (iii) показывает Nishi NK-клетки. Nishi NK-клетки экспрессируют NKG2D, NKp30, NKp44, NKp46, DNAM1, 2В4, LFA-1, и TRAIL, но не экспрессируют или экспрессируют на очень низком уровне NKG2C, как указано в незаштрихованных накладывающаяся гистограммах.
- Фиг.3В показывает, что NK-клетки элиминируют прикрепленные RA-FLS in vitro:
- Фиг.3В (i) показывает, что NK-клетки, совместно культивированные с RA-FLS в течение ночи, приводят к элиминации прикрепленных RA-FLS дозозависимым образом.
- Фиг.3В (ii) показывает область лунок, покрытых прикрепленными RA-FLS при культивировании в одиночку или при совместном культивировании со сниженным числом NK-клеток в течение ночи, при анализе путем Immunospot image.
- Фиг.3С показывает, что в соответствии с измерением экспрессии CD107 а/b клеточной поверхности NK-клетки дегранулируют при совместном культивировании с RA-FLS, но не дегранулируют при культивировании в одиночку, что доказывает, что NK-клетки активно уничтожают RA-FLS.
- Фиг.3D показывает, что маскировка NKG2D, NKp44, NKp46, DNAM-1 или TRAIL, экспрессированных NK-клетками, приводит к значительному снижению уничтожения RA-FLS, что измеряется экспрессией CD107a/b на клеточной поверхности эффекторных NK-клеток.
Фиг.4 показывает, что RA-FLS защищены от цитотоксичности, опосредованной NK-клетками, путем экспрессии HLA-E, способного при лигировании ингибировать NK-клеточные рецепторы CD94-NKG2A.
- Фиг.4А показывает, что синовиальные NK-клетки RA (верхняя панель), здоровые PB-NK-клетки CD56bright (средняя панель) и NK-клетки Nishi (нижняя панель) экспрессируют на клеточной поверхности NKG2A (слева), но не имеют KIR (справа). Кроме того, Nishi-клетки экспрессируют LIR1 (средняя панель), а синовиальные NK-клетки или NK-клетки CD56bright его не экспрессируют.
- Фиг.4В показывает увеличение дегрануляции NK-клеток в соответствии с измерением экспрессии CD107 а/b клеточной поверхности при совместном культивировании с RA-FLS в присутствии анти-NKG2A (правая панель), но не в присутствии анти-LIRI (левая панель).
- Фиг.4С показывает повышенное удаление прикрепленных RA-FLS, зависимое от NK-клеток, при обработке анти-NKG2A (правое изображение) по сравнению с обработкой изотипическим контролем (среднее изображение). RA-FLS, культивированные в отсутствие NK-клеток, показаны на левом изображении.
- Фиг.4D показывает, что синовиальные NK-клетки дегранулируют при совместном культивировании с аутологичными RA-FLS (14%, вверху слева), и что маскировка NKG2A приводит к увеличению дегрануляции (44%, вверху справа). Аутологичные CD3* CD8+ Т-клетки значительно не дегранулируют при совместном культивировании с аутологичными RA-FLS в отсутствие анти-NKG2A (т.е. культуры, обработанные изотипическим контролем, внизу слева) или в присутствии анти-NKG2A (внизу справа).
- Фиг.4Е показывает, что недавно выделенные и нестимулированные РВ-NK-клетки CD56bright от здоровых доноров дегранулируют при совместном культивировании с RA-FLS в присутствии анти-NKG2A, но минимально при обработке изотипическим контрольным антителом. Верхняя панель показывает репрезентативный пример, а нижний график показывает % экспрессии CD107a/b на 5 отдельных донорских NK-клетках CD56bright, культивируемых совместно с RA-FLS в присутствии изотипа в сравнении с анти-NKG2A.
Фиг.5А показывает, что блокирование NKG2A с помощью NNC141-0100 (humZ270) приводит к повышенной элиминации RA-FLS, опосредованной NK-клетками, измеренной в анализе высвобождения ЛДГ. Эффекторные NKL-клетки показаны слева, а NK-клетки Nishi показаны справа от репрезентативной клетки-мишени RA-FLS.
Фиг.5В показывает, что блокирование NKG2A с помощью NNC14-0100 (humZ270) приводит к повышенному лизису репрезентативных RA-FLS (RA-FLS2), но не влияет на элиминацию клеточной линии нормальных фибробластов крайней плоти (FSK4).
Фиг.6 показывает, что NNC14-0100 (humZ270) ингибирует образование многоядерных остеокластов TRAP+:
- Фиг.6А показывает репрезентативный пример RA-SFMC, культивированных в течение 7 дней в присутствии изотипа humlgG4. Можно видеть несколько крупных многоядерных клеток TRAP+.
- Фиг.6В показывает, что обработка humZ270 приводит к резкому снижению числа крупных многоядерных клеток TRAP+.
- Фиг.6С показывает образование остеокластов в SFMC, полученных от пациентов с RA, культивируемых в среде или IL-15 в присутствии изотипического контроля, в сравнении с анти-NGC2A (humZ270, NNC14-0100), как указано. Маскировка NKG2A в культурах, стимулированных IL-15, приводит к снижению числа многоядерных клеток TRAP+.
- Фиг.6D показывает, что формирование остеокластов, вызывающих эрозию минералов кости, в SFMC, полученных от пациентов с RA, подавляется обработкой NNC14-0100. Показан репрезентативный пример эрозии минералов кости, наблюдаемый в культуре SFMC от пациента с RA №2357. SFMC выращивали на остеологических дисках в присутствии IL-15 и изотипического МКА (слева) в сравнении с анти-NKG2A (humZ270, справа). Диски окрашивали методикой фон Косса, и эродированные области анализировали с использованием ImmunoSpot S5 Analyzer и представляли белыми на темном фоне.
- Фиг.6Е. SFMC, полученные от пациентов с RA (n=5) культивировали в среде, дополненной 10 нг/мл IL-15. В начале анализа к культурам добавляли 20 мкг/мл человеческого изотипа IgG4 (белый столбец) или 20 мкг/мл NNC14-0100 (humZ270, черный столбец). С помощью ImmunoSpot S5 Analyzer количественно оценивали средний процент +/-SEM эродированной площади диска.
- Фиг.6F показывает, что HumZ270 подавляет эрозию минералов кости в культурах эксплантов синовиальной ткани RA. Фигура показывает пример, в котором стружку синовиальной ткани RA выращивали в трех лунках на костных минеральных дисках в присутствии только среды (контроль, вверху), изотипического контроля (второй сверху), инфликсимаба (IFX, третий сверху) или анти-NKG2A (humZ270, снизу). Светлые области представляют эрозию минералов кости.
- Фиг.6G показывает наблюдаемый процент эрозии минералов кости, определенный с помощью анализа с использованием ImmunoSpot.
Фиг.7:
- Фиг.7А. показывает модуляцию уровней цитокинов, измеренных через 24 часа в культурах SFMC in vitro, при обработке humZ270 (NNC14-0100, темно-серые столбцы) по сравнению с изотипическим контролем (светло-серые столбцы). При маскировке NKG2A наблюдается значительное снижение уровней IL6. Кроме того, наблюдается небольшое увеличение M-CSF.
- Фиг.7В показывает попарное сравнение уровней IL-6, полученных в присутствии анти-NKG2A (NNC14-0100, humZ270), в сравнении с изотипическим контролем в культурах RA-SFMC (n=11).
- Фиг.7С показывает, что анти-NKG2A ингибирует как базальную (т.е. только со средой), так и IL-15-стимулированную продукцию IL-6 в культурах SFMC ex vivo, полученных от пациентов с RA. Показаны средние значения и SD от двух репрезентативных пациентов с RA.
Фиг.8 показывает, что NK-клетки, присутствующие в синовиальной ткани RA, экспрессируют ингибиторный рецептор NKG2A и локализованы преимущественно в лимфоидных агрегатах, прилегающих к синовиоцитам, которые экспрессируют HLA-E, лиганд для CD94-NKG2A.
- 8А показывает синовиальную ткань RA от ID 1144-09, окрашенную на NK-клетки анти-NKp46-антителом.
- 8В показывает синовиальную ткань RA от ID 1591-08, окрашенную на NK-клетки анти-NKp46-антителом.
- 8С показывает синовиальную ткань RA от ID 1144-09, окрашенную на NKG2A Z199-антителом (анти-NKG2A-антителом).
- 8D показывает синовиальную ткань RA от ID 1591-08, окрашенную на NKG2A Z199-антителом (анти-NKG2A-антителом).
- 8Е показывает синовиальную ткань RA от ID 1144-09, окрашенную на HLA-Е 3D12-антителом.
- 8F показывает синовиальную ткань RA от ID 1591-08, окрашенную на HLA-Е 3D12-антителом.
- 8G показывает синовиальную ткань RA от ID 1144-09, окрашенную на Т-клетки анти-CDS-антителом.
- 8Н показывает синовиальную ткань RA от ID 1591-08, окрашенную на Т-клетки анти-CDS-антителом.
- 8I показывает синовиальную ткань RA от ID 1144-09, окрашенную изотипическим контрольным антителом IgG2b.
- 8J показывает синовиальную ткань RA от ID 1591-08, окрашенную изотипическим контрольным антителом IgG2b.
- 8K показывает фотографии высокого увеличения NKp46+ NK-клеток от ID 1595-08.
- 8L показывает фотографии высокого увеличения NKG2A+-клеток от ID 1595-08.
- 8М показывает цифровой анализ изображения для корреляции числа NKG2A+-клеток в синовиальной оболочке от 15 пациентов с RA и числа NKp46+NK-клеток.
Фиг.9 показывает, что NKG2A и его лиганд, HLA-E, экспрессированы в синовиальной оболочке у пациентов с остеоартритом (ОА).
- 9А изображает NKG2A+-клетки (Z199-антитело) среди инфильтрирующих лимфоцитов.
- 9В изображает экспрессию HLA-E (3D12-aHTHTeno) инфильтрирующими иммунными клетками, эндотелиальными клетками и синовиоцитами.
- 9С показывает цифровой анализ изображения для корреляции частоты NKG2A+-клеток с частотой NK-клеток в синовиальной оболочке пациентов с ОА.
Фиг.10 показывает, что лиганд CD94-NKG2A экспрессируется в воспаленной синовиальной оболочки не только у пациентов с RA и ОА, но также у пациентов с PsA.
- 10А изображает окрашивание образцов синовиальной ткани от пациента с RA.
- 10В изображает окрашивание образцов синовиальной ткани от пациента с PsA.
- 10С изображает окрашивание образцов синовиальной ткани от пациента с RO (ОА????)
- 10D изображает окрашивание образцов синовиальной ткани от нормального контроля.
Фиг.11 показывает аминокислотную последовательность:
- 11А: SEQ ID №1; humNKG2A,
- 11В: SEQ ID №2; вариабельный домен тяжелой цепи (VH) антитела humZ270,
- 11С: SEQ ID №3; вариабельный домен легкой цепи (VL) антитела humZ270,
- 11D; SEQ ID №4; вариабельный домен тяжелой цепи (VH) антитела humZ199,
- 11Е: SEQ ID №5; вариабельный домен легкой цепи (VL) антитела humZ199.
Подробное описание изобретения
Термин «антитело», используемый в данном документе, относится к полипептиду, полученному из зародышевой последовательности иммуноглобулина. Этот термин включает полноразмерные антитела и их любые антигенсвязывающие фрагменты или одиночные цепи. Термины «антитело», «моноклональное антитело» и «МКА», используемые в данном документе, используются для обозначения молекул иммуноглобулина и их фрагментов, которые обладают способностью специфически связываться с антигеном. Подкласс иммуноглобулинов, представляющий конкретный фармацевтический интерес, принадлежит семейству IgG, которое может быть поделено на изотипы IgG1, IgG2, IgG3 и IgG4. Молекулы IgG состоят из двух тяжелых цепей, связанных между собой двумя или несколькими дисульфидными связями, и двух легких цепей, каждая из которых присоединена к тяжелой цепи дисульфидной связью. Тяжелая цепь IgG состоит из четырех Ig-доменов, в том числе вариабельного домена (VH) и трех константных доменов (СН1, СН2 и СН3). Каждая легкая цепь состоит из вариабельной области легкой цепи (VL) и константной области легкой цепи (CL). Вариабельные области тяжелой и легкой цепей содержат связывающий домен, который взаимодействует с антигеном. VH- и VL-области могут быть разделены на участки гипервариабельности, называемые областями, определяющими комплементарность (CDR), которые чередуются с областями, которые являются более консервативными и называются каркасными областями (FR). Каждая VH и VL состоит из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Константные области антител могут опосредовать связывание антитела с тканями или факторами хозяина, в том числе с различными клетками иммунной системы (например, эффекторными клетками), Fc-рецепторами (FcR) и первым компонентом (C1q) классической системы комплемента. Связывание с FcR и C1q может опосредовать такие эффекты как ADCC или CDC.
Антитело изобретения может быть любым NKG2A-связывающим антителом, антителом humZ270 (SEQ ID №2 и SEQ ID №3) или антителом humZ199 (SEQ ID №4 и SEQ ID №5) или любым другим антителом изобретения или вариантом любого из этих антител.
Термин «гуманизированное Z270» или «humZ270» или «hZ270», используемый в данном документе, включает антитело, раскрытое в патентной заявке WO 08009545, включенной в данный документ посредством ссылки. Термин «гуманизированное Z199» или «humZ199», используемый в данном документе, включает антитело, раскрытое в патентной публикации W009092805, включенной в данный документ посредством ссылки.
Используемый в данном документе термин «антитело» включает антитело или его фрагмент, который специфически связывается с соответствующим антигеном. Примеры антигенсвязывающих фрагментов включают Fab, Fabʺ, F(ab)2, F(ab')2, F(ab)S, Fv (как правило, VL- и VH-домены одной ветви антитела), одноцепочечный Fv (scFv; см., например, Bird et al., Science 1988; 242:428-426; и Huston et al. PNAS 1988; 85:5879-5883), dsFv, Fd (как правило, VH- и СН1-домен) и dAb (как правило, VH-домен); VH-, VL-, VhH- и V-NAR-домены; моновалентные молекулы, содержащие одиночную VH- и одиночную VL-цепи; миниантитела, двух-, трех-, четырехвалентные антитела и каппа-антитела (см., например, III et al., Protein Eng 1997; 10: 949-57); верблюжий IgG; IgNAR; а также один или более чем один изолированный CDR или функциональный паратоп, где изолированные CDR или антигенсвязывающие остатки или полипептиды могут быть ассоциированы или связаны друг с другом с тем, чтобы сформировать функциональный фрагмент антитела. Различные типы фрагментов антитела были описаны и рассмотрены, например, в Holligerand Hudson, Nat Biotechnol 2005:23, 1126-1136; WO 2005040219, и в опубликованных патентных заявках США 20050238646 и 20020161201.
Термин «антигенсвязывающий фрагмент» антитела относится к одному или более чем одному из фрагментов антитела, которые сохраняют способность специфически связываться с антигеном, например с NKG2A или с другим белком-мишенью, описанным в данном документе. Было показано, что антигенсвязывающая функция антитела может быть выполнена фрагментом полноразмерного антитела. Примеры связывающих фрагментов, охватываемые термином «антигенсвязывающий фрагмент» антитела, включают Fab-фрагмент, F(ab’)2-фрагмент, Fab'-фрагмент, Fd-фрагмент, Fv-фрагмент, scFv-фрагмент, dAb-фрагмент и выделенную область, определяющую комплементарность (CDR). Одноцепочечные антитела, такие как scFv, и антитела тяжелой цепи, такие как VHH, и однодоменные верблюжьи антитела также могут быть охвачены термином «антигенсвязывающая часть» антитела. Эти фрагменты антител могут быть получены с помощью обычных методик, известных специалистам в данной области, и фрагменты могут быть оценены на полезность тем же образом, что и интактные антитела.
«Fab»-фрагмент включает вариабельный домен и константный домен легкой цепи и вариабельный домен и первый константный домен (СН1) тяжелой цепи. Fab'-фрагмент включает одну или более чем одну цистеиновую карбокси-концевую связь с тяжелой или легкой цепями. F(ab')2-фрагменты антитела содержат пару Fab-фрагментов, которые, как правило, ковалентно связаны вблизи их карбокси-концов шарнирными цистеинами. Другие химические связи фрагментов антитела также известны в данной области. Fab-фрагмент сохраняет способность родительского антитела связываться с его антигеном, потенциально с более низкой аффинностью. F(ab')2-фрагменты способны к двухвалентному связыванию, тогда как Fab-фрагменты могут связываться только моновалентно. Как правило, Fab-фрагменты лишены константных СН2- и СН3-доменов, т.е. Fc-части, где будет происходить взаимодействие с Fc-рецепторами. Таким образом, Fab-фрагменты, как правило, лишены эффекторных функций.
«Fv»-фрагмент представляет собой фрагмент антитела, который содержит полный сайт, распознающий и связывающий антиген, и, как правило, содержит димер вариабельных доменов одной тяжелой и одной легкой цепи в тесной ассоциации, которые могут быть ковалентными в природе, например, в одноцепочечном фрагменте вариабельного домена (scFv). Именно в этой конфигурации три гипервариабельные области каждого вариабельного домена взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. Совместно шесть гипервариабельных областей или их подгруппа придают антителу специфичность связывания с антигеном. Тем не менее, даже одиночный вариабельный домен, содержащий только три гипервариабельные области, специфичные к антигену, обладает способностью распознавать и связывать антиген, хотя обычно с более низкой аффинностью, чем полный сайт связывания (Cai & Garen, Proc. Natl. Acad. Sci. USA, 93: 6280-6285, 1996). Например, природные верблюжьи антитела, которые имеют только вариабельный домен тяжелой цепи (VHH), могут связывать антиген (Desmyteret al., J. Biol. Chem., 277: 23645-23650, 2002; Bond et al., J. Mol. Biol. 2003; 332: 643-655).
«Одноцепочечные Fv» или «scFv»-фрагменты антитела включают VH- и VL-домены антитела, где эти домены присутствуют в одной полипептидной цепи. Как правило, Fv-полипептид также содержит полипептидный линкер между доменами VH и VL, который позволяет scFv формировать желаемую структуру для связывания антигена. Для обзора scFv см. Pluckthun, 1994, In: The Pharmacology of Monoclonal Antibodies, Vol.113, Rosenburg and Moore eds. Springer-Verlag, New York, pp.269-315.
Термин «двухвалентные антитела» относится к малым фрагментам антител с двумя антигенсвязывающими участками, где фрагменты содержат вариабельный домен тяжелой цепи (VH), соединенный с вариабельным доменом легкой цепи (VL) в той же полипептидной цепи (VH и VL). При использовании линкера, который является слишком коротким, чтобы позволить спаривание двух вариабельных доменов на одной и той же цепи, вариабельные домены вынуждены спариваться с комплементарными доменами другой цепи, создавая два антигенсвязывающих сайта. Двухвалентные антитела более подробно описаны, например, в ЕР 404097, WO 93/11161 и Hollingeretal., 1993, Proc. Natl. Acad. Sci. USA, 90:6444-6448.
Выражение «линейные антитела» относится к антителам, которые описаны в Zapata et al., 1995, Protein Eng., 8(10):1057-1062. Вкратце, эти антитела содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), которые вместе с комплементарными полипептидами легкой цепи образуют пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Термин «моноантитело», используемый в данном документе, относится к антигенсвязывающей молекуле с вариабельным доменом тяжелой цепи и без вариабельного домена легкой цепи. Моноантитело может связываться с антигеном в отсутствие легких цепей и, как правило, имеет три гипервариабельные области, например CDR, обозначенные как CDRH1, CDRH2 и CDRH3. Моноантитело с тяжелой цепью IgG имеет две антигенсвязывающие молекулы тяжелой цепи, связанные дисульфидной связью. Вариабельный домен тяжелой цепи содержит одну или более чем одну гипервариабельную область, предпочтительно CDRH3-или HVL-Н3-область.
Термин «гипервариабельная область», используемый в данном документе, относится к аминокислотным остаткам антитела, ответственным за связывание антигена. Гипервариабельная область содержит аминокислотные остатки из «области, определяющей комплементарность», или «CDR» (определенные последовательностью в виде остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в вариабельном домене легкой цепи и 31-35 (Н1), 50-65 (Н2) и 95-102 (Н3) в вариабельном домене тяжелой цепи; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)), и/или эти остатки из «гипервариабельной петли» (с определенной структурой и отличающейся для каждого антитела; см., например, Chothia and Lesk, J. Mol. Biol 1987:196:901-917). В одном примере HVL-остатки могут включать 26-32 (L1), 50-52 (L2) и 91-96 (L3) в вариабельном домене легкой цепи и 26-32 (Н1), 53-55 (Н2) и 96-101 (Н3) в вариабельном домене тяжелой цепи.
Фрагменты антител могут быть получены с использованием обычных рекомбинантных методик или методик белковой инженерии, и фрагменты могут быть подвергнуты скринингу на связывание с NKG2A или на другую функцию, таким же образом, как интактные антитела.
Фрагменты антител изобретения могут быть получены путем усечения, например, путем удаления одной или более чем одной аминокислоты с N- и/или С-конца полипептида. Фрагменты также могут быть сформированы путем одной или более чем одной внутренней делеции.
Антитело изобретения может представлять собой или может содержать фрагмент любого анти-NKG2A-антитела, антитело humZ270 (SEQ ID №2 и SEQ ID №3) или антитело humZ199 (SEQ ID №4 и SEQ ID №5) или любое другое антитело изобретения или вариант любого из этих антител. Антитело изобретения может представлять собой или может содержать антигенсвязывающую часть одного из этих антител или их вариантов. Например, антитело изобретения может быть Fab-фрагментом одного из этих антител или их вариантов, или оно может быть одноцепочечным антителом, полученным из одного из этих антител или их вариантов.
Антитело изобретения может быть человеческим антителом или гуманизированным антителом. Термин «человеческое антитело», используемый в данном документе, включает антитела, имеющие вариабельные области, в которых и каркасная область, и CDR-области получены из человеческих иммуноглобулиновых зародышевых последовательностей. Кроме того, если антитело содержит константную область, то константная область также получена из человеческих иммуноглобулиновых зародышевых последовательностей. Человеческие антитела изобретения могут включать аминокислотные остатки, не закодированные человеческими иммуноглобулиновыми зародышевыми последовательностями (например, мутации, введенные случайно или путем сайт-специфического мутагенеза in vitro или путем соматических мутаций in vivo). Тем не менее, термин «человеческое антитело», используемый в данном документе, не включает антитела, в которых CDR-последовательности, полученные из зародышевой линии других видов млекопитающих, таких как мышь, были привиты в человеческие каркасные последовательности.
Такое человеческое антитело может быть человеческим моноклональным антителом. Такое человеческое моноклональное антитело может быть получено с помощью гибридомы, которая содержит В-клетку, полученную из трансгенного животного, отличного от человека, например, из трансгенной мыши, имеющей геном с человеческим трансгеном тяжелой цепи и трансгеном легкой цепи, слитую с иммортализованной клеткой.
Человеческие антитела могут быть выделены из библиотек последовательностей, построенных на подборке человеческих зародышевых последовательностей, также диверсифицированных с разнообразием природных и синтетических последовательностей.
Человеческие антитела могут быть получены путем in vitro иммунизации лимфоцитов человека с последующей трансформацией лимфоцитов вирусом Эпштейна-Барр.
Термин «производные человеческого антитела» относится к любой модифицированной форме человеческого антитела, например к конъюгату антитела и другому агенту или антителу.
Термин «гуманизированное антитело», используемый в данном документе, относится к химерному антителу человек/нечеловек, которое содержит минимальную последовательность (CDR-области), полученную из нечеловеческого иммуноглобулина. Таким образом, гуманизированное антитело является человеческим иммуноглобулином (реципиентное антитело), в котором остатки из гипервариабельной области реципиента заменены остатками гипервариабельной области нечеловеческого вида (донорное антитело), например мыши, крысы, кролика или примата, с нужной специфичностью, аффинностью и активностью. В некоторых случаях FR-остатки человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Примером такой модификации является введение одной или более чем одной так называемой обратной мутации.
Кроме того, гуманизированные антитела могут содержать остатки, которые не встречаются в реципиентном антителе или донорном антителе. Эти модификации сделаны для дальнейшего уточнения характеристик антитела. Как правило, гуманизированное антитело будет содержать практически все из по меньшей мере одного или, как правило, двух вариабельных доменов, в которых все или практически все гипервариабельные петли соответствуют таковым в нечеловеческом иммуноглобулине, и все или практически все FR-остатки принадлежат человеческой иммуноглобулиновой последовательности. Гуманизированное антитело, возможно, может также содержать по меньшей мере часть константной области иммуноглобулина (Fc), как правило, человеческого иммуноглобулина.
Термин «химерное антитело», используемый в данном документе, относится к антителу, в котором гены легкой и тяжелой цепей были сконструированы, как правило, путем генной инженерии, из генов вариабельных и константных областей иммуноглобулинов, происходящих из различных видов. Например, вариабельные сегменты генов из моноклонального мышиного антитела могут быть соединены с константными сегментами человека.
Кристаллизуемый фрагмент («Fc-область»/«Fc-домен») антитела представляет собой «хвостовую» область антитела, включающую константные СН2- и СН3-домены. Fc-домен может взаимодействовать с рецепторами клеточной поверхности, называемыми Fc-рецепторами, а также с некоторыми белками системы комплемента. Fc-область позволяет антителам активировать иммунную систему. В одном аспекте данного изобретения антитела могут быть сконструированы так, чтобы они включали модификации в пределах Fc-области, как правило, для изменения одного или более чем одного функционального свойства, такого как время полужизни в сыворотке, фиксация комплемента, Fc-рецепторное связывание, стабильность белка и/или антигензависимая клеточная цитотоксичность, или отсутствие таковых. Кроме того, антитело изобретения может быть химически модифицировано (например, к антителу может быть присоединена одна или более чем одна химическая группировка) или модифицировано для изменения его гликозилирования, снова для изменения одного или более чем одного функционального свойства антитела. Предпочтительно, модифицированный Fc-домен включает одну или более, предпочтительно все следующие мутации, которые приведут к снижению аффинности к определенным Fc-рецепторам (L234A, L235E и G237A) и к снижению dq-опосредованного связывания комплемента (А330 и P331S), соответственно.
Изотип антитела изобретения может быть IgG, например IgG1, IgG2, IgG4. Если нужно, то класс антитела может быть «переключен» с помощью известных методик. Например, антитело, которое первоначально было получено как IgM-молекула, может быть переключено на антитело класса IgG. Методики переключения класса также могут быть использованы для преобразования одного подкласса IgG в другой, например: с IgG1 в IgG2 или IgG4; с IgG2 в IgG1 или IgG4, или с IgG4 в IgG1 или IgG2. Также может быть выполнена инженерия антител для создания химерных молекул с константной областью путем комбинации областей из различных подклассов IgG.
Термин «эпитоп», используемый в данном документе, используется в контексте молекулярного взаимодействия между «антигенсвязывающим полипептидом», таким как антитело (Ab), и соответствующим ему «антигеном» (Ag). Термин «антиген» (Ag) относится к молекулярной единице, используемой для иммунизации иммунокомпетентного позвоночного для производства антитела (АЬ), которое распознает антиген. В данном документе термин «антиген» понимается более широко и, как правило, включает молекулы-мишени, которые специфически распознаются антителом, таким образом включая фрагменты или имитаторы молекулы, используемой в процессе иммунизации для получения антитела.
Как правило, термин «эпитоп» относится к области или участку на антигене, с которым специфически связывается антитело, т.е. к области или участку, который физически контактирует с антителом. Белковый эпитоп может включать аминокислотные остатки в антигене, которые непосредственно участвуют в связывании с антителом (также называемые иммунодоминантным компонентом эпитопа), и другие аминокислотные остатки, которые непосредственно не участвуют в связывании, такие как аминокислотные остатки антигена, которые эффективно блокируются антителом (другими словами, аминокислотный остаток на «поверхности исключенного из растворителя объема» и/или «посадочное, место» антитела). Термин «эпитоп» в данном документе включает оба типа сайтов связывания в любой конкретной области NKG2A, которые специфически связываются с анти-NKG2A-антителом или другим NKG2A-специфическим агентом в соответствии с изобретением, если не указано иное (например, в некоторых контекстах изобретение относится к антителам, которые связываются непосредственно с конкретными аминокислотными остатками). NKG2A может содержать ряд различных эпитопов, которые могут включать, но не ограничиваясь ими, (1) линейный пептидный эпитоп, (2) конформационный эпитоп, который состоит из одной или более несмежных аминокислот, расположенных рядом друг с другом в конформации зрелого NKG2A; и (3) посттрансляционный эпитоп, который состоит, полностью или частично, из молекулярных структур, ковалентно присоединенных к NKG2A, таких как углеводные группы.
Эпитоп для данной пары антитело (Ab)/антиген (Ag) может быть определен и охарактеризован на различных уровнях детализации с помощью различных экспериментальных и расчетных способов картирования эпитопов. Экспериментальные способы включают мутагенез, рентгеновскую кристаллографию, спектроскопию ядерного магнитного резонанса (NMR), масс-спектрометрию с водородно-дейтериевым обменом (HX-MS) и различные способы конкурентного связывания; способы, известные в данной области. Поскольку каждый способ основан на уникальном принципе, описание эпитопа тесно связано со способом, которым оно было проведено. Таким образом, эпитоп для данной пары Ab/Ag будет определен по-разному в зависимости от используемого способа картирования эпитопа.
На самом детальном уровне эпитоп для взаимодействия между Ag и Ab можно определить посредством пространственных координат, определяющих атомные контакты, присутствующие во взаимодействии Ag-Ab, а также как информацию об их относительной роли в термодинамике связывания. На менее детальном уровне эпитоп можно охарактеризовать посредством пространственных координат, определяющих атомные контакты между Ag и Ab. На еще менее детальном уровне эпитоп можно охарактеризовать посредством аминокислотных остатков, которые он содержит, определенных по специфическим критериям, например по расстоянию между атомами в Ab и Ag. На еще менее детальном уровне эпитоп можно охарактеризовать через функцию, например при конкурентном связывании с другими антителами. Эпитоп также может быть определен в более общем плане как включающий аминокислотные остатки, для которых замещение другой аминокислотой изменит характеристики взаимодействия между Ab и Ag.
В контексте полученной с помощью рентгеновских лучей кристаллической структуры, определенной по пространственным координатам комплекса между Ab, например Fab-фрагментом, и его Ag, термин «эпитоп» в данном документе специфически определяется как NKG2A-остатки, характеризующиеся наличием тяжелого атома (т.е. не атома водорода) на расстоянии 4Å от тяжелого атома в Ab, если не указано иное, или если это не противоречит контексту.
Из того факта, что описания и определения эпитопов получают на разных уровнях детализации в зависимости от используемого способа картирования эпитопа, следует, что сравнение эпитопов для различных Ab на одном и том же Ag может быть проведено аналогичным образом на различных уровнях детализации.
Эпитопы, описанные на уровне аминокислот, например определенные рентгеноструктурным образом, называют идентичными, если они содержат одинаковый набор аминокислотных остатков. Эпитопы называют перекрывающимися, если у них хотя бы одна аминокислота является общей. Эпитопы называют отдельными (уникальными), если они не имеют общих аминокислотных остатков с другими эпитопами.
Эпитопы, которые характеризуются конкурентным связыванием, называют перекрывающимися, если связывание соответствующих антител является взаимоисключающим, т.е. связывание одного антитела исключает одновременное связывание другого антитела. Эпитопы называют отдельными (уникальными), если антиген может обеспечить связывание обоих соответствующих антител одновременно.
Определение термина «паратоп» получают из данного выше определения «эпитопа», меняя перспективу. Таким образом, термин «паратоп» относится к области или участку на антителе, с которым специфически связывается антиген, т.е. с которым он имеет физический контакт.
В контексте полученной с помощью рентгеновских лучей кристаллической структуры, определенной по пространственным координатам комплекса между Ab, например Fab-фрагментом, а его Ag, термин «паратоп» в данном документе специфически определяется как антигенные остатки, характеризующиеся наличием тяжелого атома (т.е. не атома водорода) на расстоянии 4А от тяжелого атома в NKG2A, если не указано иное или если это не противоречит контексту.
Эпитоп и паратоп для данной пары антитело (Ab)/антиген (Ag) могут быть выявлены стандартными способами. Например, общее местонахождение эпитопа может быть определено путем оценки способности антитела связываться с разными фрагментами или вариантами полипептидов NKG2A. Специфические аминокислоты в NKG2A, которые создают контакт с антителом (эпитоп), и специфические аминокислоты в антителе, которые создают контакт с NKG2A (паратоп), также могут быть определены с помощью обычных способов. Например, антитело и молекула-мишень могут быть объединены, и комплекс Ab/Ag может быть кристаллизован. Кристаллическая структура комплекса может быть определена и использована для идентификации специфических сайтов взаимодействия между антителом и его мишенью.
Антитела, связывающиеся с одним и тем же антигеном, могут быть охарактеризованы с точки зрения их способности связываться с их общим антигеном одновременно и могут быть подвергнуты «сортировке». В контексте данного изобретения термин «сортировка» относится к способу группировки антител, которые связываются с одним и тем же антигеном. «Сортировка» антител может быть основана на конкуренции связывания двух антител с их общим антигеном в анализах на основе стандартных методик, таких как поверхностный плазменный резонанс (SPR), ELISA или проточная цитометрия.
«Сортировка» определяется с помощью референсного антитела. Если второе антитело не может связываться с антигеном в то же самое время, что и референсное антитело, то про второе антитело говорят, что оно принадлежит к тому же «сорту», что и референсное антитело. В этом случае референсное и второе антитела конкурируют за связывание с антигеном, таким образом, пара антител называются «конкурирующими антителами». Если второе антитело способно связываться с антигеном в то же время, что и референсное антитело, то про второе антитело говорят, что оно принадлежат к отдельному «сорту». В этом случае референсное и второе антитела не конкурируют за связывание с антигеном, таким образом, пара антител называются «неконкурирующими антителами».
«Сортировка» антител не дает прямой информации об эпитопе. Конкурирующие антитела, т.е. антитела, принадлежащие к одному и тому же «сорту», могут иметь идентичные эпитопы, перекрывающиеся эпитопы или даже отдельные эпитопы. В последнем случае референсное антитело, связанное с его эпитопом на антигене, занимает пространство, необходимое второму антителу, чтобы связаться с его эпитопом на антигене («стерическое препятствие). Неконкурирующие антитела имеют отдельные эпитопы.
Термин «аффинность связывания» в данном документе используется для обозначения силы нековалентного взаимодействия двух молекул, например антитела или его фрагмента и антигена. Термин «аффинность связывания» используется для описания одновалентных взаимодействий (внутренняя активность).
Аффинность связывания двух молекул, например антитела или его фрагмента и антигена, через моновалентное взаимодействие может быть количественно оценена путем определения константы диссоциации (KD). В свою очередь, KD может быть определена путем измерения кинетики формирования и диссоциации комплекса, например с помощью SPR. Константы скоростей, соответствующие ассоциации и диссоциации одновалентного комплекса, называются константой скорости ассоциации ka (или kon) и константой скорости диссоциации kd (или koff), соответственно. KD связана с ka и kd через уравнение KD=kd/ka.
Следуя приведенному выше определению, связанные с различными молекулярными взаимодействиями аффинности связывания, например, аффинности связывания различных антител с данным антигеном, можно сравнить путем сравнения значений Ко для отдельных комплексов антитело/антиген.
Аналогичным образом, специфичность взаимодействия можно оценить путем определения и сравнения значений Ко взаимодействия, представляющего интерес, например специфического взаимодействия между антителом и антигеном, со значением Ко взаимодействия, не представляющего интерес.
Как правило, KD антитела по отношению к мишени будет в 2 раза, предпочтительно в 5 раз, более предпочтительно в 10 раз меньше, чем KD по отношению к другим, не целевым, молекулам, таким как неродственный материал или сопроводительный материал в окружающей среде. Более предпочтительно Ко будет в 50 раз меньше, например в 100 раз меньше или в 200 раз меньше; еще более предпочтительно в 500 раз меньше, например в 1000 раз меньше или в 10000 раз меньше.
Значение этой константы диссоциации можно определить непосредственно с помощью способов, таких как стандартные анализы для оценки связывающей способности лигандов, таких как антитела, с мишенями, которые хорошо известны в данной области и включают, например, ИФА, вестерн-блот, радиоиммунологический анализ и проточную цитометрию. Кинетику связывания и аффинность связывания антитела также можно оценить с помощью стандартных анализов, известных в данной области, таких как SPR.
Можно проводить анализ конкурентного связывания, в котором связывание антитела с мишенью сравнивают со связыванием мишени с другим лигандом этой мишени, например, с другим антителом.
Антитело изобретения может иметь KD для своей мишени 1×10-7 М или меньше, 1×10-8 М или меньше, или 1×10-9 М или меньше, или 1×10-10 М или меньше, 1×10-11 М или меньше, или 1×10-12 М или меньше. The KD антитела данного изобретения может быть меньше 0,8 нМ, например меньше 0,7 нМ, например меньше 0,6 нМ, например меньше 0,5 нМ, например меньше 0,4 нМ, например меньше 0,3 нМ, например меньше 0,2 нМ, например меньше 0,1 нМ, например меньше 0,05 нМ, например меньше 0,025 нМ, например меньше 0,015 нМ, например от 0,015 нМ до 0 нМ.
Термин «идентичность», известный в данной области, относится к взаимосвязи последовательностей двух или более полипептидов, определенной путем сравнения последовательностей. В данной области «идентичность» также означает степень связанности полипептидных последовательностей, определенную по количеству совпадений между строками двух или более аминокислотных остатков. «Идентичность» измеряет процент совпадений в меньшей из двух или более последовательностей с пробелами для выравнивания (если таковые имеются), рассматриваемых определенной математической моделью или компьютерной программой (т.е. «алгоритмами»). Идентичность родственных полипептидов можно легко вычислить известными способами. Такие способы включают, но не ограничиваясь ими, те, которые описаны в Computational Molecular Biology, Lesk, A.M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D.W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A.M., and Griffin, H.G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; и Carillo etal., SIAM J. Applied Math. 48, 1073 (1988).
Предпочтительные способы определения идентичности разработаны так, чтобы получить самое большое совпадение анализируемых последовательностей. Способы определения идентичности описаны в общедоступных компьютерных программах. Предпочтительные компьютерные программы для определения идентичности двух последовательностей включают программный пакет GCG, в том числе GAP (Devereux et al., Nucl. Acid. Res. 12. 387 (1984); Genetics Computer Group, University of Wisconsin, Madison, Wis.), BLASTP, BLASTN и FASTA (Altschul et al., J. Mol. Biol. 215. 403-410 (1990)). Программа BLASTX общедоступна в Национальном центре биотехнологической информации (NCBI) и в других источниках (BLAST Manual, Altschul et al. NCB/NLM/NIH Bethesda, Md. 20894; Altschul et al., см. выше). Для определения идентичности также может быть использован хорошо известный алгоритм Смита-Уотермана.
Например, с помощью компьютерного алгоритма GAP (Genetics Computer Group, Университет штата Висконсин, Мэдисон, Висконсин) два полипептида, для которых должен быть определен процент идентичности последовательностей, выравнивают для оптимального совпадения их соответствующих аминокислот («интервал совпадения», определенный с помощью алгоритма). В сочетании с алгоритмом используется штраф за открытие делеции (который рассчитывается как 3-кратная средняя диагональ; «средняя диагональ» является средним значением диагонали используемой матрицы сравнения; «диагональ» является оценкой или числом, присваиваемым каждому точному совпадению аминокислоты с конкретной матрицей сравнения) и штраф за удлинение делеции (который обычно равен {(1/10) части} штрафа за открытие делеции), а также матрица сравнения, такая как РАМ 250 или BLOSUM 62. Стандартная матрица сравнения (см. Dayhoff et al., Atlas of Protein Sequence and Structure, vol.5, supp.3 (1978) for the РАМ 250 comparison matrix; Henikoff et al., Proc. Natl. Acad. Sci USA 89, 10915-10919 (1992) также используется алгоритмом.
Предпочтительные параметры для сравнения пептидных последовательностей являются следующими:
Алгоритм: Needleman et al., J. Mol. Biol. 48, 443-453 (1970); Матрица сравнения: BLOSUM 62 из Henikoff et al., PNASUSA89, 10915-10919 (1992); штраф за открытие делеции: 12, штраф за удлинение делеции: 4, порог подобия: 0.
Программа GAP используется с указанными выше параметрами. Вышеупомянутые параметры являются параметрами по умолчанию для сравнения пептидов (наряду с отсутствием штрафа за концевые делеции) с использованием алгоритма GAP.
Термин «сходство» является родственной концепцией, но в отличие от «идентичности» относится к взаимоотношению последовательностей, которое включает как идентичные совпадения, так и консервативные замены. Если бы две полипептидные последовательности имели, например, (часть (10/20)) идентичных аминокислот, а все остальные являлись бы неконсервативными заменами, то и процент идентичности, и процент сходства составлял бы 50%. Если бы в том же примере более 5 позиций были бы заняты консервативными заменами, то процент идентичности остался бы 50%, но процент сходства составил бы 75% ((часть (15/20))). Таким образом, в случаях, когда имеются консервативные замены, степень сходства между двумя полипептидами будет выше, чем процент идентичности между этими двумя полипептидами.
«Рецептор» определяется как молекулярная структура, присутствующая на поверхности или внутри клетки. Рецептор образует характерный клеточный ответ, т.е. биологическую активность, когда связывается с лигандом. «Лиганд» для рецептора определяется как любая молекула (например, пептид, полипептид, углевод, небольшая молекула или ион), которая селективно способна связываться с рецептором. Агонистический лиганд («агонист») представляет собой лиганд, который после связывания с рецептором способен в некоторой степени вызывать характерный ответ рецептора. Антагонистический лиганд («антагонист») представляет собой лиганд, который обладает способностью связываться с рецептором и в некоторой степени блокировать действие агониста, например, природный лиганд рецептора.
NKG2A (OMIM 161555, полное раскрытие которого включено в данный документ посредством ссылки) является членом группы транскриптов NKG2 (Houchins, et al. (1991) J. Exp. Med. 173:1017-1020). NKG2A кодируется 7 экзонами, охватывающими 25 kb, показывая некоторый дифференциальный сплайсинг. Вместе с CD94 NKG2A формирует гетеродимерный ингибиторный рецептор CD94/NKG2A, найденный на поверхности субпопуляций NK-клеток, α/β Т-клеток, γ/δ Т-клеток и NKT-клеток. Подобно ингибиторным KIR-рецепторам он имеет ITIM в его цитоплазматическом домене. Используемый в данном документе термин «NKG2A» относится к любому варианту, производному или изоформе гена NKG2A или кодируемого белка. Также охватывает любые нуклеиновокислотные или белковые последовательности, имеющие одно или более чем одно общее биологическое свойство или функцию с диким типом, полноразмерным NKG2A, и имеющие по меньшей мере 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более высокую нуклеотидную или аминокислотную идентичность. Человеческий NKG2A включает 233 аминокислоты в трех доменах с цитоплазматическим доменом, включающим остатки 1-70, трансмембранной областью, включающей остатки 71-93, и внеклеточной областью, содержащей остатки 94-233, в следующей последовательности:
MDNQGVIYSDLNLPPNPKRQQRKPKGNKSSILATEQE1TYAELNLQKASQDFQGNDKTYHCKDLPSAPEKLIVGILGIICLILMASWTIWIPSTLIQRHNNSSLNTRTQKARHCGHCPEEWITYSNSCYYIGKERRTWEESLLACTSKNSSLLSIDNEEEMKFLSIISPSSWIGVFRNSSHHPWVTMNGLAFKHEIKDSDNAELNCAVLQVNRLKSAQCGSSIIYHCKHKL(SEQ ID №1).
HLA-E (OMIM 143010, полное раскрытие которого включено в данный документ посредством ссылки) представляет собой неклассическую молекулу МНС, которая экспрессируется на поверхности клетки и регулируется связыванием с пептидами, образованными из сигнальной последовательности других молекул МНС класса I. HLA-E связывает натуральные киллеры (NK) и некоторые Т-клетки, специфически связываясь с CD94/NKG2A, CD94/NKG2B и CD94/NKG2C (см., например, Braud et al. (1998) Nature 391:795-799, полное раскрытие которого включено в данный документ посредством ссылки). Поверхностная экспрессия HLA-E достаточна для того, чтобы защитить клетки-мишени от лизиса клеточными клонами CD94/NKG2A+NK, Т или NKT. Используемый в данном документе термин «HLA-E» относится к любому варианту, производному или изоформе гена HLA-E или кодируемого белка. Также охватывает любые последовательности нуклеиновых кислот или белков, имеющие одно или более чем одно общее биологическое свойство или функцию с диким типом, полноразмерным HLA-E, и имеющие по меньшей мере 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или более высокую нуклеотидную или аминокислотную идентичность.
В контексте данного изобретения термин «агент, который связывается с человеческим рецептором CD94/NKG2A» или «анти-NKG2A-антитело» или «NKG2A-связывающее антитело» относится к любому агенту и/или антителу со связыванием с человеческим рецептором CD94/NKG2A, детектируемым с помощью любого стандартного анализа, где агент и/или антитело инкубируется в присутствии CD94/NKG2A или NKG2A, а связывание обнаруживается, например, с помощью радиоактивных, физических способов, таких как масс-спектрометрия, или прямых или косвенных флуоресцентных меток, обнаруживаемых, например, с помощью цитофлуорометрического анализа (например, FACScan). Любое значение связывания, превышающее значение с контролем, неспецифическим агентом, указывает, что агент связывается с мишенью.
Термин «гуманизированное Z270» или «humZ270» или «DZ270», используемый в данном документе, включает антитело (SEQ ID №2 и SEQ №3), раскрытое в патентной заявке WO 08009545, включенной в данный документ посредством ссылки. Термин «гуманизированное Z199» или «humZ199», используемый в данном документе, включает антитело (SEQ ID №4 и SEQ ID №5), раскрытое в патентной публикации WO 9092805, включенной в данный документ посредством ссылки.
Под «пролонгирующими группами»/«группировками, удлиняющими время полужизни» в данном документе понимаются одна или более чем одна химическая группа, присоединенная к одному или более чем одному аминокислотному сайту, с функциональностями, например -SH, -ОН, -СООН, -CONH2, -NH2, или одна или более чем одна N- и/или O-гликановая структура, которая может увеличить in vivo время полужизни в кровотоке терапевтических белков/пептидов, когда они конъюгированы с этими белками/пептидами. Примеры «пролонгирующих групп» включают, но не ограничиваясь ими: биосовместимые жирные кислоты и их производные, гидроксиалкилкрахмал (HAS), например, гидроксиэтилкрахмал (HES), полиэтиленгликоль (PEG), Poly (Glyx-Sery)n (НАР), гиалуроновую кислоту (НА), полимеры гепарозана (НЕР), полимеры на основе фосфорилхолина (РС-полимер), флексимеры, декстран, полисиаловые кислоты (PSA), Fc-домен, трансферрин, альбумин, эластинподобные пептиды, ХТЕМ-полимеры, альбуминсвязывающие пептиды, СТР-пептид и любые их комбинации.
Термин «NKG2A-Рс-гибридный белок» в данном описании охватывает NKG2A, слитый с Fc-доменом, который может быть получен из любого изотипа антитела.
Воспаление представляет собой комплексную биологическую реакцию тканей на различные стимулы, в том числе патогены, поврежденные клетки или раздражители. Воспаление является защитной реакцией организма, чтобы удалить или изолировать вредные стимулы и начать процесс восстановления. Воспаление не является синонимом инфекции - инфекция представляет собой вторжение в организм экзогенного патогена, в то время как воспаление является ответом иммунной системы на патоген.
Воспаление представляет собой каскад событий с участием многих компонентов, включая сосудистую систему (например, эндотелиальные клетки, перициты, гладкомышечные клетки), клетки иммунной системы (например, Т- и В-лимфоциты, моноциты, дендритные клетки, нейтрофилы), растворимые медиаторы клеток (цитокины, хемокины), а также резидентные клетки в целевой ткани (например, эпителиальные клетки, синовиальные фибробласты, нервные клетки). Острое воспаление является кратковременным (от нескольких часов до нескольких дней) и в значительной степени включает резидентные клетки в ткани, миграцию лейкоцитов и экссудацию жидкости и белков плазмы в месте воспаления. Это связано с изменением сосудистого потока, активацией клеток и клеточными компонентами, которые привлекают лейкоциты из кровотока к месту повреждения. Хроническое воспаление является длительным процессом, при котором активное воспаление, разрушение ткани и попытка восстановления развиваются одновременно. Хроническое воспаление может возникнуть в результате хронической инфекции, длительного и повторного воздействия токсических агентов или в результате аутоиммунитета, явления, при котором иммунные клетки организма атакуют собственные ткани, вызывая повреждение.
Как правило, иммунная система способна различать нормальные клетки организма (или «свои») и чужие патогены или неномальные клетки («не свои»). В некоторых случаях иммунная система теряет способность распознавать «свои» как нормальные и несоответственно инициирует реакцию против ткани или клеток. Этот ответ связан с потерей толерантности к своим клеткам и называется «аутоиммунитетом». Патологии в результате аутоиммунитета часто имеют серьезные клинические последствия и являются одной из основных в мире проблем в области здравоохранения, особенно в развитых странах. Примеры таких аутоиммунных заболеваний включают ревматоидный артрит (RA), псориаз, псориатический артрит, системную красную волчанку (SLE), волчаночный нефрит, сахарный диабет 1 типа, болезнь Грейвса, синдром воспаления кишечника (IBD), болезнь Крона (CD), язвенный колит (UC), синдром раздраженного кишечника, рассеянный склероз (MS), аутоиммунный миокардит, болезнь Кавасаки, ишемическую болезнь сердца, хроническую обструктивную болезнь легких, интерстициальную болезнь легких, аутоиммунный тиреоидит, склеродермию, системный склероз, остеоартрит, атопический дерматит, витилиго, реакцию трансплантата против хозяина, синдром Шегрена, аутоиммунный нефрит, синдром Гудпасчера, хроническую воспалительную демиелинизирующую полинейропатию, аллергию, астму и другие аутоиммунные заболевания, которые являются результатом острого или хронического воспаления.
Процесс, при котором иммунная система теряет способность распознавать «свое» как нормальное, и последующий ответ, направленный против ткани или клеток, приводит к потере толерантности, состоянию «аутоиммунитета». Патологии, развивающиеся в результате аутоиммунитета, часто имеют серьезные клинические последствия и являются одной из основных в мире проблем в области здравоохранения.
Целевые биологические терапевтические средства в настоящее время доступны для лечения некоторых аутоиммунных заболеваний и/или хронических воспалительных заболеваний. Например, пациентов с ревматоидным артритом можно лечить анти-CD20, антагонистом TNF (растворимым TNFR или анти-TNF-α); пациентов с псориазом можно лечить анти-CDHα; пациентов с рассеянным склерозом можно лечить INF-бета; пациентов с язвенным колитом можно лечить анти-TNF-α, а пациентов с болезнью Крона можно лечить анти-TNF-α или анти-CD4-интегрином. К сожалению, большое число пациентов, получающих лечение любым из этих биопрепаратов, могут испытывать различные побочные эффекты, могут не отвечать на лечение и/или могут образовывать нейтрализующие антитела против лекарственного средства. До сих пор существует потребность в альтернативных биологических лекарственных средствах, которые были бы специфично направлены на патологию, но не влияли бы на здоровые клетки/ткани, приводили бы к уменьшению числа или менее серьезным побочным эффектам, могли бы использоваться в течение долгого времени и/или не приводили бы к образованию нейтрализующих антител. Данное изобретение относится к этим неудовлетворенными потребностями среди пациентов с аутоиммунными и/или хроническими воспалительными заболеваниями, раскрывая антитела, которые подходят для применения в таком лечении.
Ревматоидный артрит (RA) является системным заболеванием, которое влияет на весь организм и является одним из наиболее распространенных форм артрита. Он характеризуется воспалением сустава, что приводит к боли, ригидности, повышению температуры, покраснению и отеку. Это воспаление является следствием воспалительных клеток, входящих в суставы, и эти воспалительные клетки выделяют ферменты, которые могут разрушать кость и хрящ. В результате это воспаление может привести к серьезным повреждениям кости и хряща и износу сустава и сильной боли помимо других физиологических эффектов. Вовлеченный сустав может потерять свою форму и ориентацию, что приводит к боли и потере подвижности.
В данной области известно несколько моделей ревматоидного артрита на животных. Например, в модели артрита, индуцированного коллагеном (CIA, collagen-induced arthritis), у мышей развивается воспалительный артрит, который напоминает человеческий ревматоидный артрит. Поскольку CIA имеет схожие иммунологические и патологические особенностей с RA, это делает его подходящей моделью для скрининга потенциальных человеческих противовоспалительных соединений. Эффективность в данной модели измеряется уменьшением отека сустава. Эффективность при RA в клинике измеряется способностью уменьшать симптомы у пациентов, которая измеряется по комбинации отека суставов, СОЭ, уровня С-реактивного белка и уровней сывороточных факторов.
Эрозия хряща или деструкция хряща, связанная с RA, главным образом вызывается субпопуляциями фибробластоподобных синовиоцитов (FLS), присутствующих в синовиальной интимальной оболочке. FLS, иногда также называемые синовиоцитами типа В или синовиальными фибробластами RA (RASP), имеют мезенхимальное происхождение и играют ключевую роль за счет продукции цитокинов, которые поддерживают воспаление, и они являются основными продуцентами протеаз, которые способствуют деструкции хряща. При RS у FLS развивается агрессивный фенотип, способный проникать во внеклеточный матрикс хряща и еще сильнее усугублять повреждение сустава.
Эрозия хряща или деструкция хряща, о которой говорится в данной заявке, является потерей или деградацией хрящевой ткани.
Резорбция кости, удаление костной ткани остеокластами, является уникальной функцией остеокластов, которые представляют собой специализированные многоядерные клетки, образованные из моноцитарной клеточной линии. Их дифференцировка регулируется колониестимулирующим фактором макрофагов, RANK-лигандом и остеопротегерином, а также множеством других медиаторов, которые могут позитивно или негативно регулировать их дифференцировку, активацию и/или выживание. Остеокласт разрабатывает специализированный цитоскелет, который позволяет установить изолированное микроокружение между ним и костью, в котором деградация костного белка и минералов происходит способом, включающим протонный транспорт и выделение фермента.
Эрозия кости, о которой говорится в данной заявке, является потерей костной массы или минеральной плотности костной ткани, что происходит, когда есть небольшое (или более значительное), но стойкое повышение темпов костной резорбции над скоростью образования костной ткани.
Остеоартрит (ОА) является наиболее распространенным типом артрита, особенно у взрослых 65 лет и старше. Заболевание характеризуется хронической дегенеративной артропатией, что часто приводит к хронической боли и инвалидности. Зарегистрированная заболеваемость и показатели распространенности ОА конкретных суставов широко варьируют из-за различий в определении случая ОА. Например, ОА может быть определен по рентгенографическим критериям (радиографический ОА), по типичным симптомам (симптоматический ОА) или по тому и другому. С помощью рентгенографических критериев было установлено, что дистальные и проксимальные межфаланговые суставы поражаются наиболее часто, но они наименее вероятно являются симптоматическими. Напротив, коленный и бедренный суставы, которые являются вторым и третьим наиболее распространенным местоположением рентгенографического ОА, соответственно, почти всегда являются симптоматическими. Первый плюснефаланговый и запястно-пястный суставы также являются частыми местами рентгенографического ОА, в то время как плечевой, локтевой, запястный и пястно-фаланговый суставы редко подвергаются идиопатическому ОА.
Возраст является наиболее единообразным выявленным фактором риска для ОА, и показатели распространенности резко возрастают после 50 лет у мужчин и 40 лет у женщин. ОА диагностируется триадой типичных симптомов, физических выводов и рентгенологических изменений. Американский колледж ревматологии изложил критерии классификации, чтобы помочь в идентификации пациентов с симптоматическим ОА, которые включают рентгенографические данные, но не полностью основываются на них. Пациенты с ранним заболеванием ощущают локализованную боль в суставах, которая снижает активность и мешает отдыху, а с тяжелой болезнью могут испытывать боль в состоянии покоя. Суставы, несущие вес тела, могут «тормозить» или «поддаваться» из-за внутреннего нарушения, что является следствием поздних стадий заболевания: Ригидность по утрам или после бездействия («феномен геля») редко превышает 30 минут.
Физические проявления при остеоартрите сустава включают костное разращение, крепитацию, холодный выпот и снижение объема движений. Чувствительность при пальпации по линии сустава и боль при пассивных движениях также распространены, хотя не уникальны для ОА. Рентгенологические признаки ОА (слайд) включают формирование остеофитов, сужение суставной щели, субхондральный склероз и кисты. Наличие остеофитов является наиболее специфичным радиографическим маркером, хотя оно указывает на относительно позднюю стадию заболевания.
Рентгенограммы считаются «золотым стандартом» для диагностики ОА, но рентгенологические изменения очевидны при заболевании только сравнительно поздно. Велика необходимость чувствительного и специфического биологического маркера, который обеспечил бы раннюю диагностику ОА и мониторинг его прогрессии. Обычные лабораторные исследования, такие как скорость седиментации и С-реактивный белок, не могут использоваться в качестве маркеров ОА, хотя недавнее исследование показало, что повышение CRP предсказывает более быструю прогрессию заболевания. Тем не менее, было описано несколько эпитопов хрящевых компонентов, которые предлагают определенные перспективы в качестве маркеров ОА. Например, эпитоп 846 хондроитинсульфат, который в норме экспрессируется только в хрящевой ткани плода и новорожденного, наблюдается при ОА, но не найден в хрящевой и синовиальной жидкости здорового взрослого. Вместе с тем, в хряще при ОА был описан эпитоп, уникальный для коллагена II типа, и он может быть обнаружен in vitro при экспозиции нормального хряща ММР. Этот эпитоп может быть измерен в крови и моче и может оказаться полезным в диагностике или мониторинге прогрессии ОА. Также было показано, что повышенные уровни гиалуроновой кислоты в сыворотке некоторым образом коррелируют с рентгенографическим ОА. Обнаружение повышенных уровней олигомерного белка хряща (СОМР) в синовиальной жидкости после травматического повреждения сустава может предвещать развитие ОА в поврежденном суставе. Другие потенциальные маркеры ОА перечислены, но либо не являются легко доступными, либо теряют чувствительность и специфичность, необходимую для рассмотрения их в качестве потенциальных маркеров ОА.
Клинические симптомы воспаления, наличие гистологического воспаления в синовиальной ткани при ОА и раннее повреждение хряща на границе воспаленной синовиальной оболочки являются убедительным свидетельством того, что синовиит является ключевым фактором в патогенезе ОА. Традиционный взгляд на ОА как на заболевание только хряща является устаревшим. В настоящее время ОА следует рассматривать как заболевание целого сустава, который включает синовиальную ткань. Кость, хрящ и синовиальная оболочка связаны посредством межклеточных взаимодействий, высвобождения растворимых медиаторов и механических сигналов. Воспаление синовиальной оболочки хотя и не является обязательным условием для развития ОА, явно вовлечено в нарушение хряща и, таким образом, в прогрессию заболевания. Нацеливание на воспалительную синовиальную оболочку должно отсрочить или предотвратить повреждение суставного хряща и формирование остеофитов, особенно в начале ОА.
Псориатический артрит является одним из типов воспалительного артрита, который возникает в подгруппе пациентов с псориазом. У этих пациентов кожная патология/симптомы сопровождаются опуханием суставов аналогично тому, которое наблюдается при ревматоидном артрите. Его признаками являются очаговые, поднятые над поверхностью, красные области воспаления кожи с образованием чешуек. Псориаз часто возникает на локтях и коленях, волосистой части головы, в области пупка и вокруг половых областей или ануса.
Термин «псориатический артрит» означает гетерогенную группу артритов, начиная от периферического моноартрикулярного, олигоартрикулярного и полиартрикулярного заболевания, и до вовлечения осевого скелета. Тем не менее, несмотря на эту очевидную клиническую гетерогенность, данные различные описания являются единообразными в их появлении у лиц с кожных проявлениями псориаза, серологической негативностью по ревматоидному фактору, похожей ассоциацией с человеческим лейкоцитарным антигеном (HLA) и рентгенологическими сходствами.
Примерно 2% европейского населения в Северной Америке страдает от псориаза. Из них 5-7% страдают от воспалительного артрита в иной форме. В целом, мужчины и женщины поражаются с одинаковой частотой, хотя фактическое соотношение мужчин и женщин может меняться в зависимости от рассматриваемой группы. Пик заболеваемости приходится на 4-6 десятилетия. Псориатическое поражение кожи предшествует началу артрита в 70% случаев, совпадает с артритом в 15% случаев и следует после начала артрита в 15% случаев.
Причина псориатического артрита неизвестна. Активность периферического сустава при псориатическом артрите параллельна активности кожных проявлений в 1/3 случаев, в то время как активность кожных проявлений и поражение осевого скелета, по-видимому, не согласуются. Генетические факторы, по-видимому, играют важную роль. Существует 70% конкордантность по псориазу у монозиготных близнецов. Существует 50-кратное увеличение риска развития псориатического артрита у первостепенных родственников пациента с этим заболеванием. Существует двукратное увеличение риска «передачи» заболевания от пораженного отца по сравнению с пораженной матерью. Есть эпидемиологические связи с экспрессией аллелей HLA класса 1 и класса II. Причастны экологические факторы. Стрептококковая инфекция может ускорить развитие каплевидного псориаза. ВИЧ-инфекция может проявляться как псориаз и псориатический артрит, а также ухудшать имеющееся заболевание. Сообщалось, что физическая травма ускоряет развитие артрита, подтверждая, что псориатический артрит является проявлением «глубокого феномена Кебнера». Воспалительный и аутоиммунный характер заболевания подтверждается не только клинической картиной, но и тем, какую роль Т-клетки и различные цитокины играют как в инициации, так и в поддержании активности заболевания.
Факторы, которые могут предвещать худший прогноз, включают широкое вовлечение кожи; серьезную историю псориаза в семье; женский пол; начало болезни в возрасте менее 20 лет; экспрессию аллелей HLA-B27, -DR3 или -DR4; и полиартрикулярное или эрозивное заболевание.
Остеопороз (ОР) является заболеванием костей, которое приводит к нарушению прочности костей и повышенному риску переломов (см., например, Theill et al. (2002) Annu Rev Immunol 20:795-23). При остеопорозе минеральная плотность костной ткани (bone mineral density, BMD) уменьшается, и микроархитектура кости постепенно ухудшается. В соответствии с определением Всемирной организации здравоохранения (ВОЗ) заболевание определяется минеральной плотностью костной ткани, которая снижена на 2,5 стандартных отклонения или более от средней пиковой массы кости (среднее для молодых здоровых взрослых). Заболевание может быть классифицировано как первичное 1 типа, первичное 2 типа или вторичное. Форма остеопороза, которая наиболее часто встречается у женщин после менопаузы, называется первичным остеопорозом 1 типа или постклимактерическим остеопорозом. Первичный остеопороз 2 типа (или старческий остеопороз) возникает в возрасте более 75 лет и наблюдается у женщин и мужчин в соотношении 2:1. Наконец, вторичный остеопороз может возникнуть в любом возрасте и поражает мужчин и женщин в равной степени. Эта форма остеопороза является результатом хронических предрасполагающих проблем со здоровьем или заболеваний, либо результатом длительного приема лекарств, таких как глюкокортикоиды. Резорбция кости является одним из основных патологических факторов постменопаузального остеопороза. Быстрая или относительно быстрая потеря костной массы/минеральной плотности кости часто возникает в результате повышения числа остеокластов или чрезмерной активности остеокластов (Walsh et al. (2005) Immunol Rev 208:228-251).
Риски развития остеопороза могут быть снижены с помощью изменения образа жизни (например, диеты, физических упражнений, предотвращения падений), а иногда и лекарств (например, кальция, витамина D, бисфосфонатов и некоторых других).
Термин «лечение», используемый в данном документе, относится к медицинскому лечению любого человека. Ожидается, что указанный субъект прошел физический осмотр у врача, который поставил предварительный или окончательный диагноз, в котором указано, что применение данного специфического лечения является полезным для здоровья указанного человека. Сроки и цель указанного лечения могут варьировать для разных людей в зависимости от состояния здоровья субъекта. Таким образом, указанные процедуры могут быть профилактическими, паллиативными, симптоматическими и/или лечебными.
С точки зрения данного изобретения профилактические, паллиативные, симптоматические и/или лечебные процедуры могут представлять отдельные аспекты изобретения.
В одном аспекте данное изобретение предусматривает композиции и составы, содержащие молекулы изобретения, такие как антитела, антигенсвязывающие фрагменты антител, полинуклеотиды, векторы и клетки, описанные в данном документе. Например, данное изобретение относится к фармацевтической композиции, которая содержит одно или более чем одно антитело или антигенсвязывающий фрагмент антител изобретения, собранный в состав вместе с фармацевтически приемлемым носителем.
Соответственно, одним из объектов данного изобретения является создание фармацевтического состава, содержащего такое антитело, которое присутствует в концентрации от 0,25 мг/мл до 250 мг/мл, и где указанная композиция имеет рН от 2,0 до 10,0. Состав также может содержать буферную систему, консервант(ы), изотонический агент(ы), хелатирующий агент(ы), стабилизаторы и/или поверхностно-активные вещества. Применение таких консервантов, изотонических агентов, хелатирующих агентов, стабилизаторов и поверхностно-активных веществ в фармацевтических композициях хорошо известно специалистам в данной области. Для удобства дана ссылка на Remington:
The Science and Practice of Pharmacy, 19th edition, 1995.
В одном воплощении фармацевтический состав является водным составом. Такой состав, как правило, является раствором или суспензией. Термин «водный состав» определяется как состав, содержащий по меньшей мере 50% (по весу) воды. Подобным же образом термин «водный раствор» определяется как раствор, содержащий по меньшей мере 50% (по весу) воды, а термин «водная суспензия» определяется как суспензия, содержащая по меньшей мере 50% (по весу) воды.
В другом воплощении фармацевтический состав является лиофилизированным составом, к которому врач или пациент добавляет растворители и/или разбавители перед применением.
В другом аспекте фармацевтический состав содержит водный раствор такого антитела и буфер, где антитело присутствует в концентрации от 1 мг/мл или выше, и где указанная композиция имеет рН от примерно 2,0 до примерно 10,0.
Антитело изобретения можно вводить парентерально, например, внутривенно, внутримышечно, подкожно. Альтернативно, антитело изобретения можно вводить непарентеральным путем, например, перорально или местно. Антитело изобретения можно вводить профилактически. Антитело изобретения можно вводить терапевтически (по требованию).
В контексте данного изобретения «селективная элиминация хрящевых деструктивных клеток» относится к процессу, в котором анти-NKG2A-антитело увеличивает опосредованную NK-клетками элиминацию хрящевых деструктивных клеток, таких как, например, фибробластоподобные синовиоциты (FLS) или другие хрящевые деструктивные клетки, не увеличивая при этом элиминацию нормальных фибробластов, таких как, например, фибробласты крайней плоти (FSK4-клетки) или другие нормальные фибробласты. Эта селективная элиминация может быть измерена, например, в стандартном анализе высвобождения LDH или в других известных подходящих анализах, в которых измеряется сила терапевтического соединения в устранении хрящевых деструктивных клеток (см. пример 4 и фиг.5В). В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 5%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 10%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 20%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 30%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 40%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 50%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 60%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 70%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 80%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 90%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 100% увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 125%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 150%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 175%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 200% увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 225%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 250%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей.мере 275%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 300% увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 350%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток. В одном воплощении анти-NKG2A-антитело вызывает по меньшей мере 400%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток или по меньшей мере 500%-ное увеличение специфической цитотоксичности хрящевых деструктивных клеток.
В контексте данного изобретения «снижает образование костных эрозийных клеток» относится к процессу, в котором анти-NKG2A-антитело снижает образование костных эрозийных клеток, таких как, например, остеокласты, многоядерные клетки TRAP+или другие костные эрозийные клетки.
Сниженное образование костных эрозийных клеток может быть измерено in vitro путем визуального подсчета прикрепленных костных эрозийных клеток (см. пример 6 и фиг.6С) или любого другого подходящего способа измерения сниженного образования костных эрозийных клеток. В одном воплощении анти-1ЧКС2А-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 5% или снижение числа костных эрозийных клеток по меньшей мере на 10%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 20% или снижение числа костных эрозийных клеток по меньшей мере на 30%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 40% или снижение числа костных эрозийных клеток по меньшей мере на 50%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 60% или снижение числа костных эрозийных клеток по меньшей мере на 70%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 80% или снижение числа костных эрозийных клеток по меньшей мере на 90%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 100% или снижение числа костных эрозийных клеток по меньшей мере на 125%. В одном воплощении анти-МК62А-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 150% или снижение числа костных эрозийных клеток по меньшей мере на 175%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 200% или снижение числа костных эрозийных клеток по меньшей мере на 225%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 250% или снижение числа костных эрозийных клеток по меньшей мере на 275%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 300% или снижение числа костных эрозийных клеток по меньшей мере на 350%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 400% или снижение числа костных эрозийных клеток по меньшей мере на 450%. В одном воплощении анти-NKG2A-антитело вызывает снижение числа костных эрозийных клеток по меньшей мере на 500%.
Кроме того «снижает образование костных эрозийных клеток» в контексте данного изобретения относится к сниженной костной минеральной эрозии in vitro.
Сниженная костная минеральная эрозия in vitro может быть оценена путем культивирования клеток или тканей на костных минеральных дисках (т.е. остеологических дисках) или с помощью других подходящих способов. (См. пример 6 и фиг.6D, 6Е, 6F и 6G). В одном воплощении анти-NKG2A вызывает 10%-ное снижение костной минеральной эрозии или 20%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 30%-ное снижение костной минеральной эрозии или 40%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 50%-ное снижение костной минеральной эрозии или 60%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 70%-ное снижение костной минеральной эрозии или 80%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 90%-ное снижение костной минеральной эрозии или 100%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 125%-ное снижение костной минеральной эрозии или 150%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 175%-ное снижение костной минеральной эрозии или 200%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 250%-ное снижение костной минеральной эрозии или 300%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 350%-ное снижение костной минеральной эрозии или 400%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 450%-ное снижение костной минеральной эрозии или 500%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 550%-ное снижение костной минеральной эрозии или 600%-ное снижение костной минеральной эрозии. В одном воплощении анти-NKG2A вызывает 650%-ное снижение костной минеральной эрозии или 700%-ное снижение костной минеральной эрозии.
Примеры
Пример 1. Молекулы клеточной поверхности, экспрессированные на фибробластоподобных синовиоцитах от пациентов с RA.
На фиг.1А прикрепленные RA-FLS, полученные из синовиальной ткани RA, были отделены с помощью 2 мМ EDTA и поверхностно окрашены на экспрессию маркера фибробластов CD55 (незаштрихованная гистограмма; правая панель) и маркера макрофагов CD68 (незаштрихованная гистограмма; левая панель). Гистограмма серого цвета представляет окрашивание с использованием изотипического контрольного антитела. Как видно на фиг.1А, RA-FLS показывают однородную экспрессию CD55 и отсутствие CD68, что подтверждает фибробластоподобное происхождение прикрепленных RA-FLS.
Как показано на фиг.1В, RA-FLS экспрессируют высокие уровни ULBP-1, ULBP-2 и ULBP3, низкие уровни MIC-A и отсутствие MIC-B, известных лигандов для активации NK-клеточного рецептора NKG2D. Кроме того, RA-FLS экспрессируют CD155 (полиовирусный рецептор PVR) и CD48, лиганды для DNAM-1 и 2 В4, соответственно. Мы не обнаружили никакой экспрессии CD112 (полиовирус-родственного рецептора 2, PRR2), другого лиганда, распознаваемого DNAM-1. Используя Fc-гибридные белки NKp30, NKp44 и NKp46, мы обнаружили относительно высокую экспрессию предполагаемого NKp44-лиганда на RA-FLS, в то время как NKp30-Fc и NKp46-Fc не метили эти клетки. Клетки анализировали с помощью проточной цитометрии. Заштрихованные гистограммы представляют релевантный изотипический контроль. Гистограммы представлены для n s 3 доноров.
Фиг.1C показывает, что связывание растворимого NKp44-Fc-гибридного белка с RA-FLS было специфичным и отменялось путем добавления возрастающих доз анти-NKp44-МКА. Прикрепленные RA-FLS отделяли с помощью 2 мМ EDTA, и поверхность окрашивали 10 мкг/мл NKp44-Рс-гибридным белком (незаштрихованная гистограмма) или таким же Fc-фрагментом (человеческий IgG1) в качестве отрицательного контроля (гистограмма серого цвета). Там, где указано, NKp44-Fc предварительно инкубировали с анти-NKp44- или анти-NKp46-МКА.
Как показано на фиг 1D, RA-FLS экспрессируют высокие уровни как HLA-E, так и HLA-G, лигандов для ингибиторных NK-клеточных рецепторов CD94-NKG2A и LIR-1, соответственно. Таким образом, HLA-E может быть важной молекулой, защищающей RA-FLS от опосредованной NK-клетками цитотоксичности в воспаленной синовиальной оболочке, так как большинство синовиальных NK-клеток экспрессируют ингибиторный рецептор CD94-NKG2A.
На фиг.1Е показано, что RA-FLS экспрессируют рецептор смерти 5 (DR5), но не DR4. Эти рецепторы преобразуют апоптотические сигналы при распознавании TRAIL (TNF-связанным апоптоз-индуцирующим лигандом). Таким образом, DR5 может быть важным лигандом, экспрессируемым на RA-FLS, который может быть распознан TRAIL-экспрессирующими клетками, которые потенциально могут опосредовать клеточную смерть RA-FLS в воспаленной синовиальной ткани.
Пример 2. МКС2А-экспрессирующие NK-клетки присутствуют в синовиальной оболочке RA и могут быть обнаружены в областях, содержащих RA-FLS, экспрессирующие HLA-E.
Фиг.2А, 2 и 2С показывают серийные срезы синовиальной ткани, полученные от пациента с RA, меченные мышиным анти-МКр46 (NK-клетки, фиг.2А), анти-NKG2A (фиг.2 В) и изотипическим контрольным антителом (фиг.2С). Иммунноспецифическую реактивность визуализировали с помощью диаминобензидина (темные пятна на микрофотографии), а ядра красили гематоксилином (слабые точки). Результаты показывают, что NKP46+ NK-клетки находятся в подлежащей области и несколько ближе к синовиальной выстилке синовиальной оболочки RA (см. фиг.2). Локализация и частота NK-клеток оказались очень похожими на таковые для NKG2A+-клеток (см. фиг.2В для сравнения). Срезы, окрашенные изотипическим контролем, выступали фоном (см. фиг.2С). При оценке путем количественного анализа цифровых изображений было обнаружено, что частота NKG2A+-клеток коррелирует (r2=0,950, р<0,0001) и соответствует числу NK-клеток, показанному на фиг.2D.
Экспрессию HLA-E, лиганда для CD94-NKG2A, на RA-FLS оценивали in situ (фиг.2Е-Н). Применение анти-HLA-Е-антитела 3D12 на срезах синовиальной ткани с RA показало окрашивание интимной выстилки, которая состоит из макрофагоподобных синовиоцитов (MLS) и RA-FLS, как показано на фиг.2Е. При использовании изотипического контроля окрашивание не наблюдается, как показано на фиг.2G. Кроме того, и инфильтрирующие иммунные клетки, показанные на фиг.2F, и сосудистые эндотелиальные клетки, показанные на фиг.2Н, экспрессировали HLA-E на относительно высоком уровне.
Вместе эти данные показывают, что NK-клетки могут быть идентифицированы среди популяции инфильтрирующих лимфоцитов в синовиальной оболочке больных RA, и подтверждают, что большинство, если не все NK-клетки экспрессируют NKG2A. Кроме того, субпопуляции NKG2A+ NK-клеток находятся в областях, близких к HLA-E+RA-FLS. Таким образом, потенциально это может означать, что NKG2A+NK-клетки распознают HLA-E на RA-FLS in situ.
Пример 3: NKG2D, DNAM-1, NKp44, NKp46 и TRAIL участвуют в NK-клеточной цитотоксичности по отношению к RA-FLS.
На фиг.3А показаны три различных типа NK-клеток, которые были окрашены на поверхностную экспрессию нескольких NK-клеточных рецепторов (незаштрихованные гистограммы), как указано ниже для каждой гистограммы, и окрашивание релевантным изотипическим контролем также показано на каждой панели (заштрихованная серая гистограмма). Фиг.3А (i) показывает NK-клетки, полученные из SFMC от репрезентативного пациента с RA, фиг.3А (ii) показывает оставшиеся CD56bright NK-клетки, полученные из РВМС от репрезентативного здорового донора, и фиг.3А (iii) показывает NK-клетки Nishi.
Клетки анализировали с помощью проточной цитометрии. NK-клетки определяли как жизнеспособные CD3-CD56bright. Данные показывают, что синовиальные NK-клетки, полученные от пациентов с RA, экспрессируют несколько активирующих рецепторов, и что они демонстрируют характер экспрессии активирующих рецепторов, аналогичный CD56bright NK-клеткам и NK-клеткам Nishi.
Фиг.3В. (i) иллюстрирует RA-FLS, которые высевали с плотностью 10000 клеток/лунку в 48-луночные планшеты и выращивали до конфлюзнтности (примерно 48000 клеток/лунку) в течение 72 часов, после чего добавляли Nishi в указанных соотношениях эффектор: мишень (Е:Т) (использовали дублирующие лунки). RA-FLS и Nishi совместно культивировали в течение ночи при 37°С, неприкрепленные клетки затем смывали, а прикрепленные клетки фиксировали 4% параформальдегидом и окрашивали эозином. Для получения изображений использовали ImmunoSpot Image Analyzer и количественно оценивали % хорошо покрытой области (как показано на фиг.3В. (ii)).
Данные в фиг.3В (i) и 3В (ii) показывают, что NK-клетки элиминируют прикрепленные к пластику RA-FLS дозозависимым образом in vitro.
На фиг.3С и фиг.3D (i) показаны RA-FLS, которые высевали с плотностью 30000 клеток/лунку в 96-луночные планшеты, и на следующий день добавляли 90000 Nishi/лунку. Nishi и FLS совместно культивировали в течение 5 часов при 37°С с BD GolgiStop, FITC-конъюгированными анти-CD107a/b-антителами и 10 мкг/мл блокирующих антител или релевантным изотипическим контролем, как указано. Для определения дегрануляции Nishi проводили проточную цитометрию. ns=не значимо, *Р<0,05, **Р<0,005, ***Р<0,001.
Фиг.3С показывает, что NK-клетки дегранулировали только в присутствии клеток-мишеней FLS и не дегранулировали при культивировании в одиночку. Фиг.3D показывает, что RA-FLS чувствительны к опосредованной NK-клетками цитотоксичности, и что NKG2D, DNAM1, NKp44, NKp46 и TRAIL вовлечены в специфическое распознавание RA-FLS NK-клетками, что указывается значительным снижением экспрессии CD107a/b при маскировке таких рецепторов.
Пример 4: RA-FLS защищены от опосредованной NK-клетками цитотоксичности путем экспрессии HLA-E. способных взаимодействовать с ингибиторными рецепторами CD94-NKG2A. экспрессированными NK-клетками
Фиг.4А показывает репрезентативные гистограммы с NK-кпетками из RA-SFMC в верхнем ряду, покоящимися CD56bright NK-клетками из здоровых РВМС в Среднем ряду и NK-клетками Nishi в нижнем ряду. Экспрессия NKG2A (левый столбец), LIR-1 (средний столбец) и KIR (правый столбец) показана (незаштрихованные гистограммы) в сравнении с соответствующим изотипическим контролем (серые заштрихованные гистограммы). NK-клетки окрашивали на поверхностную экспрессию с помощью анти-NKG2A, анти-LIR1 и смеси анти-KIR-MKA, а затем анализировали с помощью проточной цитометрии. NK-клетки гейтировали на жизнеспособные CD3-негативные CD56bright положительные клетки.
Данные показывают, что большинство NK-клеток синовиальной жидкости, подобно NK-клеткам Nishi и CD56bright РВ-NK-клеткам, экспрессируют NKG2A, но не имеют KIR. В отличие от NK-клеток синовиальной жидкости NK-клетки Nishi также экспрессируют LIR-1.
Фиг.4В иллюстрирует RA-FLS, которые высевали с плотностью 3×104 клеток/лунку в 96-луночные планшеты, на следующий день добавляли Nishi в соотношении Е:Т=3:1 (эксперименты анти-LIR-l, левая панель) или 6:1 (эксперименты анти-NKG2A, правая панель). Nishi и FLS совместно культивировали в течение 5 часов при 37°С с BD GolgiStop, FITC-конъюгированными анти-CD107a/b-антителами и 10 мкг/мл блокирующих антител или релевантным изотипическим контролем, как указано. Для определения дегрануляции Nishi проводили проточную цитометрию. ns = не значимо, **Р<0,005, как показано на фиг.4В.
Данные показывают, что маскировка NKG2A антителом приводит к значительному увеличению дегрануляции NK-клеток по отношению к RA-FLS (правая панель), в то время как маскировка LIR-1, по-видимому, не приводит к какому-либо увеличению лизиса RA-FLS (левая панель). Таким образом, тот факт, что обработка NK-клеток анти-NKG2A-антителом приводит к увеличению лизиса RA-FLS, показывает, что HLA-E молекулы, экспрессированные на RA-FLS, представляют соответствующие пептиды, важные для взаимодействия с CD94-NKG2A-ингибиторными рецепторами.
Фиг.4С показывает RA-FLS, которые высевали с плотностью 2,4×104 клеток/лунку в 96-луночные планшеты, на следующий день добавляли 6×103/лунку NK-клеток Nishi (т.е. в соотношении Е:Т=1:4). FLS и Nishi совместно культивировали в течение ночи при 37°С с добавлением анти-NKG2A или человеческого изотипического контроля IgG4. На следующий день неприкрепленные клетки смывали, а прикрепленные клетки фиксировали 4% параформальдегидом и окрашивали эозином. Лунки анализировали, и с помощью ImmunoSpot Image Analyzer количественно оценивали % хорошо покрытой области, как показано на фиг.4С. Таким образом, данные показывают, что маскировка NKG2A приводит к значительному увеличению элиминации прикрепленных RA-FLS.
RA-FLS высевали с плотностью 1,5×104 клеток/лунку в 96-луночных планшетах, на следующий день в каждую лунку добавляли 4,5×104 аутологичных SFMC (т.е. Е: Т=3:1). SFMC и RA-FLS совместно культивировали в течение 5 часов при 37°С с BD GolgiStop, FITC-конъюгированными анти-CD107a/b-антителами и 10 мкг/мл блокирующих антител или с человеческим изотипическим контролем IgG4, как показано на фиг.4D.
Таким образом, маскировка NKG2A моноклональным антителом приводит к значительному повышению элиминации аутологичных RA-FLS in vitro, подтверждая, что терапевтическое введение анти-NKG2A-МКА приведет к повышению элиминации RA-FLS in vivo.
Фиг.4Е показывает 3х104 FLS/лунку, которые высевали в 96-луночные планшеты. На следующий день аллогенные NK-клетки CD56brightCD16dim выделяли из крови здорового донора путем магнитной сепарации и немедленно совместно культивировали с RA-FLS (Е:Т=3:1) в течение 5 часов при 37°С с BD GolgiStop, FITC-конъюгированными анти-С0107а/b-антителами и 10 мкг/мл блокирующих антител, или релевантным изотипическим контролем. Для определения дегрануляции проводили проточную цитометрию. NK-клетки определяли как жизнеспособные CD3-CD16dimCD56bright. Нижний график показывает CD56bright NK-клетки от одного здорового донора, совместно культивированные с RA-FLS от пяти разных пациентов. *Р<0,05.
Таким образом, маскировка NKG2A моноклональным антителом на оставшихся свежевыделенных РВ-NK-клетках приводит к значительному повышению элиминации аллогенных RA-FLS in vitro, снова подтверждая, что терапевтическое введение анти-NKG2A-MKA приведет к повышению элиминации RA-FLS in vivo. Таким образом, агрессивное заболевание, распространяющее RA-FLS, которые могут мигрировать с кровотоком в другие суставы, может быть устранено путем циркуляции CD56bright РВ-NK-клеток при маскировке их CD94-NKG2A-ингибиторного рецептора.
Фиг.5А показывает анализ высвобождения LDH, который используется для оценки цитотоксичности FLS, опосредованной NK-клетками, с использованием двух различных NK-клеточных линий (NKL, слева; и Nishi, справа) в присутствии NNC141-0100 (HumZ270, черные столбцы), изотипического контроля (белые столбцы) или только среды (серые столбцы). Соотношение NK-клеток-эффекторов и мишеней составляло 1:1. Фиг.5 В показывает, что блокирование NKG2A с помощью NNC141-0100 (humZ270) приводит к увеличению лизиса репрезентативных RA-FLS (RA-FLS2, левая панель), но не влияет на элиминацию клеточной линии нормальных фибробластов крайней плоти (FSK4, правая панель). Таким образом, вместе данные, представленные на фиг.3, фиг.4 и фиг.5, ясно показывают, что анти-NKG2A-лечение приводит к повышенной элиминации RA-FLS, опосредованной NK-клетками, в то время как опосредованная NK-клетками элиминация клеточной линии нормальных фибробластов крайней плоти (FSK4) не изменяется в присутствии блокирующего антитела (т.е. HumZ270), направленного против NKG2A.
Пример 6: Лечение с помощью humZ270 (анти-NKG2A) ингибирует образование многоядерных остеокластов TRAP+
Фиг.6А показывает репрезентативный пример, в котором 106 SFMC/лунку, выделенных от больного с RA, культивировали в течение 7 дней в среде, дополненной 10 нг/мл IL-15. Культуры обрабатывали 20 мкг/мл человеческого изотипического контроля IgG4 (фиг.6А) или 20 мкг/мл humZ270 (фиг.6 В) в начале анализа. Следует понимать, что лечение анти-NKG2A на фиг.6 В приводит к значительной элиминации больших прикрепленных к пластику многоядерных клеток, которые экспрессируют TRAP (т.е. определяются как остеокласты).
Фиг.6С демонстрирует данные для SFMC, полученных от пациентов с RA, которые культивировали в течение 7 дней только в среде (п=6) или в среде, дополненной 10 нг/мл IL-15 (n=14). В начале анализа (определяемом как базальные данные) к культурам добавляли 20 мкг/мл человеческого изотипа IgG4 (белые и темно-серые столбцы) или 20 мкг/мл NNC141-0100 (humZ270, светлосерые и черные столбцы). Остеокласты количественно оценивали как число многоядерных ТРАР+-клеток/лунка. Таким образом, взятые вместе, фиг.6А, фиг.6В и фиг.6С показывают, что обработка культур SFMC in vitro антителом против NKG2A приводит к значительному уменьшению образования остеокластов, измеренному по образованию больших многоядерных ТРАР+-клеток (т.е. остеокластов). Таким образом, полученные данные свидетельствуют о том, что терапевтическое лечение пациентов с RA анти-NKG2A-МКА приведет к гашению эрозии кости, серьезного клинического признака RA.
На фиг.6D показан типичный пример минеральной эрозии кости, который наблюдается в культуре SFMC от пациента с RA №2357. Здесь SFMC растили на дисках, покрытых тонким слоем костной минеральной подложки (т.е. остеологических дисках) в присутствии IL-15 и изотипического МКА (слева) в сравнении с анти-NKG2A (humZ270, справа). Затем диски окрашивали по методике фон Косса, и с помощью ImmunoSpot S5 Analyzer анализировали эродированные области, которые проявлялись как светлые/белые области на темном фоне.
На фиг.6Е продемонстрированы данные, полученные в общей сложности от пяти пациентов с RA. SFMC культивировали в среде, дополненной 10 нг/мл IL-15. В начале анализа к культурам добавляли 20 мкг/мл человеческого изотипа IgG4 (белый столбец) или 20 мкг/мл NNC141-0100 (humZ270, черный столбец). С помощью ImmunoSpot S5 Analyzer количественно оценивали средний процент +/-SEM площади эродированных дисков. Взятые вместе, фиг.6D и фиг.6Е показывают, что обработка анти-NKG2A приводит к значительному снижению образования активных остеокластов, вызывающих костную минеральную эрозию. Таким образом, полученные данные свидетельствуют о том, что терапевтическое лечение пациентов с RA анти-NKG2A-МКА приведет к гашению эрозии кости, большого клинического признака RA.
Фиг.6F показывает, что HumZ270 (анти-NKG2A) подавляет эрозию кости в культурах эксплантов синовиальной ткани с RA, культивированных непосредственно ex vivo. Стружку синовиальной ткани с RA выращивали в течение 7 дней в среде IMDM, дополненной 10% FBS, 2% HuS, P/S, L-глутамином, без добавления МКА (контроль) или с добавлением изотипа, инфликсимаба (IFX) или анти-NKG2A (humZ270); все МКА добавляли в начале культивирования в концентрации 10 мкг/мл. Эксперимент проводили в трех повторах. На 7-й день среду и клетки удаляли путем трехкратного промывания лунок 200 мкл воды Milli-Q™. Затем диски промывали 200 мкл отбеливающего раствора (примерно 6% NaOCl, примерно 5,2% NaCl) в течение 5 минут, после чего осторожно пипетировали, чтобы удалить любые оставшиеся клетки. Наконец, диски промывали 3 раза водой Milli-Q™, сушили на воздухе и окрашивали по методике фон Косса. Из этого примера с тремя повторами культур можно понять, что обработка эксплантов синовиальной ткани с RA антителом humZ270 приводит к снижению эрозии (светлые/белые области) по сравнению с культурами, обработанными контролем или изотипом.
На фиг.6G проиллюстрированы рассчитанные результаты (среднее +/-SEM) от трех повторов культур стружки синовиальной ткани с RA, которые выращивали в течение 7 дней в среде IMDM, дополненной 10% FBS, 2% HuS, P/S, L-глутамином, без добавления МКА (контроль) или с добавлением изотипа, инфликсимаба (IFX) или анти-NKG2A (humZ270); все МКА добавляли в начале культивирования в концентрации 10 мкг/мл. На 7-й день среду и клетки удаляли путем трехкратного промывания лунок 200 мкл воды Milli-Q™. Затем диски промывали 200 мкл отбеливающего раствора (примерно 6% NaOCl, примерно 5,2% NaCl) в течение 5 минут, после чего осторожно пипетировали, чтобы удалить любые оставшиеся клетки. Наконец, диски промывали 3 раза водой Milli-Q™, сушили на воздухе и окрашивали методикой фон Косса. Обработка эксплантов синовиальной ткани с RA антителом humZ270 приводит к значительному снижению эрозии (р=0,005, t-критерий Стьюдента) по сравнению с культурами, обработанными контролем или изотипом. Таким образом, ткань RA, растущая непосредственно ex vivo на диске, покрытом костными минералами (т.е. на остеологическом диске), свидетельствует о значительной эрозивной способности, и такая активность резко ингибируется обработкой анти-NKG2A, четко подтверждая, что терапевтическое лечение пациентов с RA анти-NKG2A-антителом будет подавлять костную эрозию, большой клинический признак RA.
Пример 7: Модуляция уровней цитокинов в культурах SFMC in vitro при обработке HumZ270 (NNC141-0100)
На фиг.7А демонстрируется модуляция уровней цитокинов (среднее +/- SEM) в in vitro культурах SFMC, полученных от пациентов с RA (n=11). SFMC культивировали в течение 7 дней в среде, дополненной 10 нг/мл IL-15. Культуры обрабатывали 20 мкг/мл человеческого изотипа IgG4 (светло-серые столбцы) или 20 мкг/мл NNC141-0100 (humZ270, темно-серые столбцы) в начале анализа. Через 24 часа собирали супернатанты и измеряли уровни цитокинов с помощью BioPlex. Уровни IL-6 значительно снижались при обработке анти-NKG2A, в то время как продукция других цитокинов существенно не изменялась, за исключением небольшого повышения уровня M-CSF через 24 часа.
Фиг.7 В показывает парное сравнение уровней IL-6, измеренных в in vitro культурах RA-SFMC, стимулированных IL-15 и обработанных изотипом против HumZ270 (анти-NKG2A). Уровни IL-6 значительно снижались при маскировке NKG2A во всех культурах SFMC in vitro.
На фиг.7С показано, что NNC141-0100 (humZ270) ингибирует и базальную, и IL-15-стимулированную продукцию IL-6 в in vitro культурах SFMC, полученных от пациентов с RA. Уровни IL-6, производимого SFMC, полученными от двух пациентов с RA, были измерены в культурах, созданных только в среде или в среде, дополненной 10 нг/мл IL-15, как указано. Культуры обрабатывали 20 мкг/мл человеческого изотипа IgG4 (черные столбцы) или 20 мкг/мл NNC141-0100 (humZ270, белые столбцы) в начале анализа. Супернатант собирали через 24, 48 и 72 часа и измеряли уровни IL-6 с помощью BioPlex. Взятые вместе, фиг.7А, 7 В и 7С показывают, что анти-NKG2A подавляет как базальный, так и стимулированный уровни IL-6 в in vitro культурах SFMC. IL-6 является важным провоспалительным цитокином, вовлеченным в патогенез RA. Потенциально снижение IL-6 играет определенную роль в наблюдаемом уменьшении образования остеокластов.
Пример 8: NKG2A и/или его лиганд HLA-E экспрессируются в воспаленной синовиальной оболочке от пациентов с RA. остеоартритом ЮА) и псориатическим артритом (PsA)
NK-клетки, присутствующие в синовиальной ткани RA, экспрессируют ингибиторный рецептор NKG2A и локализованы преимущественно в лимфоидных агрегатах, прилегающих к синовиоцитам, которые экспрессируют HLA-E, лиганд для CD94-NKG2A. Это показано на фиг.8, где приведены репрезентативные изображения синовиальной ткани с RA от двух из 15 доноров (ID 1144-09: А, С, Е, G, I и ID 1591-08: В, D, F, H, J). Серийные срезы синовиальной оболочки с RA окрашивали на NK-клетки анти-NKp46-антителом (фиг.8А и 8 В), на NKG2A Z199-антителом (фиг.8С и 8D), на HLA-E 3D12-антителом (фиг.8Е и 8F) и на Т-клетки анти-CDS-антителом (фиг.8G и 8Н). Окрашивание не наблюдалось при использовании изотипического контрольного антитела IgG2b (Фиг.81 и 8J). Иммунноспецифическую реактивность визуализировали с помощью диаминобензидина (DAB), а ядра окрашивали гематоксилином (столбцы=100 мкм). Короткие стрелки указывают на лимфоидные агрегаты в подлежащей ткани с субпопуляциями клеток, экспрессирующих NKp46, NKG2A, HLA-E и CD3. Длинные стрелки указывают на синовиоциты HLA-E+ в гиперплазированном синовиальном подлежащем слое, прилегающем к лимфоидным агрегатам с NK-клетками. Звездочки указывают на сосудистые эндотелиальные клетки HLA-E+.
Фотографии большого увеличения NK-клеток NKp46+ (фиг.8K) и NKG2A+-клеток (фиг.8L) в серийных срезах синовиальной оболочки RA от третьего донора (ID 1595-08) показаны подчеркнуть, что локализация и частота NK-клеток были очень похожи на таковые для NKG2A+-клеток. Цифровой анализ изображений использовали для соотнесения числа NKG2A+-клеток в синовиальной оболочке от 15 пациентов с RA с числом NKp46+NK-клеток (фиг.8М). Результаты выражены как число клеток на мм2 и показывают, что частота NKG2A+-клеток сильно коррелирует с (r2=0,950, р<0,0001) и соответствует численно NK-клеткам. NKG2A+-клетки присутствовали в синовиальной оболочке у 13 из 15 пациентов с RA.
Вместе эти данные показывают, что NK-клетки могут быть выявлены среди популяции инфильтрирующих лимфоцитов в синовиальной оболочке пациентов с RA, и подтверждают, что большинство, если не все NK-клетки экспрессируют NKG2A. Лиганд для CD94-NKG2A, HLA-E, экспрессируется многими инфильтрирующими иммунными клетками, эндотелиальными клетками сосудов и синовиоцитами (макрофагоподбными синовиоцитами (MLS) и RA-FLS). Субпопуляции NKG2A+ NK-клеток находятся в областях, близких к синовиоцитам HLA-E+. Таким образом, потенциально это может означать, что NKG2A+ NK-клетки распознают HLA-E на RA-FLS in situ. Кроме того, инфильтрирующие иммунные клетки HLA-E+ и эндотелий сосудов также могут быть распознаны NKG2A+ NK-клетками.
NKG2A и его лиганд, HLA-E, экспрессированы в синовиальной оболочке пациентов с остеоартритом (ОА). Это показано на фиг.9, которая изображает NKG2A+-клетки (антитело Z199) среди инфильтрирующих лимфоцитов (фиг.9А) и экспрессию HLA-E (антитело 3D12) инфильтрирующими иммунными клетками, эндотелиальными клетками и синовиоцитами (Фиг.9В). NKG2A+-клетки присутствовали в синовиальной оболочке 6 из 9 пациентов с ОА. В отличие от пациентов с RA частота NKG2 A+-клеток, по-видимому, не коррелирует с частотой NK-клеток в синовиальной оболочке при ОА, когда количественная оценка с помощью цифрового анализа изображения (r2=0.136, р=0.3295; фиг.9С) показала, что некоторые из NK-клеток, которые инфильтрируют синовиальную оболочку при ОА, могут не экспрессировать NKG2A.
Вместе эти данные показывают экспрессию NKG2A и HLA-E в субпопуляциях синовиальных клеток при ОА, аналогичную таковой в синовиальной оболочке при RA. Таким образом, NKG2A+ NK-клетки могут распознавать HLA-E+ синовиоциты, эндотелий сосудов и инфильтрирующие иммунные клетки в воспаленной синовиальной оболочке пациентов с ОА.
Было установлено, что лиганд для CD94-NKG2A, HLA-E, экспрессируется в воспаленной синовиальной оболочке не только у пациентов с RA и ОА, но также у пациентов с псориатическим артритом (PsA). Это показано на фиг.10, которая изображает окрашивание образцов синовиальной ткани от пациентов с RA, ОА и PsA (как указано) анти-HLA-А-Е-антителом mAb MEM-E/02. В синовиальной оболочке нормальных контролей экспрессия HLA-E наблюдается в эндотелии сосудов и, более слабо, в субпопуляциях синовиоцитов, расположенных в синовиальной подложке, как показано на фиг.10.
Эти данные показывают экспрессию HLA-E синовиоцитами, сосудистым эндотелием и инфильтрирующими иммунными клетками в воспаленной синовиальной оболочке пациентов с PsA, и это означает, что NKG2A+-клетки могут распознавать такие субпопуляции HLA-Е+-клеток у этих пациентов.
Хотя некоторые детали изобретения были проиллюстрированы и описаны в данном документе, многие модификации, замещения, изменения и эквиваленты будут приходить на ум специалистами в данной области. Таким образом, следует понимать, что прилагаемые воплощения предназначены для охвата всех таких модификаций и изменений, которые попадают в рамки истинной сущности изобретения.
Воплощения:
1. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент для лечения деструкции хряща и/или эрозии кости.
2. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 1 для лечения заболевания или нарушения, когда уменьшение деструкции хряща и/или эрозии кости является выгодным для пациента.
3. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 1 или 2, где указанное анти-NKG2A-антитело стимулирует селективную элиминацию хрящевых деструктивных клеток и/или снижает образование костных эрозийных клеток.
4. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где селективная элиминация хрящевых деструктивных клеток и/или уменьшение костных эрозийных клеток является выгодным для пациента.
5. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где хрящевыми деструктивными клетками являются фибробластоподобные синовиоциты (FLS).
6. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент по любому из воплощений 1-5, где костными эрозийными клетками являются остеокласты.
7. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 6, где костными эрозийными остеокластами являются многоядерные ТРАР+-клетки.
8. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений для лечения заболевания или нарушения, которое характеризуется деструкцией хряща и/или эрозией кости.
9. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 8, где заболевание или нарушение представляет собой остеоартрит.
10. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 8, где заболевание или нарушение представляет собой остеопороз.
11. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 8, где заболевание или нарушение представляет собой псориатический артрит.
12. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 8, где заболевание или нарушение представляет собой ревматоидный артрит.
13. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело представляет собой антигенсвязывающий фрагмент.
14. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 13, где фрагмент антитела выбран среди Fab, Fab', F(ab)2, F(ab')2, F(ab)3, Fv, одноцепочечного Fv, dsFv, Fd-фрагмента, dAb-фрагмента, миниантитела, двух-, трех-, четырехвалентного антитела, каппа-антитела, верблюжьего IgG; IgNAR; и фрагмента мультиспецифического антитела.
15. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело представляет собой Fab-фрагмент.
16. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело представляет собой биспецифическое антитело.
17. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело конъюгировано с группировкой, увеличивающей время полужизни.
18. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанная группировка, увеличивающая время полужизни, содержит одну или более чем одну группировку, увеличивающую время полужизни, выбранную из списка, включающего: жирные кислоты и их производные, гидроксиэтилкрахмал (HES), полиэтиленгликоль (PEG), гиалуроновую кислоту (НА), полимеры гепарозана (НЕР), полимеры на основе фосфорилхолина (РС-полимер), флексимеры, декстран, полисиаловые кислоты (PSA), Fc-домен, трансферрин, альбумин, эластинподобные пептиды, XTEN-полимеры, альбуминсвязывающие пептиды и любые их комбинации.
19. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 18, где антитело может быть конъюгировано с двумя или более различными типами группировок, увеличивающих время полужизни.
20. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело содержит мутированный Fc-домен, где указанные мутации приводят к снижению функций Fcγ-рецепторного связывания.
21. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 20, где указанный Fc-домен включает одну или более чем одну из следующих мутаций: L234A, L235E, и G237A, А330 и P331S (в соответствии со схемой нумерации по Кабату).
22. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело содержит Fc-домен IgG4.
23. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 22, где указанный Fc-домен IgG4 содержит мутацию S241P/S228P.
24. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело представляет собой полноразмерное антитело IgG4 или его фрагмент.
25. Анти-NKGA-антитело или его антигенсвязывающий фрагмент в соответствии с любым из предыдущих воплощений, где указанное антитело является гуманизированным или человеческим антителом.
26. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 25, где указанное антитело представляет собой DumZ270 или humZ199.
27. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 25 или 26, где указанное антитело представляет собой humZ270.
28. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-27, где тяжелая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков с 31 по 35 (SYWMN) из SEQ ID №2, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
CDR2-последовательность аминокислотных остатков 50-59 (RIDPYDSETH) из SEQ ID №2, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
CDR3-последовательность аминокислотных остатков 95-102 (YCARGGYD) из SEQ ID №2, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами.
29. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-28, где легкая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков 24-34 (RASENIYSYLA) из SEQ ID №3, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами; и/или
CDR2-последовательность аминокислотных остатков 50-56 (NAKTLAE) из SEQ ID №3, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотами; и/или
CDR3-последовательность аминокислотных остатков 89-97 (QHHYGTPRT) из SEQ ID №3, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами.
30. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-29, где тяжелая цепь указанного антитела содержит:
CDR1 -последовательность аминокислотных остатков с 31 по 35 (SYWMN) из SEQ ID №2; и/или
CDR2-последовательность аминокислот 50-59 (RIDPYDSETH) из SEQ ID №2; и/или
CDR3-последовательность аминокислот 95-102 (YCARGGYD) из SEQ ID №2.
31. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-30, где легкая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков 24-34 (RASENIYSYLA) из SEQ ID №3; и/или
CDR2-последовательность аминокислотных остатков 50-56 (NAKTLAE) из SEQ ID №3; и/или
CRD3-последовательность аминокислотных остатков 89-97 (QHHYGTPRT) из SEQ ID №3.
32. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-31, где тяжелая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков с 31 по 35 (SYWMN) из SEQ ID №2; и/или
CDR2-последовательность аминокислот 50-59 (RIDPYDSETH) из SEQ ID №2; и/или
CRD3-последовательность аминокислот 95-102 (YCARGGYD) из SEQ ID №2;
и где легкая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков 24-34 (RASENIYSYLA) из SEQ ID №3; и/или
CDR2-последовательность аминокислотных остатков 50-56 (NAKTLAE) из SEQ ID №3; и/или
CRD3-последовательность аминокислотных остатков 89-97 (QHHYGTPRT) из SEQ ID №3.
33. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-32, где тяжелая цепь указанного антитела содержит SEQ ID №2, а легкая цепь указанного антитела содержит SEQ ID №3.
34. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 1-24, который конкурирует с антителом по любому из воплощений 25-33 за связывание с NKG2A.
35. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с воплощением 25 или 26, где указанное антитело представляет собой humZ199.
36. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или воплощением 35, где тяжелая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков с 31 по 35 (SYAMS) из SEQ ID №4, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
CDR2-последовательность аминокислот 50-65 (EISSGGSYTYYADSVK) из SEQ ID №4, где один, два, три или четыре из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
CDR3-последовательность аминокислот 99-108 (HGDYPRFFDV) из SEQ ID №4, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами.
37. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или 35-36, где легкая цепь указанного антитела содержит:
DCDR1-последовательность аминокислотных остатков 24-34 (SASSSVSSYIY) из SEQ ID №5, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами, и/или
DCDR2-последовательность аминокислотных остатков 50-56 (LTSNLAS) из SEQ ID №5, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотами, и/или
DCDR3-последовательность аминокислотных остатков 89-97 (QQWSGNPYT) из SEQ ID №5, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотами.
38. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или 35-37, где тяжелая цепь указанного антитела содержит:
DCDR1-последовательность аминокислотных остатков с 31 по 35 (SYAMS) из SEQ ID №4, и/или
CDR2-последовательность аминокислот 50-65 (EISSGGSYTYYADSVK) из SEQ ID №4, и/или
CDR3-последовательность аминокислот -108 (HGDYPRFFDV) из SEQ ID №4.
39. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или 35-38, где легкая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков 24-34 (SASSSVSSYIY) из SEQ ID №5; и/или
CDR2-последовательность аминокислотных остатков 50-56 (LTSNLAS) из SEQ ID №5; и/или
CDR3-последовательность аминокислотных остатков -97 (QQWSGNPYT) из SEQ ID №5.
40. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или 35-39, где тяжелая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков с 31 по 35 (SYWMN) из SEQ ID №2; и/или
CDR2-последовательность аминокислот 50-59 (RIDPYDSETH) из SEQ ID №2; и/или
CDR3-последовательность аминокислот 95-102 (YCARGGYD) из SEQ ID №2;
и где легкая цепь указанного антитела содержит:
CDR1-последовательность аминокислотных остатков 24-34 (RASENIYSYLA) из SEQ ID №3; и/или
CDR2-последовательность аминокислотных остатков 50-56 (NAKTLAE) из SEQ ID №3; и/или
CDR3-последовательность аминокислотных остатков 89-97 (QHHYGTPRT) из SEQ ID №3.
41. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 25-26 или 35-40, где тяжелая цепь указанного антитела содержит SEQ ID №4, а легкая цепь указанного антитела содержит SEQ ID №5.
42. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 1-25, который конкурирует с антителом по любому из воплощений 35-41 за связывание с NKG2A.
43. Применение анти-NKG2A-антитела по любому из воплощений 1-7 или 13-42 для лечения деструкции хряща и/или эрозии кости.
44. Применение анти-NKG2A-антитела по воплощению 43 для лечения заболевания или нарушения, которое характеризуется деструкцией хряща и/или эрозией кости.
45. Применение анти-NKG2A-антитела по воплощению 44, где заболевание или нарушение представляет собой остеоартрит.
46. Применение анти-NKG2A-антитела по воплощению 44, где заболевание или нарушение представляет собой остеопороз.
47. Применение анти-NKG2A-антитела по воплощению 44, где заболевание или нарушение представляет собой псориатический артрит.
48. Применение анти-NKG2A-антитела по воплощению 44, где заболевание или нарушение представляет собой ревматоидный артрит.
49. Способ лечения заболевания или нарушения, характеризующегося деструкцией хряща и/или эрозией кости, который включает введение пациенту анти-NKG2A-антитела по любому из предыдущих воплощений.
50. Способ лечения заболевания или нарушения, характеризующегося деструкцией хряща, который включает введение пациенту анти-NKG2A-антитела по любому из воплощений 1-49.
51. Способ лечения заболевания или нарушения, характеризующегося эрозией кости, который включает введение пациенту анти-NKG2A-антитела по любому из воплощений 1-49.
52. Способ лечения заболевания или нарушения, характеризующегося деструкцией хряща и эрозией кости, который включает введение пациенту анти-NKG2A-антитела по любому из воплощений 1-49.
53. Анти-NKG2A-антитело или его антигенсвязывающий фрагмент в соответствии с любым из воплощений 1-49 для применения в качестве лекарственного средства.
54. Фармацевтический состав анти-NKG2A-антитела или его антигенсвязывающего фрагмента, содержащий антитело в соответствии с любым из воплощений 1-49.
55. Применение анти-NKG2A-антитела или его антигенсвязывающего фрагмента в соответствии с любым из воплощений 1-49 для изготовления лекарственного средства.
Все ссылки, включая публикации, патентные заявки и патенты, приведенные в данном документе, настоящим включены путем ссылки в той же степени, как если бы каждая ссылка была отдельно и конкретно указана, и должны быть включены путем ссылки и изложены целиком в данном документе.
Все заголовки и подзаголовки используются в данном документе только для удобства и не должны быть истолкованы как ограничивающие изобретение ни в каком случае.
Данным изобретением охватывается любая комбинация описанных выше элементов во всех возможных вариантах, если это явно не противоречит контексту, или в документе прямо не утверждается иное.
Если иное не указано или явно противоречит контексту, Термин «или» в данном документе используется в смысле, включающем «и/или», и, соответственно, косвенно предусматривает воплощение или аспект, в котором этот термин следует интерпретировать в смысле, включающем «либо то, либо это».
Все термины и подобные объекты, которые используются в контексте описания изобретения, должны быть истолкованы как охватывающие и единственное, и множественное число, если это явно не противоречит контексту, или в документе прямо не утверждается иное.
Указание диапазонов значений в данном документе предназначено только в качестве краткого способа отсылки индивидуально для каждого отдельного значения, находящегося в пределах диапазона, если не указано иное, и каждое отдельное значение включено в описание, как если бы оно было индивидуально приведено в данном документе. Если не утверждается иное, то все точные значения, предложенные в документе, представлены соответствующими приближенными значениями (например, все точные типичные значения, предложенные по отношению к конкретному фактору или измерению, могут быть рассмотрены также как соответствующие приблизительные оценки, скорректированные добавлением «примерно» в случае необходимости).
Все описанные в данном документе способы могут быть выполнены в любом подходящем порядке, если это явно не противоречит контексту, или в документе прямо не утверждается иное.
Любые использованные или все примеры или обороты (например «такой как»), содержащиеся в данном документе, предназначены только для лучшего освещения изобретения и не ставят ограничений в сфере применения изобретения, если не утверждается иное. Никакие обороты в описании не должны толковаться как указывающие на то, что какой-либо элемент, не включенный в формулу изобретения, является необходимым для осуществления изобретения.
Цитирование и вставление в данный документ патентных документов делается только для удобства и не отражает какой-либо связи с обоснованностью, патентоспособностью и/или законной силой этих патентных документов.
Описание здесь любого аспекта или воплощения изобретения, использующее такие термины, как «содержащий», «имеющий» или «включающий» со ссылкой на элемент или элементы, предназначено для обоснования аналогичного аспекта или воплощения изобретения, который «состоит из», «состоит в основном из» или «по существу содержит» конкретный элемент или элементы, если это явно не противоречит контексту или не утверждается иное (например, композицию, описанную здесь как содержащую конкретный элемент, следует понимать также как описанную композицию, состоящую из этого элемента, если это явно не противоречит контексту или не утверждается иное).
Данное изобретение включает в себя все модификации и эквиваленты объектов изобретения, включенных в аспекты или формулу изобретения, представленную в данном документе, в соответствии с разрешением действующего законодательства.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К NKG2A И ИХ ПРИМЕНЕНИЯ | 2007 |
|
RU2499001C2 |
| ЛЕЧЕНИЕ РАКОВЫХ ЗАБОЛЕВАНИЙ С ПРИМЕНЕНИЕМ АНТИ-NKG2A СРЕДСТВ | 2015 |
|
RU2721271C2 |
| НЕЙТРАЛИЗАЦИЯ ИНГИБИТОРНЫХ ПУТЕЙ В ЛИМФОЦИТАХ | 2015 |
|
RU2734771C2 |
| НЕЙТРАЛИЗАЦИЯ ИНГИБИТОРНЫХ ПУТЕЙ В ЛИМФОЦИТАХ | 2017 |
|
RU2769569C2 |
| ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА К CD33 | 2015 |
|
RU2747384C2 |
| СВЯЗЫВАЮЩИЕ KIR3DL2 АГЕНТЫ | 2013 |
|
RU2682449C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2694412C2 |
| НЕЙРОЭНДОКРИННЫЕ ФАКТОРЫ ДЛЯ ЛЕЧЕНИЯ ДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2496790C2 |
| RA АНТИГЕННЫЕ ПЕПТИДЫ | 2004 |
|
RU2359974C2 |




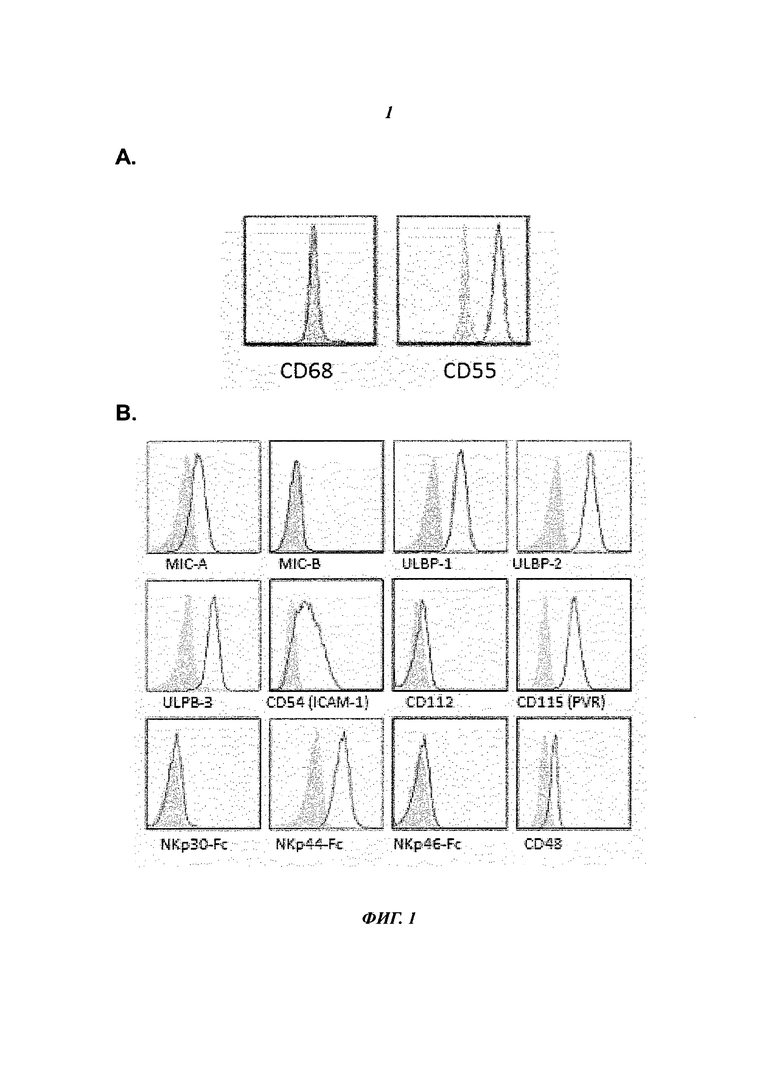
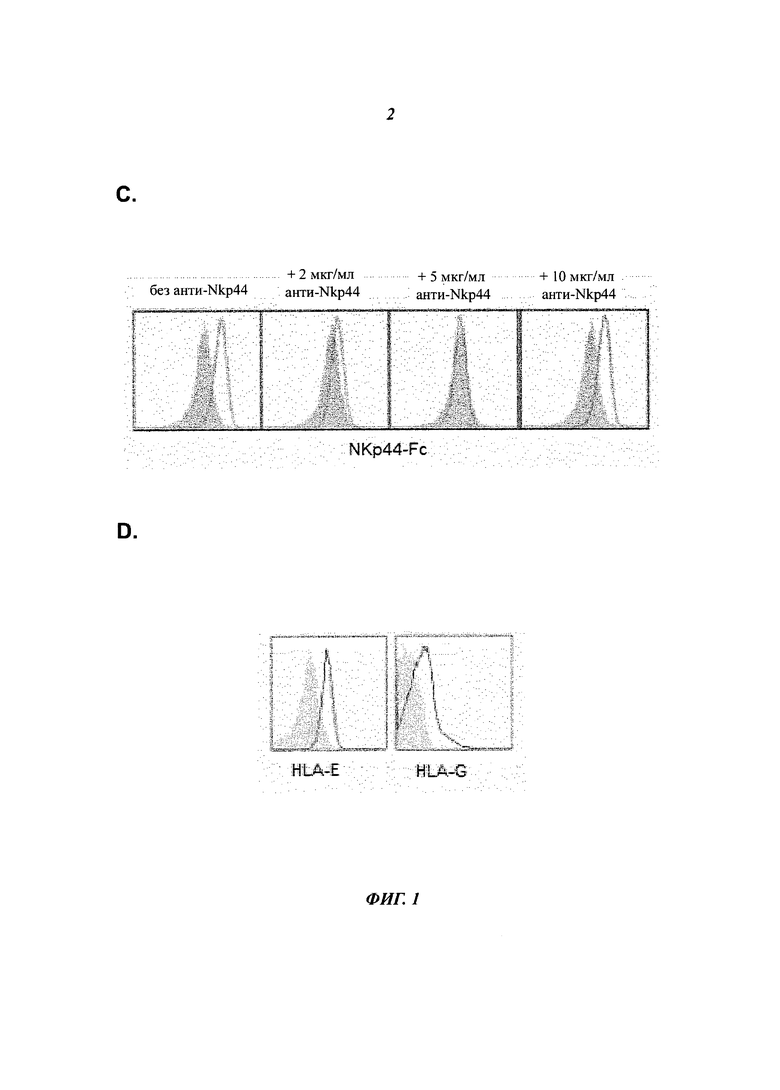

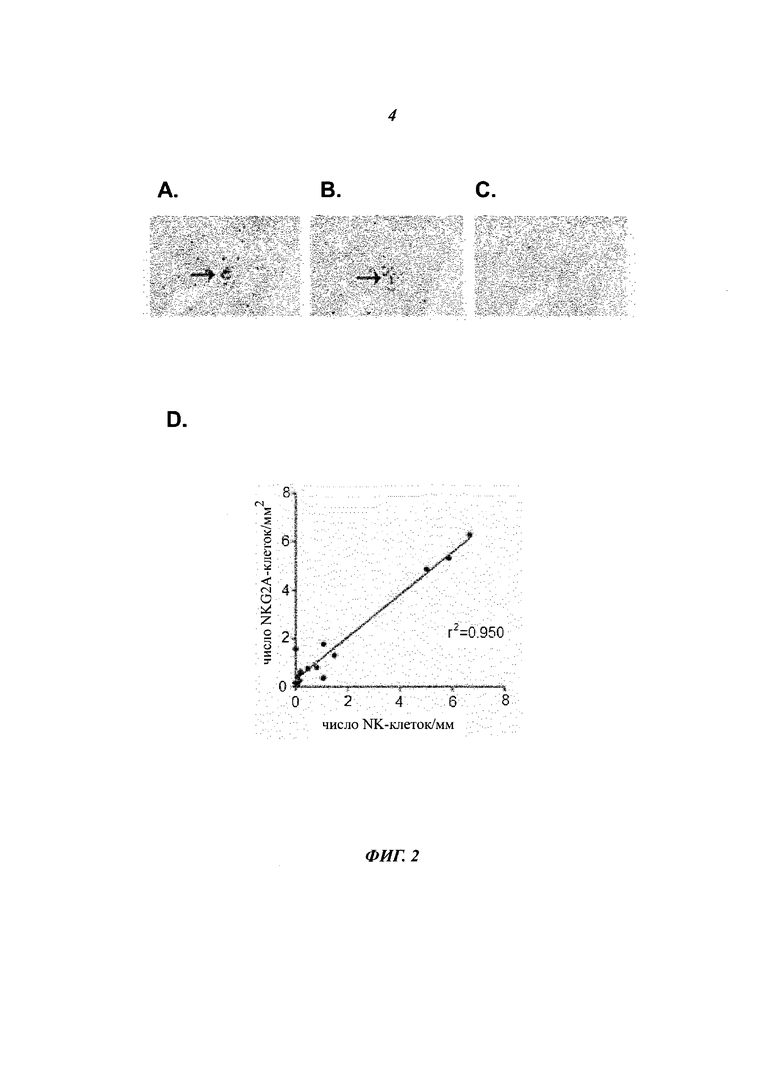
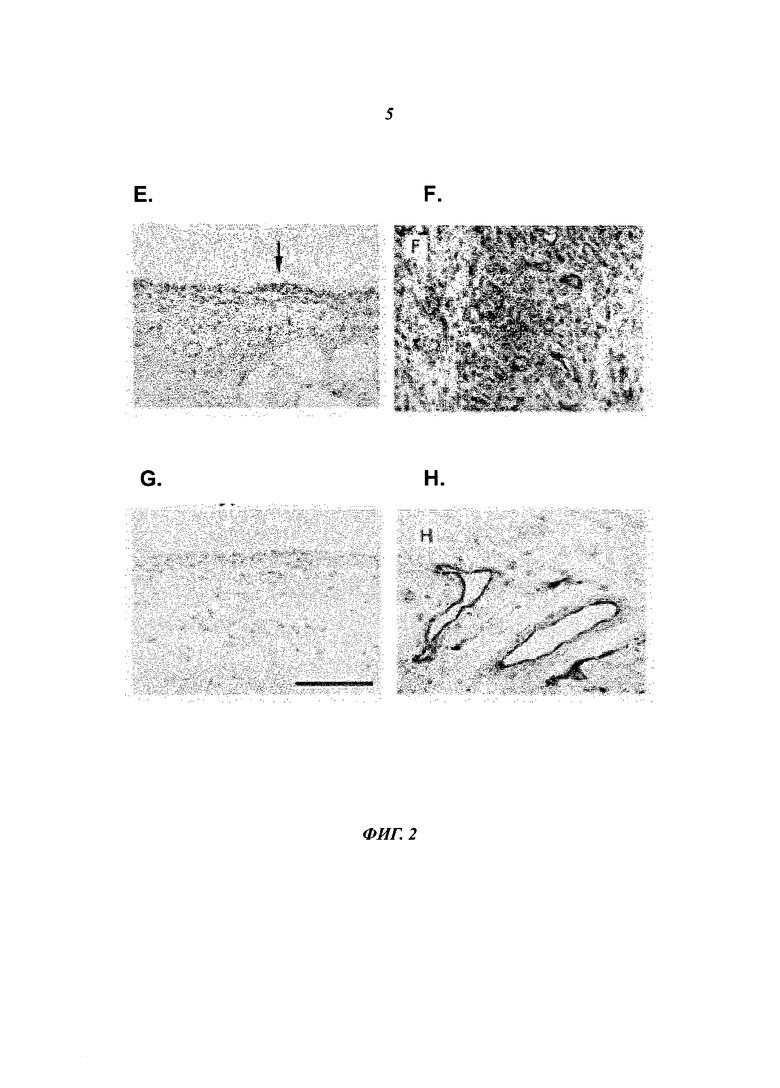
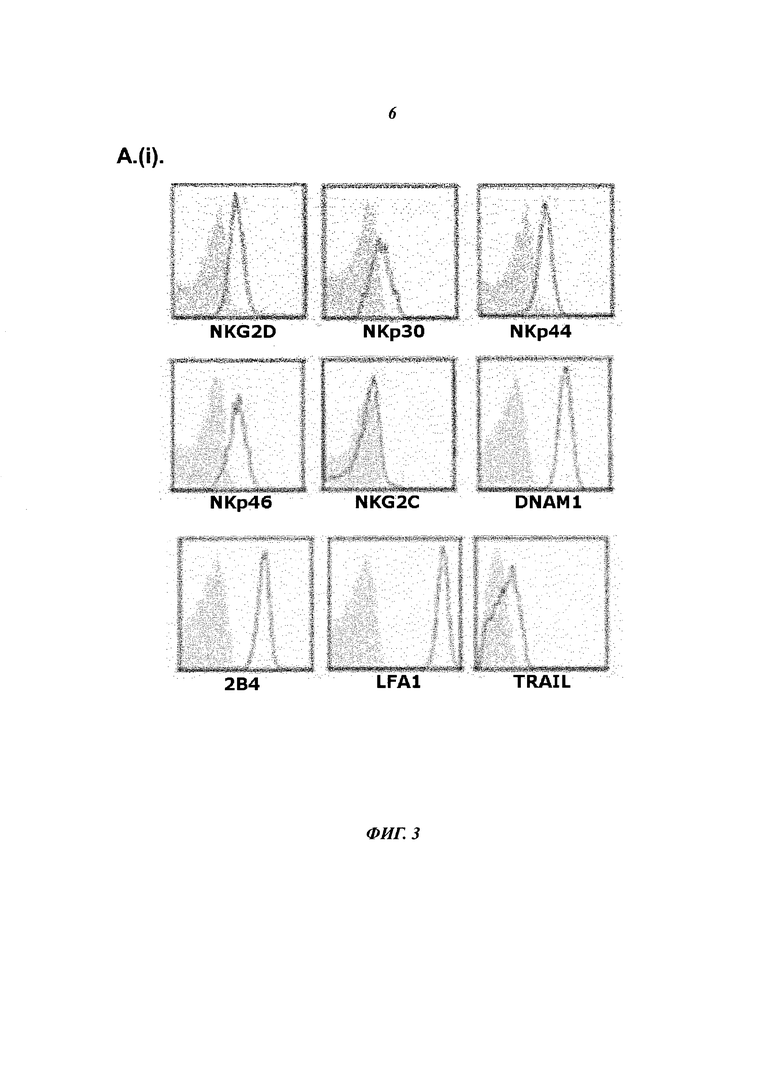


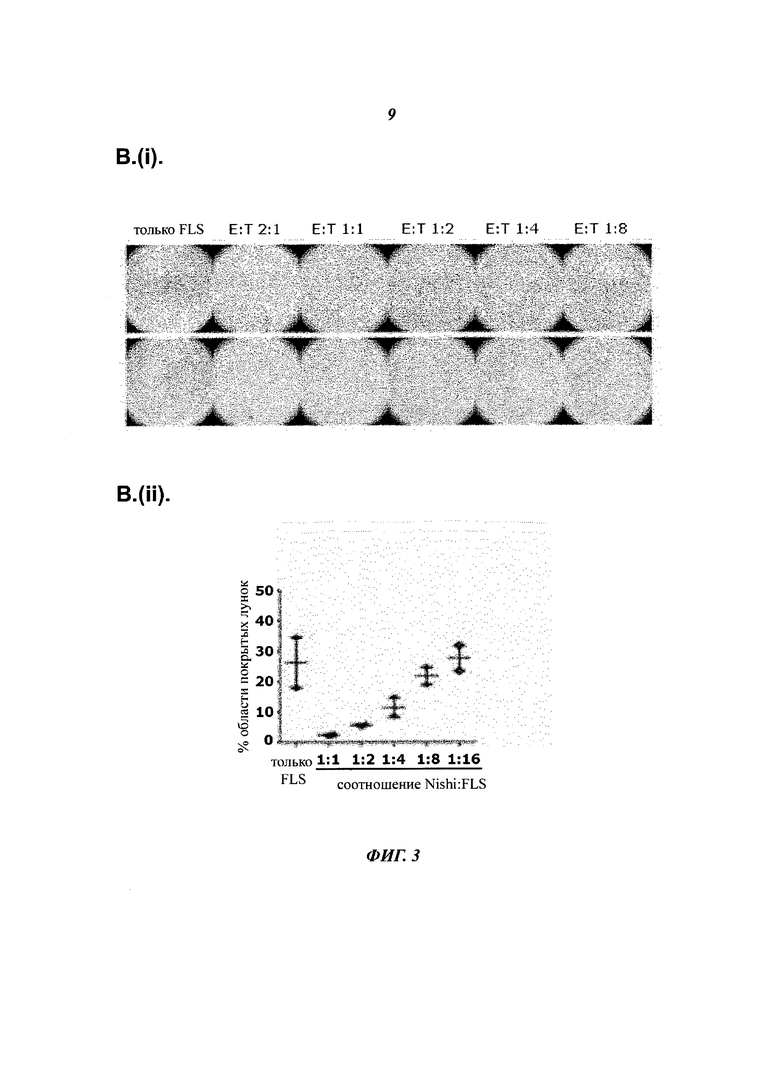
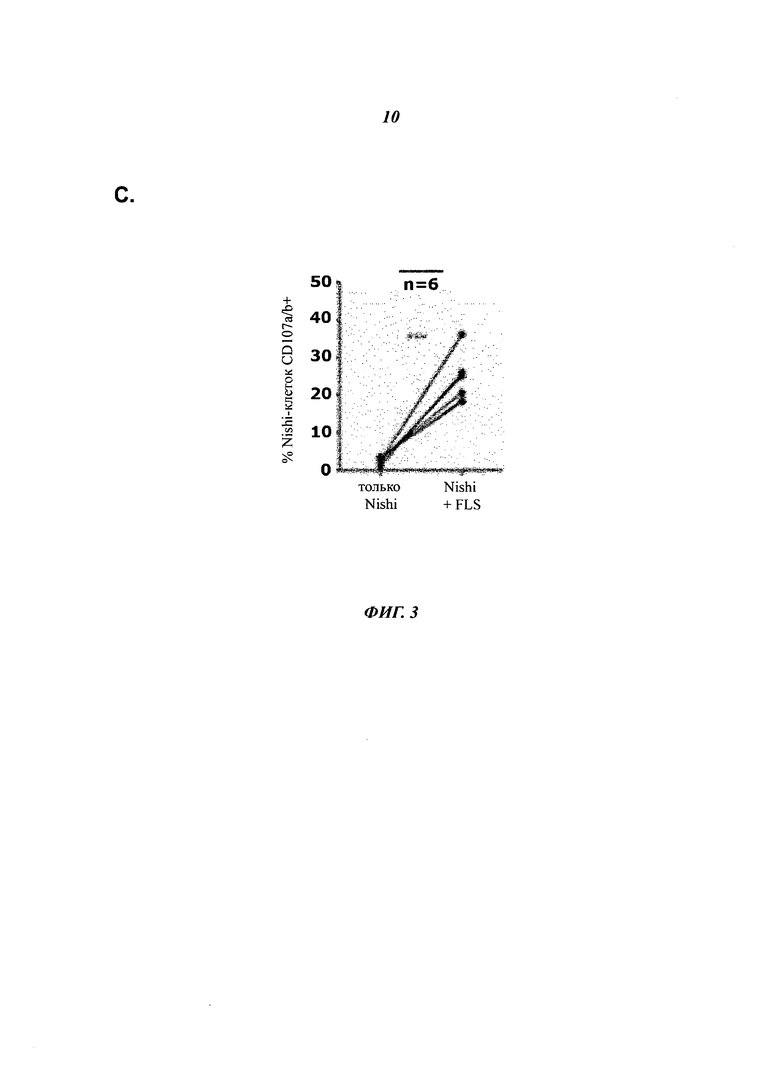




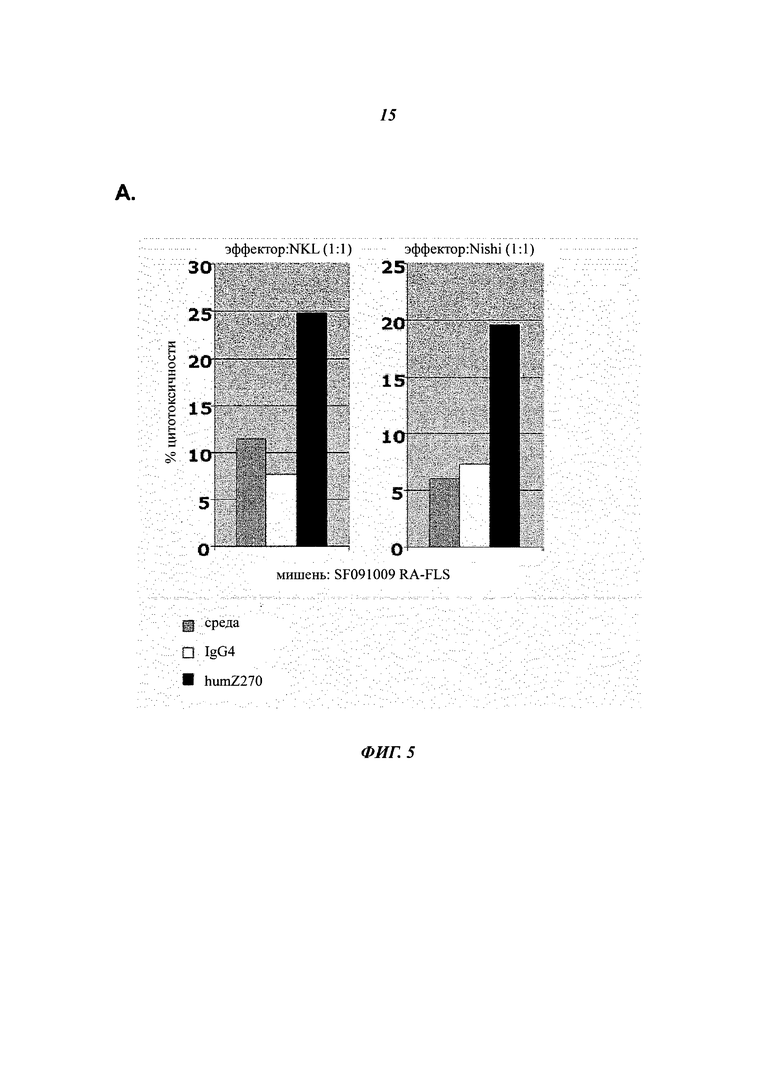

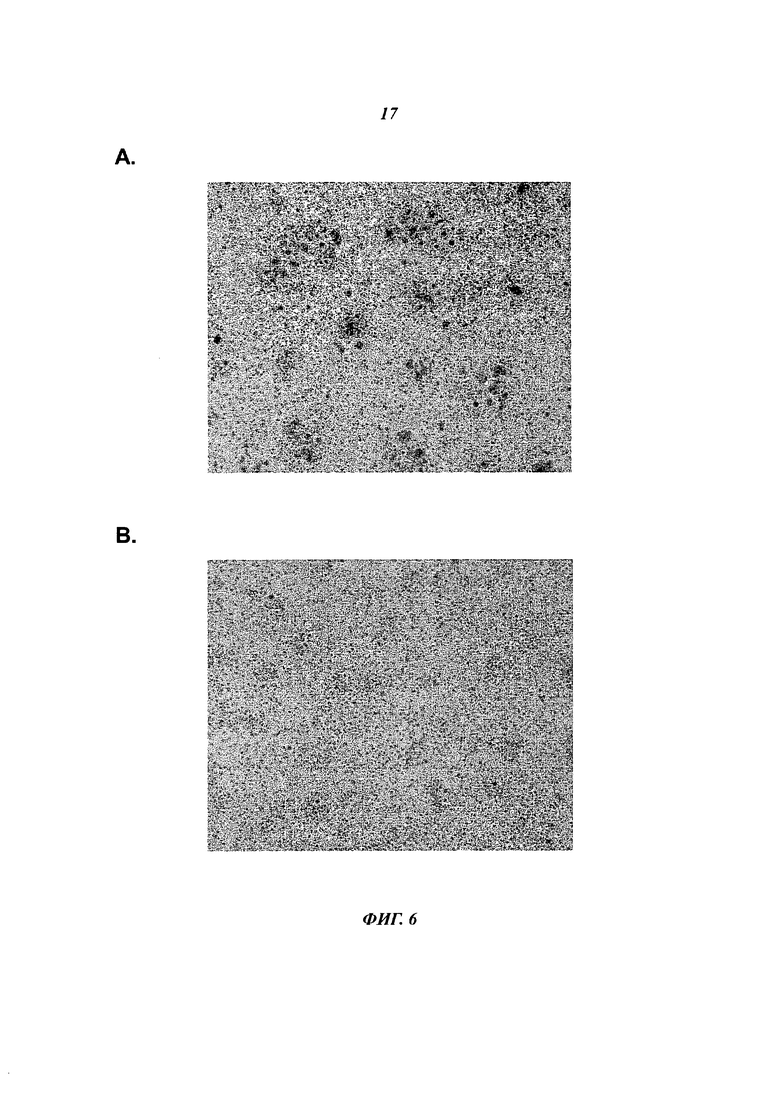
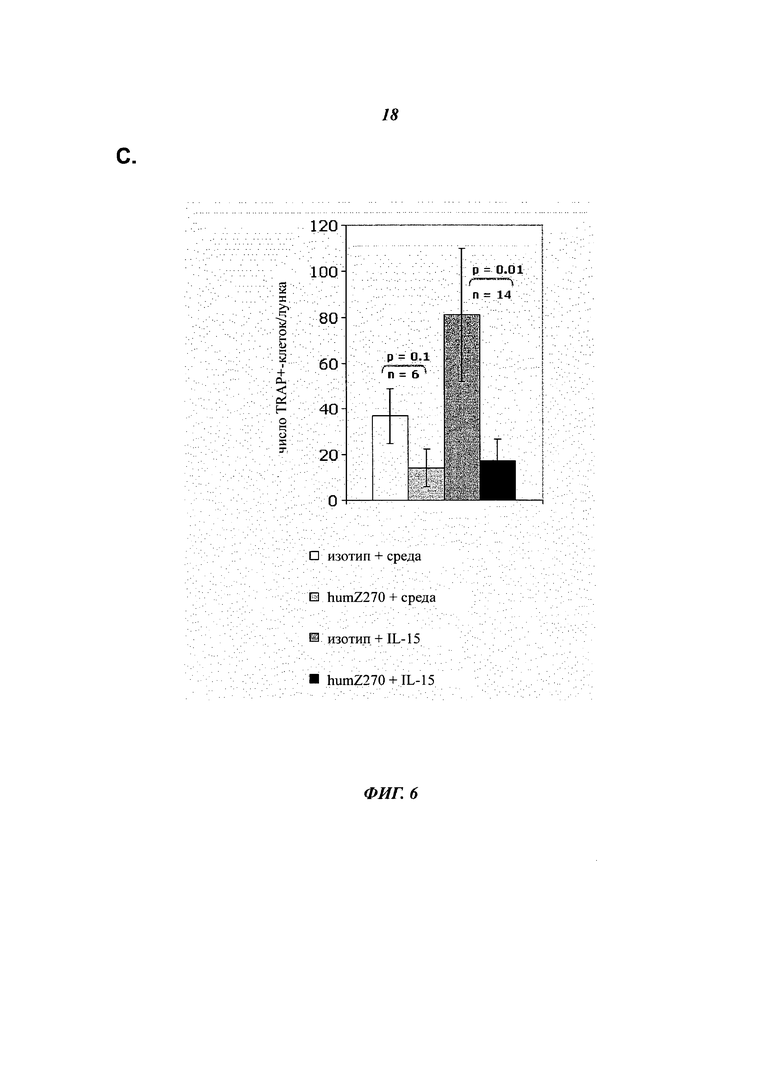
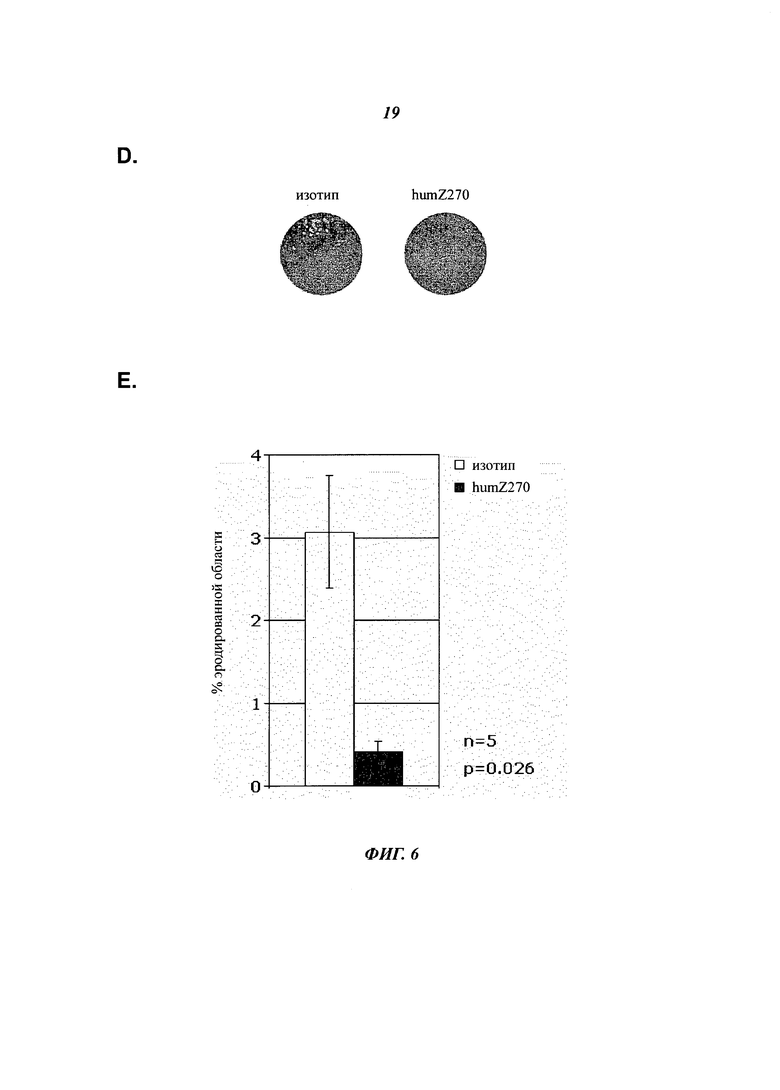

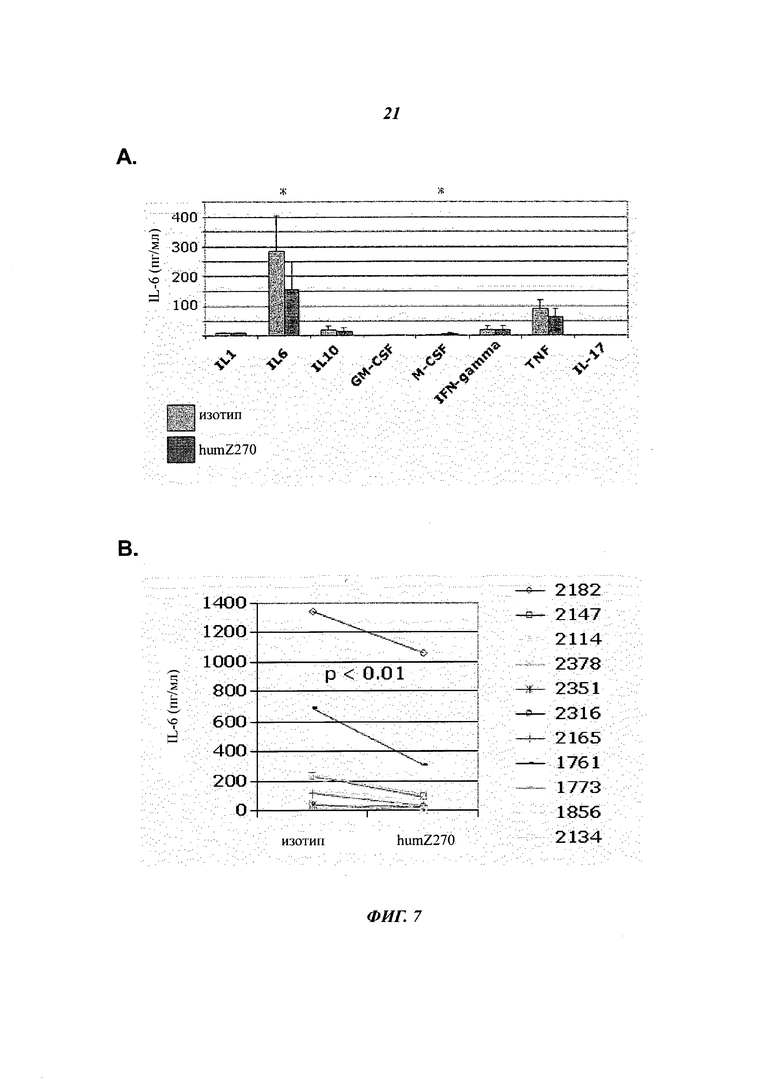
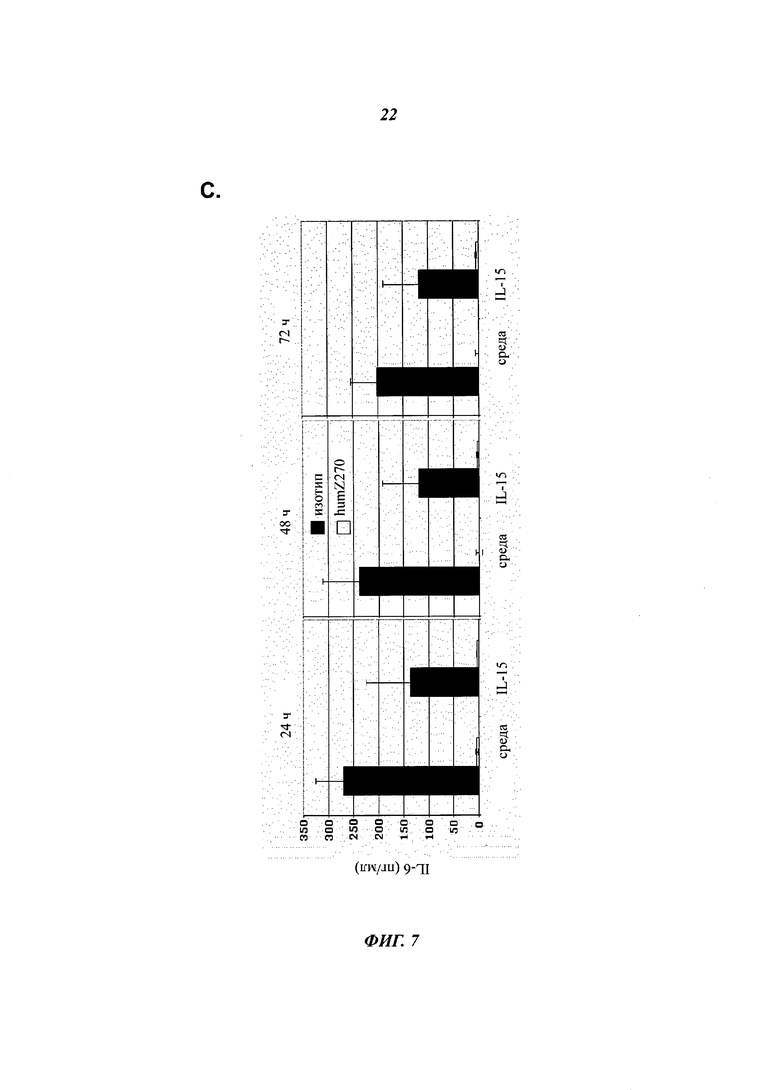



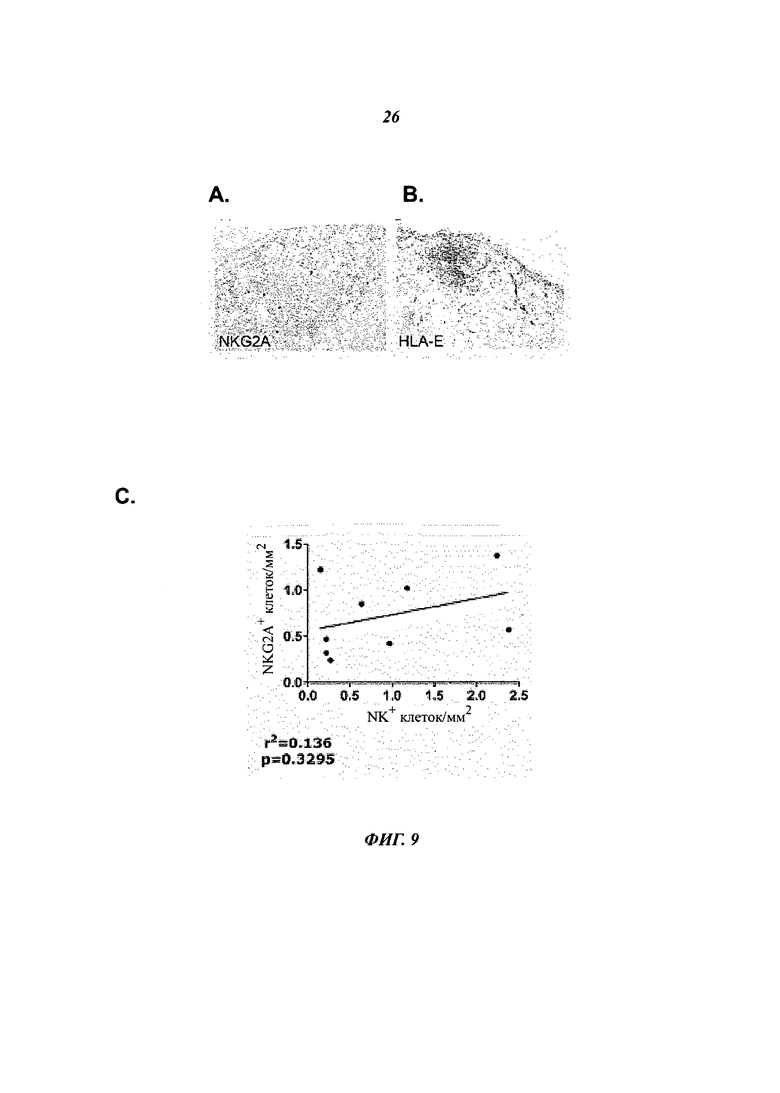



Группа изобретений относится к медицине, а именно к ревматологии, и может быть использована при лечении заболеваний, характеризующихся деструкцией хряща и/или эрозией кости. Для лечения указанных состояний применяют анти-NKG2A-антитело или его антигенсвязывающий фрагмент. Использование изобретений позволяет остановить эрозию кости и/или деструкцию хряща, опосредованные остеокластами и фибробластоподобными синовиоцитами, за счет лизиса последних специфическими NK-клетками синовиальной оболочки, экспрессирующими NKG2A, индуцированных анти-NKG2A-антителами. 2 н. и 13 з.п. ф-лы, 25 ил., 8 пр.
1. Применение анти-NKG2A-антитела или его антигенсвязывающего фрагмента для лечения деструкции хряща и(или) эрозии кости.
2. Применение по п.1, где указанное анти-NKG2A-антитело стимулирует селективную элиминацию хрящевых деструктивных клеток и(или) снижает образование костных эрозийных клеток.
3. Применение по п.1, где хрящевые деструктивные клетки являются фибробластоподобными синовиоцитами (FLS).
4. Применение по п.1, где костные эрозийные клетки являются остеокластами.
5. Применение анти-NKG2A-антитела или его антигенсвязывающего фрагмента для лечения заболевания или нарушения, которое характеризуется деструкцией хряща и(или) эрозией кости.
6. Применение по п.5, где заболевание или нарушение представляет собой остеоартрит.
7. Применение по п.5, где заболевание или нарушение представляет собой остеопороз.
8. Применение по п.5, где заболевание или нарушение представляет собой псориатический артрит.
9. Применение по п.5, где заболевание или нарушение представляет собой ревматоидный артрит.
10. Применение по п.1 или 5, где указанное антитело является гуманизированным или человеческим антителом.
11. Применение по п.10, где указанное антитело представляет собой humZ270 или humZ199.
12. Применение по п.1 или 5, где тяжелая цепь указанного антитела содержит:
- CDR1-последовательность аминокислотных остатков с 31 по 35 (SYWMN) из SEQ ID №2, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR2-последовательность аминокислот 50-59 (RIDPYDSETH) из SEQ ID №2, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR3-последовательность аминокислот 95-102 по системе Kabat из SEQ ID №2, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками;
и где легкая цепь указанного антитела содержит:
- CDR1-последовательность аминокислотных остатков 24-34 (RASENIYSYLA) из SEQ ID №3, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR2-последовательность аминокислотных остатков 50-56 (NAKTLAE) из SEQ ID №3, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR3-последовательность аминокислотных остатков 89-97 (QHHYGTPRT) из SEQ ID №3, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками.
13. Применение по п.1 или 5, где тяжелая цепь указанного антитела содержит:
- CDR1-последовательность аминокислотных остатков с 31 по 35 (SYAMS) из SEQ ID №4, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR2-последовательность аминокислот 50-65 (EISSGGSYTYYADSVK) из SEQ ID №4, где один, два, три или четыре из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR3-последовательность аминокислот 99-108 (HGDYPRFFDV) от SEQ ID №4, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками;
и где легкая цепь указанного антитела содержит:
- CDR1-последовательность аминокислотных остатков 24-34 (SASSSVSSYIY) из SEQ ID №5, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR2-последовательность аминокислотных остатков 50-56 (LTSNLAS) из SEQ ID №5, где один или два из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками; и/или
- CDR3-последовательность из аминокислотных остатков 89-97 (QQWSGNPYT) из SEQ ID №5, где один, два или три из этих аминокислотных остатков могут быть замещены другими аминокислотными остатками.
14. Применение по п.1 или 5, где указанное антитело конкурирует с антителом по п.12 и/или антителом по п.13.
15. Применение по п.1 или 5, где указанное антитело представлено в форме фармацевтического препарата.
| WO 2008009545 A1, 24.01.2008 | |||
| WO 2006070286 A2, 06.07.2006 | |||
| ZWERINA J et al | |||
| Single and combined inhibition of tumor necrosis factor, interleukin-1, and RANKL pathways in tumor necrosis factor-induced arthritis: effects on synovial inflammation, bone erosion, and cartilage destruction// Arthritis Rheum | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| он лайн, найдено в Интернет на (http://onlinelibrary.wiley.com/doi/10.1002/art.11487/pdf) 10.05.2016. | |||
Авторы
Даты
2017-04-19—Публикация
2012-06-18—Подача