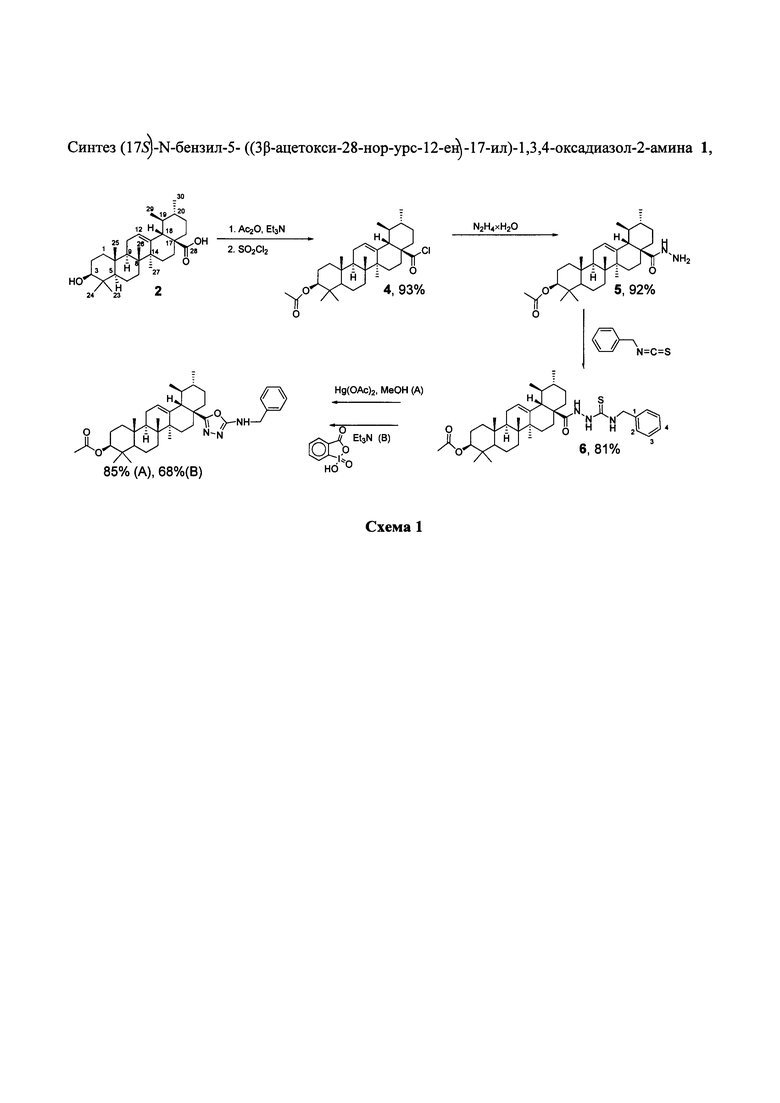
Изобретение относится к новому химическому соединению, конкретно (17S)-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен)-17-ил)-1,3,4-оксадиазол-2-амину 1,
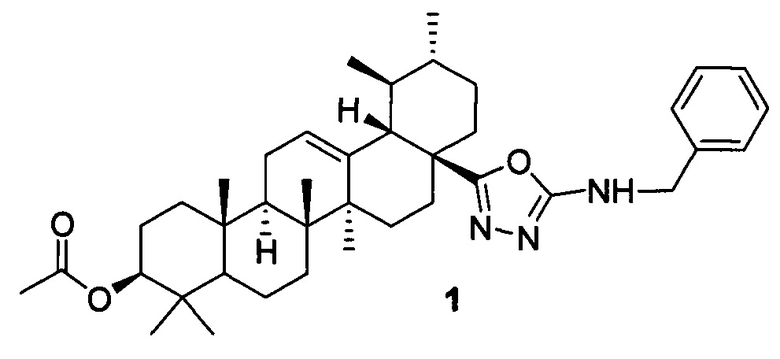
обладающему селективной цитотоксической активностью в отношении клеток рака молочной железы MCF-7. Указанное свойство определяет возможность использования соединения в медицине в качестве фармацевтического препарата при терапии рака молочной железы.
Широкая распространенность онкологических заболеваний молочной железы, а также несовершенство известных средств химиотерапии, заключающееся либо в их недостаточной эффективности, либо в существовании негативных побочных эффектов при их применении, стали стимулом использования природных соединений для создания новых цитотоксичных веществ, эффективных в отношении опухолевых клеток и малотоксичных для неопухолевых человеческих клеток.
Доступное и малотоксичное природное соединение урсоловая кислота 2 (УК) привлекает большое внимание своей многофункциональной противораковой активностью [М.K. Shanmugam, X. Dai, А.Р. Kumar, В.K. Tan, G. Sethi, A. Bishayee, Ursolic acid in cancer prevention and treatment: molecular targets, pharmacokinetics and clinical studies, Biochem. Pharmacol. 85 (2013) 1579-1587].
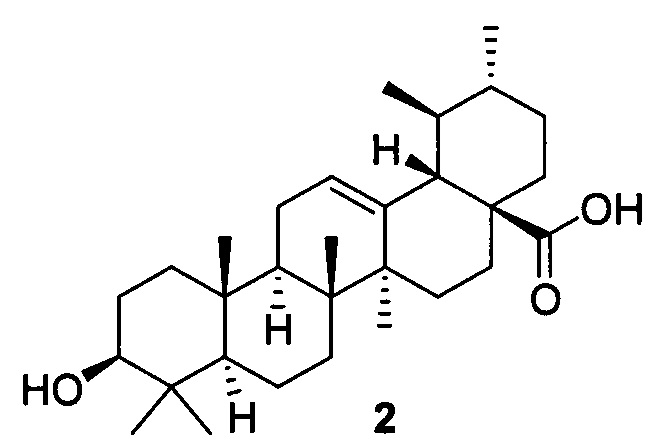
УК также используется в профилактике онкологических заболеваний в виде пищевых функциональных добавок [Z. Ovesna, A. Vachalkova, K. Horvathova, D. Tothova, Pentacyclic triterpenoic acids: new chemoprotective compounds. Minireview, Neoplasma 51 (2004) 327-333]. Противоопухолевый эффект УК объясняется ее способностью индуцировать апоптоз раковых клеток, предотвращать онкогенез и ингибировать пролиферацию раковых клеток. УК вызывает аутофагию, остановку клеточного цикла и апоптоз в различных раковых клеточных линиях воздействием через ряд сигнальных путей [М.K. Shanmugam, X. Dai, А.Р. Kumar, В.K. Tan, G. Sethi, A. Bishayee, Ursolic acid in cancer prevention and treatment: molecular targets, pharmacokinetics and clinical studies, Biochem. Pharmacol. 85 (2013) 1579-1587.], включая NF-kB [S. Shishodia, S. Majumdar, S. Banerjee, B.B. Aggarwal, Ursolic acid inhibits nuclear factor-kappaB activation induced by carcinogenic agents through suppression of I kappaB alpha kinase and p-65 phosphorylation: correlation with down-regulation of cyclooxygenase 2, matrix metalloproteinase 9, and cyclin D1, Cancer Res. 63 (2003) 4375-4383.], STAT3 [W. Wang, C. Zhao, D. Jou, J. Lu, C. Zhang, L. Lin, J. Lin, Ursolic acid inhibits the growth of colon cancer-initiating cells by targeting STAT3, Anticancer Res. 33 (2013) 4279-4284.] и TRAIL [S. Prasad, V.R. Yadav, R. Kannappan, B.B. Aggarwal, Ursolic acid, a pentacyclin triterpene, potentiates TRAIL-induced apoptosis through p53-independent up-regulation of death receptors: evidence for the role of reactive oxygen species and JNK, J. Biol. Chem. 286 (2011) 5546-5557.] Недостатком урсоловой кислоты является ее относительно низкая активность в отношении ряда опухолевых клеток, в частности рака молочной железы.
Известно широкое применение в терапии опухолей полусинтетических цитотоксических препаратов, таких как доксорубицин.
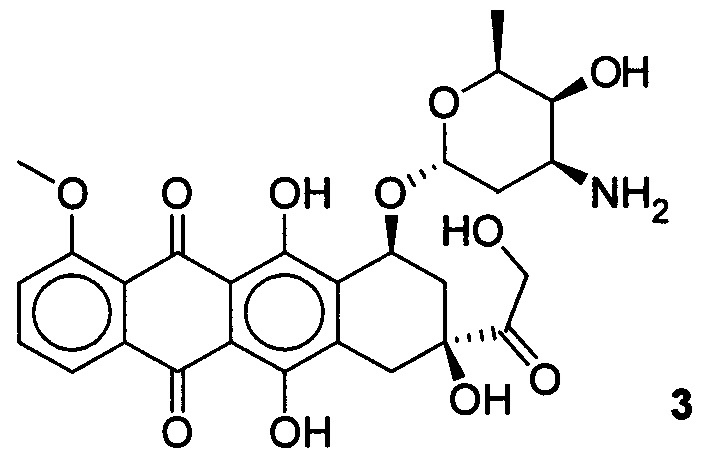
Доксорубицин ((8S-цис)-10-(3-амино-2,3,6-тридезокси-альфа-L-ликсогексо-пиранозил)окси-7,8,9,10-тетра-гидро-6,8,11-тригидрокси-8-(гидроксилацетил)-1-метокси-5,12-нафтацендион) является противоопухолевым антибиотиком антрациклинового ряда. Оказывает антимитотическое и цитотоксическое действие. Обладает способностью к блокированию матричной активности ДНК [Машковский М.Д. Лекарственные средства. - М.: Медицина, 1993 с. 534-535]. Доксорубицин применяется в терапии ряда онкологических заболеваний, таких как лимфобластный лейкоз, саркома мягких тканей, остеогенная саркома, саркома Юинга, рак молочной железы, рак щитовидной железы, опухоль Вильмса, нейробластома, рак мочевого пузыря, рак желудка, рак яичников и др. Доксорубицин обладает рядом побочных эффектов, основным недостатком его применения является низкая селективность в отношении здоровых клеток, что может приводить к токсическим эффектам при его терапевтическом использовании. Задачей настоящего изобретения, является разработка новых эффективных и селективных цитотоксических агентов в отношении опухолевых клеток молочной железы, на основе доступного растительного метаболита урсоловой кислоты.
Поставленная задача решается новым химическим соединением (17S-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен-17-ил)-1,3,4-оксадиазол-2-амином 1, обладающим селективной цитотоксической активностью в отношении клеток рака молочной железы. Указанное соединение является малотоксичным для здоровых клеток человека.
В качестве исходного вещества использована урсоловая кислота 2, выделяемая из доступного сырья - отходов пищевой промышленности: шротов ягод, в частности, черноплодной рябины [Л.П. Козлова, Е.В. Малыхин, С.М. Обут, С.А. Попов, О.П. Шеремет Способ получения урсоловой кислоты Заявка 2006138543/15, приоритет от 31.10.2006, Патент RU 2329048, Бюл. №20, 20.07.2008.].
Синтез нового соединения 1 осуществляли по схеме 1. Последовательной обработкой урсоловой кислоты 2 ацетангидридом в присутствии триэтиламина и хлористым тионилом получают хлорангидрид 4 [C.W. Lee, N.H. Park, J.W. Kim, B.H. Um, A.V. Shpatov, E.E. Shults, I.V. Sorokina, S.A. Popov Study of skin anti-ageing and anti-inflammatory effects of dihydroquercetin, natural triterpenoids, and their synthetic derivatives - Russian Journal of Bioorganic Chemistry, 2011, vol. 37, 5, p. 569-577]. Взаимодействие 4 с избытком гидразина приводит к гидразиду 5, в результате взаимодействия которого с эквимолярным количеством бензилизотиоцианата выделяют ацилтиосемикарбазид 6. Целевой продукт выделяют в результате реакции дегидросульфурирования 6 под действием ацетата ртути или 2-иодозобензойной кислоты.
Предложенный метод получения 1 является простым и эффективным. Выход соединения 1 в соответствии со схемой 1 в расчете на урсоловую кислоту 2 составляет 58% (окисление ацетатом ртути) и 47% (окисление 2-иодозобензойной кислотой). Физико-химические данные новых, впервые полученных соединений 5, 6,1 приведены в примере 1, 2, 3.
Цитостатическая активность соединений I, 2 и препарата сравнения доксорубицина изучалась по способности подавлять рост опухолевых клеток в культурах: MCF-7 с низким уровнем экспрессии HER-2 (рак молочной железы), U-87 MG (мультиформная глиобластома) клеток карциномы легкого А549, клеток гепатоцеллюлярной карциномы HepG2. В качестве неракового контроля использовали иммортализованные фибробласты человека hTERT. Определяли GI50 - концентрацию вещества, ингибирующую на 50% жизнеспособность опухолевых клеток. Для определения GI50 использовали стандартный МТТ тест, как описано в рекомендациях [Mosmann Т. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. // J Immunol Methods, 1983, v. 16 (1), p. 55-63; Wilson J.K., Sargent J.M., Elgie A.W., Hill J.G., Taylor C.G. A feasibility study of the MTT assay for chemosensitivity testing in ovarian malignancy // Br. J. Cancer, 1990, v. 62 (2), p. 189-194].
Результаты исследования представлены в таблице 1.

Из данных таблицы 1 следует, что терпеноидный 2-аминооксадиазол 1 проявил значительную эффективность и селективность в отношении клеток MCF-7. Активность 1 в отношении раковых клеток MCF7, U-87 MG, HepG2 значительно превышала активность исходного соединения урсоловой кислоты 2 и в тестах с MCF-7 приближалась к активности доксорубицина, но соединение 1 значительно превосходило доксорубицин по селективности, поскольку оно отличалось низкой токсичностью для неопухолевых клеток.
Изобретение иллюстрируется следующими примерами:
Пример 1. Синтез (3β-ацетокси-урс-12-ен)-28-оил-гидразида 5. (3β-ацетокси-урс-12-ен)-28-оил-хлорид 2 был получен по известной методике [C.W. Lee, N.H. Park, J.W. Kim, B.H. Um, A.V. Shpatov, E.E. Shults, I.V. Sorokina, S.A. Popov, Study of skin anti-ageing and anti-inflammatory effects of dihydroquercetin, natural triterpenoids, and their synthetic derivatives - Russian Journal of Bioorganic Chemistry, 2011, vol. 37, 5, p. 569-577].
К перемешиваемой смеси N2H4 × H2O (10 ммоль) в тетрагидрофуране (20 мл) по каплям добавляли раствор хлорангидрида 2 (1 ммоль) в тетрагидрофуране (10 мл) при 5-10°С. После перемешивания в течение 2 часов растворитель удаляли в вакууме и к остатку добавляли воду (30 мл). Осадок отделяли фильтрованием, промывали водой (3×30 мл) и сушили в вакууме над P2O5..
Белый порошок, выход 92%.
ИК (KBr) ν max (см-1): 3849, 3419, 2970, 2945, 2926, 2872, 1736, 1630, 1456, 1371, 1248, 1146, 1028, 1003, 966, 903, 804, 661, 608. ЯМР 1Н (500.13 МГц, пиридин D5 δ, м.д., J/Гц): 0.79 (3Н, с, Н-26), 0.84 (3Н, с, Н-25), 0.86 (6Н, м, Н-24, Н-30), 0.90 (3Н, с, Н-23), 0.94 (3Н, д, J29,19=6.4, Н-29), 1.15 (3Н, с, Н-27), 2.39 (1Н, д, J18,19=11.0, Н-18), 2.03 (1H, с, CH3CO), 3.62 (1Н, м, N-H), 4.64 (1Н, дд, J3,2акс=11.4; J3,2экв=4.8, Н-3), 5.21 (1Н, дд, J=J=3.5, Н-12). ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 15.2 (С-25), 16.6 (С-24), 16.7 (С-26), 17.3 (С-29), 18.1 (С-6), 20.8 (С-30), 21.1 (СН3СО), 23.2 (С-11), 23.5 (С-2), 23.6 (С-27), 24.3 (С-16), 27.8 (С-23), 27.9 (С-15), 30.7 (С-21), 32.6 (С-7), 36.6 (С-10), 37.5 (С-4), 37.6 (С-22), 37.9 (С-1), 39 (С-19), 39.3 (С-20), 39.5 (С-8), 42.0 (С-14), 46.8 (С-17), 47.4 (С-9), 52.4 (С-18), 55.1 (С-5), 80.4 (С-3), 125.4 (С-12), 139.3 (С-13), 170.3 (СН3СО), 177.4 (С-28).
Найдено, м/z: 512.3961 [М]+. C32H52O3N2 вычислено, м/z: 512.3986
Пример 2. 5-N-бензил-2-(3-ацетокси-ур-12-ен-28-оил) гидразинкарботиоамид 6
Раствор гидразида 5 (1 ммоль) и бензилизотиоцианата (1 ммоль) в ТГФ (30 мл) кипятили с обратным холодильником в течение 2 часов. Смесь охлаждали до комнатной температуры среды и концентрировали в вакууме на роторном испарителе. Остаток очищали колоночной хроматографией (SiO2; элюент - гексан: МТБЭ 2: 1).
Бледно-желтый порошок, выход 81%. Т.пл. 164-166°С.
ИК (KBr) ν макс (см-1): 3300, 2947, 2928, 2872, 2856, 2091, 1734, 1628, 1543, 1497, 1466, 1454, 1371, 1348, 1246, 1203, 1146, 1078, 1028, 1007, 985, 968, 901, 829, 806, 754, 698, 665, 534. ЯМР 1Н (500.13 МГц, CDCl3, СД3ОД δ, м.д., J/Гц): 0.65 (3Н, с, Н-26), 0.81-0.86 (9Н, м, Н-25, Н-29, Н-24), 0.89 (3Н, с, Н-30), 0.92 (3Н, с, Н-23), 0.99 (3Н, с, Н-27), 1.88 (1Н, д, J18,19=10.3, Н-18), 4.46 (1H, дд, J3,2акс=8.7; J3,2экв=7.0, H-3), 4.70 (1H, м, HA(CH2Ph)), 4.79 (1H, м, HB(CH2Ph)), 5.48 (1H, дд, J=J=3.5, H-12), 7.20-7.38 (5H, м, H-Ph), 7.91 (1H, c, N-H), 10.05 (1H, c, N-H), 10.67 (1H, c, N-H). ЯМР 13C (125 МГц, CDCl3, δ, м.д.): 15.5 (C-25), 16.1 (C-24), 16.6 (C-26), 16.9 (C-29), 18.1 (C-6), 20.9 (C-30), 21.1 (CH3CO), 23.1 (C-11), 23.4 (C-16), 23.4 (C-27), 24.61 (C-2), 27.1 (C-15), 27.8 (C-23), 30.5 (C-21), 32.3 (C-7), 36.4 (C-22), 36.6 (C-10), 37.5 (C-4), 38.09 (C-1), 38.5 (C-19), 39.3 (C-20), 39.4 (C-8), 41.7 (C-14), 46.5 (C-9), 47.4 (C-17), 48.3 (CH2-Ph), 52.4 (C-18), 55 (C-5), 80.59 (C-3), 127.4 (C-Ar-4), 127.8 (C-Ar-2), 128 (C-12), 128.4 (C-Ar-3), 137.1 (C-13), 137.6 (C-Ar-1), 170.7 (C=C), 170.8 (CH3CO), 177.8 (C-28).
Найдено: м/z: 643,4171 [М+-Н2О]. Вычислено: м/z: 661.4272
Пример 3а (17S)-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен)-17-ил)-1,3,4-оксадиазол-2-амин 1
К раствору ацилтиосемикарбазида 6 (0,1 ммоль) в метаноле (15 мл) добавляли Hg(OAc)2 (1,1 экв.). Реакционную смесь кипятили с обратным холодильником в течение 2-3 ч до завершения реакции (по ТСХ). Реакционную смесь центрифугировали и фильтрат концентрировали в вакууме. Полученное твердое вещество хроматографировали (SiO2, CH2Cl2-МТБЭ), получали аминопроизводное 1.
Пример 3b
К раствору ацилтиосемикарбазида 6 (0,1 ммоль) в CH2Cl2 (15 мл) добавляли триэтиламин (0,2 ммоль), затем при перемешивании добавляли порциями 2-йодозобензойную кислоту (0,1 ммоль). Перемешивание продолжали в течение 1 часа. Реакционную смесь промывали насыщенным водным раствором NaHCO3. Водный слой экстрагировали CH2Cl2. Объединенные органические слои сушили (Na2CO4) и концентрировали в вакууме. Остаток хроматографировали (SiO2, CH2Cl2-МТБЭ), получали аминопроизводное 1.
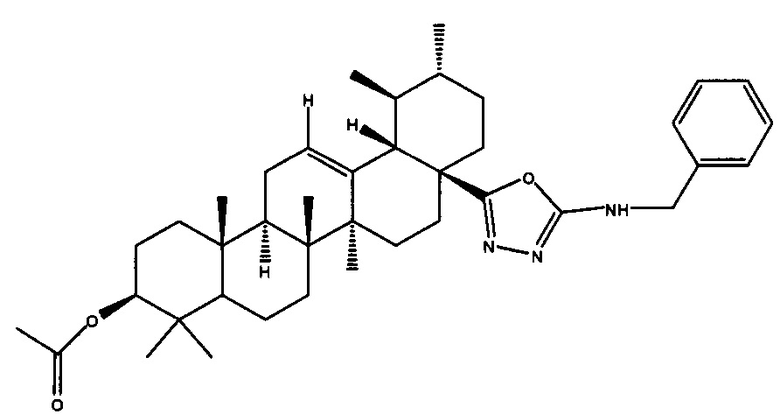
Белый порошок, 85% (метод А), 68% (метод Б) в расчете на ацилтиосемикарбазид 6.
ИК (KBr) ν макс (см-1): 3525, 3298, 3086, 3064, 3028, 2970, 2947, 2926, 2872, 2858, 1734, 1628, 1545, 1495, 1454, 1373, 1346, 1246, 1203, 1144, 1105, 1078, 1028, 1007, 987, 968, 931, 906, 827, 806, 733, 698, 663, 608, 534, 511, 455.
ЯМР 1H (500.13 МГц, CDCl3, СД3ОД δ, м.д., J/Гц): 0.44 (3Н, с, Н-26), 0.82 (3Н, с, Н-25), 0.83 (3Н, с, Н-24), 0.85 (3Н, д, J29,19=6.5, Н-29), 0.87 (3Н, с, Н-23), 0.94 (3Н, д, JA,B=6.4, Н-30), 1.04 (3Н, с, Н-27), 2.02 (3Н, с, CH3CO), 2.25 (1Н, д, J18,19=11.1, Н-18), 4.44 (1Н, м, Н-3), 4.46 (2Н, м, СН2-Ph), 5.18 (1H, дд, J=J=3.2, Н-12), 5.98 (1H, br с, N-H), 7.23-7.39 (5Н, м, H-Ph). ЯМР 13С (125 МГц, CDCl3, δ, м.д.): 15.3 (С-25), 16.4 (С-24), 16.6 (С-26), 17 (С-29), 18 (С-6), 21.0 (С-30), 21.2 (СН3СО), 23.1 (С-2), 23.4 (С-11), 23.6 (С-27), 24.3 (С-16), 26.8 (С-15), 27.9 (С-23), 30.4 (С-21), 32.5 (С-7), 36.6 (С-10), 37.5 (С-4), 38.1 (С-22), 38.4 (С-1), 38.7 (С-19), 38.7 (С-20), 39.4 (С-8), 41 (С-17), 41.5 (С-14), 47.3 (С-9), 53.2 (С-18), 55.1 (С-5), 80.8 (С-3), 126.0 (С-Ar-4), 127.4 (С-Ar-2), 127.5 (С-12), 128.3 (С-Ar-3), 137.5 (С-13), 137.8 (С-Ar-1), 162.4 (C-NH), 165.6 (С-28), 170.9 (СН3СО).
Найдено, m/z: 627.4410 [М]+. C40H57N3O3 Вычислено, m/z: 627.4400.
Пример 4 Сравнительное изучение цитотоксической активности.
Культуры рака молочной железы MCF7 (АТСС НТВ-22), мультиформные клетки глиобластомы MG U-87 (АТСС НТВ-14), клетки карциномы легкого А549, клетки гепатоцеллюлярной карциномы HepG2 были получены из АТСС, США. Иммортализованные человеческие фибробласты (ИЦИГ СОР АН) использованы в качестве здорового клеточного контроля. Цитотоксичность тестируемых соединений оценивали с использованием анализа МТТ по стандартной методике [Т. Mosmann, Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays. J. Immunol. Methods, 65 (1983), 55-63.]. Клетки инокулировали в 96-луночные планшеты (5000 клеток на лунку) и инкубировали при 37°С в атмосфере 5% CO2. Среду в лунках заменяли через 24 часа свежей средой, содержащей испытуемые соединения в ДМСО (1 об. %), после чего продолжали инкубирование в течение 72 часов. Оптическую плотность измеряли спектрофотометрически. Все соединения были испытаны в концентрациях 10, 25, 50 и 100 мкМ с использованием необходимых контролей, то есть отрицательного, ДМСО (растворитель) и положительного доксорубицина (стандартный цитостатик). Каждый эксперимент проводился в трех независимых сериях по три теста в каждой серии. Результаты представлены в таблице 1 в виде средней ингибирующей концентрации GI50 ± SEM.
| название | год | авторы | номер документа |
|---|---|---|---|
| ((3β-АЦЕТОКСИ-УРС-12-ЕН-28-ОИЛ-ОКСИАЦЕТОКСИ)МЕТИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ) МЕТИЛ)-4-МЕТИЛ-1,2,5-ОКСАДИАЗОЛ-2-ОКСИД, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2020 |
|
RU2739559C1 |
| Лекарственное средство, обладающее противовоспалительной активностью | 2016 |
|
RU2617123C1 |
| Гибридные производные урсоловой кислоты и галловой кислоты, содержащие 1,2,3-триазольные линкеры, обладающие антиоксидантной и противовоспалительной активностью | 2022 |
|
RU2802957C1 |
| Фосфорил замещенные 3-кето-андрост-4-ен-[16,17-d]пиридазины и способ их получения | 2023 |
|
RU2807870C1 |
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| Средство для ингибирования фермента тирозил-ДНК-фосфодиэстеразы 1 человека на основе фенилкумаринов, сенсибилизирующее опухоли к действию противоопухолевых агентов | 2019 |
|
RU2724878C1 |
| 7-ТРИАЗОЛИЛ-ЗАМЕЩЕННЫЕ ГИДРОКСИСПИРОСТАНЫ, ОБЛАДАЮЩИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2023 |
|
RU2798105C1 |
| Гибридное производное лупанового тритерпеноида и галловой кислоты, содержащее 1,2,3-триазольный линкер, обладающее антиоксидантной и противовоспалительной активностью | 2023 |
|
RU2811236C1 |
| МЕТИЛОВЫЙ ЭФИР 24-ДИБРОМ-4-ОКСО-2-ЦИАНО-3,23-ДИНОРЛУП-28-ОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2022 |
|
RU2784317C1 |
| МЕТИЛОВЫЕ ЭФИРЫ 3-МЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ И 3-БРОММЕТИЛЕН-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ КИСЛОТ, ПРОЯВЛЯЮЩИЕ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2016 |
|
RU2632002C1 |
Изобретение относится к (17S)-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен)-17-ил)-1,3,4-оксадиазол-2-амину структурной формулы 1. Технический результат: (17S)-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен)-17-ил)-1,3,4-оксадиазол-2-амин, обладающий цитотоксической активностью в отношении раковых клеток молочной железы MCF-7 и малотоксичный в отношении здоровых клеток человека. 1 ил., 1 табл., 5 пр.
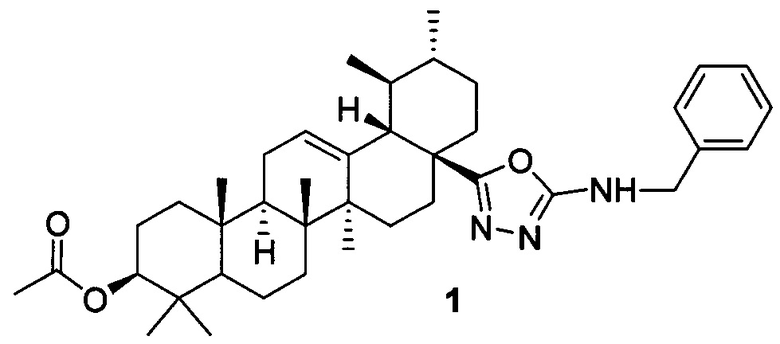
(17S)-N-бензил-5-((3β-ацетокси-28-нор-урс-12-ен)-17-ил)-1,3,4-оксадиазол-2-амин,
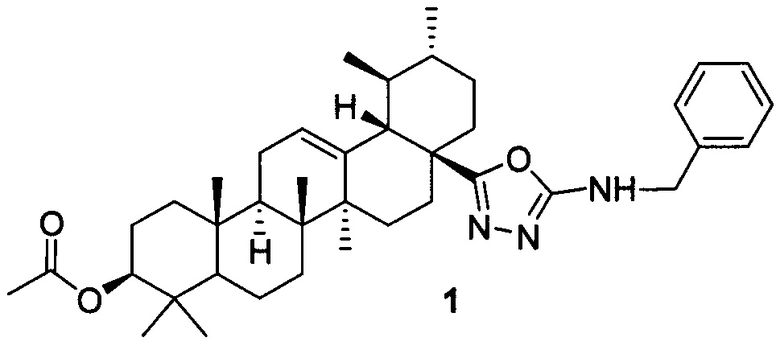
обладающий селективной цитотоксичностью в отношении клеток рака молочной железы MCF-7.
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2019-12-06—Публикация
2019-08-07—Подача