Изобретение относится к области органической химии, в частности к новым фосфониевым солям на основе гликозидов лупанового тритерпеноида – бетулиновой кислоты, содержащих фрагменты D-глюкопиранозы и L-рамнопиранозы формулы 1 – 2, которые могут найти применение в фармакологии и медицине в качестве противоопухолевых средств:
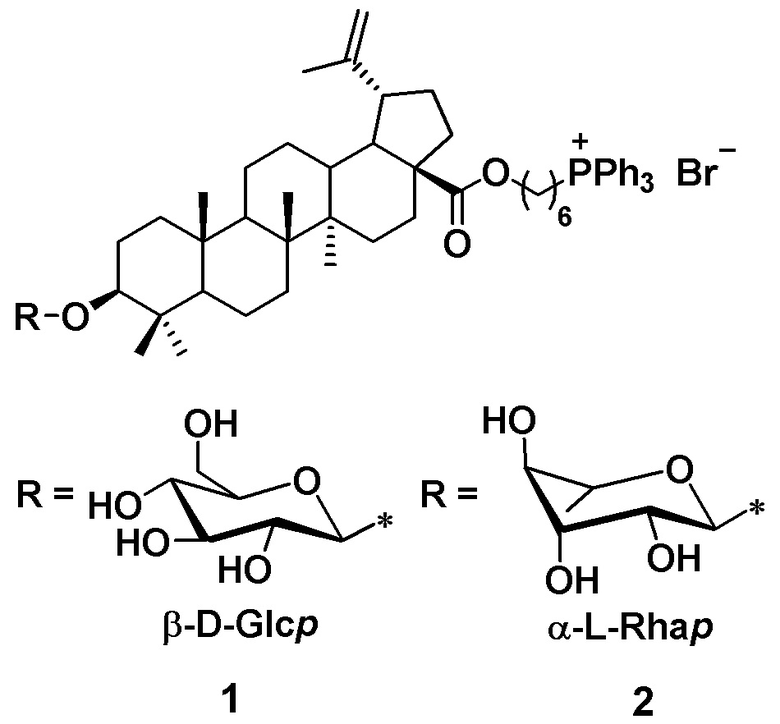
Далее заявителем представлены термины и определения, использованные в заявленном техническом решении:
Гликозиды – органические соединения, состоящие из углеводного и неуглеводного компонентов.
Лупановый тритерпеноид (тритерпеноид) – соединение класса терпенов, образующихся в результате конденсации шести изопреновых единиц.
Вторичные метаболиты – органические вещества, синтезируемые организмом, но не участвующие в росте, развитии или репродукции.
Тритерпеноиды образуют важную группу вторичных метаболитов растений, которые обладают рядом ценных биологических и фармакологических свойств, представляющих значительный интерес в лечении различных заболеваний [S. Alakurtti, T. Mäkelä, S. Koskimies, J. Yli-Kauhaluoma. Pharmacological properties of the ubiquitous natural product betulin. Eur J Pharm Sci. 2006. Vol.29(1). P.5-8; S. M. Kamble, S. N. Goyal, C. R. Patil. Multifunctional pentacyclic triterpenoids as adjuvants in cancer chemotherapy: a review. RSC Advances. 2014. Vol.63. P.33370-33382]. Тритерпеноиды проявляют цитотоксическую активность в отношении опухолевых клеток человека и животных, что было продемонстрировано на примере таких клеточных линий как A-549 (аденокарцинома легкого), MCF-7 (аденокарцинома молочной железы), LNCaP и PC-3 (аденокарцинома предстательной железы) и др. [M. H. Ghante, P. G. Jamkhande. Role of Pentacyclic Triterpenoids in Chemoprevention and Anticancer Treatment: An Overview on Targets and Underling Mechanisms. J Pharmacopuncture. Vol.22(2). P.60-63; W.Zhang, X.Men, P.Lei. Review on anti-tumor effect of triterpene acid compounds. J.Can Res Ther. 2014. Vol.10. Suppl S1:14-9]. Тритерпеноиды и, в частности, бетулиновая (3β-гидроксилуп-20(29)-ен-28-овая) кислота вызывают программируемую клеточную гибель (апоптоз) опухолевых клеток, индукция которой является одним из основных подходов к лечению опухолевых заболеваний [F. B. Mullauer, J. H. Kessler, J. P. Medema. Betulinic acid induces cytochrome c release and apoptosis in a Bax/Bak-independent, permeability transition pore dependent fashion. Apoptosis. 2009. Vol.14. P.191-202]. Наряду с противоопухолевым действием бетулиновая кислота ингибирует воспалительные процессы, вовлеченные в развитие опухолей, например, посредством влияния на активность фактора транскрипции NF-κB, нарушение регуляции которого вызывает воспаление [R. Checker , S. K. Sandur, D. Sharma, R. S. Patwardhan, S. Jayakumar, V. Kohli, G. Sethi, B. B. Aggarwal, K. B. Sainis. Potent anti-inflammatory activity of ursolic acid, a triterpenoid antioxidant, is mediated through suppression of NF-kappaB, AP-1 and NF-AT. PloS One. 2012. Vol.7(2). P. e31318]. Таким образом, проанализированные литературные данные свидетельствуют, что тритерпеноиды и, в частности, бетулиновая кислота, обладают фармакологическими свойствами, такими как противоопухолевая и противовоспалительная, что делает их перспективными веществами для терапии раковых заболеваний.
Известно, что фармакологические и медицинские применения бетулиновой кислоты ограничены из-за низкой растворимости в воде (0.02 мкг/мл) [S. Jäger, K. Winkler, U.Pfüller, A.Scheffler. Solubility studies of oleanolic acid and betulinic acid in aqueous solutions and plant extracts of Viscum album L. Planta Med. 2007. Vol.73(2). P.159-161], а также пониженного цитотоксического действия в отношении опухолевых клеток [W. Jiang, X. Li, S. Dong, H.Zhou. Betulinic acid in the treatment of tumor diseases: Application and research progress. 2021. Vol.142.P.3-5]. Анализ литературных источников свидетельствует о необходимости химической модификации бетулиновой кислоты и других тритерпеноидов для преодоления вышеуказанных недостатков [M. Ali-Seyed, I.Jantan, K.Vijayaraghavan, S. N. Abbas Bukhari. Betulinic Acid: Recent Advances in Chemical Modifications, Effective Delivery, and Molecular Mechanisms of a Promising Anticancer Therapy. Chem Biol Drug Des. 2016. Vol.87. P.524-527]. Таким образом, из представленного выше следует, что для успешного применения тритерпеноидов, и в частности, бетулиновой кислоты, в медицине в терапии опухолевых заболеваний необходимо повысить их растворимость в физиологических средах и повысить эффективность избирательного проникновения через мембрану опухолевых клеток, что может быть достигнуто химической модификацией их структуры.
Известен ряд химически модифицированных тритерпеноидов, которые могут быть рассмотрены в качестве аналогов предлагаемого изобретения с общими признаками.
Известно изобретение по патенту WO2009067891A1 «Водорастворимые тритерпен-фенольные соединения, имеющие противоопухолевую активность, и способ их получения», сущностью являются водорастворимые фенольные тритерпеновые соединения формулы А1, полученные на основе хинонметидных производных тритерпеноидов и содержащие сульфогруппу в положении С-6, обладающие противоопухолевой активностью:
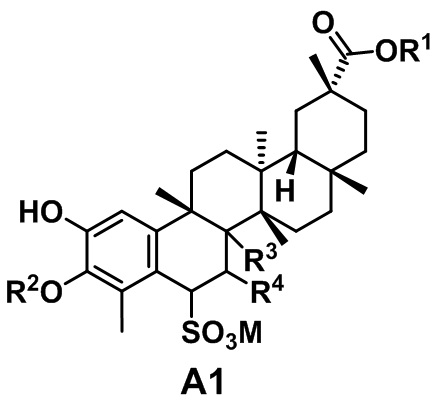
где R2 = H, C1-C12 алкил или C1-C12 ацил; M = Na, K, NH4 или Ca; R1 = H или C1-C12 алкил; R3 и R4 представляют собой H или OH, или R3 представляет собой H, а R4 представляет собой (O=), или атомы углерода в положениях 7 и 8, где расположены R4 и R3, соответственно, образуют двойную связь.
Известно изобретение по патенту CN102532246B «Производное олеаноловой кислоты, а также способы его получения и применения», сущностью является амидное производное олеаноловой кислоты формулы А2, полученное путем ковалентного присоединения к олеаноловой кислоте короткоцепочечного амина, обладающее противоопухолевой активностью:
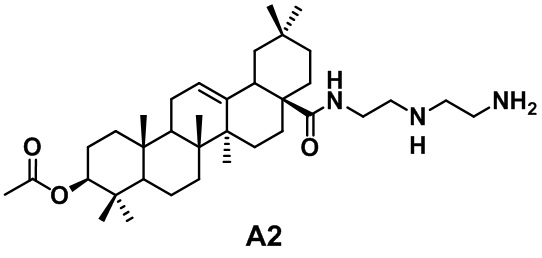
В совокупности молекулярная масса короткоцепочечного амина составляет 20-200.
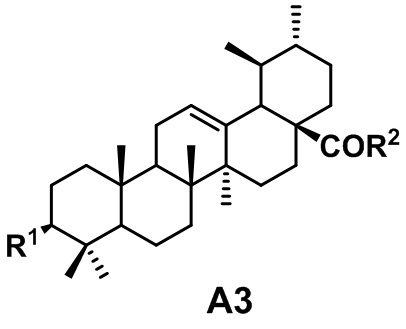
Известно изобретение по патенту CN101928322B «Урсоловая кислота, модифицированная моноэфирами полиолов с противораковой активностью», сущностью являются производные урсоловой кислоты формулы А3, где R1 представляет собой гидроксил, ацетокси, сукцинилокси или полиол, монозамещенный сукцинилокси, R2 представляет собой гидроксил или полиол. Получены модификацией урсоловой кислоты галогенпроизводными полиоловых моноэфиров, обладают цитотоксической активностью в отношении клеток рака печени человека HepG2, клеток нейробластомы человека SH-SY5Y, рака толстой кишки человека HT-29, рака желудка человека BGC-823 и AGS:
Общим недостатком изобретений-аналогов WO2009067891A1, CN102532246B, CN101928322B является пониженное цитотоксическое действие в отношении опухолевых клеток, что ограничивает практическое применение. Пониженная цитотоксичность связана с тем, что структура применяемых в известных изобретениях модификаторов, хотя и повышает растворимость тритерпеноидов в водных средах, но не обеспечивает их нацеленного воздействия на митохондрии, нарушение работы которых способствует запуску апоптоза в опухолевых клетках. Таким образом, анализ недостатков технического результата в целом, изобретений-аналогов WO2009067891A1, CN102532246B, CN101928322B свидетельствует о необходимости введения в структуру модифицированных тритерпеноидов наряду с фрагментами, обеспечивающими растворимость в водных средах, также функциональные группы, обеспечивающие целевое проникновение в опухолевые клетки.
Одним из наиболее действенных модификаторов противоопухолевых соединений является катион трифенилфосфония (ТФФ), обладающий способностью не только повышать растворимость липофильных соединений, но транспортировать их пропорционально величине мембранных потенциалов внутрь клетки и далее в митохондрии. ТФФ помогает избирательно нацеливать соединения на опухолевые клетки, поскольку последние часто имеют повышенные мембранные потенциалы в сравнении с нормальными клетками [D.C. Rideout , T. Calogeropoulou, J.S. Jaworski, R.Dagnino Jr, M.R. McCarthy. Phosphonium salts exhibiting selective anti-carcinoma activity in vitro. Anticancer Drug Des. 1989. Vol.4(4). P.265-270].
Из исследованного заявителем уровня техники выявлены ТФФ производные тритерпеноидов, полученные на основе галогеналкиловых эфиров бетулиновой кислоты – изобретение по патенту RU 2665922 «Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы», наиболее близкие по структуре и назначению заявленному техническому изобретению, выбранные в качестве прототипа. Сущностью являются фосфониевые соли на основе бетулиновой кислоты формулы А4-А9, обладающие цитотоксичностью в отношении аденокарциномы простаты:
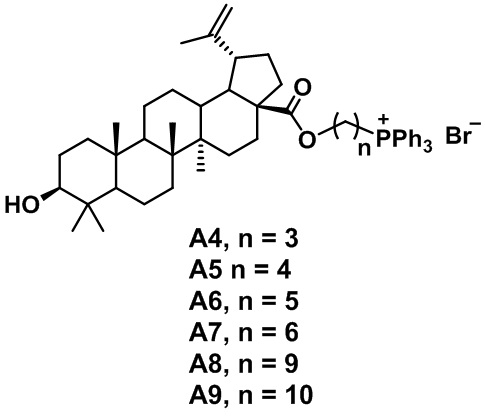
Преимуществом прототипа по сравнению с приведенными выше аналогами является направленное воздействие на митохондрии и повышенная цитотоксическая активность в отношении опухолевых клеток вызывающих аденокарциному простаты, указанная цель достигается за счет присутствия ТФФ группы в производных бетулиновой кислоты.
Недостатком прототипа является то, что применяемый в его структуре искусственный модификатор (ТФФ) обеспечивает только физико-химический принцип накопления соединений в опухолевых клетках, в частности – аденокарциномы простаты (посредством электродвижущей силы мембранных потенциалов) и не обеспечивает биологического распознавания опухолевой клетки, которое позволило бы повысить эффективность клеточной доставки и цитотоксического действия соединений в отношении клеток с опухолевым фенотипом.
Таким образом, основными недостатками ТФФ производных бетулиновой кислоты по прототипу RU2665922 являются пониженные клеточное проникновение и цитотоксическое действие в отношении опухолевых клеток (вследствие отсутствия биологически распознающего компонента).
Техническим результатом заявленного технического решения является создание новых фосфониевых солей на основе гликозидов бетулиновой кислоты, преодолевающих вышеуказанные недостатки прототипа, повышающих клеточное проникновение и цитотоксическое действие в отношении опухолевых клеток (вследствие наличия биологически распознающего компонента – фрагментов D-глюкопиранозы и L-рамнопиранозы).
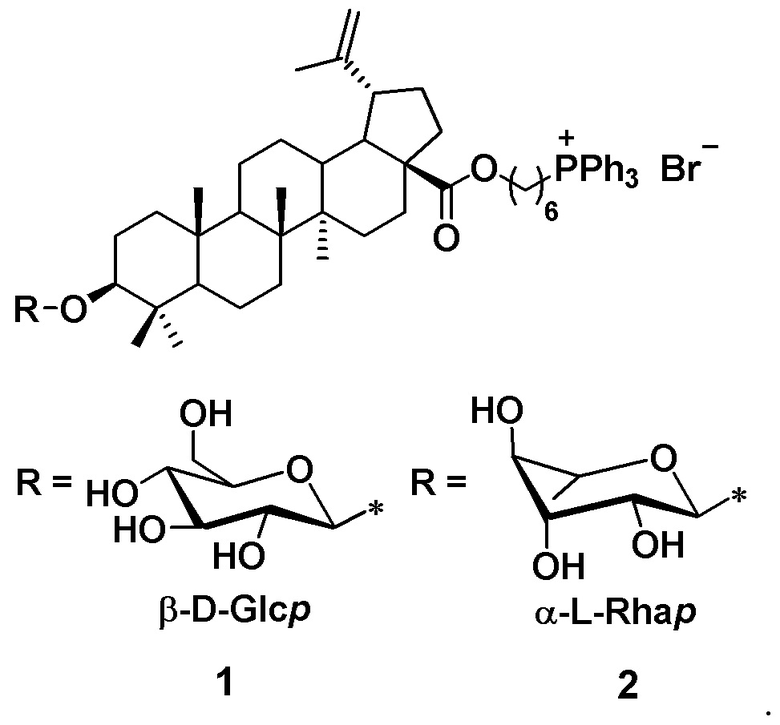
Сущностью заявленного технического решения являются фосфониевые соли на основе гликозидов бетулиновой кислоты формулы 1-2:
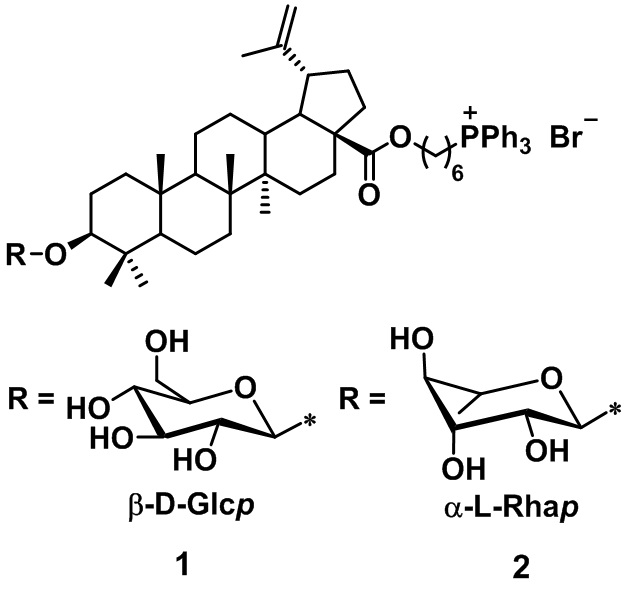 .
.
Фосфониевые соли на основе гликозидов бетулиновой кислоты по п.1, обладающие противоопухолевой активностью.
Заявленное техническое решение иллюстрируется Фиг. 1 – Фиг. 3.
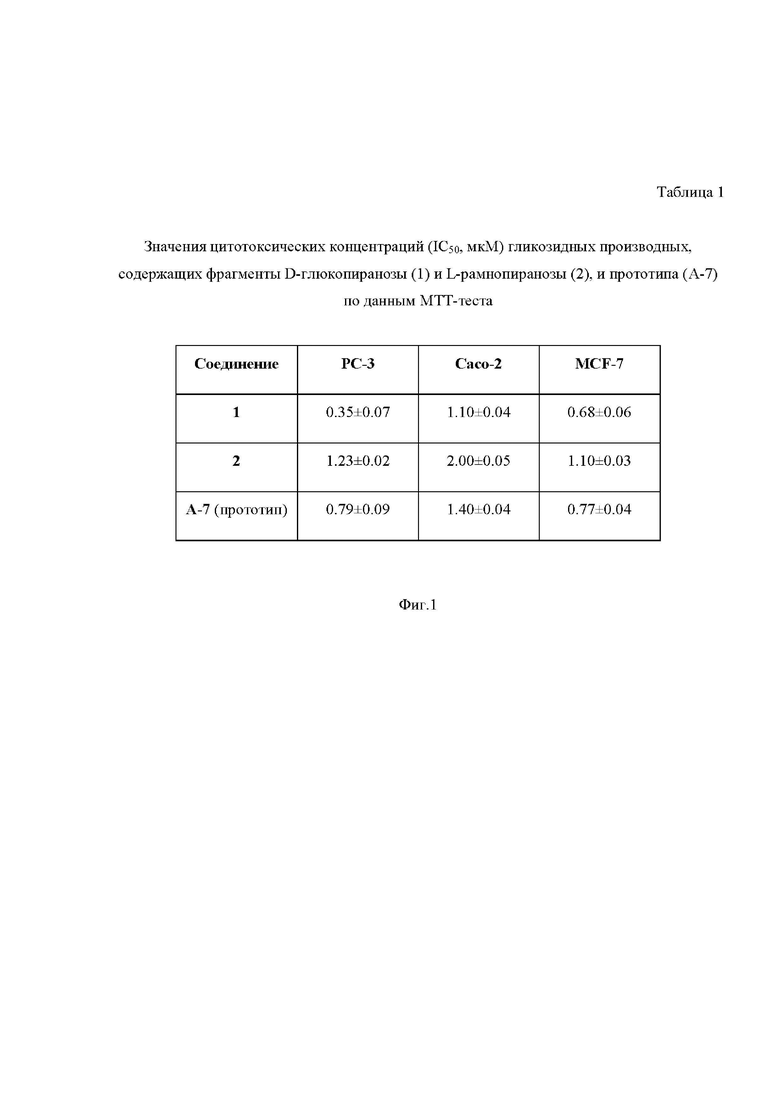
На Фиг.1 приведена Таблица 1, в которой представлены значения цитотоксических концентраций гликозидных производных, содержащих фрагменты D-глюкопиранозы (1) и L-рамнопиранозы (2), по данным теста на жизнеспособность с использованием индикатора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолиум бромид)) в отношении опухолевых клеток (аденокарцинома предстательной железы PC-3, аденокарцинома кишечника Caco-2, аденокарцинома молочной железы MCF-7). Данные представлены в виде полумаксимальных ингибирующих концентраций (IC50, мкМ).
Результаты, представленные в Таблице 1 показывают, что соединения 1 и 2 обладают высокой цитотоксичностью в отношении раковых линий клеток PC-3, CaCo-2 и MCF-7 со значениями IC50 0.35÷2.0 мкМ. При этом соединение 1 обладает более низкими значениями IC50 в сравнении с соединением А-7. Таким образом, соединение 1 по цитотоксической активности в отношении опухолевых клеток превосходит прототип.
На Фиг. 2 приведена Таблица 2, в которой показаны значения среднеканальной флуоресценции красителя TMRE (тетраметилродамин, этиловый эфир) для клеток РС-3, обработанных гликозидными производными, содержащими фрагменты D-глюкопиранозы (1) и L-рамнопиранозы (2), и прототипом (А-7), по данным проточной цитофлуориметрии.
Результаты, представленные в Таблице 2 показывают значительное снижение флуоресценции индикатора TMRE в опухолевых клетках РС-3 под действием соединений 1 и 2, что свидетельствует о значительном снижении трансмембранного потенциала (деполяризации) митохондрий. При этом эффект соединений 1 и 2 существенно превосходит таковой для соединения А-7. Таким образом, соединения 1 и 2 по эффективности снижения мембранного потенциала митохондрий превосходят прототип.
На Фиг.3 приведена Таблица 3, в которой представлены значения обнаруженных концентраций гликозидных производных, содержащих фрагменты D-глюкопиранозы (1) и L-рамнопиранозы (2), и прототипа (А-7) в лизате клеток PC-3, предварительно обработанных соединениями, по данным хромато-масс-спектрометрического анализа.
Результаты, представленные в Таблице 3 демонстрируют, что соединения 1 и 2 характеризуются значительно более высокими клеточными концентрациями в сравнении с соединением А-7. Таким образом, соединения 1 и 2 по эффективности проникновения в опухолевые клетки превосходят прототип.
Далее заявителем приведено описание заявленного технического решения.
Известно, что модификация противоопухолевых соединений биологически распознающим природным компонентом лежит в основе улучшения их клеточной доставки. Для решения этой задачи могут быть использованы углеводные (гликозидные) группы, способные транспортироваться в опухолевые клетки специфическими мембранными транспортерами, такими как – глюкоза. При этом следует принять во внимание, что подобные транспортеры, как правило, более активны в опухолевых клетках, чем в нормальных клетках [K. Adekola, S.T. Rosen, M. Shanmugam. Glucose transporters in cancer metabolism. Curr Opin Oncol. 2012. Vol.24(6). P.652-654].
Технический результат достигается созданием заявленных фосфониевых солей на основе гликозидов бетулиновой кислоты формулы 1 – 2, получаемых по схеме 1, а именно, посредством взаимодействия С-28 бромгексилового эфира бетулиновой кислоты (3) с трихлорацетимидатными производными сахаров (D-глюкопиранозы (4) и L-рамнопиранозы (5) в среде CH2Cl2 в присутствии триметилсилилтрифлата с последующим взаимодействием с трифенилфосфином в среде ацетонитрила.
На заключительном этапе проводится удаление защитных бензоильных групп в гликозильном фрагменте действием поташа в метаноле.
Заявленные фосфониевые соли на основе гликозидов бетулиновой кислоты характеризуются повышенным клеточным проникновением и цитотоксическим действием в отношении опухолевых клеток (вследствие наличия биологически распознающего компонента).
Далее заявителем представлена детальная последовательность (схема 1) синтеза заявленного технического решения.
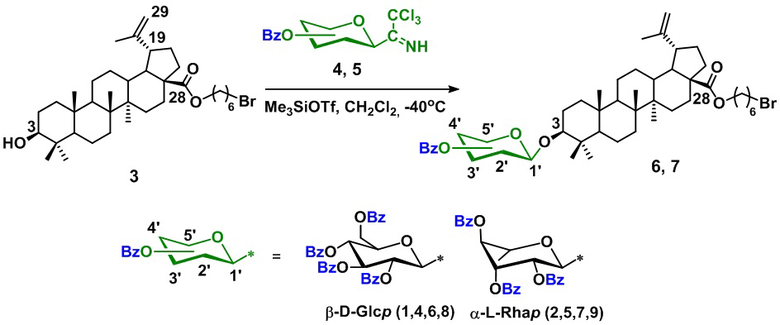
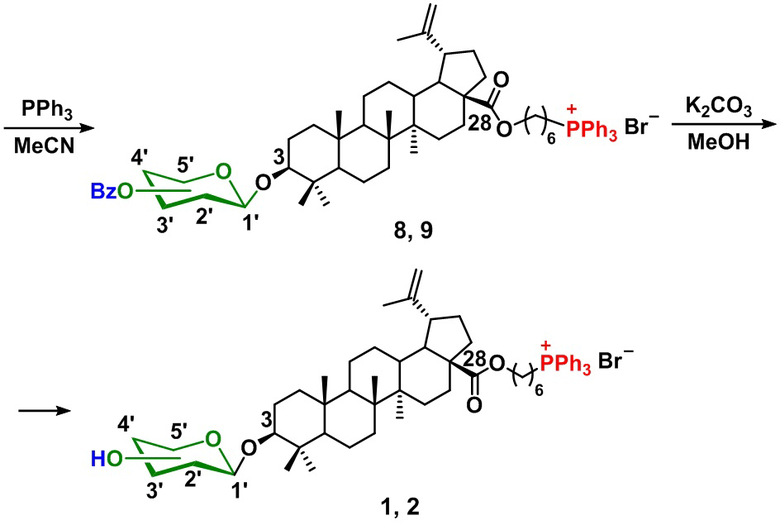
Схема 1
Исходный С-28 бромгексиловый эфир бетулиновой кислоты (3) синтезирован по известной методике: [J.-H. Liu, J. Tang, Z.-F. Zhu, L. Chen. Design, synthesis, and anti-tumor activity of novel betulinic acid derivatives. J Asian Nat Prod Res. 2014. Vol.16. P. 34-42].
Изобретение иллюстрируется примерами 1–5 по получению заявленных соединений 1 – 2, и обеспечивают доказательную базу, подтверждённую экспериментально противоопухолевой активности, внутриклеточной концентрации и изменению мембранного потенциала митохондрий.
Далее заявителем приведены примеры осуществления заявленного технического решения, начиная с синтеза соединений 1 и 2 из галогенгексилового эфира бетулиновой кислоты (Примеры 1 и 2), демонстрирующие легкость синтеза в 3 стадии и доступность используемых субстратов. Пример 3 демонстрирует превосходство соединения 1 прототипа по цитотоксической активности в отношении опухолевых клеток. Пример 4 демонстрирует превосходство соединений 1 и 2 прототипа по эффективности снижения мембранного потенциала митохондрий. Пример 5 демонстрирует превосходство соединений 1 и 2 прототипа по эффективности внутриклеточного накопления.
Пример 1. Получение 6-трифенилфосфониогексил 3β-O-(β-D-глюкопиранозил)луп-20(29)-ен-28-оата бромида – соединения 1.
1. Получение 3β-O-(2,3,4,6-тетра-O-бензоил-β-D-глюкопиранозил-28-O-(6-бромгексил) бетулината (6).
Раствор эфира бетулиновой кислоты (3) (206 мг, 0.28 ммоль) и 2,3,4,6-тетра-О-бензоил-β-D-глюкопиранозилтрихлорацетимидата (4) (154 мг, 0.25 ммоль) в дихлорметане (15 мл) перемешивали в течение 30 мин при комнатной температуре с молекулярными ситами (4 Å, 300 мг) в атмосфере аргона, затем охлаждали до -40°С и добавляли раствор триметилсилилтрифлата (0.15 ммоль) в дихлорметане (1 мл). Смесь перемешивали в течение 1 ч и реакцию останавливали добавлением Et3N (0.5 мл). Смесь концентрировали и остаток очищали колоночной хроматографией (петролейный эфир/EtOAc, 4:1) с получением соединения (6) (203 мг, 68%); т.пл. 100 °C, [α]20D +11.8 (с 1.0, CHCl3), ИК (KBr) νmax: 2943, 2868, 1730, 1602, 1452, 1376, 1315, 1266, 1177, 1155, 1107, 1094, 1069, 1027, 975, 910 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.62, 0.68, 0.76, 0.87, 0.94 (с, 15H, H23-27), 1.73 (с, 3H, H30), 3.0 (м, 1H, H19), 3.0 (дд, 1H, J = 10.6, 4.5 Гц, H-3), 3.43 (т, J = 6.8 Гц, 2H, CH2Br), 4.0 (м, 2H, С(O)OCH2), 4.16 (м, 1H, H5'), 4.5 (дд, 1H, J = 12, 6.7 Гц, H6'), 4.6 (дд, 1H, J = 12, 3.5 Гц, H6'), 4.65 (с, 1H, HА29), 4.76 (с, 1H, HВ29), 4.86 (д, 1H, J = 8 Гц, H1'), 5.56 (т, 1H, J = 8 Гц, Н2'), 5.59 (1H, J = 9.6 Гц, Н4'), 5.91 (1H, J = 9.6 Гц, Н3') 7.2-8.0 (м, 20H, HAr). Найдено: C, 70.0; H, 7.1; Br, 6.7 %, Вычислено для C70H85BrO12: C, 70.2; H, 7.15; Br, 6.7 %.
2. Получение 6-трифенилфосфониогексил 3β-O-(2,3,4,6-тетра-O-бензоил-β-D-глюкопиранозил)луп-20(29)-ен-28-оата бромида (8).
К раствору соединения (6) (191 мг, 0.16 ммоль) в 10 мл сухого ацетонитрила (10 мл) в атмосфере аргона добавляли трифенилфосфин (168 мг, 0.64 ммоль) и смесь перемешивали с обратным холодильником в течение 12–18 ч до завершения реакции (контроль по ТСХ). Ацетонитрил удаляли при пониженном давлении, осадок промывали горячим петролейным эфиром (3 × 5 мл) и растворяли в этилацетате. К реакционной смеси добавляли петролейный эфир (10 мл). Образовавшийся осадок промывали диэтиловым эфиром (3 мл) и сушили в вакууме, получая чистый (8). (198 мг, 85%); т.пл. 126-130 °C, [α]20D +11 (с 0.6, CHCl3), ИК (KBr) νmax: 2920, 2869, 1727, 1602, 1586, 1452, 1439, 1377, 1315, 1266, 1177, 1070, 1027, 975 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.6, 0.7, 0.7, 0.8, 0.9 (с, 15H, H23-27), 1.70 (с, 3H, H30), 2.9 (м, 1H, H19), 3.0 (дд, 1H, J = 11.6, 4.4 Гц, H3), 3.88 (м, 2H, CH2P), 4.0 (м, 2H, С(O)OCH2), 4.15 (м, 1H, H5'), 4.5 (дд, 1H, J = 12, 6.7 Гц, H6'), 4.6 (дд, 1H, J = 12, 3.5 Гц, H6'), 4.62 (с, 1H, HА29), 4.72 (с, 1H, HВ29), 4.8 (д, 1H, J = 8 Гц, H1'), 5.56 (т, 1H, J = 8 Гц, Н2'), 5.58 (1H, J = 9.6 Гц, Н4'), 5.9 (1H, J = 9.6 Гц, Н3'), 7.2-8.0 (м, 35H, HAr); ЯМР 13C (CDCl3, 100 МГц): δ 14.6, 15.3, 16.0, 16.1, 18.3, 19.3, 20.9, 22.6, 22.6, 22.7, 22.75 (d, J = 49.5 Гц, CH2-P), 25.5, 25.77, 27.4, 27.9, 28.3, 29.6, 29.9, 30.0, 30.6, 32.1, 34.3, 37.0, 37.1, 38.2, 38.7, 38.8, 40.7, 42.4, 47.0, 49.4, 50.5, 55.3, 56.5, 63.7, 70.3, 71.9, 72.1, 72.9, 90.6 (C3), 103.2 (C1'), 109.4 (C29), 118.5 (d, J = 85.8 Гц, Cipso), 128.3-135.0 (CAr), 150.57, 165.0, 165.3, 165.8, 166.0, 176.2; ЯМР 31P (CDCl3, 162 МГц): δ 25.0; MALDIMS m/z 1381.2 [M-Br]+; Найдено: 72.3; H, 6.9; Br, 5.4 % Вычислено для C88H100BrO12P: C, 72.4; H, 6.9; Br, 5.5 %
3. Получение 6-трифенилфосфониогексил 3β-O-(β-D-глюкопиранозил)луп-20(29)-ен-28-оата бромида (1).
Суспензию (8) (146 мг, 0.1 ммоль) и K2CO3 (25 мг) в МеОН (5 мл) перемешивали 1 ч, затем нейтрализовали смолой Amberlyst 15 (Н+-форма), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (CH2Cl2/MeOH (100:0–100:10) с получением свободного гликозида (1) в виде аморфного порошка (83 мг, 80 %); т.пл. 95 °C, ИК (KBr) νmax: 3402, 2940, 2868, 1720, 1639, 1558, 1452, 1439, 1390, 1376, 1317, 1267, 1243, 1131, 1113, 1054, 1026, 976, 882, 724, 691 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.82, 0.83, 0.89, 1.0, 1.05 (с, 15H, H23-27), 1.70 (с, 3H, H30), 0.7-2.2 (м, 34H, сигналы протонов бетулинового остова и протоны (CH2)2 фрагмента линкера), 3.0 (м, 1H, H19), 3.18 (м, 1H, H3), 3.2-3.5 (м, 5Н, H5',2',4', CH2-P), 3.71 (м, 1H, H3'), 3.85 (м, 1H, H6'), 4.0-4.1 (м, 3H, H6', С(O)OCH2), 4.34 (д, 1H, J = 7.7 Гц, H1'), 4.6 (с, 1H, HА29), 4.7 (с, 1H, HВ29), 7.8-7.9 (м,15H, HAr); ЯМР 13C (CDCl3, 100 МГц): 13.0, 13.6, 15.4, 15.5, 17.9, 18.1, 19.5, 20.7, 21.4 (d, J = 51.2 Гц, CH2-P), 22.22, 22.26, 25.25, 25.44, 25.76, 27.04, 28.14, 29.37, 29.68, 29.84, 30.31, 31.81, 34.17, 36.64, 38.42, 38.56, 38.85, 40.58, 42.15, 49.15, 50.45, 55.66, 56.55, 61.39, 63.48 (С6'), 70.28 (С4'), 74.28 (С2'), 76.2 (С3'), 76.3 (С5'), 89.3 (C3), 105.2 (С1'), 108.9 (C29), 118.5 (д, J = 86.3 Гц, Cipso), 130.1 (CAr), 133.3 (CAr), 135.0 (CAr), 150.4, 176.5; ЯМР 31P (CDCl3, 162 МГц): δ 23.6. MALDIMS m/z 963.6 [M-Br]+; Найдено: C, 69.4; H, 8.0; Br, 7.6 %, Вычислено для C60H84BrO8P: C, 69.0; H, 8.1; Br, 7.6 %,
Пример 2. Получение 6-трифенилфосфониогексил 3β-O-(α-L-рамнопиранозил)луп-20(29)-ен-28-оат бромид – соединения 2.
1. Получение 3β-O-(2,3,4-три-O-бензоил-α-L-рамнопиранозил) 28-O-(6-бромгексил)бетулината (7).
Раствор (3) (173 мг, 0.28 ммоль) и 2,3,4-три-О-бензоил-α-L-рамнопиранозилтрихлорацетимидата (5) (154 мг, 0.25 ммоль) в дихлорметане (15 мл) перемешивали в течение 30 мин при комнатной температуре над молекулярными ситами (4 Å, 300 мг) в атмосфере аргона, затем охлаждали до –40 °С и добавляли раствор триметилсилилтрифлата (0.15 ммоль) в дихлорметане (1 мл). Смесь перемешивали в течение 1 ч и реакцию останавливали добавлением Et3N (0.5 мл). Смесь концентрировали и остаток очищали колоночной хроматографией (петролейный эфир/EtOAc, 4:1) с получением (7) (194 мг, 72 %); [α]20D +64.2 (с, 0.8, CHCl3), ИК (KBr) νmax: 2942, 2869, 1730, 1642, 1602, 1585, 1452, 1315, 1278, 1263, 1177, 1154, 1108, 1070, 1028, 975, 711 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.91, 0.96, 0.96, 1.0, 1.01 (с, 15H, H23-27), 1.36 (д, 3Н, J = 6.3 Гц, H6'), 1.7 (s, 3H, H30), 3.0 (м, 1H, H19), 3.2 (м, 1H, H3), 3.42 (т, J = 6.7 Гц, 2H, CH2Br), 4.1 (м, 2H, С(O)OCH2), 4.3 (м, 1H, H5'), 4.6 (с, 1H, HА29), 4.7 (с, 1H, HВ29), 5.1 (д, 1H, J = 1.3 Гц, H1'), 5.67 (дд, 1Н, J = 3.2, 1.8 Гц, H2'), 5.7 (т, 1Н, J = 10 Гц, H4'), 5.85 (дд, 1Н, J = 10.1, 3.2 Гц, H3'), 7.2-8.1 (м, 15Н, HAr); Найдено: C, 70.0; H, 7.5; Br, 7.4 %, Вычислено для C63H81BrO10: C, 70.2; H, 7.6; Br, 7.4 %
2. Получение 6-трифенилфосфониогексил 3β-O-(2,3,4,-три-O-бензоил-α-L-рамнопиранозил)луп-20(29)-ен-28-оата бромида (9).
К раствору соединения (7) (172 мг, 0.16 ммоль) в 10 мл сухого ацетонитрила (10 мл) в атмосфере аргона добавляли трифенилфосфин (168 мг, 0.64 ммоль) и смесь перемешивали с обратным холодильником в течение 12–18 ч до завершения реакции (контроль по ТСХ). Ацетонитрил удаляли при пониженном давлении, осадок промывали горячим петролейным эфиром (3 х 5 мл) и растворяли в этилацетате. К реакционной смеси добавляли петролейный эфир (10 мл). Образовавшийся осадок промывали диэтиловым эфиром (3 мл) и сушили в вакууме, получая чистый (9) (178 мг, 83%); т.пл. 118 °C, [α]20D +2.3 (с 0.8, CHCl3), IR (KBr) νmax: 2925, 2868, 1728, 1641, 1602, 1586, 1452, 1439, 1377, 1315, 1262, 1216, 1177, 1110, 1070, 1028, 975, 883, 859, 802, 755, 712, 690 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.88, 0.90, 0.94, 0.97, 1.06 (с, 15H, H23-27), 1.37 (д, 3Н, J = 6.3 Гц, H6'), 1.7 (с, 3H, H30), 0.7-2.3 (м, 34H, протоны бетулинового остова и протоны (CH2)2 фрагмента линкера), 3.0 (м, 1H, H19), 3.2 (м, 1H, H3), 3.94-3.99 (м, 2H, CH2P), 4.0 (м, 2H, С(O)OCH2), 4.3 (м, 1H, H5'), 4.6 (с, 1H, HА29), 4.7 (с, 1H, HВ29), 5.1 (д, 1H, J = 1.3 Гц, H1'), 5.65-5.66 (м, 1Н, H2'), 5.7 (т, 1Н, J = 10 Гц, H4'), 5.84 (дд, 1Н, J = 10.0, 3.1 Гц, H3'), 7.25-8.13 (м, 30Н, HAr); ЯМР 13C (CDCl3, 100 МГц): 14.7, 16.0, 16.2, 16.4, 17.5, 18.3, 19.3, 20.9, 22.67, 22.70, 22.8 (d, J = 49.6 Гц, CH2-P), 25.55, 25.66, 25.78, 28.3, 28.4, 29.6, 29.9, 30.0, 30.7, 30.9, 32.1, 34.3, 37.0, 37.05, 38.2, 38.7, 39.1, 40.7, 42.4, 47.05, 49.4, 50.5, 55.5, 56.5, 63.8, 66.8 (C5'), 70.2 (C3'), 71.3 (C2'), 72.0 71.3 (C4'), 90.0 (C3), 99.75 (C1'), 109.5 (C29), 118.4 (d, J = 85.6 Гц, Cipso), 128.2-135.0 (CAr), 150.6, 165.6, 165.7, 165.8, 176.1; ЯМР 31P (CDCl3, 162 МГц): 24.9; MALDI-MS m/z 1261.3 [M – Br]+; Найдено: C, 72.4; H, 7.1; Br, 5.9 %, Вычислено для C81H96BrO10P, C, 72.6; H, 7.2; Br, 6.0 %.
3. Получение 6-трифенилфосфониогексил 3β-O-(α-L-рамнопиранозил)луп-20(29)-ен-28-оата бромида (2).
Суспензию соединения (9) (134 мг, 0.1 ммоль) и K2CO3 (25 мг) в MeOH (5 мл) перемешивали в течение 1 ч, затем нейтрализовали смолой Amberlyst 15 (H+-форма), фильтровали и концентрировали. Остаток очищали колоночной хроматографией (CH2Cl2/MeOH (100:10–100:0) с получением (2) в виде аморфного порошка (66 мг, 65 %); т.пл. 110 °C, [α]20D –2 (с 0.4, CHCl3), ИК (KBr) νmax: 3395, 2934, 2870, 1719, 1639, 1439, 1385, 1318, 1262, 1113, 1051, 984, 904, 807, 774, 691 см–1; ЯМР 1H (CDCl3, 400 МГц): δ 0.75, 0.81, 0.88, 0.92, 0.97 (с, 15H, H23-27), 1.28 (д, 3Н, J = 6.1 Гц, H6'), 1.70 (с, 3H, H30), 0.7-2.36 (м, 34H, протоны бетулинового остова и протоны (CH2)2 фрагмента линкера), 2.9 (м, 1H, H19), 3.07 (дд, 1Н, J = 11.0, 4.7 Гц, H3), 3.46 (т, 1Н, J = 9.8 Гц, H4'), 3.75-3.94 (м, 3Н, H3',5',2'), 3.96 (м, 2Н, CH2P), 4.0 (м, 2H, С(O)OCH2), 4.6 (с, 1H, HА29), 4.7 (с, 1H, HВ29), 4.8 (с, 1H, H1'), 7.7-7.9 (м, 15Н, HAr); ЯМР 13C (CDCl3, 100 MHz): 14.5, 15.8, 16.0, 17.0, 18.1, 19.0, 20.8, 22.41, 22.45, 22.57, 22.6 (д, J = 51.3 Гц, CH2-P), 25.37, 25.41, 27.9, 28.3. 29.54, 29.58, 30.0, 30.16, 30.5, 32.0, 34.24, 36.8, 37.0, 38.3, 38.6, 38.95, 40.66, 42.34, 47.0, 50.3, 55.4, 56.55, 63.46, 68.13 (C5'), 70.97 (C3'), 71.46 (C2'), 72.84 (C4'), 89.13 (C3), 102.5 (C1'),109.5 (C29), 117.8 (д, J = 91.3 Гц, Cipso), 130.6 ( CAr), 133.3 ( CAr), 135.5 ( CAr), 150.4, 176.5; ЯМР 31P (CDCl3, 162 МГц): 23.5; MALDI-MS m/z 947.6 [M – Br]+; Найдено: C, 71.9; H, 8.2; Br, 7.7%, Вычислено для C60H84BrO7P: C, 70.0; H, 8.2; Br, 7.7%.
Пример 3. Исследование цитотоксической активности соединений 1 – 2.
Цитотоксическую активность соединений 1 – 2 оценивали на микропланшетном анализаторе Infinite 200 PRO (TECAN) с помощью теста на жизнеспособность с использованием индикатора МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-тетразолий бромид)), реагирующего с жизнеспособными клетками с образованием окрашенного продукта [O.V. Tsepaeva, A.V. Nemtarev, T.I. Abdullin, L.R. Grigor’eva, T.I. Salikhova. S.A. Khozyainova, V.F. Mironov. Synthesis, anticancer, and antibacterial activity of betulinic and betulonic acid c-28-triphenylphosphonium conjugates with variable alkyl linker length. Anticancer agents in Med. Chem. 2020. Vol. 20(3). P. 286-300].
Использовали линии опухолевых клеток: аденокарцинома молочной железы человека MCF-7, аденокарцинома предстательной железы человека PC-3, колоректальная аденокарцинома человека CaCo-2. Клетки культивировали в питательной среде DMEM c добавлением 10% эмбриональной сыворотки крови, 4.5 г/л глюкозы, 4 мМ L-глутамина, пенициллин+стрептомицин 100 ЕД/мл в стерильных условиях. Клетки культивировали в CO2-инкубаторе при 37°С.
Исходные растворы соединений готовили в диметилсульфоксиде с последующим разбавлением до рабочих концентраций в изотоническом растворе. Клетки культивировали в присутствии тестируемых соединений в течение 72 ч и оценивали их жизнеспособность относительно контрольных необработанных клеток (жизнеспособность 100%). Определяли полумаксимальные ингибирующие концентрации (IC50), т.е. концентрации, ингибирующие жизнеспособность клеток на 50%, с помощью программы GraphPad Prizm (Фиг. 1).
Результаты демонстрируют, что соединение 1 обладает более низкими значениями IC50, а соединение 2 – сопоставимыми значениями IC50 в сравнении с соединением А-7 (Таблица 1 на Фиг. 1). Следовательно, из заявленных соединений, по меньшей мере, соединение 1 превосходит по своей цитотоксической активности прототип. Результаты Примера 3 следует рассматривать в совокупности с данными Примера 4 (Таблица 2 на Фиг. 2).
Пример 4. Изучение влияния соединений 1 – 2 на трансмембранный потенциал митохондрий.
Анализ производили методом проточной цитофлуориметрии, позволяющим регистрировать флуоресценцию отдельных клеток в суспензии, на приборе Guava easyCyte 8HT (Merck Millipore) с использованием тетраметилродамина, этилового эфира (TMRE) – флуоресцентного индикатора трансмембранного потенциала митохондрий.
Выращенные клетки РС-3 диссоциировали с помощью раствора трипсин-ЭДТА, промывали изотоническим раствором и суспендировали с плотностью 1×106 клеток в 1 мл. Суспензию клеток смешивали с заявленными соединениями в конечной концентрации 30 мкМ и инкубировали при 37 °C в течение 1 ч. Для анализа трансмембранного потенциала митохондрий обработанные таким образом клетки окрашивали TMRE в конечной концентрации 0.1 мкM в течение 20 мин при 37°C. В качестве сигнала регистрировали флуоресценцию TMRE в клетках (Фиг. 2), величина которой прямо пропорциональна трансмембранному потенциалу митохондрий.
Известно, что этот потенциал связан с митохондриальной активностью клеток и выработкой ими энергетических молекул. Значительное снижение трансмембранного потенциала (деполяризация) митохондрий нарушает жизнеспособность клеток, вызывает активацию апоптоза и служит важным показателем противоопухолевого действия ТФФ производных [O.V. Tsepaeva, A.V. Nemtarev, T.I. Abdullin, L.R. Grigor’eva, T.I. Salikhova, S.A. Khozyainova, V.F. Mironov. Synthesis, anticancer, and antibacterial activity of betulinic and betulonic acid c-28-triphenylphosphonium conjugates with variable alkyl linker length. Anticancer agents in Med. Chem. 2020. Vol. 20. P. 286; I. Antipin, D. Ponomaryov, L. Grigor'eva, T. Salikhova, R. Ali, T. Dang, O. Tsepaeva, A. Nemtarev, T. Abdullin, V. Mironov, Anti-tumor activity of triphenylphosphonium conjugates of betulinic acid and their effect on ROS level in mitochondria. Eur J Clin Inv. 2019. Vol. 49. P. 60].
Результаты демонстрируют, что соединения 1 и 2 вызывают значительное понижение флуоресценции индикатора TMRE в опухолевых клетках, которое свидетельствует о значительном понижении трансмембранного потенциала (деполяризации) митохондрий. При этом эффект соединений 1 и 2 существенно превосходит таковой для соединения А-7 (Таблица 2 на Фиг.2). Следовательно, оба заявленных соединения обладают повышенной противоопухолевой активностью по сравнению с прототипом.
Пример 5. Изучение клеточного накопления соединений 1 – 2.
Анализ клеточного проникновения соединений 1 – 2 производили методом хромато-масс-спектрометрии с использованием высокоэффективной жидкостной хроматографической системы Infinity 1290 (Agilent) в сочетании с трехквадрупольным масс-спектрометром, оснащенным источником ионизации электрораспылением QTRAP 6500 (ABSciex). Параметры детектирования ионизированных соединений оптимизировали с использованием программного обеспечения Analyst 1.6.2. Хроматографическое разделение соединения проводили на гидрофобной колонке Discovery HS C18 (3 мкм, 5 см × 2.1 мм) (Supelco) с подвижными фазами, состоящими из A (95% воды, 5% метанола, 5 мМ ацетата аммония) и B (50% метанола, 50% изопропанола, 5 мМ ацетат аммония).
Выращенные клетки PC-3 диссоциировали с использованием раствора трипсина и этилендиаминтетраацетата, промывали изотоническим раствором и супендировали с плотностью 1×106 клеток в 1 мл. Суспензию клеток инкубировали в присутствии соединений в конечной концентрации 1 мкМ в СО2-инкубаторе при 37°C в течение 1 ч. Обработанные клетки промывали центрифугированием далее лизировали в смеси метанол-вода в условиях ультразвуковой обработки. Лизат клеток центрифугировали, и отбирали надосадочный раствор для анализа соединений. Концентрации соединений определяли по калибровочному графику, полученному с использованием стандартных растворов соединений с известной концентрацией (Таблица 3 на Фиг. 3).
Результаты демонстрируют, что соединения 1 и 2 характеризуются значительно более высокими клеточными концентрациями, чем соединение А-7. Следовательно, заявленные соединения обладают повышенным клеточным накоплением по сравнению с прототипом. Это показывает, что дополнительная гликозидная группа в ТФФ производных бетулиновой кислоты (соединениях 1 и 2) еще более усиливает доставку соединений в опухолевые клеток. Усиливающий доставку эффект гликозидных групп (D-глюкозы и L-рамнозы), по-видимому, связан с их распознаванием мембранными транспортерами, осуществляющими активный транспорт заявленных соединений внутрь клеток. Этот эффект, по-видимому, вносит вклад в выявленную повышенную специфическую противоопухолевую активность заявленных соединений по сравнению с прототипом (Таблица 1 на Фиг. 1, Таблица 2 на Фиг. 2).
Таким образом, изложенное выше позволяет сделать вывод о том, что заявителем достигнут заявленный технический результат, а именно созданы новые фосфониевые соли на основе гликозидов бетулиновой кислоты, характеризующиеся повышенным клеточным проникновением и цитотоксическим действием в отношении опухолевых клеток (вследствие наличия биологически распознающего компонента – фрагментов D-глюкопиранозы и L-рамнопиранозы). Заявленные соединения устраняют недостатки ТФФ производных бетулиновой кислоты по прототипу RU2665922.
Заявленное техническое решение соответствует условию патентоспособности «новизна», предъявляемому к изобретениям, так как из исследованного заявителем уровня техники не выявлены технические решения, обладающие заявленной совокупностью признаков и полученными техническими результатами.
Заявленное техническое решение соответствует условию патентоспособности «изобретательский уровень», предъявляемому к изобретениям, так как не является очевидным для специалистов в данной области науки и техники, а в существующем уровне техники не были известны гликозидные производные бетулиновой кислоты заявленного состава, обладающие противоопухолевой активностью.
Заявленное техническое решение соответствует условию патентоспособности «промышленная применимость», предъявляемому к изобретениям, так как заявленное техническое решение может быть реализовано в различных химических, медицинских и фармацевтических предприятиях с применением известных соединений, материалов и технологического оборудования.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы | 2018 |
|
RU2665922C1 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВООПУХОЛЕВЫХ ВЕЩЕСТВ | 2012 |
|
RU2551647C2 |
| КОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ И (Е)-4-(1Н-ИНДОЛ-3-ИЛВИНИЛ)-ПИРИДИНИЙ БРОМИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2786134C2 |
| ТРИФЕНИЛФОСФОНИЕВЫЕ СОЛИ ЛУПАНОВЫХ И УРСАНОВЫХ ТРИТЕРПЕНОИДОВ, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ШИСТОСОМОЗА | 2013 |
|
RU2576658C2 |
| N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-2,2,6,6-ТЕТРАМЕТИЛПИПЕРИДИН-4-ИЛАМИН, ОБЛАДАЮЩИЙ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ОПУХОЛЕВЫХ КЛЕТОК ЧЕЛОВЕКА | 2017 |
|
RU2641900C1 |
| Низкотоксичные аминофосфониевые соли, обладающие противоопухолевой активностью, и способ их получения | 2024 |
|
RU2836726C1 |
| МЕТИЛОВЫЙ ЭФИР 24-ДИБРОМ-4-ОКСО-2-ЦИАНО-3,23-ДИНОРЛУП-28-ОВОЙ КИСЛОТЫ, ПРОЯВЛЯЮЩИЙ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2022 |
|
RU2784317C1 |
| Фосфониевые соли на основе алантолактона, обладающие противоопухолевой активностью, и способ их получения | 2023 |
|
RU2818095C1 |
| МЕТИЛОВЫЕ ЭФИРЫ 3-МЕТИЛ-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ И 3-БРОММЕТИЛЕН-3-ОКСО-1-ЦИАНО-2,3-СЕКО-2-НОРЛУП-20(29)-ЕН-30-АЛЬ-28-ОВОЙ КИСЛОТ, ПРОЯВЛЯЮЩИЕ ЦИТОТОКСИЧЕСКУЮ АКТИВНОСТЬ | 2016 |
|
RU2632002C1 |
| Бромсодержащие пространственно-затрудненные фенолы, обладающие противоопухолевой активностью | 2023 |
|
RU2822270C1 |


Изобретение относится к области органической химии и фармацевтики, а именно к новым фосфониевым солям на основе гликозидов бетулиновой кислоты. Раскрываются фосфониевые соли на основе гликозидов бетулиновой кислоты формулы 1–2. Изобретение обеспечивает эффективную противоопухолевую активность. 1 з.п. ф-лы, 3 ил., 5 пр.
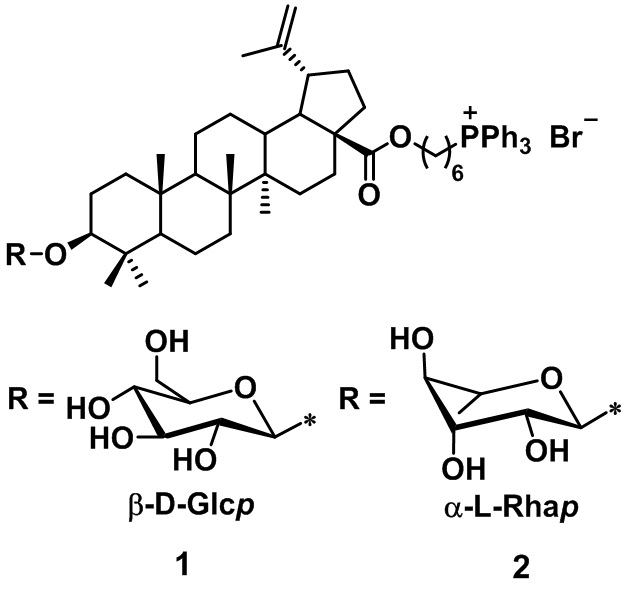
1. Фосфониевые соли на основе гликозидов бетулиновой кислоты формулы 1 – 2:
2. Фосфониевые соли на основе гликозидов бетулиновой кислоты по п. 1, обладающие противоопухолевой активностью.
| TSEPAEVA O.V | |||
| et al | |||
| Synthesis of novel mannopyranosyl betulinic acid phosphoniohexyl ester | |||
| Mendeleev Communications, 2021, vol.31(1), pp.110-112 | |||
| NEDOPEKINA D.A | |||
| et al | |||
| Mitochondria-targeted betulinic and ursolic acid derivatives: synthesis and anticancer activity | |||
| Med | |||
| Chem | |||
| Commun, 2017, no.8, pp.1934-1945 | |||
| Фосфониевые соли на основе бетулиновой кислоты, обладающие цитотоксической активностью в отношении аденокарциномы предстательной железы | 2018 |
|
RU2665922C1 |
| RU | |||
Авторы
Даты
2023-09-19—Публикация
2022-12-23—Подача