Данное изобретение относится к идентификации анализируемых химических, органических и биологических объектов. В частности, изобретение касается распознавания биомаркеров и представляет устройство для точного определения низких концентраций молекулярных биомаркеров в образцах жидких сред.
Одной из перспективных областей применения такой методики распознавания является диагностика болезней с помощью молекул биомаркеров. Существующие подходы к диагностике хронических заболеваний (например, туберкулеза) часто основаны на сложных лабораторных исследованиях проб крови, мочи или ткани пациента. В приведенном примере с туберкулезом (ТВ) традиционно применяют исследование под микроскопом мазка мокроты на обнаружение бацилл Mycobacterium tuberculosis или кожную туберкулиновую пробу.
Следует принимать во внимание, что проведение подобного рода сложных лабораторных исследований в непосредственной близости от пациента не всегда возможно, требуется дорогостоящее оборудование, высококвалифицированный персонал. Необходима развитая инфраструктура для транспортировки проб от места взятия у пациентов в диагностических центрах до аналитической лаборатории и возврата результатов анализа через определенное времени к месту нахождения пациентов.
Известно, что такие хронические заболевания, как туберкулез, распространены преимущественно в развивающихся странах, где трудно обеспечить описанные выше условия лабораторного обследования. Создание эффективной сети лабораторий, закрывающей потребности всего населения этих стран, может быть осложнено дороговизной лабораторно-диагностического оборудования или нехваткой квалифицированного персонала. Проблемы могут возникнуть как на этапе транспортировки проб от медицинских пунктов их отбора до лабораторий, так и на этапе последующего розыска - по причине миграции населения - инфицированных пациентов через период времени до нескольких недель готовых результатов анализа по месту взятия проб.
Ограниченный доступ к современным методам исследования в странах с эндемичными заболеваниями означает выполнение программ выявления туберкулеза в этих странах с применением устаревших и неточных методик, таких как микроскопия мазка, твердая культура, рентгенография грудной клетки и кожная проба. Например, известно, что используемая с прежних времен туберкулиновая кожная проба при выявлении туберкулеза имеет тот недостаток, что не позволяет устанавливать различие между латентной и активной стадиями туберкулеза. Анализ мазка мокроты точен лишь в пределах от половины до трех четвертей случаев, а чтобы отличить М. tuberculosis от других микобактерий, необходимы большое количество организмов, присутствующих в образце, и лаборант, квалифицировано владеющий микроскопом.
В отличие от известных методик, требующих централизованные лабораторные исследования, в качестве нового способа диагностирования заболеваний привлекательна возможность использования молекулярных биомаркеров. Быстро развивающаяся область протеомики [биохимии структуры и анализа животных белков] показывает, что многие болезни могут быть распознаны тестированием на наличие молекулярных биомаркеров в биологических жидкостях - в плазме крови, моче или слюне.
Одним из биомаркеров, содействующих обнаружению туберкулеза, является неоптерин, катаболический продукт, синтезируемый макрофагами (лейкоцитами) в ответ на возбуждение сигнальной молекулой интерферона. Известно, что наличие неоптерина указывает на воспалительный иммунный ответ, а одной из болезней, продуцирующей неоптерин, является туберкулез. Другими известными маркерами активации макрофагов являются прокальцитонин, С-реактивный белок, растворимая молекула межклеточной адгезии 1, растворимый рецептор активатора плазминогена урокиназы и моноцит CDIIc66.
Еще одним биомаркером, способствующим детекции туберкулеза является тромбин, фактор свертывания крови, влияющий на фибриноген с образованием фибрина, фибриллярного белка, участвующего в свертывании крови, уровень которого также повышен у больных туберкулезом. Существует широкий и постоянно растущий диапазон молекулярных биомаркеров, применяемых в диагностике болезней, среди которых два названных выше биомаркера являются лишь примерами. Другими примерами могут служить лизоцим и никотинамид-аденин-динуклеотид (NAD).
Следует также принимать во внимание, что выраженность различных биомаркеров может варьироваться в зависимости от стадии заболевания. В частности, уровень неоптерина, повышенный при постановке диагноза в зависимости от степени патологии, снижается в течение и после курса терапии. Последующее увеличение уровня неоптерина связано с рецидивом. Следовательно, при диагностике большое значение имеет длительное квантитативное измерение.
Другие биомаркеры могут быть идентифицированы в микробных маркерах в мокроте, в микробных маркерах в моче, в туберкулез-специфических Т-клетках и других маркерах активации макрофагов. Показатели риска реактивации, как и ликвидации латентной инфекции туберкулеза, также могут быть предсказаны с помощью, например, гамма-интерферона или неоптерина. Биомаркеры могут быть использованы для оценки эффективности вакцины, например, путем мониторинга полифункциональных Т-клеток.
Большая специфичность тестирования и прогностическая достоверность могут быть достигнуты за счет совокупного приложения неспецифических биомаркеров, относящихся к туберкулезу путем измерения множества параметров, полученных методами протеомики (комплексного исследование белков), метаболомики (изучения химических следов специфических клеточных процессов) и транскриптомики (исследования мРНК для генной транскрипции).
Например, один из способов идентификации биомаркеров с использованием ДНК-подобных молекул представлен в публикации WO 2007/001401 (Dupont/Boussard и др.), где используются олигонуклеотиды на углеродных нанотрубках. Аптамеры представляют собой синтетические олигонуклеотиды (короткие полимеры нуклеиновых кислот), лиганды или пептиды, изолированные или образованные, в частности, методом SELEX [systematic evolution of ligands by exponential enrichment = систематическая эволюция лигандов при экспоненциальном обогащении], нацеленные на такие разнообразные мишени, как органические микромодули, токсины, бактериальные и вирусные белки, вирус-инфицированные клетки, раковые клетки и патогенные организмы. Они имеют определенные формы и связывают функциональные участки на соответствующих им мишенях с аффинностью и специфичностью, зачастую превышающими таковые многих более широко распространенных реагентов антител. Аптамеры нуклеиновых кислот легко изолируются в ходе полуавтоматического процесса исключительно in vitro, что устраняет необходимость в опытах на животных. Дальнейшая характеризация позволяет минимизировать их до такой степени, что, применяя технологии химического синтеза, их можно будет выпускать граммами. Они легко сцепляются с другими последовательностями нуклеиновых кислот, позволяя создавать бифункциональные разновидности. Химическая функционализация аптамеров (= наделение аптамеров целевыми химическими свойствами), обеспечивающая целенаправленную иммобилизацию и детектирование, также не представляет трудность. Можно синтезировать аптамер, функционально направленный на конъюгацию с одним из индицирующих болезнь биомаркеров, о которых говорилось выше, например, с тромбином или неоптерином.
Для введения в раствор, предположительно содержащий молекулы-мишени, аптамеры должны быть связаны с или "установлены на" соответствующей подложке. Для обнаружения случая связывания предпочтительно использовать проводящую или полупроводящую подложку с большой удельной поверхностью. Одним из перспективных материалов для подложки являются наноразмерные углеродные трубки.
Углеродные нанотрубки хорошо известны как аллотроп углерода с цилиндрической структурой. Для прикрепления аптамера к нанотрубкам может быть применен как ковалентный, так и нековалентный подход. Например, "опорная" химическая структура может быть присоединена к неспецифическому для биомаркера концу молекулы аптамера посредством компаунда, например, антрацена, который затем вступит в контакт с поверхностью углеродной нанотрубки, покрывая ее слоем специфического аптамера. Предположим, если углеродные нанотрубки с полупроводящими свойствами, покрытые аптамером, ввести в анализируемое вещество, на которое нацелен нанесенный слой аптамера, то частотность случаев соединения и изменения удельной электропроводности покрытого аптамером углеродного нанопроводника или нанотрубки будут отслеживаться электронными средствами, допустим, через изменение удельной электропроводности, емкости, сопротивления или индуктивности при высокочастотном переменном токе. Случаи аптамерного соединения могут влиять также на проводимость металлических нанотрубок.
Описанные выше углеродные нанотрубки с аптамерным покрытием могут быть смонтированы на затворе полевого транзистора для формирования канала. Полевой транзистор (ПТ) с углеродными нанотрубками (УНТ) (ПТ-УНТ / CNT-FET) с областями истока, стока и контактом нижнего затвора, с областью канала, выполненной из нитей углеродной нанотрубки с аптамерным покрытием, рассматривается в патенте США №7,854,826 (So et al. / Korea Research Institute of Chemical Technology).
При том, что подобные детекторы весьма перспективны, они вариабельны по точности и чувствительности. Это обусловлено индивидуальными особенностями, вариативностью концентрации электролита, колебаниями температуры, геометрией и другими факторами.
Следует учитывать, что химические характеристики биологических жидкостей, содержащих интересующие биомаркеры будут меняться; от индивида к индивиду в биологических жидкостях будут варьироваться концентрации электролитов и других молекул, таких как белки и ферменты. В отсутствие способов контроля подобных побочных эффектов определение наличия биомаркеров выглядит ненадежным.
Желательно повысить надежность детекторов этого типа, и, в особенности, представить детектор биомаркеров, обеспечивающий возможность в сложных ситуациях, рассмотренных выше, недорого, быстро и достоверно распознавать болезни без привлечения квалифицированного лабораторного персонала.
Краткое описание изобретения
Согласно заявляемому изобретению представлено устройство по пункту 1 и способ по пункту 26 патентной формулы.
В изобретении использована система эталонных ссылок, снижающая вероятность случаев обнаружения ложных биомаркеров. В вариантах осуществления изобретения использована покрытая аптамером проводящая или полупроводящая база или основа, например, решетка или отложение наноразмерных углеродных трубок, или пластинчатая структура типа графена, или полупроводящая ДНК, или другие "нанопроводники", для формирования структуры одного датчика и структуры второго датчика, в целом идентичного, но "кэппированного" (защищенного, блокированного), что означает, что у аптамера способность распознавать молекулы-мишени предварительно заблокирована, например, посредством нанесения на него покрытия из или его конъюгации или его соединения с молекулами-мишенями, или конъюгации с комплементарной нитью ДНК, или посредством его мутантной версии, отличающейся несколькими основаниями. К примерам конъюгации, среди прочего, можно причислить применение стандартного фотосшивания последовательности аптамера с его мишенью, или сохранение защитного комплементарного олиго[нуклеотида] в цепочке аптамера; можно также использовать вариант последовательности аптамера, который предотвращает связывание. В присутствии молекул-мишеней или диагностируемых биомаркеров, связывающихся с аптамером, происходит перенос электронов и изменение проводимости подложки. Можно сказать, что полупроводящая основа действует как канал полевого транзистора или ПТ-УНТ / CNT-FET. Такие изменения могут фиксироваться соответствующей встраиваемой в устройство схемотехникой, сопряженной с системой электродов. Затем, показания, считываемые "живым" датчиком, интерпретируются путем сравнения с "предконъюгированным" (эталонным) датчиком. Поскольку оба датчика в паре находятся в идентичных молекулярных средах, т.е. - в одном пространстве измерений, другие изменения, например, являющиеся следствием применения электролитов в образцах жидкостей исключаются.
При том, что аптамеры являются предпочтительной формой специфического и недорогого детектора молекулы-мишени, предусмотрены также другие молекулы - или структуры-рецепторы биомаркеров, например, даже - антитела или пептидные аптамеры, при условии, что в процессе образования связи формируется достаточный электрический сигнал.
Иногда желателен одновременный поиск нескольких биомаркеров, поскольку такое сочетание биомаркеров более точно индицирует наличие хронического состояния, скажем, туберкулеза; с учетом этого некоторые конструктивные решения детектора предусматривают несколько пар датчиков, позволяющих легко и надежно обнаруживать множество биомаркеров одновременно.
При этом, например, каждый из детекторов, чувствительных к биомаркеру, будет размещен рядом с детектором, сатурированным биомаркером. Такие контрольные детекторы идентичны детекторам биомаркеров с той существенной разницей, что в контрольных электродах применены аптамеры, уже связанные со своей мишенью посредством, например, фотосшивания, введения несоединяемого варианта последовательности или сохранения основы, спаренной с комплементарной нитью, таким образом, что они "кэппированы" (защищены, блокированы) и не могут участвовать в реакциях диагностического теста. Таким образом, аптамер предварительно связан с молекулой-мишенью или биологическим объектом. Кроме указанного различия, эталонный детектор наравне с активным детектором биомаркера проходит анализ на электрическую проводимость, емкость и т.п. Целью этого является то, что каждый из множества, например, пяти, детекторов биомаркеров имеет встроенный эталон положительного результата обнаружения анализируемого вещества с учетом тех же паразитных эффектов, которые воздействуют на весь детектор. За счет этого выполняется „управляющее" сравнение, которое обеспечивает устранение паразитных эффектов первого порядка, возникающих вследствие вариативности индивидов или условий отбора проб, и - посредством этого - калибрование каждого случая распознавания биомаркера.
Существуют различные способы покрытия подложки аптамерами. В качестве альтернативы применению углеродной нанотрубки (или графена) с покрытием аптамером, специфическим к биомаркеру, предусмотрена возможность, сначала, посредством аптамера „функционализировать" (задать определенные функции) нить ДНК, используемую исключительно как основу, а затем, обмотать функционализированной нитью ДНК подложку из углеродной нанотрубки (или сначала нить может быть намотана, а затем функционализирована). Аптамер, специфический к биомаркеру, и кэппированный аптамер могут быть присоединены к группам ДНК с применением клик-химии. Еще одной возможностью является присоединение аптамера к нанотрубкам через стрептавидин-биотиновую связь, где один из этих элементов функционализирован на аптамер, а другой элемент прикреплен к нанотрубкам через ковалентную или нековалентную связь. Как вариант, металлизированный нанопроводник ДНК может быть непосредственно покрыт аптамером и кэппированным аптамером. Кроме того, может быть использован электропроводящий полимер, покрытый аптамером или кэппированным аптамером.
Как упоминалось ранее, соединение биомаркеров-мишеней с их специфическими аптамерами вызывает небольшое, но ощутимое изменение электрических характеристик в электродах. При необходимости этот сигнал может быть усилен, например, путем превращения электродов в терминалы истока-стока ПТ-УНТ (CNT-FET). После того, как проба выведена на множество специфических для биомаркера датчиков и соответствующих им эталонов, выполняется запрос ПТ-УНТ/CNT-FET на оценку изменений их электрических характеристик. Такие измерения могут иметь форму как простой проверки электропроводности с помощью источника постоянного тока, так и более сложного замера сопротивления на определенных частотах или в диапазоне частот. Таким же образом должны быть протестированы множественные эталонные датчики с целью устранения возможных паразитных фоновых эффектов в показателях концентрации биомаркера "живого" датчика.
В одном из вариантов конструкции золотые контакты истока и стока ПТ-УНТ/CNT-FET размещены в виде травленой встречно-гребенчатой структуры на кремниевой подложке с проходящими поверх углеродными нанотрубками с аптамерным покрытием, образующими разновидность канала или полупроводникового моста. При использовании углеродных нанотрубок со смешанной природой электропроводности предпочтительно, чтобы интервал встречно-гребенчатой структуры превышал длину отдельной нанотрубки во избежание замыкания электродов одной металлической нанотрубкой, что будет восприниматься как примесь.
Таким образом, структура датчика (12) может быть выполнена на полупроводниковой основе, покрытой молекулами, способными к соединению с биомаркером, при этом полупроводниковая основа может иметь каркас из углеродных нанотрубок (УНТ) или представлять собой ДНК-каркас, покрытый, например, ПВФ (поли-4-винилфенолом), Al (алюминием) или Si (кремнием), образующий "нанопроводник", обеспечивающий улучшенное качество измерения электрических эффектов.
В альтернативной схеме устройства обнаружения применена полимерная подложка с золотыми электродными парами, размещенными в виде решетчатой структуры, а углеродные нанотрубки, покрытые аптамером, проложены над встречно-гребенчатой структурой. Известно много возможных вариантов; при этом в каждом случае используются пары датчиков, включенные в соответствующие контуры, обеспечивающие калиброванный результат.
В заявленном устройстве конъюгирующие молекулы могут быть ассоциированы с биомаркерами, генерируемыми под воздействием патологических процессов, таких как туберкулез, гепатит В или гепатит С, или возникающими из-за нарушения других биологических процессов в результате, например, воздействия вредных для живых организмов веществ, таких как зарин, VX или рицин.
Для автоматического выполнения измерений и получения результатов, рассмотренных выше, предусмотрено схемотехническое обеспечение интерфейса с матрицей ПТ-УНТ (CNT-FET), включая, в частности, переключатели, источники сигнала, усилители, аналого-цифровые преобразователи и микропроцессоры.
Устройство может предусматривать проверку в начале работы годности взятого для исследования образца посредством контроля содержания электролита перед измерениями в процессе конъюгации (в случае образования связи). Для проверки перед началом измерения наличия на головке датчика надлежащего количества опытной биологической жидкости (мокроты, мочи, крови и т.п.) предусмотрена логическая схема, обеспечивающая встроенную функцию самотестирования. После начальной активации регистрируют изменение проводимости контрольного электрода каждого детектора и сравнивают с известным диапазоном, получая данные о наличии на детекторе достаточного количества жидкой пробы, что обеспечивает достоверность последующих измерений. Схема выполняет измерение сухой удельной электропроводности всех дорожек, проверяя работоспособность системы. После взаимодействия с детектором биологической жидкости, например, слюны, проверяют изменение удельной электропроводности, которая должна превышать предварительно заданный уровень. С помощью усилительной схемы выполняют проверку соответствия динамических диапазонов электрических сигналов по каждому чувствительному элементу. Некоторые жидкостные среды после предварительной обработки в соответствующем буфере могут потребовать селективную фильтрацию, например, для удаления клеточных примесей.
Чтобы удовлетворять заявленным качествам дешевого мобильного диагностического прибора для оперативной обработки проб в пунктах медицинского обслуживания минимально подготовленным персоналом, вся компоновка подложки с датчиками и схемотехнических контуров, рассмотренных ранее, может быть встроена в литой корпус наподобие известных цифровых карт памяти для фотокамер. Набор чувствительных элементов углублен в мелкий желоб для обеспечения контакта пробы жидкости тела с батареей ПТ-УНТ с аптамерным покрытием. Съемная изолирующая пленка покрывает активную область детектора, предотвращая проникновение посторонних включений. Конструкция предусматривает вывод на одну из сторон или концов литого корпуса разъема для соединения схемы детектора с мобильным устройством, таким как смартфон, для обеспечения интерфейса соответствующих данных и протоколов. В другом варианте осуществления литой корпус датчика скомпонован в виде "щупа", предназначенного для погружения и исследования растворов таких жидкостей, как моча. Из-за малых размеров детектора плате чувствительных элементов в гнезде разъема должна быть обеспечена устойчивая механическая опора.
Важно, что результаты, полученные детектором, могут быть загружены на смартфон или другое портативное устройство для сбора, отображения или анализа. Более того, данные могут быть отправлены через любое общедоступное устройство радиосвязи и встроенный в смартфон стек TCP/IP на центральный сервер. Устройство также может предусматривать использование программного обеспечения для автоматизированного сбора информации и обмена данными. При этом обеспечивают наличие разъема для интерфейса с считывающим устройством, которое выполняет расчеты по показаниям системы датчиков и выводит заключение или определяет диагноз.
Краткое описание фигур
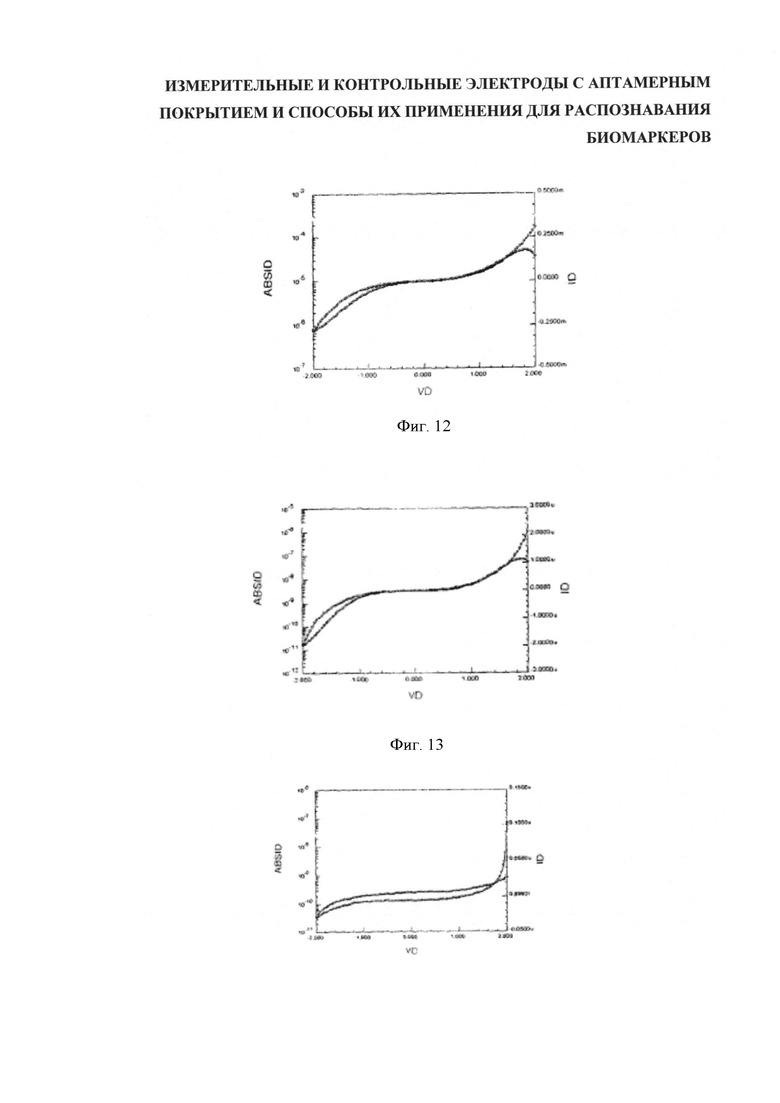
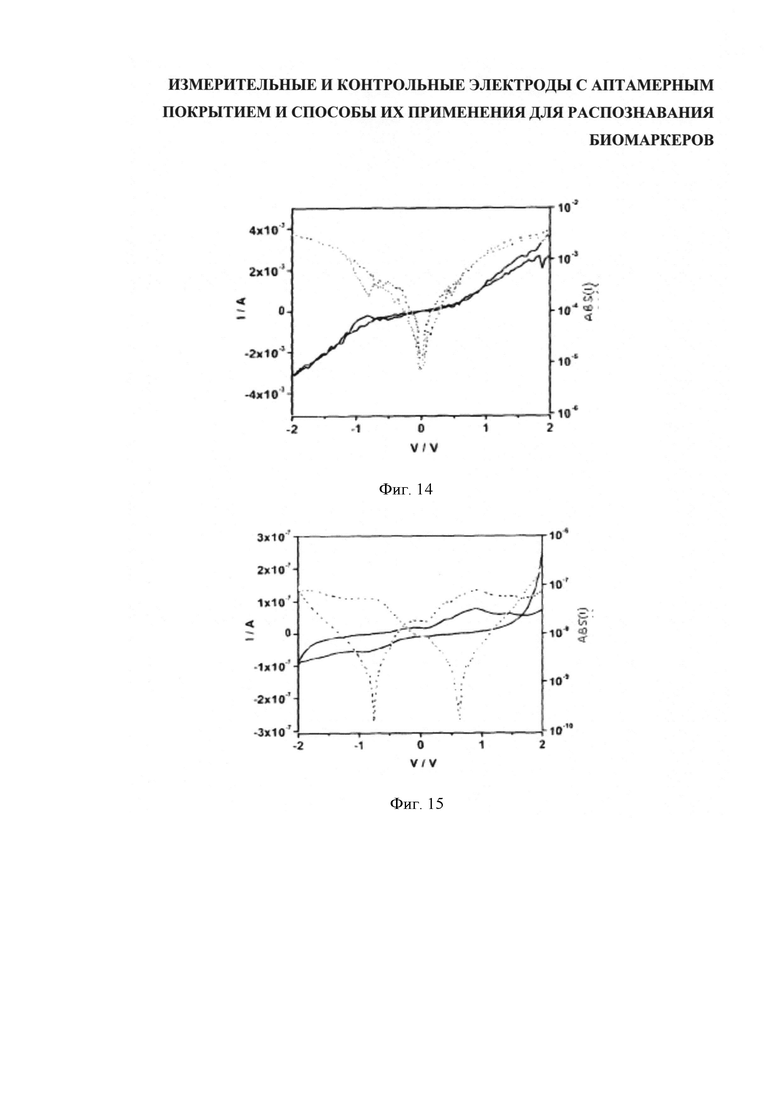
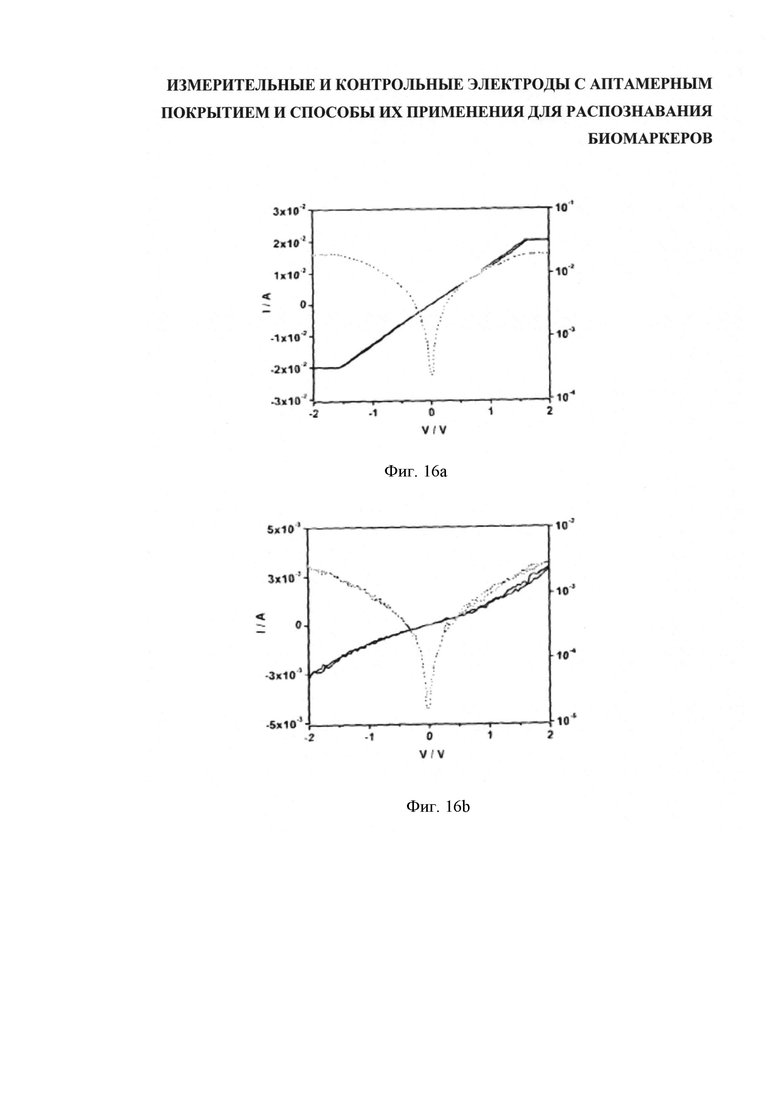
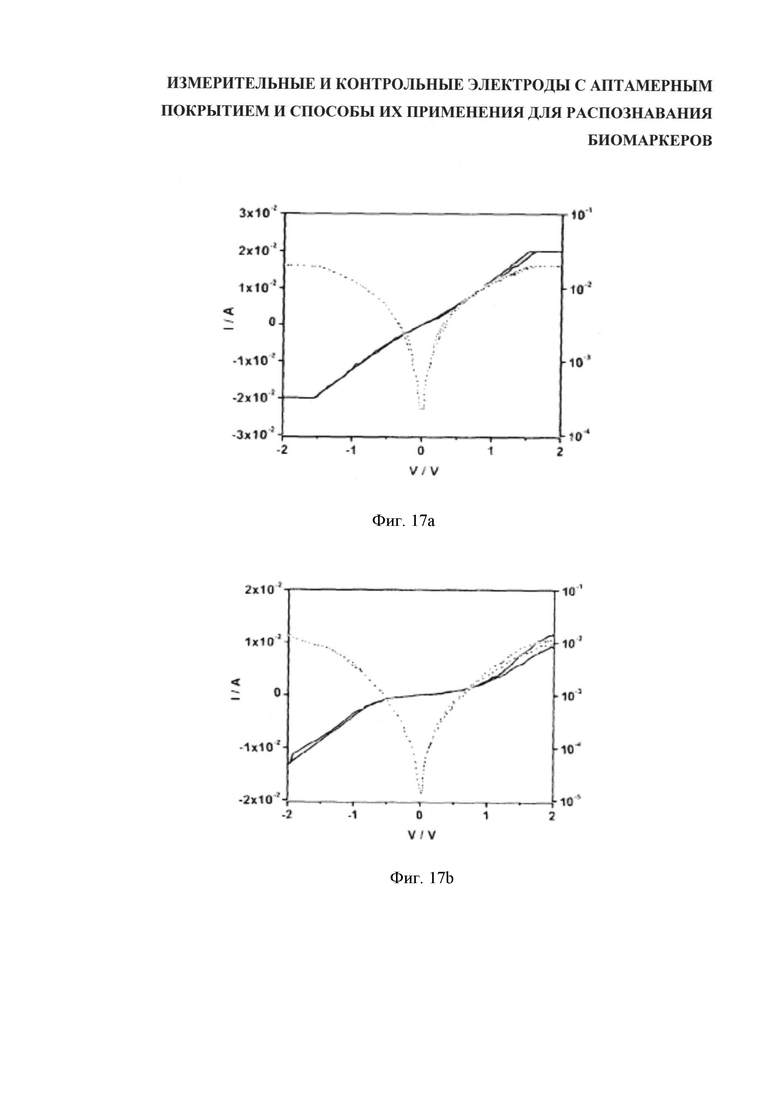
Для лучшего понимания изобретения и демонстрации возможности его практической реализации далее будет делаться ссылка на примеры, отображенные на сопроводительных фигурах, где: на фигуре 1 (Figure 1) показан вид сбоку варианта компоновки, имеющего литой корпус, содержащий подложку, датчики и уплотняющую пленку; на фигуре 2 (Figure 2) показан вид сверху расположения контрольных и измерительных электродов; на фигуре 3 (Figure 3) показан вид сверху варианта исполнения подложки с пятью парными датчиками с контрольным электродом каждый; на фигуре 4 (Figure 4) дан вид спереди и сверху примерной схемы прикрепления аптамера к каркасу из углеродных нанотрубок; на фигуре 5 (Figure 5) представлены три разных варианта сочетания аптамер-биомаркер на каркасе ДНК; на фигуре 6 (Figure 6) показана сравнительная локализация кэппированного и некэппированного биомаркеров относительно каркаса ДНК контрольного и измерительного электродов; на фигуре 7(а-е) (Figure 7(а-е)) пошагово представлена последовательность формирования функционализированных углеродных нанотрубок (УНТ/CNT) с применением клик-химии; на фигуре 8 (Figure 8) показана схема системы управления датчиками, обеспечивающая последующую обработку результатов и двухстороннюю информационную связь со средствами обработки данных; на фигуре 9 (Figure 9) дано полученное атомно-силовой микроскопией изображение одностенных углеродных нанотрубок, которые были диспергированы с использованием однонитевой спермы сельди и затем высушены на подложке; на фигуре 10 (Figure 10) показана схема встречногребенчатого расположения электродов для измерения электрических характеристик сети нанотрубок, включая функционализированные на распознавание объектов целевой идентификации; на фигуре 11 (Figure 11) ток в электродах представлен как функция напряжения затвора для сети нанотрубок, образованных осаждением нанотрубок покрытых ДНК молок сельди; на фигуре 12 (Figure 12) даны электрические характеристики устройства нанотрубок, выполненного осаждением комплекса нанотрубок-(GT)10; на фигуре 13 (Figure 13) ток устройства (правая ось, темная линия) и абсолютный ток устройства (левая ось, светлая линия) представлен как функция напряжения затвора для "защищенного" и "незащищенного" устройства с использованием аптамера к лизоциму; на фигуре 14 (Figure 14) представлены характеристики устройства в версии разблокированного аптамера (GT)10 к тромбину; на фигуре 15 (Figure 15) представлена характеристика настройки, как на фигуре 14, но с сохранением блокирующей (защитной) группы на месте; на фигуре 16а (Figure 16а) приведены результаты, полученные с помощью контрольного электрода с уставкой (нанотрубки, функционализированные посредством защищенного аптамера (GT)10 к тромбину), а на фигуре 16b (Figure 16b) показан "разблокированный" результат; на фигуре 17а (Figure 1a) приведены результаты для контрольного электрода с уставкой (нанотрубки, функционализированные посредством защищенного аптамера (GT)10 к тромбину), а на фигуре 17b (Figure 17b) дан эквивалент со снятой защитой.
Подробное описание
Устройство обнаружения биомаркеров 50, реализованное согласно настоящему изобретению, встроено в литой корпус 1, как схематично показано на фигуре 1. Изнутри к литому корпусу 1 прикреплена подложка 2, на верхней поверхности которой размещено множество планарных контактов или электродов 3, 4, образующих датчики 8, 9. Над контактными поверхностями в подложке могут быть выполнены неглубокие желоба 6 для направления в них текучих сред в начале тестирования и для сохранения текучих сред в областях контактных поверхностей в процессе детектирования в случае наличия ограниченного количества исследуемой жидкости. На верхнюю поверхность литого корпуса накладывается съемная полимерная изолирующая лента 7 со слабой адгезией, обеспечивающая защиту контактных поверхностей подложки от воздействия воздуха и влаги для предотвращения преждевременного загрязнения нежелательными примесями или повреждения под воздействием окисления или гидролиза.
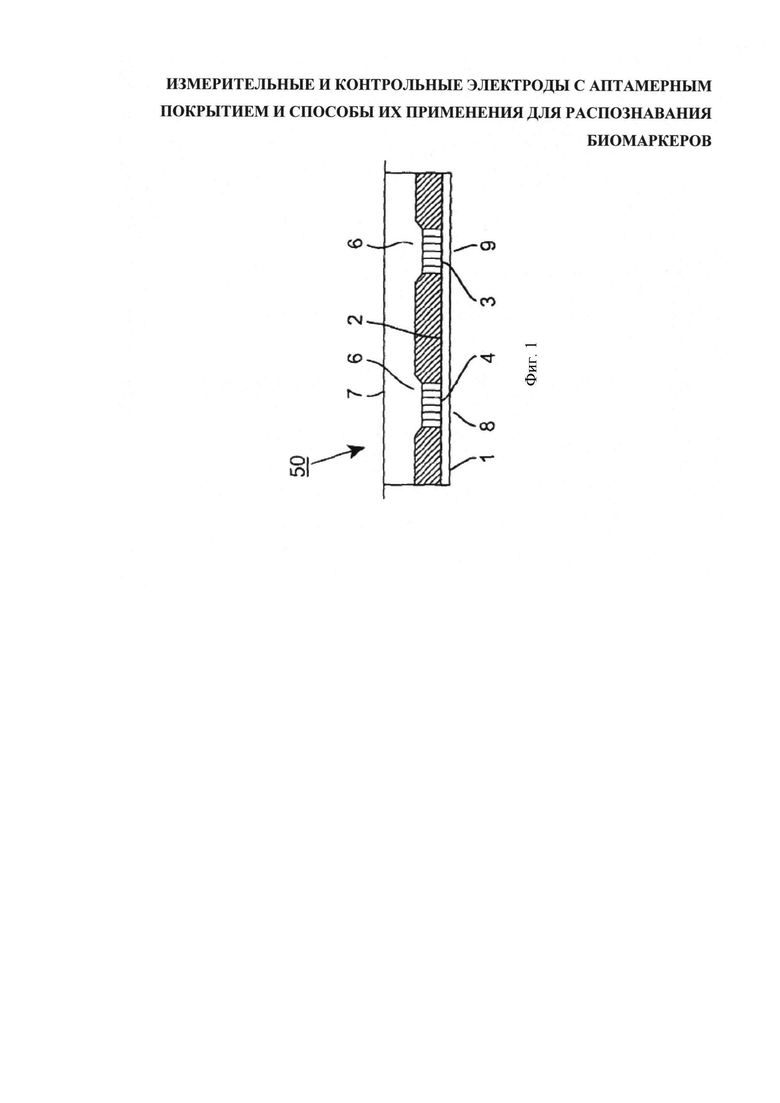
На виде в плане фигуры 2 дана детализация размещения электродов на подложке 2. Подложка 2 может быть выполнена из кремния с покрытием двуокисью кремния предпочтительной толщиной 300 нм. В состав каждого датчика 8, 9 входят электроды 3, 4, выполненные поочередным осаждением и травлением с получением параллельных встречногребенчатых контактов, сформированных из адгезионного слоя хрома толщиной 20 нм под слоем золота толщиной 100 нм. Электроды расположены параллельно с интервалом 10-50 мкм друг от друга и подсоединены поочередно к электродным контактам 30, 31. Эти контакты можно было бы обозначить как "исток" и "сток", хотя, строго говоря, в большинстве схемотехнических версий данное устройство не является полевым транзистором в полном смысле. Встречногребенчатые электроды чередуются попарно по двадцать или тридцать пар (на фигуре схематически показано всего несколько пар), составляя в ширину порядка 300 мкм, и имеют сопоставимую высоту (как показано на схеме). Терминалы 10, 11 принимают ток от встречногребенчатых электродов 3, 4, соответственно. Электродные пары каждого датчика могут быть размещены в непосредственной близости друг к другу, допустим, на расстоянии 500-1000 мкм.
Проводящую или полупроводящую структуру датчика 12, предназначенную для соединения с целевым биомаркером, наносят на первый из пары встречногребенчатых контактов 3, 4, формируя - обозначим это как - "измерительный" датчик. Следующую структуру датчика 14, в целом идентичную предыдущей, но уже сопряженную с целевым биомаркером измерительного датчика, наносят на второй из пары встречногребенчатых контактов 9, формируя - обозначим это как - "эталонный" датчик. При наличии интерфейса с соответствующим схемотехническим обеспечением, которое будет описано позже, спаренные измерительный и эталонный датчики образуют детекторную пару 16, нацеленную на один биомаркер-мишень.
Структура датчика 12 предназначена для соединения с биомаркером-мишенью, включает углеродные нанотрубки, функционально предназначенные для работы со специфическим аптамером, и сформирована посредством покрытия подложки 2 и, соответственно, встречногребенчатых контактов 3, 4 слоем углеродных нанотрубок. Аптамер может представлять собой, например, короткий фрагмент (допустим, около 40 нуклеотидов) ДНК или РНК, или пептида. Если подложкой 2 служит кремний, на электроды наносят тонкий изолирующий слой и формируют обратносмещенный "углеродно-нанотрубчатый" "полевой транзистор" с терминалами, которые можно обозначить как исток и сток, с каналом, образованным углеродными нанотрубками, и с затвором, сформированным за счет легированного слоя в кремнии. При отсутствии необходимости усиления посредством обратного смещения затвор не нужен.
В конструктивных решениях с использованием сети полупроводящих нанотрубок в качестве структуры датчика интервал между электродами должен быть рассчитан так, чтобы статистически исключить возможность возникновения мостика проводимости нанотрубок, закорачивающего датчик, даже в случае содержания в полупроводящих нанотрубках проводящих включений. При интервале между дорожками 10-50 мкм длина УНТ(CNT) может составлять порядка 1-10 мкм. Более подробно их структура и функции описаны ниже.
Интервалы, задаваемые встречногребенчатыми электродами, в результате формируют очень широкий канал между двумя электродами. Сигналы, снятые с электродов каждой встречногребенчатой пары, поступают в соответствующие контуры (не показаны). Здесь сигнал с кэппированного датчика 9 сравнивается с показаниями "экспонированного", или "измерительного", датчика 8. При том, что ожидаемый абсолютный уровень сигнала может иметь отклонения или изменения в зависимости от условий, разность (или отношение, или другой вид сопоставления) дает достоверное показание. Поскольку два эти датчика размещены близко друг к другу, они испытывают одинаковое воздействие однородной среды.
Достаточно часто для повышения вероятности правильного обнаружения требуется одновременное распознавание некоего набора биомаркеров, часто называемого биоподписью или "подчерком", например, какой-нибудь патологии.
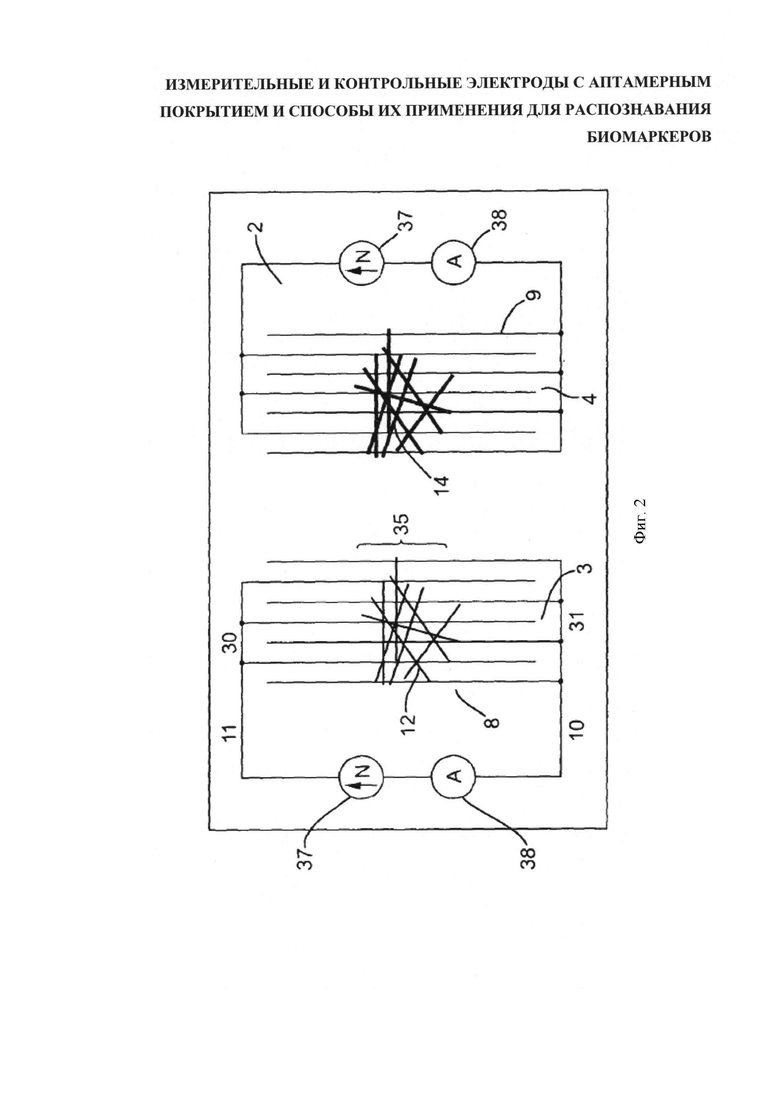
Фигура 3 схематично отображает вид сверху линейного расположения встречногребенчатых электродов детектора биомаркеров, подобного детектору на фигуре 2, но состоящего из пяти детекторных пар, в каждую из которых входит измерительный 8 и эталонный (контрольный) 9 датчики на общей подложке 2; при этом большее или меньшее количество задействуемых детекторных пар зависит от индивидуального набора целевых биомаркеров и варьируется в каждом конкретном случае применения устройства. Примененное здесь рядное построение детекторных пар соответствует по ширине неглубокому желобу 6а, который обеспечивает омывание текучей средой всего множества детекторных пар.
Как правило, биомаркеры служат индикаторами, но не на 100% специфичными, скажем, для какого-либо заболевания. Однако, считывание и интерпретация множества биомаркеров в надлежащей комбинации могут дать должную степень достоверности. Например, туберкулез (ТВ) помогают идентифицировать четыре биомаркера: неоптерин, индицирующий наличие воспалительных процессов и оксидантного стресса в клетках; прокальцитонин, дифференцирующий бактериозы от вирусных патологий; липоарабиноманнан (LAM), способный дифференцировать латентный ТВ от активного, и С-реактивный белок (CRP), который опять же ассоциируется с воспалительными процессами и окислительным стрессом. См.: Tuberculosis 4, Biomarkers and diagnostics for tuberculosis: progress, needs, and translation into practice (Туберкулез 4, Биомаркеры и диагностика туберкулеза: прогресс, потребности и реализация на практике); Robert S Wallis, Madhukar Pai, Dick Menzies, T Mark Doherty, Gerhard Walzl, Mark D. Perkins, Alimuddin Zumla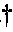 . Издано онлайн 19 мая 2010 г; DOI: 10.1016/S0140-6736(10)60359-5: <http://www.mossmanassociates.com/>TB%20Biomarker%20report%20Lancet_2010.pdf
. Издано онлайн 19 мая 2010 г; DOI: 10.1016/S0140-6736(10)60359-5: <http://www.mossmanassociates.com/>TB%20Biomarker%20report%20Lancet_2010.pdf
Устройство, подобное показанному на фигуре 3, может выдать результат после одного рабочего цикла.
В качестве альтернативы этой системе множества отдельных измерений и контрольных сравнений можно многочисленные эталонные системы свести в систематизированную матрицу для получения результата при единичном измерении и сравнении.
Вариантом конструктивного исполнения токопроводящих дорожек в зоне распознавания может быть применение полимерной подложки, где поверхность соприкосновения формируется из нескольких пар параллельных дорожек, образующих сетчатую структуру. В таком варианте компоновки контакты могут быть сформированы посредством осаждения золота, серебра или углерода с использованием процесса струйной печати. Встречногребенчатые токопроводящие дорожки могут иметь любую форму - от прямой до криволинейной.
Для формирования ПТ с нижним или с верхним затвором, образующего полупроводниковую структуру датчика 12, область канала между контактами истока и стока (отстоящими друг от друга приблизительно на 10 мкм) должна быть покрыта функционализированным материалом канала, предпочтительно - УНТ(CNT), в особенности - однослойными УНТ(ОСУНТ/SWCNT), и преимущественно - полупроводящими, хотя это и дороже. Одним из простейших способов достижения этого является покрытие электродов суспензией из растворенных ОСУНТ/SWCNT.
В одной из методик ОСУНТ/SWCNT модифицируют β-циклодекстрином (β-ЦД), что не требует длительного нагревания, фильтрации и промывки углеродных нанотрубок, в процессе которых они могли бы быть повреждены. Однослойные углеродные нанотрубки диспергируют в растворе β-ЦД с разрушением ультразвуком, как правило, с образованием суспензии 2 мг/мл. Затем, аликвоту суспензии помещают на контактную поверхность в желоб 6 подложки 2. Главным требованием является максимально равномерное распределение функционализированных ОСУНТ/SWCNT 12,14 по встречногребенчатым контактам 3, 4, для чего может быть применено воздействие электрическим полем на контактную поверхность подложки 2 после испарения аликвоты суспензии.
Другой пример методики точного осаждения углеродных нанотрубок между электродами, основанной на диэлектрофорезе, приведен в Suhiro et al. ("Fabrication of a carbon-nanotube-based gas sensor using dielectrophoresis and its application for ammonia detection by impedance spectroscopy" ("Изготовление газового датчика на основе углеродных нанотрубок с использованием диэлектрофореза и его применение для выявления аммиака импедансной спектроскопией"), J. Phys D: Appl. Phys. 36 (2003) L109-L114).
Методика заключается в том, что суспендированные в этаноле многослойные УНТ разрушают ультразвуком. Матрица встречногребенчатых хромовых электродов на стеклянной подложке окружена уплотнителем из силиконового каучука, образующим герметичную камеру. Суспензия углеродных нанотрубок непрерывно циркулирует над электродами, которые одновременно подвергаются возбуждению при 100 кГц, 10 В пик ~ РК переменного напряжения, в результате чего многослойные углеродные нанотрубки заполняют промежутки между электродными зубцами гребенки. Возможно применение и других технологий осаждения углеродных нанотрубок между электродами.
После применения функционализированных углеродных нанотрубок 12, 14 в контактной области они подлежат обработке "пэгиляцией". Пэгиляция известна специалистам в данной области как процесс, в котором цепи полиэтиленгликоля (ПЭГ) прикрепляются к белкам, увеличивая, таким образом, молекулярную массу белков. Однако, в таком случае полиэтиленгликоль осаждается непосредственно на поверхность углеродных нанотрубок, покрывая области нанотрубок, не функционализированных аптамером или нитью ДНК. Цель такой обработки - в предупреждении связывания белков, не специфических для функционализированного аптамера, с каким-либо нефункционализированным участком датчика, что могло бы внести паразитные эффекты в измерения. Это повышает чувствительность функционализированной нанотрубки при взаимодействии с пробой текучей среды, содержащей разнообразные белковые формы. Поверхности подложки 2 и/или желоба 6 также могут быть пэгилированы для предотвращения абсорбции веществ, способных влиять на измерения. В результате стандартной обработки ПЭГ на поверхности датчика образуется слой толщиной 2 и 3 нм. Процедура может выполняться как на поверхности подложки после осаждения нанотрубок, так и в растворе перед покрытием контактов нанотрубками.
Следует обратить внимание на то, что в процесс изготовления измерительных 19 и контрольных 20 электродов детекторной пары 16 входят аналогичные операции, за исключением покрытия контактов ОСУНТ/SWCNT. Следовательно, измерительные и контрольные электроды могут изготавливаться одновременно до более позднего этапа нанесения покрытия ОСУНТ/SWCNT. На этом этапе применяют две отдельные суспензии ОСУНТ: первую наносят на электроды измерительного датчика 19 при защищенном контрольном датчике, а вторую наносят на контрольный датчик 20 при защищенном измерительном датчике. Применяемые взвеси различаются между собой тем, что углеродные нанотрубки, суспендированные в первой из них, наносят на измерительный электрод 19 как функционализированные аптамеры, способные соединяться с биомаркером-мишенью. Углеродные нанотрубки, содержащиеся во второй суспензии для нанесения на контрольный электрод, функционализированы аптамером, уже насыщенным (предсвязанным, конъюгированным или кэппированным) биомаркером-мишенью.
В состоянии рабочей готовности устройство имеет кэппированную структуру [контрольного] датчика 14 в одной части подложки с электродами 4 и некэппированную, или голую, структуру [измерительного] датчика 12 в другой части подложки с электродами 3. Устройство приводят во взаимодействие с анализируемой средой путем погружения или внесения капли анализируемой жидкости. Электролит и другое содержимое могут вызвать изменение проводимости структур датчиков 12, 14, но для обоих оно будет одинаковым. Различие в изменениях проявляется только в случаях образования связи. Результирующий сигнал анализируется соответствующими схемотехническими средствами устройства. Анализ может быть выполнен в течение заданного времени, скажем, 30 секунд, с автоматической выдачей в конце результата, например, концентрации электролита.
Кроме того, предусмотрена возможность распознавания объекта целевой идентификации (этиологического агента) в воздушных или небиологических системах, если распознаваемое вещество - VX или аналогичное.
Типичный случай обнаружения состоит в определении степени легирования, например, переноса дырок или электронов в случае образования связи между иммобилизованным на поверхности углеродной нанотрубки аптамером и биомаркером-мишенью. Большое количество случаев легирования (например, переноса электронов), вызванных образованием связей, модулирует прохождение тока в "ПТ-УНТ/CNT-FET" от истока к стоку, на что в последующем может воздействовать напряжение затвора. Устройство также может работать в режиме датчика усреднения по времени по типу радиационного дозиметра; то есть, находясь в рабочем режиме, оно конъюгирует с целевыми объектами и подает сигнал только в том случае, когда усредненная по времени конъюгация, которая может быть привязана к концентрации, превышает определенный уровень, или же устройство интегрируется в течение времени для замера экспозиции, превышающей определенный порог. Как говорилось в контексте фигуры 3 и выше в описании, батарея спаренных датчиков устройства предусматривает возможность обнаружения комбинации биомаркеров, в которой каждому биомаркеру соответствует одна детекторная пара. Например, детектор, способный обнаруживать пять биомаркеров, будет состоять из подложки 2 с рядом 6а из пяти детекторных пар 16. Для детектора пяти биомаркеров должно быть выполнено десять отдельных покрытий ОСУНТ/SWCNT, из которых первая серия из пяти покрытий относится к "живым" ОСУНТ/SWCNT, нанесенным на измерительные электроды, и вторая серия [из пяти] покрытий относится к ОСУНТ/SWCNT, покрытым кэппированными аптамерами, нанесенными на контрольные электроды.
Выше говорилось, что для обнаружения специфических молекул основы из углеродных нанотрубок сначала должны быть "функционализированы". По одному из способов однослойные углеродные нанотрубки (ОСУНТ/SWCNT) функционализируют (наделяют функциями) напрямую путем нековалентного присоединения к их внешней стенке специфических к биомаркеру аптамеров.
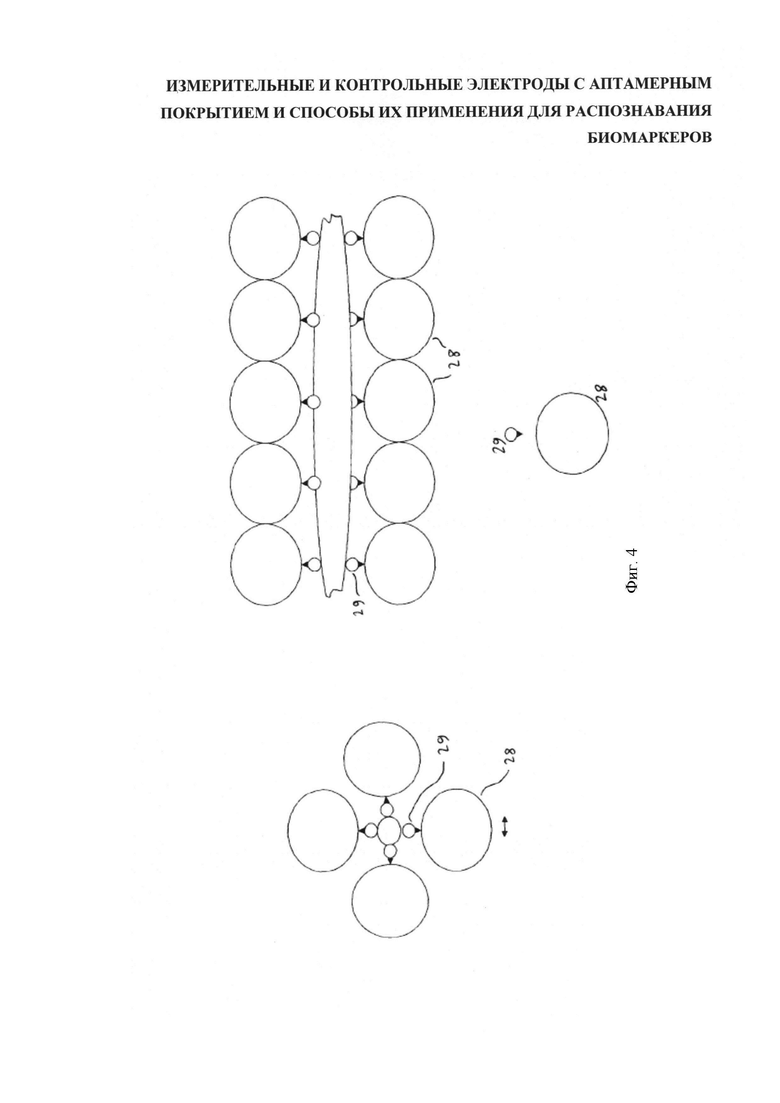
Предпочтительно, аптамеры иммобилизуют на поверхности углеродной нанотрубки с использованием вещества с высокой аффинностью к углеродной нанотрубке, например, антрацена или однонитевой ДНК-основы (которая выполняет роль "опоры"). После этого углеродную нанотрубку, как это принято называть, функционализируют на целевой для аптамера биомаркер (биомаркер-мишень). На фигуре 4 схематично представлены осевая и горизонтальная проекции наноразмерной углеродной трубки 27 с иммобилизованным с помощью антрацена 29 на ее внешней стенке обобщенным функционализированным аптамером 28. При этом, на известном уровне техники существует много способов функционализации нанотрубок, в частности, карбоксилирование, сопровождаемое эстерификацией, или клик-химия, о которой будет сказано ниже. Следует подчеркнуть, что изображение схематично, и в действительности УНТ имеет большую длину, а аптамеры, вероятнее всего, не имеют сферическую форму.
Типичная углеродная нанотрубка имеет длину 1000 нм при диаметре 1,25 нм, а средние диаметры аптамера и антрацена составляют, соответственно, 3 нм и 0,4 нм. Исходя из этих данных, по окружности ОСУНТ может быть размещено четыре функционализированных аптамера, а по длине - 330, что в общей сложности составит 1320 функционализированных аптамеров на одну ОСУНТ.
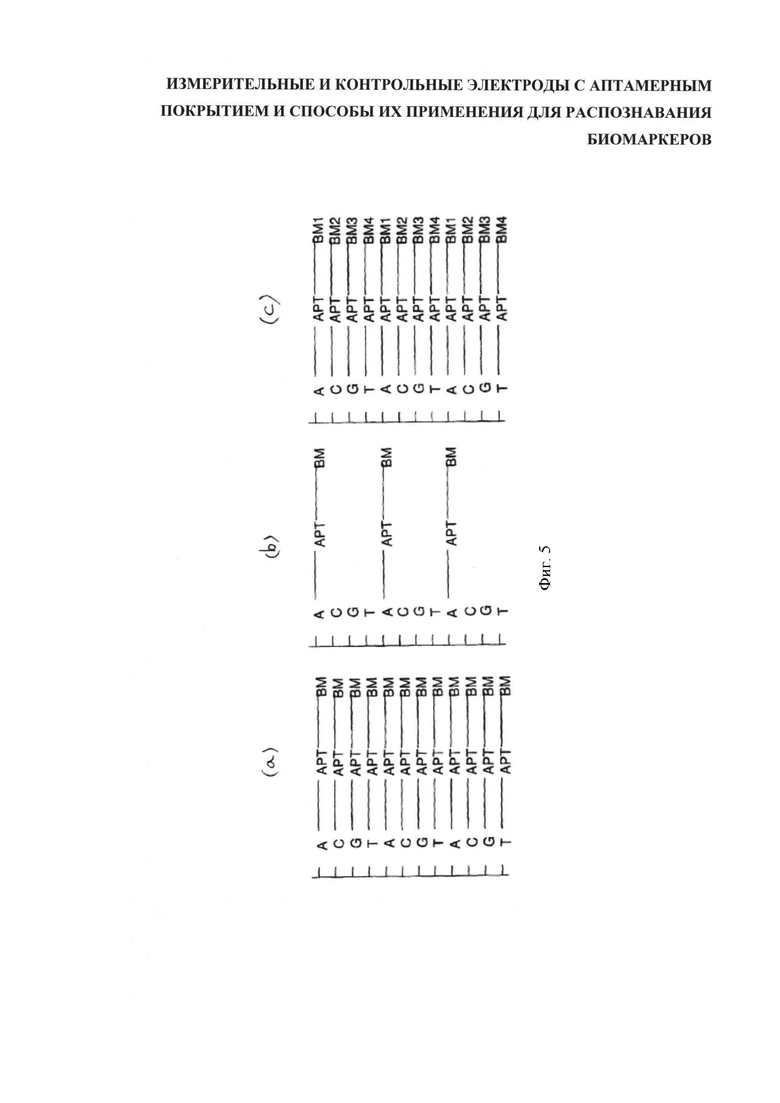
Второй тип способов функционализации углеродных нанотрубок заключается в преобразовании однонитевой ДНК в основу, несущую аптамеры, с применением клик-химии, как показано на фигуре 5. Такая нить в последующем наматывается вокруг однослойной углеродной нанотрубки.
"Клик-химия" описывает реакции между функциональными группами, образующими в результате устойчивую связь, проявляющими минимальную тепловую перекрестную реактивность с другими функциональными группами, обеспечивающими конечный целевой продукт, дающими пренебрежимо малый объем побочных продуктов и протекающими в безвредных условиях.
Принципы клик-химии применимы к модификации нуклеиновых кислот, и известно, что с ее помощью можно маркировать олигонуклеотиды флуоресцентными красителями, сахарами или пептидами; к циклизации ДНК; и к присоединению олигонуклеотидов к ДНК.
В предпочтительном варианте реализации присоединение состоит из полинуклеотидного основания, преимущественно, чередующихся GT-последовательностей (GT)n, где число n повторов GT составляет от 5 до 50, наиболее предпочтительно n=10. GT-последовательность содержит подвеску алкалиновой функциональной группы, к которой методами клик-химии может быть присоединен азид-модифицированный аптамер. Наиболее предпочтительно, если аптамер прикрепляется к середине опорной структуры, образуя Т-образное соединение, обеспечивающее надлежащий контакт с нанотрубкой.
В ином случае углеродная нанотрубка может быть функционализирована аптамером напрямую с помощью клик-химии, без промежуточной обмотки ДНК вокруг углеродной нанотрубки.
Предпочтительно, в обоих случаях - когда аптамер присоединен или к полинуклеотидному основанию, или непосредственно к УНТ - во время химической конъюгации аптамер должен быть защищен комплементарной молекулой, такой, как нить ДНК. По завершении конъюгации защитная молекула удаляется. Такой подход уменьшает нежелательную функционализацию распознающей части аптамера в ходе химических процессов и снижает вероятность нежелательной адсорбции аптамера нанотрубками. Защитная последовательность достаточно комплементарна аптамеру, чтобы обеспечить надлежащую связь и защиту аптамера при функционализации, но может содержать несопряженные участки, снижающие точку плавления комплекса и упрощающие удаление. Для требуемого снижения температуры в процессе удаления могут использоваться также мочевина или изменения рН.
Для насыщения поверхностей нанотрубок во избежание неспецифического связывания целевых аптамеров могут быть введены избыточные (GT)n.
На фигуре 5 представлена нить ДНК, обмотанная вокруг ОСУНТ/SWCNT или МСУНТ/MWCNT (многослойной углеродной нанотрубки), или другая проводящая среда. Проиллюстрировано три варианта конфигурации аптамеров, присоединенных к каркасу ДНК с использованием клик-химии. На вкладке (а) специфический к биомаркеру аптамер сопряжен с каждым из базовых компонентов - (А) аденином, (С) цитозином, (G) гуанином и (T) тимином - цепочки ДНК. На (b) аптамер сопряжен только с адениновой основой, что дает, например, более низкую плотность аптамеров по сравнению с каркасом на (а). На (с) с ДНК сопряжены до четырех аптамеров к различным биомаркерам. Следует подчеркнуть, что аптамеры, сопряженные с каркасом, могут быть активными (без связи со своими биомаркерами-мишенями) или заглушенными, "кэппированными" (уже сопряженными со своими биомаркерами-мишенями). За счет этого могут быть подготовлены нити ДНК для обмотки углеродных нанотрубок для изготовления измерительных или контрольных датчиков.
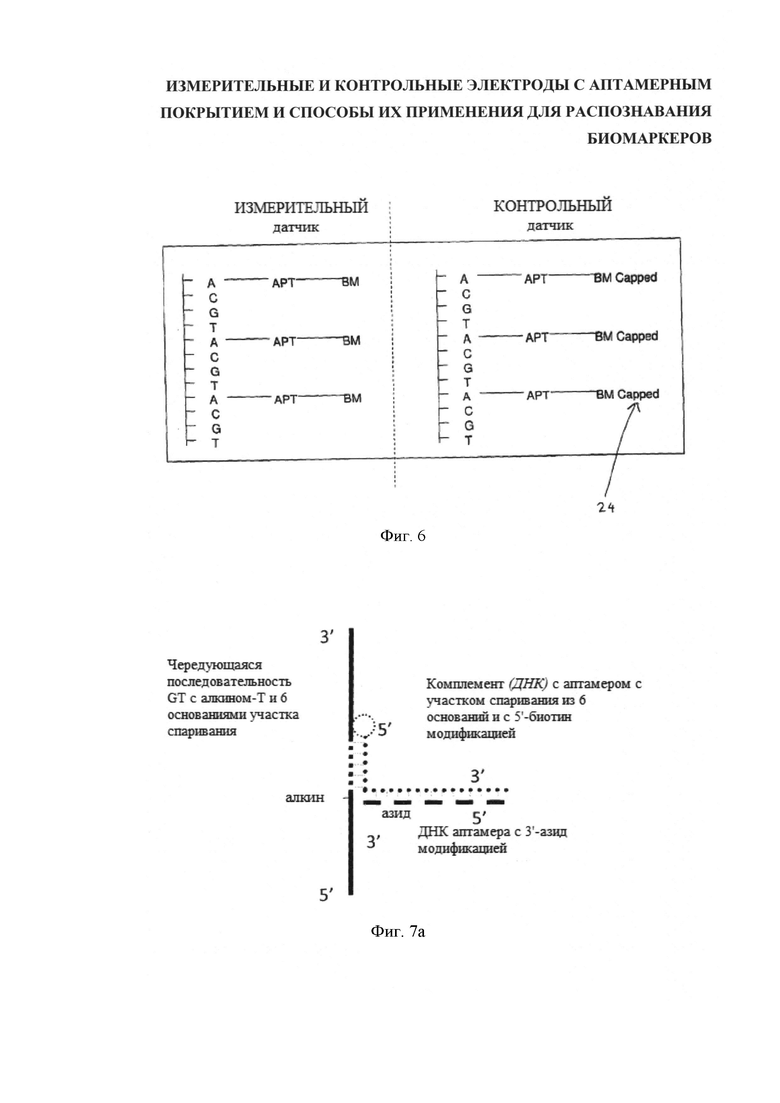
Гибрид функционализированных ДНК и углеродных нанотрубок получают обмоткой нанотрубки нитью функционализированной ДНК. Основное заключается в том, что как в варианте реализации через прямое присоединение аптамеров к углеродной нанотрубке, например, посредством карбоксилирования, так и в варианте осуществления через наматывание нити ДНК на углеродную нанотрубку, аптамеры, присоединенные к нанотрубке напрямую или через нить ДНК, в измерительном датчике неконъюгированы, а в контрольном датчике конъюгированы со своими целевыми биомаркерами, или, иначе говоря, аптамеры, соответственно "некэппированы" ("незащищены") или "кэппированы" ("защищены").
На фигуре 6 дана схема парной структуры датчика измерения и сравнения, соответствующая фигуре 5 (b), в которой область сравнения предварительно связана с биомаркером, а область измерения образует связь с биомаркером в процессе измерения.
На схеме показаны аптамеры, связанные с каркасом основы, которая, исходя из того, что она присоединена к УНТ хребтом вовне, фактически, представляет собой гидрофобную основу.
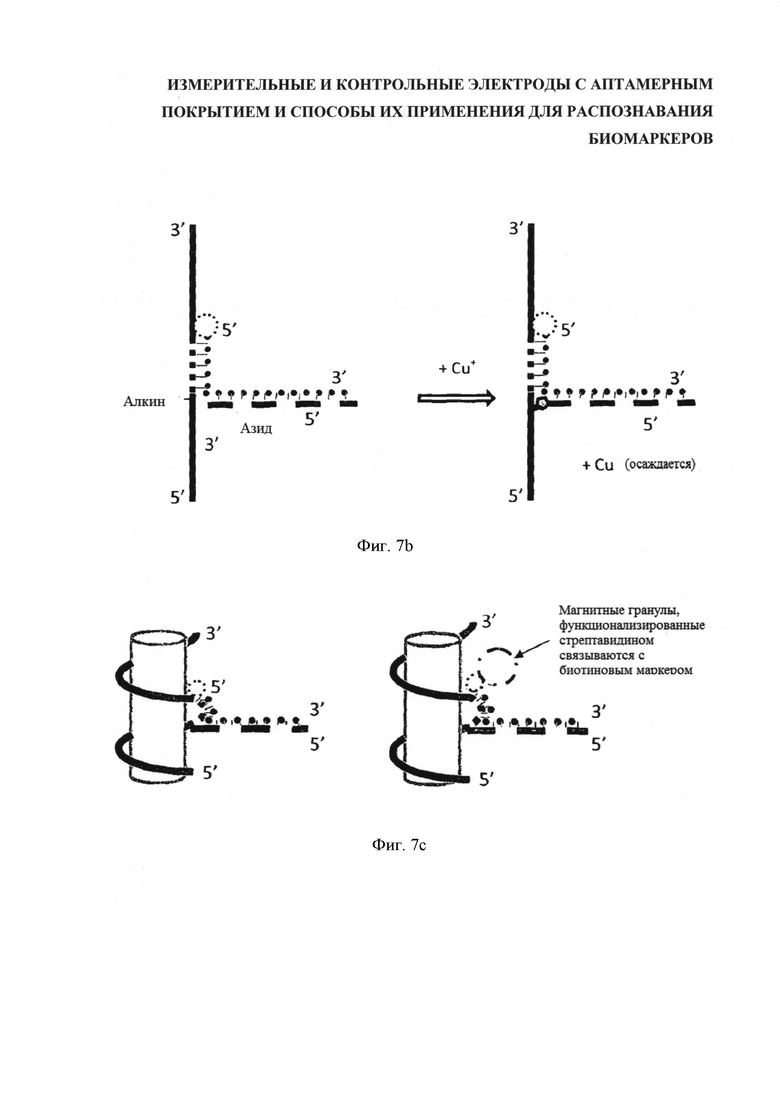
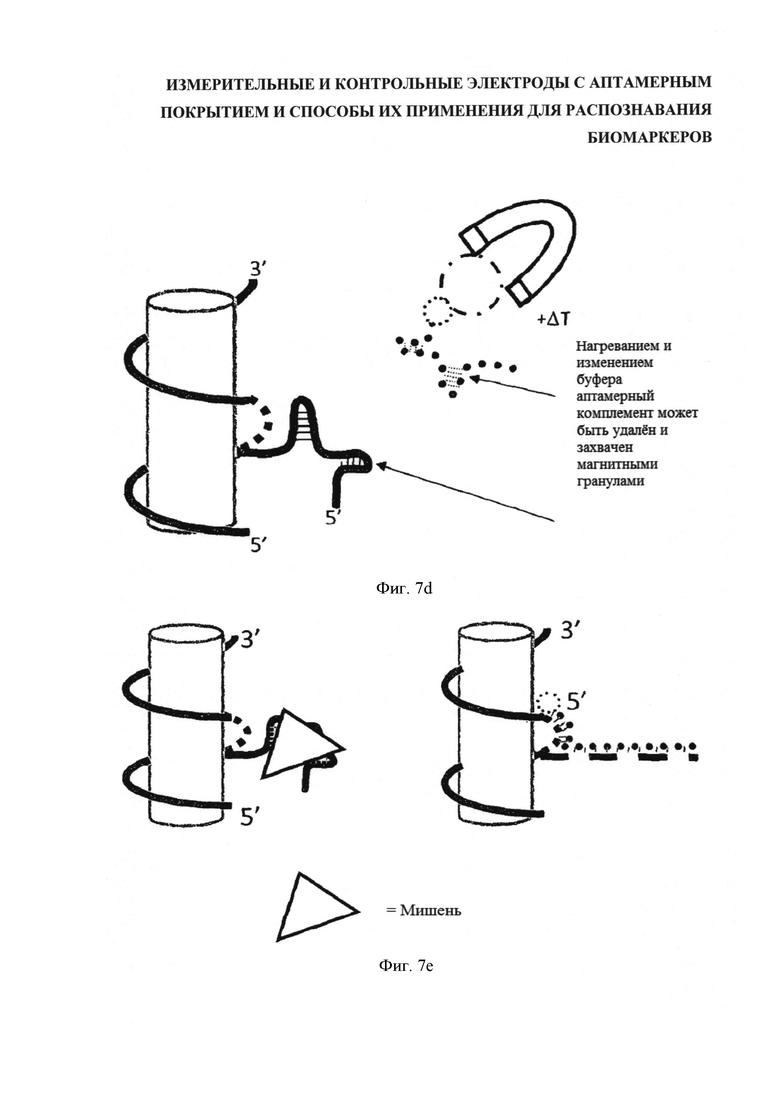
На фигуре 7 последовательно отображен процесс нанесения ДНК-аптамерного покрытия на УНТ. С одной стороны [на фигуре 7(a)] расположена цепочка ДНК (вертикальная линия), состоящая, главным образом, из чередующейся последовательности GT, включая одиночный алкин-Т, примыкающий к короткой специфической последовательности, с другой стороны посредством ДНК (горизонтальная линия) присоединен требуемый аптамер, при этом, ДНК с 3'-азид-модификацией защищена полностью комплементарной нитью ДНК с добавленной областью спаривания оснований для выстраивания на несущей нити ДНК (на "опоре") и с 5'-биотин-модификацией. При добавлении Cu+ в позиции алкин-азидной связи (фигура 7(b)) происходит клик-конъюгация. Затем, ДНК диспергируют с УНТ и подвергают соответствующей обработке, например, взбалтывают, для равномерной дисперсии УНТ. Далее, полученную суспензию инкубируют со стрептавидином в виде покрытия магнитных гранул и короткое время нагревают. Стрептавидин связывается с биотином (разбивка 3 [фигура 7(c)]), после чего гранулы удаляют (разбивка 4 [фигура 7(d)]), вытягивая из аптамеров защитный комплемент, в результате чего получают готовые к применению активные УНТ.
В то же время в другой порции шихты, предназначенной для контрольных датчиков, защиту аптамеров сохраняют. После этого взвеси равномерно распределяют по электродам. Последнюю операцию предпочтительно выполнять после присоединения аптамера, чтобы для присоединения были доступны все возможные участки. Как показано на последней схеме [фигура 7(e)], результат захвата мишени (слева) в последующем может быть сравнен с контрольным, или неактивным, датчиком (справа) при одинаковых химических условиях.
В другой схемотехнической версии датчик может быть изготовлен с применением технологий, обычно ассоциирующихся с областью печатных электронных схем. В этом случае подложка может быть выполнена из полимера, такого как полиэтилентерефталата (ПЭТ), полиэтиленнафталат (ПЭН), поли-4-винилфенол (ПВФ) или полиэтиленгликоль (ПЭГ). Токопроводящие дорожки из металла или углерода осаждают на пластиковую подложку, а углеродные нанотрубки осаждают между ними способом, описанным ниже.
Вновь обращаясь к фигуре 2, вспомним, что необходимо обеспечение средствами измерения электрических характеристик между встречногребенчатыми контактами истока 30 и стока 31 контрольного и измерительного электродов. Как описано выше, измерительный датчик 8 имеет основные электродные терминалы 30 и 31 и затвор, являясь до некоторой степени аналогом полевого транзистора (ПТ), в котором, однако, для формирования области затвора ПТ между терминалами "истока" и "стока" необходимо нанести слой углеродных нанотрубок с аптамерным покрытием. Терминалы устройства могут быть подсоединены к электронным средствам возбуждения 37 и измерения 38 для определения электрических характеристик между электродами истока и стока.
Допустим, в качестве источника возбуждения 37 может служить генератор напряжения, а роль средства измерения 38 может играть амперметр, отслеживающий изменения электропроводности между электродами истока и стока 30, 31.
Безусловно, при проведении исследований могут применяться и другие электронные схемы, такие как измерительные усилители и источники переменного тока или напряжения. Кроме того, следует учитывать, что средства возбуждения 37 и измерения 38 могут быть смонтированы на той же подложке 2, которая формирует контактную поверхность, если это - кремний, или, наоборот, могут быть размещены на отдельной плате в непосредственной близости к силиконовой подложке с подсоединением к контактам истока 30 и стока 31 через соединительную шину.
Путем изменения средств возбуждения и измерения можно варьировать снимаемые между электродами истока 30 и стока 31 параметры. Средством возбуждения, предположим, может быть высокочастотный источник, обеспечивающий возбуждение контактов ОСУНТ на одной частоте, или в широком диапазоне частот. Это позволит оценивать сопротивление между электродами истока 30 и стока 31. Аналогично предусматривается оснащение средствами измерения сопротивления, емкости или индуктивности.
При разработке обеспечения схемотехническими средствами детекции следует учитывать, что электронный инструментарий, задействуемый для считывания характеристик электродов измерения 34, одновременно может быть использован для контроля показателей электродов сравнения.
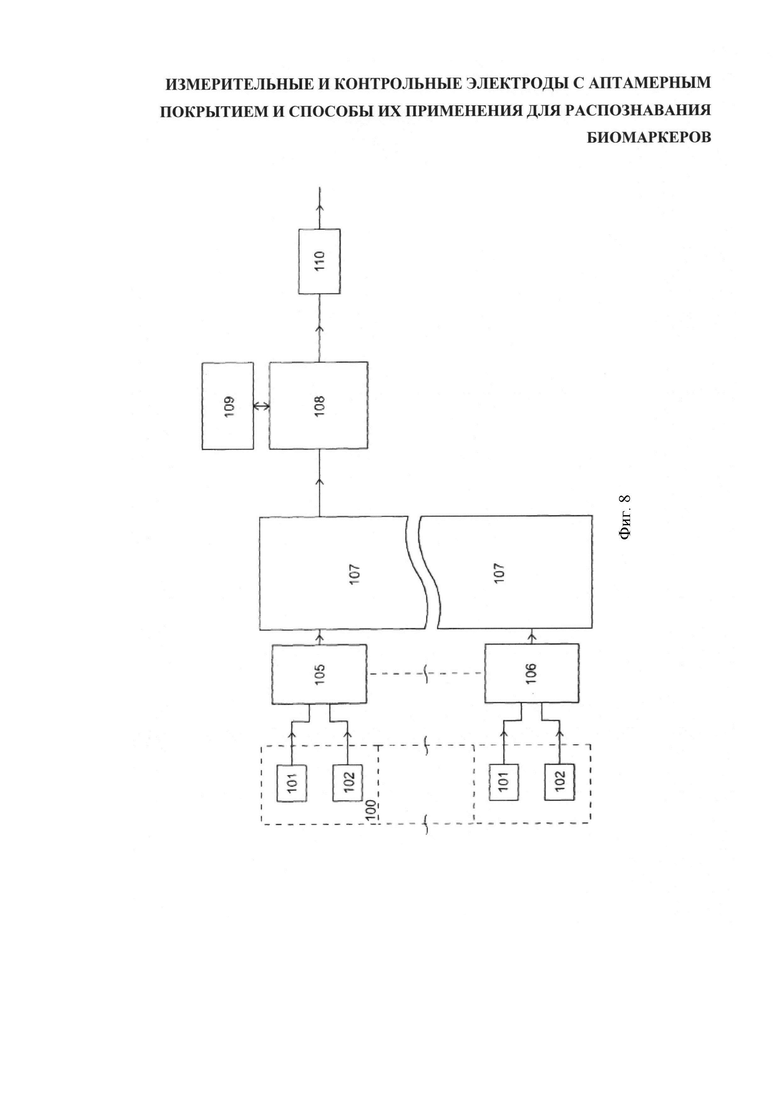
На фигуре 8 показано, что сигналы, отражающие изменение характеристик электропроводности, импеданса, сопротивления, емкости или индуктивности, принимаемые, например, от детекторной пары 100, включающей измерительные электроды 101 и контрольные электроды 102, могут быть переданы на средства калибрования 105. В случае работы с аналоговыми сигналами средства принятия решений для выведения итоговой разности показаний могут оперировать аналоговым математическим инструментарием. Однако, предусмотрена возможность цифровой обработки сигналов от измерительных и контрольных датчиков с использованием аналого-цифрового преобразователя для выведения разности показаний между ними в цифровой форме. На выход устройства подается скорректированный сигнал 111. Ранее говорилось о возможности детекции комплекса биомаркеров с помощью множества детекторных пар. Это, соответственно, требует соразмерное количество калибровочных средств.
Калиброванный сигнал последовательно поступает на средство принятия решений 107. Средство принятия решений обрабатывает совокупность откалиброванных сигналов, поступающих от множества детекторных пар, и оценивает сложившиеся условия. Если условия удовлетворительны, средство принятия решений индицирует это, выводя логический сигнал. Предусмотрен также вывод другой информации, относящейся к протеканию процесса детектирования, например, текущие показания электропроводности каждой нанотрубки.
Следует отметить, что описанные выше схемные решения могут быть осуществлены на печатной плате (ПП) и соединены с подложкой датчика посредством шины или другим способом. В предпочтительной версии исполнения подложка датчика представляет собой блок однократного применения с простым разъемом для соединения и разъединения с универсальным измерительным устройством, содержащим контуры измерения и устройства вывода. Предлагаемая компоновка обеспечивает оптимальные условия содержания подложек датчиков - стерильную среду и температурный контроль. Альтернативное конструктивное решение предусматривает изготовление определенной части схем непосредственно на подложке датчика и размещение остальных контуров на печатной плате, сопрягаемой с подложкой. Кроме того, печатная плата может соединяться механически и электрически с разъемом, рассчитанным на совместимость с USB, микро-USB и многими другими типами коннекторов передачи данных, в том числе - беспроводными.
Система прошла испытания на техническую применимость с выполнением измерений, что описано далее.
Этап 1: получение ДНК-аптамера
i) Синтез ДНК
ДНК синтезировали методом поэтапного синтеза в твердой фазе с использованием синтезатора ДНК/РНК ABI 394 DNA/RNA Synthesiser с применением химической защиты DMTr для 5'-ОН и β-цианоэтил-защищенный 3'фосфит. Азид функционализировали введением 3'амино-CPG, который затем преобразовывали в 3'азид с использованием химии азидобутират-NHS-эфира. Алкиновую группу вводили в последовательность ДНК с использованием функционализированного алкином фосфорамидита "Т".
ii) Очистка олигонуклеотидов после расщепления и снятие защиты с использованием HPLC/ВЭЖХ (высокоэффективной жидкостной хроматографии).
Олигонуклеотиды очищали с применением:
- или ОФЖХ (обратно-фазовой жидкостной хроматографии) с использованием градиента от 50 mM 100%-го уксуснокислого аммония, рН 6,8, до 50 mM 100%-го уксуснокислого аммония в 50%-ом ацетонитриле при 55°С;
- или ионообменной хроматографии с использованием воды для 100%-го NaCl на 1,2 М при 60°С.
iii) Преобразование 3'-аминогруппы в 3'-азид:
NHS-эфир азидобутирата растворяли в MeCN. 3'-амино-ДНК растворяли в 0,1 М карбоната/бикарбоната, рН 9. NHS-эфир азидобутирата был добавлен в растворенный олигонуклеотид и реагировал при комнатной температуре в течение 2 часов. Для концентрирования добавляли 2 объема холодного этанола, 20 минут инкубировали при -80°С и гранулировали (4000 г, 30 минут). Повторно растворенную ДНК обессоливали в 18,2 mΩ воды и лиофилизировали.
iv) Клик-химия (см. фигуру 7)
Маркированную алкином ДНК (в воде) добавляли к маркированной азидом ДНК и растворяли. Раствор CuBr, содержащий 0,1 М ТВТА в смеси ДМСО/трет-бутанол 3:1 (объем/объем), инкубировали при 45°С в течение 2 часов [1,2]. Реакцию разбавляли водой, обессоливали в 18,2 mΩ воды и лиофилизировали.
v) Верификация синтеза ДНК и продуктов клик-реакций
Синтезированные ДНК были подвергнуты масс-спектрометрии в режиме отрицательной ионизации электрораспылением для проверки правильности масс. Продукты клик-реакции маркировали по 5'-фосфату с использованием γ-[32Р]-АТФ [3].
Данные были проанализированы в 10%-ном денатурирующем полиакриламидном геле (ПААГ) в присутствии додецилсульфата натрия (ДСН) (SDS PAGE) для подтверждения успешной клик-конъюгации.
Литература:
1. Kocalka, P., А.Н. El-Sagheer, and Т. Brown, Rapid and efficient DNA strand cross-linking by click chemistry. Chembiochem., 2008. 9(8): p.1280-5;
2. El-Sagheer, A.H. and T. Brown, Click chemistry with DNA. Chem. Soc. Rev., 2010. 39: p. 1388-1405;
3. Sambrook, J., Molecular Cloning; A Laboratory Manual. 2nd ed 1989, Cold Spring Harbour:
Cold Spring Harbour Laboratory Press.
Протоколы и реагенты
www.glenresearch.com
www.linktechnologies.co.uk
Этап 2: Защита олигомера, снятие.
Защитный каркас или защитные нити синтезированы с 5'биотиновой группой, что обеспечивает их удаление после иммобилизации УНТ на Т-участке между одноцепочечной ДНК и фрагментом GT "опоры" посредством короткой (2-минутной) инкубации выше соответствующего Tm в присутствии покрытых стрептавидином магнитных гранул. После воздействия магнитом супернатант, содержащий свободные цепочки аптамера, присоединенные к УНТ через "опоры", был использован для покрытия элементов электродов.
Этап 3: Конструкция контрольного электрода.
Образцы контрольных электродов были получены удержанием связанных водородом комплементарной или каркасной нитей аптамера, за счет чего блокировалась активная конформация аптамера. В другом случае цепочки аптамеров синтезировали посредством перекрестного сшивания светочувствительной группы и ковалентно соединяли с соответствующими мишенями в присутствии избыточного количества мишеней при воздействии ультрафиолетовым облучением.
Начальный эксперимент был проведен с использованием замороженного раствора ДНК молок сельди для подтверждения однородности дисперсии нанотрубок с ДНК-покрытием.
На фигуре 9 дан атомно-силовой микрофотоснимок, на котором отображен пример дисперсии нанотрубок с ДНК-покрытием, высушенных на кварцевой подложке, и формирования перколированной сетки. Изображения и строчные развертки подтверждают, что нанотрубки хорошо диспергированы и могут быть высушены с образованием необходимых для датчика проводящих сетей.
Этап 4: Дисперсия нанотрубок в (GT)10 в фосфатном буферном растворе (ФБР/PBS). Для получения нанотрубок, несущих аптамеры, использовали синтетическую ДНК, а именно - (GT)10, сопряженную с кэппированной (защищенной) нитью аптамера. Замороженный раствор (GT)10 в концентрации 3,25 мг/мл размораживали при комнатной температуре. 115 микролитров раствора ДНК разрушали ультразвуком в течение 15 мин.
0,19 мг нанотрубок в порошкообразном состоянии от производителя (Nanolntegresis, полупроводящие) был добавляли к 1 мл ФБР и 80 минут разрушали ультразвуком, используя ультразвуковой зонд, из них 40 минут - при 15 Вт с добавлением 0,5 мл ФБР. Дисперсную систему нанотрубок разбавляли до 0,19 мг в 1,5 мл ФБР и разрушали в ультразвуковой ванне в течение 2 часов перед смешиванием с ДНК.
Раствор ДНК (115 микролитров) добавляли к дисперсной системе УНТ и разрушали в ультразвуковой ванне. Затем, в дисперсную систему (285 μл) вводили ФБР до получения необходимой концентрации нанотрубок. Получена общая пропорция 2:1 (ДНК:ОСНТ [одностенные нанотрубки] вес/вес), где концентрация составила кДНК:0,2 мг/мл и кУНТ:0,1 мг/мл. Дисперсные системы интенсивно разрушали ультразвуком в воде со льдом до приобретения пробой темно-красного цвета. Ультразвуковое разрушение дисперсных систем проводили в общей сложности в течение 2 часов, добавляя каждые 20-20 минут в акустическую ванну лед, не допуская рост температуры выше 8°С. В заключение, дисперсные системы мягко центрифугировали 1 час при 3300 об/мин., после чего фильтровали с помощью 1 -микронного струйного фильтра.
Этап 5: Осаждение эмульсии нанотрубок на электроды.
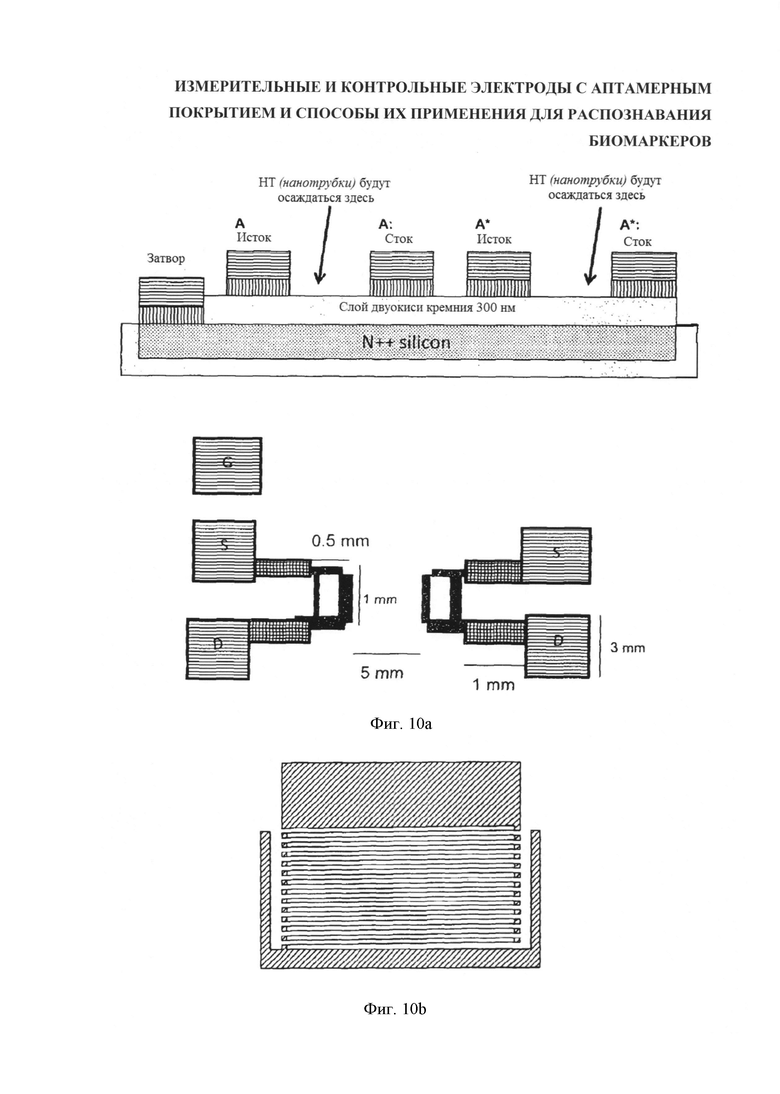
Электроды были выполнены методом литографии. Электроды имели встречно-гребенчатую конфигурацию, как показано на фигуре 10а. На верхней схеме этой фигуры показано поперечное сечение встречно-гребенчатого расположения электродов, на нижней схеме фиг. 10а показан вид сверху пары измерительного и контрольного датчиков. На верхней схеме показано поперечное сечение одного электрода, а на нижней - вид сверху пары электродов, один из которых используется как "эталонный/контрольный", а другой - как "измерительный" электрод. Прямоугольники, обозначенные буквами G, S и D являются контактными площадками для соединения электродов с измерительными контурами. При этом указанная маркировка относится к транзисторной компоновке с контактными площадками - соответственно - затвора, истока и стока. Однако такое же расположение электродов возможно при нетранзисторной компоновке, где измеряется ток между двумя встречно-гребенчатыми электродами с или без смещения затвора.
Фигура 10b представляет собой схему микрографии встречногребенчатых электродов датчика. Золотые токопроводящие дорожки шириной 10 микронов расположены с интервалом 10 микронов.
Голые электроды промывали метанолом, ацетоном, a IPA продували N2 и очищали UV-О3 в течение 30 мин. Электроды изолировали на подложке, используя гидрофобный карандаш. 2-микронную каплю суспензии УНТ с ДНК осаждали на электродах.
Результат 1: Электрические измерения комплекса нанотрубок с ДНК на электродах.
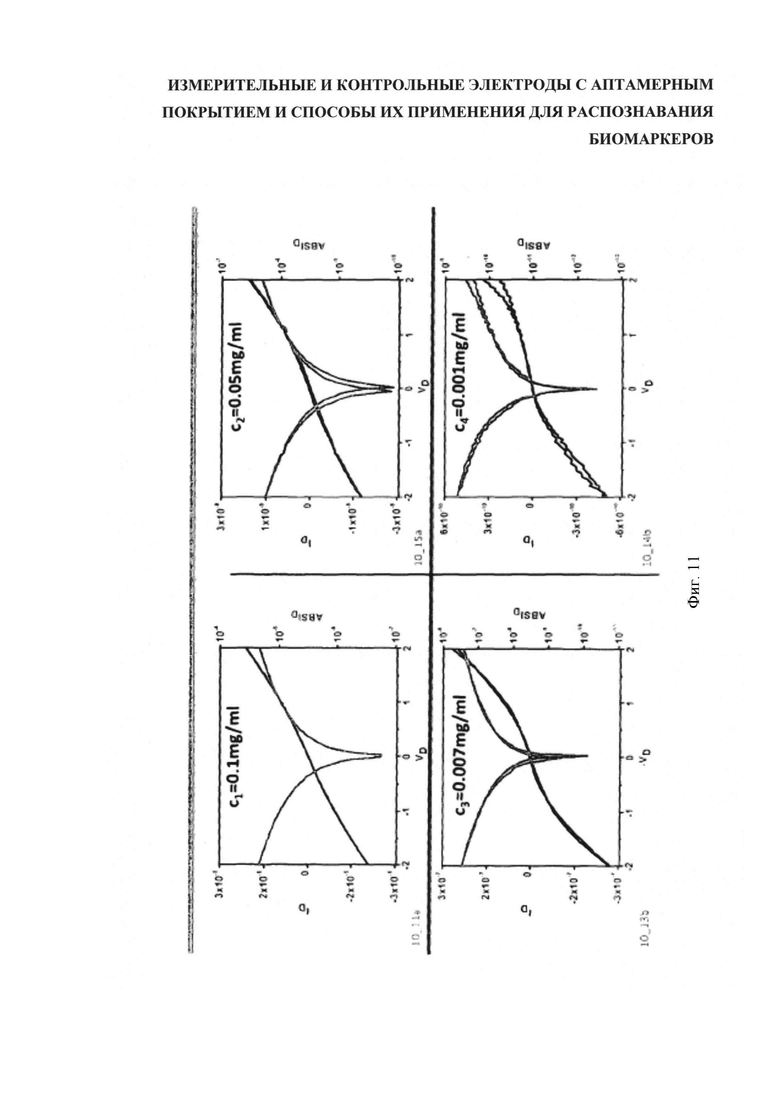
Полупроводящие нанотрубки (NanoIntegresis) диспергировали с однонитевой ДНК согласно протоколу к фигуре 9. Дисперсные системы нанотрубок препарировали в концентрациях 0,1 мг/мл, 0,05 мг/мл, 0,007 мг/мл 0,001 мг/мл и осаждали на электродах. Через электроды пропускали напряжение 2 В, и измерение тока на электродах показывало изменение напряжения на затворе.
Результаты показаны на графиках фигуры 11, где ток устройства (левая ось) и абсолютный ток устройства (правая ось) представлены как функция напряжения затвора для различных начальных концентраций дисперсных систем. Абсолютное значение тока имеет форму V в силу биполярной природы сети УНТ. Начальные концентрации нанотрубок указаны в заголовках графиков. Установлено, что концентрация нанотрубок порядка 0,007 мг/мл обеспечивает надежное покрытие без избыточного риска короткого замыкания. Короткое замыкание может быть вызвано металлическими нанотрубками; формирование беспримесных полупроводящих нанотрубок сложно и затратно, поэтому в образцах использованы формы с 10%-ным металлосодержанием. Кроме того, замыкание предупреждалось за счет оптимального соотношения между интервалом между электродами и длиной используемых нанотрубок, как описано ранее.
Результат 2: Электрические измерения комплекса нанотрубок-(GT)10 на электродах.
Полупроводящие нанотрубки (Nanolntegresis) диспергировали с однонитевой ДНК согласно протоколу этапа 4. Препарировали дисперсные системы нанотрубок концентрацией 0,1 мг/мл и осаждали их на электроды согласно примеру 4. Через электроды пропускали напряжение 2 В, и измерение тока на электродах показывало изменение напряжения на затворе.
На фигуре 12 даны графики тока устройства (правая ось, темная линия) и абсолютного тока устройства (левая ось, светлая линия) как функции напряжения затвора.
Результат 3: Электрические измерения комплекса нанотрубок-(GT)10 на электродах.
В этом опыте аптамеры связывали с ДНК. Полупроводящие нанотрубки
(Nanolntegresis) диспергировали с Т-участком одинонитевого аптамера (GT)10 к лизоциму согласно протоколу примера 2. Эти образцы обозначили как "защищенные", поскольку с аптамером сопряжена защитная цепочка. Второй набор образцов, обозначенных как "незащищенные", вырабатывали, нагревая дисперсную систему Т-участка однонитевого аптамера (GT)10 к лизоциму при 70°С в течение 15 минут перед введением их в суспензию нанотрубок. Дисперсные системы препарировали в концентрации 0,007 мг/мл и 2 микролитра осаждали на электродах, как описано в примере 4.
На графиках фигуры 13 представлены ток устройства (правая ось, темная линия) и абсолютный ток устройства (левая ось, светлая линия) как функция напряжения затвора: СЛЕВА - для "защищенного" устройства, где аптамер сопряжен с его защитной цепочкой, и СПРАВА - для "незащищенного" устройства, где защитная цепочка аптамера удалена.
В опытах использовали аптамер к лизоциму.
Далее будут описаны некоторые примеры тромбин-специфических датчиков.
Пример 1: УНТ/разблокированный аптамер (GT)10 к тромбину.
Замороженный защищенный (GT)10 тромбин размораживали при комнатной температуре. 100 микролитров этого раствора разбавляли в 900 микролитрах ФБР с получением тромбина (GT)10 в примерной концентрации 1,2 мг/мл. Раствор инкубировали 2 минуты при 90°С и медленно остужали при комнатной температуре, чтобы перед диспергированием все олигомеры были спарены с основанием.
0,6 мг нанотрубок в порошкообразном состоянии от NanoIntegris помещали в 2 мл ФБР и разрушали ультразвуком с помощью ультразвукового зонда в течение 80 минут при 15 Вт.Дисперсную систему УНТ разрушали ультразвуком в ультразвуковой ванне 30 минут перед смешиванием с ДНК. 1 мл раствора тромбина (GT)10 добавляли в дисперсную систему нанотрубок и разрушали ультразвуком в ультразвуковой ванне. Затем ФБР добавляли в дисперсную систему (3 мл) до достижения дисперсной системой требуемой концентрации нанотрубок. Результатом процесса было ДНК:ОСНТ вес/вес=кДНК:0,2 мг/мл, кУНТ:0,1 мг/мл.
Дисперсные системы интенсивно разрушали ультразвуком в воде со льдом до приобретения образцом черного цвета. Пробирку подвешивали на глубине 20-40 мм по центру ванны со льдом по краям ванны во избежание нагрева образца.
Дисперсные системы разрушали ультразвуком в общей сложности в течение 2 часов с добавлением каждые 20-30 минут в акустическую ванну льда для предотвращения повышения температуры более 5°С. После функционализации нанотрубок аптамером к тромбину (GT)10 защитную группу удаляли быстрым нагреванием до 70°С, извлекая при этом защитную группу с использованием магнитных гранул стрептавидина.
Затем, дисперсные системы мягко центрифугировали 1 час при 3300 об/мин, после чего фильтровали с помощью струйного фильтра Ватмана. Далее, дисперсные системы разбавляли ФБР до требуемой концентрации. В данном примере дисперсная система была разбавлена до концентрации нанотрубок 0,007 мг/мл.
Электроды очищали и изолировали с помощью гидрофобного карандаша. Каплю из 2 миллилитров суспензии помещали на электрод и давали высохнуть. Конечные устройства состояли из сети нанотрубок, покрытых аптамером к тромбину со снятой защитой. Этот электрод является "измерительным".
Затем ток (ID) между электродами истока и стока, или основными электродами, замеряли как функцию напряжения затвора (VD), как показано на фигуре 14. Устройство работает в режиме полупроводника. Устройство представляет собой датчик, выполненный функционализацией УНТ разблокированным аптамером (GT)10 к тромбину. После высушивания выполняли измерения. Ток между электродами (I, левая ось, темная линия) как функция напряжения затвора (V). (Правая ось и светлая линия обозначают абсолютный ток (ABS(I)).)
Пример 2: УНТ/защищенный аптамер (GT)10 к тромбину.
Электрод выполнен аналогично примеру 1. Однако, защитная группа была оставлена на месте, в результате чего конечные устройства состояли из сети нанотрубок, покрытых защищенным аптамером к тромбину. Этот электрод - "контрольный(/ эталонный)".
На графике фигуры 15 ток между главными электродами (ID) представлен как функция напряжения затвора (VD). Как и в случае со снятой защитой электрод работает в режиме полупроводника. В этом устройстве электрод выполнен из УНТ, функционализированных защищенным аптамером (GT)10 к тромбину. После высушивания выполняли измерения. После высушивания выполняли измерения. Ток между электродами (I, левая ось, темная линия) как функция напряжения затвора (V). (Правая ось и светлая линия обозначают абсолютный ток (ABS(I)).)
Пример 3: Сравнение характеристик контрольных и измерительных электродов.
Измерительные электроды выполнены согласно описанию примера 1, а контрольные электроды выполнены согласно описанию примера 2. Измеряли электрические характеристики электродов (фигура 16). Замет на электроды наносили 100 нМ тромбина, давали высохнуть и вновь измеряли электрические свойства (фигура 17). В контрольном электроде после введения тромбина никакие существенные изменения не наблюдались, тогда как в "измерительном" электроде ток возрос на коэффициент ~4 при напряжении на стоке 2 В.
На графике фигуры 16а показаны характеристики готового контрольного электрода (нанотрубки, функционализированные защищенным аптамеров (GT)10 к тромбину), на графике фигуры 16b показаны характеристики готового измерительного электрода (нанотрубки, функционализированные незащищенным(/разблокированным) аптамером (GT)10 к тромбину). После высушивания выполняли измерения. Ток между электродами (левая ось, "I", темная линия) отображен как функция напряжения на затворе (V). (Правая ось и светлая линия обозначают абсолютный ток (ABS(I)).)
На графике фигуры 17а показаны характеристики готового контрольного электрода (нанотрубки, функционализированные защищенным аптамером (GT)10 к тромбину), и на графике фигуры 17b показаны характеристики измерительного электрода (нанотрубки, функционализированные разблокированным аптамером (GT)10 к тромбину) после осаждения 100 нМ тромбина и последующего высушивания. Ток между истоком и стоком электрода (ID - темная линия) отображен как функция напряжения на затворе (VD). (Правая ось и светлая линия отображают абсолютный ток.)
Несмотря на то, что изобретение предназначено для распознавания туберкулеза, следует принимать во внимание, что оно может быть также направлено на обнаружение биомаркеров, индицирующих многие другие состояния. Более того, данная методика может быть применена для обнаружения молекулярных форм небиологической природы, включая, но не ограничиваясь, компоненты химического оружия, наркотики и взрывчатые вещества. Возможные сферы интереса: медицина/ветеринария, в частности, такие инфекционные заболевания, как туберкулез человека/КРС; национальная безопасность, в частности, такие факторы биологической угрозы, как сибирская язва, столбняк, нервнопаралитические газы и взрывчатые вещества, например, ТНТ, 2,4-ДНТ, 2-6-ДНТ и т.п.; правоохранительная деятельность, включая борьбу с наркотиками, например идентификация каннабиноидов, бензоилэкгонина и т.д.; охрана здоровья и обеспечение безопасности, в частности, выявление токсичных газов/паров, нефтепродуктов, углеводородов; контроль технологических процессов и качества; высокоценные продукты, такие как ароматические вещества, например, мускус (галаксолид); общие измерения, одномоментные, длительные или накопительные: газы, пары, жидкости, дыхание, слюна, отпечатки пальцев и следы пользования; общая или персональная среда; одиночные или множественные измеряемые величины.
Другие возможные сферы приложения: специфические комплексы диагностики коровьего туберкулеза; специфические комплексы диагностики туберкулеза человека в портах прибытия; наборы аптамерных датчиков для параллельного количественного распознавания "биоподписи" туберкулеза; диагностические схемы специфических биомаркеров для выявления других заболеваний (например, гепатита В и С); специальные диагностические схемы для детектирования боевых биологических агентов; специальные диагностические схемы для детектирования взрывчатых веществ; специальные диагностические схемы для детектирования наркотических средств; специальные диагностические схемы для детектирования токсичных газов, таких как зарин.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ковалентной функционализации углеродных нанотрубок с одновременным ультразвуковым диспергированием для введения в эпоксидные композиции | 2017 |
|
RU2660852C1 |
| ЧУВСТВИТЕЛЬНЫЙ ЭЛЕМЕНТ БИОЛОГИЧЕСКОГО СЕНСОРА | 2016 |
|
RU2661884C2 |
| Способ иммобилизации коротких нуклеотидных последовательностей на поверхность и торцевые области наноматериалов | 2019 |
|
RU2745511C1 |
| ПРОЗРАЧНЫЕ ПРОВОДЯЩИЕ ПОКРЫТИЯ БОЛЬШОЙ ПЛОЩАДИ, ВКЛЮЧАЮЩЕЕ ДОПИРОВАННЫЕ УГЛЕРОДНЫЕ НАНОТРУБКИ И НАНОПРОВОЛОЧНЫЕ КОМПОЗИТНЫЕ МАТЕРИАЛЫ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2578664C2 |
| ТОНКОПЛЕНОЧНЫЙ ГИБРИДНЫЙ ФОТОЭЛЕКТРИЧЕСКИЙ ПРЕОБРАЗОВАТЕЛЬ И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2017 |
|
RU2694113C2 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ФУНКЦИОНАЛИЗИРОВАННОЙ ФУЛЛЕРЕНАМИ УГЛЕРОДНОЙ НАНОТРУБКИ, КОМПОЗИЦИОННЫЙ МАТЕРИАЛ, ТОЛСТАЯ ИЛИ ТОНКАЯ ПЛЕНКА, ПРОВОД И УСТРОЙСТВО, ВЫПОЛНЕННЫЕ С ИСПОЛЬЗОВАНИЕМ ПОЛУЧАЕМЫХ НАНОТРУБОК | 2006 |
|
RU2483022C2 |
| УГЛЕРОДНЫЕ НАНОТРУБКИ, ФУНКЦИОНАЛИЗИРОВАННЫЕ ФУЛЛЕРЕНАМИ | 2006 |
|
RU2437832C2 |
| Способ получения тонких слоёв оксида графена с формированием подслоя из углеродных нанотрубок | 2018 |
|
RU2693733C1 |
| СПОСОБ ПОВЫШЕНИЯ ПРОЧНОСТИ НА РАЗРЫВ КОМПОЗИТНОГО МАТЕРИАЛА С ПОМОЩЬЮ ПРЕДВАРИТЕЛЬНОЙ ПРОПИТКИ УГЛЕВОЛОКОН | 2018 |
|
RU2703635C1 |
| Способ получения многослойных нанокомпозитных пленок CuO/C с сенсорными свойствами в широком спектральном оптическом диапазоне | 2023 |
|
RU2810420C1 |

Группа изобретений относится к области молекулярной диагностики и может быть использована для диагностики заболеваний с помощью молекул биомаркеров. Устройство для обнаружения специфической молекулы-мишени или биомаркера путем определения изменения электрических свойств включает: измерительный датчик, включающий проводящую или полупроводящую структуру; систему электродов, передающих сигнал от устройства; и контрольный датчик, имеющий структуру, идентичную измерительному датчику, но защищенную, т.е. предотвращающую образование связи с биомаркером и действующую как встроенный эталон. Структура измерительного датчика включает аптамерное покрытие и способна образовывать связь с биомаркером, вызывая изменение электрических свойств. Группа изобретений относится также к способу анализа пробы на наличие молекулы-мишени или биомаркера посредством указанного устройства. Группа изобретений обеспечивает повышение достоверности анализов. 2 н. и 28 з.п. ф-лы, 17 ил., 3 пр.
1. Устройство для обнаружения специфической молекулы-мишени или биомаркера посредством определения изменения электрических свойств, включающее, по крайней мере, один измерительный датчик (8), в состав которого входят:
проводящая или полупроводящая структура датчика (12), включающая аптамерное покрытие и способная образовывать связь с биомаркером, вызывая изменение электрических свойств,
и система электродов (3), передающих сигнал от устройства;
в которое входит еще, по крайней мере, один контрольный датчик (9) устройства, в целом имеющий идентичную, но защищенную структуру (14), предотвращающую образование связи с биомаркером и действующую как встроенный эталон.
2. Устройство по п. 1, в котором установление защиты структуры произведено предварительным насыщением структуры датчика молекулой-мишенью или биомаркером.
3. Устройство по п. 1, в котором структура датчика содержит олигонуклеотид и установление защиты структуры выполняется посредством связывания структуры датчика с комплементарным олигонуклеотидом.
4. Устройство по п. 1, в котором установление защиты структуры выполняется путем использования мутантной версии аптамера с рядом изменений в последовательности оснований, за счет чего блокируется распознавание биомаркера.
5. Устройство по п. 1, в котором структура датчика (12) выполнена на полупроводниковой основе, покрытой молекулами, способными к соединению с биомаркером.
6. Устройство по п. 5, в котором указанные молекулы являются аптамерами, предпочтительно специфическими.
7. Устройство по п. 5, в котором полупроводниковая основа имеет каркас из углеродных нанотрубок (УНТ).
8. Устройство по п. 7, в котором к каркасу из УНТ присоединена нить ДНК, с которой связан аптамер.
9. Устройство по п. 5, в котором полупроводниковая основа представляет собой ДНК-каркас, покрытый, например, ПВФ (поли-4-винилфенолом), Al (алюминием) или Si (кремнием), образующий "нанопроводник", обеспечивающий улучшенное качество измерения электрических эффектов.
10. Устройство по п. 7, в котором система электродов содержит пару встречногребенчатых электродов (3), между которыми расположена структура датчика.
11. Устройство по п. 10, в котором электроды (3) содержат золотые или другие токопроводящие дорожки, расположенные с интервалом, большим, чем средняя длина УНТ.
12. Устройство по п. 11, в котором дорожки отстоят относительно друг друга на 10-50 мкм.
13. Устройство по пп. 1-12, имеющее подложку (2), на который сформированы датчики и электроды.
14. Устройство по п. 13, в котором подложка выполнена из полимера, подобного ПЭТФ, ПЭН, ПВФ или ПЭГ.
15. Устройство по п. 13, в котором подложка выполнена из кремния.
16. Устройство по п. 13, имеющее два или более указанных измерительных датчиков, каждый - для отдельного специфического биомаркера.
17. Устройство по п. 13, имеющее один или более внутренних контрольных датчиков (9) и множество измерительных датчиков (8) для многофакторного измерения одного биомаркера.
18. Устройство по п. 13, в котором структуры датчиков выполнены на одной подложке (2).
19. Устройство по п. 16, в котором по соотношению электрических свойств, измеренных по снятым с электродов биомаркеров показаниям, идентифицируют вещество.
20. Устройство по пп. 1-12, в котором измеряемые электрические свойства представляют собой или включают в себя сопротивление, проводимость, емкость, импеданс или индуктивность и измеряются по сигналу постоянного тока или переменного тока высокой частоты.
21. Устройство по пп. 5-9, в котором конъюгирующие молекулы ассоциированы с биомаркерами, генерируемыми под воздействием патологических процессов, таких как туберкулез, гепатит В или гепатит С, или возникающими из-за нарушения других биологических процессов в результате, например, воздействия вредных для живых организмов веществ, таких как зарин, VX или рицин.
22. Устройство по пп. 1-12, встраиваемое в литой корпус (1), снабженный соответствующими электрическими разъемами и герметизируемый перед началом использования полимерной защитной пленкой.
23. Устройство по п. 22, предусматривающее наличие разъема для интерфейса с считывающим устройством, которое выполняет расчеты по показаниям системы датчиков и выводит заключение или определяет диагноз.
24. Устройство по п. 22, система электродов которого совместима с сопрягаемыми контурами, выполняющими сравнение сигналов от указанных двух структур датчиков для определения концентрации молекул-мишеней в пробе.
25. Устройство по п. 24, предусматривающее проверку в начале работы годности взятого для исследования образца посредством контроля содержания электролита перед измерениями в процессе конъюгации (в случае образования связи).
26. Устройство по пп. 1, 22, предусматривающее использование программного обеспечения для автоматизированного сбора информации и обмена данными.
27. Способ анализа пробы на наличие молекулы-мишени или биомаркера, согласно которому проба проходит через детектор, состоящий, по крайней мере, из двух спаренных датчиков с идентичной структурой - измерительного и контрольного, содержащих аптамерное покрытие и предназначенных для соединения с мишенью, при этом структура контрольного датчика защищена от образования связи с мишенью и используется для контроля измерений, выполняемых измерительным датчиком.
28. Способ по п. 27, согласно которому одновременно используют несколько пар измерительных и контрольных датчиков, где каждая пара функционализирована индивидуальной мишенью.
29. Способ по п. 27, согласно которому молекулы-мишени могут быть как биомаркерами заболеваний, так и идентификаторами взрывчатых веществ, наркотиков или других нежелательных молекул, например, боевых отравляющих веществ, таких как зарин, для чего структура датчика содержит аптамеры, нацеленные на образование связи с этими молекулами.
30. Способ по пп. 27-29, согласно которому в результате измерения возникает электрический сигнал, который усиливается и передается, допустим, через мобильный телефон, из точки снятия измерений в полевых условиях на центральный пункт сбора данных.
| WO 2007102629 A1, 13.09.2007 | |||
| WO 2007001401 A2, 04.01.2007 | |||
| US 2004200734 A1, 14.10.2004. |
Авторы
Даты
2017-04-25—Публикация
2012-04-02—Подача