Изобретение относится к области биотехнологии, в частности к получению генетических конструкций, содержащих оптимизированную нуклеотидную последовательность, которая кодирует рекомбинантный белок - аналог интерферона альфа-17.
Вирусный гепатит С (ВГС) является основной причиной хронических болезней печени таких как цирроз и гепатоклеточная карцинома. ВГС является одной из основных проблем мирового здравоохранения, около 3% населения планеты страдают хроническим ВГС. В настоящее время терапия ВГС основана на использовании интерферонов I типа, в первую очередь интерферонов альфа 2а и 2b. Однако эффективность лечения не достигает 55%, при применении высоких доз интерферонов альфа часто проявляются побочные действия, что приводит к снижению качества жизни больных и служит причиной вынужденного прерывания курса лечения.
Одним из методов улучшения терапии ВГС может быть использование других вариантов молекул интерферонов альфа, обладающих повышенной антивирусной активностью. Исследования последних лет показали, что среди интерферонов альфа существуют варианты, значительно превосходящие по антивирусной активности интерфероны альфа-2.
Наибольшей активностью против ВГС в различных тестах in vitro обладает интерферон альфа-17 [Virology Journal 2009, 6:70. Enhanced anti-HCV activity of interferon alpha 17 subtype]. В исследованиях на клеточной линии Huh 7, несущей геном вируса гепатита С, было показано, что концентрация интерферона, необходимая для 50% уменьшения экспрессии субгеномной РНК (ЕС50), для интерферона альфа-17 составляет 22 пг/мл, а для интерферона альфа-2 - 154 пг/мл. Ингибирование образования вирусных частиц (IC50) для интерферона альфа-17 составило 4 пг/мл, а для интерферона альфа-2 - 14,6 пг/мл. Т.о. в тестах in vitro показано значительное превышение активности против вируса гепатита С интерферона альфа-17 по сравнению с интерфероном альфа-2.
Препарат на основе рекомбинантного белка - аналога интерферона альфа-17 представляет большой интерес для терапии ВГС, т.к. позволит преодолеть недостатки существующих препаратов интерферонов альфа за счет снижения количества вводимого лекарственного препарата и частоты его введения, а проведение исследований этого препарата, в том числе доклинических и клинических, является актуальной задачей.
Природный ген, кодирующий интерферон альфа-17 человека не приспособлен для эффективной экспрессии в Е. coli. Это связано с наличием редко встречающихся в Е. coli кодонов AGG и AGA для аргинина, а так же с наличием последовательностей гомологичных регуляторным участкам генов Е. coli, что приводит к прерыванию трансляции либо инициации трансляции с внутренних участков гена (SD-сайты). Совокупность этих причин приводит к низкой эффективности экспрессии (не более 5%), что не позволяет разработать коммерчески выгодную технологию получения препаратов на основе интерферона альфа-17.
Наличие неоптимальных для Е. coli кодонов характерно для всех генов кодирующих интерфероны первого типа. Для преодоления этой проблемы используются оптимизированные гены, кодирующие целевые белки. Так в патенте US 7,642,072 описана оптимизированная последовательность гена, кодирующая интерферон бета 1b. В патенте RU 2354703 описана оптимизированная последовательность гена, кодирующая IL-21.
Ближайшим аналогом изобретения является патент US 7,371,819, описывающий экспрессию полипептидов неоптимизированного гена интерферона альфа-17.
Задачей изобретения является получение генетической конструкции, содержащей оптимизированную нуклеотидную последовательность, которая кодирует рекомбинантный белок - аналог интерферона альфа-17, для эффективной экспрессии в Е. coli. с целью получения препарата на основе интерферона альфа-17.
Для этого:
1. Получена нуклеиновая кислота, кодирующая рекомбинантный белок аналог интерферона альфа-17 человека с SEQ ID NO: 2 и характеризующаяся нуклеотидной последовательностью SEQ ID NO: 1.
2. Получен штамм-продуцент бактерий Е. Coli BL-30-A17 для продукции рекомбинантного белка аналога интерферона альфа-17 с SEQ ID NO: 2, полученный путем трансформации клеток E. coli BL(DE3) плазмидой рЕТ30а, содержащей нуклеиновую кислоту по п. 1.
3. Получен штамм-продуцент бактерий Е. Coli BL-32-A17 для продукции рекомбинантного белка аналога интерферона альфа-17 с SEQ ID NO: 2, полученный путем трансформации клеток E. coli BL(DE3) плазмидой рЕТ32а, содержащей нуклеиновую кислоту по п. 1.
Краткое описание чертежей.
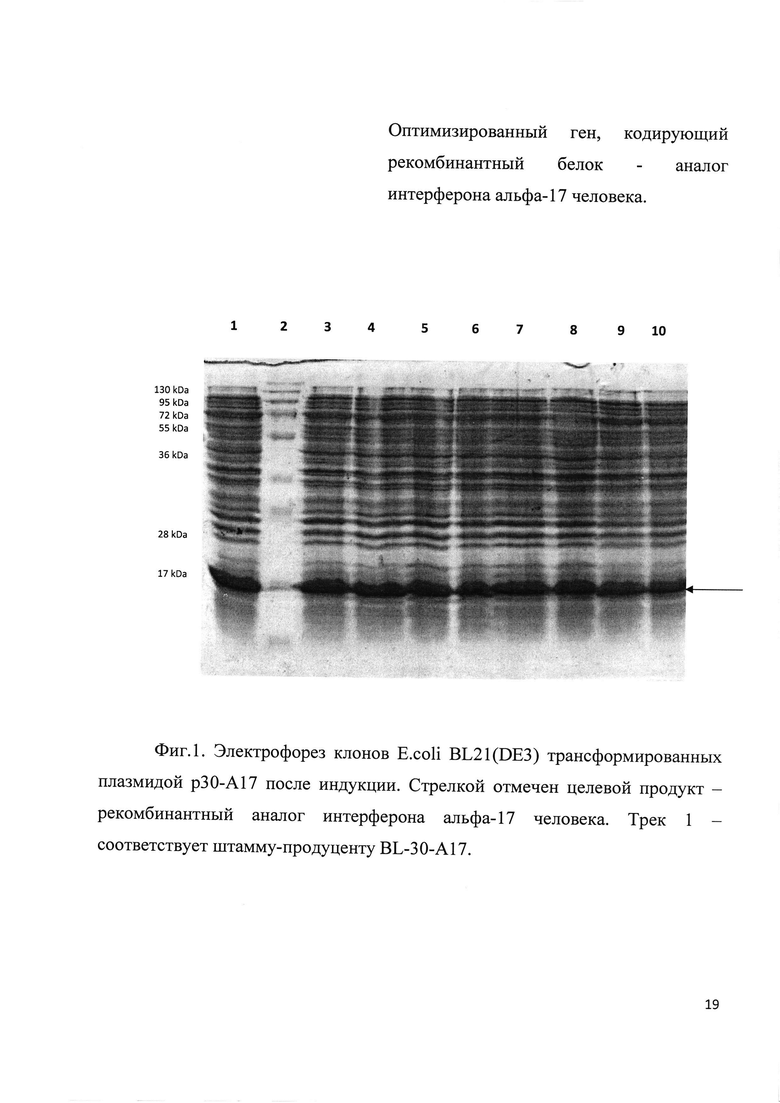
Фиг. 1. Электрофорез клонов E. coli BL21(DE3) трансформированных плазмидой р30-А17 после индукции. Стрелкой отмечен целевой продукт - рекомбинантный аналог интерферона альфа-17 человека. Трек 1 - соответствует штамму-продуценту BL-30-A17.
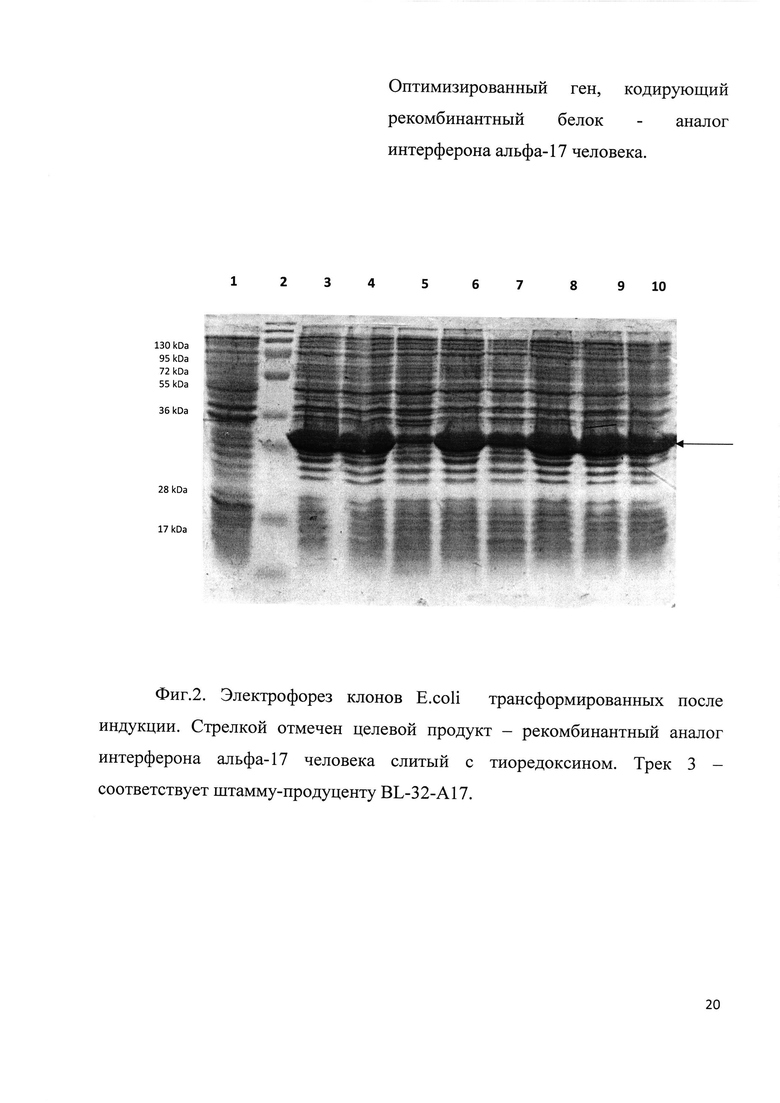
Фиг. 2. Электрофорез клонов E. coli трансформированных после индукции. Стрелкой отмечен целевой продукт - рекомбинантный аналог интерферона альфа-17 человека слитый с тиоредоксином. Трек 3 - соответствует штамму-продуценту BL-32-A17.
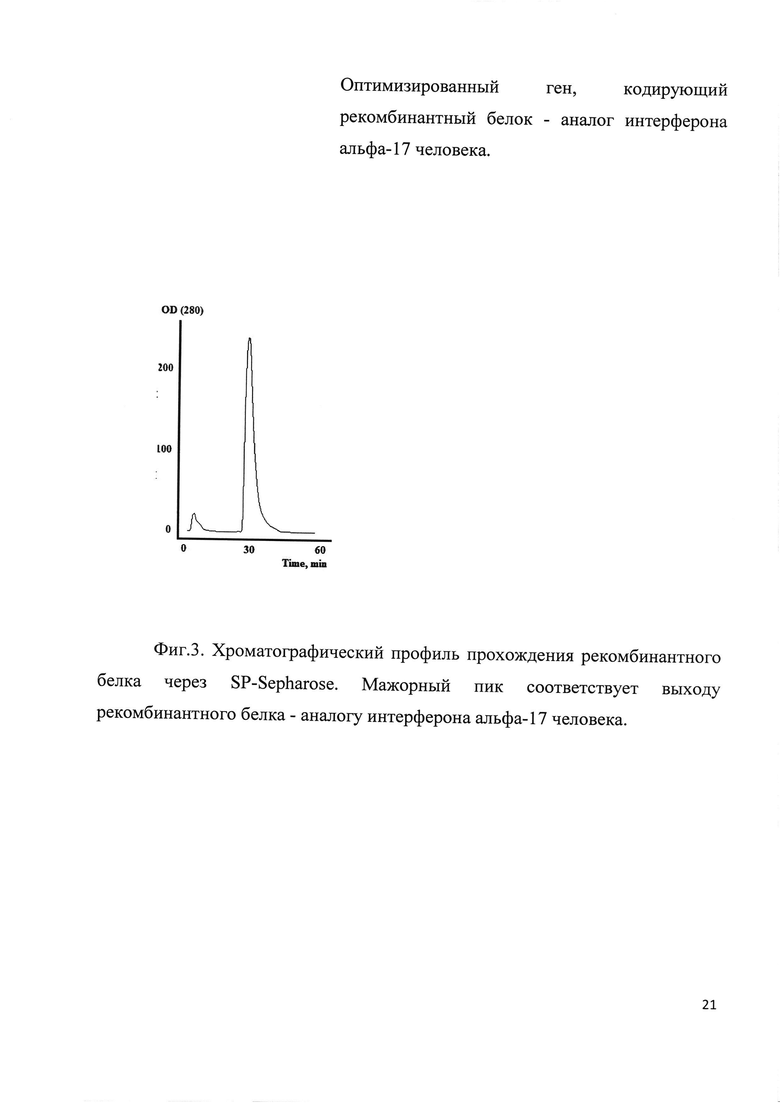
Фиг. 3. Хроматографический профиль прохождения рекомбинантного белка через SP-Sepharose. Мажорный пик соответствует выходу рекомбинантного белка - аналогу интерферона альфа-17 человека.
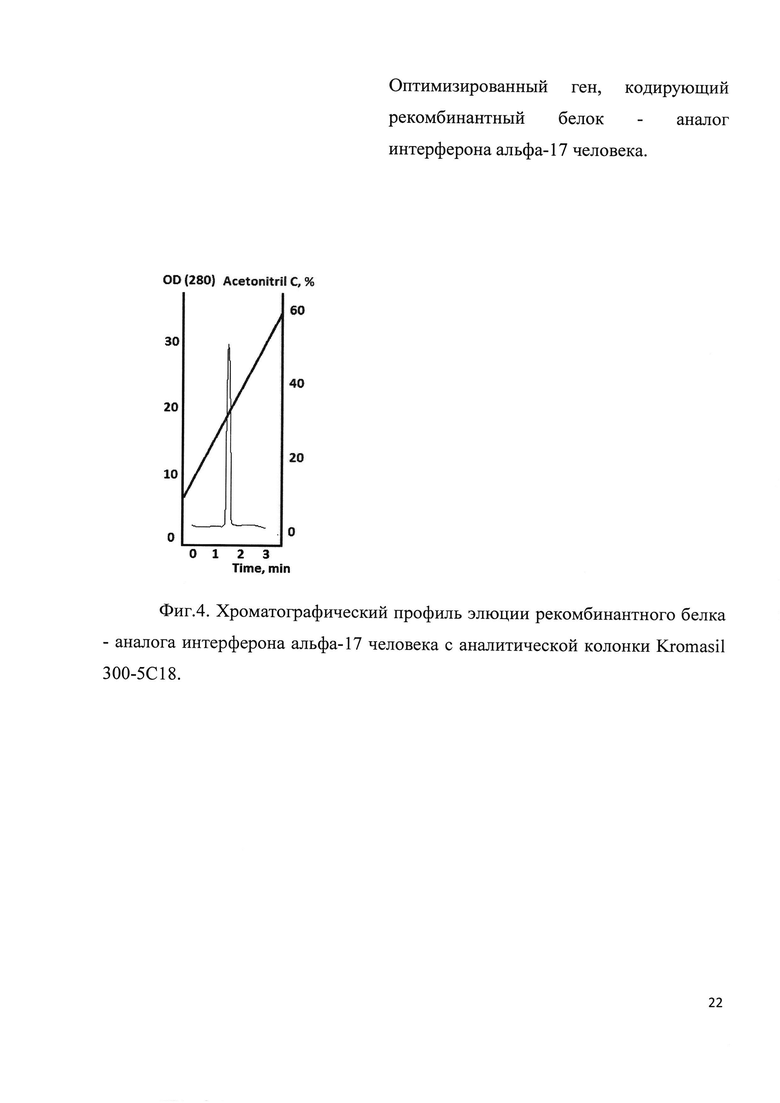
Фиг. 4. Хроматографический профиль элюции рекомбинантного белка - аналога интерферона альфа-17 человека с аналитической колонки Kromasil 300-5С18.
Фиг. 5 Определение рекомбинантного белка аналога интерферона альфа-17 твердофазным иммунным анализом.
Фиг. 6. Электрофорез лизатов клеток штамма-продуцента Е. coli BL-32-A17.
Техническим результатом является получение генетической конструкции, позволяющей эффективно синтезировать в клетках E. coli рекомбинантный белок - аналог интерферона альфа-17 с SEQ ID NO: 2, а также получение стабильных штаммов-продуцентов Е. Coli BL-30-A17 и Е. Coli BL-32-A17 с эффективностью экспрессии рекомбинантного белка - аналога интерферона альфа-17 с SEQ ID NO: 2 не менее 50% от суммарного клеточного белка.
ИЗОБРЕТЕНИЕ ИЛЛЮСТРИРУЮТ ПРИМЕРЫ.
1. ОПТИМИЗАЦИЯ НУКЛЕОТИДНОЙ ПОСЛЕДОВАТЕЛЬНОСТИ.
Кодоны нуклеотидной последовательности, кодирующей рекомбинантный белок - аналог интерферона альфа-17, были оптимизированы для экспрессии в клетках Е. coli, путем замены на кодоны, часто встречаемые в геноме Е. coli K12. Частота использования кодонов в геноме Е. coli взята из: Y Nakamura, K Wada, Y Wada, Н Doi, S Kanaya, T Gojobori, and T Ikemura. Codon usage tabulated from the international DNA sequence databases. Nucleic Acids Res. 1996 Jan 1; 24(1): 214-215.
Дополнительно часть кодонов CTG, кодирующих лейцин были заменены на кодоны ТТА или TTG, все кодоны AGC, кодирующие серии, были заменены на кодоны ТСТ или ТСС. Замены были введены для того, чтобы ликвидировать внутренние SD-сайты. Разработанная оптимизированная нуклеотидная последовательность показана на SEQ ID NO: 1.
2. ПОЛУЧЕНИЕ ПЛАЗМИДЫ Р30-А17.
Оптимизированную нуклеотидную последовательность, кодирующую рекомбинантный белок - аналог интерферона альфа-17, гидролизовали ферментами рестрикции NdeI и HindIII. Коммерческую плазмиду рЕТ30а так же гидролизовали ферментами рестрикции NdeI и HindIII. Продукты гидролиза разделяли с помощью электрофореза в 1% агарозе, продукты выделяли из геля, объеденяли и лигировали с помощью Т4 ДНК-лигазы. Лигазной смесью трансформировали клетки XL-1, высевали на чашку Петри и инкубировали 16 часов при 37 С. Выросшие клоны анализировали на присутствие целевой плазмиды методом ПЦР. Клоны, содержащие рекомбинантную плазмиду, выращивали, из полученной биомассы выделяли целевой продукт - плазмиду р30-А17.
3. ПОЛУЧЕНИЕ ПЛАЗМИДЫ Р32-А17.
Оптимизированную нуклеотидную последовательность, кодирующую рекомбинантный белок - аналог интерферона альфа-17 гидролизовали ферментами рестрикции KpnI и HindIII. Коммерческую плазмиду рЕТ32а так же гидролизовали ферментами рестрикции KpnI и HindIII. Продукты гидролиза разделяли с помощью электрофореза в 1% агарозе, продукты выделяли из геля, объеденяли и лигировали с помощью Т4 ДНК-лигазы. Лигазной смесью трансформировали клетки XL-1, высевали на чашку Петри и инкубировали 16 часов при 37 С. Выросшие клоны анализировали на присутствие целевой плазмиды методом ПЦР. Клоны, содержащие рекомбинантную плазмиду, выращивали, из полученной биомассы выделяли целевой продукт - плазмиду р32-А17.
4. ПОЛУЧЕНИЕ ШТАММОВ-ПРОДУЦЕНТОВ.
Плазмидами р30-А17 и р32-А17 трансформировали клетки Е. coli штамма BL21(DE3) высевали на чашку Петри и инкубировали 16 часов при 37 С. Выросшие клоны анализировали на экспрессию целевого белка методом электрофореза в ПААГ. Клоны экспрессирующие наибольшее количество белка (Фиг. 1 и Фиг. 2) были отобраны как штаммы продуценты BL-30-A17 и BL-32-A17. Клетки штаммов продуцентов выращивали и хранили при -70С.
5. ВЫДЕЛЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА.
Клетки штамма-продуцента пересевали в культуральную колбу с 200 мл LB, содержащим 25 мг/мл канамицина. Культура выращивалась на шейкере при 280 об/мин при температуре 37 С до достижения оптической плотности значения OD585=0,8E. Индукция экспрессии белка проводилась добавлением IPTG до концентрации 1 mM. Культура дополнительно культивировалась 4 часа, далее клетки осаждались центрифугированием при 5000 g. Осадок клеток лизировали в 8 М мочевине и обрабатывали на ультразвуковом дезинтеграторе. Лизат клеток центрифугировали при 20000 g 2 часа. Супернатант фильтровали через колонку с Q-Sepharose. Фракцию, не связавшуюся с данным сорбентом, хроматографировали на SP-Sepharose в градиенте NaCl (стартовый буфер: 20 mM TrisHCl рН 6.8, 20 mM NaCl, итоговый буфер 20 mM TrisHCl рН 6.8, 400 mM NaCl). Хроматографический профиль представлен на Фиг. 3. Фракции, содержащие целевой продукт объединяли и диализовали в 10 mM уксусную кислоту. Чистоту продукта анализировали методом ВЭЖХ (Фиг. 4). Биологическая активность выделенного рекомбинантного белка - аналога интерферона альфа-17 в системе MDBK/VSV составила 2,1*109 Ед/мкмоль.
ПРИМЕР 1. ОПРЕДЕЛЕНИЕ РЕКОМБИНАНТНОГО БЕЛКА АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17 ТВЕРДОФАЗНЫМ ИММУННЫМ АНАЛИЗОМ.
В основу экспресс-методики определения подлинности рекомбинантного белка аналога интерферона альфа-17 положен стандартный твердофазный иммунный анализ (взаимодействие специфических антител с антигенами на твердом носителе), представленный на Фиг. 5.
Исследуемый раствор смешивается с проявляющим раствором, в котором содержатся антитела к определяемому веществу, окрашенные красителем акридиновым желтым, а так же мышиные IgG, так же окрашенные красителем акридиновым желтым. Если в растворе содержится рекомбинантный белок аналог интерферона альфа-17, то оно специфически связывается с соответствующими антителами, если нет, то специфического связывания не происходит. Тест-полоска с сорбированными антителами к белку и антителами к IgG мыши помещается сорбентом С1 в исследуемый раствор, который ранее был смешен с проявляющим раствором. За счет капиллярного эффекта раствор начинает подниматься вверх по нитроцеллюлозе. Если в растворе есть рекомбинантный белок аналог интерферона альфа- 17, то он связалось с окрашенными антителами и прекратит свое продвижение по нитроцеллюлозе как только достигнет сорбированных на ней антител к рекомбинантному белку ИФН альфа-17, начнет формироваться желтая полоса. Мышиные IgG продвигаются дальше пока не достигнут сорбированных антитела кролика к мышиным антителам, начнет формироваться вторая желтая полоса. Если в растворе нет рекомбинантного белка ИФН альфа-17, то все антитела двигаются до тех пор, пока не достигнут сорбированных антитела кролика к мышиным антителам, будет сформирована одна желтая полоса. Избыток жидкости будет впитан сорбентом С2.
Определяли свойства экспресс-методики на растворах с определяемым веществом (рекомбинантный белок аналог интерферона альфа- 17), и на веществах, схожих с ним по строению (рекомбинантный белок - аналог интерферона альфа-17, соединенный с белком-стабилизатором), а так же по чистому растворителю (50 мМ Tris-HCl рН 6,8) и раствору БСА.
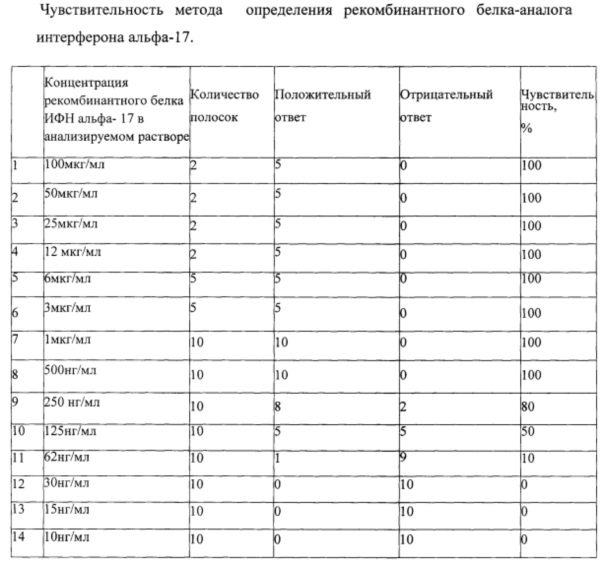
ВАЛИДАЦИЯ ПО РЕКОМБИНАНТНОМУ БЕЛКУ ИФН АЛЬФА-17 - ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ
В анализируемом растворе определяли концентрацию рекомбинантного белка ИФН альфа-17 по Бредфорд. Приготовили раствор с концентрацией 0,1 мг/мл рекомбинантного белка ИФН альфа-17 в 50 мМ Tris-HCl рН 6,8. Разбавляя данный раствор получены растворы с концентрацией 100 мкг/мл, 50 мкг/мл, 25 мкг/мл, 12 мкг/мл, 6 мкг/мл, 3 мкг/мл, 1 мкг/мл, 500 нг/мл, 250 нг/мл, 125 нг/мл, 62 нг/мл, 30 нг/мл, 15 нг/мл, и 10 нг/мл. Все растворы в количестве 0,5 мл смешивали с 0,5 мл проявляющего раствора и анализировали на тест-полосках. Все растворы, до концентрации 500 нг/мл были определены с точностью на 100% как положительные, растворы с концентрацией 250 нг/мл были определены как положительные с точностью 80%, с концентрации от 125 нг/мл и ниже точность определения ниже. Таким образом, предел определения составил 500 нг/мл вещества. Данные представлены в таблице 1.
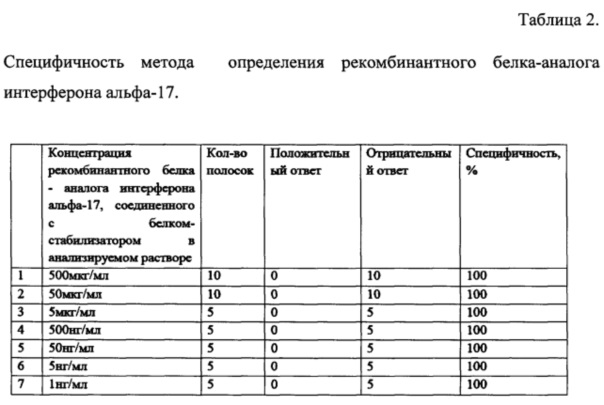
ВАЛИДАЦИЯ ПО РЕКОМБИНАНТНОМУ БЕЛКУ-АНАЛОГУ ИНТЕРФЕРОНА АЛЬФА-17, СОЕДИНЕННОГО С БЕЛКОМ-СТАБИЛИЗАТОРОМ - ОПРЕДЕЛЕНИЕ СПЕЦИФИЧНОСТИ.
Приготовили раствор, содержащий рекомбинантный белок-аналог интерферона альфа-17, соединенного с белком-стабилизатором в концентрации 1000 мкг/мл в 50 мМ Tris-HCl рН 6,8. Разбавляя данный раствор получены растворы с концентрацией веществ в 500 мкг/мл, 50 мкг/мл, 5 мкг/мл, 500 нг/мл, 50 нг/мл и 5 нг/мл. Все растворы в количестве 0,5 мл смешивали с 0,5 мл проявляющего раствора и анализировали на тест-полосках. Все растворы были определены как растворы, не содержащие в своем составе рекомбинантный белок аналог интерферона альфа-17. Данные представлены в таблице 2.
Таким образом, полученные данные доказывают подлинность рекомбинантного белка аналога интерферона альфа-17 человека с SEQ ID NO: 2, кодируемого нуклеотидной последовательностью SEQ ID NO: 1
ПРИМЕР 2. ИЗУЧЕНИЕ СПЕЦИФИЧЕСКОЙ АНТИВИРУСНОЙ АКТИВНОСТИ И МЕХАНИЗМОВ ДЕЙСТВИЯ
Изучение механизмов противовирусной активности проводили на клеточных линиях MDBK и WISH, т.к. они имеют рецепторы к интерферонам. Известно, что после связывания с рецептором на поверхности клеток интерферон альфа 17 индуцирует передачу внутриклеточного сигнала посредством белковых факторов STAT1 и STAT2 в ядро клетки и тем самым запускает экспрессию генов противовирусной защиты, таких как гены MX и ISG56. В связи с этим, в рамках данной тест-системы в клетки MDBK и WISH, содержащие на своей поверхности рецепторы к интерферону альфа 17, методом трансфекции внедряли плазмиды, кодирующие репортерный ген галактозидазы Gal под контролем промоторов генов MX и ISG56; соответствующие названия плазмид pMX-Gal и pISG56-Gal. Таким образом, выбранная тест-система позволяет оценить механизм противовирусного действия рекомбинантного ИФН альфа- 17 (BL-30-A17) и рекомбинантного ИФН альфа-17 (BL-32-A17), полученных штаммами-продуцентами бактерий Е. Coli BL-30-A17 и Е. Coli BL-32-A17, трансфецированными плазмидами рЕТ30а и рЕТ32а, соответсвенно. А также оценить - опосредуется ли противовирусная активность активацией генов MX и ISG56, как это описано для природного интерферона альфа 17. Для исследования противовирусной активности ИФН альфа- 17 (BL-30-A17) и ИФН альфа- 17 (BL-32-A17) был выбран широкий диапазон концентраций: 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ, 0,01 пМ. А для изучения механизмов действия используют концентрации: 1000 пМ, 100 пМ, 10 пМ и 1 пМ. В качестве препарата сравнения используют идентичные концентрации коммерческого препарата IFNα2. Противовирусную активность исследуемых препаратов изучали с использованием вируса везикулярного стоматита VSV, штамм Indiana, или цитомегаловируса (ECMV) взятого в дозе 100 LD50/лунку. Результат оценивали с помощью световой микроскопии и выражали в ЕС50 - эффективная концентрация препарата, при которой наблюдается 50% протективный противовирусный эффект.
Для этого клетки засеивали в 96-луночный планшет в количестве 20 тыс. кл./лунку в объеме 100 мкл/лунку полной среды Игла -MEM (содержащей 10% фетальной сыворотки 300 мг/л L-глутамина и антибиотик гентамицин 100 мг/мл). Затем инкубировали в течении суток CO2-инкубаторе при 370 С в 5% атмосфере CO2. После инкубации культуру клеток отмывали от сывороточной среды Игла -MEM, для этого снимали старую среду и, не касаясь монослоя с помощью многоканальной пипетки, вносили по 100 мкл/лунку стерильного физиологического раствора, инкубировали в течение 5 мин, затем отбирали физиологический раствор, не касаясь монослоя клеток и вносили по 100 мкл/лунку безсывороточной среды Игла - MEM. После отмывки проводили трансфекцию клеток 300 нг плазмиды pMX-Gal или pISG56-Gal с использованием набора реагентов Escort IV (Sigma) в соответствии с рекомендациями производителя. Трансфецированная культура клеток инкубировалась в течении суток в CO2-инкубаторе при 37 С в 5% атмосфере CO2. Далее повторяли процедуру отмывки (как описано выше) и вносили исследуемые препараты и коммерческий препарат сравнения IFNα2 в четырех следующих концентрациях: 1000 пМ, 100 пМ, 10 пМ и 1 пМ. После внесения проводили инкубацию в течении 18 часов в CO2-инкубаторе при 370 С в 5% атмосфере CO2. После окончания инкубации клетки промывали, как описано выше, и лизировали буфером (Sigma), в дальнейшем в лизаты вносили 50 мкл субстрата p-Nitrophenyl β-D-glucopyranoside (Sigma) и измеряли оптическую плотность раствора лизата с помощью микропланшетного фотометра Reader MPR1 (ScoTech, Германия) при длине волны 360 нм. Значения оптической плотности раствора лизата клеток были прямо пропорциональны количеству фермента галактозидазы, кодированной плазмидами. Для изучения механизма противовирусной активности препарата использовали тест систему на основе клеток WISH и MDBK, которые имеют на своей поверхности рецепторы к интерферону альфа 17. В данные клеточные линии методом химической трансфекции были внедрены две рекомбинантные плазмиды, несущие репортерный ген галактозидазы Gal, под контролем либо MX- либо ISG56-промотера. В результате, данная тест система по степени окрашивания галактозидазой субстрата позволяет оценить - активируются ли гены MX и ISG56 в ответ на обработку клеток ИФН альфа- 17 (BL-30-A17) и ИФН альфа- 17 (BL-32-A17). При этом активность галактозидазы (определяемая по оптической плотности) была прямо пропорциональна степени активации генов MX и ISG56.
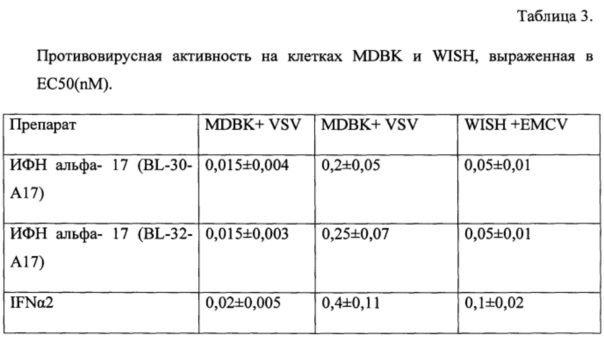
Для ИФН альфа- 17 (BL-30-A17) и ИФН альфа- 17 (BL-32-A17) и коммерческого препарата IFNα2 была изучена их противовирусная активность в шести концентрациях 1000 пМ, 100 пМ, 10 пМ, 1 пМ, 0,1 пМ, 0,01 пМ. Было показано, что коммерческий препарат сравнения "IFNα2" проявлял выраженную противовирусную активность по отношению к модельному вирусу VSV и EMCV, а значения ЕС50 составили от 0,02 до 0,4 пМ в зависимости от типа клеток. Противовирусная активность разрабатываемых ИФН альфа- 17 (BL-30-A17) и ИФН альфа- 17 (BL-32-A17) превосходила таковую у коммерческого препарата IFNα2, т.к. требовалась их меньшая концентрация (от 0,015 до 0,25 пМ) для аналогичного ингибирования цитопатического действия вируса (Таблица 3).
ПРИМЕР 3. НАРАБОТКА И ИНДУКЦИЯ СИНТЕЗА РЕКОМБИНАНТНОГО БЕЛКА - АНАЛОГА ИНТЕРФЕРОНА АЛЬФА-17.
В реактор ферментера BioFlo 100 - New Brunswick Scientific с рабочим объемом 6 литров вносилась среда LB стерилизованная фильтрацией через 0,22 мкм фильтр, содержащей 25 мкг/мл канамицина. Пробирка со штаммом-продуцентом помещалась в ферментер. При 37 С, в течение 10 часов при 300 об/мин культура выращивалась. Далее содержимое ферментера стерильно переносилось в реактор ферментера BioFlo 100 - New Brunswick Scientific с рабочим объемом 15 литров, туда же вносилось 12 литров среды 1,5XLB стерилизованной фильтрацией через 0,22 мкм фильтр, содержащей 25 мкг/мл канамицина. Ферментация проводилась согласно подобраным условиям, т.е. при dO2=69%, Т=34 С, рН=7.2, при частоте вращения 900 об/мин. После засева при 34 С, в течение 3 часов при 900 об/мин культура выращивалась. Далее вносилось 400 мл среды LB стерилизованной фильтрацией через 0,22 мкм фильтр, содержащей 25 мкг/мл канамицина и 0,9 мг/мл IPTG. Происходила индукция экспрессии рекомбинантного белка - аналога интерферона альфа-17, соединенного с белком-стабилизатором. Далее ферментация продолжалась еще 7 часов. Затем культура клеток подвергалась лизису. Для этого шейкер переводили на самые малые обороты (50 об/мин) и вносили лизирующий буфер. Буфер содержит ферменты лизоцим и ДНК-азу. Лизоцим разрушает полисахаридную оболочку клетки, ДНК-аза гидролизует ДНК, выходящую из лизированных клеток, снижая вязкость. Буфер так же содержит мягкий детергент TRITON Х-100 в концентрации 500 мкг/мл, который не позволяет активироваться бактериальным протеазам и повредить целевой продукт, при этом он участвует в деструкции билипидного слоя клеточной мембраны бактерии. Концентрация детергента такова, что не мешает сорбции рекомбинантного белка на металл-афинный сорбент. После инкубации с лизирущим буфером культура клеток анализируется на наличие целевого белка методом SDS-электрофореза в ПААГ. Лизат клеток, содержащий целевой продукт, затем подвергался хроматографической очистки. Результаты электрофореза представлены на фиг. 6.
По результатам электрофореза установлено, что количество рекомбинантного белка составляло 50% общего клеточного белка. На фиг. 6 представлен электрофорез лизатов клеток штамма-продуцента Е. coli BL-32-А17 в полиакриламидном геле.
Таким образом, полученная генетическая конструкция позволяет эффективно синтезировать в клетках E. coli рекомбинантный белок - аналог интерферона альфа-17, представленный последовательностью SEQ ID NO 2.
Полученный штамм Е. coli BL-32-A17 позволяет получать рекомбинантный белок - аналог интеферона альфа-17 с SEQ ID NO: 2 в количестве не менее 50% от суммарного клеточного белка.
Перечень последовательностей
<110> ФГБУ "ГНЦ Институт иммунологии" ФМБА России
<120> «Оптимизированный ген, кодирующий рекомбинантный белок-аналог интерферона альфа-17 человека»
<160> NUMBER OF SEQ ID NOS: 2
<210> SEQ ID NO 1
<211> 515
<212> DNA
<213> artificial
<400> SEQUENCE 1:
CATATGTGTGATTTACCACAAACTCATTCTTTAGGTAATCGTCGTGCACTGATCCTCTTGGCTCAGATGGGTCGTATCTCTCCGTTCTCCTGCCTGAAAGATCGTCATGACTTTGGCCTGCCGCAGGAAGAGTTCGATGGTAACCAGTTTCAGAAGACCCAAGCAATCTCTGTGCTGCATGAGATGATCCAACAGACCTTCAACCTGTTCTCTACTGAAGATTCTTCCGCTGCATGGGAACAGTCTCTCTTAGAAAAATTCTCTACCGAACTGTACCAGCAACTGAACAATCTTGAAGCATGCGTGATCCAAGAAGTGGGTTGCGAAGAGACTCCGTTGATGAACGAAGATTCTATCCTGGCAGTGCGTAAATACTTCCAGCGTATCACCTTGTACCTGACTGAGAAGAAATACTCTCCGTGCGCTTGGGAAGTGGTTCGTGCAGAGATCATGCGTTCTCTGTCCTTCTCTACCAACCTGCAGAAGATTCTCCGCCGCAAGGACTAATGAAGCTT
<210> SEQ ID NO 2
<211> 166
<212> AA (amino acid)
<213> artificial
<400> SEQUENCE 2:
CDLPQTHSLGNRRALILLAQMGRISPFSCLKDRHDFGLPQEEFDGNQFQKTQAISVLHEMIQQTFNLFSTEDSSAAWEQSLLEKFSTELYQQLNNLEACVIQEVGMEETPLMNEDSILAVRKYFQRITLYLTEKKYSPCAWEVVRAEIMRSLSFSTNLQKILRRKD
| название | год | авторы | номер документа |
|---|---|---|---|
| ОПТИМИЗИРОВАННЫЙ ГЕН, КОДИРУЮЩИЙ РЕКОМБИНАНТНЫЙ БЕЛОК - АНАЛОГ ИНТЕРФЕРОНА БЕТА ЧЕЛОВЕКА | 2015 |
|
RU2614264C2 |
| ОПТИМИЗИРОВАННЫЙ ГЕН, КОДИРУЮЩИЙ РЕКОМБИНАНТНЫЙ БЕЛОК ИПФIII | 2015 |
|
RU2614124C1 |
| Штамм бактерий Escherichia Coli - продуцент рекомбинантного белка IL-29 | 2020 |
|
RU2760585C1 |
| Рекомбинантная плазмидная ДНК pET21-IFN-γ, содержащая ген, кодирующий гамма-интерферон человека, штамм E.coli BL21/pET21-IFN-γ - продуцент рекомбинантного гамма-интерферона человека и способ получения гамма-интерферона человека | 2023 |
|
RU2827613C1 |
| ГИБРИДНЫЙ БЕЛОК, ОБЛАДАЮЩИЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ, НА ОСНОВЕ РЕКОМБИНАНТНОГО ИНТЕРФЕРОНА АЛЬФА-2 ЧЕЛОВЕКА (ВАРИАНТЫ), СПОСОБ ЕГО ПОЛУЧЕНИЯ И ШТАММ Saccharomyces cerevisiae ДЛЯ ОСУЩЕСТВЛЕНИЯ ЭТОГО СПОСОБА (ВАРИАНТЫ) | 2013 |
|
RU2515913C1 |
| Способ очистки лекарственного средства пролонгированного действия на основе рекомбинантного аналога интерферона альфа-17 для лечения вирусного гепатита С | 2017 |
|
RU2650755C1 |
| СИСТЕМА ЭКСПРЕССИИ И СПОСОБ ПОЛУЧЕНИЯ НЕМОДИФИЦИРОВАННЫХ РЕКОМБИНАНТНЫХ БЕЛКОВ В Escherichia coli С ЕЁ ИСПОЛЬЗОВАНИЕМ | 2015 |
|
RU2604796C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pET32a-IFG144, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ИНТЕРФЕРОНА ГАММА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI JM109/pET32a-IFG144 ПРОДУЦЕНТ БЕЛКА ИНТЕРФЕРОН ГАММА И СПОСОБ ПОЛУЧЕНИЯ ИНТЕРФЕРОНА ГАММА | 2022 |
|
RU2787131C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pET32a-IFG144, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ИНТЕРФЕРОНА ГАММА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI JM109/pET32a-IFG144 - ПРОДУЦЕНТ БЕЛКА ИНТЕРФЕРОН ГАММА, СПОСОБ ПОЛУЧЕНИЯ ИНТЕРФЕРОНА ГАММА И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2809358C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК L-HEP, ШТАММ ESCHERICHIA COLI ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2019 |
|
RU2716975C1 |


Изобретение относится к области биотехнологии, конкретно к рекомбинантному получению белков человека, и может быть использовано для получения рекомбинантного белка аналога интерферона альфа-17. Нуклеотидная последовательность, кодирующая рекомбинантный белок - аналог интерферона альфа-17, оптимизирована для экспрессии в клетках Е. coli за счет использования кодонов, оптимальных для данной бактерии. Нуклеотидная последовательность клонирована в плазмиды рЕТ30а и рЕТ32а, которые использованы для получения штаммов-продуцентов Е. coli. Изобретение позволяет экспрессировать с эффективностью более 50% аналог интерферона альфа-17 с активностью в системе MDBK/VSV 2,1*109 Ед/мкмоль. 3 н.п. ф-лы, 6 ил., 3 табл., 3 пр.
1. Нуклеиновая кислота, кодирующая рекомбинантный белок - аналог интерферона альфа-17 человека с SEQ ID NO: 2 и характеризующаяся нуклеотидной последовательностью SEQ ID NO: 1.
2. Штамм бактерий Е. coli BL-30-A17 для продукции рекомбинантного белка - аналога интерферона альфа-17 с SEQ ID NO: 2, полученный путем трансформации клеток E. coli BL(DE3) плазмидой рЕТ30а, содержащей нуклеиновую кислоту по п. 1.
3. Штамм бактерий Е. coli BL-32-A17 для продукции рекомбинантного белка - аналога интерферона альфа-17 с SEQ ID NO: 2, полученный путем трансформации клеток E. coli BL(DE3) плазмидой рЕТ32а, содержащей нуклеиновую кислоту по п. 1.
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ ПРОТИВОВИРУСНОЙ, АНТИПРОЛИФЕРАТИВНОЙ И/ИЛИ ИММУНОМОДУЛИРУЮЩЕЙ АКТИВНОСТЬЮ, ВЫДЕЛЕННЫЙ ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ПОЛИПЕПТИД И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2328528C2 |
| CN 102660491 A, 12.09.2012 | |||
| CN 102994611 A, 27.03.2013 | |||
| US 7642072 B2, 05.01.2010 | |||
| ПРОДУЦИРОВАНИЕ IL-21 В ПРОКАРИОТИЧЕСКИХ КЛЕТКАХ-ХОЗЯЕВАХ | 2003 |
|
RU2354703C2 |
| HUSSAIN M | |||
| et al., A new allele of interferon-a17 gene encoding IFN -a17b is the major variant in human population, Journal of interferon and cytokine research, 1998, v.18, p.469-477. | |||
Авторы
Даты
2017-05-22—Публикация
2015-06-02—Подача