Связанные заявки
Настоящее изобретение имеет приоритет по французской заявке 0105516, поданной 24 апреля 2001 и озаглавленной "Новые полинуклеотиды и полипептиды гена IFNα-17".
Предшествующий уровень техники
Область, к которой относится изобретение
Настоящее изобретение относится к новым полинуклеотидам, происходящим от нуклеотидной последовательности гена IFNα-17, содержащей новые SNP, и к новым полипептидам, происходящим от природного белка дикого типа IFNα-17, содержащего мутации, вызванные указанными SNP, а также к их терапевтическому применению.
Предшествующий уровень техники
Ген интерферона альфа 17, называемого далее IFNα-17, описан в следующих публикациях:
- Olopade et al.: "Mapping of the shortest region of overlap of deletions of the short arm of chromosome 9 associated with human neoplasia"; Genomics; 14: 437-443; 1992.
- Lawn R.M. et al.: "DNA sequence of two closely linked human leukocyte interferon genes"; Science 212 (4499), 1159-1162 (1981).
Нуклеотидная последовательность этого гена имеется в базе данных Genbank под регистрационным номером V00532.
IFNα известны своим антипролиферативным действием на клетки и своим участием в противовирусных и противопаразитарных ответах.
Также известно, что IFNα ингибируют экспрессию некоторых других цитокинов на уровне гемопоэтических стволовых клеток, а также ингибируют клеточную пролиферацию некоторых опухолей.
Кроме того, известно, что IFNα подавляют экспрессию рецепторов EGF в карциномах почек, ингибируют экспрессию некоторых митохондриальных генов, ингибируют пролиферацию фибробластов, моноцитов и В-лимфоцитов, особенно in vitro, и блокируют синтез антител В-лимфоцитами.
Также известно, что IFNα индуцируют экспрессию опухолеспецифических антигенов на поверхности опухолевых клеток, а также индуцируют гены, находящиеся под контролем промоторных областей типа ISRE (элемент ответа, стимулируемого интерфероном), путем воздействия на специфический фактор транскрипции указанного ISRE.
Известно, что IFNα вызывают различные расстройства и/или болезни у человека, такие как различные виды рака, например карциномы, меланомы, лимфомы, лейкозы и рак печени, шеи, головы и почек; сердечно-сосудистые заболевания; болезни обмена веществ, не связанные с иммунной системой, например, такие как ожирение; инфекционные заболевания, такие как гепатит В и С и СПИД; пневмонии, язвенный колит; заболевания центральной нервной системы, например болезнь Альцгеймера, шизофрения и депрессия; отторжение трансплантата ткани или органов; заживление ран; анемия у пациентов, подвергнутых диализу; аллергии; астма; рассеянный склероз; остеопороз; псориаз; ревматоидный артрит; болезнь Крона, аутоиммунные заболевания и расстройства; расстройства желудочно-кишечного тракта или даже расстройства, связанные с лечением химиотерапией.
IFNα используются, в частности, для лечения некоторых видов лейкоза, метастазирующих карцином почек, а также опухолей, вызываемых иммунодефицитом, таких как саркома Капоши в случае СПИДа. IFNα является также эффективным против других типов опухолей и против некоторых вирусных инфекций. IFNα также одобрен FDA (Управлением по контролю за качеством пищевых продуктов, медикаментов и косметических средств) как средство для лечения остроконечных бородавок или венерических болезней.
Однако IFNα, а в частности IFNα-17, при их использовании в фармацевтических композициях, дают множество побочных эффектов, таких как реакции острой гиперчувствительности (крапивница, бронхоспазм, анафилактический шок и т.п.), сердечные аритмии, пониженное кровяное давление, эпилептические припадки, нарушение функции щитовидной железы, синдромы, подобные гриппу (повышенная температура, потливость, миалгии) и т.п.
Кроме того, у пациентов, проходящих лечение интерфероном IFNα, могут вырабатываться антитела, нейтрализующие эти молекулы, в результате чего его эффективность снижается.
Авторами настоящего изобретения были обнаружены новые полипептидные и новые полинуклеотидные аналоги гена IFNα-17, имеющего функции, отличающиеся от природного белка IFNα-17 дикого типа.
Эти новые полипептиды и полинуклеотиды могут быть, в частности, использованы для лечения или профилактики вышеупомянутых расстройств или заболеваний, и при этом они не обладают всеми или частью из тех побочных эффектов, которые обычно связаны с их применением.
Краткое описание изобретения
Первым объектом настоящего изобретения являются новые полинуклеотиды, которые отличаются от нуклеотидной последовательности исходного гена IFNα-17 дикого типа тем, что они содержат один или несколько SNP (полиморфизм по одному нуклеотиду).
Нуклеотидная последовательность SEQ ID NO:1 исходного человеческого гена IFNα-17 дикого типа состоит из 1873 нуклеотидов и содержит кодирующую последовательность из 570 нуклеотидов, начиная с нуклеотида 639 (старт-кодон) и до нуклеотида 1208 (стоп-кодон).
Заявителем были идентифицированы 2 SNP в нуклеотидной последовательности исходного гена IFNα-17 дикого типа.
Такими SNP являются: g771с, 808Ins(a).
Следует отметить, что в описании настоящего изобретения нумерация, соответствующая положению SNP, определенного выше, относится к нумерации нуклеотидной последовательности SEQ ID NO:1.
Буквы а, t, c и g соответствуют азотистым основаниям аденину, тимину, цитозину и гуанину соответственно.
Первая буква соответствует нуклеотиду дикого типа, а последняя буква соответствует мутированному нуклеотиду.
Так, например, SNP g771с соответствует мутации с заменой гуанина (g) в положении 771 нуклеотидной последовательности SEQ ID NO:1 исходного гена IFNα-17 дикого типа на цитозин (с).
SNP 808Ins(a) соответствует инсерции аденина (а) в положении 808 нуклеотидной последовательности SEQ ID NO:1 исходного гена IFNα-17 дикого типа.
Эти SNP были идентифицированы заявителем в соответствии со способом определения, описанным заявителем в патентной заявке FR 00 22894, озаглавленной "Process for the determination of one or several functional polymorphism(s) in the nucleotide sequence of a preselected functional candidate gene and its applications" и поданной 6 декабря 2000, описание которой вводится в настоящее описание посредством ссылки.
Способ, описанный в этой патентной заявке, позволяет идентифицировать один (или несколько) уже имеющихся SNP, по крайней мере, у одного индивидуума, произвольно выбранного из данной популяции.
В соответствии с объемом настоящего изобретения фрагмент нуклеотидной последовательности гена IFNα-17, включающий, например, кодирующую последовательность, выделяли у различных индивидуумов, произвольно выбранных из данной популяции.
Затем, после анализа, проведенного с помощью ДВЭЖХ ("денатурирующей высокоэффективной жидкостной хроматографии"), осуществляли секвенирование этих фрагментов на некоторых из этих образцов, имеющих гетеродуплексный профиль (т.е. профиль, отличающийся от профиля последовательности исходного гена IFNα-17 дикого типа).
Затем фрагмент, секвенированный этим способом, сравнивали с нуклеотидной последовательностью фрагмента исходного гена IFNα-17 дикого типа и SNP, идентифицированными в соответствии с настоящим изобретением.
Таким образом, указанные SNP являются природными, и каждый из них присутствует у некоторых индивидуумов населения всего мира.
Исходный ген IFNα-17 дикого типа кодирует незрелый белок из 189 аминокислот, соответствующий аминокислотной последовательности SEQ ID NO:2, которая может быть превращена в зрелый белок из 166 аминокислот путем отщепления сигнального пептида, включающего первые 23 аминокислоты.
Кодирующий SNP настоящего изобретения, а именно g771с и 808Ins(a), приводит к модификациям на уровне аминокислотной последовательности белка, кодируемого нуклеотидной последовательностью гена IFNα-17. Такими модификациями являются:
- SNP g771с вызывает мутацию аминокислоты глицина (G) в положении 45 в незрелом белке гена IFNα-17, соответствующем аминокислотной последовательности SEQ ID NO:2, с заменой на аргинин (R) и в положении 22 зрелого белка. В описании настоящего изобретения мутации, кодируемые SNP, обозначаются G22R и G45R, независимо от того, присутствуют ли они в зрелом белке или в незрелом белке;
- SNP 808Ins(a) вызывает мутацию аминокислоты гистидина (Н) в положении 57 в незрелом белке гена IFNα-17, соответствующем аминокислотной последовательности SEQ ID NO:2, с заменой на глутамин (Q) и в положении 34 зрелого белка. Кроме того, инсерция аденина в положение 808 нуклеотидной последовательности приводит к сдвигу рамки считывания при трансляции белка, в результате чего стоп-кодон присутствует в положении 58 аминокислотной последовательности. Таким образом, SNP 808Ins(a) приводит к остановке трансляции сразу после глутамина 57. Как следствие, полученный незрелый белок укорачивается и состоит только из 57 аминокислот. Такой полиморфизм также называется "Н57Q-рамка 57". В описании настоящего изобретения такой полиморфизм, то есть мутацию, кодируемую указанным SNP, обозначают "Н34Q-рамка 34" и "Н57Q-рамка 57", независимо от того, присутствует ли она в зрелом белке или в незрелом белке.
Аминокислотная последовательность SEQ ID NO:3 соответствует мутированному незрелому белку ("Н57Q-рамка 57"), кодируемому нуклеотидной последовательностью SEQ ID NO:1, содержащей SNP 808Ins(a).
Каждый из SNP настоящего изобретения приводит к модификациям пространственной конформации полипептидов настоящего изобретения по сравнению с полипептидом, кодируемым нуклеотидной последовательностью исходного гена IFNα-17 дикого типа.
Эти модификации могут наблюдаться при компьютерном молекулярном моделировании, осуществляемом методами, хорошо известными специалистам, с использованием, например, программ по моделированию de novo (например, SEQFOLD/MSI), гомологии (например, MODELER/MSI), минимизации силового поля (например, DISCOVER, DELPHI/MSI) и/или молекулярной динамики (например, CFF/MSI).
Один из примеров таких моделей приводится ниже в описании экспериментальной части.
Компьютерное молекулярное моделирование показало, что мутация G22R в мутированном зрелом белке вызывает модификацию и замену в петле АВ возле положения 22, что приводит к элиминации водородных связей.
На фигурах 1А и 1В показано, что петля АВ не является уложенной и выступающей петлей.
На исходном IFNα-17 дикого типа остаток G22 находится очень близко к остатку R144. Известно, что этот остаток R144 участвует в связывании интерферона α-2 (IFNα-2) с его рецептором. Структуры IFNα-2 и IFNα-17 имеют большое сходство, и, по всей вероятности, остаток R144 в IFNα-17 участвует в связывании с его рецептором.
Таким образом, G22R-мутированный белок имеет трехмерную конформацию, отличающуюся от конформации природного белка IFNα-17 дикого типа.
Компьютерное молекулярное моделирование также позволяет предсказать, что присутствие аминокислоты аргинина в положении 22 приводит к значительному изменению структуры и функции природного белка дикого типа IFNα-17, а именно на уровне связывания IFNα-17 с его рецептором.
Генотипирование полинуклеотидов настоящего изобретения может быть осуществлено так, чтобы можно было определить частоту встречаемости аллелей этих полинуклеотидов в данной популяции.
Определение функциональных свойств полипептидов настоящего изобретения может быть аналогичным образом осуществлено с помощью теста на их биологическую активность.
Для этого можно измерить, например, трансдукцию сигнала, созревание дендритных клеток, высвобождение цитокинов Т-лимфоцитами, высвобождение цитокинов моноцитами, in vitro или in vivo антивирусную активность полипептидов настоящего изобретения, клеточную антипролиферативную активность полипептидов настоящего изобретения по отношению к клеточной линии Дауди Беркитта, клеточную антипролиферативную активность полипептидов настоящего изобретения по отношению к клеточной линии TF-1 и провести сравнение с IFNα-17 дикого типа или с IFNα-2 дикого типа, выбранного в качестве репрезентативного коммерческого продукта Intron А.
Настоящее изобретение также относится к применению полинуклеотидов и полипептидов настоящего изобретения, а также терапевтических молекул, полученных и/или идентифицированных на основании из этих полинуклеотидов и полипептидов, а в частности для профилактики и лечения некоторых расстройств и/или заболеваний человека.
Краткое описание графического материала
На фигуре 1А представлена модель кодируемого белка настоящего изобретения, включающего SNP G45R, и белка IFNα-17 дикого типа. На фигуре 1В, в более крупном масштабе, представлена модель нижней части каждого из белков, представленных на фигуре 1А.
На фигурах 1А и 1В черные "ленты" представляют структуру белка IFNα-17 дикого типа, а белые "ленты" представляют структуры G22R-мутированного белка IFNα-17.
На фигуре 2 представлены результаты теста для оценки антипролиферативного действия G45R-мутированного IFNα-17 на клеточную линию TF-1. На этой фигуре по оси абсцисс отложена концентрация IFNα (нг/мл), а по оси ординат отложена степень ингибирования пролиферации клеток (%). Антипролиферативное действие G45R-мутированного IFNα-17 (черные ромбы) сравнивали с антипролиферативным действием IFNα-2 дикого типа (белые квадраты).
На фигуре 3 представлены результаты теста для оценки антипролиферативного действия G45R-мутированного IFNα-17 на клеточную линию Дауди Беркитта. На этой фигуре по оси абсцисс отложена концентрация IFNα (нг/мл), а по оси ординат отложена степень ингибирования пролиферации клеток (%). Антипролиферативное действие G45R-мутированного IFNα-17 (черные ромбы) сравнивали с антипролиферативным действием IFNα-2 дикого типа (белые квадраты).
На фигуре 4 представлены оценки выживаемости мышей, предварительно инфицированных вирусом VSV и обработанных G45R-мутированным белком IFNα-17, по сравнению с мышами, обработанными IFNα-2 дикого типа, или по сравнению с необработанными мышами. На этой фигуре по оси абсцисс отложено время выживания (дни), а по оси ординат отложен относительный уровень выживания VSV-инфицированных мышей. Черные ромбы относятся к данным, полученным для VSV-инфицированных мышей, обработанных G45R-мутированным IFNα-17, черные квадраты относятся к данным, полученным для VSV-инфицированных мышей, обработанных IFNα-2 дикого типа, а незаштрихованные треугольники относятся к данным, полученным для необработанных VSV-инфицированных мышей.
Подробное описание изобретения
Определения
Выражение "нуклеотидная последовательность исходного гена дикого типа" следует понимать как "нуклеотидная последовательность SEQ ID NO:1 человеческого гена IFNα-17".
Эта последовательность имеется в Genbank под регистрационным номером V00532 и описана в работах:
Olopade et al.: "Mapping of the shortest region of overlap of deletions of the short arm of chromosome 9 associated with human neoplasia"; Genomics; 14: 437-443; 1992.
Lawn R. M. et al.: "DNA sequence of two closely linked human leukocyte interferon genes"; Science 212 (4499), 1159-1162 (1981).
Термины "природный белок IFNα-17 дикого типа" или белок IFNα-17 дикого типа" означают зрелый белок, кодируемый нуклеотидной последовательностью исходного гена IFNα-17 дикого типа. Природный незрелый белок IFNα-17 дикого типа соответствует пептидной последовательности, представленной в SEQ ID NO:2.
Термин "полинуклеотид" означает полирибонуклеотид или полидезоксирибонуклеотид, который может представлять собой модифицированную или немодифицированную ДНК или РНК.
Термин "полинуклеотид" означает, например, одноцепочечную или двухцепочечную ДНК; ДНК, состоящую из смеси одной или нескольких одноцепочечных областей или одной или нескольких двухцепочечных областей; одноцепочечную или двухцепочечную РНК и РНК, состоящую из смеси одной или нескольких одноцепочечных областей и одной или нескольких двухцепочечных областей. Термин "полинуклеотид" может также означать РНК и/или ДНК, включающую одну или несколько трехцепочечных областей. Термин "полинуклеотид" может также означать ДНК и РНК, содержащие одно или несколько оснований, модифицированных так, чтобы они имели скелет, модифицированный в целях его стабилизации или в других целях. Термин "модифицированное основание" означает, например, необычные основания, такие как инозин.
Термин "полипептид" означает пептид, олигопептид, олигомер или белок, содержащий, по крайней мере, две аминокислоты, присоединенные друг к другу нормальной или модифицированной пептидной связью, такой как, например, в случаях изостерических пептидов.
Полипептид может состоять из аминокислот, не входящих в 20 аминокислот, определенных генетическим кодом. Полипептид может также состоять из аминокислот, модифицированных в ходе природных процессов, таких как процессы посттрансляционного созревания, или в ходе химических процессов, хорошо известных специалистам. Такие модификации подробно описаны в литературе. Эти модификации могут наблюдаться в любой части полипептида: в пептидном скелете, в аминокислотной цепи или даже у карбокси- или амино-концов.
Полипептид может быть сделан разветвленным после обработки убихитином, или он может быть циклическим с ветвлением или без ветвления. Такой тип модификации может быть результатом природного или искусственного посттрансляционного процессов, хорошо известных специалистам.
Так, например, в понятие "полипептидные модификации" входят ацетилирование, ацилирование, ADP-рибозилирование, амидирование, ковалентное связывание с флавином, ковалентное связывание с гемом, ковалентное связывание с нуклеотидом или с нуклеотидным производным, ковалентное связывание с липидом или с липидным производным, ковалентное связывание с фосфатидилинозитом, ковалентное или нековалентное перекрестное связывание, циклизация, образование дисульфидных связей, деметилирование, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, включая введение ПЭГ, образование GPI-якоря, гидроксилирование, иодирование, метилирование, миристоилирование, окисление, протеолитические процессы, фосфорилирование, пренилирование, рацемизация, сенелоилирование, сульфатирование, присоединение аминокислот, таких как аригинин, или присоединение убихитина. Такие модификации подробно описаны в литературе: PROTEINS-STRUCTURE AND MOLECULAR PROPERTIES, 2nd Ed., T. E. Creighton, New York, 1993, POST-TRANSLATIONAL COVALENT MODIFICATION OF PROTEINS, В. С. Johnson, Ed., Academic Press, New York, 1983, Seifter et al. "Analysis for protein modifications and nonprotein cofactors", Meth. Enzymol. (1990) 182: 626-646, and Rattan et al. "Protein Synthesis: Post-translational Modifications and Aging", Ann NY Acad Sci (1992) 663: 48-62.
Термины "выделенный полинуклеотид" или "выделенный полипептид" означают соответственно полинуклеотид или полипептид, такой как полинуклеотид или полипептид, определенный ранее и выделенный из организма человека или продуцированный каким-либо другим техническим способом.
Термин "идентичность" означает степень идентичности нуклеотидной или полипептидной последовательностей.
Термин "идентичность" хорошо известен специалистам и хорошо описан в литературе. COMPUTATIONAL MOLECULAR BIOLOGY, Lesk, A.M., Ed., Oxford University Press, New York, 1998; BIOCOMPUTING INFORMATICS AND GENOME PROJECT, Smith, D.W., Ed., Academic Press, New York, 1993; COMPUTER ANALYSIS OF SEQUENCE DATA, PART I, Griffin, A.M. and Griffin H.G., Ed, Humana Press, New Jersey, 1994; and SEQUENCE ANALYSIS IN MOLECULAR BIOLOGY, von Heinje, G., Academic Press, 1987.
Методы, широко используемые для определения идентичности и сходства между двумя последовательностями, также хорошо описаны в литературе. См. GUIDE TO HUGE COMPUTER, Martin J. Bishop, Ed, Academic Press, San Diego, 1994 и Carillo H. & Lipton D., Siam J. Applied Math (1988) 48:1073.
Полинуклеотид, который, например, на 95% идентичен нуклеотидной последовательности SEQ ID NO:1, представляет собой полинуклеотид, содержащий максимум 5 точечных мутаций на 100 нуклеотидов, по сравнению с указанной последовательностью.
Такими точечными мутациями могут быть одна (или несколько) замен, добавлений и/или делеций в одном (или нескольких) нуклеотиде.
Аналогичным образом, полипептид, который, например, на 95% идентичен аминокислотной последовательности SEQ ID NO:2, представляет собой полипептид, содержащий максимум 5 точечных мутаций на 100 аминокислот, по сравнению с указанной последовательностью.
Такими точечными мутациями могут быть одна (или несколько) замен, добавлений и/или делеций в одной (или нескольких) аминокислоте.
Полинуклеотиды и полипептиды настоящего изобретения, которые не являются полностью идентичными соответственно:
- нуклеотидной последовательности SEQ ID NO:1, содержащей, по крайней мере, одну из следующих SNP: g771с и 808Ins(a),
- аминокислотной последовательности SEQ ID NO:2, содержащей SNP G45R,
- аминокислотной последовательности SEQ ID NO:3, содержащей SNP G45R,
рассматриваются как варианты этих последовательностей.
Обычно полинуклеотид настоящего изобретения обладает биологической активностью, аналогичной или почти аналогичной активности нуклеотидной последовательности SEQ ID NO:1, содержащей, по крайней мере, одну из SNP: g771с и 808Ins(a).
Аналогичным образом, полипептид настоящего изобретения обычно обладает биологической активностью, аналогичной или почти аналогичной активности:
- аминокислотной последовательности SEQ ID NO:2, содержащей SNP G45R, и/или
- аминокислотной последовательности SEQ ID NO:3, возможно, содержащей SNP G45R.
Вариант настоящего изобретения может быть получен, например, путем сайт-направленного мутагенеза или прямого синтеза.
Термин "SNP" означает любое природное изменение в основании нуклеотидной последовательности. При этом SNP на нуклеотидной последовательности может быть кодирующим, молчащим и некодирующим.
"Кодирующий SNP" представляет собой полиморфизм, содержащийся в кодирующей последовательности нуклеотидной последовательности, который влечет за собой аминокислотную модификацию в последовательности аминокислот, кодируемых указанной нуклеотидной последовательностью. В этом случае, в более широком смысле, термин "SNP" также означает мутацию в аминокислотной последовательности.
"Молчащий SNP" представляет собой полиморфизм, содержащийся в кодирующей последовательности нуклеотидной последовательности, который не влечет за собой аминокислотную модификацию в последовательности аминокислот, кодируемых указанной нуклеотидной последовательностью.
"Некодирующий" SNP представляет собой полиморфизм, содержащийся в некодирующей последовательности нуклеотидной последовательности. Этот полиморфизм может, в частности, присутствовать в интроне, в области сплайсинга, в промоторе транскрипции или в энхансерной последовательности.
Термин "функциональный SNP" означает SNP, определенный выше, который присутствует в нуклеотидной последовательности или в аминокислотной последовательности, обладающей функциональностью.
Термин "функциональность" означает биологическую активность полипептида или полинуклеотида.
Функциональность полипептида или полинуклеотида настоящего изобретения может заключаться в сохранении, усилении, снижении или подавлении биологической активности полипептида, кодируемого нуклеотидной последовательностью исходного гена дикого типа или последовательностью указанного полинуклеотида.
Функциональность полипептида или полинуклеотида настоящего изобретения может также заключаться в изменении природы биологической активности полипептида, кодируемого нуклеотидной последовательностью исходного гена дикого типа или последовательностью указанного полинуклеотида.
Биологическая активность может быть, в частности, ассоциирована с аффинностью или с отсутствием аффинности полипептида настоящего изобретения по отношению к рецептору.
Полинуклеотид
Первым объектом настоящего изобретения является выделенный полинуклеотид, включающий:
а) нуклеотидную последовательность, которая, по крайней мере, на 90% идентична, предпочтительно, по крайней мере, на 95% идентична, а более предпочтительно, по крайней мере, на 99% идентична последовательности SEQ ID NO:1 или ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), причем указанная нуклеотидная последовательность включает, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a), или
b) нуклеотидную последовательность, комплементарную нуклеотидной последовательности (а).
В соответствии с настоящим изобретением нуклеотидная последовательность (а) может содержать SNP g771с или 808Ins(a), либо SNP g771с и 808Ins(a).
Следует отметить, что в контексте настоящего изобретения данная нумерация совпадает с положениями SNP в нуклеотидной последовательности SEQ ID NO:1.
Настоящее изобретение также относится к выделенному полинуклеотиду, содержащему:
а) нуклеотидную последовательность SEQ ID NO:1 или ее кодирующую последовательность, причем каждая из этих последовательностей содержит, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a) или
b) нуклеотидную последовательность, комплементарную нуклеотидной последовательности (а).
Полинуклеотид настоящего изобретения, предпочтительно, состоит из последовательности SEQ ID NO:1 или ее кодирующей последовательности, причем каждая из этих последовательностей включает, по крайней мере, один из следующих кодирующих SNP: g771с и 808Ins(a).
В соответствии с настоящим изобретением полинуклеотид, определенный выше, включает один кодирующий SNP, выбранный из группы, состоящей из g771с и 808Ins(a).
Настоящее изобретение также относится к выделенному полинуклеотиду, состоящему из части:
а) нуклеотидной последовательности SEQ ID NO:1 или ее кодирующей последовательности, где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с и 808Ins(a), или
b) нуклеотидной последовательности, комплементарной нуклеотидной последовательности (а),
при этом указанный выделенный полинуклеотид состоит, по крайней мере, из 10 нуклеотидов.
Предпочтительно выделенный полинуклеотид, определенный выше, состоит из 10-40 нуклеотидов.
Настоящее изобретение также относится к выделенному полинуклеотиду, кодирующему полипептид, включающий:
а) аминокислотную последовательность SEQ ID NO:2 или
b) аминокислотную последовательность, содержащую аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2,
где каждая из аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: G45R.
Следует отметить, что в контексте настоящего изобретения данная нумерация совпадает с положением SNP G45R в аминокислотной последовательности SEQ ID NO:2.
Еще одним объектом настоящего изобретения является выделенный полинуклеотид, кодирующий полипептид, включающий:
а) аминокислотную последовательность SEQ ID NO:3 или
b) аминокислотную последовательность, содержащую аминокислоты, расположенные между положениями 24 и 57 аминокислотной последовательности SEQ ID NO:3.
Каждая из аминокислотных последовательностей а) и b) определенного выше полипептида может также содержать SNP G45R.
В соответствии с предпочтительным объектом настоящего изобретения определенный выше полипептид содержит один кодирующий SNP, такой как SNP, определенный выше.
Более предпочтительно выделенный полинуклеотид настоящего изобретения кодирует полипептид, содержащий всю аминокислотную последовательность SEQ ID NO:2 или ее часть и имеющий кодирующий SNP G45R.
Более предпочтительно выделенный полинуклеотид настоящего изобретения кодирует полипептид, содержащий всю аминокислотную последовательность SEQ ID NO:3 или ее часть и, возможно, также имеющий кодирующий SNP G45R.
Полинуклеотид настоящего изобретения предпочтительно состоит из ДНК- или РНК-молекулы.
Полинуклеотид настоящего изобретения может быть получен стандартными методами синтеза ДНК или РНК.
Полинуклеотид настоящего изобретения, содержащий SNP g771с, может быть также получен с помощью сайт-направленного мутагенеза из этой нуклеотидной последовательности гена IFNα-17 путем модификации нуклеотидной последовательности дикого типа посредством замены гуанина (g) на цитозин (с) в положении 771 нуклеотидной последовательности SEQ ID NO:1.
Полинуклеотид настоящего изобретения, содержащий SNP 808Ins(a), может быть также получен с помощью сайт-направленного мутагенеза из нуклеотидной последовательности гена IFNα-17 путем добавления аденина (а) в положение 808 нуклеотидной последовательности SEQ ID NO:1.
Сайт-направленный мутагенез, который может быть осуществлен таким способом, хорошо известен специалистам. В этой связи может быть упомянута публикация T.A. Kunkel, 1985, "Proc.Natl. Acad. Sci., USA", 82:488.
Выделенный полинуклеотид может также включать, например, нуклеотидные последовательности, кодирующие аминокислотные последовательности пре-, про- или пре-про-белка или маркерные аминокислотные последовательности, такие как гекса-гистидиновый пептид.
Полинуклеотид настоящего изобретения может быть также ассоциирован с нуклеотидными последовательностями, кодирующими другие белки или фрагменты белка, в целях получения гибридных белков или других продуктов для очистки.
Полинуклеотид настоящего изобретения может также включать нуклеотидные последовательности, такие как 5'- и/или 3'-некодирующие последовательности, например такие как транскрибируемые или нетранскрибируемые последовательности, транслируемые или нетранслируемые последовательности, последовательности сигнала сплайсинга, последовательности полиаденилирования, последовательности, связывающиеся с рибосомой, или даже последовательности, которые стабилизируют мРНК.
Нуклеотидная последовательность, комплементарная нуклеотидной или полинуклеотидной последовательности, означает, что она может гибридизоваться с этой нуклеотидной последовательностью в жестких условиях.
Термины "жесткие условия гибридизации" означают, в основном, но необязательно, химические условия, позволяющие осуществляться гибридизации, в случае, если указанные нуклеотидные последовательности имеют идентичность, по крайней мере, 80%, предпочтительно превышающую или равную 90%, еще более предпочтительно превышающую или равную 95%, а наиболее предпочтительно превышающую или равную 97%.
Жесткие условия могут быть получены методами, хорошо известными специалистам, например, путем инкубирования полинуклеотидов при 42°С в растворе, содержащем 50% формамида, 5 х SSC (150 мМ NaCl, 15 мМ тринатрийцитрата), 50 мМ фосфата натрия (рН=7,6), 5 х раствор Денхардта, 10% сульфата декстрана и 20 мкг денатурированной ДНК спермы лосося, с последующей промывкой фильтров в 0,1 х SSC при 65°С.
В соответствии с объемом настоящего изобретения в случае, если жесткие условия позволяют осуществляться гибридизации нуклеотидных последовательностей, имеющих идентичность, равную 100%, то считается, что эта нуклеотидная последовательность является строго комплементарной нуклеотидной последовательности, описанной в (а).
Следует отметить, что в контексте настоящего изобретения нуклеотидная последовательность, комплементарная какой-либо нуклеотидной последовательности, содержит, по крайней мере, один антисмысловой SNP настоящего изобретения.
Так, например, если данная нуклеотидная последовательность содержит SNP g771с, то ее комплементарная нуклеотидная последовательность содержит нуклеотид g в эквивалентном положении 771.
Идентификация, гибридизация и/или амплификация полинуклеотида, содержащего SNP
Настоящее изобретение также относится к использованию всего или части:
а) полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, и/или
b) полинуклеотида настоящего изобретения, содержащего, по крайней мере, один SNP,
в целях идентификации, гибридизации и/или амплификации всего или части полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, или, если необходимо, ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с, 808Ins(a).
Генотипирование и частоты встречаемости SNP
Настоящее изобретение также относится к использованию всего или части:
а) полинуклеотида, который на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичен нуклеотидной последовательности SEQ ID NO:1, и/или
b) полинуклеотида настоящего изобретения, содержащего, по крайней мере, один SNP,
для генотипирования всего или части полинуклеотида, являющегося на 80-100% (предпочтительно, по крайней мере, на 90%, более предпочтительно на 95%, а особенно предпочтительно на 100%) идентичным нуклеотидной последовательности SEQ ID NO:1, или, если необходимо, ее кодирующей последовательности (от нуклеотида 639 до нуклеотида 1208), где каждая из этих последовательностей включает, по крайней мере, один из следующих SNP: g771с, 808Ins(a).
В соответствии с настоящим изобретением генотипирование может быть осуществлено у индивидуума или у популяции индивидуумов.
В контексте настоящего изобретения понятие "генотипирование" означает процесс генотипирования у одного индивидуума или у популяции индивидуумов. Генотип состоит из аллелей, присутствующих в одном или в более специфических локусах.
Термин "популяция индивидуумов" означает группу индивидуумов, выбранных произвольным или непроизвольным образом. Такими индивидуумами могут быть человек, животное, микроорганизмы или растения.
Обычно группа индивидуумов включает, по крайней мере, 10 индивидуумов, а предпочтительно от 100 до 300 индивидуумов. Эти индивидуумы могут быть выбраны по их этническим принадлежности или по их фенотипу, а в частности могут быть выбраны такие индивидуумы, которые страдают такими расстройствами и/или заболеваниями, как карциномы, меланомы, лимфомы, лейкозы и рак печени, шеи, головы и почек; сердечно-сосудистые заболевания; болезни обмена веществ, которые не связаны с иммунной системой, например ожирение; инфекционные заболевания, такие как гепатит В и С и СПИД; пневмонии, язвенный колит; заболевания центральной нервной системы, например болезнь Альцгеймера, шизофрения и депрессия; отторжение трансплантата ткани или органов; заживление ран; анемия у пациентов, подвергнутых диализу; аллергии; астма; рассеянный склероз; остеопороз; псориаз; ревматоидный артрит; болезнь Крона, аутоиммунные заболевания и расстройства; расстройства желудочно-кишечного тракта или даже расстройства, связанные с лечением химиотерапией.
Предпочтительно, чтобы у данной группы индивидуумов был генотипирован функциональный SNP настоящего изобретения.
Для генотипирования SNP существует множество технологий (см., например, Kwok Pharmacogenomics, 2000, vol.1, pp.95-100. "High-throughput genotyping assay approaches"). Эти технологии основаны на одном из четырех следующих принципов: гибридизации аллель-специфических олигонуклеотидов; удлинении олигонуклеотидов дидезоксинуклеотидами, необязательно в присутствии дезоксинуклеотидов; лигировании аллель-специфических олигонуклеотидов или расщепления аллель-специфических олигонуклеотидов. Каждая из этих технологий может быть ассоциирована с системой детекции, такой как измерение прямой или поляризованной флуоресценции или масс-спектрометрия.
Генотипирование может быть, в частности, осуществлено с помощью минисеквенирования с использованием "горячих" ddNTP (2 различных ddNTP, меченных различными флуорофорами) и "холодных" ddNTP (2 различных немеченных ddNTP) в комбинации с использованием поляризационно-флуоресцентного сканера. Протокол минисеквенирования со считыванием поляризованной флуоресценции (FP-TDI Technology or Fluorescence Polarization Template-direct Dye-Terminator Incorporation) хорошо известен специалистам.
Это может быть осуществлено на продукте, полученном после амплификации с помощью полимеразной цепной реакции (ПЦР) ДНК от каждого индивидуума. Этот ПЦР-продукт выбирают так, чтобы он включал генную область полинуклеотида, содержащую исследуемый SNP. После последней стадии в ПЦР-термоячейке планшет помещают на поляризационно-флуоресцентный сканер для считывания меченых оснований с использованием фильтров флуорофор-специфического возбуждения и излучения. Величины интенсивности меченных оснований представлены на графике.
Для ПЦР-амплификации, в случае одного SNP настоящего изобретения, смысловые и антисмысловые праймеры соответственно могут быть легко выбраны любым специалистом в соответствии с положением SNP настоящего изобретения.
Так, например, в качестве праймеров для ПЦР-амиплификации могут служить следующие смысловые и антисмысловые нуклеотидные последовательности соответственно:
SEQ ID NO:4: Смысловой праймер: TTCAAGGTTACCCATCTCAASEQ ID NO:5: Антисмысловой праймер TTAGTCAATCAGGATCATTGC.
Нуклеотидные последовательности позволяют амплифицировать фрагмент, имеющий длину 655 нуклеотидов, начиная от нуклеотида 591 и до нуклеотида 1245 в нуклеотидной последовательности SEQ ID NO:1.
Затем для группы индивидуумов проводят статистический анализ частоты встречаемости каждого аллеля (аллельная частота), кодируемого геном, содержащим SNP, где указанный анализ позволяет определить важность влияния и распределения этих аллелей в различных подгруппах, а в частности, если это необходимо, в различных этнических группах, которые составляют данную популяцию индивидуумов.
Данные, полученные генотипированием, анализируют для оценки частоты распределения различных аллелей, наблюдаемых у исследуемых популяций. Определение частоты встречаемости аллелей может быть осуществлено с помощью компьютерной программы, такой как SAS-suite® (SAS) или SPLUS® (MathSoft). Сравнение аллельного распределения SNP настоящего изобретения в различных этнических группах популяции индивидуумов может быть осуществлено с использованием компьютерных программ ARLEQUIN® и SAS-suite®.
SNP настоящего изобретения, используемые в качестве генетических маркеров
Поскольку SNP, модифицирующие функциональные последовательности генов (например, промотор, сайты сплайсинга, кодирующая область), вероятно, непосредственно связаны с восприимчивостью или резистентностью к заболеванию, то все SNP (функциональные или нефункциональные) могут служить ценными маркерами для идентификации одного или нескольких генов, ответственных за эти патологические состояния, и следовательно, они могут быть опосредованно ассоциированы с указанным патологическими состояниями (см. Cargill et al. (1999). Nature Genetics 22:231-238; Riley et al. (2000). Pharmacogenomics 1:39-47; Roberts L. (2000) Science 287:1898-1899).
Таким образом, настоящее изобретение также относится к банку данных, включающему, по крайней мере, один из следующих SNP: g771с, 808Ins(a) в полинуклеотиде гена IFNα-17.
При этом понятно, что указанные SNP пронумерованы в соответствии с нуклеотидной последовательностью SEQ ID NO:1.
Указанный банк данных может быть проанализирован в целях определения статистически релевантных ассоциаций между:
(i) по крайней мере, одним из следующих SNP: g771с, 808Ins(a) в полинуклеотиде гена IFNα-17,
(ii) заболеванием или резистентностью к заболеванию.
Более предпочтительно настоящее изобретение относится к способу определения статистически релевантных ассоциаций между, по крайней мере, одним из SNP, выбранным из группы, состоящей из g771с, 808Ins(a) в полинуклеотиде гена IFNα-17, и заболеванием или резистентностью к заболеванию, включающему:
а) генотипирование группы индивидуумов;
b) определение распределения указанного заболевания или резистентности к заболеванию в указанной группе индивидуумов:
с) сравнение данных генотипирования с данными распределения указанного заболевания или резистентности к указанному заболеванию; и
d) анализ такого сравнения для выявления статистически релевантных ассоциаций.
Настоящее изобретение также относится к использованию, по крайней мере, одного из следующих SNP: g771с, 808Ins(a) в полинуклеотиде гена IFNα-17 в целях получения диагностических/прогностических наборов для выявления заболевания или резистентности к заболеванию.
SNP настоящего изобретения, такой как SNP, определенный выше, может быть прямо или опосредованно ассоциирован с заболеванием или с резистентностью к заболеванию.
Предпочтительно указанными заболеваниями могут быть заболевания, упомянутые выше.
Экспрессирующий вектор и клетки-хозяева
Настоящее изобретение также относится к рекомбинантному вектору, включающему, по крайней мере, один полинуклеотид настоящего изобретения.
При этом может быть использовано множество экспрессирующих систем, включая, но не ограничиваясь ими, хромомсомы, эписомы и происходящие от них вирусы. Более конкретно, используемые рекомбинантные векторы могут происходить от бактериальных плазмид, транспозонов, дрожжевых эписом, инсерционных элементов, дрожжевых хромосомных элементов, вирусов, таких как бакуловирус, папиломавирусов, таких как SV40, вирусов коровьей оспы, аденовирусов, лисьих поксвирусов, псевдорабивирусов и ретровирусов.
Такими рекомбинантными векторами могут быть также космидные или фагмидные производные. Нуклеотидная последовательность может быть встроена в рекомбинантный экспрессирующий вектор методами, хорошо известными специалистам, например, такими как методы, описанные в руководстве Molecular Cloning: A Laboratory manual, Sambrook et al. 4th Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 2001.
Рекомбинантный вектор может включать нуклеотидные последовательности, которые регулируют экспрессию полинуклеотидов, а также нуклеотидные последовательности, которые обеспечивают экспрессию и транскрипцию полинуклеотида настоящего изобретения и трансляцию полипептида настоящего изобретения, где указанные последовательности выбирают в соответствии с используемыми клетками-хозяевами.
Так, например, в рекомбинантный вектор может быть интегрирован соответствующий сигнал секреции, так, чтобы полипептид, кодируемый полинуклеотидом настоящего изобретения, направлялся непосредственно в просвет эндоплазматического ретикулума, в периплазматическое пространство, на мембрану или в межклеточное пространство.
Настоящее изобретение также относится к клетке-хозяину, включающей рекомбинантный вектор настоящего изобретения.
Введение рекомбинантного вектора в клетку-хозяина может быть осуществлено методами, хорошо известными специалистам, такими как методы, описанные в BASIC METHODS IN MOLECULAR BIOLOGY, Davis et al., 2nd ed., McGraw-Hill Professional Publishing, 1995 and MOLECULAR CLONING: A LABORATORY MANUAL, выше, например трансфекция фосфатом кальция, трансфекция DEAE-декстраном, трансфекция, микроинжекция, трансфекция катионными липидами, электропорация, трансдукция или инфицирование.
Такими клетками-хозяевами могут быть, например, бактериальные клетки, такие как клетки стрептококков, стафилококков, E.coli или Bacillus subtilis; клетки грибков, такие как дрожжевые клетки и клетки Aspergillus, Streptomyces, клетки насекомых, такие как клетки Drosophila S2 и Spodoptera Sf9, клетки животных, такие как клетки СНО, COS, HeLa, С127, ВНК, НЕК 293 и клетки человека, подвергаемого лечению, или даже клетки растений.
Клетки-хозяева могут быть использованы, например, для экспрессии полипептида настоящего изобретения или в качестве активного продукта в фармацевтических композициях, описанных ниже.
Полипептид
Объектом настоящего изобретения также является выделенный полипептид, включающий аминокислотную последовательность, которая, по крайней мере, на 80%, предпочтительно, по крайней мере, на 90%, более предпочтительно, по крайней мере, на 95% и еще более предпочтительно, по крайней мере, на 99% идентична всей или части:
а) аминокислотной последовательности SEQ ID NO:2 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2,
причем каждая из указанных аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: G45R.
Полипептид настоящего изобретения может также включать всю или часть:
а) аминокислотной последовательности SEQ ID NO:2 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2,
причем каждая из указанных аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: G45R.
Более конкретно, полипептид настоящего изобретения может состоять из всей или части:
а) аминокислотной последовательности SEQ ID NO:2 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2,
причем каждая из указанных аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: G45R.
Объектом настоящего изобретения также является выделенный полипептид, включающий аминокислотную последовательность, которая, по крайней мере, на 80%, предпочтительно, по крайней мере, на 90%, более предпочтительно, по крайней мере, на 95%, а еще более предпочтительно, по крайней мере, на 99% идентична всей или части:
а) аминокислотной последовательности SEQ ID NO:3 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 57 аминокислотной последовательности SEQ ID NO:3,
причем каждая из указанных аминокислотных последовательностей (а) и (b) содержит следующий кодирующий SNP: "Н57Q-рамка 57".
Полипептид настоящего изобретения может также включать всю или часть:
а) аминокислотной последовательности SEQ ID NO:3 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 57 аминокислотной последовательности SEQ ID NO:3.
Более конкретно, полипептид настоящего изобретения может состоять из всей или части:
а) аминокислотной последовательности SEQ ID NO:3 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 57 аминокислотной последовательности SEQ ID NO:3.
Каждая из указанных аминокислотных последовательностей (а) и (b) указанного полипептида может также содержать SNP: G45R.
Предпочтительно полипептид настоящего изобретения содержит один кодирующий SNP, выбранный из группы, состоящей из G45R, "Н57Q-рамка 57".
Более предпочтительно полипептид настоящего изобретения содержит аминокислоты 24-189 аминокислотной последовательности SEQ ID NO:2 и имеет кодирующий SNP G45R.
Более предпочтительно полипептид настоящего изобретения содержит аминокислоты 24-57 аминокислотной последовательности SEQ ID NO:3.
Настоящее изобретение также относится к способу получения вышеупомянутого полипептида, в котором раскрытую ранее клетку-хозяина культивируют в культуральной среде, и указанный полипептид выделяют из культуральной среды.
Полипептид может быть очищен из культуральной среды клеток-хозяев методами, хорошо известными специалистам, такими как осаждение хаотропными агентами, такими как соли, а в частности сульфат аммония, этанол, ацетон или трифторуксусная кислота; экстракция кислотой; ионообменная хроматография; хроматография на фосфоцеллюлозе; гидрофобная хроматография; аффинная хроматография; хроматография на гидроксиаппатитах или эксклюзионная хроматография.
Термин "культуральная среда" означает среду, из которой выделяют или очищают полипептид настоящего изобретения. Эта среда может состоять из внеклеточной среды и/или клеточного лизата. Если конформация указанного полипептида была изменена в процессе выделения или очистки, то активная конформация указанного полипептид может быть восстановлена методами, хорошо известными специалистам.
Антитела
Настоящее изобретение также относится к способу получения иммуноспецифического антитела.
Термин "антитело" означает моноклональное, поликлональное, химерное, одноцепочечное, "гуманизированное" антитело, а также Fab-фрагменты, включая продукты библиотеки экспрессируемых Fab или иммуноглобулинов.
Иммуноспецифическое антитело может быть получено путем иммунизации животного полипептидом настоящего изобретения.
Настоящее изобретение также относится к иммуноспецифическому антителу против полипептида настоящего изобретения, определенного выше.
Полипептид настоящего изобретения или его фрагменты, аналог, один из его вариантов или клетка, экспрессирующая этот полипептид, могут быть также использованы для продуцирования иммуноспецифических антител.
Термин "иммуноспецифический" относится к антителу, обладающему более высокой аффинностью по отношению к полипептиду настоящего изобретения, чем по отношению к другим полипептидам, известным специалистам.
Иммуноспецифические антитела могут быть получены путем введения полипептида настоящего изобретения, одного из его фрагментов, его аналога, или эпитопного фрагмента, или клетки, экспрессирующей этот полинуклеотид, млекопитающему, предпочтительно не являющемуся человеком, методами, хорошо известными специалистам.
Для получения моноклональных антител могут быть использованы стандартные методы продуцирования антител из клеточных линий, такие как гибридомная техника (Kohler et al., Nature (1975) 256:495-497), триомная техника, гибридомная техника с использованием человеческих В-клеток (Kozbor et al., Immunology Today (1983) 4:72) и гибридомная техника с использованием EBV (Cole et al., "The EBV-hybridoma technique and its application to human lung cancer", Monoclonal Antibodies and Cancer Therapy (Vol. 27, UCLA Symposia on Molecular and Cellular Biology, New Series)(eds. R.A. Reisfeld and S.Sell), pp.77-96, Alan R.Liss, Inc. N.Y. 1985, pp.77-96).
Могут быть также использованы методы продуцирования одноцепочечного антитела, такого как, например, антитело, описанное в патенте США № 4946778.
Для продуцирования " гуманизированных" антител могут быть также использованы трансгенные животные, например мыши.
Агенты, взаимодействующие с полипептидом настоящего изобретения
Настоящее изобретение также относится к способу идентификации агента, активирующего или ингибирующего полипептид настоящего изобретения, включающему:
а) получение рекомбинантного вектора, включающего полинуклеотид настоящего изобретения, содержащий, по крайней мере, один кодирующий SNP,
b) получение клеток-хозяев, включающих рекомбинантный вектор (а),
с) контактирование клеток-хозяев (b) с тестируемым агентом и
d) определение активирующего или ингибирующего эффекта, генерируемого тестируемым агентом.
Полипептид настоящего изобретения может быть также использован в способе скрининга соединений, взаимодействующих с ним.
Указанные соединения могут представлять собой активирующие агенты (агонисты) или ингибирующие агенты (антагонисты) по отношению к активности, присущей полипептиду настоящего изобретения. Такими соединениями могут быть также лиганды или субстраты полипептида настоящего изобретения. См. Coligan et al., Current Protocols in Immunology 1(2), Chapter 5 (1991).
В общих чертах, для реализации указанного способа сначала желательно продуцировать соответствующие клетки-хозяева, экспрессирующие полипептид настоящего изобретения. Такими клетками могут быть, например, клетки млекопитающих, дрожжей, насекомых, таких как Drosophila, или бактерий, таких как E.coli.
Затем эти клетки или мембранные экстракты этих клеток выдерживают в присутствии тестируемых соединений.
Затем могут быть проведены оценки способности тестируемых соединений связываться с полипептидами настоящего изобретения, а также ингибировать или активировать функциональный ответ.
Стадия (d) вышеописанного способа может быть осуществлена с использованием тестируемого агента, помеченного прямым или опосредованным способом. Эта стадия может также включать тест на конкурентное связывание с использованием меченого или немеченого агента и меченого конкурирующего агента.
Можно также определить, продуцирует ли тестируемый агент сигнал активации или ингибирования на клетках, экспрессирующих полипептид настоящего изобретения, с использованием подходящих средств для детекции, выбранных в соответствии с детектируемым сигналом.
Такими активирующими или ингибирующими агентами могут быть полинуклеотиды, а в некоторых случаях олигонуклеотиды или полипептиды, такие как, например, белки или антитела.
Настоящее изобретение также относится к способу идентификации агента, активированного или ингибируемого полипептидом настоящего изобретения, включающему:
а) получение рекомбинантного вектора, включающего полинуклеотид настоящего изобретения, содержащий, по крайней мере, один кодирующий SNP,
b) получение клеток-хозяев, включающих рекомбинантный вектор (а),
с) выдерживание клеток-хозяев (b) в присутствии тестируемого агента и
d) определение активирующего или ингибирующего действия данного полипептида на тестируемый агент.
Агент, активируемый или ингибируемый полипептидом настоящего изобретения, представляет собой агент, который продуцирует ответ соответственно при активации или ингибировании в присутствии указанного полипептида.
Агенты, активированные или ингибируемые непосредственно или опосредованно полипептидом настоящего изобретения, могут состоять из полипептидов, таких как, например, мембранные или ядерные рецепторы, киназы, а более предпочтительно тирозинкиназы, факторы транскрипции или полинуклеотиды.
Выявление заболевания
Настоящее изобретение также относится к способу анализа биологических свойств полинуклеотида настоящего изобретения и/или полипептида настоящего изобретения у индивидуума, включающий осуществление, по крайней мере, одной из следующих процедур:
а) определения присутствия или отсутствия полинуклеотида настоящего изобретения в геноме индивидуума;
b) определения уровня экспрессии полинуклеотида настоящего изобретения у индивидуума;
с) определения присутствия или отсутствия полипептида настоящего изобретения у индивидуума;
d) определения концентрации полипептида настоящего изобретения у индивидуума и/или
е) определения функциональности полипептида настоящего изобретения у индивидуума.
Эти биологические свойства могут быть проанализированы у индивидуума или в образце, взятом у индивидуума.
Указанные биологические свойства позволяют осуществлять генетический диагноз и определить, имеет ли данный индивидуум данное заболевание или подвержен ли он риску возникновения у него данного заболевания, либо, наоборот, имеется ли у данного индивидуума частичная резистентность к развитию данного заболевания, недомогания или расстройства, связанного с присутствием полинуклеотида настоящего изобретения и/или полипептида настоящего изобретения.
Указанными заболеваниями могут быть расстройства и/или заболевания человека, такие как рак и опухоли, инфекционные заболевания, венерические заболевания, иммуно-ассоциированные заболевания и/или аутоиммунные заболевания и расстройства, сердечно-сосудистые заболевания, болезни обмена веществ, заболевания центральной нервной системы и расстройства, связанные с применением химиотерапии.
Указанными раковыми заболеваниями и опухолями являются карциномы, включая метастазирующие карциномы почек, меланомы, лимфомы, включая фолликулярные лимфомы и Т-клеточные лимфомы кожи, лейкозы, включая лейкемический ретикулез, хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз, рак печени, шеи, головы и почек; множественные миеломы, карциноидные опухоли и опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа.
Указанными инфекционными заболеваниями являются вирусные инфекции, включая хронический гепатит В и С и ВИЧ/СПИД, инфекционные пневмонии и венерические заболевания, такие как остроконечные бородавки.
Указанными иммунными и аутоиммунными заболеваниями могут быть отторжение трансплантата ткани или органов; аллергии; астма; псориаз; ревматоидный артрит; рассеянный склероз; болезнь Крона и язвенный колит.
Указанными болезнями обмена веществ могут быть неиммунные заболевания, такие как ожирение.
Указанными заболеваниями центральной нервной системы могут быть болезнь Альцгеймера, болезнь Паркинсона, шизофрения и депрессия.
Указанными заболеваниями и расстройствами могут также быть заболевания, ассоциированные с заживлением ран, анемия у пациентов, подвергнутых диализу, и остеопороз.
Этот способ также позволяет установить генетический диагноз заболевания или резистентность к заболеванию, связанному с присутствием у индивидуума мутантного аллеля, кодируемого SNP настоящего изобретения.
Предпочтительно, в стадии (а) может быть детектировано присутствие или отсутствие полинуклеотида, содержащего, по крайней мере, один кодирующий SNP, определенный выше.
Детекция полинуклеотида может быть осуществлена в биологических образцах, взятых у обследуемого индивидуума, таких как клетки, кровь, моча, слюна, или в образцах, взятых при биопсии или аутопсии данного индивидуума. Для прямой детекции или детекции после ПЦР-амплификации может быть, например, использована геномная ДНК. Аналогичным образом может быть также использована РНК или кДНК.
Затем может быть проведено сравнение нуклеотидной последовательности полинуклеотида настоящего изобретения с нуклеотидной последовательностью, обнаруженной в геноме индивидуума.
Сравнение нуклеотидных последовательностей может быть осуществлено путем секвенирования; методами гибридизации ДНК; по различию в подвижности ДНК-фрагментов при гель-электрофорезе, осуществляемом с использованием или без использования денатурирующих агентов; либо по различию температур плавления (см. Myers et al., Science (1985) 230:1242). Такие модификации в конкретной точке структуры нуклеотидной последовательности могут быть выявлены с помощью тестов по защите от действия нуклеазы, такой как РНКаза или нуклеаза S1, путем ферментативного гидролиза, а также с использованием химических расщепляющих агентов. См. Cotton et al., Proc.Natl. Acad. Sci., USA (1985) 85:4397-4401. Олигонуклеотидные зонды, содержащие фрагмент полинуклеотида настоящего изобретения, могут быть также использованы для проведения скрининга.
Для определения экспрессии полинуклеотида настоящего изобретения и для идентификации генетической вариабельности указанного полинуклеотида могут быть использованы многие методы, хорошо известные специалистам (см., Chee et al., Science (1996), Vol.274, pp.610-613).
В стадии (b) уровень экспрессии полинуклеотида может быть измерен путем количественной оценки уровня РНК, кодируемой указанным полинуклеотидом (и кодирующим полипептид), методами, хорошо известными специалистам, например ПЦР, ОТ-ПРЦ, методом защиты от РНКазы, с помощью Нозерн-блот-анализа и других методов гибридизации.
В стадиях с) и d) присутствие или отсутствие, а также концентрация полипептида настоящего изобретения у индивидуума или в образце, взятом у индивидуума, может быть определено методами, хорошо известными специалистам, например, с помощью радиоиммуноанализа, тестов на конкурентное связывание, Вестерн-блот-анализа и ELISA.
После этого в стадии d) определенную концентрацию полипептид настоящего изобретения можно сравнить с концентрацией белка дикого типа, обычно присутствующего у индивидуума.
Специалистом может быть определен тот порог, выше или ниже которого возникает чувствительность или, наоборот, резистентность к заболеванию, недомоганию или расстройству, указанному выше, с помощью публикаций, известных из уровня техники, или с помощью традиционных тестов или анализов, например для упомянутых выше.
В стадии е) определение функциональности полипептида настоящего изобретения может быть осуществлено методами, хорошо известными специалистам, например, с помощью in vitro-тестов, таких как тесты, упомянутые выше, или с использованием клеток хозяев, экспрессирующих указанный полипептид.
Терапевтические соединения и лечения заболеваний
Настоящее изобретение также относится к терапевтическому соединению, содержащему полипептид настоящего изобретения в качестве активного агента.
Настоящее изобретение также относится к использованию полипептида настоящего изобретения для производства терапевтического соединения для профилактики или лечения различных расстройств и/или заболеваний человека. Указанными заболеваниями могут быть расстройства и/или заболевания человека, такие как рак и опухоли, инфекционные заболевания, венерические заболевания, иммуно-ассоциированные заболевания и/или аутоиммунные заболевания и расстройства, сердечно-сосудистые заболевания, болезни обмена веществ, заболевания центральной нервной системы и расстройства, связанные с применением химиотерапии.
Указанными раковыми заболеваниями и опухолями являются карциномы, включая метастазирующие карциномы почек, меланомы, лимфомы, включая фолликулярные лимфомы и Т-клеточные лимфомы кожи, лейкозы, включая лейкемический ретикулез, хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз, рак печени, шеи, головы и почек, множественные миеломы, карциноидные опухоли и опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа.
Указанными инфекционными заболеваниями являются вирусные инфекции, включая хронический гепатит В и С и ВИЧ/СПИД, инфекционные пневмонии и венерические заболевания, такие как остроконечные бородавки.
Указанными иммунными и аутоиммунными заболеваниями могут быть отторжение трансплантата ткани или органов, аллергии, астма, псориаз, ревматоидный артрит, рассеянный склероз, болезнь Крона и язвенный колит.
Указанными болезнями обмена веществ могут быть неиммунные заболевания, такие как ожирение.
Указанными заболеваниями центральной нервной системы могут быть болезнь Альцгеймера, болезнь Паркинсона, шизофрения и депрессия.
Указанными заболеваниями и расстройствами могут быть также заживление ран, анемия у пациентов, подвергнутых диализу, и остеопороз.
Предпочтительно полипептид настоящего изобретения может быть также использован для производства терапевтического соединения для профилактики или лечения различных расстройств и/или заболеваний человека, таких как некоторые вирусные инфекции, например хронический гепатит В и С, лейкозы, включая лейкемический ретикулез и хронический миелоидный лейкоз, множественные миеломы, фолликулярные лимфомы, карциноидные опухоли, злокачественные миеломы, метастазирующие карциномы почек, болезнь Альцгеймера, болезнь Паркинсона, а также опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа, остроконечные бородавки и/или венерические заболевания.
Некоторые соединения, позволяющие получить полипептид настоящего изобретения, а также соединения, полученные или идентифицированные с использованием указанного полипептида или исходя из этого полипептида, могут быть также использованы для терапевтического лечения организма человека, т.е. они могут быть использованы в качестве терапевтического соединения.
Поэтому настоящее изобретение также относится к лекарственному средству, содержащему в качестве активного агента полинуклеотид настоящего изобретения, включающий, по крайней мере, один определенный выше кодирующий SNP, определенный выше рекомбинантный вектор, определенную выше клетку-хозяина и/или определенное выше антитело.
Настоящее изобретение также относится к применению полинуклеотида настоящего изобретения, содержащего, по крайней мере, один определенный выше кодирующий SNP, определенный выше рекомбинантный вектор, определенную выше клетку-хозяина и/или определенное выше антитело, для производства лекарственного средства для профилактики и/или лечения различных расстройств и/или заболеваний человека. Указанными заболеваниями могут быть расстройства и/или заболевания человека, такие как рак и опухоли, инфекционные заболевания, венерические заболевания, иммуно-ассоциированные заболевания и/или аутоиммунные заболевания и расстройства, сердечно-сосудистые заболевания, болезни обмена веществ, заболевания центральной нервной системы и расстройства, связанные с применением химиотерапии.
Указанными раковыми заболевания и опухолями являются карциномы, включая метастазирующие карциномы почек, меланомы, лимфомы, включая фолликулярные лимфомы и Т-клеточные лимфомы кожи, лейкозы, включая лейкемический ретикулез, хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз, рак печени, шеи, головы и почек, множественные миеломы, карциноидные опухоли и опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа.
Указанными инфекционными заболеваниями являются вирусные инфекции, включая хронический гепатит В и С и ВИЧ/СПИД, инфекционные пневмонии и венерические заболевания, такие как остроконечные бородавки.
Указанными иммунными и аутоиммунными заболеваниями могут быть отторжение трансплантата ткани или органов, аллергии, астма, псориаз, ревматоидный артрит, рассеянный склероз, болезнь Крона и язвенный колит.
Указанными болезнями обмена веществ могут быть неиммунные заболевания, такие как ожирение.
Указанными заболеваниями центральной нервной системы могут быть болезнь Альцгеймера, болезнь Паркинсона, шизофрения и депрессия.
Указанными заболеваниями и расстройствами могут также быть заживление ран, анемия у пациентов, подвергнутых диализу, и остеопороз.
Предпочтительно настоящее изобретение также относится к использованию полинуклеотида настоящего изобретения, содержащего, по крайней мере, один определенный выше кодирующий SNP, определенный выше рекомбинантный вектор, определенную выше клетку-хозяина и/или определенное выше антитело, для производства лекарственного средства для профилактики и/или лечения различных расстройств и/или заболеваний человека, таких как некоторые вирусные инфекции, например хронический гепатит В и С, лейкозы, включая лейкемический ретикулез и хронический миелоидный лейкоз, множественные миеломы, фолликулярные лимфомы, карциноидные опухоли, злокачественные меланомы, метастазирующие карциномы почек, болезнь Альцгеймера, болезнь Паркинсона, а также опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа, остроконечные бородавки или венерические заболевания.
Доза полипептида и других соединений настоящего изобретения, используемых в качестве активного агента, зависит от выбора соединения, терапевтических показаний, способа введения, природы композиции, конкретного индивидуума и назначения врача.
При использовании в качестве активного агента полипептид настоящего изобретения обычно вводят в дозах, составляющих от 1 до 15 МЕ (международных единиц). Рекомендованная доза может быть введена либо подкожно, либо внутримышечно от 1 до 5 раз в неделю в течение 1-12 месяцев.
Настоящее изобретение также относится к фармацевтической композиции, которая содержит в качестве активного агента, по крайней мере, одно вышеупомянутое соединение, такие как полипептид настоящего изобретения, полинуклеотид настоящего изобретения, содержащий, по крайней мере, один определенный выше SNP, определенный выше рекомбинантный вектор, определенную выше клетку-хозяина и/или определенное выше антитело, а также фармацевтически приемлемый носитель.
В указанных фармацевтических композициях активный агент преимущественно присутствует в физиологически эффективных дозах.
Указанные фармацевтические композиции могут представлять собой, например, твердые вещества или жидкости и могут присутствовать в фармацевтических формах, используемых в современной медицине, таких как, например, обычные таблетки или таблетки с покрытиями, гелевые капсулы, гранулы, карамели, суппозитории, а предпочтительно препараты и порошки для инъекций. Указанные фармацевтические формы могут быть получены стандартными методами.
Активный агент(ы) может быть введен в наполнители, обычно используемые в фармацевтических композициях, такие как тальк, аравийская камедь, лактоза, крахмал, декстроза, глицерин, этанол, стеарат магния, масло какао, водные или безводные носители, жиры животного или растительного происхождения, парафиновые производные, гликоли, различные смачивающие агенты, диспергирующие или эмульгирующие агенты и консерванты.
Активный агент(ы) настоящего изобретения может быть введен отдельно или в комбинации с другими соединениями, такими как терапевтические соединения, например другие цитокины, такие как, например, интерлейкины или интерфероны.
Различные составы фармацевтических композиций адаптируют в соответствии со способом введения.
Фармацевтические композиции могут быть введены различными способами, известными специалистам.
Настоящее изобретение также относится к диагностической композиции, которая, в качестве активного агента, содержит, по крайней мере, одно вышеупомянутое соединение, такое как полипептид настоящего изобретения, весь полинуклеотид настоящего изобретения или его часть, определенный выше рекомбинантный вектор, определенную выше клетку-хозяина и/или определенное выше антитело, а также подходящий фармацевтически приемлемый носитель.
Эта диагностическая композиция может содержать, например, подходящий наполнитель, такой как наполнитель, обычно используемый в диагностической композиции, например буферы и консерванты.
Настоящее изобретение также относится к применению:
а) терапевтически эффективного количества полипептида настоящего изобретения и/или
b) полинуклеотида настоящего изобретения и/или
с) определенной выше клетки-хозяина, взятой от индивидуума, подвергаемого лечению, и
для получения терапевтического соединения, предназначенного для повышения уровня экспрессии или активности полипептида настоящего изобретения у индивидуума.
Так, например, лечение индивидуума, нуждающегося в повышении уровня экспрессии или активности полипептида настоящего изобретения, может быть осуществлено несколькими методами.
Индивидууму может быть введено терапевтически эффективное количество полипептида настоящего изобретения вместе с фармацевтически приемлемым носителем.
Может быть также усилено эндогенное продуцирование полипептида настоящего изобретения путем введения индивидууму полинуклеотида настоящего изобретения. Так, например, указанный полинуклеотид может быть встроен в ретровирусный экспрессирующий вектор. Такой вектор может быть выделен из клеток, инфицированных ретровирусным плазмидным вектором, содержащим РНК, кодирующую полипептид настоящего изобретения, так, чтобы трансдуцированные клетки продуцировали инфекционные вирусные частицы, содержащие нужный ген. См. Gene Therapy and other Molecular Genetic-based Therapeutic Approaches, Chapter 20, Human Molecular Genetics, Strachan & Read, BIOS Scientifics Publishers Ltd (1996).
В соответствии с настоящим изобретением предпочтительным является полинуклеотид, содержащий, по крайней мере, один кодирующий SNP, например SNP, определенный выше.
Индивидууму могут быть также введены принадлежащие ему клетки-хозяева, которые были предварительно взяты у индивидуума и модифицированы так, чтобы они экспрессировали полипептид настоящего изобретения, как описано выше.
Настоящее изобретение также относится к применению:
а) терапевтически эффективного количества определенного ранее иммуноспецифического антитела и/или
b) полинуклеотида, ингибирующего экспрессию полинуклеотида настоящего изобретения
для получения терапевтического соединения, предназначенного для снижения уровня экспрессии или активности полипептида настоящего изобретения у индивидуума.
Таким образом, индивидууму может быть введено терапевтически эффективное количество ингибирующего агента и/или антитела, такого как антитело, определенное выше, либо оно может быть введено в комбинации с фармацевтически приемлемым носителем.
Может быть также уменьшено эндогенное продуцирование полипептида настоящего изобретения путем введения указанному индивидууму комплементарного полинуклеотида настоящего изобретения, ингибирующего экспрессию полинуклеотида настоящего изобретения.
Предпочтительно может быть использован комплементарный полинуклеотид, содержащий, по крайней мере, один кодирующий SNP, такой как SNP, определенный выше.
Настоящее изобретение также относится к применению белка IFNα-17 для получения лекарственного средства для профилактики или лечения пациента, страдающего расстройством или заболеванием, вызываемым вариантом IFNα-17 и ассоциированным с присутствием в геноме указанного пациента нуклеотидной последовательности, которая, по крайней мере, на 95 % (предпочтительно на 97%, более предпочтительно на 99%, а особенно предпочтительно на 100%) идентична нуклеотидной последовательности SEQ ID NO:1, при условии, что указанная нуклеотидная последовательность включает один из следующих SNP: g771с, 808Ins(a).
Указанное лекарственное средство, предпочтительно используют для профилактики или лечения одного из заболеваний, выбранных из группы, состоящей из рака и опухолей, инфекционных заболеваний, венерических заболеваний, иммуно-ассоциированных заболеваний и/или аутоиммунных заболеваний и расстройств, сердечно-сосудистых заболеваний, болезней обмена веществ, заболеваний центральной нервной системы и расстройств, связанных с применением химиотерапии.
Указанными раковыми заболевания и опухолями являются карциномы, включая метастазирующие карциномы почек, меланомы, лимфомы, включая фолликулярные лимфомы и Т-клеточные лимфомы кожи, лейкозы, включая лейкемический ретикулез, хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз, рак печени, шеи, головы и почек, множественные миеломы, карциноидные опухоли и опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа.
Указанными инфекционными заболеваниями являются вирусные инфекции, включая хронический гепатит В и С и ВИЧ/СПИД, инфекционные пневмонии и венерические заболевания, такие как остроконечные бородавки.
Указанными иммунными и аутоиммунными заболеваниями могут быть отторжение трансплантата ткани или органов, аллергии, астма, псориаз, ревматоидный артрит, рассеянный склероз, болезнь Крона и язвенный колит.
Указанными болезнями обмена веществ могут быть неиммунные заболевания, такие как ожирение.
Указанными заболеваниями центральной нервной системы могут быть болезнь Альцгеймера, болезнь Паркинсона, шизофрения и депрессия.
Указанными заболеваниями и расстройствами могут также быть заживление ран, анемия у пациентов, подвергнутых диализу, и остеопороз.
Соединения-миметики полипептида IFNα-17, содержащие SNP g771с настоящего изобретения
Настоящее изобретение также относится к новому соединению, обладающему биологической активностью, в основном, аналогичной активности полипептида с:
а) аминокислотной последовательностью SEQ ID NO:2 или
b) аминокислотной последовательности, содержащей аминокислоты, расположенные между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2;
при условии, что указанные аминокислотные последовательности (а) и (b) содержат SNP G45R.
Указанная биологическая активность может быть измерена, например, путем оценки созревания дендритных клеток, высвобождения цитокинов CD4+- или CD8+-Т-лимфоцитами, высвобождения цитокинов моноцитами, in vitro или in vivo противовирусной активности, клеточной антипролиферативной активности по отношению к клеточной линии TF-1 или клеточной антипролиферативной активности по отношению к клеточной линии Дауди Беркитта, как описано в экспериментальной части.
Как упоминается в экспериментальной части, по сравнению с IFNα-2 дикого типа, G45R-мутированный IFNα-17 обладает:
- более высокой способностью стимулировать высвобождение IFN-гамма CD4+-Т-лимфоцитами,
- более высокой способностью стимулировать высвобождение IFN-гамма и IL-10 CD8+-Т-лимфоцитами,
- более низкой способностью стимулировать высвобождение IL-10 и IL-12 моноцитами,
- аналогичным антипролиферативным действием на клетки TF-1,
- более высоким антипролиферативным действием на клетки клеточной линии Дауди Беркитта,
- более высокой противовирусной активностью in vitro в клеточной культуре, инфицированной VS,
- более высокой противовирусной активностью in vivo в мышиной EMCV-модели.
Как было также упомянуто в экспериментальной части, G45R-мутированный IFNα-17, по сравнению с IFNα-17 дикого типа, обладает более низким антипролиферативным действием на клеточные линии Дауди Беркитта.
Новое соединение настоящего изобретения, такое как соединение, определенное выше, может обладать биологической активностью, в основном, аналогичной активности G45R-мутированного IFNα-17.
Указанное соединение может также обладать биологической активностью, такой как стимуляция высвобождения IFN-гамма CD4+- или CD8+-Т-лимфоцитами и высвобождения IL-10 CD8+-Т-лимфоцитами, противовирусная активность in vitro, или противовирусная активность in vivo, которая является даже более высокой, чем активность G45R-мутированного IFNα-17.
Указанное соединение может также обладать биологической активностью, такой как стимуляция высвобождения IL-10 и IL-12 моноцитами, которая является еще более низкой, чем активность G45R-мутированного IFNα-17.
Указанным соединением может быть биохимическое соединение, такое как, например, полипептид или пептид, или органическое химическое соединение, такое как, например, синтетический пептид-миметик.
Настоящее изобретение также относится к применению полипептида настоящего изобретения, содержащего SNP G45R, для идентификации соединения, такого как соединение, определенное выше.
Настоящее изобретение также относится к способу идентификации соединения настоящего изобретения, включающему следующие стадии:
а) определения биологической активности тестируемого соединения, такой как, например, созревание дендритных клеток, высвобождение цитокинов CD4+- или CD8+-Т-лимфоцитами, высвобождение цитокинов моноцитами, клеточная антипролиферативная активность по отношению к клеточной линии TF-1 или клеточная антипролиферативная активность по отношению к клеточной линии Дауди Беркитта, in vitro или in vivo противовирусная активность;
b) сравнения:
(i) активности тестируемого соединения, определенной в стадии а), с
(ii) активностью полипептида с аминокислотной последовательностью SEQ ID NO:2 или с аминокислотной последовательностью, содержащей аминокислоты, находящиеся между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2, при условии, что указанные аминокислотные последовательности содержат SNP G45R и
с) определения, на основании сравнения, проводимого в стадии (b), обладает ли тестируемое соединение, в основном, аналогичной, или более низкой, или более высокой активностью по сравнению с активностью полипептида с аминокислотной последовательностью SEQ ID NO:2 или с аминокислотной последовательностью, содержащей аминокислоты, находящиеся между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2, при условии, что указанные аминокислотные последовательности содержат SNP G45R.
Предпочтительно тестируемое соединение может быть предварительно идентифицировано из комбинаторных библиотек синтетического пептида, высокоэффективного скрининга, либо оно может быть сконструировано путем компьютерного моделирования лекарственного средства, так, чтобы оно имело такую же трехмерную структуру, как и полипептид с аминокислотной последовательностью SEQ ID NO:2, или с аминокислотной последовательностью, содержащей аминокислоты, находящиеся между положениями 24 и 189 аминокислотной последовательности SEQ ID NO:2, при условии, что указанные аминокислотные последовательности содержат SNP G45R.
Методы идентификации и конструирования соединений хорошо известны специалистам.
Эти методы можно найти, например, в публикациях:
- Silverman R.B. (1992). "Organic Chemistry of Drug Design and Drug Action". Academic Press, 1st edition (January 15, 1992).
- Anderson S. and Chiplin J. (2002). "Structural genomics; shaping the future of drug design" Drug Discov. Today. 7(2): 105-107.
- Selick H.E., Beresford A.P., Tarbit M.H. (2002). "The merging importance of predictive ADME simulation in drug discovery". Drug Discov. Today. 7(2): 109-116.
- Burbidge R., Trotter M., Buxton B., Holden S. (2001). "Drug design by machine learning: support vector machines for pharmaceutical data analysis". Comput. Chem. 26(1): 5-14.
Kauvar L.M. (1996). "Peptide mimetic drugs: a comment on progress and prospects". 14(6): 709.
Соединения настоящего изобретения могут быть использованы для получения лекарственного средства, предназначенного для профилактики или лечения одного из заболеваний, выбранных из группы, состоящей из рака и опухолей, инфекционных заболеваний, венерических заболеваний, иммуно-ассоциированных заболеваний и/или аутоиммунных заболеваний и расстройств, сердечно-сосудистых заболеваний, болезней обмена веществ, заболеваний центральной нервной системы и расстройств, связанных с применением химиотерапии.
Указанными раковыми заболевания и опухолями являются карциномы, включая метастазирующие карциномы почек, меланомы, лимфомы, включая фолликулярные лимфомы и Т-клеточные лимфомы кожи, лейкозы, включая лейкемический ретикулез, хронический лимфоцитарный лейкоз и хронический миелоидный лейкоз, рак печени, шеи, головы и почек, множественные миеломы, карциноидные опухоли и опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа.
Указанными инфекционными заболеваниями являются вирусные инфекции, включая хронический гепатит В и С и ВИЧ/СПИД, инфекционные пневмонии и венерические заболевания, такие как остроконечные бородавки.
Указанными иммунными и аутоиммунными заболеваниями могут быть отторжение трансплантата ткани или органов, аллергии, астма, псориаз, ревматоидный артрит, рассеянный склероз, болезнь Крона и язвенный колит.
Указанными болезнями обмена веществ могут быть неиммунные заболевания, такие как ожирение.
Указанными заболеваниями центральной нервной системы могут быть болезнь Альцгеймера, болезнь Паркинсона, шизофрения и депрессия.
Указанными заболеваниями и расстройствами могут также быть заживление ран, анемия у пациентов, подвергнутых диализу, и остеопороз.
Предпочтительно соединения настоящего изобретения могут быть использованы для получения лекарственного средства, предназначенного для профилактики и/или лечения одного из заболеваний, выбранных из группы, состоящей из некоторых вирусных инфекций, таких как, например, хронический гепатит В и С, лейкозы, включая лейкемический ретикулез и хронический миелоидный лейкоз, множественные миеломы, фолликулярные лимфомы, карциноидные опухоли, злокачественные меланомы, метастазирующие карциномы почек, болезнь Альцгеймера, болезнь Паркинсона, а также опухоли, которые возникают вследствие иммунодефицита, такие как саркома Капоши в случае СПИДа, остроконечные бородавки и/или венерические заболевания.
Экспериментальная часть
Пример 1: Моделирование белка, кодируемого полинуклеотидом нуклеотидной последовательности, содержащей SNP G45R, и белка, кодируемого нуклеотидной последовательностью исходного гена дикого типа
В первой стадии конструировали трехмерную структуру IFNα-17 исходя из структуры IFNα-2, которая имеется в базе данных PDB (код доступа 1ITF), с использованием компьютерной программы Modeler (MSI, San Diego, CA).
Затем фрагмент зрелого полипептида модифицировали так, чтобы он мог репродуцировать мутацию G45R.
На этом мутированном фрагменте проводили тысячу стадий молекулярной минимизации с использованием программ AMBER и DISCOVER (MSI: Molecular Simulations Inc.).
Затем с использованием тех же самых программ и тех же самых силовых полей проводили две серии вычислений параметров молекулярной динамики.
В каждом случае проводили 50000 стадий вычислений при 300 К, после чего проводили 300 стадий уравновешивания.
Результаты этого моделирования визуализированы на фигурах 1А и 1В.
Пример 2. Экспрессия природного IFNα-17 дикого типа и G45R-мутированого IFNα-17 в дрожжах
а) Клонирование природного IFNα-17 дикого типа и мутированого IFNα-17 в эукариотическом экспрессирующем векторе pPicZα-topo
Нуклеотидные последовательности, кодирующие зрелую часть природного IFNα-17 дикого типа и G45R-мутированного IFNα-17, амплифицировали с помощью ПЦР с использованием в качестве матрицы геномной ДНК, взятой от индивидуума, который является гетерозиготным по SNP.
Для амплификации могут быть использованы следующие ПЦР-праймеры:
SEQ ID NO:6: смысловой праймер: TGTGATCTGCCTCAGACCCAC.
SEQ ID NO:7: антисмысловой праймер: TCAATCCTTCCTCCTTAATATTTTTTGC.
ПЦР-продукты встраивали в эукариотический экспрессирующий вектор pPicZα-topo, находящийся под контролем гибридного промотора АОХ1, индуцируемого метанолом (ТОРОТМ-клонирование; Invitrogen Corp.).
Этот вектор обеспечивает гетерологичную экспрессию эукариотических белков в дрожжах Pichia pastoris.
После проверки нуклеотидной последовательности той области вектора, которая кодирует рекомбинантные белки, этот вектор линеаризовали с использованием рестриктирующего фермента PmeI и штамм P. pastoris (Invitrogen) трансформировали указанными рекомбинантными экспрессирующими векторами.
b) Гетерологичная экспрессия в P. pastoris и очистка белков IFNα-17 дикого типа и G45R-мутированного IFNα-17
Две насыщенные пре-культуры в 50 мл среды BMGY (2% пептон, 1% дрожжевой экстракт, 1,34% YNB, 1% глицерина, 100 мМ фосфата калия, 0,4 мг/литр биотина, рН 6,0), содержащей клон, кодирующий белок IFNα-17 дикого типа, или клон, кодирующий G45R-мутированный IFNα-17, выращивали в течение 24-48 часов при 30°С, перемешивая при 200 оборотов в минуту (об/мин).
Когда клеточная плотность в культуре достигала насыщения (что соответствовало оптической плотности 12, измеренной при длине волны 600 нм), эту культуру использовали для инокуляции, при 5 OD/мл, 250 мл среды BMMY (2% пептон, 1% дрожжевой экстракт, 1,34% YNB, 0,5% метанола, 100 мМ фосфата калия, 0,4 мг/литр биотина, рН 6,0).
Затем экспрессию белка индуцировали метанолом при конечной концентрации 1% в течение 24 часов при 30°С и при перемешивании в колбе для культивирования при 180 об/мин.
Благодаря присутствию сигнальной пептидной последовательности "альфа-фактора", расположенной выше кодирующей последовательности, белки секретировались дрожжами в культуральную среду. Альфа-фактор обычно отщепляется во время процессинга.
Суспензию центрифугировали и белок выделяли из полученного супернатанта с помощью ВЭЖХ.
В предварительной стадии, проводимой путем ультрафильтрации (Labscale, отсечка 5000 Да, Millipore) с последующим диализом, достигалось десятикратное концентрирование дрожжевого супернатанта в буфере 50 мМ Трис-HCl, рН 9,0, 25 мМ NaCl.
В первой хроматографической стадии проводили очистку белка на аффинной колонке с сефарозой (Sepharose Blue, Amersham Pharmacia). Присутствие белка в собранных фракциях подтверждалось, с одной стороны, путем электрофореза в ДСН-ПААГ, и с другой стороны, путем иммунодетекции с использованием специфического антитела, направленного против белка IFNα-17. В этой стадии чистота нужного белка составляла более чем 75%.
Во второй стадии очистки гель-фильтрация позволяла проводить замену буфера в собранных фракциях, соответствующих белкам IFNα-17, вместо 50 мМ трис рН 9,0, 25 мМ NaCl.
Последняя стадия очистки заключалась в разделении белков на ионообменной хроматографической колонке.
Фракции, содержащие рекомбинантный белок, инъецировали на анионообменной колонке (ResourceQ 6,0 мл, Pharmacia), предварительно уравновешенной в трис-буфере, 50 мМ, рН 9, NaCl, 25 мМ. Элюирование белков осуществляли с использованием градиента в пределах 0,25 и 1 М NaCl в трис-буфере, 50 мМ, рН 9.
Чистоту нужного белка оценивали посредством электрофореза в ДСН/ПАГ-геле, а концентрации белка измеряли с помощью денситометрии (Quantity one, Biorad) и ВСА-анализа (бицинхониновая кислота - сульфат меди, Sigma).
И наконец, очищенный белок IFNα-17 дикого типа и G45R-мутированный белок IFNα-17, полученные в соответствии с описанным протоколом в более крупном масштабе для продуцирования больших количеств белка, использовали для функциональных тестов, описанных ниже.
Пример 3. Оценка иммуномодулирующей активности природного IFNα-17 дикого типа и G45R-мутированного IFNα-17
IFN типа I (IFN-альфа и IFN-бета) способны модулировать некоторые функции иммунной системы. Было продемонстрировано, что они ускоряют созревание дендритных клеток (ДК): то есть усиливают экспрессию МНС-молекул класса I (HLA-АВС) и II (HLA-DR), усиливают экспрессии молекул, участвующих в ко-стимуляции Т-лимфоцитов, CD80-, CD86- и CD83-молекул, и усиливают стимулирующую функцию Т-лимфоцитов.
а) Действие G45R-мутированного IFNα-17 на созревание дендритных клеток
Сначала исследовали иммуномоделирующую активность G45R-мутированного IFNα-17 по отношению к созреванию дендритных клеток и сравнивали ее с активностью IFNα-2 дикого типа, выбранного в качестве репрезентативного коммерческого продукта Intron A.
Для этого сначала получали дендритные клетки из моноцитов периферической крови взрослого индивидуума, культивированных в присутствии цитокинов GM-CSF и IL-4. После очистки с использованием набора для очистки CD14+-клеток эти дендритные клетки выдерживали в присутствии 100 нг/мл IFNα-2 дикого типа или G45R-мутированного IFNα-17 и их фенотип определяли с помощью FACS-анализа путем оценки экспрессии молекул МНС-молекул класса I и II и маркеров CD40, CD80, CD86, CD83 и CD1а. Стадию созревания указанных дендритных клеток также сравнивали со стадиями созревания дендритных клеток, полученных без IFNα-обработки, то есть нестимулированных дендритных клеток, которые использовали в качестве контроля.
Средние значения интенсивности флуоресценции для каждого маркера и для трех экспериментальных условий, выраженные в условных единицах, представлены в следующей таблице:
ABC
DR
Результаты этого теста продемонстрировали, что G45R-мутированный белок IFNα-17 способен стимулировать созревание дендритных клеток.
b) Действие G45R-мутированного IFNα-17 на высвобождение цитокинов Т-лимфоцитами
Иммуномодулирующую активность G45R-мутированного IFNα-17 также исследовали путем оценки высвобождения цитокинов Т-лимфоцитами в присутствии мутированного белка IFNα-17 и в присутствии или в отсутствие сильного антигена (SEB), используемого для имитации иммунного ответа против цитотоксической реакции. Этот тест также осуществляли в присутствии IFNα-2 дикого типа, используемого в качестве контроля и выбранного в качестве репрезентативного коммерческого продукта Intron A.
Для этого у здорового донора выделяли мононуклеарные клетки периферической крови (МКПК) и стимулировали в течение 16 часов в соответствующей среде, содержащей анти-CD3 и анти-CD28 антитела или SEB. В каждую культуру добавляли 4 мкг/мл IFNα-2 дикого типа или G45R-мутированный IFNα-17. После стимуляции Т-лимфоциты метили внеклеточно анти-CD3, анти-CD4- и анти-CD69 антителами или анти-CD3, анти-CD8- и анти-CD69 антителами и метили внутриклеточно специфическими антителами, направленными против цитокинов Th1-типа (IFN-гамма) или против цитокинов Th2-типа (IL-10). Флуоресцентные клетки анализировали с использованием программ FACScalibur и CellQuest.
Полученные результаты показали, что G45R-мутированный IFNα-17 и IFNα-2 дикого типа не стимулировали высвобождение IL-10 и IFN-гамма, а следовательно, не активировали Т-лимфоциты в отсутствии SEB.
В противоположность этому, G45R-мутированный IFNα-17 и IFNα-2 дикого типа стимулировали высвобождение цитокинов (IL-10 и IFN-гамма) SEB-активированными Т-лимфоцитами, как показано ниже в таблице. В этой таблице продемонстрировано высвобождение цитокинов Т-лимфоцитами в присутствии SEB, выраженное в процентах CD4+-, CD69+-клеток или CD8+,CD69+-клеток для CD4+-Т-лимфоцитов и CD8+-Т-лимфоцитов соответственно и указан процент CD69+-клеток от общего числа клеток.
Эти результаты ясно продемонстрировали, что G45R-мутированный IFNα-17 сильно стимулирует высвобождение цитокинов (IFN-гамма) CD4+-Т-лимфоцитами и CD8+-Т-лимфоцитами, предварительно активированным антигеном SEB. В этом тесте уровень продуцирования интерферона гамма CD4+-Т-лимфоцитами в присутствии G45R-мутированного IFNα-17 был выше, чем в присутствии IFNα-2 дикого типа, а уровень продуцирования интерферона гамма и IL-10 CD8+-Т-лимфоцитами в присутствии G45R-мутированного IFNα-17 был выше, чем в присутствии IFNα-2 дикого типа.
с) Действие G45R-мутированного IFNα-17 на высвобождение цитокинов моноцитами
И наконец, иммуномодулирующую активность G45R-мутированного IFNα-17 исследовали путем измерения уровня высвобождения цитокинов моноцитами в отсутствие или в присутствии бактериального токсического агента (ЛПС). Этот тест также осуществляли в присутствии IFNα-2 дикого типа, используемого в качестве контроля и выбранного в качестве репрезентативного коммерческого продукта Intron А.
Для этого у здорового донора выделяли мононуклеарные клетки периферической крови (МКПК) и проводили анализ на их фенотип для определения относительного количества CD64+CD4dim-клеток (CD64 и CD4dim являются маркерами моноцитов крови). После культивирования в течение ночи эти МКПК инкубировали в культуральной среде, взятой отдельно (нестимулированные клетки) или в присутствии ЛПС (стимулированные клетки). В каждую культуру добавляли 4 мкг/мл IFNα-2 дикого типа или G45R-мутированного IFNα-17. После культивирования, клетки метили внеклеточно анти-CD64 и анти-CD4dim антителами и внутриклеточно специфическими антителами, направленными против цитокинов Th1-типа (TNF-альфа), IL-12 и IL-10.
Флуоресцентные клетки анализировали с использованием программ FACScalibur и CellQuest.
Полученные результаты показали, что G45R-мутированный IFNα-17 и IFNα-2 дикого типа не стимулировали высвобождение цитокинов (IL-10, IL-12 и TNF-альфа) в отсутствие ЛПС.
В противоположность этому, моноциты высвобождали цитокины в присутствии ЛПС. Высвобождение IL-10 и IL-12 моноцитами в присутствии ЛПС еще более увеличивалось в присутствии IFNα-2 дикого типа, но не в присутствии G45R-мутированного IFNα-17, как показано ниже в таблице. В этой таблице продемонстрировано высвобождение цитокинов моноцитами в присутствии ЛПС, выраженное в процентах CD64+, CD4dim-клеток, и указан процент CD4dim, CD64+-клеток от общего числа клеток.
Таким образом, отсутствие синергического эффекта, наблюдаемого в присутствии G45R-мутированного IFNα-17 и ЛПС, позволяет предположить, что G45R-мутированный IFNα-17 может оказывать иммуносупрессорное действие.
Пример 4. Оценка in vitro антипролиферативного действия G45R-мутированного IFNα-17 на клеточную линию эритролейкоза TF-1
Действие G45R-мутированного IFNα-17 также оценивали по отношению к клеточной линии эритролейкоза TF-1. Этот тест также осуществляли в присутствии IFNα-2 дикого типа, используемого в качестве контроля и выбранного в качестве репрезентативного коммерческого продукта Intron А.
Для этого клетки TF-1 подвергали контакту с возрастающими концентрациями мутированного IFNα-21 или IFNα-2 дикого типа (0,001 - 1000 нг/мл) и измеряли пролиферацию клеток.
Результаты, представленные на фиг.2, показали, что G45R-мутированный IFNα-17 обладает слабыми антипролиферативным действием на клетки TF-1, и это действие аналогично действию IFNα-2 дикого типа, что дает основание предположить, что гематологичная токсичность G45R-мутированного IFNα-17 не превышает токсичность IFNα-2 дикого типа.
Пример 5. Оценка способности G45R-мутированного IFNα-17 индуцировать антипролиферативную активность человеческой клеточной линии лимфомы Дауди Беркитта
Эти тесты осуществляли на двух различных белках IFNα-17, а именно на G45R-мутированном белке IFNα-17 и природном белке IFNα-17 дикого типа. Клетки (человеческой клеточной линии лимфомы Дауди Беркитта, далее называемой "клетками Дауди"), предварительно культивированные в среде RPMI 1640 (в которую были добавлены 10% фетальная телячья сыворотка и 2 мМ L-глутамина), затем инокулировали в 96-луночные планшеты при клеточной плотности 4 х 104 клеток/лунку.
В каждой лунке клетки Дауди подвергали контакту с возрастающими концентрациями белков либо природного IFNα-17 дикого типа, либо G45R-мутированного IFNα-17.
Концентрации исследуемого IFNα-17 (природного белка дикого типа или мутированного белка) составляли от 0,003 пмоль до 600 нмоль (конечные концентрации в лунках).
Затем клетки Дауди инкубировали в течение 66 ч при 37оС в 5% СО2, после чего в эти культуры добавляли реагент Uptiblue (Uptima). После дополнительного инкубирования в течение 4 часов степень пролиферации клеток количественно оценивали путем измерения флуоресценции, излучаемой на длине волны 590 нмоль (возбуждение 560 нм).
Антипролиферативную активность природного IFNα-17 дикого типа или G45R-мутированного IFNα-17 измеряли как IC50, соответствующую концентрации белка IFNα-17, в пикомолях (пмоль), которая ингибирует 50% клеточного роста.
Осуществляли четыре аналогичных эксперимента, каждый из которых повторяли четыре раза. Величины IC50 для каждого эксперимента представлены в следующей таблице:
Средние величины IC50, измеренные для IFNα-17 дикого типа, составляли 0,49 пмоль, а средние величины IC50, измеренные для G45R-мутированного IFNα-17, составляли 5,31 пМ. Таким образом, среднее отношение величины IC50 для мутированного IFNα-17 к величине для природного IFNα-17 дикого типа достигало 10,80 (со стандартным отклонением 3,46).
Этот тест продемонстрировал, что в случае G45R-мутированного IFNα-17 антипролиферативная активность сильно ингибировалась (т.е. была приблизительно в 5-15 раз меньше) по сравнению с IFNα-17 дикого типа.
Аналогичные независимые эксперименты были проведены с использованием IFNα-2 дикого типа для сравнения антипролиферативного действия G45R-мутированного IFNα-17 на пролиферацию клеток Дауди с действием IFNα-2 дикого типа. Для этого клетки Дауди культивировали в присутствии концентраций G45R-мутированного IFNα-17 или IFNα-2 дикого типа, составляющих в пределах от 0,001 до 10 нг/мл.
Проводили три аналогичных эксперимента. Результаты одного репрезентативного эксперимента приводятся на фигуре 3.
Эти результаты продемонстрировали, что антипролиферативное действие G45R-мутированного IFNα-17 на пролиферацию клеточной линии Дауди Беркитта выше, чем действие IFNα-2 дикого типа.
Пример 6. Оценка противовирусной активности G45R-мутированного IFNα-17
IFN играют важную роль в противовирусной защите. Противовирусная активность IFN частично обусловлена IFN-индуцированными ферментными системами, такими как:
- 2'5'-олигоаденилат-синтетаза, фермент, который катализирует синтез аденозинового олигомера. Эти олигомеры активируют РНКазу L, эндорибонуклеазу, которая, после активации, разрушает вирусную РНК;
- белки Мх (GTPазы), которые ингибируют синтез и/или созревание вирусных транскриптов. Эта активность, главным образом, влияет на вирус гриппа;
- белок PKR (или киназа р68), который активируется двухцепочечной РНК. Активированный PKR ингибирует синтез белка.
Противовирусная активность IFN также индуцируется другими механизмами, такими как, в случае ретровирусов, ингибирование проникновения вирусных частиц в клетки, репликация, связывание и выход частиц, а также инфекционность вирусных частиц.
И наконец, IFN оказывает опосредованное противовирусное действие посредством модуляции некоторых функций иммунной системы, а в частности посредством стимуляции ответа на клеточно-опосредованные реакции (включая увеличение молекул МНС класса I и II, увеличения продуцирования IL-12 и IFN-гамма, увеличения CTL-активности и т.п.).
Противовирусную активность G45R-мутированного IFNα-17 также оценивали in vitro в клеточной культуре и in vivo на мышиной модели. Оба теста проводили параллельно с IFNα-2 дикого типа, используемого в качестве контроля и выбранного в качестве репрезентативного коммерческого продукта Intron А.
а) Противовирусная активность in vitro в клеточной культуре
Этот анализ позволяет оценить противовирусную активность G45R-мутированного IFNα-17 и IFNα-2 дикого типа в клеточной культуре с использованием вируса везикулярного стоматита (VSV).
Для этого человеческие эпителиальные клетки WISH культивировали в течение 24 часов в присутствии снижающихся концентраций G45R-мутированного IFNα-17 или IFNα-2 дикого типа. Затем эти клетки инфицировали вирусом везикулярного стоматита (VSV) в течение еще 24-48 часов и оценивали лизис клеток.
Противовирусное действие различных протестированных IFNα определяли путем сравнения величины IC50, соответствующей концентрации IFN, ингибирующей 50% лизис клеток, индуцированный вирусом VSV.
Аналогичный эксперимент проводили два раза, и величины IC50, измеренные в одном репрезентативном эксперименте, представлены в следующей таблице:
Таким образом, G45R-мутированный IFNα-17 обладал противовирусной активностью в клеточной культуре, инфицированной VSV, и эта противовирусная активность превышала активность IFNα-2 дикого типа.
b) Противовирусная активность in vivo в мышиной модели
Этот тест проводили in vivo на EMCV-мышиной модели (мыши, инфицированной вирусом энцефаломиокардита).
Человеческие IFN обнаруживали дозозависимую противовирусную активность у мышей, и эта активность была, в основном, в 100-1000 раз меньше, чем активность аналогичного количества мышиного IFN (Meister et al., (1986). J. Gen. Virol. 67, 1633-1644).
Внутрибрюшинная инъекция вируса энцефаломиокардита мышам (EMCV) приводила к быстрому прогрессированию летального заболевания, характеризующегося поражением центральной нервной системы и энцефалитом (Finter N.B. (1973). Front.Biol. 2:295-360). Было обнаружено, что мышиный и человеческий интерферон альфа являются эффективными для защиты мышей от летальной EMCV-инфекции (Tovey & Maury (1999). J. IFN Cytokine Res. 19:145-155).
Группам из 20 шестинедельных мышей Swiss инфицировали внутрибрюшинно (i.p.) 100 х LD50 EMCV, и эту же дозу инъецировали еще через один час, а затем ежедневно в течение 3 дней вводили 2 мкг препаратов G45R-мутированного IFNα-17 и IFNα-2 дикого типа. В качестве контрольной группы служили животные, обработанные только наполнителем. За выживаемостью этих животных ежедневно наблюдали в течение 21 дня.
Результаты, представленные на фигуре 4, указывают на то, что относительная выживаемость мышей, обработанных G45R-мутированным IFNα-17, была гораздо выше, чем выживаемость необработанных мышей, и даже выше, чем выживаемость мышей, обработанных IFNα-2 дикого типа. Эти данные продемонстрировали сильную противовирусную активность G45R-мутированного IFNα-17 в мышиной модели in vivo.
Все полученные результаты продемонстрировали, что G45R-мутированный IFNα-17 обладает уникальными биологическими свойствами.
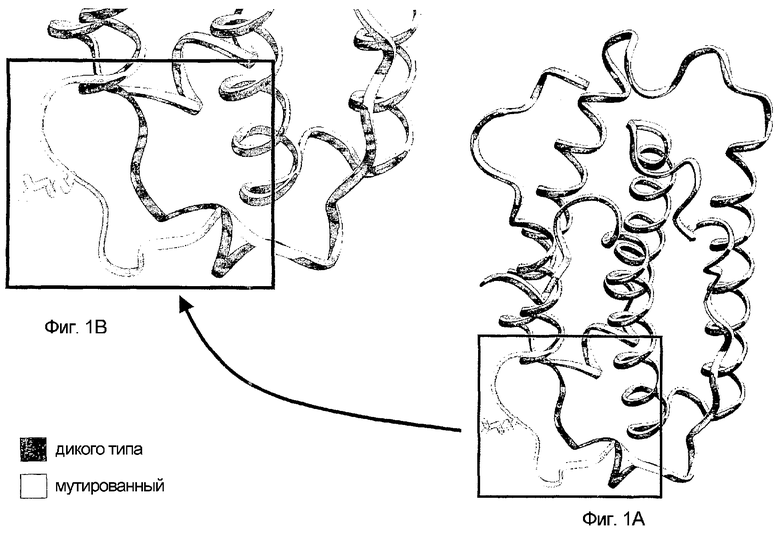
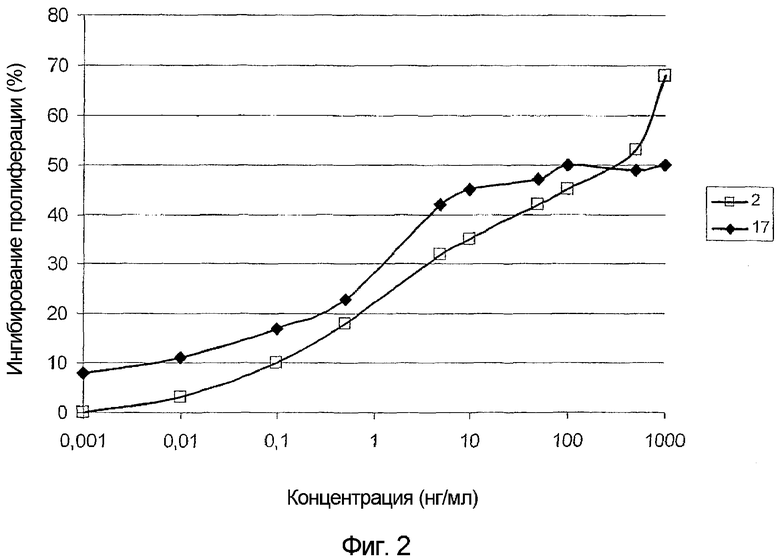
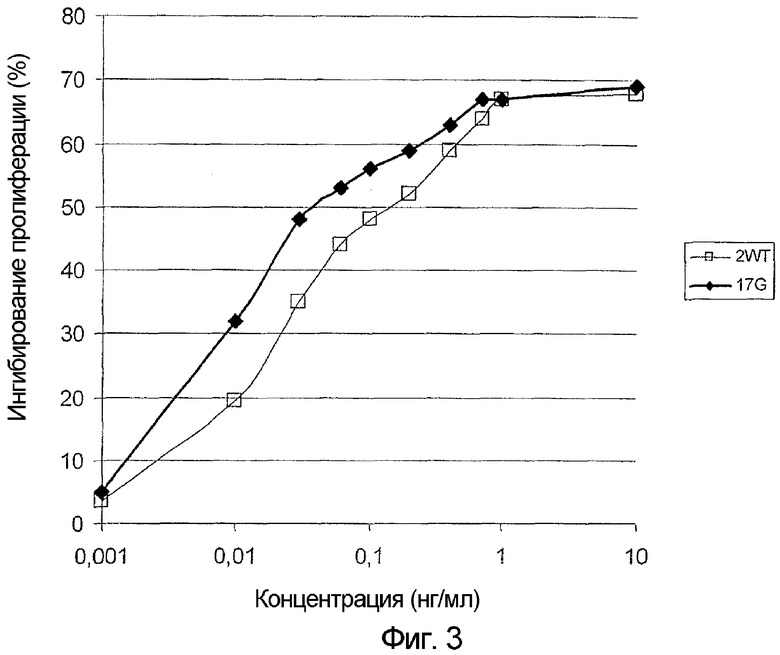
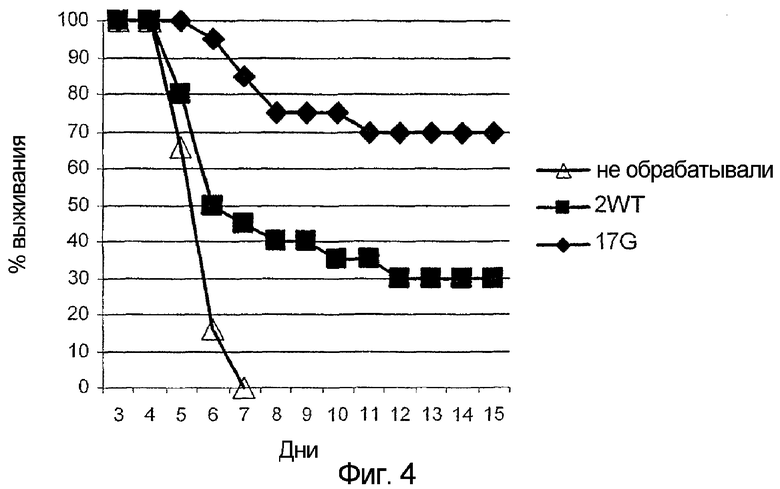
Изобретение относится к биотехнологии. Предложен новый полинуклеотид, полученный из нуклеотидной последовательности гена IFNα-17, содержащий единичный нуклеотидный полиморфизм SNP g771c. Также предложен новый полипептид, происходящий от природного белка IFNα-17 дикого типа, содержащий SNP G45R. Изобретение может быть использовано для получения эффективного терапевтического средства, обладающего противовирусной, антипролиферативной и/или иммуномодулирующей активностью. 7 н. и 6 з.п. ф-лы, 5 табл., 5 ил.
a) нуклеотидной последовательности, которая, по крайней мере, на 95% идентична нуклеотидной последовательности SEQ ID NO:1 или ее кодирующей последовательности, при условии, что указанная нуклеотидная последовательность имеет единичный нуклеотидный полиморфизм SNP g771c, основываясь на нумерации SEQ ID NO:1; или
b) нуклеотидной последовательности, комплементарной нуклеотидной последовательности (а).
a) части или всей последовательности SEQ ID NO:1, или ее кодирующей последовательности, при условии, что такая нуклеотидная последовательность содержит SNP g771c, основываясь на нумерации SEQ ID NO:1, или
b) нуклеотидной последовательности, комплементарной нуклеотидной последовательности (а), при этом указанный полинуклеотид состоит, по крайней мере, из 40 нуклеотидов.
| US 4780530 А, 25.10.1988 | |||
| US 4801685 А, 31.01.1989 | |||
| ULLRICH A | |||
| et al | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| J | |||
| OF MOLECULAR BIOLOGY, LONDON, GB, 15.04.1982, v.156, №3, p.467-486 | |||
| HENCO К | |||
| ет al | |||
| Structural relationship of human interferon alpha genes and pseudogenes | |||
| J | |||
| OF MOLECULAR | |||
Авторы
Даты
2008-07-10—Публикация
2002-04-23—Подача