Изобретение относится к имплантируемым таблеткам налтрексона и обеспечивает точное и контролируемое количество налтрексона, выделяемое в организм в течение 3-6 мес. Изобретение также относится к процессу приготовления и стерилизации имплантируемых таблеток налтрексона.
Наркотики и злоупотребление алкоголем зачастую являются симптомами основных социальных проблем и связаны с неконтролируемым поведением, таким как, небезопасные сексуальные привычки и риск ВИЧ/СПИДа, которые все чаще проявляются в настоящее время. Важность проблемы и все имеющиеся данные свидетельствуют о катастрофе в ближайшее время и требуют неотложного внимания от всех заинтересованных сторон. Значительное количество населения мира подчеркивает необходимость вмешательства с целью предотвращения катастрофы как сегодняшнего, так и завтрашнего дня в сфере продуктивности поколения.
Налтрексон является антагонистом опиоидных рецепторов, используемых в первую очередь при лечении алкогольной и наркотической зависимости. Он есть на рынке в виде непатентованной формы гидрохлоридной соли, гидрохлорида налтрексона. Он продается под торговыми названиями Revia и Depade в форме таблеток 50 мг, покрытых оболочкой.
Однако эти оральные таблетки действуют от 24 до 48 ч, и, как известно, большинство пациентов, которые сильно зависят от наркотика, забывает или намеренно не хотят принимать лекарства, и лечение становится неэффективным для преодоления зависимости. Чтобы избежать данной проблемы, были разработаны ежемесячные депо-инъекции, которые высвобождают контролируемое количество налтрексона в организм, чтобы делать лечение эффективным. Во многих странах, в том числе в США, инъекционный препарат для введения в организм раз в месяц (депо-инъекции) продается под торговым названием Вивитрол. Налтрексон также назначают, чтобы уменьшить прием героина и амфетамина.
В последнее время имплантаты налтрексона используются для лечения различных зависимостей, которые включают наркотики и алкоголь. Имплантат налтрексона - это небольшая таблетка, которая вводится в нижнюю часть брюшной стенки под местной анестезией. Этот имплантат эффективен в течение 3-6 мес в зависимости от типа используемого имплантата и высвобождает контролируемое количество налтрексона в организм. Имплантат работает путем блокирования воздействия опиатных наркотиков. Терапия налтрексоном должна продолжаться от 6 до 12 мес, что позволяет пациенту избежать поражения мозга наркотиками, а также дает пациенту возможность вести нормальную жизнь после восстановления. Однако существует ряд побочных эффектов, связанных с имплантатом налтрексона, к которым относится инфекция, раздражение или воспаление в месте имплантации.
Информация об имплантируемых таблетках налтрексона была впервые опубликована в WO 98030171(А1), публ. 16.07.1998 г., где налтрексон помещен в магний стеарат. Эти имплантаты вызывают раздражение тканей из-за наличия в их составе магния стеарата. Имплантаты растворяются и исчезают полностью в среднем примерно за 5-6 недель.
Улучшенные имплантаты налтрексона 1000 мг разработаны Джорджем Шерманом (Towne Pharmacy, NJ) в комбинации с замедленным высвобождением триамцинолона 100 мг для уменьшения тканевой реакции, они эффективно блокируют наркотик в течение 12-14 недель. Эти имплантаты под торговой маркой "Продетоксон" в настоящее время реализуются в России.
Кроме того, улучшенные имплантаты налтрексона были разработаны доктором Джорджем О'Нилом (GO-Medical Industries) (http://www.naltrexane.com/80500/info.php?p=4?). Они включают в себя налтрексон, помещенный в матрицу из биоразлагаемых полимерных микросфер. Эти имплантаты высвобождают налтрексон в течение 5-12 мес или более. Состав имплантата содержит приблизительно 50% налтрексона, 49% биологически разлагаемого полимера и менее чем 1% стеарата магния. Эти имплантаты обычно вводят с антибиотиками. После приготовления имплантаты должны быть простерилизованы перед введением. Их стерилизуют гамма-облучением интенсивностью минимум 25 кГр и не более 40 кГр. Стерилизация при высоких температурах и при высоком гамма-излучении приводит к химическому разложению с выделением нороксимофона.
Эксперименты, проведенные авторами изобретения, показывают, что высвобождение нороксимофона высокое, даже когда имплантаты стерилизуют при минимальном излучении 25 кГр. Нороксимофон, являясь продуктом разложения, по своей природе является канцерогеном, поэтому его содержание должно быть в минимально допустимых пределах с тем, чтобы устранить побочные эффекты этих имплантатов.
Существуют и другие имплантаты налтрексона, в настоящее время зарегистрированные/незарегистрированные, находящиеся на стадии разработки или на стадии регистрации некоторыми компаниями в Китае, Европе и США, как показано ниже в таблице 1.

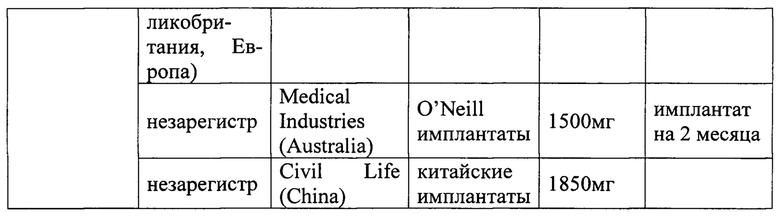
Было замечено, что соли магния или стеарат магния в сочетании с налтрексоном в имплантируемых таблетках вызывают раздражение и воспаление в месте имплантации. В известных решениях пытались уменьшить такие раздражения и воспаления путем соединения композиций налтрексона, содержащих соли магния, с триамцинолоном, который уменьшает раздражение и воспаление при использовании таких имплантатов. Однако, как видно из предшествующего уровня техники, существует другая проблема - наличие продукта разложения нороксимофона, который не должен превышать фармацевтически допустимых пределов для избежания дополнительных побочных эффектов, включая раковые заболевания.
Наиболее близким к предложенному является имплант налтрексона длительного действия (CN №105512399 А, МПК А61К 31/485, опубл. 27.06.2012 г.), который состоит из полимолочной кислоты и налтрексона в соотношении 1:(0,5-1,8) по весу. Имплант спрессован в таблетку с покрытием, покрытие частицы медленно высвобождают гранулы, которые состоят из полимолочной кислоты и налтрексона в соотношении 1: (1-2) по весу; покрытие - это DL - полимолочная кислота.
Однако известное изобретение недостаточно эффективно для лечения пациентов с алкогольной зависимостью.
Технический результат предложенного изобретения заключается в повышении эффективности действия имплантируемых таблеток налтрексона благодаря оптимальному рецепту, обеспечивающему пролонгированное и равномерное высвобождение налтрексона в организм при снижении вероятности воспаления и отторжения имплантата.
Указанный технический результат достигается имплантируемым лекарственным средством на основе налтрексона для лечения пациентов от алкогольной зависимости, включающим в качестве активного вещества налтрексон в количестве 500-2000 мг, размещенный в полости, образованной сформованным биоразлагаемым полимером на основе DL-лактидов и/или DL-гликолидов с добавлением фармацевтического полимера Eudragit и смазочного материала для обеспечения контролируемого высвобождения активного вещества в течение 3 мес и более.
Согласно изобретению смазочный материал состоит из стеариновой кислоты или глицерил моностеарата для предотвращения раздражения ткани и воспаления в месте имплантации.
Согласно изобретению имплантируемое лекарственное средство содержит 765 мг налтрексона.
Согласно изобретению имплантируемое лекарственное средство выполнено в виде одной таблетки или двух таблеток одинаковой силы с общим содержанием налтрексона 765 мг.
Согласно изобретению имплантируемое лекарственное средство содержит 903 мг налтрексона.
Согласно изобретению имплантируемое лекарственное средство выполнено в виде одной таблетки или двух таблеток одинаковой силы с общим содержанием налтрексона 903 мг.
Согласно изобретению способ стерилизации имплантируемого лекарственного средства включает воздействие на него гамма-облучением интенсивностью 8-12 кГр.
Технический результат данного изобретения достигается благодаря следующему.
Как известно, при использовании указанных имплантатов соли магния вызывают раздражение и воспаление, а триамцинолон вводят в состав для устранения раздражения и воспаления и нежелательных побочных эффектов, таких как значительное снижение веса и вялость. Это наблюдение авторов данного изобретения весьма значительное, и существует необходимость устранения этих нежелательных побочных эффектов. Дальнейшие наблюдения, связанные с повышенным содержанием примесей нороксимофона, генерируемых в процессе стерилизации имплантируемого лекарственного средства при более высоких уровнях гамма-излучения, привели к корректировке процесса, который был реализован в данном изобретении.
Предложенная композиция имплантируемых таблеток содержит налтрексон, размещенный в биоразлагаемых полимерах, выбранных из DL-лактидов и/или DL-глюколидов с добавлением Eudragit и смазки с целью обеспечения контролируемого количества налтрексона в организме, действующего в течение 3 мес или более. Смазочный материал состоит из стеариновой кислоты или глицерил моностеарата для предотвращения раздражения тканей и воспаления в месте имплантации.
Предложенное изобретение обеспечивает получение имплантируемых таблеток налтрексона, лишенных магния стеарата и триамцинолона, с тем, чтобы сократить не только метаболическую нагрузку на печень, но и снизить токсичность и канцерогенность.
Как правило, кортикостероиды, такие как триамцинолон ацетонид, преднизолон и гидрокортизон используются для уменьшения раздражения в месте имплантации, вызванного наличием магниевых солей в композиции. Однако изобретатели обнаружили в ходе исследования токсичности, которому предшествовали фармакологические и клинические исследования, что введение кортикостероидов, таких как триамцинолон ацетонид даже в небольших количествах (30 мг) в организм млекопитающего посредством имплантируемых таблеток, является причиной значительной потери массы тела, сопровождаемой вялостью.
В настоящее время, когда фармаконадзор требует предоставления информации о побочных реакциях на лекарства, стало также необходимым рассмотреть вопрос об эффективности действия препарата и уменьшении реакции при взаимодействии лекарств. Создатели данного изобретения добились этой цели, исключив кортикостероиды.
Предложенное изобретение состоит в создании композиции имплантируемых таблеток налтрексона, которая содержит налтрексон, размещенный в биоразлагаемых полимерах, выбранных из DL-лактидов и/или DL-глюколидов вместе с Eudragit и смазкой с целью обеспечения контролируемого количества налтрексона, выделяемого в организм, действующего в течение 3 мес или более.
Согласно изобретению разработаны имплантируемые таблетки налтрексона, в которых содержание налтрексона находится в диапазоне 500-2000 мг. Имплантаты согласно данному изобретению содержат 765 мг и 903 мг налтрексона, достаточного для высвобождения его выше терапевтического уровня 1 нг/мл в крови в течение 3 мес и более.
Согласно изобретению, смазка для производства имплантата выбрана предпочтительно из стеариновой кислоты или глицерила моностеарата.
Согласно изобретению обеспечивается получение композиции имплантируемой таблетки налтрексона в форме одной таблетки или двух таблеток: налтрексон 765 мг иналтрексон 903 мг.
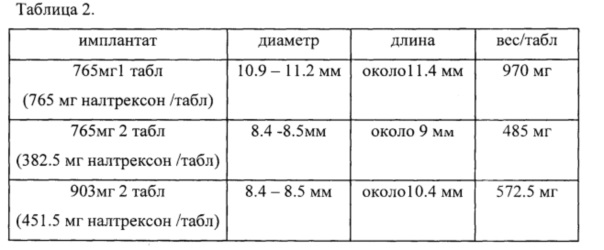
При получении налтрексона 765 мг в виде двух таблеток, каждая таблетка весит всего 485 мг и содержит 382.5 мг налтрексона с общим содержанием 765 мг и общим весом имплантата 970 мг. Каждая таблетка имеет одинаковый размер и форму. Однако размер таблетки может меняться в зависимости от количества налтрексона и вспомогательных веществ, которые используются в приготовлении таблетки.
Например, размер одной таблетки налтрексона 765 мг с общим весом 970 мг будет иметь диаметр от 10.9 до 11.2 мм и длину 11.4 мм. В комплексе из двух таблеток каждая таблетка налтрексона 382.5 мг с общим весом каждой таблетки 485 мг, будет иметь диаметр от 8,4 до 8,5 мм и длину 9,0 мм.
Аналогичным образом, для налтрексона 903 мг, представленного одной таблеткой или двумя имплантируемыми таблетками в комплексе, каждая таблетка содержит налтрексона 451.5 мг и будет иметь диаметр от 8.4 до 8.5 мм и длину 10.4 мм. Единственная разница между 1 таблеткой и комплексом из 2 таблеток - это форма и размер таблетки и простота имплантации. Для длительного действия таблетки и лучшей мотивации и комфорта используются 2 таблетки меньшего размера, имеющие одинаковый состав с общим содержанием налтрексона 903 мг. Одна таблетка при введении в нижнюю брюшную стенку под местной анестезией создает ощущение выбухания, причиняя дискомфорт пациенту, и поэтому две таблетки наиболее предпочтительны.
Разлагаемые DL-лактиды и/или гликолиды используются для изготовления имплантата налтрексона с целью контроля скорости высвобождения в течение 3 мес или более. Эти полимеры различных марок имеют различные композиции лактидтликолид, а именно 50:50, 65:35, 75:25, 85:15, 5:95.
В предпочтительном варианте был использован сополимер 50/50 DL-лактид: гликолид. Кроме того, в производстве имплантатов используется полимер Eudragit.
Предложенное изобретение обеспечивает способ стерилизации композиции имплантируемой таблетки.
Обычно, после изготовления имплантатов их помещают в полипропиленовые шприцы и упаковывают в термосвариваемую стерильную упаковку, которую подвергают стерилизации в окиси этилена. Так как окись этилена не может проникнуть в упаковку из металл/полимерной пленки, алюминиевые упаковки не используются в качестве окончательного упаковочного материала. Три временные отрезка, а именно 4.5; 6; 8 ч, использовались для стерилизации в стандартной дозировке окиси этилена, результаты были удовлетворительными при 8 часовой стерилизации. Тем не менее, остатки окиси этилена и этилена хлоргидрина могут оказать смертельное воздействие на пациента. Поэтому упакованные имплантаты были подвергнуты гамма-облучению, которое является более предпочтительным, чем стерилизация в окиси этилена.
Была проведена стерилизация гамма-облучением от 8 до 25 кГр, при этом никаких значимых/заметных изменений цвета, состава и растворения имплантируемых таблеток налтрексона не наблюдалось при низкой интенсивности гамма-облучения. Также не было никакого заметного изменения в примесях после облучения, кроме увеличения содержания нороксимофона, который является продуктом разложения налтрексона.
Было отмечено, что изначально цвет имплантата - от белого до грязно-белого. При облучении цвет меняется от светло-желтого до желтоватого и до серо-зеленого. Такое изменение цвета зависит от интенсивности облучения. Он становится желтоватым при интенсивности 8-12 кГр и становится насыщеннее или меняется на серо-зеленый, когда интенсивность составляет 25 кГр.
Изобретение предлагает способ стерилизации, который включает воздействие на имплантаты налтрексона гамма-облучением интенсивностью 8-12 кГр с тем, чтобы уменьшить выделение нороксимофона и сохранить стерильность продукта.
Тип шприца для имплантации может быть выбран из группы, состоящей из полипропилена, поликарбоната и циклического сополимера олефина. Выбор шприца никак не влияет на изделие. Шприцы из полипропилена наиболее подходят для использования.
Эффективная доза налтрексона предположительно 1 нг/мл в плазме крови. При испытании имплантата налтрексона уровень содержания его в крови колеблется от 5,2 нг/мл (1 мес) до 0,9 нг /мл (6 мес) и для 6 бета налтрексол основной активный метаболит налтрексона составляет от 9,1 нг/мл (1 мес) до 3,5 нг /мл (6 мес).
Приведенные ниже примеры показывают практическое применение изобретения.
Пример 1.
Состав имплантируемой таблетки (общий вес: 970 мг/табл.):
Налтрексон - 765 мг
Стеариновая кислота или глицерил моностеарат DL-лактид / гликолид сополимер Eudragit
Пример 2.
Система из 2 имплантируемых таблеток, вес: 485 мг/табл. и каждая таблетка содержит:
налтрексон - 382.5 мг
Стеариновая кислота или глицерил моностеарат
DL-лактид/гликолид сополимер
Eudragit
Пример 3.
Способ стерилизации:
Так как имплантат предназначен для введения под кожу человека, его стерильность играет важную роль в разработке лекарственной формы и выборе подходящего метода стерилизации для получения стерильного препарата. Стерилизация была проведена оксидом этилена и гамма-облучением.
Таблетки налтрексона для имплантации находятся в полипропеленовых шприцах и упакованы в термосвариваемую стерильную упаковку для стерилизации оксидом этилена. Так как оксид этилена не может проникнуть в металл/полимерную пленку, алюминиевые упаковки не использовались в качестве окончательного упаковочного материала. Три временные отрезка, а именно 4.5; 6; 8 ч, использовались для стерилизации в стандартной дозировке оксида этилена, результаты были удовлетворительными при 8 часовой стерилизации. Тем не менее, остатки оксида этилена и этилена хлор-гидрина могут оказать смертельное воздействие на пациента. Поэтому для безопасности пользователей упакованные имплантаты были подвергнуты гамма-облучению.
Гамма-облучение проводилось при различных интенсивностях/дозах: 4 кГр, 8 кГр, 12 кГр, 16 кГр, 20 кГр и 25 кГр. Все образцы, которые подверглись облучению 8 кГр и выше, сохранили стерильность 14 дней, в то время как при облучении в 4 и 6 кГр не удалось пройти испытание на стерильность на 8-10 день. Стерилизация гамма-облучением интенсивностью 8 и 25 кГр не показала никаких существенных изменений в содержании и растворе. Также не было никакого заметного изменения в примесях после облучения, кроме увеличения содержания нороксимофона, который является продуктом разложения налтрексона.
Когда препарат подвергли облучению интенсивностью 25 кГр, начальное содержание нороксимофона составляло 0,5%. После ускоренного исследования (при 40°С и относительной влажности воздуха 75%) в течение 3 и 6 мес было обнаружено 1,54 и 1.6% соответственно.
Однако, когда продукт подвергли облучению интенсивностью 8 кГр, начальное содержание нороксимофона составляло 0,45%. После ускоренного исследования (при 40°С и относительной влажности воздуха 75%) в течение 3 и 6 мес, было обнаружено 0.64% и 0.68% соответственно, и менее половины содержания нороксимофона при стерилизации интенсивностью 25 кГр.
Таким образом, при облучении продукта интенсивностью между 8 и 10 кГр, начальное содержание нороксимофона составляло 0,4%, а остаток составил ниже 1% (между 0.4% и 0.9%) до конца срока годности (2 года).
Кроме того, в лабораторных условиях состав препарата оставался таким же при облучении интенсивностью 8 кГр или 10 кГр для 1 имплантируемой таблетки и 2 имплантируемых таблеток 765 мг.
Пример 4.
Высвобождение лекарственного средства:
Эффективная доза налтрексона предположительно равна 1 нг/мл в плазме крови. В открытой пробе имплантата налтрексона достигнутый уровень налтрексона в крови колебался от 5,2 нг/мл (1 месяц) до 0,9 нг/мл (6 мес) и для 6 бета-налтрексола основной метаболит налтрексона составлял от 9,1 нг/мл (1 месяц) до 3,5 нг /мл (6 мес).
Пример 5.
Пример выполнения таблетки имплантата налтрексона, его вес и размеры приведены в таблице 2. Однако специалист в данной области техники может изменить форму и размер имплантата.
Пример 6.
Клинические испытания:
В крупных клинических исследованиях, проведенных с участием 50 пациентов с различной алкогольной и наркотической зависимостью, после имплантации таблеток налтрексона по данному изобретению, от 1 до 90 дней, было замечено, что нет тяги к алкоголю и в анализе мочи не обнаружен наркотик. Это наблюдение подтверждает, что имплантаты налтрексона по данному изобретению блокируют действие наркотиков, тем самым способствуют отказу от приема алкоголя и наркотиков у больных, зависимых от них. Кроме того, исследование подтверждает, что имплантаты по данному изобретению высвобождают контролируемое количество налтрексона по меньшей мере в течение 3 мес с целью поддержания минимальных терапевтических уровней в крови.
Сравнение имплантатов, содержащих в своем составе триамцинолон и не содержащих триамцинолон, привело к тому, что имплантаты, содержащие триамцинолон, приводят к значительной потере веса и наличию заторможенности, а имплантаты, не содержащие соли магния и триамцинолон, успешно обеспечивают блокаду наркотиков, не вызывая побочных эффектов, как это предусмотрено данным изобретением.
Промышленные преимущества.
Имплантируемые таблетки налтрексона, согласно предложенному изобретению, имеют преимущества перед имплантируемыми таблетками, описанными в предшествующем уровне техники, а именно их использование позволяет избежать неблагоприятного взаимодействия лекарств, побочных эффектов, таких как значительное уменьшение массы тела и вялость, воспаление и зуд в месте имплантации. Оптимально стерилизованный продукт с пониженным содержанием примесей обеспечивает высвобождение контролируемого количества налтрексона в течение 3-6 мес, легко устанавливается, комфортен для пациента.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИМПЛАНТИРУЕМОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ НАЛТРЕКСОНА ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ, ЗАВИСИМЫХ ОТ АЛКОГОЛЯ ИЛИ ОПИАТОВ | 2012 |
|
RU2476209C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОПИЙНОЙ НАРКОМАНИЕЙ И СПОСОБ ИХ ЛЕЧЕНИЯ | 1999 |
|
RU2147879C1 |
| ИМПЛАНТИРУЕМЫЕ УСТРОЙСТВА ДЛЯ ЛЕЧЕНИЯ ВИЧ | 2009 |
|
RU2546529C2 |
| СПОСОБЫ И КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КЛОНИДИН, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ЛЕЧЕНИЯ ПОСЛЕОПЕРАЦИОННОЙ БОЛИ | 2009 |
|
RU2510263C2 |
| СПОСОБ ЛЕЧЕНИЯ ОПИОИДНОЙ И/ИЛИ АЛКОГОЛЬНОЙ ЗАВИСИМОСТИ | 2006 |
|
RU2310449C1 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ХРОНИЧЕСКИМ АЛКОГОЛИЗМОМ И СПОСОБ ИХ ЛЕЧЕНИЯ | 1999 |
|
RU2147880C1 |
| ИМПЛАНТИРУЕМОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ ДИСУЛЬФИРАМА ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ, ЗАВИСИМЫХ ОТ АЛКОГОЛЯ ИЛИ ОПИАТОВ | 2012 |
|
RU2475272C1 |
| ГЛАЗНОЙ ИМПЛАНТАТ, ИЗГОТАВЛИВАЕМЫЙ СПОСОБОМ ДВОЙНОЙ ЭКСТРУЗИИ | 2005 |
|
RU2389479C2 |
| СОСТАВЫ, СОДЕРЖАЩИЕ КЛОНИДИН В РАЗЛАГАЕМОМ ПОЛИМЕРЕ | 2009 |
|
RU2494731C2 |
| ПОЛИМЕРНЫЕ КОМПОЗИЦИИ ДЛЯ ДОСТАВКИ ЛЕЙПРОЛИДА С УЛУЧШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2001 |
|
RU2271826C2 |
Изобретение относится к медитцине. Описаны имплантируемые таблетки налтрексона и способ стерилизации имплантируемых таблеток налтрексона. Имплантируемая таблетка включает налтрексон в количестве 500-2000 мг, размещенный в полости, образованной сформованным биоразлагаемым полимером на основе DL-лактидов и/или DL-глюколидов с добавлением фармацевтического полимера Eudragit и смазочного материала для обеспечения контролируемого высвобождения активного вещества в течение 3 месяцев и более. Смазочный материал состоит из стеариновой кислоты или глицерил моностеарата для предотвращения раздражения ткани и воспаления в месте имплантации. Получают имплантируемые таблетки налтрексона, лишенные магния стеарата и триамцинолона, с тем, чтобы сократить не только метаболическую нагрузку на печень, но и снизить токсичность и канцерогенность. 2 н. и 5 з.п. ф-лы, 2 табл., 6 пр.
1. Имплантируемое лекарственное средство для лечения пациентов от алкогольной зависимости, включающее налтрексон в качестве активного вещества и покрытие из биоразлагаемого высокомолекулярного полимера для доставки лекарственных средств, отличающееся тем, что содержит налтрексон в количестве 500-2000 мг, размещенный в полости, образованной сформованным биоразлагаемым полимером на основе DL-лактидов и/или DL-глюколидов с добавлением фармацевтического полимера Eudragit и смазочного материала для обеспечения контролируемого высвобождения активного вещества в течение 3 мес и более.
2. Имплантируемое лекарственное средство по п. 1, отличающееся тем, что смазочный материал состоит из стеариновой кислоты или глицерил моностеарата для предотвращения раздражения ткани и воспаления в месте имплантации.
3. Имплантируемое лекарственное средство по п. 1, отличающееся тем, что содержит 765 мг налтрексона.
4. Имплантируемое лекарственное средство по п. 3, выполненное в виде одной таблетки или двух таблеток одинаковой силы с общим содержанием налтрексона 765 мг.
5. Имплантируемое лекарственное средство по п. 1, отличающееся тем, что содержит 903 мг налтрексона.
6. Имплантируемое лекарственное средство по п. 5, выполненное в виде одной таблетки или двух таблеток одинаковой силы с общим содержанием налтрексона 903 мг.
7. Способ стерилизации имплантируемого лекарственного средства по любому из пп. 1-6, включающий воздействие на него гамма-облучением интенсивностью 8-12 кГр.
| CN 102512399 A, 27.06.2012 | |||
| ГЕМИГИДРАТ ОСНОВАНИЯ НАЛТРЕКСОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ИЗГОТОВЛЕНИЯ МИКРОСФЕР | 2012 |
|
RU2505542C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ | 2007 |
|
RU2445077C2 |
| ЛЕКАРСТВЕННОЕ СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ С ОПИЙНОЙ НАРКОМАНИЕЙ И СПОСОБ ИХ ЛЕЧЕНИЯ | 1999 |
|
RU2147879C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРИГОТОВЛЕНИЯ ОБЛАДАЮЩЕЙ ПРОЛОНГИРОВАННЫМ ДЕЙСТВИЕМ ЛЕКАРСТВЕННОЙ ФОРМЫ | 2012 |
|
RU2519723C1 |
| ИМПЛАНТИРУЕМОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ОСНОВЕ НАЛТРЕКСОНА ДЛЯ ЛЕЧЕНИЯ ПАЦИЕНТОВ, ЗАВИСИМЫХ ОТ АЛКОГОЛЯ ИЛИ ОПИАТОВ | 2012 |
|
RU2476209C1 |
Авторы
Даты
2017-05-24—Публикация
2016-01-20—Подача