СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к способу подавления резистентности по отношению к лечению ингибиторами BRAF.
УРОВЕНЬ ТЕХНИКИ
Участие киназ в пролиферативных заболеваниях хорошо известно. Например, киназы, связанные с онкогенезом, включают рецепторные тирозинкиназы и серин/треонинкиназу, Raf киназу. Эти киназы играют критически важные роли в путях передачи сигналов, которые влияют на многие функции клеток, такие как пролиферация, дифференциация и жизнеспособность, и регулируют их.
Разработка средств лечения пролиферативных заболеваний остается важной задачей. Постоянно необходимы улучшенные способы лечения, в особенности с учетом многочисленных различий характеристик раковых клеток, таких как механизмы роста и выживания, их ответ на терапевтические средства и их способность мутировать и приобретать устойчивость или резистентность по отношению к таким средствам.
Киназа Raf является частью пути передачи сигналов активированной митогеном протеинкиназы (MAPK), включающего сигнальные молекулы Ras-Raf-MEK1-ERK. Raf обладает тремя различными изоформами, A-Raf, B-Raf и C-Raf, которые различаются по своей способности взаимодействовать с расположенным в обратном направлении модулятором Ras. Активирующую мутацию одного из генов Ras можно наблюдать примерно в 20% всех опухолей, и путь Ras/Raf/MEK/ERK активирован примерно в 30% всех опухолей (Bos et al., Cancer Res. 49: 4682-4689, 1989; Hoshino et al., Oncogene 18:813-822, 1999). Активирующая мутация в киназном домене B-Raf происходит примерно в 66% меланом, 12% карцином толстой кишки и 14% рака печени (Davies et al., Nature 417: 949-954, 2002; Yuen et al., Cancer Research 62: 6451-6455, 2002; Brose et al., Cancer Research 62: 6997-7000, 2002).
Малые молекулы - ингибиторы RAF, такие как вемурафениб, подтвердили предположение о том, что BRAFV600E является ключевым движущим фактором пролиферации меланомы и выживания при ее наличии, о чем свидетельствует регрессия опухолей и увеличенная продолжительность жизни пациентов на последней фазе клинических исследований. К сожалению, ответ опухоли может быть кратковременным, если быстро развивается резистентность по отношению к ингибитору RAF.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
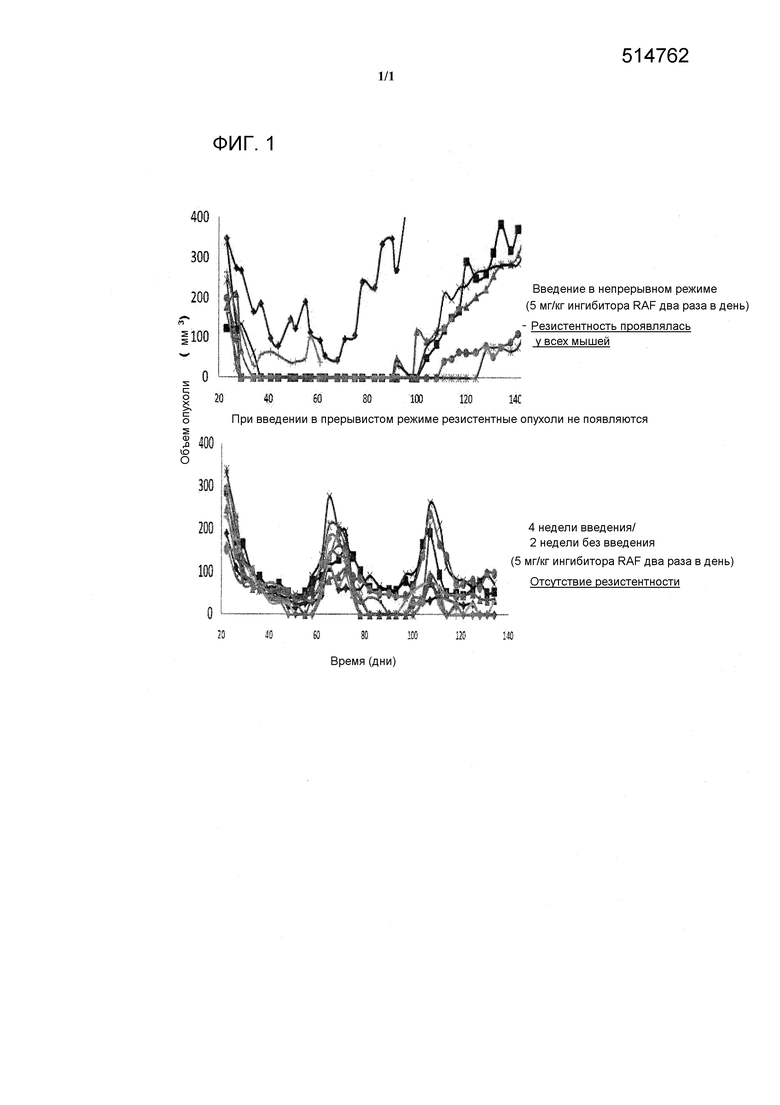
На фиг. 1 проведено сопоставление введения ингибитора BRAF формулы II в непрерывном и в прерывистом режиме и показано, что без учета преимущества роста резистентных клеток введение в прерывистом режиме задерживает или предупреждает начало проявления резистентности по отношению к ингибитору BRAF.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение основано на обнаружении того, что резистентные по отношению к Raf киназе опухолевые клетки являются менее чувствительными, чем опухолевые клетки, которые чувствительны к ингибитору киназы Raf, и обладают селективным недостатком по сравнению с чувствительными клетками при отсутствии ингибитора киназы Raf. Таким образом, в соответствии с настоящим изобретением резистентность по отношению к лечению ингибитором киназы Raf подавляют путем введения ингибитора киназы Raf в прерывистом режиме.
Подавление резистентности по отношению к лечению означает задержку или предупреждение начала проявления резистентности по отношению к лечению ингибитором киназы Raf.
В настоящей заявке введение в прерывистом режиме означает, что ингибитор киназы B-Raf вводят в течение некоторого периода времени, за которым следует период времени, в течение которого лечение ингибитором киназы B-Raf прекращают. Например, ингибитор киназы Raf вводят ежедневно в течение 4 недель, за которым следуют 2 недели без лечения, и этот цикл повторяют, пока пациента лечат ингибитором киназы Raf.
Ингибиторы BRAF и их применение для лечения пролиферативных заболеваний известны в данной области техники.
Вемурафениб (PLX4032) является ингибитором BRAF, который утвержден FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) для лечения пациентов, страдающих меланомой, опухоли которых экспрессируют мутацию BRAF V600E. Вемурафениб обладает следующей химической структурой:
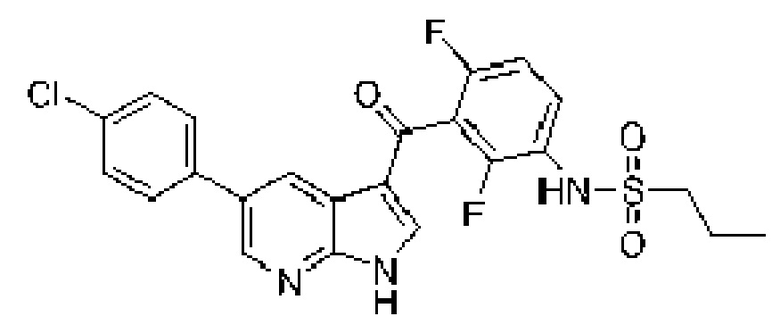
Другим классом соединений, которые ингибируют некоторые киназы на пути MAPK, являются простые эфиры бензимидазолилпиридила. В патенте US 7482367, который во всей своей полноте включен в настоящее изобретение в качестве ссылки, раскрыт ингибитор киназы B-RAF формулы I.
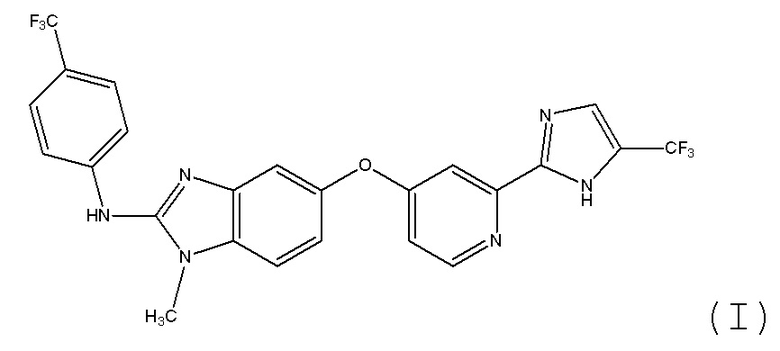 .
.
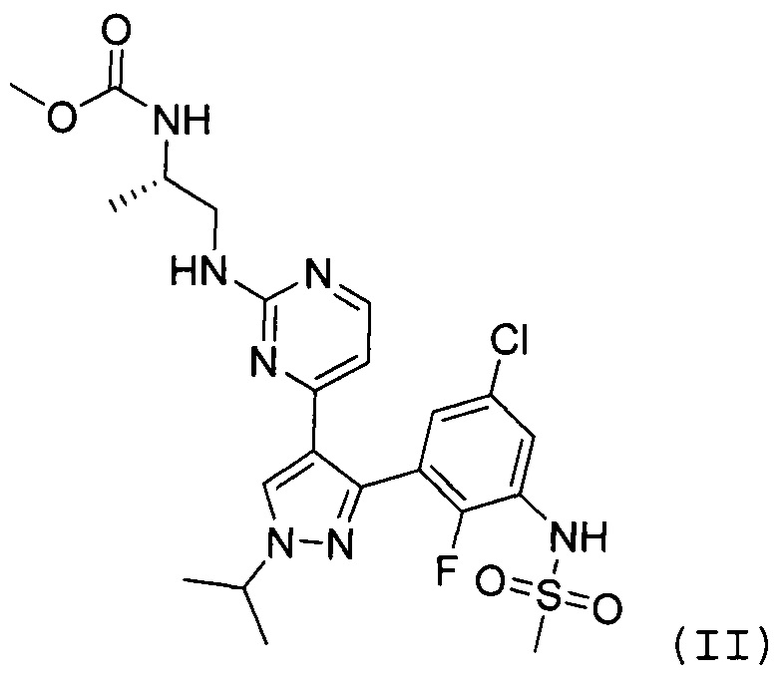
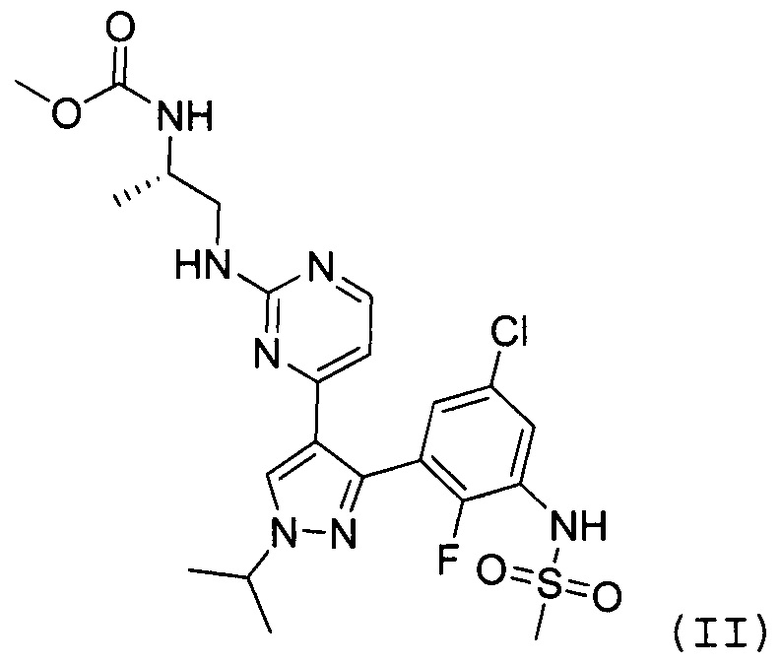
Другим классом соединений, которые ингибируют некоторые киназы на пути MAPK, являются пиразолопиримидины. В WO 2011/025927, которая во всей своей полноте включена в настоящее изобретение в качестве ссылки, раскрыто соединение формулы II как ингибитор киназы BRAF, в частности, с мутацией BRAFV600E:
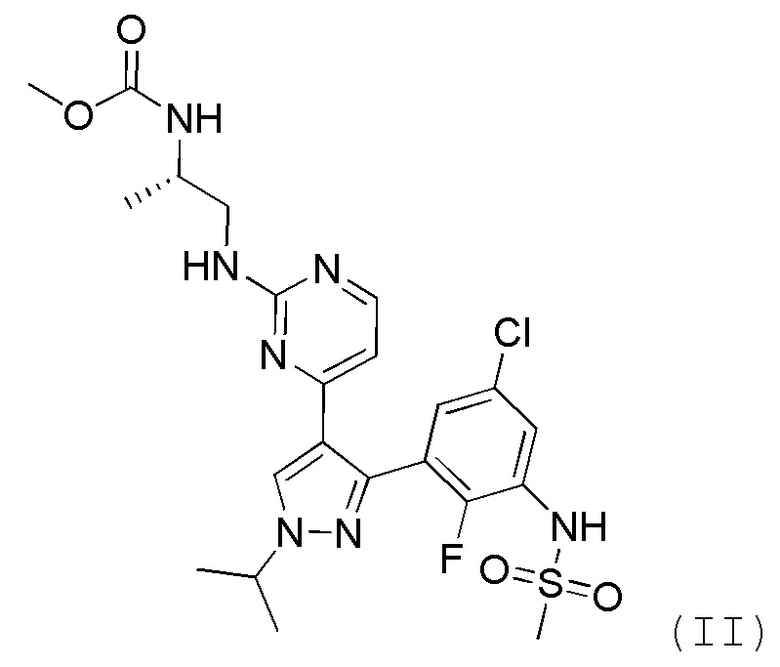 .
.
В способе, предлагаемом в настоящем изобретении, ингибитором BRAF предпочтительно является соединение формулы II.
В раннем пассаже модели ксеротрансплантата первичной меланомы человека, разработанной для изучения появления резистентности по отношению к ингибитору BRAF, авторы настоящего изобретения установили, что лечение ксенотрансплантатов ингибитором BRAF в режиме длительного непрерывного введения клинически требующихся доз в течение от 4 до 6 недель приводило к появлению резистентных опухолей. Фармакодинамический (ФД) анализ отдельных опухолей показал, что путь RAF-MEK-ERK все же подавлен в резистентных опухолях, хотя степень и длительность подавления меньше, чем в чувствительных опухолях. Кроме того, кинетики пути ингибирования и восстановления для разных резистентных опухолей являются разными. Биохимические анализы показывают, что серин/треонинкиназы и модулирование отрицательных контуров обратной связи к серин/треонинкиназам могут участвовать в резистентности, а также повышающей регуляции экспрессии BRAFV600E. Фармакологическое исследование ответа опухоли дало информацию о популяциях опухолевых клеток и эволюции резистентности. Увеличение дозы лекарственного средства, вводимого мышам, у которых имеются резистентные опухоли, приводит к значительному, но временному ответу опухоли с последующим прогрессированием опухоли. С учетом данных ФД разумно заключить, что существует значительная гетерогенность опухолевых клеток и что опухоли способны быстро адаптироваться по отношению к селективному воздействию, оказываемому путем введения лекарственного средства. Дополнительное свидетельство в пользу такого заключения получено при прекращении лечения лекарственным средством мышей, которым имплантировали резистентные опухоли. После отмены лекарственного средства сначала происходила регрессия опухолей в течение от нескольких дней до недель, затем возобновлялся рост. Эти данные показывают, что адаптация, которая происходит в популяции опухолевых клеток при селективном воздействии, делает клетки менее чувствительными при отсутствии лекарственного средства.
Все резистентные опухоли обладают более значительными содержаниями p-ERK в присутствии соединения-ингибитора BRAF, чем чувствительные опухоли, и обладают более значительными скоростями восстановления после введения дозы. Кинетики восстановления для разных резистентных опухолей являются разными. Рост резистентных к BRAF опухолей зависит от наличия лекарственного средства, и отмена лекарственного средства приводит к регрессии опухолей. Резистентные клетки менее чувствительны, чем чувствительные клетки, при отсутствии соединения. В настоящем изобретении этот факт используется для подавления резистентности по отношению к лечению ингибитором BRAF путем введения ингибитора BRAF в прерывистом режиме.
Таким образом, настоящее изобретение включает способ лечения пролиферативного заболевания, который включает подавление резистентности к лечению с помощью ингибитора BRAF путем введения ингибитора BRAF киназы в прерывистом режиме.
В частности, настоящее изобретение включает способ лечения пролиферативного заболевания, характеризующегося мутацией BRAF киназы, который включает подавление резистентности к лечению с помощью ингибитора BRAF формулы II
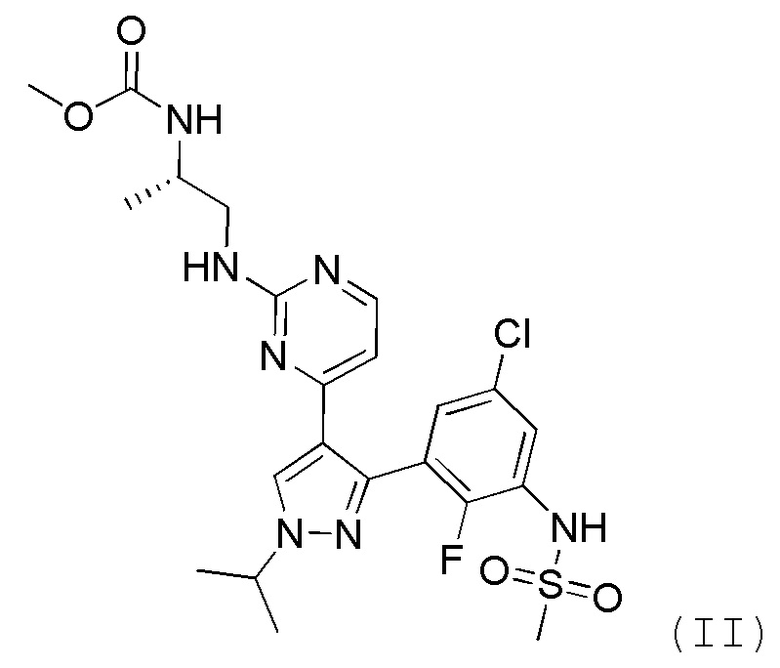
путем введения ингибитора BRAF формулы II в прерывистом режиме.
В предпочтительном варианте осуществления настоящее изобретение также относится к способу лечения пролиферативного заболевания, характеризующегося мутацией BRAF киназы, который включает подавление резистентности к лечению с помощью ингибитора BRAF путем введения ингибитора BRAF в прерывистом режиме.
Этот объект настоящего изобретения также относится к способу, в котором мутацией BRAF является мутация V600, такая как BRAFV600E.
Пролиферативные заболевания, которые лечат способом, предлагаемым в настоящем изобретении, включают рак, такой как, но не ограничиваясь только ими, рак мочевого пузыря, молочной железы, головного мозга, головы и шеи, печени, желчных путей, карциномы, острые и хронические лимфолейкозы, острые и хронические миелолейкозы, хронические миеломоноцитарные лейкозы, колоректальный желудка, желудочно-кишечный, стромальный, глиому, лимфомы, меланомы, множественную миелому, миелодиспластический синдром, нейроэндокринный, легких, поджелудочной железы, яичников, предстательной железы, почечно-клеточный, саркомы и щитовидной железы, такой как папиллярный рак щитовидной железы. Другие пролиферативные заболевания включают тучноклеточный лейкоз, герминомы, мелкоклеточную карциному легких, желудочно-кишечные стромальные опухоли, нейробластому и остеосаркому.
Более предпочтительно, если пролиферативным заболеванием, которое лечат способом, предлагаемым в настоящем изобретении, является меланома, которая характеризуется мутацией V600, такой как BRAFV600E, или колоректальный рак, характеризующийся мутацией V600, такой как BRAFV600E.
В важном объекте введение в прерывистом режиме включает введение ингибитора BRAF в течение 4 недель с последующим периодом в 2 недели без лечения и повторение цикла, когда пациента лечат ингибитором BRAF или до проявления резистентности. Однако дополнительное введение в прерывистом режиме включает, например, циклы, включающие 1 неделю лечения и 1 неделю без лечения, 2 недели лечения и 1 или 2 недели без лечения, 3 недели лечения и 1, 2 или 3 недели без лечения, 4 недели лечения и 1, 2, 3 или 4 недели без лечения, предпочтительно 4 недели лечения и 1 неделю без лечения или 4 недели лечения и 2 недели без лечения, 5 недель лечения и 1, 2 3, 4 или 5 недель без лечения, 6 недель лечения и 1, 2, 3, 4, 5 или 6 недель без лечения и т. д.
Настоящее изобретение также включает применение ингибитора BRAF для приготовления лекарственного средства, предназначенного для лечения пролиферативного заболевания, при котором ингибитор BRAF вводят в прерывистом режиме. Предпочтительно применение ингибитора BRAF формулы II для приготовления лекарственного средства, предназначенного для лечения пролиферативного заболевания, при котором ингибитор BRAF формулы II вводят в прерывистом режиме.
Приведенный ниже пример иллюстрирует настоящее изобретение.
Пример 1
Опухоли первичной меланомы человека Hmex1906 с помощью 3 пассажей имплантировали голым мышам. За мышами следили, пока объем имплантированных опухолей не достигал 200-400 мм3. После достижения этого объема мышам два раза в день вводили 5 мг/кг ингибитора Raf (соединение формулы II) в течение 4 недель. Часть мышей лечили в непрерывном режиме, а других лечили в прерывистом режиме, включающем 4 недели лечения и 2 недели без введения лекарственного средства.
Результаты приведены на фиг. 1. Резистентность проявлялась у всех мышей, получавших соединение формулы II в непрерывном режиме, однако у мышей, которым введение проводили в прерывистом режиме, резистентность не проявлялась.
Группа изобретений относится к медицине, а именно к онкологии, и может быть использована для лечения пролиферативного заболевания, характеризующегося мутацией BRAF киназы. Для этого вводят ингибитор BRAF формулы II

в прерывистом режиме, включающем введение ингибитора BRAF в течение 1, 2, 3, 4, 5 или 6 недель с последующим периодом в 1, 2, 3, 4, 5 или 6 недель без лечения. Также предложено применение ингибитора BRAF формулы II для изготовления лекарственного средства для лечения пролиферативного заболевания. Группа изобретений обеспечивает повышение эффективности лечения за счет задерживания или предупреждения начала проявления резистентности по отношению к ингибитору BRAF. 2 н. и 5 з.п. ф-лы, 1 ил., 1 пр.
1. Способ лечения пролиферативного заболевания, характеризующегося мутацией BRAF киназы, который включает подавление резистентности к лечению с помощью ингибитора BRAF формулы II
путем введения ингибитора BRAF формулы II в прерывистом режиме, где прерывистый режим включает введение ингибитора BRAF в течение 1, 2, 3, 4, 5 или 6 недель с последующим периодом в 1, 2, 3, 4, 5 или 6 недель без лечения.
2. Способ по п. 1, в котором мутацией BRAF является мутация V600.
3. Способ по п. 1, в котором пролиферативным заболеванием является меланома, которая характеризуется мутацией V600, или колоректальный рак, характеризующийся мутацией V600.
4. Способ по п. 1, в котором пролиферативным заболеванием является меланома, которая характеризуется мутацией BRAFV600E, или колоректальный рак, характеризующийся мутацией BRAFV600E.
5. Способ по п. 1, где прерывистый режим включает введение ингибитора BRAF в течение 4 недель с последующим периодом в 2 недели без лечения и повторение цикла, когда пациента лечат ингибитором BRAF или до появления резистентности.
6. Способ по п. 1, где прерывистый режим усиливает терапевтическое воздействие на опухолевые клетки, уже резистентные к лечению ингибитором киназы BRAF формулы II.
7. Применение ингибитора BRAF формулы II
для приготовления лекарственного средства, предназначенного для лечения пролиферативного заболевания, при котором ингибитор BRAF вводят в прерывистом режиме, где прерывистый режим включает введение ингибитора BRAF в течение 1, 2, 3, 4, 5 или 6 недель с последующим периодом в 1, 2, 3, 4, 5 или 6 недель без лечения.
| WO 2011025927 A1, 03.03.2011 | |||
| КЛЕТОЧНАЯ ЛИНИЯ МЕЛАНОМЫ ЧЕЛОВЕКА mel Rac, ИСПОЛЬЗУЕМАЯ ДЛЯ ПОЛУЧЕНИЯ ПРОТИВООПУХОЛЕВЫХ ВАКЦИН | 2009 |
|
RU2402602C1 |
| ЧИССОВ В.И | |||
| и др | |||
| "Онкология | |||
| Национальное руководство"//М., ГЭОТАР-Медиа, с.848-862 | |||
| PIZZOLATO N | |||
| et al | |||
| Stochastic dynamics of leukemic cells under an intermittent targeted therapy// Theory Biosci | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| TOMASETTI C | |||
| et al | |||
| An elementary approach to modeling drug resistance in cancer// Math Biosci Eng | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
Авторы
Даты
2017-06-08—Публикация
2012-11-09—Подача