Изобретение относится к биотехнологии, в частности к генной и белковой инженерии, и представляет собой способ получения рекомбинантного антиангиогенного пептида Тумастина, представляющего собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N-концу последовательностью Ser-Gly-Ala-Met-Gly и к С-концу последовательностью Pro-Gly-Pro. Проявляемые им антиангиогенные свойства определяют возможность его использования в качестве препарата для терапии заболеваний, ассоциированных с офтальмоангиопатиями.
Ангиогенез - процесс образования новых кровеносных сосудов в органе или ткани (Battegay E.J. J. Mol. Med. 1995. V. 73. №7. 333-346). Различают 2 вида ангиогенеза: физиологический и патологический. Физиологический ангиогенез является неотъемлемой частью физиологических и репаративных процессов. Патологический ангиогенез развивается как при избытке его стимуляторов и/или дефиците ингибиторов, так и при дефиците стимуляторов и/или избытке ингибиторов (Gao G., Ma J. Drug Discov. Today. 2002. V. 7. №3. 171-172). Неоангиогенез (неоваскуляризация) имеет место при ряде заболеваний глаз, таких как: диабетическая ретинопатия, возрастная макулярная дегенерация (ВМД), тромбоз центральной вены сетчатки, неоваскулярная глаукома, опухоли хориоидеи и сетчатки.
Сложный механизм ангиогенеза предоставляет много возможностей для терапевтического вмешательства. Основной мишенью антиангиогенной терапии является проангиогенный сосудистый эндотелиальный фактор роста (VEGF). Однако развитие неоангиогенеза зависит от множества других проангиогенных белков и их функций.
Тумстатин (28 кДа) - NC1 домен цепи α3 коллагена IV типа, встречающейся в гломерулярных и альвеолярных базальных мембранах, а также в базальных мембранах передней капсулы хрусталика, внутреннего уха и некоторых других органов (Hudson B.G., Reeders S.T., Tryggvason К.J. Biol. Chem. 1993. V. 268. №35. P. 26033-26036). Тумстатин высвобождается из базальной мембраны в результате гидролиза коллагена IV под воздействием металлопротеиназы ММР-9. Исследования на мышах с инактивированным геном цепи α3ColIV показали, что отсутствие тумстатина в крови не влияет на эмбриональное развитие, физиологический ангиогенез и репаративные процессы, однако приводит к ускоренному росту опухолей в результате усиленной патологической неоваскуляризации (Hamano Y., Zeisberg M., Sugimoto H., Lively J.C., Maeshima Y., Yang C., Hynes R.O., Werb Z., Sudhakar A., Kalluri R. Cancer Cell. 2003. V. 3. №6. P. 589-601).
Тумстатин ингибирует пролиферацию эндотелиальных клеток, стимулированных bFGF (основной фактор роста фибробластов) и VEGF (сосудистый эндотелиальный фактор роста), задерживая их деление на стадии G1 (Maeshima Y., Colorado P.С., Torre A., Holthaus K.A., Grunkemeyer J.A., Ericksen M.B., Hopfer H., Xiao Y., Stillman I.E., Kalluri R. J. Biol. Chem. 2000. V. 275. №28. P. 21340-21348; Maeshima Y., Manfredi M., Reimer C., Holthaus K.A., Hopfer H., Chandamuri B.R., Kharbanda S., Kalluri R. J. Biol. Chem. 2001. V. 276. №18. P. 15240-15248). Тумстатин индуцирует апоптоз пролиферирующих эндотелиальных клеток, активируя каспазу-3 (Maeshima Y., Yerramalla U.L., Dhanabal М., Holthaus K.А., Barbashov S., Kharbanda S., Reimer C., Manfredi M., Dickerson W.M., Kalluri R. J. Biol. Chem. 2001. V. 276. №34. 31959-31968). Действие тумстатина опосредовано через связывание с интегрином αVβ3 на поверхности эндотелиальных клеток, что приводит к ингибированию белкового синтеза (Maeshima Y., Colorado Р.С., Kalluri R. J. Biol. Chem. 2000. V. 275. №31. P. 23745-23750).
Недавно была исследована антиангиогенная активность рекомбинантного тумстатина, полученного в бакуловирусной экспрессионной системе, на модели неоваскуляризации роговицы мыши. Был выявлен значимый антиангиогенный эффект тумстатина и отмечено снижение экспрессии VEGF у экспериментальных животных (Gunda V., Wang S., Sheibani N., Sudhakar, A. J. Clinic. Experiment. Ophthalmol. 2011. V. 2. P. 132). Однако высокий молекулярный вес, потенциальная иммуногенность и низкая растворимость являются существенными ограничивающими его клинические исследования факторами.
Было показано, что антиангиогенная активность тумстатина локализована во фрагменте Tum5 (а.о. 54-132) (Maeshima Y., et al. J. Biol. Chem. 2001. V. 276. №18. P. 15240-15248). Этот фрагмент, взаимодействуя с интегрином αVβ3 активирует FAK-PI3-PKB/Akt-mTOR сигнальный каскад и предотвращает диссоциацию фактора инициации трансляции 4Е от 4Е-связывающего белка, в результате чего происходит подавление Сар-зависимой трансляции в эндотелиальных клетках (Maeshima Y., Sudhakar A., Lively J.С., Ueki K., Kharbanda S., Kahn C.R., Sonenberg N., Hynes R.O., Kalluri R. Science. 2002. V. 295. №5552. P. 140-143). Путем сравнения гомологичных последовательностей тумстатина и NCl домена цепи α5 ColIV, не обладающего антиангиогенными свойствами, позволило выявить аминокислоты, ответственные за антиангиогенную активность тумстатина: Leu78, Val82 и Asp84 (Petitclerc Е., Boutaud A., Prestayko A., Xu J., Sado Y., Ninomiya Y., Sarras M.P. Jr, Hudson B.G., Brooks P.C. J. Biol. Chem. 2000. V. 275. №11. P. 8051-8061). Была исследована способность различных фрагментов пептида Tum-5 к ингибированию пролиферации эндотелиальных клеток и выявлен короткий биологически активный участок Tum-7 [74-98] (Maeshima Y., et al. J. Biol. Chem. 2001. V. 276. №34. 31959-31968). В связи с его высокой гидрофобностью и, как следствие, низкой растворимостью была исследована активность фрагмента [69-95] с N-концевой заменой Leu на Lys с большей растворимостью. Данный пептид обладал сопоставимым с фрагментом Tum-7 антиангиогенным эффектом на эндотелиальные клетки.
Первым описанным способом получения фрагментов тумстатина человека с антиангиогенной активностью является твердофазный синтез (Maeshima Y., et al. J. Biol. Chem. 2001. V. 276. №34. 31959-31968). Патент CN 101519658 описывает получение рекомбинантных фрагментов Tum-7 [74-98] тумстатина человека и его модифицированной формы T7-NGR с N-концевой аффинной меткой (CN 101519658, А Institute of Radiation Medicine, Chinese Academy of Medical Sciences, 02.09.2009).
Изобретение решает задачу получения высокопродуктивного бактериального штамма-продуцента, позволяющего получать с высоким выходом рекомбинантный антиангиогенный пептид Тумастин (TMS), представляющий собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно.
Поставленная задача решается за счет того, что:
1. Путем трансформации клеток штамма Escherichia coli BL21(DE3) плазмидной ДНК pTEV-TMS, содержащей гибридный ген, состоящий из слитых в рамке нуклеотидных последовательностей тиоредоксина, специфического сайта для расщепления TEV-протеиназой (Glu-Asn-Leu-Tyr-Phe-Gln, ENLYFQ) и антиангиогенного пептида Тумастина, представляющего собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно, получают штамм-продуцент гибридного белка TrxTEVrs-TMS, состоящего из разделенных сайтом для расщепления протеиназой вируса гравировки табака (TEV-протеиназой) тиоредоксина и антиангиогенного пептида TMS и накапливающегося в растворимой форме во время культивирования.
2. После разрушения клеточной биомассы в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз осветленный клеточный лизат, содержащий гибридный белок TrxTEVrs-TMS, отделяют от клеточного дебриса центрифугированием, разбавляют тем же буфером и наносят при рН 8.0 на колонну с анионообменным сорбентом. Проводят элюцию гибридного белка при рН 8.0 в линейном градиенте от 0 до 500 мМ NaCl.
Протеолитическое расщепление рекомбинантной TEV-протеиназой проводят в течение не менее 20 часов при комнатной температуре при рН 8.0-8.5 в присутствии дитиотреитола при соотношении фермент : белок от 1:50 до 1:100 (Esipov RS, Stepanenko VN, Beyrakhova KA, Muravjeva TI, Miroshnikov AI. Biotechnol Appl Biochem. 2010 V. 19. №5689) P. 17-25). Полученный белковый раствор наносят при рН 9.0 на колонну с анионообменным сорбентом. Элюат, полученный во время нанесения, титруют до рН 11 и наносят на колонну с тем же анионообменным сорбентом. Элюцию целевого пептида TMS проводят в изократическом градиенте 150 мМ NaCl при рН 10.0. Дальнейшую очистку целевого продукта проводят с помощью обращенно-фазовой высокоэффективной жидкостной и гель-фильтрационной хроматографий. Идентичность полученного пептида TMS подтверждают с помощью масс-спектрометрии.
Технический результат
Техническим результатом изобретения является получение в результате протеолитического расщепления гибридного белка антиангиогенного пептида Тумастина, представляющего собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно.
Антиангиогенный пептид TMS (SEQ ID NO 1, 2) получают на С-конце гибридного белка, содержащего N-концевой тиоредоксин и сайт для расщепления протеазой вируса гравировки табака (TEV протеазой, ЕС 3.4.22.4). С этой целью в штамм Е. coli BL21(DE3) (New England Biolabs, www.neb.com/products/c2527-bl21de3-competent-e-coli) трансформируют рекомбинантный плазмидный вектор pTEV-TMS, содержащий гибридный ген, состоящий из слитых в рамке нуклеотидных последовательностей тиоредоксина, специфического сайта для расщепления TEV-протеиназой (Glu-Asn-Leu-Tyr-Phe-Gln, ENLYFQ) и антиангиогенного пептида Тумастина. Полученный штамм Е. coli BL21(DE3)/pTEV-TMS является продуцентом гибридного белка, состоящего из разделенных сайтом для расщепления TEV-протеиназой тиоредоксина и антиангиогенного пептида TMS. Выделение антиангиогенного пептида TMS, представляющего собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно, включает выделение и протеолитическое расщепление гибридного белка и последующую хроматографическую очистку целевого продукта.
В предлагаемом техническом решении используют штамм Е. coli BL21(DE3)/pTEV-TMS, являющийся продуцентом гибридного белка TrxTEVrs-TMS, состоящего из разделенных сайтом для расщепления TEV-протеиназой тиоредоксина и антиангиогенного пептида TMS, представляющего собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно.
Штамм Е. coli BL21(DE3)/pTEV-TMS, продуцирующий гибридный полипептид TrxTEVrs-TMS, состоящий из разделенных сайтом для расщепления TEV-протеиназой тиоредоксина и антиангиогенного пептида TMS, получают путем трансформации клеток штамма Е. coli BL21(DE3) рекомбинантной плазмидной ДНК pTEV-TMS. Данная плазмида содержит гибридный ген TrxTEVrs-TMS, состоящий из слитых в рамке последовательностей тиоредоксина, сайта для расщепления TEV-протеиназой и антиангиогенного пептида TMS.
Предлагаемый штамм-продуцент Е. coli BL21(DE3)/pTEV-TMS характеризуется следующими признаками:
Морфологические признаки.
Клетки палочковидной формы, грамотрицательные, неспороносные.
Культуральные признаки.
Клетки хорошо растут на простых питательных средах. При росте на агаре "Дифко" - колонии круглые, гладкие, мутные, блестящие серые, край ровный. При росте на жидких средах (на минимальной среде с глюкозой или среде Лурье-Бертрана) образуют интенсивную ровную муть.
Физико-биологические признаки.
Клетки растут при температуре от 4°С до 40°С при оптимуме рН от 6,8 до 7,5. В качестве источника азота используют как минеральные соли в аммонийной форме, так и органические соединения в виде пептона, триптона, дрожжевого экстракта, аминокислот и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам.
Клетки проявляют устойчивость к пенициллиновым антибиотикам (до 500 мкг/мл).
Штамм-продуцент Е. coli BL21(DE3)/pTEV-TMS отличается от штамма-реципиента Е. coli BL21(DE3) наличием рекомбинантной плазмидной ДНК pTEV-TMS, которая и придает ему устойчивость к пенициллиновым антибиотикам.
Генетические особенности штамма.
Генотип штамма - F-ompT gal dcm lon hsdSB(rB-mB-) λ(DE3[lacI lacUV5-T7 gene 1 ind1 sam7 nin5]).
Осуществление изобретения
Плазмидный вектор pTEV-TMS получают следующим образом.
Штамм-продуцент получают путем трансформации компетентных клеток Е. coli BL21(DE3) рекомбинантной плазмидной ДНК pTEV-TMS. Созданный штамм Е. coli BL21(DE3)/pTEV-TMS является суперпродуцентом гибридного белка TrxTEVrs-TMS, который накапливается в клетках в растворимой форме.
Культивирование штамма-продуцента проводят в богатой культуральной среде (среда Лурье-Бертрана) при 37°С. Индукцию белкового биосинтеза вызывают путем добавления в культуральную среду индуктора изопропилтио-β-D-галактозида (ИПТГ). Выращивание проводят до достижения наибольшего содержания гибридного белка относительного суммарного белка клетки (4 часа при 37°С после внесения ИПТГ).
Выделение антиангионного пептида TMS осуществляют в несколько этапов.
После разрушения клеточной биомассы в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз осветленный клеточный лизат, содержащий гибридный белок TrxTEVrs-TMS, отделяют от клеточного дебриса центрифугированием, разбавляют тем же буфером и наносят при рН 8.0 на колонну с анионообменным сорбентом. Проводят элюцию гибридного белка при рН 8.0 в линейном градиенте от 0 до 500 мМ NaCl.
Протеолитическое расщепление рекомбинантной TEV-протеиназой проводят в течение 20 часов при комнатной температуре при рН 8.0 в присутствии дитиотреитола при соотношении фермент : белок от 1:50 до 1:100.
Полученный белковый раствор наносят при рН 9.0 на колонну с анионообменным сорбентом. Элюат, полученный во время нанесения, титруют до рН 11 и наносят на колонну с тем же анионообменным сорбентом. Во время элюции при рН 10, изократическим градиентом 150 мМ NaCl собирают фракцию, содержащую пептид TMS. Дальнейшую очистку целевого продукта проводят с помощью обращенно-фазовой высокоэффективной жидкостной и гель-фильтрационной хроматографий. Идентичность полученного пептида TMS подтверждают с помощью масс-спектрометрии.
Перечень последовательностей, представленных в описании изобретения.
На SEQ ID NO 1 приведена аминокислотная последовательность рекомбинантного антиангиогенного пептида TMS.
На SEQ ID NO 2 приведена нуклеотидная последовательность гена, содержащего кодирующую антиангиогенный пептид TMS последовательность.
На SEQ ID NO 3 приведена нуклеотидная последовательность гибридного гена TrxTEVrs-TMS и аминокислотная последовательность кодируемого им гибридного белка TrxTEVrs-TMS.
На SEQ ID NO 4 приведена аминокислотная последовательность гибридного белка TrxTEVrs-TMS.
Краткое описание фигур
Изобретение иллюстрируют следующие графические материалы.
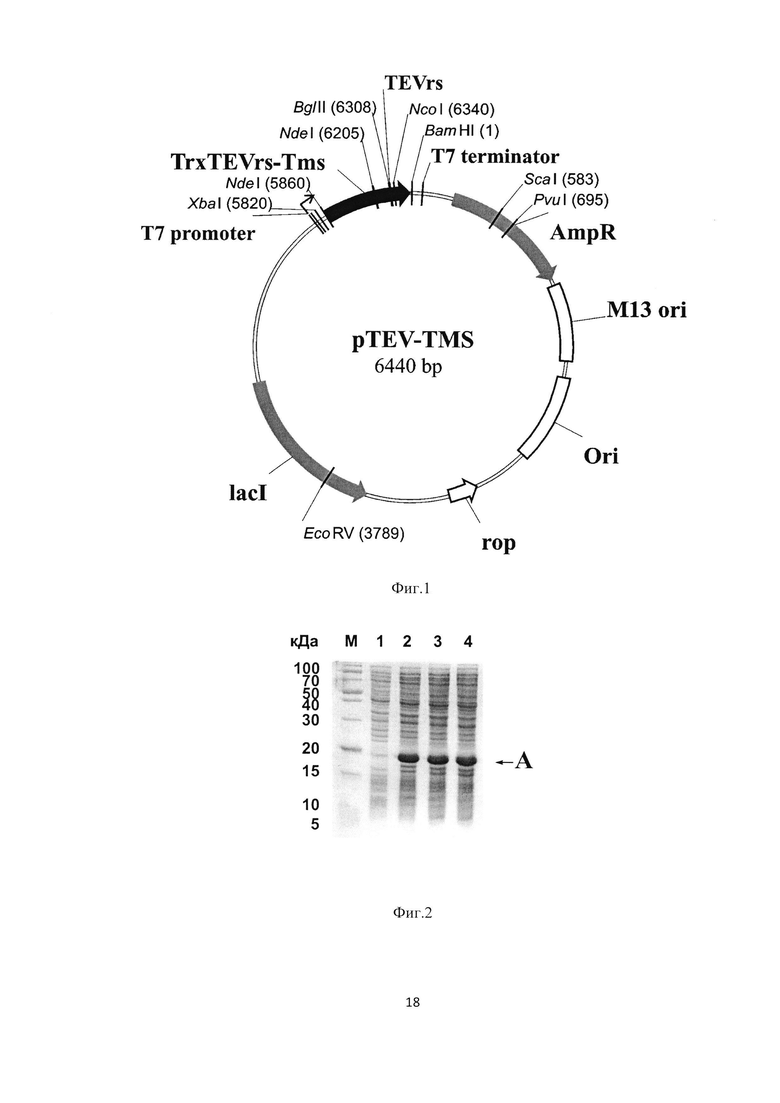
На Фиг. 1 показана физическая карта рекомбинантной плазмиды pTEV-TMS. Указаны уникальные сайты эндокуклеаз рестрикции. Ori - участок инициации репликации плазмидного вектора, М13 ori - участок инициации репликации фага М13, AmpR - ген устойчивости к ампициллину, lacI - ген репрессора лактозного оперона, Rop - ген РНК-организующего белка, TrxTEVrs-TMS - ген гибридного белка TrxTEVrs-TMS, состоящего из разделенных сайтом для расщепления TEV-протеиназой тиоредоксина и антиангиогенного пептида TMS.
На Фиг. 2 представлена электрофореграмма накопления гибридного белка TrxTEVrs-TMS в ходе выращивания клеточной культуры штамма-продуцента Е. coli BL21(DE3)/pTEV-TMS. M - стандарт молекулярных масс; 1 - тотальный клеточный лизат после 2 часов выращивания после внесения ИПТГ; 2 - тотальный клеточный лизат после 3 часов выращивания после внесения ИПТГ; 3 - тотальный клеточный лизат после 4 часов выращивания после внесения ИПТГ; А - гибридный белок TrxTEVrs-TMS, содержащий антиангиогенный пептид TMS; Б - остаточный белок TrxTEVrs.
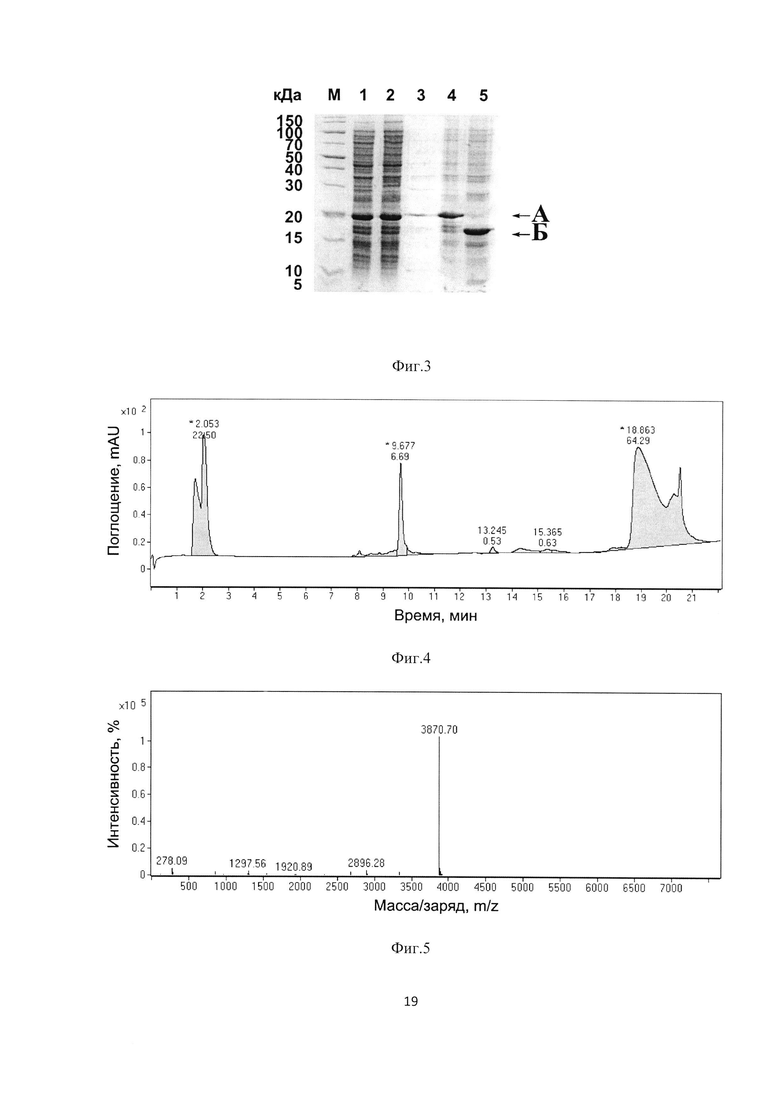
На Фиг. 3 представлена электрофореграмма выделения и протеолитического расщепления гибридного белка TrxTEVrs-TMS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат; 2 - осветленный клеточный супернатант; 3 - осадок клеточного дебриса; 4 - гибридный белок TrxTEVrs-TMS после анионообменной хроматографии; 5 - продукты расщепления гибридного белка TrxTEVrs-TMS с помощью TEV-протеиназы в соотношении 1:100 (фермент : белок) после инкубации в течение в течение 20 часов при комнатной температуре при рН 8.0.
На Фиг. 4 показан хроматографический профиль анализа продуктов протеолитического расщепления гибридного белка TrxTEVrs-TMS с помощью аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии.
На Фиг. 5 показан результат масс-спектрометрического анализа рекомбинантного антиангиогенного пептида TMS.
Изобретение иллюстрируется нижеследующими примерами.
Пример 1.
Получение штамма-продуцента Е. coli BL21(DE3)/pTEV-TMS и определение его продуктивности
Штамм-продуцент Е. coli BL21(DE3)/pTEV-TMS получают трансформацией компетентных клеток Е. coli BL21(DE3) с генотипом [F-ompT hsdSB (r-m-) gal dcm (DE3)] рекомбинантной плазмидой pTEV-TMS, содержащей гибридный ген TrxTEVrs-TMS, состоящий из слитых в рамке последовательностей тиоредоксина, сайта для расщепления TEV-протеиназой и антиангиогенного пептида TMS (SEQ ID NO 1, 2).
Клетки штамма Е. coli BL21(DE3)/pTEV-TMS являются продуцентом гибридного белка TrxTEVrs-TMS (SEQ ID NO 3, 4), состоящего из разделенных сайтом для расщепления TEV-протеиназой тиоредоксина и антиангиогенного пептида TMS.
Трансформированные клетки высевают на агаризованную среду LB, содержащую ампициллин (100 мкг/мл), и выращивают в течении 14 часов при 37°С для получения отдельных колоний. После чего несколько колоний переносят в 100 мл среды LB, содержащую 2% глюкозу и ампициллином (100 мкг/мл), и выращивают 10 ч при 37°С на шейкере при перемешивании со скоростью 180 об/мин для получения культуры с ОД600=3.5. Полученной ночной культурой (процент засева составляет 2%) засевают требуемый объем среды LB, содержащей 0.2% глюкозу и ампициллин (100 мкг/мл), и выращивают при 37°С при перемешивании со скоростью 200 об/мин. При плотности клеточной культуры ОД600=0.8 вносят ИПТГ до концентрации 0.4 мМ и выращивают при 37°С в течение 4 часов. Каждый час после добавления ИПТГ отбирают аликвоты для последующего электрофоретического анализа.
На Фиг. 1 представлена физическая карта плазмиды pTEV-TMS. Указаны сайты эндонуклеаз рестрикции. Ori - участок инициации репликации плазмидного вектора, М13 ori - участок инициации репликации фага М13, AmpR - ген устойчивости к ампициллину, lacI - ген репрессора лактозного оперона, Rop - ген РНК-организующего белка, TrxTEVrs-TMS - ген гибридного белка TrxTEVrs-TMS, состоящий из тиоредоксина и антиангиогенного пептида TMS, разделенных сайтом для расщепления TEV-протеиназой.
На Фиг. 2 представлена электрофореграмма накопления гибридного белка TrxTEVrs-TMS в ходе выращивания клеточной культуры штамма-продуцента Е. coli BL21(DE3)/pTEV-TMS. На электрофореграмме представлены: М - стандарт молекулярных масс, 1 - тотальный клеточный лизат после 2 часов выращивания после внесения ИПТГ, 2 - тотальный клеточный лизат после 3 часов выращивания после внесения ИПТГ, 3 - тотальный клеточный лизат после 4 часов выращивания после внесения ИПТГ; А - гибридный белок TrxTEVrs-TMS, содержащий антиангиогенный пептид TMS.
Пример 2.
Получение гибридного белка TrxTEVrs-TMS, его протеолитическое расщепление и выделение рекомбинантного антиангиогенного пептида TMS
По окончании культивирования, описанного в примере 1, клеточную биомассу штамма Е. coli BL21(DE3)/pTEV-TMS отделяют центрифугированием в течение 30 мин при 10°С и 7500 об/мин. Разрушение клеточной биомассы проводят в буферном растворе при рН 7.6-8.0 в присутствии ингибитора протеаз с помощью УЗ-дезинтегратора при 10°С.
Клеточный дебрис отделяют центрифугированием в течение 40 мин при 10°С и 7500 об/мин.
Полученный клеточный супернатант разбавляют буферным раствором, использованным для разрушения клеточной биомассы, титруют до рН 8.0 и наносят на колонну с анионообменным сорбентом Q Sepharose XL (GE Healthcare). Элюцию гибридного белка TrxTEVrs-TMS проводят при 8.0 в линейном градиенте от 0 до 500 мМ NaCl. Полученный раствор титруют до рН 8.0, добавляют дитиотреитол до конечной концентрации 1 мМ и раствор рекомбинантной TEV-протеиназы в 50% глицерине с концентрацией 5 мг/мл в соотношении 1:100. Протеолитическое расщепление проводят при комнатной температуре в течение 20 часов. После окончания инкубации белковый раствор титруют до рН 9 и наносят на колонну с анионообменным сорбентом Q Sepharose XL. Элюат, собранный во время нанесения, титруют до рН 11 и наносят на колонну с анионообменным сорбентом Q Sepharose XL. Во время элюции изократическим градиентом 150 мМ NaCl при рН 10.0 собирают фракцию, содержащую пептид TMS. Последующую очистку TMS осуществляют с помощью ОФ ВЭЖХ на хроматографической колонне PerfectSil300 С18 (MZ-Analysentechnik GmbH) в линейном градиенте от 0 до 32% ацетонитрила (0.1% ТФУ). Окончательную очистку рекомбинантного TMS осуществляют с помощью гель-фильтрационной хроматографии на колонне, содержащей сорбент Bio-Gel Р-2 Gel (Bio-Rad) в буферном растворе 5 мМ уксусной кислоты. Полученный пептид TMS лиофильно высушивают.
Идентификацию образующегося рекомбинантного антиангиогенного пептида TMS проводят с помощью масс-спектрометрического анализа. Молекулярная масса продукта составляет 3870.68 Да, что соответствует теоретически рассчитанному значению 3870.70 Да.
На Фиг. 3 представлена электрофореграмма выделения и протеолитического расщепления гибридного белка TrxTEVrs-TMS. М - стандарт молекулярных масс; 1 - тотальный клеточный лизат; 2 - осветленный клеточный супернатант; 3 - осадок клеточного дебриса; 4 - гибридный белок TrxTEVrs-TMS после анионообменной хроматографии; 5 - продукты расщепления гибридного белка TrxTEVrs-TMS с помощью TEV-протеиназы в соотношении 1:100 (фермент : белок) после инкубации в течение в течение 20 часов при комнатной температуре при рН 8.0; А - гибридный белок TrxTEVrs-TMS, содержащий антиангиогенный пептид TMS; В - остаточный белок TrxTEVrs.
На Фиг. 4 показан хроматографический профиль анализа продуктов протеолитического расщепления гибридного белка TrxTEVrs-TMS с помощью аналитической обращенно-фазовой высокоэффективной жидкостной хроматографии; 1 - антиангиогенный пептид TMS; 2 - остаточный белок TrxTEVrs.
На Фиг. 5 показан результат масс-спектрометрического анализа рекомбинантного антиангиогенного пептида TMS.
Пример 3.
Оценка антиангиогенной активности рекомбинантного пептида Тумастина in vitro
Для подтверждения антиангиогенной активности Тумастина проводят стандартный комплекс тестов, позволяющий оценить действие на ранних этапах ангиогенеза (пролиферация эндотелиальных клеток и образование капилляроподобных структур). Антиангиогенные свойства Тумастина изучают в диапазоне концентраций от 0.1 нМ до 20 нМ (Мирошников А.И., Лихванцева В.Г., Степанова Е.В., Арутюнян Е.В., Осипов Р.А., Бейрахова К.А., Степаненко В.Н., Белоус О.В. Офтальмохирургия. 2011. №1. Р. 76-82). В работе используют иммортализованную культуру эндотелиальных клеток мыши SVEC-4-10 (O'Connel K., Edidin М. 1990. V. 144. №2. Р. 521-525).
С помощью стандартного МТТ-теста по выживаемости эндотелиальных клеток мыши SVEC4-10 оценивают цитотоксичность пептида TMS. К эндотелиальным клеткам (6×104 в мл) после 24-часовой инкубации в среде DMEM, содержащей 0.1% эмбриональной сыворотки и 2 мМ глутамина, добавляют рекомбинантный пептид TMS в концентрациях от 0.1 до 20 нМ и инкубируют 2 дня. После чего вносят МТТ (3-(4,5-диметилтиазол-2-ил)-2,5-дифенил-2Н-тетразолиум бромид) в конечной концентрации 0.5 мг/мл и инкубируют 4 часа. По окончании инкубации среду сливают, клетки растворяют в ДМСО. Оптическую плотность оценивают с помощью планшетного спектрофотометра при длине волны 540 нм. Выживаемость эндотелиальных клеток при инкубации с исследуемым пептидом TMS высокая: выживаемость клеток составляет 90±1% при максимальной концентрации пептида (20 нМ) и достигает 101±4% при минимальной концентрации (0.1 нМ).
С помощью модифицированного митогенного теста исследуют ингибирование bFGF-стимулированной пролиферации иммортализованной культуры эндотелиальных клеток мыши SVEC-4-10. К эндотелиальным клеткам (15×103 в мл) после 24-часовой инкубации в среде DMEM, содержащей 0.1% эмбриональной сыворотки, 2 мМ глутамина и 20 нг/мл основного фактора роста фибробластов (bFGF), добавляют рекомбинантный пептид TMS в концентрациях от 0.1 до 20 нМ и инкубируют в течение 6 дней (среду и исследуемый пептид меняют каждые 3 дня), после чего клетки окрашивают красителем Crystal Violet. Оптическую плотность оценивают с помощью планшетного спектрофотометра при длине волны 540 нм. Максимальное ингибирование (ИК50) пролиферации клеток наблюдают при концентрации пептида 10 нМ (50% от контроля). При более высоких концентрациях пептида антипролиферативный эффект менее выражен.
Для определения ингибирующего действия пептида TMS на образование трубочко-подобных структур эндотелиальные клетки (4×105 в мл) инкубируют вместе с исследуемым пептидом TMS в нецитотоксичных концентрациях 10 и 20 нМ в среде DMEM, содержащей 0.1% эмбриональной сыворотки, 2 мМ глутамина в течение 20 минут при 37°С. Аликвоту клеток (500 мкл) вносят в лунки, покрытые матригелем и инкубируют в СО2-инкубаторе в течение 4-5 часов. Оценивают длину трубочек и количество контактов между трубочками. Пептид TMS в концентрациях 10 и 20 нМ вызывает 50 и 80% ингибирование образования трубочко-подобных структур соответственно.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантная плазмидная ДНК pERIG-PGS, кодирующая гибридный белок, способный к автокаталитическому расщеплению с образованием антиангиогенного пептида пигастина - производного фрагмента [44-77] фактора роста пигментного эпителия человека, штамм Escherichia coli BL21(DE3)/pERIG-PGS - продуцент указанного белка, и способ получения рекомбинантного антиангиогенного пептида | 2017 |
|
RU2664199C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PTRX-TEVRS-РТН, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК, СПОСОБНЫЙ К ПРОТЕОЛИТИЧЕСКОМУ РАСЩЕПЛЕНИЮ С ОБРАЗОВАНИЕМ ФРАГМЕНТА ЭНДОГЕННОГО ЧЕЛОВЕЧЕСКОГО ПАРАТИРЕОИДНОГО ГОРМОНА (1-34), ШТАММ ESCHERICHIA COLI BL21(DE3)/PTRX-TEVRS-РТН - ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО PTH (1-34) | 2019 |
|
RU2700452C1 |
| Способ получения пептида, модулирующего активность пуринергических рецепторов | 2019 |
|
RU2714114C1 |
| Плазмидный вектор pET-mChBac75Na, штамм бактерии Eschrichia coli BL21(DE3/ pET-mChBac75Na для экспрессии антимикробного пептида минибактенецина ChBac7.5 Nα и способ получения указанного пептида | 2016 |
|
RU2618850C2 |
| ПЛАЗМИДНЫЙ ВЕКТОР pET-His8-TrxL-Acip1, ШТАММ БАКТЕРИИ Escherichia coli BL21(DE3)/pET-His8-TrxL-Acip1 ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АЦИПЕНСИНА-1 И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2015 |
|
RU2580031C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИАНГИОГЕННОГО ПОЛИПЕПТИДА | 2012 |
|
RU2488635C1 |
| Рекомбинантная плазмидная ДНК pSMT3_HCRG21, кодирующая гибридный белок SMT3-HCRG21, штамм бактерий Escherichia coli BL21(DE3)/pSMT3_HCRG21 - продуцент анальгетического пептида HCRG21 и способ получения рекомбинантного анальгетического пептида HCRG21 | 2022 |
|
RU2798545C1 |
| ПЛАЗМИДНЫЙ ВЕКТОР pE-Trx-Aur, ШТАММ ESCHERICHIA COLI ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА АУРЕЛИНА И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2009 |
|
RU2412999C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНТИМИКРОБНОГО ПЕПТИДА АРЕНИЦИНА | 2006 |
|
RU2316595C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pЕ-Trx-Lc-def, ШТАММ Escherichia coli ДЛЯ ЭКСПРЕССИИ АНТИМИКРОБНОГО ПЕПТИДА ДЕФЕНСИНА ЧЕЧЕВИЦЫ Lens culinaris И СПОСОБ ПОЛУЧЕНИЯ УКАЗАННОГО ПЕПТИДА | 2010 |
|
RU2456345C1 |



Изобретение относится к области генной инженерии, конкретно к рекомбинантному получению антиангиогенных пептидов, и может быть использовано в медицине. Способ получения рекомбинантного антиангиогенного пептида Тумастина - производного модифицированного фрагмента [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно, предусматривает культивирование штамма-продуцента Е. coli BL21(DE3)/pTEV-TMS, разрушение клеточной биомассы в присутствии ингибитора протеаз, центрифугирование клеточного лизата и отделение клеточного супернатанта, содержащего гибридный белок, хроматографическую очистку гибридного белка на колонне с анионообменным сорбентом, протеолитическое расщепление с помощью TEV-протеиназы, хроматографическую очистку антиангиогенного пептида Тумастина. Изобретение позволяет получить с высоким выходом антиангиогенный пептид Тумастин. 2 н.п. ф-лы, 5 ил., 3 пр.
1. Штамм Е. coli BL21(DE3)/pTEV-TMS, продуцирующий в растворимой форме гибридный полипептид TrxTEVrs-TMS (SEQ ID NO: 3, 4), содержащий разделенные сайтом для расщепления протеиназой вируса гравировки табака (TEV-протеиназой) тиоредоксин и антиангиогенный пептид Тумастин (SEQ ID NO: 1, 2), представляющий собой модифицированный фрагмент [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно, и полученный путем трансформации клеток штамма Е. coli BL21(DE3) рекомбинантной плазмидной ДНК pTEV-TMS длиной 6440 п. о. с физической картой, приведенной на фиг. 1, содержащей последовательность гибридного гена TrxTEVrs-TMS с SEQ ID NO: 3, состоящего из слитых в рамке 5'-концевой последовательности, кодирующей N-концевой белок-носитель из тиоредоксина и сайт для расщепления TEV-протеиназой, и 3'-концевой последовательности с оптимизированными для экспрессии в Е. coli кодонами, кодирующей С-концевой отщепляемый антиангиогенный пептид TMS.
2. Способ получения рекомбинантного антиангиогенного пептида Тумастина - производного модифицированного фрагмента [L69K-95] тумстатина человека с присоединенными к N- и С-концам последовательностями Ser-Gly-Ala-Met-Gly и Pro-Gly-Pro соответственно, включающий культивирование штамма-продуцента Е. coli BL21(DE3)/pTEV-TMS по п. 1, разрушение клеточной биомассы в присутствии ингибитора протеаз, центрифугирование клеточного лизата и отделение клеточного супернатанта, содержащего гибридный белок, хроматографическую очистку гибридного белка на колонне с анионообменным сорбентом, протеолитическое расщепление с помощью TEV-протеиназы, хроматографическую очистку антиангиогенного пептида Тумастина.
| БЕЙРАХОВА К.А | |||
| Рекомбинантные полипептиды для терапии глазных заболеваний, сопровождающихся патологическим ангиогенезом, Автореферат диссертации, Москва, 2012, 24 с | |||
| CN 101519658 A, 02.09.2009 | |||
| Способ производства полуфабрикатов из высокопрочных алюминиевых сплавов | 1975 |
|
SU722494A3 |
| WALKER J.R | |||
| et al., Using protein-based motifs to stabilize peptides, J | |||
| Pept | |||
| Res., 2003, v.62, n.5, p.214-226. | |||
Авторы
Даты
2017-07-11—Публикация
2015-11-06—Подача