Изобретение относится к области биотехнологии, в частности к генетической инженерии, и представляет собой способ получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 453 по 543 аминокислоту, его выделения и очистки.
Изобретение может быть использовано в медицинской промышленности для создания новых лекарственных препаратов с антиангиогенным терапевтическим эффектом.
Одной из важнейших задач, стоящих перед медициной, является поиск эффективных методов для лечения больных со злокачественными заболеваниями. Одним из ключевых достижений науки XX века в этой области является доказательство необходимости процесса ангиогенеза для роста злокачественных солидных опухолей, а также создание концепции противоопухолевой терапии, основанной на подавлении ангиогенеза, разработанной Дж. Фолкманом [Folkman J., Angiogenesis in cancer, vascular, rheumatoid and other disease. Nat. Med., 1:27-31, 1995].
Ангиогенез - процесс роста капилляров из кровеносных сосудов, в результате которого образуются новые сосудистые сети. В здоровом организме взрослого человека ангиогенез не встречается в большинстве органов и тканей, или его интенсивность пренебрежимо мала, кроме процессов тканевой регенерации, а также образования желтого тела, эндометрия и плаценты. Однако при экспрессии факторов роста (таких как фактор роста эндотелия сосудов (VEGF), факторы роста фибробластов (FGF(s)) и др.) эндотелиальные клетки сосудов, находящиеся в покоящемся состоянии, могут вступать в клеточный цикл, пролиферировать, мигрировать и образовывать новые кровеносные сосуды. При этом патологический рост новых сосудов обусловливает прогрессию многих заболеваний, прежде всего рост и метастазирование солидных опухолей [Carmeliet P. and Jain R.K. Angiogenesis in cancer and other diseases. Nature, 407:249-257, 2000].
При нормальных физиологических условиях интенсивность ангиогенеза зависит не только от уровня экспрессии указанных и некоторых других факторов роста, но и от уровня экспрессии ингибиторов ангиогенеза. Низкая интенсивность ангиогенеза обеспечивается паритетом в экспрессии как факторов роста, стимулирующих ангиогенез, так и ингибиторов последнего. Среди специфических ингибиторов ангиогенеза, воздействующих на пролиферирующие эндотелиальные клетки сосудов, одним из самых мощных является ангиостатин - белок с молекулярной массой 38-40 кДа, выделенный М. О'Рейлли и соавт.[О 'Reilly M.S. et al. Angiostatin: a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma. Cell, 79:315-328, 1994] из крови и сыворотки мышей с солидными опухолями в организме.
Специфически ингибируя ангиогенез, можно проводить терапию злокачественных новообразований и заболеваний, связанных с неоваскуляризацией, например, сетчатки глаза, таких как диабетическая и серповидноклеточная ретинопатия и др. Ряд антиангиогенных препаратов, например, ангиостатин, скволамин, 2-метоксиэстрадиол и др., находятся в настоящее время на стадии клинических испытаний в странах Западной Европы и США [Moschetta M. et al. Angiogenesis inhibitors: implications for combination with conventional therapies, Curr. Pharm. Des., 16 (35): 3921-39 31, 2010]. В связи с этим поиск новых ингибиторов ангиогенеза и разработка методов их получения в количествах, достаточных для проведения доклинических исследований, становится важной научно-прикладной задачей современной медицины.
При изучении ангиостатина, одного из самых мощных ингибиторов пролиферации эндотелиальных клеток in vitro и ангиогенеза in vivo, было обнаружено, что этот белок является фрагментом одного из компонентов системы свертывания крови, а именно плазминогена. Ангиостатин образуется в организме, несущем раковую опухоль, путем протеолиза плазминогена рядом ферментов, специфически экспрессирующимися в опухолевой ткани. Помимо ангиостатина, при протеолизе плазминогена различными ферментами образуется ряд других полипептидов, также обладающих антиангиогенной активностью.
Плазминоген человека, белок с молекулярной массой 90 кДа содержит пять так называемых крингл-доменов (обозначаемых номерами от 1 до 5), представляющих собой особую жесткую структуру полипептидной цепи, свернутую в два кольца и поддерживаемую тремя дисульфидными связями; длина цепи каждого крингл-домена приблизительно 80 аминокислотных остатков. Ангиостатин представляет собой структуру, соответствующую крингл-доменам 1-3 (К1-3) или крингл-доменам 1-4 (К1-4) плазминогена. При исследованиях фрагментов плазминогена (ангиостатин, К1, К3, К2-3 и т.д.) было показано, что наибольшей ингибирующей активностью обладает крингл-домен 5 (К5) [Cao Y. et al. Kringle 5 of plasminogen is a novel inhibitor of endothelial cell growth. J Biol Chem, 272:22924-22928, 1997]. Его антипролиферативный эффект в несколько раз превосходит таковой у ангиостатина, а также любого индивидуального крингл-домена. Это может объясняться тем, что антиэндотелиальный эффект К5 и других крингл-доменов реализуется посредством разных механизмов. Так, рецептором К5 на поверхности эндотелиальных клеток является особый белок - электрозависимый анионный канал (VDAC1) [Gonzalez-Grono-w M. et al. The voltage-dependent anion channel is a receptor for plasminogen kringle 5 on human endothelial cells, J Biol Chem, 278:27312-27318, 2003], в то время как для ангиостатина рецепторами являются АТФ-синтаза, ассоциированная с цитоплазматической мембраной, и интегрин αvβ3 [Tarui Т. et al. Specific interaction of angiostatin with integrin αvβ3 in endothelial cells. J Biol Chem, 276:39562-29567, 2001].
Помимо высокой антипролиферативной активности, очевидны и другие преимущества крингл-домена 5 плазминогена человека как антиангиогенного препарата. Во-первых, К5 проявляет свою ингибирующую активность специфично, только на пролиферирующие эндотелиоциты кровеносных сосудов, и поэтому нетоксичен для других типов клеток, в том числе для предшествующих нормальных эндотелиальных клеток [Zhang D. et al. Intravitreal injection of plasminogen kringle 5, an endogenous angiogenic inhibitor, arrests retinal neovascularization in rats. Diabetologia, 44:757-765, 2001]). Во-вторых, плазминоген является эндогенным белком тканей человека, и поэтому К5 не будет вызывать иммунный ответ. В-третьих, К5, как полипептид с небольшой молекулярной массой (12-13 кДа), может легко быть получен как рекомбинантный белок в клетках Е. coli, а кроме того, как стабильный белок, может использоваться в фармакокинетических системах направленной доставки и замедленного высвобождения.
Крингл-домен 5 плазминогена человека представляет собой белок с молекулярной массой 12,8 кДа. К настоящему времени установлено его ингибирующее действие на миграцию и пролиферацию эндотелиальных клеток in vitro и in vivo, и, следовательно, К5 является перспективным терапевтическим агентом при раковом росте и метастазировании. Его терапевтический эффект обусловлен супрессивным действием на клеточный цикл эндотелиальных клеток и запуском в последних апоптоза [Lu H. et al. Kringle 5 causes cell cycle arrest and apoptosis of endothelial cells. Biochem Biophys Res Communic, 258:668-673, 1999}. Перспектива успешного применения К5 в качестве терапевтического агента при патологических процессах, связанных с нарушением регуляции ангиогенеза, делают необходимым развитие методов его получения как генно-инженерного продукта, что обеспечит исследователей достаточными количествами данного белка.
К настоящему времени описаны системы экспрессии рекомбинантного К5 в дрожжах Pichia pastoris [Zhu M. et al. Expression of kringle 5 domain of human plasminogen in Pichia pastoris. Prep Biochem Biotechnol. 2003 Nov; 33(4): 2 69-81] и кишечной палочке (Е. coli).
Наиболее близкой по техническим деталям к нашему изобретению является рекомбинантная плазмидная ДНК и созданный в результате ее трансфекции штамм-продуцент Е.coli, который обеспечивает получение биологически активного мышиного К5 [Lu H. et al. Kringle 5 causes cell cycle arrest and apoptosis of endothelial cells. Biochem Biophys Res Communic, 258:668-673, 1999]. Рекомбинантная ДНК (плазмида pET-22b(+), Novagen, Germany) содержит ген крингл-домена 5 плазминогена мыши (аминокислотные остатки Cys48i-Ala563), слитый с нуклеотидной последовательностью 6-ти остатков гистидина (His-tag) и сигнальной последовательностью (peIB leader), которая обеспечивает секрецию целевого полипептида в периплазму бактериальной клетки. Рекомбинантный К5 экспрессировался в Е.coli и затем очищался с помощью агарозного сорбента Ni-NTA. Однако с использованием данной методики в секретируемой как в периплазму, так и частично в культуральную среду форме экспрессировалось только около 15% белка; остальная часть (около 85% суммарного К5) после биосинтеза образовывала в клетках Е.coli нерастворимые тельца включения. Для его очистки приходилось применять денатурирующие условия, при концентрации мочевины до 8 М. Это приводило к снижению выхода целевого рекомбинантного продукта; кроме того, обеспечить ренатурацию, учитывая многостадийность процесса при работе с тельцами включения, а также крингл-структуру К5, достаточно сложно.
Задачей изобретения является разработка способа получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 453 по 543 аминокислоту, включающего крингл-домен 5 плазминогена человека, в клетках штамма-продуцента Е. coli, обеспечивающего секрецию целевого полипептида в периплазму клетки с высоким выходом.
В основном технический результат достигается в результате экспрессии гена целевого белка в составе созданных экспрессионных векторов. Способы культивирования бактериальных клеток при этом вытекают из особенностей полученного штамма на основе клеток Е. coli BL21 (DE3), а способы выделения и очистки конечного продукта - от особенностей его экспрессии (в периплазму, а также в случае вектора рЕК5Н-содержащим дополнительные последовательности, введенные с целью облегчения и повышения эффективности процедуры очистки).
Задача решается способом получения данного полипептида в составе клеток Е. coli с последующим выделением и очисткой конечного продукта из периплазмы клеток, при котором экспрессию осуществляют в клетках Е. coli BL21 (DE3), трансформированных рекомбинантными плазмидными ДНК рЕК5 или рЕК5Н. Рекомбинантная плазмидная ДНК рЕК5 имеет размер 3592 пар оснований и включает следующие основные элементы: ген целевого полипептида, слитый с геном сигнального пептида ОтрА, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора. Рекомбинантная плазмидная ДНК рЕК5Н имеет размер 3625 пар оснований и состоит из следующих основных элементов: ген целевого полипептида, слитый с геном сигнального пептида OmpA, участки, кодирующие аминокислотные последовательности НННННН и DDDDK, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора.
Способ получения рекомбинантного полипептида заключается в том, что экспрессию гена осуществляют путем культивирования клеток в среде LB, содержащей 40-50 мкг/мл канамицина до уровня плотности 0,4-0,6 OD, затем продолжают культивирование в присутствии 0,1-0,3 мМ изопропилтио-β-D-галактопиранозида до накопления продукта, и целевой полипептид выделяют из периплазмы клеток Е.coli различными методами в зависимости от используемой встроенной рекомбинантной плазмидной ДНК. Очистку целевого продукта, полученного в штаммах, трансфецированных рекомбинантной плазмидой рЕК5, из раствора белков периплазмы проводят с помощью метода обращеннофазовой жидкостной хроматографии с помощью системы HPLC. Очистку целевого продукта, полученного в штаммах, трансформированных рекомбинантной плазмидной ДНК рЕК5Н, осуществляют с помощью последовательно применяемых стадий катионообменной хроматографии на агарозном носителе, ферментативного расщепления энтерокиназой и ионообменной хроматографии на сорбенте DEAE-Sepharose.
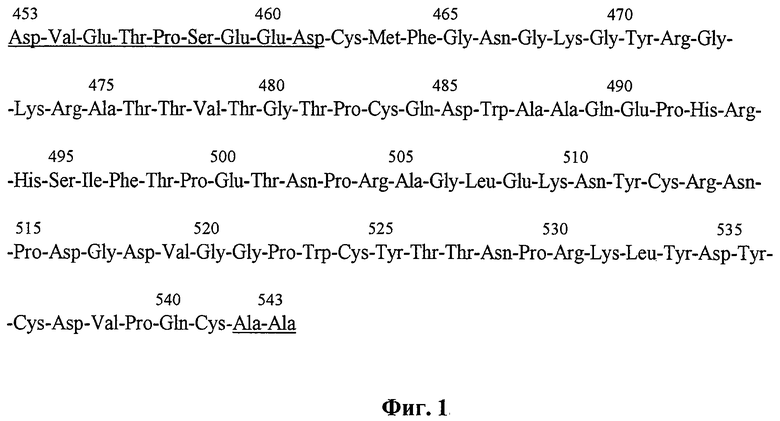
Разработанные экспрессионные векторы несут ген, кодирующий целевой полипептид, аминокислотная последовательность которого представлена на фиг.1 и включает крингл-домен 5 плазминогена человека с несколькими дополнительными аминокислотными остатками-9 остатков с N-конца и 2 остатка с С-конца (на фиг.1 подчеркнуты). Такая последовательность точно соответствует аминокислотной последовательности плазминогена человека, ограниченной остатками Asp 453 и Ala 543 (SEQ ID NO 1). В участках Leu 451-Pro 452 и Ala 543-Pro 544 молекулы плазминогена находятся сайты протеолитического действия фермента эластазы, в результате действия которой путем ограниченного протеолиза образуется нативный K5; кроме того, такой выбор первичной последовательности целевого полипептида обусловлен тем, что с остающимися аминокислотными «кончиками» (т.е. аминокислотными последовательностями, не формирующими структуру крингл-домена) можно проводить различные химические модификации: ковалентное присоединение антител к опухолеспецифическим антигенам, конъюгирование с противоопухолевыми антибиотиками и т.д. Включив в состав этой генетической конструкции последовательность, связанную с геном крингл-домена 5, и кодирующую дополнительные шесть аминокислотных остатков гистидина в молекуле целевого белка (не показано на фиг.1), мы также получили рекомбинантную плазмидную ДНК рЕК5Н. Такая модификация целевого полипептида позволяет облегчить его дальнейшую очистку, используя ионообменную хроматографию. В то же время в указанной генетической конструкции предусмотрено кодирование аминокислотной последовательности Asp-Asp-Asp-Asp-Lys в целевом белке (не показано на фиг.1), которая является сайтом протеолитического расщепления эндонуклеазой энтерокиназой, что позволяет отщеплять от очищенного с помощью ионообменной хроматографии полипептида, полученного с помощью экспрессионного вектора рЕК5Н, аминокислотную последовательность из шести остатков гистидина, получая таким образом полипептид, структура которого соответствует нативному. Схема генетических конструкций рЕК5 и рЕК5Н представлена на фиг.2.
Изобретение иллюстрируется следующими примерами:
Пример 1. Создание генетических конструкций, обеспечивающих биосинтез и секрецию целевого полипептида в клетках Е. coli.
А) Синтез полинуклеотидной последовательности, содержащей 3'-часть гена К5 плазминогена человека, стоп-кодон и сайты ферментов рестрикции SacII и HmdIII (К5 В).
Праймеры для синтеза:
К5 В 5': ATCTACCGCGGCAAGAGGGCGACCACTGTTA
K5B-R 5': ACAAAGCTTATTATCAGGCCGCACACTGAGGGACAT
С помощью праймеров К5 В 5' (SEQ ID NO 2), K5B-R 5' (SEQ ID NO 3) и кДНК библиотеки генов человека синтезировали последовательность ДНК К5 В (SEQ ID NO 4), содержащую 3'-часть гена К5, стоп-кодон и сайты ферментов рестрикции SacII и HindIII:
ATCTACCGCGGCAAGAGGGCGACCACTGTTACTGGGACGCCATGCCAGGAC
TGGGCTGCCCAGGAGCCCCATAGACACAGCATTTTCACTCCAGAGACAAAT
CCACGGGCGGOTCTGGAAAAAAATTACTGCCGTAACCCTGATGGTGATGTAG
GTGGTCCCTGGTGCTACACGACAAATCCAAGAAAACTTTACGACTACTGTGA
TGTCCCTCAGTGTGCGGCCTGATAATAAGCTTTGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции SacII;
выделенный фрагмент - сайт узнавания ферментом рестрикции Hind III.
Б) Синтез полинуклеотидной последовательности, содержащей 5'-часть сигнального пептида ОтрА с сайтами ферментов рестрикции BamHI и NruI (ОМР5).
Праймеры для синтеза:
ОМР5 5': ACTATAGGATCCATGAAAAAGACAGCTATCGCAATTGCAGT
OMP5-R 5': ACTATATCGCGAAACCAGCCAAGGCCACTGCAATTGCGATA
Для синтеза ОМР5 праймеры ОМР5 5' (SEQ ID NO 5) и OMP5-R 5' (SEQ ID NO 6) смешивали и амплифицировали, при этом получался следующий олигонуклеотид ОМР5 (SEQ ID NO 7):
ACTTGGATCCATGAAAAAGACAGCTATCGCAATTGCAGTGGCCTTGOCTGGT
TCGCGATATAGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI;
выделенный фрагмент - сайт узнавания ферментом рестрикции Nml.
В) Синтез полинуклеотидной последовательности, кодирующей 3'-часть сигнального пептида ОтрА с сайгом рестрикции ферментом Nml и содержащей 5'-часть гена К5 с сайтом рестрикции ферментом SacII (OMDK5).
Праймеры для синтеза:
OMDK5 5':
ACTATATCGCGACCGTAGCGCAAGCCCAGATGTAGAGACTCCTTCCGAAGAAGACTGT
OMDK5-R 5':
ACTATACCGCGGTATCCTTTCCCATTCCCAAACATACAGTCTTCTTCGGAAGGAGTCT
Для синтеза OMDK5 праймеры OMDK5 5' (SEQ ID NO 8) и OMDK5-R 5' (SEQ ID NO 9) смешивали и амплифицировали, при этом получался следующий олигонуклеотид OMDK5 (SEQ ID NO 10):
ACTATATCGCGACCGTAGCGCAAGCCCAGATGTAGAGACTCCTTCCGAAGA
AGACTGTATGTTTGGGAATGGGAAAGGATACCGCGGTATAGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции NruI;
выделенный фрагмент - сайт узнавания ферментом рестрикции SacII.
Г) Синтез полинуклеотидной последовательности, кодирующей ген сигнального пептида с сайтом рестрикции ферментом BamHI и старт-кодоном, и содержащей 5'-часть гена К5 с сайтом рестрикции ферментом SacII (SP5K5).
Для получения SP5K5 олигонуклеотиды ОМР5 (SEQ ID NO 7) и OMDK5 (SEQ ID NO 10) обрабатывали рестриктазой Nml и лигировали между собой с помощью лигазы фага Т4. В результате получали следующую последовательность SP5K5 (SEQ ID NO 11):
ACTTGGATCCATGAAAAAGACAGCTATCGCAATTGCAGTGGCCTTGGCTGGT
TTCGCGACCGTAGCGCAAGCCCAGATGTAGAGACTCCTTCCGAAGAAGACT
GTATGTTTGGGAATGGGAAAGGATACCGCGGTATAGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI;
выделенный фрагмент - сайт узнавания ферментом рестрикции SacII.
Д) Синтез полинуклеотидной последовательности, содержащей ген сигнального пептида с сайтом рестрикции ферментом BamHI и старт-кодоном, и ген К5 со стоп-кодоном и сайтом рестрикции ферментом HindIII (SPAK5).
Для получения SPAK5 олигонуклеотиды SP5K5 (SEQ ID NO 11) и К5 В (SEQ ID NO 4) обрабатывали рестриктазой SacII, и лигировали между собой с помощью лигазы фага Т4. В результате получали следующую последовательность SPAK5 (SEQ ID NO 12):
ACTTGGATCCATGAAAAAGACAGCTATCGCAATTGCAGTGGCCTTGGCTGGT
TTCGCGACCGTAGCGCAAGCCCAGATGTAGAGACTCCTTCCGAAGAAGACT
GTATGTTTGGGAATGGGAAAGGATACCGCGGCAAGAGGGCGACCACTGTTA
CTGGGACGCCATGCCAGGACTGGGCTGCCCAGGAGCCCCATAGACACAGCA
TTTTCACTCCAGAGACAAATCCACGGGCGGGTCTGGAAAAAAATTACTGCCG
TAACCCTGATGGTGATGTAGGTGGTCCCTGGTGCTACACGACAAATCCAAGA
AAACTTTACGACTACTGTGATGTCCCTCAGTGTGCGGCCTGATAATAAGCTT
TGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI;
выделенный фрагмент - сайт узнавания ферментом рестрикции HindIII.
Е) Синтез полинуклеотидной последовательности, кодирующей 3'-часть сигнального пептида OmpA с сайтом рестрикции ферментом NruI, и пептид из шести остатков гистидина с сайтом рестрикции ферментом RcaI (3O6H).
Праймеры для синтеза:
3O6H 5': ACTATATCGCGACCGTAGCGCAAGCCATCATCAT
3O6H-R 5': ACTATATCATGATTGGTGATGATGATGGCTTGCGCTA
Для синтеза 3O6H праймеры 3O6H 5' (SEQ ID NO 13) и 3O6H-R 5' (SEQ ID NO 14) смешивали и амплифицировали, при этом получался следующий олигонуклеотид 3O6H (SEQ ID NO 15):
ACTATATCGCGACCGTAGCGCAAGCCATCATCATCACCATCATGATATAGT
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции Nrul;
выделенный фрагмент - сайт узнавания ферментом рестрикции RcaI.
Ж) Синтез полинуклеотидной последовательности, представляющей собой фрагмент ДНК, кодирующий аминокислотную последовательность сайта расщепления энтерокиназой с сайтом рестрикции ферментом Rcal и 5'-часть гена K5 с сайтом рестрикции ферментом SacII (E5K5). Праймеры для синтеза:
E5K5 5':
ACTATATCATGATGATGACGATAAACCAGATGTAGAGACTCCTTCCGAAGA
А
E5K5-R 5':
ACTATACCGCGGTATCCTTTCCCATTCCCAAACATACAGTCTTCTTCGGAAG
GT
Для синтеза E5K5 праймеры E5K5 5' (SEQ ID NO 16) и E5K5-R 5' (SEQ ID NO
17) смешивали и амплифицировали, при этом получался следующий
олигонуклеотид E5K5 (SEQ ID NO 18):
ACTATATCATGATGATGACGATAAACCAGATGTAGAGACTCCTTCCGAAGA AGACTGTATGTTTGGGAATGGGAAAGGATACCGCGGTATAGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции RcaI;
выделенный фрагмент - сайт узнавания ферментом рестрикции SacII.
3) Синтез полинуклеотидной последовательности, кодирующей сигнальный пептид с сайтом рестрикции ферментом BamHI и старт-кодоном, пептид из шести остатков гистидина, аминокислотную последовательность сайта расщепления энтерокиназой и содержащей 5'-часть гена K5 с сайтом рестрикции ферментом SacII (SPH5K5).
Для получения SPH5K5 олигонуклеотиды OMP5(SEQ ID NO 7), 3O6H (SEQ ID NO 15) и E5K5 (SEQ ID NO 16) обрабатывали рестриктазами Nrul и RcaI и лидировали между собой с помощью лигазы фага Т4. При этом получали следующую последовательность SPH5K5 (SEQ ID NO 19):
ACTTGGATCCATGAAAAAGACAGCTATCGCAATTGCAGTGGCCTTGGCTGGT
TTCGCGACCGTAGCGCAAGCCATCATCATCACCATCATGATGATGACGATAA
ACCAGATGTAGAGACTCCTTCCGAAGAAGACTGTATGTTTGGGAATGGGAAA
GGATACCGCGGTATAGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI;
выделенный фрагмент - сайт узнавания ферментом рестрикции SacII.
И) Синтез полинуклеотидной последовательности, кодирующей сигнальный пептид с сайтом рестрикции ферментом BamHI и старт-кодоном, пептид из шести остатков гистидина, аминокислотную последовательность сайта расщепления энтерокиназой и содержащей ген K5 со стоп-кодоном и сайтом рестрикции ферментом HindIII (SPHisK5).
Для получения SPHisK5 олигонуклеотиды SPH5K5 (SEQ ID NO 19) и K5 В (SEQ ID NO 4) обрабатывали рестриктазой SacII, и лигировали между собой с помощью лигазы фага Т4. При этом получали следующую последовательность SPHisK5 (SEQ ID NO 20):
ACTTGGATCCATGAAAAAGACAGCTATCGCAATTGCAGTGGCCTTGGCTGGT
TTCGCGACCGTAGCGCAAGCCATCATCATCACCATCATGATGATGACGATAA
ACCAGATGTAGAGACTCCTTCCGAAGAAGACTGTATGTTTGGGAATGGGAAA
GOATACCGCGGCAAGAGGGCGACCACTGTTACTGGGACGCCATGCCAGGAC
TGGGCTGCCCAGGAGCCCCATAGACACAGCATTTTCACTCCAGAGACAAAT
CCACGGGCGGGTCTGGAAAAAAATTACTGCCGTAACCCTGATGGTGATGTAG
GTGOTCCCTGGTGCTACACGACAAATCCAAGAAAACTTTACGACTACTGTGA
TGTCCCTCAGTGTGCGGCCTGATAATAAGCTTTGT,
подчеркнутый фрагмент - сайт узнавания ферментом рестрикции BamHI;
выделенный фрагмент - сайт узнавания ферментом рестрикции HindIII.
Для получения экспрессионных векторов последовательности SPAK5 (SEQ ID NO 12) и SPHisK5 (SEQ ID NO 20) обработали ферментами рестрикции BamHI и Hind III и вставили по сайтам рестрикции BamHI и Hind III в вектор pBSH2. Полученные векторы назвали pEK5 и pEK5H соответственно. Схематическое изображение структуры экспрессионных векторов pEK5 и pEK5H представлено на фиг.2.
Пример 2. Продукция целевого полипептида в штаммах Е. coli.
Экспрессионный вектор pEK5, либо pEK5H, полученные, как описано в примере 1, был инкорпорирован в штамм кишечной палочки Escherichia coli BL-21/DE3. Для осуществления экспрессии целевого белка 30 мл трансфецированного штамма выдерживали при покачивании в течение 2-3 ч в среде LB при 37°С с добавлением канамицина (50 мкг/мл) и глюкозы (0,2%). Затем разбавляли эту культуру в 20 раз свежей средой LB, содержащей канамицин (40 мкг/мл), и наращивали 2-3 ч при покачивании. По достижении культуральной средой плотности OD280 нм=0,5 вносили в нее изопропилтио-β-D-галактопиранозид (IPTG) до концентрации 0,5 мМ для индукции биосинтеза целевого полипептида. Затем инкубировали данную культуру около 5 ч при 25°С при покачивании, центрифугировали при 10000 g в течение 15 мин, супернатант отбрасывали.
Пример 3. Выделение целевого полипептида из штамма-продуцента Е.coli, содержащего рекомбинантную плазмидную ДНК pEK5.
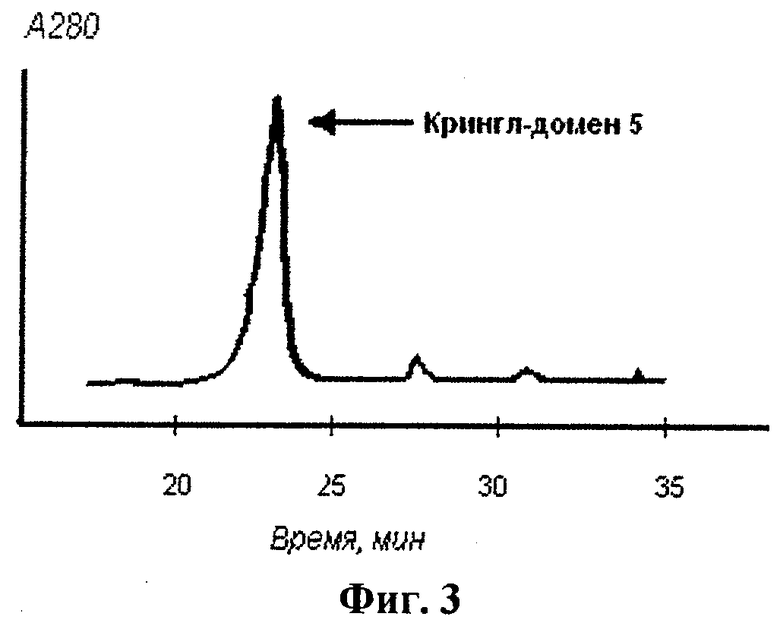
Осадок клеток, полученный, как описано в примере 2, ресуспендировали в буфере А (20 мМ Трис, рН 8.0, 15% галактоза и 1 мМ ЭДТА) в течение 10 мин при 20°С.Суспензию клеток затем центрифугировали при 10000 g в течение 15 мин; супернатант удаляли и ресуспендировали клетки в 7 мМ растворе магния (II) сульфата при 0°С в течение 20 мин. Высвободившиеся в результате белки периплазмы отделяли затем от клеток с помощью центрифугирования при 10000 g в течение 20 мин при 4°С; осадок отбрасывали. Полученный раствор белков периплазмы концентрировали с помощью ультрафильтрации в ячейке для концентрирования и диализовали против буфера Б (12 мМ Трис, рН 7.5) в течение 5 ч при 4°С. Затем очистку целевого продукта, полученного в штаммах, трансфецированных рекомбинантной плазмидой pEK5, осуществляли методом обращеннофазовой жидкостной хроматографии с помощью системы HPLC. Раствор белков периплазмы пропускали через хроматографическую колонку Brownlee Aquapore C4 (Applied Biosystems, USA); в качестве элюента использовали 0-60% градиент ацетонитрила, содержащего 0,05% трифторуксусной кислоты. Профиль элюпии целевого полипептида, полученного в штамме, содержащем экспрессионный вектор pEK5, при проведении высокоэффективной жидкостной хроматографии с обращенной фазой представлен на фиг.3.
Пример 4. Выделение целевого полипептида из штамма-продуцента E.coli, содержащего рекомбинантную плазмидную ДНК pEK5H.
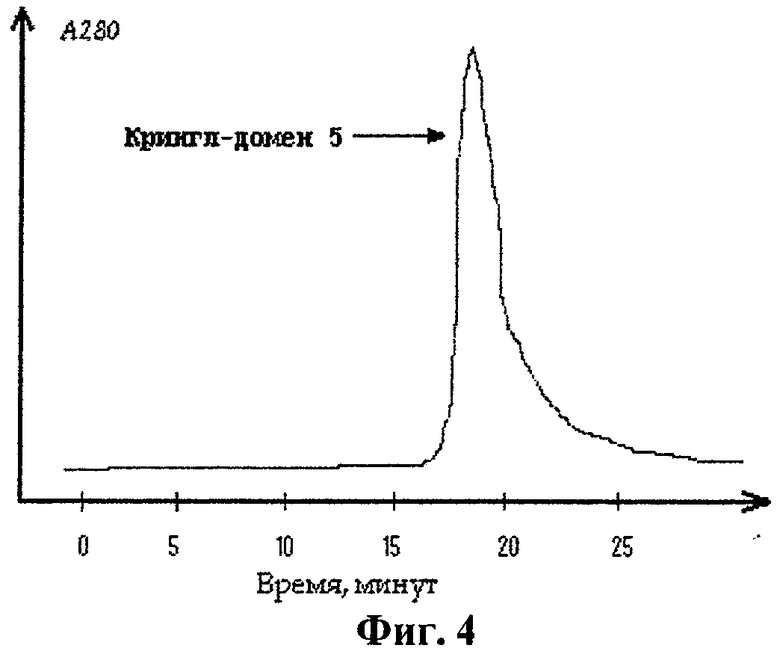
Осадок клеток, полученный, как описано в примере 2, ресуспендировали в буфере А (20 мМ Трис, рН 8.0, 15% галактоза и 1 мМ ЭДТА) в течение 10 мин при 20°С. Суспензию клеток затем центрифугировали при 10000 g в течение 15 мин; супернатант удаляли и ресуспендировали клетки в 7 мМ растворе магния (II) сульфата при 0°С в течение 20 мин. В результате перешедшие в раствор белки периплазматического пространства отделяли затем от клеток с помощью центрифугирования при 10000 g в течение 20 мин при 4°С; осадок отбрасывали. Полученный раствор белков периплазмы концентрировали с помощью ультрафильтрации в ячейке для концентрирования и добавляли к нему натрий дигидрофосфат до конечной концентрации 20 мМ, натрий хлорид до конечной концентрации 200 мМ и имидазол до конечной концентрации 10 мМ. Очистку целевого полипептида проводили на хроматографическом сорбенте Ni-NTA-агарозе. Сорбент, помещенный в колонку объумом 7 мл, предварительно уравновешивался 10-ю объемами буфера В (30 мМ Трис, рН 8.0, 20 мМ натрий дигидрофосфат, 30 мМ имидазол). Раствор белков периплазмы наносили на колонку и пропускали через нее буфер В до достижения базовой линии, после чего начинали промывать колонку буфером Г (30 мМ Трис, рН 8.0, 20 мМ натрий дигидрофосфат, 150 мМ имидазол), также до достижения базовой линии. Элюцию целевого белка проводили буфером Д (30 мМ Трис, рН 8.0, 20 мМ натрий дигидрофосфат, 300 мМ имидазол). Элюированный с колонки белок трижды диализовали против 100 объемов буфера Е (10 мМ натрия дигидрофосфата, 3 мМ калия хлорида, 120 мМ натрия хлорида, рН 7.4) при 4°С по 12 ч. Профиль элюции целевого полипептида, полученного в штамме, содержащем экспрессионный вектор pEK5H, при проведении ионообменной хроматографии на Ni-NTA-агарозе представлен на фиг.4.
Далее проводили отщепление от целевого полипептида, полученного из штамма-продуцента, содержащего экспрессионный вектор рЕК5Н, аминокислотной последовательности из шести остатков гистидина. Для этого раствор с концентрацией белка инкубировали 6 ч с энтерокиназой в массовом соотношении белок:фермент = 100000:1. Затем из реакционной смеси выделяли целевой полипептид, не содержащий 6×His, с помощью ионообменной хроматографии на сорбенте DEAE-Sepharose.
Пример 5. Определение уровня эндотоксина в препарате целевого полипептида.
Учитывая будущее использование целевого полипептида, полученного с использованием описываемой методики, преимущественно в качестве терапевтического агента, вводимого в организм парентерально, полученный продукт исследовали на содержание бактериальных эндотоксинов (липолисахаридов). Анализ на качественное содержание бактериальных эндотоксинов (липолисахаридов) (ЛАЛ-тест) проводили в апирогенных пробирках из натриевого стекла размером 10×75 мм. Готовили реакционную смесь, представляющую собой 0,1 мл раствора ЛАЛ-реактива (Limulus Amebocyte Lysate, Pyrotell, США) и 0,1 мл раствора целевого полипептида. После внесения реакционной смеси в пробирки и перемешивания, пробирки инкубировали при 37°С в течение 60 мин. Затем вынимали пробирки из инкубатора и переворачивали на 180°. Если на дне пробирки образовывался твердый гель, который не разрушался при переворачивании 180°, это рассматривали как положительный результат на наличие в анализируемом растворе бактериального эндотоксина; в случае же разрушения геля при переворачивании на 180° или его отсутствия, делали заключение об апирогенности анализируемого раствора. Все образцы целевого полипептида, полученные с применением вышеописанного способа, проявляли отрицательную реакцию на наличие бактериальных эндотоксинов.
Пример 6. Определение биологической активности целевого полипептида.
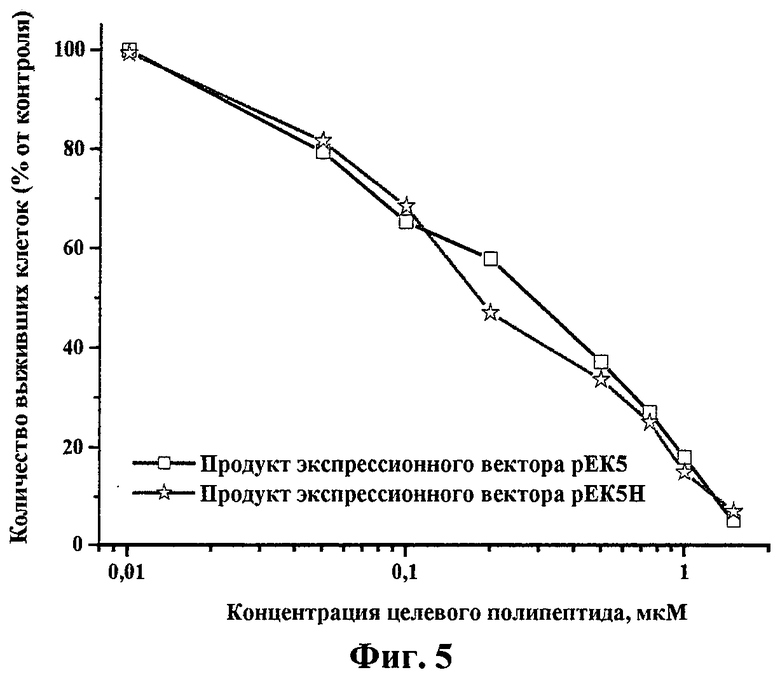
Исследование влияния исследуемых препаратов на пролиферацию эндотелиальных клеток проводили описанным ранее методом (О 'Reilly M. et al. Endostatin: an endogenous inhibitor of angiogenesis and tumor growth. Cell, 88:277-285, 1997). Клетки HUVEC (эндотелиальные клетки пупочной вены человека) из монослоя трипсинизировали и ресуспендировали в среде M199, содержащей 5% фетальной бычьей сыворотки. Затем клетки рассеивали в 96-луночные планшеты, покрытые желатином, в плотности 5000 клеток в лунку. Через 24 ч добавляли раствор целевого полипептида в различных концентрациях. По прошествии 20 мин культуры клеток обрабатывались 5 нг/мл раствором BFGF (Life Technilogies Inc., USA) в присутствии гепарина (1 мкг/мл). Выживаемость клеток в контрольной и в обработанных растворами целевого полипептида группах определяли с помощью МТТ-теста через 72 ч инкубации. МТТ-тест эффективно определяет метаболитическую активность митохондрий, и его результат прямо коррелирует с числом живых клеток. На фиг.5 показана зависимость пролиферации клеток HUVEC от концентрации целевого полипептида. Как видно на фиг.5, препараты полученного целевого полипептида вызывали гибель эндотелиальных клеток человека дозозависимым образом.










Изобретение относится к области биотехнологии, конкретно к получению рекомбинантного плазминогена человека, и может быть использовано в медицине для создания новых лекарственных препаратов с антиангиогенным терапевтическим эффектом. Способ заключается в экспрессии гена фрагмента плазминогена человека с 453 по 543 аминокислоту в составе клеток E.coli с последующим выделением и очисткой конечного продукта из периплазмы клеток. Экспрессию осуществляют в клетках E.coli BL21 (DE3), трансформированных рекомбинантными плазмидными ДНК pEK5 или pEK5H с физическими картами, представленными на фиг.2, содержащими ген целевого полипептида, слитый с геном сигнального пептида OmpA, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем T7-промотора. При этом рекомбинантная плазмидная ДНК рЕК5Н дополнительно содержит между генами OmpA и целевого полипептида участки, кодирующие аминокислотные последовательности НННННН и DDDDK. Изобретение обеспечивает секрецию целевого полипептида в периплазму клетки с высоким выходом. 3 з.п. ф-лы, 5 ил., 6 пр.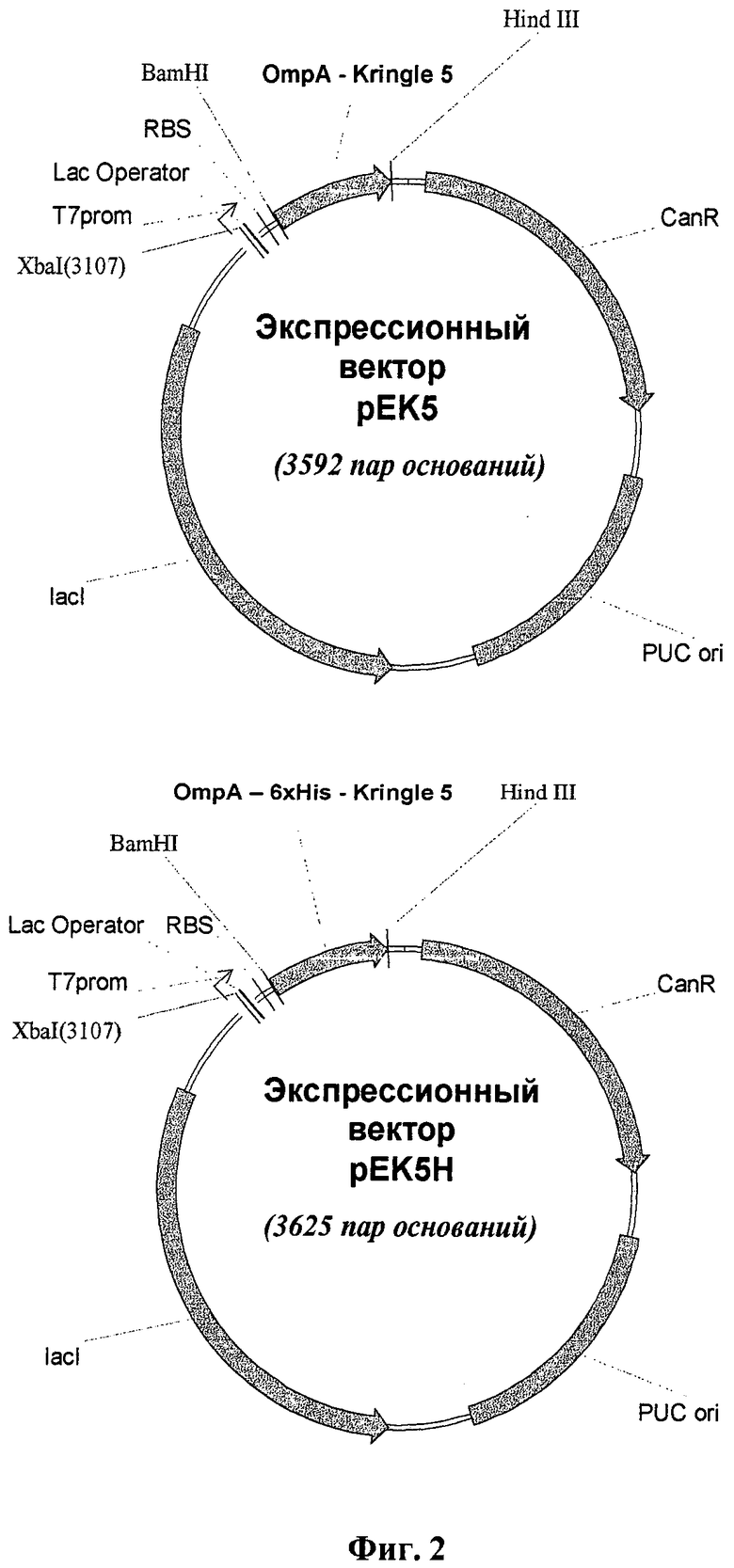
1. Способ получения рекомбинантного полипептида, представляющего собой фрагмент плазминогена человека с 453 по 543 аминокислоту (SEQ ID NO 1), заключающийся в экспрессии его гена в составе клеток E.coli с последующим выделением и очисткой конечного продукта из периплазмы клеток, при котором экспрессию осуществляют в клетках E.coli BL21 (DE3), трансформированных рекомбинантными плазмидными ДНК pEK5 или pEK5H согласно фиг.2, содержащими ген целевого полипептида, слитый с геном сигнального пептида OmpA, ориджин репликации pUC ori, ген устойчивости к канамицину и ген, кодирующий lac-репрессор под контролем Т7-промотора, причем рекомбинантная плазмидная ДНК рЕК5Н дополнительно содержит между генами OmpA и целевого полипептида участки, кодирующие аминокислотные последовательности НННННН и DDDDK.
2. Способ получения рекомбинантного полипептида по п.1, заключающийся в том, что экспрессию гена осуществляют путем культивирования клеток в среде LB, содержащей 40-50 мкг/мл канамицина до уровня плотности 0,4-0,6 OD, затем продолжают культивирование в присутствии 0,1-0,3 мМ изопропилтио-β-D-галактопиранозида до накопления продукта, и целевой полипептид выделяют из периплазмы клеток E.coli различными методами в зависимости от используемой встроенной рекомбинантной плазмидной ДНК.
3. Способ получения по пп.1 и 2, заключающийся в том, что выделение целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК рЕК5, осуществляют с помощью обращеннофазовой хроматографии.
4. Способ получения по пп.1 и 2, заключающийся в том, что выделение и дополнительную очистку целевого полипептида, полученного при культивировании клеток, трансформированных рекомбинантной плазмидной ДНК рЕК5Н, осуществляют катионообменной хроматографией на агарозном носителе, ферментативным расщеплением энтерокиназой и ионообменной хроматографией на сорбенте DEAE-Sepharose.
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА БЕЛКА ИЗ СЕМЕЙСТВА СТРЕССОВЫХ И ПРЕПАРАТ БЕЛКА HSP70, ПОЛУЧЕННЫЙ ЭТИМ СПОСОБОМ | 2005 |
|
RU2283128C1 |
| HUA L | |||
| et al., Kringle 5 causes cell cycle arrest and apoptosis of endothelial cells, 1999, Biomedical and biophysical Research Communications 258, 668-673 | |||
| ПРЕПАРАТ ЧЕЛОВЕЧЕСКОГО ЭНДОСТАТИНА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2004 |
|
RU2278688C1 |
| Приспособление для перевода железнодорожных стрелок с движущейся повозки | 1928 |
|
SU9771A1 |
| KALPESH OZA, Cloning of a DNA repair gene (uvsF) from Aspergillus, A thesis | |||
Авторы
Даты
2013-07-27—Публикация
2012-03-22—Подача