Область техники, к которой относится изобретение
Настоящее изобретение относится к области медицины, в частности иммунологии, и молекулярной биологии и может быть использовано для разработки средств профилактики и лечения вирусных инфекционных заболеваний.
Уровень техники
Своевременная и доступная вакцинация от бешенства продолжает оставаться важным вопросом здравоохранения как в России, так и во всем мире. На сегодняшний день для предупреждения бешенства используют культуральную антирабическую вакцину (КАВ), которая представляет собой препараты инактивированного вируса бешенства, выращенного в клеточных культурах или куриных эмбрионах. Такая вакцина иммуногенна и безопасна, но требует соблюдения строгих условий транспортировки, хранения (холодовая цепь), режима введения. Нарушение этих условий может приводить к снижению эффективности соответствующих препаратов. Поэтому сейчас разрабатываются различные рекомбинантные антирабические вакцины, среди которых важное место отводится ДНК-вакцинам [Стародубова Е.С., Преображенская О.В., Кузьменко Ю.В., Латанова А.А., Ярыгина Е.И., Карпов В.Л. 2015. Вакцины против бешенства: современное состояние и перспективы развития. Молекулярная биология, 49, 1-8]. К очевидным преимуществам препаратов ДНК-вакцин относятся достаточно простые технологии производства и нетребовательность к условиям хранения и транспортировки, что определяет их невысокую себестоимость.
В самом простом варианте ДНК-вакцина представляет собой плазмидный вектор, содержащий ген белка патогена и элементы, необходимые для транскрипции этого гена в клетках млекопитающих. ДНК-вакцины применяются для индукции протективного иммунного ответа против различных инфекций как на мелких животных, например грызунах, так и на животных более крупных видов [Powell K. 2004. DNA vaccines-back in the saddle again? Nat Biotechnol, 22, 799-801.; Breathnach C.C., Clark H.J., Clark R.C., Olsen C.W., Townsend H.G. and Lunn D.P. 2006. Immunization with recombinant modified vaccinia Ankara (rMVA) constructs encoding the HA or NP gene protects ponies from equine influenza virus challenge. Vaccine, 24, 1180-1190.; Bahloul C., Taieb D., Diouani M.F., Ahmed S.B., Chtourou Y., B'Chir В I., KTiarmachi H. and Dellagi K. 2006. Field trials of a very potent rabies DNA vaccine which induced long lasting virus neutralizing antibodies and protection in dogs in experimental conditions. Vaccine, 24, 1063-1072.]. Проводятся серии испытаний профилактических и терапевтических ДНК-вакцин против патогенов человека, таких как HIV-1 и HCV [Ulmer J.B., Wahren В. and Liu Μ.Α. 2006. DNA vaccines for HIV/AIDS. Curr Opin HIV AIDS, 1, 309-313.; Liu Z., Singh D.K., Sheffer D., Smith M.S., Dhillon S., Chebloune Y., Hegde R., Buch S. and Narayan O. 2006. Immunoprophylaxis against AIDS in macaques with a lentiviral DNA vaccine. Virology, 351, 444-454.; Ahlen G., Soderholm J., Tjelle T., Kjeken R., Frelin L., Hoglund U., Blomberg P., Fons M., Mathiesen I. and Sallberg M. 2007. In vivo electroporation enhances the immunogenicity of hepatitis С virus nonstructural 3/4A DNA by increased local DNA uptake, protein expression, inflammation, and infiltration of CD3+ Τ cells. J Immunol, 179, 4741-4753.].
В настоящее время разрабатываются и антирабические ДНК-вакцины, некоторые из них находятся на стадии клинических и доклинических испытаний [Kaur M., Garg R., Singh S. and Bhatnagar R. 2014. Rabies vaccines: where do we stand, where are we heading? Expert Rev Vaccines, 1-13.; Yang D.K., Kim H.H., Lee K.W. and Song J.Y. 2013. The present and future of rabies vaccine in animals. Clin Exp Vaccine Res, 2, 19-25.; Тучков И.В. and Никифоров A.K. 2010. ДНК-иммунизация против бешенства. Проблемы особо опасных инфекций, 104, 74-78.]. Для защиты организма от бешенства необходимым и достаточным условием является наличие нейтрализующих антител к гликопротеину (G-белку) вируса, поэтому ДНК-вакцины разрабатываются на основе гена именного этого белка. Проводимые испытания демонстрируют, что антирабические ДНК-вакцины индуцируют иммунный ответ на гликопротеин, но не всегда способны обеспечить полную защиту от развития бешенства [Ferraro В., Morrow М.Р., Hutnick N.A., Shin Т.Н., Lucke СЕ. and Weiner D.B. 2011. Clinical applications of DNA vaccines: current progress. Clin Infect Dis, 53, 296-302.].
Так, например, было показано, что генная иммунизация мышей плазмидой, кодирующей гликопротеин вируса бешенства штамма Внуково-32, индуцирует у всех животных антитела, но обеспечивает защиту от развития болезни с эффективностью до 90% [Fodor I., Kucsera L., Fodor Ν., Palfi V. and Grabko V.I. 2000. Gene immunization of mice with plasmid DNA expressing rabies virus glycoprotein. Acta Vet Hung, 48, 229-236]. Для повышения эффективности ДНК-вакцин используются различные подходы [Hutnick N.A., Myles D.J., Bian C.B., Muthumani K. and Weiner D.B. 2011. Selected approaches for increasing HIV DNA vaccine immunogenicity in vivo. Curr Opin Virol, 1, 233-240.; Saade F. and Petrovsky Ν. 2012. Technologies for enhanced efficacy of DNA vaccines. Expert Rev Vaccines, 11, 189-209.]. Один из них основан на оптимизации представленности кодонов в вирусном гене, составляющем основу ДНК-вакцины. Это позволяет значительно повысить экспрессию данного гена в клетках млекопитающих и увеличить количество белка-антигена, синтезируемого с ДНК-вакцины, что является важным фактором при формировании иммунного ответа. Так, на мышах было показано, что ДНК-вакцины с оптимизированными генами вируса папилломы человека [Cheung Y.K., Cheng S.C., Sin F.W. and Xie Y. 2004. Plasmid encoding papillomavirus Type 16 (HPV16) DNA constructed with codon optimization improved the immunogenicity against HPV infection. Vaccine, 23, 629-638], ВИЧ-1 [Megati S., Garcia-Hand D., Cappello S., Roopchand V., Masood Α., Xu R., Luckay Α., Chong S.Y., Rosati M, Sackitey S. et al. 2008. Modifying the HIV-1 env gpl60 gene to improve pDNA vaccine-elicited cell-mediated immune responses. Vaccine, 26, 5083-5094], респираторного синцитиального вируса [Temerte Ν., Tippler В., Uberla K. and Grunwald T. 2007. Immunogenicity and efficacy of codon optimized DNA vaccines encoding the F-protein of respiratory syncytial virus. Vaccine, 25, 7271-7279] и вируса гриппа [Tenbusch M., Grunwald T., Niezold T., Storcksdieck Genannt Bonsmann M., Hannaman D., Norley S. and Uberla K. 2010. Codon-optimization of the hemagglutinin gene from the novel swine origin H1N1 influenza virus has differential effects on CD4(+) T-cell responses and immune effector mechanisms following DNA electroporation in mice. Vaccine, 28, 3273-3277] индуцировали значительно более сильный и эффективный иммунный ответ как клеточный, так и гуморальный, а также обеспечивали лучшую защиту от вирусов.
Другой современный и эффективный подход по модификации вирусных антигенов заключается в составлении консенсусных последовательностей вирусных белков [Obeng-Adjei Ν., Hutnick N.A., Yan J., Chu J.S., Myles D.J., Morrow M.P., Sardesai N.Y. and Weiner D.B. 2013. DNA vaccine cocktail expressing genotype A and С HBV surface and consensus core antigens generates robust cytotoxic and antibody responses in mice and Rhesus macaques. Cancer Gene Ther, 20, 652-662.; Yan J., Villarreal D.O., Racine T., Chu J.S., Walters J.N., Morrow M.P., Khan A.S., Sardesai N.Y., Kim J.J., Kobinger G.P. et al. 2014. Protective immunity to H7N9 influenza viruses elicited by synthetic DNA vaccine. Vaccine, 32, 2833-2842; Latimer В., Toporovski R., Yan J., Pankhong P., Morrow M.P., Khan A.S., Sardesai N.Y., Welles SX., Jacobson J.M., Weiner D.B. et al. 2014. Strong HCV NS3/4a, NS4b, NS5a, NS5b-specific cellular immune responses induced in Rhesus macaques by a novel HCV genotype la/lb consensus DNA vaccine. Hum. Vaccin. Immunother., 10, 2357-2365]. Консенсус белка представляет собой аминокислотную последовательность, в каждом положении которой находится аминокислота, наиболее часто встречающая в выбранной популяции.
Консенсусные последовательности составляют для вирусов одного субтипа или для вирусов, циркулирующих на определенной территории. Показано, что вакцина на основе белков ВИЧ-1 отдельного изолята не эффективна против других изолятов ВИЧ-1, присутствующих в популяции [Yan J., Corbitt Ν., Pankhong P., Shin T., Khan Α., Sardesai Ν.Υ. and Weiner D.B. 2011. Immunogenicity of a novel engineered HIV-1 clade С synthetic consensus-based envelope DNA vaccine. Vaccine, 29, 7173-7181]. В то же время ДНК-вакцины на основе консенсусных последовательностей антигена способны вызывать иммунный ответ широкой специфичности и значительной интенсивности [Almeida R.R., Rosa D.S., Ribeiro S.P., Santana V.C., Kallas E.G., Sidney J., Sette Α., Kalil J. and Cunha-Neto E. 2012. Broad and cross-clade CD4+ T-cell responses elicited by a DNA vaccine encoding highly conserved and promiscuous HIV-1 M-group consensus peptides. PLoS One, 7, e45267]. Использование консенсуной последовательности белка env ВИЧ-1 дает гораздо более сильную и широкую активацию иммунного ответа [Liao Н.Х., Tsao С.Y., Alam S.M., Muldoon M., Vandergrift N., Ma В J., Lu X., Sutherland L.L., Scearce R.M., Bowman С.et al. 2013. Antigenicity and immunogenicity of transmitted/founder, consensus, and chronic envelope glycoproteins of human immunodeficiency virus type 1. J Virol, 87, 4185-4201].
На сегодняшний день консенсусных ДНК-вакцинных антигенов для вируса бешенства не предложено. Важно отметить, что в Российской Федерации антирабические ДНК-вакцины в настоящее время не разрабатываются. Можно указать лишь патент №2008355, опубл. 28.02.1994, а также работу [Fodor I., Kucsera L., Fodor Ν., Palfi V. and Grabko V.I. 2000. Gene immunization of mice with plasmid DNA expressing rabies virus glycoprotein. Acta Vet Hung, 48, 229-236], в которой было показано, что генная иммунизация мышей плазмидой, кодирующей гликопротеин вируса бешенства штамма Внуково-32, индуцирует у всех животных антитела, но обеспечивает защиту от развития болезни с эффективностью до 90%. В своей работе авторы использовали экспрессионный вектор pWS4 и фенольную очистку препаратов плазмидной ДНК, которыми иммунизировали мышей. В заявляемом нами изобретении ген гликопротеина вируса бешенства встраивался в экспрессионный вектор нового поколения pVAX1 и при очистке полученой ДНК-конструкции использовались современные технологии очистки плазмид на фирменных колонках, которые позволяют избавиться от эндотоксинов. Однако основное преимущество нашего изобретения заключается в том, что предложенная ДНК-конструкция создана на основе оптимизированного дизайна антигена - гликопротеина (белка G) вируса бешенства. Предложенный дизайн включает в себя создание консенсусной аминокислотной последовательности гликопротеина вируса бешенства и оптимизацию по представленности кодонов нуклеотидной последовательности гена, кодирующего этот белок.
Предложенное нами изобретение направлено на решение задачи, которая заключается в создании высокоэффективной, недорогой и стабильной ДНК-вакцины против бешенства. Поскольку количество белка-антигена, синтезируемого с ДНК-вакцины, и экспрессия соответствующего гена в клетках млекопитающих являются важными факторами при формировании иммунного ответа, мы разработали ДНК-конструкцию, проверка которой в трансформированных клетках человека продемонстрировала, что она обеспечивает достижение требуемых условий. Было показано, что в культуре клеток человека, трансфицированной вектором pVAX1, содержащем предложенную нами ДНК-конструкцию, синтезируется в 20 раз больше белка G, чем в контрольном эксперименте.
Раскрытие изобретения
В настоящем изобретении предложен оптимизированный дизайн гликопротеина (белок G) вируса бешенства для использования его в составе ДНК-вакцин. Предложенный модифицированный гликопротеин с консенсусной аминокислотной последовательностью SEQ ID NO 1, представляет собой территориально-адаптированный антиген, сконструированный с учетом аминокислотных последовательностей гликопротеина вирусов бешенства, зарегистрированных на территории РФ, и вакцинного штамма Внуково-32.
На основании полученной консенсусной аминокислотной последовательности составлена нуклеотидная кодон-оптимизированная последовательность гена такого модифицированного гликопротеина - нуклеотидная последовательность SEQ ID NO 2. В соответствии с предложенным дизайном аминокислотной и нуклеотидной последовательностей методами генной инженерии мы получили рекомбинантный ген длиной 1575 п.о., который был клонирован в вектор pVAX1 (фирма "Invitrogen" Cat. No V260-20), позволяющий экспрессировать этот ген в клетках млекопитающих. Проверка экспрессии полученного нами гена по оценке уровня накопления м-РНК показала, что предложенная нуклеотидная последовательность в трансфицированной культуре клеток человека обеспечивает двукратное увеличение экспрессии оптимизированного гена по сравнению с экспрессией гена вирусного гликопротеина штамма Внуково-32 в аналогичном векторе. Далее при анализе количества синтезируемого белка было показано, что накопление модифицированного белка G в 20 раз превышает количество контрольного белка, который синтезируется при использовании плазмиды, содержащей ген вирусного гликопротеина штамма Внуково-32. Таким образом, полученный модифицированный гликопротеин с консенсусной аминокислотной последовательностью является перспективным белком для использования в качестве ДНК-вакцинного антигена, а заявляемая ДНК-конструкция может быть использована при создании антирабических ДНК вакцин, эффективно работающих на территории РФ.
Краткое описание чертежей
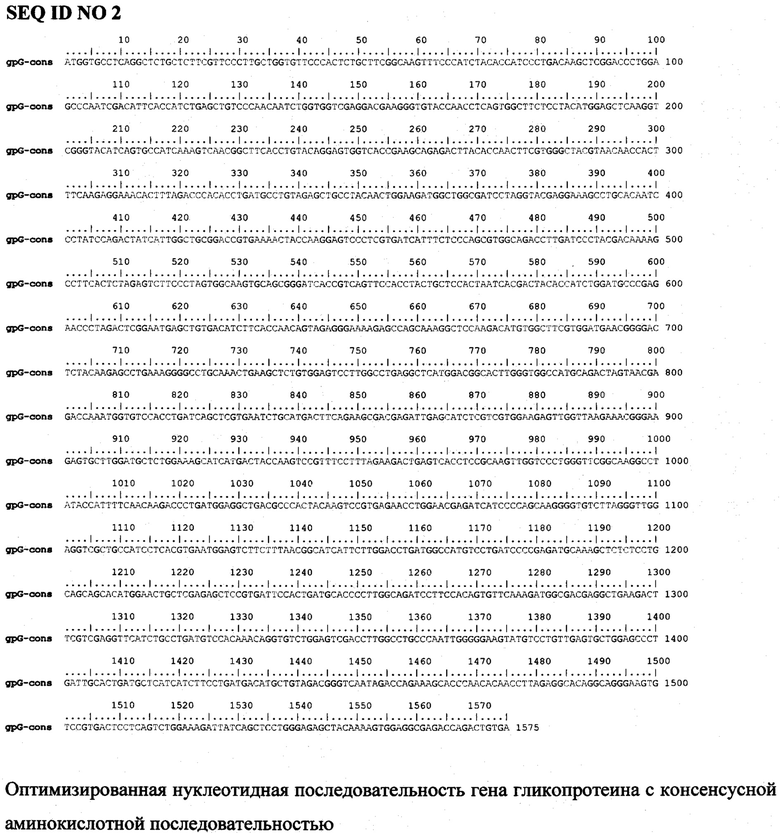
Фиг. 1. Показывает относительный уровень экспрессии м-РНК генов гликопротеина с плазмид pVAX-G-vn32 и pVAX-G-cons в трансфицированных клетках HeLa.
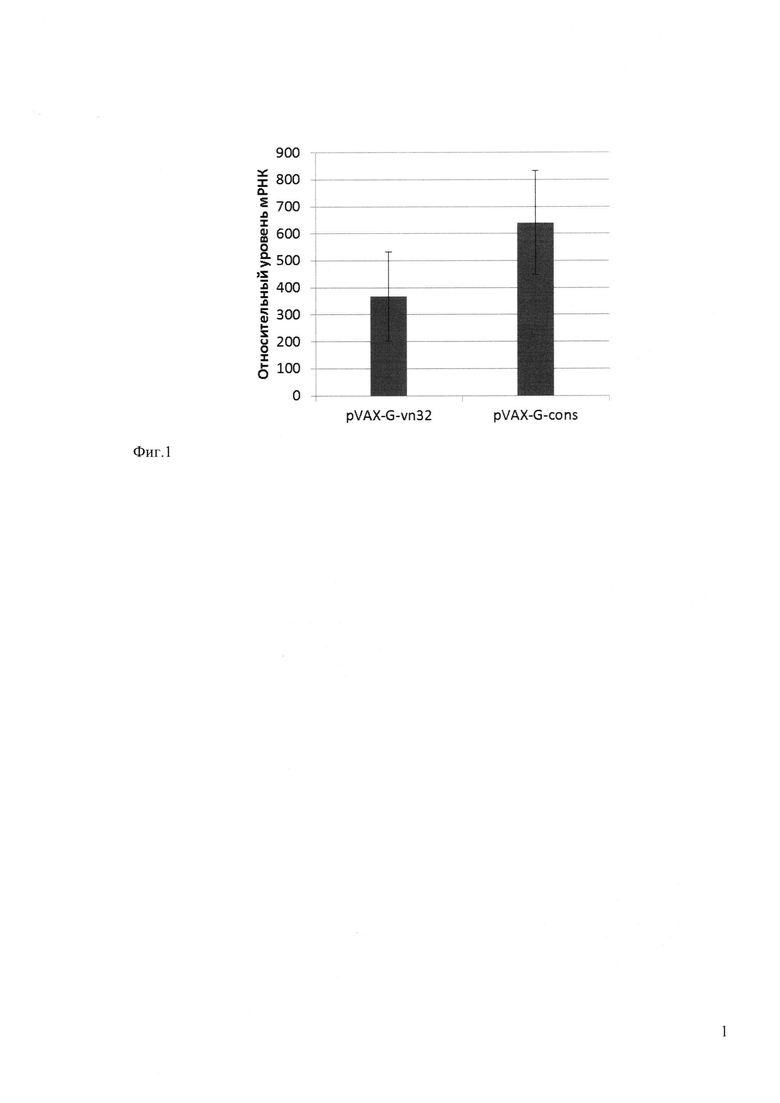
Фиг. 2. Показывает накопление вариантов гликопротеина в трансфицированных клетках HeLa. Приведены результаты иммуноблотинга белков лизатов клеток, трансфицированых ДНК-векторами: pVAX1 (дорожка 1), pVAX-gpG-vn-32 (дорожка 2), pVAX-G-cons (дорожка 3). Стрелкой указано положение гликопротеина, справа указано положение маркеров молекулярных масс. В качестве внутреннего контроля проводили вторичное окрашивание антителами к актину (нижнее поле).
Осуществление изобретения
1. Составление консенсусной аминокислотной последовательности вирусного антигена, что является необходимым этапом для получения антигена наиболее приближенного к штаммам вируса бешенства, циркулирующим на территории Российской Федерации
В ряде работ было показано, что использование для иммунизации вирусных антигенов с консенсусной последовательностью позволяет расширить специфичность узнавания различных штаммов. Для составления консенсусной последовательности был проведен поиск в базе данных Protein (http://www.ncbi.nlm.nih.gov/protein/) аминокислотных последовательностей выбранного антигена вируса бешенства. Данная база данных является наиболее полной, поскольку объединяет коллекцию последовательностей из различных источников, включающих открытые рамки считывая из аннотированных кодирующих участков в базах GenBank, RefSeq и TPA, а также записи из баз SwissProt, PIR, PRF и PDB.
В результате поиска были отобраны последовательности:
- содержащие полноразмерный антиген;
- полученные из образцов, зарегистрированных на территории Российской Федерации.
Было выявлено 126 аминокислотных последовательностей гликопротеина изолятов вируса бешенства, зарегистрированных на территории Российской Федерации. Полученные последовательности экспортированы из базы данных и проанализированы в программе BioEdit. Последовательности выровнены и построена консенсусная аминокислотная последовательность SEQ ID NO 1.
Данная консенсусная последовательность сравнивалась с последовательностью гликопротеина вакцинного штамма Внуково-32, зарегистрированной в GenBank: САА50713.1. Данный штамм используется для приготовления вакцинного препарата КОКАВ. Была обнаружена 21 аминокислотная замена:
L71S, M75V, N89T, L106F, S139H, R166K, V181I, А182Т, K206M, E224K, R297K, L358I, N389H, V415M, N444K, T468I, S486P, P488S, T506S, W507G, H506Y.
2. Составление оптимизированной по представленности кодонов нуклеотидной последовательности гена, кодирующего консенсусную аминокислотную последовательность антигена вируса бешенства
Оптимизация нуклеотидной последовательности гена позволяет повысить эффективность синтеза гликопротеина, что приводит к увеличению его накопления в клетке и тем самым позволяет повысить силу иммунного ответа.
Для составления нуклеотидной последовательности, оптимизированной по представленности кодонов, были использованы программы Gene Designer 2.0, и он-лайн ресурсы/ инструменты (Integrated DNA Technologies - http://eu.idtdna.com/CodonOpt, OPTIMIZER http://genomes.urv.es/OPTIMIZER/, EnCor Biotechnology Inc. - http://www.encorbio.com/protocols/Codon.htm, Entelechon - http://www.entelechon.com/2008/10/backtranslation-tool/). На основе составленной консенсусной аминокислотной последовательности гликопротеина изолятов вируса бешенства, циркулирующих на территории Российской Федерации, с использованием предложенных программ была составлена нуклеотидная последовательность, оптимизированная по представленности кодонов - последовательность SEQ ID NO 2.
3. Получение рекомбинантного гена модифицированного гликопротеина (G-cons) и клонирование его в вектор pVAX1
На основе данной нуклеотидной последовательности методами генной инженерии был получен рекомбинантный ген, кодирующий антиген вируса бешенства с консенсусной аминокислотной последовательностью. Сначала из синтетических олигонуклеотидов были получены фрагменты ДНК длиной 726 и 849 н.п., которые затем были соединены в полноразмерный ген gpG-cons длиной 1575 н.п. Ген gpG-cons был клонирован в вектор pVAX1, по сайтам BamHI EcoRI. Структуру нуклеотидной последовательности района вставки подтверждали секвенированием. Вектор, содержащий предложенную нами ДНК-конструкцию, был обозначен pVAX-G-cons, а используемый для сравнения вектор с геном, кодирующим гликопротеин вируса бешенства штамма Внуково-32 (Rabies virus mRNA for glyoprotein G GenBank: X71879.1), обозначен pVAX-G-vn32.
Были использованы стандартные способы молекулярного клонирования, включающие такие стадии, как ПЦР со специфическими праймерами, клонирование полученного фрагмента по выбранным сайтам рестрикции, трансформация клеток E.coli, выделение плазмиды методом щелочного лизиса и секвенирование полученных конструкций.
4. Препаративное выделение и очистка плазмиды
Выделение плазмидной ДНК в условиях пониженного содержания эндотоксинов проводилось с использованием ряда коммерчески доступных наборов EndoFree Plasmid Kit (Qiagen, США).
5. Проверка полученной ДНК-конструкции: экспрессия полученной ДНК-конструкции в клетках эукариот
А) Трансфекцию клеток HeLa проводили липосомным препаратом Lipofectamine LTX в сочетании с Plus реагентом (Invitrogen, США) в соответствии с рекомендациями фирмы изготовителя.
За день до трансфекции клетки рассевали на чашки Петри или планшеты из расчета - 3×105 клеток на мл среды. Так, при использовании чашки Петри диаметром 3.5 см в 250 мкл среды OPTI-MEM (Invitrogen, США) растворяли 3 мкл липосомного реагента. Затем туда добавляли комплекс, состоящий из 1 мкг плазмидной ДНК и 1 мкл Plus реагента, разведенных в 250 мкл OPTI-MEM. Полученную смесь инкубировали 30 мин при комнатной температуре. Добавляли 500 мкл DMEM и наносили на клеточный слой, который предварительно дважды промывали буфером PBS. Клетки инкубировали в СО2-инкубаторе 4 часа, после чего трансфицирующую смесь заменяли на полную ростовую среду DMEM, содержащую 10%-ную эмбриональную телячью сыворотку, и продолжали инкубацию клеток в стандартных условиях.
Б) Экспрессия генов гликопротеина оценивалась по уровню накопления м-РНК. Клетки HeLa трансфицировали плазмидами и через 2 суток из клеток выделяли РНК с помощью набора (GeneJet RNA PurificationKit, ThermoSci, США). Затем синтезировали кДНК с использованием обратной транскриптазы Mint (Евроген, Россия) и праймера олиго-Т (Thermo, США). Полученные образцы анализировали высокоспецифичной ПЦР в реальном времени с интеркалирующим красителем SYBR Green I с использованием реактивов qPCRmixHS-SYBR (Евроген, Россия). Для гена гликопротеина G-vn32 использовали праймеры (top-vn32 - 5'CGATCAGAACCTACGCAACAC, bot-vn32 - 5'TTCTCACAGTCTGGTCTCACC), для гена гликопротеина G-cons (top-cons-5'GCACCCAACACAACCTTAGAG, bot-cons 5'TGGTCTCGCCTCCACTTTTG). В качестве референсного гена использовали ген актина [Ivanov A.V., Smirnova О.А., Ivanova O.N., Masalova O.V., Kochetkov S.N. and Isaguliants M.G. 2011. Hepatitis С virus proteins activate NRF2/ARE pathway by distinct ROS-dependent and independent mechanisms in HUH7 cells. PLoS One, 6, е24957]. Обработку результатов проводили методом прямого сравнения данных 2-ΔΔCt [Schmittgen T.D. and Livak K.J. 2008. Analyzing real-time PCR data by the comparative C(T) method. Nat Protoc, 3, 1101-1108]. Данные, представленные на фигуре 1, демонстрируют, что уровень м-РНК, экспрессированной с кодон-оптимизированного гена, в 2 раза выше, чем количество м-РНК, полученной при использовании гена гликопротеина вирусного вакцинного штамма Внуково-32.
В) Оценка уровня накопления белков, кодируемых полученными ДНК-конструкциями.
Клетки HeLa также трансфицировали плазмидами, через 2 суток клетки лизировали и определяли содержание гликопротеинов с помощью иммуноблотинга, используя специфические антитела. Результаты, представленные на фигуре 2, показывают, что в лизатах трансфицированных клеток был детектирован белок с молекулярной массой 67 кДа, что соответствует ожидаемой массе гликозилированного гликопротеина [Kaur M., Rai A. and Bhatnagar R. 2009. Rabies DNA vaccine: no impact of MHC class I and class II targeting sequences on immune response and protection against lethal challenge. Vaccine, 27, 2128-2137]. При этом уровень накопления модифицированного гликопротеина в 20 раз выше, чем гликопротеина вакцинного штамма Внуково-32. Следует отметить, что уровень м-РНК модифицированного гликопротеина всего в 2 раза выше, чем у гликопротеина штамма Внуково-32. Поэтому можно предположить, что такое значительное повышение синтеза белка связано с более эффективной трансляцией м-РНК модифицированного гликопротеина, ген которого был оптимизирован по представленности кодонов. Таким образом, мы получили модифицированный антиген вируса бешенства - гликопротеин, который экспрессируется значительно эффективнее, чем гликопротеин вакцинного штамма Внуково-32. Такой модифицированный гликопротеин является перспективным белком для использования его в качестве ДНК-вакцинного антигена на территории Российской Федерации. Он может значительно повысить эффективность антирабической ДНК-вакцины и служить платформой для дальнейших модификаций, позволяющих изменять пути процессинга антигенов.

| название | год | авторы | номер документа |
|---|---|---|---|
| Генетическая конструкция на основе оптимизированного гена консенсусного гликопротеина вируса бешенства для профилактики бешенства | 2018 |
|
RU2707544C1 |
| Нуклеотидная последовательность, оптимизированная для экспрессии в бактериях консенсусного гликопротеина вируса бешенства | 2018 |
|
RU2717255C1 |
| ТРИМЕРИЗОВАННОЕ ОДНОДОМЕННОЕ АНТИТЕЛО, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ G ВИРУСА БЕШЕНСТВА, НЕЙТРАЛИЗУЮЩЕЕ ВИРУС БЕШЕНСТВА | 2013 |
|
RU2533802C1 |
| НЕЙТРАЛИЗУЮЩЕЕ МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СВЯЗЫВАЮЩЕЕСЯ С ГЛИКОПРОТЕИНОМ G ВИРУСА БЕШЕНСТВА, ФРАГМЕНТЫ ДНК, КОДИРУЮЩИЕ УКАЗАННОЕ АНТИТЕЛО, И АНТИГЕНСВЯЗЫВАЮЩИЙ ФРАГМЕНТ | 2017 |
|
RU2718835C2 |
| Рекомбинантный слитый белок, специфически связывающий и нейтрализующий вирус бешенства, способ его получения и применение | 2023 |
|
RU2829507C1 |
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ СИНТЕЗ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PVG18-1, КОДИРУЮЩАЯ ГЛИКОПРОТЕИН G ВИРУСА БЕШЕНСТВА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА | 1991 |
|
RU2008355C1 |
| НАБОР СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ ДЛЯ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА И СПОСОБ ВЫЯВЛЕНИЯ РНК ВИРУСА БЕШЕНСТВА С ПОМОЩЬЮ СИНТЕТИЧЕСКИХ ОЛИГОНУКЛЕОТИДНЫХ ПРАЙМЕРОВ В ПОЛИМЕРАЗНОЙ ЦЕПНОЙ РЕАКЦИИ С ОБРАТНОЙ ТРАНСКРИПЦИЕЙ (ОТ-ПЦР) | 2014 |
|
RU2575088C1 |
| ГУМАНИЗИРОВАННЫЕ АНТИГЕНСВЯЗЫВАЮЩИЕ ФРАГМЕНТЫ (Fab) ПРОТИВ ВИРУСА БЕШЕНСТВА, ИЗОЛИРОВАННЫЙ ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ Fab ПРОТИВ ВИРУСА БЕШЕНСТВА, КЛЕТКА ДРОЖЖЕЙ, ТРАНСФОРМИРОВАННАЯ ФРАГМЕНТОМ ДНК, И СПОСОБ ПОЛУЧЕНИЯ Fab ПРОТИВ ВИРУСА БЕШЕНСТВА С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ | 2010 |
|
RU2440412C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПАССИВНОЙ ИММУНИЗАЦИИ ПРОТИВ БЕШЕНСТВА, ФАРМАЦЕВТИЧЕСКИЙ НАБОР, СПОСОБ ПРИМЕНЕНИЯ ФАРМАЦЕВТИЧЕСКОГО НАБОРА | 2016 |
|
RU2661028C2 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ФИКСИРОВАННОГО ВИРУСА БЕШЕНСТВА ШТАММА "МОСКВА 3253" | 2012 |
|
RU2511440C2 |
Настоящее изобретение относится к области иммунологии и молекулярной биологии. Предложена генетическая ДНК-конструкция, представленная нуклеотидной последовательностью SEQ ID NO 2, содержащей кодон-оптимизированный ген, кодирующий гликопротеин (белок G) вируса бешенства с консенсусной аминокислотной последовательностью SEQ ID NO 1, учитывающей разнообразие штаммов вируса бешенства, циркулирующих на территории РФ. Предложенная ДНК-конструкция в составе вектора pVAX1 обеспечивает в трансфицированной культуре клеток человека увеличение экспрессии гена белка G по сравнению с экспрессией гена вирусного белка G штамма Внуково-32 в аналогичном векторе. Предложенная ДНК-конструкция может быть использована для создания антирабической ДНК-вакцины, обеспечивающей эффективный синтез гликопротеина - основного антигена вируса бешенства - в клетках млекопитающих. 2 ил.
Генетическая (рекомбинантная) ДНК-конструкция, представленная нуклеотидной последовательностью SEQ ID NO 2, содержащей кодон-оптимизированный ген, который кодирует гликопротеин (белок G) вируса бешенства с консенсусной аминокислотной последовательностью SEQ ID NO 1, составленной с учетом аминокислотных последовательностей белка G, выделяемого из штаммов вируса бешенства, циркулирующих на территории РФ, предназначенная для получения антирабических вакцин и применения в диагностике бешенства.
| ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ СИНТЕЗ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА, РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PVG18-1, КОДИРУЮЩАЯ ГЛИКОПРОТЕИН G ВИРУСА БЕШЕНСТВА, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ГЛИКОПРОТЕИНА G ВИРУСА БЕШЕНСТВА | 1991 |
|
RU2008355C1 |
| US 0007901691 B2, 08.03.2011 | |||
| WO 2008071959 A1, 19.06.2008 | |||
| US 0007863041 B2, 04.01.2011 | |||
| ВАКЦИНА СОБАК ПРОТИВ БЕШЕНСТВА (ВАРИАНТЫ), СПОСОБ ВАКЦИНАЦИИ (ВАРИАНТЫ), НАБОР ДЛЯ ВАКЦИНАЦИИ (ВАРИАНТЫ) | 1997 |
|
RU2319504C2 |
| ТУЧКОВ И.В | |||
| и др | |||
| Тепловоз | 1924 |
|
SU3253A1 |
| Проблемы особо опасных инфекций, 2013, No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2017-07-28—Публикация
2015-11-25—Подача