ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
ЗАЯВЛЕНИЕ О ПРИОРИТЕТЕ
[0001] Настоящая заявка представляет собой заявку, частично продолжающую и испрашивающую приоритет на основании заявки на патент США 12/463374, поданной 8 мая 2009 г., содержание которой включено в настоящее описание посредством ссылки. Настоящая заявка также испрашивает приоритет на основании заявки на патент Китая №200910135997.0, поданной 8 мая 2009 г., содержание которой включено в настоящее описание посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к области фармацевтических композиций, способных проникать через один или более биологических барьеров, и способам применения указанных фармацевтических композиций для предупреждения, диагностирования и/или лечения состояния или заболевания у человека и животных, поддающегося лечению пептидами или родственными пептидам соединениями. Настоящее изобретение также относится к способам применения указанных фармацевтических композиций для скрининга новых потенциальных лекарственных средств и способам применения фармацевтических композиций для диагностирования состояния у биологического субъекта. Был разработан способ синтеза НРР/НРС (пролекарств с высокой степенью проникновения/композиций с высокой степенью проникновения) на основе пептидов от N-конца к С-концу.
УРОВЕНЬ ТЕХНИКИ
[0003] Пептиды представляют собой полимеры, образуемые путем соединения аминокислот амидными связями. Пептиды играют различные роли в биологической системе. Например, пептидный гормон представляет собой самую большую группу гормонов, модулирующих различные биологические процессы у биологических субъектов. Один нанограмм тиреотропин-высвобождающего гормона, введенный мыши путем инъекции, увеличивает поглощение йодида из крови щитовидной железой (R.L. Kisliuk, Principles of Medicinal Chemistry, 4th Ed., W.O. Foye, et al. Eds., Williams & Wilkins, 4th Ed. 1995, p.606). Тафтсин (Thr-Lys-Pro-Arg) стимулирует фагоцитоз и способствует антителозависимой клеточной цитотоксичности (V.A. Najjar, Mol. Cell. Biochem. 41, 1, 1981). Met-энкефалин (Tyr-Gly-Gly-Phe-Met), выделяемый головным мозгом и тонким кишечником, действует аналогично морфию в том отношении, что он связывается с тем же рецептором и обладает анальгетической активностью (J.R.Jaffe and W.R. Martin, в Pharmacological Basis of Therapeutics, A.G. Oilman, et al., Eds., New York, Pergamon Press, 1990, p.481). Другие примеры пептидных гормонов включают, без ограничения, окситоцин (Pierce et al., J. Biol. Chem. 199. 929, 1952), вазопрессин (Kamm et al., J. Am. Chem. Soc. 50, 573, 1928), ангиотензин (J.C. Garrison and M.J. Peach в Pharmacological Basis of Therapeutics, A.G. Gilman, et al., Eds., New York, Pergamon Press, 1990, p.749), гастрин (P.C. Emson and B.E.B. Sandberg, Annu, Rep.Med. Chem., 18, 31, 1983), соматостатин (A.V. Schally, et al., Annu. Rev. Biochem., 47, 89, 1978), динорфин (M.G. Weisskopf, et al., Nature, 362. 423, 1993), эндотелии (A.M. Doherty, J. Med. Chem., 35, 1493, 1992), секретин (Е. Jorper, Gastroenterology, 55, 157, 1968), кальцитонин (M.V.L. Ray, et al.. Biotechnology, Ц, 64, 1993), инсулин (F. Sanger, Br. Med. Bull., 16, 183, 1960) и стимулирующий компетентность пептид (CSP).
[0004] Другая группа пептидов представляет собой противомикробные пептиды, которые, как было обнаружено, участвуют во врожденном иммунитете у широкого круга организмов (Reddy et al. 2004). Данные и другие пептиды привлекли большой интерес вследствие их потенциальной пригодности для лечения инфекций, особенно из-за того, что они зачастую эффективны против бактериальных штаммов, которые стали устойчивыми к традиционным антибиотикам. Один из хорошо известных классов противомикробных пептидов представляет собой тахиплезины (tachyplesins). Другой класс противомикробных пептидов представляет собой гистатиновые пептиды и производные. Другой класс противомикробных пептидов представляет собой гепсидин, который также называют LEAP-1, в случае экспрессируемого печенью противомикробного пептида.
[0005] Другая группа пептидов представляет собой связывающие кальций пептиды, которые специфично связываются с кальцинированными поверхностями. Один из примеров связывающего кальций пептида содержит повторяющуюся последовательность из трех аминокислот (X-Y-Z)n, где×представляет собой аспарагиновую кислоту, глутаминовую кислоту, аспарагин, аланин или глутамин, Y и Z представляют собой аланин, серин, треонин, фосфосерин или фосфотреонин, и n представляет собой число от 1 до 40.
[0006] К сожалению, пептиды и родственные пептидам соединения быстро протеолизируются протеолитическими ферментами. При пероральном приеме пептидов и родственных пептидам соединений они будут протеолизированы в течение нескольких минут. Другие виды системного введения пептидов и родственных пептидам соединений являются болезненными и во многих случаях требуют частых и дорогостоящих посещений клиники для лечения хронических состояний.
[0007] Следовательно, в данной области техники существует необходимость в разработке новых композиций, которые могут быть эффективно и действенно доставлены к эпицентру состояния (например, заболевания) для предупреждения, уменьшения или лечения состояний, а также минимизации нежелательных побочных эффектов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] Один аспект настоящего изобретения относится к пролекарству с высокой степенью проникновения (НРР) или композиции с высокой степенью проникновения (НРС), содержащей функциональную единицу, ковалентно связанную с транспортной единицей посредством линкера. В настоящем описании термины «НРР» и «НРС» используются по отдельности или вместе и являются взаимозаменяемыми, если специально не указано.
[0009] В некоторых вариантах реализации функциональная единица НРР или НРС содержит фрагмент агента, причем необходима эффективная и действенная доставка указанного агента биологическому субъекту и/или перенос указанного агента через один или более биологических барьеров.
[0010] В некоторых вариантах реализации функциональная единица может быть гидрофильной, липофильной или амфифильной (т.е. как гидрофильной, так и липофильной). Например, липофильная природа функциональной единицы может быть присущей соединению или достигнутой путем превращения гидрофильных фрагментов функциональной единицы в липофильные фрагменты.
[0011] В некоторых вариантах реализации функциональная единица НРР или НРС содержит фрагмент пептида или родственного пептиду соединения. Родственное пептиду соединение представляет собой соединение, содержащее пептидную структуру, пептидный метаболит или агент, который может быть метаболизирован в пептид или пептидный метаболит после проникновения НРР или НРС через один или более биологических барьеров. Родственное пептиду соединение также включает соединение, представляющее собой аналог или миметик пептида или пептидного метаболита, или агент, который может быть метаболизирован в аналог или миметик пептида или пептидного метаболита после проникновения НРР или НРС через один или более биологических барьеров. Примеры пептидов включают, но не ограничиваются ими, пептидные гормоны (например,
тиреотропин-высвобождающий гормон, тафтсин (Thr-Lys-Pro-Arg), met-энкефалин (Tyr-Gly-Gly-Phe-Met), окситоцин, ангиотензин, гастрин, соматостатин, динорфин, эндотелин, секретин, кальцитонин и инсулин), энтеростатины (например, Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR) и Ala-Pro-Gly-Pro-Arg (APGPR)), Меланокортин II (цикло(l,6)-Ac-Nle-Asp-His-Phe-Arg-Тrp-Lys-OH), опиоидные пептиды (например, Met-энкефалин (H-Tyr-Gly-Gly-Phe-Met-OH), Leu-энкефалин (Н-Tyr-Gly-Gly-Phe-Leu-OH), H-Tyr-D-Ala-Gly-N-Me-Phe-Met(0)-OL и H-Tyr-D-Ala-Gly-Phe-Leu-OH), нейропептиды, алкалоиды, противовоспалительные пептиды, противомикробные пептиды (например, стимулирующие компетентность пептиды, тахиплезины, гистатиновые пептиды и производные), связывающие кальций пептиды, регуляторные пептиды, пептидные вакцины и миметики пептидов (например, имитаторы α-спирали и имитаторы β-слоя).
[0012] В некоторых вариантах реализации транспортная единица НРР или НРС содержит способную к протонированию аминогруппу, которая способна облегчать или усиливать перенос или переход НРР или НРС через один или более биологических барьеров. В некоторых вариантах реализации указанная способная к протонированию аминогруппа по существу протонируется при рН биологических барьеров, через которые проникает НРР или НРС. В некоторых вариантах реализации аминогруппа может обратимо протонироваться или депротонироваться.
[0013] В некоторых вариантах реализации линкер ковалентно связывает функциональную единицу с транспортной единицей НРР или НРС и содержит связь, способную к расщеплению после прохождения НРР или НРС через один или более биологических барьеров. Указанная расщепляемая связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, сложнотиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связь. [0014] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей по меньшей мере одно НРР или НРС пептида или родственного пептиду соединения и фармацевтически приемлемый носитель. [0015] Другой аспект настоящего изобретения относится к способу проникновения через биологический барьер с применением НРР или НРС пептида или родственного пептиду соединения.
[0016] Другой аспект настоящего изобретения относится к способу диагностирования начала, развития или ремиссии состояния у биологического субъекта путем применения НРР или НРС пептида или родственного пептиду соединения. В некоторых вариантах реализации может быть детектировано НРР (или НРС) или его функциональная единица. В некоторых вариантах реализации НРР/НРС или функциональная единица НРР/НРС является изначально детектируемой, меченой или конъюгированной с детектируемым маркером.
[0017] Другой аспект настоящего изобретения относится к способу скрининга функциональных единиц, линкеров или транспортных единиц на предмет требуемых характеристик.
[0018] Другой аспект настоящего изобретения относится к способу предупреждения, облегчения или лечения состояния у биологического субъекта путем введения указанному субъекту композиции согласно настоящему изобретению. В некоторых вариантах реализации указанный способ относится к лечению состояния у субъекта, поддающегося лечению пептидами или родственными пептидам соединениями, путем введения указанному субъекту терапевтически эффективного количества пептидного НРР/НРС или его фармацевтической композиции. В некоторых вариантах реализации состояния, поддающиеся лечению указанным способом, включают, без ограничения, боль, травмы, связанные с воспалением состояния, связанные с микроорганизмами состояния, связанные с нейропептидами состояния, связанные с гормонами состояния, опухоль, аномальное кровяное давление, ожирение, травмы головного мозга, аллергию, мужскую и женскую половую дисфункцию, метастазирование и другие состояния, связанные с: тафтсином, дородовым, послеродовым периодом, видами активности против AD, видами антидиуретической активности, гомеостазом кальция, меланоцитом, высвобождением гормонов, агрегацией тромбоцитов, активностью ЦНС и фагоцитозом.
[0019] В некоторых вариантах реализации фармацевтическую композицию НРР/НРС вводят биологическому субъекту различными способами, включающими, но не ограничивающимися ими, пероральный, энтеральный, трансбуккальный, назальный, топический, ректальный, вагинальный, аэрозольный, трансмукозальный, эпидермальный, трансдермальный, дермальный, офтальмологический способ, способ введения через легкие, подкожный и/или парентеральный способ. В некоторых предпочтительных вариантах реализации фармацевтическую композицию НРР вводят перорально, трансдермально, местно, подкожно и/или парентерально.
[0020] В соответствии с преимуществами настоящего изобретения, не желая быть ограниченными рамками какого-либо конкретного механизма, терапевтически эффективное количество НРР или НРС может быть введено местно в эпицентр с меньшей дозой при более высокой концентрации. Преимущества настоящего изобретения также включают, например, избежание системного введения, уменьшение нежелательных эффектов (например, боли при инъекции, действий на желудочно-кишечный тракт/почки и другого побочного эффекта) и возможные новые виды лечения вследствие высокой местной концентрации НРР, НРС или активного агента. Преимущества также включают, например, системное введение НРР или НРС биологическому субъекту с достижением более быстрой и более эффективной биодоступности, проникновение через биологические барьеры (например, гематоэнцефалический барьер), через которые было трудно проходить, и новые показания благодаря прохождению через биологические барьеры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0021] Фиг.1: Структуры: Структура 2, Структура 3, Структура 4, Структура 5, Структура 6, Структура 7, Структура 8, Структура 9, Структура 10, Структура 11, Структура 12, Структура 13, Структура 14, Структура 15, Структура 16, Структура 17, Структура 18, Структура 19, Структура 20, Структура 21, Структура 22, Структура 23, Структура 24, Структура 25, Структура 26, Структура 27, Структура 28, Структура 29, Структура 30, Структура 31, Структура 32, Структура 33, Структура 34, Структура 35, Структура 36, Структура 37, Структура 38, Структура 39, Структура 40, Структура 41, Структура 42, Структура 43, Структура 44, Структура 45, Структура 46, Структура 47, Структура 48, Структура 49, Структура 50, Структура 51, Структура 52, Структура 53, Структура 54, Структура 55, Структура 56, Структура 57, Структура 58, Структура 59, Структура 60, Структура 61, Структура 62, Структура 63, Структура 64, Структура 65, Структура 66, Структура 67, Структура 68, Структура 69, Структура 70, Структура 71, Структура 72, Структура 73, Структура 74, Структура 75, Структура 76, Структура 77, Структура 78, Структура 79, Структура 80, Структура 81, Структура 82, Структура 83, Структура 84, Структура 85, Структура 86, Структура 87, Структура 88, Структура 89, Структура 90, Структура 91, Структура 92, Структура 93, Структура 94, Структура 95, Структура 96, Структура 97, Структура 98, Структура 99, Структура 100, Структура 101, Структура 102, Структура 103, Структура 104, Структура 105, Структура 106, Структура 107, Структура 108, Структура 109, Структура 110, Структура 111, Структура 112, Структура 113, Структура 114, Структура 115, Структура 116, Структура 117, Структура 118, Структура 119, Структура 120, Структура 121, Структура 122, Структура 123, Структура 124, Структура 125, Структура 126, Структура 127, Структура 128, Структура 129, Структура 130, Структура 131, Структура 132, Структура 133, Структура 134, Структура 135, Структура 136, Структура 137, Структура 138, Структура 139, Структура 140, Структура 141, Структура 142, Структура 143, Структура 144, Структура 145, Структура 146, Структура 147, Структура 148, Структура 149, Структура 150, Структура 151, Структура 152, Структура 153, Структура 154, Структура 155, Структура 156, Структура 157, Структура 158, Структура 159, Структура 160, Структура 161, Структура 162, Структура 163, Структура 164, Структура 165, Структура 166, Структура 167, Структура 168, Структура 169, Структура 170, Структура 171, Структура 172, Структура 173, Структура 174, Структура 175, Структура 176, Структура 177, Структура 178, Структура 179, Структура 180, Структура 181, Структура 182, Структура 183, Структура 184, Структура 185, Структура 186, Структура 187, Структура 188, Структура 189, Структура 190, Структура 191, Структура 192, Структура 193, Структура 194, Структура 195, Структура 196, Структура 197, Структура 198, Структура 199, Структура 200, Структура 201, Структура 202, Структура 203, Структура 204, Структура 205, Структура 206, Структура 207, Структура 208, Структура 209, Структура 210, Структура 211, Структура 212, Структура 213, Структура 214, Структура 215, Структура 216, Структура 217, Структура 218, Структура 219, Структура 220, Структура 221, Структура 222, Структура 223, Структура 224, Структура 225, Структура 226, Структура 227, Структура 228, Структура 229, Структура 230, Структура 231, Структура 232, Структура 233, Структура 234, Структура 235, Структура 236, Структура 237, Структура 238, Структура 239, Структура 240, Структура 241, Структура 242, Структура 243, Структура 244, Структура 245, Структура 246, Структура 247, Структура 248, Структура 249, Структура 250, Структура 251, Структура 252, Структура 253, Структура 254, Структура 255, Структура 256, Структура 257, Структура 258, Структура 259, Структура 260, Структура 261, Структура 262, Структура 263, Структура 264, Структура 265, Структура 266, Структура 267, Структура 268, Структура 269, Структура 270, Структура 271, Структура 272, Структура 273, Структура 274, Структура 275, Структура 276, Структура 277, Структура 278, Структура 279, Структура 280, Структура 281, Структура 282, Структура 283, Структура 284, Структура 285, Структура 286, Структура 287, Структура 288, Структура 289, Структура 290, Структура 291, Структура 292, Структура 293, Структура 294, Структура 295, Структура 296, Структура 297, Структура 298, Структура 299, Структура 300, Структура 301, Структура 302, Структура 303, Структура 304, Структура 305, Структура 306, Структура 307, Структура 308, Структура 309, Структура 310, Структура 311, Структура 312, Структура 313, Структура 314, Структура 315, Структура 316, Структура 317, Структура 318, Структура 319, Структура 320, Структура 321, Структура 322, Структура 323, Структура 324, Структура 325, Структура 326, Структура 327, Структура 328, Структура 329, Структура 330, Структура 331, Структура 332, Структура 333, Структура 334, Структура 335, Структура 336, Структура 337, Структура 338, Структура 339, Структура 340, Структура 341, Структура 342, Структура 343, Структура 344 и Структура 345.
[0022] Фиг.2: Суммарные количества Ac-Tyr(Ac)-Gly-Gly-Phe-Met-OCH2CH2N(СН2СН3)2⋅HCl, HCl⋅(CH3)2NCH2CH2CH2CO-Tyr(Ac)-Gly-Gly-Phe-Met-ОСН2СН2СН2СН3, цикло(1,6)-Ac-Nle-Asp-His-Phe-ArgOwAc)-Trp-Lys-OCH2CH2N(СН2СН3)2⋅HCl, цикло(1,6)-H-Nle-Asp-His-D-Phe(4-I)-Arg(Ac)-Trp-Lys-NH2⋅HCl, цикло(116)-H-Nle-Asp-His-D-Ala(2-нафтил)-Arg(NO2)-Trp-Lys-NH2⋅HCl, Ac-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2N(CH2CH3)2⋅HCl, Ac-Tyr-Gly-Gly-Phe-Met-OH, цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg-Trp-Lys-OH, цикло(1,6)-Ac-Nle-Asp-His-D-Phe(4-1)-Arg-Trp-Lys-NH2 и H-Val-Pro-Gly-Pro-Arg-OH, проходящие через выделенную ткань кожи человека в ячейках Франца (n=5). В каждом случае носитель представлял собой фосфатный буфер рН 7,4 (0,2 М).
[0023] ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
I. Структуры пролекарства с высокой степенью проникновения (НРР) или композиции с высокой степенью проникновения (НРС) на основе пептида или родственного пептиду соединения.
[0024] Один аспект настоящего изобретения относится к пролекарству с высокой степенью проникновения (НРР) или композиции с высокой степенью проникновения (НРС). В настоящем описании термин «пролекарство с высокой степенью проникновения» или «НРР», или «композиция с высокой степенью проникновения» или «НРС» относится к композиции, содержащей функциональную единицу, ковалентно связанную с транспортной единицей посредством линкера.
[0025] Функциональная единица НРР/НРС, содержащая фрагмент исходного лекарственного средства, обладает следующими свойствами: 1) требуется доставка указанного исходного лекарственного средства или НРР/НРС биологическому субъекту и/или перенос исходного лекарственного средства через биологический барьер, 2) НРР/НРС способна проникать или проходить через биологический барьер и 3) НРР/НРС способна к расщеплению таким образом, что фрагмент исходного лекарственного средства превращается в исходное лекарственное средство или метаболит исходного лекарственного средства.
[0026] В некоторых вариантах реализации функциональная единица может быть гидрофильной, липофильной или амфифильной (гидрофильной и липофильной). Липофильный фрагмент указанной функциональной единицы может быть присущим соединению или достигнутым путем превращения одного или более гидрофильного фрагмента функциональной единицы в липофильный фрагмент. Например, липофильный фрагмент функциональной единицы получают путем превращения одной или более гидрофильных групп указанной функциональной единицы в липофильные группы посредством органического синтеза. Примеры гидрофильных групп включают, без ограничения, карбоксильные, гидроксильные, тиольные группы, аминогруппы, фосфатные/фосфонатные и карбонильные группы. Липофильные фрагменты, получаемые посредством модификации данных гидрофильных групп, включают, без ограничения, простые эфиры, простые тиоэфиры, сложные эфиры, сложные тиоэфиры, карбонаты, карбаматы, амиды, фосфаты и оксимы. В некоторых вариантах реализации функциональную единицу липофилизируют путем ацетилирования. В некоторых вариантах реализации функциональную единицу липофилизируют путем этерификации.
[0027] В некоторых вариантах реализации исходное лекарственно средство НРР или НРС выбрано из группы, состоящей из пептида и родственного пептиду соединения. Группа пептида или родственного пептиду соединения также может быть превращена в липофильный фрагмент, как описано выше. В настоящем описании термин «пептидное НРР/НРС» относится к НРР или НРС пептида или родственного пептиду соединения. В настоящем описании термин «пептидные НРР/НРС» относится к НРР или НРС пептидов или родственных пептидам соединений.
[0028] Пептиды хорошо известны в данной области техники и их применяют для различных состояний. В настоящем описании термин «пептид» относится к последовательности аминокислот, причем длина указанной последовательности составляет от примерно 2 до примерно 50 аминокислот. Например, пептид может содержать 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или более аминокислот. Пептид может содержать как D-аминокислоты, так/или L-аминокислоты.
[0029] Аминокислота представляет собой соединение, содержащее как функциональные аминогруппы, так и карбоксильные группы. Атом углерода рядом с карбонильной группой функциональной карбоксильной группы называют альфа-углеродным атомом. Аминокислоты с боковой цепью, связанной с альфа-углеродным атомом, называют альфа-аминокислотами. В аминокислотах, содержащих аминогруппу и углеродную цепь, присоединенную к альфа-углеродному атому, атомы углерода обозначают по порядку альфа, бета, гамма и т.д. от карбонильного атома углерода. Аминокислота, содержащая аминогруппу, присоединенную к бета- или гамма-углеродному атому, называют бета- или гамма-аминокислотой соответственно и т.д.
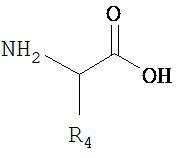
[0030] Альфа-аминокислота представляет собой аминокислоту, содержащую амино- и карбоксилатные группы, связанные с одним и тем же атомом углерода (альфа-углеродным атомом). Альфа-углеродный атом представляет собой первый атом от карбоксилатной группы. Альфа-аминокислота обладает структурой, соответствующей Структуре 1:
H2NCHR'COOH
Структура 1
включая ее стереоизомеры и фармацевтически приемлемые соли, где:
R' выбран из группы, состоящей из замещенных и незамещенных имидазолильных, замещенных и незамещенных гуанидино-, замещенных и незамещенных карбоксильных, замещенных и незамещенных карбоксамидных, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино-, замещенных и незамещенных алкилкарбонильных, замещенных и незамещенных перфторалкильных, замещенных и незамещенных алкилгалогенидных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп.
[0031] В некоторых вариантах реализации аминокислота имеет Структуру 1, включая ее стереоизомеры и фармацевтически приемлемые соли, где:
R' выбран из группы, состоящей из Н-, СН3, HN=C(NH2)-NH-(CH2)3-, H2N-CO-CH2-, НООС-СН2-, HS-CH2-, H2N-CO-(CH2)2-, HS-(CH2)2-, HOOC-(CH2)2-, СН3-СН2-СН(СН3)-, (СН3)2СН-СН2-, H2N-(CH2)4-, СН3-S-(СН2)2-, фенил-СН2-, НО-СН2-, СН3-СН(ОН)-, 4-ОН-фенил-CH2-, СН3-СН(СН3)-, 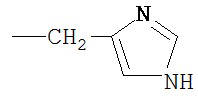 ,
, 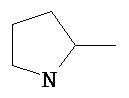 ,
, 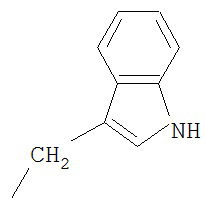 и производных указанных групп.
и производных указанных групп.
[0032] Примеры альфа-аминокислоты включают, без ограничения, аланин (Ala), аргинин (Arg), аспарагин (Asn), аспарагиновую кислоту (Asp), цистеин (Cys), глутаминовую кислоту (Glu), глутамин (Gin), глицин (Gly), гистидин (His), гомоцистеин (Нсу), гомосерин (Hse), изолейцин (Ile), лейцин (Leu), лизин (Lys), метионин (Met), норлейцин (Nie), норвалин (Nva), орнитин (Orn), пеницилламин (Pen), фенилаланин (Phe), пролин (Pro), серии (Ser), тирозин (Thr), треонин (Trp), триптофан (Tyr), валин (Val), пироглутаминовую кислоту (pGLU), динитробензилированный лизин (dnp-LYS}, фосфорилированный треонин (pTHR), фосфорилированный серин (pSER), фосфорилированный тирозин (pTYR), цитруллин (CIT), N-метилированный аланин (nme-ALA), N-метилированный изолейцин (nme-ILE), N-метилированный лейцин (nme-LEU), N-метилированный фенилаланин (nme-PHE), N-метилированный валин (nme-VAL), N-метилированный серин (nme-SER), N- метилированный треонин (nme-THR), N-метилированный тирозин (nme-TYR), альфа-аминомасляную кислоту (альфа-АВА), изоаспарагиновую кислоту (изо-ASP), ацетилированный лизин (Ac-LYS), 2-метилаланин (2-Me-ALA) и оксаминовую кислоту (ОХА).
[0033] Бета-аминокислота представляет собой аминокислоту, содержащую аминогруппу, связанную с бета-углеродным атомом, который представляет собой второй атом углерода от карбоксилатной группы. Примеры бета-аминокислоты включают, без ограничения, бета-аланин (β-Ala), бета-аргинин (β-Arg), бета-аспарагин (β-Asn), бета-аспарагиновую кислоту (β-Asp), бета-цистеин (β-Cys), бета-глутаминовую кислоту (β-Glu), бета-глутамин (β-Gln), бета-гистидин (β-His), бета-изолейцин (β-Ile), бета-лейцин (β-Leu), бета-лизин (β-Lys), бета-метионин (β-Met), бета-фенилаланин (β-Phe), бета-пролин (β-Pro), бета-серин (β-Ser), бета-тирозин (β-Thr), бета-треонин (β-Тrp), бета-триптофан (β-Tyr) и бета-валин (β-Val).
[0034] Гамма-аминокислота представляет собой аминокислоту, содержащую аминогруппу, связанную с гамма-углеродным атомом, который представляет собой третий атом углерода от карбоксилатной группы. Примеры гаммы-аминокислоты включают, без ограничения, гамма-глутаминовую кислоту (γ-GLU).
[0035] Родственное пептиду соединение представляет собой соединение, содержащее пептидную структуру, пептидный метаболит или агент, который может быть метаболизирован в пептид или пептидный метаболит после проникновения НРР/НРС через один или более биологических барьеров. Родственное пептиду соединение также включает соединение, представляющее собой аналог или миметик пептида или пептидного метаболита, или агент, который может быть метаболизирован в аналог или миметик пептида или пептидного метаболита после проникновения НРР/НРС через один или более биологических барьеров.
[0036] Примеры пептидов и родственных пептидам соединений включают, но не ограничиваются ими, пептидные гормоны, нейропептиды, алкалоиды, противомикробные пептиды, противовоспалительные пептиды, пептидные токсины, регуляторные пептиды, связывающие кальций пептиды, пептидные вакцины и миметики пептидов.
[0037] Пептидные гормоны представляют собой класс пептидов, обладающих эндокринными функциями у животных. Пептидные гормоны также идентифицируют в растениях и они играют важную роль во взаимодействии клеток и защите растений. Пептидные гормоны вырабатываются различными органами и тканями, например, сердцем (предсердный натрийуретический пептид (ANP), предсердный натрийуретический фактор (ANF)), поджелудочной железой (например, инсулин, энтеростатин, соматостатин), желудочно-кишечным трактом (холецистокинин, гастрин (например, гастрин-34, гастрин-17 и гастрин-14), опиоидные пептиды (например, Met-энкефалин, Leu-энкефалин, H-Tyr-D-Ala-Gly-N-Me-Phe-Met(0)-OL и H-Tyr-D-Ala-Gly-Phe-Leu-OH), холецистокинин, секретин, мотилин, вазоактивный кишечный пептид и энтероглюкагон), запасами жировой ткани (например, лептин), гипофизом (например, лютеинизирующий гормон, фолликулостимулирующий гормон, пролактин, адренокортикотропный гормон (АКТГ), гормон роста, антидиуретический гормон окситоцин, Меланокортин (например Меланокортин II)), щитовидной железой (например, кальцитонин), селезенкой (например, тафтсин), головным мозгом (например, окситоцин, динорфин), печенью (например, ангиотензин, ангиотензин I и ангиотензин II), эндотелием (например, эндотелии). Другие примеры пептидного гормона включают, без ограничения, тиреотропин-высвобождающий гормон (TRH) и брадикинин.
[0038] Нейропептиды представляют собой пептиды, обнаруживаемые в нервных тканях, которые включены в регуляторные процессы и процессы передачи сигнала. Примеры нейропептидов включают, без ограничения, нейромедиаторы (например, N-ацетиласпартилглутаминовая кислота, гастрин, холецистокинин, нейропептид Y, вазопрессин, окситоцин, секретин, Вещество Р, соматостатин, вазоактивный кишечный пептид (VIP), опиоиды (например, энкефалин, динорфин, эндорфин), галанин, нейротензин, TRH, предсердный натрийуретический пептид.
[0039] Алкалоиды представляют собой пептиды, как правило, получаемые из растений, грибов и некоторых животных, таких как моллюски. Алкалоиды вовлечены в защиту одного организма от поглощения другими организмами. Примеры алкалоидов включают, без ограничения, эрготамин, пандамин (pandamine), динорфин А-(1-8)-октапептид, N бета-(D-Leu-D-Arg-D-Arg-D-Leu-D-Phe)-налтрексамин (naltrexamine).
[0040] Противомикробные пептиды представляют собой пептиды, ингибирующие рост микроорганизмов, таких как клетки бактерий, грибки и простейшие. Примеры противомикробных пептидов включают, без ограничения, бацитрацин, грамицидин, валиномицин, стимулирующие компетентность пептиды, тахиплезины, гистатиновые пептиды и их производные.
[0041] Примерами противовоспалительных пептидов являются пептиды, обладающие последовательностями Seq ID: 47, Seq ID: 48 и Seq ID: 49. (Таблица А)
[0042] Пептидные токсины представляют собой пептиды, которые являются ядовитыми. Примерами пептидных токсинов являются палутоксины, агатоксины и куртатоксины.
[0043] Регуляторные пептиды представляют собой пептиды, регулирующие один или более процессов у биологического субъекта. Примеры регуляторных пептидов включают, без ограничения, ан серии и карнозин.
[0044] Другие примеры пептидов и родственных пептидам соединений включают связывающие кальций пептиды, пептидные вакцины [например, p45(IEIGLEGKGFEPTLEALFGK) и Р210 (KTTKQSFDLS VKAQY KKNKH)] и миметики пептидов (например, имитаторы α-спирали и имитаторы β-слоя).
[0045] В некоторых вариантах реализации функциональная единица пептидного НРР/НРС содержит фрагмент, который обладает структурой, соответствующей Структуре F-1:
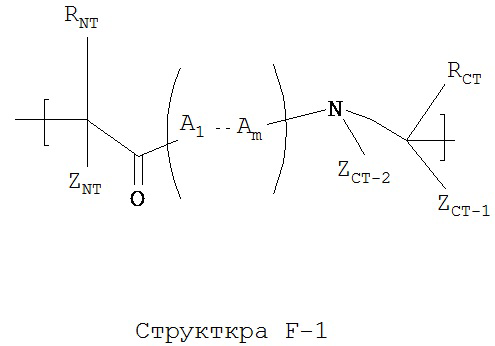
Структура F-1 включая ее стереоизомеры и фармацевтически приемлемые соли, где:
каждый из A1-Am независимо выбран из группы, состоящей из 2-нафтилаланина, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных остатков и Структуры А:
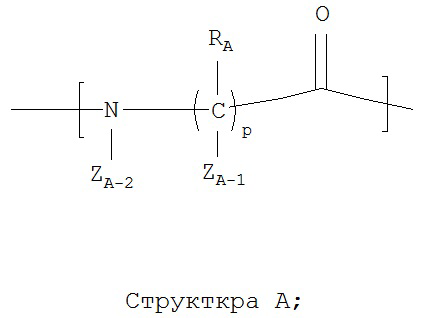
p в каждом A1-Am представляет собой независимо выбранное целое число;
ZA-1 при каждом атоме углерода каждого из A1-Am, ZA-2 для каждого из A1-Am, ZNT, ZCT-1 и ZCT-2 независимо выбраны из группы, состоящей из Н, СН3, C2H5, С3Н7, CF3, C2F5, C3F7, замещенного и незамещенного алкила, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида;
RA при каждом атоме углерода каждого из A1-Am, RNT и RCT выбраны из группы, состоящей из Н, замещенных и незамещенных имидазолильных, замещенных и незамещенных гуанидино-, замещенных и незамещенных карбоксильных, замещенных и незамещенных карбоксамидных, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино, замещенных и незамещенных алкилкарбонильных, замещенных и незамещенных перфторалкильных, замещенных и незамещенных алкилгалогенидных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп;
в случае, когда р группы A1-Am представляет собой целое число не меньше 2, RA при каждом атоме углерода может быть одинаковым или разным, ZA-1 при каждом атоме углерода может быть одинаковьм или разным;
функциональная амино- и карбоксильная группа в пептидной цепи может дополнительно образовывать лактамные мостики; и
тиольная группа может дополнительно образовывать дисульфидные мостики.
[0046] В некоторых вариантах реализации функциональная единица пептидного НРР/НРС содержит фрагмент, обладающий структурой, выбранной из группы, состоящей из Структуры F-1, определенной выше, включая ее стереоизомеры и фармацевтически приемлемые соли, где RA группы A1-Am может быть дополнительно липофилизирован путем ацетилирования или этерификации.
[0047] В некоторых вариантах реализации функциональная единица пептидного НРР/НРС содержит фрагмент, обладающий структурой, соответствующей Структуре F-1, определенной выше, включая ее стереоизомеры и фармацевтически приемлемые соли, где m выбран из группы, состоящей из 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 и 100.
[0048] В некоторых вариантах реализации функциональная единица пептидного НРР/НРС содержит фрагмент, обладающий структурой, соответствующей Структуре F-1, определенной выше, включая ее стереоизомеры и фармацевтически приемлемые соли, где р представляет собой 1, 2 или 3.
[0049] В некоторых вариантах реализации функциональная единица пептидного НРР/НРС содержит фрагмент, обладающий структурой, соответствующей Структуре F-1, определенной выше, включая ее стереоизомеры и фармацевтически приемлемые соли, где:
р представляет собой 1, 2 или 3;
ZA-1 при каждом атоме углерода каждого из A1-Am, ZA-2, для каждого из A1-Am, ZNT, ZCN-1 и ZCT-2 независимо выбраны из группы, состоящей из Н, СН3, С2Н5, С3Н7, CF3, C2F5, C3F7, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида;
RA при каждом атоме углерода каждого из A1-Am, ZNT и RCT выбраны из группы, состоящей из Н, замещенных и незамещенных имидазолильных, замещенных и незамещенных гуанидино-, замещенных и незамещенных карбоксильных, замещенных и незамещенных карбоксамидных, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкоксильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных групп, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино-, замещенных и незамещенных алкилкарбонильных, замещенных и незамещенных перфторалкильных, замещенных и незамещенных алкилгалогенидных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп;
в случае, когда р группы A1-Am представляет собой целое число не меньше 2, RA при каждом атоме углерода может быть одинаковым или разным, ZA-1 при каждом атоме углерода может быть одинаковым или разным;
функциональная амино- и карбоксильная группа в пептидной цепи может дополнительно образовывать лактамные мостики; и
тиольная группа может дополнительно образовывать дисульфидные мостики.
[0050] В настоящем описании термин «фармацевтически приемлемая соль» означает те соли соединений согласно настоящему изобретению, которые безопасны для применения у субъекта. Фармацевтически приемлемые соли включают соли кислых или основных групп, присутствующих в соединениях согласно настоящему изобретению. Фармацевтически приемлемые соли присоединения кислоты включают, но не ограничиваются ими, гидрохлоридные, гидробромидные, гидройодидные, нитратные, сульфатные, бисульфатные, фосфатные, кислые фосфатные, изоникотинатные, ацетатные, лактатные, салицилатные, цитратные, тартратные, пантотенатные, битартратные, аскорбатные, сукцинатные, малеатные, гентизинатные, фумаратные, глюконатные, глюкаронатные, сахаратные, формиатные, бензоатные, глутаматные, метансульфонатные, этансульфонатные, бензолсульфонатные, п-толуолсульфонатные и памоатные (т.е. 1,11-метилен-бис-(2-гидрокси-3-нафтоат)) соли. Некоторые соединения согласно настоящему изобретению могут образовывать фармацевтически приемлемые соли с различными аминокислотами.
Подходящие основные соли включают, но не ограничиваются ими, соли алюминия, кальция, лития, магния, калия, натрия, цинка и диэтаноламина. Для обзора фармацевтически приемлемых солей, см. BERGE ЕТ AL., 66 J. PHARM. SCI. 1-19 (1 977), содержание которого включено в настоящее описание посредством ссылки.
[0051] В настоящем описании, если не указано иное, термин «алкил» означает разветвленную или неразветвленную, насыщенную или ненасыщенную, одновалентную или поливалентную углеводородную группу, включая насыщенные алкильные группы, алкенильные группы и алкинильные группы. Примеры алкила включают, но не ограничиваются ими, метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил, этенил, пропенил, бутенил, изобутенил, пентенил, гексенил, гептенил, октенил, ноненил, деценил, ундеценил, додеценил, этинил, пропинил, бутинил, изобутинил, пентинил, гексинил, гептинил, октинил, нонинил, децинил, ундецинил, додецинил, метилен, этилен, пропилен, изопропилен, бутилен, изобутилен, трет-бутилен, пентилен, гексилен, гептилен, октилен, нонилен, децилен, ундецилен и додецилен. В некоторых вариантах реализации углеводородная группа содержит от 1 до 30 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 20 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 12 атомов углерода.
[0052] В настоящем описании, если не указано иное, термин «циклоалкил» означает алкил, содержащий по меньшей мере одно кольцо и не содержащий ароматические кольца. Примеры циклоалкила включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил, циклодецил, циклоундецил и циклододецил. В некоторых вариантах реализации углеводородная цепь содержит от 1 до 30 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 20 атомов углерода. В некоторых вариантах реализации углеводородная группа содержит от 1 до 12 атомов углерода.
[0053] В настоящем описании, если не указано иное, термин «гетероциклоалкил» означает циклоалкил, в котором по меньшей мере один атом кольца представляет собой неуглеродный атом. Примеры неуглеродного атома кольца включают, но не ограничиваются ими, S, О и N.
[0054] В настоящем описании, если не указано иное, термин «алкоксил» означает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов кислорода. Примеры алкоксила включают, но не ограничиваются ими, -СН2-ОН, -ОСН3, -O-алкил, -алкил-ОН, -алкил-O-алкил-, где указанные два алкила могут быть одинаковыми или разными.
[0055] В настоящем описании, если не указано иное, термин «алкилгалогенид» означает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов галогена, причем указанные атомы галогена могут быть одинаковыми или разными. Термин «галоген» означает фтор, хлор, бром или йод. Примеры алкилгалогенида включают, но не ограничиваются ими, -алкил-F, -алкил-Cl, -алкил-Br, -алкил-I, -алкил(F)-, -алкил(Cl)-, -алкил(Br)- и -алкил(I)-.
[0056] В настоящем описании, если не указано иное, термин «алкилтио» означает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов серы. Примеры алкилтио включают, но не ограничиваются ими, -CH2-SH, -SCH3, -S-алкил, -алкил-SH, -алкил-3-алкил-, где указанные два алкила могут быть одинаковыми или разными.
[0057] В настоящем описании, если не указано иное, термин «алкиламино» означает алкил, циклоалкил или гетероциклоалкил, содержащий один или более атомов азота. Примеры алкиламино включают, но не ограничиваются ими, -CH2-NH, -NCH3, -N(алкил)-алкил, -N-алкил, -алкил-NH2, -алкил-N-алкил и -алкил-N(алкил)-алкил, причем указанные алкилы могут быть одинаковыми или разными.
[0058] В настоящем описании, если не указано иное, термин «алкилкарбонил» означает алкил, циклоалкил или гетероциклоалкил, содержащий одну или более карбонильных групп.Примеры алкилкарбонильной группы включают, но не ограничиваются ими, альдегидную группу (-R-C(O)-H), кетонную группу (-R-C(O)-R'), группу карбоновой кислоты (R-COOH), сложноэфирную группу (-R-COO-R'), карбоксамидную, (-R-COO-N(R')R"), еноновую группу (-R-C-(O)-C(R’)=C(R”)R'"), ацилгалогенидную группу (-R-C(O)-X) и группу ангидрида кислоты (-R-C(O)-O-C(O)-R'), где R, R', R" и R'" представляют собой одинаковый или разный алкил, циклоалкил или гетероциклоалкил.
[0059] В настоящем описании, если не указано иное, термин «перфторалкил» означает алкил, циклоалкил или гетероциклоалкил, содержащий одну или более групп фтора, включая, без ограничения, перфторметил, перфторэтил, перфторпропил.
[0060] В настоящем описании, если не указано иное, термин «арил» означает химическую структуру, содержащую одно или более ароматических колец. В некоторых вариантах реализации все атомы кольца представляют собой атомы углерода. В некоторых вариантах реализации один или более атомов кольца представляют собой неуглеродные атомы, например, атомы кислорода, азота или серы («гетероарил»). Примеры арила включают, без ограничения, фенил, бензил, нафталинил, антраценил, пиридил, хиноил, изохиноил, пиразинил, хиноксалинил, акридинил, пиримидинил, хиназолинил, пиридазинил, циннолинил, имидазолил, бензимидазолил, пуринил, индолил, фуранил, бензофуранил, изобензофуранил, пирролил, индолил, изоиндолил, тиофенил, бензотиофенил, пиразолил, индазолил, оксазолил, бензоксазолил, изоксазолил, бензизоксазолил, тиаксолил, гуанидино и бензотиазолил.
[0061] В некоторых вариантах реализации транспортная единица НРР/НРС содержит способную к протонированию аминогруппу, способную облегчать перенос или переход НРР/НРС через один или более биологических барьеров (например, в>примерно 10 раз,>примерно 50 раз,>примерно 100 раз,>примерно 300 раз,>примерно 500 раз,>примерно 1,000 раз быстрее по сравнению с исходным лекарственным средством). В некоторых вариантах реализации указанная способная к протонированию аминогруппа по существу протонируется при физиологическом рН. В некоторых вариантах реализации аминогруппа может обратимо протонироваться. В некоторых вариантах реализации транспортная единица может отщепляться или не отщепляться от функциональной единицы после проникновения НРР/НРС через один или более биологических барьеров. В некоторых вариантах реализации транспортная единица может происходить из функциональной единицы, особенно для пептидов и родственных пептидам соединений, содержащих по меньшей мере свободную аминогруппу. В некоторых вариантах реализации в случае, когда в пептиде или родственном пептиду соединении содержится более одной способной к протонированию группы, указанный пептид или родственное пептиду соединение модифицируют так, что остается только одна или две способные к протонированию аминогруппы, а все остальные способные к протонированию группы защищают.
[0062] В некоторых вариантах реализации способная к протонированию аминогруппа выбрана из группы, состоящей из фармацевтически приемлемых замещенных и незамещенных первичных аминогрупп, фармацевтически приемлемых замещенных и незамещенных вторичных аминогрупп и фармацевтически приемлемых замещенных и незамещенных третичных аминогрупп.
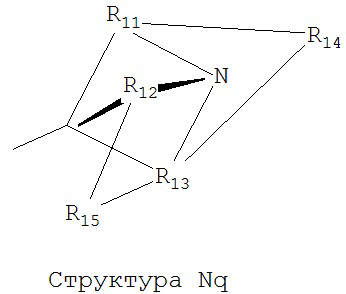
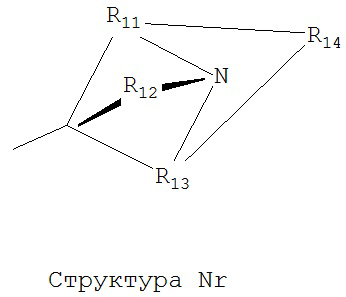
[0063] В некоторых вариантах реализации способная к протонированию аминогруппа выбрана из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr:

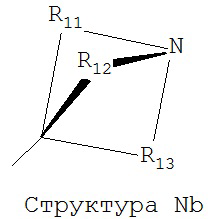 ,
,
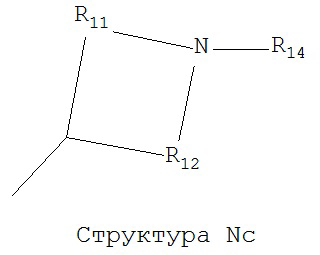
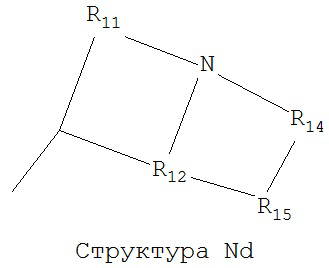
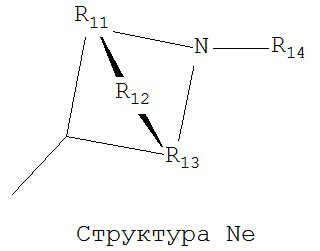
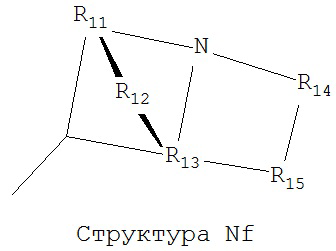
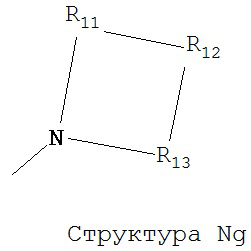
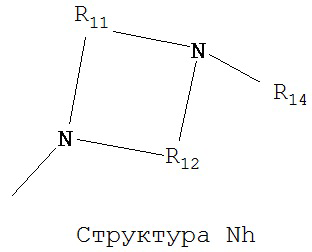
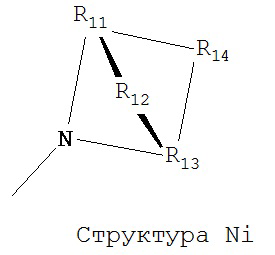
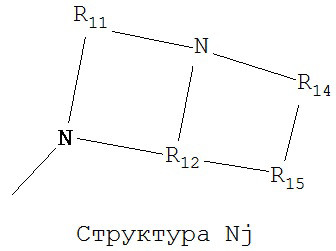
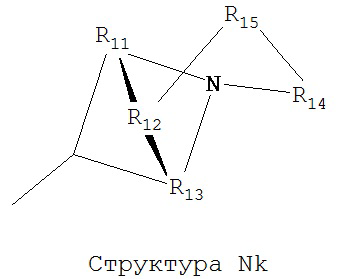
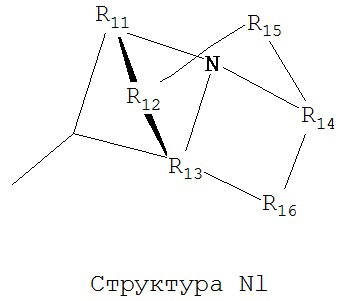
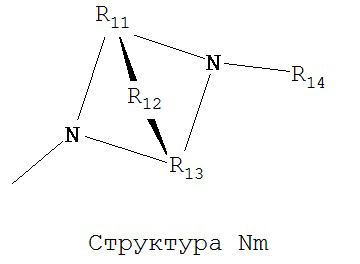
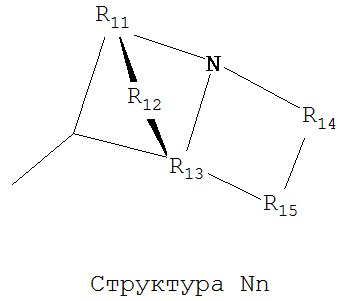
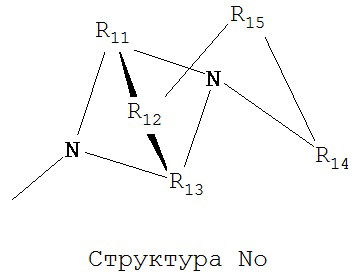
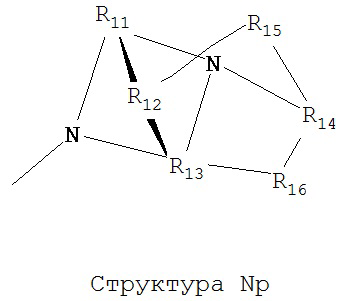
включая ее стереоизомеры и фармацевтически приемлемые соли.
[0064] В настоящем описании, если не указано иное, каждый из R11-R16 независимо выбран из группы, состоящей из ничего, Н, CH2COOR11, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио-, замещенного и незамещенного алкиламино-, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида, причем любой атом углерода или водорода может быть дополнительно независимо заменен на О, S, P, NR11 или любые другие фармацевтически приемлемые группы.
[0065] В некоторых вариантах реализации линкер, ковалентно связывающий функциональную единицу с транспортной единицей НРР/НРС, содержит связь, способную к расщеплению после проникновения НРР/НРС через один или более биологических барьеров. Указанная расщепляемая связь включает, например, ковалентную связь, простую эфирную, простую тиоэфирную, амидную, сложноэфирную, сложнотиоэфирную, карбонатную, карбаматную, фосфатную или оксимную связь.
[0066] В некоторых вариантах реализации пептидное НРР/НРС обладает следующей Структурой L-1:
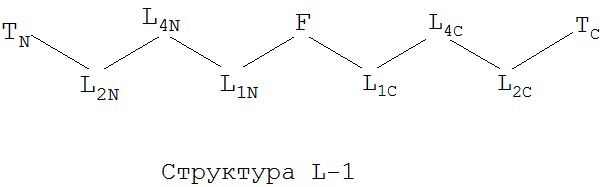
включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F представляет собой функциональную единицу пептидного НРР/НРС. Примеры F включают Структуру F-1, определенную выше;
TC и TN независимо выбраны из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных групп, Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше;
L1C и L1N независимо выбраны из группы, состоящей из ничего, О, S, N(L3), -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O и -S-СН(L3)-O-;
L2C и L2N независимо выбраны из группы, состоящей из ничего. О, S, N(L3), -N(L3)-СН2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O, -S-СН(L3)-O-, -О-L3-, -N-L3-, -S-L3-, -N(L3)-L5- и L3;
L4C и L4N независимо выбраны из группы, состоящей из ничего, С=O, C=S,
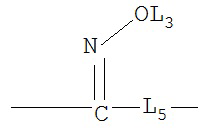 ,
,  ,
, 
для каждого из L1c, L1N, L2C, L2N, L4C и L4N, L3 и L5 независимо выбраны из группы, состоящей из ничего, Н, CH2COOL6, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио-, замещенного и незамещенного алкиламино-, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида, причем любой атом углерода или водорода может быть дополнительно независимо заменен на О, S, P, NL3 или любые другие фармацевтически приемлемые группы;
L6 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного, и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио-, замещенного и незамещенного алкиламино-, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида, причем любой атом углерода или водорода может быть дополнительно независимо замещен на О, S, N, Р(O)OL6, СН=СН, С≡С, CHL6, CL6L7, арильные, гетероарильные или циклические группы;
и
L7 независимо выбран из группы, состоящей из Н, ОН, Cl, F, Br, I, замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного алкоксила, замещенного и незамещенного алкилтио-, замещенного и незамещенного алкиламино-, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида, причем любой атом углерода или водорода может быть дополнительно независимо замещен на О, S, N, Р(O)OL6, СН=СН, С≡С, CHL6, CL6L7, арильные, гетероарильные или циклические группы.
[0067] В некоторых вариантах реализации НРР или НРС пептида или родственного пептиду соединения содержит структуру, соответствующую Структуре L-1, включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1C, L1N, L2C, L2N, TC и TN определены, как указано выше; и L4C и/или L4N представляют/представляет собой С=O.
[0068] В некоторых вариантах реализации НРР или НРС пептида или родственного пептиду соединения содержит структуру, соответствующую Структуре L-1, включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1C, L1N, L2C, L2N, L4C и L4N определены, как указано выше;
TC представляет собой транспортную единицу пептидного НРР/НРС.Например, TC выбран из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше; и
TN выбран из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп.
[0069] В некоторых вариантах реализации НРР или НРС пептида или родственного пептиду соединения содержит структуру, представляющую собой Структуру L-1, включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1C, L1N, L2C, L2N, L4C и L4N определены, как указано выше;
TN представляет собой транспортную единицу пептидного НРР/НРС. Например, TN выбран из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше; и
TC выбран из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп.
[0070] В некоторых вариантах реализации пептидное НРР/НРС обладает следующей Структурой L-2:
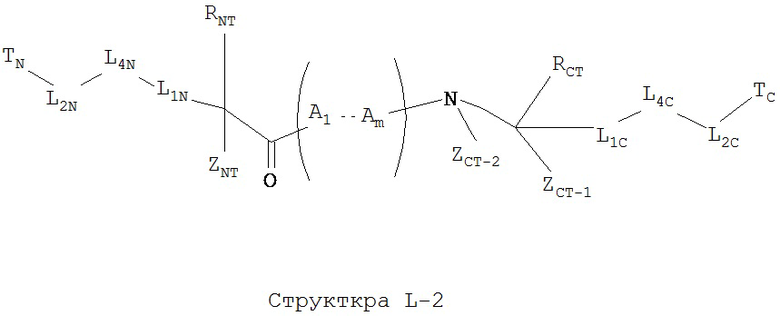
включая ее стереоизомеры и фармацевтически приемлемые соли, где:
каждый из A1-Am независимо выбран из группы, состоящей из 2-нафтилаланина, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных остатков, Структуры А и Структуры В:
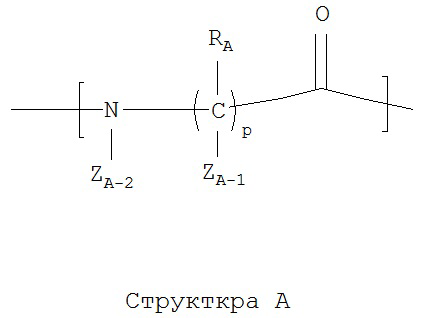
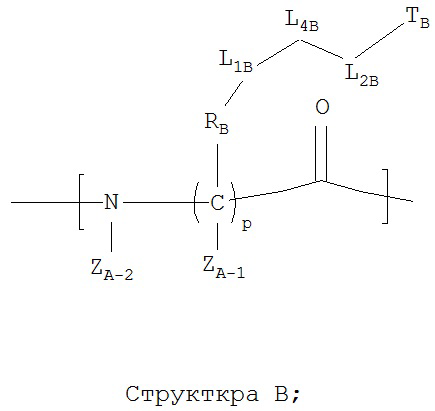
р в каждом A1-Am представляет собой независимо выбранное целое число;
TB в каждом A1-Am, TC и TN независимо выбраны из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных групп, Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше;
L1B в каждом A1-Am, L1C и L1N независимо выбраны из группы, состоящей из ничего, О, S, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O и -S-СН(L3)-O-;
L2B в каждом A1-Am, L2C и L2N независимо выбраны из группы, состоящей из ничего, О, S, -N(L3)-, -N(L3)-CH2-O, -N(L3)-CH2-N(L5)-, -O-CH2-O-, -O-СН(L3)-O, -S-СН(L3)-O-, -О-L3-, -N-L3-, -S-L3-, -N(L3)-L5- и L3;
L4B в каждом A1-Am, L4C и L4N независимо выбраны из группы, состоящей из С=O, C=S,
 ,
,  ,
, 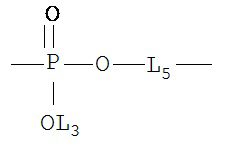 ;
;
L3 и L5 определены, как указано выше;
ZA-1 при каждом атоме углерода каждого из A1-Am, ZA-2 для каждого из A1-Am, ZNT, ZCT-1 и ZCT-2 независимо выбраны из группы, состоящей из Н, СН3, С2Н5, С3Н7, CF3, C2F5, C3F7, замещенного и незамещенного алкила, замещенного и незамещенного перфторалкила, и замещенного и незамещенного алкилгалогенида;
RA при каждом атоме углерода каждого из A1-Am, RB при каждом атоме углерода каждого из A1-Am, RNT и RCT независимо выбраны из группы, состоящей из замещенных и незамещенных имидазолильных, замещенных и незамещенных гуанидино-, замещенных и незамещенных карбоксильных, замещенных и незамещенных карбоксамидных, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных групп, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино-, замещенных и незамещенных алкилкарбонильных, замещенных и незамещенных перфторалкильных, замещенных и незамещенных алкилгалогенидных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп;
в случае, когда р группы A1-Am представляет собой целое число не меньше 2, RA или RB при каждом атоме углерода могут быть одинаковым или разным, ZA-1 при каждом атоме углерода может быть одинаковым или разным;
функциональная амино- и карбоксильная группа в пептидной цепи могут дополнительно образовывать лактамные мостики; и
тиольная группа может дополнительно образовывать дисульфидные мостики. Примеры пептидных НРР/НРС.
[0071] В некоторых вариантах реализации пептидное НРР/НРС включает соединение, обладающее структурой, выбранной из группы, состоящей из Структуры 2, Структуры 3, Структуры 4, Структуры 5, Структуры 6, Структуры 7, Структуры 8, Структуры 9, Структуры 10, Структуры 11, Структуры 12, Структуры 13, Структуры 14, Структуры 15, Структуры 16, Структуры 17, Структуры 18, Структуры 19, Структуры 20, Структуры 21, Структуры 22, Структуры 23, Структуры 24, Структуры 25, Структуры 26, Структуры 27, Структуры 28, Структуры 29, Структуры 30, Структуры 31, Структуры 32, Структуры 33, Структуры 34, Структуры 35, Структуры 36, Структуры 37, Структуры 38, Структуры 39, Структуры 40, Структуры 41, Структуры 42, Структуры 43, Структуры 44, Структуры 45, Структуры 46, Структуры 47, Структуры 48, Структуры 49, Структуры 50, Структуры 51, Структуры 52, Структуры 53, Структуры 54, Структуры 55, Структуры 56, Структуры 57, Структуры 58, Структуры 59, Структуры 60, Структуры 61, Структуры 62, Структуры 63, Структуры 64, Структуры 65, Структуры 66, Структуры 67, Структуры 68, Структуры 69, Структуры 70, Структуры 71, Структуры 72, Структуры 73, Структуры 74, Структуры 75, Структуры 76, Структуры 77, Структуры 78, Структуры 79, Структуры 80, Структуры 81, Структуры 82, Структуры 83, Структуры 84, Структуры 85, Структуры 86, Структуры 87, Структуры 88, Структуры 89, Структуры 90, Структуры 91, Структуры 92, Структуры 93, Структуры 94, Структуры 95, Структуры 96, Структуры 97, Структуры 98, Структуры 99, Структуры 100, Структуры 101, Структуры 102, Структуры 103, Структуры 104, Структуры 105, Структуры 106, Структуры 107, Структуры 108, Структуры 109, Структуры 110, Структуры 111, Структуры 112, Структуры 113, Структуры 114, Структуры 115, Структуры 116, Структуры 117, Структуры 118, Структуры 119, Структуры 120, Структуры 121, Структуры 122, Структуры 123, Структуры 124, Структуры 125, Структуры 126, Структуры 127, Структуры 128, Структуры 129, Структуры 130, Структуры 131, Структуры 132, Структуры 133, Структуры 134, Структуры 135, Структуры 136, Структуры 137, Структуры 138, Структуры 139, Структуры 140, Структуры 141, Структуры 142, Структуры 143, Структуры 144, Структуры 145, Структуры 146, Структуры 147, Структуры 148, Структуры 149, Структуры 150, Структуры 151, Структуры 152, Структуры 153, Структуры 154, Структуры 155, Структуры 156, Структуры 157, Структуры 158, Структуры 159, Структуры 160, Структуры 161, Структуры 162, Структуры 163, Структуры 164, Структуры 165, Структуры 166, Структуры 167, Структуры 168, Структуры 169, Структуры 170, Структуры 171, Структуры 172, Структуры 173, Структуры 174, Структуры 175, Структуры 176, Структуры 177, Структуры 178, Структуры 179, Структуры 180, Структуры 181, Структуры 182, Структуры 183, Структуры 184, Структуры 185, Структуры 186, Структуры 187, Структуры 188, Структуры 189, Структуры 190, Структуры 191, Структуры 192, Структуры 193, Структуры 194, Структуры 195, Структуры 196, Структуры 197, Структуры 198, Структуры 199, Структуры 200, Структуры 201, Структуры 202, Структуры 203, Структуры 204, Структуры 205, Структуры 206, Структуры 207, Структуры 208, Структуры 209, Структуры 210, Структуры 211, Структуры 212, Структуры 213, Структуры 214, Структуры 215, Структуры 216, Структуры 217, Структуры 218, Структуры 219, Структуры 220, Структуры 221, Структуры 222, Структуры 223, Структуры 224, Структуры 225, Структуры 226, Структуры 227, Структуры 228, Структуры 229, Структуры 230, Структуры 231, Структуры 232, Структуры 233, Структуры 234, Структуры 235, Структуры 236, Структуры 237, Структуры 238, Структуры 239, Структуры 240, Структуры 241, Структуры 242, Структуры 243, Структуры 244, Структуры 245, Структуры 246, Структуры 247, Структуры 248, Структуры 249, Структуры 250, Структуры 251, Структуры 252, Структуры 253, Структуры 254, Структуры 255, Структуры 256, Структуры 257, Структуры 258, Структуры 259, Структуры 260, Структуры 261, Структуры 262, Структуры 263, Структуры 264, Структуры 265, Структуры 266, Структуры 267, Структуры 268, Структуры 269, Структуры 270, Структуры 271, Структуры 272, Структуры 273, Структуры 274, Структуры 275, Структуры 276, Структуры 277, Структуры 278, Структуры 279, Структуры 280, Структуры 281, Структуры 282, Структуры 283, Структуры 284, Структуры 285, Структуры 286, Структуры 287, Структуры 288, Структуры 289, Структуры 290, Структуры 291, Структуры 292, Структуры 293, Структуры 294, Структуры 295, Структуры 296, Структуры 297, Структуры 298, Структуры 299, Структуры 300, Структуры 301, Структуры 302, Структуры 303, Структуры 304, Структуры 305, Структуры 306, Структуры 307, Структуры 308, Структуры 309, Структуры 310, Структуры 311, Структуры 312, Структуры 313, Структуры 314, Структуры 315, Структуры 316, Структуры 317, Структуры 318, Структуры 319, Структуры 320, Структуры 321, Структуры 322, Структуры 323, Структуры 324, Структуры 325, Структуры 326, Структуры 327, Структуры 328, Структуры 329, Структуры 330, Структуры 331, Структуры 332, Структуры 333, Структуры 334, Структуры 335, Структуры 336, Структуры 337, Структуры 338, Структуры 339, Структуры 340, Структуры 341, Структуры 342, Структуры 343, Структуры 344 и Структуры 345, показанной на Фиг.1, включая их стереоизомеры и фармацевтически приемлемые соли, где:
R выбран из группы, состоящей из И, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино-, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных остатков;
X, Х4, Х5, Х6, Х7, X8, X9, Х10, Х21, Х22, Х23, Х24, Х25, Х26 и Х27 независимо выбраны из группы, состоящей из C=O, C=S, COO, CSO, CH2OCO, COOCH2OCO, COCH2OCO, CH2-O-CH(CH2OR4)2, CH2-O-CH(CH2OCOR4)2, SO2, PO(OR), NO2, NO, O, S, NR5 и ничего;
R1, R2, R4, R5, R6, R7, R8, R9, R10, R21, R22, R23, R24, R25, R26 и R27 независимо выбраны из группы, состоящей из Н, О, NO2, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкилтио-, замещенных и незамещенных алкиламино, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных остатков;
в настоящем описании, если не указано иное, термин «НА» ничего не представляет собой или представляет собой фармацевтически приемлемую кислоту, например, гидрохлорид, гидробромид, гидройодид, азотную кислоту, серную кислоту, пиросерную кислоту, фосфорную кислоту, фосфористую кислоту, фосфоновую кислоту, изоникотиновую кислоту, уксусную кислоту, молочную кислоту, салициловую кислоту, лимонную кислоту, винную кислоту, пантотеновую кислоту, дивинную кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, гентизиновую кислоту, фумаровую кислоту, глюконовую кислоту, глюкароновую кислоту, сахарную кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту, п-толуолсульфоновую кислоту или памовую кислоту;
и
Ar выбран из группы, состоящей из фенила, 2'-нафтила, 4-йодфенила, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных остатков.
[0072] Соответствующие исходные пептиды пептидных НРР/НРС, обладающие структурой, представляющей собой Структуры 2-343, приведены ниже в Таблицах А(I) и (II):
Таблица А. Исходный пептид пептидных НРР/НРС, обладающий структурой, соответствующей Структурам 2-345
(I)
(II)
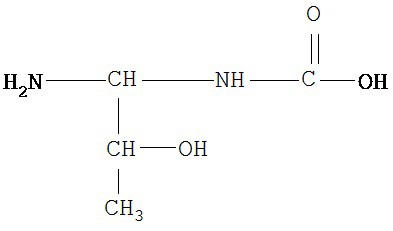
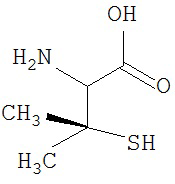
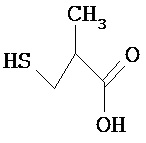
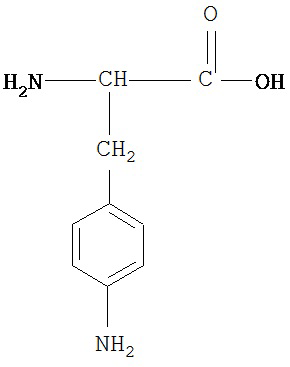
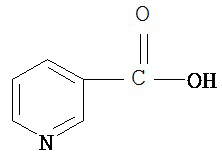
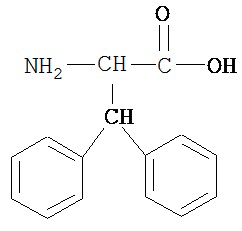
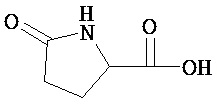
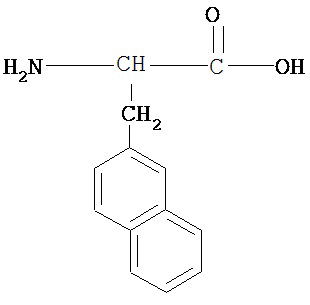
[0073] Структуры редких аминокислот (Xaal, Хаа2, Хаа3, Хаа4, Хаа5, Хаа7, Хаа9, Хаа13, Хаа14, Хаа15, Хаа17, Хаа19, Хаа21, Хаа22, Хаа23, Хаа24, Хаа25 и Хаа26) в SEQ ID NO. 1-172 приведены в Таблице В:
 , где R4 определен, как указано выше
, где R4 определен, как указано выше

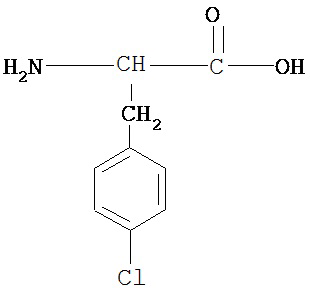

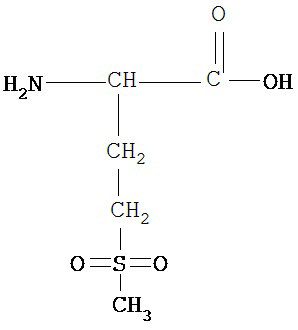

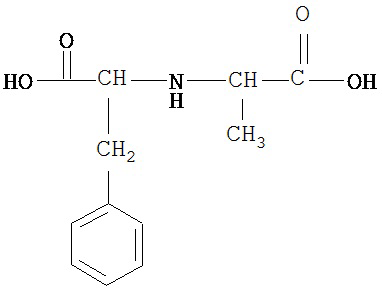
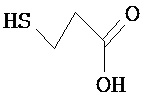
[0074] В некоторых вариантах реализации пептидное НРР/НРС содержит соединение, обладающее структурой, выбранной из группы, состоящей из Структур 2-345, определенных выше, включая их стереоизомеры и фармацевтически приемлемые соли, где:
НА, Ar, X, Х4, Х5, Х6, Х7, X8, Х9, Х10, X21, Х22, Х23, Х24, Х25, Х26 и Х27 определены, как указано выше;
R выбран из группы, состоящей из И, замещенных и незамещенных алкильных с 1-20 атомами углерода, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных с 1-20 атомами углерода, замещенных и незамещенных алкилтио с 1-20 атомами углерода, замещенных и незамещенных алкиламино с 1-20 атомами углерода, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных остатков;
R1, R2, R4, R5, R6, R7, R8, R9, R10, R21, R22, R23, R24, R25, R26 и R27 независимо выбраны из группы, состоящей из Н, О, замещенных и незамещенных алкильных с 1-20 атомами углерода, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных с 1-20 атомами углерода, замещенных и незамещенных алкилтио с 1-20 атомами углерода, замещенных и незамещенных алкиламино с 1-20 атомами углерода, замещенных и незамещенных алкенильных с 1-20 атомами углерода, замещенных и незамещенных алкинильных с 1-20 атомами углерода, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных остатков.
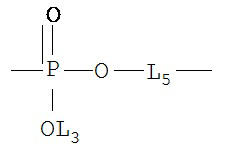
[0075] В некоторых вариантах реализации пептидное НРР/НРС содержит структуру, выбранную из группы, состоящей из Структуры 1а, Структуры 1b, Структуры 1с, Структуры Id, Структуры 1е, Структуры If, Структуры 1g и Структуры 1h:
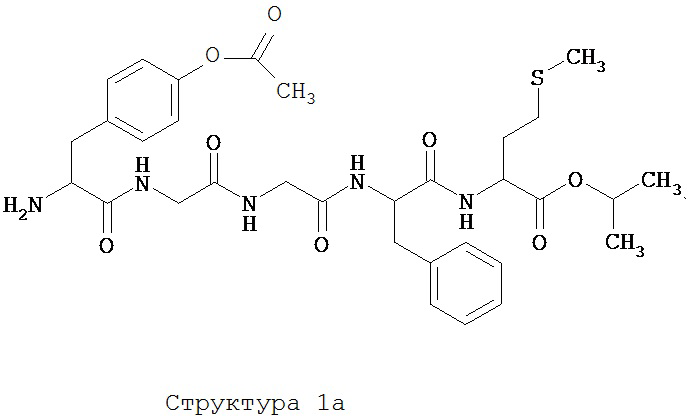
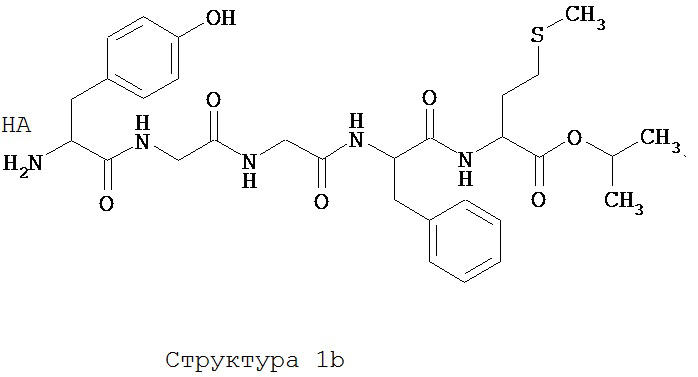
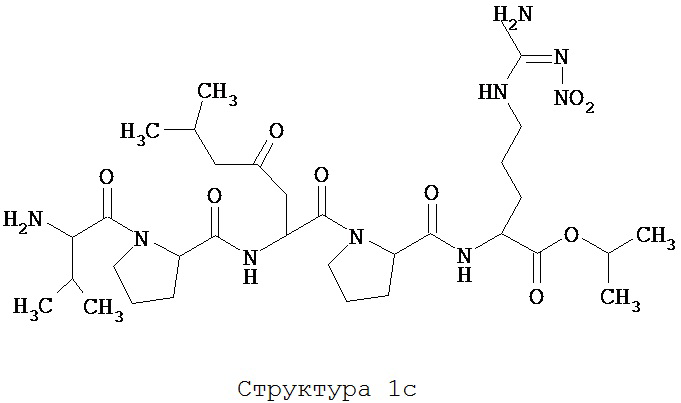
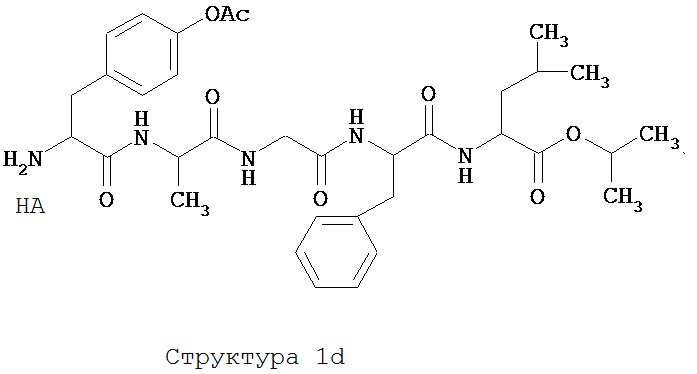
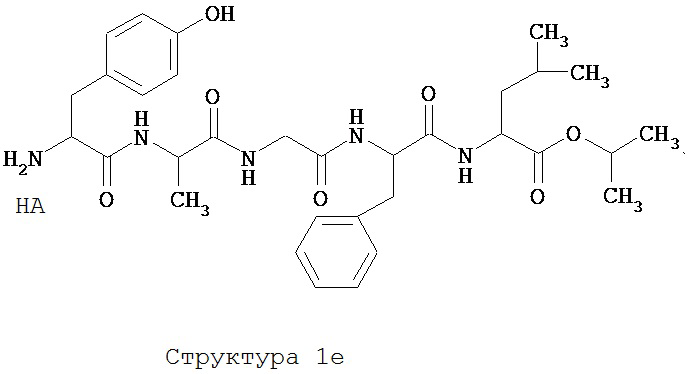
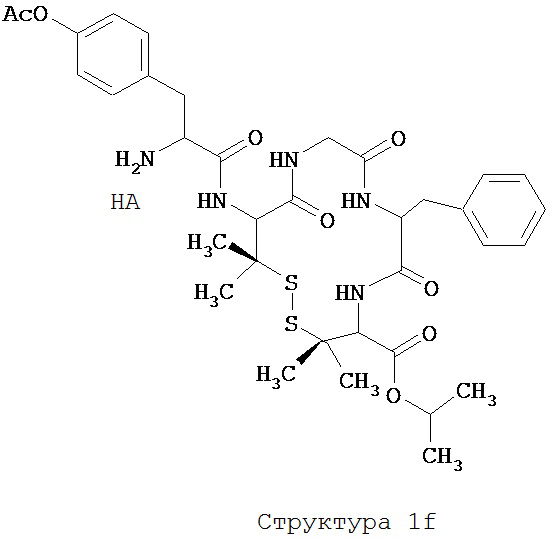
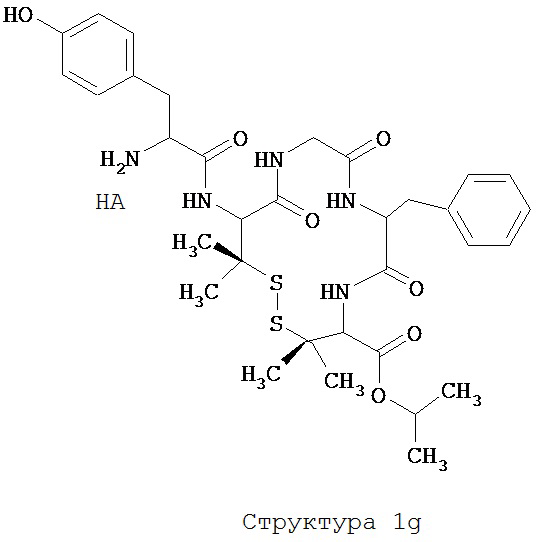
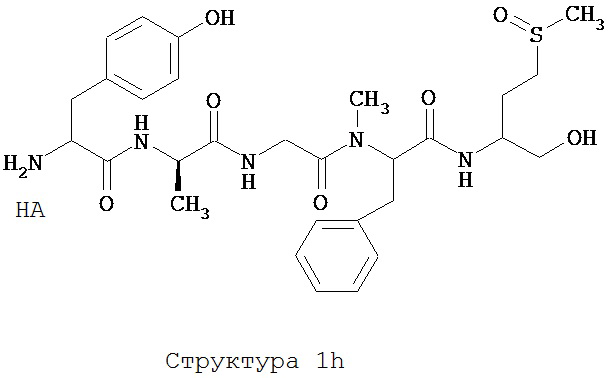
включая их стереоизомеры и фармацевтически приемлемые соли, где:
Х4, Х5, Х6, Х7, X8, X9, R4, R5, R6, R7, R8, R9 и НА являются такими, как указано выше.
Твердофазный синтез пептидного НРР/НРС
[0076] Более короткие пептиды (<10 аминокислот) могут быть синтезированы посредством синтеза в жидкой фазе, однако очень трудно синтезировать длинные пептиды с помощью жидкой фазы. HPPs/HPCs пептидов в настоящем описании представляют собой модифицированные пептиды и не могут быть синтезированы стандартным способом твердофазного синтеза пептидов (от С-конца к N-концу).
[0077] В некоторых вариантах реализации пептидное НРР/НРС синтезируют от N-конца к С-концу, при этом указанный способ синтеза включает следующие стадии:
[0078] Способ получения пептидной НРС с применением твердофазного синтеза, включающий:
a) обеспечение химически модифицированной смолы (например, тритилхлоридной смолы и карбонатной эфирной смолы);
b) защиту карбоксильной группы всех природных или модифицированных аминокислотных остатков, необходимых согласно пептидной НРС, с помощью защитной группы (например, 2-(4-нитрофенилсульфонил)этильной группы и 9-флуоренилметильной группы) с получением СООН-защищенного аминокислотного остатка;
c) проведение реакции сочетания СООН-защищенного аминокислотного остатка на N-конце пептидной НРС с химически модифицированной смолой с обеспечением иммобилизированного СООН-защищенного предшественника пептидной НРС, содержащего один аминокислотный остаток;
d) снятие защиты с защищенной карбоксильной группы указанного иммобилизированного СООН-защищенного предшественника пептидной НРС с применением реагентов для снятия защиты (например, 1% DBU/20% пиперидин/79% ДМФ или других реагентов, способных снимать защиту с защищенной карбоксильной группы); с получением иммобилизированного СООН-незащищенного предшественника пептидной НРС, содержащего один аминокислотный остаток;
e) повторение стадий с) и d) с применением СООН-защищенного аминокислотного остатка пептидной НРС до получения иммобилизированного С-незащищенного предшественника пептидной НРС, содержащего все аминокислотные остатки за исключением С-концевого аминокислотного остатка;
f) связывание С-концевого аминокислотного остатка с RT посредством ковалентной связи с обеспечением модифицированной С-концевой аминокислоты, причем RT выбран из группы, состоящей из замещенного и незамещенного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного гетероциклоалкила, замещенного и незамещенного алкилоксила, замещенного и незамещенного алкенила, замещенного и незамещенного алкинила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, и транспортная единица выбрана из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры N1, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше;
g) проведение реакции сочетания модифицированной С-концевой аминокислоты с иммобилизированным С-незащищенным предшественником пептидной НРС, полученным на стадии е), с получением иммобилизированной пептидной НРС; и
h) высвобождение иммобилизированной пептидной НРС из смолы с получением пептидной НРС.
[0079] В некоторых вариантах реализации химически модифицированная смола может быть подвергнута реакции сочетания напрямую с защищенной аминокислотой или химически модифицированная смола может быть сначала дополнительно модифицирована, а затем подвергнута реакции сочетания с СООН-защищенной аминокислотой;
[0080] В некоторых вариантах реализации пептидное НРР/НРС, содержащее транспортную единицу на С-концевой аминокислоте, получают путем проведения реакции сочетания с пептидной цепью С-концевой аминокислоты, в котором карбоксильную группу связывают с транспортной единицей, как описано выше. Например, транспортная единица выбрана из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, описанной выше.
[0081] В некоторых вариантах реализации пептидное НРР/НРС, содержащее транспортную единицу на С-концевой аминокислоте, получают путем проведения реакции сочетания с пептидной цепью С-концевой аминокислоты, где карбоксильную группу защищают, путем снятия защиты с карбоксильной группы и, наконец, путем проведения реакции сочетания с транспортной единицей. Например, транспортная единица выбрана из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, описанной выше.
[0082] В некоторых вариантах реализации высвобождение пептидного НРР/НРС осуществляют с высоким выходом. Например, в некоторых вариантах реализации смола представляет собой тритилхлоридную смолу, при этом этап высвобождения может быть осуществлен путем взаимодействия с ТФУ/ДХМ (например, 5%). В некоторых вариантах реализации смола представляет собой карбонатную эфирную смолу и этап высвобождения может быть осуществлен путем осуществления с Pd-C (например, 10% в метаноле) и Н2.
[0083] В некоторых вариантах реализации реакцию сочетания проводят в присутствии реагентов для реакции сочетания. Примеры реагентов для реакции сочетания включают, без ограничения, HBTU/DIPEA/HOBt, TBTU/DIPEA/HOBt, BOP/DIPEA/HOBt, HATU/DIPEA/HOBt и DIC/HOB, и комбинации указанных веществ.
[0084] В настоящем описании, если не определено иное:
«DBU» означает 1,8-диазабицикло[5,4,0]ундек-7-ен;
«ДМФ» означает диметилформамид;
«DIPEA» означает N,N-диизопропилэтиламин;
«HBTU» означает O-бензотриазол-N,N,N',N’-тетраметилуроний-гексафторфосфат;
«HOBt» означает 1-гидроксибензотриазол;
«TBTU» означает O-бензотриазол-N,N,N’,N’-тетраметилуроний-тетрафторборат;
«ВОР» означает бензотриазол-1-ил-N-окси-трис(пирролидино)фосфоний гексафторфосфат;
«HATU» означает N-оксид гексафторфосфата N-[(диметиламино)-1Н-1,2,3-тразоло[4,5-b]пиридино-1-илметилен]-N-метилметанаминия;
«DIC» означает диизопропилкарбодиимид; и
«ТФУ» означает трифторуксусную кислоту.
II. Фармацевтические композиции, содержащие HPPs/HPCs
[0085] Другой аспект настоящего изобретения относится к фармацевтической композиции, содержащей по меньшей мере одно пептидное НРР/НРС и фармацевтически приемлемый носитель.
[0086] В настоящем описании термин «фармацевтически приемлемый носитель» означает фармацевтически приемлемое вещество, композицию или наполнитель, такой как жидкий или твердый наполнитель, разбавитель, наполнитель, растворитель или инкапсулирующее вещество, вовлеченное в перенос или транспортировку НРР/НРС из одного участка, жидкости организма, ткани, органа (внутреннего или внешнего) или части организма в другой участок, жидкость организма, ткань, орган или часть организма.
[0087] Каждый носитель является «фармацевтически приемлемым» в смысле совместимости с другими компонентами, например, НРР/НРС, состава и подходит для применения в контакте с тканью или органом биологической системы, не вызывая при этом чрезмерной токсичности, раздражения, аллергической реакции, иммуногенности или других проблем или осложнений, в соответствии с разумным соотношением польза/риск.
[0088] Некоторые примеры веществ, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал и картофельный крахмал; (3) целлюлозу и ее производные, такие как натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетилцеллюлоза; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) наполнители, такие как масло какао и воски для суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический раствор; (18) раствор Рингера; (19) спирт, такой как этиловый спирт и пропиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в фармацевтических составах, такие как ацетон.
[0089] Фармацевтические композиции могут содержать фармацевтически приемлемые вспомогательные вещества, необходимые для приближения к физиологическим условиям, такие как регулирующие рН и буферные вещества, регулирующие токсичность агенты и т.п., например, ацетат натрия, хлорид натрия, хлорид калия, хлорид кальция, лактат натрия и т.п.
[0090] В одном из вариантов реализации фармацевтически приемлемый носитель представляет собой водный носитель, например, буферный раствор и т.п. В некоторых вариантах реализации фармацевтически приемлемый носитель представляет собой полярный растворитель, например воду, ацетон и спирт.
[0091] Концентрация НРР/НРС в данных составах может широко варьироваться и будет выбрана, главным образом, исходя из объемов жидкости, значений вязкости, массы тела и т.п.в соответствии с конкретным выбранным способом введения и потребностями биологической системы. Например, концентрация может составлять от 0,0001% до 100%, от 0,001% до 50%, от 0,01% до 30%, от 0,1% до 10% по массе.
[0092] Композиции согласно настоящему изобретению могут быть введены для профилактического, терапевтического и/или гигиенического применения. Указанное введение может представлять собой топический, трансмукозальный, например, пероральный, назальный, вагинальный, ректальный, парентеральный, трансдермальный, подкожный, внутримышечный, внутривенный, путем ингаляции, офтальмологический и другие подходящие способы. Фармацевтические композиции могут быть введены в различных дозированных лекарственных формах в зависимости от способа введения. Например, дозированные лекарственные формы, подходящие для перорального введения, включают порошки, таблетки, пилюли, капсулы и пастилки.
[0093] Таким образом, типичная фармацевтическая композиция для внутривенного введения будет составлять от примерно 10'10 г до примерно 100 г, от примерно 10'10 г до примерно 10"3 г, от примерно 10"9 г до примерно 10"6 г, от примерно 10"6 г до примерно 100 г, от примерно 0,001 г до примерно 100 г, от примерно 0,01 г до примерно 10 г или от примерно 0,01 г до примерно 1 г для каждого субъекта в сутки. Могут быть использованы дозы от примерно 0,01 мг до примерно 50 г для каждого субъекта в сутки. Фактические способы получения парентерально вводимых композиций известны или очевидны специалисту в данной области техники и более подробно описаны в таких публикациях, как Remington's Pharmaceutical Science, 15th ed., Mack Publishing Company, Easton, Pa. (1980).
III. Виды применения HPPs/HPCs
[0094] i) Способы проникновения через биологический барьер.
[0095] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению для проникновения через один или более биологических барьеров у биологического субъекта. Указанный способ включает этап введения биологическому субъекту НРР/НРС или пептида, или родственного пептиду соединения, или его фармацевтической композиции. В некоторых вариантах реализации НРР/НРС демонстрирует более чем примерно в 10 раз или выше, 50 раз или выше, >примерно 100 раз или выше, >примерно 200 раз или выше, >примерно 300 раз или выше, >примерно 500 раз или выше, >примерно 1,000 раз или выше скорость проникновения через один или более биологических барьеров по сравнению с его исходным лекарственным средством.
[0096] В настоящем описании термин «биологический барьер» относится к биологическому слою, который разделяет окружающую среду на разные пространственные области или участки, при этом разделение способно к модуляции (например, сокращению, ограничению, усилению или бездействию) прохождения, проникновения или перемещения вещества или состава из одной области/участка в другую. Разные пространственные области или участки, указанные в настоящем описании, могут иметь одинаковое или различное химическое или биологическое окружение (окружения). Биологический слой, указанный в настоящем описании, включает, но не ограничивается ими, биологическую мембрану, слой клеток, биологическую структуру, внутреннюю поверхность субъектов, организмов, органов или полостей тела, наружную поверхность субъектов, организмов, органов или полостей тела, или их любую комбинации или множество.
[0097] Примеры биологической мембраны включают структуру липидного бислоя, мембрану эукариотических клеток, мембрану прокариотических клеток и внутриклеточную мембрану (например, мембрану ядра или органеллы, такую как мембрана или оболочка аппарата Гольджи, шероховатого и гладкого эндоплазматического ретикулума (ER), рибосом, вакуолей, везикул, липосом, митохондрий, лизосомы, ядра, хлоропластов, пластид, пероксисом или микротелец).
[0098] Липидный бислой, указанный в настоящем описании, представляет собой двойной слой молекул класса липидов, включая, но не ограничиваясь ими, фосфолипиды и холестерин. В конкретном варианте реализации липиды для бислоя представляют собой амфифильные молекулы, состоящие из полярных головок и неполярных хвостов жирных кислот. Бислой состоит из двух слоев липидов, расположенных таким образом, что их углеводородные хвосты обращены друг к другу с образованием масляного ядра, удерживаемые вместе за счет гидрофобного эффекта, тогда как их заряженные головки обращены к водным растворам по обе стороны мембраны. В другом конкретном варианте реализации липидный бислой может содержать одну или более встроенных молекул белка и/или сахара.
[0099] Примеры слоя клеток включают выстилку эукариотических клеток (например, эпителий, собственная пластинка слизистой оболочки и гладкая мышца или мышечная слизистая оболочка (в желудочно-кишечном тракте)), выстилку прокариотических клеток (например, поверхностный слой или S-слой, относящийся к мономолекулярному слою с двухмерной структурой, состоящему из идентичных белков или гликопротеинов, в частности, S-слой относится к части клеточной оболочки, обычно встречающейся у бактерий и архибактерий), биопленку (структурированное сообщество микроорганизмов, заключенных в произведенную ими полимерную матрицу и прикрепившихся к живой или инертной поверхности) и слой растительных клеток (например, эпидермис). Клетки могут представлять собой нормальные клетки или патологические клетки (например, клетки заболевания, раковые клетки).
[00100] Примеры биологических структур включают структуры, изолированные плотными или закрывающими соединениями, которые обеспечивают барьер от проникновения токсинов, бактерий и вирусов, например, гематомолочный барьер и гематоэнцефалический барьер (ГЭБ). В частности, ГЭБ состоит из непроницаемого класса эндотелия, который представляет собой как физический барьер за счет плотных соединений примыкающих соседних эндотелиальных клеток, так и транспортный барьер, состоящий из переносчиков эффлюкса. Биологическая структура также может включать смесь клеток, белков и Сахаров (например, сгустки крови).
[00101] Примеры внутренней поверхности субъектов, организмов, органов или полостей тела включают слизистую оболочку щеки, слизистую оболочку пищевода, слизистую оболочку желудка, слизистую оболочку кишечника, слизистую оболочку обонятельной области, слизистую оболочку полости рта, слизистую оболочку бронхов, слизистую оболочку матки и эндометрий (слизистая оболочка матки, внутренний слой стенки пыльцевого зерна или внутренний слой стенки споры) или их комбинацию, или множество.
[00102] Примеры наружной поверхности субъектов, организмов, органов или полостей тела включают капилляры (например, капилляры в сердечной ткани), слизистые оболочки, переходящие в кожу (например, такие как в ноздрях, губах, ушах, области гениталий и заднего прохода), наружную поверхность органа (например, печени, легкого, желудка, головного мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, желудка, ободочной и прямой кишки, кишечника, вены, дыхательной системы, сосудистой, аноректума и анального зуда), кожу, кутикулу (например, мертвые слои эпидермальных клеток или кератиноцитов, или поверхностный слой перекрывающихся клеток, покрывающий волосяной стержень животного, многослойная структура вне эпидермиса многих беспозвоночных, кутикулы растений или полимеры кутин и/или кутан), наружный слой стенки пыльцевого зерна или наружный слой стенки споры и их комбинацию или множество.
[00103] Кроме того, биологический барьер дополнительно включает сахарный слой, белковый слой или любой другой биологический слой, или их комбинацию, или множество. Например, кожа представляет собой биологический барьер, обладающий множеством биологических слоев. Кожа включает слой эпидермиса (наружная поверхность), слой дермы и подкожный слой. Слой эпидермиса содержит несколько слоев, включая базальный слой клеток, шиповатый слой клеток, зернистый слой клеток и роговой слой. Клетки в эпидермисе называют кератиноцитами. Роговой слой представляет собой самый дальний слой эпидермиса, в котором клетки являются плоскими и чешуйчатыми («сквамозными») по форме. Данные клетки содержат большое количество кератина и расположены в перекрывающихся слоях, которые придают поверхности кожи плотный и маслонепроницаемый, и водонепроницаемый характер.
[00104] и) Способы диагностирования состояния в биологической системе.
[00105] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению для диагностирования состояния в биологической системе. Указанный способ включает следующие этапы:
1) введение композиции, содержащей пептидное НРР/НРС, биологическому субъекту;
2) детектирование присутствия, локализации и количества НРР/НРС, функциональной единицы НРР/НРС или его метаболита у биологического субъекта; и
3) определение состояния в биологической системе.
[00106] В некоторых вариантах реализации НРР/НРС (или агент, способный к расщеплению из НРР/НРС) агрегируется в эпицентре, где возникает состояние. В некоторых вариантах реализации также детектируют присутствие, локализацию или количество функциональной единицы НРР/НРС. В некоторых вариантах реализации также определяют начало, развитие, течение или ремиссию связанного состояния (например, рака).
[00107] В некоторых вариантах реализации НРР/НРС метят или конъюгируют с детектируемым агентом. В качестве альтернативы, получают НРР/НРС, которая содержит радиоизотопы для детектирования. Доступны многочисленные детектируемые агенты, которые в целом можно разделить на следующие категории:
(a) Радиоизотопы, такие как 35S, 14C, 13С, 15N, 125I, 3H и 131I. Диагностический агент можно метить указанным радиоизотопом с использованием технологий, известных в данной области техники, и радиоактивность может быть измерена с использованием подсчета сцинтилляций; кроме того, диагностический агент может быть спин-меченым для электронного парамагнитного резонанса для мечения углерода и азота.
(b) Флуоресцентные агенты, такие как BODIPY, аналоги BODIPY, редкоземельные хелаты (хелаты европия), флуоресцеин и его производные, FITC, 5,6 карбоксифлуоресцеин, родамин и его производные, дансил, Лиссамин, фикоэритрин, зеленый флуоресцентный белок, желтый флуоресцентный белок, красный флуоресцентный белок и техасский красный. Флуоресценцию можно определять количественно с использованием флуорометра.
(c) Различные агенты фермент-субстрат, такие как люциферазы (например, люцифераза светлячка и бактериальная люцифераза), люциферин, 2,3-дигидрофталазиндионы, малатдегидрогеназа, уреаза, пероксидаза, такая как пероксидаза хрена (HRPO), щелочная фосфатаза, β-галактозидаза, глюкоамилаза, лизоцим, сахаридоксидазы (например, глюкозооксидаза, галактозоксидаза и глюкозо-6-фосфатдегидрогеназа), гетероциклические оксидазы (такие как уриказа и ксантиноксидаза), лактопероксидаза, микропероксидаза и т.п. Примеры комбинаций фермент-субстрат, включают, например: i) пероксидазу хрена (HRPO) с перекисью водорода в качестве субстрата, при этом перекись водорода окисляет предшественник красителя (например, ортофенилендиамин (OPD) или 3,3',5,5'-тетраметилбензидин гидрохлорид (ТМВ)); ii) щелочную фосфатазу (АР) с пара-нитрофенилфосфатом в качестве хромогенного субстрата; и hi) β-D-галактозидазу (β-D-Gal) с хромогенным субстратом (например, п-нитрофенил-β-О-галактозидазу) или флурогенным субстратом 4-метилумбеллиферил-β-0-галактозидазу.
[00108] В некоторых вариантах реализации детектируемый агент не обязательно конъюгируют с диагностическим агентом, но он способен распознавать присутствие диагностического агента, и указанный диагностический агент может быть детектирован.
[00109] В некоторых вариантах реализации пептидное НРР/НРС может быть предложено в наборе, т.е. упакованной комбинации реагентов в заранее определенных количествах с инструкциями по проведению диагностического анализа. В случае, когда НРР/НРС метят ферментом, указанный набор будет содержать субстраты и кофакторы, необходимые данному ферменту (например, предшественник субстрата, который обеспечивает детектируемый хромофор или флуорофор). Кроме того, могут быть включены другие добавки, такие как стабилизаторы, буферы (например, блокирующий буфер или буфер для лизиса) и т.п. Относительные количества различных реагентов можно широко варьировать с получением концентраций в растворе реагентов, которые по существу оптимизируют чувствительность анализа. В частности, реагенты могут быть получены в виде сухих порошков, как правило, лиофилизированных, включая наполнители, которые при растворении обеспечат раствор реагента, обладающий подходящей концентрацией.
[00110] iii) Способы скрининга вещества на предмет требуемого свойства
[00111] Другой аспект настоящего изобретения относится к способу скрининга НРР/НРС на предмет требуемого свойства.
[00112] В некоторых вариантах реализации указанный способ включает:
1) ковалентное связывание тестируемой функциональной единицы с транспортной единицей посредством линкера с образованием тестируемой композиции (или ковалентное связывание функциональной единицы с тестируемой транспортной единицей посредством линкера, или ковалентное связывание функциональной единицы с транспортной единицей посредством тестируемого линкера)
2) введение указанной тестируемой композиции в биологическую систему; и
3) определение того, обладает ли тестируемая композиция требуемой природой или свойством.
[00113] В одном из вариантов реализации требуемое свойство может включать, например, 1) способность тестируемой функциональной единицы образовывать композицию с высокой степенью проникновения или снова превращаться в исходное лекарственное средство, 2) проникающую способность и/или скорость тестируемой композиции, 3) действенность и/или эффективность тестируемой композиции, 4) способность тестируемой транспортной единицы к переносу и 5) расщепляемость тестируемого линкера.
[00114] iv) Способы лечения состояния у биологического субъекта
[00115] Другой аспект настоящего изобретения относится к способу применения композиции согласно настоящему изобретению для лечения состояния в биологической системе. Указанный способ включает введение фармацевтической композиции в биологическую систему.
[00116] В настоящем описании термин «проведение лечения» означает лечение, облегчение, ингибирование или предупреждение. В настоящем описании термин «лечить» означает лечить, облегчать, ингибировать или предупреждать. В настоящем описании термин «лечение» означает лечение, облегчение, ингибирование или предупреждение.
[00117] В настоящем описании термин «биологическая система», «биологический субъект» или «субъект» означает орган, группу органов, которые совместно работают для выполнения определенной задачи, организм или группу организмов. В настоящем описании термин «организм» означает сборку молекул, функционирующих как более или менее стабильное единое целое, и обладает свойствами жизни, например, животное, растение, гриб или микроорганизм.
[00118] В настоящем описании термин «животное» означает эукариотический организм, характеризующийся произвольным движением. Примеры животного включают, без ограничения, позвоночные (например, человек, млекопитающие, птицы, рептилии, земноводные, рыбы, мешкожаберные (marsipobranchiata) и бесчерепные (leptocardia)), туникаты (например, сальпы (thaliacea), аппендикулярии (appendicularia), сорберацеи (sorberacea) и ascidioidea), членистые (например, насекомые, мириаподы, малакоподы, паукообразные, коленчатоногие, меростомовые, ракообразные и аннелиды), гехиру (anarthropoda) и паразитические черви (например, коловратки).
[00119] В настоящем описании термин «растение» означает организмы, принадлежащие царству Растений. Примеры растений включают, без ограничения, семенные растения, мхи, папоротники и родственники папоротников. Примеры семенных растений включают, без ограничения, цикадовые растения, гинкго, хвойные, гнетовые (gnetophytes), покрытосеменные. Примеры мхов включают, без ограничения, печеночники, роголистники и мхи. Примеры папоротников включают, без ограничения, ужовниковые (например, ужовники, гроздовники и гроздовники рассеченные), мараттиевые и лептоспорангиатные папоротники. Примеры родственников папоротников включают, без ограничения, плауновидные (например, плауны, зубчатые мхи (spikemosses) и полушники), псилотовые (например, плаунообразные и метельчатые папоротники) и хвощевые (например, хвощи). [00120] В настоящем описании термин «гриб» означает эукариотический организм, являющийся членом царства Грибы. Примеры гриба включают, без ограничения, хитридиомицеты, бластокладиевые, неокаллимастигомикоту, зигомикоту, гломеромикоту, аскомикоту и базидиомикоту.
[00121] В настоящем описании термин «микроорганизм» означает организм, являющийся микроскопическим (например, по шкале длины составляющий микрометр). Примеры микроорганизма включают, без ограничения, бактерии, грибы, архебактерии, протесты и микроскопические растения (например, зеленые водоросли), и микроскопических животных (например, планктон, планарии и амеба).
[00122] Некоторые примеры состояний, которые можно лечить указанным способом, включают состояния, которые можно лечить исходным лекарственным средством НРР/НРС.
[00123] v) Способы применения пептидных НРР/НРС и их фармацевтических композиций в лечении.
[00124] Другой аспект настоящего изобретения относится к способу применения пептидных НРР/НРС или их фармацевтических композиций в лечении состояния в биологической системе или у субъекта путем введения пептидного НРР/НРС или его фармацевтической композиции в биологическую систему или субъекту.
[00125] Пептиды и родственные пептидам соединения можно применять для регулирования широкого спектра биологических процессов в биологической системе. Состояния, связанные с указанными биологическими процессами, можно лечить соответствующими пептидами или родственными пептидам соединениями и, следовательно, можно лечить пептидными НРР/НРС и их фармацевтической композицией.
[00126] Указанные состояния включают, но не ограничиваются ими, старение, стенокардию, дефицит антитромбина, аритмию, атеросклероз, мерцательную аритмию, трепетание предсердий, сгустки крови, ишемию сердца, операции на сердце, кардиомиопатию, сердечно-сосудистые аномалии, заболевание сонных артерий, боль в груди, нарушения кровообращения, хромоту, коллагеноз сосудов, врожденные заболевания сердца, застойную сердечную недостаточность, ишемическую болезнь сердца, диабет, диабет и гипертонию, дислипидемию, аритмию, повышенный уровень триглицеридов, порок сердца, заболевание сердца, сердечную недостаточность, заболевание сердечных клапанов, гемангиому, высокий уровень холестерина, гипертриглицеридемию, перемежающуюся хромоту, гипертонию, болезнь Кавасаки, сердечный приступ, ишемию миокарда, ортостатическую гипотензию, заболевание периферических артерий, окклюзионное поражение периферических артерий, заболевание периферических сосудов, болезнь Рейно, отказ от курения, тахикардию (высокая частота сердечных сокращений), тромбоз, варикозное расширение вен, сосудистые заболевания, венозные язвы ног, гингивит, заболевания десен, неприятный запах изо рта, рак полости рта, периодонтит, височно-нижнечелюстные расстройства, синдром височно-нижнечелюстного сустава, солнечный ожог, акне, старение кожи, алопецию, анестезию, стопу атлета, атопический дерматит, пролежни, бурситы, ожоги, ожоговые инфекции, герпес (герпетические губные инфекции), врожденные заболевания кожи, контактный дерматит, кожную красную волчанку, диабетические язвы стопы, экзему, повышенное потоотделение, болезнь Фабри, грибковые инфекции, генитальный герпес, остроконечные кондиломы, выпадение волос, удаление волос, дерматит рук, педикулез, гемангиому, наследственный ангионевротический отек, инфекции простого герпеса, инфекции опоясывающего герпеса, герпетическую невралгию, крапивницу, ихтиоз, ишемические язвы стопы, кератозы, волчанку, облысение у мужчин, злокачественную меланому, медицинское протезирование, меланому, контагиозный моллюск, грибовидный микоз, онихомикоз, обыкновенную пузырчатку, постгерпетическую невралгию, пролежневые язвы, псориаз и псориатические расстройства, псориатический артрит, порезы бритвой, розацею, саркоидоз, расстройства волосистой части головы, рубцовую ткань, склеродермию, себорею, себорейный дерматит, опоясывающий лишай, рак кожи, кожные инфекции, кожные липомы, раны кожи, солнечные лентигинозы, споротрихоз, стафилококковые кожные инфекции, застойный дерматит, растяжки, системные грибковые инфекции, солнечное отравление, стригущий лишай, микоз волосистой части головы, разноцветный лишай, уртикарию, витилиго, бородавки, раны, акромегалию, рак надпочечников, врожденную гиперплазию надпочечников, сахарный диабет (тип I и тип II), сахарный диабет (тип I), сахарный диабет (тип II), диабетический гастропарез, диабетическое заболевание почек, диабетической отек желтого пятна, диабетическую нейропатию, диабетическую ретинопатию, диабетическое кровоизлияние в стекловидное тело, дислипидемию, дефицита гормонов у женщин/гормональные нарушения, гиперлипопротеинемию фредриксоновского типа III, дефициты/нарушения гормона роста, гинекомастию, удаление волос, гиперлипидемию, дефицита гормонов, приливы, гиперпаратиреоз, идиопатическую низкорослость, показание: диабет типа II, дефицита гормонов у мужчин/гормональные нарушения, синдром МакКьюна-Олбрайта, менопаузальные расстройства, метаболический синдром, ожирение, рак яичников, рак поджелудочной железы, расстройства поджелудочной железы, панкреатит, рак паращитовидной железы, заболевание паращитовидной железы, расстройства паращитовидной железы, перименопаузу, расстройства гипофиза, синдром поликистоза яичников, постменопаузальные расстройства, постменопаузальную остеопению, преждевременное половое созревание, первичную гиперсекрецию инсулина, тяжелую низкорослость, половую дисфункцию, заболевание щитовидной железы, расстройства щитовидной железы, синдром Тернера, опухоль Вильмса, болезнь Вильсона, рак брюшной полости, ахалазию, дефицит альфа-1-антитрипсина, анальные трещины, аппендицит, пищевод Барретта, рак желчных путей, дисфункцию кишечника, глютеновую болезнь, хроническую диарею, диарею, вызванную клостридиум диффициле, рак толстой кишки, полипы толстой кишки, рак ободочной и прямой кишки, запор, болезнь Крона, диабетический гастропарез, новообразования пищеварительной системы, язвы двенадцатиперстной кишки, болезнь Фабри, недержание кала, функциональную диспепсию, расстройства желчного пузыря, рак желудка, язвы желудка, гастроэнтерит, гастроэзофагеальную рефлюксную болезнь, заболевание и расстройства желудочно-кишечного тракта, гастропарез, изжогу, хеликобактер пилори, геморрой, печеночную энцефалопатию, гепатит, кишечную непроходимость, инфекционный колит, воспалительное заболевание кишечника, внутрибрюшинные инфекции, синдром раздраженной кишки, заболевание печени, расстройства печени, неэрозивную рефлюксную болезнь, неязвенную диспепсию, отторжение органа после трансплантации органа, послеоперационную тошноту и рвоту, рвоту, рак прямой кишки, расстройства прямой кишки, рецидивирующую диарею, рак желудка, дискомфорт в желудке, язвенный колит, аномальные кровеносные сосуды, острый миелобластный лейкоз, анемию, анемию (неходжкинскую лимфому), немелкоклеточный рак легкого, анемический рак, аневризму, антифосфолипидный синдром, дефицит антитромбина, апластическую анемию, сгустки крови, кандидемию/кандидоз, хроническую почечную анемию, болезнь Гоше, злокачественное заболевание крови, гематологические расстройства, пароксизмальную гемоглобинурию, геморрагии, гиперкальциемию, гипогаммаглобулинемию, гипонатриемию, идиопатическую тромбоцитопеническую пурпуру, рак инсулярных клеток, лейкоз, В-клеточную лимфому, лимфомы, множественные миеломы, миелодиспластические синдромы, ишемию миокарда, окклюзии, дефициты тромбоцитов, тромбоцитарные нарушения, эритроцитарные нарушения, почечную анемию, синдром Сезари, серповидно-клеточную анемию, Т-клеточную лимфому, талассемию, тромбоцитопению, болезнь Виллебранда, лейкоцитарные нарушения, синдром приобретенного иммунодефицита (СПИД), СПИД-ассоциированные инфекции, острый ринит, аллергии, астму, анальную дисплазию, бактериальные инфекции, афтозные стоматиты, глютеновую болезнь, цервикальную дисплазию, ветряную оспу, синдром хронической усталости, простуду, вариабельный неклассифицируемый иммунодефицит, бактериальный конъюнктивит, хроническое обструктивное заболевание легких, кожных кандидоз, кожную Т-клеточную лимфому, цитомегаловирусные инфекции, дерматомиозит, лихорадку, гомологичную болезнь, гепатит, гепатит В, гепатит С, ВИЧ-инфекции, ВИЧ/СПИД, инфекции вируса папилломы человека, гипогаммаглобулинемию, идиопатические воспалительные миопатии, грипп, внутрибрюшные инфекции, саркому Капоши, волчанку, болезнь Лайма, инфекции, вызываемые комплексом Mycobacterium avium, менингит, онихомикоз, кандидоз ротовой полости, пневмонию, полимиозит (воспалительное заболевание мышц), постгерпетическую невралгию, первичные расстройства иммунодефицита, инфекцию респираторно-синцитиального вируса, ревматическую атаку, аллергический ринит, ротавирусную инфекцию, саркоидоз, сепсис и септицемию, заболевания, передающиеся половым путем, опоясывающий лишай, синдром Шегрена, оспу, инфекции мягких тканей, стафилококковые инфекции, стафилококковые инфекции кожи, острый фарингит, системный кандидоз, системную красную волчанку, инфекции горла и миндалин, уртикарию, резистентные к ванкомицину энтерококки, инфекции вируса Западного Нила, акромегалию, анкилозирующий спондилит, потерю костной массы, спортивные травмы, заболевания костей, метастазы в кости, боль в груди, бурситы, бурсит, туннельный кистевой синдром, повреждения хрящей, боль в груди, хроническую боль в спине, хроническую боль в ногах, хроническую боль, хроническую боль в плече, хромоту, врожденный молочный ацидоз, заболевания соединительной ткани, дерматомиозит, болезнь Дюпюитрена, фибромиалгию, синдром «замороженного плеча», адгезивный капсулит, подагру (гиперурикемию), идиопатические воспалительные миопатии, перемежающуюся хромоту, повреждения суставов, повреждения колена, рассеянный склероз, мышечную боль, мышечную дистрофию, заболевания опорно-двигательного аппарата, миастению гравис (хроническую слабость), генерализованную миастению гравис, ортопедию, остеоартрит, остеомиелит, остеопороз, остеосаркому, болезнь Педжета, частичную медиальную менискэктомию, заболевание паращитовидной железы, постменопаузальную остеопению, постменопаузальный остеопороз, синдром рефлекторной симпатической дистрофии, ревматоидный артрит, ишиас, расстройства спинного мозга, злокачественные опухоли спинного мозга, артропластику позвоночника, растяжения, повреждения сухожилий, «теннисный локоть», тиковые расстройства, анальную дисплазию, доброкачественную гиперплазию предстательной железы, рак мочевого пузыря, расстройства мочевого пузыря, раковые заболевания крови, осложнения, связанные с введением катетера, хроническую тазовую боль, диабетическое заболевание почек, энурез, эректильную дисфункцию, болезнь Фабри, никтурию, урогенитальный пролапс, гломерулонефрит, гломерулосклероз, идиопатическую мембранозную нефропатию, импотенцию, интерстициальный цистит, рак почки, заболевание почек, почечную недостаточность, камни в почках, рак печени, низкий уровень тестостерона, мастэктомию, медицинское протезирование, нефропатию, болезнь Пейрони, преждевременную эякуляцию, рак предстательной железы, расстройства предстательной железы, внутриэпителиальную неоплазию предстательной железы, протеинурию, синдром Рейтера, заболевание почечных артерий, почечно-клеточную карциному, почечную недостаточность, рак яичка, тирозинемию, стриктуры уретры, недержание мочи, инфекции мочевыводящих путей, рак уротелия, эректильную дисфункцию у мужчин и женскую половую дисфункцию, системное артериальное давление, аборт, гипотензивный контроль, ингибирование агрегации тромбоцитов, заболевания легких, заболевание желудочно-кишечного тракта, воспаление, шок, репродукцию, фертильность, ожирение.
[00127] Состояния, связанные с агрегацией тромбоцитов, включают, например, тромбоэмболию после хирургического вмешательства, каротидной эндартерэктомии, рецидив стеноза после коронарной ангиопластики, тромбоэмболические осложнения при хронической артериальной фибрилляции, окклюзии после аортокоронарного шунтирования, сердечный приступ, инсульт, мультиинфарктную деменцию, деменцию, тромбоз гемодиализного шунта и артериальные эмболические осложнения у пациентов с искусственными клапанами сердца.
[00128] Некоторые примеры состояний, поддающихся лечению способом, включающим применение пептидного НРР/НРС или его фармацевтической композиции, включают, без ограничения, связанные с пептидными гормонами состояния, воспаление и связанные с ним состояния, связанные с агрегацией тромбоцитов состояния, связанные с нейропептидами состояния, связанные с микроорганизмами состояния и другие состояния, регулируемые пептидами или родственными пептидам соединениями.
[00129] В некоторых вариантах реализации способ лечения состояния, поддающегося лечению пептидами, включает введение в биологическую систему пептидного НРР/НРС пептида или родственного пептиду соединения, такого как ангиотензин, антагонисты ангиотензина II, рецептор АТ2 ангиотензина II, противомикробные пептиды, анти-окситоцин, гормоны, антидиуретические гормоны, адренокортикотропные гормоны, противомикробный пептид, противовоспалительный пептид, брадикинин, антагонист брадикинина, эндотелиновые пептиды, антагонист эндотелинового пептида, гастрин, кальцитонин, ассоциированный с меланомой антигенный пептид, ламининовый пептид, фибриногенный пептид, индуцирующие ЕАЕ пептиды, факторы роста, пептиды, высвобождающие гормон роста, соматостатин, гормоны, высвобождающие гормоны, гормон, высвобождающий лютеинизирующий гормон, нейропептид, меланоцит-стимулирующие гормоны, пептид сна, амилоидный пептид, тафтсин, ретроинверсо-тафтсин, энтеростатины, Меланокортин II и опиоидные пептиды, и миметики.
[00130] В некоторых вариантах реализации способ лечения состояния, связанного с пептидными гормонами, включает введение в биологическую систему НРР/НРС пептидного гормона или родственного пептидному гормону соединения, или их фармацевтической композиции. В биологической системе гормоны регулируют широкий диапазон процессов, таких как энергетические уровни, репродукция, рост и развитие, гомеостаз и реакции на окружающие условия, стресс и травму. Примеры состояний, связанных с пептидными гормонами, включают, без ограничения:
a) менопаузу;
b) заболевания костей, например, остеопороз, болезнь Педжета и метастазы в кости;
c) дефицит гормона роста;
d) гипертиреоз или гипотиреоз;
e) расстройство метаболизма, например, ожирение, аномальный уровень глюкозы в крови, аномальный уровень липидов в крови, сахарный диабет (тип I и/или тип II) и индуцируемые диабетом осложнения, включая диабетическую ретинопатию, некробиотические язвы и диабетическую протеинурию;
f) аномальное кровяное давление, например, гипертонию и гипотонию;
g) кожное состояние, например, псориаз и псориатические расстройства, акне, кистозное акне, заполненные гноем или красноватые пузырьки, комедоны, папулы, пустулы, узелки, эпидермоидные кисты, волосяной кератоз, аномальные сосудистые повреждения кожи, родимые пятна, родинки (невусы), мягкие бородавки, склеродермию, витилиго и родственные заболевания или старческие пятна (печеночные пятна);
h) аутоиммунное заболевание, например, дискоидную красную волчанку, системную красную волчанку (СКВ), аутоиммунный гепатит, склеродермию, синдром Шегрена, ревматоидный артрит, полимиозит, склеродермию, тиреоидит Хашимото, ювенильный сахарный диабет, болезнь Аддисона, витилиго, злокачественную анемию, гломерулонефрит, фиброз легких, рассеянный склероз (PC) и болезнь Крона;
i) заболевание глаз, например, глаукому, глазную гипертензию, потерю зрения после офтальмологической операции, зрение теплокровного животного, нарушенное кистозным макулярным отеком, и катаракту;
j) преэкламптическую токсемию у женщин группы высокого риска
k) мужскую и женскую половую дисфункцию;
l) аллергию и астму;
m) бессонницу;
n) депрессию и связанные с ней состояния;
о) сердечно-сосудистые заболевания, например сердечный приступ, нестабильную стенокардию, окклюзионное поражение периферических артерий и инсульт;
р) опухоль, например, доброкачественную опухоль, рак молочной железы, рак ободочной и прямой кишки, рак ротовой полости, раковые опухоли легких или других органов дыхательной системы, раковые опухоли кожи, рак матки, рак поджелудочной железы, рак предстательной железы, генитальный рак, раковые опухоли органов мочевыделения, лейкоз или другой рак крови и лимфатических тканей; и
q) метастазирование.
[00131] В некоторых вариантах реализации способ лечения состояния, связанного с микроорганизмами, включает введение в биологическую систему НРР/НРС противомикробного пептида или родственного противомикробному пептиду соединения, или их фармацевтической композиции. Примеры состояний, связанных с микроорганизмами, включают, без ограничения, воспаление и связанные с ним состояния:
a) боль;
b) травмы;
c) состояния, связанные с микроорганизмами;
d) связанные с воспалением состояния, например, воспаление предстательной железы (простатит), простатоцистит, увеличивающий предстательную железу фиброз, геморрой, синдром Кавасаки, гастроэнтерит, мембранопролиферативный гломерулонефрит 1-типа, синдром Бартера, хронический увеит, анкилозирующий спондилит, гемофилическую артропатию, воспаление геморроидальных узлов, постлучевой (искусственный) проктит, хронический язвенный колит, воспалительное заболевание кишечника, криптит, периодонтит, артрит и воспалительное состояние в органе, выбранном из группы, состоящей из печени, легкого, желудка, головного мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, прямой и ободочной кишки, кишечника, вены, дыхательной системы, сосудистой системы, аноректума, и анальный зуд.
[00132] В некоторых вариантах реализации способ лечения состояния, связанного с нейропептидами, включает введение в биологическую систему НРР/НРС нейропептида или родственного нейропептиду соединения, или их фармацевтической композиции. Примеры состояний, связанных с нейропептидами, включают, без ограничения, боль и нейродегенеративное заболевание, например, болезнь Альцгеймера и болезнь Паркинсона.
[00133] Другие состояния, поддающиеся лечению НРР/НРС или его фармацевтической композицией, включают, без ограничения, состояния, связанные с: агрегацией тромбоцитов, например, тромбоэмболия после хирургического вмешательства, каротидной эндартерэктомии, рецидив стеноза после коронарной ангиопластики, тромбоэмболические осложнения при хронической артериальной фибрилляции, окклюзии после аортокоронарного шунтирования, сердечный приступ, инсульт, мультиинфарктная деменция, деменция, тромбоз гемодиализного шунта и артериальные эмболические осложнения у пациентов с искусственными клапанами сердца; дородовым, послеродовым периодом, видами активности против AD, видами антидиуретической активности, гомеостазом кальция, меланоцитом, активностью ЦНС и фагоцитозом.
[00134] В некоторых вариантах реализации способ лечения состояния у субъекта, облегчаемого или поддающегося лечению пептидами или родственными пептидам соединениями, включает введение терапевтически эффективного количества пептидного НРР/НРС или его фармацевтической композиции указанному субъекту.
[00135] НРР/НРС или его фармацевтическая композиция может быть введена в биологическую систему любым способом введения, известным в данной области техники, включая, без ограничения, пероральное, энтеральное, трансбуккальное, назальное, топическое, ректальное, вагинальное, аэрозольное, трансмукозальное, эпидермальное, трансдермальное, дермальное, офтальмологическое введение, легочное введение, подкожное и/или парентеральное введение. Указанные фармацевтические композиции могут быть введены в различных дозированных лекарственных формах в зависимости от способа введения.
[00136] Парентеральное введение относится к способу введения, который, как правило, относится к инъекции, включающей, но не ограничивающейся ими, внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, внутриглазную, внутрисердечную, внутрикожную, интраперитонеальную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную и/или интрастернальную инъекцию и/или инфузию.
[00137] НРР/НРС или его фармацевтическая композиция может быть введена субъекту в форме составов или препаратов, подходящих для каждого способа введения. Составы, подходящие в способах согласно настоящему изобретению, содержат одно или более НРР/НРС, один или более фармацевтически приемлемых носителей для них и возможно другие терапевтические ингредиенты. Составы могут быть удобно представлены в дозированной лекарственной форме и могут быть получены любыми способами, хорошо известными в области фармации. Количество активного компонента, который может быть комбинирован с веществом-носителем для получения единой лекарственной формы, будет варьировать в зависимости от вылечиваемого субъекта и конкретного способа введения. Количество НРР/НРС, которое может быть комбинировано с веществом-носителем с получением фармацевтически эффективной дозы, как правило, будет представлять собой такое количество НРР/НРС, которое оказывает терапевтический эффект. Как правило, из ста процентов данное количество будет находиться в диапазоне от примерно 1 процента до примерно девяносто девяти процентов НРР/НРС, предпочтительно от примерно 20 до примерно 70 процентов.
[00138] Способы получения данных составов или композиций включают этап приведения НРР/НРС в соединение с одним или более фармацевтически приемлемыми носителями и, возможно, одним или более дополнительными компонентами. В целом, указанные составы получают путем равномерного и тщательного приведения НРР/НРС в соединение с жидкими носителями или тонкоизмельченными твердыми носителями, или обоими, а затем, при необходимости, путем формования продукта.
[00139] Составы, подходящие для перорального введения, могут быть в форме капсул, облаток, пилюль, таблеток, пастилок (с использованием ароматизированной основы, как правило, сахарозы и камеди или трагаканта), порошков, гранул или в виде раствора, или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде пастилок (с использованием инертного основания, такого как желатин и глицерин, или сахароза и камедь), и/или в виде полосканий для рта и т.п., каждое из которых содержит заранее определенное количество НРР/НРС в качестве активного компонента. Соединение также может быть введено в виде болюса, электуария или пасты.
[00140] В твердых лекарственных формах для перорального введения (например, капсулах, таблетках, пилюлях, драже, порошках, гранулах и т.п.) НРР/НРС находится в смеси с по меньшей мере одним или более фармацевтически приемлемыми носителями, такими как цитрат натрия или дикальцийфосфат, и/или с любым из следующих веществ: (1) наполнители или сухие разбавители, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; (2) связующие вещества, такие как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь; (3) смачивающие вещества, такие как глицерин; (4) разрыхлители, такие как агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия, 5) ингибиторы растворения, такие как парафин, (6) ускорители абсорбции, такие как соединения четвертичного аммония; (7) увлажняющие агенты, такие как, например, ацетиловый спирт и моностеарат глицерина; (8) абсорбенты, такие как каолиновая и бентонитовая глина; (9) смазывающие вещества, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и смеси указанных соединений; и (10) красители. В случае капсул, таблеток и пилюль фармацевтические композиции также могут содержать буферные агенты. Твердые композиции сходного типа также могут быть использованы в качестве наполнителей в мягких и твердых желатиновых капсулах с применением таких наполнителей, как лактоза или молочный сахар, а также высокомолекулярных полиэтиленгликолей и т.п.
[00141] Таблетка может быть получена путем прессования или формования, возможно совместно с одним или более дополнительными компонентами. Прессованные таблетки могут быть получены с использованием связующего вещества (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натрия крахмалгликолята или сшитой карбоксиметилцеллюлозы натрия), поверхностно-активного или диспергирующего агента. Формованные таблетки могут быть получены путем формования в подходящем устройстве смеси порошкообразного пептида или пептидомиметика, смоченного инертным жидким разбавителем. Таблетки и другие твердые лекарственные формы, такие как драже, капсулы, таблетки и гранулы, могут представлять собой таблетки с рисками или могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в области приготовления фармацевтических препаратов. Они также могут быть получены таким образом, чтобы обеспечивать медленное или контролируемое высвобождение НРР/НРС с использованием, например, гидроксипропилметилцеллюлозы в различных пропорциях для обеспечения требуемых характеристик высвобождения, других полимерных матриц, липосом и/или микросфер. Они могут быть стерилизованы, например, путем фильтрования через фильтр, удерживающий бактерии, или путем включения стерилизующих веществ в форме стерильных твердых композиций, которые могут быть растворены в стерильной воде или другой стерильной среде для инъекций непосредственно перед применением. Данные композиции также могут содержать успокаивающие вещества и иметь состав, обеспечивающий возможность постепенного высвобождения HPP(s)/HPC(s) исключительно или предпочтительно в определенной части желудочно-кишечного тракта. Примеры заливочных композиций, которые могут быть использованы, включают полимерные вещества и воски. НРР/НРС также может находиться в микроинкаспулированной форме, при необходимости, совместно с одним или более вышеописанными наполнителями.
[00142] Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо НРР/НРС, жидкие лекарственные формы могут содержать инертные разбавители, обычно применяемые в данной области техники, такие как, например, вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, масло ростков, оливковое, касторовое и кунжутное масло), глицерин, тетрагидрофуриловый спирт, полиэтиленгликоли и сорбитановые эфиры жирных кислот, и смеси указанных веществ. Кроме инертных разбавителей композиции для перорального введения также могут содержать адъюванты, такие как смачивающие агенты, эмульгаторы и суспендирующие агенты, подсластители, ароматизаторы, красители, отдушки и консерванты.
[00143] Суспензии помимо НРР/НРС могут содержать суспендирующие агенты такие как, например, этоксилированные изостеариловые спирты, полиоксиэтиленсорбит и сорбитановые эфиры, микрокристаллическая целлюлоза, метагидроксид алюминия, бентонит, агар-агар и трагакант, и смеси указанных веществ.
[00144] Составы для ректального или вагинального введения могут быть представлены в виде суппозитория, который может быть получен путем смешивания одного или более НРР/НРС с одним или более подходящими нераздражающими наполнителями или носителями, например, маслом какао, полиэтиленгликолем, воском для суппозиторий или салицилатом, и который является твердыми при комнатной температуре, но становится жидким при температуре тела, а, следовательно, будет плавиться в ректальной или вагинальной полости и высвобождать активный агент.Составы, подходящие для вагинального введения, также включают пессарии, тампоны, кремы, гели, пасты, пены или составы в виде спрея, содержащие указанные носители, которые, как известно в данной области техники, являются подходящими,
[00145] Составы для топического или трансдермального, или эпидермального, или дермального введения композиции НРР включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и ингаляционные препараты. Активный компонент может быть смешан в стерильных условиях с фармацевтически приемлемым носителем, таким как вода, этанол и раствор этанола, и любыми консервантами, буферами или пропеллентами, которые могут быть необходимы. Помимо композиции НРР, указанные мази, пасты, кремы и гели могут содержать наполнители, такие как жиры животного и растительного происхождения, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка или смеси указанных веществ. Помимо композиции НРР, порошки и спреи могут содержать наполнители, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси данных веществ. Спреи могут дополнительно содержать традиционные пропелленты, такие как хлорфторуглеводороды и летучие не содержащие заместители углеводороды, такие как бутан и пропан.
[00146] НРР/НРС или его фармацевтическая композиция в качестве альтернативы может быть введена посредством аэрозоля. Это может быть осуществлено путем получения водного аэрозоля, липосомального препарата или твердых частиц, содержащих HPPs/HPCs. Может быть использована неводная (например, с фторуглеродным пропеллентом) суспензия. Также могут быть использованы ультразвуковые распылители. Водный аэрозоль получают путем получения водного раствора или суспензии агента совместно с традиционными фармацевтически приемлемыми носителями и стабилизаторами. Указанные носители и стабилизаторы варьируют в зависимости от требований конкретного соединения, но, как правило, включают неионные поверхностно-активные вещества (Твины (Tweens), Плюроники (Pluronics) или полиэтиленгликоль), безопасные белки, такие как сывороточный альбумин, сорбитановые эфиры, олеиновую кислоту, лецитин, аминокислоты, такие как глицин, буферы, соли, сахара или сахарные спирты. Аэрозоли, как правило, получают из изотонических растворов.
[00147] Трансдермальные пластыри также можно применять для доставки композиций НРР в участок опухоли. Указанные составы могут быть получены путем растворения или диспергирования агента в подходящей среде. Усилители абсорбции также можно применять для увеличения проникновения пептидомиметика через кожу. Скорость указанного проникновения можно контролировать либо путем обеспечения контролирующей скорость мембраны, либо путем диспергирования пептидомиметика в полимерной матрице или геле.
[00148] В некоторых вариантах реализации трансдермальная терапевтическая система нанесения содержит пептидное НРР/НРС в качестве активного вещества для лечения состояний, поддающихся лечению исходным соединением, при этом указанная система представляет собой спрей или раствор для втирания, дополнительно содержащий растворитель, который может растворять пептидное НРР/НРС. Примеры растворителя включают, без ограничения, органические растворители и неорганические растворители, такие как вода, этанол, изопропанол, ацетон, ДМСО, ДМФ и комбинации указанных растворителей.
[00149] В некоторых вариантах реализации трансдермальная терапевтическая система нанесения содержит пептидное НРР/НРС в качестве активного вещества для лечения состояний, поддающихся лечению исходным соединением, при этом указанная система дополнительно включает объект, содержащий матричный слой, из активного вещества, и непроницаемый защитный слой. В некоторых вариантах реализации указанный объект представляет собой пластырь или бинт. В некоторых вариантах реализации указанный объект представляет собой резервуар с активным веществом, имеющий проницаемое дно, обращенное к коже, при этом путем контроля скорости высвобождения указанная система позволяет достигать постоянно оптимальных терапевтических уровней активного компонента или метаболита активного компонента в крови с увеличением эффективности и уменьшением побочных эффектов активного компонента или метаболита активного компонента.
[00150] Офтальмологические составы, глазные мази, порошки, растворы и т.п.также включены в объем настоящего изобретения.
[00151] Составы, подходящие для парентерального введения, содержат НРР/НРС в комбинации с одним или более фармацевтически приемлемыми стерильными изотоническими водными или неводными растворами, дисперсиями, суспензиями или эмульсиями, или стерильными порошками, которые могут быть восстановлены с получением стерильных растворов или дисперсий для инъекций непосредственно перед применением, которые могут содержать антиоксиданты, буферы, бактериостаты, растворенные вещества, приводящие состав в состояние изотоничности с кровью предполагаемого реципиента, или суспендирующие агенты или загустители.
[00152] Примеры подходящих водных и неводных носителей, которые могут быть использованы в составах, подходящих для парентерального введения, включают воду, этанол, полиолы (например, такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и подходящие смеси указанных веществ, растительные масла, такие как оливковое масло, и органические эфиры для инъекций, такие как этилолеат.Подходящая текучесть может быть сохранена, например, путем применения веществ для покрытия, таких как лецитин, путем поддержания необходимого размера частиц в случае дисперсий, а также путем применения поверхностно-активных веществ.
[00153] Составы, подходящие для парентерального введения, также могут содержать адъюванты, такие как консерванты, смачивающие агенты, эмульгаторы и диспергирующие агенты. Предотвращение развития микроорганизмов может быть обеспечено путем включения различных антибактериальных и противогрибковых агентов, например, парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п.Также может быть необходимым включение в композиции изотонических агентов, таких как сахара, хлорид натрия и т.п.Кроме того, пролонгированная абсорбция фармацевтической формы для инъекций может быть обеспечена путем включения агентов, замедляющих абсорбцию, таких как моностеарат алюминия и желатин.
[00154] Депо-формы для инъекций получают путем создания микрокапсульных матриц НРР/НРС в биоразлагаемых полимерах, таких как полилактид-полигликолид. В зависимости от соотношения НРР/НРС и полимера, и природы конкретного применяемого полимера, можно контролировать скорость высвобождения лекарственного средства. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Депо-составы для инъекций также получают путем введения НРР/НРС в состав липосом или микроэмульсий, совместимых с тканью организма.
[00155] В некоторых вариантах реализации пептидное НРР/НРС или его фармацевтическую композицию доставляют в участок заболевания или опухоли в терапевтически эффективной дозе. Как известно в области фармакологии, точное количество фармацевтически эффективной дозы НРР/НРС, которое позволит получить наиболее эффективные результаты в отношении эффективности лечения у данного пациента, будет зависеть, например, от активности, конкретной природы, фармакокинетики, фармакодинамики и биодоступности конкретного НРР/НРС, физиологического состояния субъекта (включая расу, возраст, пол, массу, диету, тип и стадию заболевания, общее физическое состояние, отвечаемость на данную дозу и вид лекарственного препарата), природы фармацевтически приемлемых носителей в составе, применяемого способа и частоты введения, и тяжести или предрасположенности к заболеванию, вызываемому патогенными целевыми микробными организмами, например. Однако вышеприведенное руководство может быть использовано в качестве основы для корректировки лечения, например, определения оптимальной дозы для введения, для которой будет необходимо не более чем рутинное проведение экспериментов, состоящее из наблюдения субъекта и регулировки дозы. Remington: The Science and Practice of Pharmacy (Gennaro ed. 20.sup.th edition, Williams & Wilkins PA, USA) (2000).
IV. ПРЕИМУЩЕСТВА
[00156] Пептиды и родственные соединения являются гидрофильными и обладают ограниченной способностью проникать через кожный мембранный барьер. При приеме пептидов перорально, пептиды и родственные соединения могут быть быстро протеолизированы протеолитическими ферментами в желудочно-кишечном тракта в течение нескольких минут. В случае инъекции введение пептидов является болезненным и во многих случаях требует частых и дорогостоящих посещений клиники для лечения хронических состояний.
[00157] В некоторых вариантах реализации поскольку пептидное НРР/НРС способно проходить через один или более биологических барьеров с более высокой эффективностью, чем его исходное соединение, НРР/НРС может быть введен местно (например, топически или трансдермально) для достижения участка, где возникает состояние, без необходимости системного введения (например, перорального или парентерального введения). Местное введение и проникновение НРР/НРС позволяет НРР/НРС достигать того же уровня местной концентрации агента или лекарственного средства при гораздо меньшем количестве или дозе НРР/НРС по сравнению с системным введением исходного агента или лекарственного средства; в качестве альтернативы, более высокий уровень местной концентрации, который не может быть обеспечен при системном введении, или если возможно, требует значительно более высокой дозы агента при системном введении. Высокая местная концентрация НРР/НРС или его исходного агента в случае расщепления позволяет осуществлять лечение состояния более эффективно или гораздо быстрее, чем системно доставляемый исходный агент и осуществлять лечение новых состояний, которое могло быть невозможным или не наблюдаемым ранее. Местное введение НРР/НРС позволяет уменьшить возможные страдания у биологического субъекта, вызванные системным введением, например, нежелательные реакции, связанные с системным воздействием агента, эффекты со стороны желудочно-кишечного тракта/почек. Кроме того, местное введение позволяет НРР/НРС проходить через множество биологических барьеров и распространяться системно посредством, например, общего кровообращения и, таким образом, избегать необходимости в системном введении (например, инъекции) и избегать боли, связанной с парентеральной инъекцией.
[00158] В некоторых вариантах реализации НРР/НРС или фармацевтическая композиция согласно настоящему изобретению может быть введена системно (например, трансдермально, перорально или парентерально). НРР/НРС или активный агент (например, лекарственное средство или метаболит) НРР/НРС может поступать в кровоток с более высокой скоростью, чем исходный агент, и получать более быстрый доступ к эпицентру состояния. Кроме того, НРР/НРС может проходить через биологический барьер (например, гематоэнцефалический барьер), который не был преодолен при введении исходного агента отдельно и, таким образом, предлагает новый вид лечения состояний, который мог быть невозможным или не наблюдаемым ранее.
[00159] Например, пептидные НРР/НРС могут демонстрировать высокую скорость проникновения через биологический барьер (например, >примерно в 10 раз, >примерно в 50 раз, >примерно в 100 раз, >примерно в 200 раз, >примерно в 300 раз, >примерно в 1000 раз выше скорости, чем в случае, если пептиды или родственные пептидам соединения вводят отдельно). Наблюдают отсутствие или незначительное количество нежелательных побочных эффектов у субъектов, получавших пептидные НРР/НРС, тогда как наблюдают побочные эффекты (такие как тошнота, потеря волос и повышенная восприимчивость к инфекции) у субъектов, получавших исходные пептиды в такой же дозе.
V. ПРИМЕРЫ
[00160] Следующие примеры приведены для лучшей иллюстрации заявленного изобретения и никоим образом не ограничивают объем настоящего изобретения. Все конкретные композиции, вещества и способы, описанные ниже, полностью или частично находятся в пределах объема настоящего изобретения. Данные конкретные композиции, вещества и способы не ограничивают настоящее изобретения, а лишь иллюстрируют конкретные варианты реализации, находящиеся в пределах объема настоящего изобретения. Специалист в данной области техники может получать эквивалентные композиции, вещества и способы без реализации изобретательского объема и в пределах объема настоящего изобретения. Очевидно, что в процедурах, указанных в настоящем описании, возможны многие вариации в пределах объема настоящего изобретения. Включение указанных вариаций в объем настоящего изобретения является намерением авторов изобретения. Пример 1. Получение НРР/НРС из исходного лекарственного средства. Получение НРР/НРС из исходного лекарственного средства, содержащего по меньшей мере одну карбоксильную группу.
[00161] В некоторых вариантах реализации исходное соединение, имеющее следующую Структуру F-C:
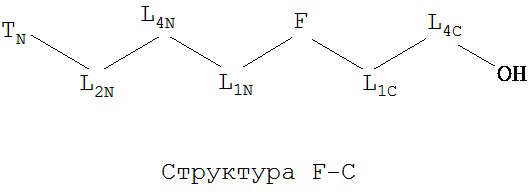
Структура F-C превращают в НРР/НРС, имеющую Структуру L-1:

включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1C, l1N, L2C, L2N, L4C и L4N определены, как указано выше;
Те представляет собой транспортную единицу пептидного НРР/НРС. Например, Те выбран из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше; и
TN выбран из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп.
[00162] В некоторых вариантах реализации настоящего изобретения НРР/НРС, имеющую Структуру L-1, получают в соответствии с органическим синтезом путем осуществления взаимодействия исходных соединений или производных исходных соединений, имеющих Структуру D (например, галогенангидридов, смешанных ангидридов исходных соединений и т.д.):
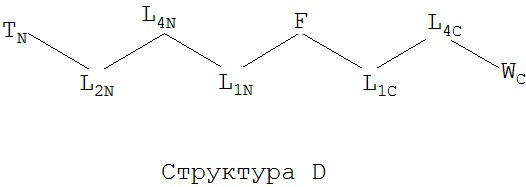
с соединениями Структуры Е (Схема I):
где WC выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и содержащего заместители арилоксикарбонилокси; и
F, L1C, L1N, L2C, L2N, L4C, L4N, TC и TN определены, как указано выше.

Схема 1. Получение НРР/НРС из исходного соединения (I).
[00163] В некоторых вариантах реализации НРР/НРС, имеющую Структуру L-1, получают в соответствии со Схемой 1, описанной выше, где L4C представляет собой С=O.
[00164] В некоторых вариантах реализации исходное соединение, имеющее следующую Структуру F:
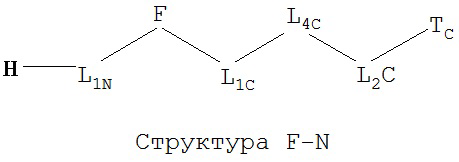
Структура F-N реагирует с соединением, имеющим следующую Структуру W:
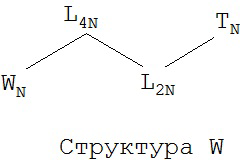
Структура W с получением НРР/НРС Структуры L:

Структура L-1
включая ее стереоизомеры и фармацевтически приемлемые соли, где:
F, L1C, L1N, L2C, L2N, L4C и L4N определены, как указано выше;
TN представляет собой транспортную единицу пептидного НРР/НРС. Например, TN выбран из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше; и
Те выбран из группы, состоящей из ничего, Н, замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, и замещенных и незамещенных гетероарильных групп.
WN выбран из группы, состоящей из ОН, галогена, алкоксикарбонила и содержащего заместители арилоксикарбонилокси. (Схема 2)
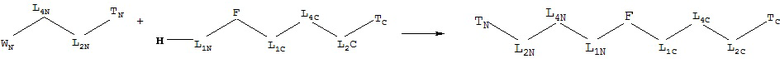
Схема 2. Получение НРР/НРС из исходного соединения (II).
[00165] В некоторых вариантах реализации НРР/НРС, имеющую структуру, соответствующую Структуре L-2, получают путем органического синтеза, при этом нежелательные реакционноспособные участки, такие как -СООН, -NH2, -ОН или -SH защищают перед связыванием транспортной единицы с функциональной единицей в соответствии с одним из способов синтеза, описанных выше. В некоторых вариантах реализации с полученного защищенного НРР/НРС затем может быть частично или полностью снята защита с получением частично защищенного НРР/НРС или незащищенного НРР/НРС соответственно.
Получение Ас-Val-Pro-Asp(OEt)-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅HCl
[00166] Получение Н-Arg(диАс)-OCH2CH2N(СН2СН3)2: 30,8 г Z-Arg-OH растворяли в 500 мл ацетона. 200 мл 20% NaOH добавляли к реакционной смеси. К реакционной смеси по каплям добавляли 40 г ангидрида уксусной кислоты. Смесь перемешивали в течение 2 часов при комнатной температуре (RT). Растворитель выпаривали. Остаток экстрагировали 500 мл этилацетата. Раствор этилацетата промывали водой (3×100 мл). Фазу этилацетата сушили над сульфатом натрия. Раствор этилацетата выпаривали досуха. Остаток (Z-Arg(диAc)-OH, 30 г) растворяли в 300 мл ацетонитрила. Смесь охлаждали до 0°С с помощью бани с ледяной водой. К реакционной смеси добавляли 12 г N,N-диэтиламиноэтанола, 2 г 4-диметиламинопиридина и 22 г 1,3-дициклогексилкарбодиимида. Реакционную смесь перемешивали в течение 1 часа при 0°С и в течение ночи при комнатной температуре. Твердое вещество удаляли путем фильтрования и раствор выпаривали досуха. Остаток экстрагировали этилацетатом (2×250 мл). Раствор этилацетата промывали 5% бикарбонатом натрия (1×500 мл) и водой (3×100 мл). Раствор этилацетата сушили над сульфатом натрия. Раствор выпаривали досуха. Остаток [Z-Arg(диАс)-OCH2CH2N(CH2CH3)2,28 г] растворяли в 300 мл метанола. К раствору добавляли 2 г 10% Pd/C. Смесь перемешивали в течение 10 часов в атмосфере водорода при комнатной температуре. Pd/C удаляли путем фильтрования. Раствор выпаривали досуха с получением 22 г H-Arg(диАс)-OCH2CH2N(CH2CH3)2.
[00167] Получение Boc-Asp(OEt)-Pro-OSu: 15 г L-пролина растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 36 г Boc-Asp(OEt)-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом ЗН HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. 25 г остатка (Boc-Asp(OEt)-Pro-OH) и 11 г N-гидроксисукцинимида растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С. К реакционной смеси добавляли 16 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 1 часа при 0°С. Твердое вещество удаляли путем фильтрования. Раствор дихлорметилена промывали 5% бикарбонатом натрия (1×200 мл) и водой (3×200 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха с получением 28 г Boc-Asp(OEt)-Pro-OSu.
[00168] Получение Н-ASp(ОЕО-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅2ТФУ: 22 г Н-Arg(AHAc)-OCH2CH2N(CH2CH3)2 растворяли в 300 мл 5% NaHCO3. К реакционной смеси добавляли 24 г Boc-Asp(OEt)-Pro-OSu в 150 мл ацетона. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Раствор этилацетата промывали водой (3×100 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. Остаток растворяли в 250 мл дихлорметилена. К смеси добавляли 200 мл трифторуксусной кислоты и смесь перемешивали в течение 30 минут. Смесь выпаривали досуха с получением 32 г H-Asp(OEt)-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅2ТФУ.
[00169] Получение Ac-Val-Pro-OSu: 15 г L-пролина растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 26 г Ac-Val-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом 3 Н HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. 20 г остатка (Ac-Val-Pro-OH) и 11 г N-гидроксисукцинимида растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С. К реакционной смеси добавляли 16 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 1 часа при 0°С. Твердое вещество удаляли путем фильтрования. Раствор дихлорметилена промывали 5% бикарбонатом натрия (1×200 мл) и водой (3×200 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха с получением 20 г Ac-Val-Pro-OSu.
[00170] Получение Ac-Val-Pro-Asp(OEt)-Pro-Arg(диАс)-OCH2CH2N(CH2CH3)2⋅HCl: 31 г Н-Asp(OEt)-Pro-Arg(диAc)-OCH2CH2N(CH2CH3)2⋅2ТФУ растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 15 г Ac-Val-Pro-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Органическую фазу промывали водой (3×100 мл). Фазу этилацетата сушили над сульфатом натрия. Сульфат натрия удаляли путем фильтрования. К раствору добавляли 15 г HCl (газ) в диоксане (200 мл). Твердое вещество собирали и промывали эфиром (3×50 мл). После сушки получали 20 г необходимого продукта (гигроскопичного продукта). Элементарный анализ: C39H66ClN9O11; ММ: 872,45. Рассчитано, % С: 53,69; Н: 7,62; С1: 4,06; N: 14,45; О: 20,17; Обнаружено, % С: 53,61; Н: 7,67; С1: 4,10; N: 14,40, О: 20,22. MS: m/e: 836,4; m/e+1: 836,4.
Получение Ас-Tyr(Ас)-Cly-Cly-Phe-Met-OCH2CH2N(СН2СН3)2⋅HCl.
[00171] Получение Н-Met-OCH2CH2N(CH2CH3)2⋅ТФУ: 25 г Boc-Met-ОН растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С с помощью бани с ледяной водой. К реакционной смеси добавляли 12 г N,N-диэтиламиноэтанола, 2 г 4-диметиламинопиридина и 22 г 1,3-дициклогексилкарбодиимида. Реакционную смесь перемешивали в течение 1 часа при 0°С и в течение ночи при комнатной температуре. Твердое вещество удаляли путем фильтрования и раствор дихлорметилена промывали 5% бикарбонатом натрия (1×500 мл) и водой (3×100 мл). Раствор этилацетата сушили над сульфатом натрия. Раствор выпаривали досуха. Остаток [Вос-Met-OCH2CH2N(СН2СН3)2,30 г] растворяли в 250 мл дихлорметилена. К смеси добавляли 250 г трифторуксусной кислоты и смесь перемешивали в течение 30 минут. Раствор выпаривали досуха с получением 26 г Н-Met-OCH2CH2N(СН2СН3)2⋅ТФУ.
[00172] Получение Boc-Gly-Phe-OSu: 20 г L-фенилаланина растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 28 г Boc-Gly-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом ЗН HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. 22 г остатка (Boc-Gly-Phe-OH) и 10 г N-гидроксисукцинимида растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С. К реакционной смеси добавляли 15 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 1 часа при 0°С. Твердое вещество удаляли путем фильтрования. Раствор дихлорметилена промывали 5% бикарбонатом натрия (1×200 мл) и водой (3×200 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха с получением 25 г Boc-Gly-Phe-OSu.
[00173] Получение Н-Cly-Phe-Met-OCH2CH2N(СН2СН3)2⋅ТФУ: 25 г H-Met-OCH2CH2N(СН2СН3)2⋅ТФУ растворяли в 300 мл 5% NaHCO3. К реакционной смеси добавляли 22 г Boc-Gly-Phe-OSu в 150 мл ацетона. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Раствор этилацетата промывали водой (3×100 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. Остаток растворяли в 250 мл дихлорметилена. К смеси добавляли 200 мл трифторуксусной кислоты и смесь перемешивали в течение 30 минут. Смесь выпаривали досуха с получением 25 г Н-Cly-Рhe-Меt-ОСН2СН2Н(СН2СН3)2⋅ТФУ.
[00174] Получение Ac-Tyr(Ac)-Gly-OSu: 11 г L-глицина растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 36 г Ac-Tyr(Ac)-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом 3Н HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. 28 г остатка (Ac-Tyr(Ac)-Gly-OH) и 13 г N-гидроксисукцинимида растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С. К реакционной смеси добавляли 18 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 1 часа при 0°С. Твердое вещество удаляли путем фильтрования. Раствор дихлорметилена промывали 5% бикарбонатом натрия (1×200 мл) и водой (3×200 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха с получением 20 г Ac-Tyr(Ac)-Gly-OSu.
[00175] Получение Ас-Tyr(Ас)-Cly-Cly-Рhе-Меt-ОСН2СН2М(СН2СН3)2⋅HCl: 24 г H-Gly-Phe-Met-OCH2CH2N(СН2СН3)2⋅ТФУ растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 15 г Ac-Tyr(Ac)-Gly-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Органическую фазу промывали водой (3×100 мл). Фазу этилацетата сушили над сульфатом натрия. Сульфат натрия удаляли путем фильтрования. К раствору добавляли 15 г HCl (газ) в диоксане (200 мл). Твердое вещество собирали и промывали эфиром (3×50 мл). После сушки получали 18 г необходимого продукта (гигроскопичного продукта). Элементарный анализ: C37H53ClN6O9S; ММ: 793,37. Рассчитано % С: 56,01; Н: 6,73; С1: 4,47; N: 10,59; О: 18,15; S: 4,04. Обнаружено % С: 55,96; Н: 6,76; Cl: 4,52; N: 10,54, О: 18,19; S: 4,03. MS: m/e: 757,4; m/e+1: 758,4.
Получение Ас-Val-Pro-Cly-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅HCl
[00176] Получение Boc-Gly-Pro-OSu: 15 г L-пролина растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 27,2 г Boc-Gly-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом 3Н HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. 21 г остатка (Boc-Gly-Pro-OH) и 11 г N-гидроксисукцинимида растворяли в 300 мл дихлорметилена. Смесь охлаждали до 0°С.К реакционной смеси добавляли 17 г 1,3-дициклогексилкарбодиимида. Смесь перемешивали в течение 1 часа при 0°С. Твердое вещество удаляли путем фильтрования. Раствор дихлорметилена промывали 5% бикарбонатом натрия (1×200 мл) и водой (3×200 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха с получением 23 г Boc-Gly-Pro-OSu.
[00177] Получение Н-Cly-Pro-Arg(диАс)-ОСН2СН2М(СН2СН3)2⋅2ТФУ: 22 г Н-Arg(диАс)-OCH2CH2N(СН2СН3)2 растворяли в 300 мл 5% NaHCO3. К реакционной смеси добавляли 20 г Boc-Gly-Pro-OSu в 150 мл ацетона. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Раствор этилацетата промывали водой (3×100 мл). Органический раствор сушили над сульфатом натрия. Раствор выпаривали досуха. Остаток растворяли в 250 мл дихлорметилена. К смеси добавляли 200 мл трифторуксусной кислоты и смесь перемешивали в течение 30 минут. Смесь выпаривали досуха с получением 28 г Н-Cly-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅2ТФУ.
[00178] Получение Ас-Val-Pro-Cly-Pro-Arg(диАс)-OCH2CH2N(СН2СН3)2⋅HCl: 26 г H-Gly-Pro-Arg(диАс)-OCH2CH2N(CH2CH3)2⋅2ТФУ растворяли в 300 мл 10% бикарбоната натрия. К реакционной смеси добавляли 150 мл ацетона и 15 г Ac-Val-Pro-OSu. Смесь перемешивали в течение 5 часов при комнатной температуре. К смеси добавляли 500 мл этилацетата. Органическую фазу промывали водой (3×100 мл). Фазу этилацетата сушили над сульфатом натрия. Сульфат натрия удаляли путем фильтрования. К раствору добавляли 15 г HCl (газ) в диоксане (200 мл). Твердое вещество собирали, промывали эфиром (3×50 мл) и сушили с получением 18 г необходимого продукта (гигроскопичного продукта). Элементарный анализ: C35H60ClN9O9; MM: 786,36. Рассчитано, % С: 53,46; Н: 7,69; Cl: 4,51; N: 16,03; О: 18,31; Обнаружено, % С: 53,43; Н: 7,73; Cl: 4.55; N: 16,01, О: 18,29. MS: m/e: 750,4; m/e+1: 751,4.
Получение цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(дисАс)-Trp-Lys-OCH2CH2N(CH2CH3)2⋅HCl. [00179]
Получение Ас-Nle-Asp(OFm)-ОН: 43 г Н-Asp(OFm)-ОН⋅ТФУ и 27 г Ac-Nle-OSu суспендировали в 300 мл ацетона. К реакционной смеси добавляли 300 мл 5% NaHC03. Смесь перемешивали в течение ночи при комнатной температуре. Смесь промывали эфиром (1×300 мл). К водной фазе добавляли 500 мл этилацетата. рН смеси доводили до 2,4-2,5 с помощью охлажденной льдом 3 Н HCl. Фазу этилацетата собирали и промывали водой (3×300 мл). Органический раствор сушили'над сульфатом натрия. Раствор выпаривали досуха с получением 42 г Ac-Nle-Asp(OFm)-OH.
[00180] Получение Fmoc-Trp-Lys(4-Pyoc)-OH: H-Lys(4-Pyoc)-OH получали согласно источнику (Н. Kunz and S. Bimbach, Tetrahedron Lett., 25, 3567, 1984; Н. Kunz and R. Barthels, Angew. Chem., Int. Ed. Engl., 22, 783, 1983). 33 r H-Lys(4-Pyoc)-OH суспендировали в 300 мл 5% NaHCO3. К реакционной смеси добавляли 300 мл ацетона и 52 г Fmoc-Trp-OSu. Смесь перемешивали в течение ночи при комнатной температуре. Смесь промывали эфиром (1×500 мл). К смеси добавляли 500 мл этилацетата и рН смеси доводили до 2,2-2,3 с помощью 3 Н HCl. Фазу этилацетата собирали и промывали водой. Органический раствор сушили над сульфатом натрия. Органический раствор выпаривали досуха с получением 55 г Fmoc-Trp-Lys(4-Pyoc)-OH.
[00181] Получение цикло(l,6)-Ac-Nle-Asp-His-Phe-Arg(диАс)-Trp-Lys-OH: 100 г смолы Ванга суспендировали в 700 мл раствора ДМФ, содержащего 50 г Fmoc-Trp-Lys(4-Pyoc)-OH, 13 г 1-гидроксибензотриазола, 2 г 4-диметиламинопиридина и 12 г N,N-диизопропилкарбодиимида. Смесь перемешивали в течение ночи при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл 20% пиперидина. Смесь перемешивали в течение 30 минут. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл ДМФ, 48 г Fmoc-Arg(диАс)-OH, 13 г 1-гидроксибензотриазола, 35 мл триэтиламина и 38 г 0-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Смесь перемешивали в течение 2 часов при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл 20% пиперидина. Смесь перемешивали в течение 30 минут. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл ДМФ, 39 г Fmoc-Phe-ОН, 13 г 1-гидроксибензотриазола, 35 мл триэтиламина и 38 г 0-(бензотриазол-1-ил)-N,N,N’,N'-тетраметилурония. Смесь перемешивали в течение 2 часов при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл 20% пиперидина. Смесь перемешивали в течение 30 минут. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл ДМФ, 60 г Fmoc-His(Fmoc)-OH, 13 г 1-гидроксибензотриазола, 35 мл триэтиламина и 38 г 0-(бензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Смесь перемешивали в течение 2 часов при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл 20% пиперидина. Смесь перемешивали в течение 30 минут. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл ДМФ, 60 г Ac-Nle-Asp(OFm)-OH, 13 г 1-гидроксибензотриазола, 35 мл триэтиламина и 38 г 0-(бензотриазол-1-ил)-N,N,N',N’-тетраметилурония. Смесь перемешивали в течение 2 часов при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). Пептидную смолу суспендировали в 700 мл ДМФ. К реакционной смеси добавляли 50 г MeI. Смесь перемешивали в течение 1 часа при комнатной температуре и 1 часа при 50°С. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл 30% пиперидина. Смесь перемешивали в течение 60 минут. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 700 мл ДМФ, 13 г 1-гидроксибензотриазола, 35 мл триэтиламина и 38 г 0-(бензотриазол-1-ил)- N,N,N',N'-тетраметилурония. Смесь перемешивали в течение 10 часов при комнатной температуре. Смолу собирали путем фильтрования и промывали ДМФ (3×400 мл), метанолом (3×400 мл) и дихлорметиленом (3×400 мл). К смоле добавляли 500 мл трифторуксусной кислоты и смесь перемешивали в течение 1 часа при комнатной температуре. Смолу удаляли путем фильтрования и раствор выпаривали досуха. Остаток промывали эфиром (3×100 мл).
[00182] Получение цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(диАс)-Trp-Lys-OCH2CH2N(CH2CH3)2⋅HCl: 10 г цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(диАс)-Trp-Lys-OH растворяли в 300 мл ДМФ. Смесь охлаждали до 0°С с помощью бани с ледяной водой. К реакционной смеси добавляли 12 г N,N-диэтиламиноэтанола, 2 г 4-диметиламинопиридина и 22 г 1,3-дициклогексилкарбодиимида. Реакционную смесь перемешивали в течение 1 часа при 0°С и в течение ночи при комнатной температуре. Твердое вещество удаляли путем фильтрования и раствор дихлорметилена промывали 5% бикарбонатом натрия (1×500 мл) и водой (3×100 мл). Раствор этилацетата сушили над сульфатом натрия. К раствору добавляли 2 г HCl в диоксане (20 мл). Твердое вещество собирали и промывали эфиром (3×30 мл). Выход составлял 8 г конечного продукта. Твердофазный синтез пептидного НРР/НРС.
[00183] Пептидное НРР/НРС пептида получают с использованием тритилхлоридной смолы и 2-(4-нитрофенилсульфонил)этильной группы в качестве защитной группы карбоксильной группы (Схема 3), где:
 представляет собой смолу;
представляет собой смолу;
X1 выбран из группы, состоящей из Н, Cl, метила и метоксила;
R1, R2,…Rn представляют собой боковые цепи аминокислот пептидного НРР/НРС, пронумерованные 1, 2,…n соответственно от N-конца к С-концу;
реагенты для реакции сочетания выбраны из группы, состоящей из HBTU/DIPEA/HOBt, TBTU/DIPEA/HOBt, BOP/DIPEA/HOBt, HATU/DIPEA/HOBt, DIC/HOB и комбинаций указанных веществ; и
RT выбран из группы, состоящей из замещенных и незамещенных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных гетероциклоалкильных, замещенных и незамещенных алкоксильных, замещенных и незамещенных алкенильных, замещенных и незамещенных алкинильных, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных групп, и транспортная единица выбрана из группы, состоящей из Структуры Na, Структуры Nb, Структуры Nc, Структуры Nd, Структуры Ne, Структуры Nf, Структуры Ng, Структуры Nh, Структуры Ni, Структуры Nj, Структуры Nk, Структуры Nl, Структуры Nm, Структуры Nn, Структуры No, Структуры Np, Структуры Nq и Структуры Nr, определенной выше.
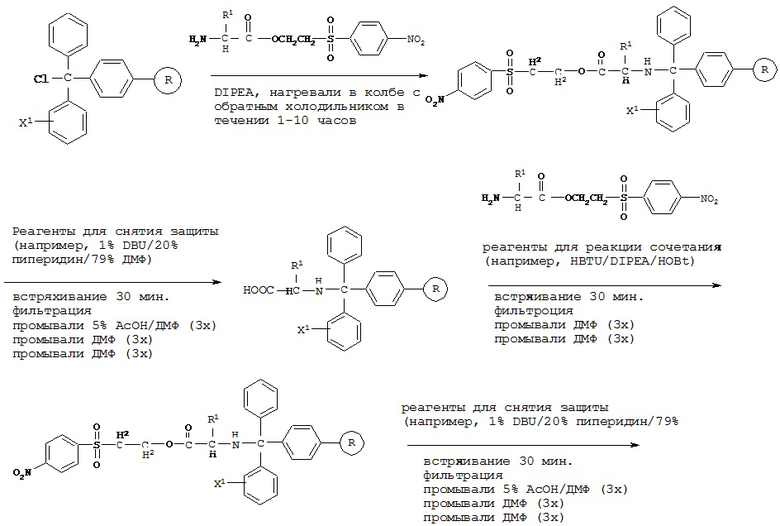
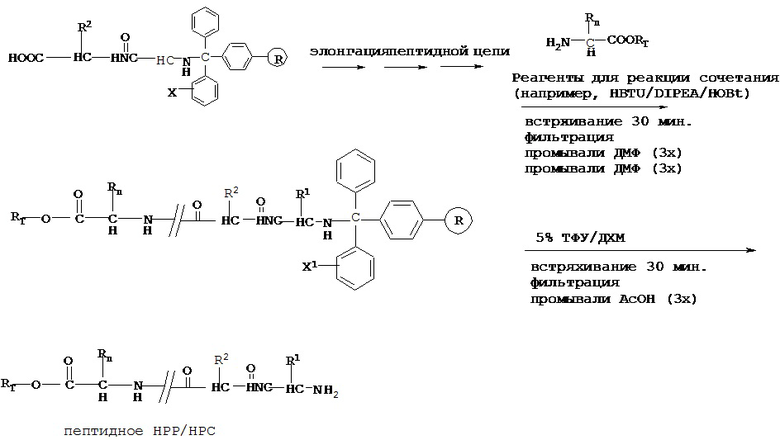
Схема 3: Синтез пептидного НРР/НРС с использованием тритилхлоридной смолы и 2-(4-нитрофенилсульфонил)этильной группы в качестве защитной группы карбоксильной группы
[00184] В настоящем описании, если не определено иное, «ДХМ» означает дихлорметан.
[00185] В некоторых вариантах реализации пептидное НРР/НРС получают с использованием тритилхлоридной смолы и 9-флуоренилметильной группы в качестве защитной группы карбоксильной группы (Схема 4), где  , X1, R1, R2,…Rn, RT и реагенты для реакции сочетания определены, как указано выше.
, X1, R1, R2,…Rn, RT и реагенты для реакции сочетания определены, как указано выше.
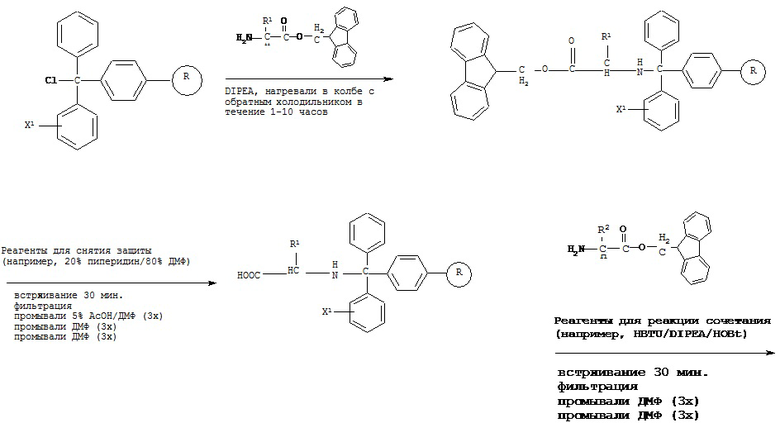
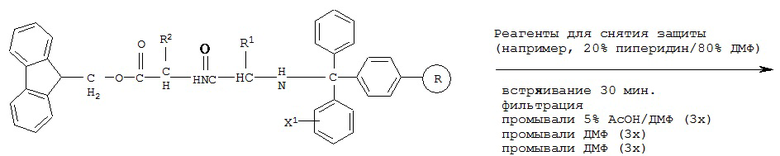
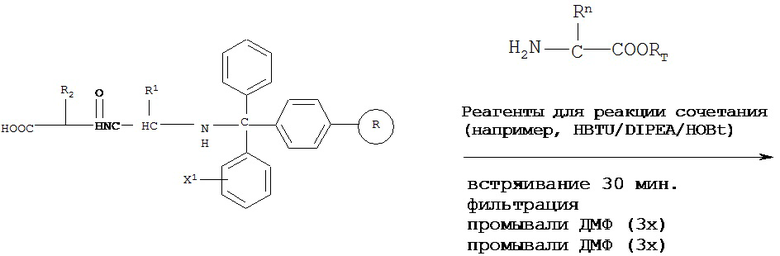
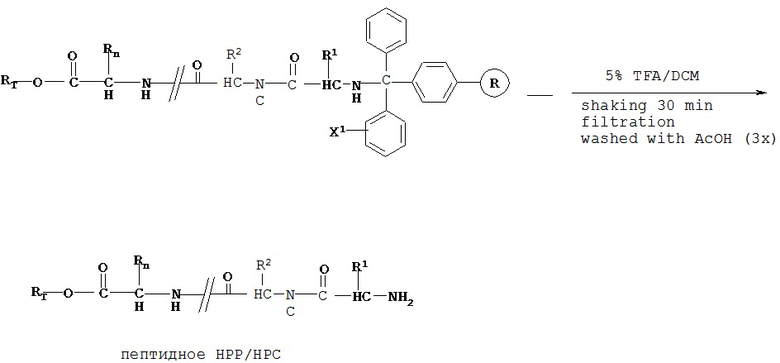
Схема 4: Синтез пептидного НРР/НРС с применением тритилхлоридной смолы и 9-флуоренилметильной группы в качестве защитной группы карбоксильной группы [00186] В некоторых вариантах реализации пептидное НРР/НРС получают с применение карбонатной эфирной смолы и 9-флуоренилметильной группы в качестве защитной
группы карбоксильной группы (Схема 5), где  , R1, R2,…Rn, RT, и реагенты для реакции сочетания определены, как указано выше.
, R1, R2,…Rn, RT, и реагенты для реакции сочетания определены, как указано выше.
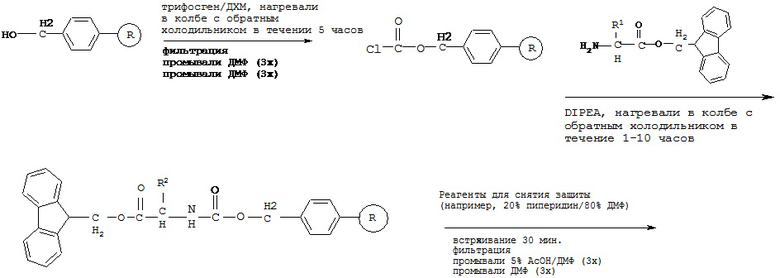
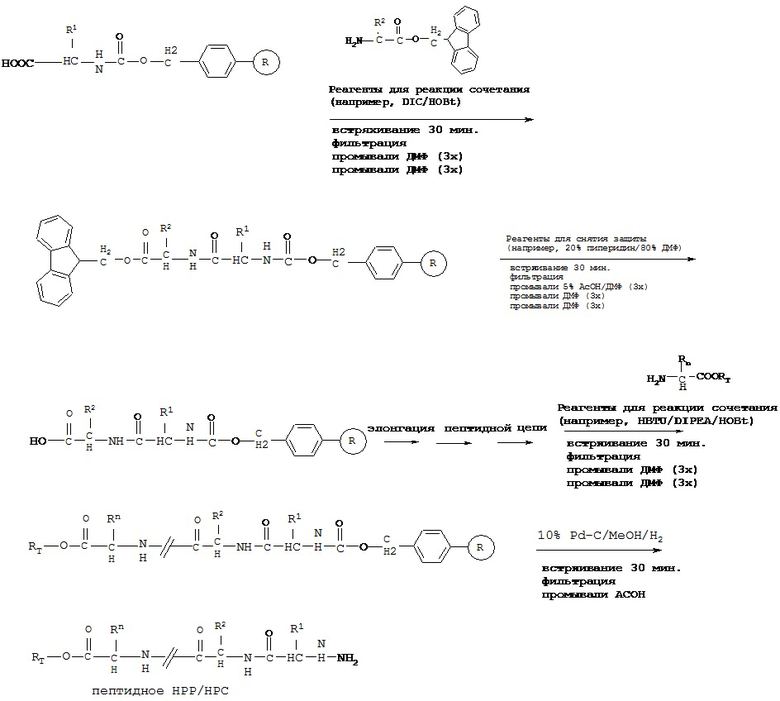
Схема 5: Синтез пептидного НРР/НРС с применением карбонатной эфирной смолы и 9-флуоренилметильной группы в качестве защитной группы карбоксильной группы. [00187] В некоторых вариантах реализации пептидное НРР/НРС получают с применением карбонатной эфирной смолы и 2-(4-нитрофенилсульфонил)этильной группы в качестве защитной группы карбоксильной группы (Схема 6), где  для R1, R2,…Rn, RT и реагенты для реакции сочетания определены, как указано выше.
для R1, R2,…Rn, RT и реагенты для реакции сочетания определены, как указано выше.
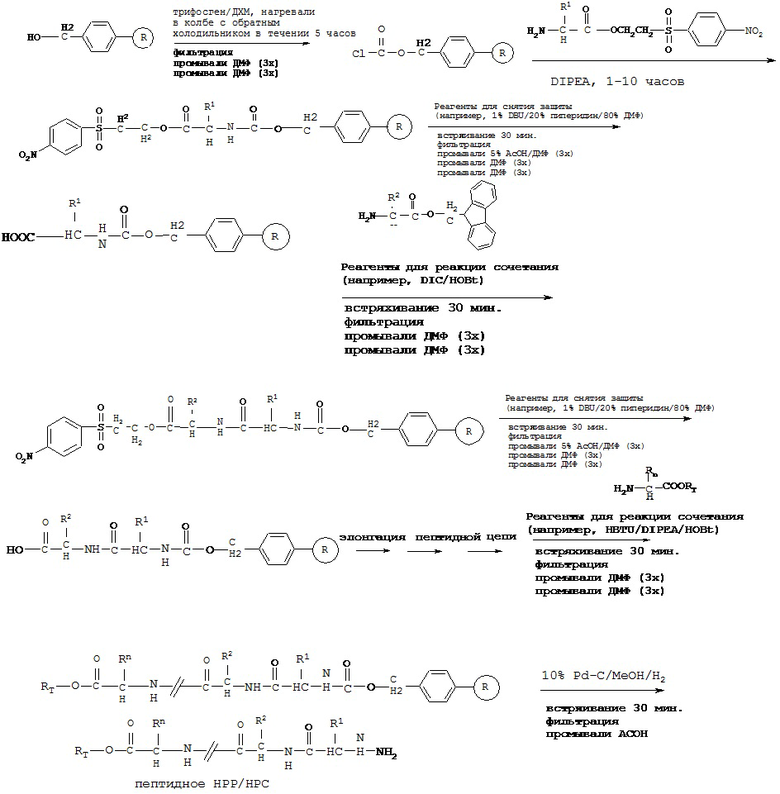
Схема 6: Синтез пептидного НРР/НРС с использованием карбонатной эфирной смолы и 2-(4-нитрофенилсульфонил)этильной группы в качестве защитной группы карбоксильной группы.
Пример 2. Пептидные НРР/НРС демонстрировали более высокие скорости проникновения in vitro через кожу человека по сравнению с их исходными лекарственными средствами.
[00188] Скорости проникновения HPPs/HPCs и их исходных лекарственных средств через кожу человека измеряли in vitro с помощью модифицированных ячеек Франца. Указанные ячейки Франца содержат две камеры, верхнюю камеру для образца и нижнюю приемную камеру. Ткань кожи человека (толщина 360-400 мкм), которая отделяла верхнюю и приемную камеру, выделяли из передней или задней области бедра.
[00189] Тестируемое соединение (2 мл, 20% в 0,2 М фосфатном буфере, рН 7,4) помещали в камеру для образца ячейки Франца. Приемная камера содержит 10 мл рН 7,4 фосфатного буфера (0,2 М), который перемешивали при 600 об/мин. Количество тестируемого соединения, проникающее через кожу, определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ). Результаты показаны на Фиг.2. Наблюдаемые значения проникновения тестируемых соединений рассчитывали по наклонам на Фиг.2 и суммировали в Таблице 1 соответственно.
[00190] Поскольку самые низкие детектируемые наблюдаемые значения проникновения в данном способе составляли 1 мкг/см2/час, исходные лекарственные средства, демонстрировавшие наблюдаемое значение проникновения, равное или меньше 1 мкг/см /час, рассматривали как недетектируемые в отношении проникновения через ткань кожи. HPPs/HPCs данных лекарственных средств (например, энтеростатины, Val-Pro-Gly-Pro-Arg (VPGPR), Меланокортин II (цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg-Trp-Lys-OH), опиоидные пептиды (например, Met-энкефалин (H-Tyr-Gly-Gly-Phe-Met-OH) составляли 1 мкг/см^час, поэтому они были недетектируемы в отношении проникновения через ткань кожи. Однако их HPPs/HPCs обладали детектируемым наблюдаемым значением проникновения. Следовательно, пептидные НРР/НРС демонстрировали более высокую скорость проникновения (в 340-600 раз выше) через ткань кожи по сравнению с их исходными соединениями.
Пример 3 Превращение HPPs/HPCs в их исходные лекарственные средства.
[00191] Пептидные НРР/НРС быстро превращались в исходные пептиды или родственные пептидам соединения с хорошим выходом в плазме крови человека.
[00192] Пептидное НРР/НРС (20 мг) инкубировали с цельной кровью (1 мл) в течение 30 минут при 37°С и анализировали путем ВЭЖХ. Результаты показывали, что большая часть пептидных НРР/НРС снова превращалась в исходные пептиды или родственные пептидам соединения (Таблица 2).
В) Гидролиз HCl⋅(CH3)2NCH2CH2CH2CO-Tyr(Ac)-Gly-Gly-Phe-Met-OCH2CH2CH2CH3,
С) Гидролиз цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(диАс)-Trp-Lys-OCH2CH2N(CH2CH3)2⋅HCl
Пример 4. Лечение ожирения с применением пептидных НРР/НРС.
[00193] Энтеростатины [Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR), и Ala-Pro-Gly-Pro-Arg (APGPR)] представляют собой пентапептиды, получаемые из МН2-конца проколипазы после триптического гидролиза, и относятся к семейству пептидов «кишечник-головной мозг». Они регулируют потребление жира и могут быть использованы для лечения ожирения (Erianson-Albertsson С, York D, Obes. Rev. 1997 Jul; 5(4): 360-72 и Sorhede M, Mei J, ErIanson-Albertsson С., J Physiol. 87:273-275,1993). H-Val-Pro-Asp-Pro-Arg-OH осуществлял дозозависимое снижение потребления пищи при введении интраперитонеально путем инъекции крысам линии Осборн-Мендель, которым не давали есть в течение ночи. Данное подавление питания наблюдали, когда крысы получали рацион питания с высоким содержанием жиров, и не наблюдали у крыс, получавших рацион питания с высоким содержанием углеводов, низким содержанием жиров (Okada S. et al. Physiol Behav., 1991 Jun; 49(6): 1185-9).
Направленная против ожирения активность H-Val-Pro-Gly-Pro-Arg(NO2)-ОСН(СН3)2⋅HCl у крыс линии Sprague Dawley и мышей линии DB/DB.
[00194] H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl (вводимый трансдермально, по 0,3 мг/кг крысе) снижал потребление пищи и массу тела у крыс линии Sprague Dawley (крысы SD) и мышей линии DB/DB. Результаты представлены в Таблицах 3, 4 и 5.
[00195] В первом эксперименте 40 самок крыс линии Sprague Dawley (15 недельные, 318-346 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl в 0,2 мл воды вводили трансдермально в спину крысы (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl эффективно снижал массу тела крыс (Таблица 3).
[00196] Во втором эксперименте 40 молодых самок крыс линии Sprague Dawley (SD) (ISO-225 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl в 0,2 мл воды вводили трансдермально в спину крыс (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl эффективно контролировал избыточную массу тела молодых крыс (Таблица 4).
[00197] В третьем эксперименте 40 страдающих ожирением самок мышей линии DB/DB (мыши линии SLAC/DB/DB, 16 недельные, 55-60 г) делили на 4 группы. В группе А 0,1 мл воды вводили в спину мыши (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 15 мг/кг, 1,5 мг/кг и 0,5 мг/кг H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl в 0,1 мл воды вводили трансдермально в спину мыши (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(NO2)-OCH(CH3)2⋅HCl эффективно снижал массу тела и уровни глюкозы в крови страдающих ожирением мышей (Таблица 5).
Направленная против ожирения активность Н-Val-Pro-Cly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl у крыс линии Sprague Dawlev.
[00198] H-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl (вводимый трансдермально, по 0,3 мг/кг крысе) снижал потребление пищи и массе тела у крыс линии SD и мышей линии DB/DB. Результаты представлены в Таблицах 6, 7 и 8.
[00199] В первом эксперименте 40 самок крыс линии Sprague Dawley (SD) (15 недельные, 315-340 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крысы (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(дисАс)-OCH2CH2CH2CH3⋅HCl эффективно снижал массу тела крыс (Таблица 6).
[00200] Во втором эксперименте 40 молодых самок крыс линии Sprague Dawley (SD) (ISO-230 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крыс (n=10) дважды в сутки в течение 30 дней. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl эффективно контролировал избыточную массу тела молодых крыс (Таблица 7).
[00201] В третьем эксперименте 40 страдающих ожирением самок мышей линии DB/DB (мыши линии SLAC/DB/DB) (16 недельные, 55-60 г) делили на 4 группы. В группе А 0,1 мл воды вводили в спину мыши (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 15 мг/кг, 1,5 мг/кг и 0,5 мг/кг H-Val-Pro-Gly-Pro-Arg(диАс)-OCH2CH2CH2CH3⋅HCl в 0,1 мл воды вводили трансдермально в спину мыши (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Gly-Pro-Arg(диАс)- OCH2CH2CH2CH3⋅HCl эффективно снижал массу тела и уровни глюкозы в крови страдающих ожирением мышей (Таблица 8).
Направленная против ожирения активность H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl у крыс линии Sprague Dawley.
[00202] H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl (вводимый трансдермально, по 0,3 мг/кг крысе) снижал потребление пищи и массу тела у крыс линии SD и мышей линии DB/DB. Результаты представлены в Таблицах 9,10 и 11.
[00203] В первом эксперименте 40 самок крыс линии Sprague Dawley (SD) (15 недельные, 320-345 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг Н-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крысы (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl эффективно снижал массу тела крыс (Таблица 9).
[00204] Во втором эксперименте 40 молодых самок крыс линии Sprague Dawley (SD) (182-223 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крыс (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что Н-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl эффективно контролировал избыточную массу тела крыс (Таблица 10).
[00205] В третьем эксперименте 40 страдающих ожирением самок мышей линии DB/DB (SLAC/DB/DB) (16 недельные, 53-61 г) делили на 4 группы. В группе А 0,1 мл воды вводили в спину мыши (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 15 мг/кг, 1,5 мг/кг и 0,5 мг/кг H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3»HCl в 0,1 мл воды вводили трансдермально в спину мыши (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Ala-Pro-Gly-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl эффективно снижал массу тела и уровни глюкозы в крови страдающих ожирением мышей (Таблица 11).
Направленная против ожирения активность H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-ОСН2СН2СН2СН3⋅HCl у крыс линии Sprague Dawlev.
[00206] H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl (вводимый трансдермально, по 0,3 мг/кг крысе) снижал потребление пищи и массу тела у крыс линии SD и мышей линии DB/DB. Результаты представлены в Таблицах 12,13 и 14. [00207] В первом эксперименте 40 самок крыс линии Sprague Dawley (SD) (15 недельные, 320-350 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крысы (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl эффективно снижал массу тела крыс (Таблица 12).
[00208] Во втором эксперименте 40 молодых самок крыс линии Sprague Dawley (SD) (185-220 г) делили на 4 группы. В группе А 0,2 мл воды вводили в спину крысы (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 10 мг/кг, 1 мг/кг или 0,3 мг/кг H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl в 0,2 мл воды вводили трансдермально в спину крыс (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl эффективно контролировал избыточную массу тела крыс (Таблица 13).
[00209] В третьем эксперименте 40 страдающих ожирением самок мышей линии DB/DB (SLAC/DB/DB) (16 недельные, 53-61 г) делили на 4 группы. В группе А 0,1 мл воды вводили в спину мыши (n=10) дважды в сутки в течение 30 дней. В группах В, С и D 15 мг/кг, 1,5 мг/кг и 0,5 мг/кг H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-OCH2CH2CH2CH3⋅HCl в 0,1 мл воды вводили трансдермально в спину мыши (n=10) дважды в сутки в течение 30 дней соответственно. Результаты показывали, что H-Val-Pro-Asp(OEt)-Pro-Arg(NO2)-ОСН2СН2СН2СН3⋅HCl эффективно снижал массу тела и уровни глюкозы в крови страдающих ожирением мышей (Таблица 14).
Пример 5 Лечение эректильной дисфункции (ЭД) и женской половой дисфункции пептидными НРР/НРС
[00210] Меланокортин II представляет собой циклический лактамный пептид цикло(1,6)-Ас-Nle-Asp-His-Phe-Arg-Trp-Lys-OH. Он представляет собой новое потенциальное лекарственное средство Palatin (AMEX:PTN) для лечения мужской и женской половой дисфункции. Первый в новом классе терапевтических средств, называемых агонистами меланокортина, меланокортин II перспективен в эффективном лечении эректильной дисфункции (ЭД) и женской половой дисфункции при отсутствии эффектов на сердечнососудистую систему, встречающихся у существующих лекарственных средств для лечения ЭД. Меланокортин II действует по механизму, в который вовлечена центральная нервная система, а не напрямую на сосудистую систему. В результате, он может оказывать значительные полезные эффекты в отношении безопасности и эффективности по сравнению с существующими продуктами.
[00211] НРР/НРС Меланокортина II диффундировала через кожу человека с очень высокой скоростью (~0,3-0,5 мг/час/см2) и представляла собой способы лечения эректильной дисфункции или усиления полового возбуждения у женщин, почти не обладающие побочными эффектами.
[00212] 2 мг/кг цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(диАс)-Trp-Lys-OCH2CH2N(СН2СН3)2⋅HCl (пептид А) в 0,2 мл рН 7,0 фосфатного буфера (0,1 М) наносили на спину самцов крыс (Группа А-1, 30 крыс) один раз в сутки в течение 5 дней. Такую же дозу цикло(1,6)-Ac-Nle-Asp-His-Phe-Arg(NO2)-Trp-Lys-OCH2CH2N(CH2CH3)2⋅HCl (пептид В) наносили на спину другой группы самцов крыс (Группа В-1, 30 крыс). Крысы контрольной группы не получали лечение никаким лекарственным средством. Результаты показывали 5-кратное увеличение приставания и 3-кратное увеличение спаривания для Группы А-1 по сравнению с отрицательной контрольной группой. Наблюдали 6-кратное увеличение приставания и 3-кратное увеличение спаривания для Группы В-1 у крыс по сравнению с контрольной группой (Таблица 15).
[00213] 2 мг/кг пептида А и пептида В в 0,2 мл рН 7,0 фосфатного буфера (0,1 М) наносили на спину как самцов крыс (30 крыс), так и самок крыс (30 крыс) один раз в сутки в течение 5 дней. Крысы контрольной группы не получали лечение никаким лекарственным средством. Результаты показывали 6-кратное увеличение приставания и 5-кратное увеличение спаривания как для Группы А-2, так и для Группы В-2 по сравнению с контрольной группой (Таблица 15).
X: лечили НРР/НРС (2 мг/кг в 0,2 мл рН 7,0 фосфатного буфера (0,1 М)), наносили на спину один раз в сутки в течение 5 дней.
Пример 6. Ингибирование корчей посредством HPPs/HPCs энкефалина и родственных соединений.
[00214] Опиоидные пептиды (например, Met-энкефалин (H-Tyr-Gly-Gly-Phe-Met-OH), Leu-энкефалин (H-Tyr-Gly-Gly-Phe-Leu-OH), H-Tyr-D-Ala-Gly-N-Me-Phe-Met(O)-OL и H-Tyr-D-Ala-Gly-Phe-Leu-OH) оказывают морфиноподобное анальгетическое действие. Подсчитывали число корчей, происходящих при введении мышам раствора уксусной кислоты интраперитонеально, и рассчитывали скорость ингибирования на основе контрольной группы. HCl⋅H-Tyr(Ac)-D-Ala-Gly-Phe-Leu-OCH2(CH2)4CH3 (10 мг/кг, В), Ас-Tyr(Ac)-D-Ala-Gly-Phe-Leu-OCH2CH2N(CH2CH3)⋅HCl (10 мг/кг, С) и HCl⋅H-Tyr(Ac)-D-Ala-Gly-Phe-Met(O)-OL (10 мг/кг, D) вводили трансдермально на шее мышей. Через 30 минут вводили раствор уксусной кислоты. Группа А представляла собой контрольную группу. Результаты представлены в Таблице 16.
[00215] Опиоидные пептиды представляют собой природные пептиды, вырабатываемые животными и нестабильные в биологических системах. Они не вызывают привыкания и они предназначены не только для лечения любой боли от зубной боли, головной боли, артрита, любого воспаления, лихорадки, рака, дисменореи и острой мигрени, но и для лечения наркотической зависимости.
Соответствующие исходные пептиды HPPs/HPCs, представленные в примерах, приведены ниже в Таблице D.













































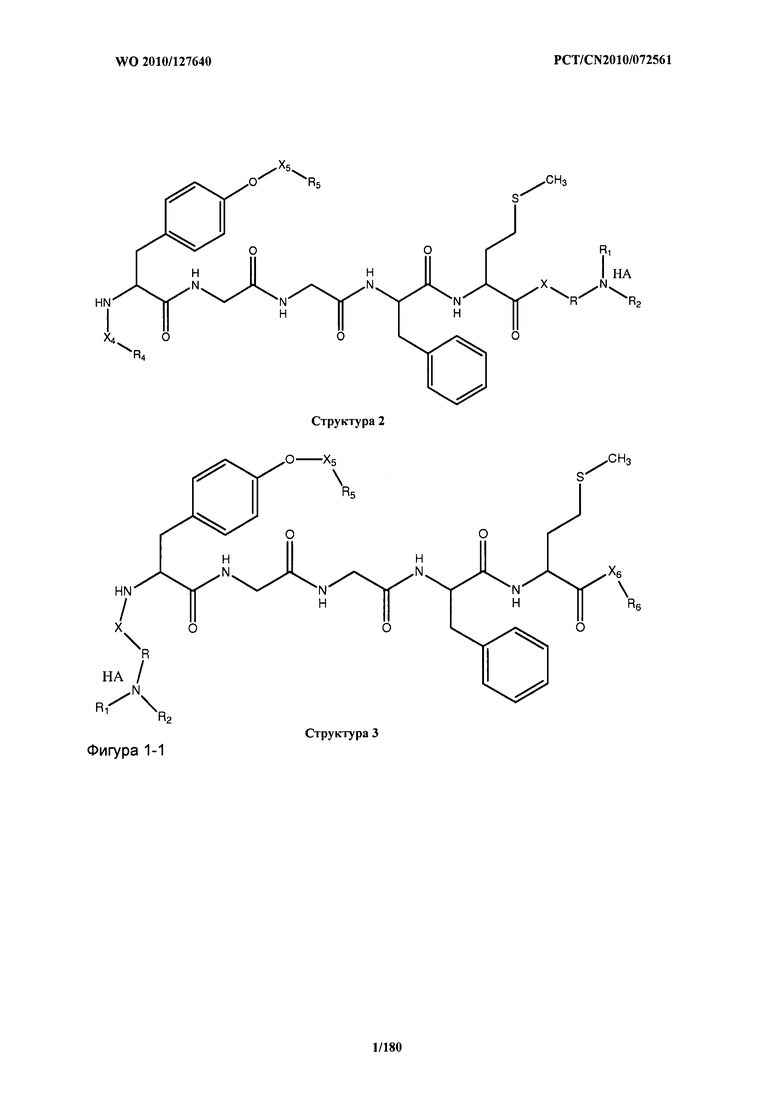
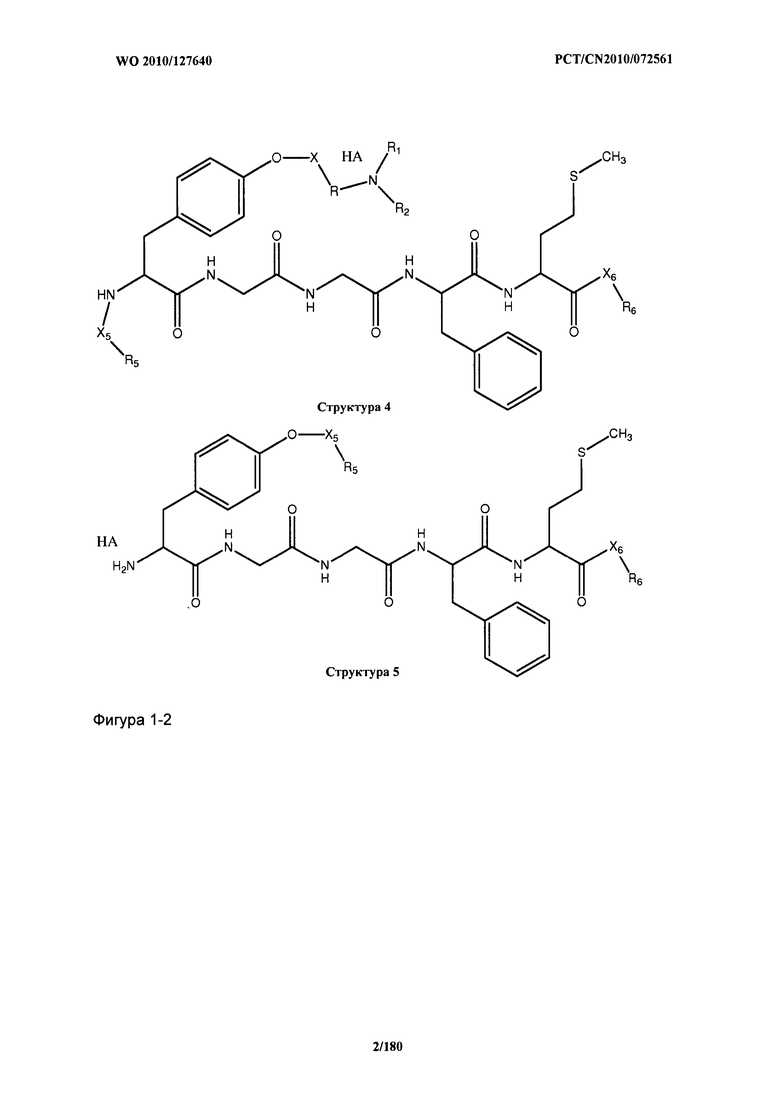
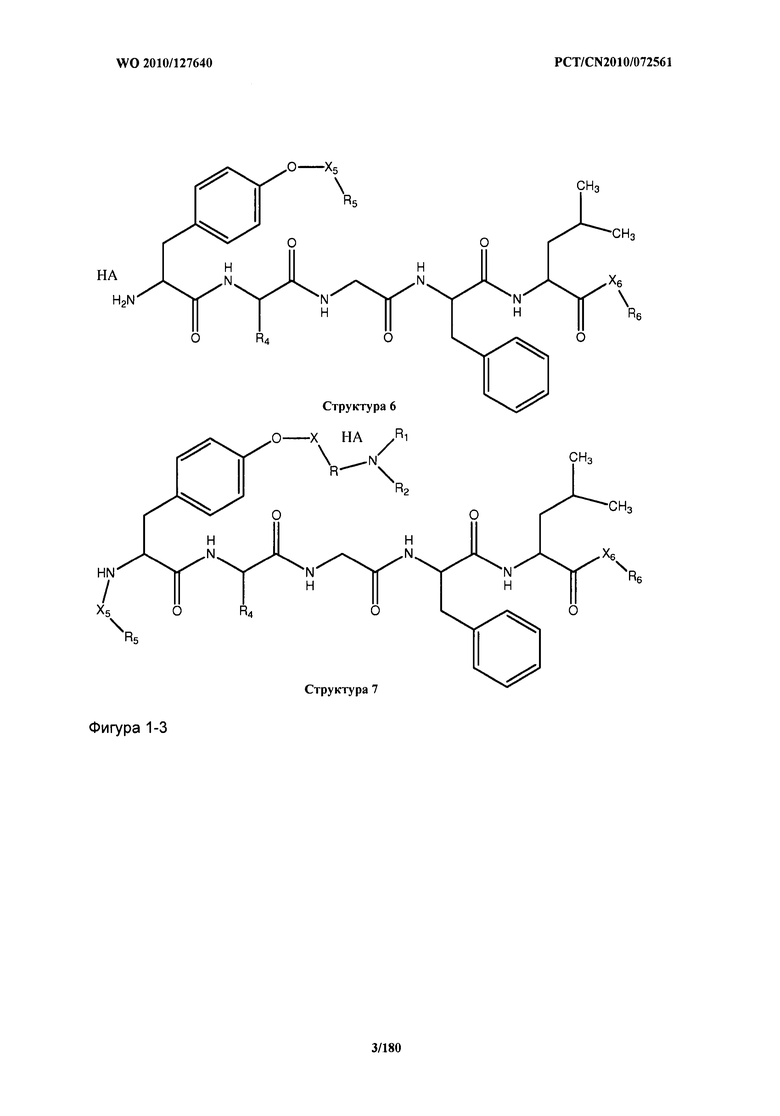
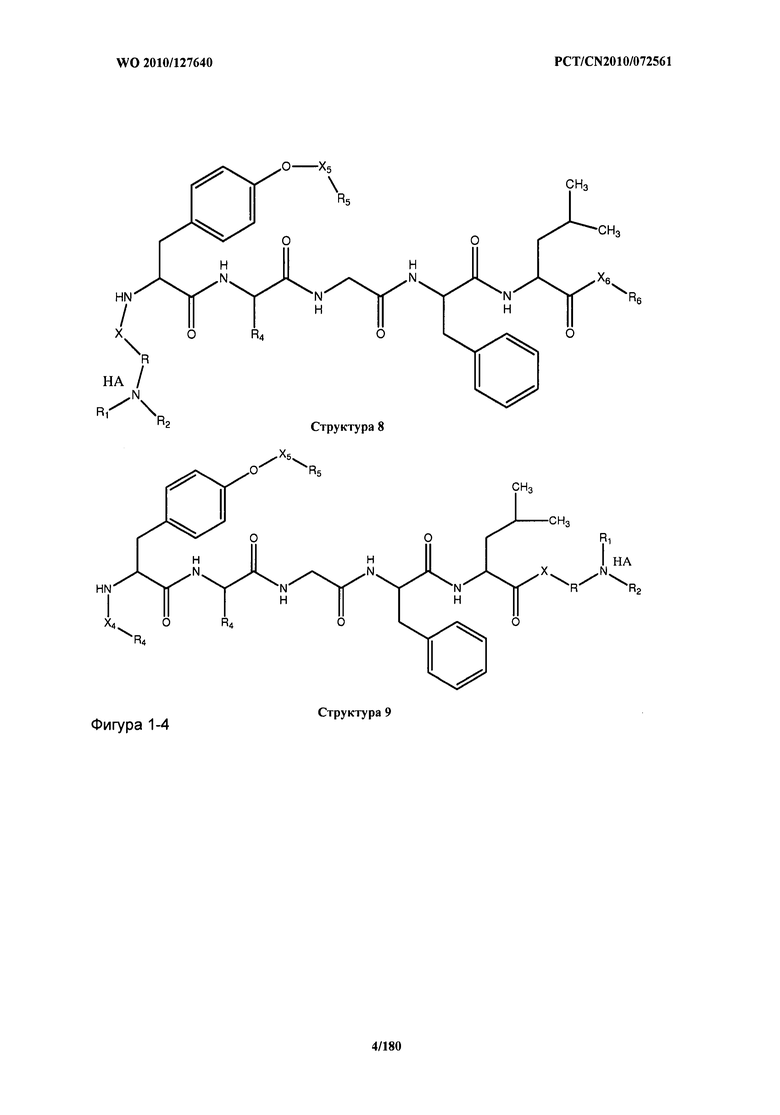
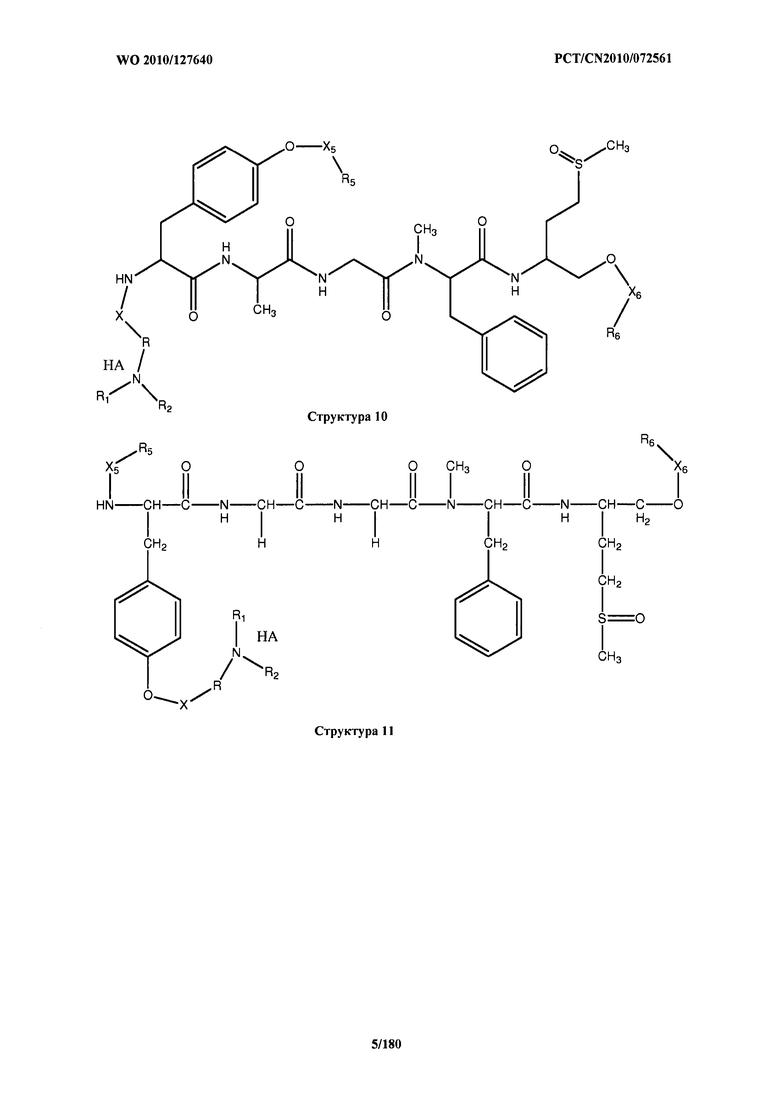
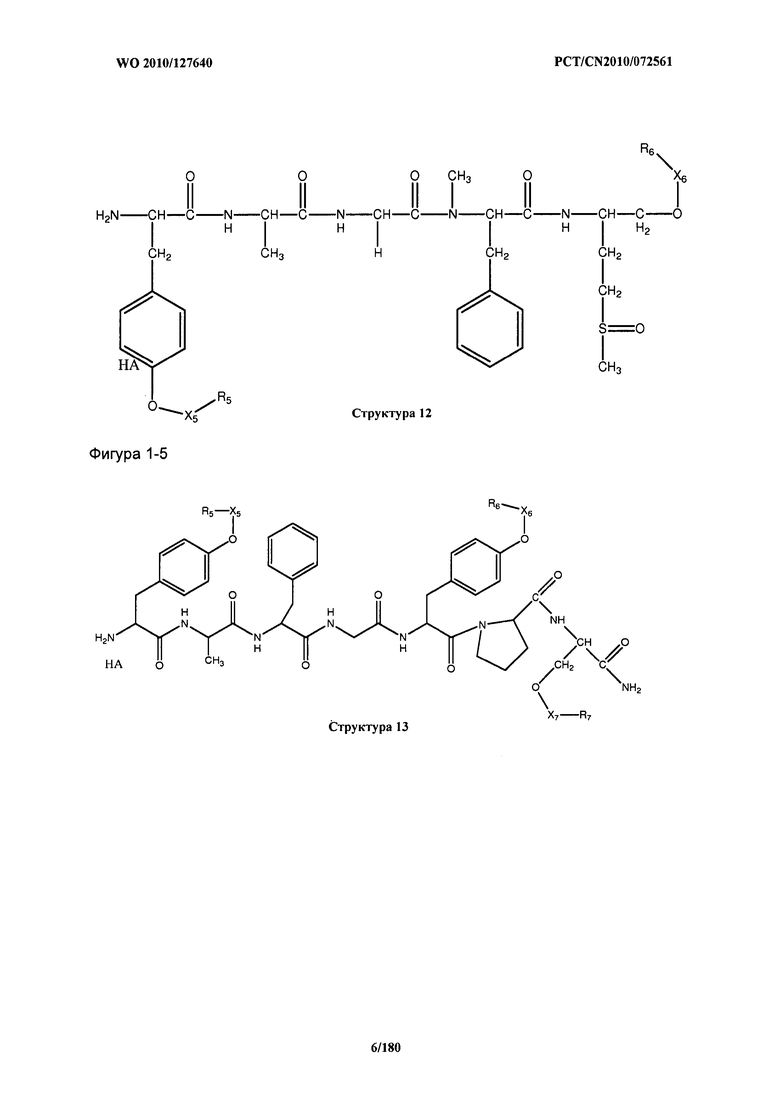
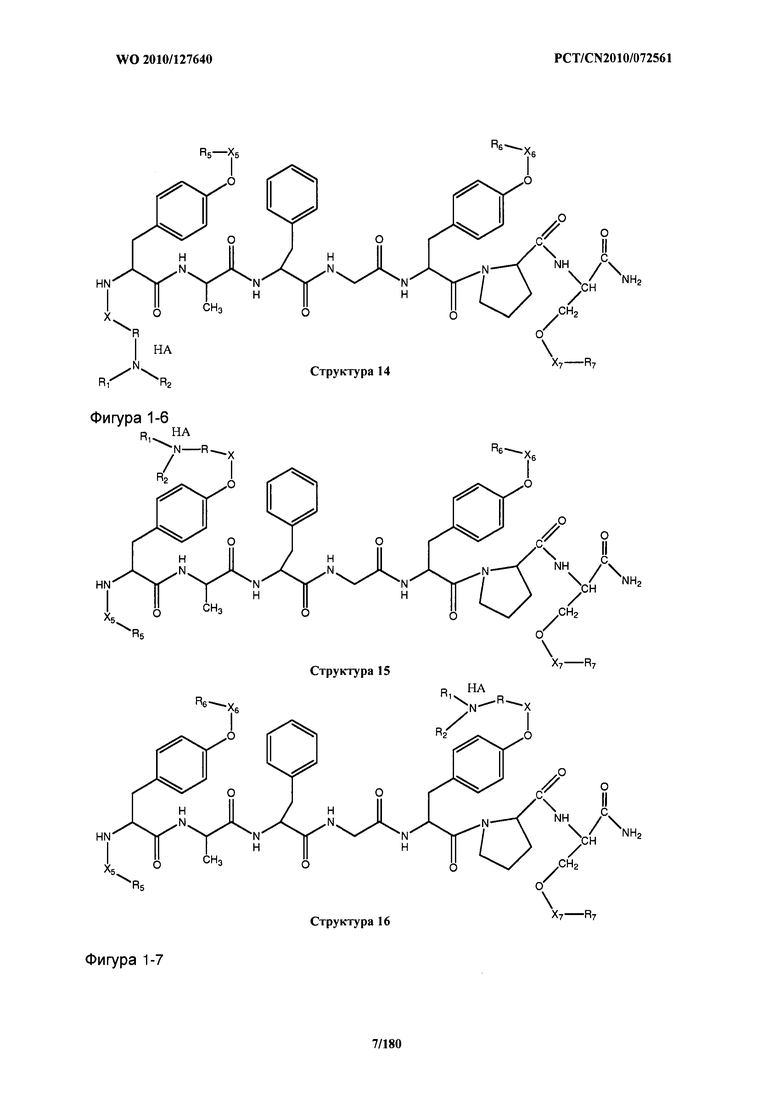
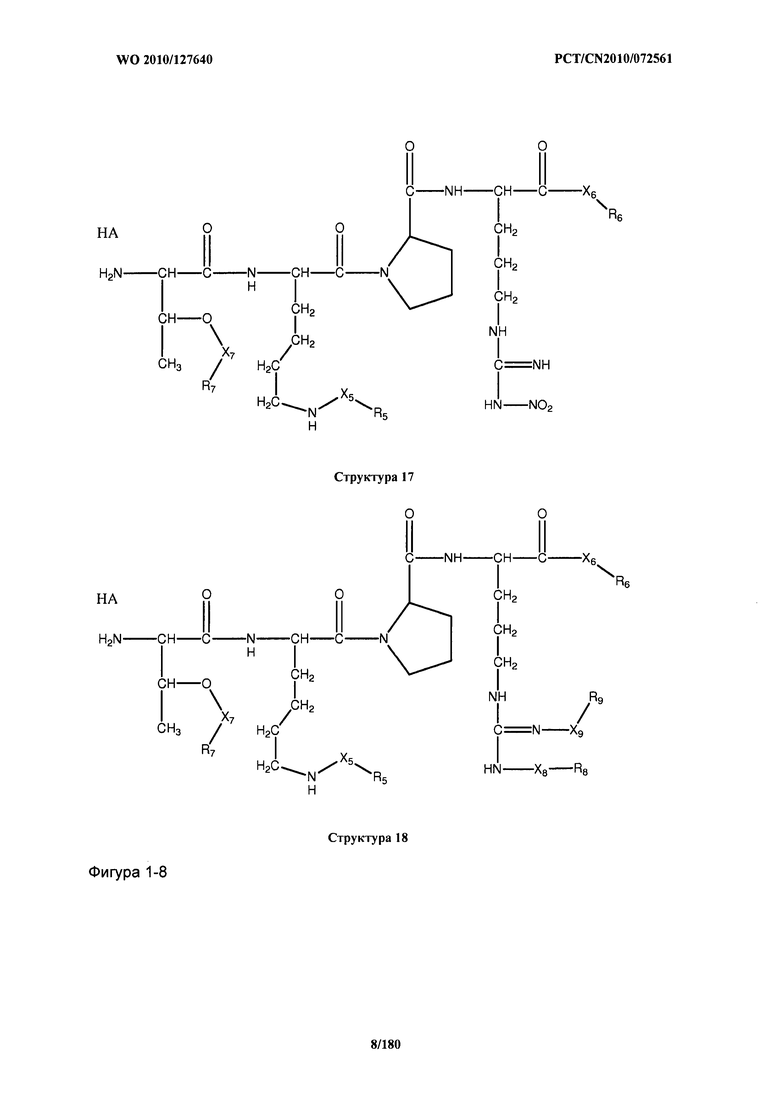
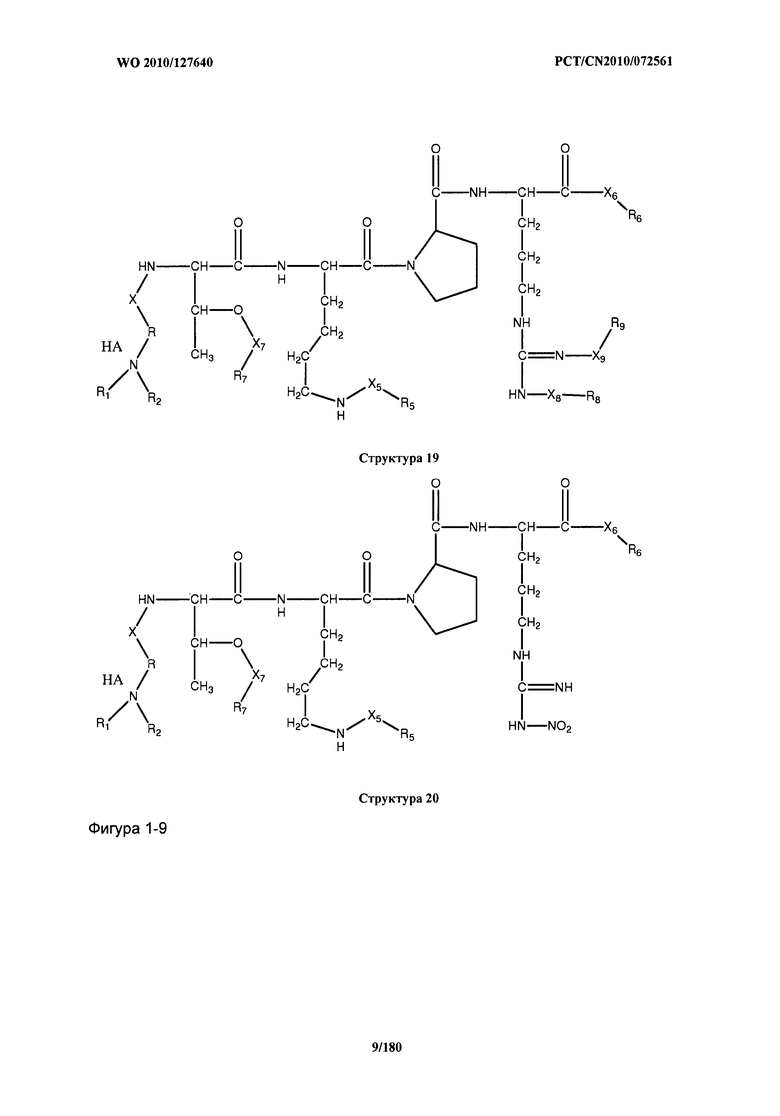
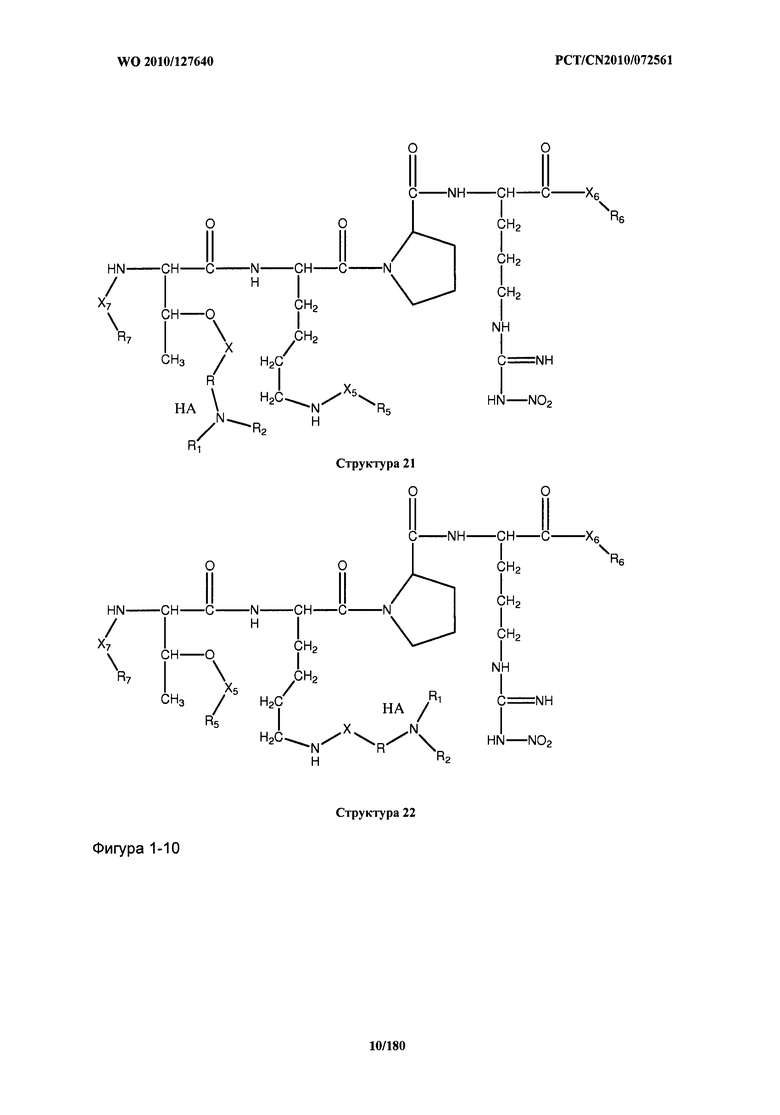
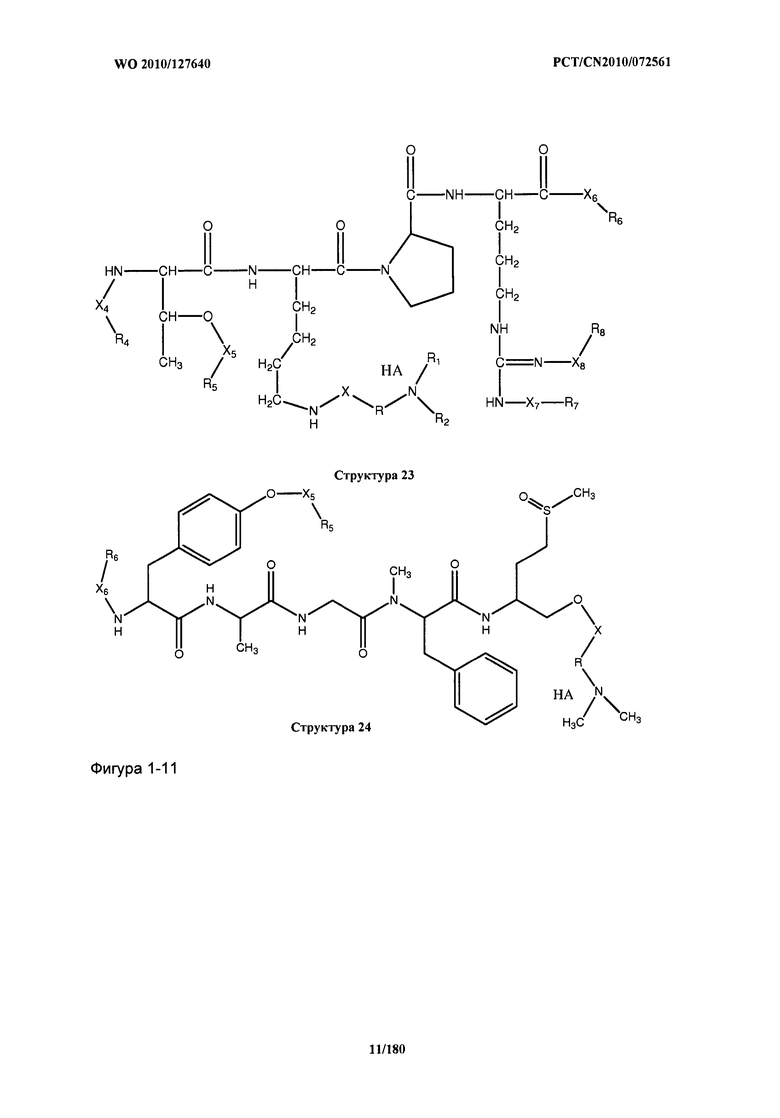
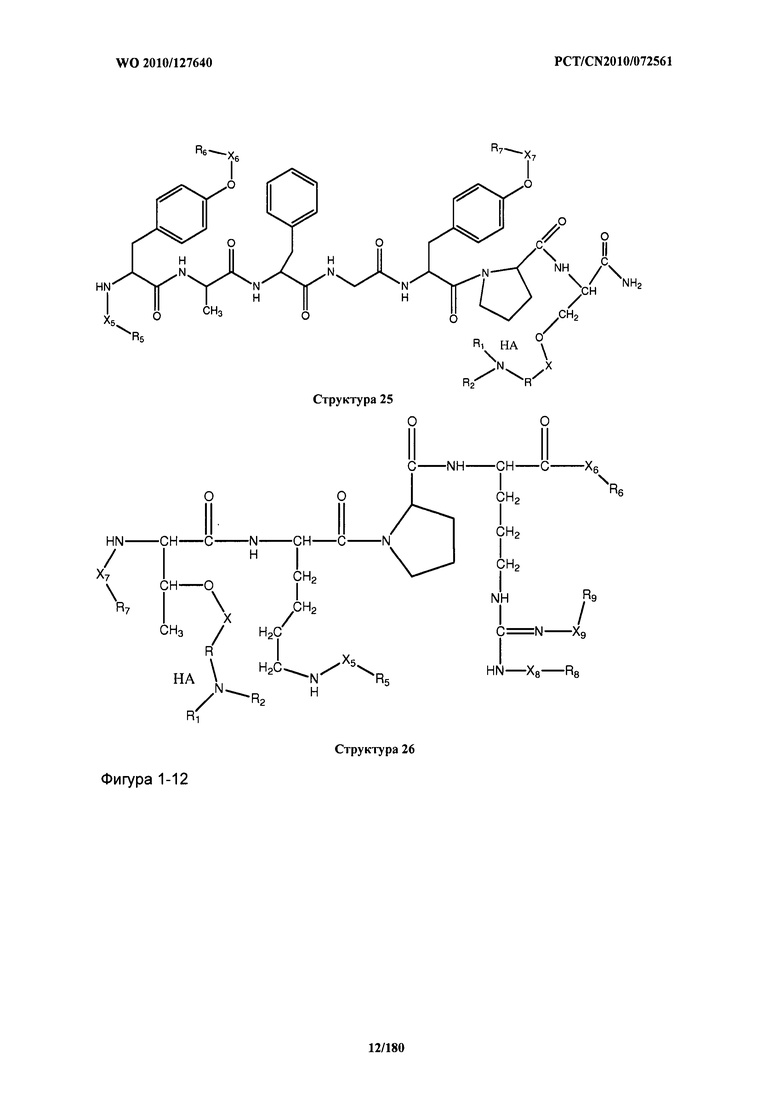
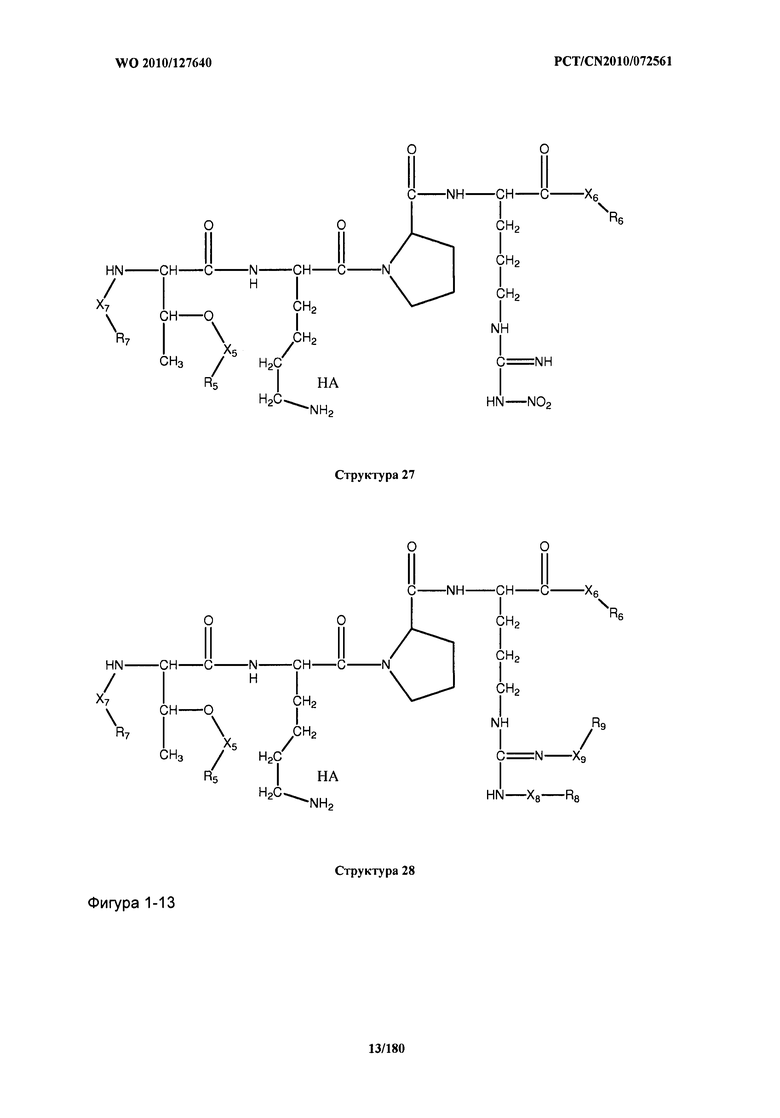
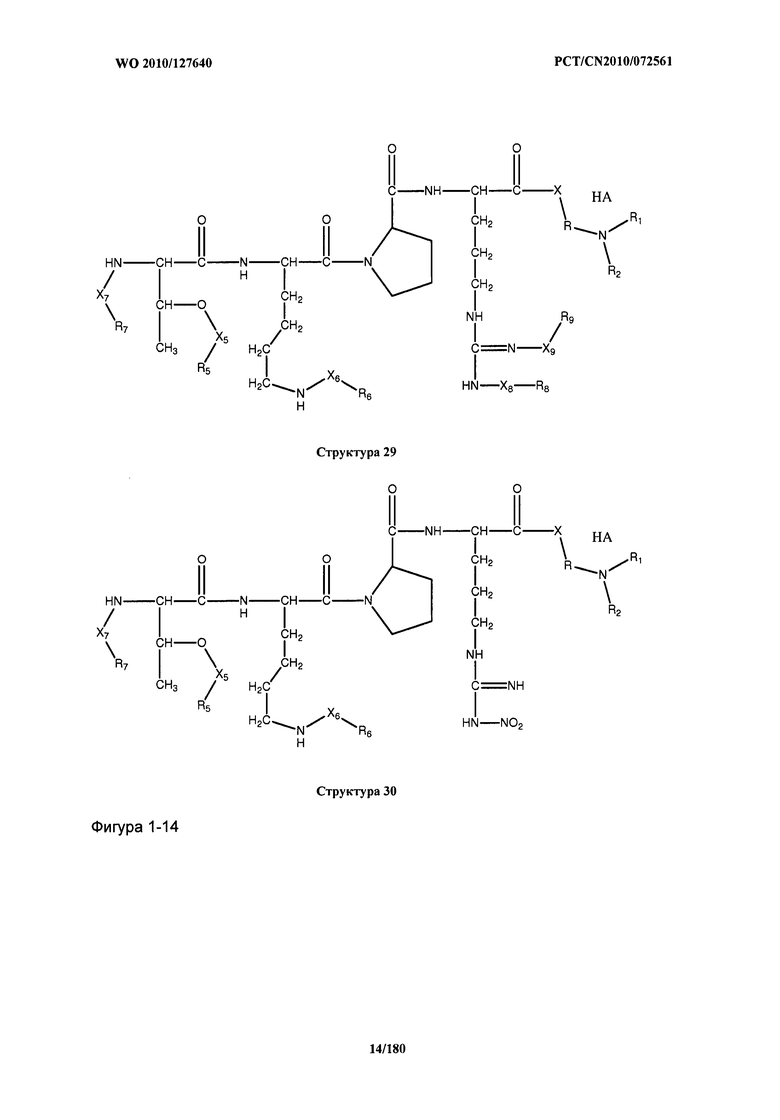
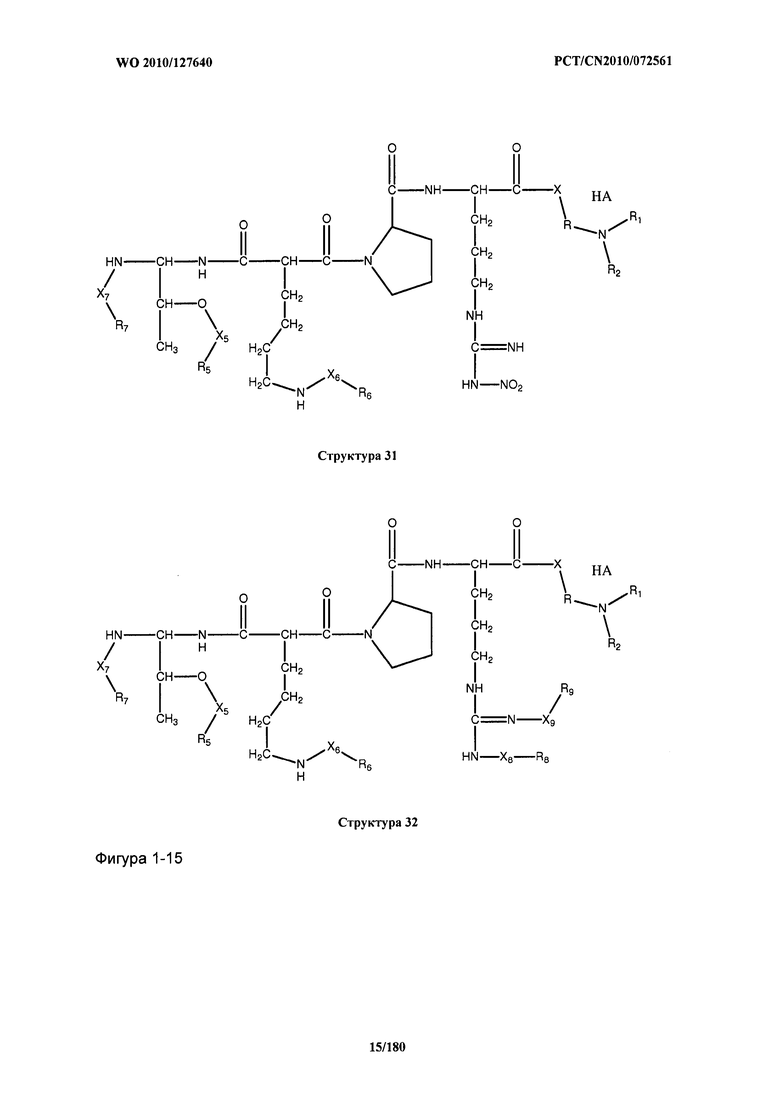
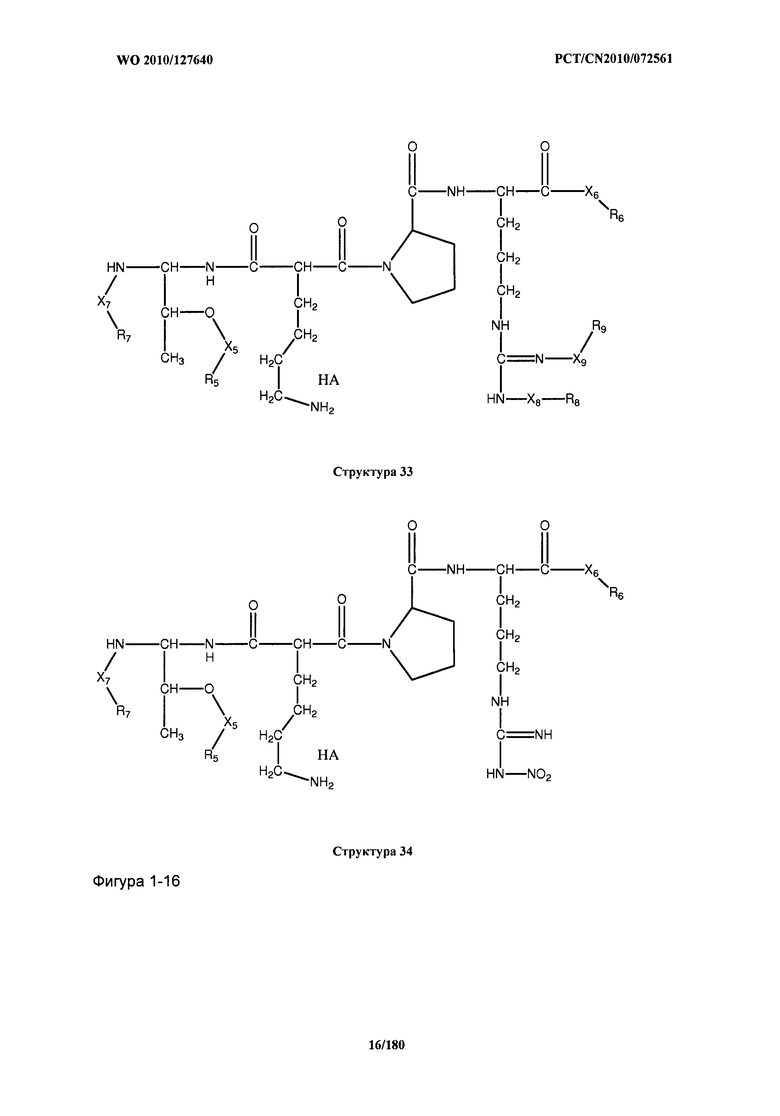
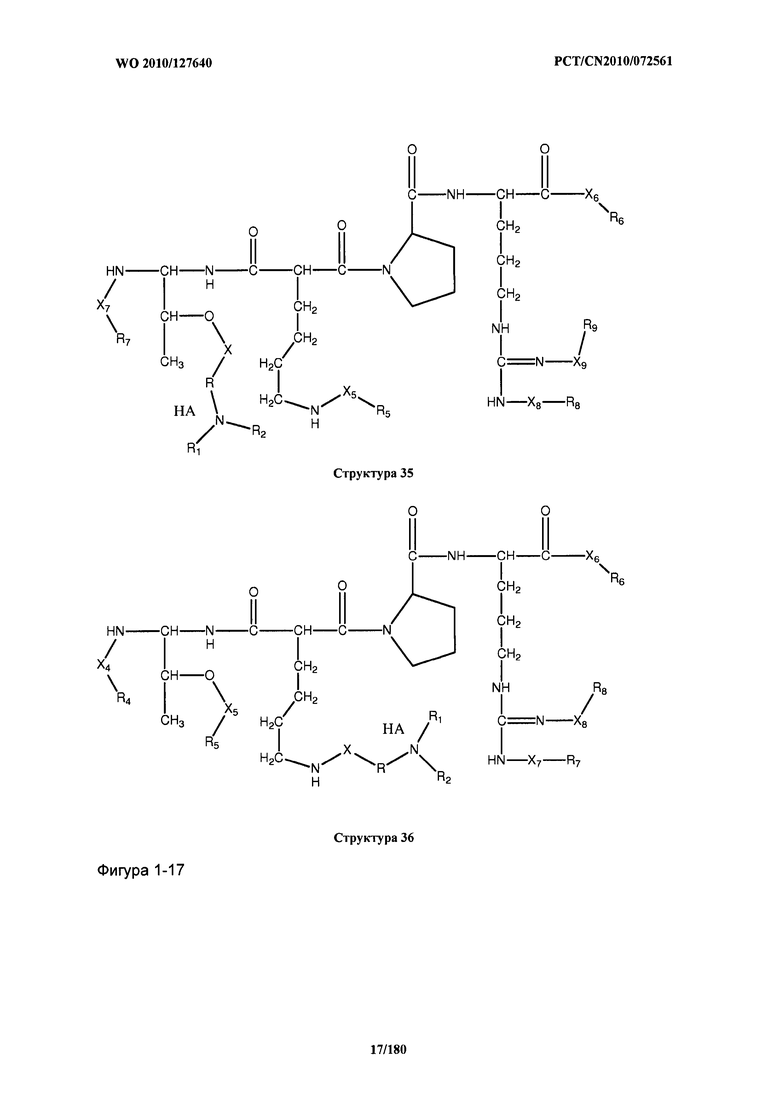
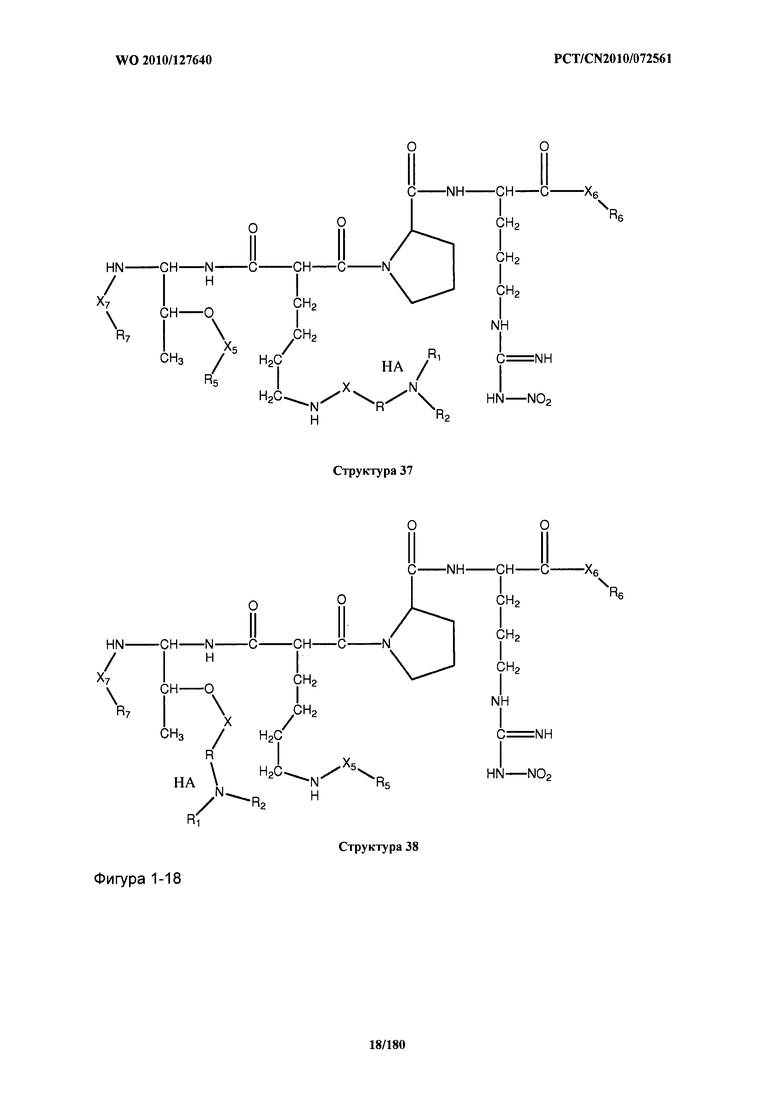
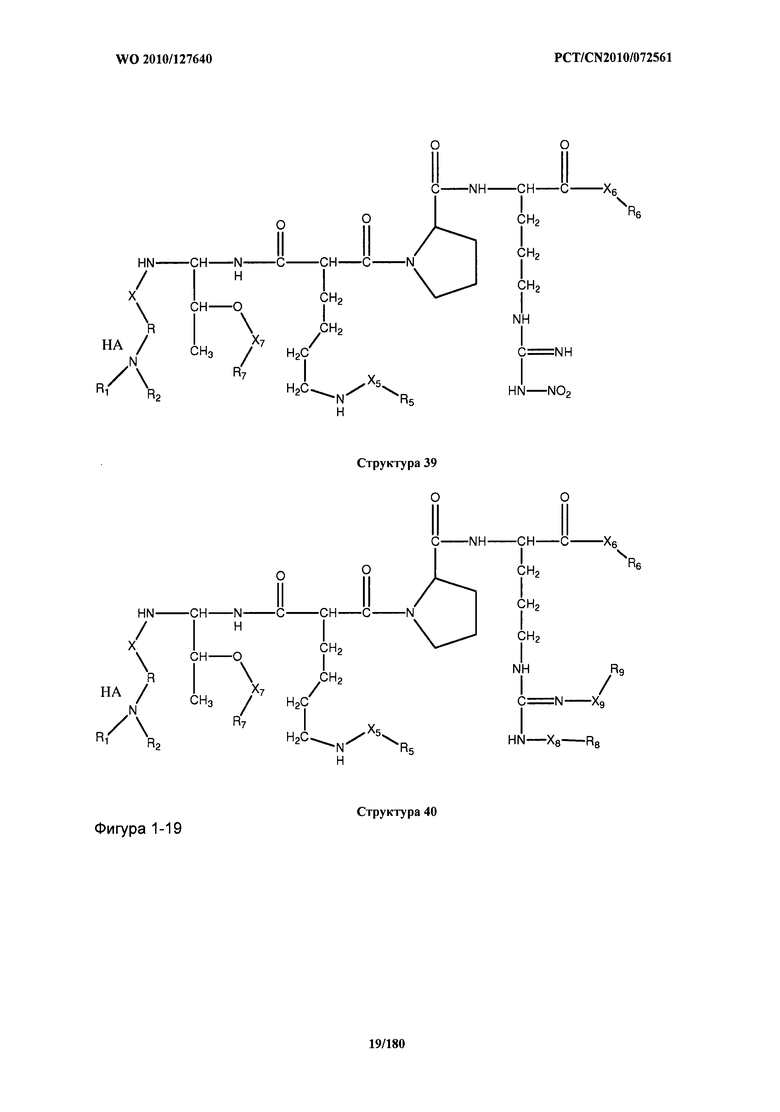
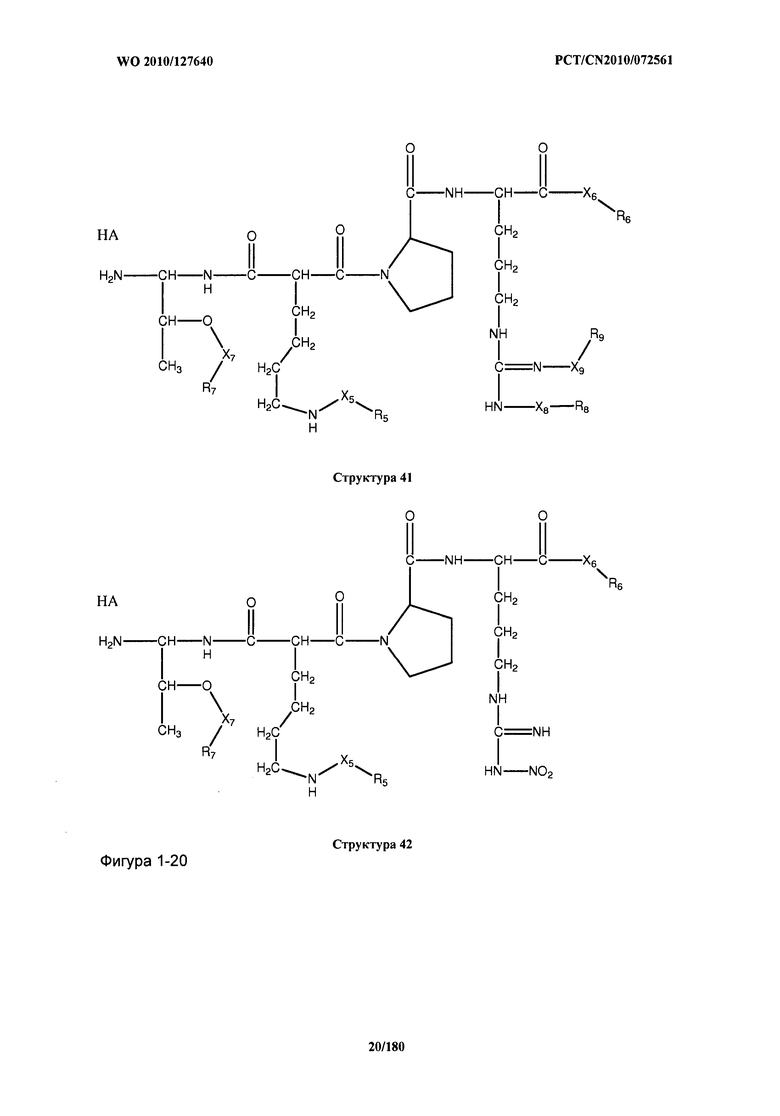
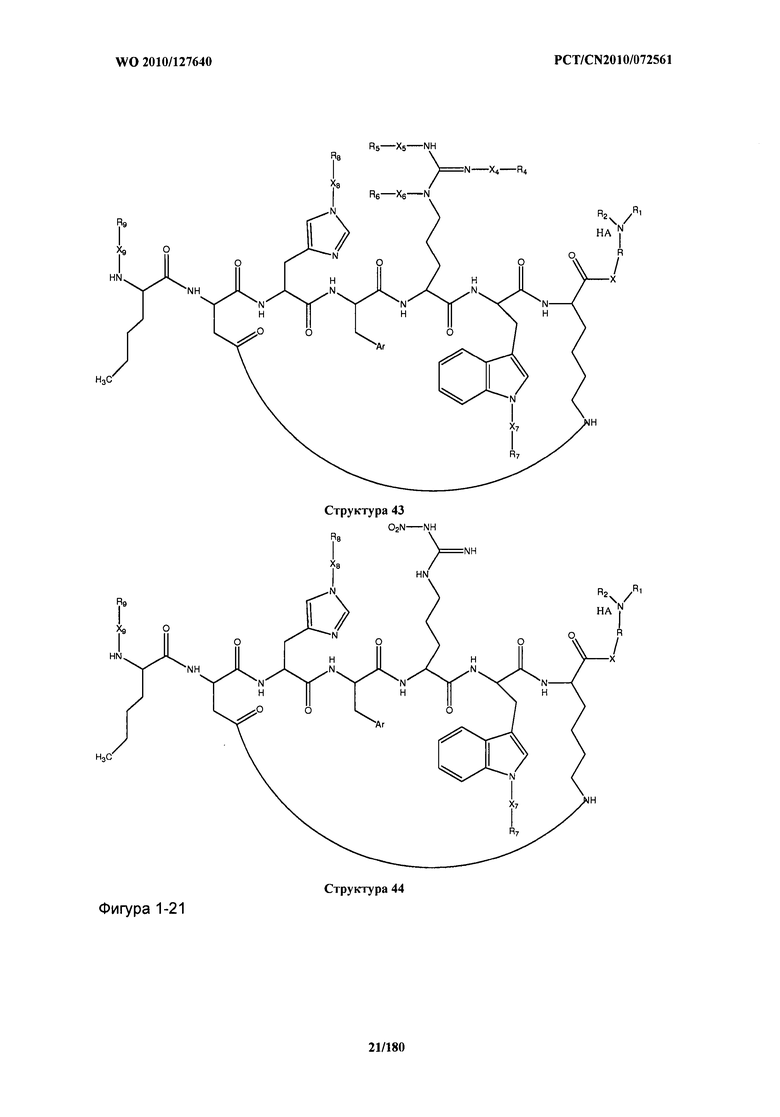
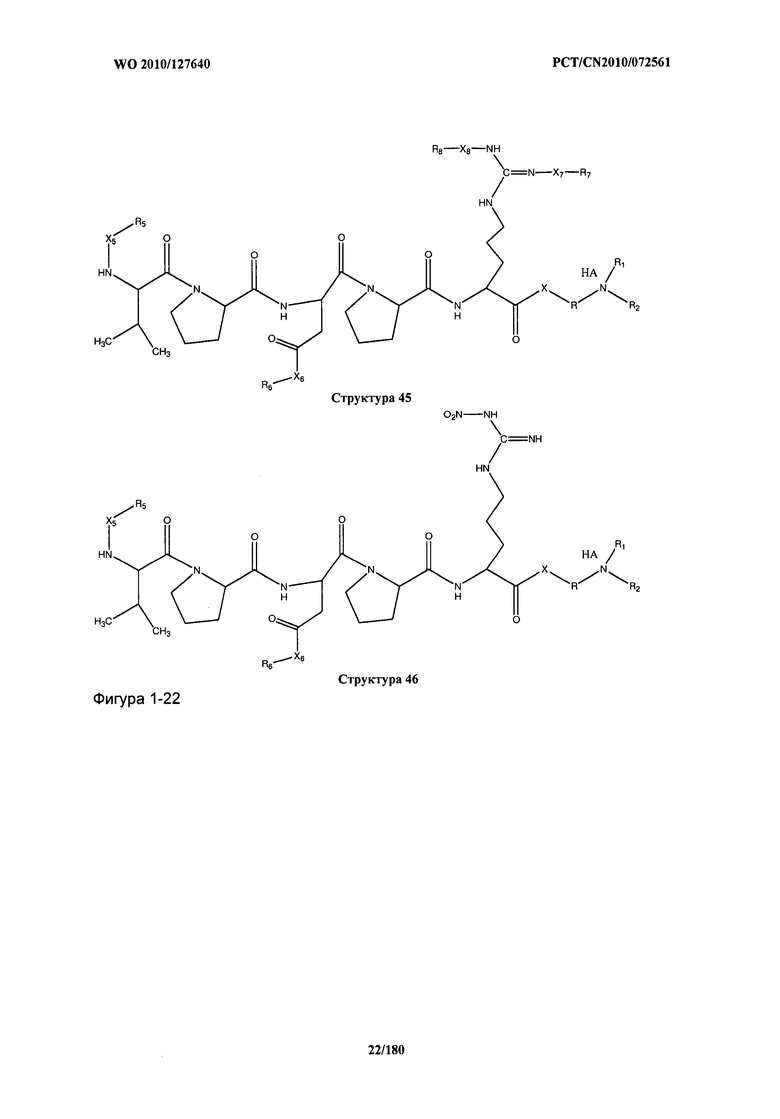
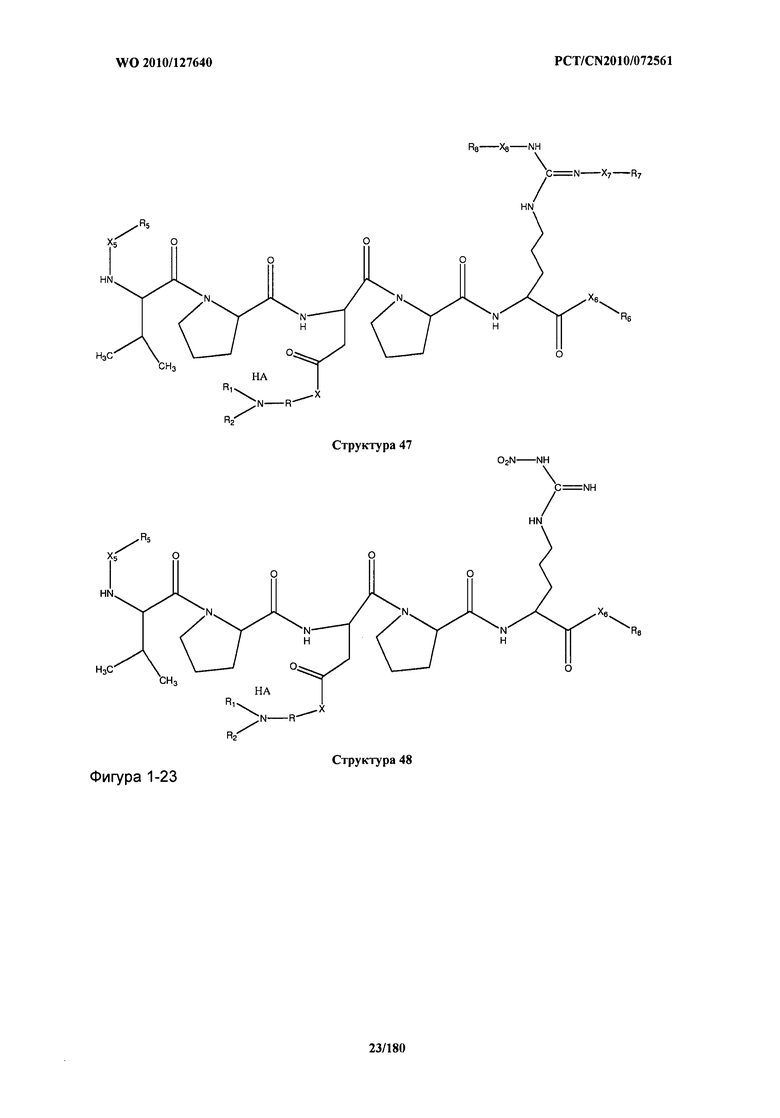
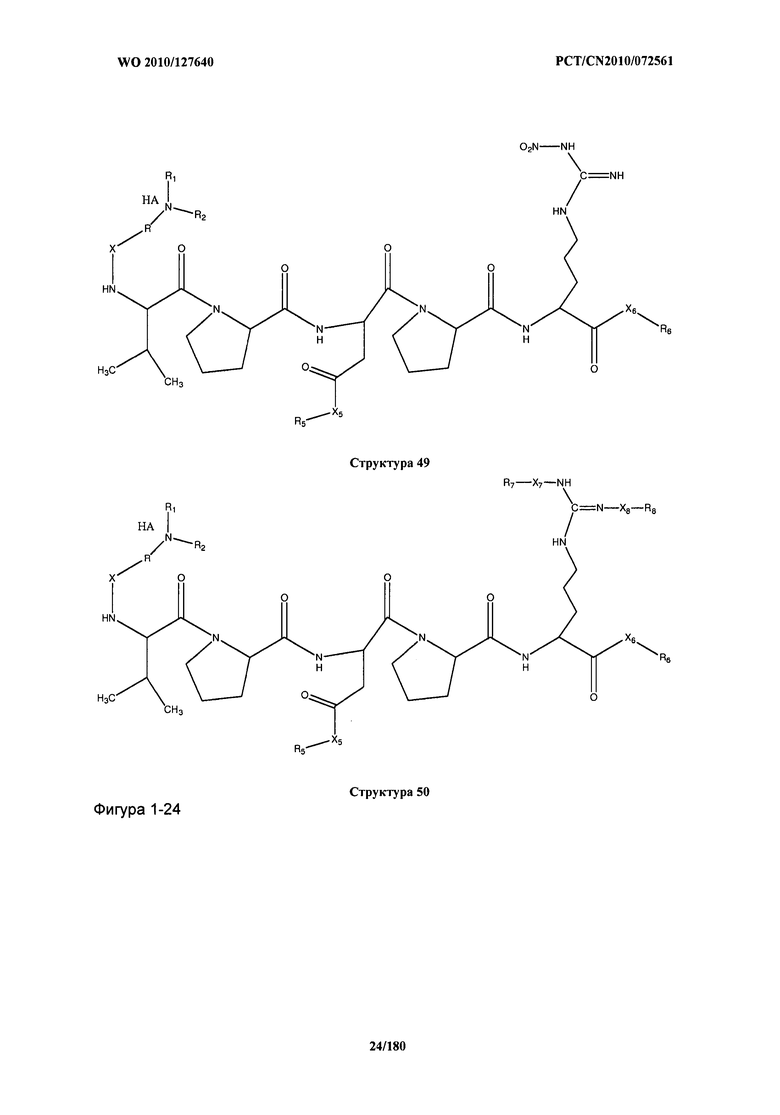
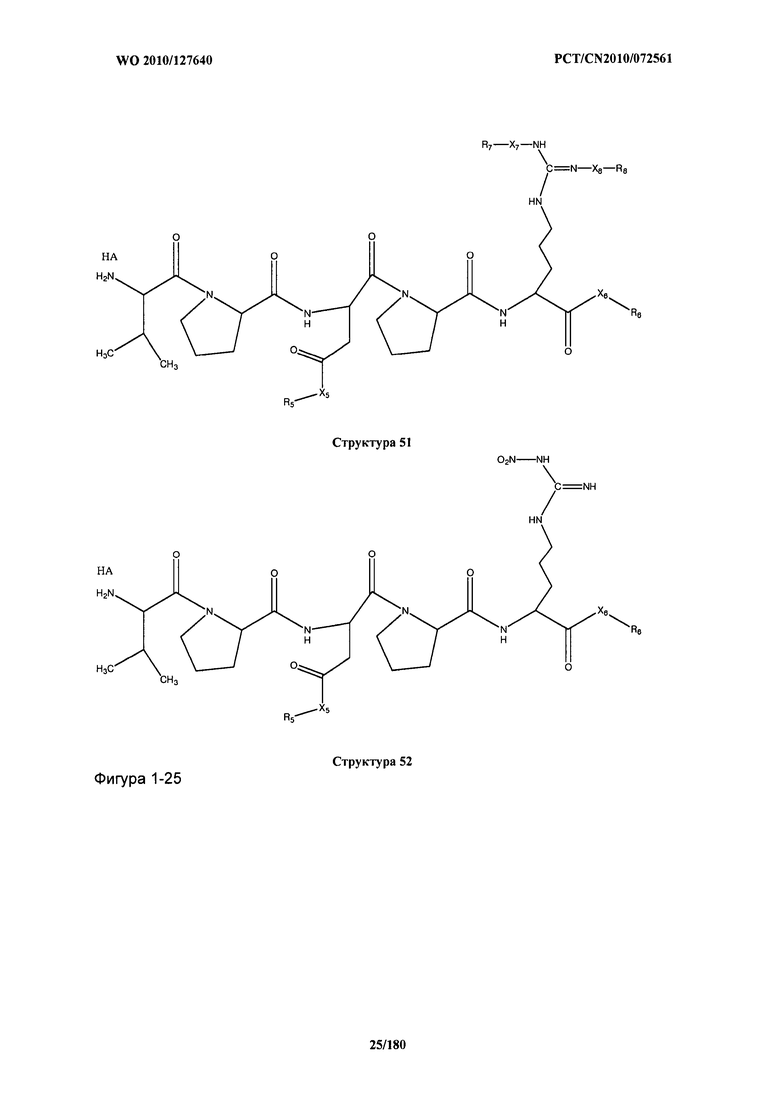
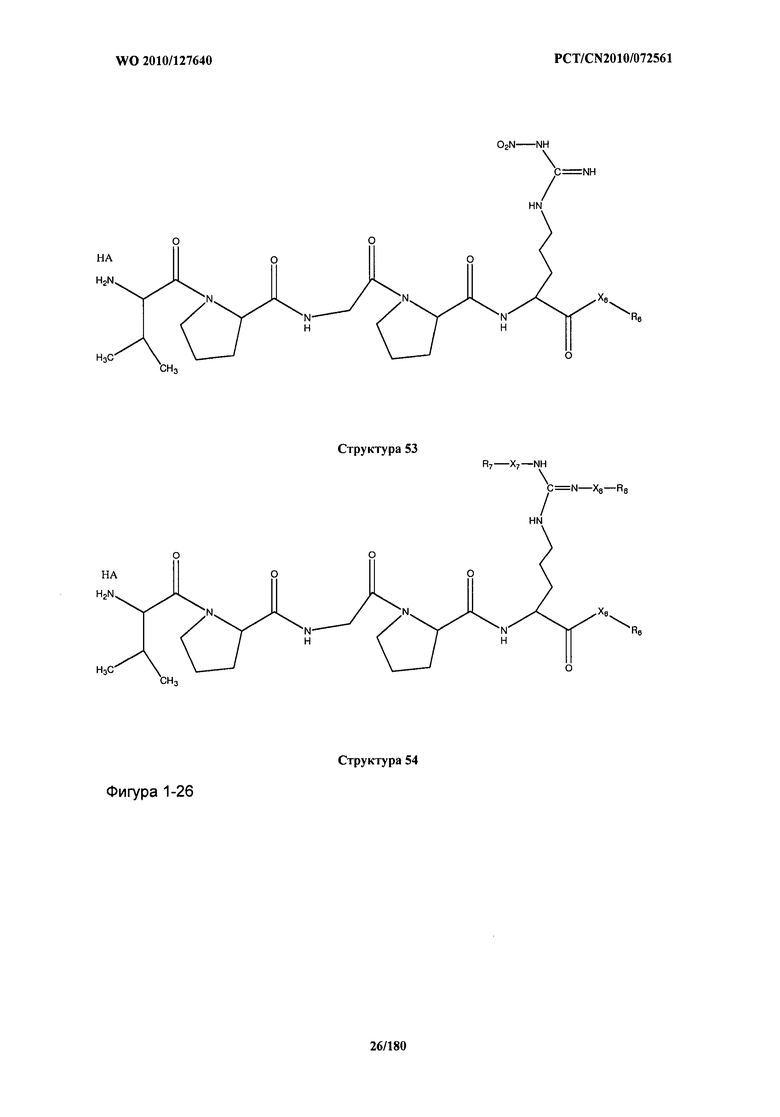
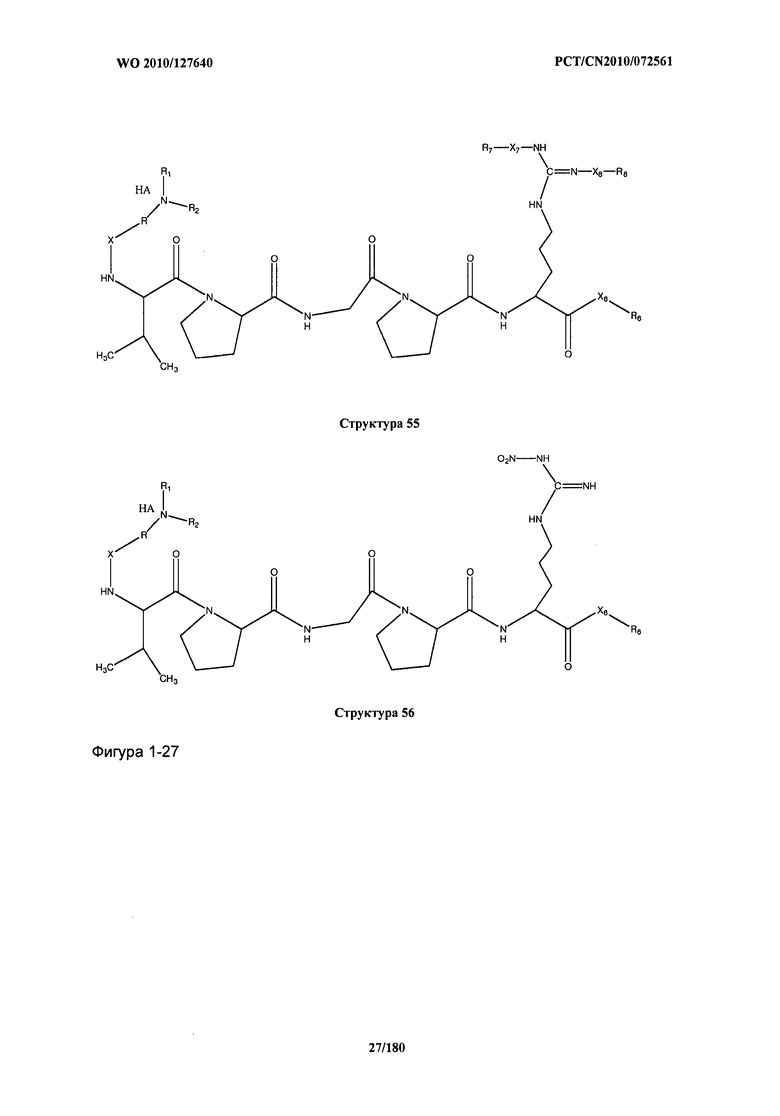
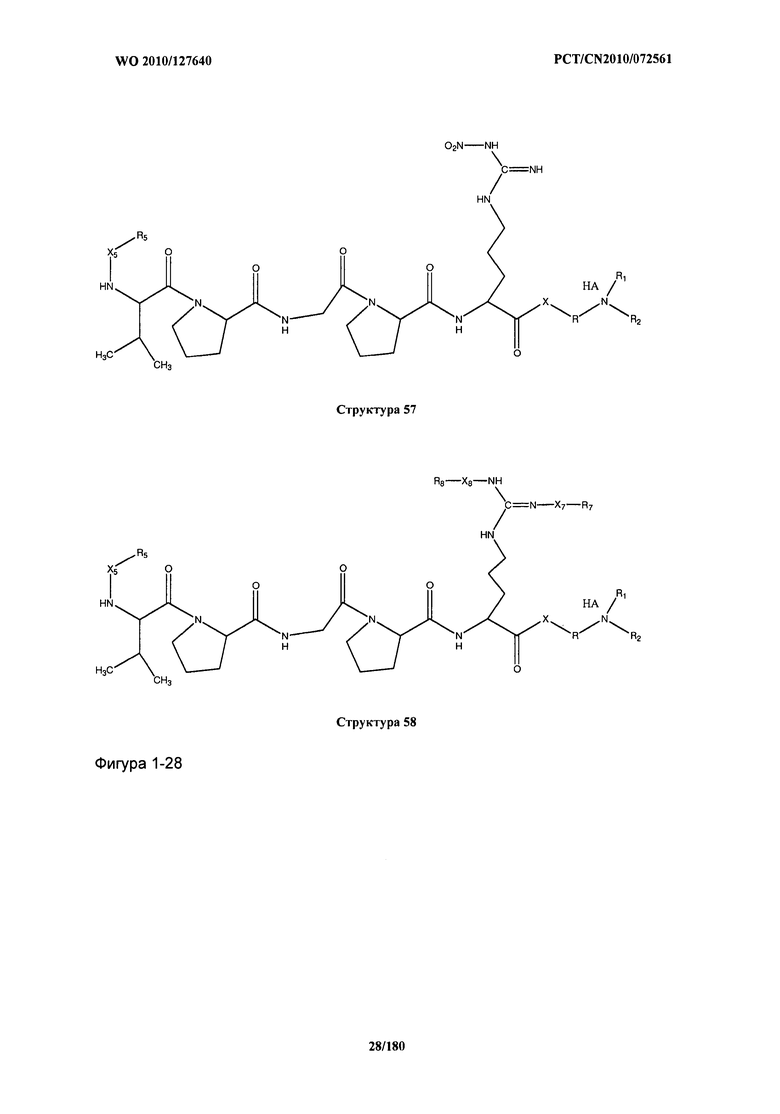
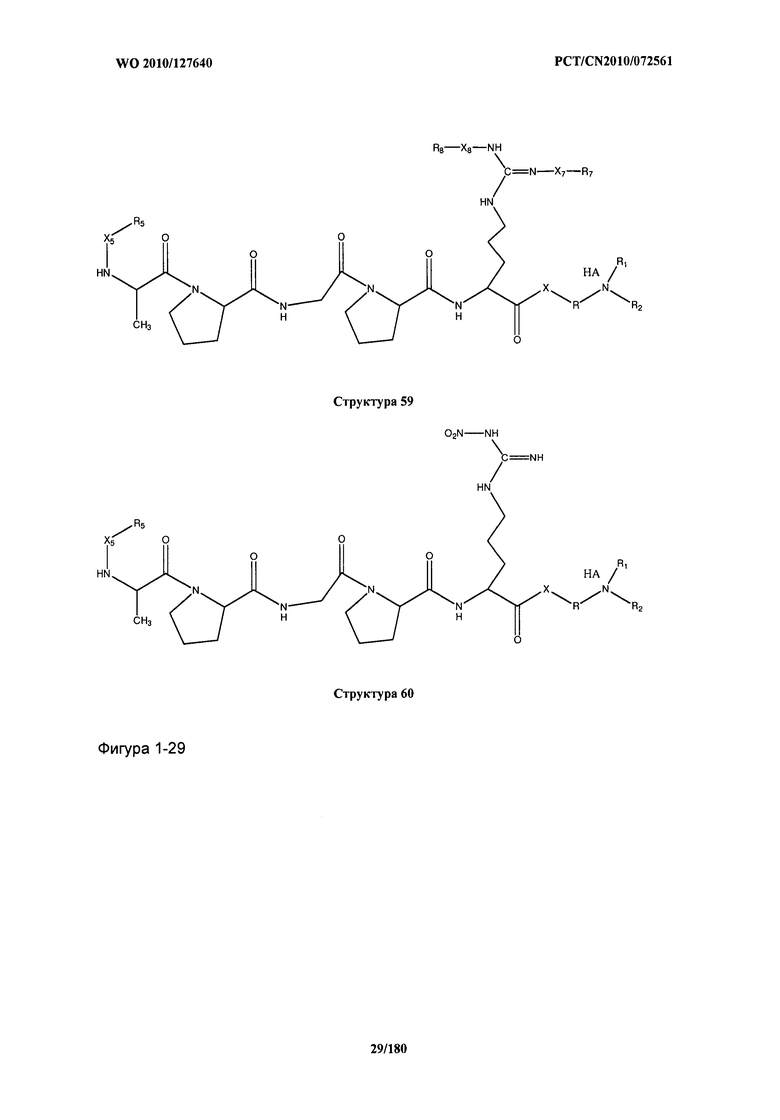
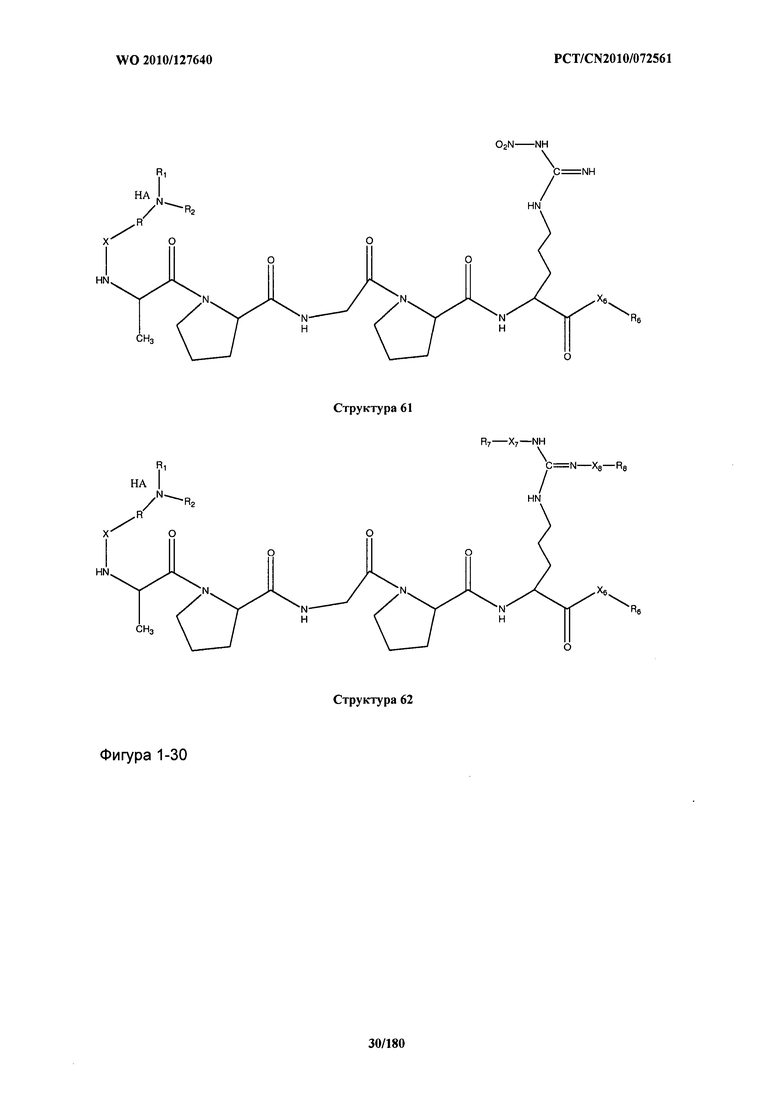
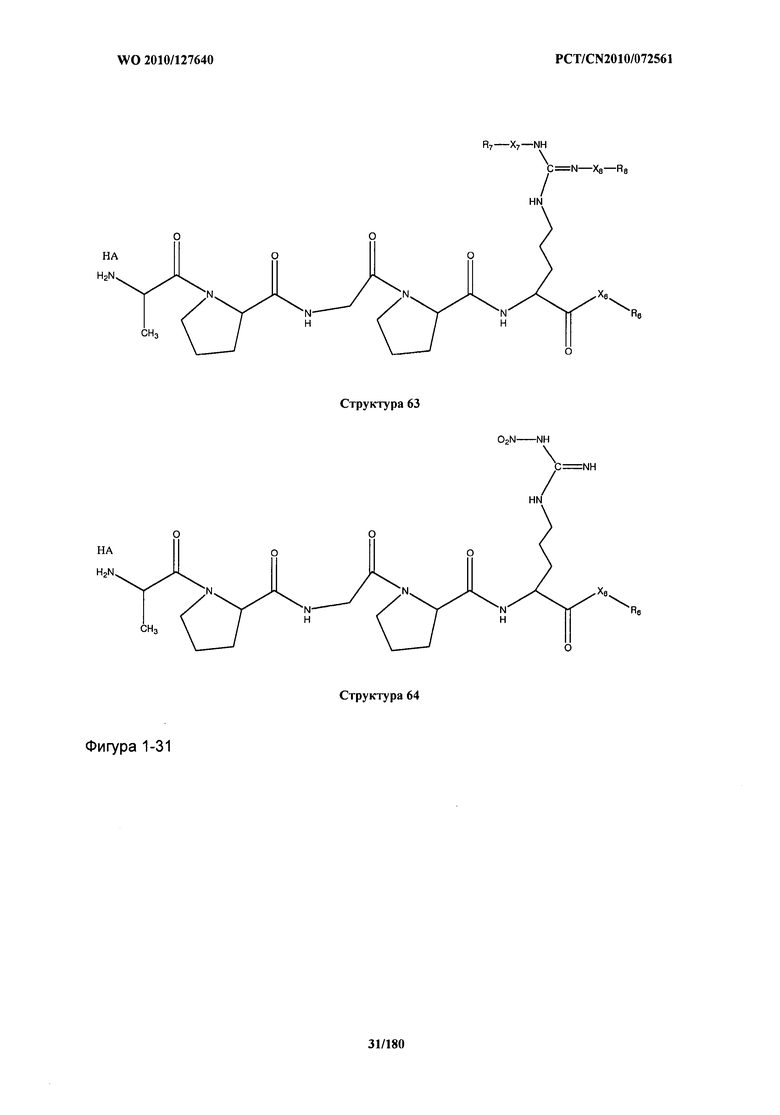
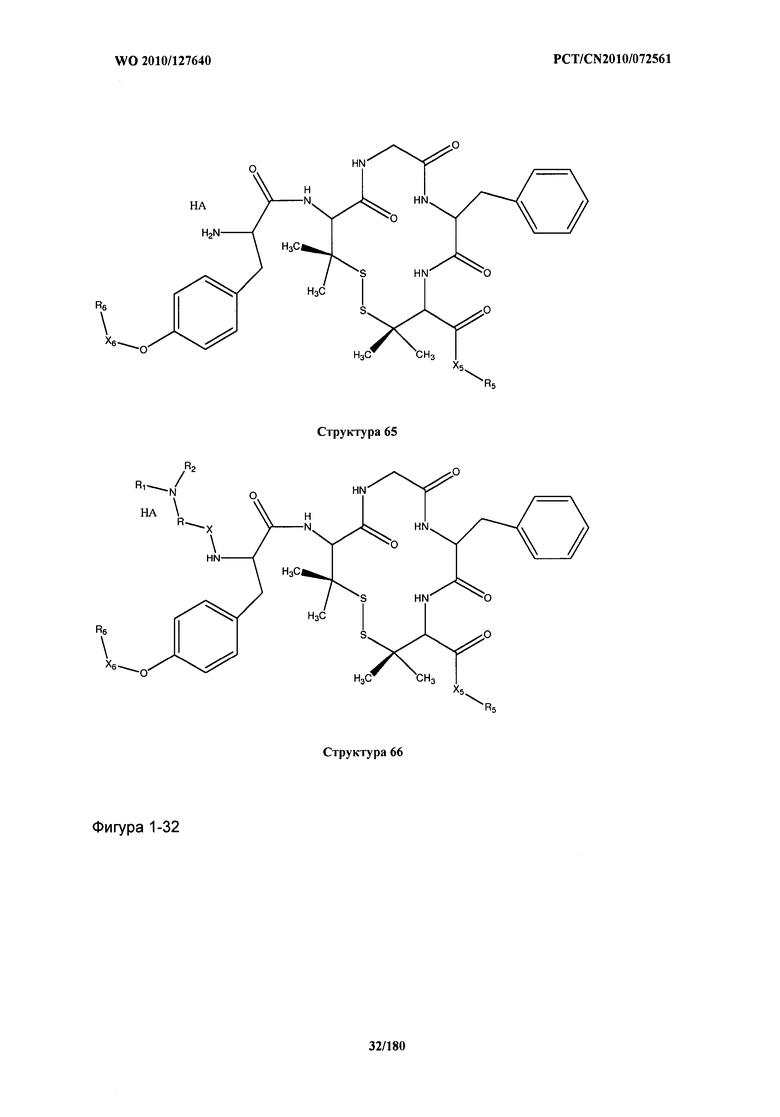
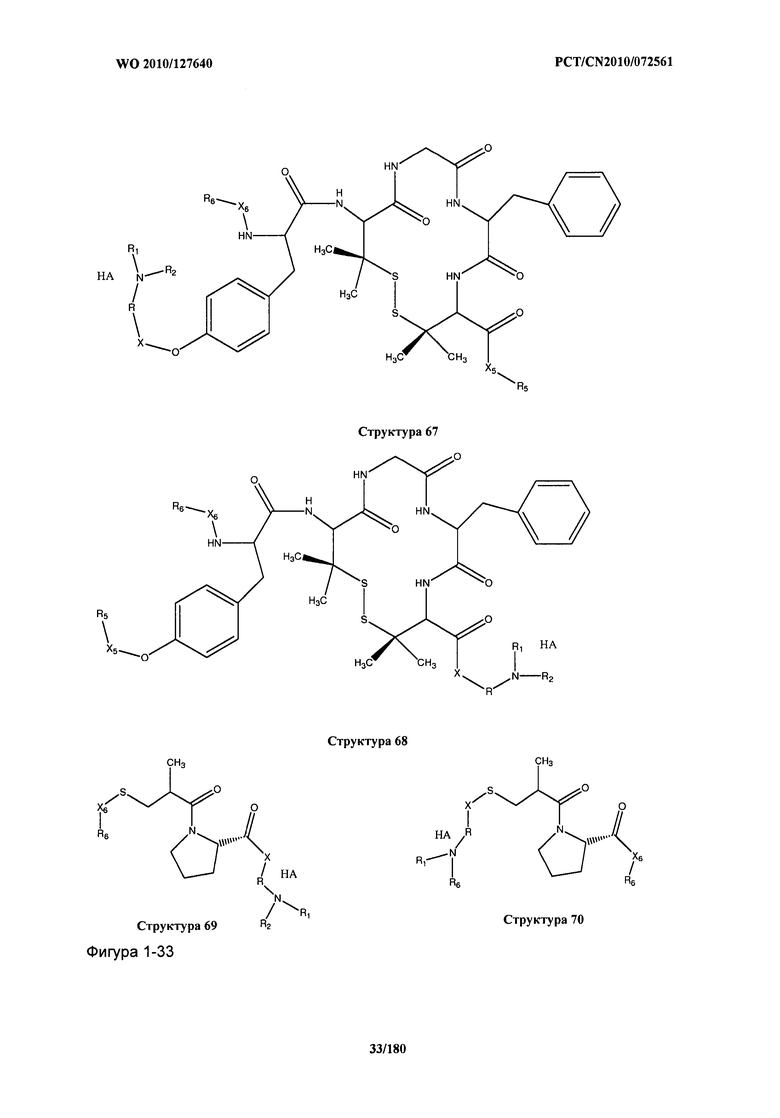
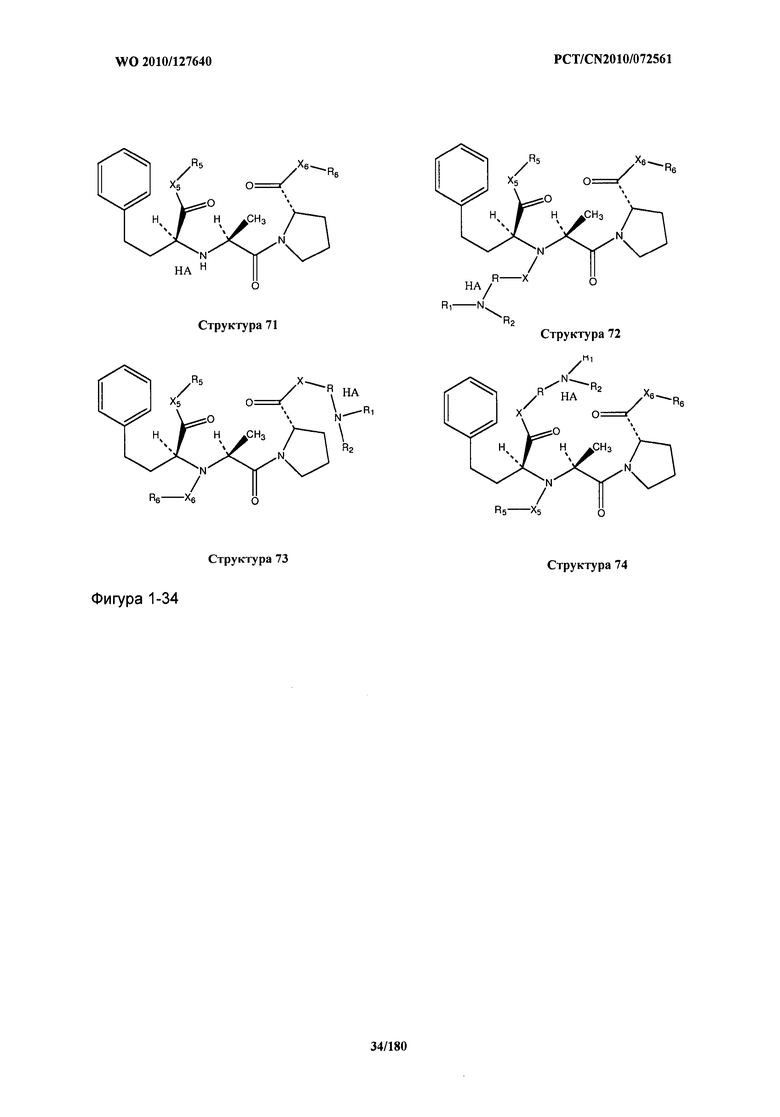
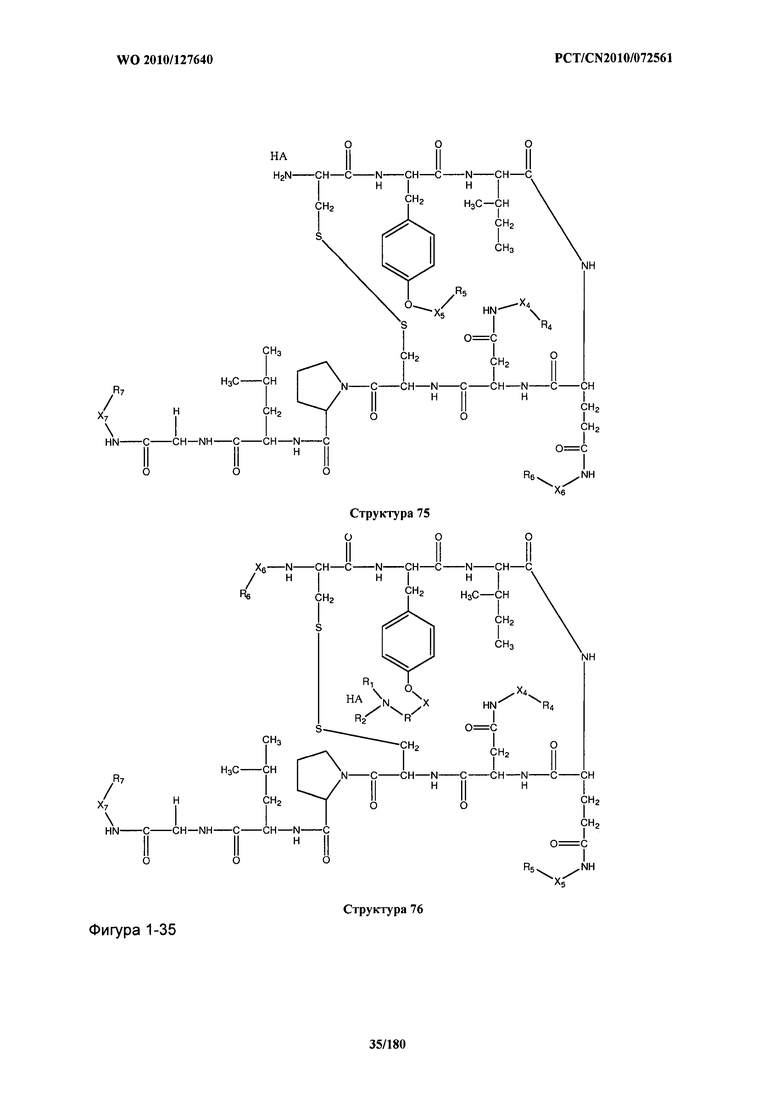
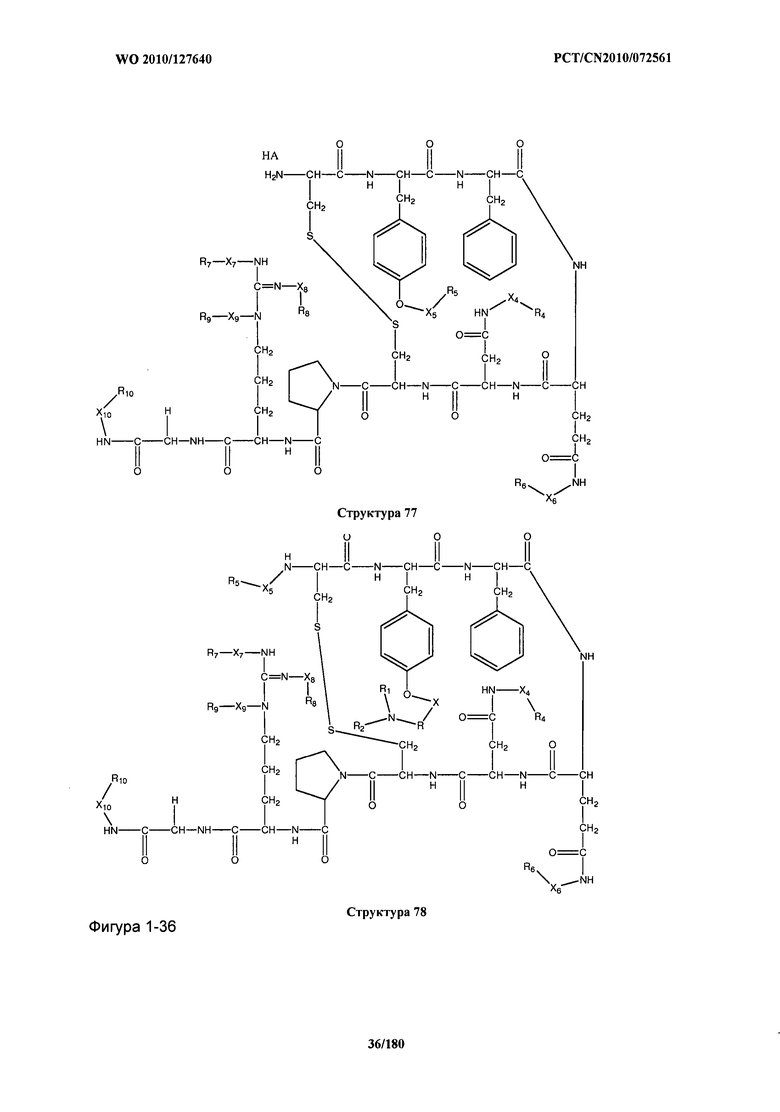
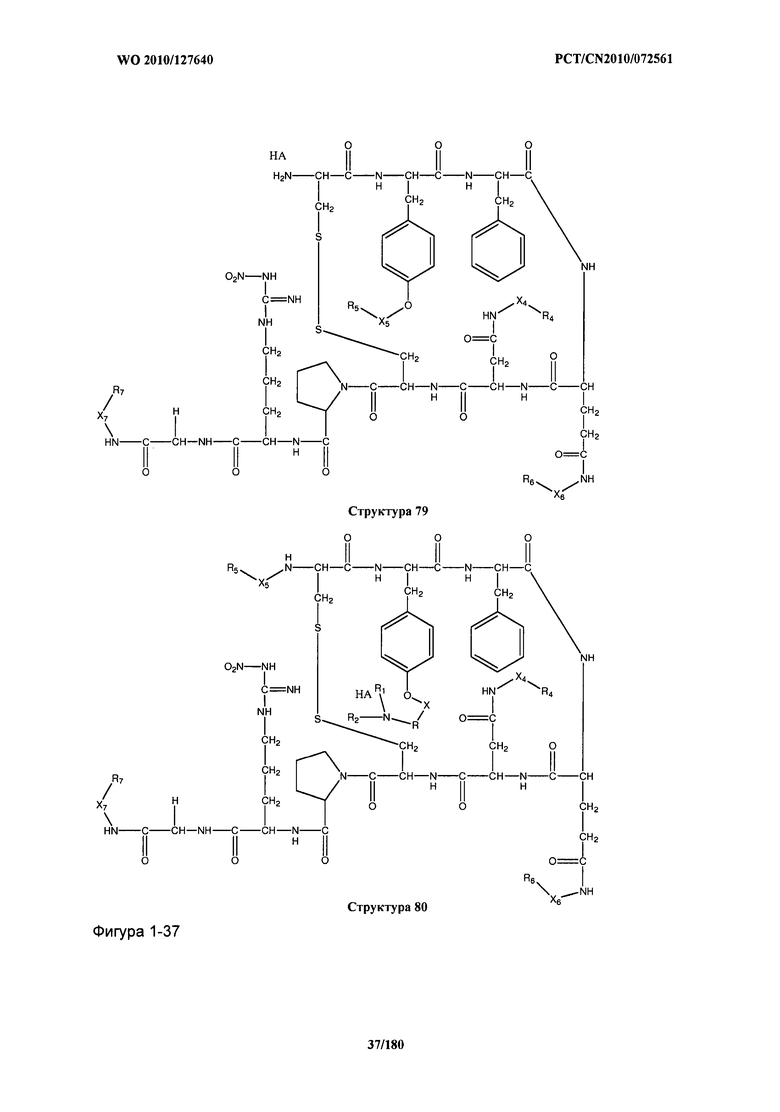
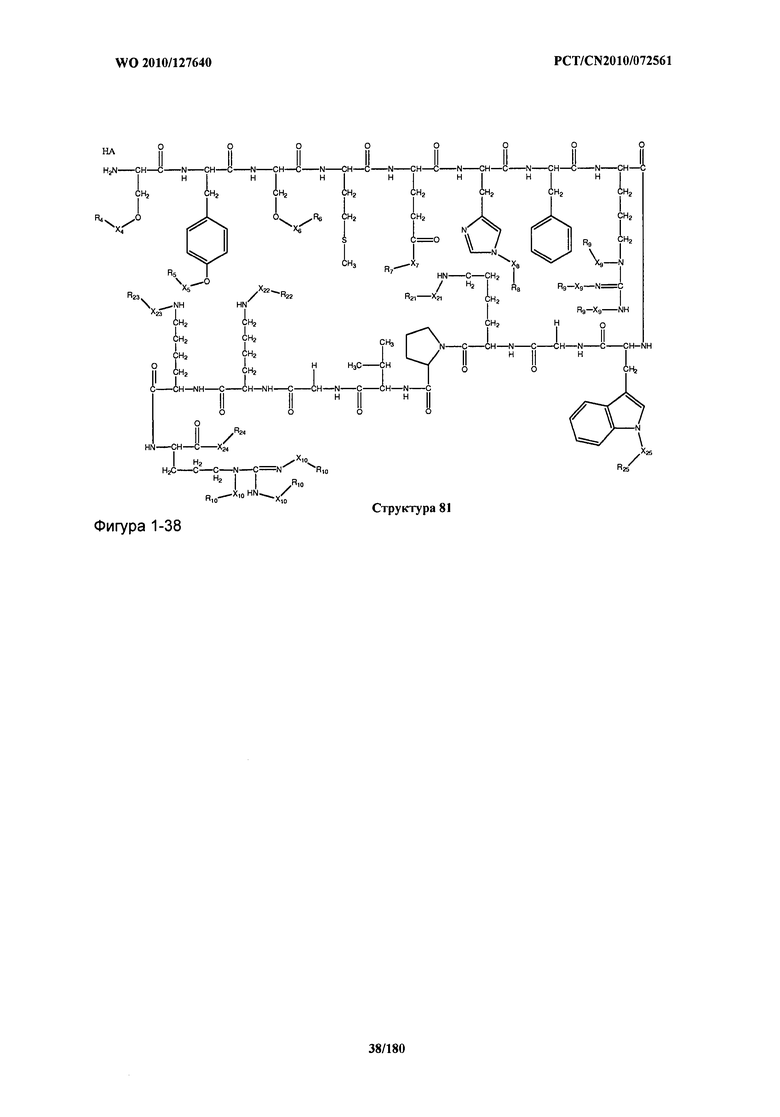
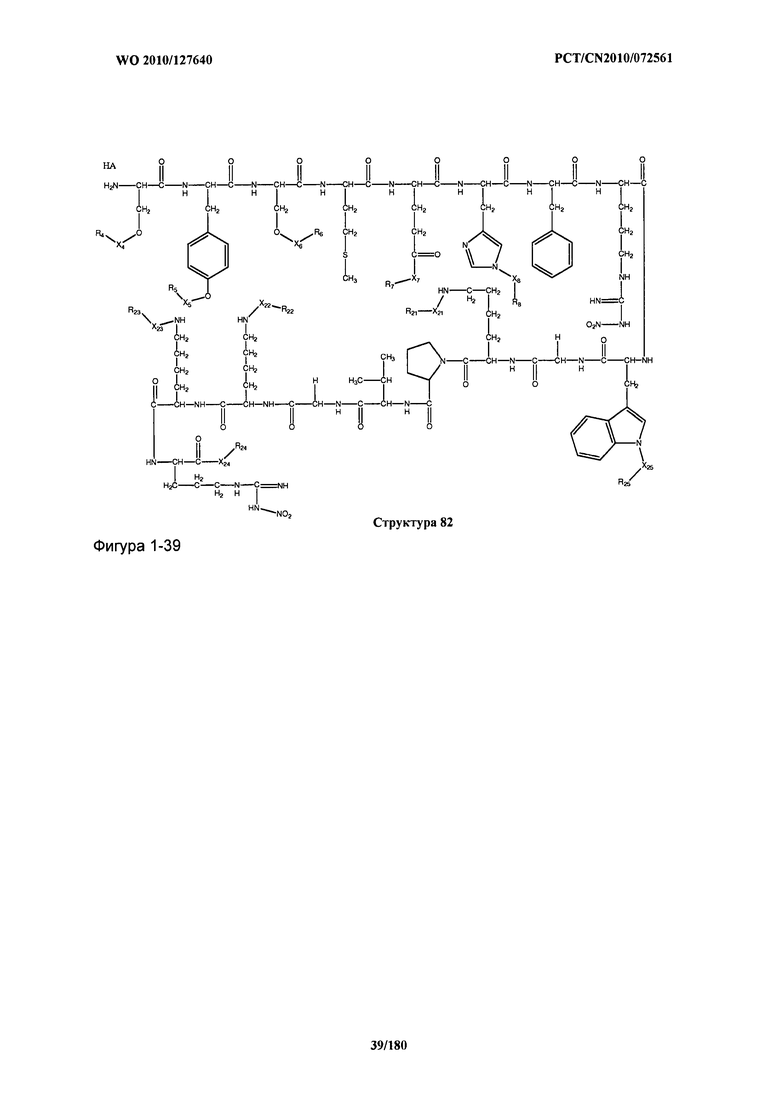
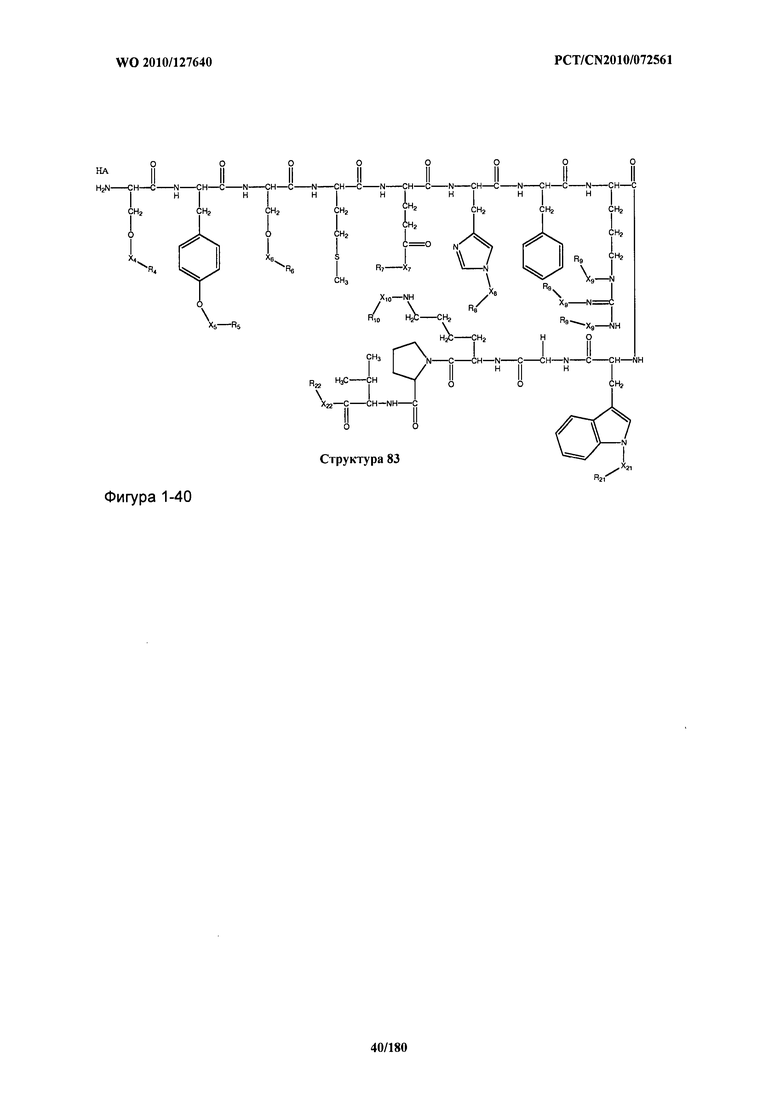
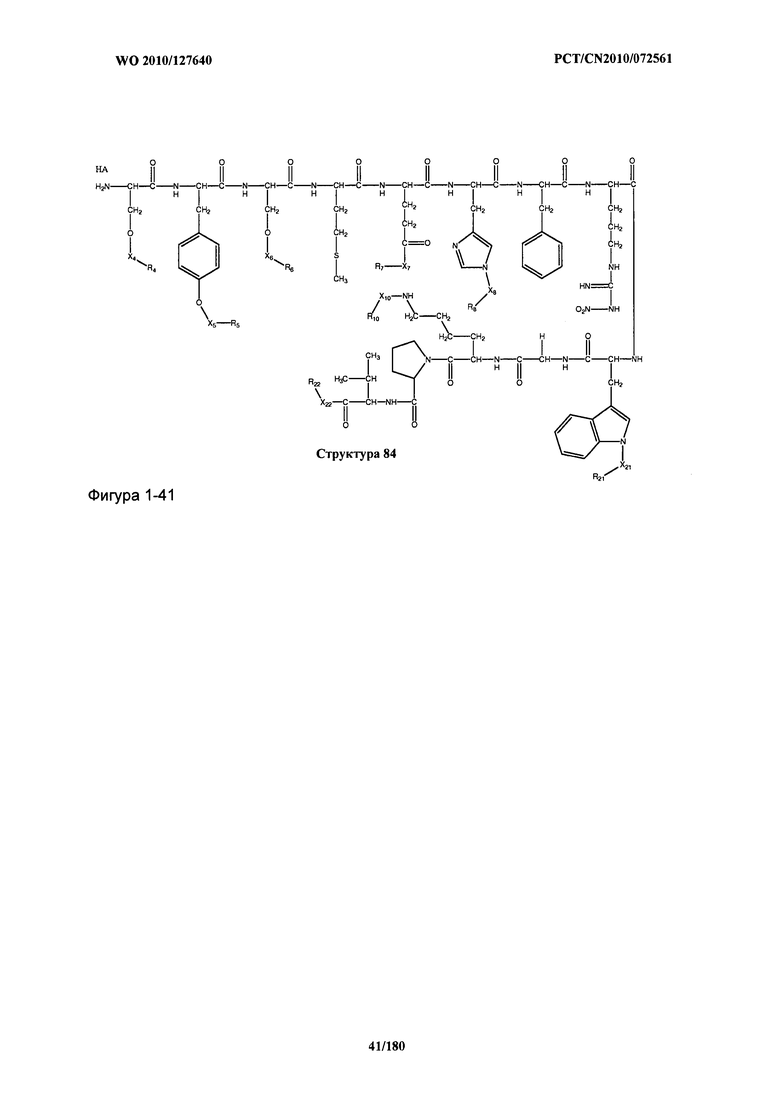
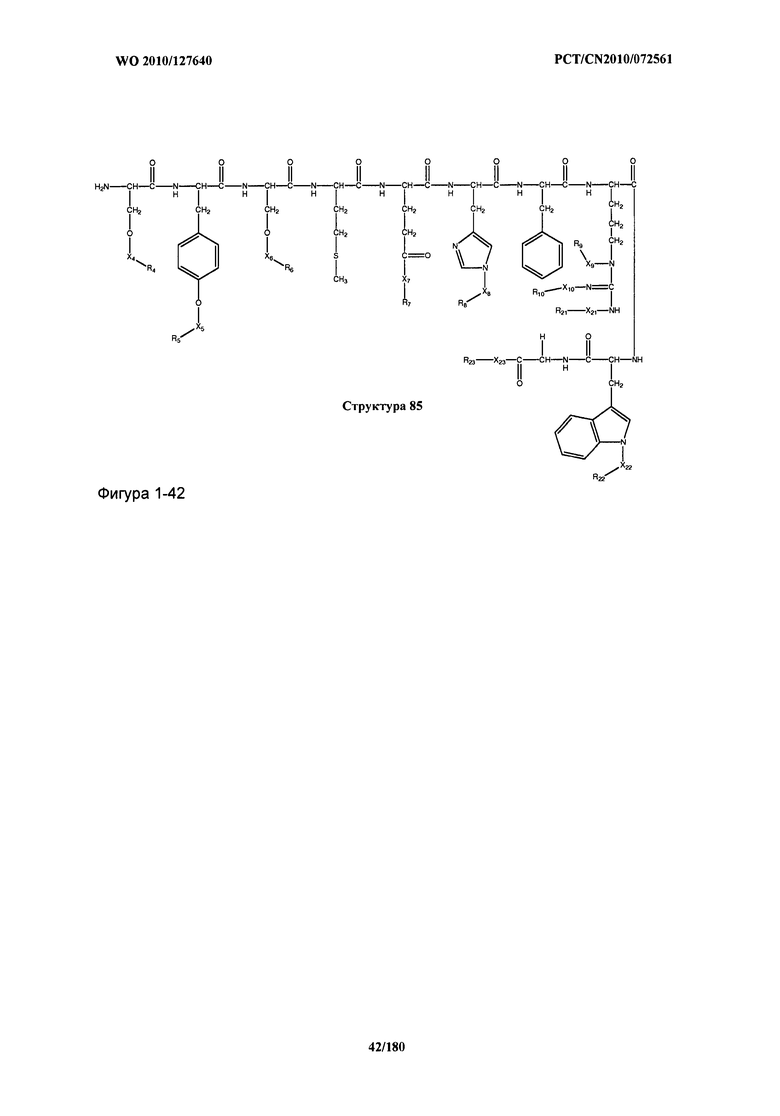
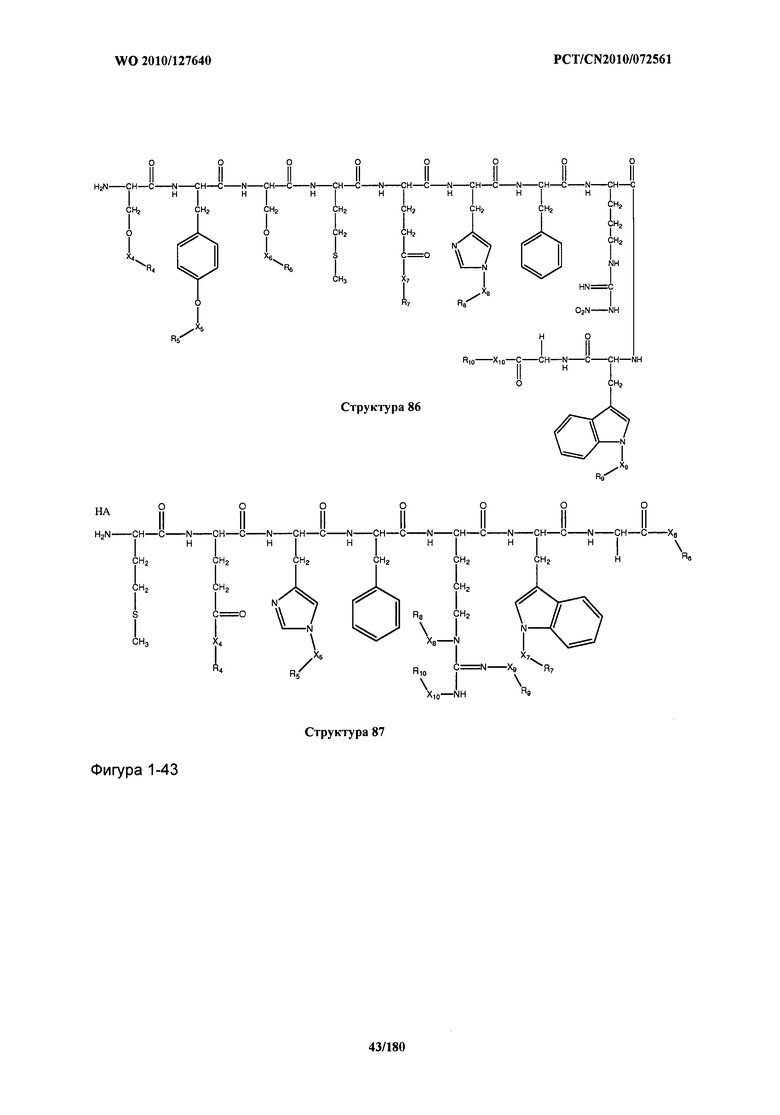
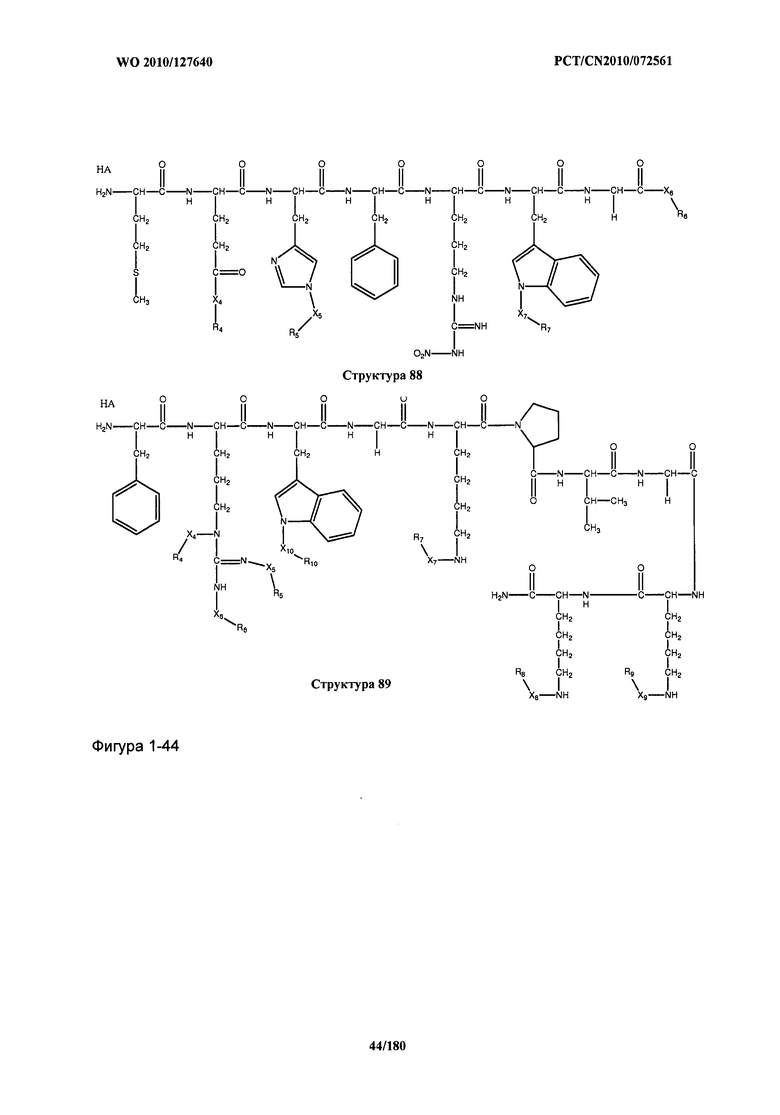
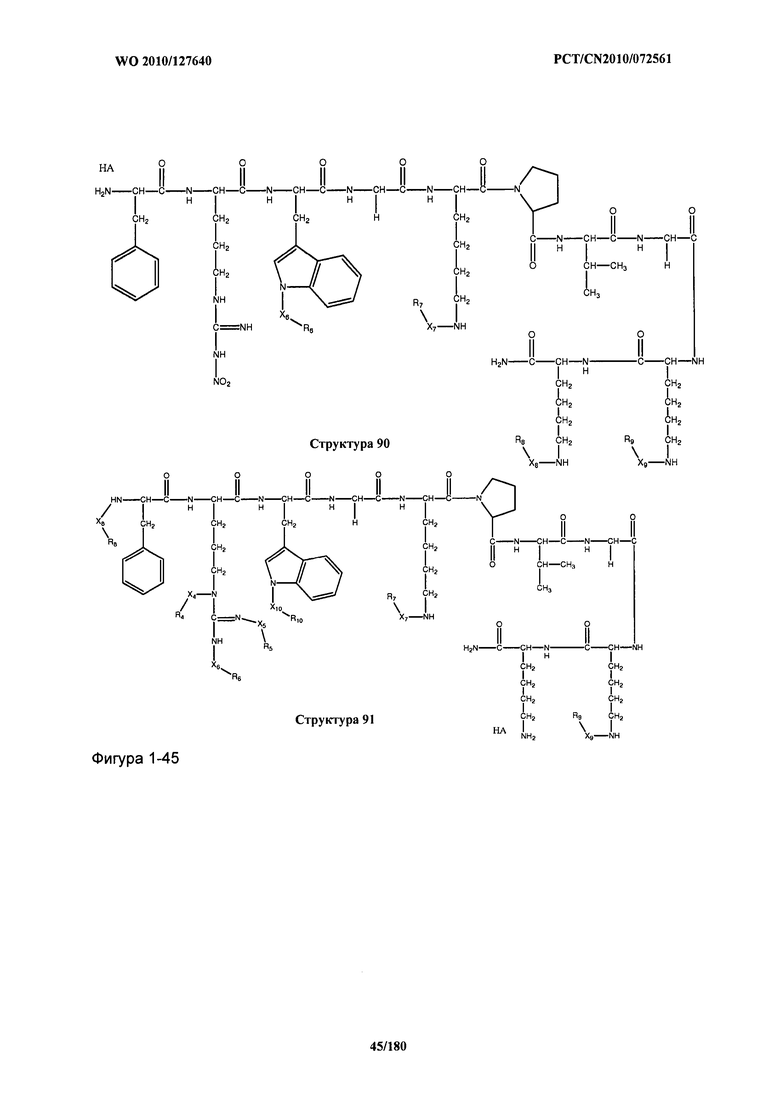
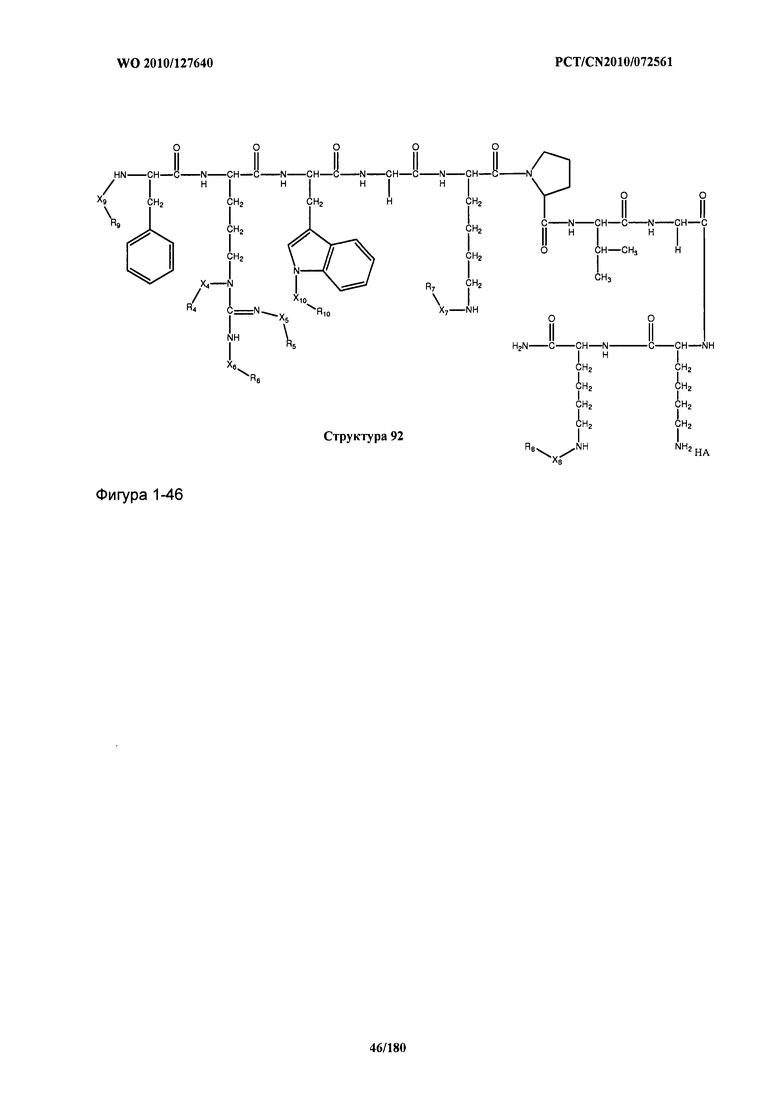
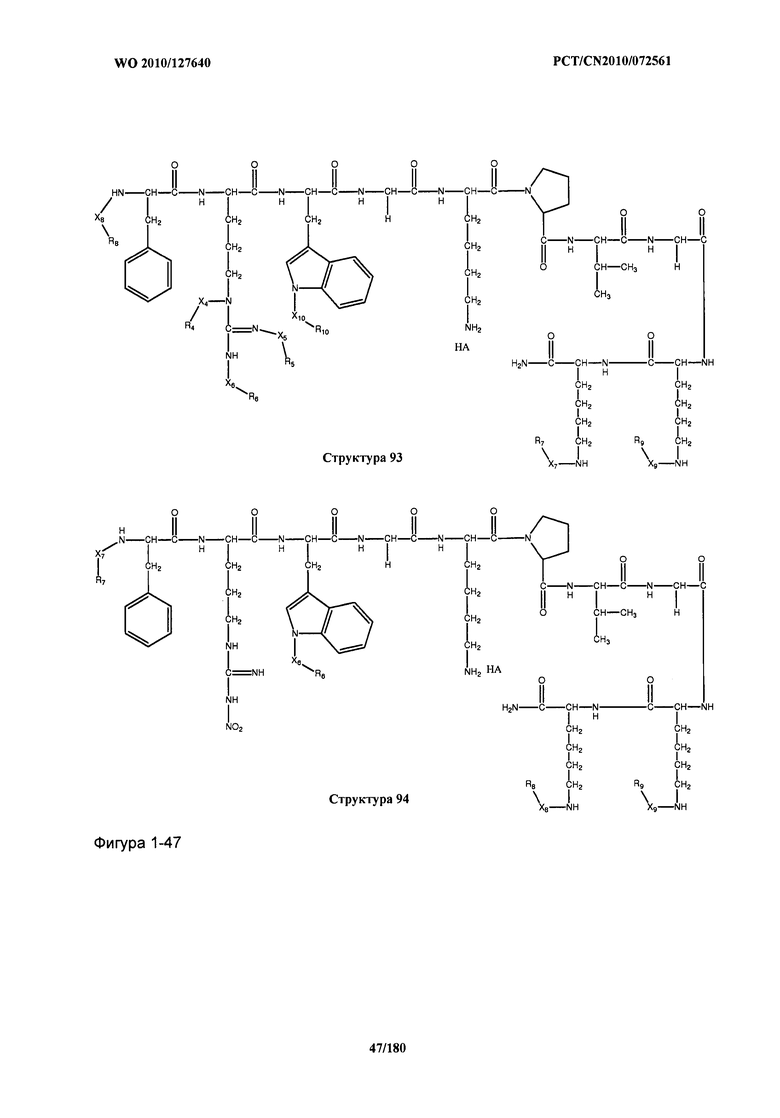
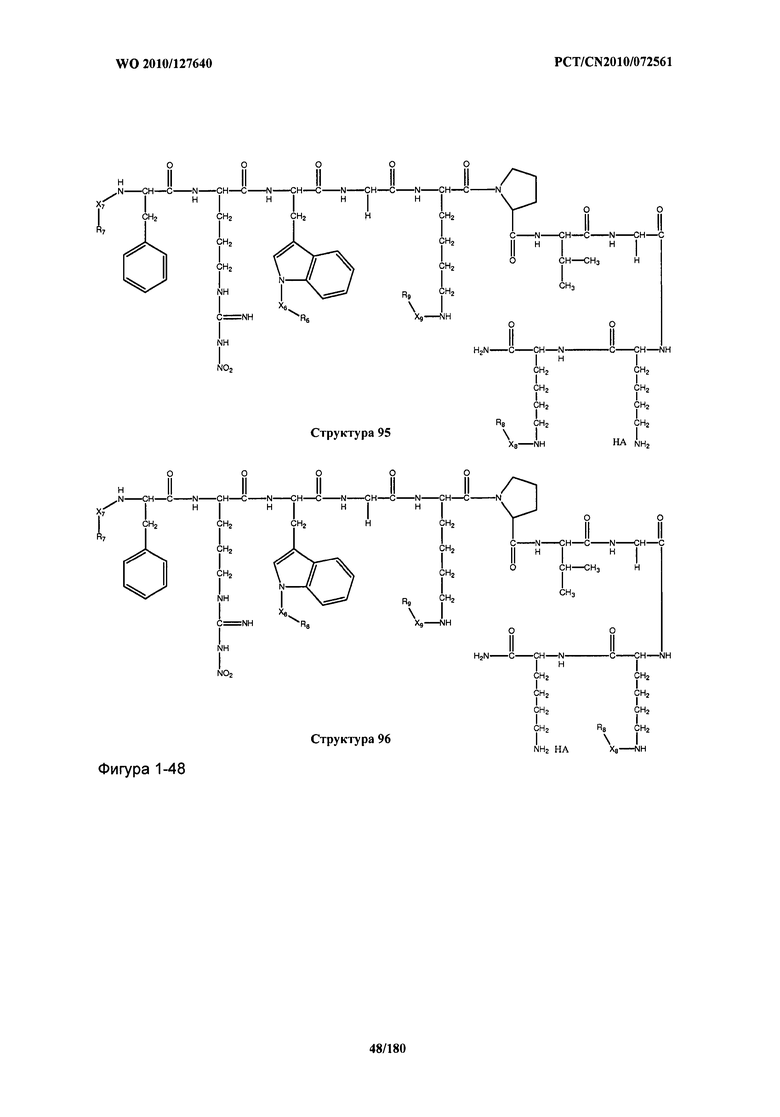
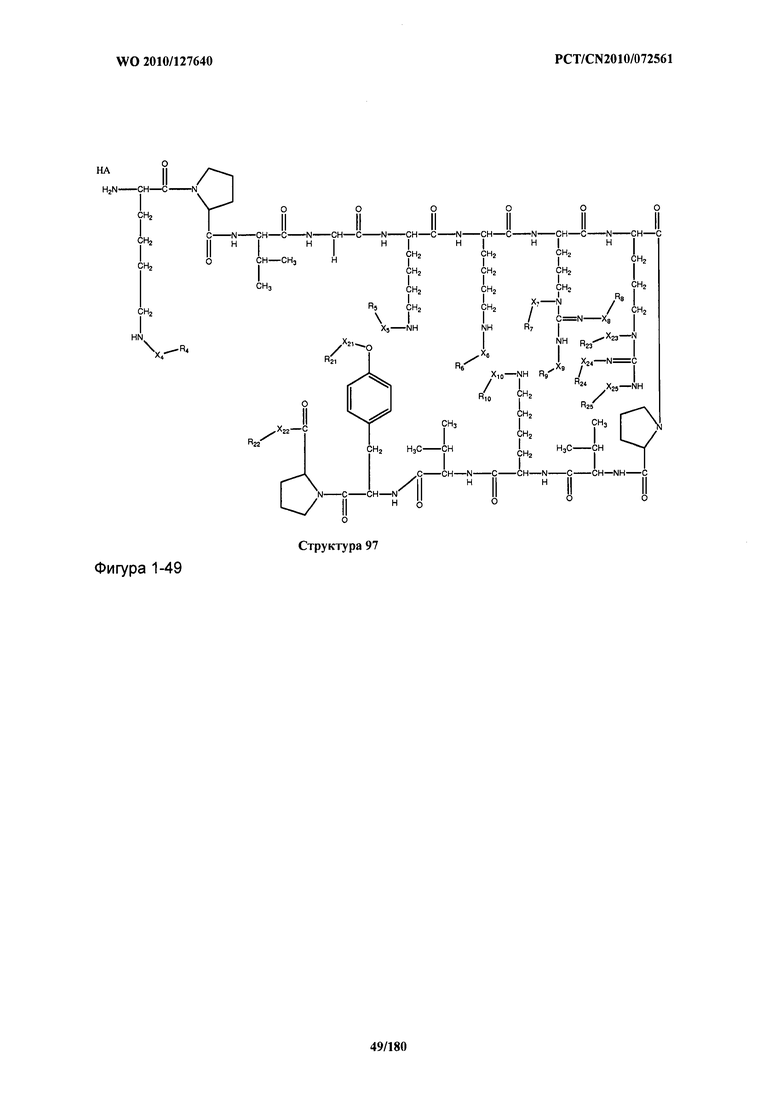
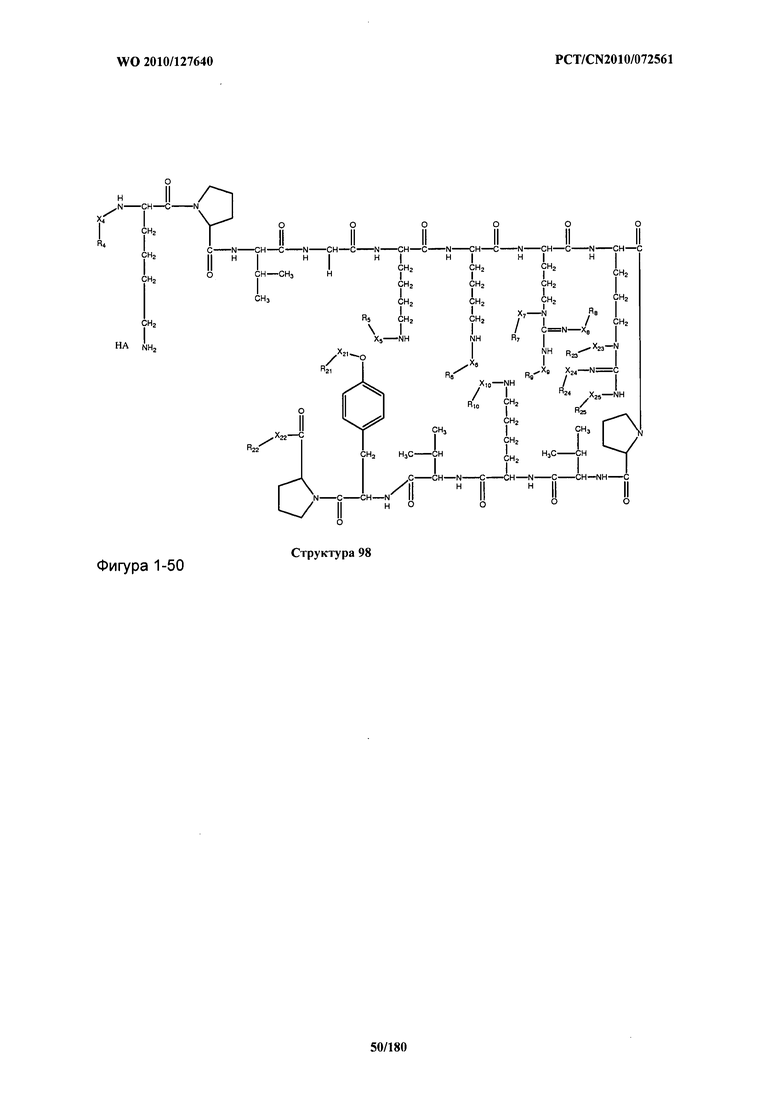
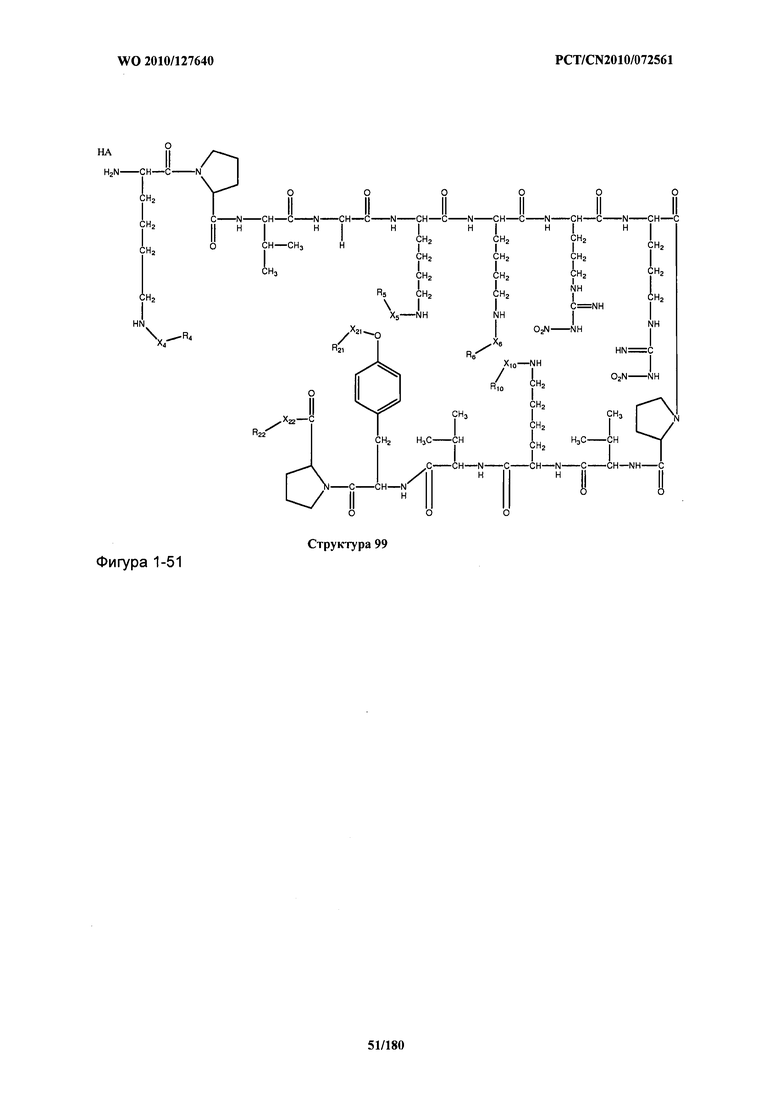
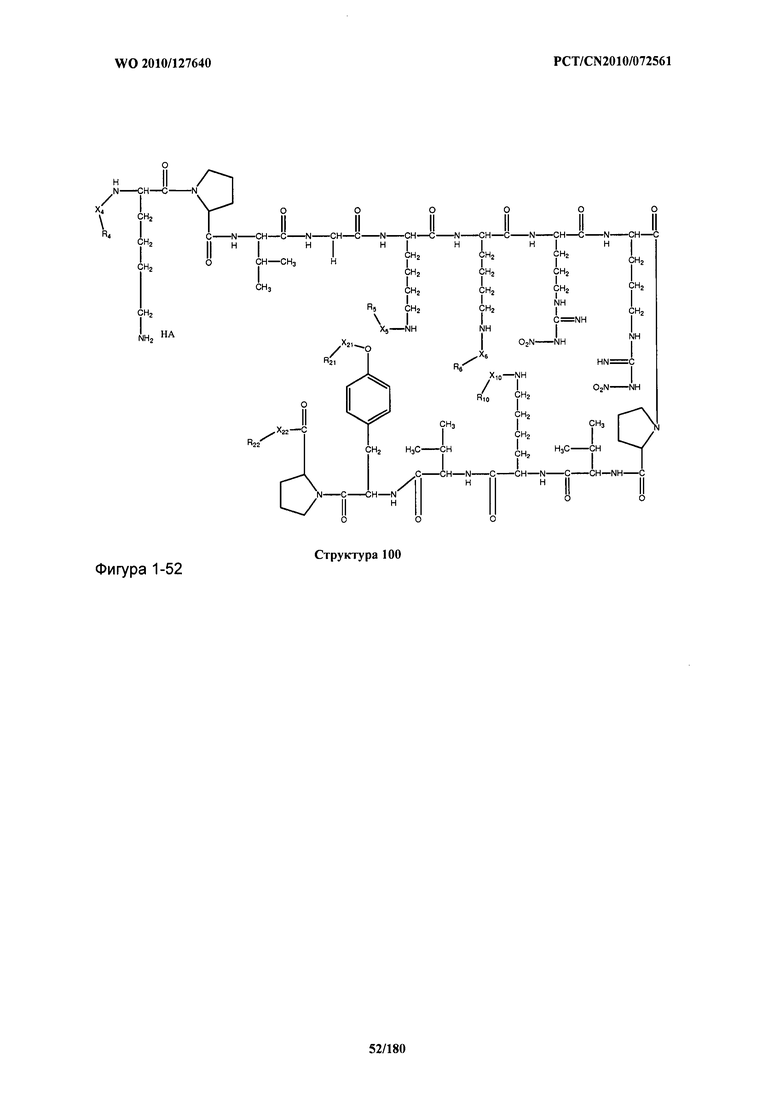
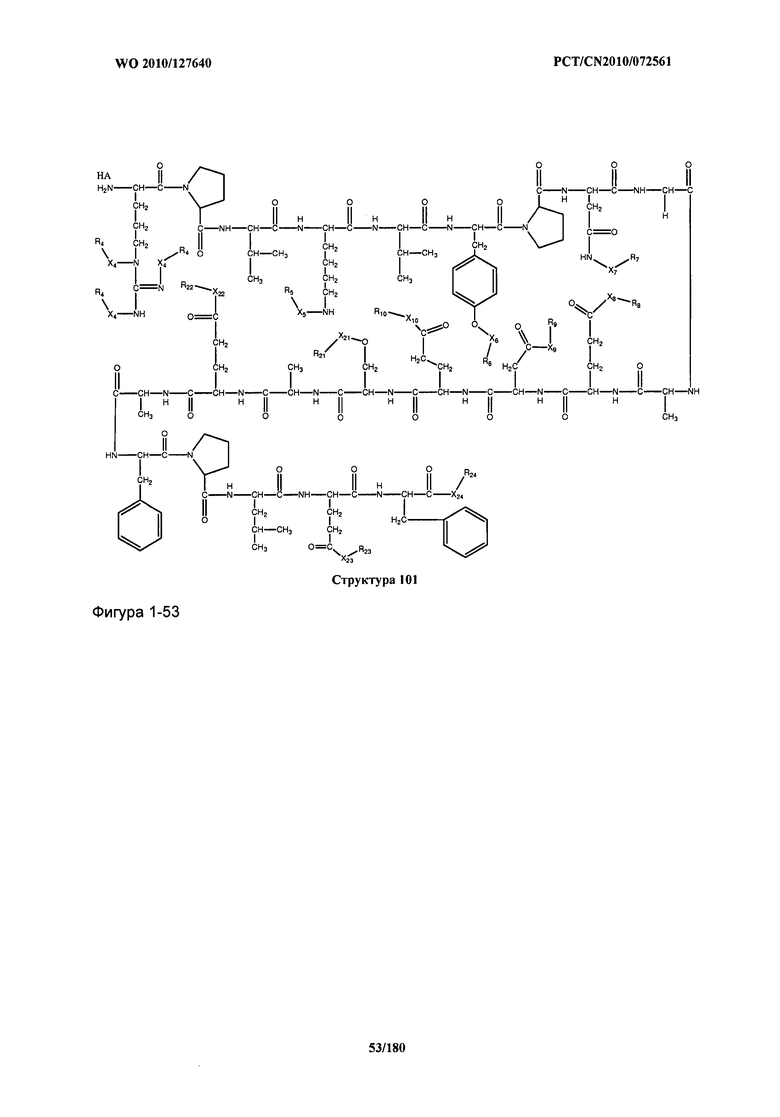
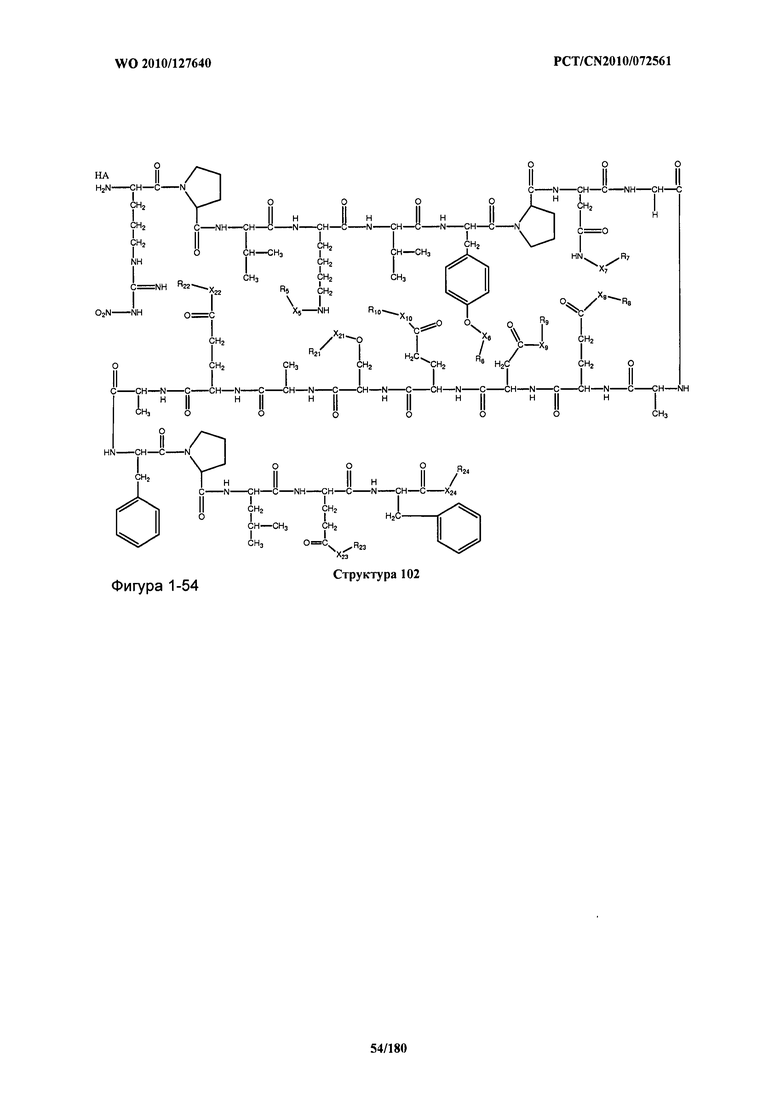
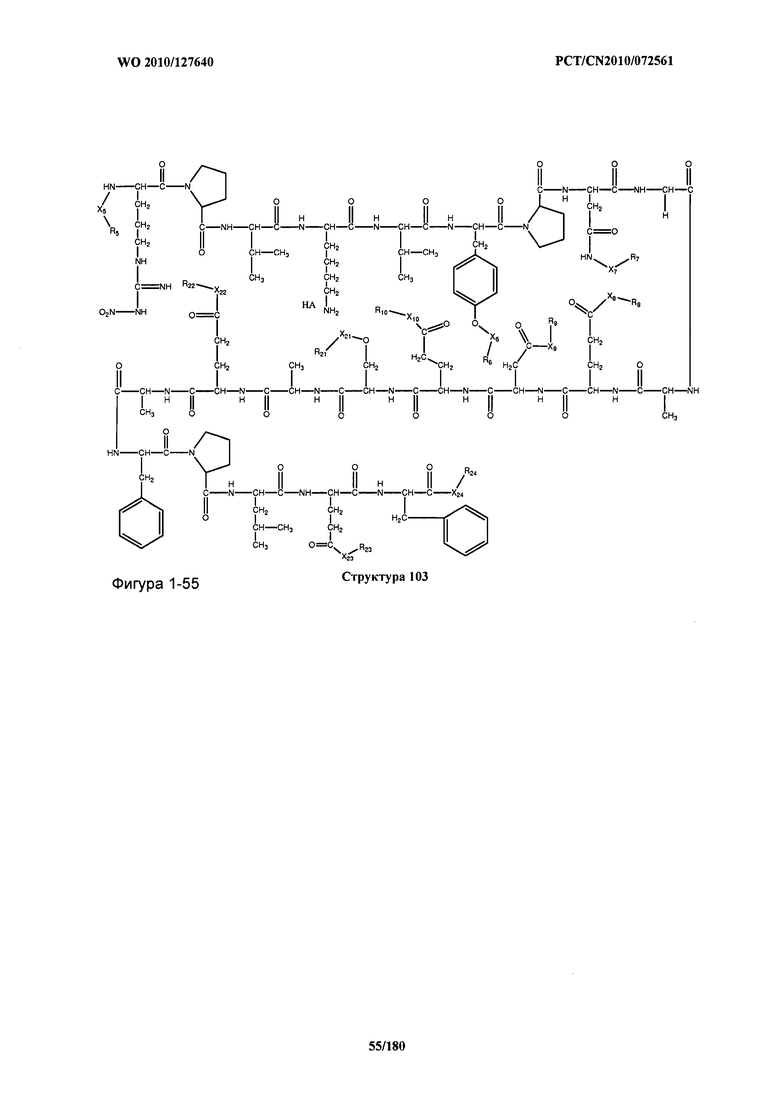
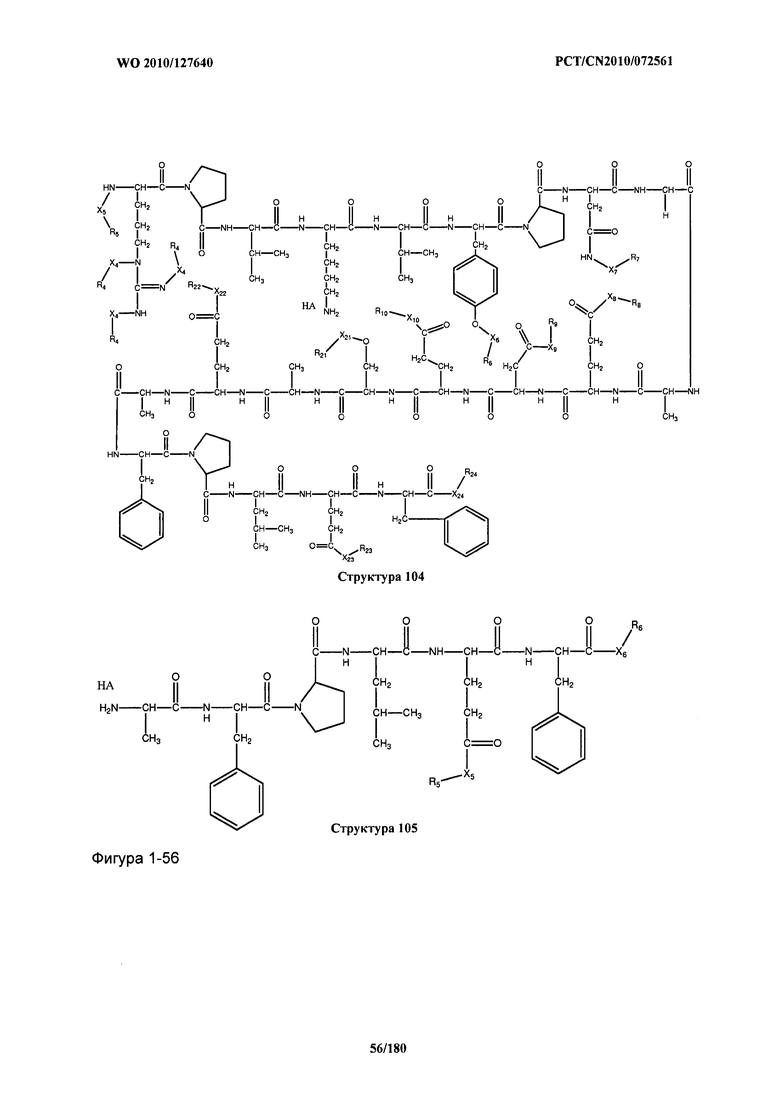
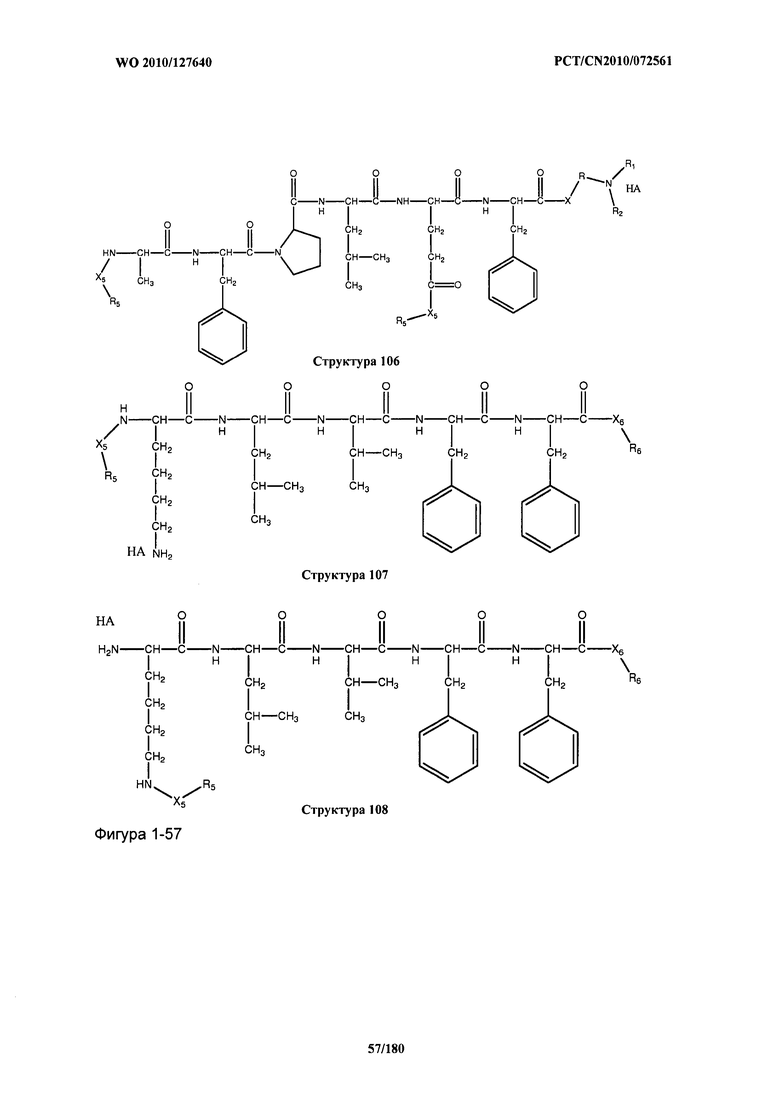
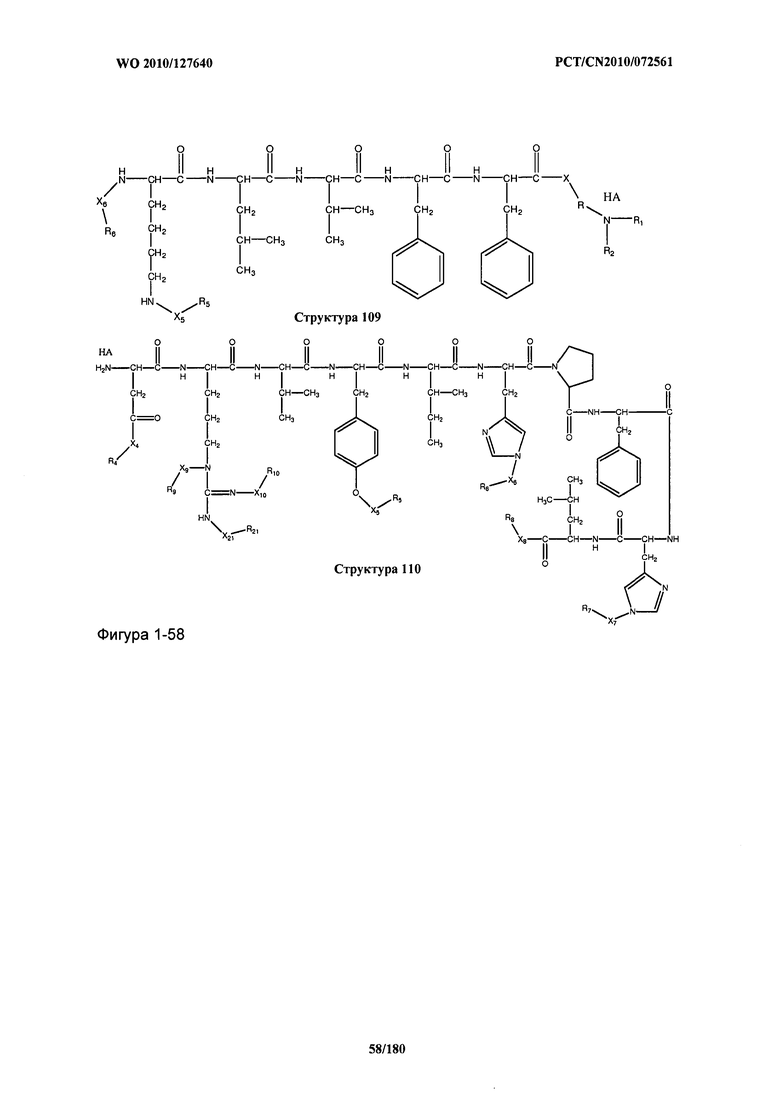
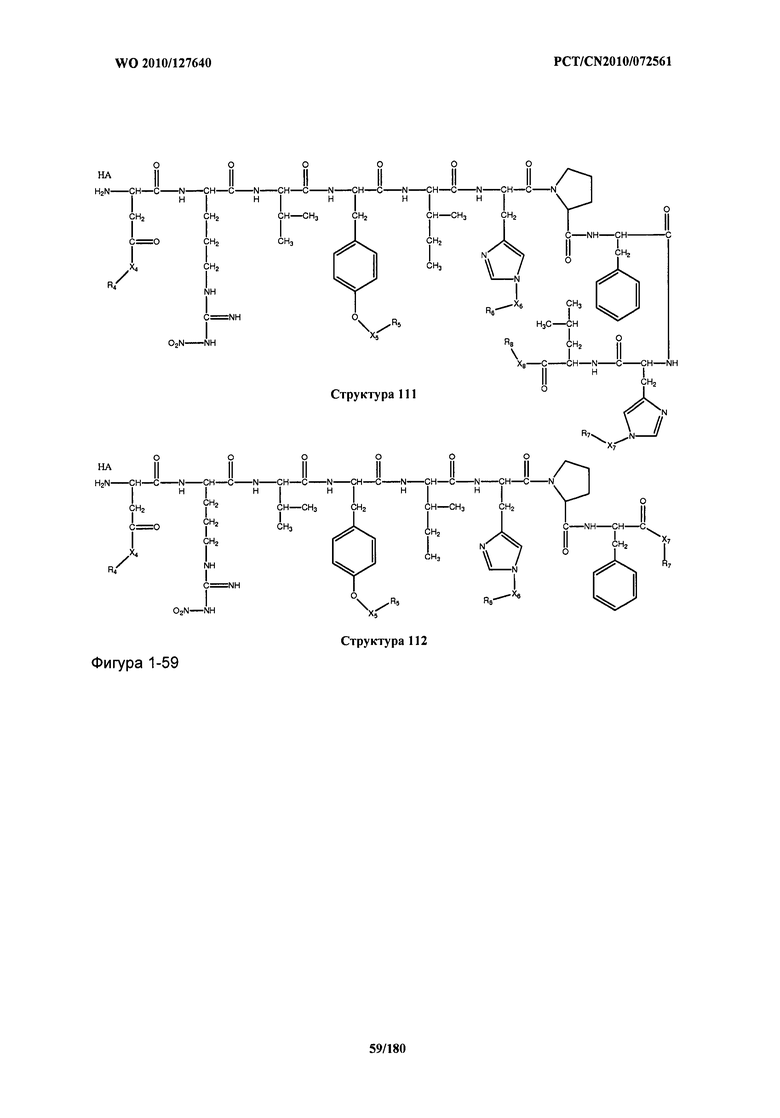
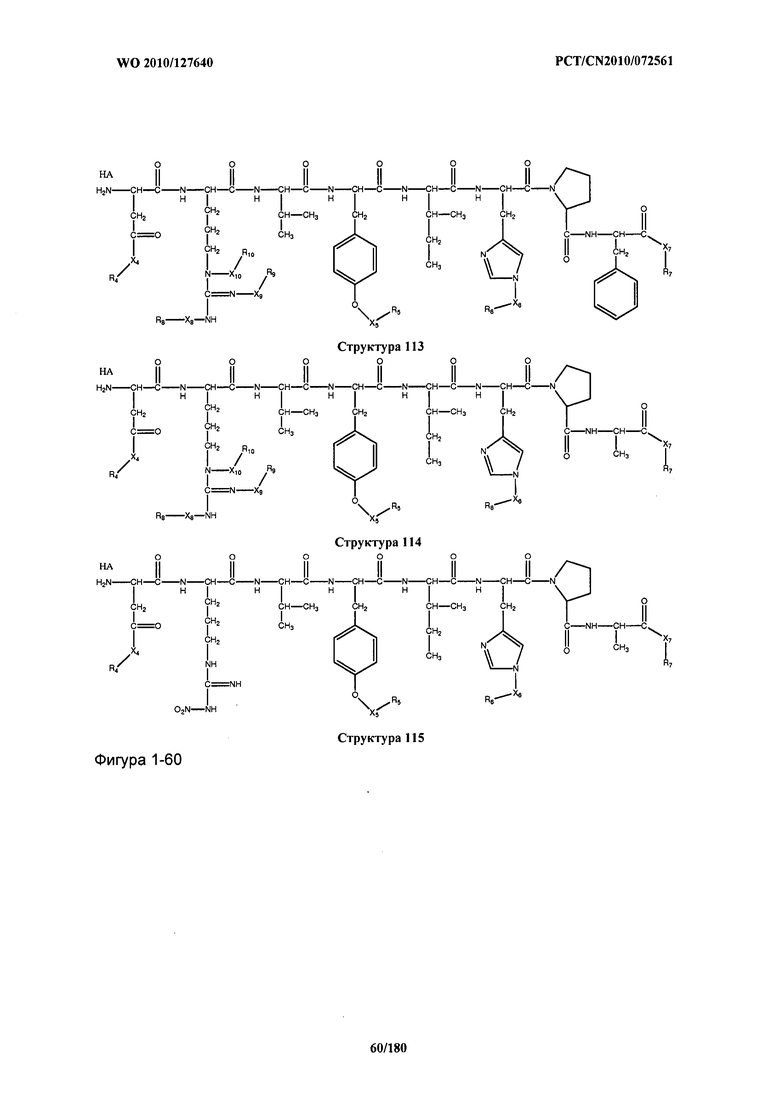
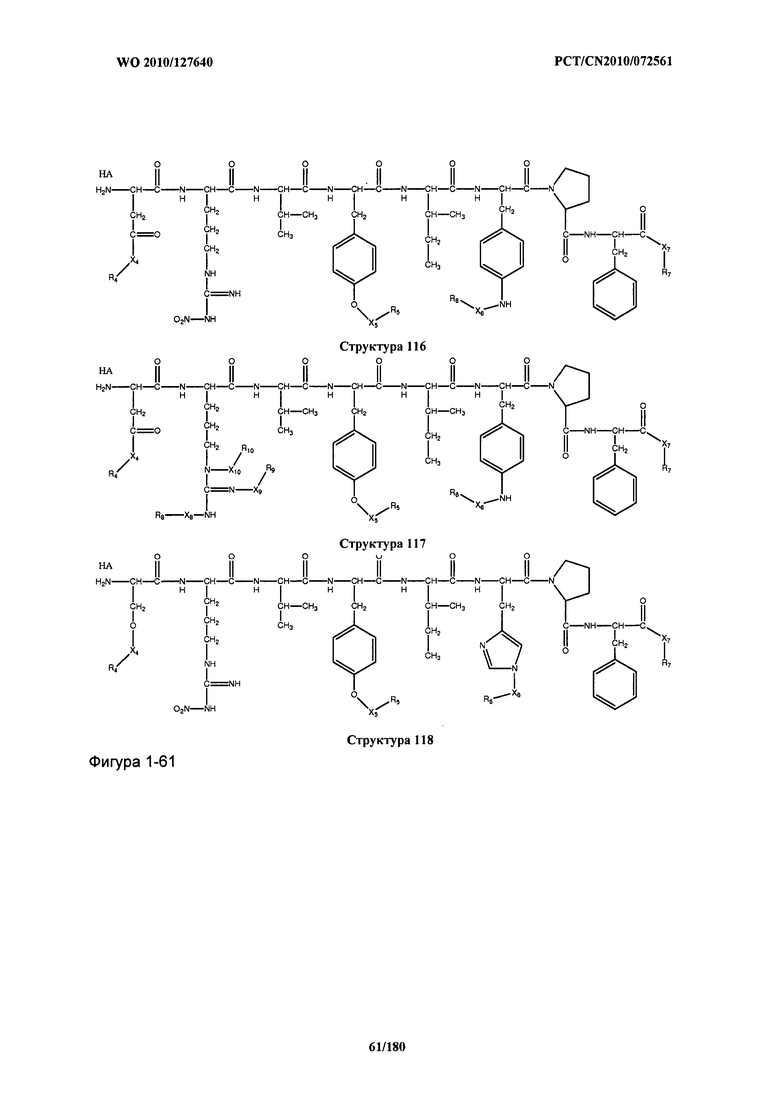
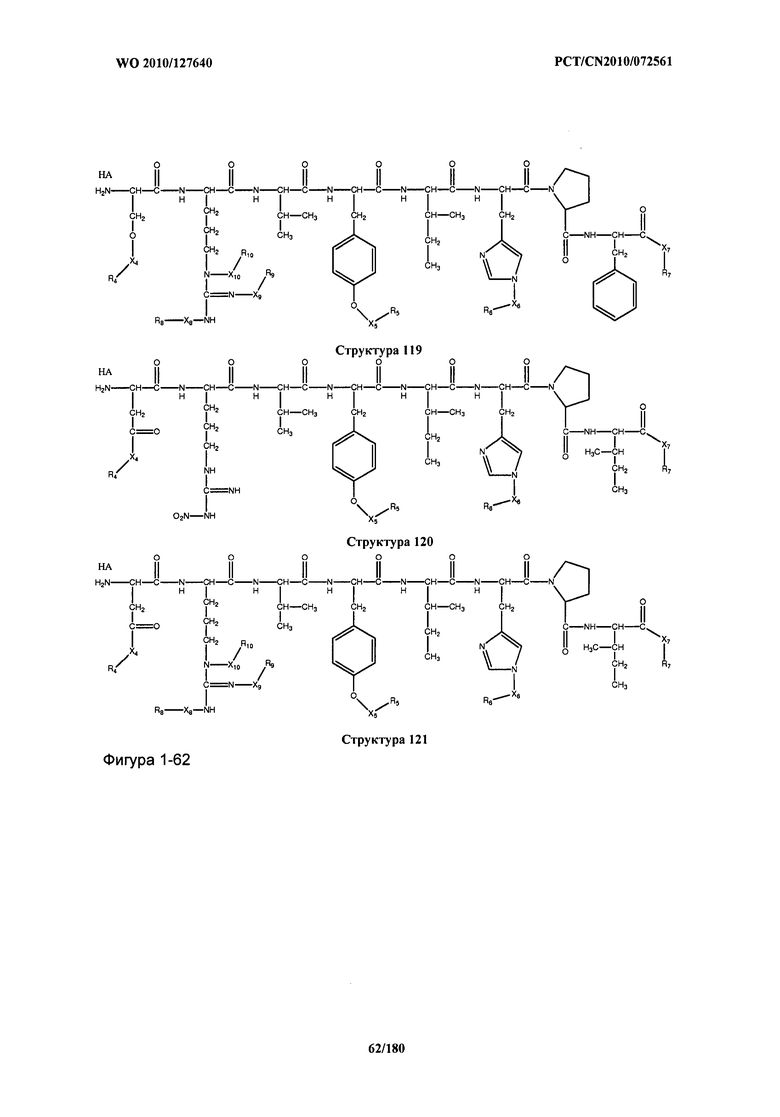
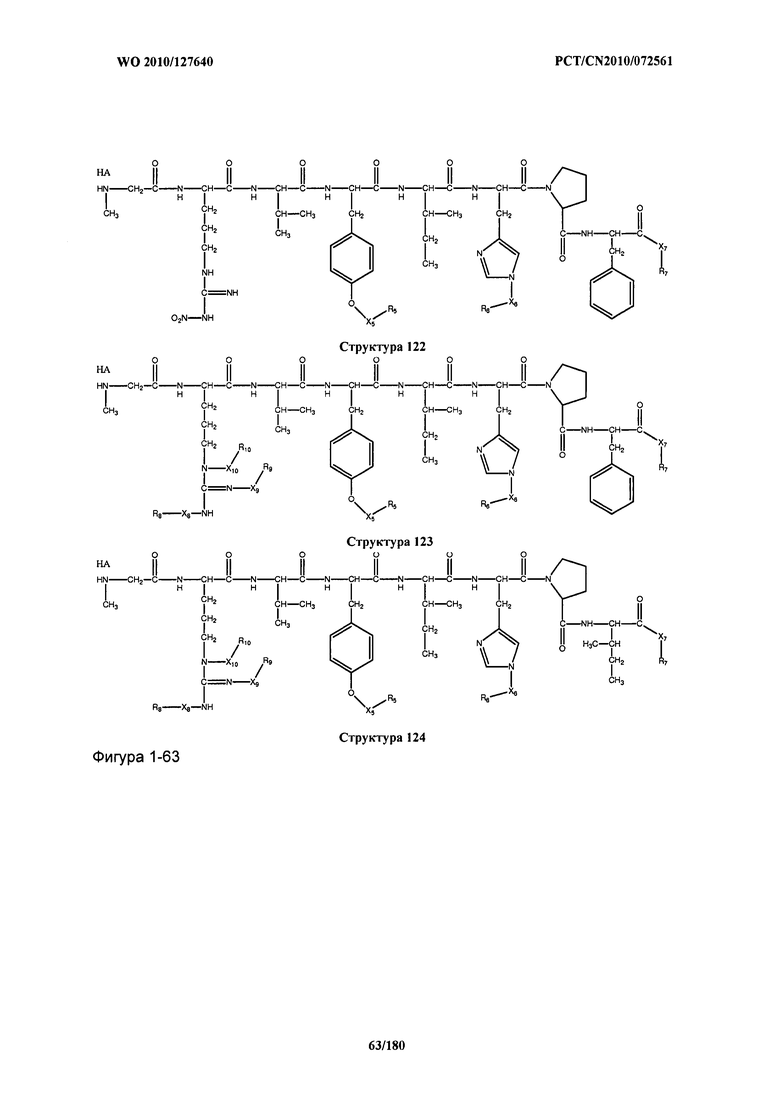
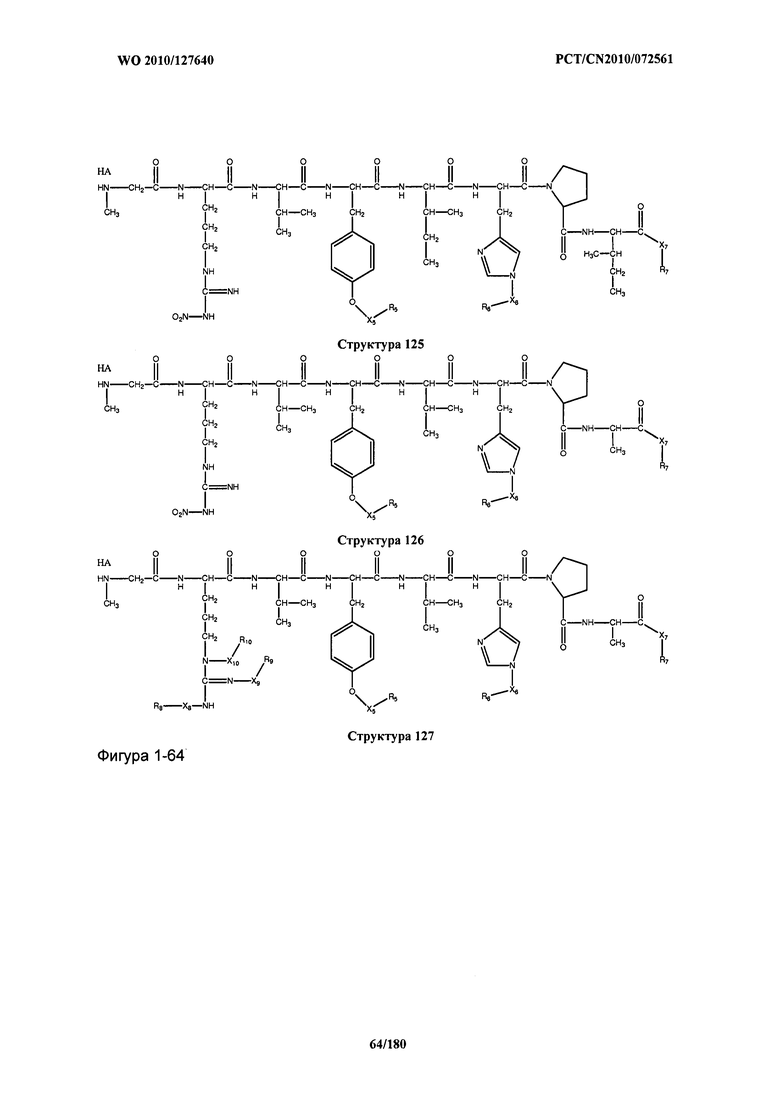
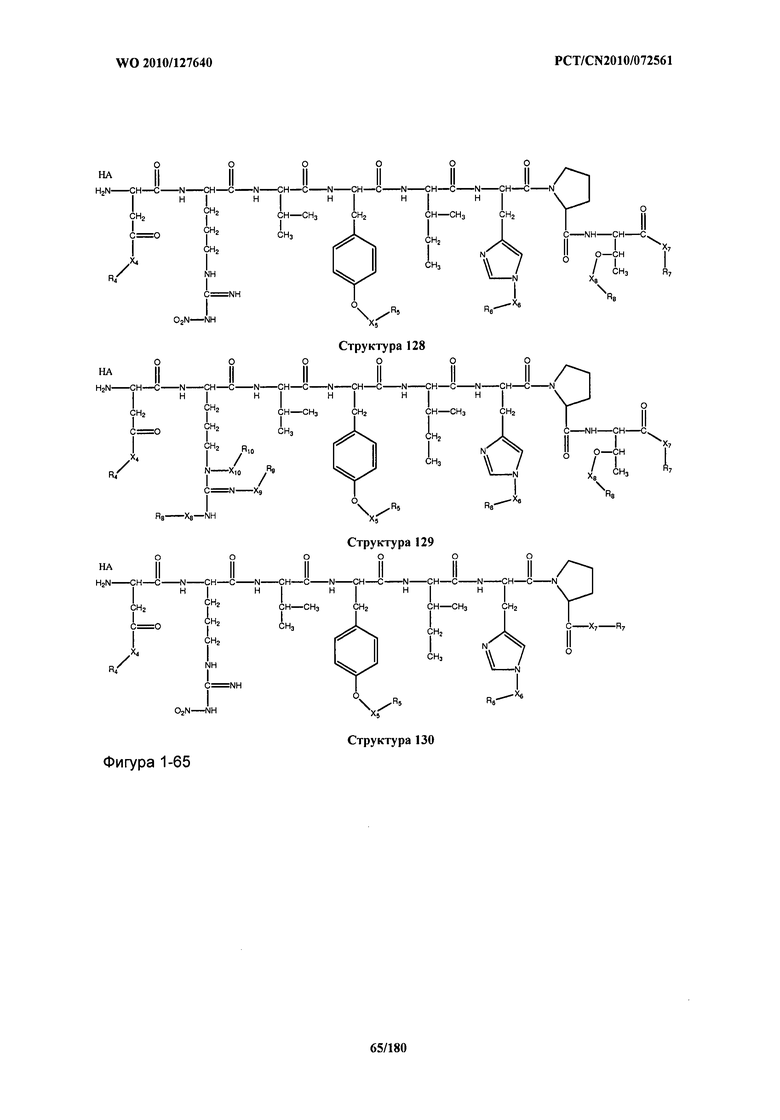
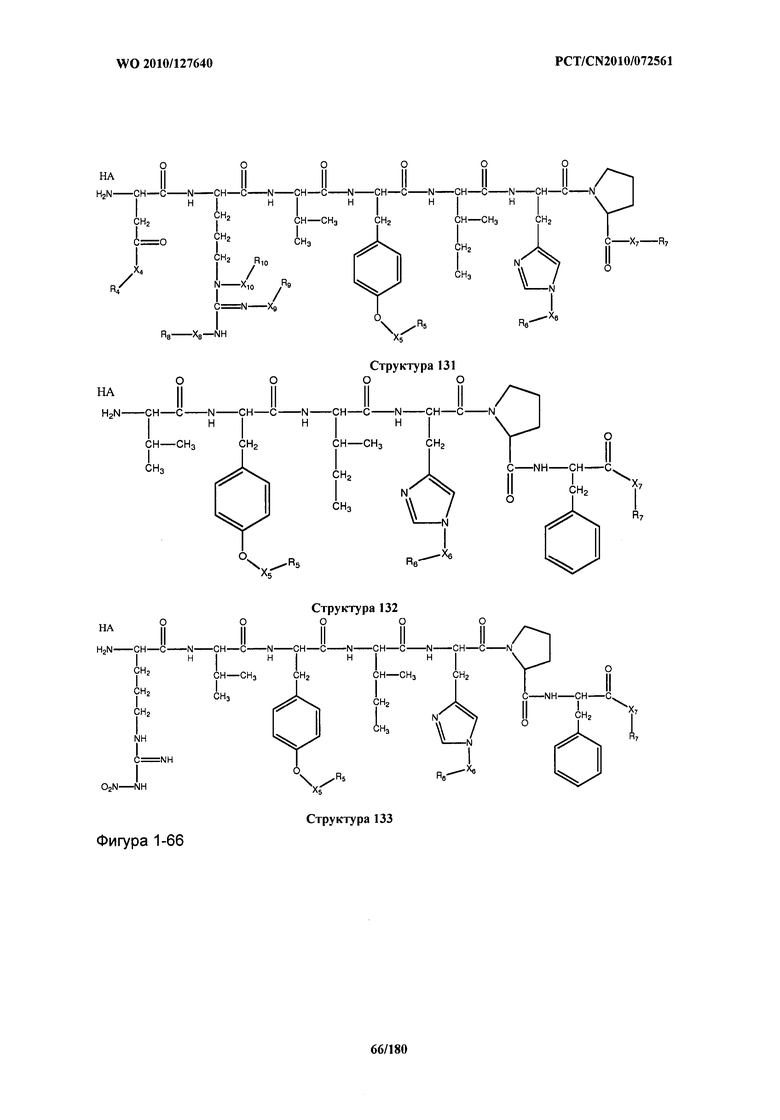
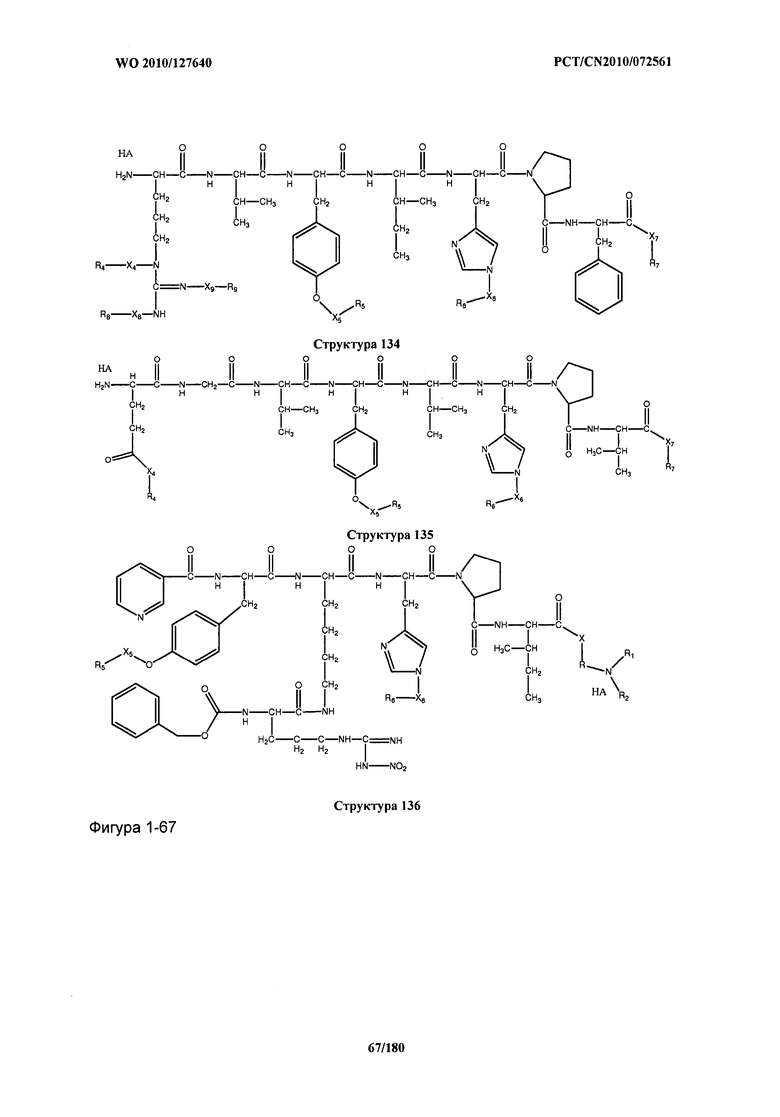
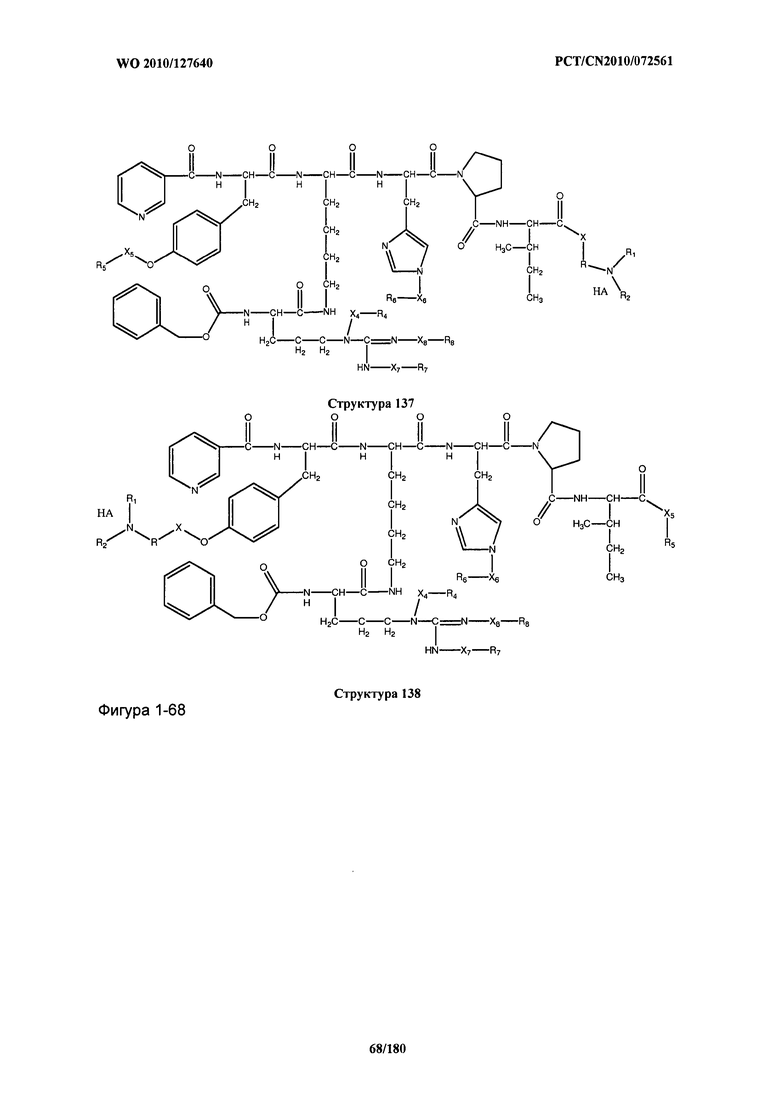
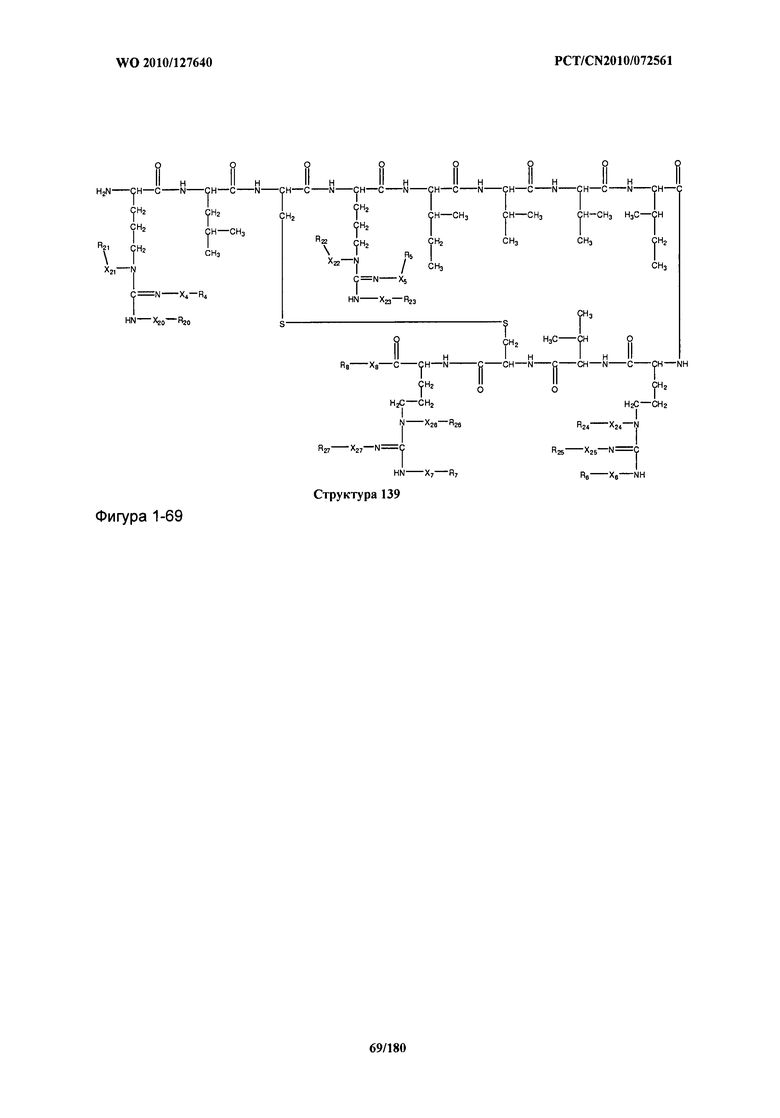
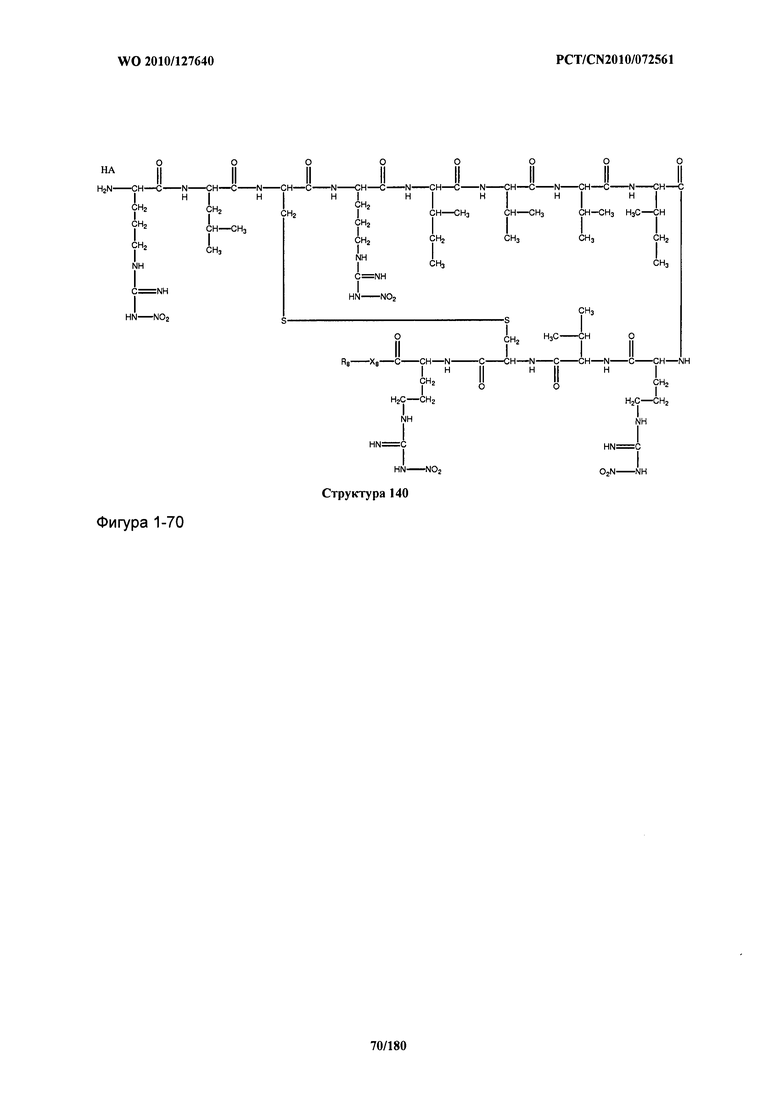
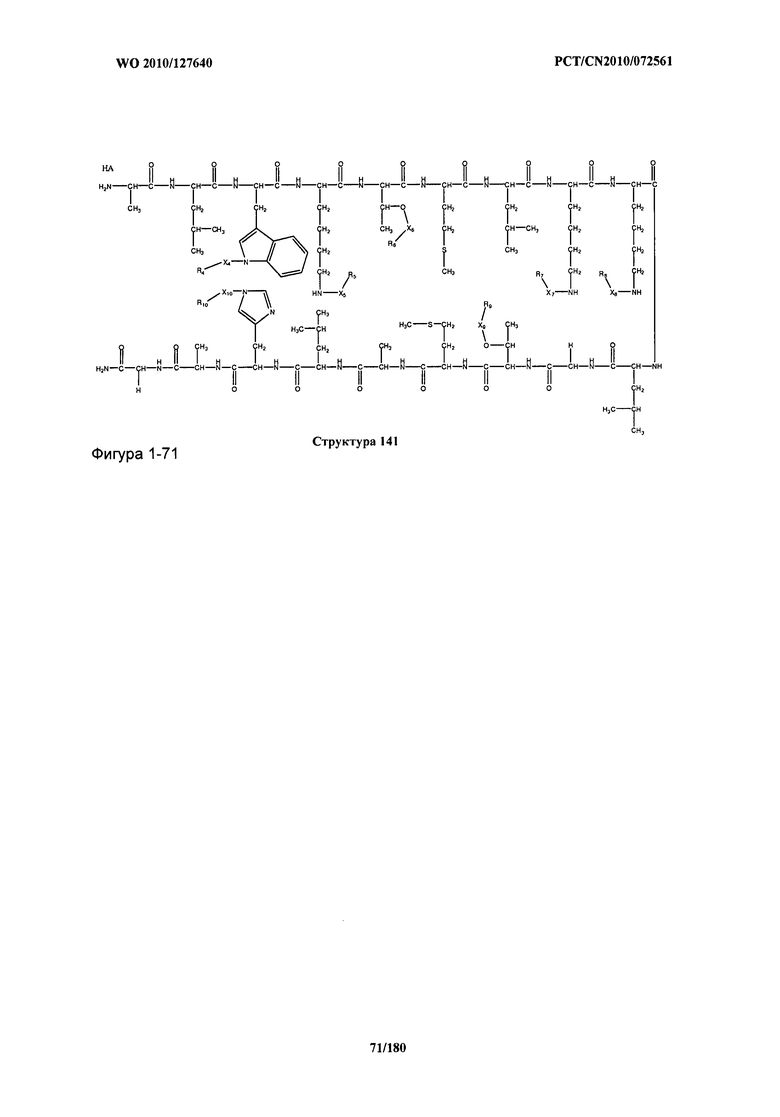
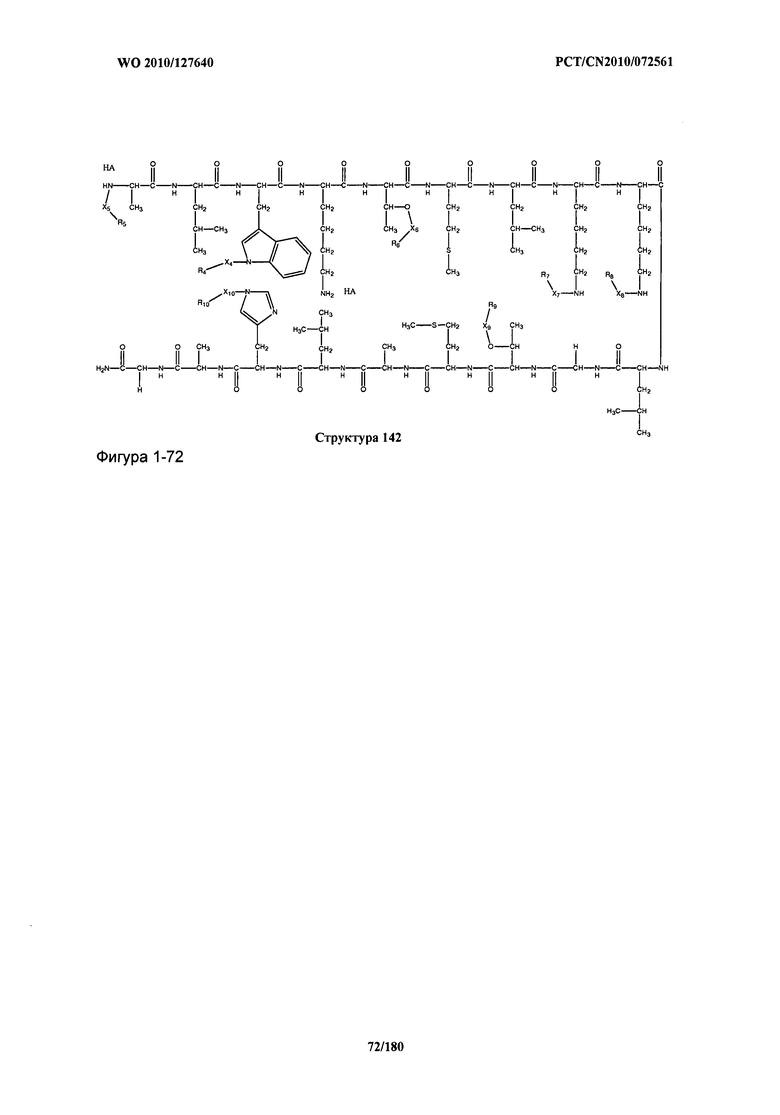
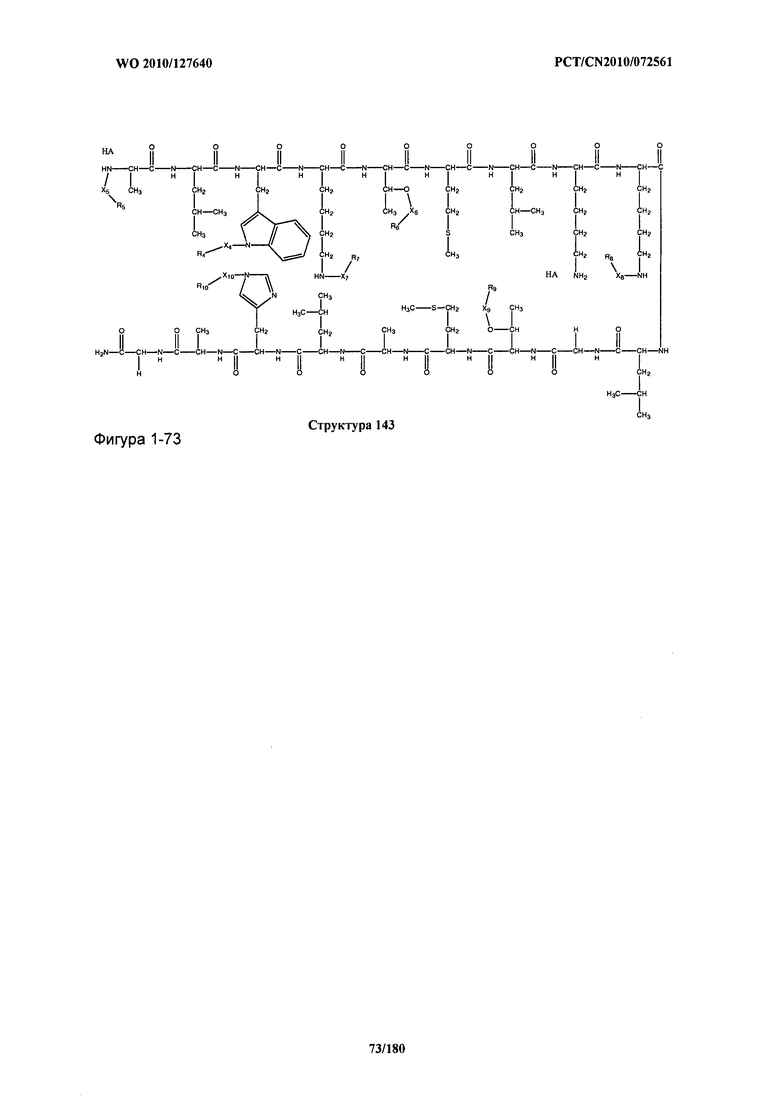
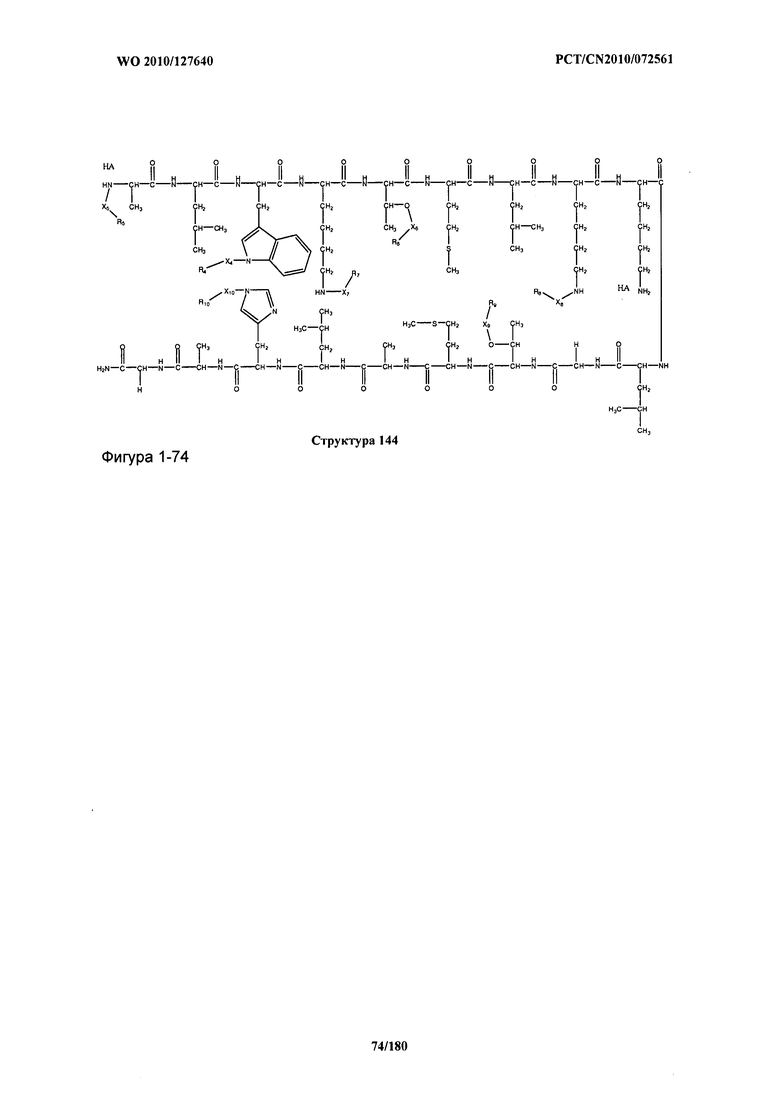
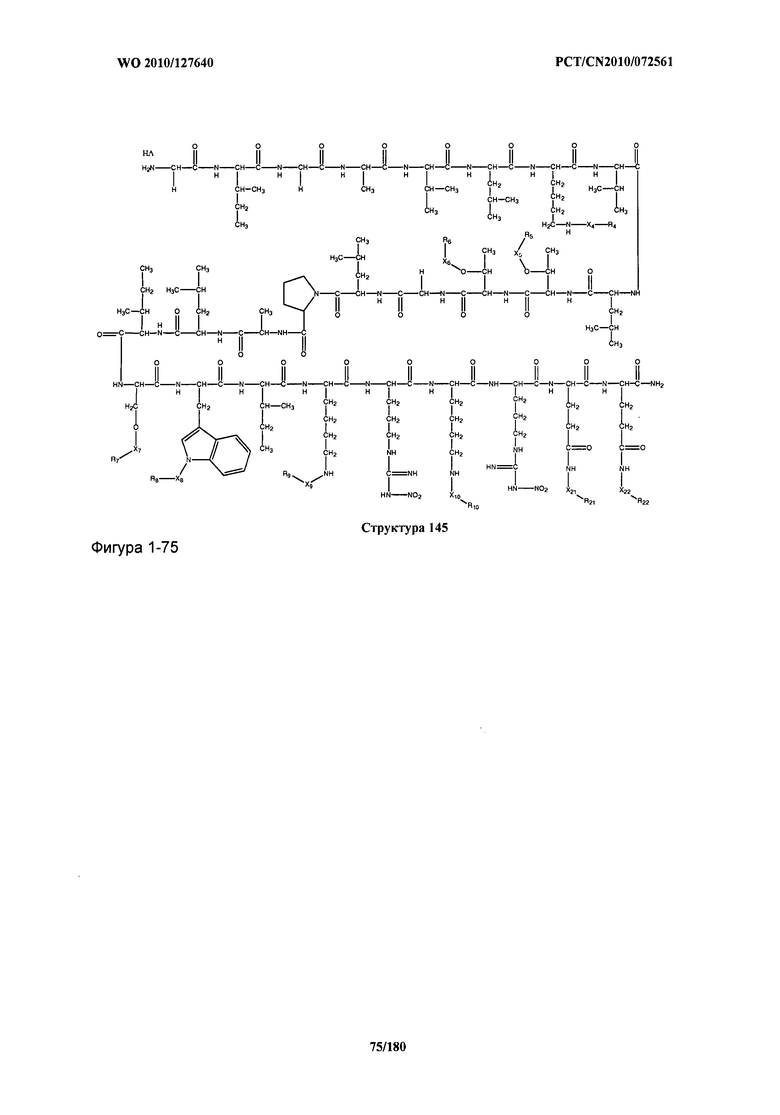
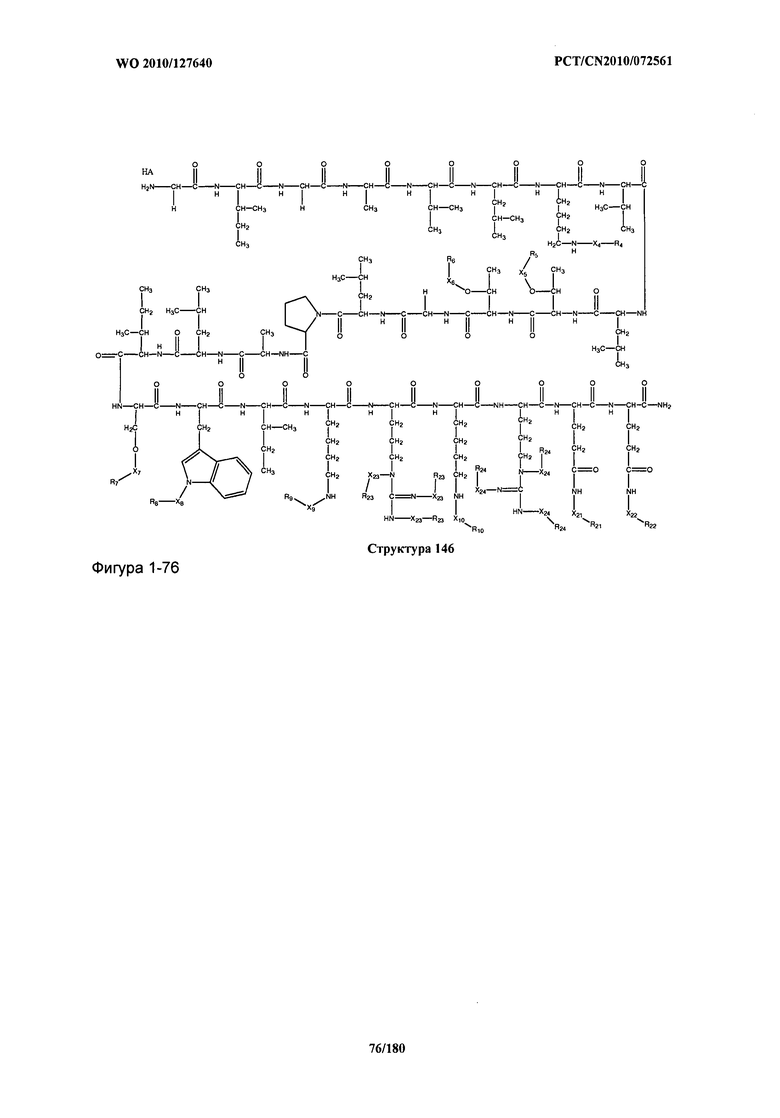
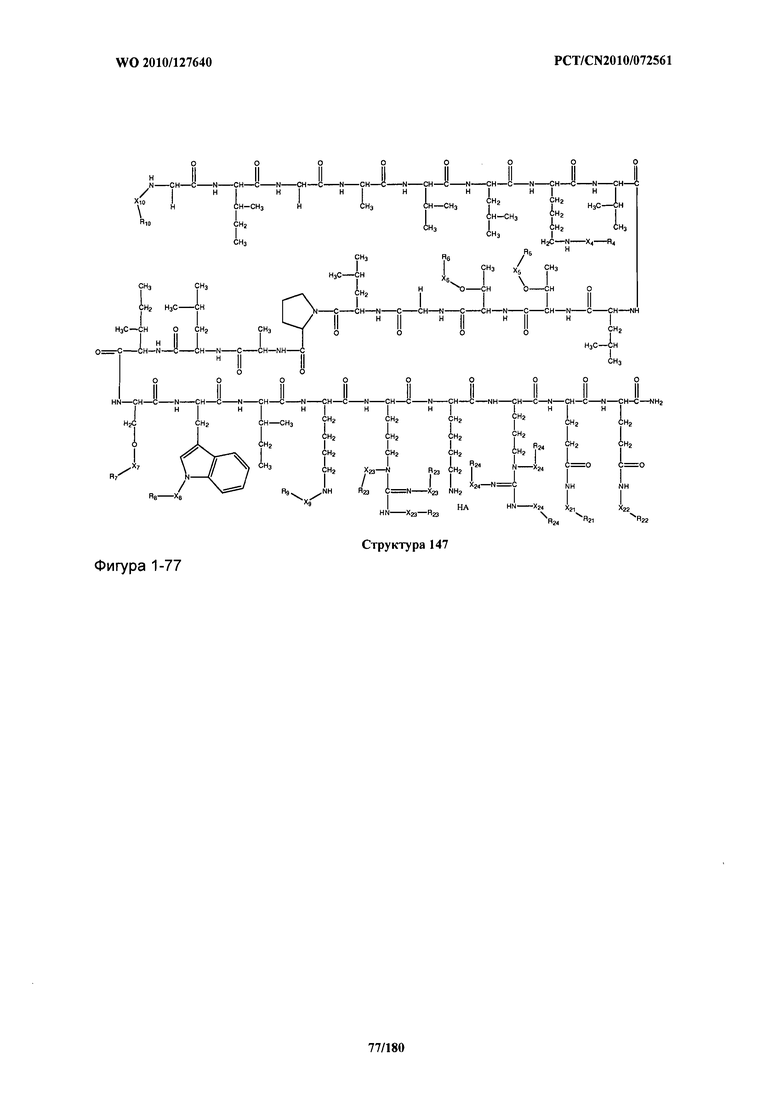
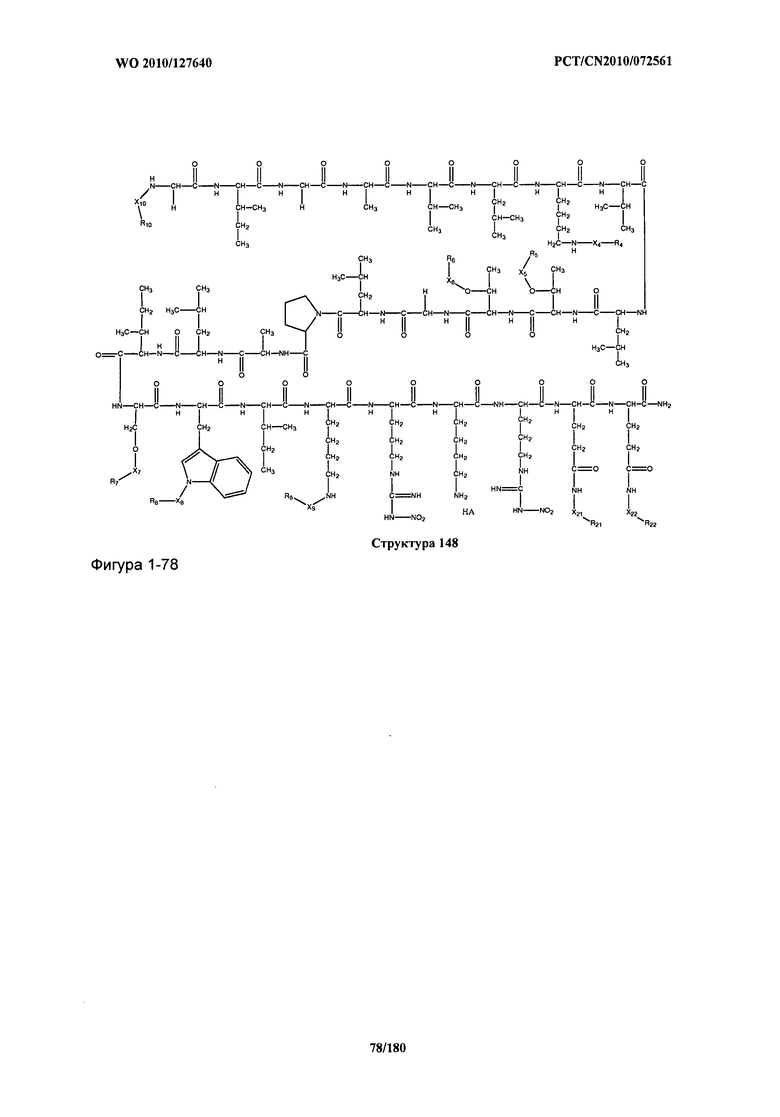
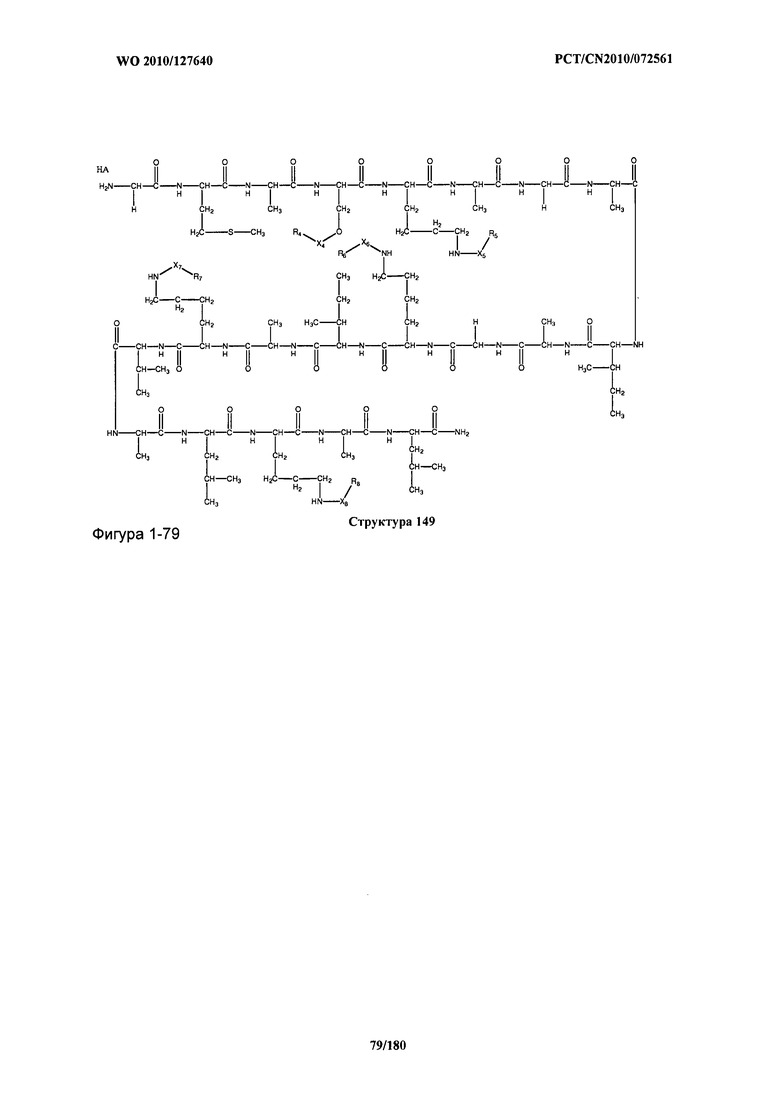
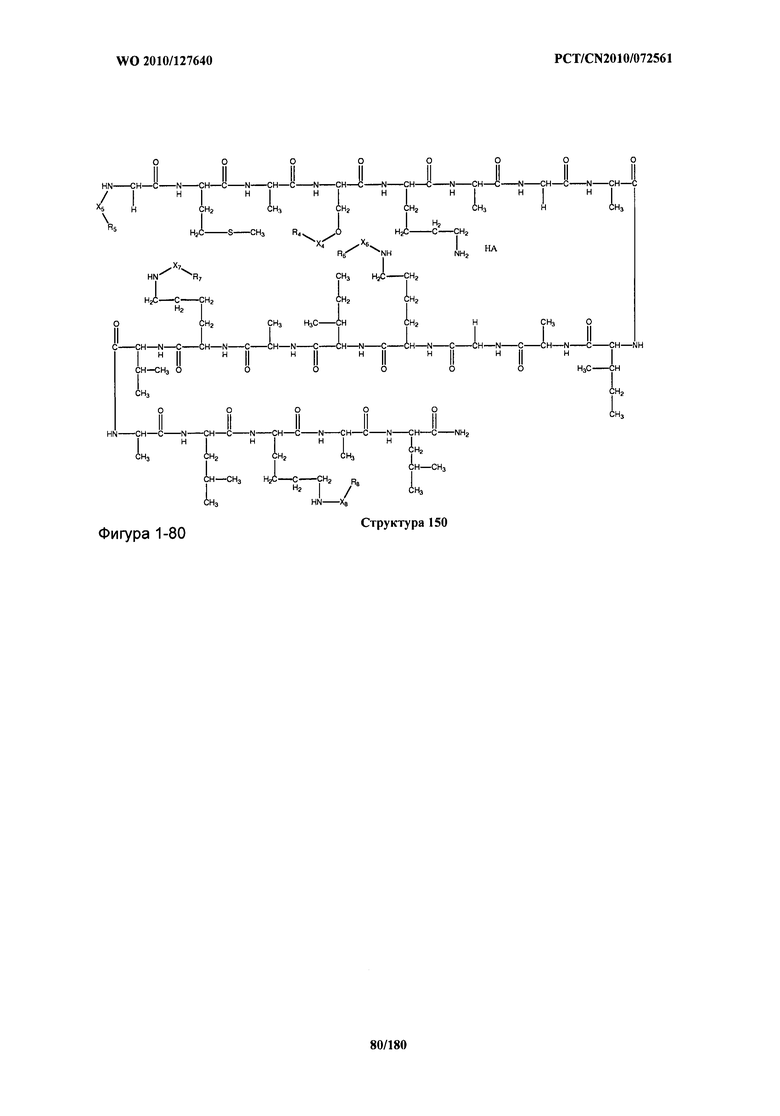
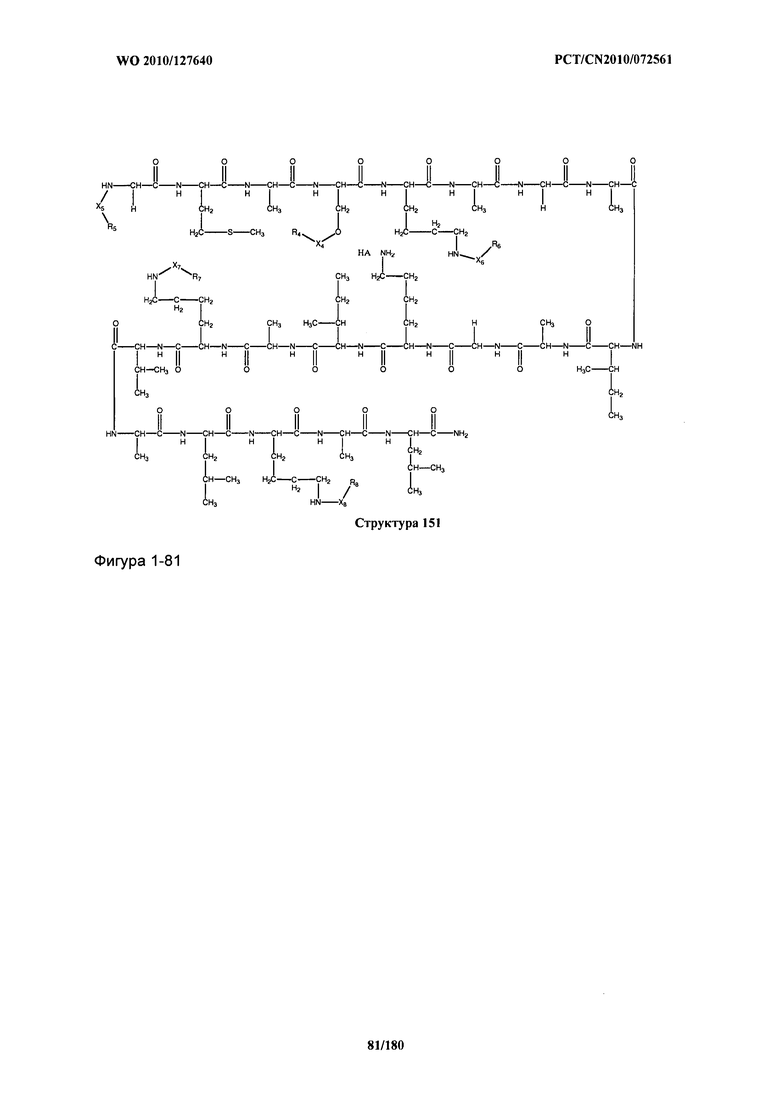
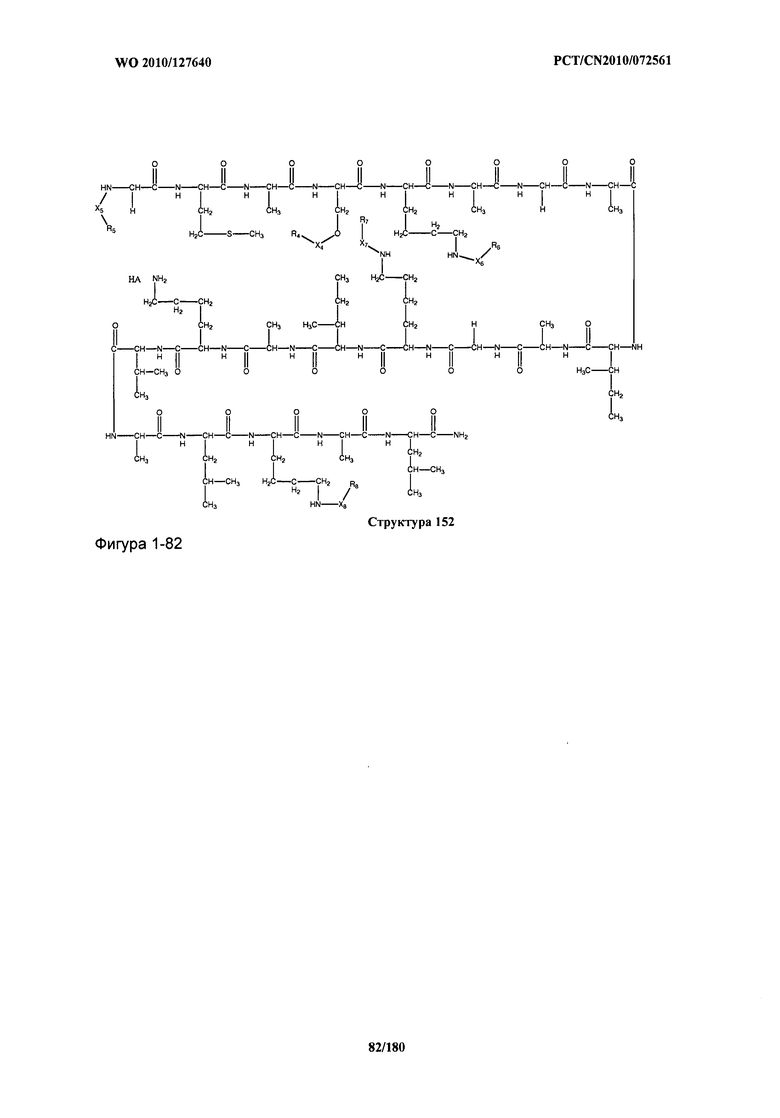
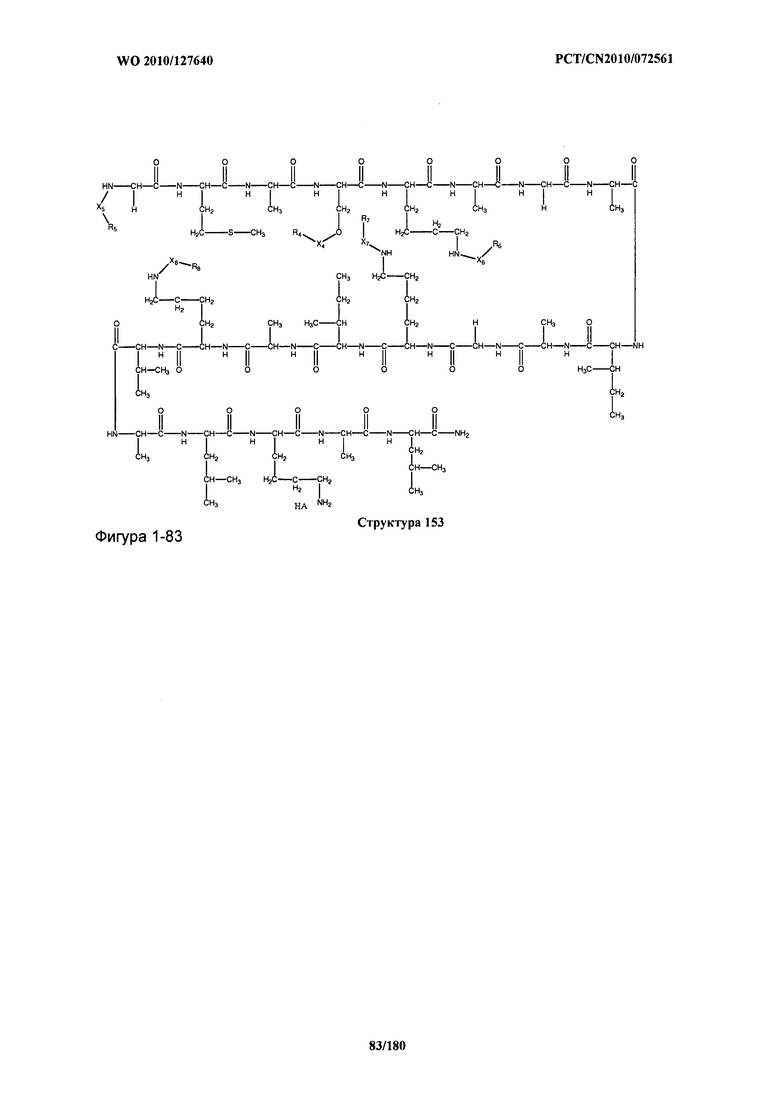
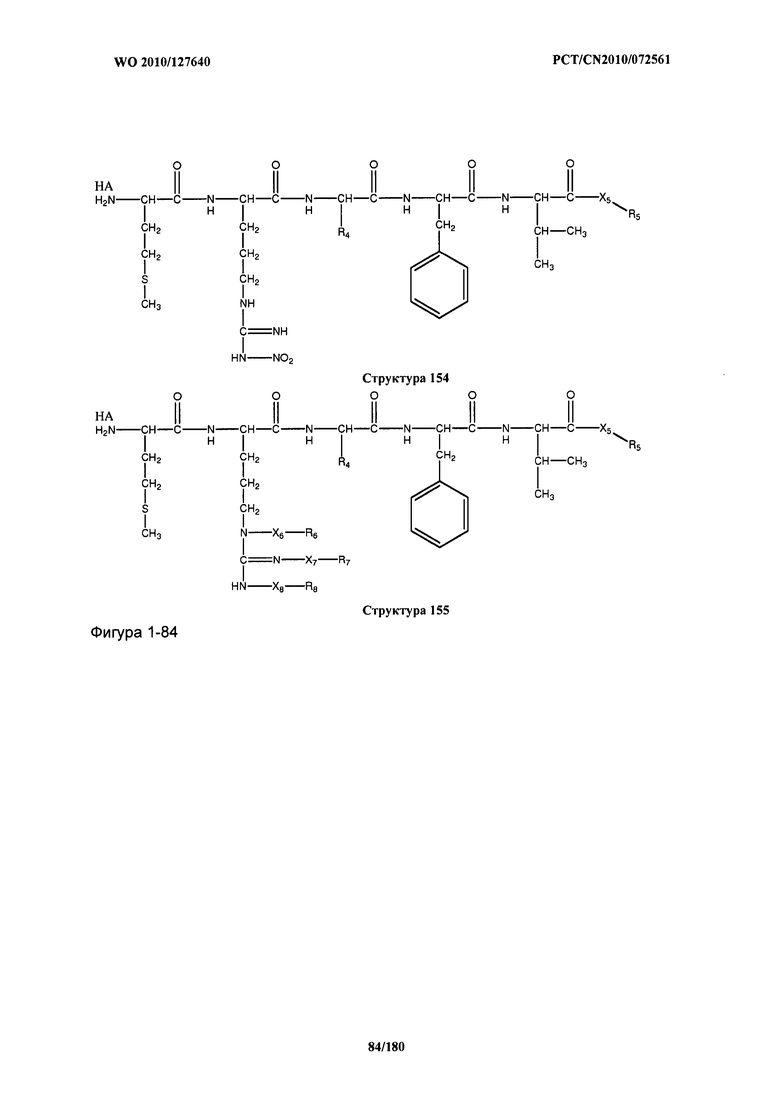
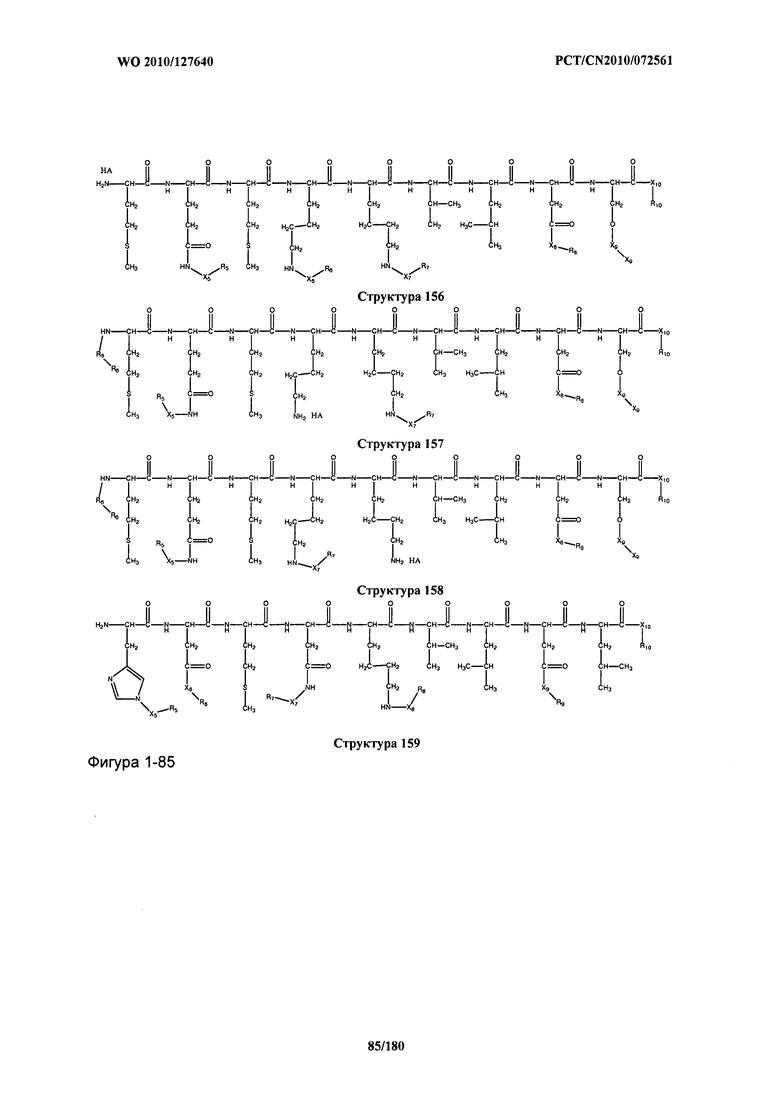
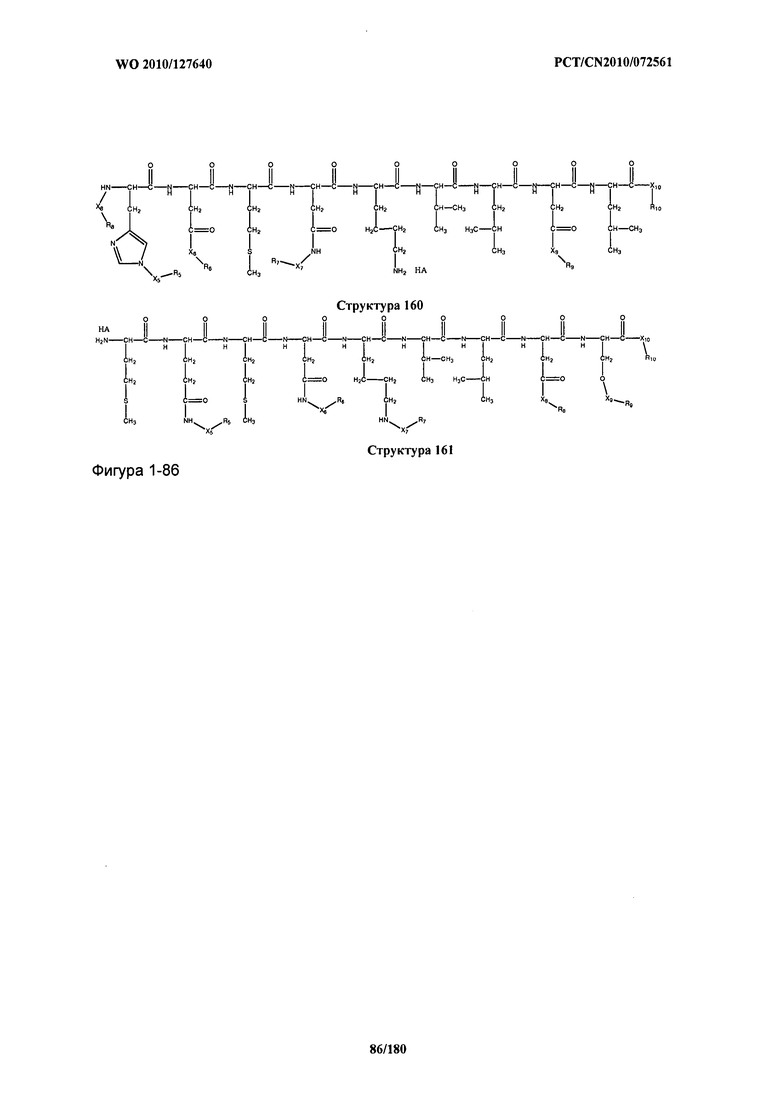
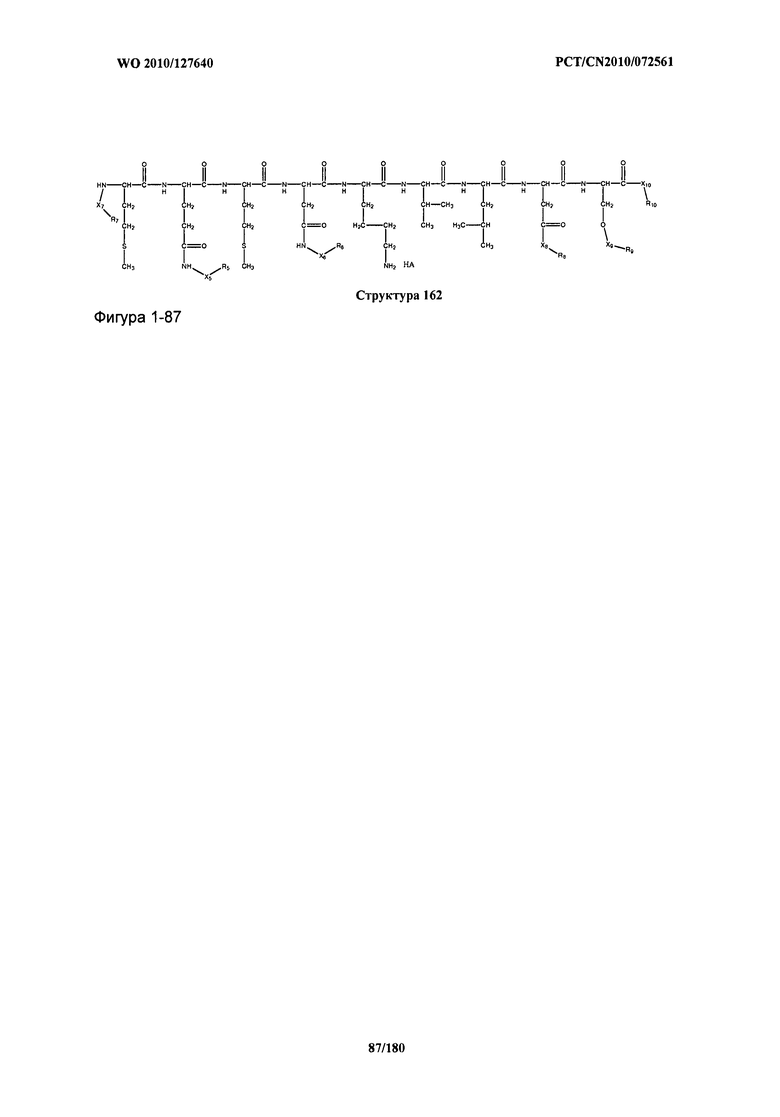
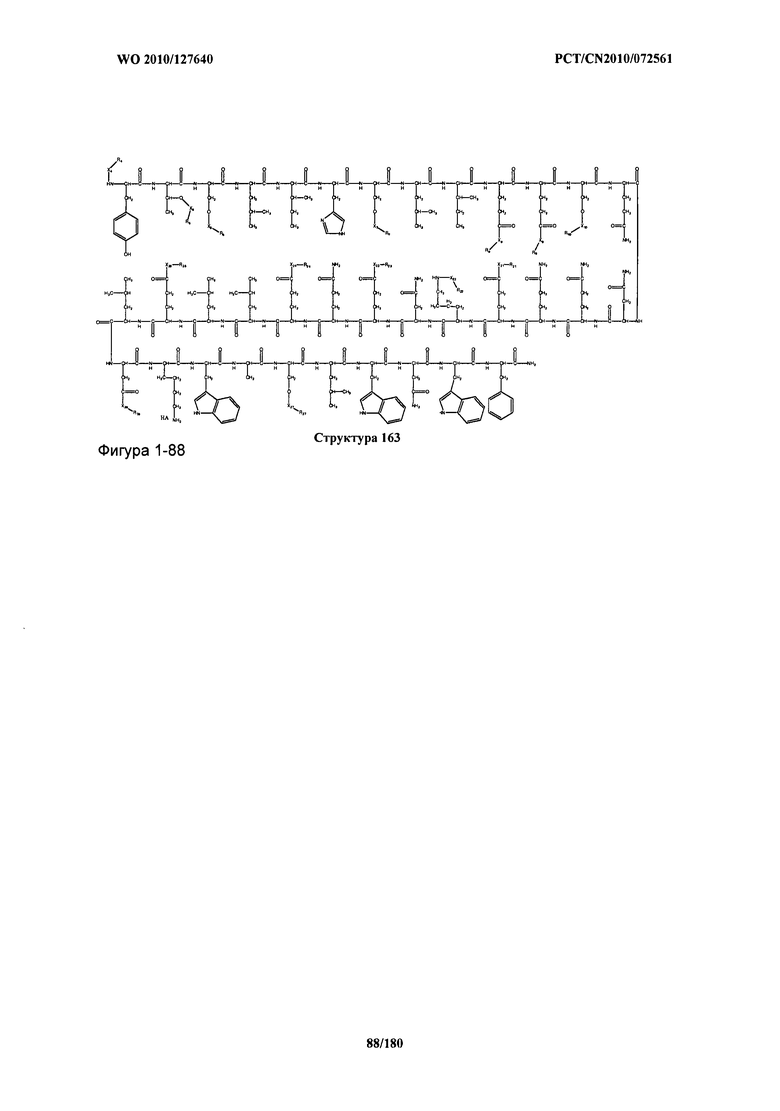

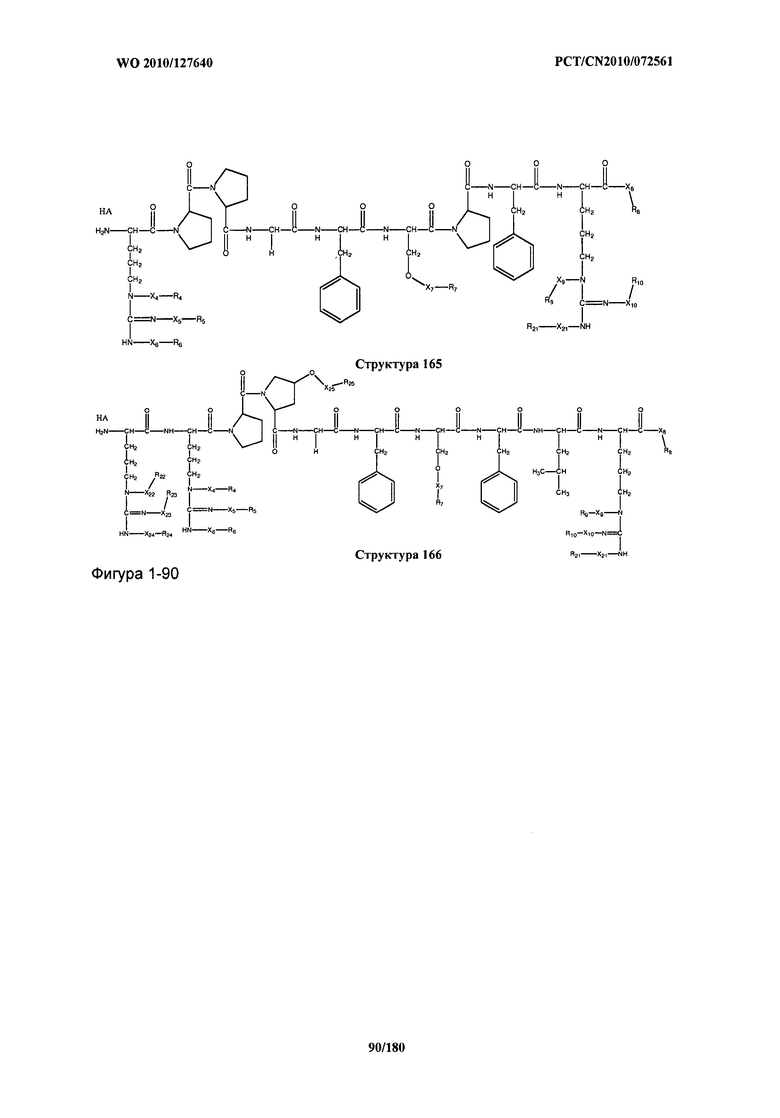
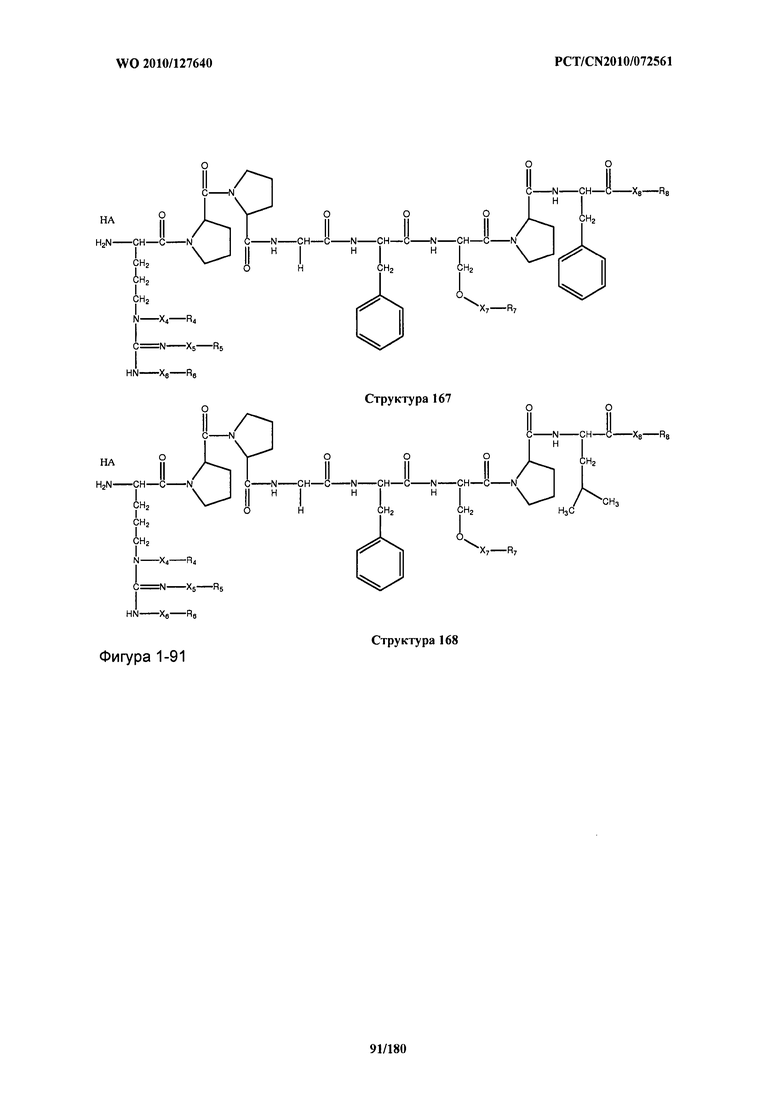
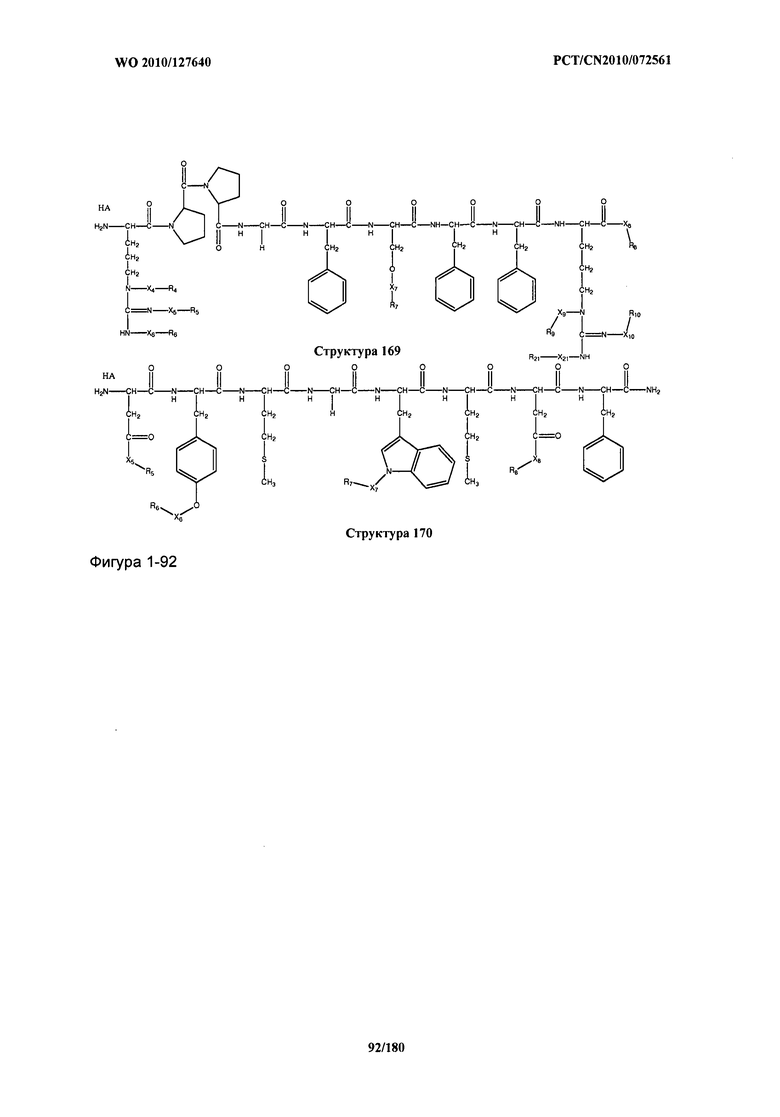
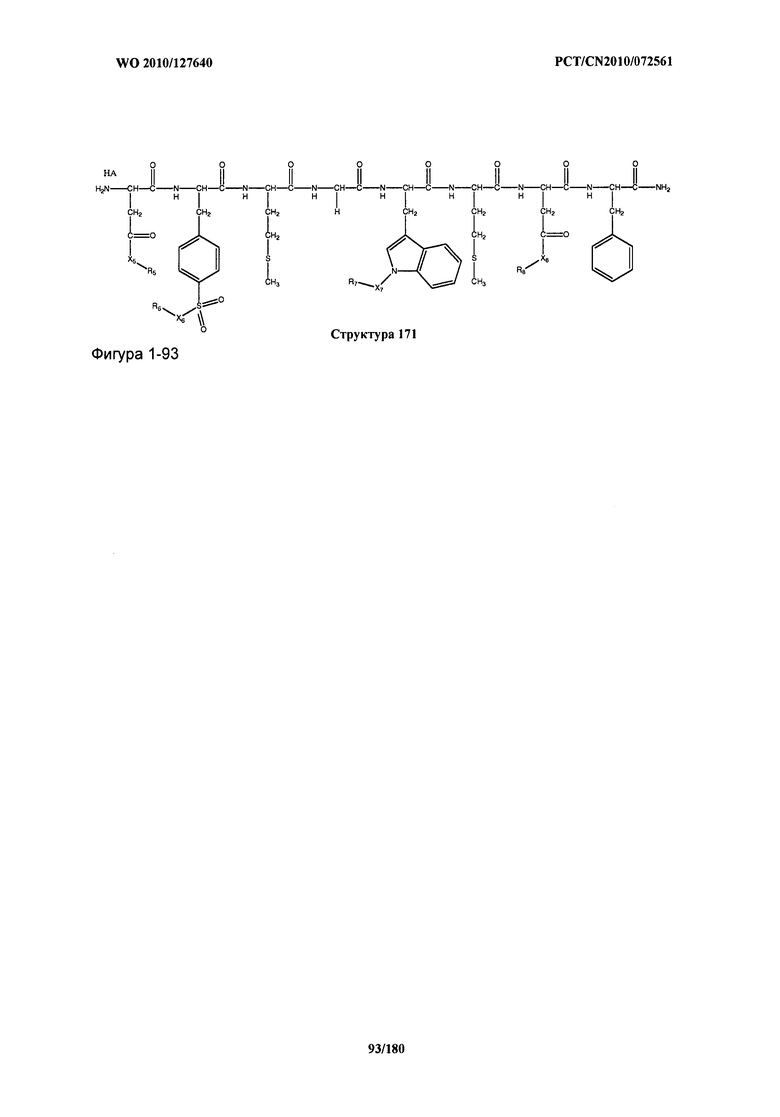
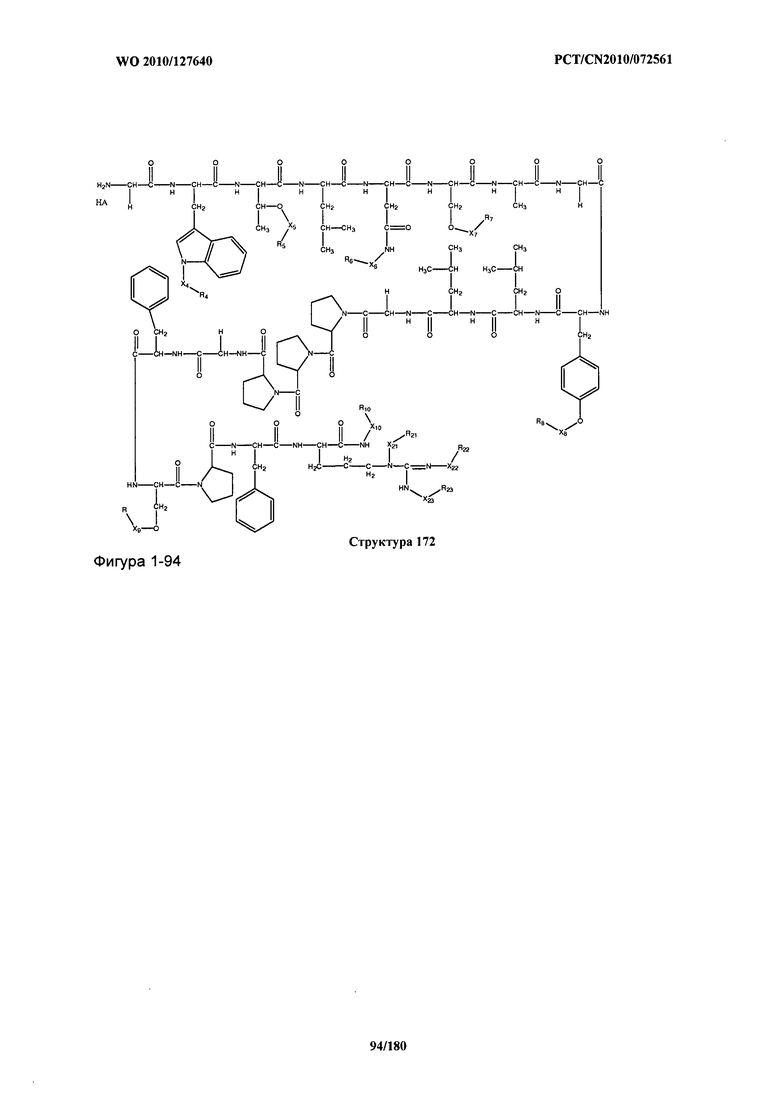
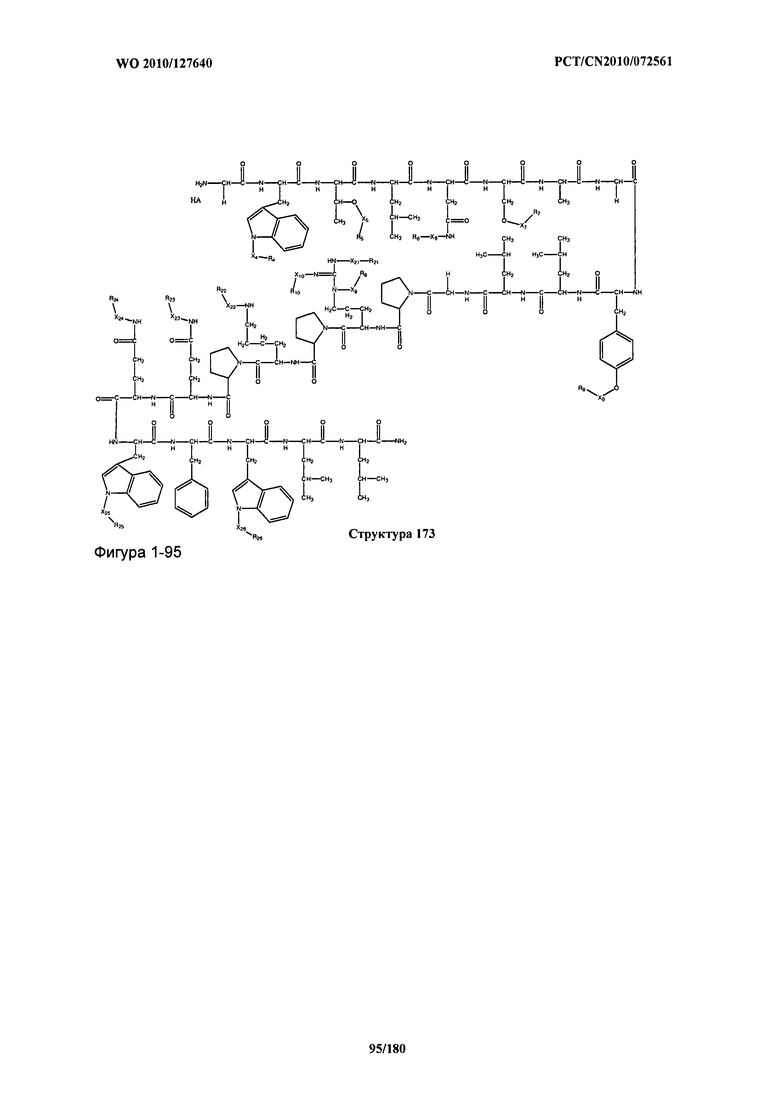
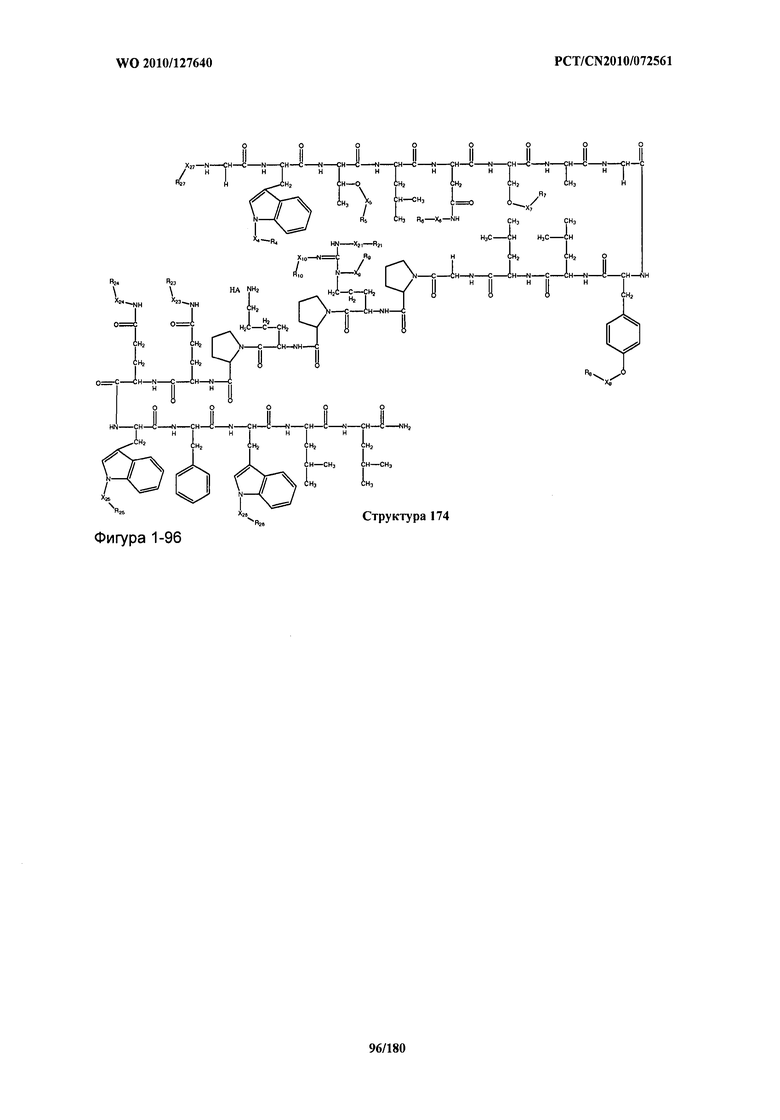
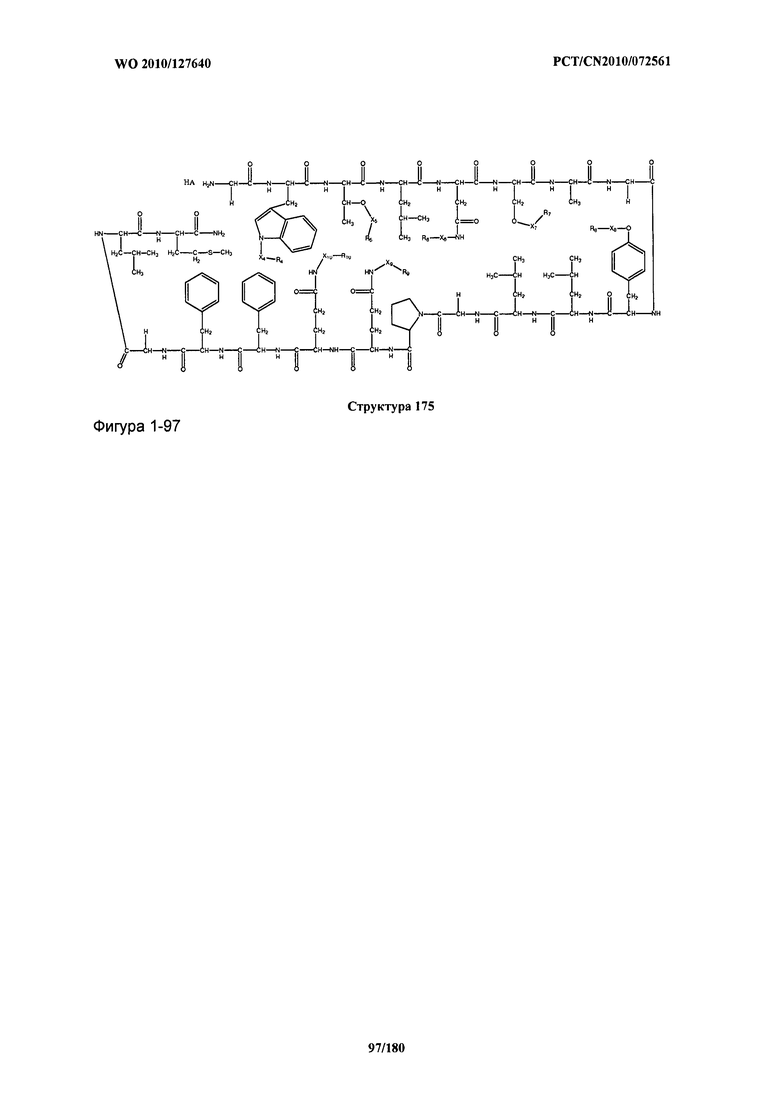
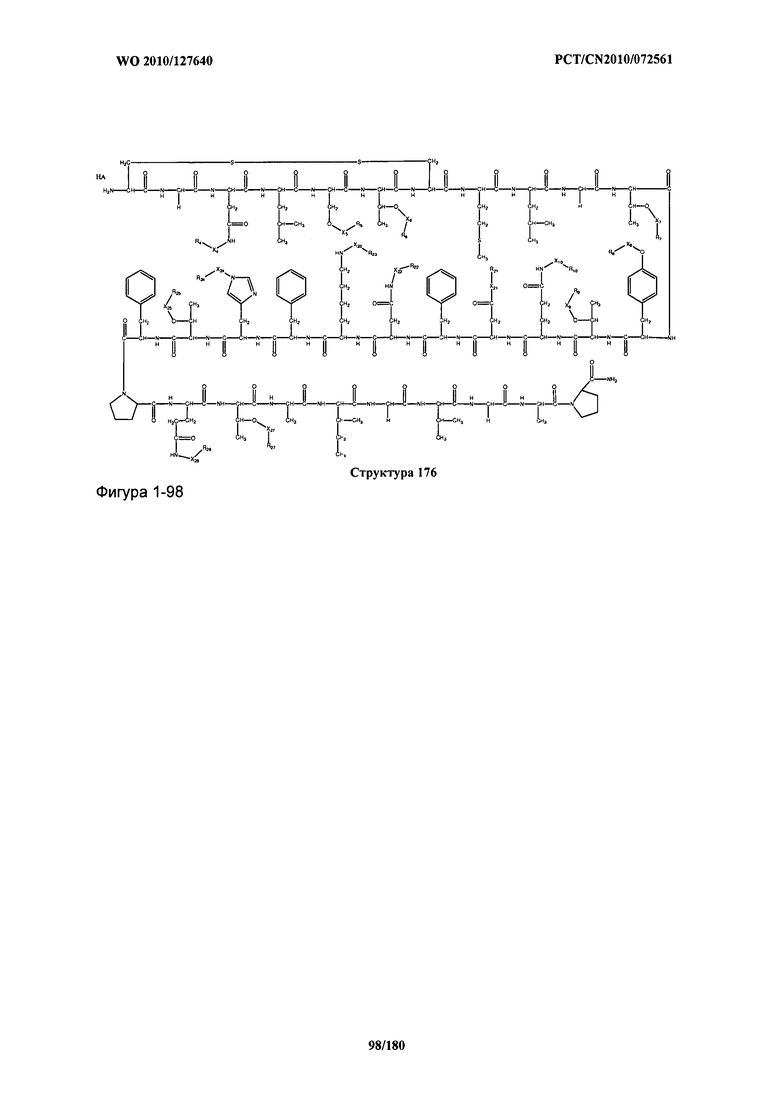
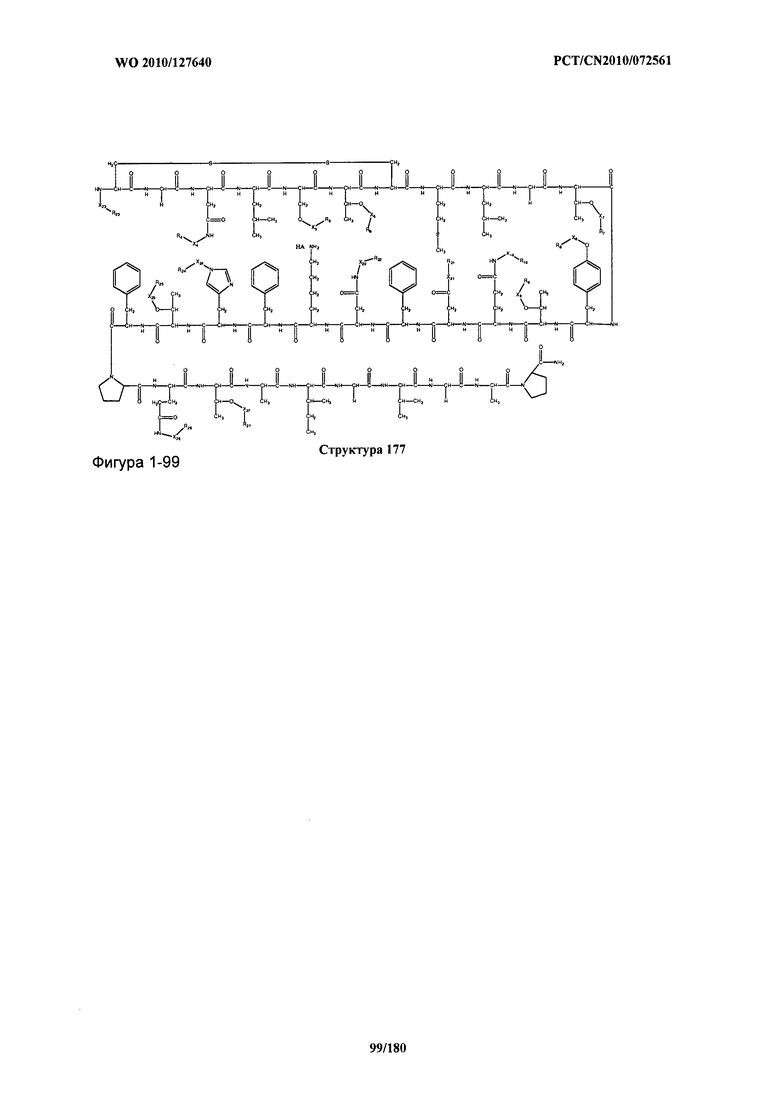

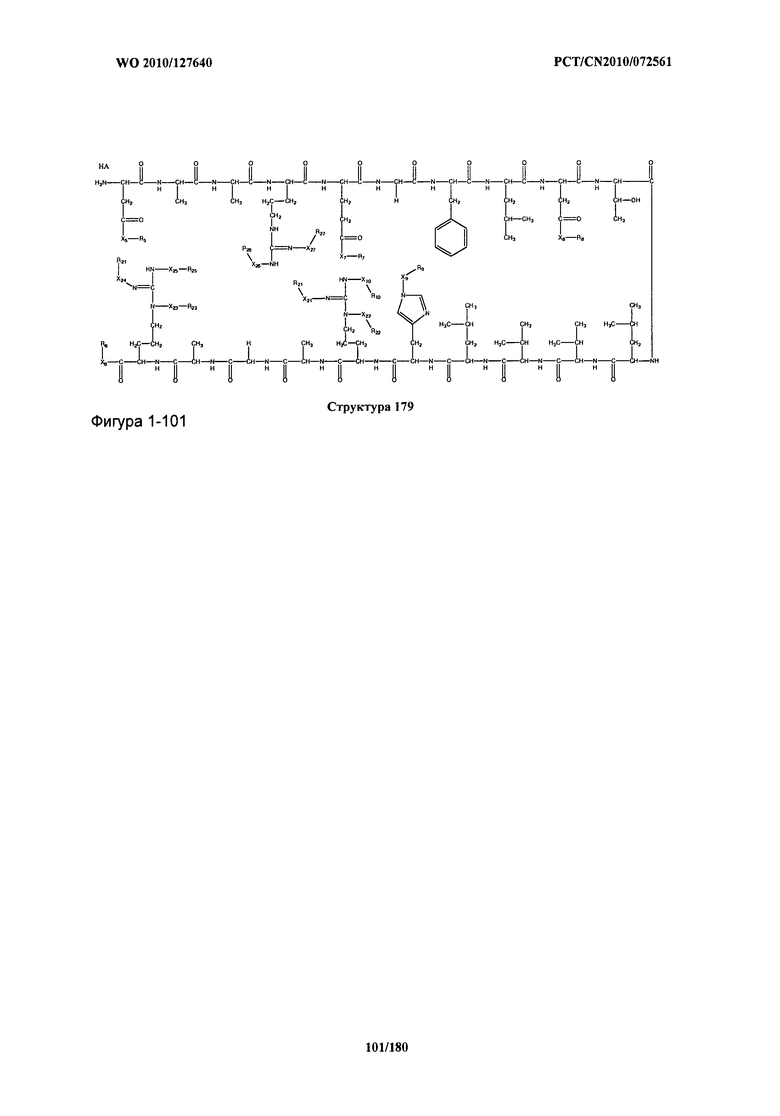
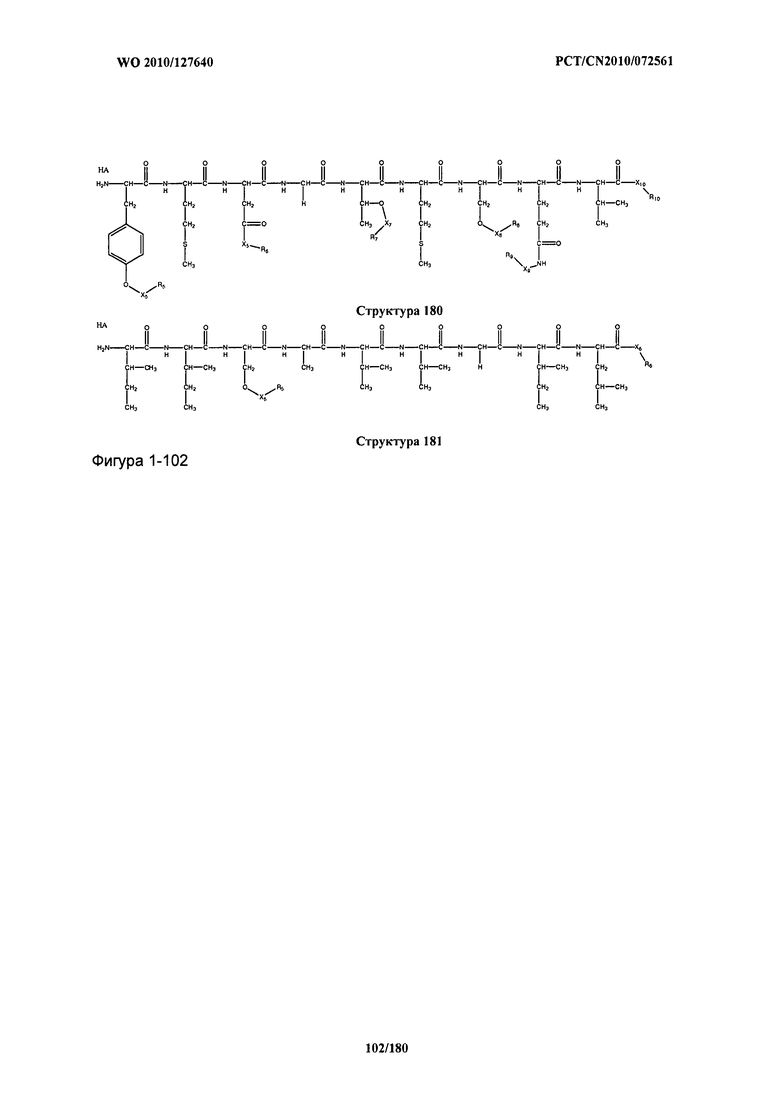
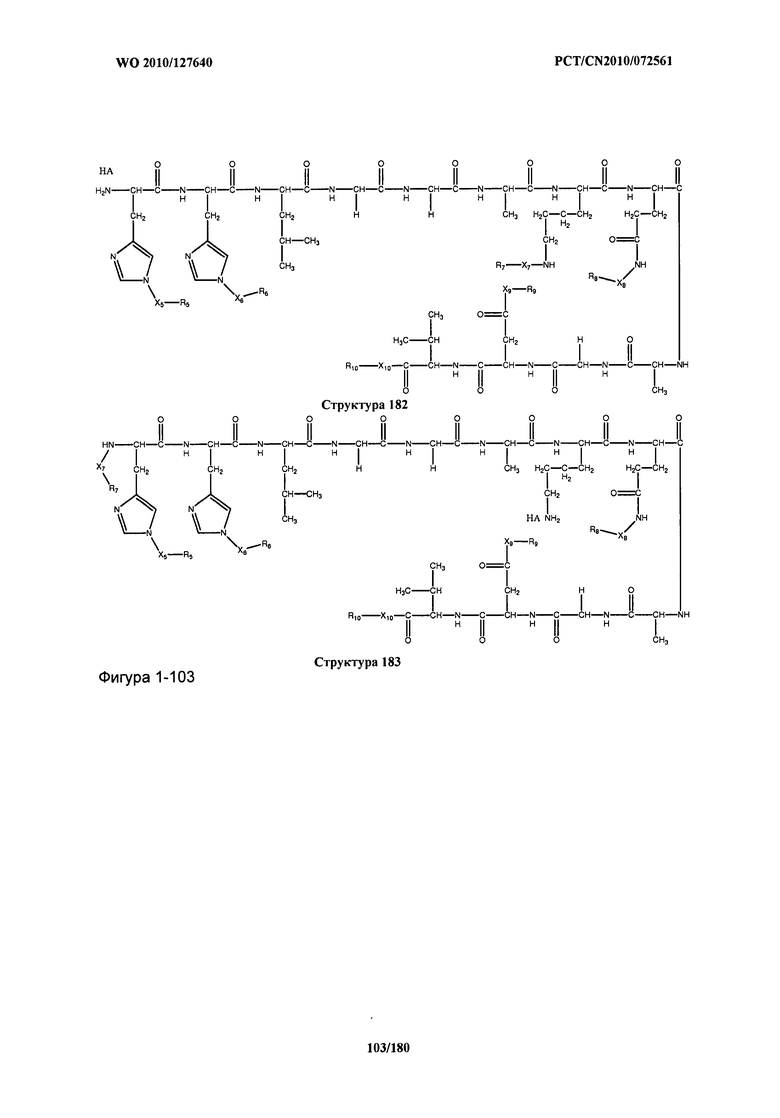
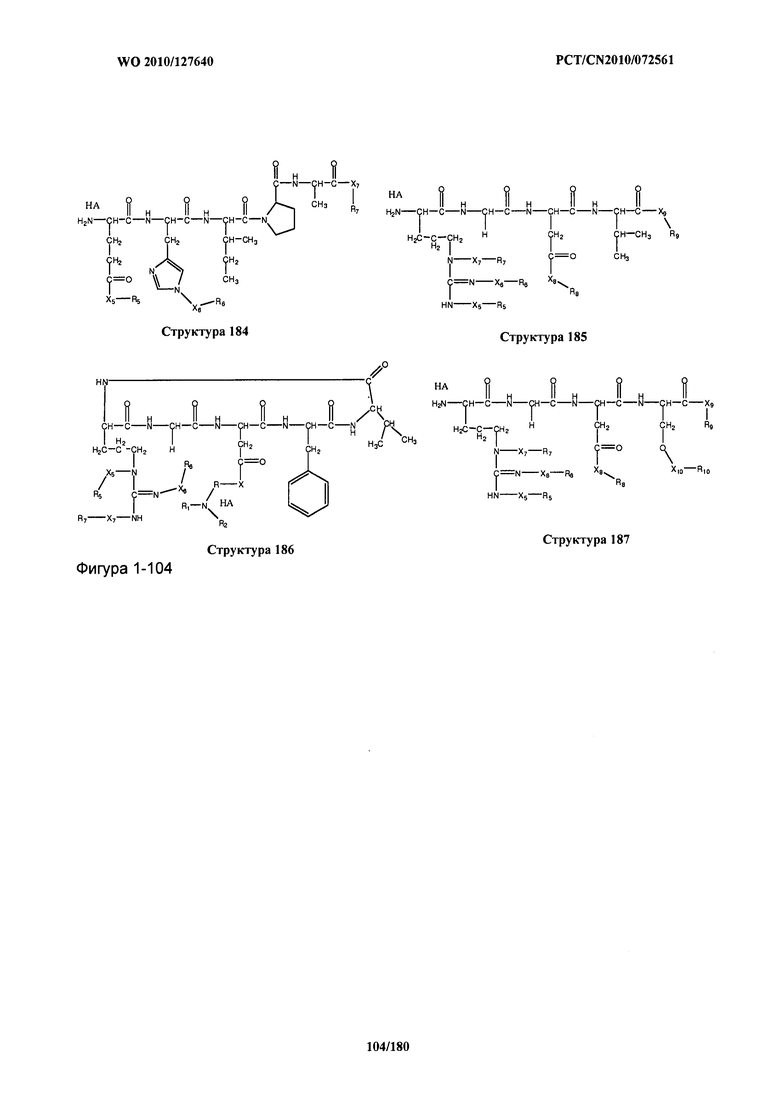
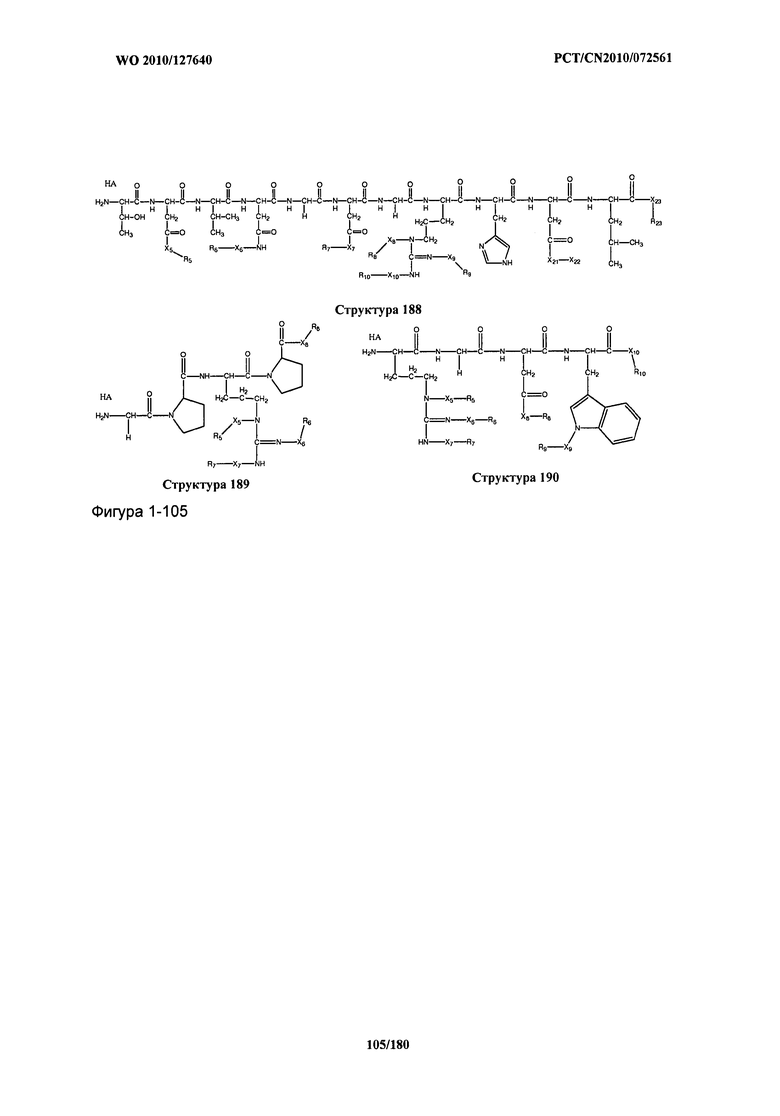
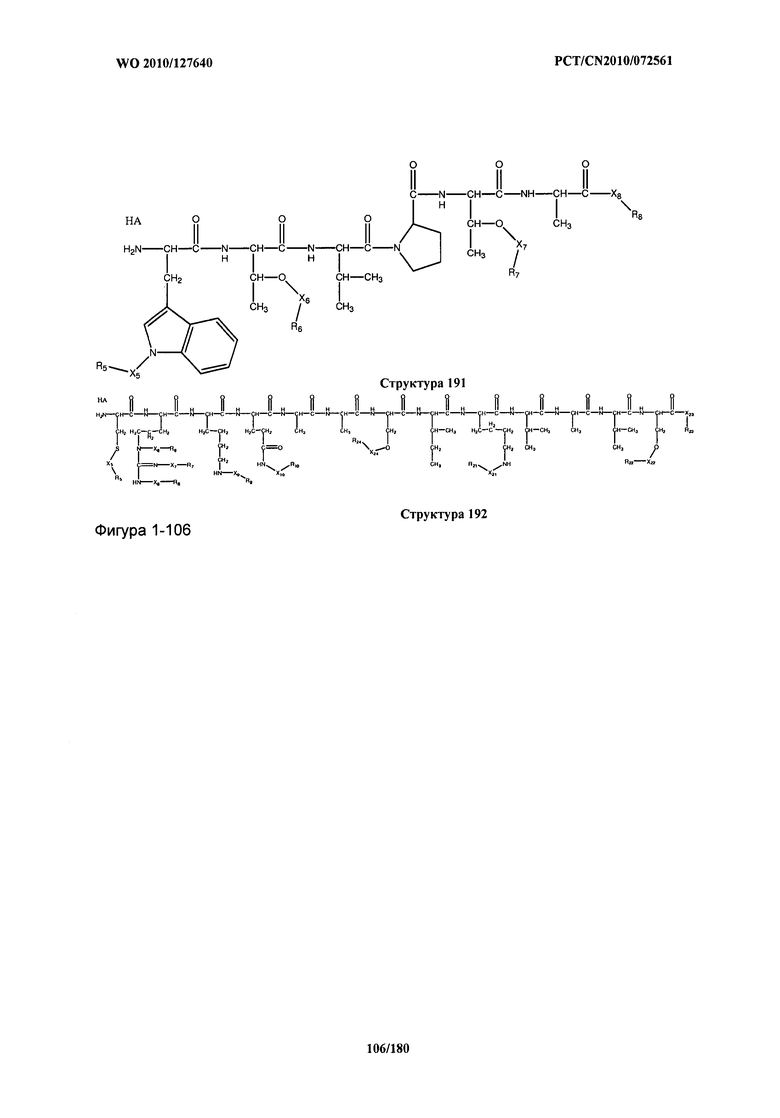
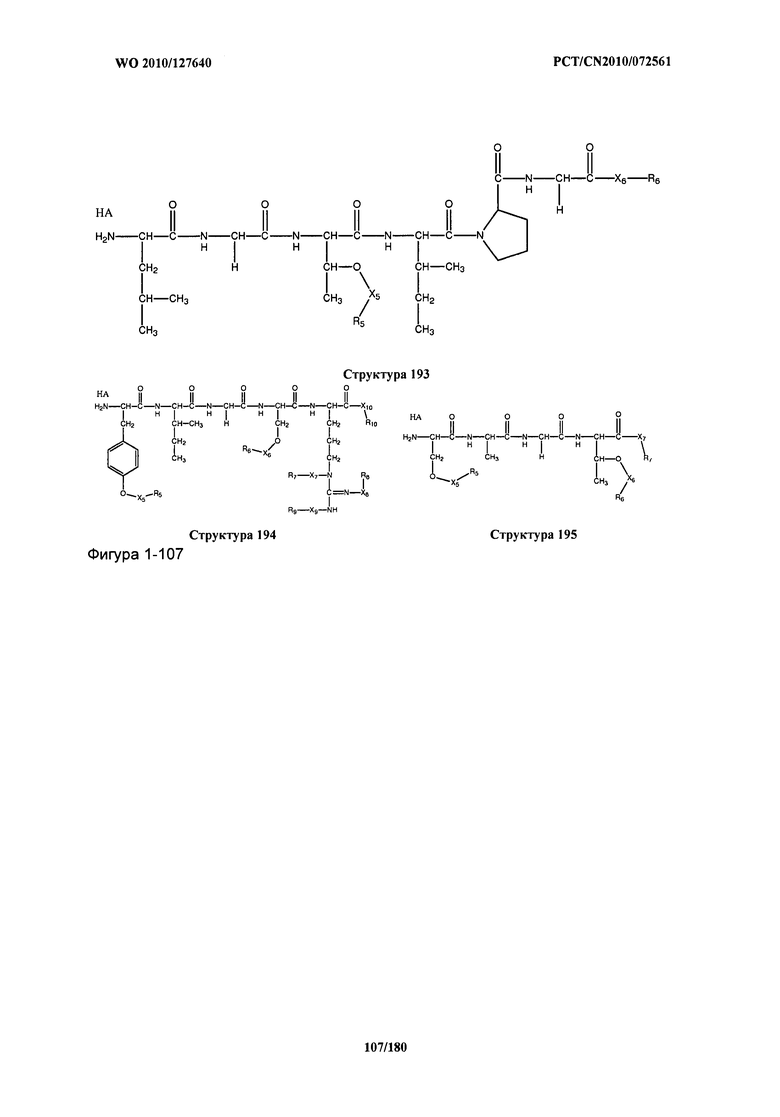

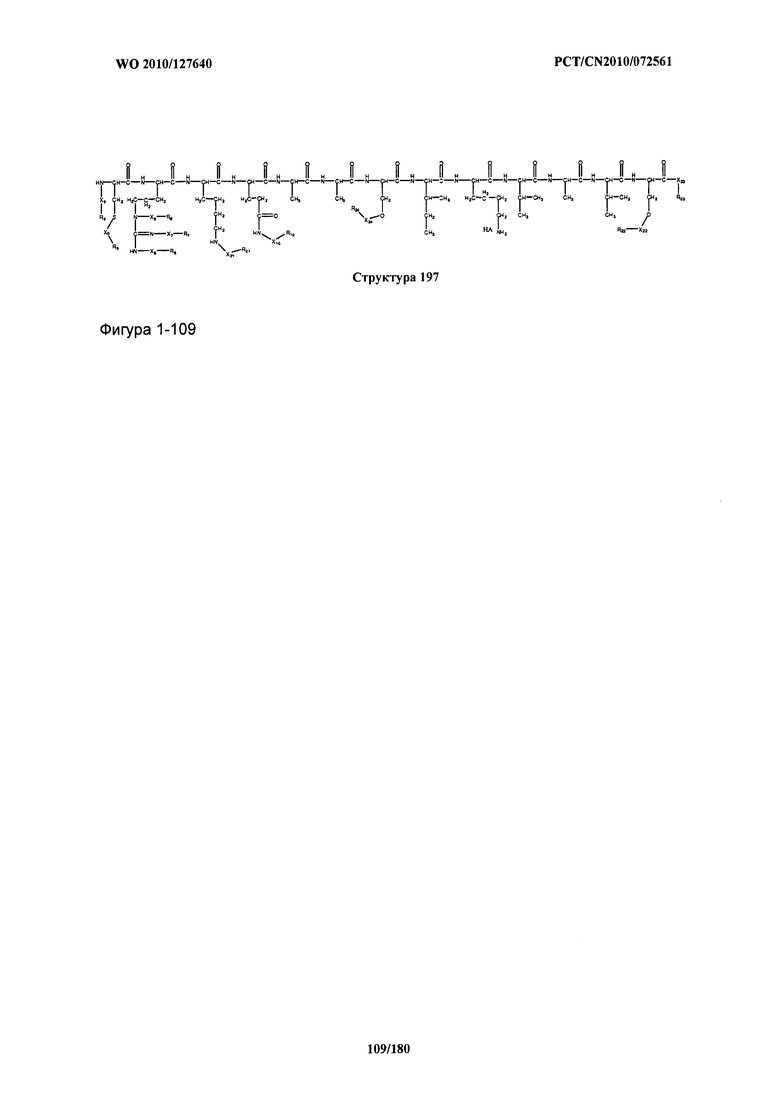
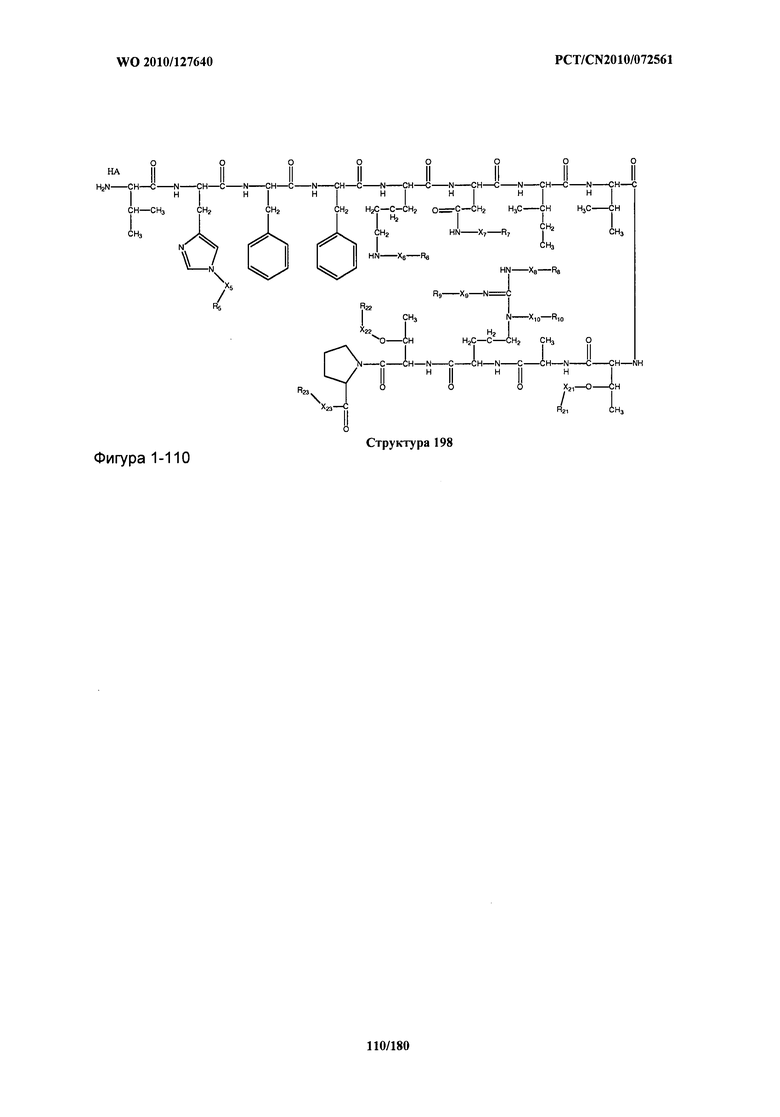
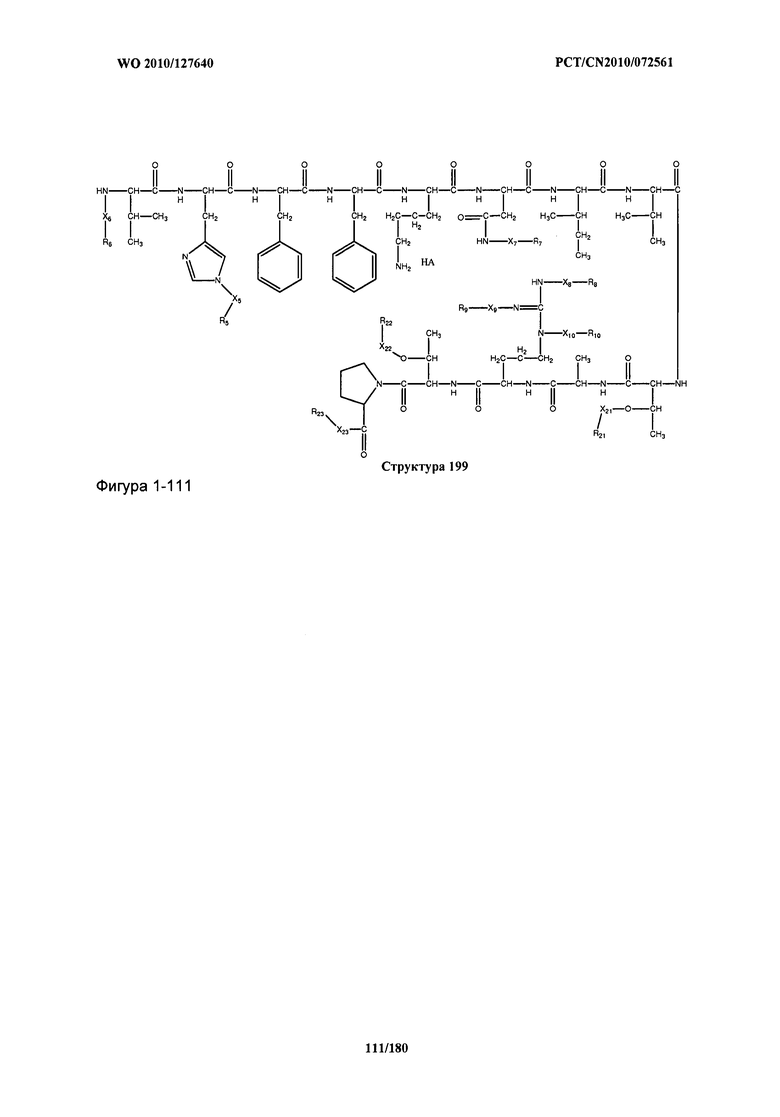
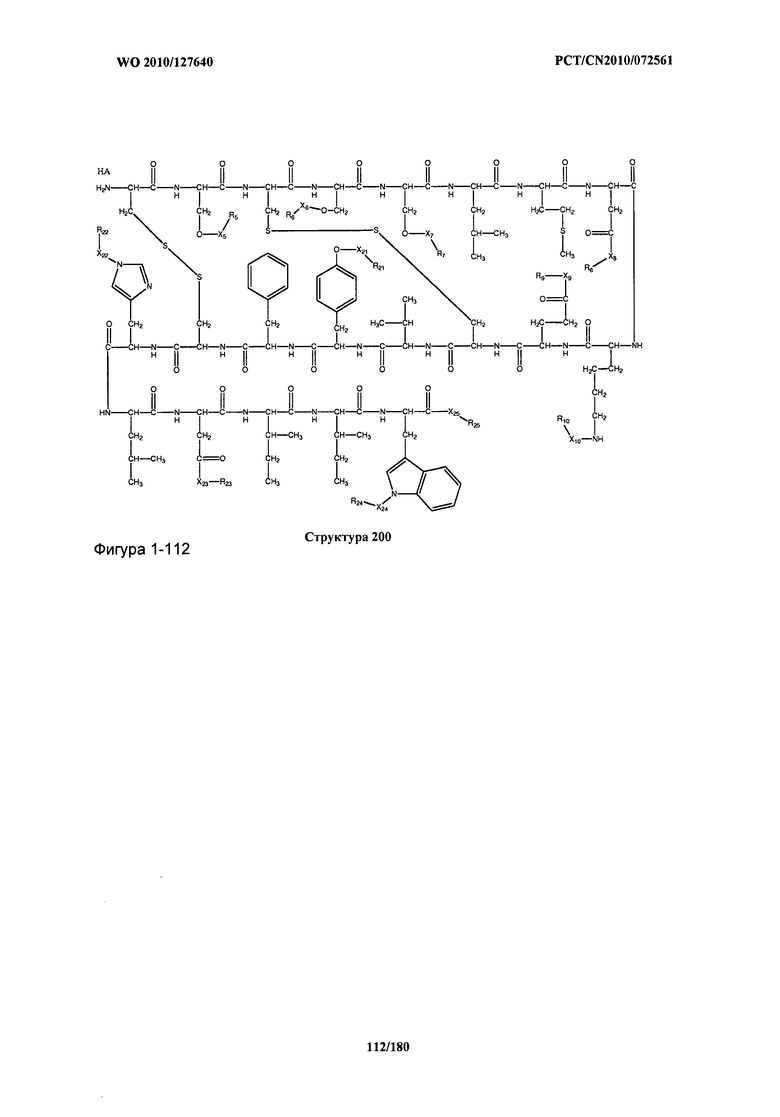

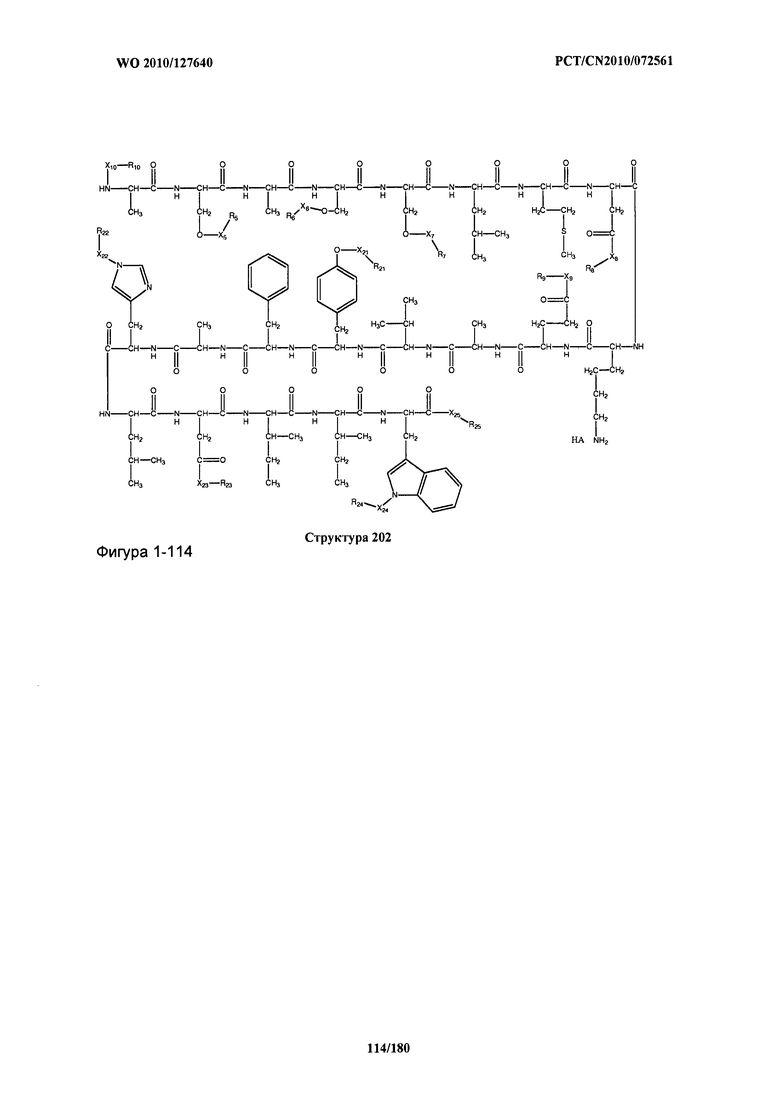
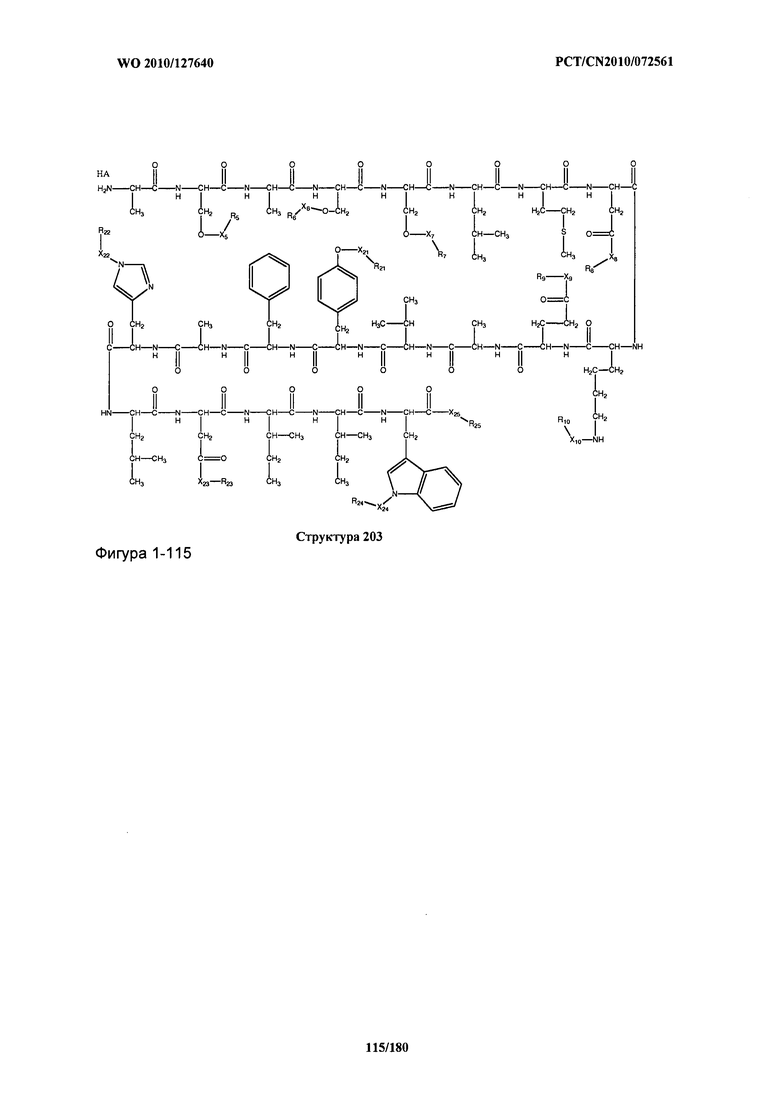
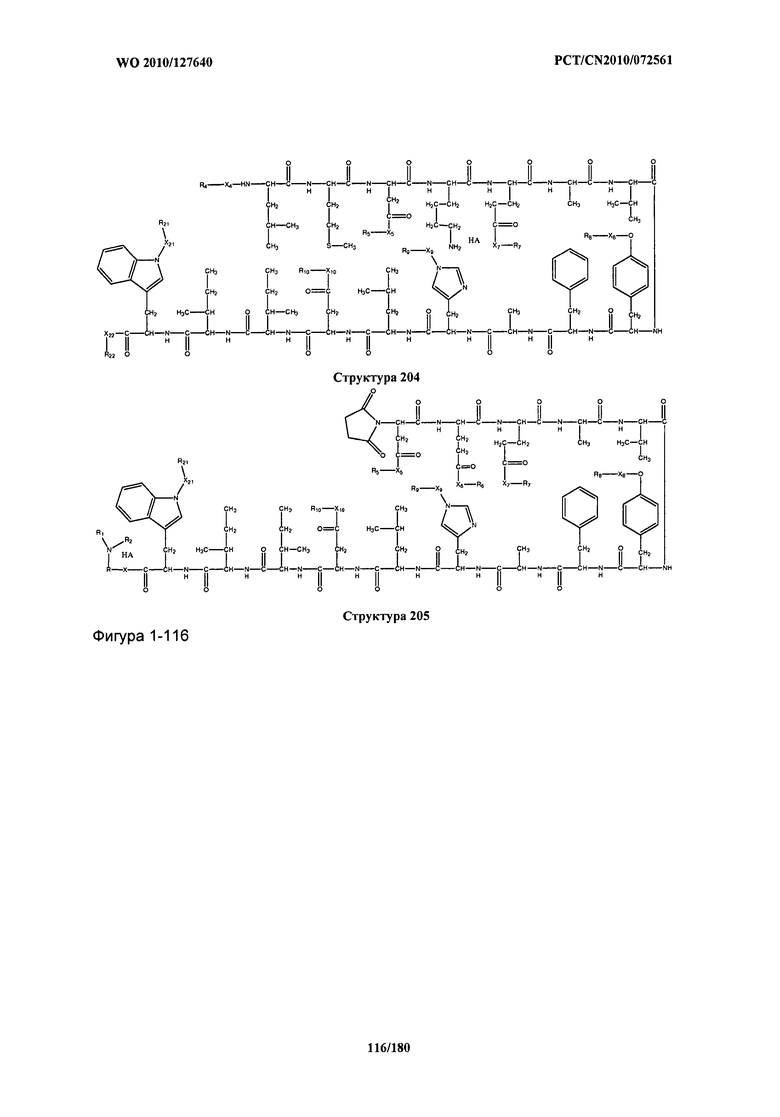
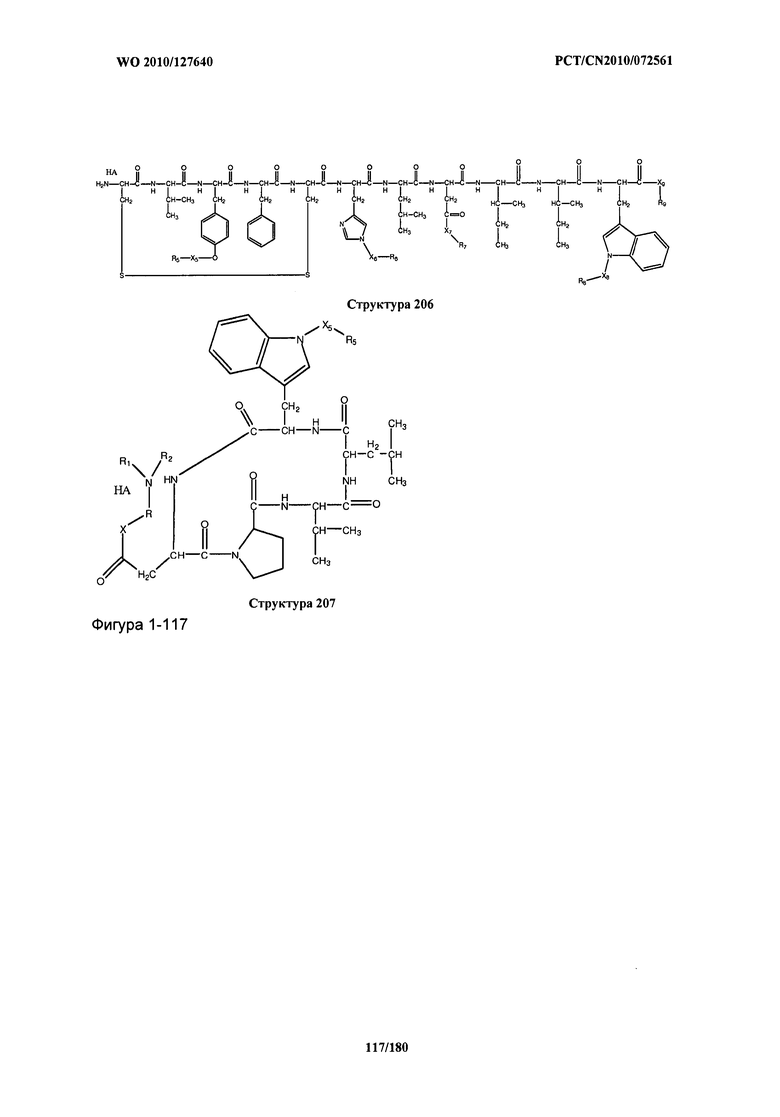
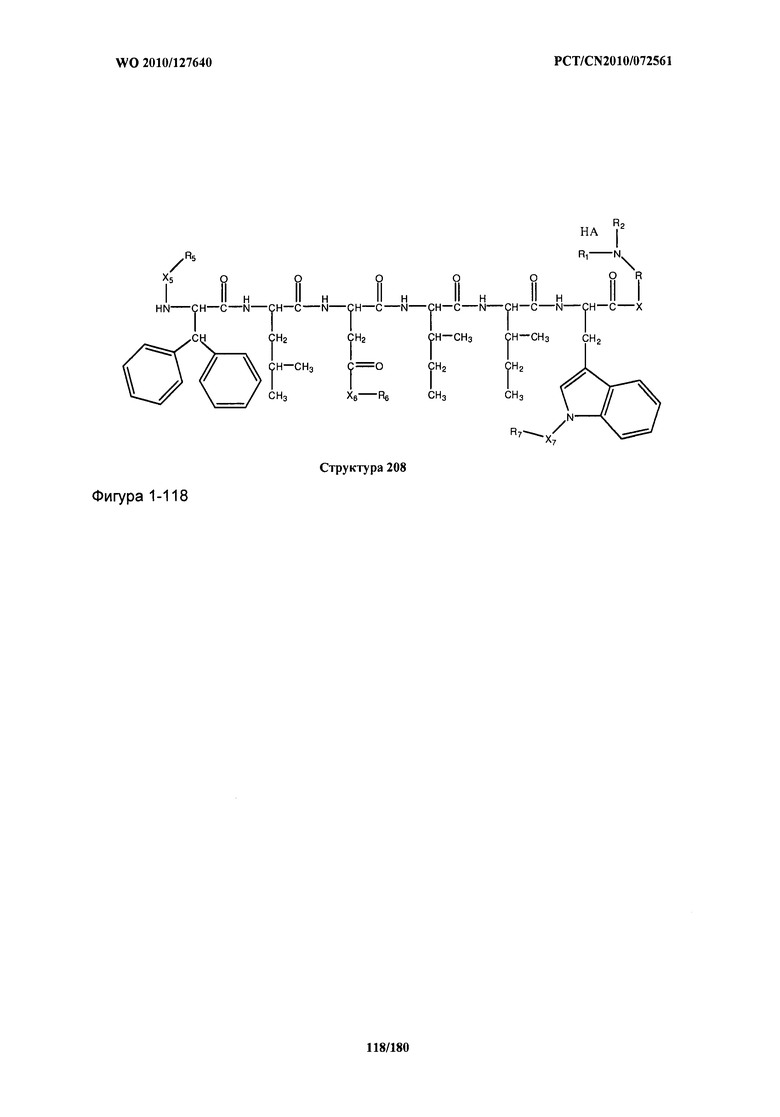
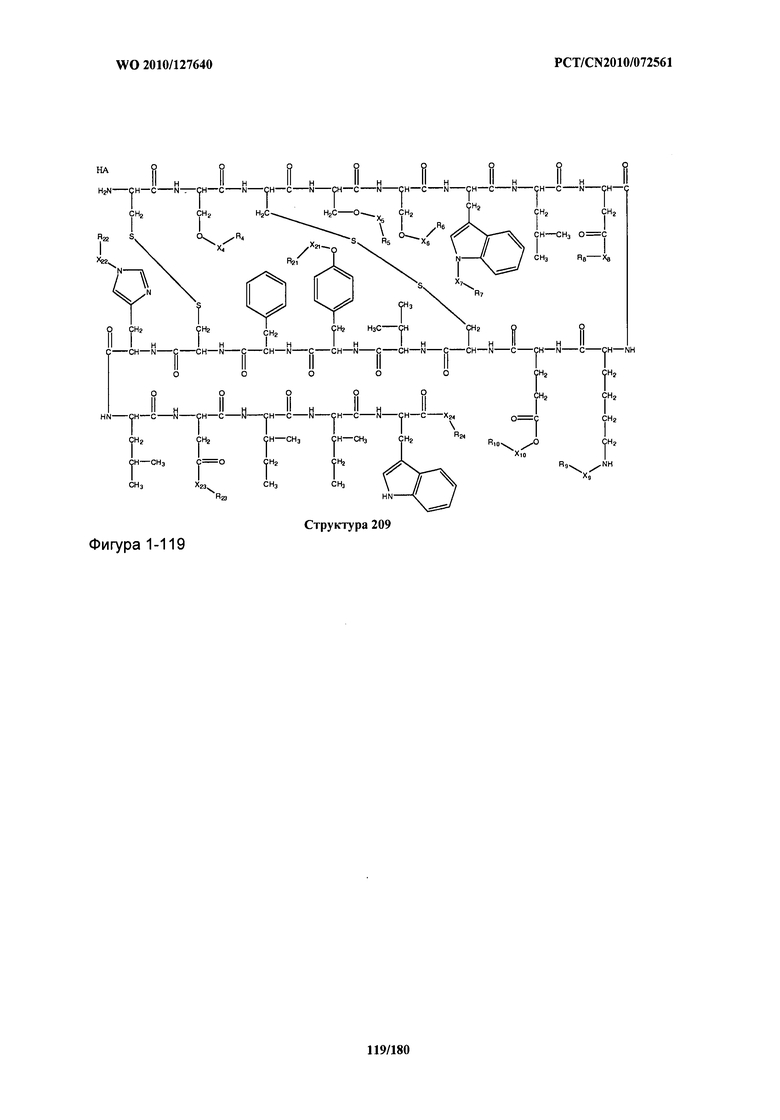
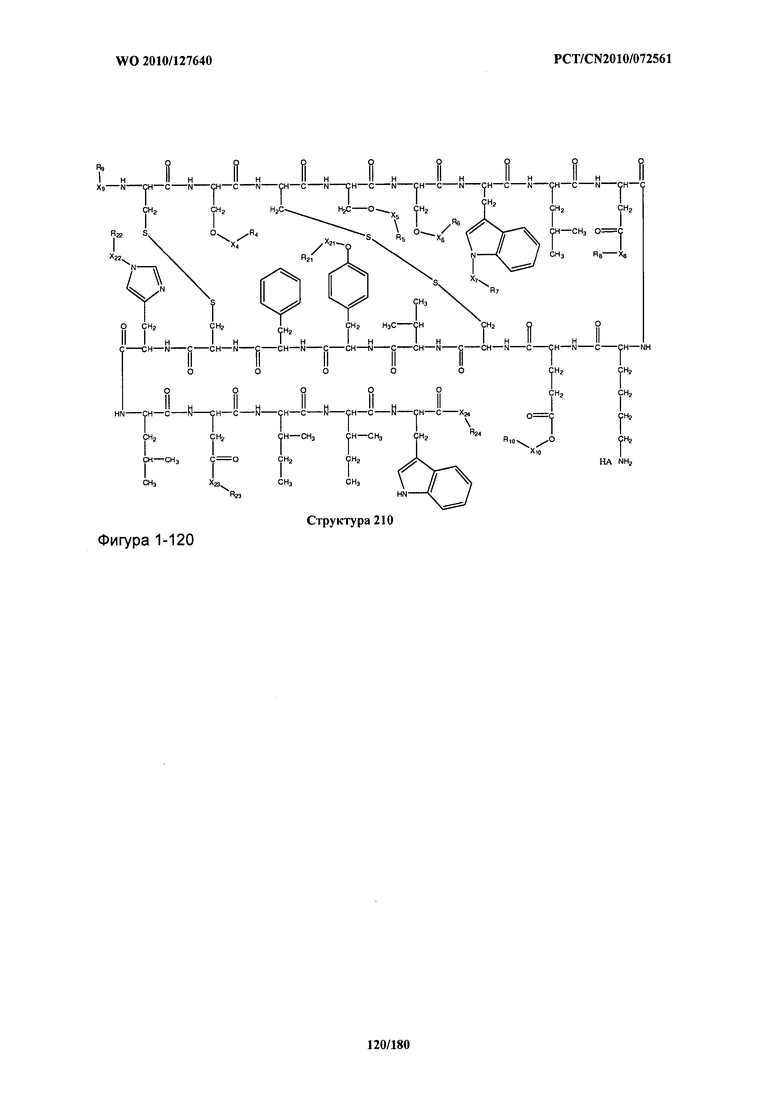
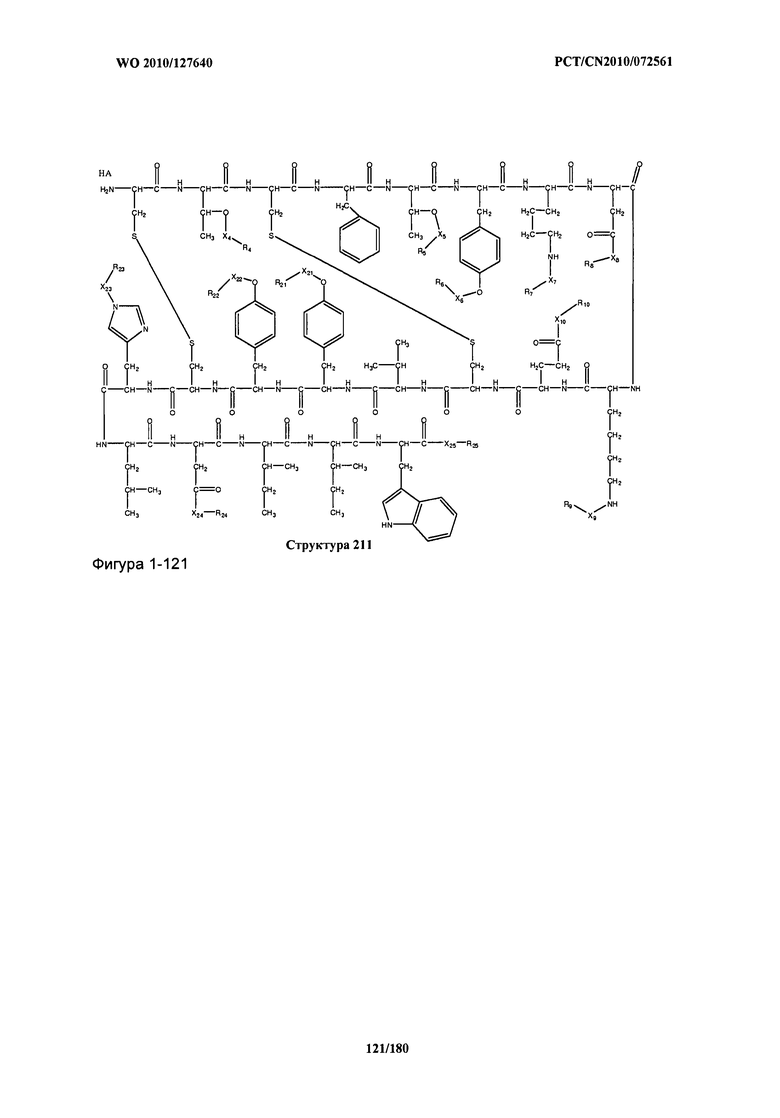
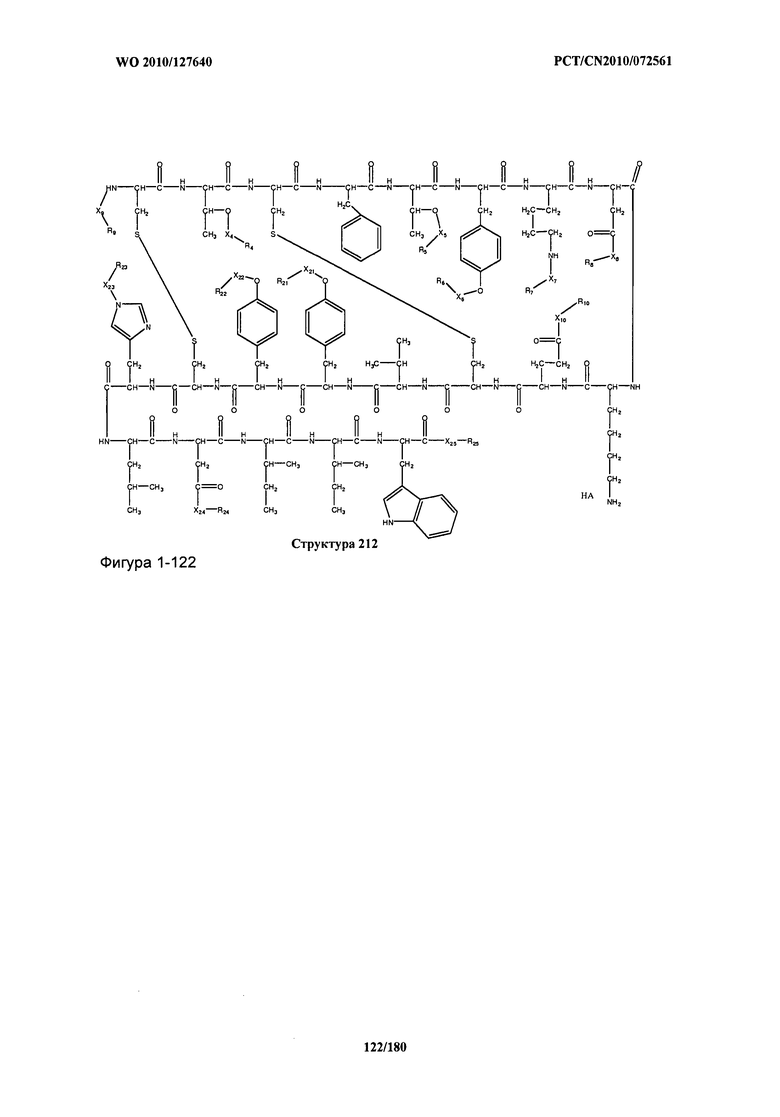
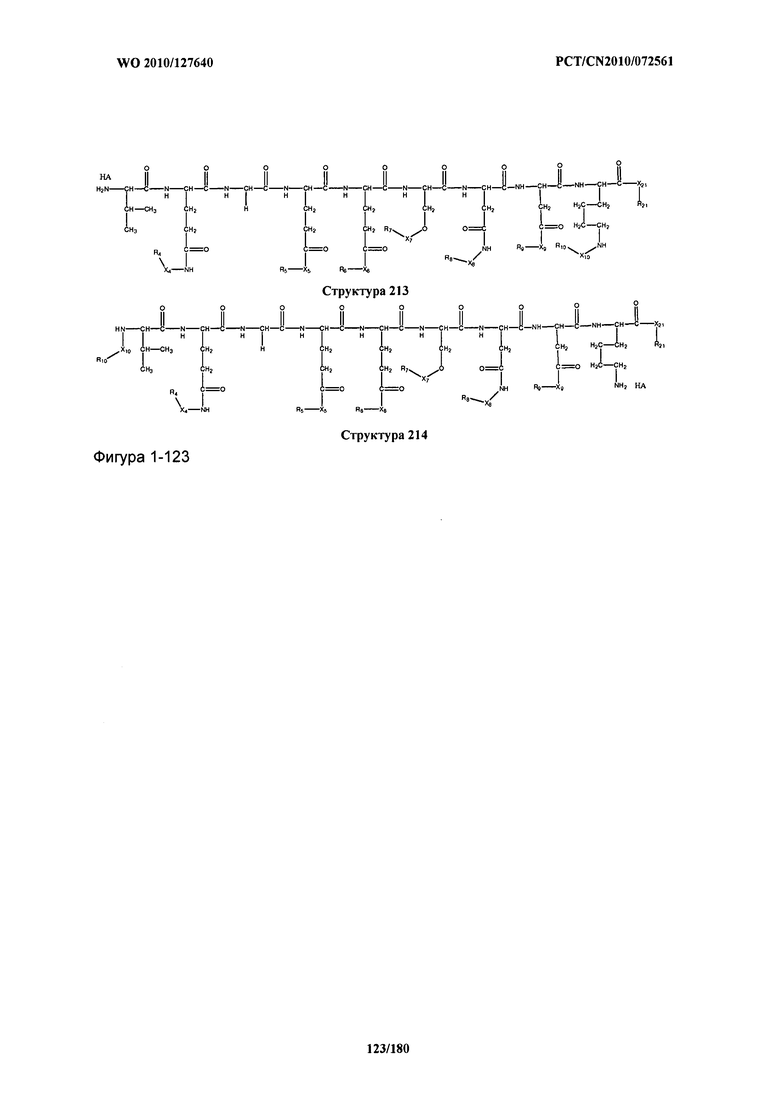
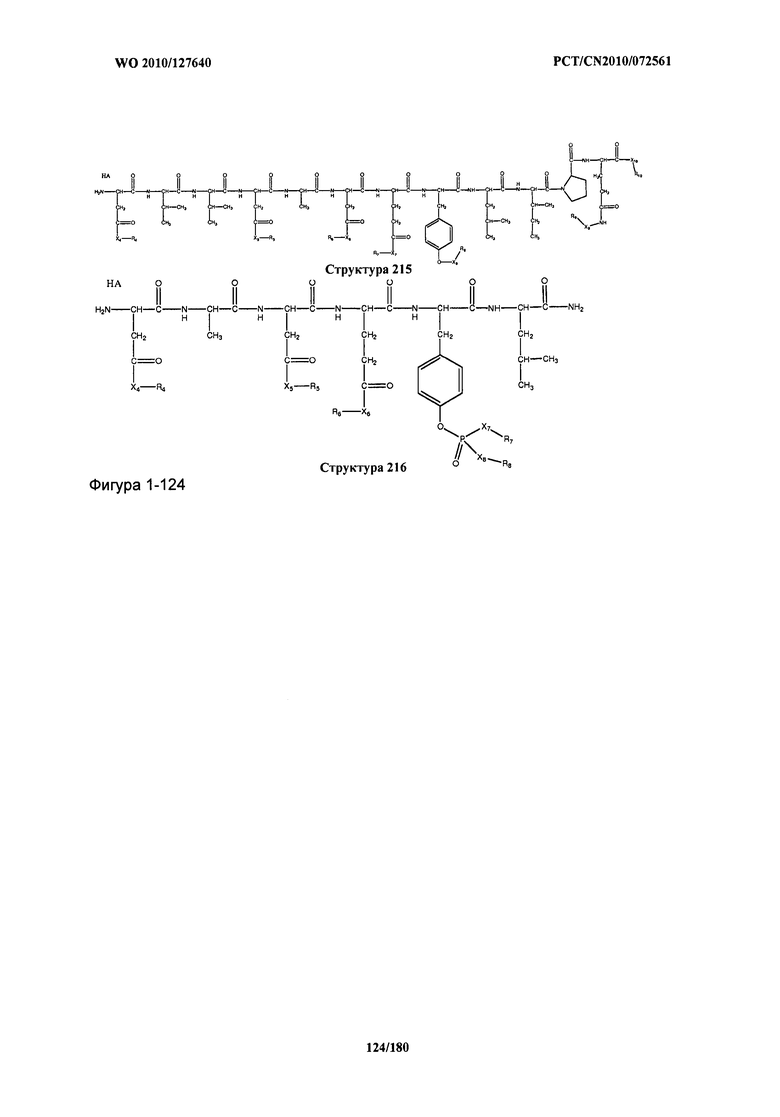
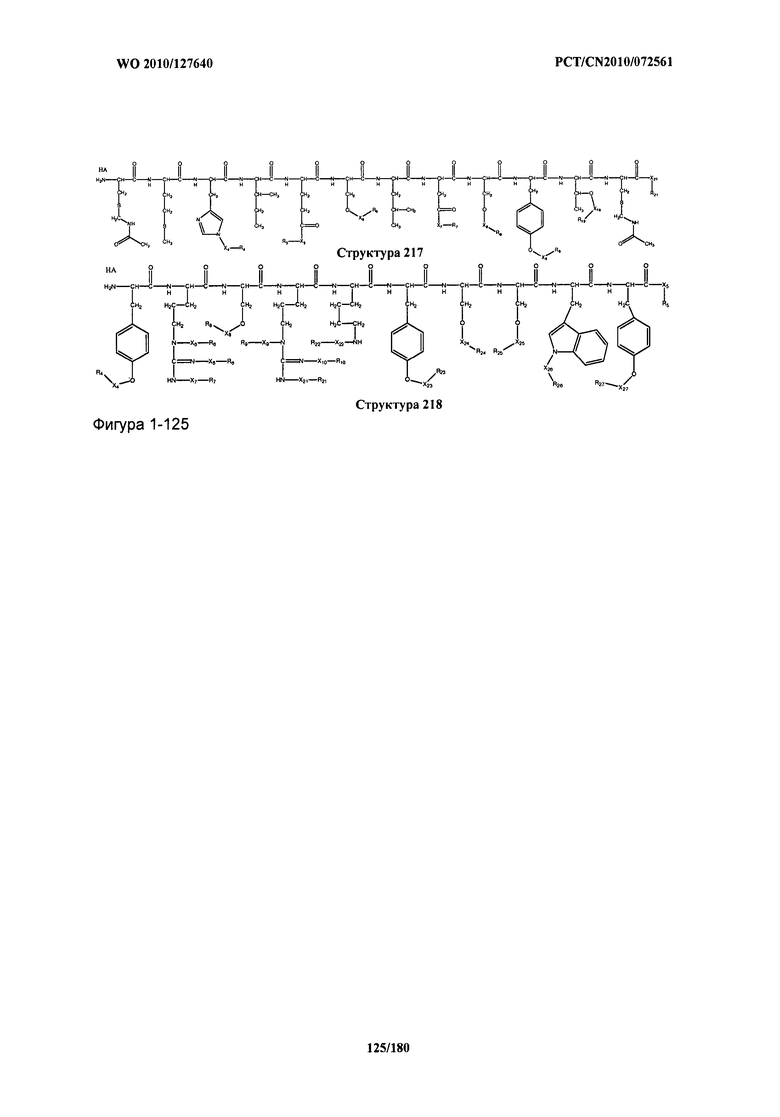
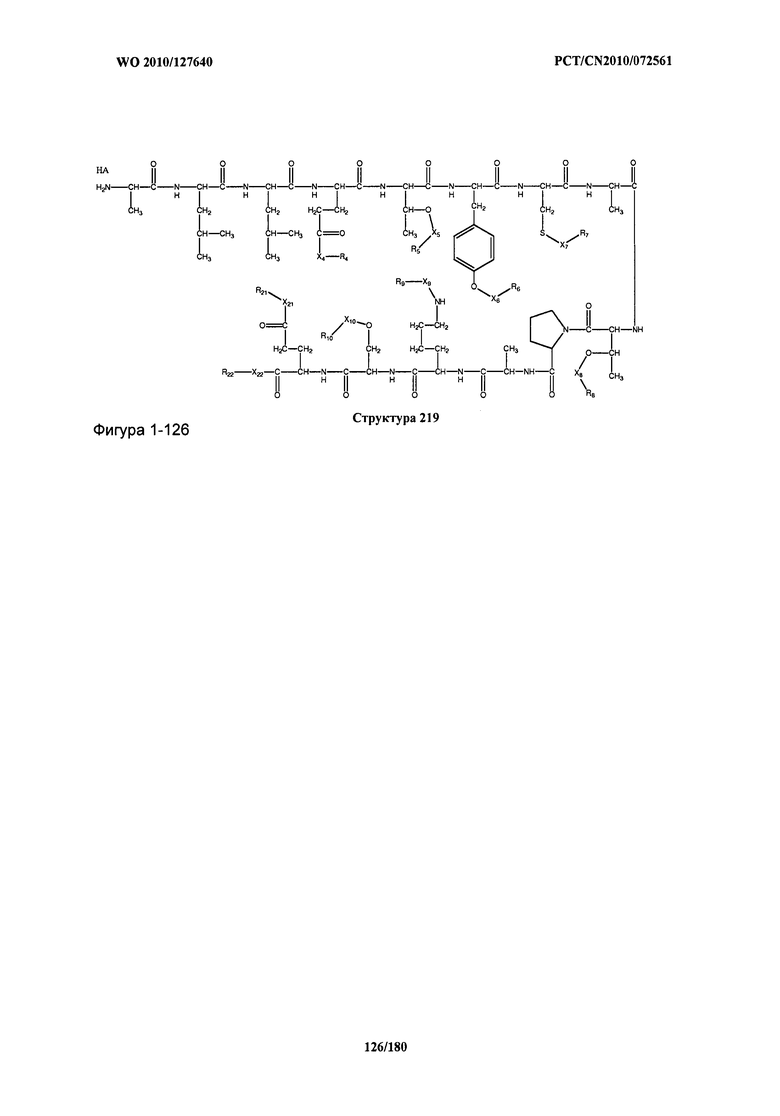
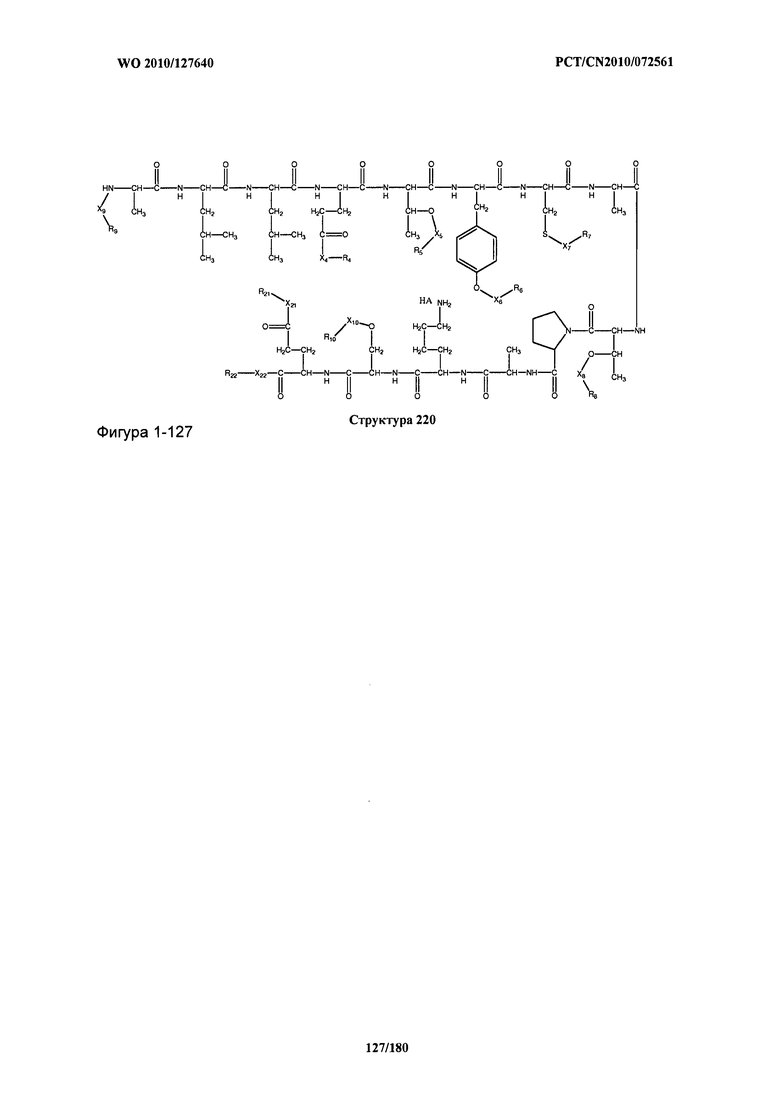
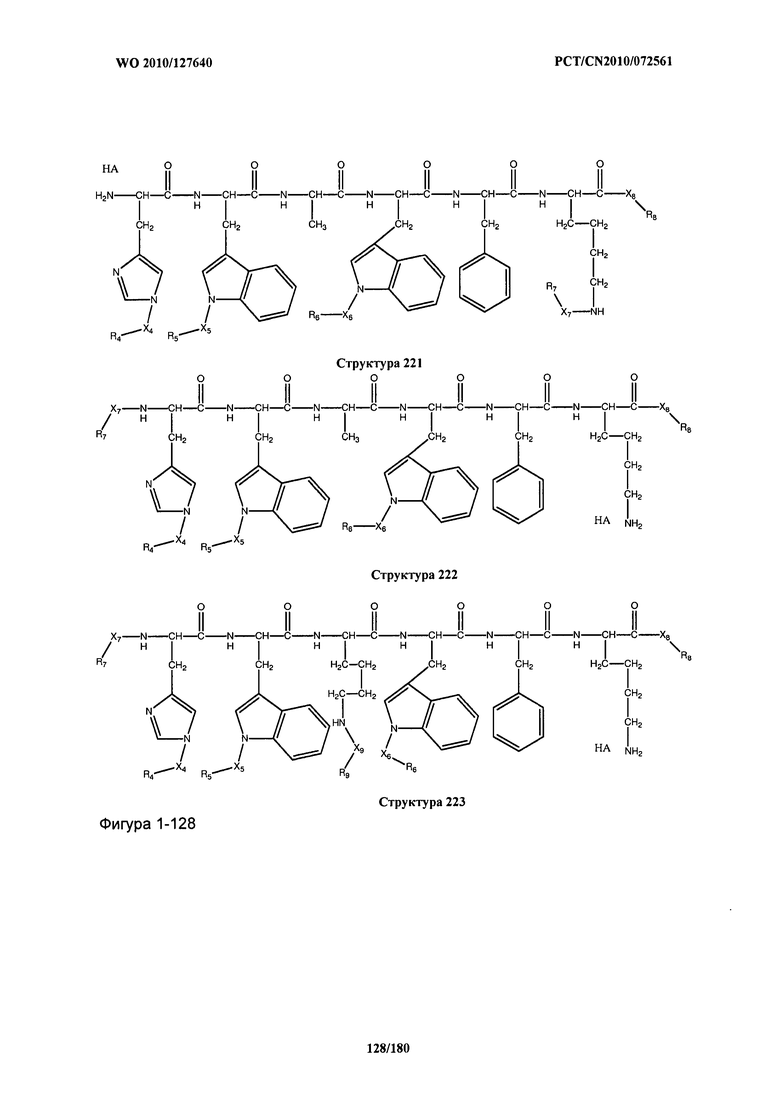
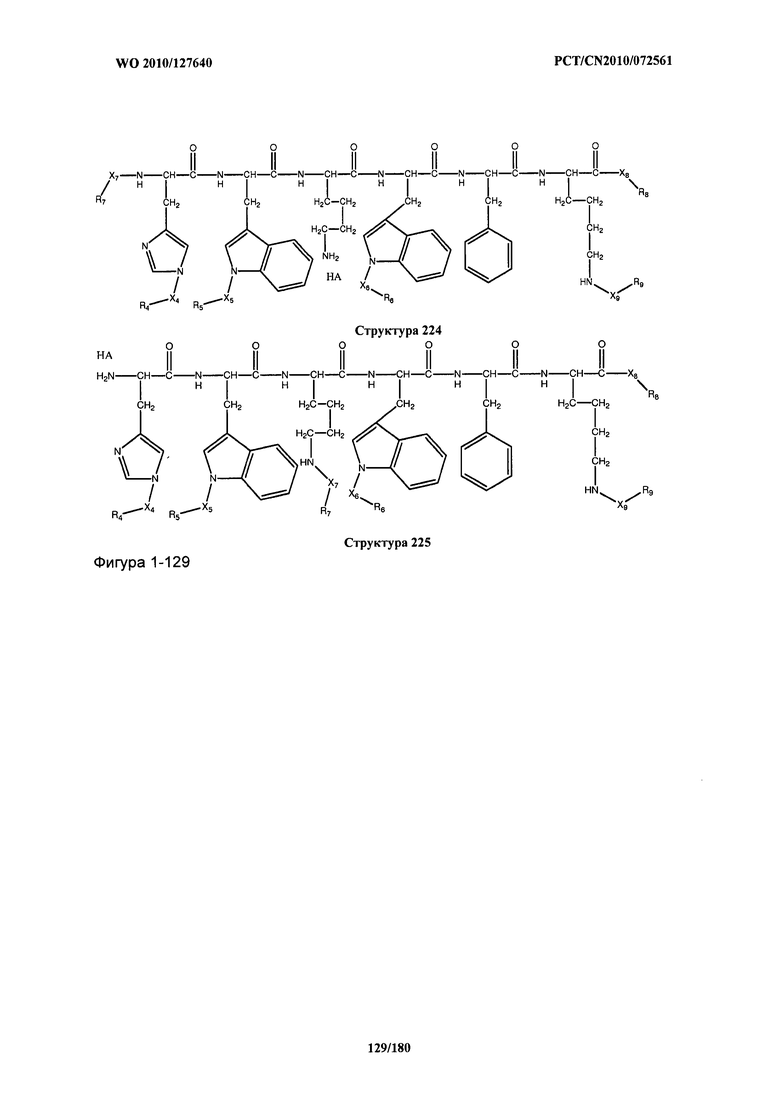
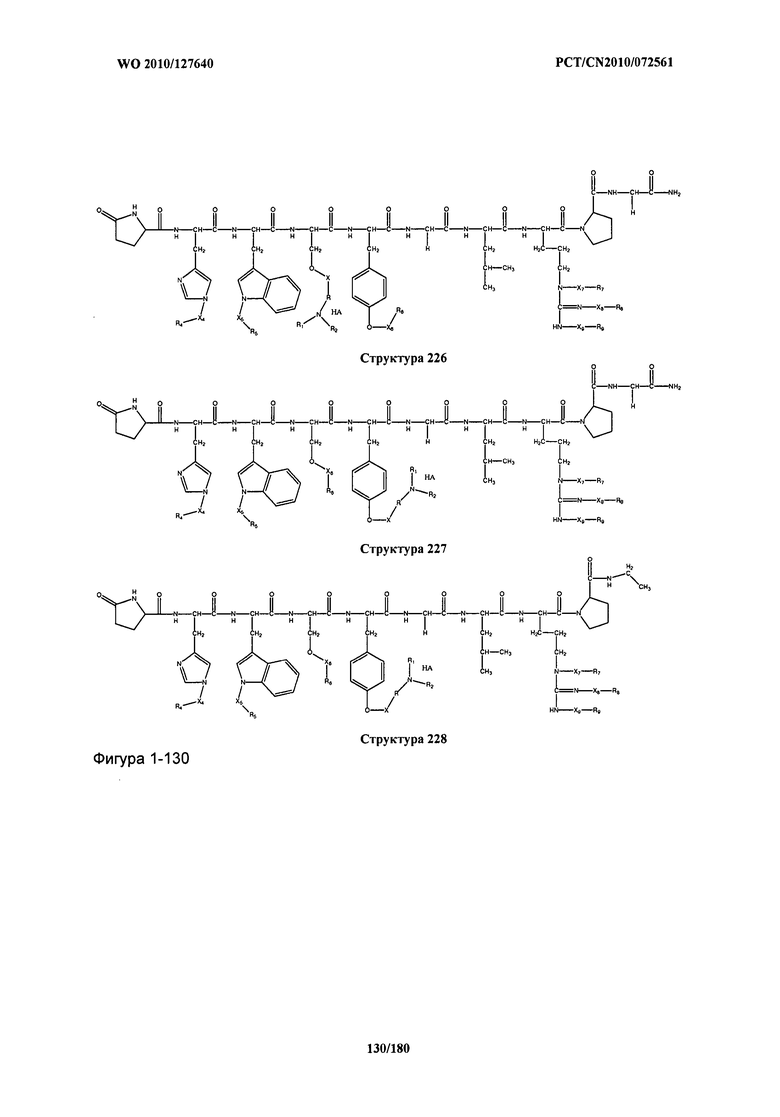
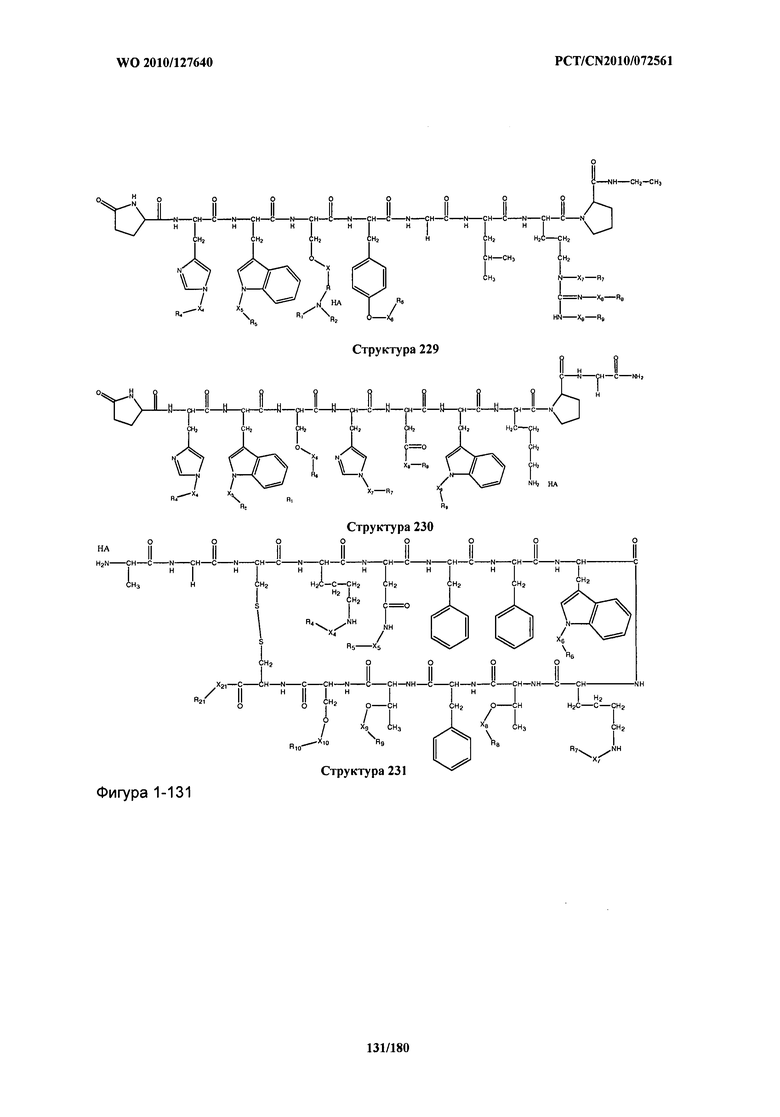
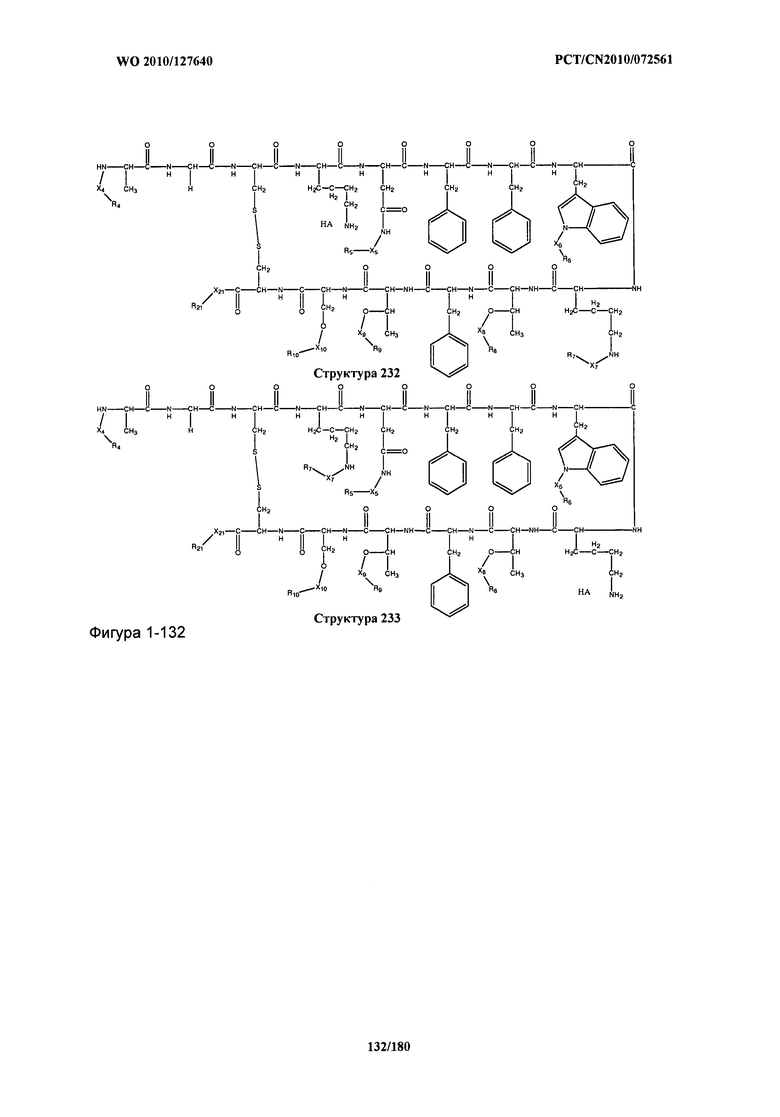
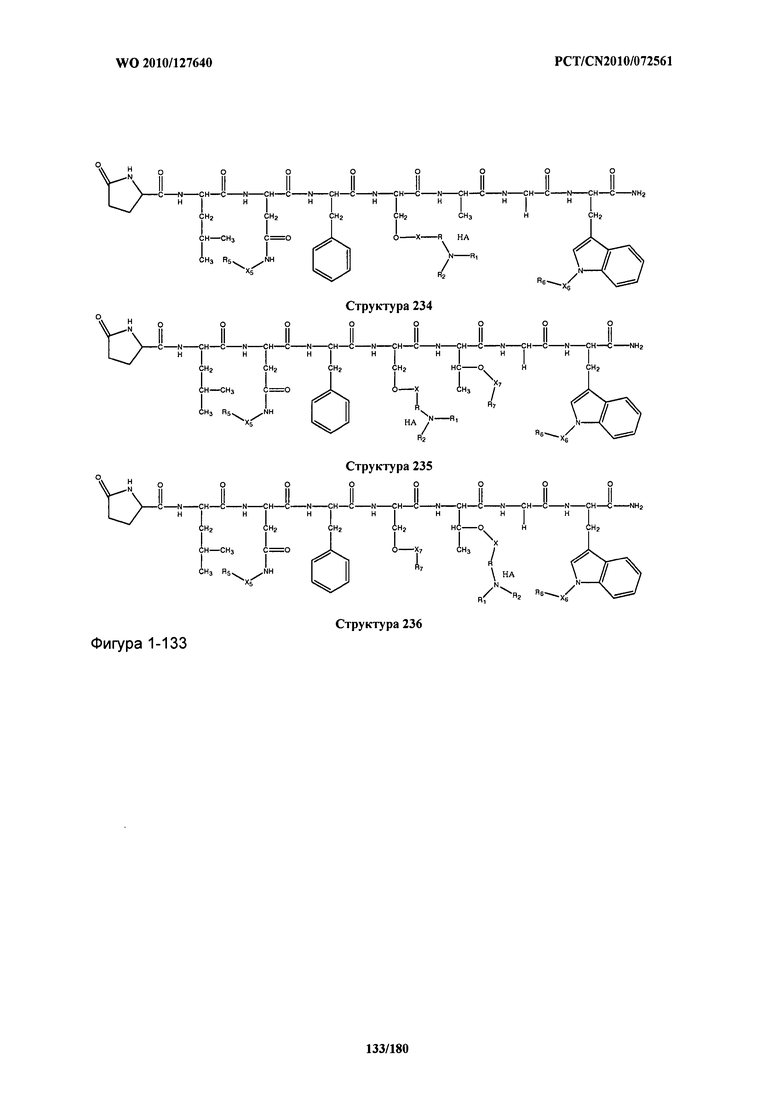

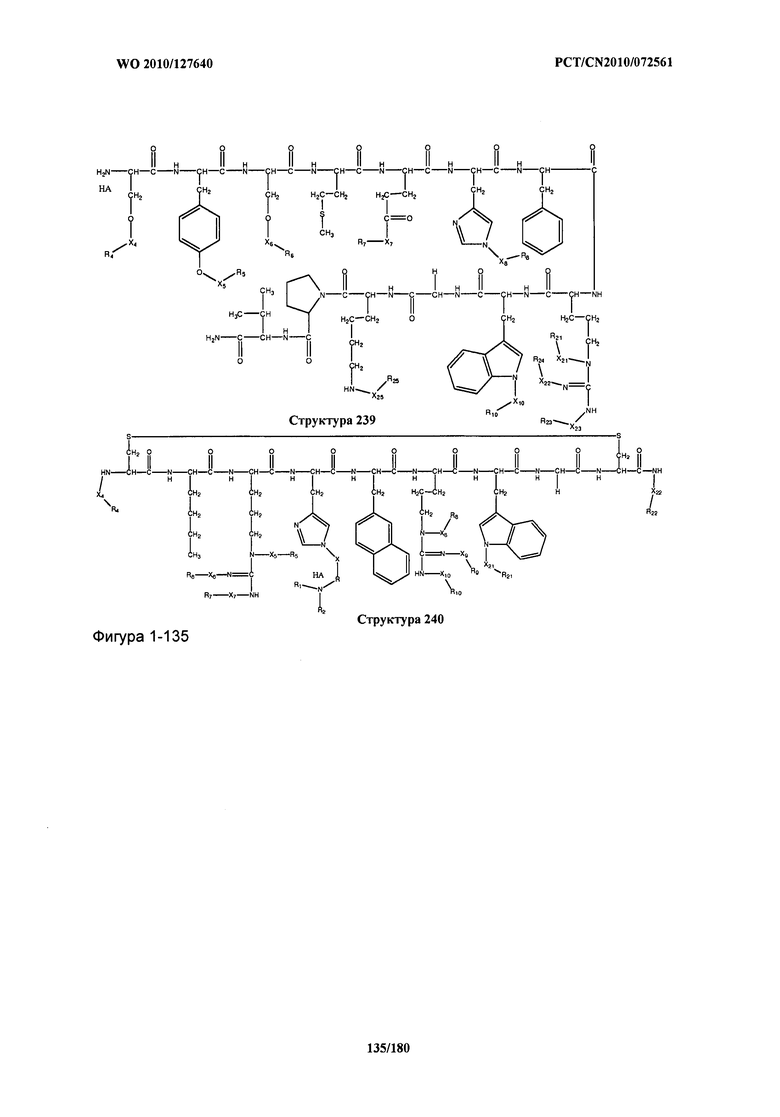
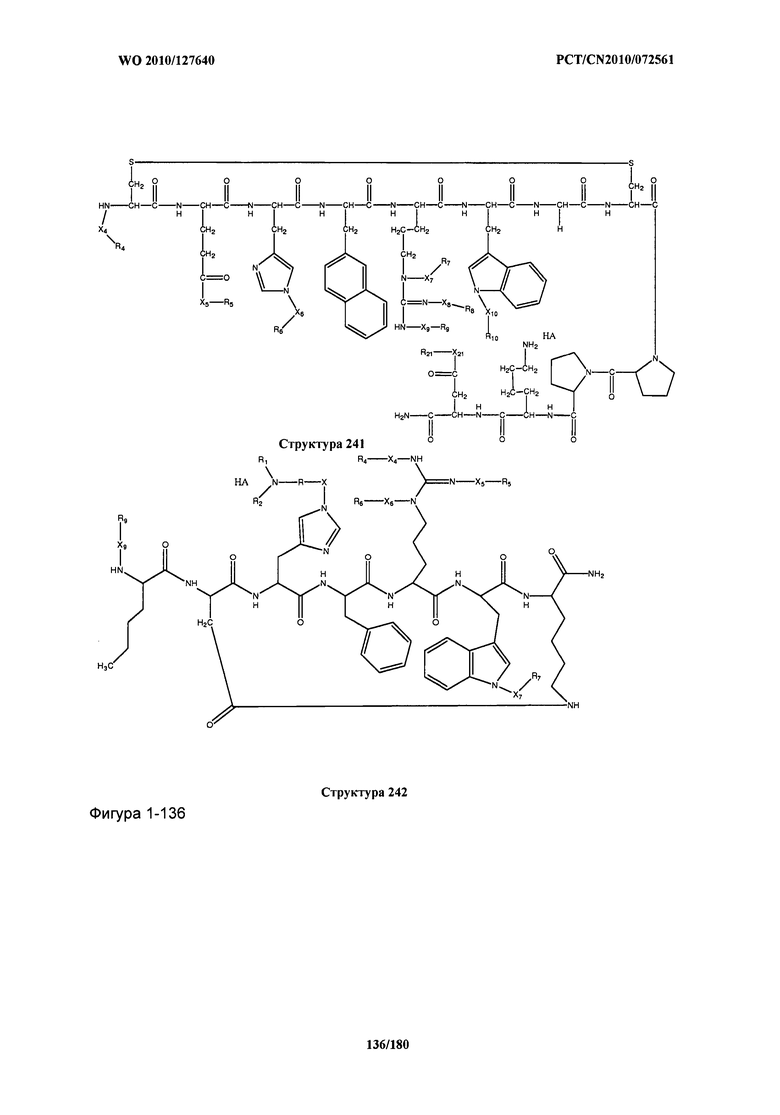
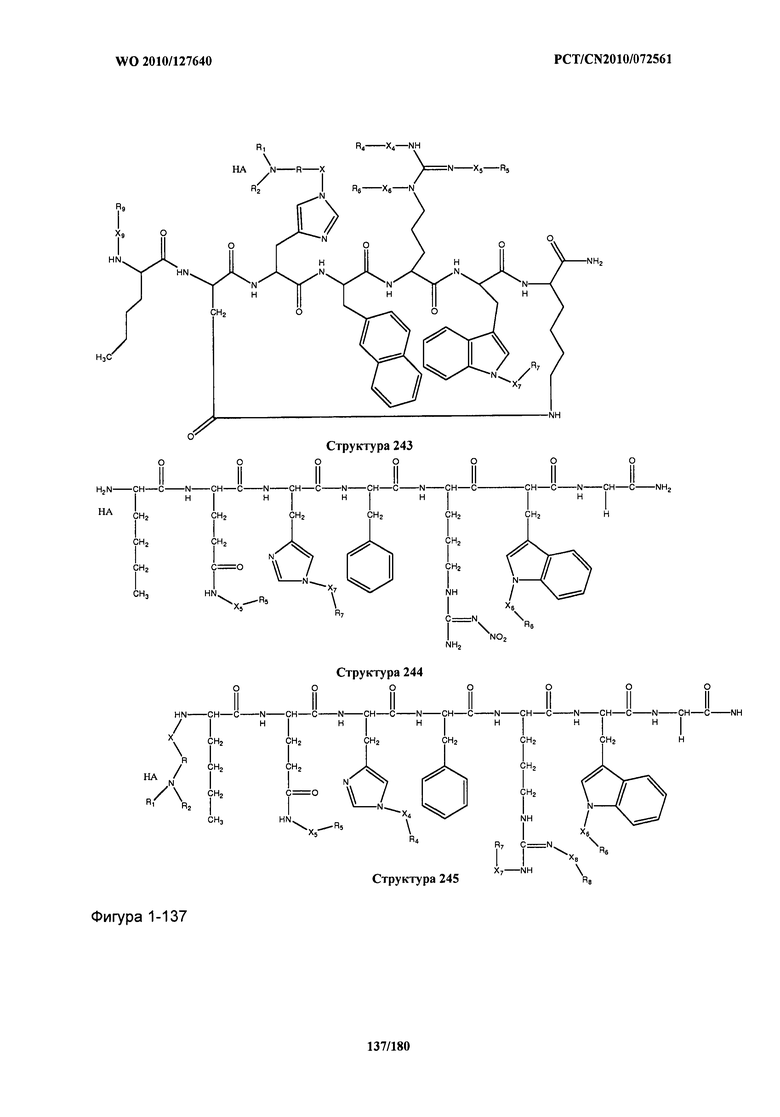
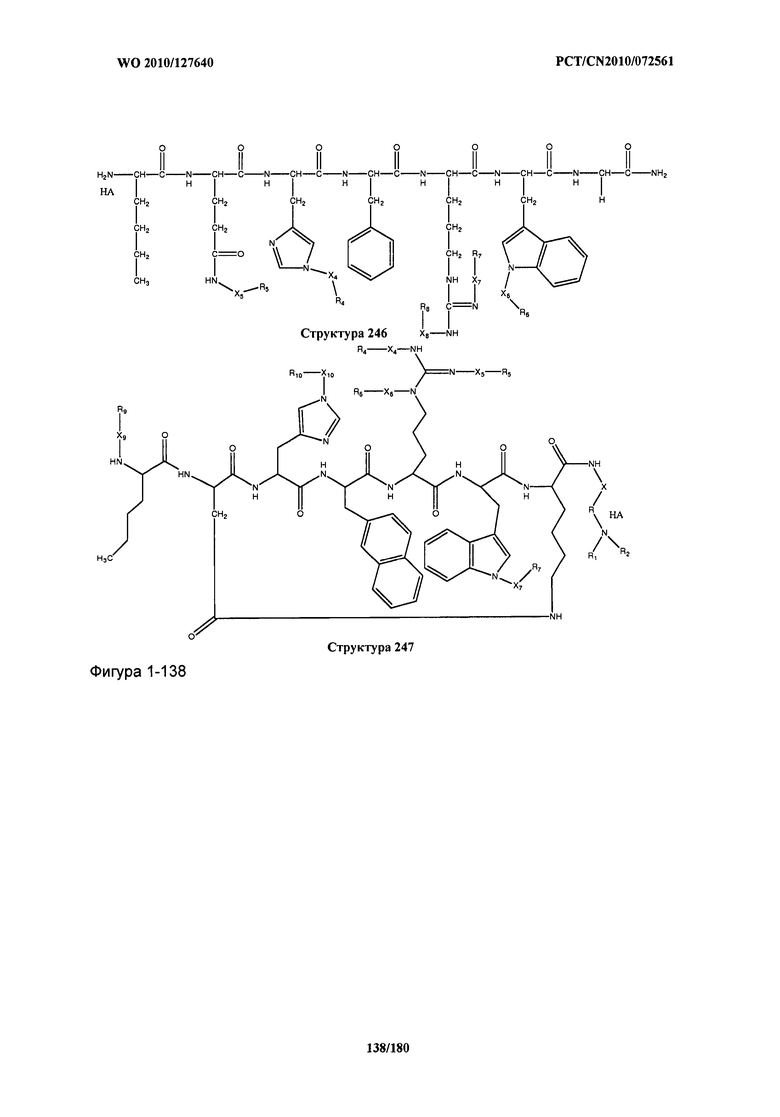
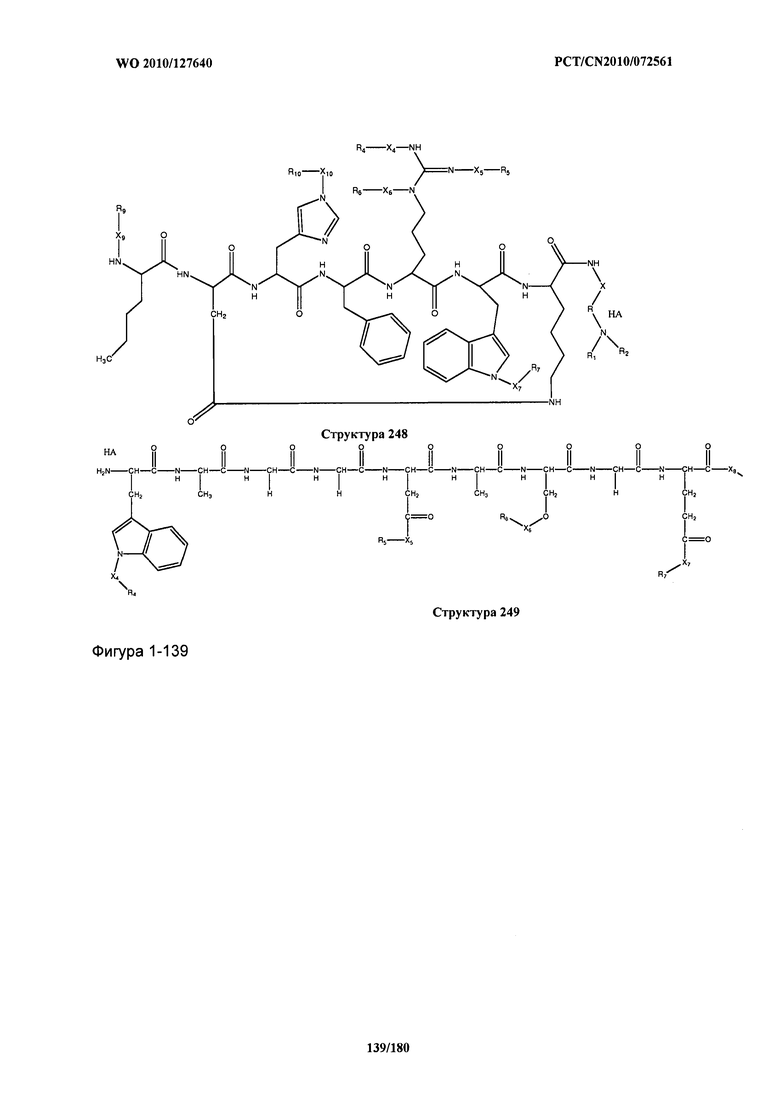
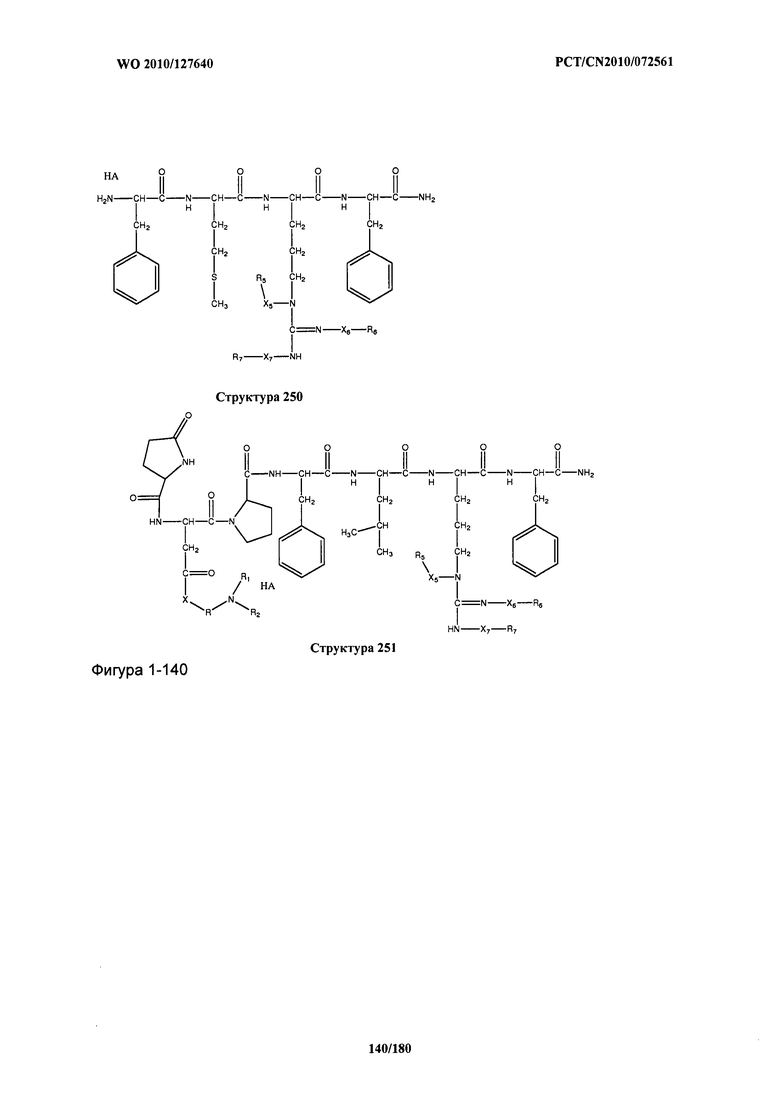
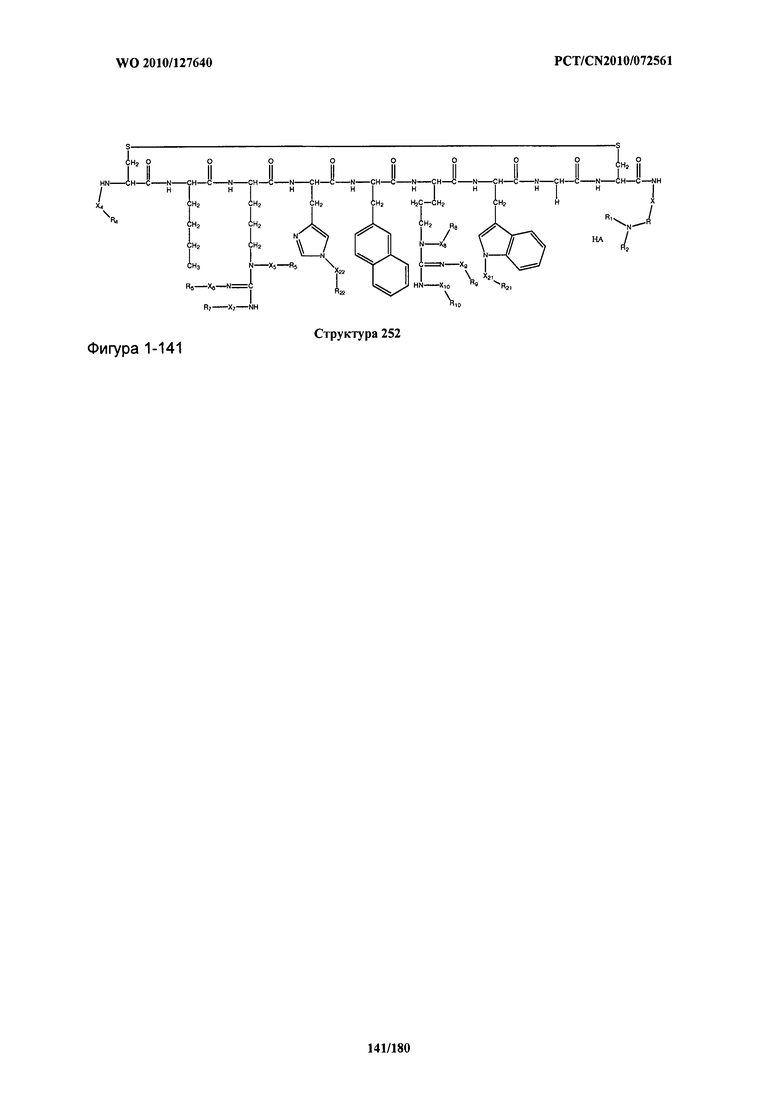

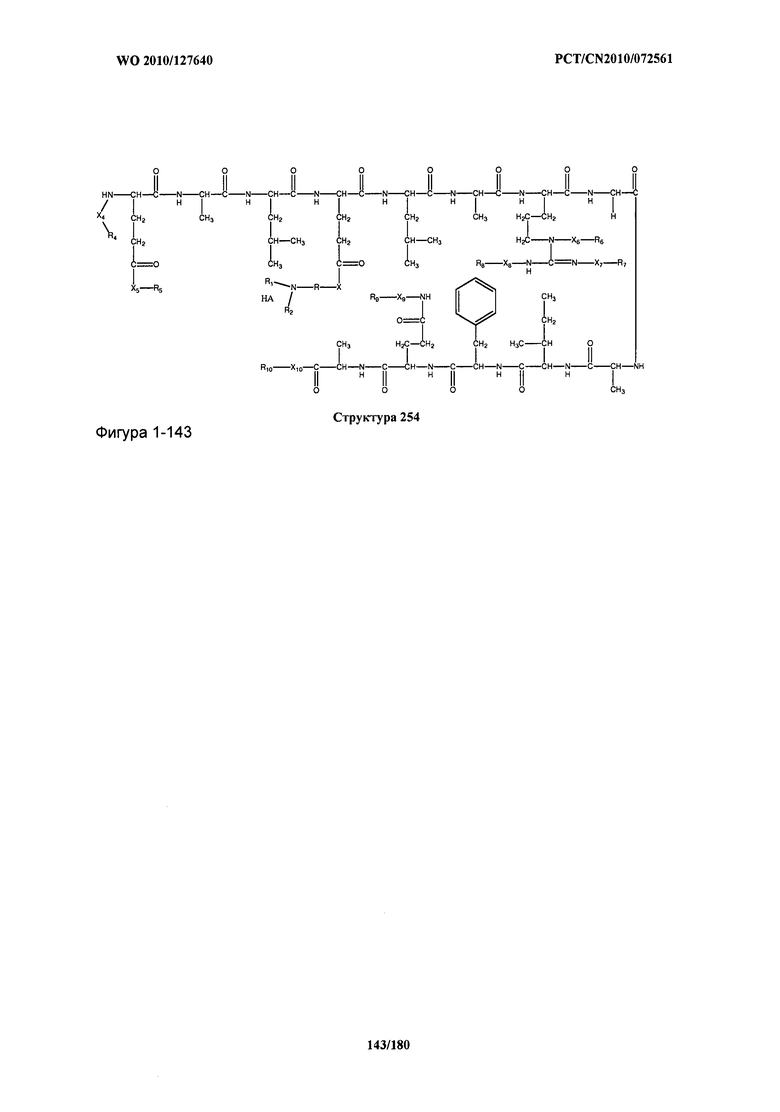
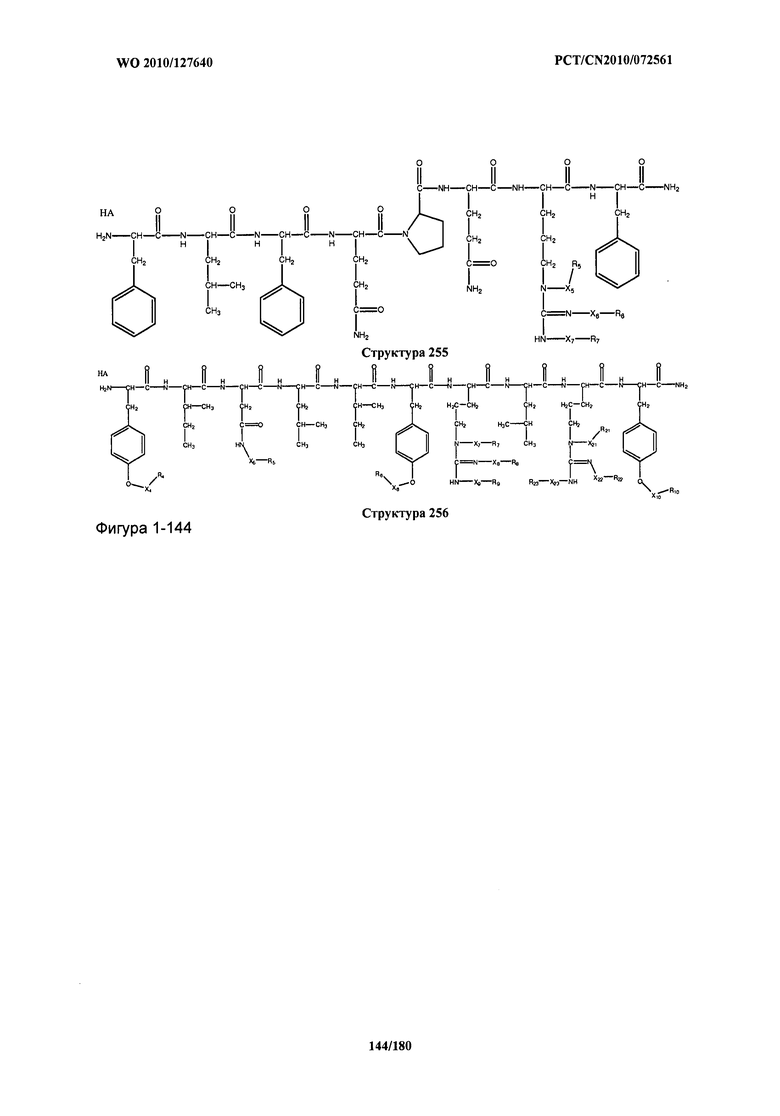
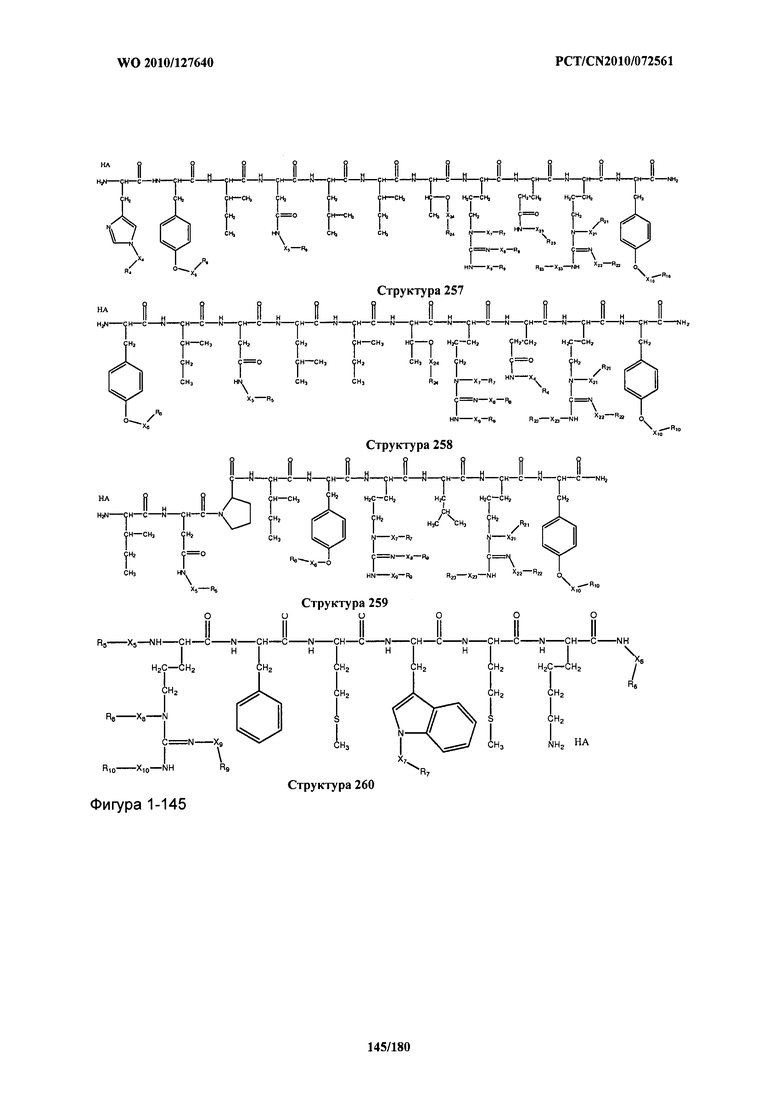

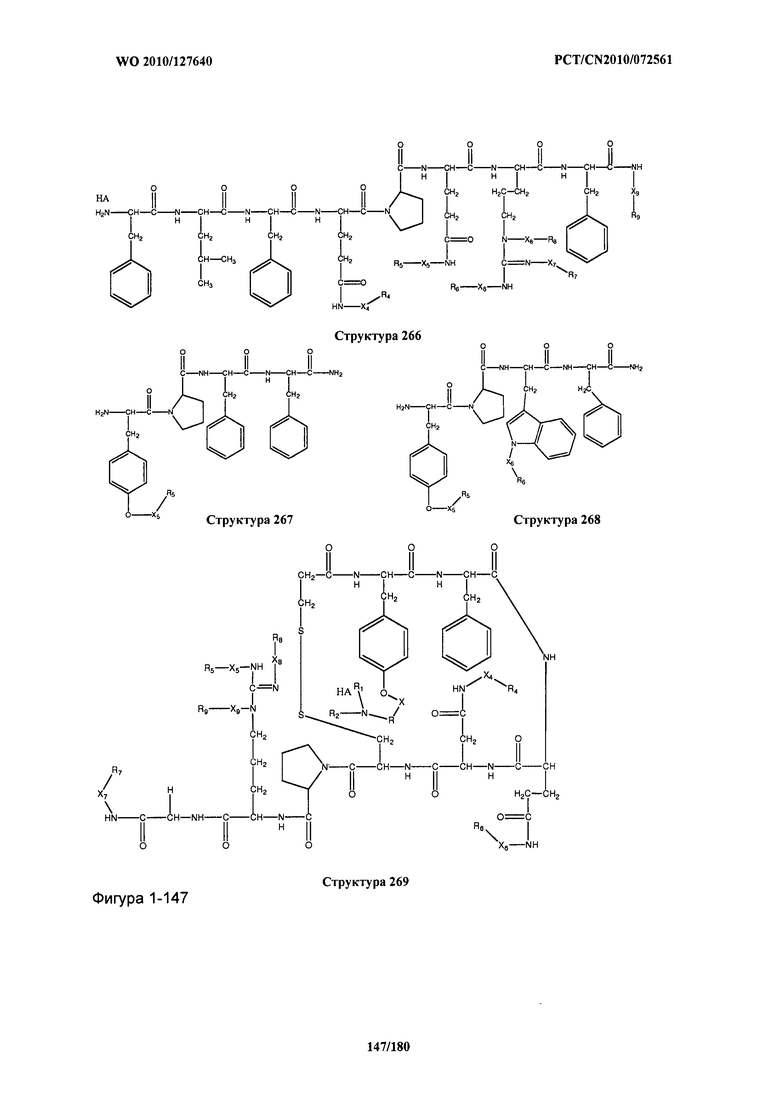
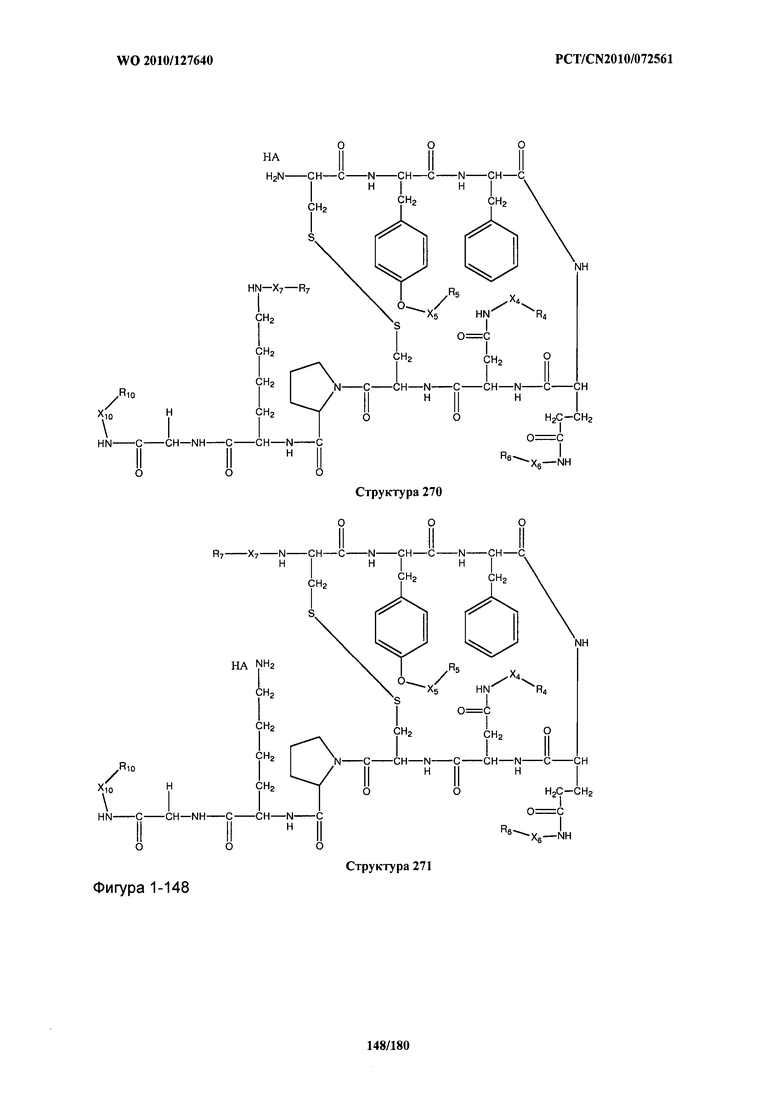
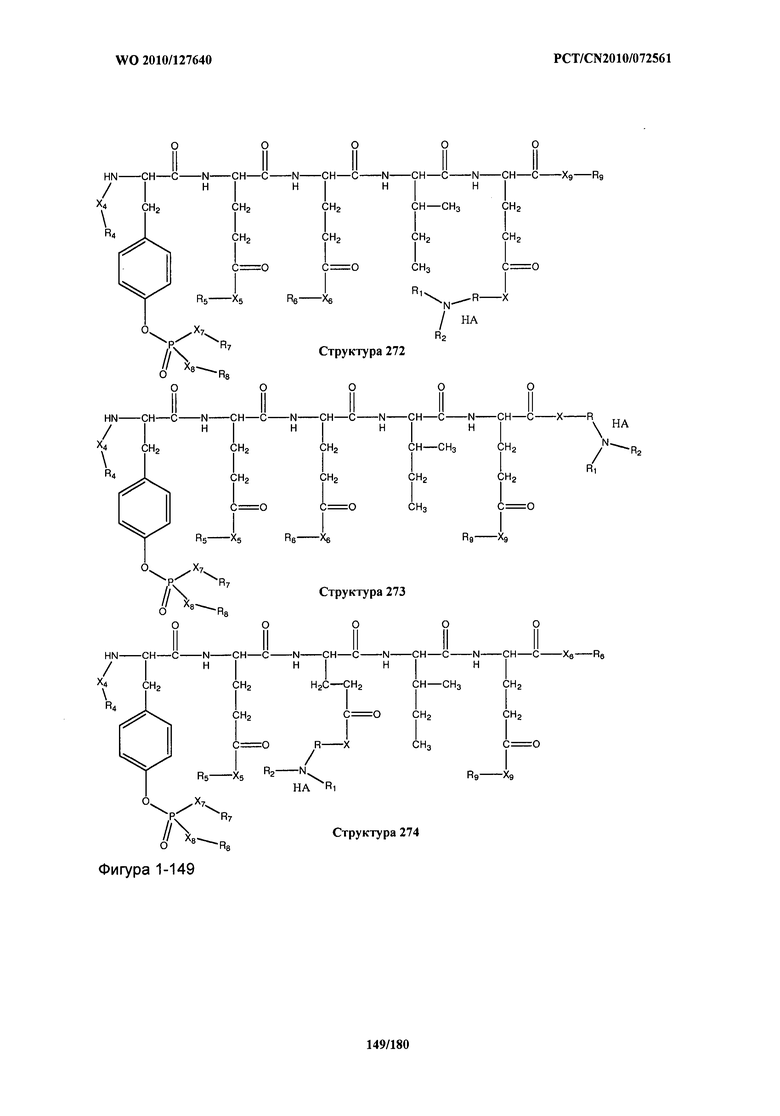
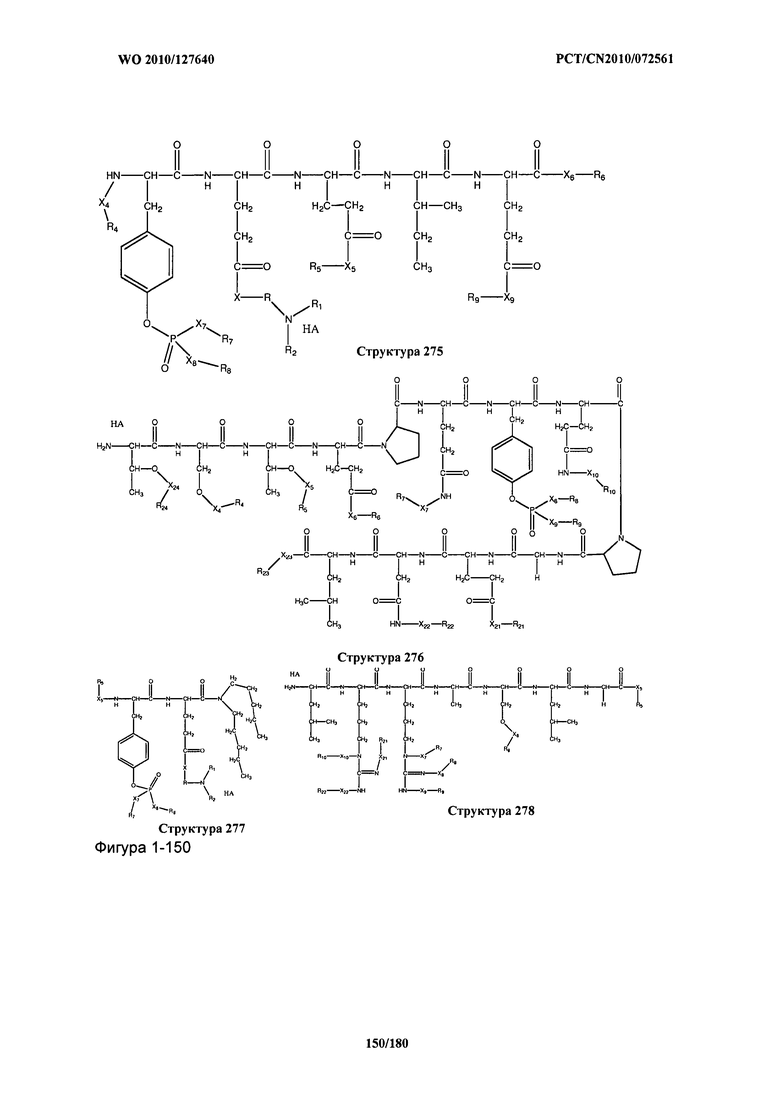
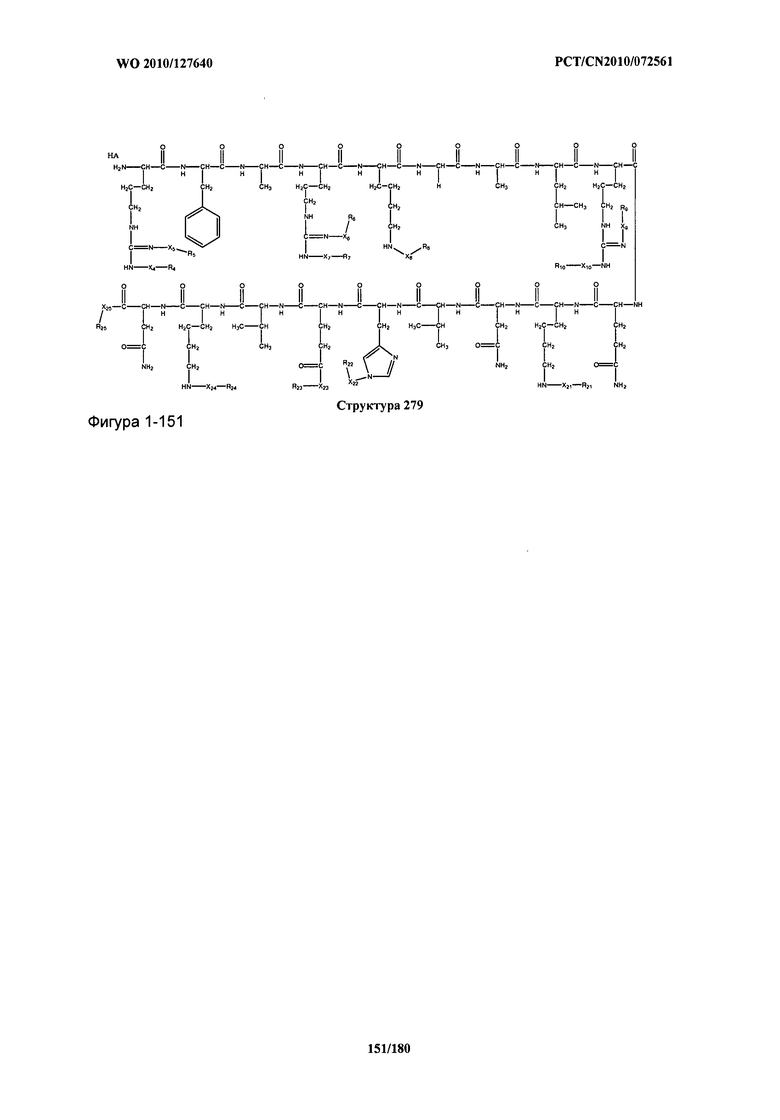
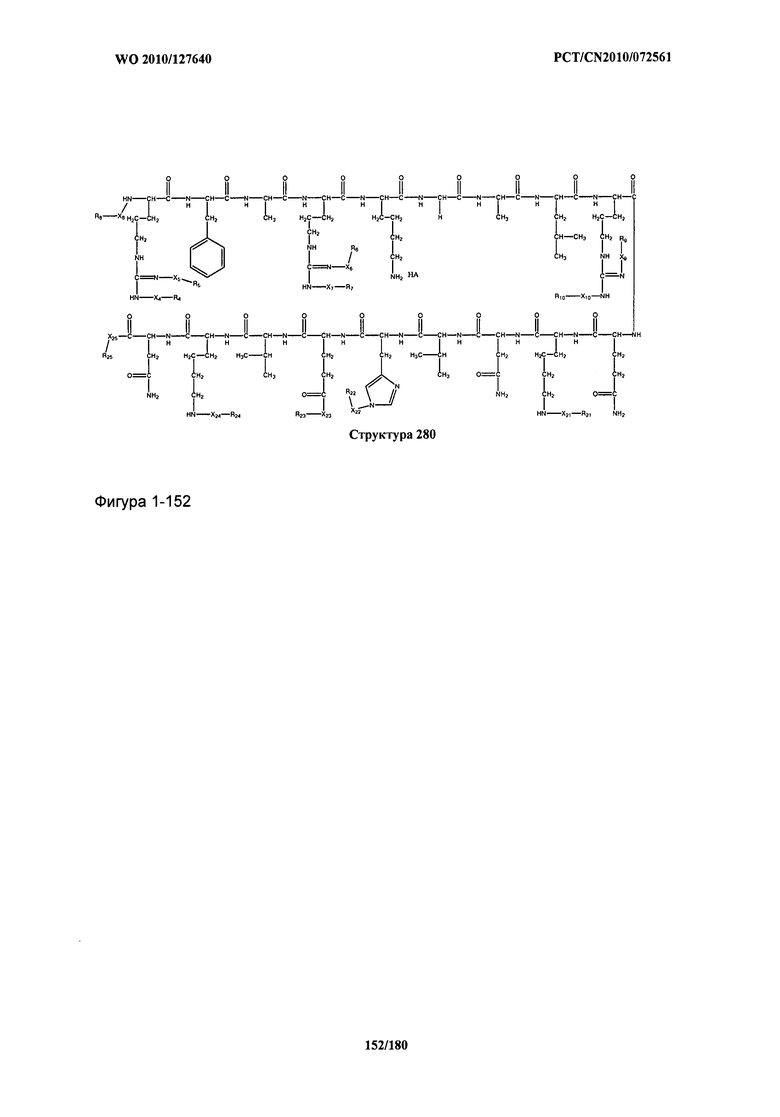
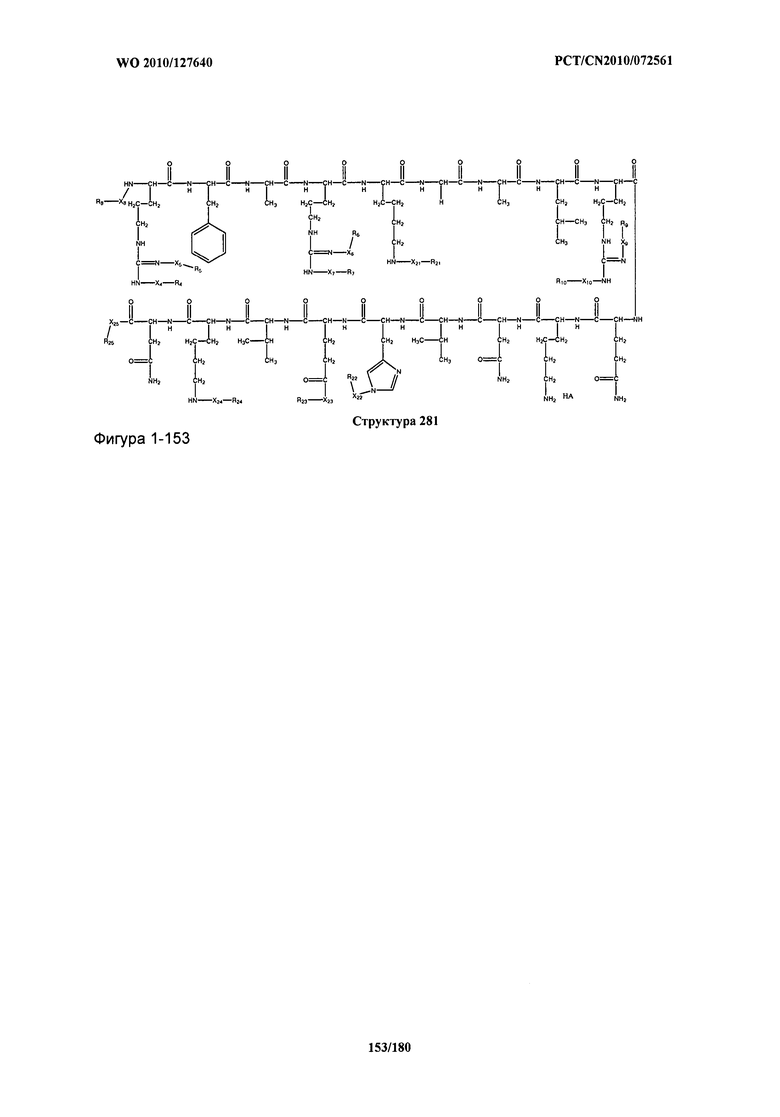
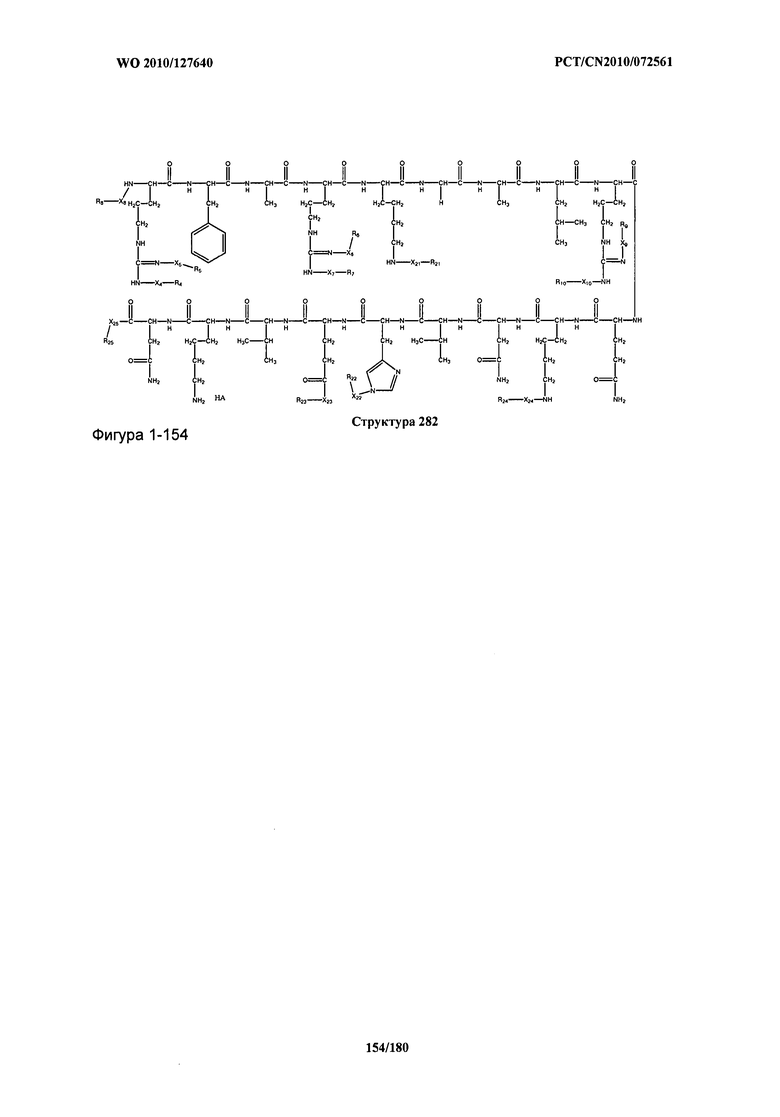
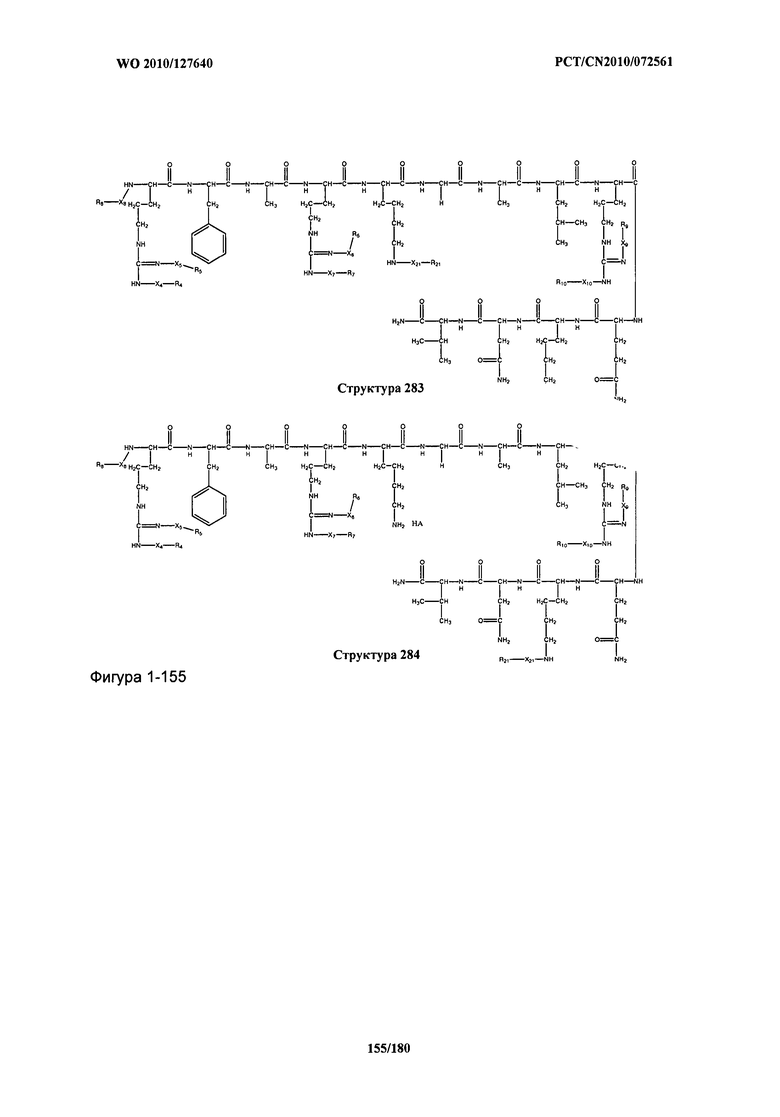
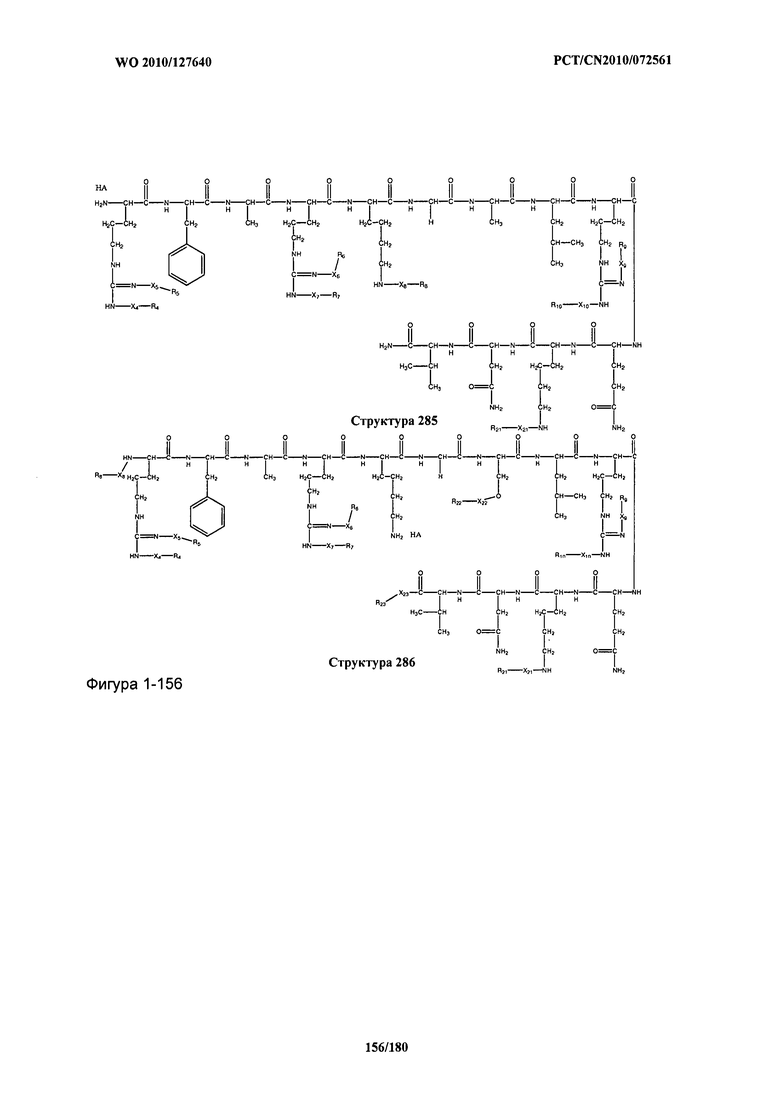
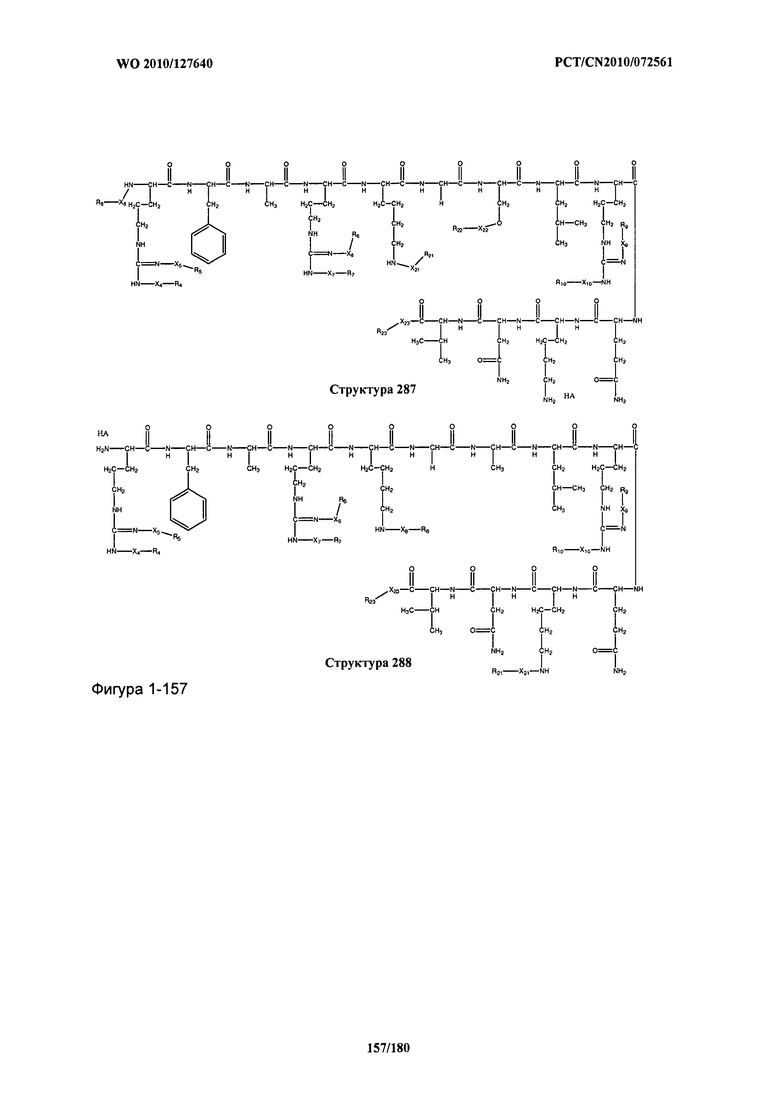
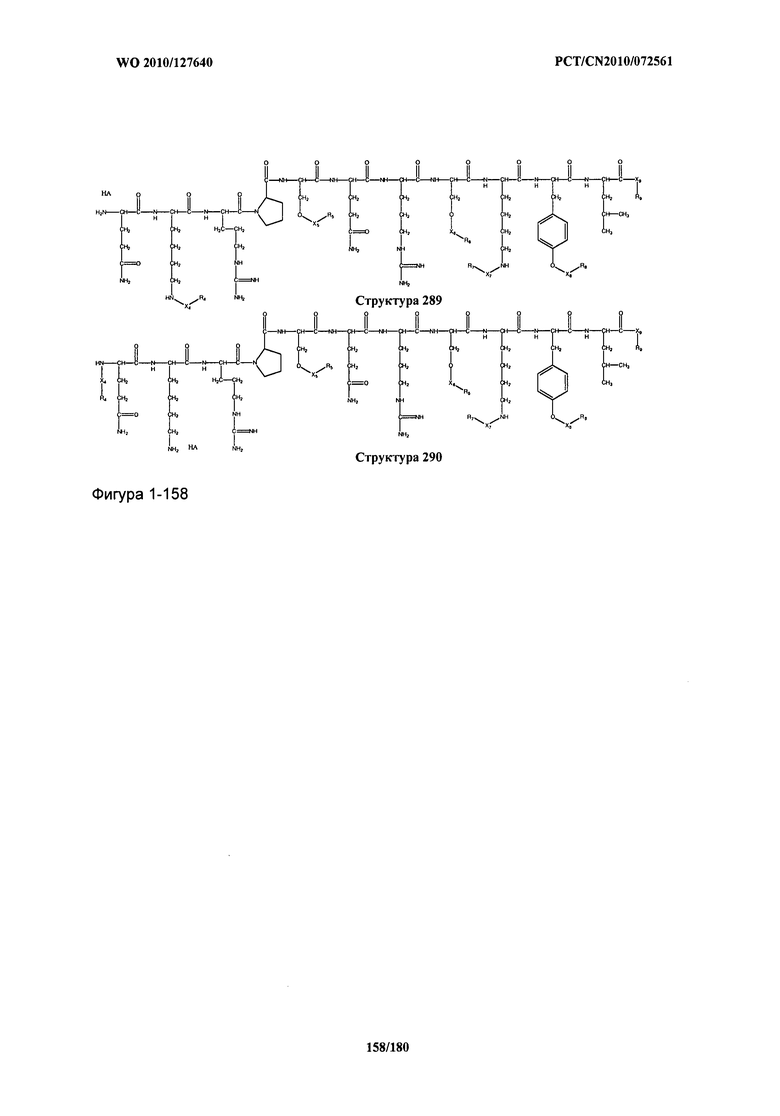
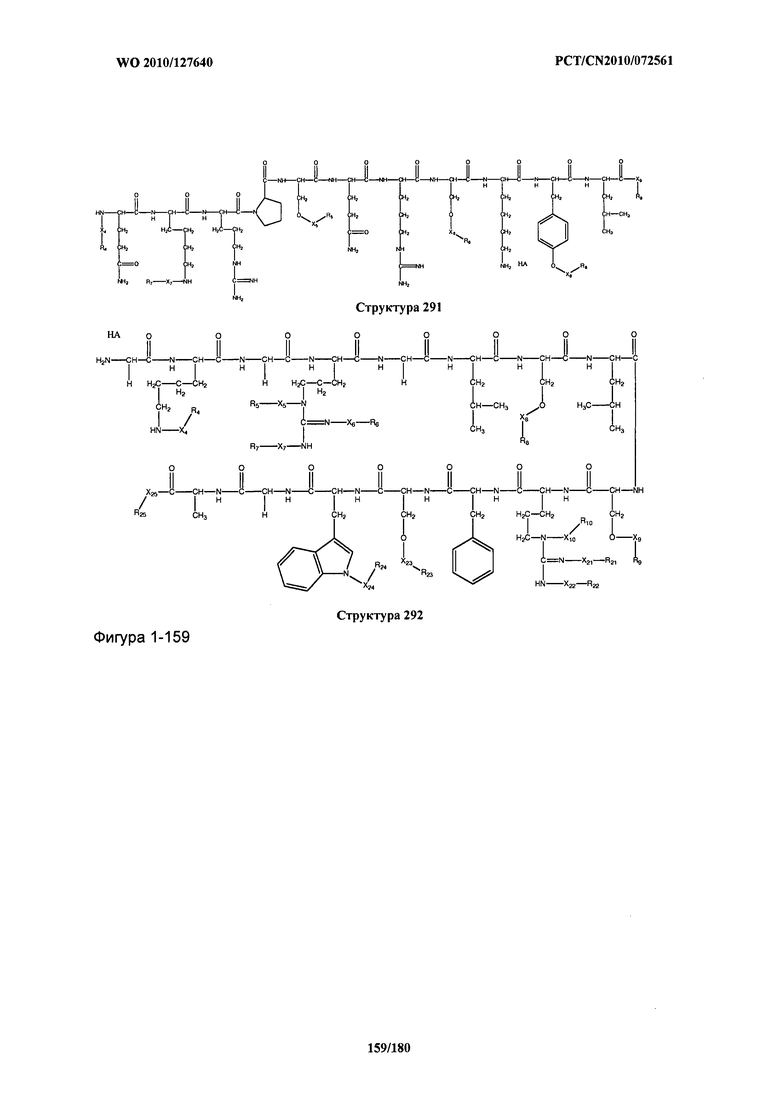
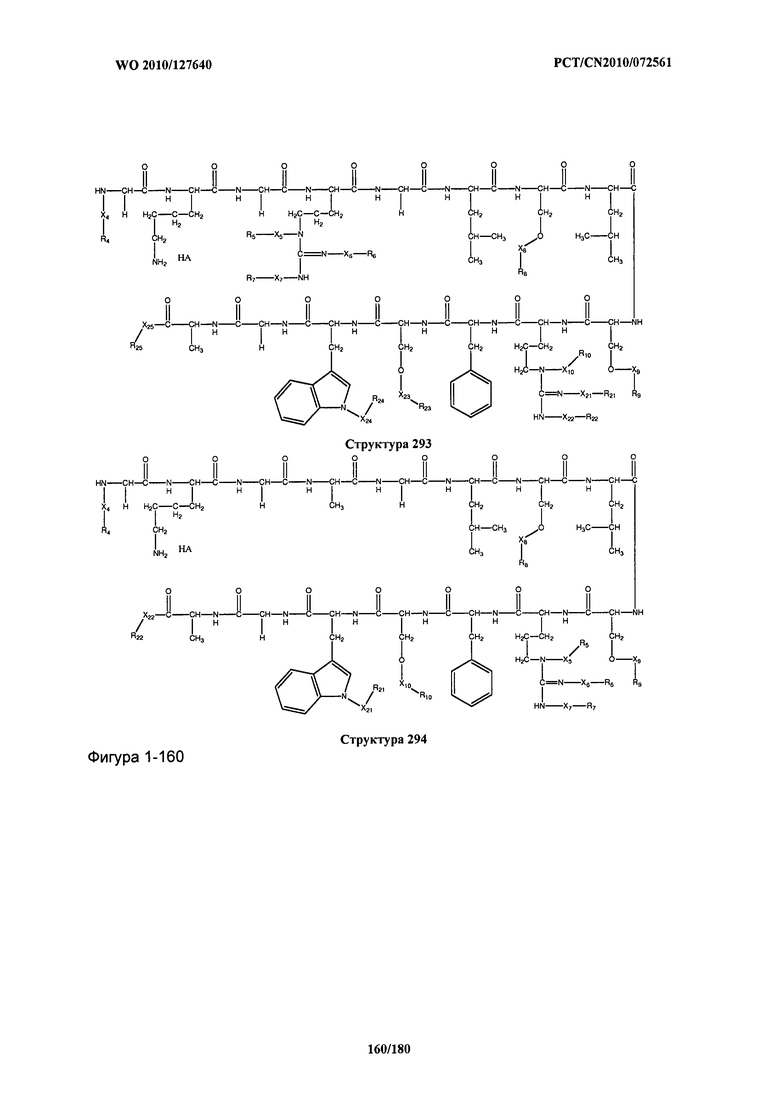
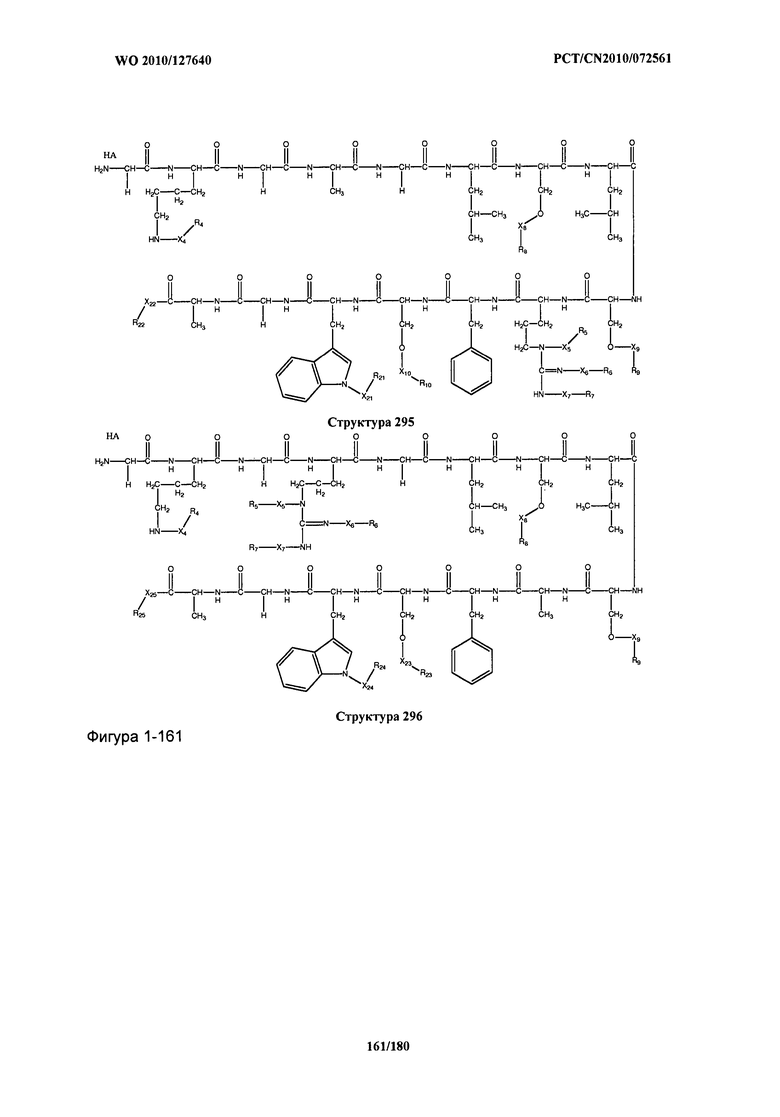
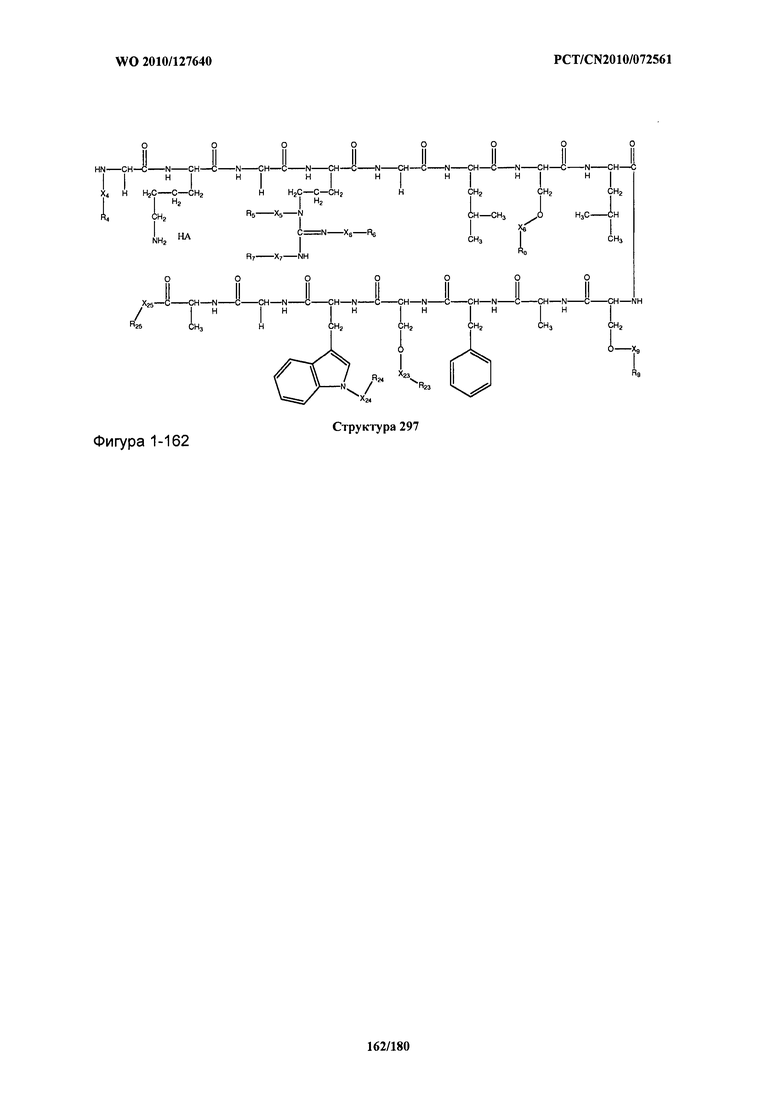
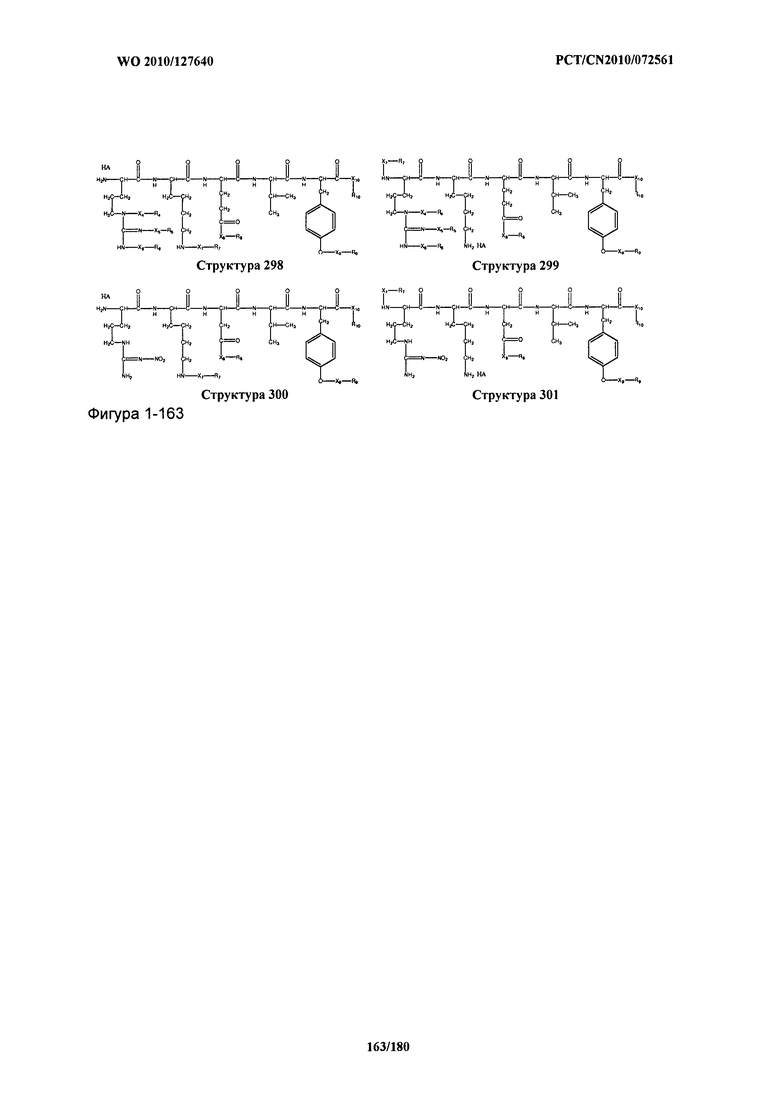
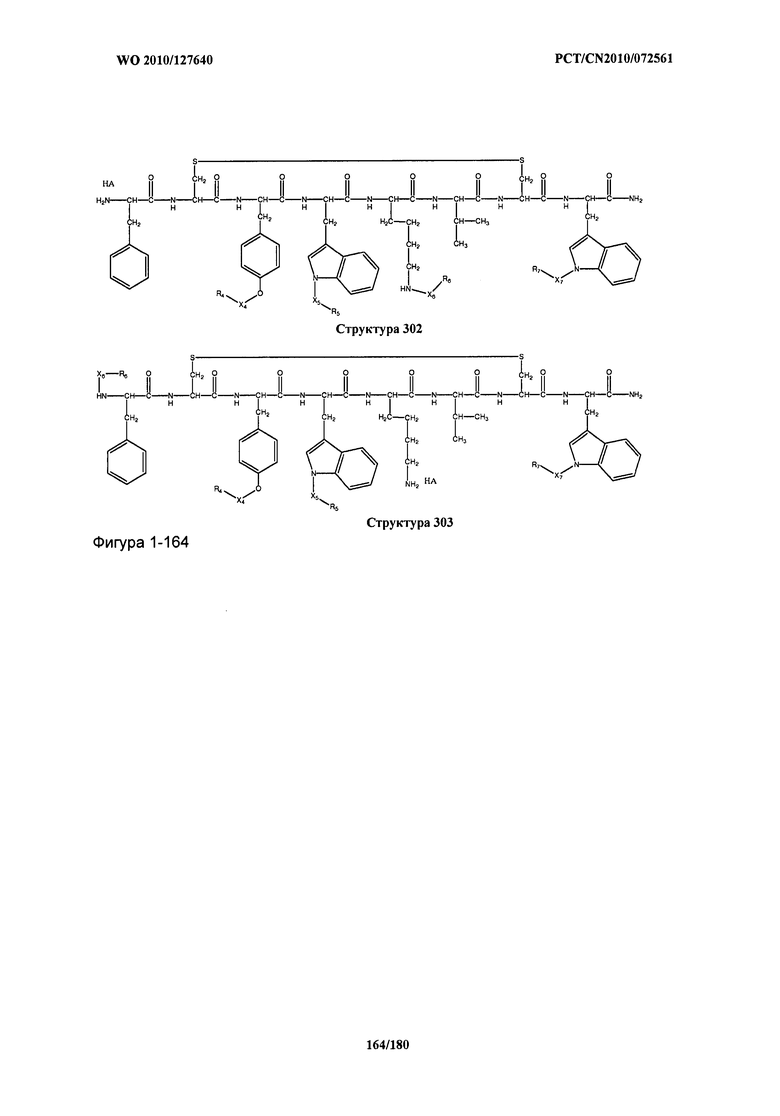
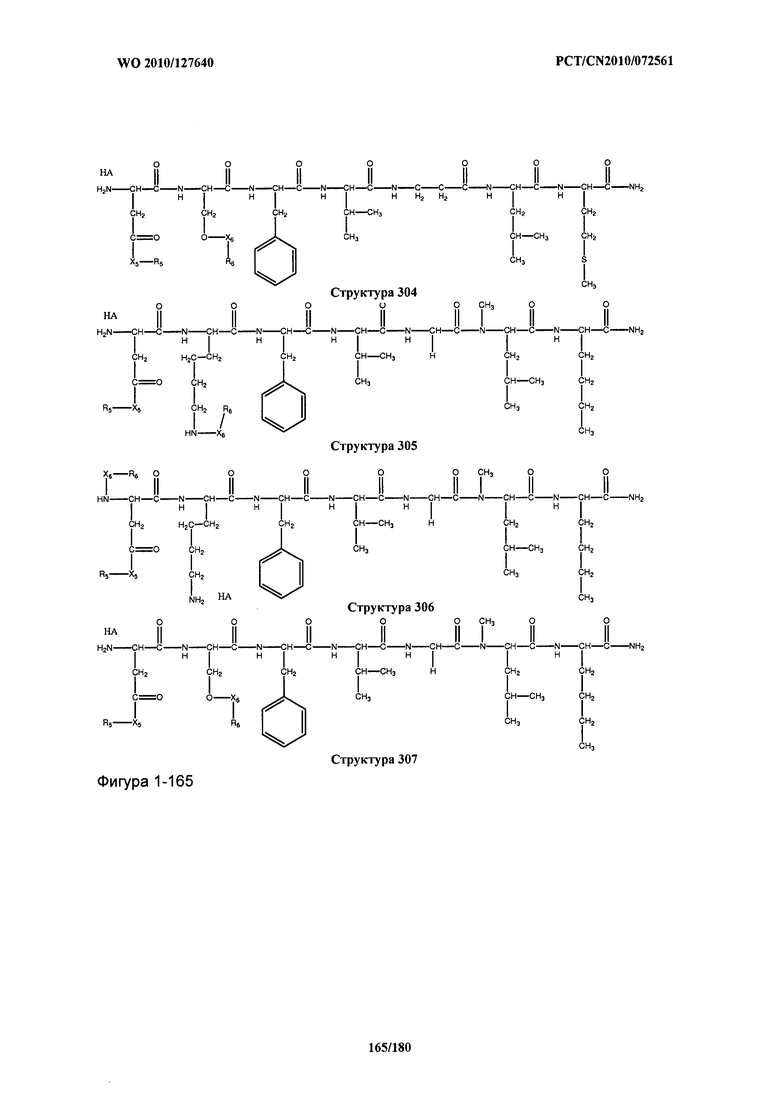
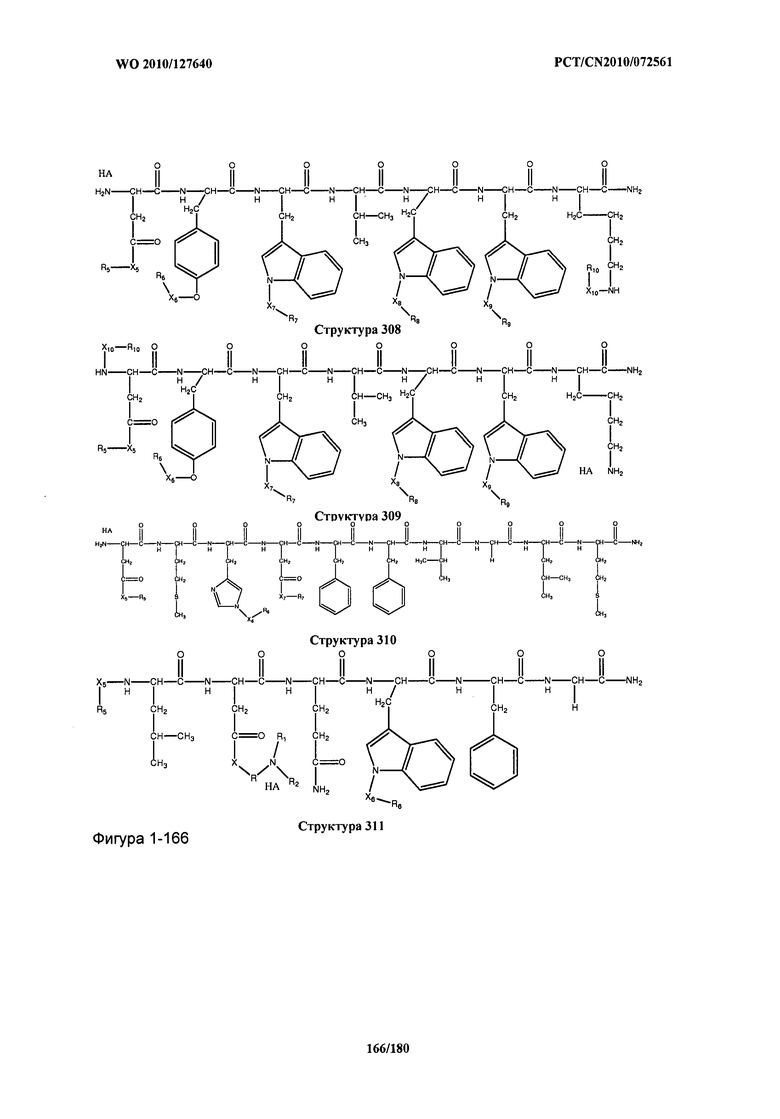
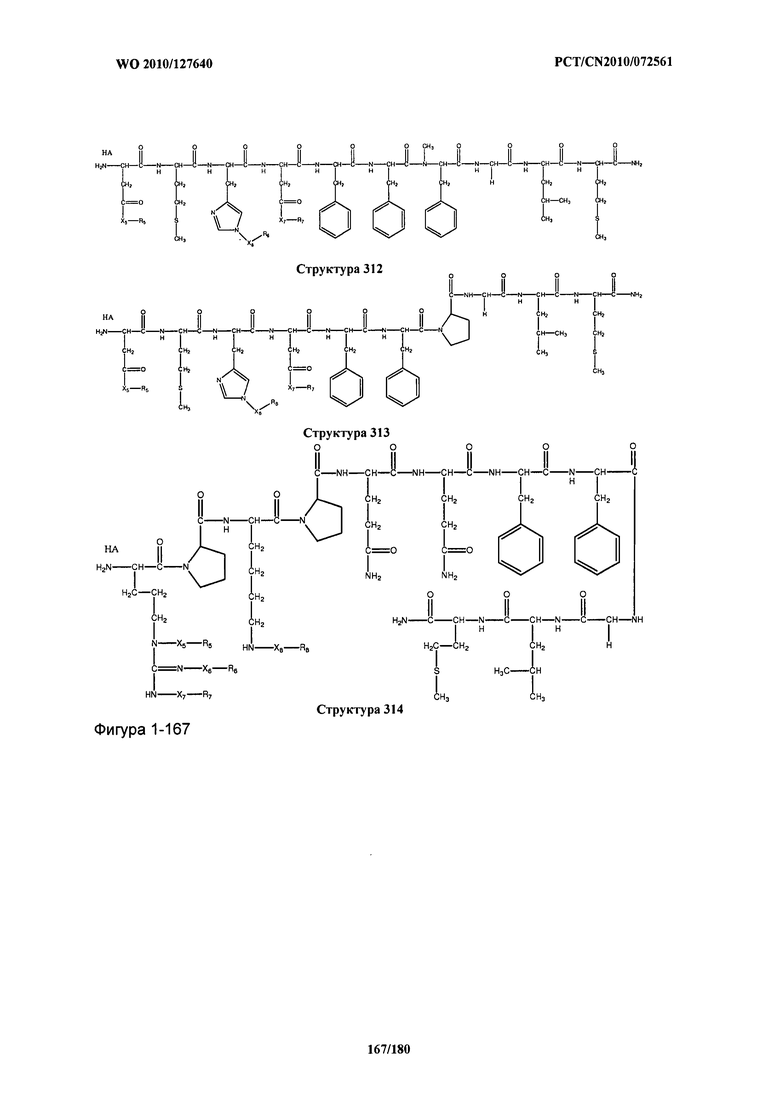
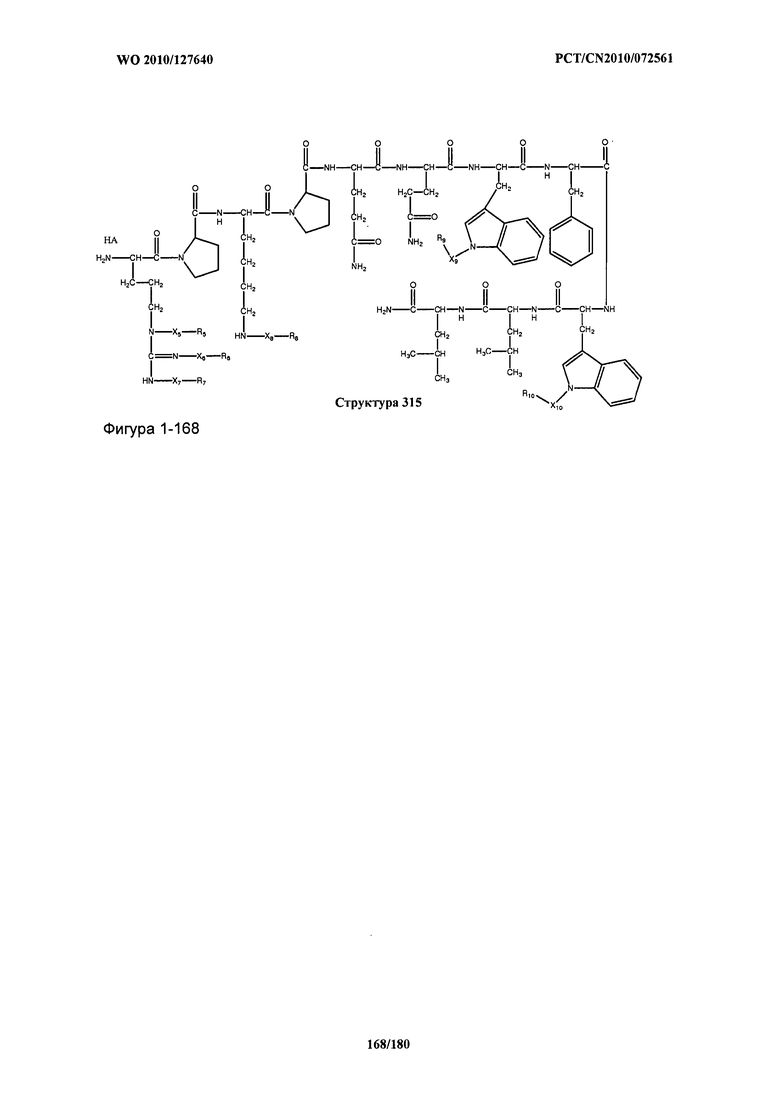
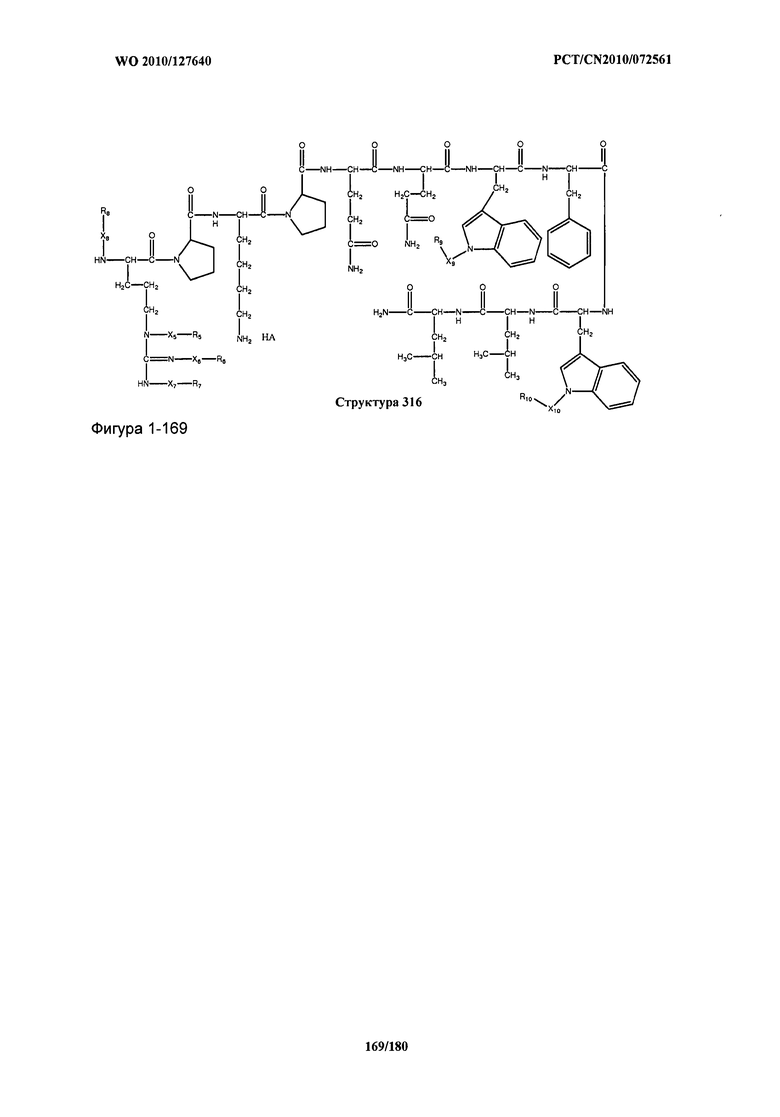
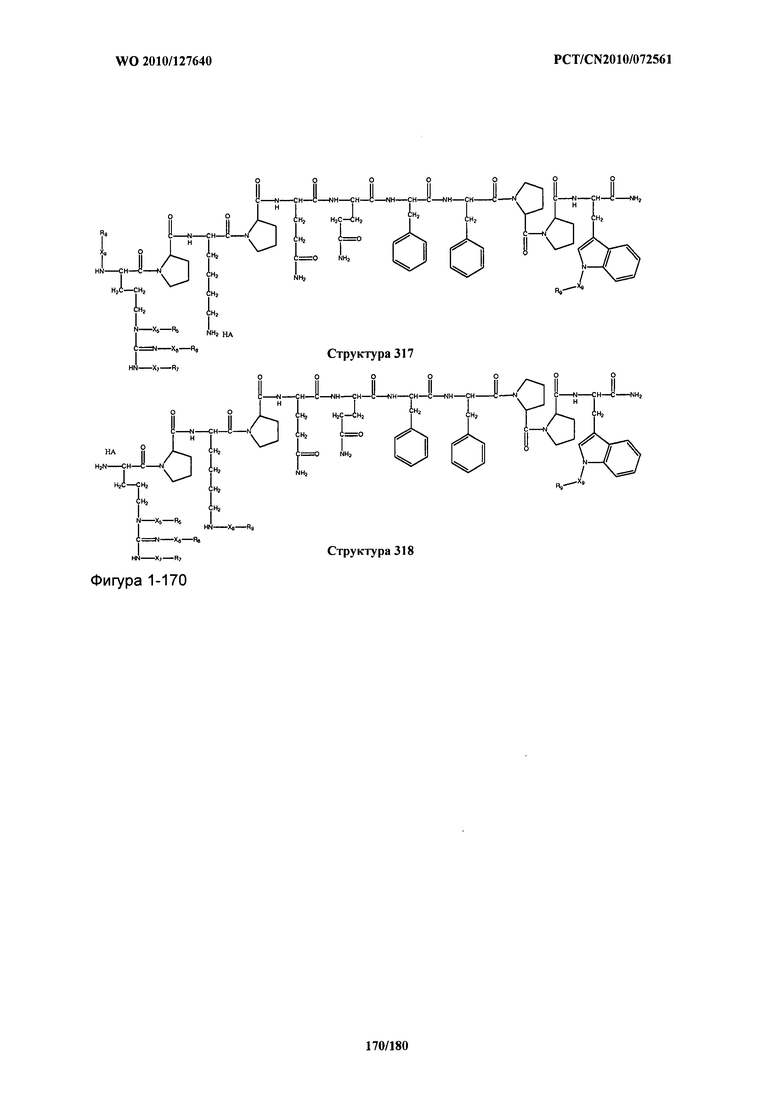
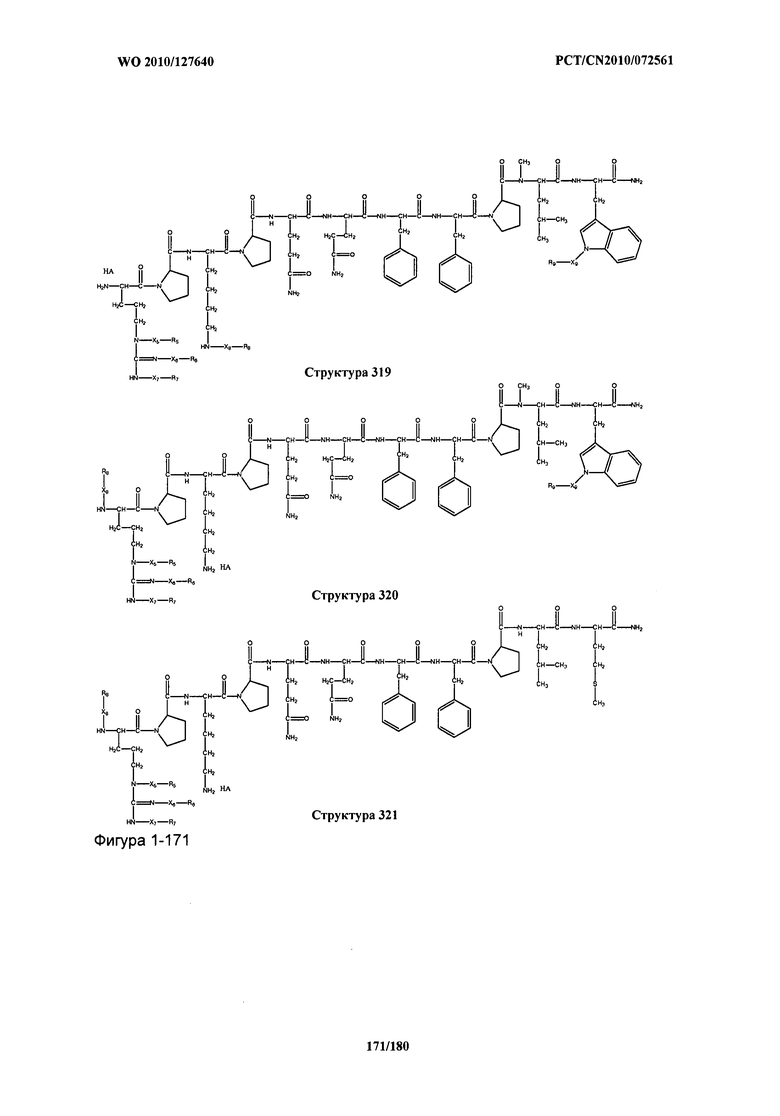
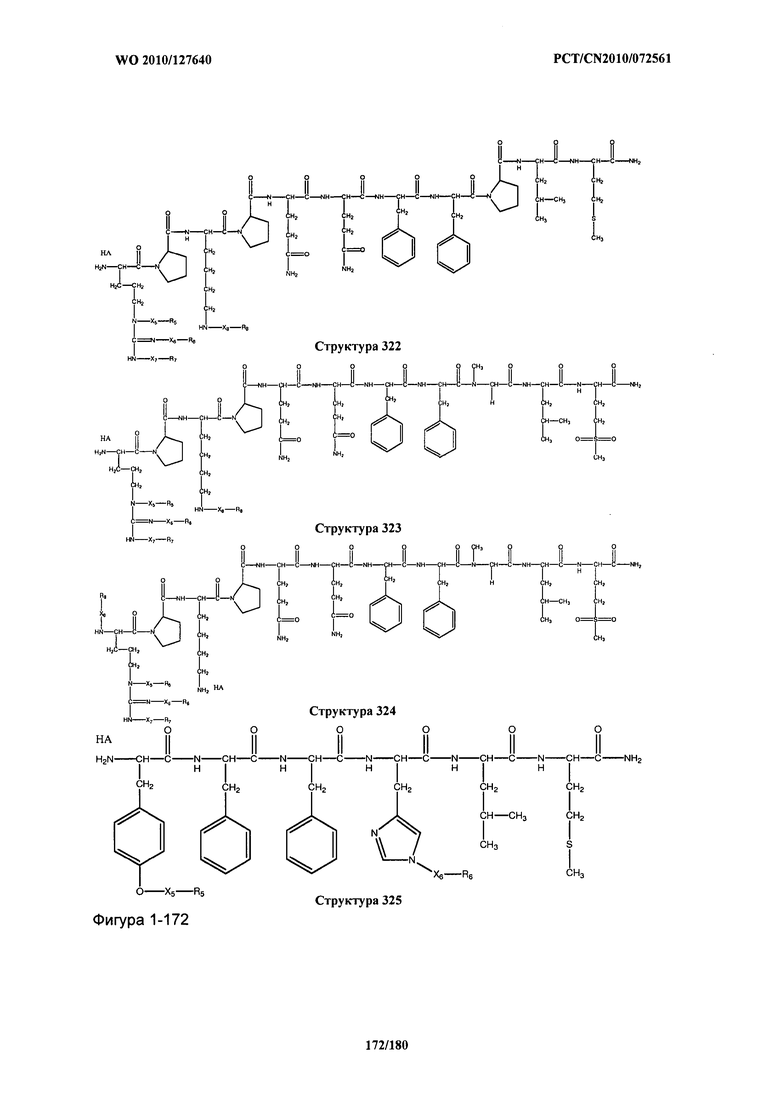
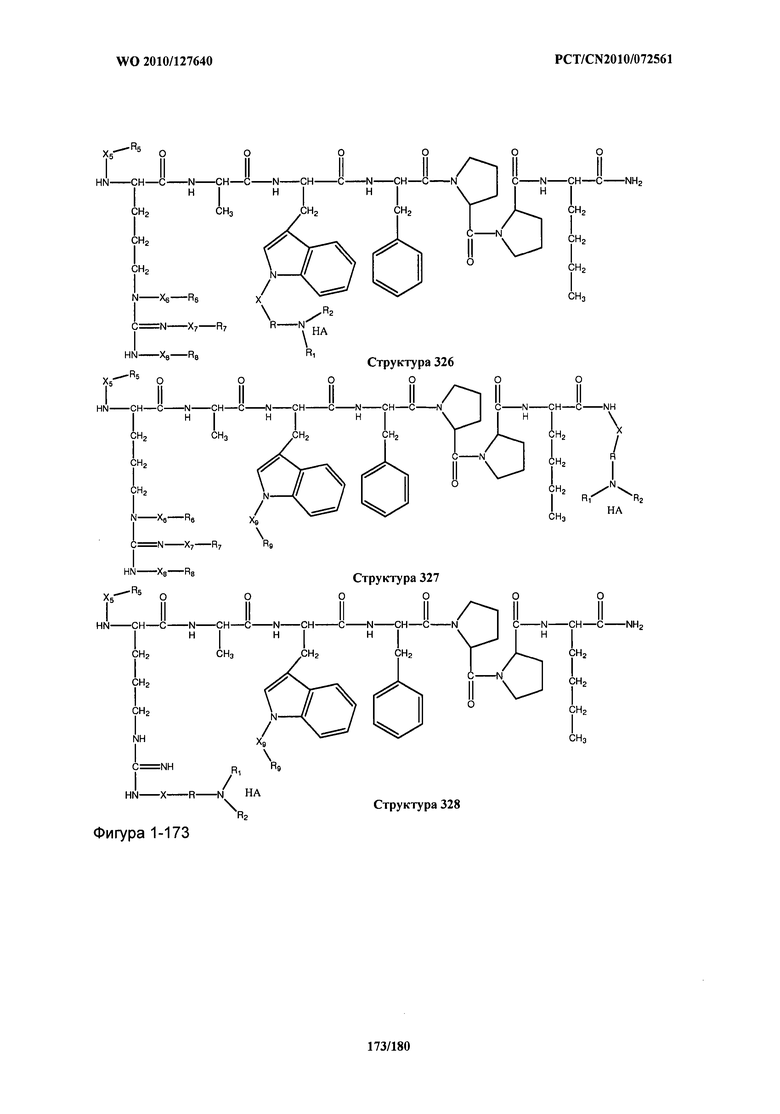
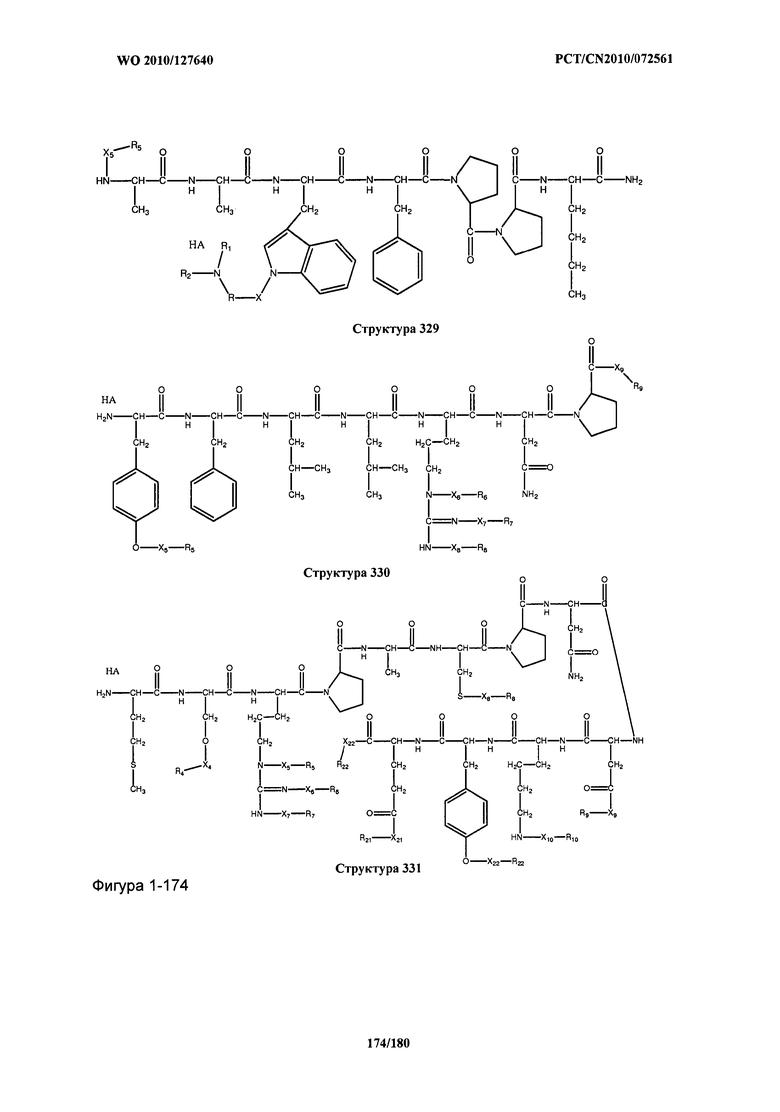
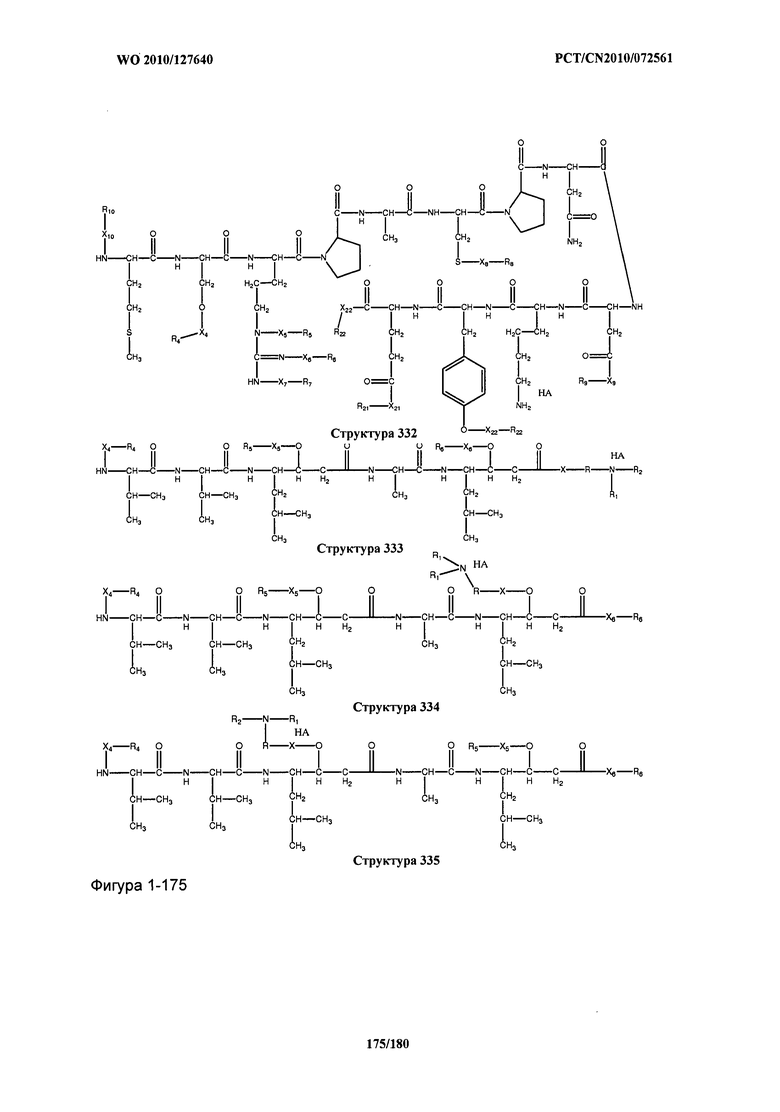
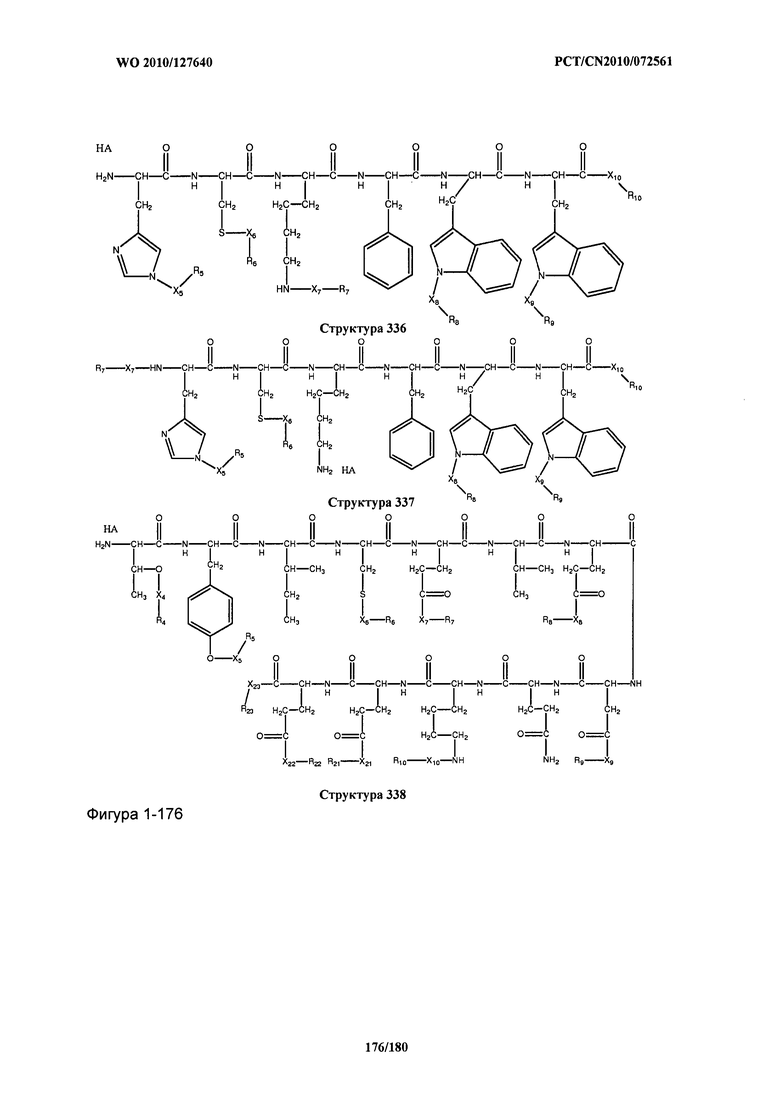
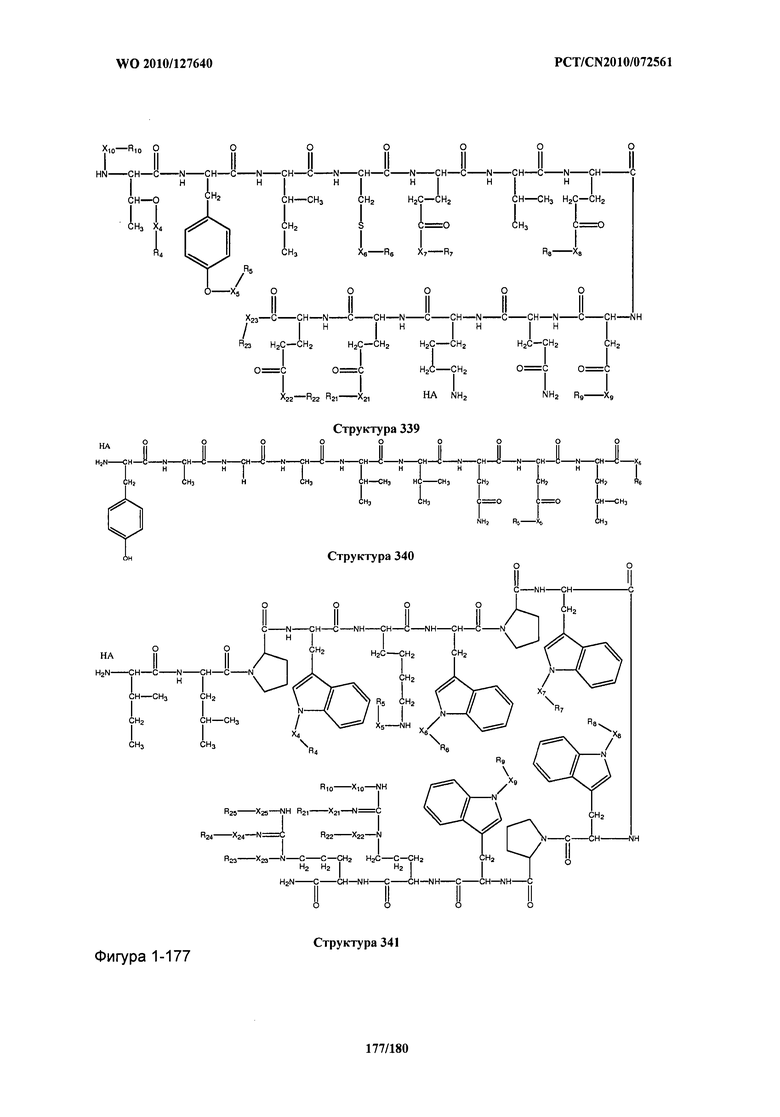
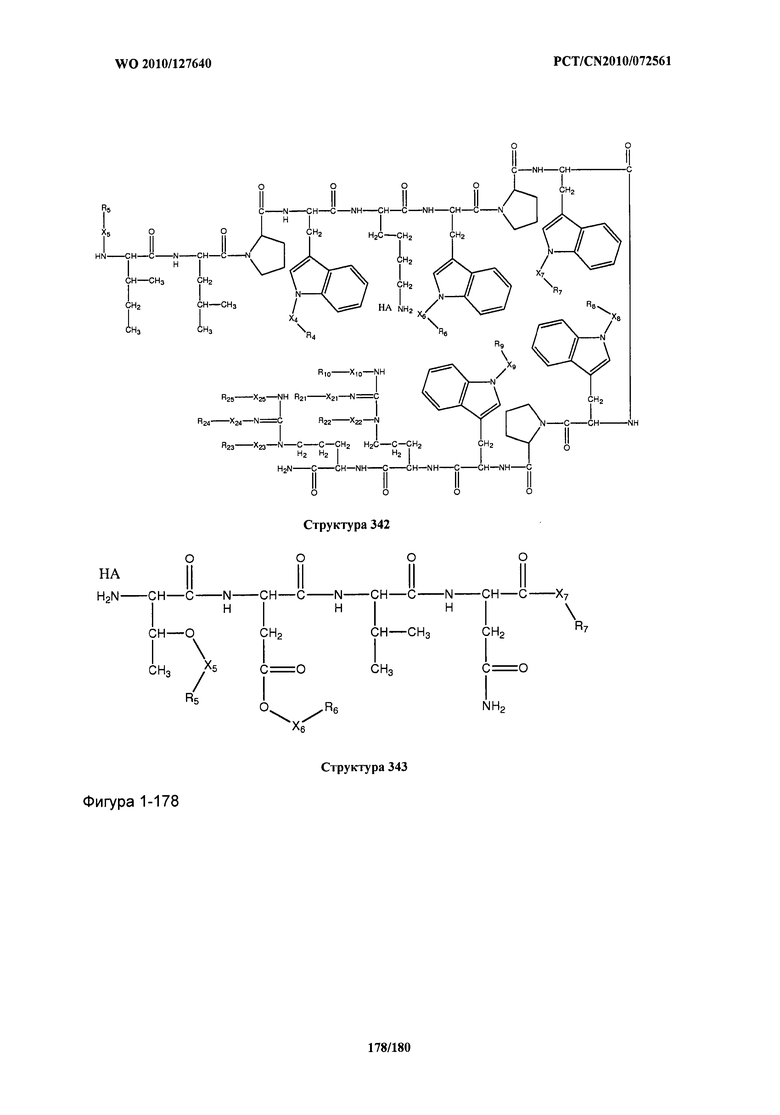

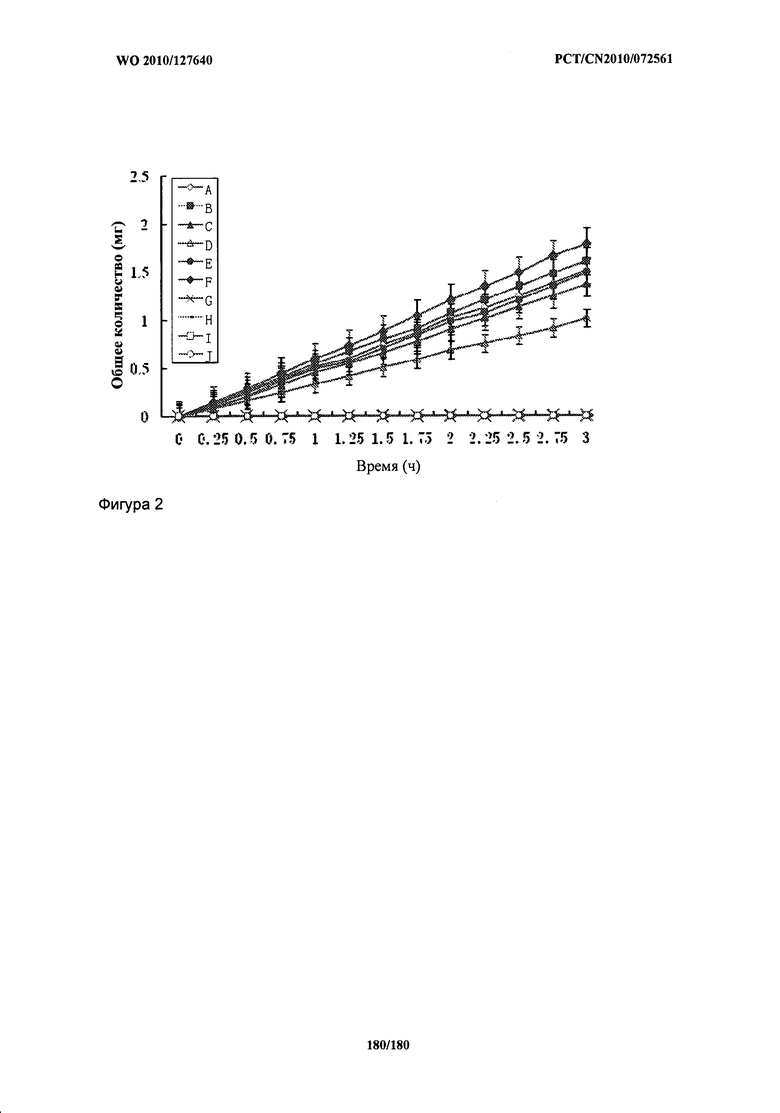
Изобретение относится к композициям с высокой степенью проникновения или пролекарствам с высокой степенью проникновения на основе пептида или родственного пептиду соединения, которые содержат функциональную единицу, линкер и транспортную единицу. Функциональная единица ковалентно связана с транспортной единицей посредством линкера и содержит фрагмент пептида или родственного пептиду соединения. Транспортная единица содержит способную к протонированию аминогруппу. Линкер содержит химическую связь, способную к расщеплению после проникновения композиции через биологический барьер. 6 н. и 21 з.п. ф-лы, 2 ил., 16 табл., 6 пр.
1. Композиция с высокой степенью проникновения для предупреждения и/или лечения состояния или заболевания, поддающегося лечению исходными пептидами или родственными пептидам соединениями, содержащая структуру, выбранную из группы, состоящей из следующих структур:
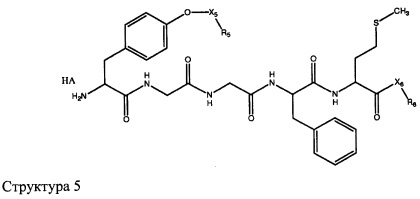
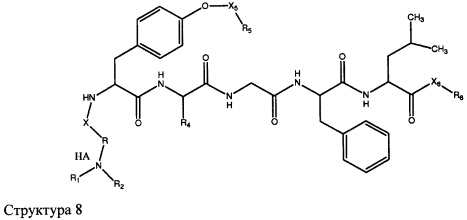
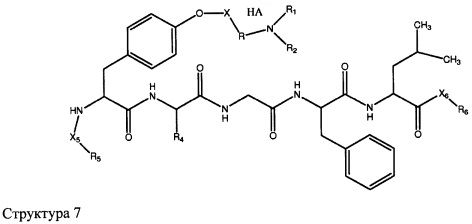
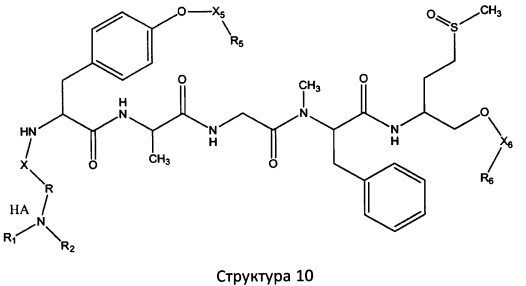
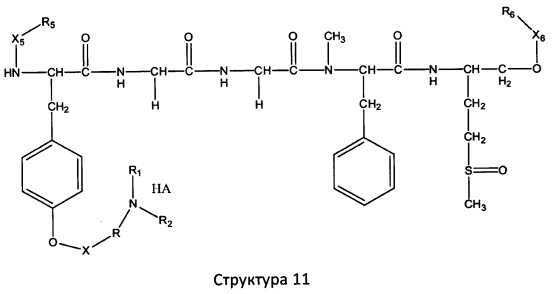
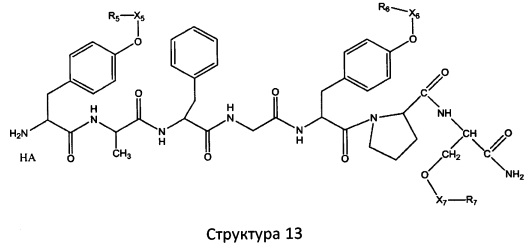
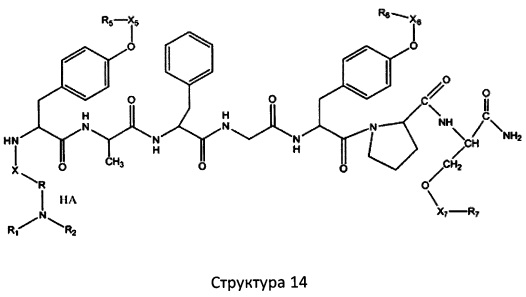
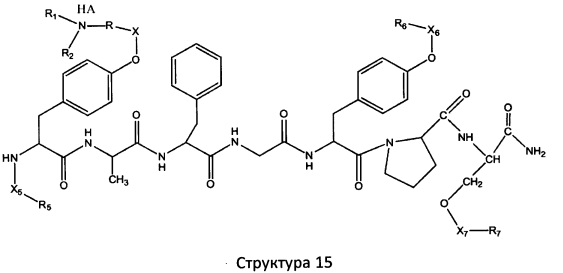
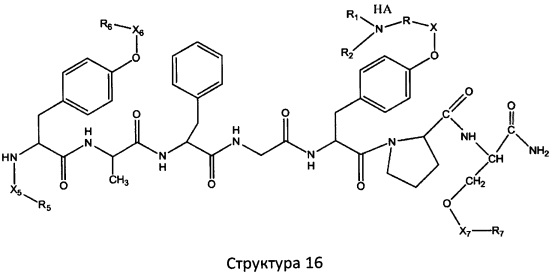
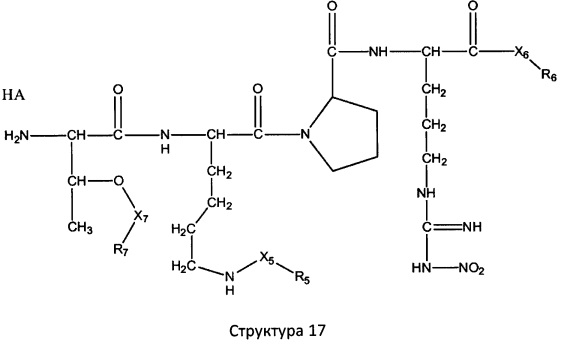
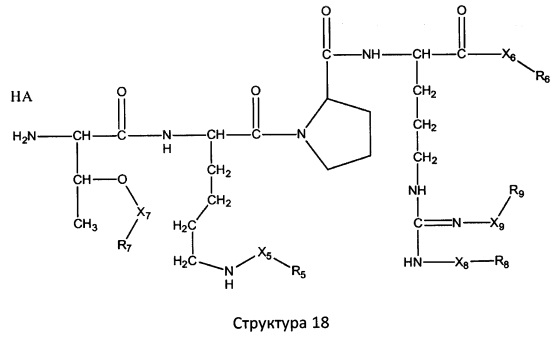
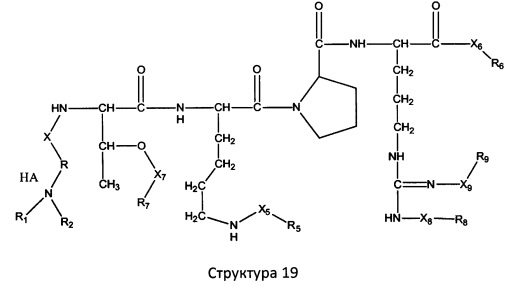
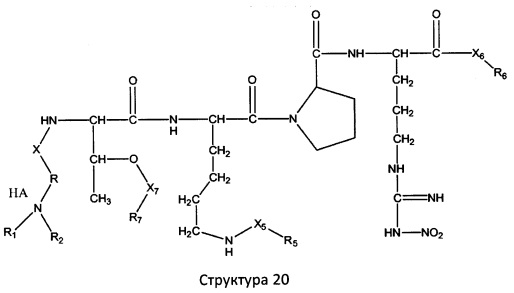
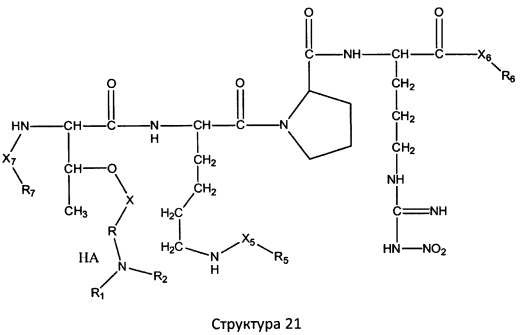
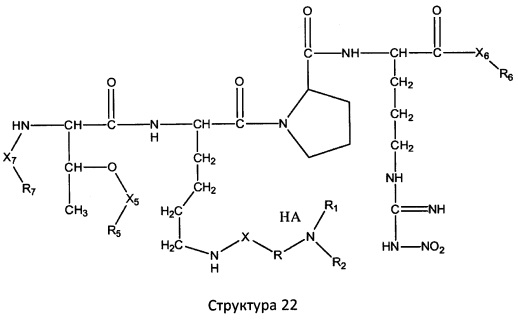
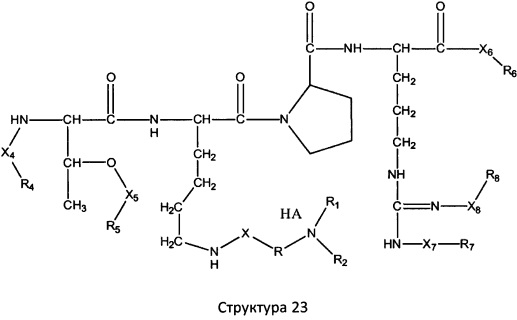
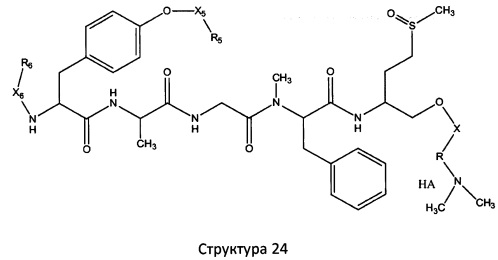
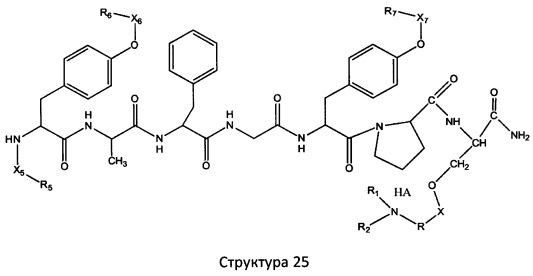
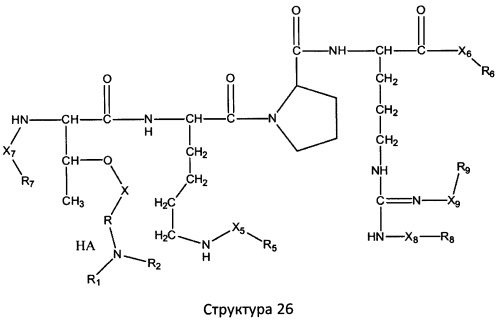
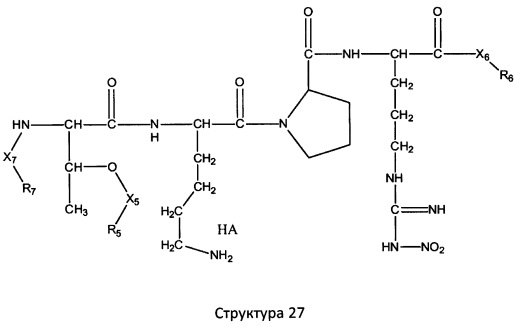
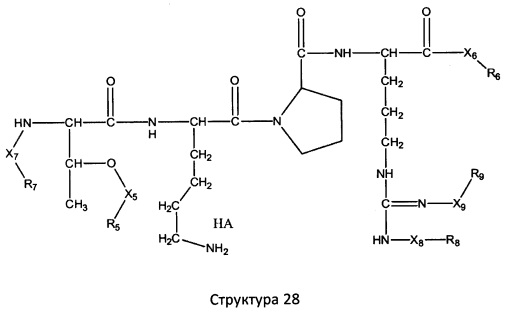
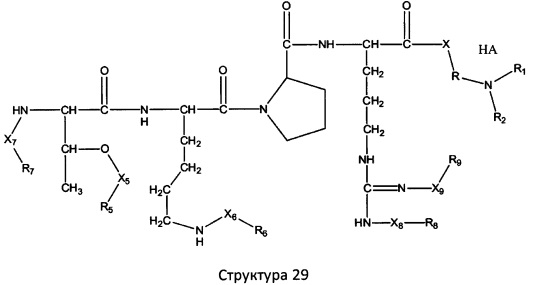
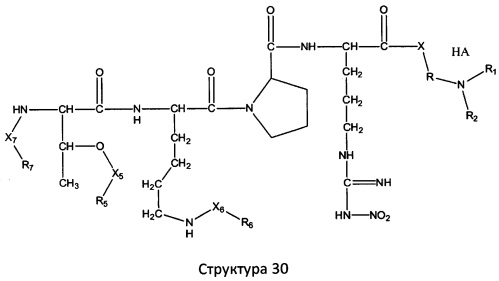
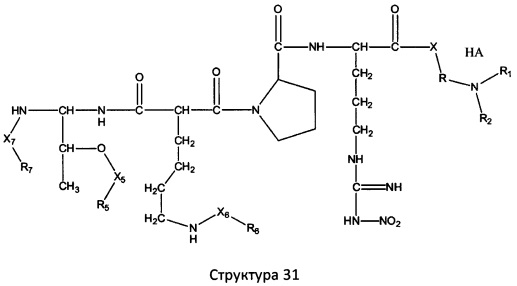
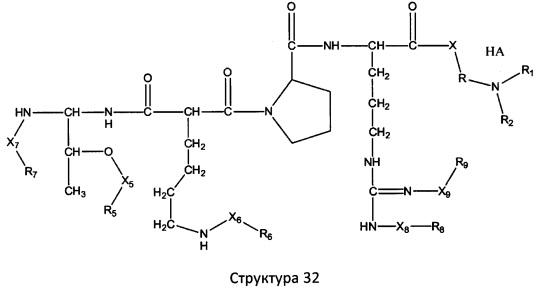
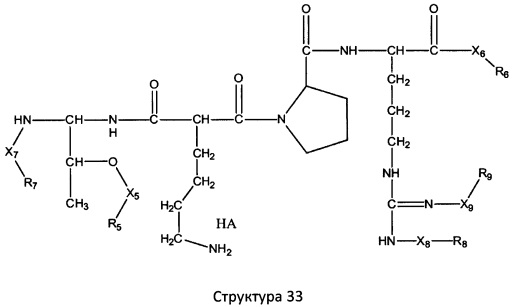
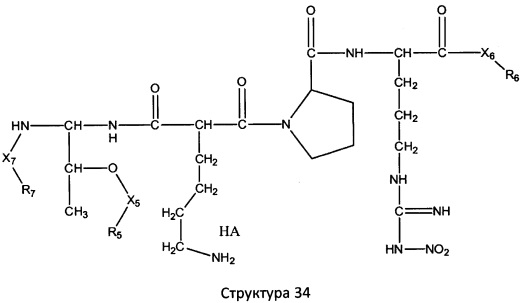
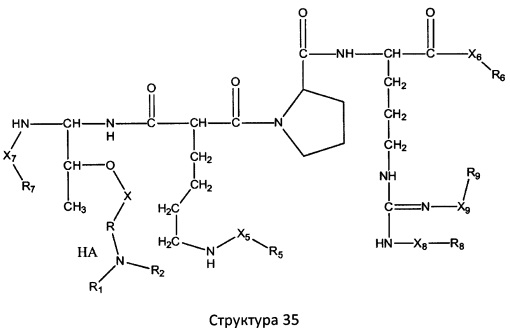
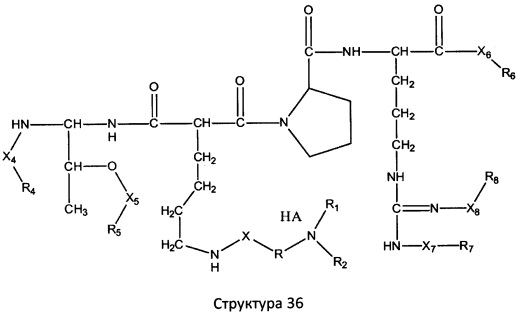
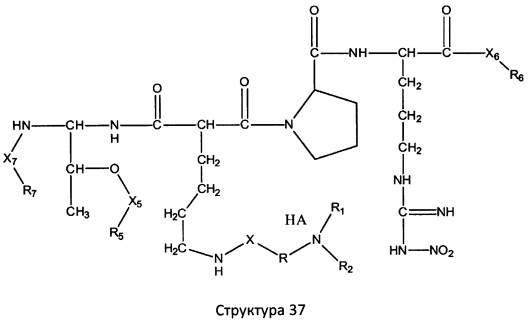
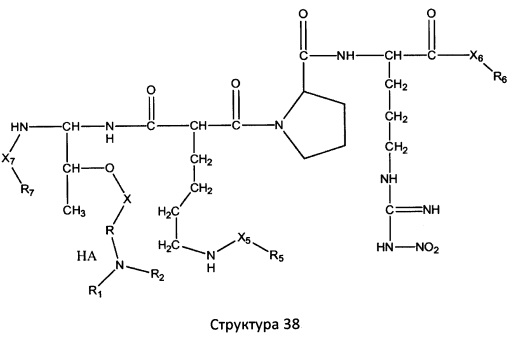
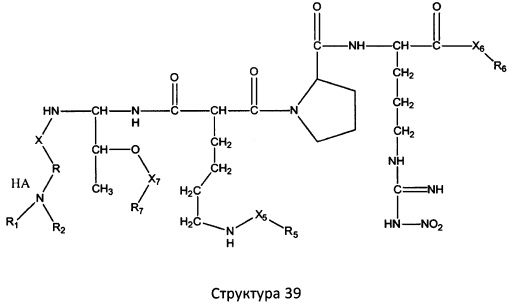
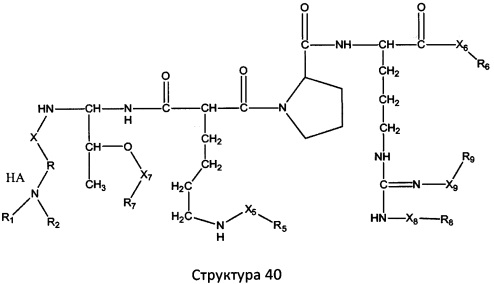
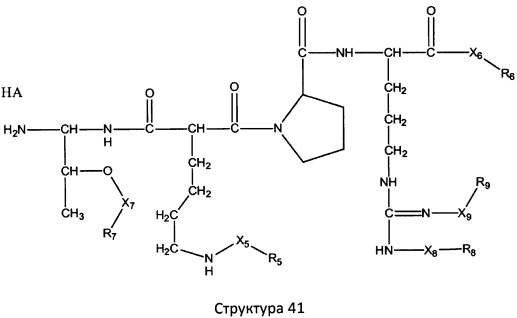
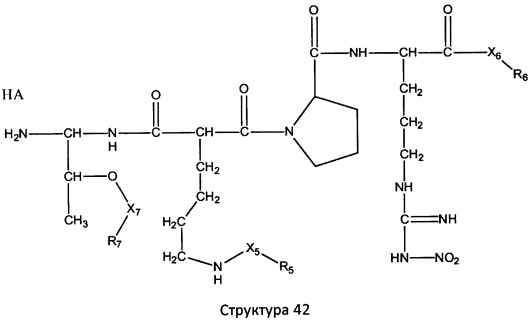
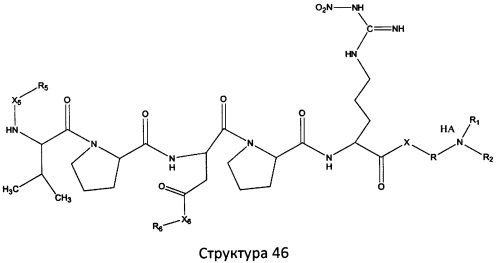
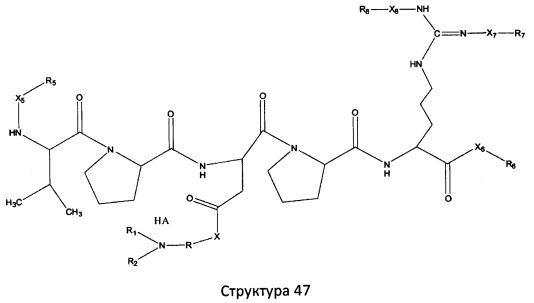
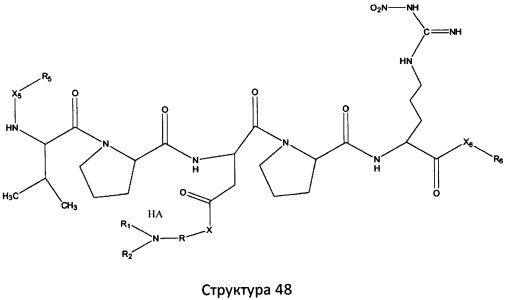
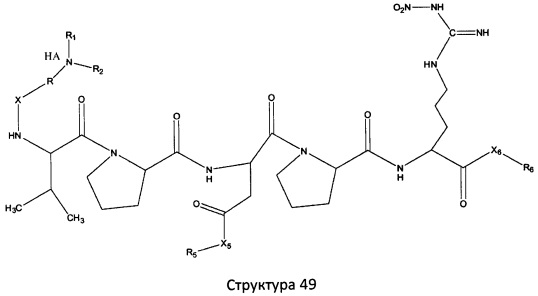
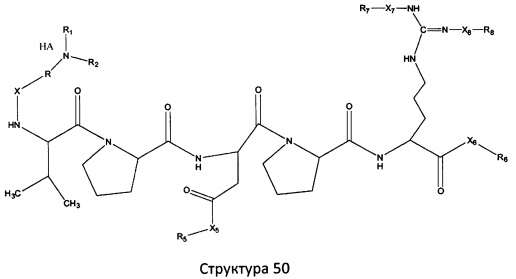
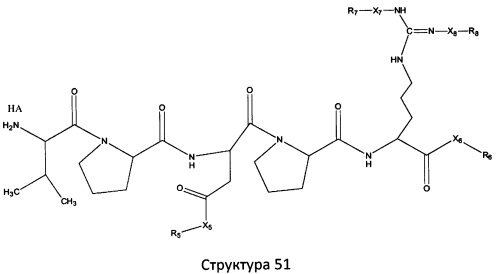
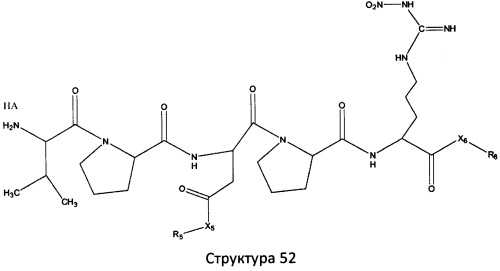
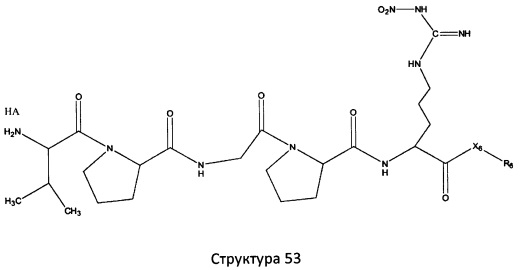
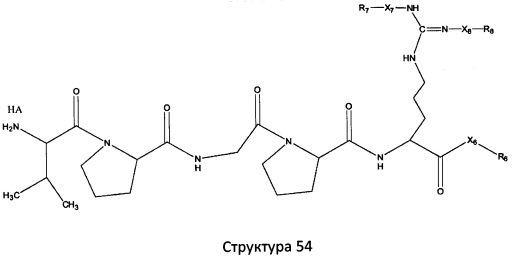
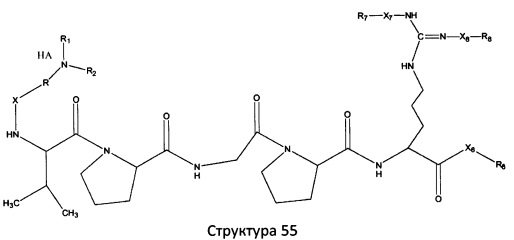
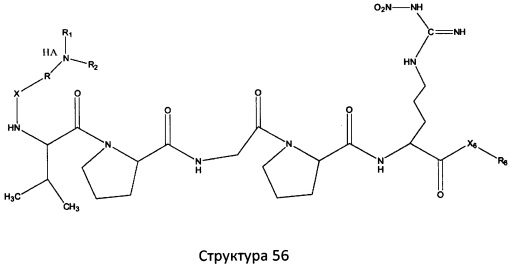
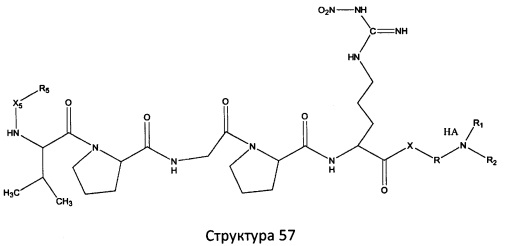
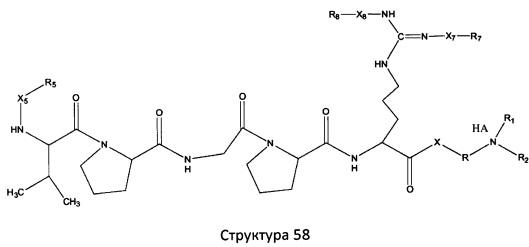
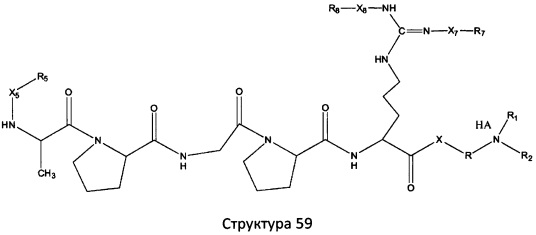
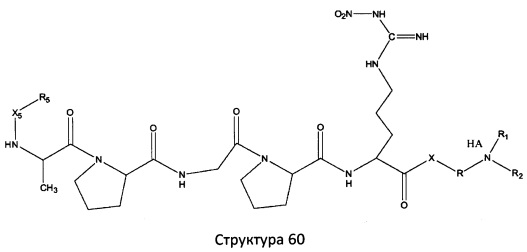
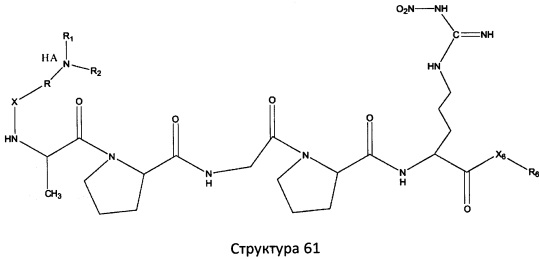
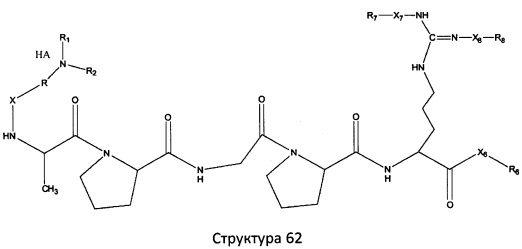
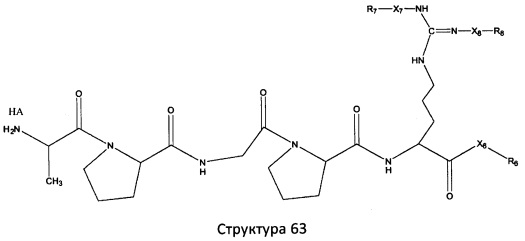
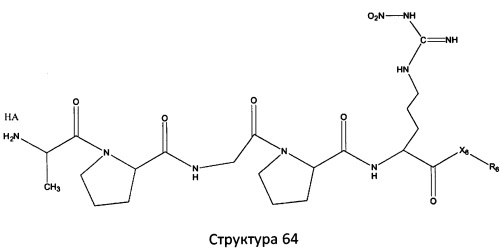
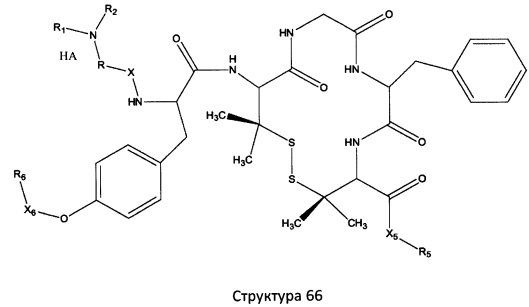
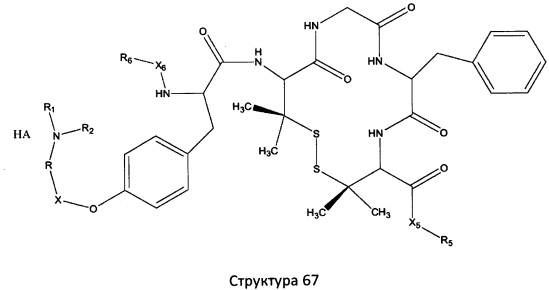
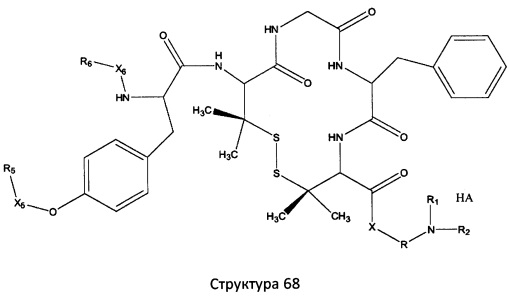
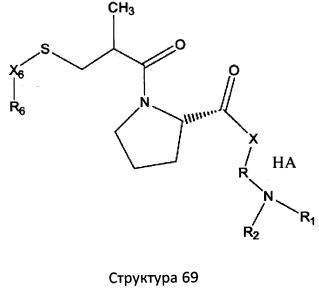
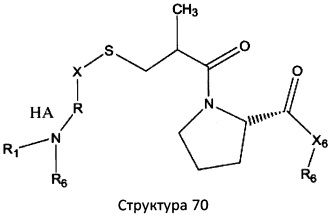
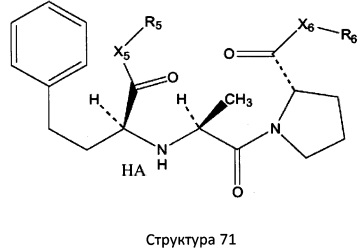
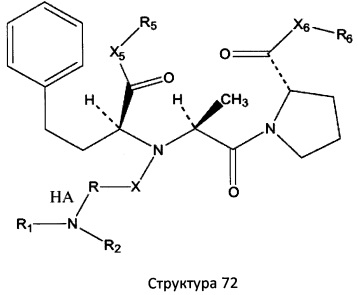
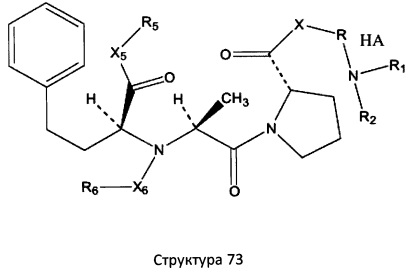
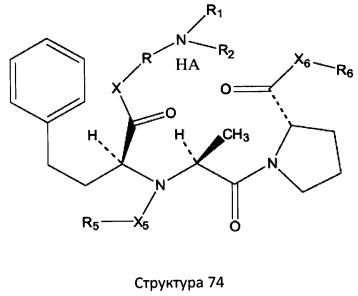
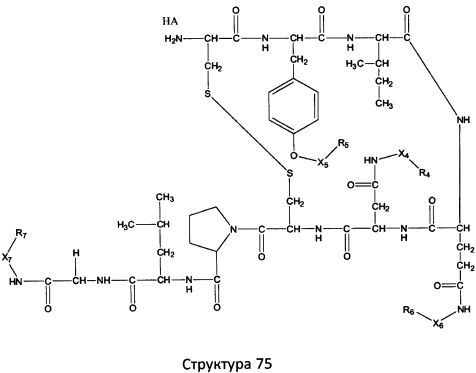
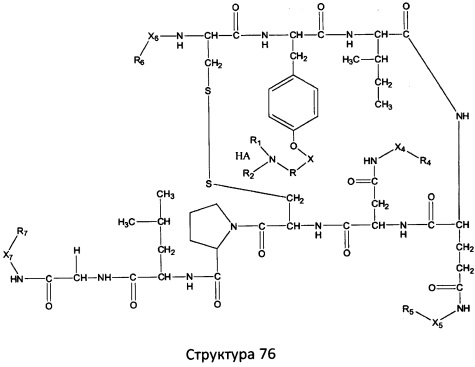
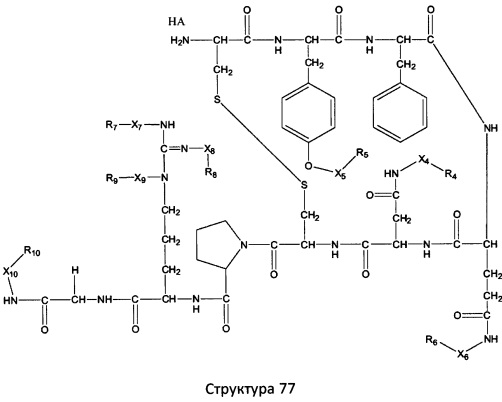
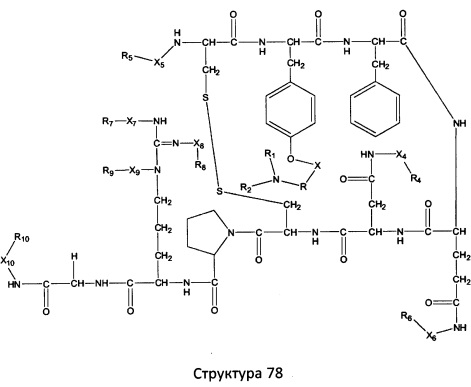
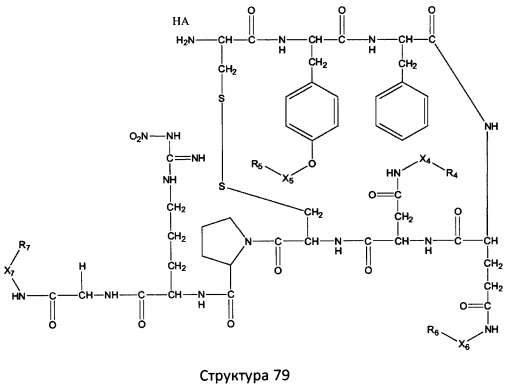
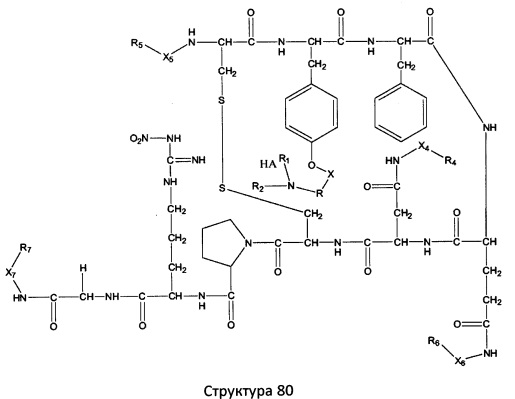
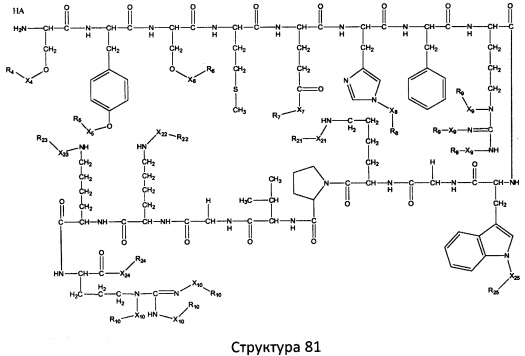
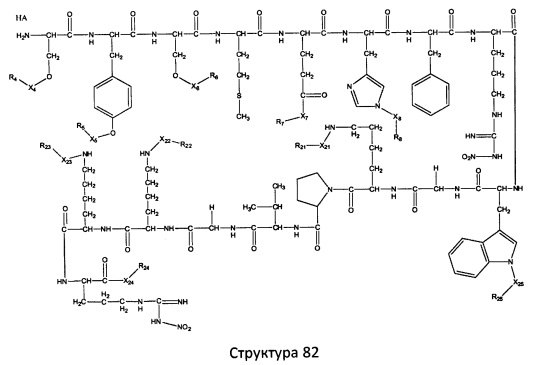
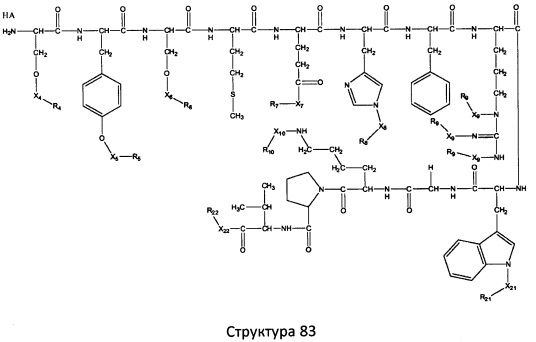
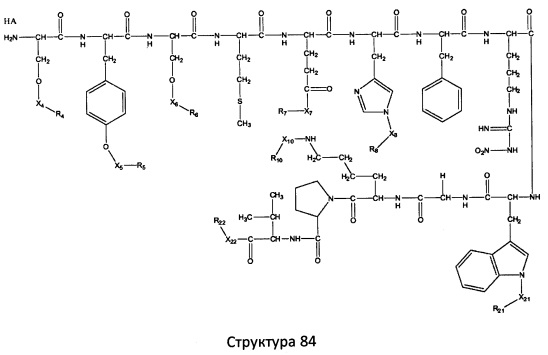
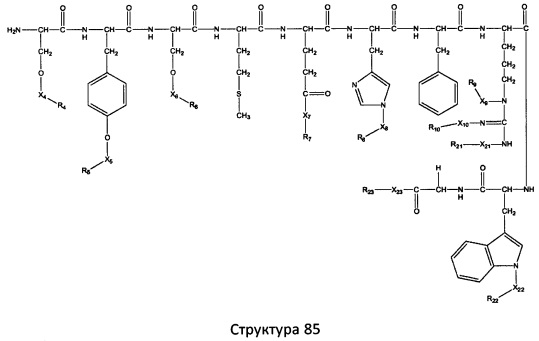
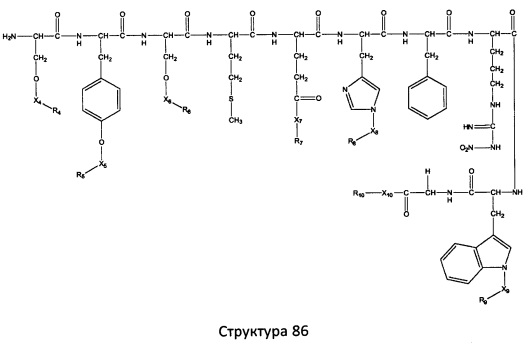
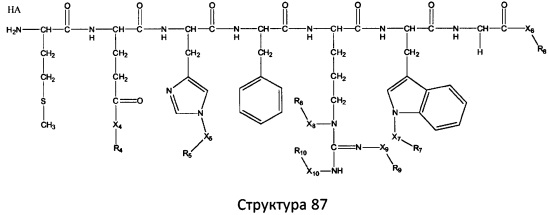
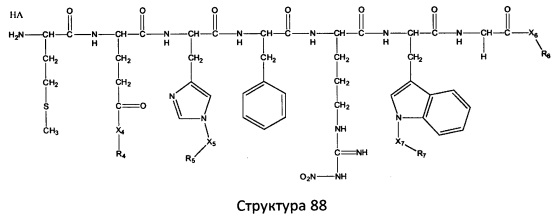
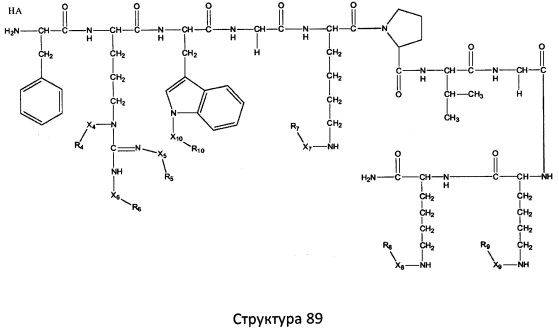
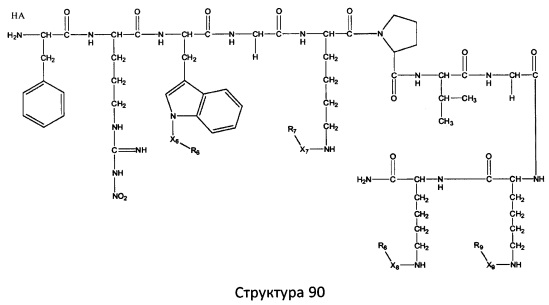
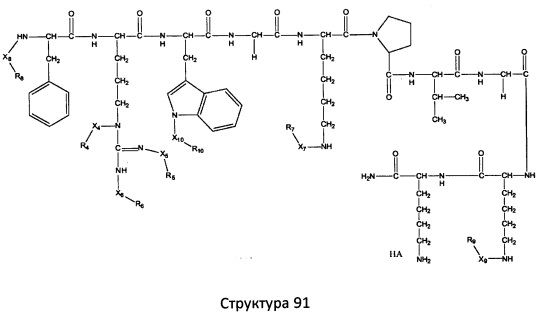
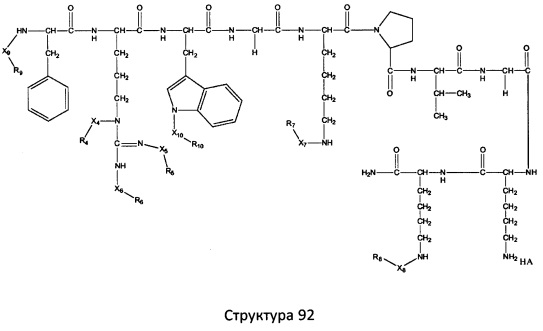
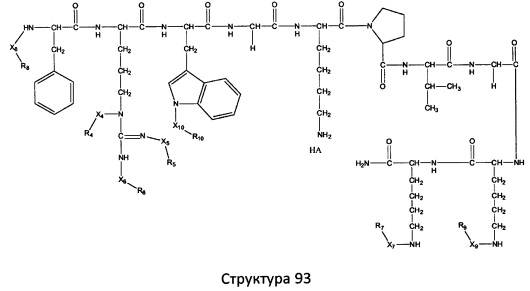
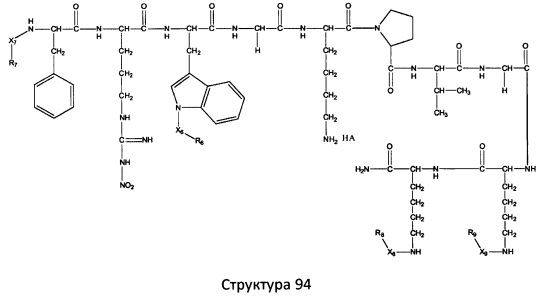
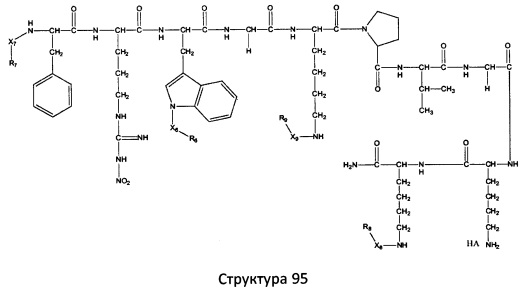
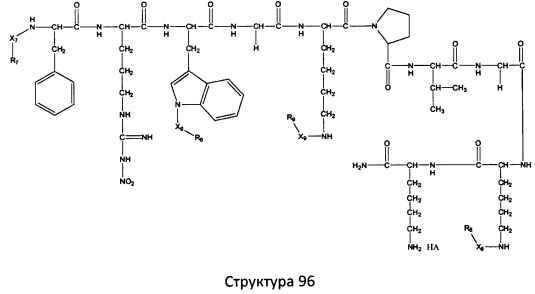
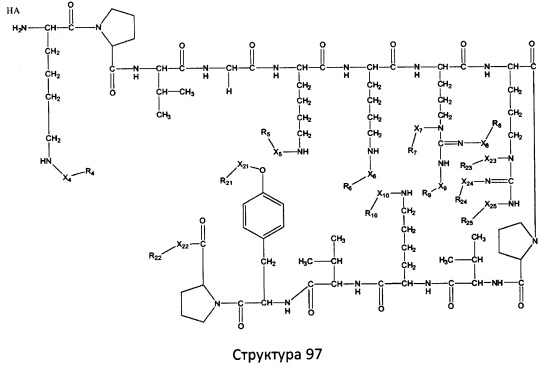
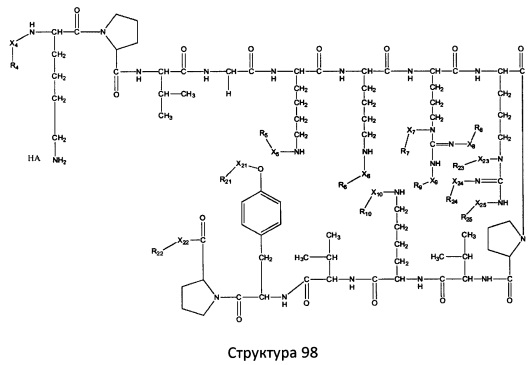
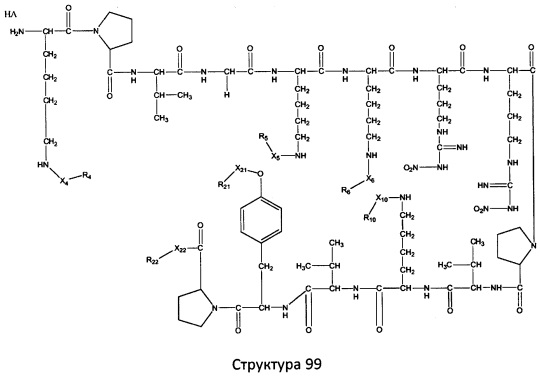
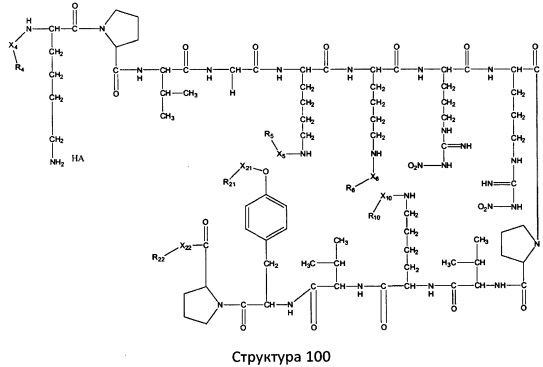
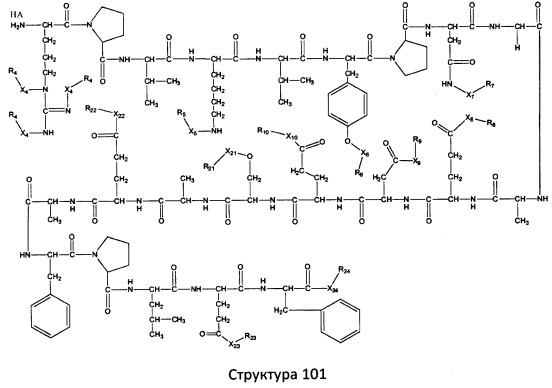
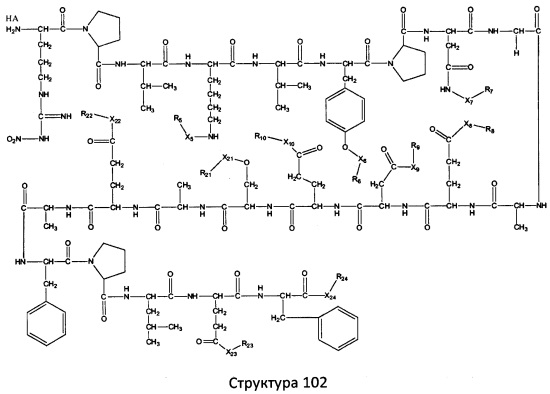
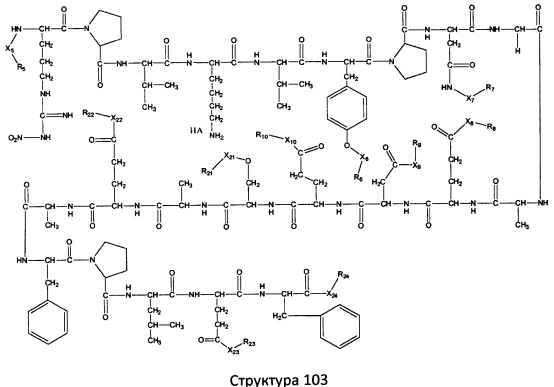
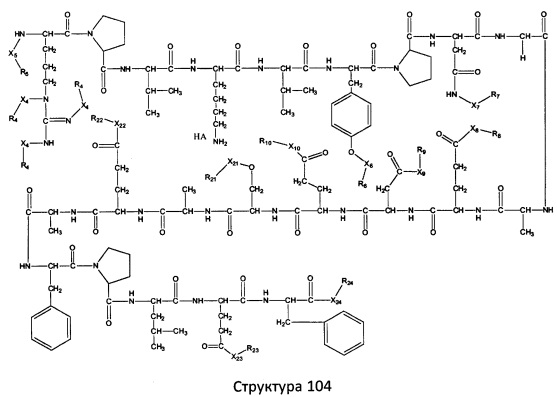
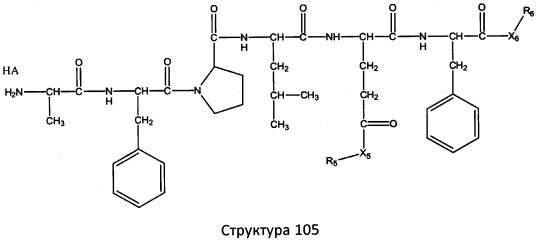
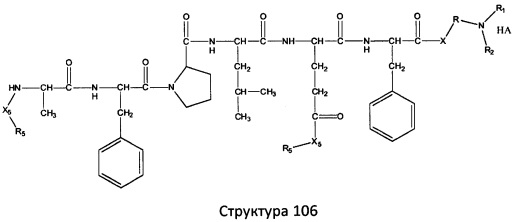
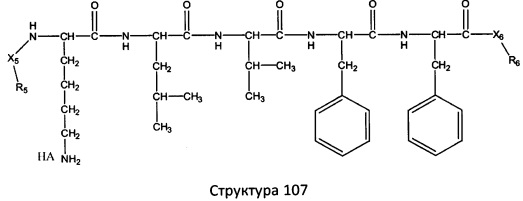
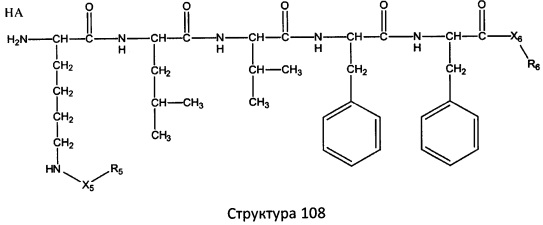
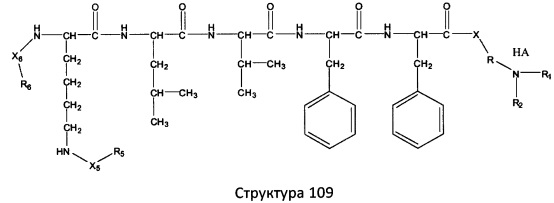
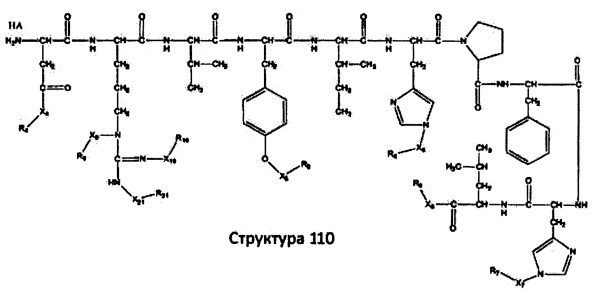
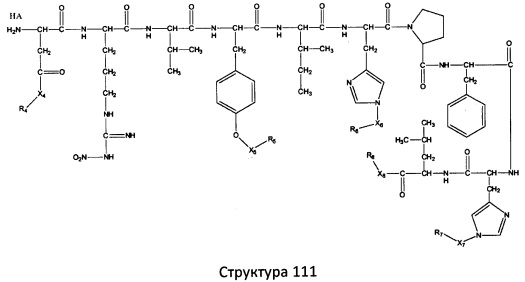
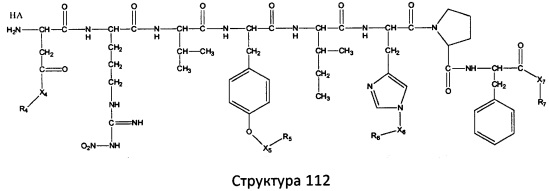
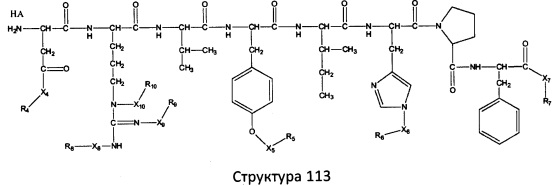
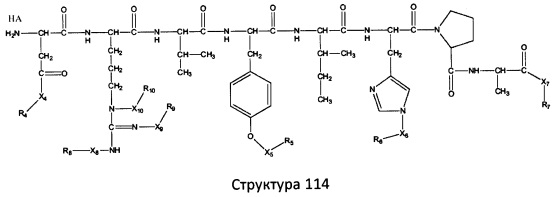
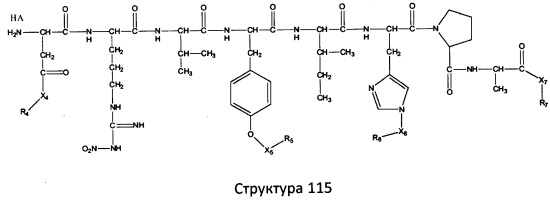
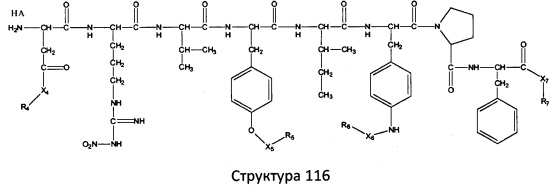
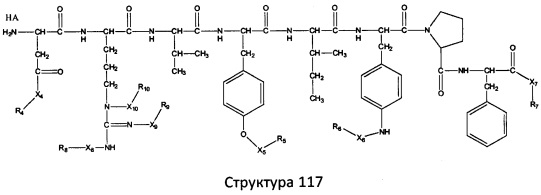
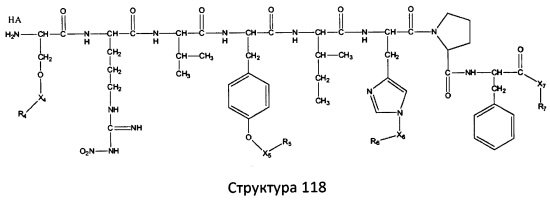
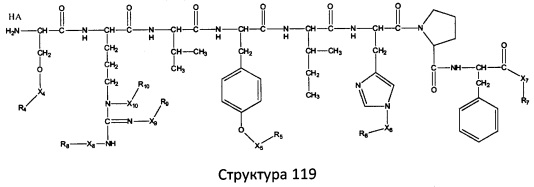
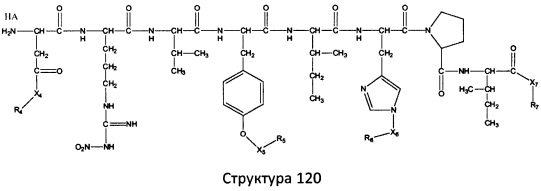
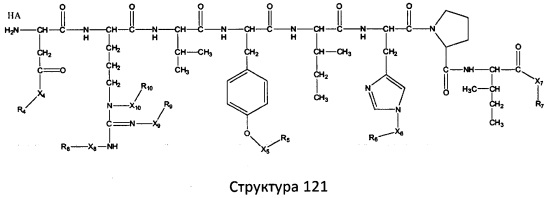
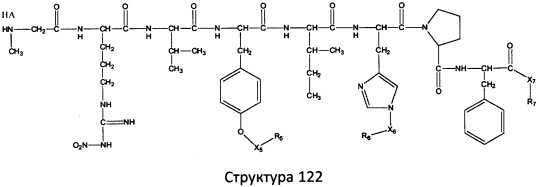
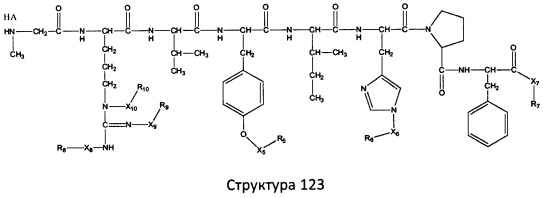
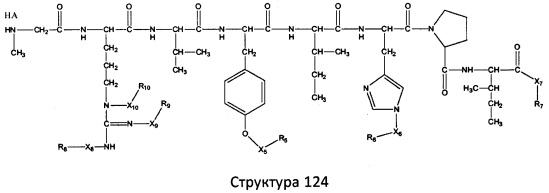
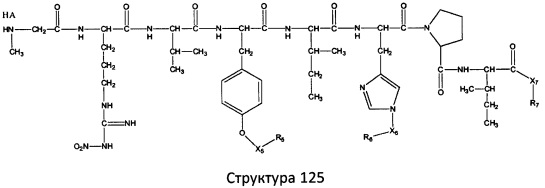
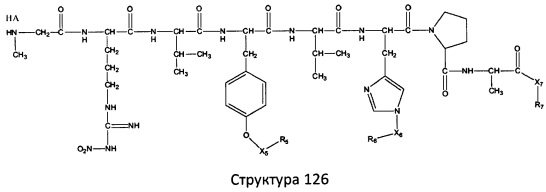
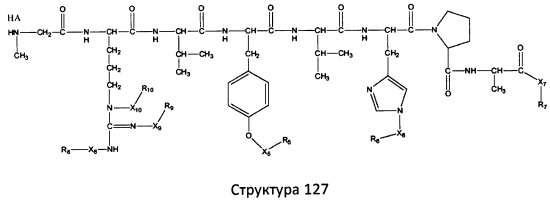
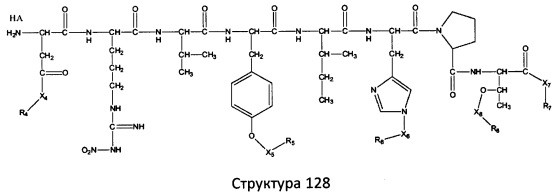
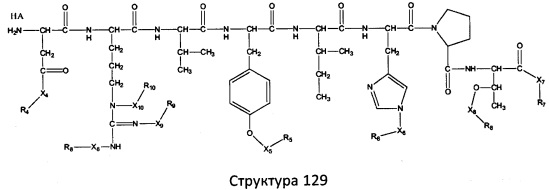
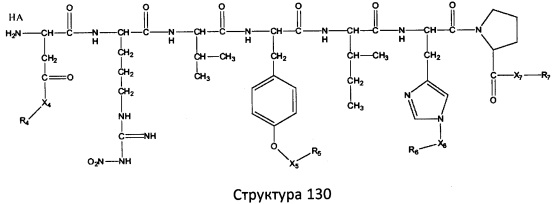
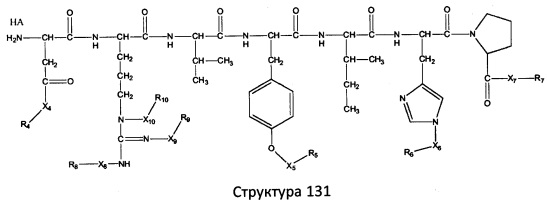
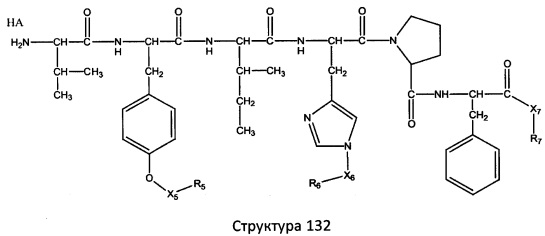
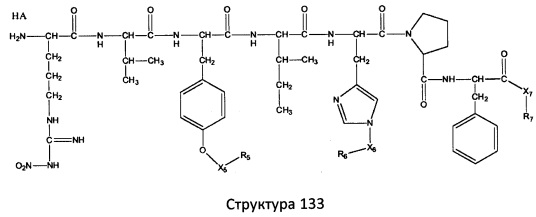
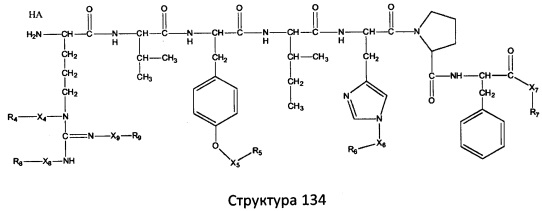
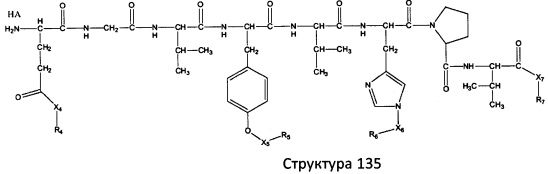
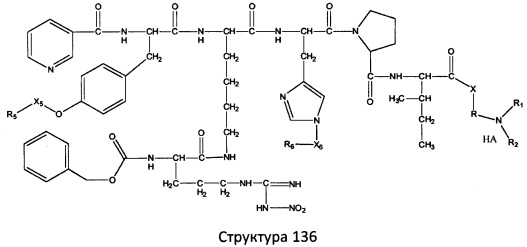
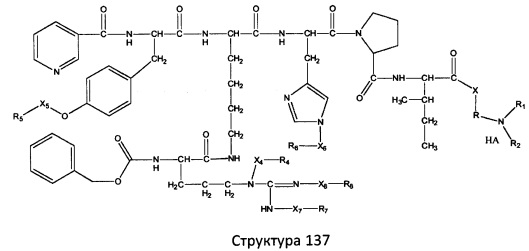
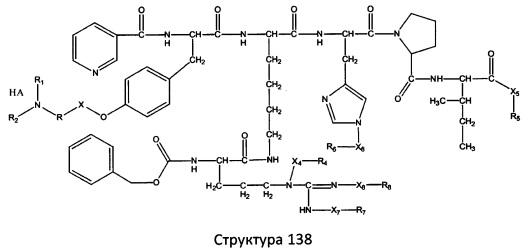
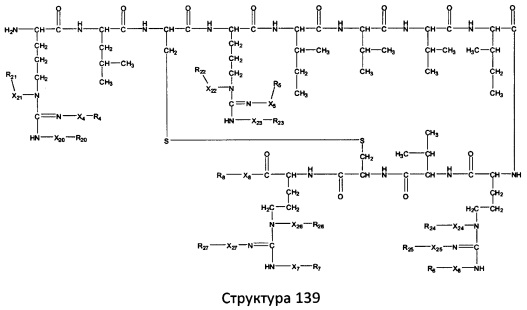
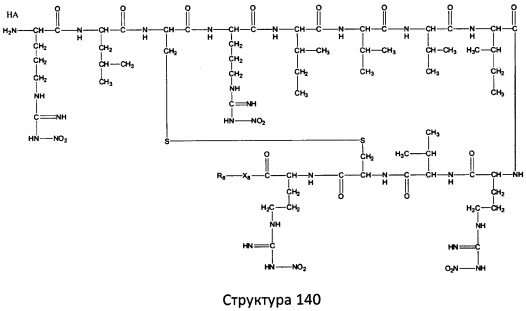
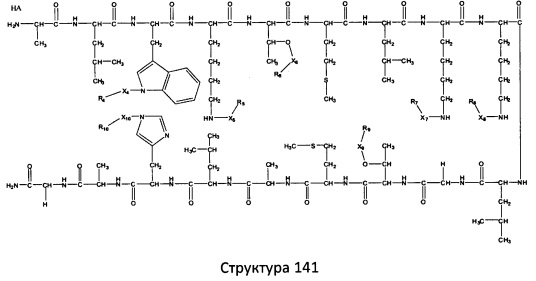
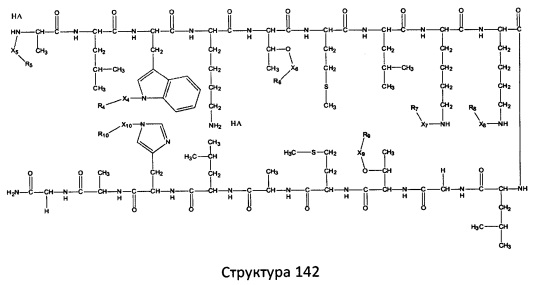
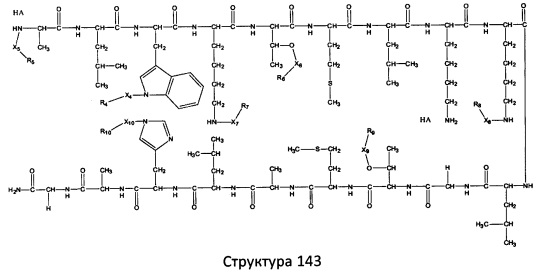
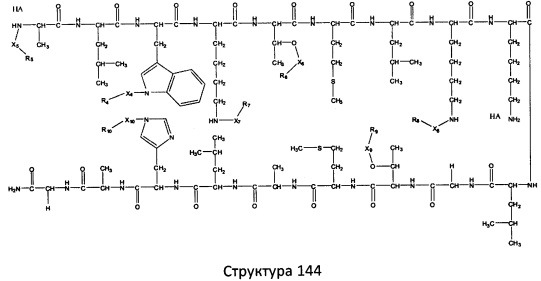
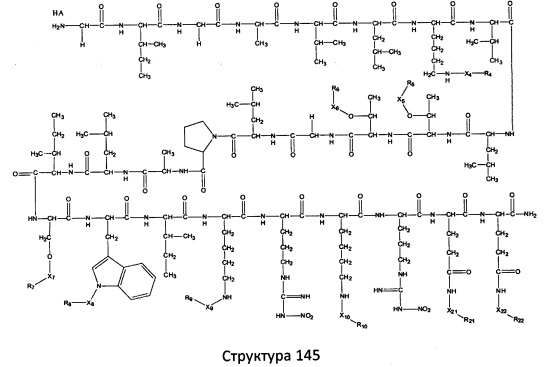
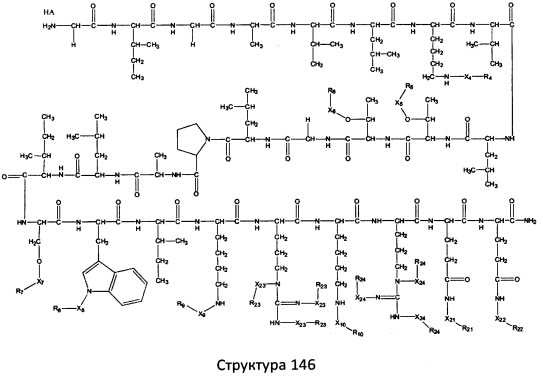
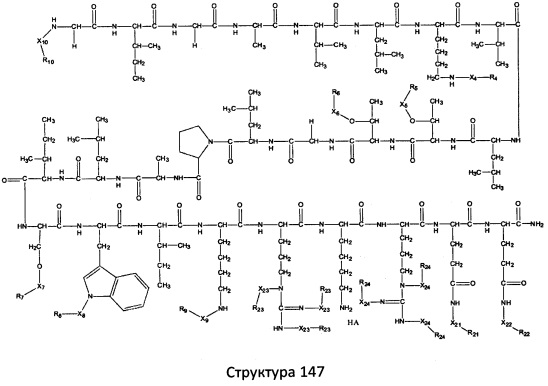
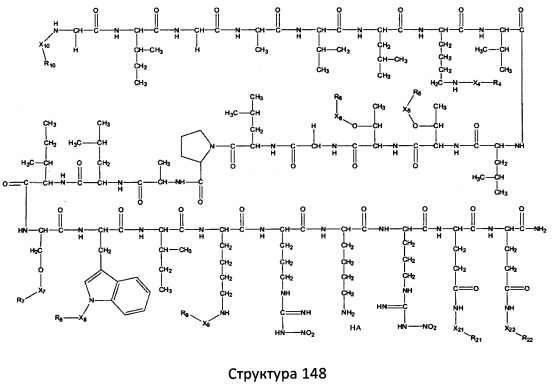
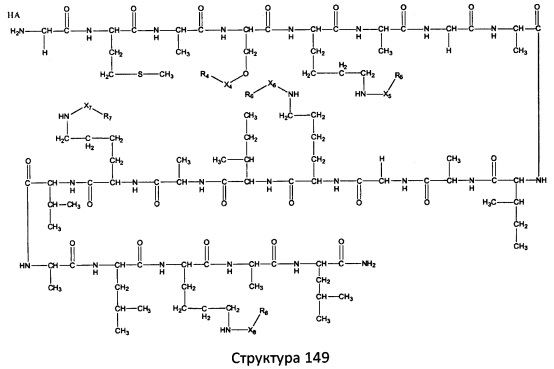
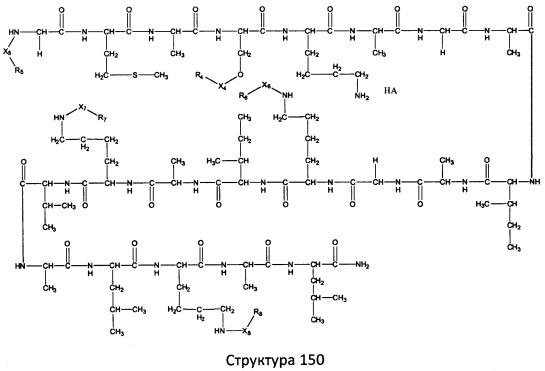
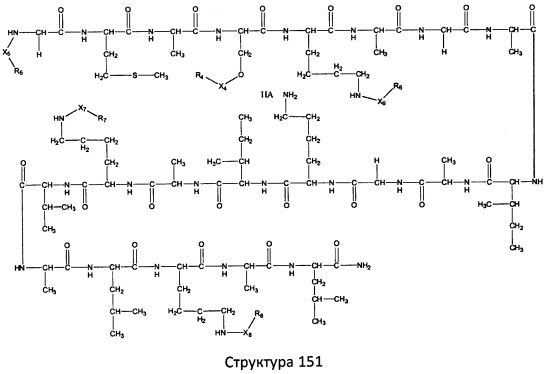
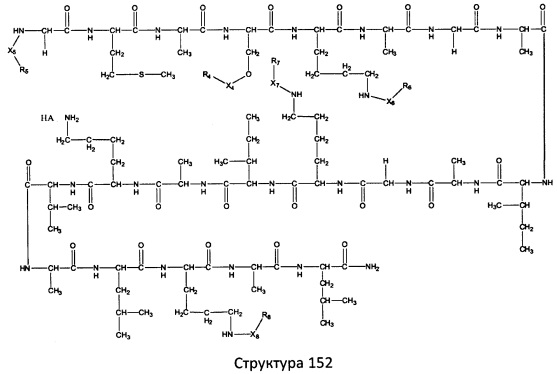
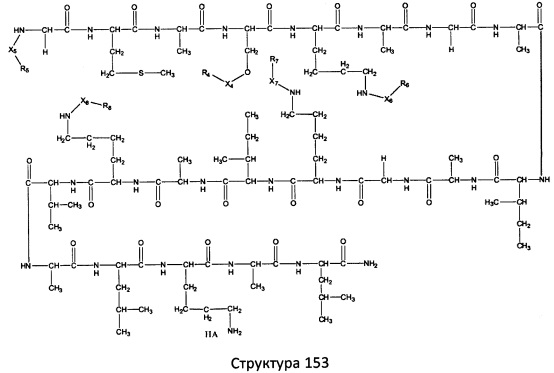
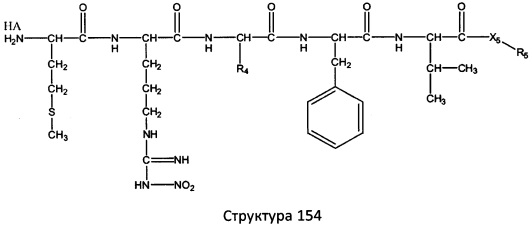
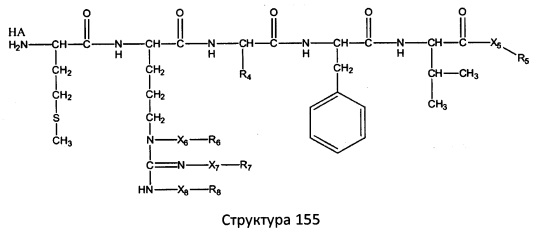
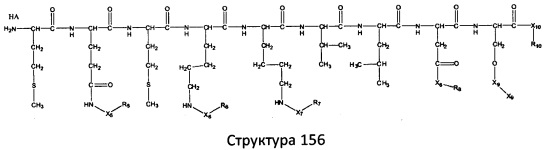
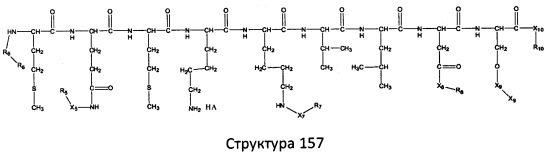
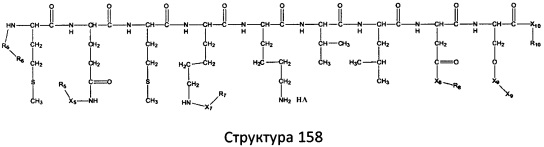
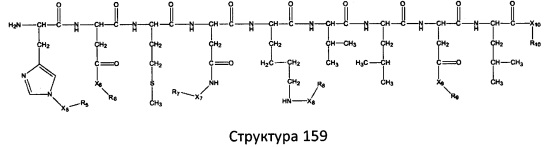
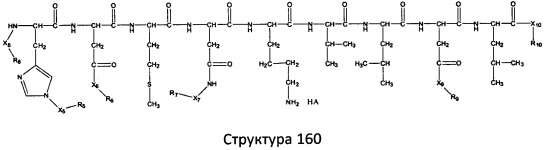
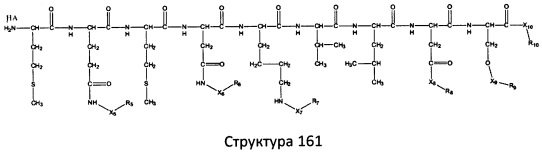
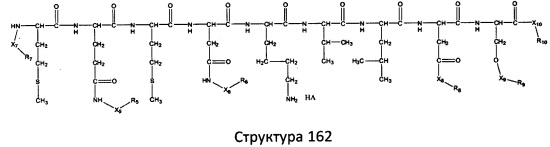
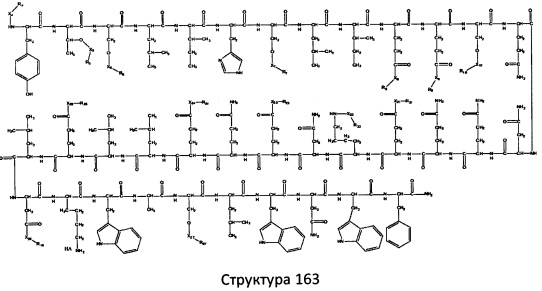
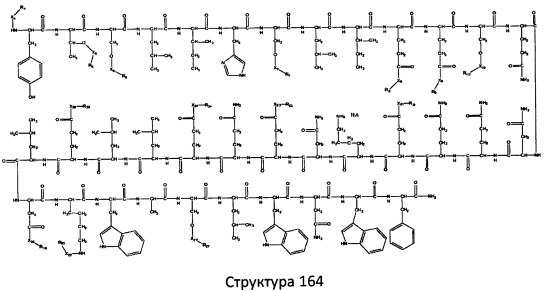
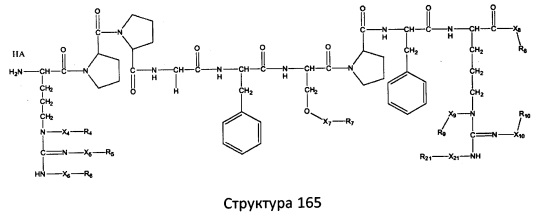
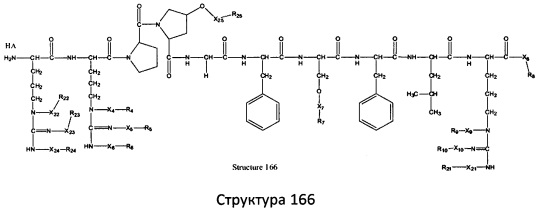
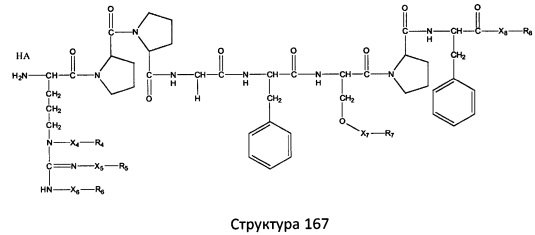
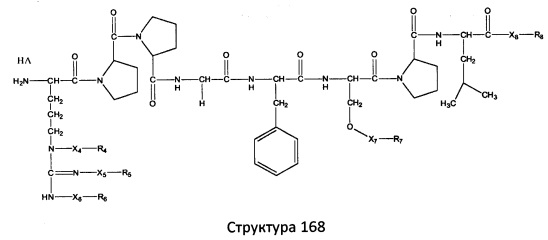
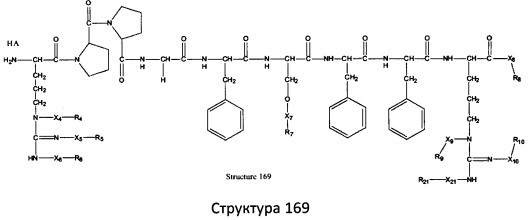
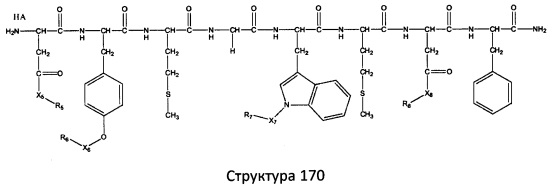
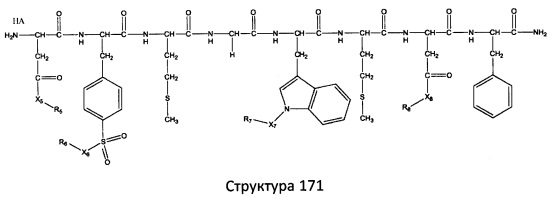
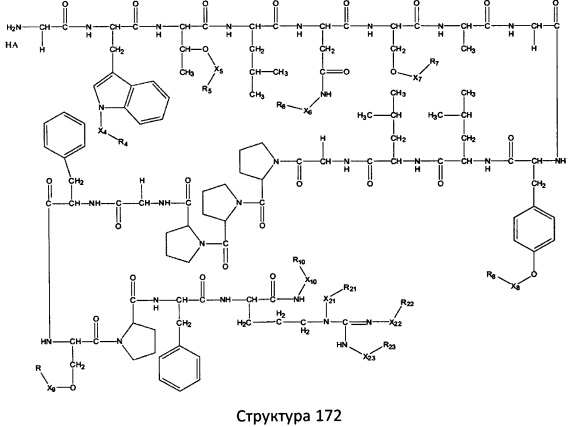
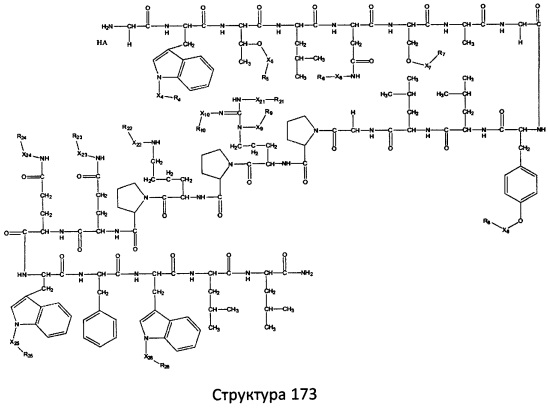
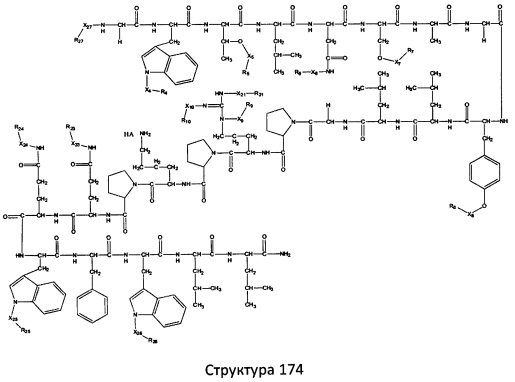
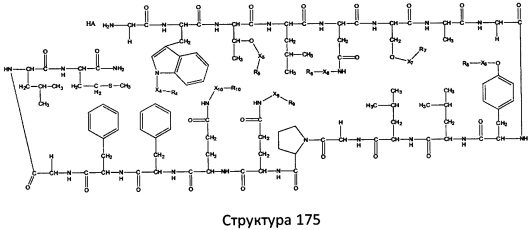
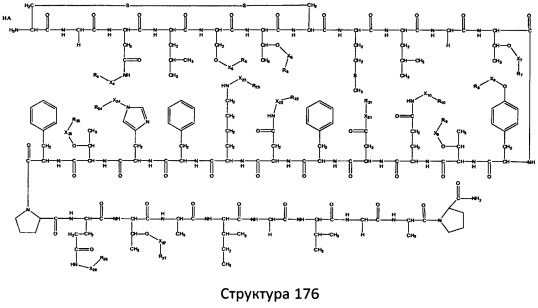
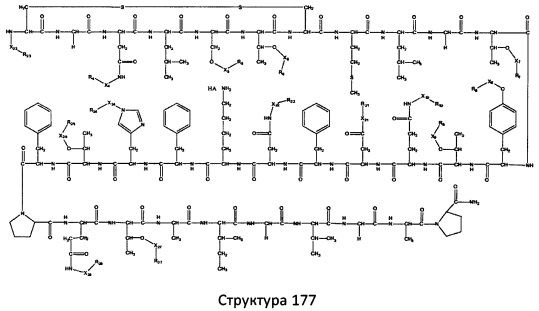
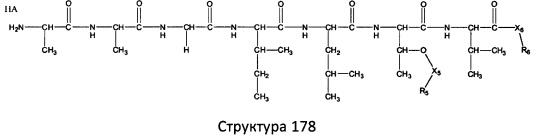
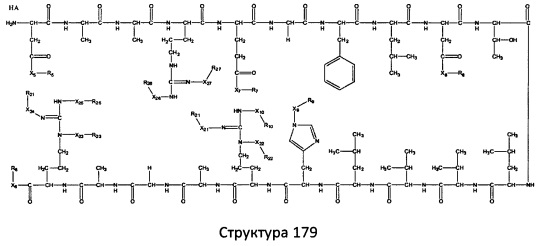
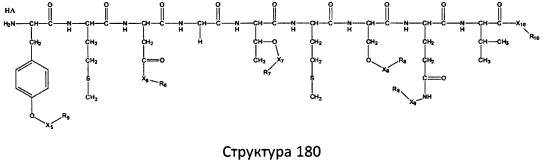
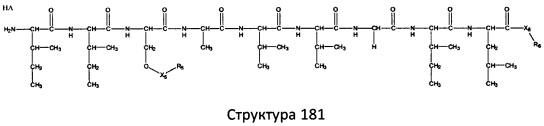
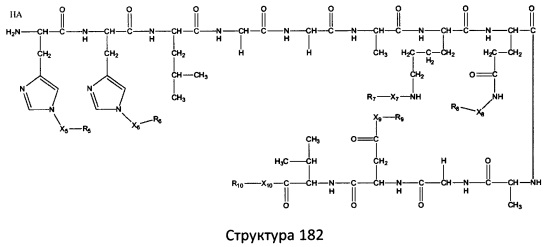
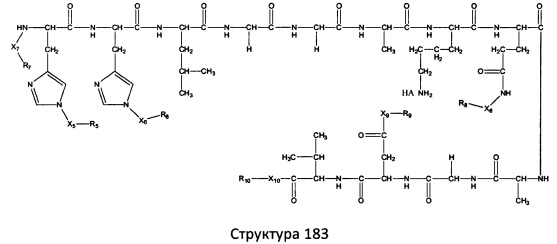
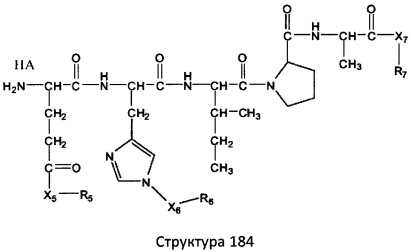
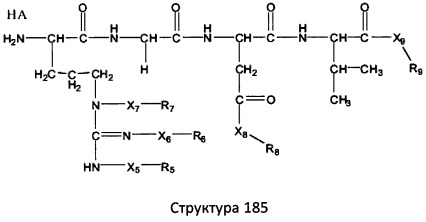
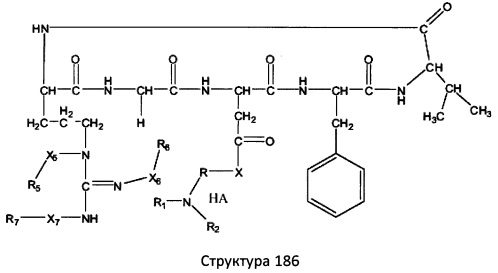
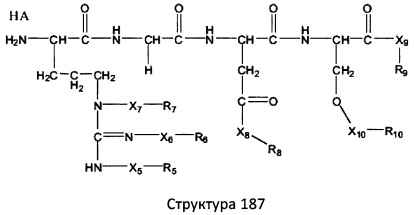
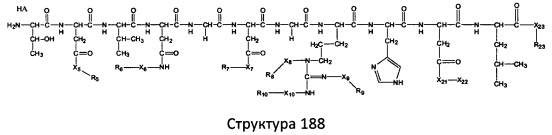
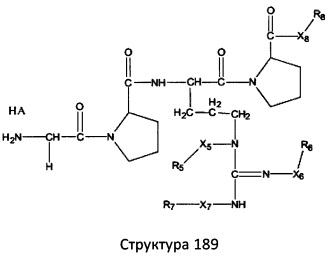
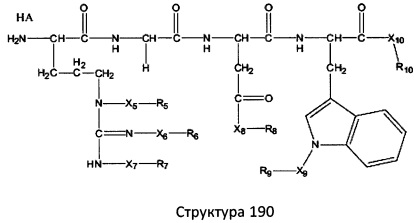
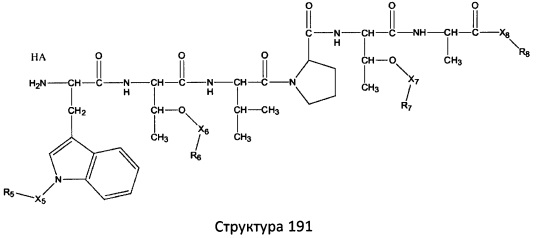
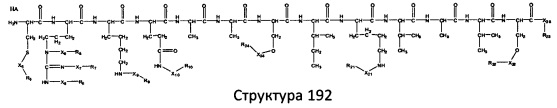
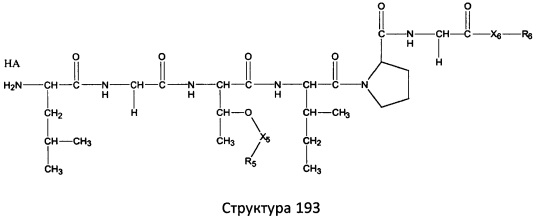
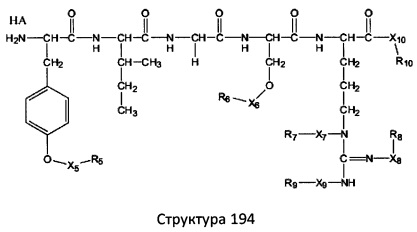
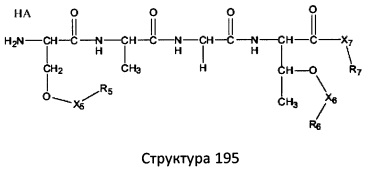
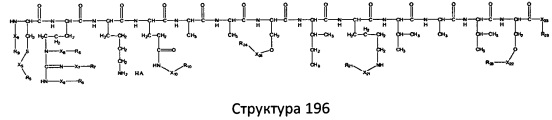
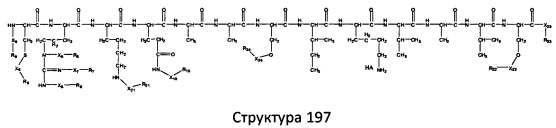
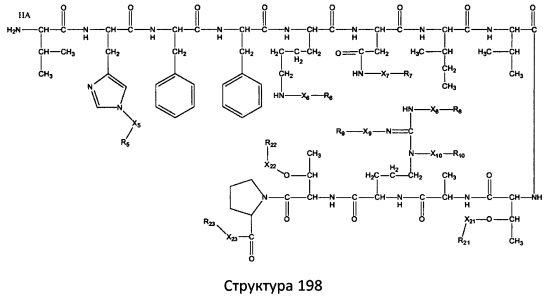
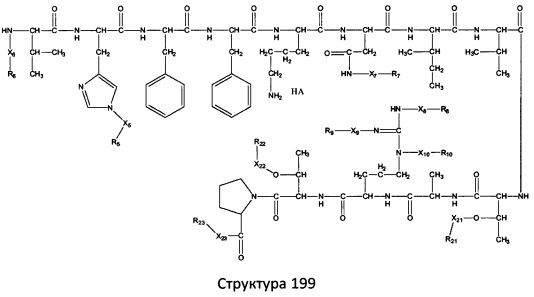
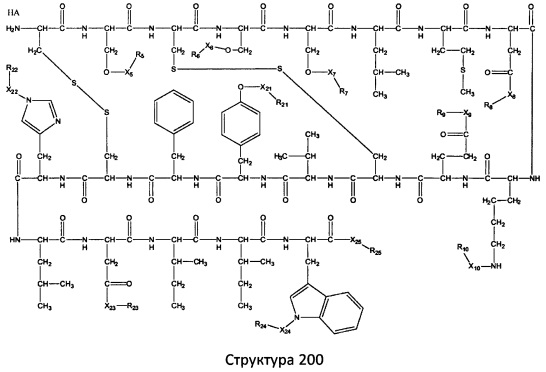
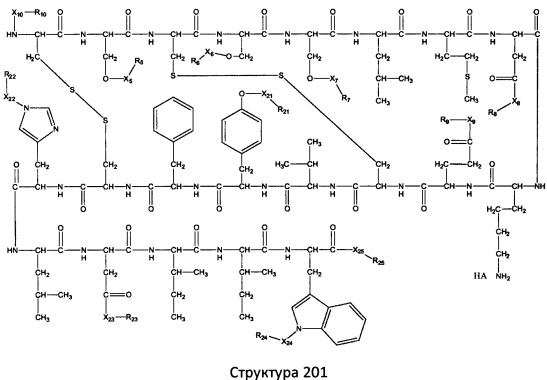
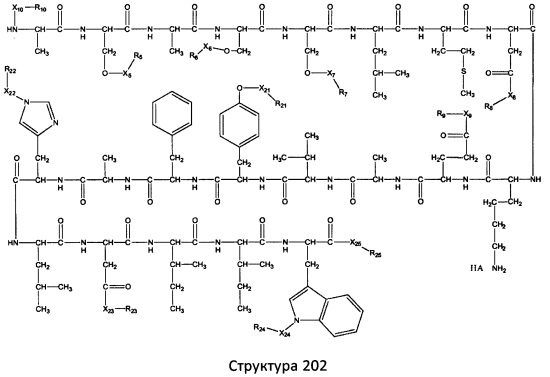
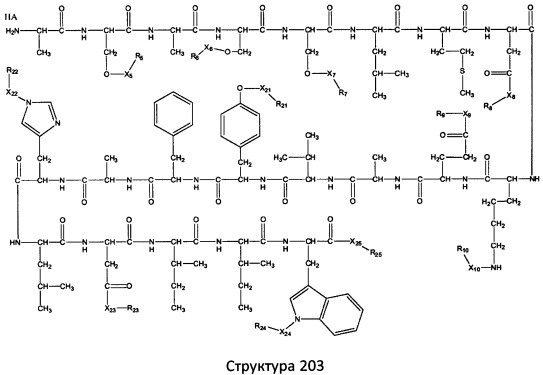
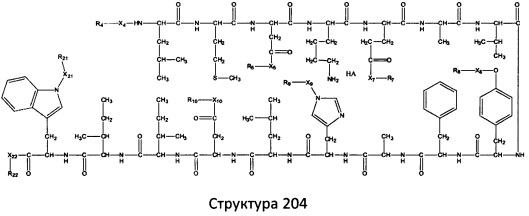
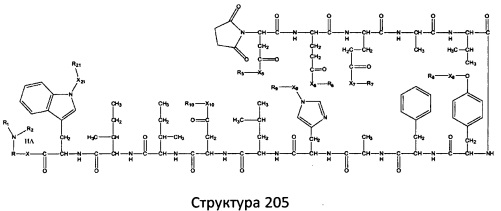
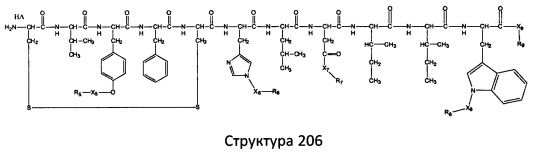
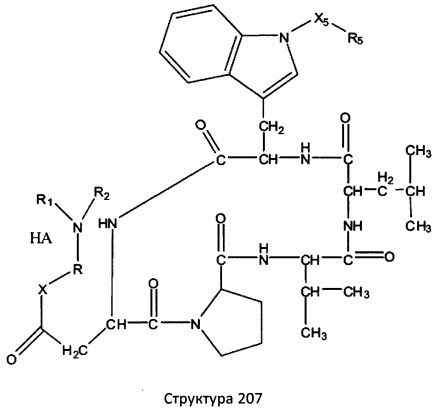
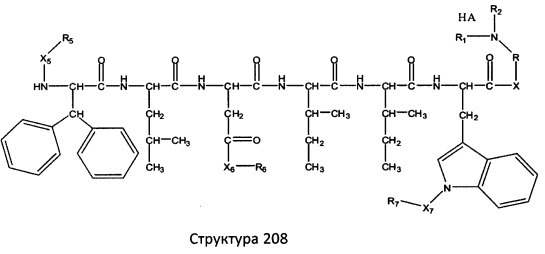
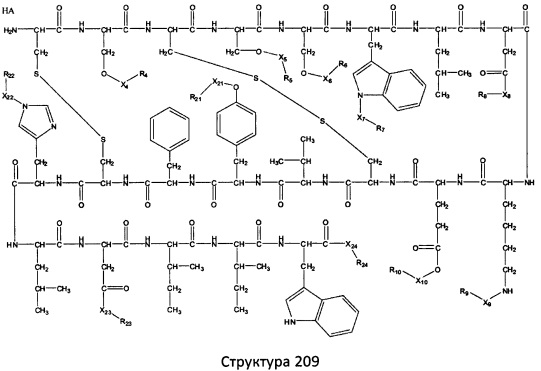
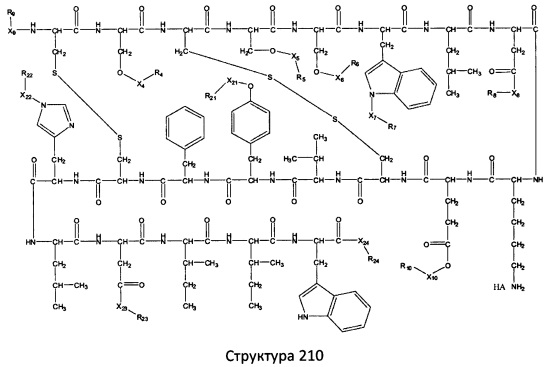
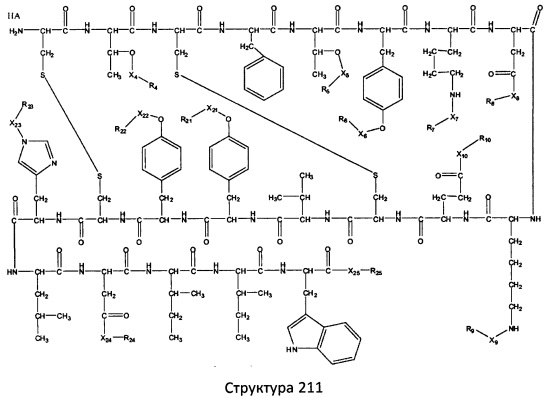
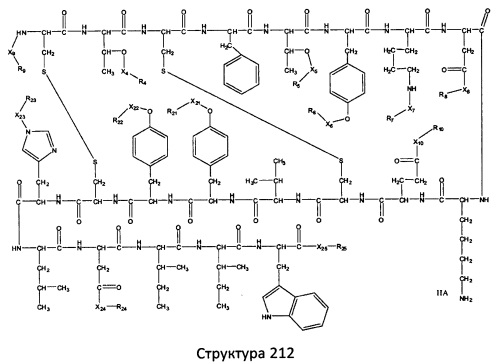
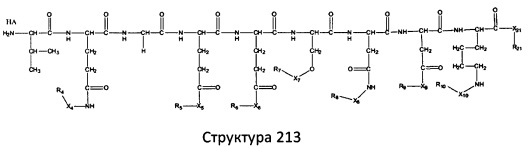
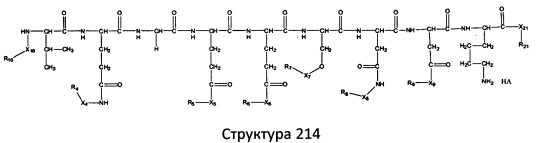
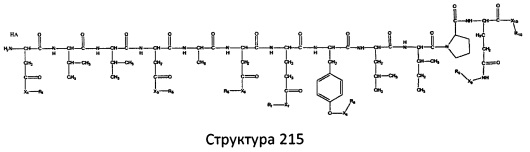
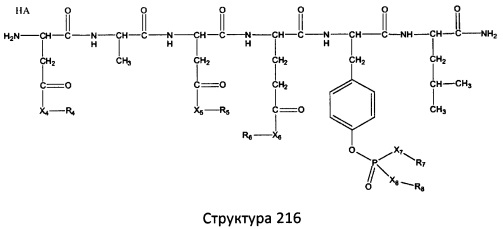

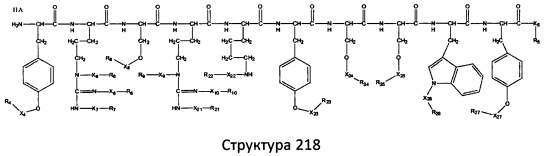
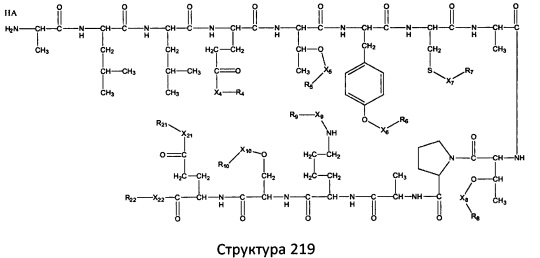
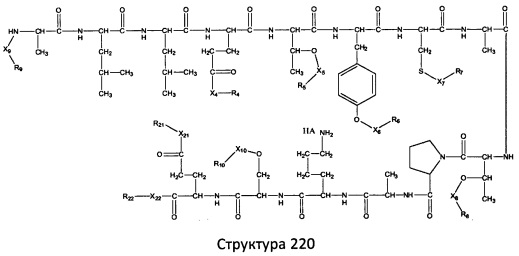
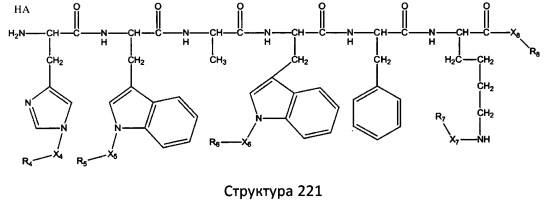
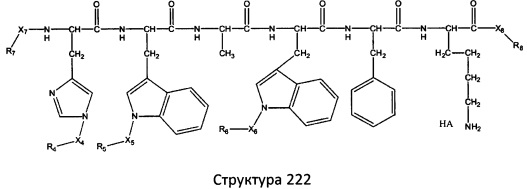
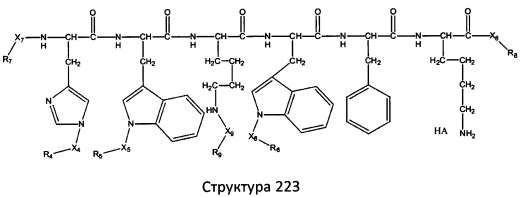
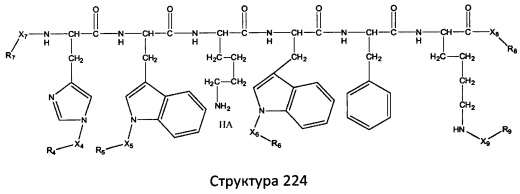
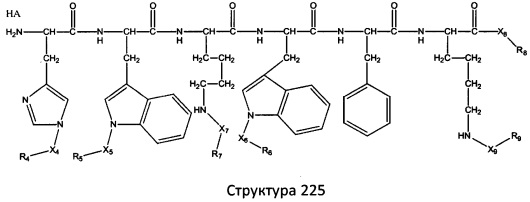
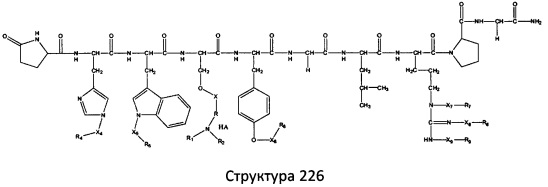
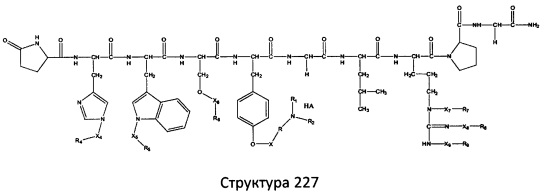
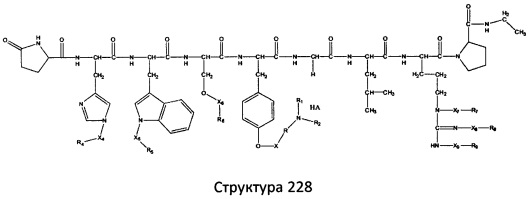
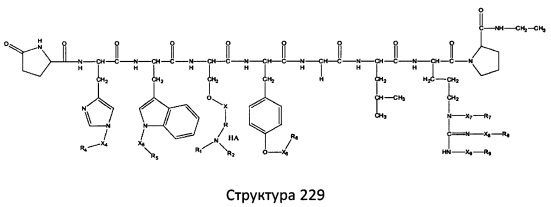
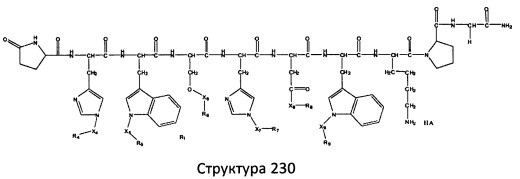
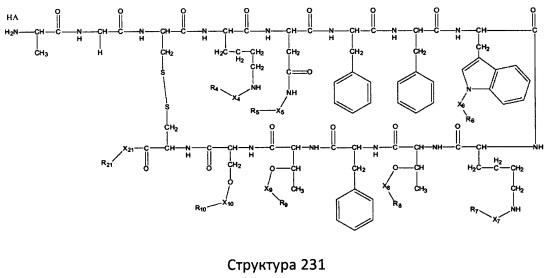
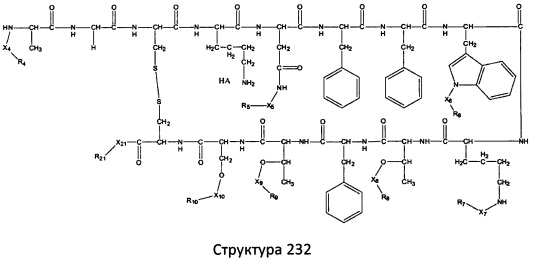
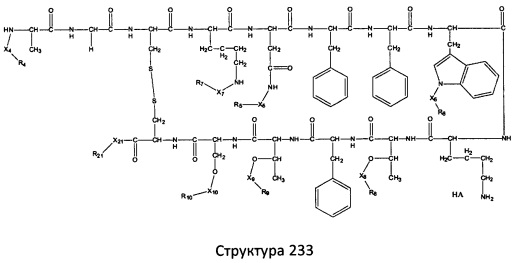
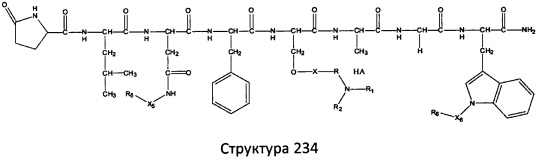
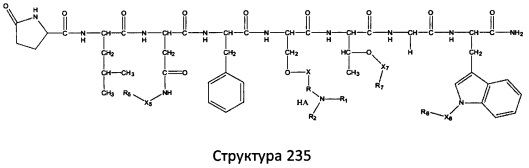

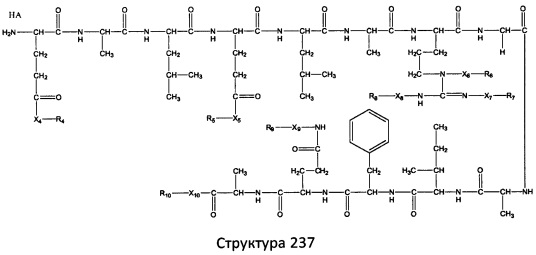
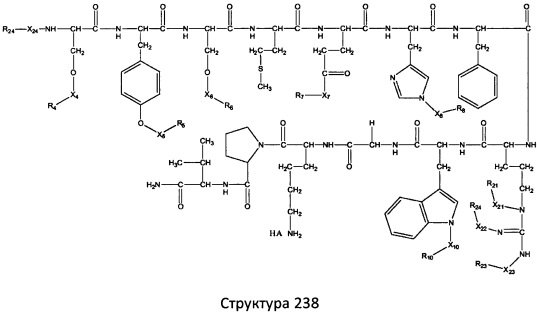

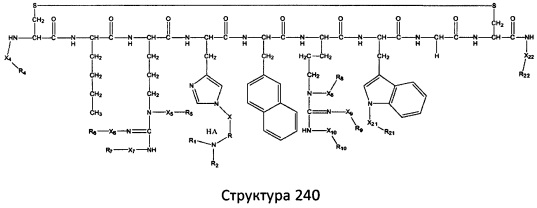
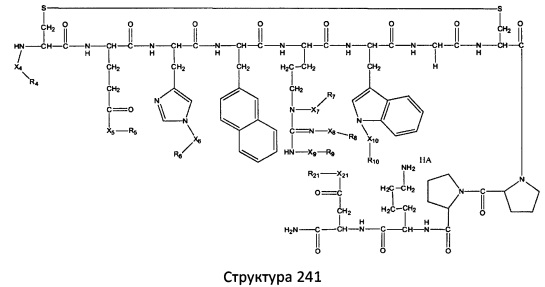
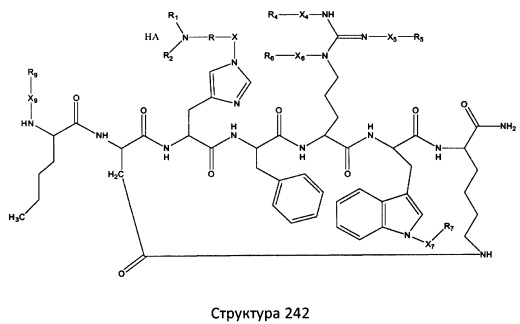
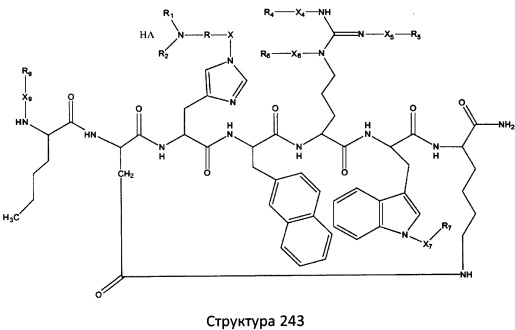
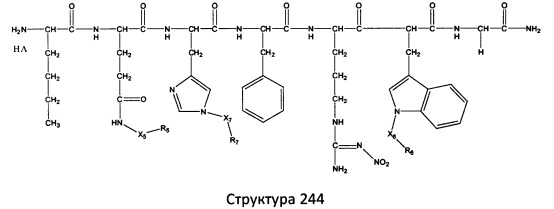
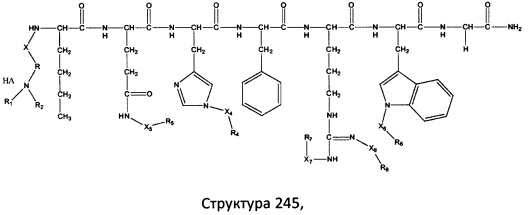
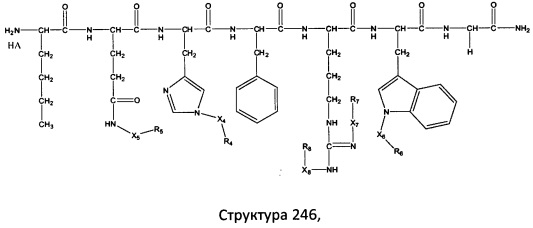
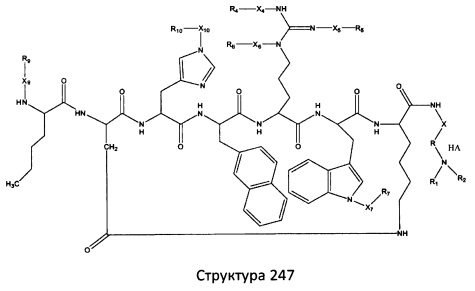
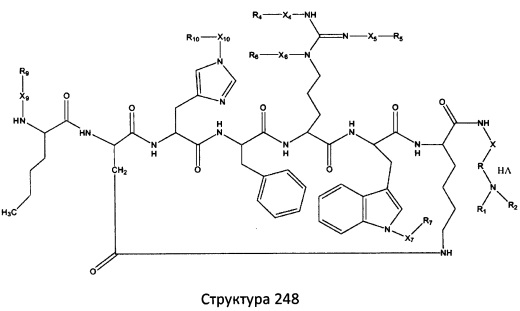
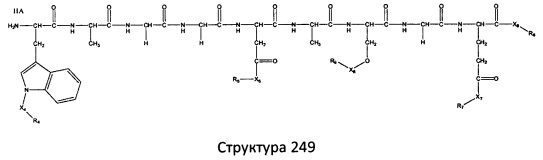
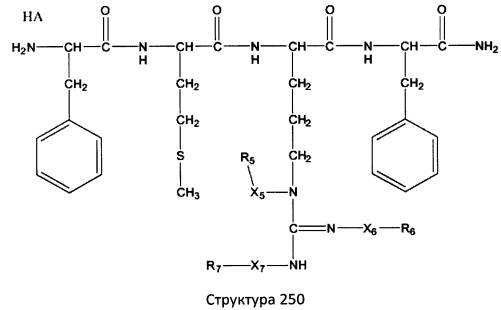
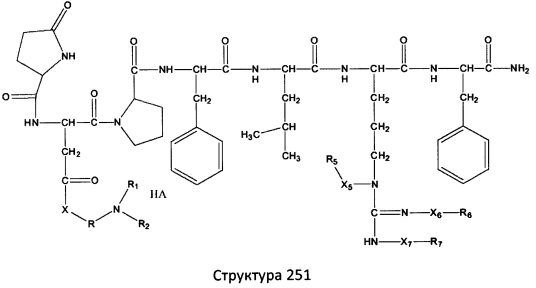
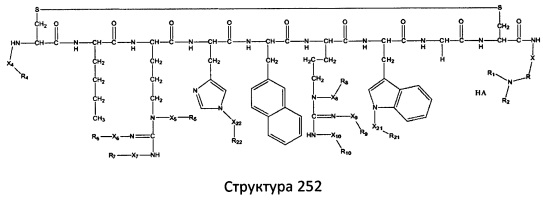
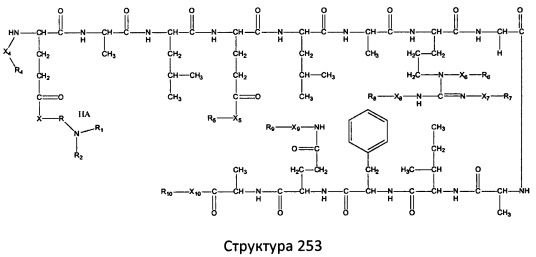
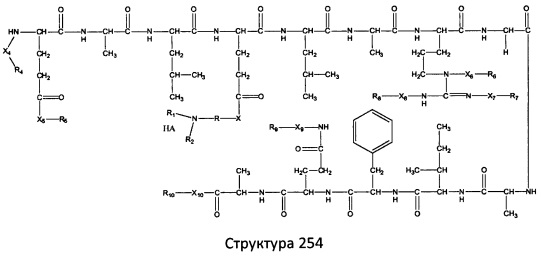
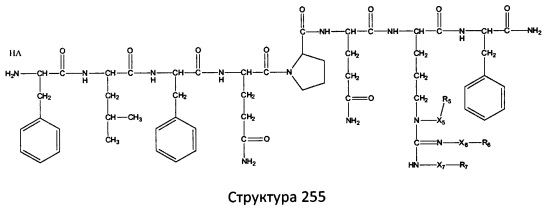
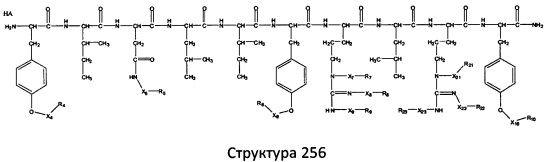
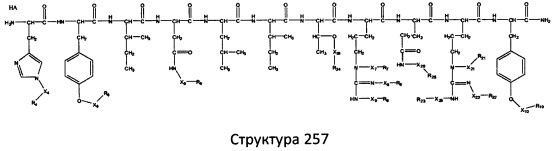
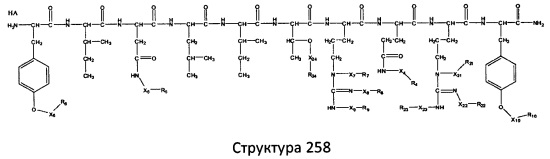
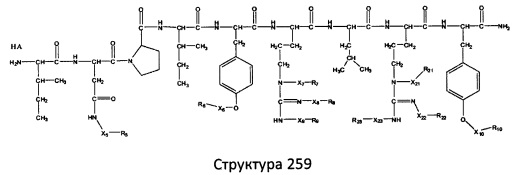
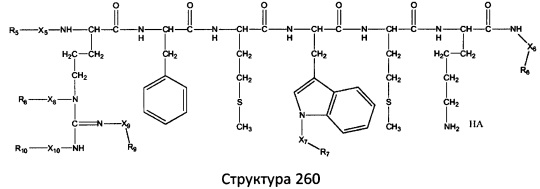
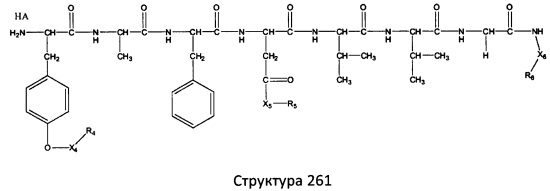
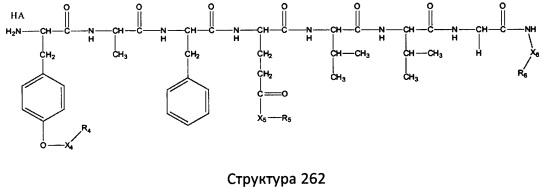
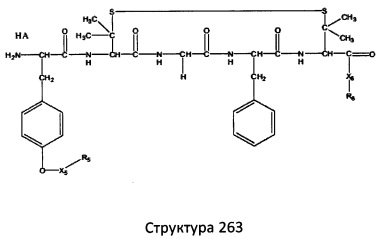
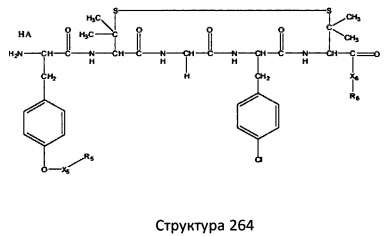

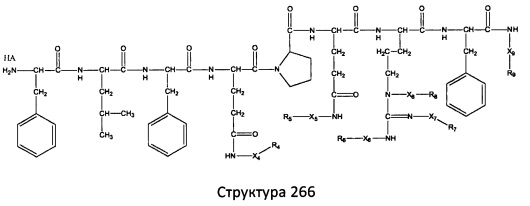
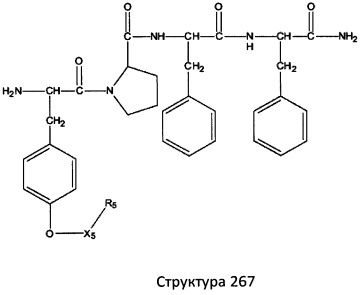
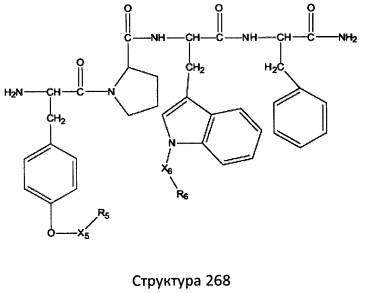
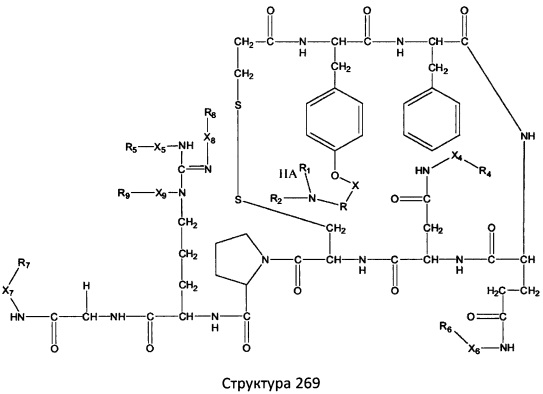

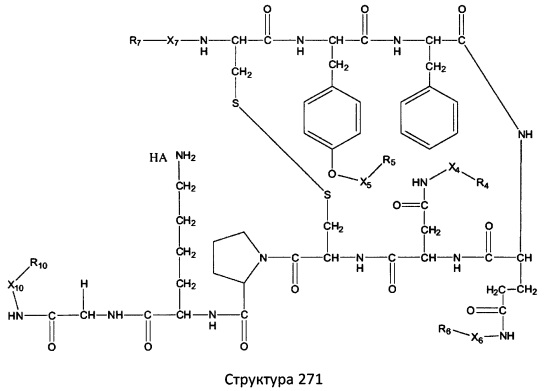
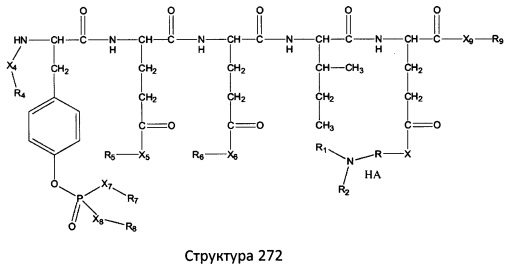
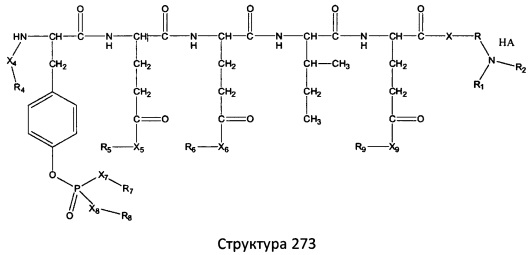
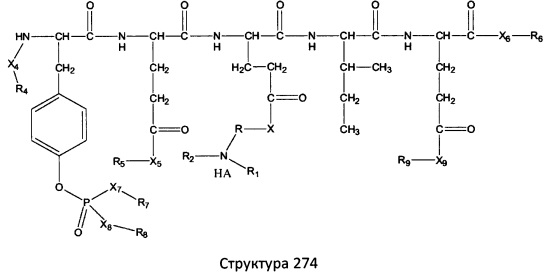
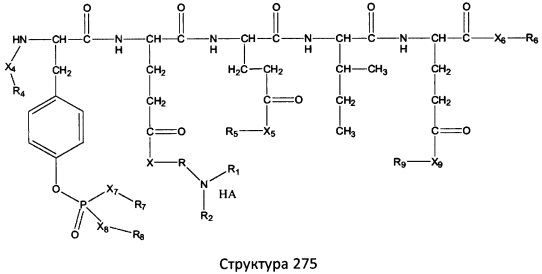
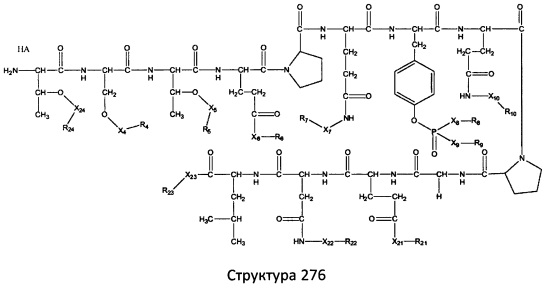
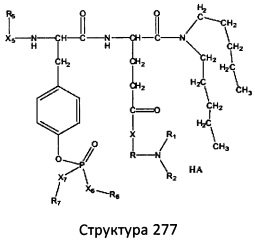
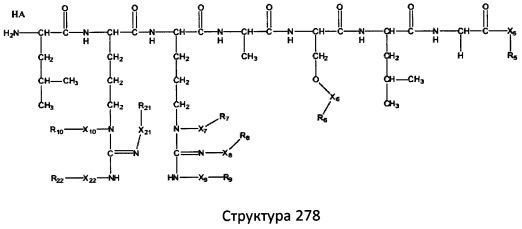
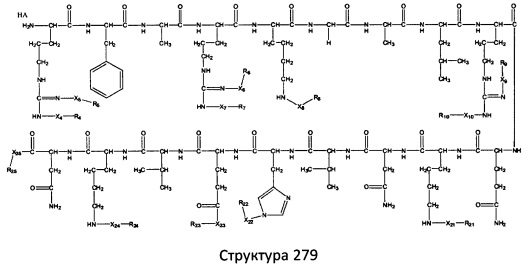
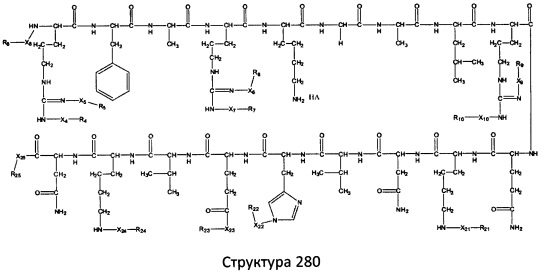
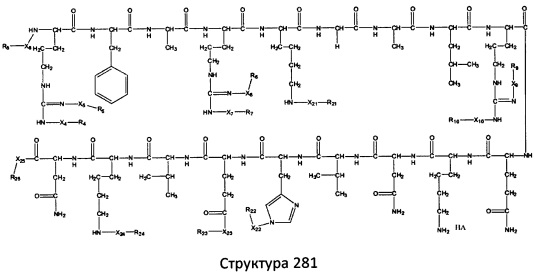
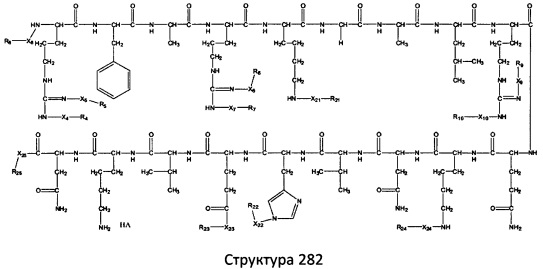
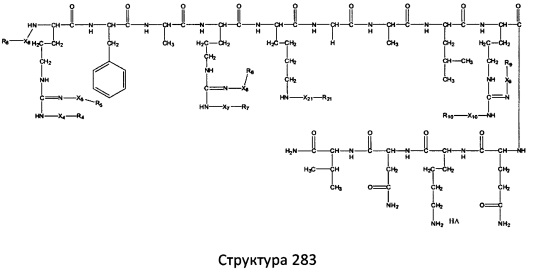
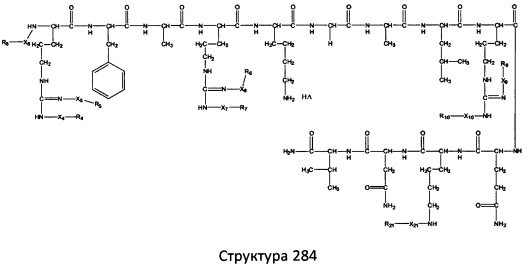
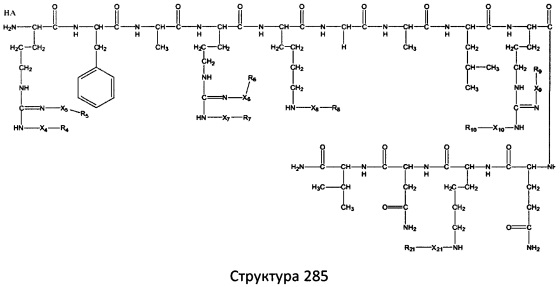
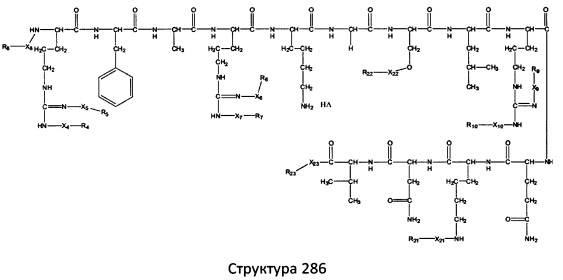
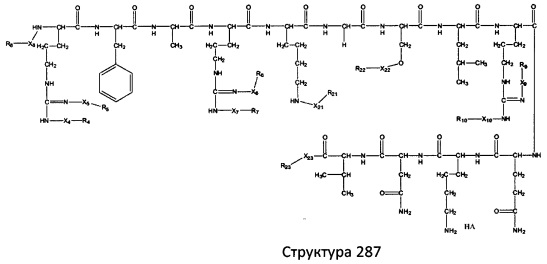
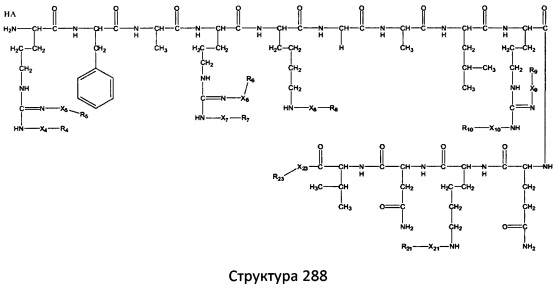
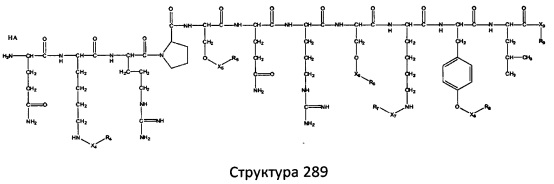
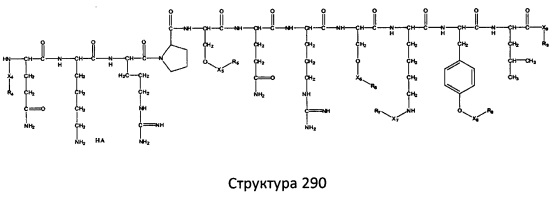
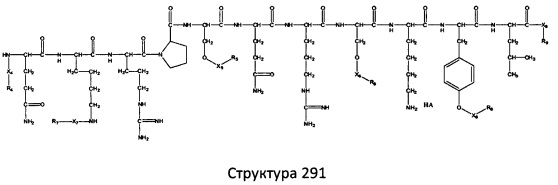
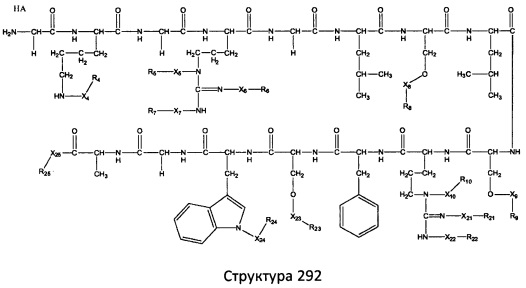
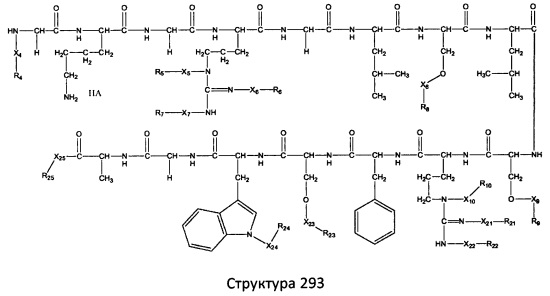
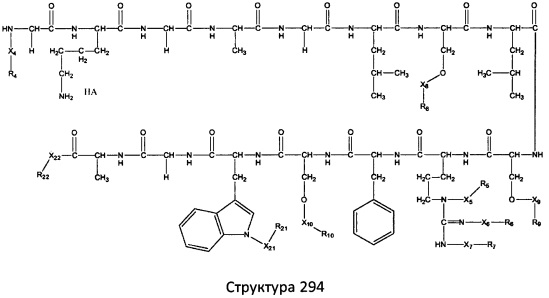
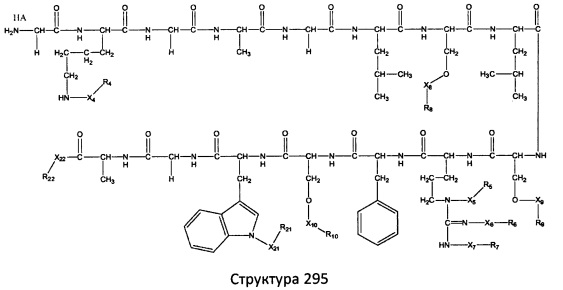
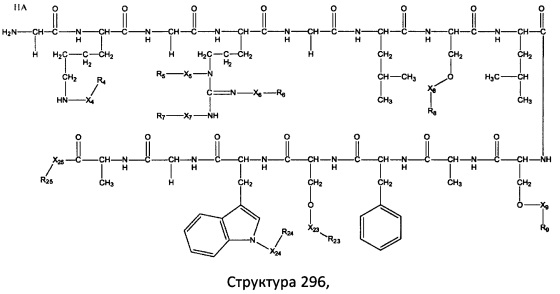
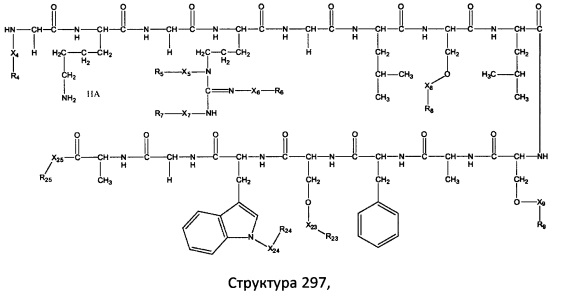
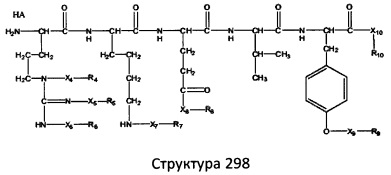
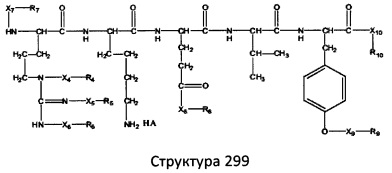

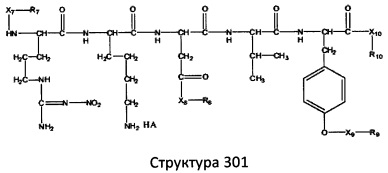
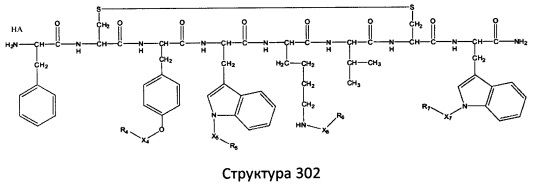
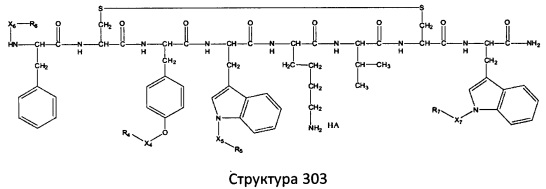
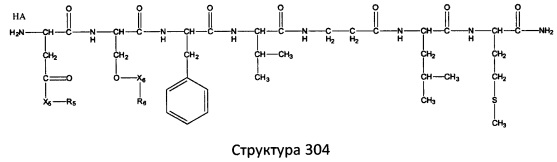
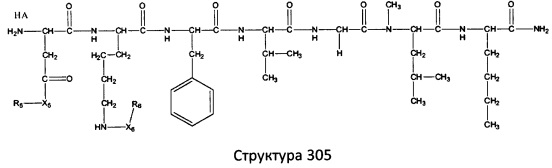
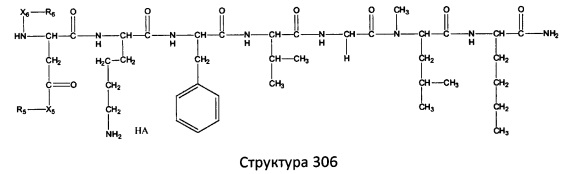
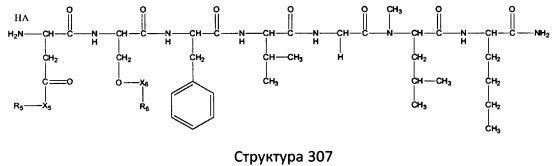
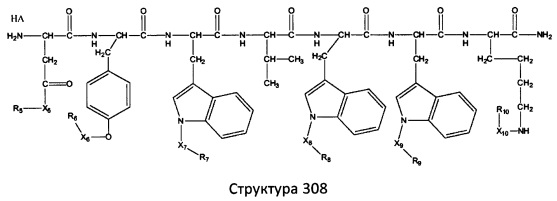
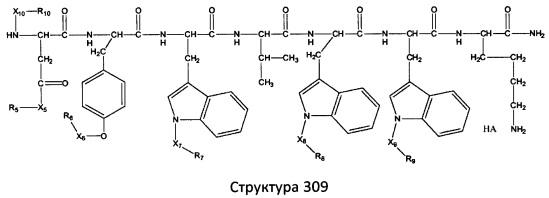
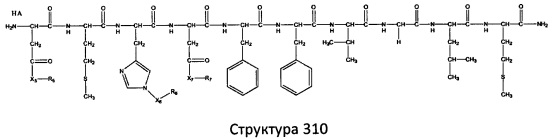
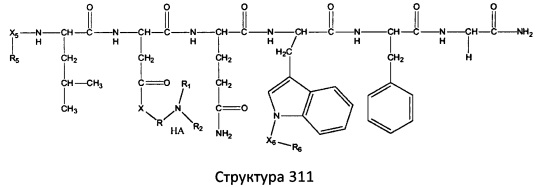
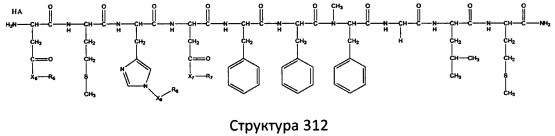
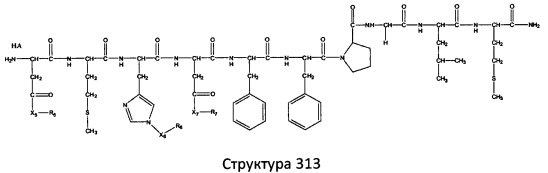
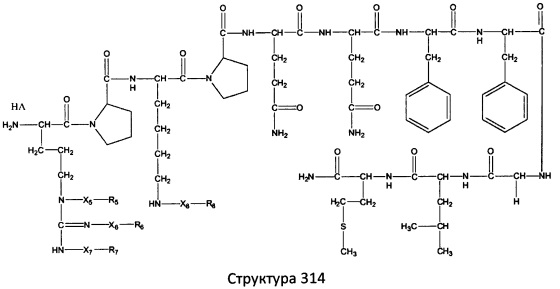
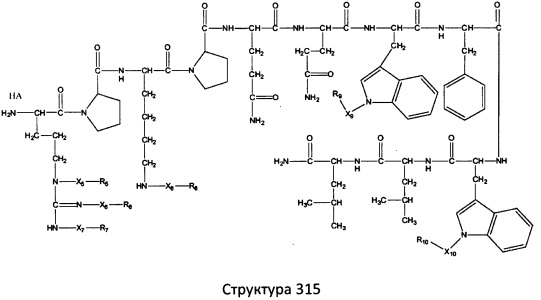
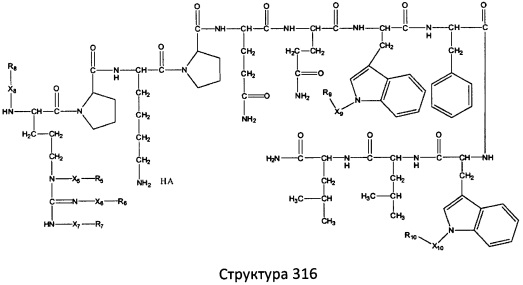

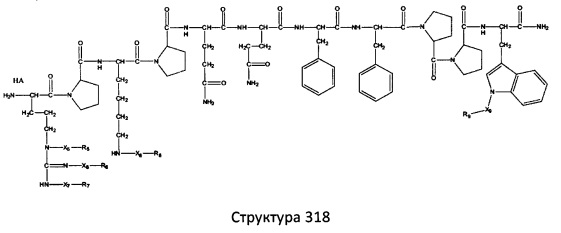
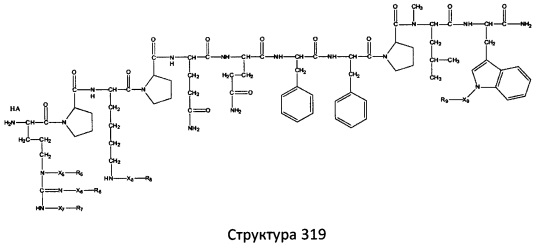
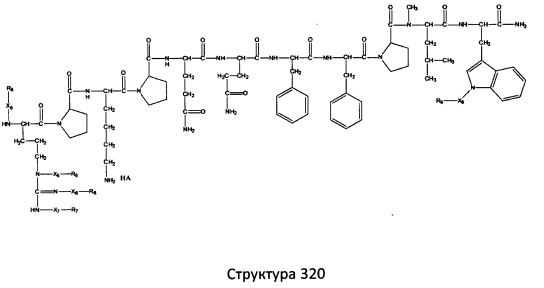
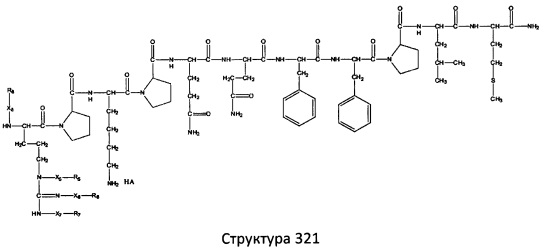
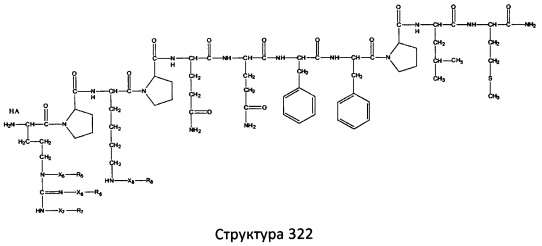
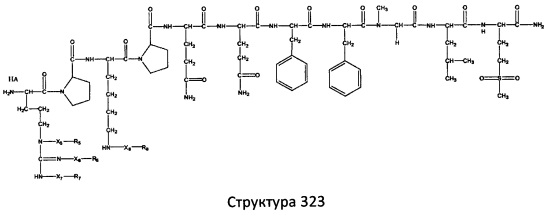
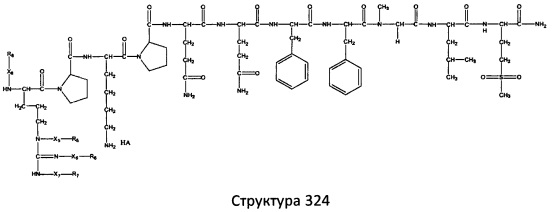
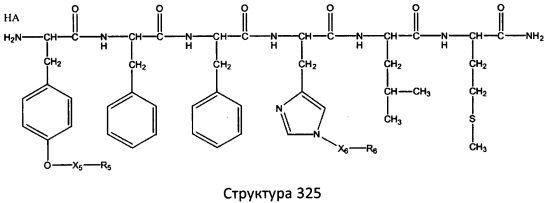
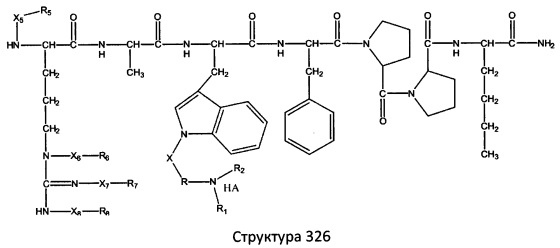
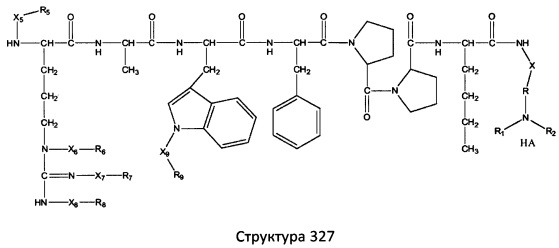
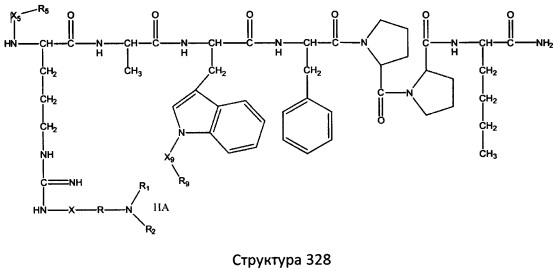
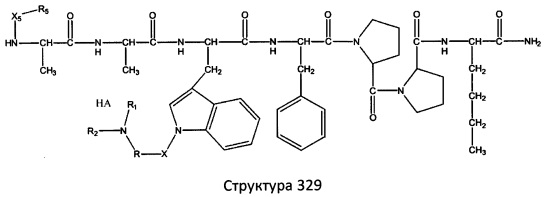
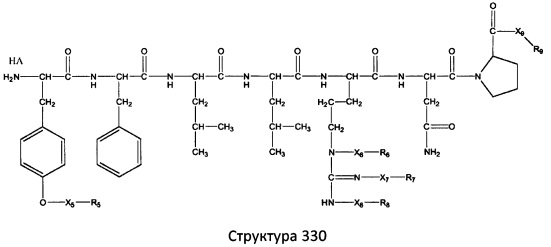
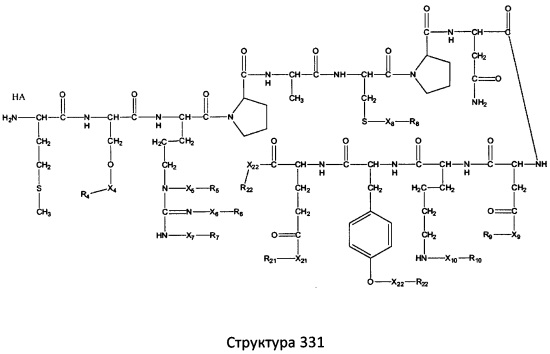
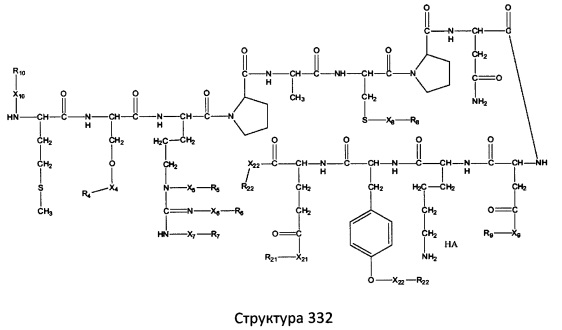
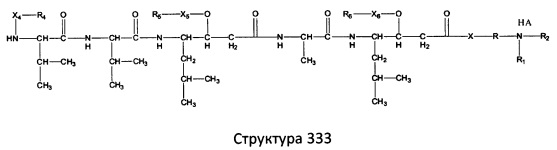
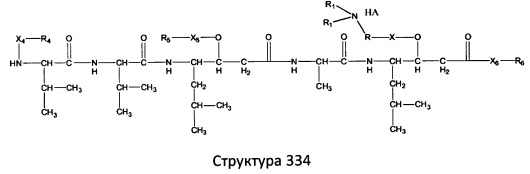
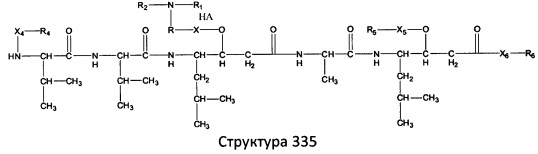
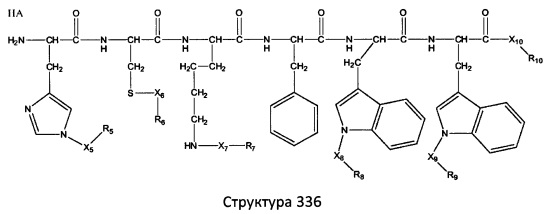
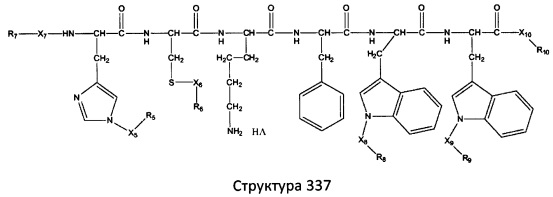
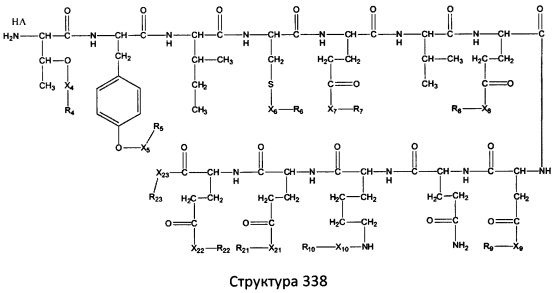
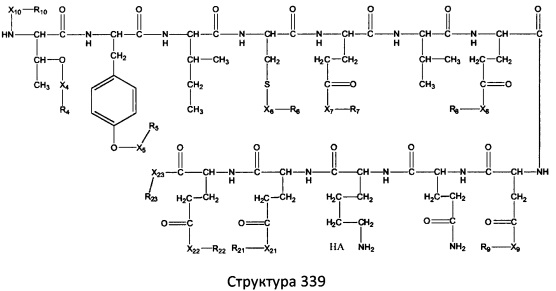
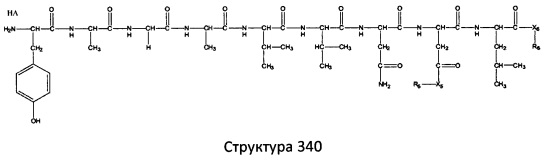
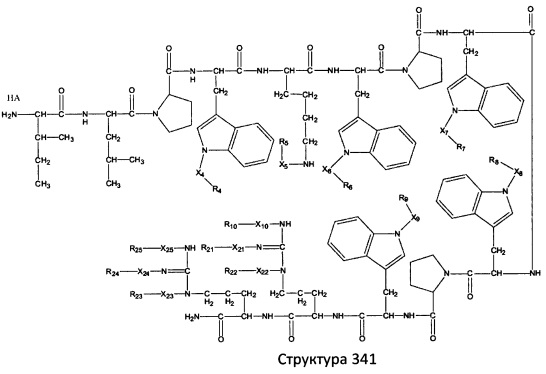
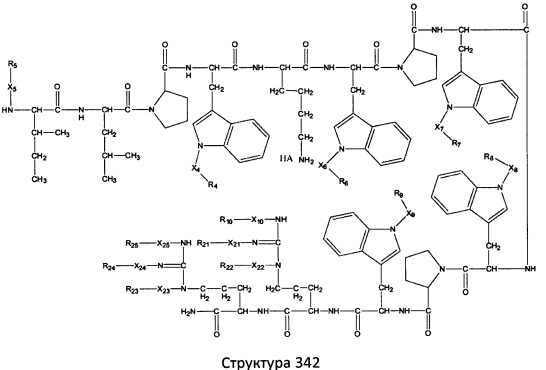
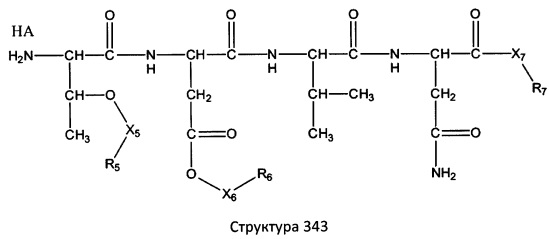
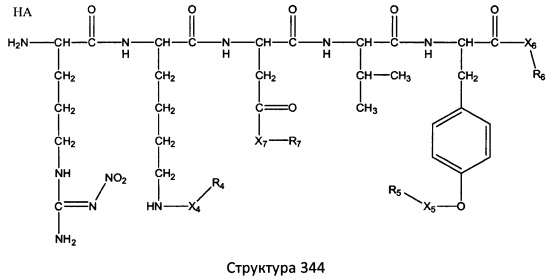
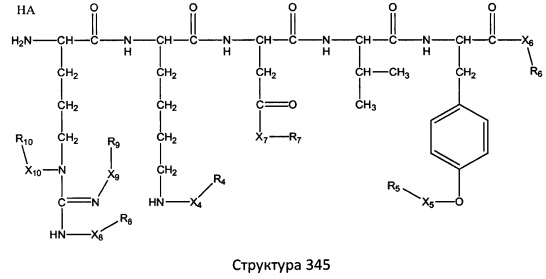
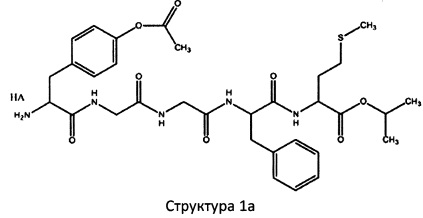
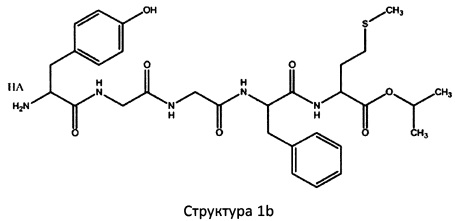
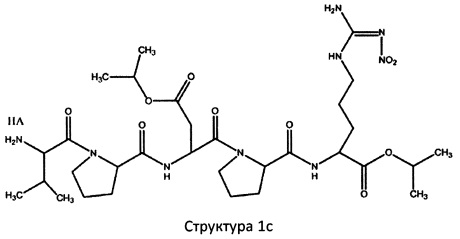
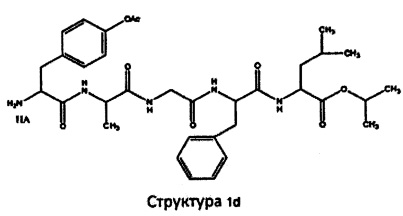
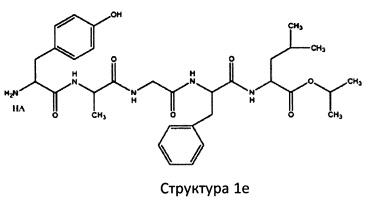
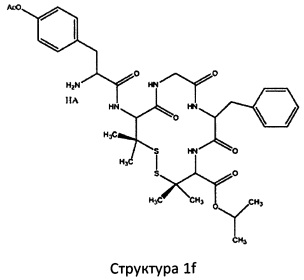
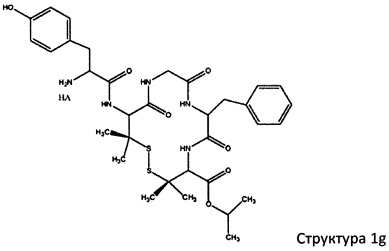
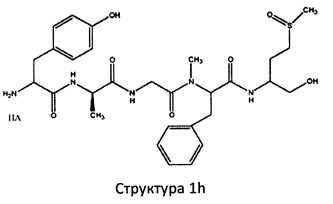
включая их стереоизомеры и фармацевтически приемлемые соли, где:
R выбран из группы, состоящей из Н, замещенных и незамещенных алкильных остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных циклоалкильных остатков, имеющих 3-16 атомов углерода, замещенных и незамещенных гетероциклоалкильных остатков, имеющих 3-16 атомов углерода, замещенных и незамещенных алкоксильных остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных алкилтио-остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных алкиламино-остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных арильных остатков, имеющих 6-16 атомов углерода и замещенных и незамещенных гетероарильных остатков, имеющих 5-16 атомов углерода;
X, Х4, Х5, Х6, Х7, Х8, Х9, Х10, Х21, Х22, Х23, Х24, Х25, Х26 и Х27 независимо выбраны из группы, состоящей из С=O, C=S, CSO, COO, СН2ОСО, СООСН2ОСО, СОСН2ОСО, СН2-О-CH(CH2OR4)2, CH2-O-CH(CH2OCOR4)2, SO2, PO(OR), NO, O, S, NR5 и ничего;
R1, R2, R4, R5, R6, R7, R8, R9, R10, R21, R22, R23, R24, R25, R26 и R27 независимо выбраны из группы, состоящей из Н, О, NO2, замещенных и незамещенных алкильных остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных циклоалкильных остатков, имеющих 3-16 атомов углерода, замещенных и незамещенных гетероциклоалкильных остатков, имеющих 3-16 атомов углерода, замещенных и незамещенных алкоксильных остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных алкилтио-остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных алкиламино-остатков, имеющих 1-16 атомов углерода, замещенных и незамещенных алкенильных остатков, имеющих 2-16 атомов углерода, замещенных и незамещенных алкинильных остатков, имеющих 2-16 атомов углерода, замещенных и незамещенных арильных остатков, имеющих 6-16 атомов углерода и замещенных и незамещенных гетероарильных остатков, имеющих 5-16 атомов углерода;
Ar выбран из группы, состоящей из фенила, 2'-нафтила, 4-йодфенила, замещенных и незамещенных арильных остатков, имеющих 6-16 атомов углерода, и замещенных и незамещенных гетероарильных остатков, имеющих 5-16 атомов углерода; и
НА выбран из группы, состоящей из ничего, гидрохлорида, гидробромида, гидройодида, азотной кислоты, серной кислоты, пиросерной кислоты, фосфорной кислоты, фосфористой кислоты, фосфоновой кислоты, изоникотиновой кислоты, уксусной кислоты, молочной кислоты, салициловой кислоты, лимонной кислоты, винной кислоты, пантотеновой кислоты, дивинной кислоты, аскорбиновой кислоты, янтарной кислоты, малеиновой кислоты, гентизиновой кислоты, фумаровой кислоты, глюконовой кислоты, глюкароновой кислоты, сахарной кислоты, муравьиной кислоты, бензойной кислоты, глутаминовой кислоты, метансульфоновой кислоты, этансульфоновой кислоты, бензолсульфоновой кислоты, п-толуолсульфоновой кислоты и памовой кислоты,
причем соединение имеет только одну или две аминогруппы и не имеет функциональной группы, выбранной из карбоновой и тиольной групп.
2. Фармацевтическая композиция для предупреждения и/или лечения состояния или заболевания, поддающегося лечению исходными пептидами или родственными пептидам соединениями, выбранными из структур по п. 1, где фармацевтическая композиция содержит композицию с высокой степенью проникновения по п. 1 и фармацевтически приемлемый носитель.
3. Фармацевтическая композиция по п. 2, отличающаяся тем, что фармацевтически приемлемый носитель является полярным.
4. Фармацевтическая композиция по п. 2, отличающаяся тем, что фармацевтически приемлемый носитель выбран из группы, состоящей из спирта, ацетона, сложного эфира, воды и водного раствора.
5. Способ проникновения через биологический барьер, включающий введение в указанный биологический барьер фармацевтической композиции по п. 2.
6. Способ предупреждения и/или лечения состояния или заболевания, поддающегося лечению исходными пептидами или родственными пептидам соединениями, выбранными из структур по п. 1, включающий введение субъекту фармацевтической композиции, которая содержит композицию с высокой степенью проникновения по п. 1 или фармацевтическую композицию по п. 2.
7. Способ по п. 6, отличающийся тем, что состояние выбрано из группы, состоящей из боли, травм, связанных с воспалением состояний, связанных с микроорганизмами состояний, связанных с нейропептидами состояний, связанных с гормонами состояний, опухоли, аномального кровяного давления, ожирения, травм головного мозга, аллергии, мужской и женской половой дисфункции, метастазирования и других состояний, связанных с: тафтсином, дородовым, послеродовым периодом, видами активности против AD, видами антидиуретической активности, гомеостазом кальция, меланоцитом, высвобождением гормонов, агрегацией тромбоцитов, активностью ЦНС и фагоцитозом.
8. Способ по п. 7, отличающийся тем, что связанные с гормонами состояния выбраны из группы, состоящей из менопаузы, заболеваний кости, дефицита гормона роста, гипертиреоза, гипотиреоза, состояний, связанных с расстройством метаболизма, аномального кровяного давления, кожного состояния, аутоиммунного заболевания, заболевания глаз, преэкламптической токсемии у женщин группы высокого риска, мужской и женской половой дисфункции, аллергии, астмы, бессонницы, депрессии и связанных с ней состояний, сердечно-сосудистых заболеваний и опухоли.
9. Способ по п. 8, отличающийся тем, что заболевания кости выбраны из группы, состоящей из остеопороза, болезни Педжета и метастазов в кости.
10. Способ по п. 8, отличающийся тем, что состояния, связанные с расстройством метаболизма, выбраны из группы, состоящей из ожирения, аномального уровня глюкозы в крови, аномального уровня липидов в крови, сахарного диабета (тип I и/или тип II) и вызванных диабетом осложнений, включая диабетическую ретинопатию, некробиотические язвы и диабетическую протеинурию.
11. Способ по п. 8, отличающийся тем, что аномальное кровяное давление выбрано из группы, состоящей из гипертонии и гипотонии.
12. Способ по п. 8, отличающийся тем, что кожное состояние выбрано из группы, состоящей из псориаза и псориатических расстройств, акне, кистозного акне, заполненных гноем или красноватых пузырьков, комедонов, папул, пустул, узелков, эпидермоидных кист, волосяного кератоза, аномальных сосудистых повреждений кожи, родимых пятен, родинок (невусов), мягких бородавок, склеродермии, витилиго и родственных заболеваний или старческих пятен (печеночных пятен).
13. Способ по п. 8, отличающийся тем, что аутоиммунное заболевание выбрано из группы, состоящей из дискоидной красной волчанки, системной красной волчанки (СКВ), аутоиммунного гепатита, склеродермии, синдрома Шегрена, ревматоидного артрита, полимиозита, склеродермии, тиреоидита Хашимото, ювенильного сахарного диабета, болезни Аддисона, витилиго, злокачественной анемии, гломерулонефрита, фиброза легких, рассеянного склероза (PC) и болезни Крона.
14. Способ по п. 8, отличающийся тем, что заболевание глаз выбрано из группы, состоящей из глаукомы, глазной гипертензии, потери зрения после офтальмологической операции, зрения теплокровного животного, нарушенного кистозным макулярным отеком, и катаракты.
15. Способ по п. 8, отличающийся тем, что сердечно-сосудистые заболевания выбраны из группы, состоящей из сердечного приступа, нестабильной стенокардии, окклюзионного поражения периферических артерий и инсульта.
16. Способ по п. 8, отличающийся тем, что опухоль выбрана из группы, состоящей из доброкачественной опухоли, рака молочной железы, рака ободочной и прямой кишки, рака ротовой полости, раковых заболеваний легких или других органов дыхательной системы, раковых заболеваний кожи, рака матки, рака поджелудочной железы, рака предстательной железы, генитального рака, раковых заболеваний органов мочевыделения, лейкоза или другого рака крови и лимфатических тканей.
17. Способ по п. 7, отличающийся тем, что связанное с микроорганизмами состояние выбрано из группы, состоящей из боли, травм и связанных с воспалением состояний.
18. Способ по п. 17, отличающийся тем, что связанное с воспалением состояние выбрано из группы, состоящей из воспаления предстательной железы (простатита), простатоцистита, фиброза с увеличением предстательной железы, геморроя, синдрома Кавасаки, гастроэнтерита, мембранопролиферативного гломерулонефрита 1 типа, синдрома Бартера, хронического увеита, анкилозирующего спондилита, гемофилической артропатии, воспаления геморроидальных узлов, постлучевого (искусственного) проктита, хронического язвенного колита, воспалительного заболевания кишечника, криптита, периодонтита, артрита и воспалительного состояния в органе, выбранном из группы, состоящей из печени, легкого, желудка, головного мозга, почки, сердца, уха, глаза, носа, рта, языка, толстой кишки, поджелудочной железы, желчного пузыря, двенадцатиперстной кишки, прямой кишки, прямой и ободочной кишки, кишечника, вены, дыхательной системы, сосудистой системы, аноректума и анального зуда.
19. Способ по п. 7, отличающийся тем, что связанные с нейропептидами состояния выбраны из группы, состоящей из болезни Альцгеймера и болезни Паркинсона.
20. Способ по п. 6, отличающийся тем, что композицию вводят биологическому субъекту посредством пути, выбранного из перорального, энтерального, трансбуккального, назального, топического, ректального, вагинального, аэрозольного, трансмукозального, эпидермального, трансдермального, дермального, офтальмологического введения, легочного, подкожного и парентерального введения.
21. Способ по п. 6, отличающийся тем, что пептиды выбраны из группы, состоящей из ангиотензина, антагонистов ангиотензина II, рецептора АТ2 ангиотензина II, противомикробных пептидов, антиокситоцина, гормонов, антидиуретических гормонов, адренокортикотропных гормонов, противомикробного пептида, противовоспалительного пептида, брадикинина, антагониста брадикинина, эндотелиновых пептидов, антагониста эндотелинового пептида, гастрина, кальцитонина, ассоциированного с меланомой антигенного пептида, ламининового пептида, фибриногенного пептида, индуцирующих ЕАЕ пептидов, факторов роста, пептидов, высвобождающих гормон роста, соматостатина, гормонов, высвобождающих гормоны, гормона, высвобождающего лютеинизирующий гормон, нейропептида, меланоцит-стимулирующих гормонов, пептида сна, амилоидного пептида, тафтсина, ретроинверсо-тафтсина, энтеростатинов, Меланокортина II и опиоидных пептидов и миметиков.
22. Способ по п. 21, отличающийся тем, что энтеростатин выбран из группы, состоящей из Val-Pro-Asp-Pro-Arg (VPDPR), Val-Pro-Gly-Pro-Arg (VPGPR) и Ala-Pro-Gly-Pro-Arg (APGPR).
23. Способ по п. 21, в котором опиоидные пептиды выбраны из группы, состоящей из Met-энкефалина (H-Tyr-Gly-Gly-Phe-Met-OH), Leu-энкефалина (H-Tyr-Gly-Gly-Phe-Leu-OH), H-Tyr-D-Ala-Gly-N-Me-Phe-Met(O)-OL и Н-Tyr-D-Ala-Gly-Phe-Leu-OH).
24. Трансдермальная терапевтическая система нанесения, содержащая соединение по п. 1 или композицию по п. 2 в качестве активного вещества для предупреждения и/или лечения состояния или заболевания, поддающегося лечению пептидами, выбранными из исходных пептидов, имеющих структуру по п. 1, при этом указанная система представляет собой спрей или раствор для втирания, дополнительно содержащий растворитель, выбранный из группы, состоящей из воды, этанола, изопропанола, ацетона, ДМСО, ДМФ и комбинаций указанных растворителей.
25. Трансдермальная терапевтическая система нанесения, содержащая соединение по п. 1 или композицию по п. 2 в качестве активного вещества для предупреждения и/или лечения состояния или заболевания, поддающегося лечению пептидами, выбранными из исходных пептидов, имеющих структуру по п. 1, при этом указанная система дополнительно включает объект, содержащий матричный слой из активного вещества и непроницаемый защитный слой.
26. Трансдермальная терапевтическая система нанесения для предупреждения и/или лечения состояния или заболевания, поддающегося лечению пептидами, выбранными из исходных пептидов по п. 25, отличающаяся тем, что указанный объект представляет собой пластырь или бинт.
27. Трансдермальная терапевтическая система нанесения по п. 25, отличающаяся тем, что указанный объект представляет собой резервуар с активным веществом, имеющий проницаемое дно, обращенное к коже, при этом указанная система, путем контроля скорости высвобождения, позволяет достигать постоянно оптимальных терапевтических уровней активного компонента или метаболита активного компонента в крови с увеличением эффективности и уменьшением побочных эффектов активного компонента или метаболита активного компонента.
| WO 2008056207 A1, 15.05.2008 | |||
| US 2006058219 A1, 16.03.2006 | |||
| US 20040186058 А1, 23.09.2004 | |||
| RU 2011127186 A1, 2010.01.13. |
Авторы
Даты
2017-08-03—Публикация
2010-05-10—Подача