УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
1. ОБЛАСТЬТЕХНИКИ
Настоящее изобретение относится к составным полипептидам, имеющим металлсвязывающий мотив, который представляет собой короткий олигопептид, способный образовывать комплекс с катионом цинка.
2. ОПИСАНИЕ РОДСТВЕННОГО УРОВНЯ ТЕХНИКИ
Биоконъюгация является методом, используемым для образования ковалентной связи между биомолекулой и другой молекулой, которая может быть или не быть биомолекулой. Биомолекулы обычно относятся к молекулам, присутствующим в организмах и необходимым для биологического процесса. Биомолекулы включают природные или синтетические полипептиды или белки, углеводы, липиды, нуклеиновые кислоты, и метаболиты.
Концепция вооружения антител или фрагментов антител с токсинами(т.е., конъюгаты антитело-токсин или “ATCs”), цитотоксическими препаратами (т.е., конъюгаты антитело-лекарственное средство или “ADCs”), и радионуклидами (т.е., конъюгаты антитело-радионуклид или “ARCs”) возникла в 1970 г. Синтез таких биоконъюгатов часто включает реакции конъюгации, такие как связывание доступных на поверхности остатков лизина, цистеина или тирозина, и модификации доступных на поверхности остатков лизина или триптофана или N- и C-концах. Тем не менее, вышеупомянутые аминокислотные остатки в большом количестве присутствуют в исходном антителе, и реакция конъюгация обычно является случайным процессом. Как следствие, реакции конъюгации не хватает хемоселективности и эффективности, и она часто приводит к гетерогенным продуктам. Например, предыдущие исследования huN901-DM1, иммуноконъюгата майтанзиноид-моноклональное антитело, показало, что образец лизин-конъюгированного ADС, содержит ADC с различным соотношением лекарственного средства к антителу (DAR) в диапазоне от 0 до 6 и возможно содержит более чем 4,5 миллионов уникальных молекул.
Ввиду вышеизложенного, существует возрастающая потребность в стратегиях конъюгации, которые помогут эффективно конъюгировать функциональный элемент со специальным сайтом биомолекулы, в частности, с молекулой на основе пептида. Считается, что настоящее изобретение является ответом на эту потребность.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Следующее представляет упрощенное изложение сущности изобретения, чтобы предоставить базовое понимание читателю. Сущность изобретения не является обширным обзором раскрытия изобретения, и оно не идентифицирует ключевые/критические элементы настоящего изобретения или очерчивает объем настоящего изобретения. Его единственная цель состоит в том, чтобы представить некоторые концепции, раскрытые в настоящем описании в упрощенной форме, в качестве вступления к более подробному описанию, которое будет представлено позже.
В одном аспекте настоящее изобретение относится к металлсвязывающему мотиву, который способен образовывать комплекс с ионом цинка в подходящих условиях.
Согласно одному варианту осуществления настоящего изобретения, металлсвязывающий мотив содержит аминокислотную последовательность CX1X2HA (SEQIDNo.1) в порядке от N-конца к C-концу, или в порядке от C-конца к N-концу, где X1 представляет собой глицин или пролин, а X2 представляет собой глицин или аланин, и металлсвязывающий мотив расположен на N- или C-конце родительского полипептида. Иллюстративные примеры металлсвязывающих мотивов включают, но не ограничиваются ими, CGGHA (SEQIDNo. 2), CPGHA (SEQIDNo. 3), CGAHA (SEQIDNo. 4), CPAHA (SEQIDNo. 5), GCGGHA (SEQIDNo. 6), ACPGHA (SEQIDNo. 7), и GCPGHA (SEQIDNo. 8).
В другом аспекте настоящее изобретение направлено на составной полипептид, который содержит металлсвязывающий мотив в соответствии с вышеупомянутым аспектом/ вариантом осуществления. Таким образом, составной полипептид способен образовывать комплекс с ионом металла (например, ионом цинка) через металлсвязывающий мотив при подходящих условиях. Таким образом, сульфгидрильная группа остатка цистеина в комплексе с ионом металла является более реакционно способной, чем сульфгидрильная группа остатка цистеина без образования комплекса с ионом металла. Как можно определить, указанный комплекс может подвергаться химической конъюгации с другим химическим соединением или биомолекулой сайт-специфичным образом, тем самым образуя биоконъюгат.
В соответствии с одним вариантом осуществления настоящего изобретения, составной полипептид включает родительский полипептид и металлсвязывающий мотив, расположенный на N- или C-конце родительского полипептида. В некоторых необязательных примерах существует последовательность от 1 до 10 остатков глицина между родительским пептидом и металлсвязывающим мотивом, тогда как в других примерах, настоящий металлсвязывающий мотив предшествует или следует за родительским полипептидом полностью.
В еще одном аспекте один или несколько функциональных элементов могут быть ковалентно конъюгированы с составным полипептидом в соответствии с указанным выше аспектом/вариантами настоящего изобретения путем взаимодействия с сульфгидрильной (SH) группой остатка цистеина в металлсвязывающем мотиве составного полипептида, тем самым образуя молекулярную конструкцию (или биоконъюгат).
Согласно необязательным вариантам осуществления настоящего изобретения, SH-реакционоспособная группа представляет собой малеимидную, иодацетильную, бромацетильную, винилсульфонильную, моносульфонильную, метилсульфонил бензотиазолую, или 2-пиридилтиольную группу.
В некоторых необязательных вариантах реализации составной полипептид находится в димерной форме; например, составной полипептид может включать часть Fc области, F(ab’)2, или антитела. В этих случаях каждая составная полипептидная цепь имеет один функциональный элемент, конъюгированный с ней.
Согласно различным вариантам осуществления настоящего изобретения, функциональный элемент представляет собой объект малой молекулы, способный вызывать терапевтический эффект. Например, объект малой молекулы может быть цитотоксическим препаратом, агонистом толл-подобного рецептора, или хелатором комплексе с радиоактивным нуклидом. Альтернативно, функциональный элемент представляет собой цепь жирной кислоты, способную модифицировать фармакокинетический профиль родительского полипептида или молекулярной конструкции в целом.
Альтернативно, функциональный элемент находится в форме линкерного звена (также называемого, как “связка”). Согласно некоторым вариантам осуществления настоящего изобретения линкерное звено содержит центральное ядро и множество нацеливающих, эффекторных или фармакокинетический элементов.
В частности, центральное ядро содержит от 2 до 10 остатков лизина (К). Любые два К остатка примыкают друг к другу или разделены наполнителем. В некоторых случаях,SH-реакционноспособная группа связана с первым или последним остатком K центрального ядра путем образования с ним амидной связи. В других случаях, центральное ядро дополнительно содержит концевой спейсер, а SH-реакционноспособная группа связана с концевым аминокислотным остатком концевого спейсера, образуя с ним амидную связь. Концевые спейсеры могут представлять собой N-концевой спейсер, связанный с N-концом первого K остатка или C-концевым спейсером, связанным с C-концом последнего K остатка. Каждый из наполнителей и концевых спейсеров содержит, независимо, (1) от 1 до 12 K аминокислотных остатка, отличных от К, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG).
Согласно некоторым вариантам осуществления настоящего изобретения центральное ядро несет локальный отрицательный заряд в или рядом с аминокислотным остатком, связанным с SH-реакционноспособной группой. Например, локальный отрицательный заряд присутствует в пределах первых 5-15 аминокислотных остатков внутри аминокислотного остатка, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. В частности, локальный отрицательный заряд присутствует в первых 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных остатках, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Локальный отрицательный заряд может передаваться путем включения одного или нескольких отрицательно заряженных аминокислотных остатков при pH=7, таких как остаток аспартата (D) и глутамата (E). Альтернативно, ядро может быть конъюгировано с множеством отрицательно заряженных эффекторных элементов.
В некоторых примерах, каждый нацеливающий, эффекторный или фармакокинетический элемент связан с К остатком ядра посредством образования амидной связи с ε-аминогруппой К остатка. В некоторых других случаях молекулярная конструкция дополнительно содержит от 2 до 10 связывающих ветвей, при этом один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остатка, и другой конец каждой связывающей ветви связан с каждым нацеливающим, эффекторным или фармакокинетическим элементом. Например, связывающая ветвь может быть пептидом, содержащим 2-12 аминокислотных остатков, отличных от К, или цепью полиэтиленгликоля (PEG), имеющей 2-24 повтора звеньев EG.
Согласно некоторым вариантам осуществления настоящего изобретения описанный выше составной полипептид служит в качестве нацеливающего элемента, способного направлять молекулярную конструкцию к интересующему сайту или повышать относительный уровень молекулярной конструкции в интересующем сайте. В этих случаях линкерное звено (или связка) может нести множество эффекторных элементов, таких как малая молекула, описанная выше.
Согласно некоторым вариантам осуществления настоящего изобретения описанный выше составной полипептид служит как эффекторный элемент, способный вызывать желаемый терапевтический эффект у субъекта. В этих случаях линкерное звено (или связка) может нести множество фармакокинетических элементов, таких как производное C8-28 жирной кислоты или производное C8-28 дикарбоновой жирной кислоты, чтобы модифицировать или оптимизировать фармакокинетический профиль молекулярной конструкции или составного полипептида у субъекта. Согласно различным вариантам осуществления настоящего изобретения,ε-аминогруппа K остатка связана с производным C8-28 жирной кислоты или производным C8-28 дикарбоновой жирной кислоты. Молекулы жирных кислот могут связываться с сывороточным альбумином и, следовательно, улучшать кинетические свойства модифицированного родительского полипептида invivo.
Кроме того, в объем настоящего изобретения входит линкерное звено, описанное выше, которое способно образовывать молекулярную конструкцию с данным составным полипептидом.
В еще одном аспекте настоящее изобретение направлено на линкерное звено, способное нести множество составных полипептидов в соответствии с вышеупомянутым аспектом/вариантами осуществления настоящего изобретения. Согласно вариантам осуществления настоящего изобретения линкерное звено, имеющее множество составных полипептидов, ковалентно связанных с его центральным ядром, иногда называют полипептидными связками.
Согласно некоторым вариантам осуществления настоящего изобретения, настоящее линкерное звено содержит центральное ядро и множество связывающих ветвей.
В частности, центральное ядро содержит от 2 до 10 остатков лизина (K) и конъюгированную группу. Любые два K остатка примыкают друг к другу или разделены наполнителем. В некоторых случаях конъюгированная группа связана с первым или последним K остатком центрального ядра путем образования с ним амидной связи. Примеры конъюгированной группы включают, но не ограничиваются ими, азидные, алкиновые, тетразиновые, циклооктеновые и циклооктиновые группы. В других случаях центральное ядро дополнительно содержит концевой спейсер, а конъюгированная группа связана с концевым аминокислотным остатком концевым спейсером, образуя с ним амидную связь. Концевые спейсеры могут представлять собой N-концевой спейсер, связанный с N-концом первого K остатка, или C-концевой спейсер, связанный с C-концом последнего K остатка. Каждый из наполнителя и концевого спейсера содержит, независимо, (1) от 1 до 12 аминокислотных остатков, отличных от K, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG).
Согласно некоторым вариантам осуществления изобретения, один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остатка, тогда как другой конец каждой связывающей ветви имеет SH-реакционноспособную группу. Например, связывающая ветвь может быть пептидом, содержащим 2-12 аминокислотных остатков, отличных от К, или цепью полиэтиленгликоля (ПЭГ), имеющей 2-24 повтора звеньев EG.
Согласно некоторым вариантам осуществления настоящего изобретения линкерное звено дополнительно содержит от 2 до 10 составных полипептидов в соответствии с вышеупомянутым аспектом/вариантами осуществления изобретения и функциональный элемент. Каждый составной полипептид конъюгирован с тиольной группой остатка цистеина в металлсвязывающем мотиве посредством химии SH-реакционноспособного сшивания.
Согласно некоторым необязательным вариантам осуществления настоящего изобретения, каждая связывающая ветвь несет локальный отрицательный заряд на аминокислотном остатке, связанном с SH-реакционноспособной группой, или рядом с ним. В частности, локальный отрицательный заряд присутствует в пределах первых 5-15 аминокислотных остатков внутри аминокислотного остатка, начиная с аминокислотного остатка, связанного с SH-реакционоспособной группой. Например, локальный отрицательный заряд присутствует в первых 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных остатках, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Локальный отрицательный заряд может передаваться путем включения одного или нескольких отрицательно заряженных аминокислотных остатков при pH=7, таких как остаток аспартата (D) и глутамата (E).
Многие из сопутствующих признаков и преимуществ настоящего изобретения станут более понятными со ссылкой на следующее подробное описание, рассматриваемое в связи с сопроводительными чертежами.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Настоящее описание будет лучше понято из следующего подробного описания, прочитанного в свете сопроводительных чертежей, где:
Фиг. 1 является результатом MALDI-TOF для центрального ядра Mal-Peptide 1 согласно одному рабочему примеру настоящего изобретения;
Фиг. 2 иллюстрирует структуру связки Mal-Peptide 2-DOTA согласно одному рабочему примеру настоящего изобретения;
Фиг. 3А иллюстрирует профиль элюирования с помощью обращенно-фазовой аналитической ВЭЖХ связки Mal-Peptide 2-DOTA;
Фиг. 3B представляет собой результат MALDI-TOF для связки Mal-Peptide 2-DOTA согласно одному рабочему примеру настоящего изобретения;
Фиг. 4A иллюстрирует структуру рекомбинантного 2-цепочечного (scFvαCD19)-Fc-MBM-1 согласно одному рабочему примеру настоящего изобретения;
Фиг. 4B иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCD19)-Fc-MBM-1 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 5 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCD19)-Fc-MBM-2 согласно одному рабочему примеру настоящего изобретения;
Фиг. 6 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCD19)-Fc-MBM-3 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 7А иллюстрирует восстанавливающий SDS-PAGE анализ анти-CD19 антитела MBM-1 или анти-CD19 антитела MBM-2 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 7B иллюстрирует восстанавливающий SDS-PAGE анализ анти-CD19 антитела MBM-1 или анти-CD19 антитела MBM-2 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 8 иллюстрирует невосстанавливающий SDS-PAGE анализ четырех (scFvαCD33)-Fc-MBM молекулярных конструкций в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 9 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного (scFvαCD20)-Fc-MBM-1 в конфигурациях как VL-VH, так и VH-VL согласно одному рабочему примеру настоящего изобретения;
Фиг. 10А иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VH-VLscFvαCD20)-Fc-MBM-2 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 10В иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCD20)-Fc-MBM-3 согласно одному рабочему примеру настоящего изобретения;
Фиг. 11A иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCA19-9)-Fc-MBM-1 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 11В иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCA19-9)-Fc-MBM-2 согласно одному рабочему примеру настоящего изобретения;
Фиг. 12А иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCC38)-Fc-MBM-1 в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 12B иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантного 2-цепочечного (VL-VHscFvαCC38)-Fc-MBM-2 в соответствии с одним рабочим примером настоящего изобретения;
Фигура 13A иллюстрирует структуру рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 13B иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 14 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-2 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 15 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-3 X 2 DOTA связок;
Фиг. 16 иллюстрирует восстанавливающий SDS-PAGE анализ интактных анти-CD19 антитело-MBM-1 X 2 DOTA связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 17 иллюстрирует восстанавливающий SDS-PAGE анализ интактных анти-CD19 антитело-MBM-2 X2 DOTA связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 18 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантных 2-цепочечных (scFvαCD33)-Fc-MBM-1 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 19 иллюстрирует невосстанавливающий SDS-PAGE анализ рекомбинантных 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 20 иллюстрирует профиль элюирования FPLC анионообменной колонки на стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связках в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 21 иллюстрирует SDS-PAGE анализ фракций, собранных из анионообменной колонки на стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связках в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 22 иллюстрирует SDS-PAGE анализ фракций, собранных из анионообменной колонки на стабилизированных 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связках в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 23 является результатом MALDI-TOF для стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 24 - результат MALDI-TOF для стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, хелатированных с ионом 89Y3+ согласно одному рабочему примеру настоящего изобретения;
Фиг. 25 является результатом MALDI-TOF для стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, хелатированных с ионом 175Lu3+ согласно одному рабочему примеру настоящего изобретения;
Фиг. 26 представляет собой результат TLC анализа радиохимической чистоты стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, меченных 111In, в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 27 иллюстрирует результат теста на стабильность 111In-меченных стабилизированных 2-цепочечных(scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, проанализированных с помощью вестерн-блоттинга согласно одному рабочему примеру настоящего изобретения;
С Фиг. 28A по Фиг. 28D проиллюстрированы результаты анализа окрашивания стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 29 иллюстрирует результат теста стабильности стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, проанализированных с помощью SDS-PAGE согласно одному рабочему примеру настоящего изобретения;
Фиг. 30 иллюстрирует результат теста стабильности стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, проанализированных с помощью ТСХ согласно одному рабочему примеру настоящего изобретения;
Фиг. 31 иллюстрирует периоды полувыведения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 32 иллюстрирует нацеливающий эффект стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок на CD19-экспрессирующую опухоль ксенотрансплантата согласно одному рабочему примеру настоящего изобретения;
Фиг. 33 иллюстрирует результат анализа биораспределения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок на CD19-экспрессирующую опухоль ксенотрансплантата согласно одному рабочему примеру настоящего изобретения;
Фиг. 34 представляет собой схематическую диаграмму, показывающую структуру Aib-GLP-1 агониста Cys согласно одному рабочему примеру настоящего изобретения;
Фиг. 35 представляет собой схематическую диаграмму, показывающую структуру Cys-октреотида согласно одному рабочему примеру настоящего изобретения;
Фиг. 36 иллюстрирует результат MALDI-TOF/TOF для Cys-октреотида в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 37 представляет собой схематическую диаграмму, показывающую структуру лиганда Cys-PSMA согласно одному рабочему примеру настоящего изобретения;
Фиг. 38 иллюстрирует результат ESI-MSCys-PSMA лиганда согласно одному рабочему примеру настоящего изобретения;
Фиг. 39 представляет собой схематическую диаграмму, показывающую структуру кальцитонин-MBM-1 согласно одному рабочему примеру настоящего изобретения;
Фиг. 40 представляет собой схематическую диаграмму, показывающую структуру связки Mal-пептид-3-Леналидомид согласно одному рабочему примеру настоящего изобретения;
Фиг. 41 иллюстрирует результат ESI-MS для связки Mal-пептид-3-леналидомид согласно одному рабочему примеру настоящего изобретения;
Фиг. 42 представляет собой схематическую диаграмму, показывающую структуру связки Mal-пептид-4-леналидомид согласно одному рабочему примеру настоящего изобретения;
Фиг. 43 представляет собой схематическую диаграмму, показывающую структуру связки Mal-пептид-5-жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 44 иллюстрирует результат ESI-MS связки Mal-пептид 5-жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 45 представляет собой схематическую диаграмму, показывающую структуру 3-DOTA ветви линкерного звена согласно одному рабочему примеру настоящего изобретения;
Фиг. 46 иллюстрирует результат ESI-MS 3-DOTA ветви линкерного звена согласно одному рабочему примеру настоящего изобретения;
Фиг. 47 иллюстрирует SDS-PAGE анализ MBM-1-IL-2 согласно одному рабочему примеру настоящего изобретения;
Фиг. 48 иллюстрирует анализ SDS-PAGE 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 49 представляет собой схематическую диаграмму, показывающую структуру связки октреотид X жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 50A представляет собой схематическую диаграмму, показывающую структуру связки Aib-GLP-1 агонист X жирная кислота в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 50B представляет собой схематическую диаграмму, показывающую структуру связки терипаратид-MBM-1 X жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 51A представляет собой схематическую диаграмму, показывающую структуру связки лейпролид-MBM-3 X жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 51B иллюстрирует результат MALDI-TOF связка лейпролид-MBM-3 X жирная кислота согласно одному рабочему примеру настоящего изобретения;
Фиг. 52A представляет собой схематическую диаграмму, показывающую структуру 3-DOTA ветвь линкерного звена X 3 PSMA лигандов согласно одному рабочему примеру настоящего изобретения;
Фиг. 52B иллюстрирует результат ESI-MS 3-DOTA ветви линкерного звена X 3 PSMA лигандов согласно одному рабочему примеру настоящего изобретения;
Фиг. 53 иллюстрирует анализ SDS-PAGE очищенных 2-цепочечных (scFvαCA19-9)-Fc-MBM-1 X 2 DOTA связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 54 иллюстрирует анализ SDS-PAGE для очищенных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 Леналидомид связок в соответствии с одним рабочим примером настоящего изобретения;
Фиг. 55 иллюстрирует результат MALDI-TOF для очищенных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок согласно одному рабочему примеру настоящего изобретения;
Фиг. 56A и Фиг. 56B иллюстрируют периоды полувыведения родительского анти-CD38 hIgG1.Fc-антитела и 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок согласно одному рабочему примеру настоящего изобретения;
С Фиг. 57A по Фиг. 57C проиллюстрирован нацеливающий эффект 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2леналидомид связок в соответствии с одним рабочим примером настоящего изобретения; и
Фиг. 58A и Фиг. 58B иллюстрируют эффект ADCC 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок в соответствии с одним рабочим примером настоящего изобретения.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Подробное описание, представленное ниже в связи с прилагаемыми чертежами, предназначено как описание настоящих примеров и не предназначено для представления единственных форм, в которых настоящий пример может быть создан или использован. В описании излагаются функции примера и последовательность шагов для построения и работы с примером. Однако одни и те же или эквивалентные функции и последовательности могут быть выполнены с помощью разных примеров.
Для удобства в настоящем описании собраны некоторые термины, используемые в описании, примерах и прилагаемой формуле изобретения. Если в настоящем описании не указано иное, научная и техническая терминология, используемая в настоящем изобретении, должна иметь значения, которые обычно понимаются и используются средним специалистом в данной области техники.
Если иное не требуется контекстом, следует понимать, что термины в единственном числе должны включать формы множественного числа тех же самых, а термины во множественном числе должны включать единственное число. Кроме того, используемые в настоящем описании и в формуле изобретения термины «по меньшей мере один» и «один или несколько» имеют одинаковое значение и включают один, два, три или более. Кроме того, фразы «по меньшей мере один из A, B и C», «по меньшей мере один из A, B или C» и «по меньшей мере один из A, B и/или C» также используемые в данном описании и прилагаемой формуле изобретения предназначены для охвата одного A, одного B, одного C, A и B вместе, B и C вместе, A и C вместе, а также A, B и C вместе.
Несмотря на то, что числовые диапазоны и параметры, определяющие широкий объем изобретения, являются приблизительными, числовые значения, изложенные в конкретных примерах, сообщаются с максимально возможной точностью. Однако любое числовое значение по своей сути содержит определенные ошибки, обязательно являющиеся результатом стандартного отклонения, обнаруженного в соответствующих испытательных измерениях. Кроме того, используемый в настоящем описании термин «примерно» обычно означает в пределах 10%, 5%, 1% или 0,5% от заданного значения или диапазона. В качестве альтернативы термин «примерно» означает в пределах допустимой стандартной ошибки среднего значения, если его рассматривает специалист в данной области техники. За исключением рабочих/демонстрационных примеров, или если иное явно не указано, все числовые диапазоны, количества, значения и проценты, такие как количества материалов, продолжительность времени, температуры, рабочие условия, соотношения количеств и т.п., раскрытые в настоящем описании, следует понимать как измененные во всех случаях с помощью термина «примерно». Соответственно, если не указано иное, числовые параметры, изложенные в настоящем изобретении и прилагаемой формуле изобретения, являются приблизительными, что могут варьироваться по желанию. По крайней мере, каждый числовой параметр должен толковаться, по крайней мере, в свете количества сообщаемых значащих цифр и с применением обычных методов округления. В настоящем описании диапазоны могут быть выражены как от одной конечной точки до другой конечной точки или между двумя конечными точками. Все диапазоны, раскрытые в настоящем описании, включают конечные точки, если не указано иное.
Используемый в настоящем описании термин «нацеливающий элемент» относится к части молекулярной конструкции, которая прямо или косвенно связывается с представляющей интерес мишенью (например, рецептором на поверхности клетки или белком в ткани), тем самым облегчая транспортировку данной молекулярной конструкции в интересующую мишень. В некоторых примерах нацеливающий элемент может направлять молекулярную конструкцию ближе к целевой клетке. В других случаях нацеливающий элемент специфически связывается с молекулой, присутствующей на поверхности клетки-мишени, или со второй молекулой, которая специфически связывает молекулу, присутствующую на поверхности клетки. В некоторых случаях нацеливающий элемент может интернализоваться вместе с настоящей молекулярной конструкцией, как только он связывается с интересующей мишенью, следовательно, перемещается в цитозоль целевой клетки. Нацеливающий элемент может быть антителом или лигандом для рецептора клеточной поверхности, или он может быть молекулой, которая связывает такое антитело или лиганд, тем самым косвенно нацеливая настоящую молекулярную конструкцию на сайт-мишень (например, поверхность выбранной клетки). Локализация эффектора (терапевтического агента) в пораженном участке будет усилена или предпочтительна с использованием настоящих молекулярных конструкций по сравнению с терапевтическим средством без функции нацеливания. Локализация зависит от степени или относительной доли; он не предназначен для абсолютной или полной локализации эффектора на пораженном участке.
Согласно настоящему изобретению термин «эффекторный элемент» относится к части молекулярной конструкции, которая вызывает биологическую активность (например, индуцирует или подавляет иммунную активность, оказывает цитотоксическое действие, ингибирует ферменты и т.п.) или другую функциональную активность (например, рекрутинг иммуноцитов или других терапевтических молекул) после того, как молекулярная конструкция направлена к своему сайту-мишени. «Эффект» может быть терапевтическим или диагностическим. Эффекторные элементы включают те, которые связываются с клетками и/или внеклеточными иммунорегуляторными факторами. Эффекторный элемент включает в себя такие агенты, как белки, нуклеиновые кислоты, липиды, углеводы, гликопептиды, части лекарственного средства (как низкомолекулярного лекарственного средства, так и биопрепаратов), соединения, элементы и изотопы, а также их фрагменты.
Согласно настоящему изобретению, «фармакокинетический элемент» означает элемент, способный изменять по меньшей мере одну из следующих характеристик молекулярной конструкции: растворимость, клиренс, период полувыведения и биодоступность. Например, фармакокинетический элемент может включать длинную цепь PEG, имеющую молекулярную массу примерно от 20 000 до 50 000 дальтон. Альтернативно, фармакокинетический элемент может содержать цепь C8-28 жирной кислоты или цепь C8-28 дикарбоновой жирной кислоты.
Термин «биоконъюгат» в соответствии с настоящим изобретением относится к молекулярной конструкции, содержащей составной полипептид настоящего изобретения и один или несколько функциональных элементов.
Хотя термины первый, второй, третий и т. д. могут быть использованы в данном описании для описания различных элементов, компонентов, областей и/или секций, эти элементы (а также компоненты, области и/или секции) не ограничиваются этими условиями. Кроме того, использование таких порядковых номеров не подразумевает последовательность или порядок, если это явно не указано в контексте. Скорее, эти термины просто используются, чтобы отличить один элемент от другого. Таким образом, первый элемент, обсуждаемый ниже, можно назвать вторым элементом без отступления от идей примерных вариантов осуществления изобретения.
В настоящем описании термины «связь», «пара» и «конъюгат» используются взаимозаменяемо для обозначения любых средств соединения двух компонентов либо через прямую связь, либо через косвенную связь между двумя компонентами.
Используемый в настоящем описании термин «полипептид» относится к полимеру, имеющему по меньшей мере два аминокислотных остатка. Обычно полипептид содержит аминокислотные остатки длиной от 2 до примерно 200 остатков; тем не менее, он также включает макромолекулы, содержащие более 200 аминокислотных остатков. Если в настоящем описании представлена аминокислотная последовательность, также рассматриваются L-, D- или бета-аминокислотные варианты этой последовательности. Полипептиды также включают аминокислотные полимеры, в которых один или несколько аминокислотных остатков являются искусственными химическими аналогами соответствующей встречающейся в природе аминокислоты, а также встречающихся в природе аминокислотных полимеров. Кроме того, этот термин применяется к аминокислотам, соединенным пептидной связью или другими «модифицированными связями», например, когда пептидная связь заменена α-сложным эфиром, β-сложным эфиром, тиоамидом, фосфорамидом, карбоматом, гидроксилатом, и тому подобное.
В некоторых вариантах реализации настоящего изобретения предусмотрены консервативные замены аминокислот, содержащих любую из описанных в настоящем изобретении последовательностей. В различных вариантах осуществления изобретения один, два, три, четыре или пять различных остатков заменены. Термин «консервативная замена» используется для обозначения аминокислотных замен, которые существенно не изменяют активность (например, биологическую или функциональную активность и/или специфичность) молекулы. Обычно консервативные замены аминокислот включают замену одной аминокислоты на другую аминокислоту с аналогичными химическими свойствами (например, заряд или гидрофобность). Некоторые консервативные замены включают «замены аналогов», когда стандартная аминокислота заменяется нестандартной (например, редкой, синтетической и т.д.) аминокислотой, минимально отличающейся от родительского остатка. Аналоги аминокислот получают синтетическим путем из стандартных аминокислот без существенного изменения структуры родительских аминокислот, являются изомерами или предшественниками метаболитов. В настоящей заявке аминокислотные остатки (1) лизин, который содержит аминогруппу в своей боковой цепи, (2) цистеин, который содержит тиольную группу в своей боковой цепи, (3) серин и треонин, которые содержат гидроксильную группу в их боковой цепи и (4) аспарагиновая кислота и глутаминовая кислота, которые содержат карбоксильную группу в своей боковой цепи, считаются четырьмя отличительными группами аминокислот. Каждая из этих четырех групп аминокислот содержит в своих боковых цепях уникальную функциональную группу, которую можно применять для конъюгирования с различными химическими компонентами. Неприродные аминокислоты, которые содержат одинаковые функциональные группы в боковых цепях, могут быть заменены для аналогичных целей.
В некоторых вариантах реализации также рассматриваются полипептиды, содержащие по меньшей мере 80%, предпочтительно по меньшей мере 85 или 90% и более предпочтительно по меньшей мере 95 или 98% идентичности последовательностей с любой из описанных в настоящем изобретении последовательностей.
«Процент (%) идентичности аминокислотной последовательности» по отношению к полипептидным последовательностям, идентифицированным в настоящем описании, определяется как процент полипептидных остатков в последовательности-кандидата, которые идентичны аминокислотным остаткам в конкретной полипептидной последовательности, после выравнивания последовательностей и введения гэпов, если это необходимо, для достижения максимального процента идентичности последовательностей и без учета каких-либо консервативных замен как части идентичности последовательностей. Выравнивание с целью определения идентичности процентной последовательности может быть достигнуто различными способами, которые известны специалистам в данной области техники, например, с использованием общедоступного компьютерного программного обеспечения, такого как программное обеспечение BLAST, BLAST-2, ALIGN или Megalign (DNASTAR). Специалисты в данной области техники могут определить подходящие параметры для измерения выравнивания, включая любые алгоритмы, необходимые для достижения максимального выравнивания по всей длине сравниваемых последовательностей. Для целей настоящего описания сравнение последовательностей двух полипептидных последовательностей проводили с помощью компьютерной программы Blastp (protein-proteinBLAST), предоставленной в режиме онлайн Национальным центром биотехнологической информации (NCBI). Процент идентичности аминокислотной последовательности данной полипептидной последовательности A данной полипептидной последовательности B (которая альтернативно может быть сформулирована как данная полипептидная последовательность A, которая имеет определенный % идентичности аминокислотной последовательности с данной полипептидной последовательностью B) рассчитывается с помощью формулы следующим образом:
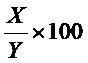 %
%
где X - количество аминокислотных остатков, подсчитанных как идентичные совпадения с помощью программы выравнивания последовательностей BLAST, при выравнивании последовательностей A и B в этой программе, а Y - общее количество аминокислотных остатков в последовательности A или последовательности B, в зависимости от того, какой из них короче.
Термин «ПЭГилированная аминокислота» в контексте настоящего описания относится к цепи полиэтиленгликоля (PEG) с одной аминогруппой и одной карбоксильной группой. Обычно ПЭГилированная аминокислота имеет формулу NH2-(CH2CH2O)n-CO2H. В настоящем описании значение n находится в диапазоне от 1 до 20; предпочтительно от 2 до 12.
Термин «конъюгирующий фрагмент», используемый здесь, относится к молекуле, имеющей одну или несколько функциональных групп (также называемых «конъюгирующей группой»), которая является химически реакционноспособной и способна ковалентно связываться с другими химическими единицами. Неограничивающие примеры функциональной группы включают гидроксил, карбонил, карбоксил, тиол, амин, трет-бутилдиметилсилил (TBDMS), N-гидроксисукцинимидил (NHS), SH-реакционоспособную группу (например, малеимид, галоацетил, сульфон или пиридилдисульфид), йод, азид йодацетамида, алкиновые, тетразиновые, циклооктеновые и циклооктиновые группы. Согласно вариантам осуществления настоящего изобретения конъюгирующий фрагмент данной молекулярной конструкции имеет две функциональные группы, одна из которых представляет собой карбоксильную или аминогруппу для связывания с альфа-амино или карбоксильной группой концевого аминокислотного остатка ядра через образование амидной связи между ними, так что конъюгирующий фрагмент связан с N- или C-концевым аминокислотным остатком ядра; а другая представляет собой SH-реакционноспособную группу для связывания со вторым элементом через SH-реакционноспособную сшивающую химию.
Используемый в настоящем описании термин «конец» по отношению к полипептиду относится к аминокислотному остатку на N- или C-конце полипептида. Что касается полимера, термин «конец» относится к структурной единице полимера (например, полиэтиленгликоль по настоящему изобретению), которая расположена на конце основной цепи полимера. В настоящем описании и формуле изобретения термин «свободный конец» используется для обозначения концевого аминокислотного остатка или структурной единицы, не связанной химически с какой-либо другой молекулой.
Термин «антиген» или «Ag» используются взаимозаменяемо и относятся к молекуле, которая вызывает иммунный ответ. Этот иммунный ответ может включать секреторный, гуморальный и/или клеточный антиген-специфический ответ. В настоящем описании термин «антиген» может быть любым из белка, полипептида (включая их мутанты или биологически активные фрагменты), полисахарида, гликопротеина, гликолипида, нуклеиновой кислоты или их комбинации.
В настоящем описании и формуле изобретения термин «антитело» или «фрагмент антитела» используется в самом широком смысле и охватывает полностью собранные антитела, фрагменты антител, которые связываются с антигенами, такие как антигенсвязывающий фрагмент (Fab/Fab'), фрагмент F(ab')2 (имеющий две антигенсвязывающие части Fab, связанные вместе дисульфидными связями), вариабельный фрагмент (Fv), одноцепочечный вариабельный фрагмент (scFv), биспецифический одноцепочечный вариабельный фрагмент (bi-scFv ), наноантитела (также называемые однодоменными антителами, sdAb), моноантитела и диантитела. «Фрагменты антител» включают часть интактного антитела, предпочтительно антигенсвязывающую область или вариабельную область интактного антитела. Фрагмент антитела может содержать пару scFv, слитых с N- или C-концом пары сегментов CH2-CH3, полученных из человеческого иммуноглобулина γ4 или γ1. Обычно «антитело» относится к белку, состоящему из одного или нескольких полипептидов, в основном кодируемых генами иммуноглобулинов или фрагментами генов иммуноглобулинов. Хорошо известные гены иммуноглобулинов включают гены константных областей каппа, лямбда, альфа, гамма, дельта, эпсилон и мю, а также множество генов вариабельных областей иммуноглобулинов. Легкие цепи классифицируются как каппа или лямбда. Тяжелые цепи классифицируются как гамма, мю, альфа, дельта или эпсилон, которые, в свою очередь, определяют классы иммуноглобулинов: IgG, IgM, IgA, IgD и IgE, соответственно. Известно, что типичная структурная единица иммуноглобулина (антитела) образует тетрамер. Каждый тетрамер состоит из двух идентичных пар полипептидных цепей, каждая пара имеет одну «легкую» цепь (около 25 кДа) и одну «тяжелую» цепь (около 50-70 кДа). N-конец каждой цепи определяет вариабельную область из примерно 100-110 или более аминокислот, в первую очередь ответственных за распознавание антигена. Термины вариабельная легкая цепь (VL) и вариабельная тяжелая цепь (VH) относятся к этим легким и тяжелым цепям, соответственно. Согласно вариантам осуществления настоящего раскрытия фрагмент антитела может быть получен путем модификации природы антитела или путем синтеза denovo с использованием методов рекомбинантной ДНК. В некоторых вариантах реализации настоящего раскрытия антитело и / или фрагмент антитела могут быть биспецифичными и могут иметь различные конфигурации. Например, биспецифические антитела могут содержать два разных антигенсвязывающих сайта (вариабельные области). В различных вариантах реализации биспецифические антитела могут быть получены гибридомным методом или методом рекомбинантной ДНК. В некоторых вариантах реализации биспецифические антитела обладают специфичностями связывания по меньшей мере с двумя разными эпитопами. Во многих молекулярных конфигурациях, в которых используются фрагменты антител, фрагменты антител могут быть заменены миметиками антител, которые связываются с теми же антигенными компонентами, что и фрагменты антител. Миметики антител включают антикалины, DARP, аффитела, фломеры, анкирины, авимеры и другие.
Термин «специфически связывается» в контексте настоящего описания относится к способности антитела или его антигенсвязывающего фрагмента связываться с антигеном с константой диссоциации (Kd) не более чем примерно 1×10−6M, 1×10−7M, 1×10−8M, 1×10−9M, 1×10−10 M, 1×10−11 M, 1×10−12M и/или способности связываться с антигеном с аффинностью, которая, по крайней мере, в два раза больше чем его аффинность к неспецифическому антигену.
Используемый в настоящем описании термин «лечение» включает предупредительное (например, профилактическое), лечебное или паллиативное лечение; и «лечение» в контексте настоящего описания также включает предупредительное (например, профилактическое), лечебное или паллиативное лечение. В частности, термин «лечение», используемый в настоящем описании, относится к применению или введению настоящей молекулярной конструкции или фармацевтической композиции, содержащей ее, субъекту, у которого есть медицинское состояние или симптом, связанный с медицинским состоянием, заболеванием или нарушением, вторичным по отношению к медицинскому состоянию или предрасположенности к заболеванию, с целью частичного или полного облегчения, улучшения, ослабления, отсрочки начала, подавления прогрессирования, уменьшения тяжести и/или уменьшения частоты одного или нескольких симптомов или особенностей указанного конкретного заболевания, расстройства и/или состояния. Лечение может быть назначено субъекту, у которого нет признаков заболевания, расстройства и/или состояния, и/или субъекту, у которого проявляются только ранние признаки заболевания, нарушения и/или состояния, с целью уменьшения риска развития патологии, связанной с заболеванием, расстройством и/или состоянием.
Термин «эффективное количество» в контексте настоящего описания относится к количеству данной молекулярной конструкции, которого достаточно для получения желаемого терапевтического ответа. Эффективное количество агента не требуется для лечения заболевания или состояния, но обеспечивает лечение заболевания или состояния, так что начало заболевания или состояния задерживается, затрудняется или предотвращается, или симптомы заболевания или состояния улучшаются. Эффективное количество может быть разделено на одну, две или более доз в подходящей форме для введения один, два или более раз в течение обозначенного периода времени. Конкретное эффективное или достаточное количество будет варьироваться в зависимости от таких факторов, как конкретное состояние, подлежащее лечению, физическое состояние пациента (например, масса тела, возраст или пол пациента), тип пациента, которого лечат, продолжительность лечения, характер сопутствующей терапии (если таковая имеется), а также конкретные используемые препараты и структура соединений или их производных. Эффективное количество может быть выражено, например, как общая масса активного компонента (например, в граммах, миллиграммах или микрограммах) или как отношение массы активного компонента к массе тела, например, как миллиграммы на килограмм (мг/кг).
Термины «применение» и «введение» используются здесь взаимозаменяемо для обозначения применения молекулярной конструкции или фармацевтической композиции по настоящему изобретению к субъекту, нуждающемуся в их лечении.
Термины «субъект» и «пациент» используются здесь взаимозаменяемо и предназначены для обозначения животного, включая человеческий вид, которое поддается лечению с помощью молекулярной конструкции, фармацевтической композиции и/или способа по настоящему изобретению. Термин «субъект» или «пациент» предназначен для обозначения как мужского, так и женского пола, если конкретно не указан один пол. Соответственно, термин «субъект» или «пациент» включает любое млекопитающее, которому может быть полезен способ лечения по настоящему изобретению. Примеры «субъекта» или «пациента» включают, но не ограничиваются ими, человека, крысу, мышь, морскую свинку, обезьяну, свинью, козу, корову, лошадь, собаку, кошку, птицу и домашнюю птицу. В примерном варианте осуществления пациентом является человек. Термин «млекопитающее» относится ко всем членам класса Mammalia, включая людей, приматов, домашних и сельскохозяйственных животных, таких как кролики, свиньи, овцы и крупный рогатый скот; а также зоопарк, спортивные или домашние животные; и грызуны, такие как мышь и крыса. Термин «нечеловеческое млекопитающее» относится ко всем членам класса млекопитающих, кроме человека.
Согласно различным вариантам осуществления настоящего изобретения термин «металлсвязывающий мотив» относится к короткому олигопептиду, способному связывать ион металла, например Zn2+, Ni2+, Co2+, Fe2+, Mn2+, orCu2+. В некоторых вариантах реализации металлсвязывающие мотивы, способные связывать ион цинка, также называют «цинк-связывающими мотивами»; тем не менее, как могут понять специалисты в данной области техники, такие метки могут также связываться с ионами других металлов с физическими и/или химическими свойствами, подобными иону цинка.
Настоящее изобретение основано, по меньшей мере, на конструировании нескольких новых металлсвязывающих мотивов, которые могут быть слиты с N- или C-концом родительского полипептида. Настоящие металлсвязывающие мотивы выгодны для конструирования биоконъюгатов в нескольких аспектах. Во-первых, настоящие металлсвязывающие мотивы представляют собой последовательности человеческого происхождения и, таким образом, они менее иммуногенны по сравнению с традиционными металлсвязывающими мотивами, которые не являются частью генома человека. Во-вторых, выход экспрессии составных полипептидов, содержащих металлсвязывающие мотивы является желательным, и экспрессированные таким образом составные полипептиды достаточно стабильны во время процессов хранения, конъюгации и очистки. В-третьих, настоящие металлсвязывающие мотивы обеспечивают легкую сайт-специфичную реакцию конъюгации между SH-группой остатка цистеина в металлсвязывающем мотиве и SH-реакционоспособной группой функционального элемента при условии, что цистеиновые остатки родительского полипептида в основном неактивны. Соответственно, настоящее изобретение предоставляет универсальные средства для конструирования многофункциональных биоконъюгатов. Ниже представлены аспекты и варианты осуществления настоящего изобретения.
(I) Металлсвязывающий мотив
Первый аспект настоящего изобретения направлен на металлсвязывающий мотив, который при подходящих условиях может образовывать комплекс с ионом металла, таким как Zn2+, Ni2+, Co2+, Fe2+, Mn2+, orCu2+.
Согласно одному варианту осуществления настоящего изобретения, металлсвязывающий мотив, содержащий аминокислотную последовательность CX1X2HA (SEQIDNo.1) в порядке от N-конца к C-концу или в порядке от C-конца к N-концу, где X1 представляет собой глицин или пролин, а X2 представляет собой глицин или аланин. Иллюстративные примеры металлсвязывающего мотива включают, но не ограничиваются ими, CGGHA (SEQIDNo. 2), CPGHA (SEQIDNo. 3), CGAHA (SEQIDNo. 4), CPAHA (SEQIDNo. 5), GCGGHA (SEQIDNo. 6), ACPGHA (SEQIDNo. 7), или GCPGHA (SEQIDNo. 8).
(II) Составной полипептид, содержащий металлсвязывающий мотив
В другом аспекте настоящее изобретение направлено на составной полипептид, который содержит металлсвязывающий мотив согласно вышеупомянутому аспекту/вариантам осуществления изобретения. Таким образом, составной полипептид способен образовывать комплекс с ионом металла через металлсвязывающий мотив при подходящих условиях.
Согласно одному варианту осуществления настоящего изобретения, составной полипептид содержит родительский полипептид и металлсвязывающий мотив в соответствии с вышеуказанным аспектом/вариантами осуществления настоящего изобретения. В различных вариантах реализации металлсвязывающий мотив, слит с N- или C-концом родительского полипептида, непосредственно или с одним или несколькими промежуточными аминокислотными остатками. В необязательных вариантах осуществления изобретения промежуточная последовательность может содержать от двух до десяти остатков глицина.
Согласно различным вариантам осуществления настоящего изобретения, когда металлсвязывающий мотив расположен на N-конце родительского полипептида, металлсвязывающий мотив может иметь последовательность CX1X2HA (SEQIDNo.1) в порядке от N- конца к С-концу или в порядке от С-конца к N-концу, где X1 представляет собой глицин или пролин, а X2 представляет собой глицин или аланин. Точно так же, когда металлсвязывающий мотив расположен на С-конце родительского полипептида, металлсвязывающий мотив может иметь последовательность CX1X2HA (SEQIDNo.1) в порядке от N-конца к C-концу или в порядок от С-конца к N-концу, где X1 представляет собой глицин или пролин, а X2 представляет собой глицин или аланин.
Согласно различным вариантам осуществления настоящего изобретения, родительский полипептид может быть пептидным гормоном или его эквивалентами. Эквиваленты пептидных гормонов включают функциональные фрагменты, предшественники, аналоги или производные, которые известны специалистам в данной области техники. Неограничивающие примеры пептидных гормонов, подходящих для использования в настоящем описании, включают адренокортикотропный гормон (ACTH), амилин, ангиотензин, предсердный натрийуретический пептид (ANP), натрийуретический пептид C-типа (CNP), кальцитонин, холецистокинин (CCK), гастрин, грелин, глюкагон, гормон роста, фолликулостимулирующий гормон (FSH), инсулин, лептин, меланоцитстимулирующий гормон (MSH), окситоцин, паратироидный гормон (PTH), пролактин, ренин, соматостатин, тиреотропный гормон (TSH), гормон, высвобождающий тиротропин (TRH), вазопрессин и вазоактивный пептид кишечника. Например, эквиваленты инсулина включают, но не ограничиваются ими, лизпро, аспарт, глулизин, детемир, деглудек и гларгин. Эквиваленты кальцитонина включают, но не ограничиваются ими, прокальцитонин и адреномедуллин. Эквиваленты соматостатина включают, но не ограничиваются ими, октреотид и ланреотид.
В некоторых вариантах реализации родительский полипептид может быть пептидомиметическим лигандом, который связывается с рецепторами клеточной поверхности. Пептидомиметики -это небольшие протеиноподобные цепочки, имитирующие пептид. Например, была разработана серия пептидомиметиков на основе глутамата-мочевины-лизина со связывающей аффинностью PSMA.
В необязательных вариантах реализации настоящего изобретения родительский полипептид может представлять собой антитело, такое как моноклональное антитело, иммуноглобулин A (IgA), IgD, IgE, IgG или IgM. Функциональные фрагменты или производные целого антитела также входят в объем настоящего изобретения, и примеры которого включают, но не ограничиваются ими, биспецифические антитела, химерные антитела, человеческие антитела, гуманизированные антитела, одноцепочечные антитела (scAbs), одноцепочечные вариабельные фрагменты (scFvs), тандемные ди-scFvs, тандемные три-scFvs, диантитела, триантитела, тетрантитела, фрагменты Fab, фрагменты F(ab’)2, Fds, доменные антитела и мини-антитела.
Альтернативно, родительский полипептид может быть цитокином или его эквивалентами. Эквиваленты цитокинов включают функциональные фрагменты, предшественники, аналоги или производные, которые известны специалистам в данной области техники. Иллюстративные примеры цитокинов включают, но не ограничиваются ими, интерлейкин-2 (IL-2), IL-10, IL-12, интерферон альфа (IFN-α), IFN-γ, трансформирующий фактор роста бета (TGF-β) и фактор некроза опухоли альфа (TNF-α).
В некоторых вариантах реализации настоящего изобретения родительский полипептид может представлять собой одноцепочечный фрагмент антитела, такой как однодоменное антитело (sdAb), одноцепочечное антитело (scAb), одноцепочечный вариабельный фрагмент (scFv), биспецифическую T-клетку-захватчик (BiTE), тандемный ди-scFv и тандемный три-scFv. В некоторых других вариантах реализации настоящего изобретения родительский полипептид может представлять собой фрагмент антитела, полученный из тяжелой цепи или легкой цепи иммуноглобулинов, и настоящий составной полипептид включает часть полноразмерного антитела, фрагментную кристаллизующуюся область (область Fc), фрагмент антигенсвязывающего фрагмента (Fab), Fab’, F(ab’)2, Fab’, Fv, (scFv)2, sc(Fv)2, диантитело, Fd, Fd' или мини-антитела. Иммуноглобулины могут происходить из иммуноглобулина D (IgD), IgE или IgG. Антитело может представлять собой биспецифическое антитело, химерное антитело, человеческое антитело, гуманизированное антитело.
В некоторых вариантах реализации антитело (а также его функциональный фрагмент) специфично для антигена клеточной поверхности, который связан с диффузной опухолью и/или сверхэкспрессируется на ней. Иллюстративные примеры таких антигенов клеточной поверхности включают CD5, CD19, CD20, CD22, CD23, CD27, CD30, CD33, CD34, CD37, CD38, CD43, CD72a, CD78, CD79a, CD79b, CD86, CD134, CD137, CD138, CD319. Антитела (или их фрагменты или производные) против этих антигенов клеточной поверхности можно использовать в качестве нацеливающих элементов, способных направлять молекулярную конструкцию, содержащую их, к месту заболевания. В других необязательных вариантах осуществления антитело (а также его функциональный фрагмент или производное) специфично для других антигенов клеточной поверхности, и такое антитело может вызывать терапевтический эффект в организме человека; примеры таких антигенов клеточной поверхности включают CD3, CD16a, CD28, CD134, цитотоксический T-лимфоцит-ассоциированный белок 4 (CTLA-4), программируемой смерти клеток1 (PD-1) и лиганд 1 программируемой смерти клеток 1 (PD-L1 )). Еще альтернативно, антитело (или его фрагмент) может быть специфичным для опухолево-ассоциированного антигена (TAA), такого как рецептор эпидермального фактора роста человека (HER1), HER2, HER3, HER4, углеводный антиген 19-9 (CA 19 -9), CA 125, карциноэмбриональный антиген (CEA), муцин 1 (MUC 1), ганглиозида GD2, антигена, связанный с меланомой (MAGE), простат-специфического мембранного антигена (PSMA), антиген стволовых клеток простаты (PSCA), мезотелина, муцин-связанного Tn, сиалированного Tn, GloboH, стадийно-специфического эмбрионального антигена-4 (SSEA-4) и адгезивной молекулы эпителиальных клеток (EpCAM). Каждый TAA часто сверхэкспрессируется на клеточной поверхности одного или нескольких типов солидных опухолей, антитело против такого TAA можно использовать в качестве нацеливающего элемента как часть предлагаемой здесь молекулярной конструкции. В некоторых других необязательных вариантах реализации антитело (или его фрагмент) специфично для фактора роста, выбранного из группы, состоящей из эпидермального фактора роста (EGF), мутантного EGF, эпирегулина, гепарин-связывающего эпидермального фактора роста (HB-EGF), фактор роста эндотелия сосудов А (VEGF-A), основной фактор роста фибробластов (bFGF) и фактор роста гепатоцитов (HGF). В некоторых вариантах реализации антитело (или его фрагмент) специфично для цитокина, описанного выше.
(III) Молекулярная конструкция функционального элемента и составного полипептида, содержащего металлсвязывающий мотив.
В еще одном аспекте один или несколько функциональных элементов могут быть ковалентно конъюгированы с составным полипептидом в соответствии с вышеупомянутым аспектом/вариантами осуществления настоящего изобретения путем взаимодействия с сульфгидрильной (SH) группой остатка цистеина в металлсвязывающем мотиве составного полипептида, тем самым образуя молекулярную конструкцию (или биоконъюгат) согласно настоящему изобретению. В частности, металлсвязывающая активность составного полипептида делает возможной сайт-специфичную конъюгацию, в результате чего получаются гомогенные молекулярные конструкции.
Согласно необязательным вариантам осуществления настоящего изобретения, SH-реакционноспособная группа представляет собой малеимидную, иодацетильную, бромацетильную, винилсульфоновую, моносульфоновую, метилсульфонилбензотиазольную или 2-пиридилдитиольную группу.
Как можно понять, функциональный элемент может быть эффекторной молекулой, способной вызывать желаемый терапевтический эффект в организме субъекта. Альтернативно, функциональный элемент может быть нацеливающим элементом, способным направлять молекулярную конструкцию к сайту-мишени в теле субъекта. Еще альтернативно, функциональный элемент представляет собой фармакокинетический элемент, способный изменять фармакокинетический профиль молекулярной конструкции в организме субъекта. Еще альтернативно, функциональный элемент находится в форме линкерного звена или связки. Согласно определенным вариантам осуществления настоящего изобретения линкерное звено содержит центральное ядро и множество нацеливающих, эффекторных или фармакокинетических элементов; структура указанного линкерного звена обсуждается в разделе (IV) ниже.
Примеры эффекторных молекул, которые можно использовать в настоящем изобретении, включают, но не ограничиваются ими, цитотоксические препараты, агонисты толл-подобных рецепторов (TLR) или хелаторы (отдельно или в комплексе с радиоактивным нуклидом).
Очевидно, что цитотоксический препарат, проявляющий цитотоксическое действие на определенные клетки, может быть антиэстрогенами (например, тамоксифеном, ралоксифеном и мегестролом), агонистами LHRH (например, госклином и лейпролидом), антиандрогенами (например, флутамид и бикалутамид), средством для фотодинамической терапии (например, вертопорфин, фталоцианин, фотосенсибилизатор Pc4 и диметоксигипокреллин A), азотистые иприты (например, циклофосфамид, ифосфамид, трофосфамид, хлорамбуцил, эстрамустин и мелфалан), нитрозомочевины (например, кармустин и ломустин), алкилсульфонаты (например, бусульфан и треосульфан), триазины (например, дакарбазин, темозоломид), соединения, содержащие платину (например, цисплатин, карбоплатин, оксалиплатин), алкалоиды барвинка (например, винкристин, винбластин, виндезин и винорелбин), таксоиды(например, паклитаксел, доцетаксеал и таксол), эпиподофиллины (например, этопозид, этопозида фосфат, тенипозид, топотекан, 9-аминокамптотецин, камптоиринотекан, иринотекан, криснатол, митомицин C), антиметаболиты, ингибиторы DHFR (например, метотрексат, дихлорметотрексат, триметрексат, эдатрексат), ингибиторы IMP дегидрогеназы (например, микофеноловая кислота, тиазофурин, рибавирин и EICAR), ингибиторы рибонуклеотидредуктазы (например, гидроксимочевина и дефероксамин), урациловые аналоги (например, 5-фторурацил (5-FU), флоксуридин, доксифлуридин, ратитрексед, тегафур-урацил, капецитабин), аналоги цитозина (например, цитарабин (araC), цитозина арабинозид и флударабин), аналоги пурина (например, меркаптопурин и тиогуанан)аналоги витамина D3 (например, EB 1089, CB 1093 и KH 1060), ингибиторы изопренилирования (например, ловастатин), дофаминергические нейротоксины (например, 1-метил-4-фенилпиридиния ион), ингибиторы клеточного цикла (например, ставроспорин), актиномицин (например, актиномицин D, дактиномицин), блеомицин (например, блеомицин A2, блеомицин B2, пепломицин),антрациклин (например, даунорубицин, доксорубицин, идарубицин, эпирубицин, пирарубицин, зорубицин, митоксантрон), ингибиторы МЛУ (например, верапамил), ингибиторы Ca2+ АТФазы (например, тапсигаргин), иматиниб, талидомид, леналидомид, ингибиторы тирозинкиназ (например, акситиниб, босутиниб, цедираниб, дазатиниб, эрлотиниб, гефитиниб, иматиниб, лапатиниб, леставртиниб, нератиниб, нилотиниб,семаксаниб, сунитиниб, тоцераниб, вандетаниб, ваталаниб, ритуксимаб, нилотиниб, сорафениб, эверолимус, темсиролимус, ингибиторы протеасом (например, бортезомиб), ингибиторы mTOR (например, рапамицин, темсиролимус, эверолимус, и ридафоролимус), облимерсен, гемцитабин, карминомицин, лейковорин, пеметрексед, циклофосфамид, дакарбазин, прокарбизин, преднизолон, дексаметазон, кампатецин, пликамицин, аспарагиназа, аминоптерин, метоптерин, порфиромицин, мелфалан, лейрозидин, лейрозин, хлорамбуцил, трабектин, прокарбазин, дискодермолид, карминомицин, аминоптерин или гексаметилмеламин. Согласно одному конкретному варианту осуществления настоящего изобретения цитотоксическое лекарственное средство представляет собой мертанзин, ауристатин, майтанзин, доксорубицин, калихеамицин или камптотецин. Согласно одному конкретному варианту осуществления настоящего изобретения цитотоксический препарат представляет собой мертанзин, ауристатин, майтанзин, доксорубицин, калихеамицин или камптотецин.
Иллюстративные примеры агонистов толл-подобных рецепторов включают липотейхоевую кислоту, глюкан, мотолимод, имиквимод, резиквимод, гардиквимод, CpG-олигодезоксинуклеотид (CpGDON), липополисахарид (LPS), монофосфориллипозид A и зимозан.
В различных вариантах реализации хелатор выбран из группы, состоящей из 1,4,7,10-тетраазациклододекан-N,N’,N″,N’-тетрауксусной кислоты (DOTA), N,N''-бис[2-гидрокси-5-(карбоксиэтил)бензил]этилендиамин-N,N''-диуксусной кислоты (HBED-CC), 1,4,7-триазациклононан-1,4,7-триуксусной кислоты (NOTA), 2-(4,7-бис(карбоксиметил)-1,4,7-триазононан-1-ил)пентандиовой кислоты (NODAGA), 2-(4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазациклододекан-1-ил)пентадиовой кислоты (DOTAGA), 1,4,7-триазациклононан фосфиновой кислоты (TRAP), 1,4,7-триазациклононан-1-[метил(2-карбоксиэтил)фосфиновой кислоты]-4,7-бис[метил(2-гидроксиметил)фосфиновой кислоты] (NOPO), 3,6,9,15-тетраазабицикло[9,3,1]пентадека-1(15), 11,13-триен-3,6,9-триуксусной кислоты (РСТА), N'-{5-[ацетил(гидрокси)амино]пентил}-N-[5-({4-[(5-аминопентил)(гидрокси)амино]-4-оксобутаноил}амино)пентил]-N-гидроксисукцинамид (DFO) и диэтилентриаминпентауксусной кислоты (DTPA), транс-циклогексил-диэтилентриаминпентауксусная кислота (CHX-DTPA), 1-окса-4,7,10-триазациколододекан-4,7,10-триуксусная кислота (oxo-Do3A), p-изотиоцианатобензил-DTPA (SCN-Bz-DTPA), 1-(p-изотиоцианатобензил)-3-метил-DTPA (1B3M), 2-(p-изотиоцианатобензил)-4-метил-DTPA (1M3B), и 1-(2)-метил-4-изоцианатобензил-DTPA (MX-DTPA). В некоторых вариантах реализации радиоактивный нуклид представляет собой 111In, 131I, или 177Lu, в других вариантах реализации радиоактивный нуклид может быть 90Y, 68Ga, 99mTc, 64Cu, 153Gd, 155Gd, 157Gd, 213Bi, 225Ac или Fe.
В других вариантах осуществления изобретения выбор эффекторных элементов для молекулярных конструкций по настоящему изобретению также охватывает широкий диапазон молекул на основе пептидов, включая (1) фрагменты антител, специфичные для воспалительных цитокинов (таких как TNF-α, IL-12/IL-23, IL-17, IL-1, IL-6, BAFF), (2) фрагменты антител, специфичные для RANKL, (3) фрагменты антител для CD3 и CD16a, экспрессированные на Т-клетках и NK-клетках, (4) фрагменты антител, специфичные для PD-1, PD-L1, CTLA-4 и других иммунных контрольных точек, и (5) иммуноусиливающие цитокины (IFN-α, IFN-γ, IL-2, TNF-α).
Нацеливающиеэлементы для использования в вариантах осуществления настоящего изобретения могут быть выбраны в зависимости от заболевания, которое необходимо лечить. Например, нацеливающие элементы для лечения различных заболеваний включают (1) фрагменты антител, специфичные для компонентов внеклеточного матрикса в суставах, коже или костях, таких как коллаген I, коллаген II, коллаген III, коллаген V, коллаген VII, коллаген IX, коллаген. XI, α-аггрекан и остеонектин; (2) фрагменты антител, специфичные для кластера маркеров дифференцировки, таких как CD19, CD20, CD22, CD30, CD52, CD79a, CD79b, CD38, CD56, CD74, CD78, CD138; или , CD319, CD5, CD4, CD7, CD8, CD30; или CD13, CD14, CD15, CD33, CD34, CD36, CD37, CD41, CD61, CD64, CD65, и CD11c и другие поверхностные антигены клеток лимфоидного и миелоидного происхождения и плазматических клеток, или (3) фрагменты антител, специфичные для рецепторов или антигенов, которые сверхэкспрессируются на поверхности клеток солидных опухолей, такие как рецептор эпидермального фактора роста человека (HER1), HER2/Neu, HER3, Tn, GloboH, ганглиозид GD-2, CA125, CA19-9 и карциноэмбриональный антиген ( CEA).
Нацеливающими элементами также могут быть антитела к гормонам, факторам роста или цитокинам, в которых рецепторы гормонов, факторов роста или цитокинов экспрессируются на опухолевых клетках или других пораженных клетках. В некоторых других необязательных вариантах реализации нацеливающий элемент настоящей молекулярной конструкции представляет собой фактор роста.
Согласно некоторым вариантам осуществления настоящего изобретения, по меньшей мере, один из родительского полипептида и функционального элемента настоящего изобретения представляет собой фрагмент антитела, специфичный для фактора роста. В некоторых вариантах реализации фактор роста выбран из группы, состоящей из эпидермального фактора роста (EGF), мутантного EGF, эпирегулина, гепаринсвязывающего эпидермального фактора роста (HB-EGF), фактора роста эндотелия сосудов A (VEGF-A), основного фактор роста фибробластов (bFGF) и фактор роста гепатоцитов (HGF). Согласно концепции, аналогичной описанной выше, когда нацеливающим элементом является фактор роста (например, EGF), настоящая молекулярная конструкция способна специфически нацеливаться на экспрессирующую рецептор клетку/ткань/орган (например, опухолевую клетку с экспрессируемым рецептором EGF на нем). В случае, если эффекторный элемент представляет собой фрагмент антитела, специфичный для фактора роста (например, VEGF-A), он может захватывать и нейтрализовать путь передачи сигнала, связанный с фактором роста (например, ангиогенез, индуцированный VEGF-A). Согласно одному рабочему примеру, настоящая молекулярная конструкция полезна при лечении солидных опухолей, в которых эффекторный элемент представляет собой фрагмент антитела, специфичный для VEGF-A.
Примерами фармакокинетических элементов являются производные C8-28 жирной кислоты или производные C8-28 дикарбоновой жирной кислоты. Каждый фармакокинетический элемент связан с одним из К остатков через ε-аминокислотную группу остатка К. Согласно различным вариантам осуществления настоящего изобретения функциональный элемент представляет собой производное жирной кислоты, которое является производным октановой кислоты, пеларгоновой кислоты, декановой кислоты, ундекановой кислоты, лауриновой кислоты, тридекановой кислоты, миристиновой кислоты, пентадекановой кислоты, пальмитиновой кислоты, маргариновой кислоты, стеариновой кислоты, нонадекановой кислоты, арахиновой кислоты, генейкозановой кислоты, бегеновой кислоты, трикозановой кислоты, лигноцериновой кислоты, пальмитолеиновой кислоты, олеиновой кислоты, линолевой кислоты, рицинолеиновой кислоты или вакценовой кислоты, эйкозапентаеновой кислоты (EPA), докозагексаеновой кислоты (DHA). Согласно некоторым вариантам осуществления настоящего изобретения функциональный элемент представляет собой производное дикарбоновой жирной кислоты, которой является производным субериновой кислоты, азелаиновой кислоты, себациновой кислоты, ундекандикарбоновой кислоты, додекандикарбоновой кислоты, брассиловой кислоты, тетрадекандикарбоновой кислоты, пентадекандикарбоновой кислоты, тапсиновой кислоты, гептадекандикарбоновой кислоты или октадекандикарбоновой кислоты. В некоторых вариантах реализации настоящий функциональный элемент является производным миристиновой кислоты или пальмитиновой кислоты. В других вариантах осуществления настоящий функциональный элемент является производным тетрадекандикарбоновой кислоты или тапсиновой кислоты.
(IV) Линкерное звено для конъюгирования с составным полипептидом, содержащим металлсвязывающий мотив
В некоторых необязательных вариантах осуществления изобретения функциональный элемент, конъюгированный с вышеупомянутым составным полипептидом, находится в форме связки или линкерного звена. Согласно некоторым вариантам осуществления настоящего изобретения линкерное звено содержит центральное ядро и множество нацеливающих, эффекторных или фармакокинетических элементов. Как можно понять, такие линкерные звенья также подпадают под объем защиты настоящего изобретения.
Согласно некоторым вариантам осуществления настоящего изобретения линкерное звено содержит центральное ядро и множество нацеливающих, эффекторных или фармакокинетических элементов в соответствии с вышеупомянутым аспектом/вариантами осуществления изобретения.
В частности, центральное ядро представляет собой полипептид, который имеет длину от 3 до 120 аминокислотных остатков и включает от 2 до 10 остатков лизина (К); например, настоящее ядро может содержать 2, 3, 4, 5, 6, 7, 8, 9 или 10 K остатков. Любые два остатка K примыкают друг к другу или разделены наполнителем. В некоторых случаях SH-реакционноспособная группа связана с первым или последним остатком K центрального ядра путем образования с ним амидной связи. В других случаях центральное ядро дополнительно содержит концевой спейсер, а SH-реакционноспособная группа связана с концевым аминокислотным остатком концевого спейсера, образуя с ним амидную связь. Таким образом, возможно конъюгировать концевую SH-реакционноспособную группу данного линкерного звена с SH-группой остатка цистеина металлсвязывающего мотива составных полипептидов при условии, что остатки цистеина родительского полипептида в основном неактивны, тем самым достигая сайт-специфичной конъюгации, которая приводит к гомогенным молекулярным конструкциям.
Концевые спейсеры могут представлять собой N-концевой спейсер, связанный с N-концом первого K остатка, или C-концевой спейсер, связанный с C-концом последнего K остатка. Каждый из наполнителя и концевого спейсера содержит, независимо, (1) от 1 до 12 аминокислотных остатков, отличных от K, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG).
В случаях, когда линкерное звено не имеет связывающих ветвей, каждый нацеливающий, эффекторный или фармакокинетический элемент связан с К остатком ядра посредством образования амидной связи с ε-аминогруппой остатка К. С другой стороны, когда линкерное звено молекулярной конструкции дополнительно содержит от 2 до 10 связывающих ветвей, один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остаток, а другой конец каждой связывающей ветви связан с каждым нацеливающим, эффекторным или фармакокинетическим элементом. Например, связывающая ветвь может быть пептидом, содержащим 2-12 аминокислотных остатков, отличных от K, или цепью полиэтиленгликоля (PEG), имеющей 2-24 повтора EG-звеньев.
Согласно необязательным вариантам осуществления настоящего изобретения, перед конъюгированием с нацеливающим, эффекторным или фармакокинетическим элементом свободный конец связывающей ветви (т.е. конец, который не связан с остатком лизина центрального ядра) может нести связывающую группу, выбранную из группы, состоящей из аминовой, карбоксильной, N-гидроксисукцинимидильной (NHS), азидной, алкиновой, циклооктиновой, тетразиновой и циклооктеновой групп. В зависимости от связывающей группы (например, аминной, карбоксильной, NHS, азидной, алкиновой, циклооктиновой, тетразиновой или циклооктеновой группа) модификация аминогруппы боковой цепи остатка лизина (в случаях, когда связывающая ветвь отсутствует) или настоящая связывающая группа, присутствующая на свободном конце связывающей ветви, можно сконструировать функциональный элемент (такой как нацеливающий элемент, терапевтический эффекторный элемент или фармакокинетический элемент) с соответствующей функциональной группой, так чтобы функциональный элемент мог быть связан со свободным концом связывающей ветви посредством любой из следующих химических реакций,
(1) образования амидной связи между ними: в этом случае связывающая группа представляет собой аминную, карбоксильную или NHS-группу, а функциональный элемент имеет аминную или карбоксильную группу;
(2) клик-реакции азид-алкинового циклоприсоединения, катализируемого медью(I) (реакция CuAAC): одна из связывающей группы и функционального элемента имеет азидную или пиколилазидную группу, тогда как другая имеет алкиновую группу;
(3) реакции Дильса-Альдера с обратными электронными требованиями (iEDDA): одна из связывающей группы и функционального элемента имеет тетразиновую группу, тогда как другая имеет циклооктеновую группу (например, TCO или норборненовую группу); или
(4) реакцииоблегченного напряжения азид-алкинового циклоприсоединения (SPAAC): одна из окрашивающей группы и функционального элемента имеет азидную группу, а другая - циклооктинную группу.
Согласно различным вариантам осуществления настоящего изобретения тетразиновая группа представляет собой 1,2,3,4-тетразин, 1,2,3,5-тетразин, 1,2,4,5-тетразин или их производные; циклооктеновая группа представляет собой норборнен или транс-циклооктеновую (TCO) группу; и циклооктиновая группа выбрана из группы, состоящей из дибензоциклооктина (DIBO), дифторированного циклооктина (DIFO), бициклононина (BCN) и дибензоазациклооктина (DIBAC или DBCO). Согласно одному варианту осуществления настоящего изобретения тетразиновая группа представляет собой 6-метилтетразин.
Согласно некоторым необязательным вариантам осуществления настоящего изобретения центральное ядро несет локальный отрицательный заряд на аминокислотном остатке, связанном с SH-реакционноспособной группой, или рядом с ним. В частности, локальный отрицательный заряд присутствует в пределах первых 5-15 аминокислотных остатков внутри аминокислотного остатка, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Например, локальный отрицательный заряд присутствует в первых 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных остатках, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Локальный отрицательный заряд может быть придан путем включения одного или нескольких отрицательно заряженных аминокислотных остатков при pH=7, таких как остаток аспартата (D) и глутамата (E).
В качестве альтернативы, ядро может быть сопряжено с множеством эффекторных элементов, которые заряжены отрицательно, так что центральное ядро несет локальный отрицательный заряд на или рядом с SH-реакционноспособной группой. Например, эффекторный элемент может содержать хелатор (например, DOTA, DOTAGA и т.п.), который может увеличивать чистый отрицательный заряд линкерного звена в целом.
Нацеливающие, эффекторные и фармакокинетические элементы, описанные в разделе (III) выше, применимы в вариантах реализации раздела (IV), и их подробное описание здесь опущено для краткости. В различных вариантах осуществления линкерные звенья, несущие множество эффекторных элементов, называются «эффекторными связками» или «связками лекарственный средств», линкерное звено, несущее множество хелаторов, упоминается как «хелаторные связки», линкерное звено, несущее множество нацеливающих элементов, упоминается как «нацеливающие связки», линкерное звено, несущее множество scFv, упоминается как «scFv связки», линкерноезвено, несущее множество фармакокинетических элементов, упоминается как «фармакокинетические (PK) связки», а линкерноезвено, несущеемножество цепей жирных кислот и/или дикарбоновых жирных кислот называют «связками жирных кислот (ЖК)».
В некоторых вариантах реализации производное жирной кислоты (или дикарбоновой жирной кислоты) представляет собой химически модифицированную молекулу жирной кислоты (или дикарбоновойжирной кислоты). Например, карбоксильная группа молекулы жирной кислоты (или одна из карбоксильных групп молекулы дикарбоновой жирной кислоты) реагирует с химическим фрагментом с двумя функциональными группами, в которых одна функциональная группа является карбоксил-реакционоспособной (таким образом, образуя ковалентная связь с молекулой (дикарбоновой) жирной кислоты), тогда как другая представляет собой функциональную группу, реагирующую с аминогруппой боковой цепи остатка лизина. Согласно необязательным вариантам осуществления настоящего изобретения химическое соединение, модифицирующее молекулу (дикарбоновой) жирной кислоты, представляет собой остаток глутамата, остаток аспартата, амино-EG2-кислоту, гамма-аминомасляную кислоту или тому подобное; однако настоящее изобретение этим не ограничивается.
Как можно понять, в случаях, когда в родительском полипептиде нет остатка цистеина или других аминокислотных остатков, содержащих сульфгидрильную группу, можно ввести концевой остаток цистеина вместо концевого металлсвязывающего мотива, с образованием составного полипептида, и настоящее линкерное звено может образовывать конъюгат с таким составным полипептидом через концевой остаток цистеина.
(V) Линкерное звено, несущее множественные составные полипептиды, содержащие металлсвязывающий мотив
В еще одном аспекте настоящее изобретение направлено на линкерное звено, способное нести множество составных полипептидов в соответствии с вышеупомянутым аспектом/вариантами осуществления настоящего изобретения. В некоторых вариантах реализации такие линкерные звенья называют «пептидными связками».
Согласно некоторым вариантам осуществления настоящего изобретения линкерное звено содержит центральное ядро, от 2 до 10 связывающих ветвей и от 2 до 10 составных полипептидов согласно вышеупомянутому аспекту/вариантам осуществления изобретения. Связывающие ветви такого линкерного звена имеют SH-реакционноспособную группу на своем свободном конце, и, поскольку каждый составной полипептид имеет настоящий металлсвязывающий мотив, можно конъюгировать составные полипептиды со связывающейветвью сайт-специфическим способом, в состоянии, при котором остатки цистеина родительского полипептида в основном неактивны.
В частности, центральное ядро представляет собой полипептид, который имеет длину от 3 до 120 аминокислотных остатков, причем ядро содержит от 2 до 10 остатков лизина (К); например, настоящее ядро может содержать 2, 3, 4, 5, 6, 7, 8, 9 или 10 K остатков и конъюгированную группу. Любые два остатка K примыкают друг к другу или разделены наполнителем.
В некоторых случаях центральное ядро дополнительно содержит конъюгированную группу, связанную с первым или последним К остатком центрального ядра, образуя с ним амидную связь. Примеры конъюгированной группы включают, но не ограничиваются ими, азидные, алкиновые, тетразиновые, циклооктеновые и циклооктиновые группы.
В других случаях центральное ядро дополнительно содержит концевой спейсер, а конъюгирующая группа связана с концевым аминокислотным остатком концевого спейсера, образуя с ним амидную связь. Концевые спейсеры могут быть N-концевыми спейсерами, связанными с N-концом первого K остатка, или C-концевым спейсером, связанным с C-концом последнего K остатка.
Каждый из наполнителя и концевого спейсера содержит, независимо, (1) от 1 до 12 аминокислотных остатков, отличных от K, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG). В общем, упомянутый выше концевой спейсер или наполнитель может быть (1) олигопептидом 1-12 (т.е. 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12) аминокислотных остатков, отличных от аминокислотного остатка K, или (2) ПЭГилированной аминокислотой с EG-звеньями от 1 до 12 (т.е. с 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 , 11 или 12 звеньев EG). В частности, в случае, когда настоящее ядро содержит множество K остатков, концевой спейсер или наполнитель может содержать либо ПЭГилированную аминокислоту, имеющую 2-12 звеньев EG, либо 1-12 аминокислотных остатков, не являющихся K, где каждый из аминокислотных остатков, отличных от K, соответственно выбран из группы, состоящей из глицина (G), аспарагиновой кислоты (D), глутаминовой кислоты (E), серина (S), аргинина (R), гистидина (H), треонина ( T), аспарагина (N), глутамина (Q), пролина (P), аланина (A), валина (V), изолейцина (I), лейцина (L), метионина (M), фенилаланина (F), тирозина ( Y) и триптофана (W) остатков; предпочтительно каждый из аминокислотных остатков, отличных от K, соответственно выбран из группы, состоящей из G, S, R, H, T, N, Q, P, A, V, I, L, M, F, Y, и W остатков; более предпочтительно, чтобы каждый из аминокислотных остатков, отличных от K, является соответственно G и/или S остатками.
Согласно некоторым вариантам осуществления изобретения, один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остатка, тогда как другой конец каждой связывающей ветви имеет сульфгидрильную группу (SH)-реакционноспособную группу. Например, связывающая ветвь может быть пептидом, содержащим 2-12 аминокислотных остатков, отличных от K, или цепью полиэтиленгликоля (PEG), имеющей 2-24 повтора EG-звеньев.
Иллюстративные SH-реакционноспособные группы включают малеимидную, галогенацетильную (например, йодацетил или бромацетил), сульфоновую (например, винилсульфон, моносульфон, метилсульфонилбензотиазол) и пиридилдисульфидную (например, 2-пиридилдитиол) группу.
Согласно некоторым вариантам осуществления настоящего изобретения, связывающая ветвь представляет собой пептид, содержащий 2-12 (т.е. 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12) аминокислотных остатков (каждый из которых может быть натуральным или неприродным аминокислотным остатком), кроме аминокислотного остатка К. Например, связывающая ветвь представляет собой пептид, содержащий 2-12 аминокислотных остатков, независимо выбранных из группы, состоящей из: G, E, D, S, R, H, T, N, Q, P, A, V, I, L, M, F, Y и W остатков. Согласно одному рабочему примеру, связывающая ветвь представляет собой пептид, содержащий 5-10 аминокислотных остатков, которые независимо выбраны из группы, состоящей из остатков G, S, E и R. В качестве альтернативы, связывающая ветвь может быть цепью PEG, имеющей 2-24 (т.е. 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 , 19, 20, 21, 22, 23 или 24) повторов звеньев EG; предпочтительно 5-15 повторов звеньев EG; более предпочтительно 6-12 повторов звеньев EG. Понятно, что пептидная или ПЭГ-цепь связующей ветви может быть заменена полимером примерно такой же длины. Полимер, содержащий углевод или другие гидрофильные составляющие, подходит для использования в качестве связывающих ветвей.
Согласно некоторым вариантам осуществления настоящего изобретения каждая связывающая ветвь несет локальный отрицательный заряд на аминокислотном остатке, связанном с SH-реакционноспособной группой, или рядом с ним. В частности, локальный отрицательный заряд присутствует в пределах первых 5-15 аминокислотных остатков внутри аминокислотного остатка, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Например, локальный отрицательный заряд присутствует в первых 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 аминокислотных остатках, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой. Локальный отрицательный заряд может быть обеспечен путем включения одного или нескольких отрицательно заряженных аминокислотных остатков при pH=7, таких как остаток аспартата (D) и глутамата (E).
Как можно понять, когда настоящее ядро содержит, по меньшей мере, два концевых спейсера или наполнители, каждый из концевых спейсеров или наполнителей может быть одинаков или различен; то есть каждый концевой спейсер или наполнитель может содержать одинаковые или разные аминокислотные последовательности и/или звенья EG. Согласно одному варианту осуществления настоящего изобретения настоящее ядро содержит три наполнителя, в которых один из спейсеров представляет собой ПЭГилированную аминокислоту, имеющую 8 повторов звена EG, а два других спейсера представляют собой соответственно один остаток S и один остаток G. Согласно другому варианту осуществления настоящего изобретения настоящее ядро содержит один концевой спейсер и четыре наполнителя, в которых один из спейсеров состоит из четырех остатков G и двух остатков S, в то время как другие четыре спейсера соответственно состоят из одного остатка G и одного остатка S. Согласно еще одному варианту осуществления настоящего изобретения настоящее ядро содержит два концевых спейсера и три наполнителя, каждый из которых представляет собой ПЭГилированную аминокислоту, имеющую 4 повтора звена EG.
Согласно необязательным вариантам осуществления настоящего изобретения вышеупомянутое линкерное звено, содержащее множество составных полипептидов (или пептидную связку), может быть конъюгировано с дополнительным линкерным звеном путем взаимодействия с конъюгирующей группой центрального ядра с образованием молекулярной конструкции. Например, указанное дополнительное линкерноезвено может быть эффекторной связкой, нацеливающей связкой или PK связкой. Например, дополнительное линкерное звено может иметь структуру, аналогичную описанной в ранее поданных заявках на патенты заявителя. Вкратце, дополнительное линкерное звено может иметь структуру, аналогичную описанной в разделе (III) выше, за исключением того, что концевая SH-реакционноспособная группа заменена конъюгирующей группой, которая соответствует конъюгированной группе пептидной связки.
В вариантах осуществления изобретения, где нацеливающие или эффекторные элементы, переносимые указанным дополнительным линкерным звеном, представляют собой элементы на основе пептида, указанный элемент на основе пептида может иметь цинк-связывающий мотив, описанный выше, а дополнительное линкерное звено может принимать структуру настоящей пептидной связки, тем самым формируя молекулярную конструкцию, состоящую из двух пептидных связок, несущих различные типы функциональных элементов.
В некоторых необязательных вариантах реализации изобретения группа конъюгации является частью конъюгирующего фрагмента, который имеет функциональную группу, способную образовывать ковалентную связь с α-аминогруппой (-NH2) концевого аминокислотного остатка (т.е. первый связывающий аминокислотный остаток или N-концевой аминокислотный остаток N-концевого спейсера) или карбоксильной группой (-COOH) концевого аминокислотного остатка (т.е. последний связывающий аминокислотный остаток или C-концевой аминокислотный остаток С-концевого спейсера), так что конъюгирующий фрагмент связан с ним. В определенном варианте осуществления ядро может иметь только один из N- и C-концевых спейсеров и имеет как первый, так и второй конъюгированные фрагменты, которые соответственно связаны с двумя концевыми аминокислотными остатками (которые могут быть концевым связывающим аминокислотным остатком или концевым аминокислотным остатком концевого спейсера). Существуют также варианты осуществления изобретения, в которых ядро содержит как N-, так и C-концевые спейсеры, и два конъюгированных фрагмента соответственно связаны с концевыми аминокислотными остатками двух концевых спейсеров. В предпочтительных вариантах ковалентная связь, образованная между конъюгирующим фрагментом и концевым аминокислотным остатком, представляет собой амидную связь. Как можно понять, для обеспечения гомогенности полученной связки важно, чтобы один конъюгированный фрагмент имел только одну функциональную группу, которая может реагировать либо с α-аминогруппой, либо с карбоксильной группой.
Необязательно, конъюгирующий фрагмент дополнительно включает цепь PEG, имеющую 2-10 (т.е. 2, 3, 4, 5, 6, 7, 8, 9 или 10) повторов звена EG, соединяющих карбоксильную или аминогруппу и конъюгированную группа; например, цепь PEG может иметь 4, 6, 7 или 8 повторов звена EG.
Согласно различным вариантам осуществления настоящего изобретения два конъюгированных фрагмента могут иметь одинаковую или различную реакционную способность. Предпочтительно, когда вторая конъюгирующая группа конъюгирующего фрагмента представляет собой азидную, алкиновую или циклооктиновую группу, тогда связывающая группа связывающей ветви не может быть какой-либо из азидной, алкиновой или циклооктиновой группы, чтобы избежать реакции между второй конъюгированной группой и связующей группой; скорее, связывающая группа может представлять собой тетразиновую, циклооктеновую, аминную, карбоксильную или N-гидроксисукцинимидильную (NHS) группу. Альтернативно, когда вторая конъюгирующая группа представляет собой тетразиновую или циклооктеновую группу, связывающая группа не может быть тетразиновой или циклооктеновой группой; вместо этого связывающая группа может представлять собой азидную, алкиновую, циклооктинную, аминную, карбоксильную или N-гидроксисукцинимидильную (NHS) группу.
Как можно понять, количество необязательных связывающих ветвей, связанных с ядром, в основном определяется количеством связывающих аминокислотных остатков (то есть K остатков), содержащихся в ядре. Поскольку в настоящее ядро входят по меньшей мере два связывающих аминокислотных остатка, настоящая нацеливающая или эффекторная связка может включать множество связывающих ветвей.
Как можно понять, описание, касающееся эффекторных, нацеливающих или фармакокинетических элементов, применимо ко всем аспектам/вариантам осуществления изобретения, включающих такие элементы, если контекст явно не указывает иное.
Как можно понять, во время твердофазного синтеза пептидного центра ядра вместо присоединения функциональных элементов к ядру после того, как ядро было синтезировано, также возможно включить K аминокислотный остаток, модифицированный специфическим функциональным элементом в пептидной цепи. Следовательно, согласно различным вариантам осуществления, K остатки, модифицированные различными функциональными элементами, могут быть добавлены последовательно во время твердофазного синтеза, чтобы получить партию гомогенных фармакокинетических связок, где каждая фармакокинетическая связка может иметь два или более различных функциональных элемента, связанных с ним.
Следующие ниже примеры предоставлены для разъяснения определенных аспектов настоящего изобретения и для помощи специалистам в данной области техники в практическом применении этого изобретения. Эти примеры никоим образом не следует рассматривать как ограничивающие объем изобретения каким-либо образом. Без дальнейшего уточнения считается, что специалист в данной области техники может, основываясь на приведенном здесь описании, использовать настоящее изобретение в его самом полном объеме.
Пример 1
Синтезцентрального ядра Mal-пептид 1
В этом примере пептид, имеющий пять остатков лизина, был разработан настоящим изобретателем, и производство было передано на внешний подряд компании KareBayCo., Ltd. (MonmouthJunction, СШA). Этот пептид можно использовать в качестве центрального ядра для построения линкерного звена или функциональной связки. Mal-пептид 1 (малеимидо-этил-GGSGGSKGSKGSKGSKGSK; SEQIDNo. 11) синтезировали с использованием стандартного основанного на Fmoc твердофазного метода. Mal-пептид 1 имел чистоту 95,67%.
Идентификацию синтезированного таким образом пептида проводили с использованием масс-спектрометрии MALDI-TOF. Масс-спектрометрические анализы были выполнены в Mass Core Facility of Institute of Molecular Biology (IMB), Academia Sinica, Taipei, Taiwan. Измерения проводили на масс-спектрометре Bruker Autoflex III MALDI-TOF/TOF (Bruker Daltonics, Bremen, Germany).
На Фигуре 1 проиллюстрирован результат масс-спектрометрии MALDI-TOF, который показывает, что Mal-пептид 1 имеет молекулярную массу 1,790.916 дальтон.
Пример 2
Синтез связки Mal-пептид 2-DOTA
В этом примере хелаторная связка (см. Фиг.2), содержащая малеимид-содержащий пептид с тремя остатками лизина в качестве центрального ядра и тремя молекулами DOTA, конъюгированными с центральным ядром (связка Mal-пептид 2-DOTA) была сконструирована настоящими изобретателями, а производство было передано на аутсорсинг компании KareBayCo., Ltd. (Monmouth Junction, USA)
Mal-пептид 2 (малеимидо-этил-GGSGGSGKGGSGGSGKGGSGGSGK, SEQIDNo. 12) для использования в качестве центрального ядра был синтезирован с использованием стандартного основанного на Fmoc твердофазного метода, а затем молекулы DOTA конъюгированы с центральным ядром с использованием жидкофазного синтеза.
Синтезированный таким образом очищенный образец хелаторной связки анализировали с использованием обращенно-фазовой аналитической высокоэффективной жидкостной хроматографии (ВЭЖХ) на колонке SupelcoC18 (250 мм × 4,6 мм; 5 мкм) с использованием подвижной фазы ацетонитрила и 0,1% трифторуксусной кислоты, линейного градиента от 0% до 100% ацетонитрила более30 минут, при скорости потока 1,0 мл/мин и температуре колонки 35°C. На Фигуре 3А проиллюстрированпрофиль обращенно-фазовой ВЭЖХ хелаторной связки из Примера 2, который показывает, что пик хелаторной связки имеет время удерживания 7,06 минут.
Идентификацию связки Mal-пептид 2-DOTA проводили масс-спектрометрией MALDI-TOF. На Фиг. 3В показан результат масс-спектрометрии MALDI-TOF, показывающий, что настоящая хелаторная связка имеет молекулярную массу 3,093.454 дальтон.
Пример 3
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD19)-Fc-MBM-1
VL и VHscFv, специфичные для CD19 человека, были получены из моноклонального антитела RB4v1.2. Последовательность гена, кодирующая рекомбинантную цепь scFv-CH2-CH3 (γ1 человека), была сконфигурирована путем слияния последовательности гена, кодирующей scFv, специфичный для человеческого CD19, с вышестоящей последовательностью гена, кодирующей гибкую шарнирную область и CH2 домен IgG1.Fc, а последовательность гена, кодирующая металлсвязывающий мотив (MBM)-1, ACPGHA(SEQIDNo. 7), была слита с последовательностью гена, кодирующей CH3 домен IgG1.Fc, и коротким гибким линкером GGGG (SEQIDNo. 9).
ScFv были сконфигурированы в двух ориентациях, то есть VL-линкер-VH и VH-линкер-VL, где VL и VH были связаны гидрофильным линкером GSTSGSGKPGSGEGSTKG (SEQIDNo. 10). Аминокислотные последовательности рекомбинантной цепи настоящего (scFvαCD19)-Fc-MBM-1 в конфигурациях VL-линкер-VH и VH-линкер-VL показаны в SEQIDNO: 13 и 14, соответственно, а общая структура этих 2-цепочечных (scFvαCD19)-Fc-MBM-1 молекулярных конструкций представлена на фиг. 4A.
Для получения вышеупомянутых рекомбинантных белков использовали систему сверхэкспрессии млекопитающих на основе линии клеток Expi293F™. В этой системе использовался ExpiFectamine™ 293 набор для трансфекции (LifeTechnologies, Carlsbad, США), состоящий из линии клеток Expi293F ™, катионного реагентана основе липидов ExpiFectamine™ 293 и ExpiFectamine™ 293 усилителей трансфекции 1 и 2, а также среды, которая была частью системы экспрессии (Gibco, NewYork, США).
Последовательность гена, сконструированную, как описано выше, помещали в кассету экспрессии pcDNA3. Клетки Expi293F высевали с плотностью of 2.0 × 106 жизнеспособных клеток/мл в Expi293F среде экспрессии и выдерживали в течение 18-24 часов перед трансфекцией, чтобы гарантировать, что клетки активно делились во время трансфекции. Для трансфекции в 2-литровойвстряхивающей колбеЭрленмейера 7.5×108клеток в 255 мл среды трансфицировали с использованием ExpiFectamine™ 293 реагента для трансфекции в соответствии с инструкциями производителя. Трансфицированные клетки инкубировали при 37°C в течение 16-18 часов после трансфекции в орбитальном шейкере (125 об/мин), а затем инкубированные клетки добавляли с ExpiFectamine™ 293 усилителем трансфекции 1 и усилителем 2 во встряхивающую колбу и инкубировали в течение еще 5-6 дней. Собирали супернатанты культур и экспрессированные рекомбинантные белки, слитые с hIgG1.Fc, в среде очищали с использованием аффинной хроматографии с белком А.
После замены буфера на фосфатно-солевой буфер (PBS) концентрацию присутствующего (scFvαCD19)-Fc-MBM-1 определяли и анализировали с использованием 10% SDS-PAGE. Результаты показывают, что настоящий (scFvαCD19)-Fc-MBM-1 имел молекулярную массу около 120 кДа на невосстанавливающем SDS-PAGE, что несколько больше ожидаемого размера 110 кДа. На фиг. 4В в качестве примера показан результат невосстанавливающего SDS-PAGE для 2-цепочечного (VL-VHscFvαCD19)-Fc-MBM-1 (см. основную полосу, указанную стрелкой). Как можно понять, результаты SDS-PAGE здесь предназначены для быстрого подтверждения приблизительной молекулярной массы синтезированной таким образом молекулярной конструкции, а более точный анализ молекулярной массы был определен с использованием масс-спектрометрического анализа. Например, результат MALDI-TOF настоящей молекулярной конструкции представлен на Фигуре 23.
Пример 4
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD19)-Fc-MBM-2
В этом примере рекомбинантный 2-цепочечный (scFvαCD19)-Fc-MBM-2 в конфигурации VL-линкер-VH был сконструирован, экспрессирован и очищен с использованием протоколов, аналогичных тем, которые изложены в рабочем примере выше, за исключением того, что использовали другой металлсвязывающий мотив, GCPGHA (SEQIDNo. 8, далее здесь, MBM-2). Аминокислотные последовательности рекомбинантной цепи настоящего (VL-VHscFvαCD19)-Fc-MBM-2 показаны в SEQIDNo. 15.
Результаты SDA-PAGE на Фигуре 5 показывают, что рекомбинантная цепь данной молекулярной конструкции имеет размер около 120 кДа (указано стрелкой), что несколько больше ожидаемого размера.
Пример 5
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD19)-Fc-MBM-3
В этом примере рекомбинантный 2-цепочечный (scFvαCD19)-Fc-MBM-3 в конфигурации VL-линкер-VH был сконструирован, экспрессирован и очищен с использованием протоколов, аналогичных тем, которые изложены в рабочем примере выше, за исключением того, что использовали другой металлсвязывающий мотив, GCGGHA (SEQIDNo. 6, далее MBM-3). Аминокислотные последовательности рекомбинантной цепи настоящего (scFvαCD19)-Fc-MBM-3 в конфигурации VL-линкер-VH показаны в SEQIDNo. 16.
Характеристику молекулярной конструкции (VL-VHscFvαCD19)-Fc-MBM-3 проводили с использованием SDS-PAGE. Результаты SDA-PAGE на Фигуре 6 показывают, что рекомбинантная цепь новой конструкции имеет размер около 110 кДа (указано стрелкой), что соответствует ожидаемому размеру.
Пример 6
Конструирование, экспрессия и очистка рекомбинантного анти-CD19-антитела-МВМ
Рекомбинантные молекулярные конструкции IgG (γ1 человека) были сконструированы путем слияния короткого гибкого линкера, GGGG (SEQIDNo. 9) и последовательности MBM (в этом примере, MBM-1 или MBM-2) с C- концом тяжелой цепи интактного антитела, специфичного к CD19. Две генные последовательности вставляли в кассету экспрессии pG1K с сайтом множественного клонирования. Экспрессию и очистку настоящего рекомбинантного анти-CD19-антитела-МВМ проводили с использованием протоколов, аналогичных описанным в рабочем примере выше.
Аминокислотные последовательности тяжелой цепи антитела, специфичного к человеческому CD19-антителу-MBM-1 или MBM-2 соответственно, указаны в SEQIDNO: 17 и 18, а аминокислотная последовательность легкой цепи интактного анти-CD19 антитела указана в SEQIDNo. 19.
Характеристику молекулярных конструкций проводили с использованием SDS-PAGE. Результаты восстанавливающего SDS-PAGE на Фигуре 7A показывают, что контрольный белок (полоса 1), человеческое CD19 антитело-MBM-1 (полоса 2) и человеческое CD19 антитело-MBM-2 (полоса 3) имеют полосу с более высокой молекулярной массой примерно 55 кДа и полосу с меньшей молекулярной массой примерно 25 кДа, что соответствует ожидаемым размерам тяжелой цепи и легкой цепи конструкции, соответственно.
Общая структура анти-CD19 антитело-MBM-1 молекулярной конструкции представлена на Фиг. 7В.
Пример 7
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD33)-Fc-MBM
VL и VHscFv, специфичные для человеческого CD33, были получены из моноклонального антитела huMy9-6. Последовательность гена, кодирующая рекомбинантную цепь (scFvαCD33)-CH2-CH3 (γ1 человека), была сконфигурирована путем слияния последовательности гена, кодирующей scFv, специфичного для человеческого CD33, с вышестоящей последовательностью гена, кодирующей гибкую шарнирную область и CH2 домен IgG1.Fc, а последовательность гена, кодирующая MBM-1 или MBM-2, была слита с последующей последовательностью гена, кодирующей CH3 домен IgG1.Fc, и коротким гибким линкером, GGGG (SEQIDNo. 9).
ScFv были сконфигурированы в двух ориентациях, то есть VL-линкер-VH и VH-линкер-VL, где VL и VH были связаны гидрофильным линкером GSTSGSGKPGSGEGSTKG (SEQIDNo. 10). Аминокислотные последовательности рекомбинантной цепи настоящего (scFvαCD33)-Fc-MBM-1 в конфигурациях VL-линкер-VH и VH-линкер-VL показаны в SEQIDNO: 20 и 21, соответственно, тогда как аминокислотные последовательности рекомбинантной цепи настоящего (scFvαCD33)-Fc-MBM-2 в конфигурациях VL-линкер-VH и VH-линкер-VL показаны в SEQIDNO: 22 и 23, соответственно.
Экспрессию и очистку настоящего рекомбинантного 2-цепочечного (scFvαCD33)-Fc-MBM проводили с использованием протоколов, аналогичных описанным в рабочем примере выше.
Характеристику молекулярных конструкций проводили с использованием невосстанавливающего SDS-PAGE. Результаты SDS-PAGE на Фигуре 8 показывают, что каждый из (VL-VHscFvαCD33)-Fc-MBM-1 (полоса 1), (VH-VLscFvαCD33)-Fc-MBM-1 (полоса2) , (VL-VHscFvαCD33)-Fc-MBM-2 (полоса 3), (VH-VLscFvαCD33)-Fc-MBM-2 (полоса 4) имеют размер около 120 кДа, что несколько больше чем ожидаемый размер 110 кДа.
Пример 8
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD20)-Fc-MBM
VL и VHscFv, специфичного для человеческого CD20, были получены из моноклонального антитела окрелизумаба. Металлсвязывающие мотивы MBM-1, MBM-2 и MBM-3 были соответственно слиты с C-концом CH3 домена рекомбинантной цепи (scFvαCD20)-CH2-CH3 (γ1 человека) через короткий гибкий линкер, GGGG (SEQIDNo. 9). ScFv имел ориентацию VL-линкер-VH или VH-линкер-VL. VL и VH были связаны гидрофильным линкером GSTSGSGKPGSGEGSTKG (SEQIDNo. 10).
Экспрессию и очистку настоящего рекомбинантного 2-цепочечного (scFvαCD20)-Fc-MBM-1, -MBM-2 или -MBM-3 проводили с использованием протоколов, аналогичных описанным в рабочем примере выше. Последовательности рекомбинантной цепи настоящего (VL-VHscFvαCD20)-Fc-MBM-1, (VH-VLscFvαCD20) -Fc-MBM-1, (VH-VLscFvαCD20)-Fc-MBM-2, (VL-VHscFvαCD20)-Fc-MBM-3 и (VH-VLscFvαCD20)-Fc-MBM-3 приведены в SEQIDNO: 24, 25, 26, 27 и 28, соответственно.
Экспрессию и очистку настоящего рекомбинантного 2-цепочечного (scFvαCD20)-Fc-MBM проводили с использованием протоколов, аналогичных описанным в рабочем примере выше.
Характеристика молекулярных конструкций была проведена с использованием невосстанавливающего SDS-PAGE. Результаты SDS-PAGE на Фигуре 9 показывают, что как (VL-VHscFvαCD20)-Fc-MBM-1 (полоса 1), так и (VH-VLscFvαCD20)-Fc-MBM-1 (полоса 2) молекулярной конструкции имеют размер около 120 кДа, что несколько больше ожидаемого размера 110 кДа. Результаты SDS-PAGE на фигурах 10A и 10B, соответственно, показывают, что молекулярные конструкции VH-VLscFvαCD20)-Fc-MBM-2 и (VL-VHscFvαCD20)-Fc-MBM-3 имеют размер примерно 120 кДа, что несколько больше ожидаемого размера 110 кДа.
Пример 9
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCA19-9)-Fc-MBM
Мышиная гибридома В-клеток HB8059, продуцирующая анти-CA19-9 антитело, была приобретена из DevelopmentalStudiesHybridomaBankattheUniversityofIowa. Поли(A)+ РНК подвергали обратной транскрипции с помощью системы SuperScriptIIIRT-PCR (Invitrogen, Waltham, USA), и синтезировали первую нить кДНК.VHи VL нуклеотидные и аминокислотные последовательности HB8059 не были опубликованы. Для определения последовательностей вариабельных областей HB8059, кДНК VH и VL амплифицировали с помощью ПЦР с использованием ДНК набора праймеров, предоставленных наборами Ig-primerSets (Novagen, Madison, USA) в соответствии с инструкциями производителя. Аминокислотная последовательность VH и VLмоноклонального антитела HB8059, специфичного к человеческому CA19-9, описана в SEQIDNO: 29 и 30.
MBM-1 или MBM-3 были слиты с C-концом CH3 домена (scFvαCA19-9)-CH2-CH3 (γ1 человека) рекомбинантной цепи через короткий гибкий линкер GGGG (SEQIDNo. 9). ScFv имели ориентацию VL-линкер-VH. VL и VH были связаны гидрофильным линкером GSTSGSGKPGSGEGSTKG (SEQIDNo. 10). Последовательности рекомбинантной цепи настоящих scFvαCA19-9)-Fc-MBM-1 и (scFvαCA19-9)-Fc-MBM-3 показаны как SEQIDNO: 31 и 32, соответственно.
Экспрессию и очистку настоящего рекомбинантного 2-цепочечного (scFvαCA19-9)-Fc-MBM проводили с использованием протоколов, аналогичных описанным в рабочем примере выше.
Характеристику молекулярной конструкции проводили с использованием SDS-PAGE. Результаты SDS-PAGE на Фигуре 11A и Фигуре 11B показывают, что рекомбинантная цепь как (scFvαCA19-9)-Fc-MBM-1 молекулярной, так и (scFvαCA19-9)-Fc-MBM-3 конструкции имеет размер около 120 кДа (полоса 1), что несколько больше ожидаемого размера 110 кДа.
Пример 10
Конструирование, экспрессия и очистка рекомбинантного 2-цепочечного (scFvαCD38)-Fc-MBM
VL и VH scFv-специфичного для человеческого CD38, были получены из моноклонального антитела даратумумаба. Металлсвязывающие мотивы MBM-1 и MBM-2 были соответственно слиты с C-концом CH3 домена рекомбинантной цепи (scFvαCD38)-CH2-CH3 (γ1 человека) через короткий гибкий линкер GGGG (SEQIDNo . 9). ScFv имел ориентацию VL-линкер-VH или VH-линкер-VL. VL и VHбыли связаны гидрофильным линкером GSTSGSGKPGSGEGSTKG (SEQIDNo. 10). Экспрессию и очистку настоящего рекомбинантного 2-цепочечного (scFvαCD38)-Fc-MBM-1 или -MBM-2 проводили с использованием протоколов, аналогичных описанным в рабочем примере выше. Последовательности рекомбинантной цепи настоящего (VL-VHscFvαCD38)-Fc-MBM-1, (VH-VLscFvαCD38)-Fc-MBM-1, (VL-VHscFvαCD38)-Fc-MBM-2 и (VH-VLscFvαCD38)-Fc-MBM-2 указаны в SEQIDNO: 33, 34, 35 и 36, соответственно.
Характеристику молекулярной конструкции проводили с использованием SDS-PAGE. Результат SDS-PAGE на Фигуре 12A показывает, что рекомбинантная цепь (VL-VHscFvαCD38)-Fc-MBM-1 (полоса 1) имеет размер около 120 кДа, что несколько больше ожидаемого размера 110 кДа. Результат SDS-PAGE на Фигуре 12B показывает, что рекомбинантная цепь (VL-VHscFvαCD38)-Fc-MBM-2 имеет размер около 120 кДа, что несколько больше ожидаемого размера 110 кДа.
Пример 11
Получение рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
В этом примере была приготовлена молекулярная конструкция, имеющая две DOTA связки, соответственно конъюгированные с двумя остатками цистеина металлсвязывающего мотива 2-цепочечного (scFvαCD19)-Fc-MBM-1; схематическая диаграмма, иллюстрирующая структуру этой молекулярной конструкции, показана на Фигуре 13A. Для уменьшения остатка цистеина на С-конце очищенного рекомбинантного 2-цепочечного (VL-VHscFvαCD19)-Fc-MBM-1 из Примера 3 рекомбинантные белки в сукцинатном буфере натрия (10 мМ сукцинат натрия, pH6.0 и 30 мМ сахарозы) восстанавливали путем инкубирования с 45 мкМ трис(2-карбоксиэтил)фосфина (TCEP) при комнатной температуре в течение 30 минут при осторожном встряхивании. После реакции восстановления избыток TCEP удаляли диализом против 10 мМ натрийсукцинатного буфера (pH 6,0 с 30 мМ сахарозы), содержащего 60 мкМ ионов Zn (II). Затем образцы восстановленного белка обрабатывали 15 мкМ связкой Mal-пептид 2-DOTA из Примера 2 и затем инкубировали в течение 1 часа при комнатной температуре. Связка непрореагировавшего DOTA была удалена с использованием обессоливающей колонки, а продукт был проанализирован с помощью SDS-PAGE.
На Фигуре 13B показан результат анализа SDS-PAGE данной молекулярной конструкции (проиллюстрирован ниже), который показывает, что настоящая молекулярная конструкция имеет молекулярную массу около 120 кДа (полоса 2, указана стрелкой), что немного больше ожидаемого. Неконъюгированный слитый белок находился на полосе1. Как можно видеть на Фигуре 13B, выход конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD19)-Fc-MBM-1 составляет приблизительно 90%. Эти полосы белков на SDS-PAGE были количественно определены ImageJ.
Пример 12
Получение рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-2 X 2 DOTA связок
В этом примере конъюгацию двух DOTA связок с рекомбинантным 2-цепочечным (VL-VHscFvαCD19)-Fc-MBM-2 из Примера 4 выполняли, как описано в предыдущем Примере.
На Фиг. 14 показан результат анализа SDS-PAGE данной молекулярной конструкции, который показывает, что настоящая молекулярная конструкция имеет молекулярную массу около 120 кДа (полоса 2, указана стрелкой), что согласуется с или немного больше ожидаемого размера. Неконъюгированный слитый белок находился на полосе 1. Как можно видеть на Фигуре 14, выход конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD19)-Fc-MBM-2 составляет приблизительно 90%.
Пример 13
Получение рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-3 X 2 DOTA связок
В этом примере конъюгацию двух DOTA связок с рекомбинантным 2-цепочечным (VL-VHscFvαCD19)-Fc-MBM-3 из Примера 5 выполняли, как описано в предыдущем Примере.
На Фиг. 15 показан результат анализа SDS-PAGE данной молекулярной конструкции, который показывает, что настоящая молекулярная конструкция имеет молекулярную массу около 120 кДа (полоса 2, указана стрелкой), что согласуется с или немного больше ожидаемого размера. Неконъюгированный слитый белок находился на полосе 1. Как можно видеть на Фиг. 15, выход конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD19)-Fc-MBM-3 составляет приблизительно 90%.
Пример 14
Получение анти-CD19 антитело-MBM-1 X 2 DOTA связок
В этом примере конъюгация двух DOTA связок с интактным человеческим анти-CD19 антителом, слитым с C-концевым MBM-1 из примера 6, была выполнена, как описано в предыдущем примере.
На фиг. 16 показан анализ SDS-PAGE настоящей молекулярной конструкции связок анти-CD19 антитело-MBM-1 X 2 DOTA. Как показано на Фигуре 16, тяжелая цепь с молекулярной массой составляет около 54 кДа (указана стрелкой №1 на полосе 2), что соответствует ожидаемому размеру. Стрелка #2 на полосе 2 представляет собой неконъюгированную тяжелую цепь анти-CD19 антитела-MBM-1, а стрелка #3 представляет собой легкую цепь анти-CD19 антитела-MBM-1.
Пример 15
Получение анти-CD19 антитело-MBM-2 X 2 DOTA связок
В этом примере конъюгация двух DOTA связок с интактным анти-CD19 антителом, слитым с C-концевым MBM-2 из примера 6, была выполнена, как описано в предыдущем примере.
На Фиг. 17 показан SDS-PAGE анализ настоящей молекулярной конструкции. Как показано на Фиг. 17, молекулярная масса тяжелой цепи составляет около 54 кДа (указана стрелкой #1 на полосе 2), что соответствует ожидаемому размеру. Стрелка #2 на полосе2 представляет собой неконъюгированную тяжелую цепь анти-CD19антитело-MBM-2, а стрелка #3 представляет собой легкую цепь анти-CD19антитело-MBM-2.
Пример 16
Получение рекомбинантных 2-цепочечных (scFvαCD33)-Fc-MBMX 2 DOTA связок
В этом примере конъюгацию двух DOTA связок с рекомбинантным 2-цепочечным (VL-VHscFvαCD33)-Fc-MBM-1 или -MBM-2 из примера 7 выполняли, как описано в предыдущем примере.
На Фиг. 18 показан результат анализа конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD33)-Fc-MBM-1 с помощью SDS-PAGE. Как показано на Фигуре 18, эта молекулярная конструкция имеет молекулярную массу около 120 кДа (указана стрелкой #1 на полосе 2), что соответствует ожидаемому размеру или немного превышает его. Стрелка #2 на полосе1 - это неконъюгированный слитый белок. Результаты SDS-PAGE показывают, что выход конъюгации DOTА связок с рекомбинантным 2-цепочечным (scFvαCD33)-hIgG1.Fc-MBM-1 составляет приблизительно 65%.
Пример 17
Получение рекомбинантных 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связок
В этом примере конъюгацию двух DOTA связок с рекомбинантным 2-цепочечным (VL-VHscFvαCD20)-Fc-MBM-1 из Примера 8 выполняли, как описано в предыдущем Примере.
На Фиг. 19 показан результат анализа конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD20)-Fc-MBM-1 с помощью SDS-PAGE. Как показано на Фигуре 19, эта молекулярная конструкция имеет молекулярную массу около 120 кДа (указана стрелкой #1 на полосе 2), что соответствует ожидаемому размеру или немного превышает его. Стрелка #2 на полосе 2 - это неконъюгированный слитый белок. Результат SDS-PAGE на Фигуре 19 также показывает, что выход конъюгации DOTA связок с рекомбинантным 2-цепочечным (scFvαCD20)-Fc-MBM-1 составляет приблизительно 90%.
Пример 18
Получение рекомбинантного 2-цепочечного (scFvαCA19-9)-Fc-MBMX 2 DOTA
В этом примере конъюгирование двух DOTA связок с рекомбинантным 2-цепочечным (scFvαCA19-9)-Fc-MBM-1 или -MBM-3 из Примера 9 выполняли, как описано в предыдущем Примере. Результаты SDS-PAGE показывают, что выходы конъюгации DOTA связок с рекомбинантными 2-цепочечными(scFvαCA19-9)-Fc-MBM-1 и -MBM-3 составляют примерно 65% и 70%, соответственно (данные не показаны).
Пример 19
Стабилизация 2-цепочечных (scFv α CD19)-Fc-MBM-1 X 2 DOTA связок
Для стабилизации 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок проводили реакцию раскрытия кольца с использованием следующего протокола.
Продукт реакции молекулярной конструкции, полученной в примере 14, представлял собой замену буфера на трис-буфер (100 мМ Трис при pH 9,0, 100 мМ L-аргинин, и 100 мМ хлорид натрия) с использованием NAP-10 SephadexG-25 колонки (GEHealthcare). Полученный раствор затем нагревали до 37°C в течение 5 часов. Раствор охлаждали и заменяли буфер центрифугированием на 50 мМ Бис-Трис буфер при pH 5,5. Конечные образцы концентрировали до ~ 1-3 мг/мл белка.
Для очистки стабилизированный продукт доводили до pH 5,5 и затем наносили на предварительно уравновешенную (50 мМ Бис-Трис буфер при pH 5,5) анионообменную колонку Hi-Trap™QHP (GEHealthcare). Стабилизированные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки элюировали, используя ступенчатую элюацию 250 мМ NaCl в течение 15 минут и линейный градиент от 250 мМ до 324 мМ NaCl со скоростью потока 1.0 мл/мин в течение 50 минут.
Анионообменную колонку QHP использовали для отделения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок от свободного 2-цепочечного слитого белка, 2-цепочечного слитого белка, конъюгированного с тремя или четырьмя DOTA связками, и агрегированного материала. Очищенный продукт, 2-цепочечной (scFvαCD19) -Fc-MBM-1 X 2 DOTA связки, концентрировали и заменяли буфер на Трис буфер (50 мМ Трис буфер при pH 7.0 и 290 мМ NaCl).
Фиг. 20 представляет собой FPLC профиль элюирования анионообменной колонки QHP на стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связках. Как показано на фигуре 20, стабилизированные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки элюировались на пике 69.91 мл. На Фигуре 21 показаны результаты анализа SDS-PAGE фракций, собранных из анионообменной колонки QHP. Полосы A, B, C и D соответственно соответствуют неконъюгированной молекулярной конструкции, молекулярной конструкции, конъюгированной с DOTA связками, стабилизированной молекулярной конструкции, конъюгированной с двумя DOTA связками в исходном растворе, и стабилизированной молекулярной конструкции, конъюгированной с двумя DOTA связками перед загрузкой в колонку.
Чистый продукт, стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, собирали из фракций #53, #54 и #55, показанных на Фигуре 21.
Пример 20
Стабилизация 2-цепочечных (scFv α CD20)-Fc-MBM-1 X 2 DOTA связок
Очистка стабилизированных 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связок
Процедура стабилизации 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связок была аналогична описанной в Примере 19.
Для очистки стабилизированный продукт доводили до pH 5,1 и затем наносили на предварительно уравновешенную (50 мМ уксусная кислота при pH 5,1) анионообменную колонку Hi-TrapTMQHP (GEHealthcare). Стабилизированные 2-цепочечные (scFvαCD20)-Fc-MBM-1 X 2 DOTA связки элюировали с использованием ступенчатого элюирования 300 мМ NaCl в течение 18 минут и линейного градиента от 300 мМ до 1000 мМ NaCl со скоростью потока 1.0 мл/мин в течение 80 минут.
Анионообменную колонку QHP использовали для отделения стабилизированных 2-цепочечных (scFvαCD20)-Fc-MBM-1 X 2 DOTA связок от свободного 2-цепочечного слитого белка, 2-цепочечного слитого белка, конъюгированного с тремя или четырьмя DOTA связок и агрегированных материалов.
На Фиг. 22 показаны результаты анализа SDS-PAGE фракций, собранных из анионообменной колонки QHP. Полосы A, B и C соответственно соответствуют неконъюгированной молекулярной конструкции, молекулярной конструкции, конъюгированной с DOTA связками, и стабилизированной молекулярной конструкции, конъюгированной с двумя DOTA связками перед загрузкой в колонку.
Чистый продукт, стабилизированных 2-цепочечных(scFvαCD20)-Fc-MBM-1 X 2 DOTA связок, собирали из фракций # 40 и # 41, показанных на Фигуре 22.
Пример 21
MALDI-TOF-анализ стабилизированных 2-цепочечных(scFv α CD19)-Fc-MBM-1 X 2 DOTA связок
Стабилизированные 2-цепочечные (scFvαCD19) -Fc-MBM-1 X 2 DOTA связки из Примера 19 анализировали с использованием масс-спектроскопии MALDI-TOF. Результат MALDI-TOF на Фигуре 23 показывает, что образец стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок имеет молекулярную массу 114,435 и 57,306 дальтон, соответственно, соответствующих m/z (z=1): [M+H]+andm/z (z=2): [M+2H]2+.
Пример 22
Получение 89Y-меченных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
В этом примере раствор Y(NO3)3 добавляли к раствору очищенных стабилизированных 2-цепочечных(scFvαCD19)-Fc-MBM-1 X 2 DOTA связок из Примера 19 в молярном соотношении 6: 1 [Y3+ ион: белок]; реакционную смесь инкубировали 6 часов при комнатной температуре. Свободные ионы Y3+ удаляли из раствора с помощью колонки NAP-10 SephadexG-25. Стабилизированные 2-цепочечные(scFvαCD19)-Fc-MBM-1 X 2 DOTA связки, хелатированные с [89Y]3+, анализировали с помощью масс-спектроскопии MALDI-TOF. Результат MALDI-TOF на Фигуре 24 показывает, что настоящая молекулярная конструкция имеет молекулярную массу 114,391 дальтон.
Пример 23
Получение175Lu меченных 2-цепочечных (scFv α CD19)-Fc-MBM-1 X 2 DOTA связок
В этом примере раствор LuCl3 добавляли к раствору очищенных стабилизированных 2-цепочечных (scFvαCD19) -Fc-MBM-1 × 2 DOTA связок при молярном соотношении 60: 1 [Lu3+ион: белок]; затем реакционную смесь инкубировали при 45°C в течение 1,5 часов с получением хелата белка 175Lu-DOTA. Свободные ионы Lu3+ удаляли из раствора путем центробежной фильтрации (Amiconcentrifugalfilter, 10кДа). Стабилизированные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки, хелатированные двумя 175Lu, анализировали с помощью масс-спектроскопии MALDI-TOF. Результат MALDI-TOF на Фигуре 25 показывает, что настоящая молекулярная конструкция имеет молекулярную массу 114,928 дальтон.
Пример 24
Получение 111ln -меченных 2-цепочечных (scFv α CD19)-Fc-MBM-1 X 2 DOTA связок
Для приготовления 111In меченного слитого белка, аликвоту 111In без носителя в 50 мМ HCl переносили в пробирку и добавляли двадцать объемов не содержащего металлов 0.1 М буфера HEPES для регулирования pH раствора до 4.5. Затем добавляли раствор 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок (30-50 мкг) в 0.1 М буфере HEPES (pH 4,5) до конечной концентрации белка 0.3-0.6 мг/мл. Полученный раствор осторожно перемешивали и инкубировали при 40-45°C в течение 60 минут. Добавляли диэтилентриаминпентауксусную кислоту (DTPA) в количестве, в 1000 раз превышающем количество белка, для захвата свободных ионов 111In3+и гашения реакции. После инкубации при 37°C в течение 30 минут, хелаты 111In-DTPAбыли удалены из 111In меченного продукта, а растворитель был заменен 0,9% физиологическим раствором путем центробежной фильтрации (Amiconcentrifugalfilter, 10 кДа).
Конкретные активности собранного 111In-меченого продукта определяли путем измерения радиоактивности соответствующей аликвоты образца с использованием γ-счетчика.
Пример 25
Анализ радио-включения 111In меченных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
Радиохимическую чистоту оценивали с помощью мгновенной тонкослойной хроматографии (iTLC). Раствор радиоактивно меченного продукта из Примера 24 разбавляли 1:10 или 1:20 исходным растворителем; затем 1 мкл образца наносили на один конец полоски 1 × 10 см бумаги для ТСХ SG. Бумага была проявлена с использованием восходящей хроматографии с использованием 0,5 М цитрата натрия (pH 4,5). Радиоактивность определяли с помощью радио-ТСХ-сканера. Связанная с белком радиоактивность выражалась в процентах от общей радиоактивности. Как показано на Фигуре 26, радиохимическая чистота 111In-меченых 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, превышает 98%.
Пример 26
Тест стабильности 111In меченных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок в сыворотке
Стабильность invitro111In меченных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок оценивали в мышиной сыворотке при 37°C в течение 96 часов. 111In меченную молекулярную конструкцию из примера 24 суспендировали в 0.2 М ацетате аммиака (pH 5). 111In меченную молекулярную конструкцию разводили 1:10 с мышиной сывороткой и затем инкубировали при 37°C в течение периода до 96 часов. В выбранные моменты времени (0, 12, 24, 48 и 96 часов) 111In-меченная молекула, была удалена и проанализирована с использованием радио-TLC, как описано в Примере 25.
Как показано на Фигуре 27, 111In-меченные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки проявляют удовлетворительную стабильность при инкубации в мышиной сыворотке при 37°C в течение 96 часов.
Пример 27
Сайт-специфическая конъюгация рекомбинантных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
Чтобы идентифицировать остаток цистеина в 2-цепочечном (scFvαCD19)-Fc-MBM-1, который конъюгирован с DOTA связкой, образец расщепляли и анализировали с помощью LC-MS. Вкратце, 5 мкл образца (0,4 мкг/мл) из Примера 11 разбавляли в растворе, содержащем 15 мкл 25 мМ тетрагидробората тетраэтиламмония (TEAB) и 2 мкл 200 мМ TCEP, и инкубировали при 55°C в течение 1 часа. Затем в реакционную смесь добавляли 2 мкл 375 мМ йодуксусной кислоты (IAA) при комнатной температуре в течение 30 минут. После алкилирования с помощью IAA ферменты, трипсин и Glu-C, добавляли в раствор при 37°C в течение ночи для ферментативного расщепления.
Результат масс-спектрометрического анализа (данные не показаны) показывает, что значение m/z фрагмента в спектре МС соответствует 4530,99 дальтон, что соответствует молекулярной массе фрагмента, содержащего аминокислотную последовательность SLSLSPGGGGACPGHA (аминокислотные остатки 468-483 SEQIDNo. 13) молекулярной конструкции и одной DOTA связки.
Пример 28
Связывающая активность стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок с B-клетками лимфомы человека
Две стабилизированные молекулярные конструкции, (scFvαCD19) -Fc-MBM-1 X 2 DOTA и (scFvαCD19)-Fc-MBM-3 X 2 DOTA связки, были проанализированы на их способность связываться с CD19 человека на Raji клеточной линии В-лимфомы человека Анализ выполняли путем инкубации1×106экспрессирующих CD19 клеток Raji с 0,001 мкг/мл каждой конструкции в PBS, 1% BSA на льду в течение 30 минут с использованием анти-CD19 антитела (RB4v1.2), (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок и (scFvαCD19)-Fc-MBM-3 X 2 DOTA связок в качестве положительных контролей. Анти-HER2 антитело (трастузумаб) использовали в качестве отрицательного контроля. Окрашивание клеток анализировали с помощью FACS (FACSCantoII; BDBiosciences) с использованием FITC-конъюгированных козьих антител против человеческого IgG.Fc (разведенных 1: 200 в PBS/BSA) (Caltag, Buckingham, UK) при 4°C в течение 20 минут в темноте. На фигурах 27A и 27B показаны результаты анализа окрашивания двух молекулярных конструкций, содержащих MBM-1 и MBM-3, на CD19-экспрессирующих Raji клетках, соответственно, которые показывают, что эти две конструкции связывались с Raji клетками по существу положительно.
Эти молекулярные конструкции также анализировали на их способность связываться с CD19 человека на Ramos линиях клеток B-лимфомы человека. Анализ выполняли с использованием протокола, аналогичного тому, который использовался в анализе связывания клеток с Raji клетками. Окрашивание Ramos клеток анализировали с помощью FACS (FACSCantoII; BDBiosciences) с использованием FITC-конъюгированного козьего античеловеческого IgG.Fc, где анти-CD19 IgG использовали в качестве положительного контроля. Анти-HER2 антитело (трастузумаб) использовали в качестве отрицательного контроля. На фигурах 27C и 27D показаны результаты анализа окрашивания двух молекулярных конструкций, содержащих MBM-1 и MBM-3, на экспрессирующих CD19 Ramos клетках, соответственно. Эти две конструкции связывались с Ramos клетками в значительной степени положительно.
Пример 29
Стабильность стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
Для оценки стабильности стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок молекулярные конструкции помещали в Трис буфер (100 мМ Трис буфер при pH 7,3, 50 мМ Бис-Трис буфер и 290 мМ NaCl) с глутатионом или человеческим сывороточным альбумином, а затем инкубировали при 37°C в течение 30 дней.
Как показано на Фиг. 29, стабилизированные 2-цепочечные (scFvαCD19) -Fc-MBM-1 X 2 DOTA связки проявляют удовлетворительную стабильность при инкубации с глутатионом или человеческим сывороточным альбумином (HSA) при 37°C в течение 30 дней. Как можно видеть на Фигуре 28, в группах, обработанных как глутатионом, так и HAS, приблизительно 90% интактной молекулярной конструкции все еще находилось в растворе без присоединенияпродукта ретро-Михаэля. Полосы U и C соответственно соответствуют неконъюгированной молекулярной конструкции и стабилизированным 2-цепочечным (scFvαCD19)-Fc-MBM-1 X 2 DOTA связкам, хранящимся при 4°C в качестве контролей.
Пример 30
Исследование присоединения продукта ретро-Михаэля стабилизированного 2-цепочечными(scFvαCD19)-Fc-MBM-1 X 2 DOTA связками.
В качестве дополнительного подтверждения стабильности 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок, стабилизированную молекулярную конструкцию инкубировали с глутатионом или HSA, а затем анализировали с помощью вестерн-блоттинга.
Вкратце, для вестерн-блоттинга анализа стабилизированных образцов, образцы разделяли на 8% SDS-PAGE гели и переносили на поли(винилиденфторидную) (PVDF) мембрану (Millipore). Мембранные блоты блокировали PBS, содержащим 5% BSA и 0,05% Tween 20, в течение 1 часа при комнатной температуре. После трехкратной промывки фосфатно-солевым буфером tween-20 (PBST), содержащим PBS и 0,05% Tween-20, блоты инкубировали с козьим антителом против человеческого IgG.Fc антитела, конъюгированным с пероксидазой хрена (Millipore). Затем мембраны 3 раза промывали PBST и иммунореагировавшие полосы детектировали с использованием реагентов для детектирования вестерн-блоттинга ECL™(Millipore) и экспонировали на Fujifilm (Tokyo, Japan).
На Фиг. 30 показан результат стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок по данным вестерн-блоттинга. Как показано на Фигуре 29, стабилизированные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки демонстрируют удовлетворительную стабильность при инкубации с глутатионом или HSA при 37°C в течение 30 дней по сравнению со стабилизированной молекулярной конструкцией, которая хранится при 4°C (полоса C). Полоса U представляет собой неконъюгированную молекулярную конструкцию в качестве контроля.
Пример 31
Период полувыведения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок
Измерение периодов полувыведения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок проводили на мышах после внутривенного введения. (scFvαCD19) -Fc-MBM-1 X 2 DOTA Связки в образце сыворотки наблюдали с помощью ELISA. 8-10-недельных мышей BALB/c были приобретены в BioLasco, Taipei, Taiwan. Мышей разделили на трех мышей в каждой группе, и им внутривенно вводили около 200 мкл 3.33 мкМ белка.
Фармакокинетические профили анти-CD19 антитела (RB4v1.2), 2 цепочеченого (scFvαCD19)-Fc-MBM-1 слитого белка, как показано на Фигуре 31, показывают, что периоды полувыведения анти-CD19 антитела (RB4v1.2), (scFvαCD19)-Fc-MBM-1 слитого белка из Примера 3, молекулярной конструкции (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок из Примера 18, и продолжительность стабилизированной молекулярной конструкции (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок из примера 19 составляет примерно 129, 179.6, 153.6, и 193.5 часа, соответственно. В заключение, стабилизационная обработка приводит к продлению периода полувыведения стабилизированной молекулярной конструкции.
Пример 32
Нацеливающий эффект стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок на CD19-экспрессирующую опухоль ксенотрансплантата
В этом примере система визуализации invivo (IVIS) была использована для исследования эффекта нацеливания стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок на CD19-экспрессирующие опухоли в модели ксенотрансплантата мыши. Перед визуализацией IVIS использовали набор для маркировки антител Dylight 680 (ThermoScientific) для конъюгирования стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок из Примера 19 и анти-CD19 антитела (RB4v1 .2) в соответствии с инструкциями производителя.
NOD-SCID (NOD.CB17-Prkdcscid/JNarl) возрастом 8-10 недель были приобретены в Laboratory Animal Facility of Institute of Cellular and Organismic Biology, Academia Sinica, Taipei, Taiwan. Мышам внутрибрюшинно вводили 1×107Raji клеток B-клеточной лимфомы на мышь за 2 недели до лечения. Мышей разделили на трех мышей в каждой группе, и им внутривенно вводили около 200 мкл меченой молекулы 6,65 мкМ. В различные моменты времени мышей анестезировали изофлураном в O2 и помещали в систему визуализации IVISSpectrumInvivo (PerkinElmer) в положении лежа на спине. Флуоресцентные изображения получали с ex/em=675/720 с использованием LivingImageSoftwareV3.2. Изображения были получены в указанные моменты времени с помощью тепловизора IVISSpectrum и проанализированы с помощью Living Image software.
Флуоресцентные изображения NOD-SCID мышей регистрировали и анализировали через 0, 24, 48 и 72 часа после введения DyLight 680 конъюгированных белков. На Фиг. 32 показано распределение молекул с флуоресцентной меткой в модели мышей. Мышам NOD-SCID внутривенно вводили анти-CD19 антитело (RB4v1.2) (1 и 2) и стабилизированные 2-цепочечные (scFvαCD19)-Fc-MBM-1 X 2 DOTA связки (3 и 4).
Как показано на Фигуре 32, через 24, 48 и 72 часа после внутривенного введения инъекции, проникновение стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок и анти-CD19 антитела (RB4v1.2) в опухоли, расположенные с правой стороны, значительно больше, чем наблюдаемое с нормальным органом слева. Таким образом, стабилизированная молекулярная конструкция демонстрирует удовлетворительный эффект нацеливания на CD19 экспрессирующие опухоли, в модели ксенотрансплантата мыши.
Пример 33
Биораспределение стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок в CD19-экспрессирующей опухоли ксенотрансплантата.
Для анализа биораспределения стабилизированных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок в модели ксенотрансплантата мышей использовали процедуру, изложенную в примере 32, с некоторыми модификациями.
Вкратце, мышам вводили подкожно 1×107Raji клеток B-клеточной лимфомы на мышь за 2-3 недели до лечения. Мышей разделили на трех мышей в каждой группе, и им внутривенно вводили около 200 мкл меченой молекулы 6,65 мкМ.
Биораспределение мышей NOD-SCID анализировали с помощью тканевого ELISA через 7 дней после введения стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок и анти-CD19 антитела. Вкратце, животных умерщвляли на 7 день после инъекции. Кровь представляла собой гемостазию из сердца, и были взяты образцы тканей из 11 органов. Образцы тканей гомогенизировали с использованием гомогенизатора и дополнительно анализировали для измерения концентрации введенных молекул с помощью ELISA.
На Фиг. 33 показано распределение стабилизированных 2-цепочечных (scFvαCD19)-Fc-MBM-1 X 2 DOTA связок (TE-1122) в модели мыши. Ось Y диаграммы биораспределения представляет соотношение ткани и крови. Результат также показывает, что стабилизированная молекулярная конструкция может нацеливаться на CD19 экспрессирующие опухоли, в модели ксенотрансплантата мыши.
Пример 34
Синтез агониста Aib-GLP-1, имеющего концевой остаток цистеина
В этом примере получали агонист глюкагоноподобного пептида -1 (GLP-1), замещенный ε-аминомасляной кислотой (Aib), имеющий свободный цистеин на С-конце; аминокислотная последовательность этой молекулярной конструкции Aib-GLP-1-Cys описана в SEQIDNo. 37. Фиг. 34 представляет собой схематическую диаграмму, иллюстрирующую структуру этой молекулярной конструкции. Подобно семаглутиду, второй аминокислотный остаток заменен остатком Aib (или U) для повышения устойчивости к деградации дипептидилпептидазы IV (DPP 4); тем не менее, в этой молекулярной конструкции гибкий линкер из 15 аминокислотных остатков (аминокислотные остатки с 31 по 45 SEQIDNo. 37) вводится перед последним остатком глицина семаглутида (т.е. аминокислотным остатком 46 SEQIDNo. 37), и к С-концу добавляется концевой остаток цистеина.
Структура Aib-GLP-1 агонист-Cys была разработана авторами настоящего изобретения, и синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China).
Очищенный образец Aib-GLP-1 агонист-Cys анализировали с помощью аналитической ВЭЖХ с обращенной фазой на колонке SupelcoC18 (250 мм × 4,6 мм; 5 мкм) с подвижной фазой ацетонитрила и 0,1% трифторуксусной кислоты, линейным градиентом от 0% до 100% ацетонитрила свыше 30 минут при скорости потока 1,0 мл/мин и температуре колонки 25°C.
Идентификацию Aib-GLP-1 агонист-Cys продукта проводили с использованием масс-спектрометрии ESI-MS. Образец Aib-GLP-1 агонист-Cys продукта показывает сильный молекулярный ион при 1,483.4, что соответствует [M+H]+, указывая на то, что фактическая молекулярная масса настоящего Aib-GLP-1-агонист-Cys агониста составляет 1,482.4 дальтон.
Пример 35
Синтез аналога соматостатина, имеющего концевой остаток цистеина
В этом примере был получен аналог соматостатина, имеющий свободный цистеин на N-конце; аминокислотная последовательность этой Cys-октреотидной молекулярной конструкции описана в SEQIDNo. 38. Фиг. 35 представляет собой схематическую диаграмму, иллюстрирующую структуру этой молекулярной конструкции. Эта молекулярная конструкция имеет 14 аминокислотных остатков, в которые введен N-концевой остаток цистеина, за которым следует гибкий линкер из 5 аминокислотных остатков и октреотидной последовательности. Подобно исходному октреотиду, седьмой аминокислотный остаток (Phe) и десятый аминокислотный остаток (Trp) настоящей Cys-октреотидной молекулярной конструкции находятся в D-формах, между восьмым и тринадцатым остатками цистеина образуется дисульфидный мостик, и остаток треонина на С-конце находится в форме треонинола. Кроме того, N-конец молекулярной конструкции Cys-октреотид модифицирован ацетильной группой.
Структура настоящей Cys-октреотидной молекулярной конструкции была разработана авторами настоящего изобретения, а синтез синтезирован стандартным твердофазным методом, который был передан на аутсорсинг компании Ontores Biotechnologies Co., Ltd. (Hangzhou, China). Cys -октреотидный продукт имеет чистоту более чем 95%.
Идентификацию Cys-октреотидного продукта проводили с использованием масс-спектрометрии MALDI-TOF. Масс-спектрометрические анализы были выполнены в Mass Core Facility at the Institute of Molecular Biology (IMB), Academia Sinica, Taipei, Taiwan. Измерения проводили на масс-спектрометре Bruker Autoflex III MALDI-TOF/TOF mass spectrometer (Bruker Daltonics, Bremen, Germany). На Фигуре 36 показан результат масс-спектрометрии MALDI-TOF, который показывает, что молекулярная конструкция настоящего изобретения имеет молекулярную массу 1,493.587 дальтон.
Пример 36
Синтез лиганда PSMA, имеющего остаток цистеина
В этом примере был получен лиганд PSMA, содержащий свободный остаток цистеина, структура этой молекулярной конструкции представлена на Фигуре 37.
Структура данной молекулярной конструкции лиганда Cys-PSMA была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China). Продукт лиганда Cys-PSMA имеет чистоту более чем 95,0%.
Идентификацию лиганда Cys-PSMA проводили с использованием масс-спектрометрии ESI-MS. На Фигуре 38 показан результат масс-спектрометрии ESI-MS, который показывает, что настоящая молекулярная конструкция имеет сильный молекулярный ион при 522.4, что соответствует [M+H]+, указывая на то, что фактическая молекулярная масса лиганда Cys-PSMA равна 521.4 дальтон.
Пример 37
Синтез кальцитонина- MBM-1
В этом примере была приготовлена молекулярная конструкция кальцитонина, имеющая металлсвязывающий мотив на его С-конце; аминокислотная последовательность этой молекулярной конструкции кальцитонин-MBM-1 описана в SEQIDNo. 39. Фиг. 39 представляет собой схематическую диаграмму, иллюстрирующую структуру этой молекулярной конструкции. Подобно кальцитонину, между первым и седьмым остатками цистеина образуется дисульфидный мостик; тем не менее, в этой молекулярной конструкции гибкий линкер из 8 аминокислотных остатков (аминокислотные остатки с 33 по 40 SEQIDNo. 39) вводится после последнего пролинового остатка кальцитонина (т.е. аминокислотного остатка 32 SEQIDNo. 39), а мотив MBM-1 (ACPGHA, SEQIDN. 7) добавлен к С-концу гибкого линкера.
Структура настоящей молекулярной конструкции кальцитонин-MBM-1 была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China).
Пример 38
Синтез терипаратид-MBM-1
В этом примере была приготовлена молекулярная конструкция терипаратида, имеющая металлсвязывающий мотив на его С-конце; аминокислотная последовательность этой молекулярной конструкции терипаратид-MBM-1 описана в SEQIDNo. 40. Терипаратид представляет собой форму паратироидного (PTH) гормона, состоящего из первых 34 аминокислот, который является активной частью гормона. Он используется при лечении некоторых форм остеопороза. В молекулярной конструкции терипаратид-MBM-1 гибкий линкер из 15 аминокислотных остатков (аминокислотные остатки с 35 по 49 SEQIDNo. 40) вводится после последнего фенилаланинового остатка терипаратида (т.е. аминокислотного остатка 34SEQIDNo. 40), и мотив MBM-1 (ACPGHA, SEQIDNo. 7) добавлен к C-концу гибкого линкера.
Структура данной молекулярной конструкции терипаратид-MBM-1 была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China).
Пример 39
Синтез лейпролида-MBM-3
В этом примере была приготовлена молекулярная конструкция лейпролида, имеющая металлсвязывающий мотив на его С-конце; аминокислотная последовательность этой молекулярной конструкции лейпролид-MBM-3 описана в SEQIDNo. 41. Лейпролид (также известный как лейпрорелин) представляет собой аналог гонадотропин-высвобождающего гормона (GnRH), действующий как агонист рецепторов GnRH гипофиза, который используется при лечении рака простаты и рака груди. Коммерчески доступный лейпролид представляет собой олигопептид, содержащий девять аминокислотных остатков. В настоящей молекулярной конструкции лейпролид-MBM-3 гибкий линкер из 8 аминокислотных остатков (аминокислотные остатки с 10 по 17 SEQIDNo. 41) вводится после последнего пролинового остатка кальцитонина (т.е. аминокислотного остатка 9 SEQIDNo. 41), и мотив MBM-3 (GCGGHA, SEQIDNo. 6) добавлен к C-концу гибкого линкера.
Структура данной молекулярной конструкции лейпролид-MBM-3 была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China). Идентификацию синтезированного пептида проводили с помощью масс-спектрометрии ESI-MS. Результат масс-спектрометрии ESI-MS показывает, что настоящая молекулярная конструкция имеет сильный молекулярный ион при 1,091.97, что соответствует [M+2H]2+, что указывает на то, что фактическая молекулярная масса молекулярной конструкции лейпролид-MBM-3 составляет 2,181.35 дальтон.
Пример 40
Синтезы связок леналидомида
В этом примере настоящими изобретателями были разработаны два набора лекарств, содержащие малеимидсодержащий пептид с тремя остатками лизина в качестве центрального ядра и три молекулы леналидомида, конъюгированные с центральным ядром. Настоящая связка леналидомида была синтезирована с использованием комбинированного метода, в котором стандартный твердофазный синтез на основе Fmoc был проведен для синтеза центрального ядра, а затем был проведен жидкофазный синтез для конъюгирования молекул леналидомида, модифицированных связывающей ветвью, с боковой цепью остатков лизина в центральном ядре. Производство было передано на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China).
Фиг. 40 иллюстрирует структуру Mal-пептид 3-леналидомид связки, где центральное ядро имеет последовательность EGEGEAGGKGAGKGAGKG (SEQIDNo. 42), где первый аминокислотный остаток модифицирован малеимидоэтильной группой. С другой стороны, перед конъюгированием с центральным ядром каждую молекулу леналидомида модифицируют связывающей ветвью пара-аминобензилкарбамат (РАВС)-аланин-валин-ПЭГ. Молекула леналидомида связана с ε-аминогруппой остатка лизина в центральном ядре через свободный конец связывающей ветви.
Идентификацию синтезированной таким образом Mal-пептид 3-леналидомид связки проводили с использованием масс-спектрометрии ESI-MS. На Фигуре41 показан результат масс-спектрометрии ESI-MS, который показывает, что данный набор лекарств имеет сильный молекулярный ион при 1,321.9, что соответствует [M+3H]3+, что указывает на то, что фактическая молекулярная масса набора лекарств составляет 3,962.02 дальтон.
Фиг. 42 иллюстрирует структуру Mal -пептид 4-леналидомид связки, где центральное ядро имеет последовательность EDEDEAGGKGAGKGAGKG (SEQIDNo. 43), где первый аминокислотный остаток модифицирован малеимидо-этильной группой. Молекула леналидомида модифицирована связывающей ветвью, как описано выше, и связана с ε-аминогруппой остатка лизина в центральном ядре через свободный конец связывающей ветви.
Идентификацию синтезированной таким образом Mal -пептид 4-леналидомид связки проводили с использованием масс-спектрометрии ESI-MS. Результат ESI-MS показывает, что настоящий набор лекарств имеет сильный молекулярный ион на уровне 1,379.2, что соответствует [M+3H]3+, что указывает на то, что фактическая молекулярная масса набора лекарств составляет 4,135.15 дальтон.
Пример 41
Синтез Mal-жирная кислота связки
В этом примере была приготовлена молекулярная конструкция ядра Mal-Peptide 5 и одной цепи стеароилдикислоты и одной цепи пальмитоиловой кислоты.
Фиг. 43 иллюстрирует структуру этой Mal-пептид 5-жирная кислота связки, где центральное ядро имеет последовательность малеимидо-этил-EGEGE-X1-K-X2-K-OMe (SEQIDNo. 44), где первый аминокислотный остаток модифицирован малеимидо-этильной группой, последний лизиновый остаток модифицирован метоксигруппой (-OMe), и оба X1 и X2 представляют собой ПЭГилированные аминокислоты с 4-мя повторами EG. Одна цепь стеароилдикислоты и одна цепь пальмитоиловой кислоты были соответственно связаны с К остатками ядра пептидного центра путем образования амидной связи между группой CO2H жирной кислоты и аминогруппой К остатка. Структура настоящей Mal-пептид 5-жирная кислота связки была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China). Связанный продукт Mal-пептид 5-жирная кислота имеет чистоту более чем 97,0%.
Идентификацию синтезированной связки жирной кислоты проводили с использованием масс-спектрометрии ESI-MS. Результат ESI-MS на Фигуре 44 показывает, что настоящая молекулярная конструкция имеет сильный молекулярный ион на уровне 1,143.6, что соответствует [M+2H]2+, указывая на то, что фактическая молекулярная масса Mal-пептид 5-жирная кислота связки равна 2,285.66 дальтон.
Пример 42
Синтез 3-DOTA ветвилинкерногозвена
В этом примере был приготовлена 3-DOTA ветвь линкерного звена для переноса трех пептидов. Фиг. 45 иллюстрирует структуру этого 3-ветвенного линкера. В частности, линкерное звено содержит центральное ядро, имеющее последовательность ацетил-KGAGGKGAGGKG (SEQIDNo. 45, пептидное ядро 6), где первый остаток лизина модифицирован ацетильной группой. Линкерноезвено также включает три пептидные связывающиеветви, имеющих последовательность малеимидо-этил-EGEGEAGKGAG (SEQIDNO: 46), где первый глутаматный остаток модифицирован малеимидо-этильной группой, а остаток лизина модифицирован молекулой DOTA.
Структура представленного 3-DOTA ветви линкерного звена была разработана авторами настоящего изобретения, а синтез был передан на аутсорсинг компании ShanghaiWuXiAppTechCo., Ltd. (Shanghai, China). Идентификацию 3-DOTA ветви звена линкера проводили с помощью масс-спектрометрии ESI-MS. Результат ESI-MS на Фиг. 46 показывает, что настоящая молекулярная конструкция имеет сильный молекулярный ион при 1,357.8, что соответствует [M+4H]4+, указывая на то, что фактическая молекулярная масса звена линкера 3-DOTA составляла 5,427.2 дальтон.
Пример 43
Конструирование, экспрессия и очистка рекомбинантного MBM-1-IL-2
В этом примере составной белок, имеющий последовательность, описанную в SEQIDNo. 47, был сконструирован, экспрессирован и очищен с использованием протоколов, аналогичных тем, которые изложены в предыдущих рабочих примерах. В частности, настоящая молекулярная конструкция MBM-1-IL-2 имеет мотив MBM-1, за которым следует короткий гибкий линкер SEQIDNo. 9 и последовательность IL-2.
Супернатанты культур собирали и экспрессированные рекомбинантные слитые белки в среде очищали с использованием анионообменной колонки. Перед очисткой рекомбинантный слитый белок MBM-1-IL-2 доводили до pH 8,5. Затем белок наносили на предварительно уравновешенную (50 мМ Бис-Трис буфер при pH 8,5) анионообменную смолу Q сефарозы (GEHealthcare). Слитый белок MBM-1-IL-2 элюировали с использованием 3-ступенчатой элюации с 200 мМ, 500 мМ и 1М NaCl в 4М растворе мочевины при pH 8,5, соответственно.
Элюированные образцы были проанализированы с использованием 10% SDS-PAGE, показанного на Фиг. 47. Слитый белок MBM-1-IL-2 был выявлен как основная полоса примерно при 16 кДа, что соответствует ожидаемому размеру (обозначенному стрелкой).
Пример 44
Синтез 2-цепочечных (scFv α CD38)-Fc-MBM-1 X 2 леналидомид связок
В этом примере слитый белок (scFvαCD38)-Fc-MBM-1 из Примера 10 и связку Mal-пептид 4-леналидомид из Примера 40 были конъюгированы с получением молекулярной конструкции, имеющей 2-цепочечную (scFvα Слитый белок CD38)-Fc-MBM-1 и 2 леналидомид связки, конъюгированные с соответствующим цистеиновым остатком металлсвязывающих мотивов слитого белка. Вкратце, очищенный слитыйбелок (scFvαCD38)-Fc-MBM-1 был приготовлен в натрий-сукцинатном буфере (30 мМ сукцинат натрия, pH 5,3, 0,02% tween 20 и 100 мМ сахароза) и восстановлен инкубированием с 45 мкМ TCEP при комнатной температуре в течение 30 минут при легком встряхивании. После реакции восстановления избыток TCEP удаляли диализом против 10 мМ натрийсукцинатного буфера (pH 5,3, 0,02% tween 20 и 100 мМ сахарозы), содержащего 60 мкМ ионов Zn (II). Затем образцы восстановленного белка обрабатывали 15 мкМ связкой Mal-пептид 4-леналидомид и затем инкубировали в течение 1 часа при комнатной температуре. Непрореагировавшие связки леналидомида удаляли с использованием обессоливающей колонки, а продукт анализировали с помощью SDS-PAGE.
На Фиг. 48 показан результат анализа молекулярной конструкции настоящего изобретения с помощью SDS-PAGE. Как показано на Фигуре 48, эта молекулярная конструкция имеет молекулярную массу около 120 кДа (обозначена стрелкой #1 на полосе 2), что несколько больше ожидаемого размера. Неконъюгированная молекулярная конструкция находилась на полосе 3 (обозначена стрелкой #2). Как показано на Фигуре 48, выход конъюгации связки 2-цепочечного(scFv α CD38)-Fc-MBM-1 с леналидомидом составляет приблизительно 85%.
Пример 45
Синтез связки октреотида X жирной кислоты
В этом примере связка Mal-пептид 5-жирная кислота из примера 41 и цис-октреотида из примера 35 были конъюгированы с использованием протоколов, аналогичных изложенным выше, так что малеимидная группа связки Mal-пептид 5-жирная кислота конъюгирован с -SH группой концевого цистеинового остатка Cys-октреотида, в результате чего образуется молекулярная конструкция связки октреотид X жирная кислота (см. фиг. 49).
Пример 46
Синтез связки Aib-GLP-1 агониста X жирной кислоты
В этом примере связка Mal-пептид 5-жирная кислота из примера 41 и Aib-GLP-1 агонист -Cys из примера 34 были конъюгированы с использованием протоколов, аналогичных изложенным выше, так что малеимидогруппа связки Mal-Пептид 5-Жирная кислота конъюгирована с -SH группой концевого цистеинового остатка Aib-GLP-1 агониста Cys, тем самым образуя молекулярную конструкцию связки Aib-GLP-1 агониста X жирная кислота (см. Фигуру 50А).
Пример 47
Синтез связки терипаратид-MBM-1 X жирная кислота
В этом примере связка Mal-пептид 5-жирная кислота из примера 41 и терипаратид-MBM-1 из примера 38 были конъюгированы с использованием протоколов, аналогичных изложенным выше, для получения молекулярной конструкции связки терипаратид-MBM-1 X жирная кислота (см. Фигуру 50B).
Пример 48
Синтез связки лейпролид-MBM-3 X жирная кислота
В этом примере связка Mal-пептид 5-жирная кислота из примера 41 и лейпролид-MBM-3 из примера 39 были конъюгированы с использованием протоколов, аналогичных изложенным выше, для получения молекулярной конструкции связки лейпролид-MBM-3 X жирная кислота (см. Фигуру 51A). Идентификацию синтезированной связки лейпролид-MBM-3 X жирная кислота проводили с использованием масс-спектрометрии MALDI-TOF, и результат на Фигуре 51B показывает, что эта молекулярная конструкция имеет молекулярную массу 4,466.019 дальтон. Молекулярная масса 2,181.038 дальтон показывает избыток молекулы лейпролид-MBM-3 при молярном соотношении 1,5:1 [лейпролид-MBM-3: Mal-пептид-5-жирная кислота] в этой реакции.
Пример 49
Синтез 3-DOTA-ветви линкерного звена X 3 PSMA лигандов
В этом примере 3-DOTA ветвь линкерного звена из примера 42 и три лиганда Cys-PSMA из примера 36 были конъюгированы с использованием протоколов, аналогичных изложенным выше, для получения молекулярной конструкции 3-DOTA ветви линкерного звенаХ 3 PSMA лигандов (Фиг. 52A). Идентификацию синтезированных 3-DOTA ветвей линкерного звена X 3 PSMA лигандов проводили с использованием масс-спектрометрии ESI-MS, и результат на Фигуре 52B показывает, что эта молекулярная конструкция имеет сильный молекулярный ион на уровне 1,749, что соответствует [M+4H]4+, что указывает на то, что фактическая молекулярная масса 3-DOTA ветви линкерного звена X 3 PSMA лигандов составляет 6,992.18 дальтон.
Пример 50
Очистка стабилизированных 2-цепочечных (scFvαCA19-9)-Fc-MBM-1 X 2 DOTA связок
Процедуру стабилизации рекомбинантных 2-цепочечных (scFvαCA19-9)-Fc-MBM-1 X 2 DOTA связок выполняли, как описано в предыдущих примерах.
2-цепочечный слитый белок, конъюгированный с двумя связками DOTA из предыдущих примеров, доводили до pH 5,0 и затем наносили на предварительно уравновешенную (0,1 мМ EDTA, 50 мМ Бис-Трис при pH 5,0) анионообменную колонку Q сефарозы (GEHealthcare). Затем образец элюировали с использованием 3-ступенчатого элюирования; первое элюирование 320 мМ NaCl в течение 70 минут, затем второе элюирование 330 мМ в течение 100 минут, а затем заключительное элюирование 1000 мМ NaCl в течение 50 минут со скоростью потока 1,0 мл/мин.
2-цепочечные (scFvαCA19-9)-Fc-MBM-1 X 2 DOTA связки были отделены от свободного 2-цепочечного (scFvαCA19-9)-Fc-MBM-1 слитого белка, 2 -цепочечного (scFvαCA19-9)-Fc-MBM-1, конъюгированного с тремя или четырьмя DOTA связками, и агрегированного материала с использованием анионообменной колонки Q сефарозы.
Очищенный продукт, 2-цепочечных (scFvαCA19-9)-Fc-MBM-1 X 2 DOTA связок, собирали. Полоса 1 и полоса 2, показанные на Фигуре 53, соответственно, соответствуют неконъюгированной молекулярной конструкции и молекулярной конструкции, конъюгированной с двумя связками DOTA.
Пример 51
Очистка стабилизированных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок
Молекулярную конструкцию 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок из примера 44 стабилизировали с использованием протоколов, аналогичных тем, которые изложены в предыдущих примерах.
Стабилизированную молекулярную конструкцию 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок доводили до pH 7,0 и затем наносили на предварительно уравновешенную (50 мМ Na2HPO4 при pH 7,0, 1М NaCl) гидрофобную колонку взаимодействия (HIC) PhenylHP (GEHealthcare). Стабилизированную молекулярную конструкцию элюировали с использованием линейного градиента от 1000 мМ до 0 мМ NaCl при скорости потока 1,0 мл/мин в течение 80 минут.
Собранные образцы предыдущей очистки HIC наносили на колонку эксклюзионной хроматографии ENrich™SEC650 (Bio-Rad) для отделения стабилизированной молекулярной конструкции от агрегированного материала. Очищенный продукт собирали. Полоса 1 и полоса 2 10%-го невосстанавливающего SDS-PAGE, показанного на фигуре 54, соответственно, соответствуют неконъюгированной молекулярной конструкции и молекулярной конструкции, конъюгированной с двумя связками леналидомида.
Очищенную стабилизированную молекулярную конструкцию 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок дополнительно анализировали с использованием масс-спектроскопии MALDI-TOF. Результат масс-спектрометрического анализа на нижней схеме рисунка 55 показывает, что образец имеет молекулярную массу 58,382 и 116,705 дальтон, что соответствует m/z (z=1): [M+H]+ и m/z (z=2): [M+2H]2+, соответственно.
Результат масс-спектрометрического анализа 2-цепочечного (scFvαCD38)-Fc-MBM-1 в качестве контроля, показанного на верхней схеме Фигуры 55, показывает, что образец имеет молекулярную массу 54,300 и 108,537 дальтон, что соответствует в m/z (z=1): [M+H]+ и m/z (z=2): [M+2H]2+, соответственно.
Пример 52
Период полувыведения стабилизированных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок у мышей NOD-SCID
Измерение периодов полувыведения стабилизированных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок проводили на мышах после внутривенного введения. Молекулярную конструкцию в образце сыворотки наблюдали с помощью метода ELISA. Мышей NOD-SCID в возрасте 8-10 недель приобретали в компании BioLasco, Taipei, Taiwan. Мышей разделили на трех мышей в каждой группе, и им внутривенно вводили посредством внутривенного болюса 100 мкл 7,6 мкМ молекул.
Результаты показывают, что периоды полувыведения родительского анти-CD38 hIgG1.Fc-антитела (Фиг. 56A) и 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок (Фиг. 56B) составляют примерно 13,1 и 23,9 часа соответственно. Результаты использования некомпартментной фармакокинетической модели показывают, что настоящие 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связки имеют более длительный период полувыведения, чем у обычного анти-CD38-антитела.
Пример 53
Цитотоксическая активность очищенных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связок по отношению к H929 и CD38-положительным U266 клеткам
Клетки H929 (5×103/лунку) добавляли в лунки 96-луночных планшетов в среде RPMI1640, содержащей 10% фекальной бычьей сыворотки. Через 2 часа клетки обрабатывали различными концентрациями (2-кратные разведения от 20 мкМ) очищенного 2-цепочечного (scFvαCD38)-Fc-MBM-1 (без связки леналидомида) и 2-цепочечного (scFvαCD38)-Fc-MBM-1 X 2 леналидомид связки. После инкубирования в течение 2 часов культуральную среду удаляли центрифугированием при 400 g в течение 5 минут и заменяли свежей средой, и клетки дополнительно инкубировали в течение еще 120 часов (5 дней) и 168 часов (7 дней). Затем определяли жизнеспособность клеток с использованием набора реагентов для определения жизнеспособности клеток alamarBlue(Invitrogen) в соответствии с инструкциями производителя.
Протоколы определения цитотоксической активности очищенного 2-цепочечного (scFvαCD38)-Fc-MBM-1 с двумя связками леналидомида или без них на CD38-положительном U266 были аналогичны описанным выше в отношении клеток H929.
На Фиг. 57A показана жизнеспособность клеток H929 в четырех группах обработки. 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связки (обозначенные как “scFv-Fc-len”) вызывали примерно 80% цитолиза клеток H929 при 20 мкМ после инкубации в течение 5 дней. 2-цепочечный (scFvαCD38)-Fc-MBM-1 (обозначенный как «scFv-Fc»), который использовали в качестве отрицательного контроля, не показал цитотоксического действия.
На Фиг. 57B показана жизнеспособность CD38-положительных клеток U266 в четырех группах лечения. 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связки вызывали приблизительно 80% цитолиза CD38-положительных клеток U266 при 20 мкМ после инкубации в течение 5 дней.
На Фиг. 57C показана жизнеспособность CD38-отрицательных клеток U266 в четырех группах лечения. 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связки (обозначенные как “scFv-Fc-len”) не могут вызывать какой-либо цитолиз CD38-отрицательных клеток U266 при каждой молярной концентрации.
В целом, результаты на фигурах 57A-57C показали, что 2-цепочечные (scFvαCD38) -Fc-MBM-1 X 2 леналидомида связки обладают сильным эффектом нацеливания.
Пример 54
Антителозависимая клеточно-опосредованная цитотоксичность (ADCC) очищенных 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связок на CD38-экспрессирующих H929 и U266 клетках.
В этом примере был проведен анализ invitro для исследования антителозависимой клеточно-опосредованной цитотоксичности (ADCC) 2-цепочечных (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связок на лизис клеток CD38-экспрессирующих H929 и CD38-позитивных клеток U266.
Мононуклеарные клетки периферической крови человека (PBMC) выделяли от доноров для исследования функции ADCC. Клетки H929 или CD38-положительные U266 клетки инкубировали с 2-цепочечными (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связками в конечной концентрации 200, 40, 8, 1.6, 0.32 или 0.064 нМ, и затем смешивали с PBMC человека при соотношении Е:Т, равном 25, и инкубировали при 37°C в течение 5 часов. Родительское анти-CD38mAb использовали в качестве положительного контроля. Цитолиз анализировали с использованием набора для анализа цитотоксичности LDH (EnzoLifeSciences).
Данные, представленные здесь, показывают, что очищенные 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связки (обозначенные как «scFv-Fc-len») рекрутировали эффекторные клетки таким же образом, как и его родительские mAb против CD38 для проявления цитолитической активности (Фиг. 58A). Родительское антитело против CD38 использовали в качестве положительного контроля (обозначено как «IgG»), а также использовали антитело изотипического контроля (обозначенное как «контрольный IgG»).
На Фиг. 58B показано, что очищенные 2-цепочечные (scFvαCD38)-Fc-MBM-1 X 2 леналидомида связки (обозначенные как «scFv-Fc-len») также проявляют цитолитическую активность в отношении CD38-положительных U266 клеток аналогично родительскому аналогу.
Следует понимать, что приведенное выше описание вариантов осуществления изобретения дано только в качестве примера и что различные модификации могут быть сделаны специалистами в данной области техники. Приведенное выше описание, примеры и данные предоставляют полное описание структуры и использования примерных вариантов осуществления изобретения. Хотя различные варианты осуществления изобретения были описаны выше с определенной степенью конкретности или со ссылкой на один или несколько отдельных вариантов осуществления, специалисты в данной области техники могут внести многочисленные изменения в раскрытые варианты осуществления, не выходя за рамки сущности или объема этого изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Иммунворк Инк.
<120> СОСТАВНОЙ ПОЛИПЕПТИД, ИМЕЮЩИЙ МЕТАЛСВЯЗЫВАЮЩИЙ МОТИВ И
СОДЕРЖАЩАЯ ИХ МОЛЕКУЛЯРНАЯ КОНСТРУКЦИЯ
<130>P3187-PCT
<150>US62/823,626
<151> 2019-03-25
<160> 47
<170>BiSSAP 1.3.6
<210> 1
<211> 5
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<220>
<221> VARIANT
<222> 2
<223>Xaa представляет собой глицин или пролин
<220>
<221> VARIANT
<222> 3
<223>Xaa представляет собой глицин или аланин
<400> 1
CysXaaXaa His Ala
1 5
<210> 2
<211> 5
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 2
CysGlyGlyHisAla
1 5
<210> 3
<211> 5
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 3
CysProGlyHisAla
1 5
<210> 4
<211> 5
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 4
CysGlyAlaHisAla
1 5
<210> 5
<211> 5
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 5
CysProAlaHisAla
1 5
<210> 6
<211> 6
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 6
GlyCysGlyGlyHisAla
1 5
<210> 7
<211> 6
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 7
AlaCysProGlyHisAla
1 5
<210> 8
<211> 6
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 8
GlyCysProGlyHisAla
1 5
<210> 9
<211> 4
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 9
GlyGlyGlyGly
1
<210> 10
<211> 18
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 10
GlySerThrSerGlySerGlyLysProGlySerGlyGluGlySerThr
1 5 10 15
LysGly
<210> 11
<211> 19
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 11
GlyGly Ser GlyGly Ser Lys Gly Ser Lys Gly Ser Lys Gly Ser Lys
1 5 10 15
GlySerLys
<210> 12
<211> 24
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 12
GlyGly Ser GlyGly Ser Gly Lys GlyGly Ser GlyGly Ser Gly Lys
1 5 10 15
GlyGly Ser GlyGly Ser Gly Lys
20
<210> 13
<211> 483
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 13
Glu Ile Val Leu ThrGln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met ThrCys Ser Ala Ser SerGly Val Asn Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro GlyThr Ser Pro ArgArgTrp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala AlaThr Tyr TyrCys His GlnArgGly Ser Tyr ThrPheGly
85 90 95
GlyGlyThr Lys Leu Glu Ile Lys ArgGly Ser Thr Ser Gly Ser Gly
100 105 110
Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys GlyGln Val Gln Leu Val
115 120 125
Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala Ser Val Lys Leu Ser
130 135 140
Cys Lys Thr Ser Gly Tyr ThrPheThr Ser AsnTrp Met His Trp Val
145 150 155 160
Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile Gly Glu Ile Asp Pro
165 170 175
Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPheGlnGly Lys Ala Lys
180 185 190
Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu Val Ser Ser
195 200 205
Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys Ala ArgGly Ser Asn
210 215 220
Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGlnGlyThr Ser Val Thr
225 230 235 240
Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val Thr
275 280 285
Cys Val ValVal Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu
405 410 415
AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGly Ala Cys Pro
465 470 475 480
GlyHisAla
<210> 14
<211> 483
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 14
Gln Val Gln Leu Val Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr ThrPheThr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPhe
50 55 60
GlnGly Lys Ala Lys Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys
85 90 95
Ala ArgGly Ser Asn Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGln
100 105 110
GlyThr Ser Val Thr Val Ser SerGly Ser Thr Ser Gly Ser Gly Lys
115 120 125
Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Ile Val Leu ThrGln
130 135 140
Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu Arg Val Thr Met Thr
145 150 155 160
Cys Ser Ala Ser SerGly Val Asn Tyr Met His Trp Tyr GlnGln Lys
165 170 175
Pro GlyThr Ser Pro ArgArgTrp Ile Tyr Asp Thr Ser Lys Leu Ala
180 185 190
Ser Gly Val Pro Ala ArgPhe Ser Gly Ser Gly Ser GlyThr Asp Tyr
195 200 205
Ser Leu Thr Ile Ser Ser Met Glu Pro Glu Asp Ala AlaThr Tyr Tyr
210 215 220
Cys His GlnArgGly Ser Tyr ThrPheGlyGlyGlyThr Lys Leu Glu
225 230 235 240
Ile Lys ArgGlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val Thr
275 280 285
Cys Val ValVal Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu
405 410 415
AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGly Ala Cys Pro
465 470 475 480
GlyHisAla
<210> 15
<211> 483
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 15
Glu Ile Val Leu ThrGln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met ThrCys Ser Ala Ser SerGly Val Asn Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro GlyThr Ser Pro ArgArgTrp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala AlaThr Tyr TyrCys His GlnArgGly Ser Tyr ThrPheGly
85 90 95
GlyGlyThr Lys Leu Glu Ile Lys ArgGly Ser Thr Ser Gly Ser Gly
100 105 110
Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys GlyGln Val Gln Leu Val
115 120 125
Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala Ser Val Lys Leu Ser
130 135 140
Cys Lys Thr Ser Gly Tyr ThrPheThr Ser AsnTrp Met His Trp Val
145 150 155 160
Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile Gly Glu Ile Asp Pro
165 170 175
Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPheGlnGly Lys Ala Lys
180 185 190
Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu Val Ser Ser
195 200 205
Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys Ala ArgGly Ser Asn
210 215 220
Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGlnGlyThr Ser Val Thr
225 230 235 240
Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val Thr
275 280 285
Cys Val ValVal Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu
405 410 415
AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGlyGlyCys Pro
465 470 475 480
GlyHisAla
<210> 16
<211> 483
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 16
Glu Ile Val Leu ThrGln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met ThrCys Ser Ala Ser SerGly Val Asn Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro GlyThr Ser Pro ArgArgTrp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala AlaThr Tyr TyrCys His GlnArgGly Ser Tyr ThrPheGly
85 90 95
GlyGlyThr Lys Leu Glu Ile Lys ArgGly Ser Thr Ser Gly Ser Gly
100 105 110
Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys GlyGln Val Gln Leu Val
115 120 125
Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala Ser Val Lys Leu Ser
130 135 140
Cys Lys Thr Ser Gly Tyr ThrPheThr Ser AsnTrp Met His Trp Val
145 150 155 160
Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile Gly Glu Ile Asp Pro
165 170 175
Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPheGlnGly Lys Ala Lys
180 185 190
Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu Val Ser Ser
195 200 205
Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys Ala ArgGly Ser Asn
210 215 220
Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGlnGlyThr Ser Val Thr
225 230 235 240
Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro Pro
245 250 255
Cys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val Thr
275 280 285
Cys Val ValVal Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu
405 410 415
AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGlyGlyCysGly
465 470 475 480
GlyHisAla
<210> 17
<211> 458
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 17
Gln Val Gln Leu Val Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr ThrPheThr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPhe
50 55 60
GlnGly Lys Ala Lys Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys
85 90 95
Ala ArgGly Ser Asn Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGln
100 105 110
GlyThr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser GlyGlyThr Ala Ala
130 135 140
Leu GlyCys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
TrpAsn Ser Gly Ala Leu Thr Ser Gly Val His ThrPhe Pro Ala Val
165 170 175
Leu Gln Ser SerGly Leu Tyr Ser Leu Ser Ser Val ValThr Val Pro
180 185 190
Ser SerSer Leu GlyThrGlnThr Tyr Ile CysAsn Val Asn His Lys
195 200 205
Pro Ser AsnThr Lys Val Asp Lys Lys Ala Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys
305 310 315 320
Asp Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu
355 360 365
ThrCys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro
435 440 445
GlyGlyGlyGly Ala Cys Pro Gly His Ala
450 455
<210> 18
<211> 458
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 18
Gln Val Gln Leu Val Gln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Thr Ser Gly Tyr ThrPheThr Ser Asn
20 25 30
Trp Met His Trp Val Lys Gln Ala Pro GlyGlnGly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asp Pro Ser Asp Ser Tyr ThrAsn Tyr AsnGlnAsnPhe
50 55 60
GlnGly Lys Ala Lys Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Val Ser Ser Leu Arg Ser Asp AspThr Ala Val Tyr TyrCys
85 90 95
Ala ArgGly Ser Asn Pro Tyr TyrTyr Ala Met Asp Tyr TrpGlyGln
100 105 110
GlyThr Ser Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser GlyGlyThr Ala Ala
130 135 140
Leu GlyCys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
TrpAsn Ser Gly Ala Leu Thr Ser Gly Val His ThrPhe Pro Ala Val
165 170 175
Leu Gln Ser SerGly Leu Tyr Ser Leu Ser Ser Val ValThr Val Pro
180 185 190
Ser SerSer Leu GlyThrGlnThr Tyr Ile CysAsn Val Asn His Lys
195 200 205
Pro Ser AsnThr Lys Val Asp Lys Lys Ala Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys
305 310 315 320
Asp Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu
355 360 365
ThrCys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro
435 440 445
GlyGlyGlyGlyGlyCys Pro Gly His Ala
450 455
<210> 19
<211> 211
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 19
Glu Ile Val Leu ThrGln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met ThrCys Ser Ala Ser SerGly Val Asn Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro GlyThr Ser Pro ArgArgTrp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp Tyr Ser Leu Thr Ile Ser Ser Met Glu Pro Glu
65 70 75 80
Asp Ala AlaThr Tyr TyrCys His GlnArgGly Ser Tyr ThrPheGly
85 90 95
GlyGlyThr Lys Leu Glu Ile Lys ArgThr Val Ala Ala Pro Ser Val
100 105 110
Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser GlyThr Ala Ser
115 120 125
Val ValCys Leu LeuAsnAsnPhe Tyr Pro Arg Glu Ala Lys Val Gln
130 135 140
Trp Lys Val Asp Asn Ala Leu Gln Ser GlyAsn Ser Gln Glu Ser Val
145 150 155 160
Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser SerThr Leu
165 170 175
Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu
180 185 190
Val Thr His GlnGly Leu Ser Ser Pro Val Thr Lys Ser PheAsnArg
195 200 205
GlyGluCys
210
<210> 20
<211> 489
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 20
Glu Ile Val Leu ThrGln Ser Pro Gly Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser SerGln Ser Val PhePhe Ser
20 25 30
Ser SerGln Lys Asn Tyr Leu Ala Trp Tyr GlnGln Ile Pro GlyGln
35 40 45
Ser Pro Arg Leu LeuThr Tyr Trp Ala Ser ThrArg Glu Ser Gly Val
50 55 60
Pro Asp ArgPheThrGly Ser Gly Ser GlyThr Asp PheThr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Pro Glu Asp Leu Ala Ile Tyr TyrCys His Gln
85 90 95
Tyr Leu Ser SerArgThrPheGlyGlnGlyThr Lys Leu Glu Ile Lys
100 105 110
ArgGly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser
115 120 125
Thr Lys GlyGln Val Gln Leu GlnGln Pro Gly Ala Glu Val Val Lys
130 135 140
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr ThrPhe
145 150 155 160
Thr Ser Tyr Tyr Ile His Trp Ile Lys GlnThr Pro GlyGlnGly Leu
165 170 175
Glu Trp Val Gly Val Ile Tyr Pro GlyAsn Asp Asp Ile Ser Tyr Asn
180 185 190
Gln Lys PheGlnGly Lys Ala Thr Leu Thr Ala Asp Lys Ser SerThr
195 200 205
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
210 215 220
Tyr TyrCys Ala Arg Glu Val Arg Leu Arg Tyr Phe Asp Val TrpGly
225 230 235 240
GlnGlyThrThr Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys
245 250 255
Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu Thr
385 390 395 400
Cys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
GlyGlyGly Ala Cys Pro Gly His Ala
485
<210> 21
<211> 489
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 21
Gln Val Gln Leu GlnGln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr ThrPheThr Ser Tyr
20 25 30
Tyr Ile His Trp Ile Lys GlnThr Pro GlyGlnGly Leu Glu Trp Val
35 40 45
Gly Val Ile Tyr Pro GlyAsn Asp Asp Ile Ser Tyr AsnGln Lys Phe
50 55 60
GlnGly Lys Ala Thr Leu Thr Ala Asp Lys Ser SerThrThr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr TyrCys
85 90 95
Ala Arg Glu Val Arg Leu Arg Tyr Phe Asp Val TrpGlyGlnGlyThr
100 105 110
Thr Val Thr Val Ser SerGly Ser Thr Ser Gly Ser Gly Lys Pro Gly
115 120 125
Ser Gly Glu Gly Ser Thr Lys Gly Glu Ile Val Leu ThrGln Ser Pro
130 135 140
Gly Ser Leu Ala Val Ser Pro Gly Glu Arg Val Thr Met Ser Cys Lys
145 150 155 160
Ser SerGln Ser Val PhePhe Ser SerSerGln Lys Asn Tyr Leu Ala
165 170 175
Trp Tyr GlnGln Ile Pro GlyGln Ser Pro Arg Leu LeuThr Tyr Trp
180 185 190
Ala Ser ThrArg Glu Ser Gly Val Pro Asp ArgPheThrGly Ser Gly
195 200 205
Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Val Gln Pro Glu Asp
210 215 220
Leu Ala Ile Tyr TyrCys His Gln Tyr Leu Ser SerArgThrPheGly
225 230 235 240
GlnGlyThr Lys Leu Glu Ile Lys ArgGlyGlyGly Ala Ser Asp Lys
245 250 255
Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu Thr
385 390 395 400
Cys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
GlyGlyGly Ala Cys Pro Gly His Ala
485
<210> 22
<211> 489
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 22
Glu Ile Val Leu ThrGln Ser Pro Gly Ser Leu Ala Val Ser Pro Gly
1 5 10 15
Glu Arg Val Thr Met Ser Cys Lys Ser SerGln Ser Val PhePhe Ser
20 25 30
Ser SerGln Lys Asn Tyr Leu Ala Trp Tyr GlnGln Ile Pro GlyGln
35 40 45
Ser Pro Arg Leu LeuThr Tyr Trp Ala Ser ThrArg Glu Ser Gly Val
50 55 60
Pro Asp ArgPheThrGly Ser Gly Ser GlyThr Asp PheThr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Pro Glu Asp Leu Ala Ile Tyr TyrCys His Gln
85 90 95
Tyr Leu Ser SerArgThrPheGlyGlnGlyThr Lys Leu Glu Ile Lys
100 105 110
ArgGly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser
115 120 125
Thr Lys GlyGln Val Gln Leu GlnGln Pro Gly Ala Glu Val Val Lys
130 135 140
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr ThrPhe
145 150 155 160
Thr Ser Tyr Tyr Ile His Trp Ile Lys GlnThr Pro GlyGlnGly Leu
165 170 175
Glu Trp Val Gly Val Ile Tyr Pro GlyAsn Asp Asp Ile Ser Tyr Asn
180 185 190
Gln Lys PheGlnGly Lys Ala Thr Leu Thr Ala Asp Lys Ser SerThr
195 200 205
Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val
210 215 220
Tyr TyrCys Ala Arg Glu Val Arg Leu Arg Tyr Phe Asp Val TrpGly
225 230 235 240
GlnGlyThrThr Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys
245 250 255
Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu Thr
385 390 395 400
Cys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
GlyGlyGlyGlyCys Pro Gly His Ala
485
<210> 23
<211> 489
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 23
Gln Val Gln Leu GlnGln Pro Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr ThrPheThr Ser Tyr
20 25 30
Tyr Ile His Trp Ile Lys GlnThr Pro GlyGlnGly Leu Glu Trp Val
35 40 45
Gly Val Ile Tyr Pro GlyAsn Asp Asp Ile Ser Tyr AsnGln Lys Phe
50 55 60
GlnGly Lys Ala Thr Leu Thr Ala Asp Lys Ser SerThrThr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr TyrCys
85 90 95
Ala Arg Glu Val Arg Leu Arg Tyr Phe Asp Val TrpGlyGlnGlyThr
100 105 110
Thr Val Thr Val Ser SerGly Ser Thr Ser Gly Ser Gly Lys Pro Gly
115 120 125
Ser Gly Glu Gly Ser Thr Lys Gly Glu Ile Val Leu ThrGln Ser Pro
130 135 140
Gly Ser Leu Ala Val Ser Pro Gly Glu Arg Val Thr Met Ser Cys Lys
145 150 155 160
Ser SerGln Ser Val PhePhe Ser SerSerGln Lys Asn Tyr Leu Ala
165 170 175
Trp Tyr GlnGln Ile Pro GlyGln Ser Pro Arg Leu LeuThr Tyr Trp
180 185 190
Ala Ser ThrArg Glu Ser Gly Val Pro Asp ArgPheThrGly Ser Gly
195 200 205
Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Val Gln Pro Glu Asp
210 215 220
Leu Ala Ile Tyr TyrCys His Gln Tyr Leu Ser SerArgThrPheGly
225 230 235 240
GlnGlyThr Lys Leu Glu Ile Lys ArgGlyGlyGly Ala Ser Asp Lys
245 250 255
Thr His ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro
260 265 270
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
275 280 285
ArgThr Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp
290 295 300
Pro Glu Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn
305 310 315 320
Ala Lys Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val
325 330 335
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp
340 345 350
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
355 360 365
Thr Ile Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr
370 375 380
Leu Pro Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu Thr
385 390 395 400
Cys Leu Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
405 410 415
Ser AsnGlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu
420 425 430
Asp Ser Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys
435 440 445
Ser ArgTrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu
450 455 460
Ala Leu His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro Gly
465 470 475 480
GlyGlyGlyGlyCys Pro Gly His Ala
485
<210> 24
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 24
Asp Ile Gln Met ThrGln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile ThrCysArg Ala Ser SerSer Val Ser Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Tyr
35 40 45
Ala Pro Ser Asn Leu Ala Ser Gly Val Pro Ser ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr TyrCysGlnGlnTrp Ser PheAsn Pro ProThr
85 90 95
PheGlyGlnGlyThr Lys Val Glu Ile Lys ArgGly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Gln
115 120 125
Leu Val Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Tyr ThrPheThr Ser Tyr Asn Met His
145 150 155 160
Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Ala Ile
165 170 175
Tyr Pro GlyAsnGly Asp Thr Ser Tyr AsnGln Lys Phe Lys GlyArg
180 185 190
PheThr Ile Ser Val Asp Lys Ser Lys AsnThr Leu Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr TyrCys Ala Arg Val
210 215 220
Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val TrpGlyGlnGly
225 230 235 240
Thr Leu Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
Gly Ala Cys Pro Gly His Ala
485
<210> 25
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 25
Glu Val Gln Leu Val Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr ThrPheThr Ser Tyr
20 25 30
Asn Met His Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Ala Ile Tyr Pro GlyAsnGly Asp Thr Ser Tyr AsnGln Lys Phe
50 55 60
Lys GlyArgPheThr Ile Ser Val Asp Lys Ser Lys AsnThr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr TyrCys
85 90 95
Ala Arg Val Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val Trp
100 105 110
GlyGlnGlyThr Leu Val Thr Val Ser SerGly Ser Thr Ser Gly Ser
115 120 125
Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Asp Ile Gln Met
130 135 140
ThrGln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile ThrCysArg Ala Ser SerSer Val Ser Tyr Met His Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Tyr Ala Pro Ser Asn
180 185 190
Leu Ala Ser Gly Val Pro Ser ArgPhe Ser Gly Ser Gly Ser GlyThr
195 200 205
Asp PheThr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
210 215 220
Tyr TyrCysGlnGlnTrp Ser PheAsn Pro ProThrPheGlyGlnGly
225 230 235 240
Thr Lys Val Glu Ile Lys ArgGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
Gly Ala Cys Pro Gly His Ala
485
<210> 26
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 26
Glu Val Gln Leu Val Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr ThrPheThr Ser Tyr
20 25 30
Asn Met His Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Ala Ile Tyr Pro GlyAsnGly Asp Thr Ser Tyr AsnGln Lys Phe
50 55 60
Lys GlyArgPheThr Ile Ser Val Asp Lys Ser Lys AsnThr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr TyrCys
85 90 95
Ala Arg Val Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val Trp
100 105 110
GlyGlnGlyThr Leu Val Thr Val Ser SerGly Ser Thr Ser Gly Ser
115 120 125
Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Asp Ile Gln Met
130 135 140
ThrGln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile ThrCysArg Ala Ser SerSer Val Ser Tyr Met His Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Tyr Ala Pro Ser Asn
180 185 190
Leu Ala Ser Gly Val Pro Ser ArgPhe Ser Gly Ser Gly Ser GlyThr
195 200 205
Asp PheThr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
210 215 220
Tyr TyrCysGlnGlnTrp Ser PheAsn Pro ProThrPheGlyGlnGly
225 230 235 240
Thr Lys Val Glu Ile Lys ArgGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
GlyGlyCys Pro Gly His Ala
485
<210> 27
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 27
Asp Ile Gln Met ThrGln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile ThrCysArg Ala Ser SerSer Val Ser Tyr Met
20 25 30
His Trp Tyr GlnGln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Tyr
35 40 45
Ala Pro Ser Asn Leu Ala Ser Gly Val Pro Ser ArgPhe Ser Gly Ser
50 55 60
Gly Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr TyrCysGlnGlnTrp Ser PheAsn Pro ProThr
85 90 95
PheGlyGlnGlyThr Lys Val Glu Ile Lys ArgGly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Gln
115 120 125
Leu Val Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Ala Ser Gly Tyr ThrPheThr Ser Tyr Asn Met His
145 150 155 160
Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly Ala Ile
165 170 175
Tyr Pro GlyAsnGly Asp Thr Ser Tyr AsnGln Lys Phe Lys GlyArg
180 185 190
PheThr Ile Ser Val Asp Lys Ser Lys AsnThr Leu Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr TyrCys Ala Arg Val
210 215 220
Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val TrpGlyGlnGly
225 230 235 240
Thr Leu Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
GlyGlyCysGlyGly His Ala
485
<210> 28
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 28
Glu Val Gln Leu Val Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Tyr ThrPheThr Ser Tyr
20 25 30
Asn Met His Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Ala Ile Tyr Pro GlyAsnGly Asp Thr Ser Tyr AsnGln Lys Phe
50 55 60
Lys GlyArgPheThr Ile Ser Val Asp Lys Ser Lys AsnThr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr TyrCys
85 90 95
Ala Arg Val Val Tyr Tyr Ser Asn Ser Tyr Trp Tyr Phe Asp Val Trp
100 105 110
GlyGlnGlyThr Leu Val Thr Val Ser SerGly Ser Thr Ser Gly Ser
115 120 125
Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Asp Ile Gln Met
130 135 140
ThrGln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr
145 150 155 160
Ile ThrCysArg Ala Ser SerSer Val Ser Tyr Met His Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Lys Ala Pro Lys Pro Leu Ile Tyr Ala Pro Ser Asn
180 185 190
Leu Ala Ser Gly Val Pro Ser ArgPhe Ser Gly Ser Gly Ser GlyThr
195 200 205
Asp PheThr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
210 215 220
Tyr TyrCysGlnGlnTrp Ser PheAsn Pro ProThrPheGlyGlnGly
225 230 235 240
Thr Lys Val Glu Ile Lys ArgGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
GlyGlyCysGlyGly His Ala
485
<210> 29
<211> 108
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 29
Asp Ile Gln Met ThrGln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile ThrCys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser TrpPheGlnGln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala AsnArg Leu Val Asp Gly Val Pro Ser ArgPhe Ser Gly
50 55 60
Ser Gly Ser GlyGln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr TyrCys Leu Gln Tyr Asp Glu Phe Pro Arg
85 90 95
ThrPheGlyGlyGlyThr Lys Leu Glu Ile Lys Arg
100 105
<210> 30
<211> 115
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 30
Glu Val Lys Leu GlnGln Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Met Lys Leu Ser Cys Ala Ala Ser GlyPheThrPhe Ser Asp Ala
20 25 30
Trp Met Asp Trp Val ArgGln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Glu Ile GlyAsn Lys GlyAsnAsn His Ala Thr Tyr Tyr Ala Glu
50 55 60
Ser Val Lys GlyArgPheThr Val Ser Arg Asp Asp Ser Lys Ser Arg
65 70 75 80
Val Tyr Leu Gln Met Asn Ser Leu Arg Val Glu Asp ThrGlyThr Tyr
85 90 95
Tyr CysThrThrArgPhe Ala Tyr TrpGlyGlnGlyThrThr Val Thr
100 105 110
ValSerSer
115
<210> 31
<211> 481
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 31
Asp Ile Gln Met ThrGln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile ThrCys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser TrpPheGlnGln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala AsnArg Leu Val Asp Gly Val Pro Ser ArgPhe Ser Gly
50 55 60
Ser Gly Ser GlyGln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr TyrCys Leu Gln Tyr Asp Glu Phe Pro Arg
85 90 95
ThrPheGlyGlyGlyThr Lys Leu Glu Ile Lys ArgGly Ser Thr Ser
100 105 110
Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val
115 120 125
Lys Leu GlnGln Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Met
130 135 140
Lys Leu Ser Cys Ala Ala Ser GlyPheThrPhe Ser Asp Ala Trp Met
145 150 155 160
Asp Trp Val ArgGln Ser Pro Glu Lys Gly Leu Glu Trp Val Ala Glu
165 170 175
Ile GlyAsn Lys GlyAsnAsn His Ala Thr Tyr Tyr Ala Glu Ser Val
180 185 190
Lys GlyArgPheThr Val Ser Arg Asp Asp Ser Lys Ser Arg Val Tyr
195 200 205
Leu Gln Met Asn Ser Leu Arg Val Glu Asp ThrGlyThr Tyr TyrCys
210 215 220
ThrThrArgPhe Ala Tyr TrpGlyGlnGlyThrThr Val Thr Val Ser
225 230 235 240
Ser GlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro ProCys Pro
245 250 255
Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro Pro Lys
260 265 270
Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val ThrCys Val
275 280 285
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsnTrp Tyr
290 295 300
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
305 310 315 320
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
325 330 335
Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser Asn Lys
340 345 350
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys GlyGln
355 360 365
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
370 375 380
ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe Tyr Pro
385 390 395 400
Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu AsnAsn
405 410 415
Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser PhePhe Leu
420 425 430
Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGlyAsn Val
435 440 445
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr ThrGln
450 455 460
Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGly Ala Cys Pro Gly His
465 470 475 480
Ala
<210> 32
<211> 481
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 32
Asp Ile Gln Met ThrGln Ser Pro Ser Ser Met Tyr Ala Ser Leu Gly
1 5 10 15
Glu Arg Val Thr Ile ThrCys Lys Ala Ser Gln Asp Ile Asn Ser Tyr
20 25 30
Leu Ser TrpPheGlnGln Lys Pro Gly Lys Ser Pro Lys Thr Leu Ile
35 40 45
Tyr Arg Ala AsnArg Leu Val Asp Gly Val Pro Ser ArgPhe Ser Gly
50 55 60
Ser Gly Ser GlyGln Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Tyr
65 70 75 80
Glu Asp Met Gly Ile Tyr TyrCys Leu Gln Tyr Asp Glu Phe Pro Arg
85 90 95
ThrPheGlyGlyGlyThr Lys Leu Glu Ile Lys ArgGly Ser Thr Ser
100 105 110
Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val
115 120 125
Lys Leu GlnGln Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Met
130 135 140
Lys Leu Ser Cys Ala Ala Ser GlyPheThrPhe Ser Asp Ala Trp Met
145 150 155 160
Asp Trp Val ArgGln Ser Pro Glu Lys Gly Leu Glu Trp Val Ala Glu
165 170 175
Ile GlyAsn Lys GlyAsnAsn His Ala Thr Tyr Tyr Ala Glu Ser Val
180 185 190
Lys GlyArgPheThr Val Ser Arg Asp Asp Ser Lys Ser Arg Val Tyr
195 200 205
Leu Gln Met Asn Ser Leu Arg Val Glu Asp ThrGlyThr Tyr TyrCys
210 215 220
ThrThrArgPhe Ala Tyr TrpGlyGlnGlyThrThr Val Thr Val Ser
225 230 235 240
Ser GlyGlyGly Ala Ser Asp Lys Thr His ThrCys Pro ProCys Pro
245 250 255
Ala Pro Glu Leu LeuGlyGly Pro Ser Val Phe Leu Phe Pro Pro Lys
260 265 270
Pro Lys Asp Thr Leu Met Ile Ser ArgThr Pro Glu Val ThrCys Val
275 280 285
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys PheAsnTrp Tyr
290 295 300
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
305 310 315 320
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
325 330 335
Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys Cys Lys Val Ser Asn Lys
340 345 350
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys GlyGln
355 360 365
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
370 375 380
ThrArgAsnGln Val Ser Leu ThrCys Leu Val Lys GlyPhe Tyr Pro
385 390 395 400
Ser Asp Ile Ala Val Glu Trp Glu Ser AsnGlyGln Pro Glu AsnAsn
405 410 415
Tyr Lys ThrThr Pro Pro Val Leu Asp Ser Asp Gly Ser PhePhe Leu
420 425 430
Tyr Ser Lys Leu Thr Val Asp Lys Ser ArgTrpGlnGlnGlyAsn Val
435 440 445
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr ThrGln
450 455 460
Lys Ser Leu Ser Leu Ser Pro GlyGlyGlyGlyGlyCysGlyGly His
465 470 475 480
Ala
<210> 33
<211> 487
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<400> 33
Glu Ile Val Leu ThrGln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser CysArg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr GlnGln Lys Pro GlyGln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser AsnArg Ala ThrGly Ile Pro Ala ArgPhe Ser Gly
50 55 60
Ser Gly Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr TyrCysGlnGlnArg Ser AsnTrp Pro Pro
85 90 95
ThrPheGlyGlnGlyThr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Gln
115 120 125
Leu Leu Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Val Ser GlyPheThrPheAsn Ser Phe Ala Met Ser
145 150 155 160
Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile
165 170 175
Ser Gly Ser GlyGlyGlyThr Tyr Tyr Ala Asp Ser Val Lys GlyArg
180 185 190
PheThr Ile Ser Arg Asp Asn Ser Lys AsnThr Leu Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr PheCys Ala Lys Asp
210 215 220
Lys Ile Leu TrpPheGly Glu Pro Val Phe Asp Tyr TrpGlyGlnGly
225 230 235 240
Thr Leu Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
Gly Ala Cys Pro Gly His Ala
485
<210> 34
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 34
Glu Val Gln Leu Leu Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser GlyPheThrPheAsn Ser Phe
20 25 30
Ala Met Ser Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser GlyGlyGlyThr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys GlyArgPheThr Ile Ser Arg Asp Asn Ser Lys AsnThr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr PheCys
85 90 95
Ala Lys Asp Lys Ile Leu TrpPheGly Glu Pro Val Phe Asp Tyr Trp
100 105 110
GlyGlnGlyThr Leu Val Thr Val Ser SerGly Ser Thr Ser Gly Ser
115 120 125
Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Ile Val Leu
130 135 140
ThrGln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser CysArg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr
165 170 175
GlnGln Lys Pro GlyGln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser
180 185 190
AsnArg Ala ThrGly Ile Pro Ala ArgPhe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp PheThr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
210 215 220
Val Tyr TyrCysGlnGlnArg Ser AsnTrp Pro ProThrPheGlyGln
225 230 235 240
GlyThr Lys Val Glu Ile Lys GlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
Gly Ala Cys Pro Gly His Ala
485
<210> 35
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 35
Glu Ile Val Leu ThrGln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser CysArg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr GlnGln Lys Pro GlyGln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser AsnArg Ala ThrGly Ile Pro Ala ArgPhe Ser Gly
50 55 60
Ser Gly Ser GlyThr Asp PheThr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr TyrCysGlnGlnArg Ser AsnTrp Pro Pro
85 90 95
ThrPheGlyGlnGlyThr Lys Val Glu Ile Lys Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Gln
115 120 125
Leu Leu Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly Ser Leu Arg
130 135 140
Leu Ser Cys Ala Val Ser GlyPheThrPheAsn Ser Phe Ala Met Ser
145 150 155 160
Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile
165 170 175
Ser Gly Ser GlyGlyGlyThr Tyr Tyr Ala Asp Ser Val Lys GlyArg
180 185 190
PheThr Ile Ser Arg Asp Asn Ser Lys AsnThr Leu Tyr Leu Gln Met
195 200 205
Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr PheCys Ala Lys Asp
210 215 220
Lys Ile Leu TrpPheGly Glu Pro Val Phe Asp Tyr TrpGlyGlnGly
225 230 235 240
Thr Leu Val Thr Val Ser SerGlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
GlyGlyCys Pro Gly His Ala
485
<210> 36
<211> 487
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 36
Glu Val Gln Leu Leu Glu Ser GlyGlyGly Leu Val Gln Pro GlyGly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser GlyPheThrPheAsn Ser Phe
20 25 30
Ala Met Ser Trp Val ArgGln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser GlyGlyGlyThr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys GlyArgPheThr Ile Ser Arg Asp Asn Ser Lys AsnThr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr PheCys
85 90 95
Ala Lys Asp Lys Ile Leu TrpPheGly Glu Pro Val Phe Asp Tyr Trp
100 105 110
GlyGlnGlyThr Leu Val Thr Val Ser SerGly Ser Thr Ser Gly Ser
115 120 125
Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Ile Val Leu
130 135 140
ThrGln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly Glu Arg Ala Thr
145 150 155 160
Leu Ser CysArg Ala Ser Gln Ser Val Ser Ser Tyr Leu Ala Trp Tyr
165 170 175
GlnGln Lys Pro GlyGln Ala Pro Arg Leu Leu Ile Tyr Asp Ala Ser
180 185 190
AsnArg Ala ThrGly Ile Pro Ala ArgPhe Ser Gly Ser Gly Ser Gly
195 200 205
Thr Asp PheThr Leu Thr Ile Ser Ser Leu Glu Pro Glu Asp Phe Ala
210 215 220
Val Tyr TyrCysGlnGlnArg Ser AsnTrp Pro ProThrPheGlyGln
225 230 235 240
GlyThr Lys Val Glu Ile Lys GlyGlyGly Ala Ser Asp Lys Thr His
245 250 255
ThrCys Pro ProCys Pro Ala Pro Glu Leu LeuGlyGly Pro Ser Val
260 265 270
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser ArgThr
275 280 285
Pro Glu Val ThrCys Val ValVal Asp Val Ser His Glu Asp Pro Glu
290 295 300
Val Lys PheAsnTrp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
305 310 315 320
Thr Lys Pro Arg Glu GluGln Tyr Asn Ser Thr Tyr Arg Val Val Ser
325 330 335
Val Leu Thr Val Leu His Gln Asp Trp Leu AsnGly Lys Asp Tyr Lys
340 345 350
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
355 360 365
Ser Lys Ala Lys GlyGln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
370 375 380
Pro Ser Arg Asp Glu Leu ThrArgAsnGln Val Ser Leu ThrCys Leu
385 390 395 400
Val Lys GlyPhe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
405 410 415
GlyGln Pro Glu AsnAsn Tyr Lys ThrThr Pro Pro Val Leu Asp Ser
420 425 430
Asp Gly Ser PhePhe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
435 440 445
TrpGlnGlnGlyAsn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
450 455 460
His Asn His Tyr ThrGln Lys Ser Leu Ser Leu Ser Pro GlyGlyGly
465 470 475 480
GlyGlyCys Pro Gly His Ala
485
<210> 37
<211> 47
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<220>
<221>VARIANT
<222> 2
<223>Xaa представляет собой ε-аминомасляная кислота
<400> 37
His Xaa Glu GlyThrPheThr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val ArgGlyArgGlyGly
20 25 30
GlyGly Ser GlyGlyGlyGly Ser GlyGlyGlyGly Ser GlyCys
35 40 45
<210> 38
<211> 14
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<220>
<221>VARIANT
<222> 7
<223> D-form
<220>
<221> VARIANT
<222> 10
<223> D-form
<400> 38
Cys Ser GlyGlyGlyGlyPheCysPheTrp Lys ThrCysThr
1 5 10
<210> 39
<211> 46
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 39
Cys Ser Asn Leu Ser ThrCys Val Leu Gly Lys Leu Ser Gln Glu Leu
1 5 10 15
His Lys Leu GlnThr Tyr Pro ArgThrAsnThrGly Ser GlyThr Pro
20 25 30
GlyGlyGly Ser GlyGlyGly Ser Ala Cys Pro Gly His Ala
35 40 45
<210> 40
<211> 55
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 40
Ser Val Ser Glu Ile Gln Leu Met His Asn Leu Gly Lys His Leu Asn
1 5 10 15
Ser Met Glu Arg Val Glu Trp Leu Arg Lys Lys Leu Gln Asp Val His
20 25 30
AsnPheGlyGlyGlyGly Ser GlyGlyGlyGly Ser GlyGlyGlyGly
35 40 45
Ser Ala Cys Pro Gly His Ala
50 55
<210> 41
<211> 23
<212>PRT
<213> Искусственная последовательность
<220>
<223> Синтетический
<220>
<221>VARIANT
<222> 1
<223> Xaa представляет собой пироглутамат
<220>
<221>VARIANT
<222> 6
<223> D-form
<400> 41
Xaa His Trp Ser Trp Leu LeuArg Pro GlyGly Ser Gly Ser GlyGly
1 5 10 15
Ser GlyCysGlyGly His Ala
20
<210> 42
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 42
Glu Gly Glu Gly Glu Ala GlyGly Lys Gly Ala Gly Lys Gly Ala Gly
1 5 10 15
LysGly
<210> 43
<211> 18
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 43
Glu Asp Glu Asp Glu Ala GlyGly Lys Gly Ala Gly Lys Gly Ala Gly
1 5 10 15
LysGly
<210> 44
<211> 9
<212>PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<220>
<221> VARIANT
<222> 6,8
<223>Xaa представляет собой ПЭГилированную аминокислоту, имеющую 4
повтора звена этиленгликоля (EG)
<400> 44
Glu Gly Glu Gly Glu Xaa Lys Xaa Lys
1 5
<210> 45
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 45
Lys Gly Ala GlyGly Lys Gly Ala GlyGly Lys Gly
1 5 10
<210> 46
<211> 11
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 46
Glu Gly Glu Gly Glu Ala Gly Lys Gly Ala Gly
1 5 10
<210> 47
<211> 144
<212> PRT
<213> Искусственная последовательность
<220>
<223>Синтетический
<400> 47
Ala Cys Pro Gly His Ala GlyGlyGlyGly Ser Ala Pro Thr Ser Ser
1 5 10 15
Ser Thr Lys LysThrGln Leu Gln Leu Glu His Leu LeuLeu Asp Leu
20 25 30
Gln Met Ile Leu AsnGly Ile AsnAsn Tyr Lys Asn Pro Lys Leu Thr
35 40 45
Arg Met Leu ThrPhe Lys Phe Tyr Met Pro Lys Lys Ala Thr Glu Leu
50 55 60
Lys His Leu GlnCys Leu Glu GluGlu Leu Lys Pro Leu Glu Glu Val
65 70 75 80
Leu Asn Leu Ala Gln Ser Lys AsnPhe His Leu Arg Pro Arg Asp Leu
85 90 95
Ile Ser Asn Ile Asn Val Ile Val Leu Glu Leu Lys Gly Ser Glu Thr
100 105 110
ThrPhe Met Cys Glu Tyr Ala Asp Glu Thr Ala Thr Ile Val Glu Phe
115 120 125
Leu AsnArgTrp Ile ThrPhe Ser Gln Ser Ile Ile Ser Thr Leu Thr
130 135 140
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ТРИСПЕЦИФИЧЕСКИЕ МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2829901C2 |
| АНТИТЕЛА, КОТОРЫЕ СВЯЗЫВАЮТСЯ С РАКОВЫМИ КЛЕТКАМИ И ОБЕСПЕЧИВАЮТ НАПРАВЛЕННЫЙ ПЕРЕНОС РАДИОНУКЛИДОВ К УКАЗАННЫМ КЛЕТКАМ | 2020 |
|
RU2833191C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| УЛУЧШЕННЫЙ БЕЛОК СЛИЯНИЯ FVIII И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2789085C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННЫМИ СПОСОБНОСТЯМИ СВЯЗЫВАТЬСЯ С FCRN | 2015 |
|
RU2730592C2 |
| СПОСОБ ПОЛУЧЕНИЯ ВАРИАНТОВ FcyRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2820161C1 |
| ВАРИАНТЫ FcγRIIB-СПЕЦИФИЧЕСКОЙ Fc-ОБЛАСТИ | 2013 |
|
RU2729831C2 |
| ВАРИАНТЫ FC-ОБЛАСТИ С МОДИФИЦИРОВАННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С FCRN И С СОХРАНЕННОЙ СПОСОБНОСТЬЮ СВЯЗЫВАТЬСЯ С БЕЛКОМ А | 2015 |
|
RU2727639C2 |
| АНТИТЕЛО-ПОДОБНЫЕ СВЯЗЫВАЮЩИЕ БЕЛКИ С ДВОЙНЫМИ ВАРИАБЕЛЬНЫМИ ОБЛАСТЯМИ, ИМЕЮЩИЕ ОРИЕНТАЦИЮ СВЯЗЫВАЮЩИХ ОБЛАСТЕЙ КРЕСТ-НАКРЕСТ | 2012 |
|
RU2823693C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИПЕПТИДНОГО ГЕТЕРОМУЛЬТИМЕРА | 2014 |
|
RU2730594C2 |
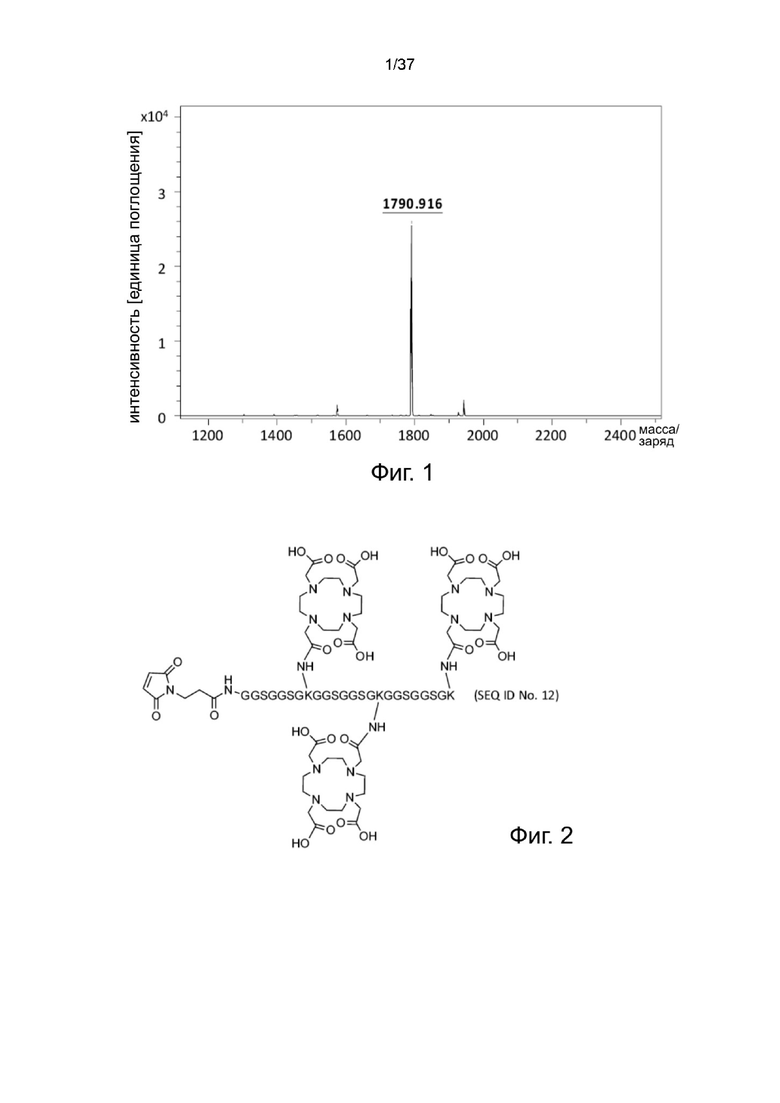
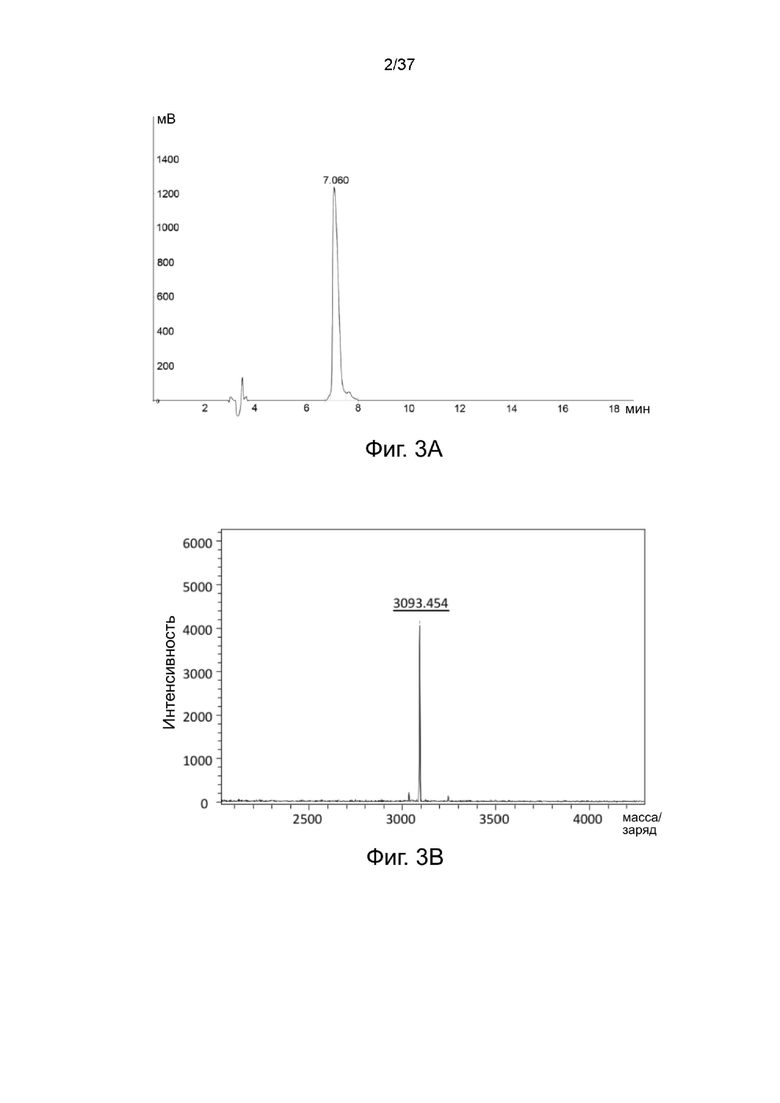
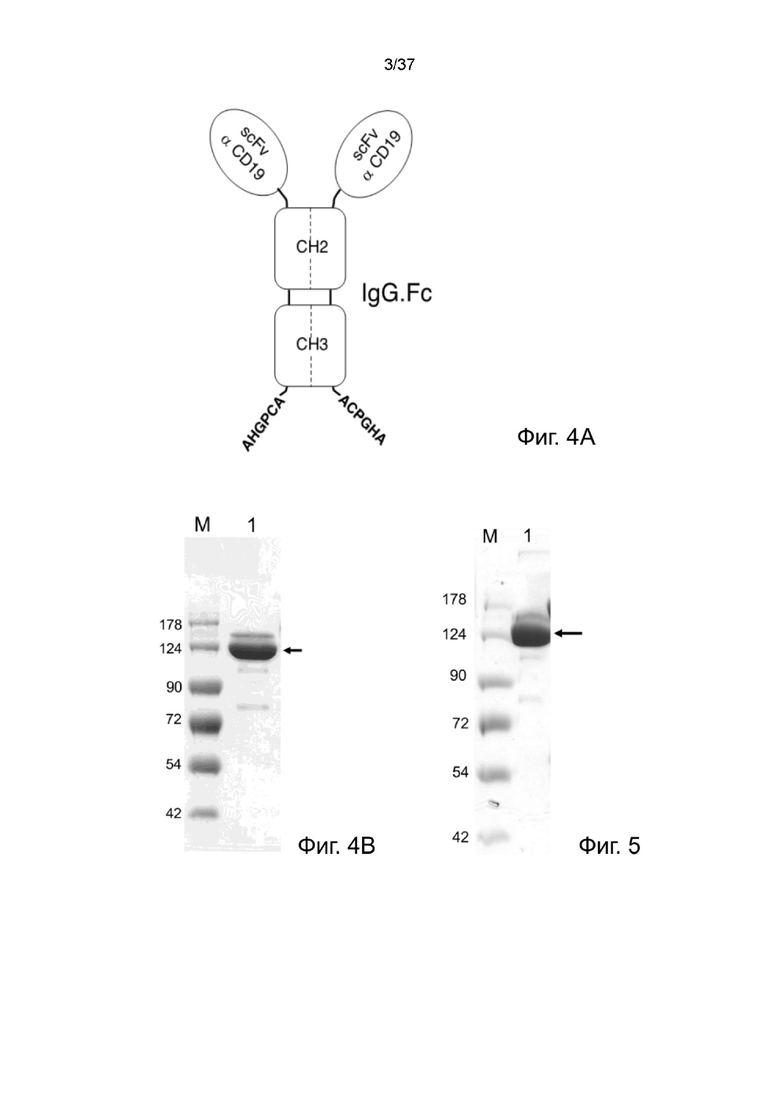
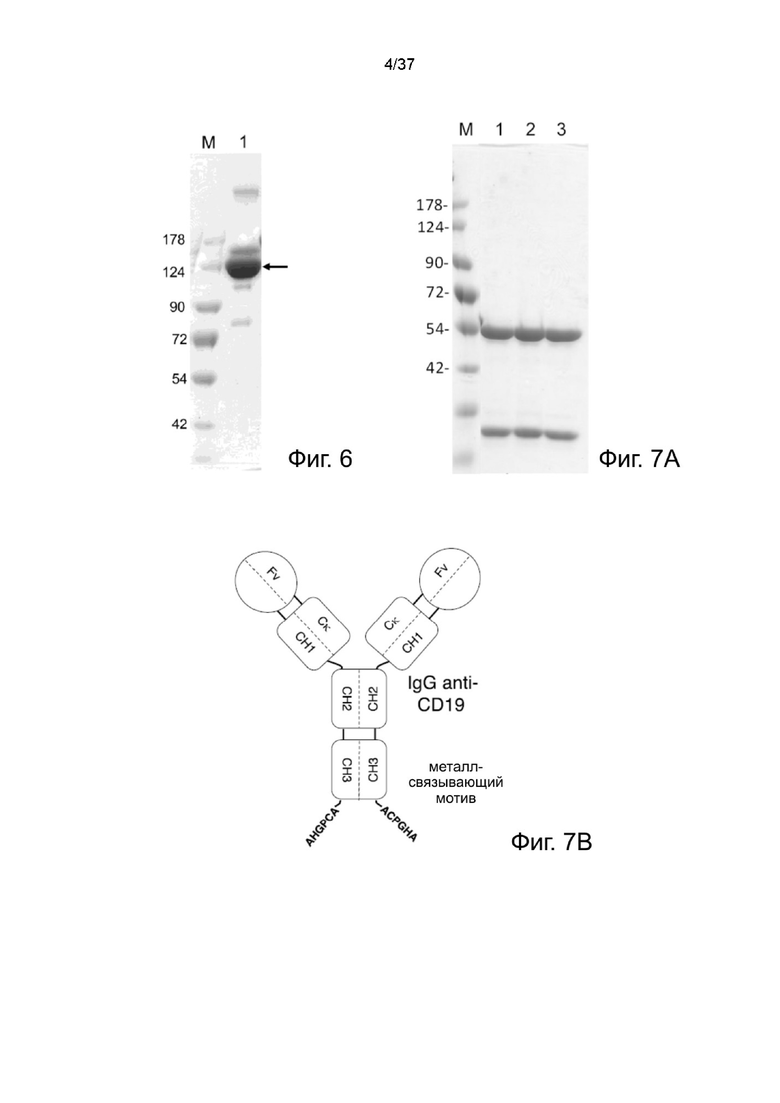
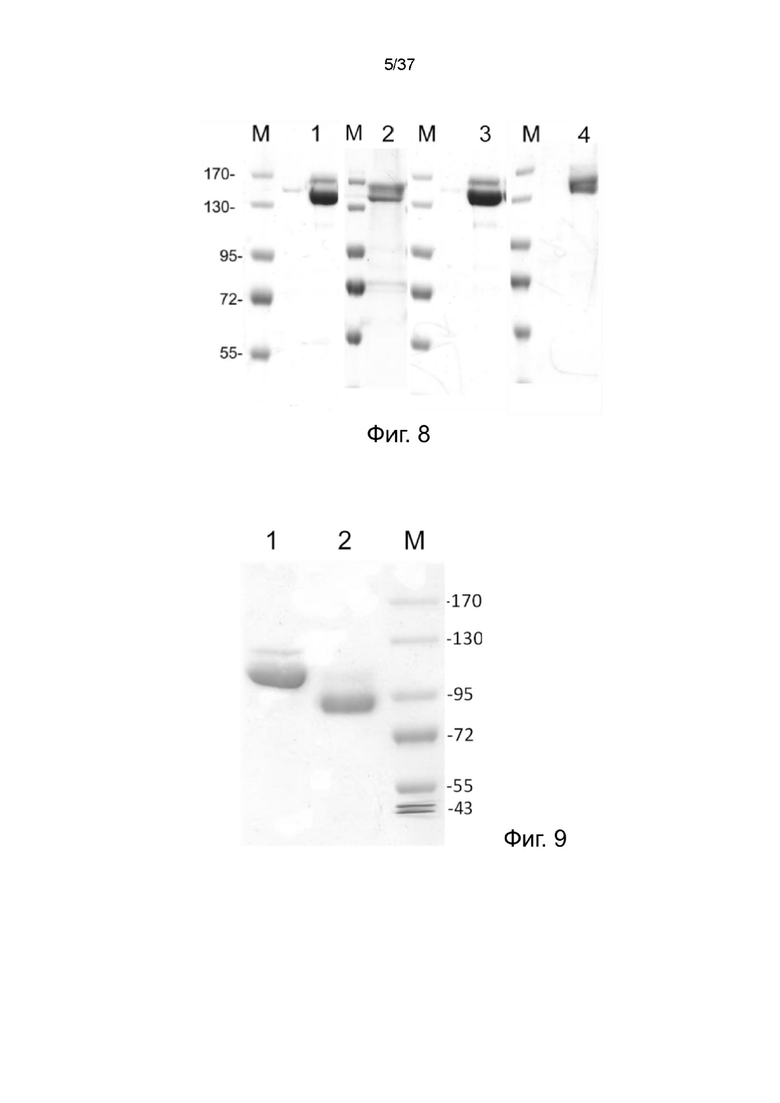
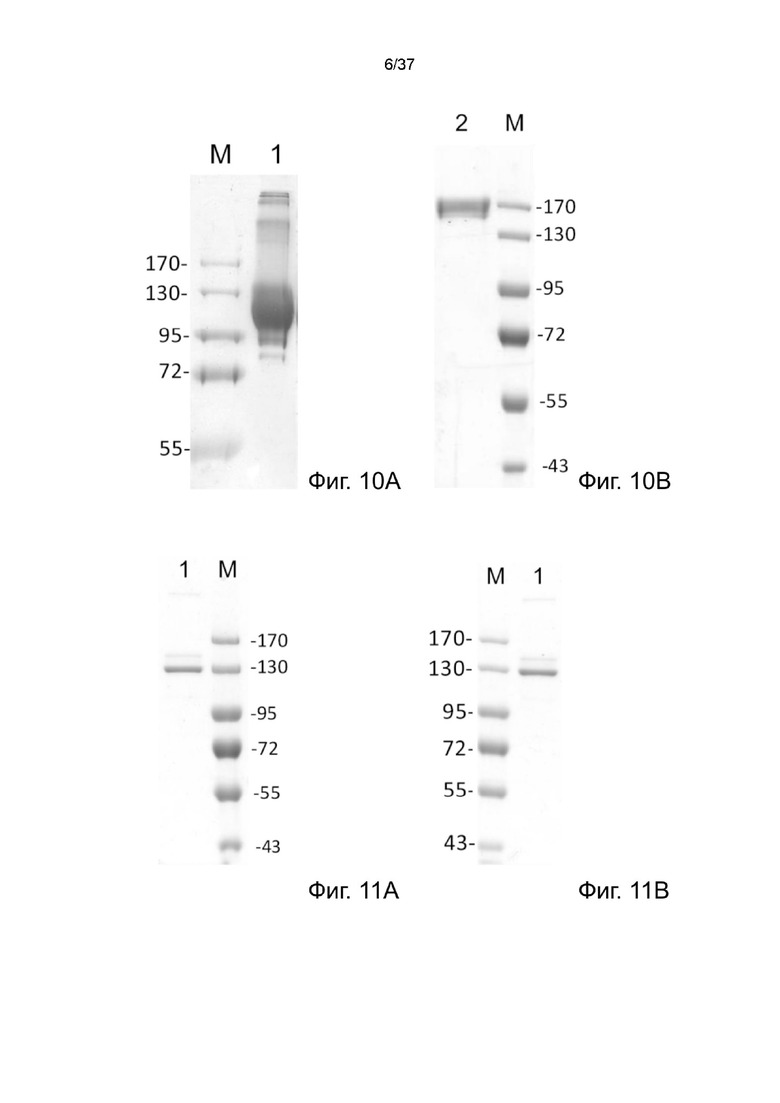
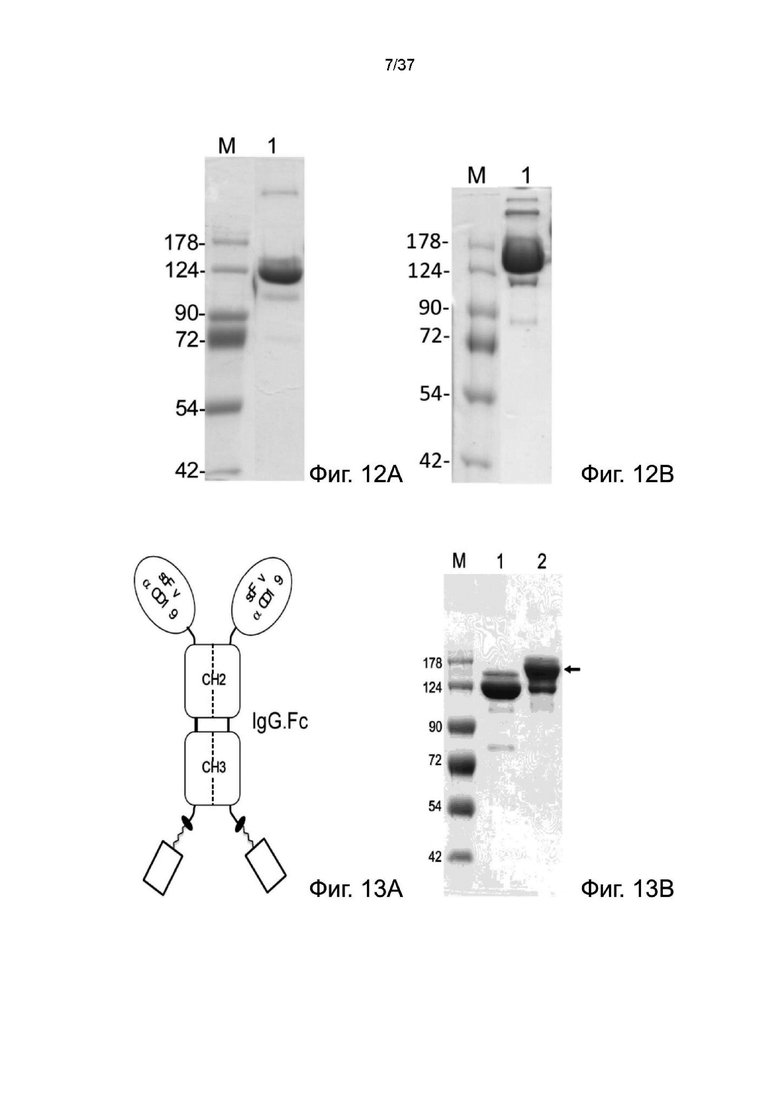
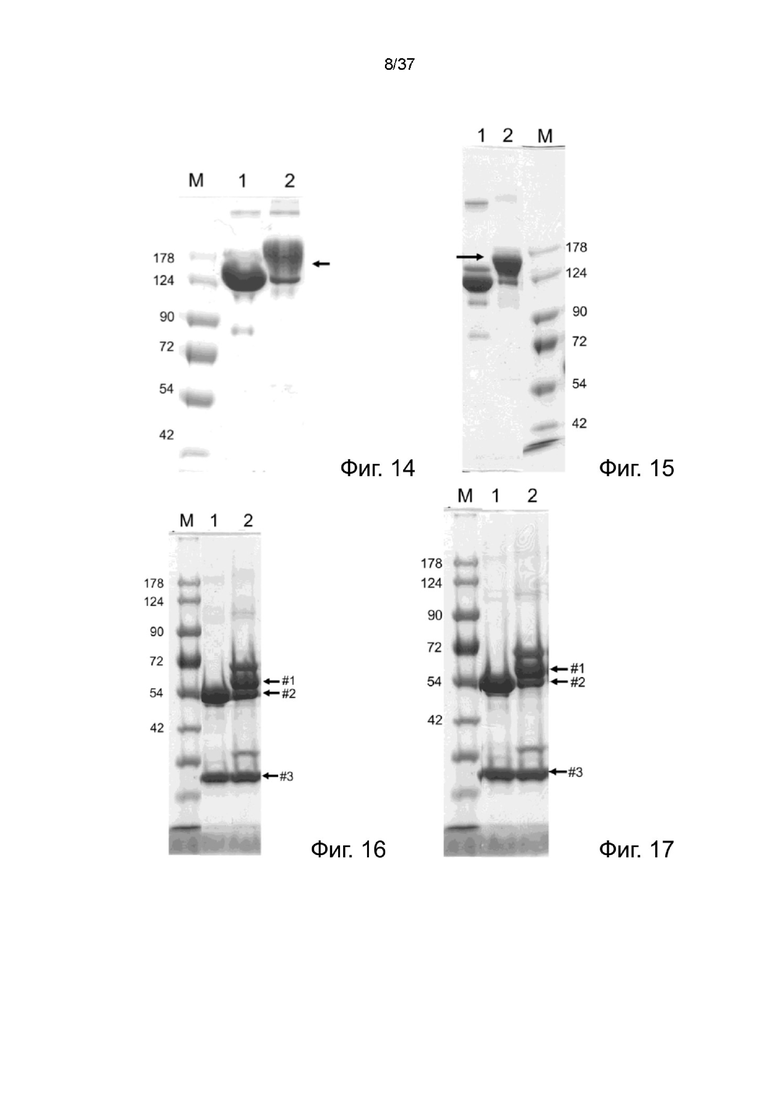
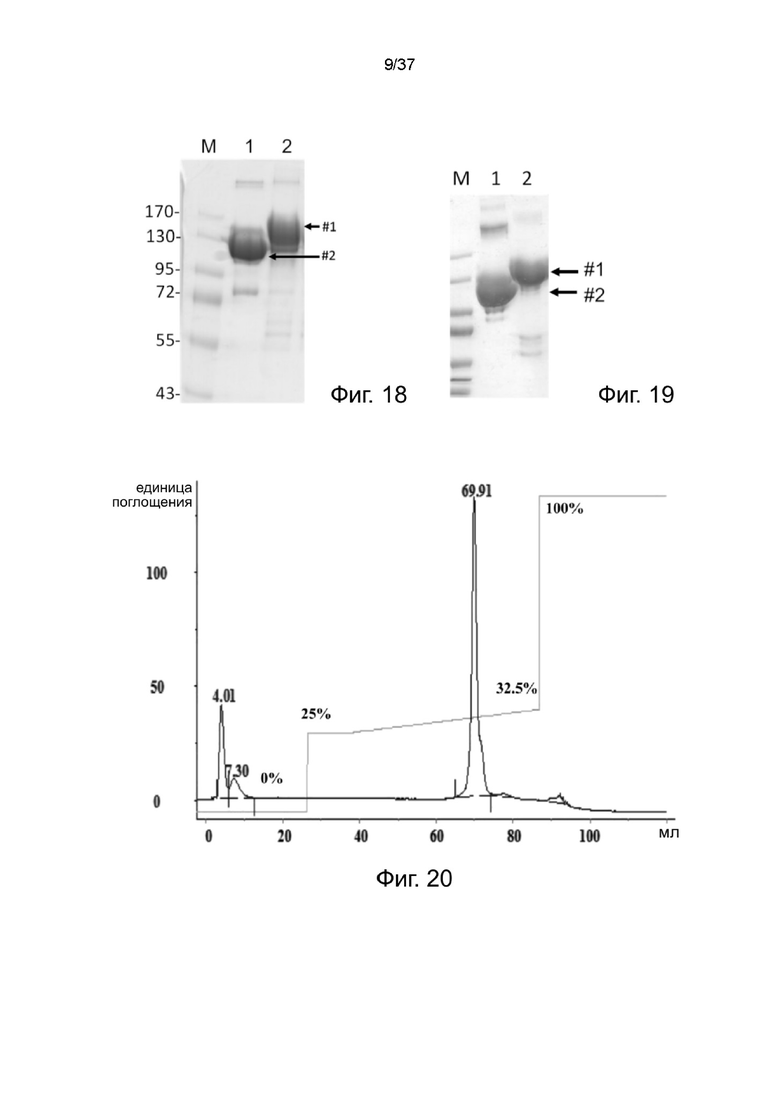
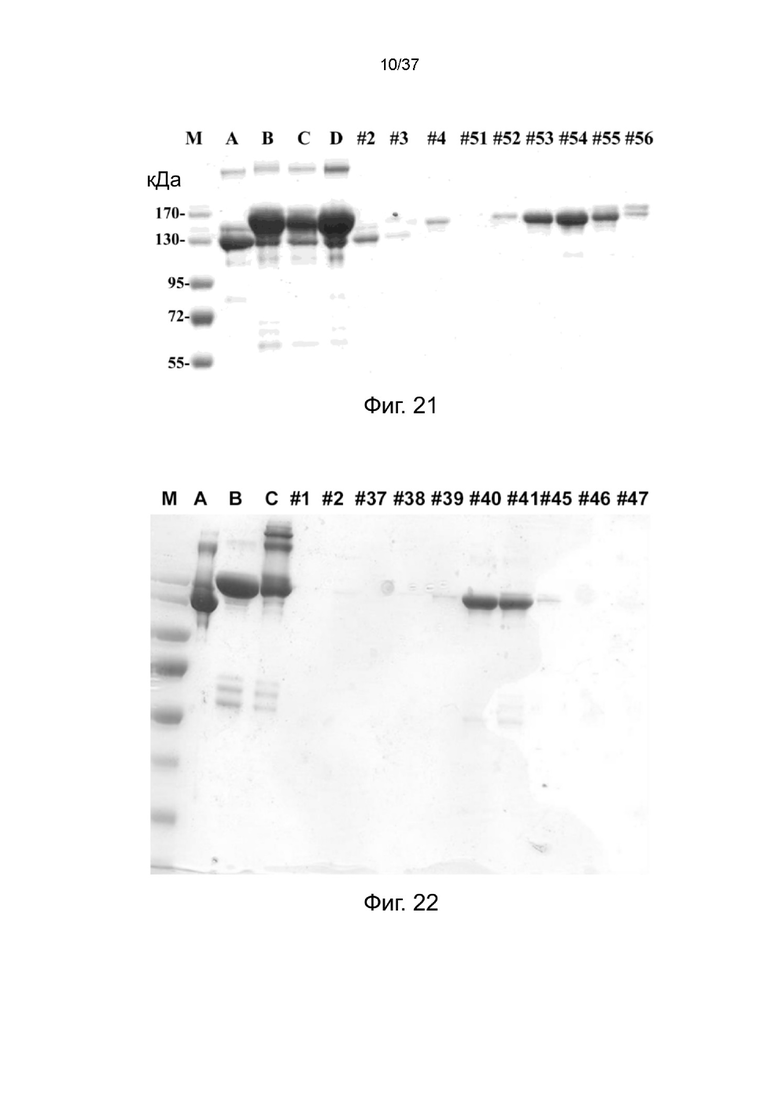
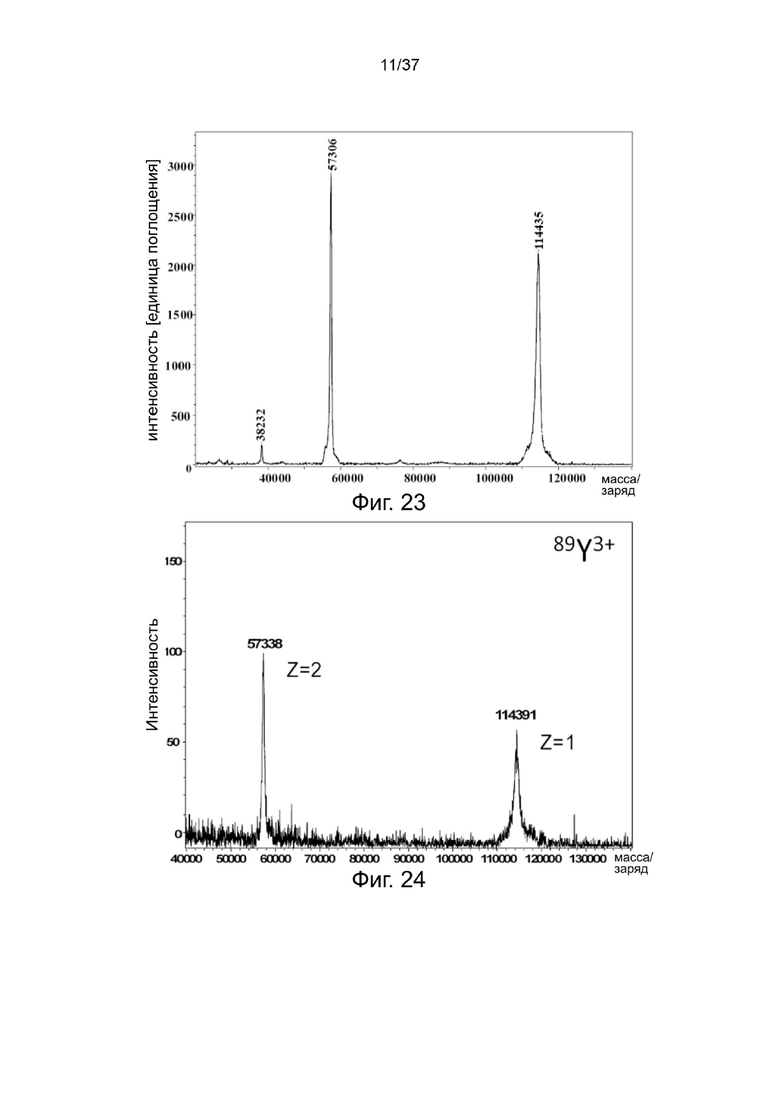
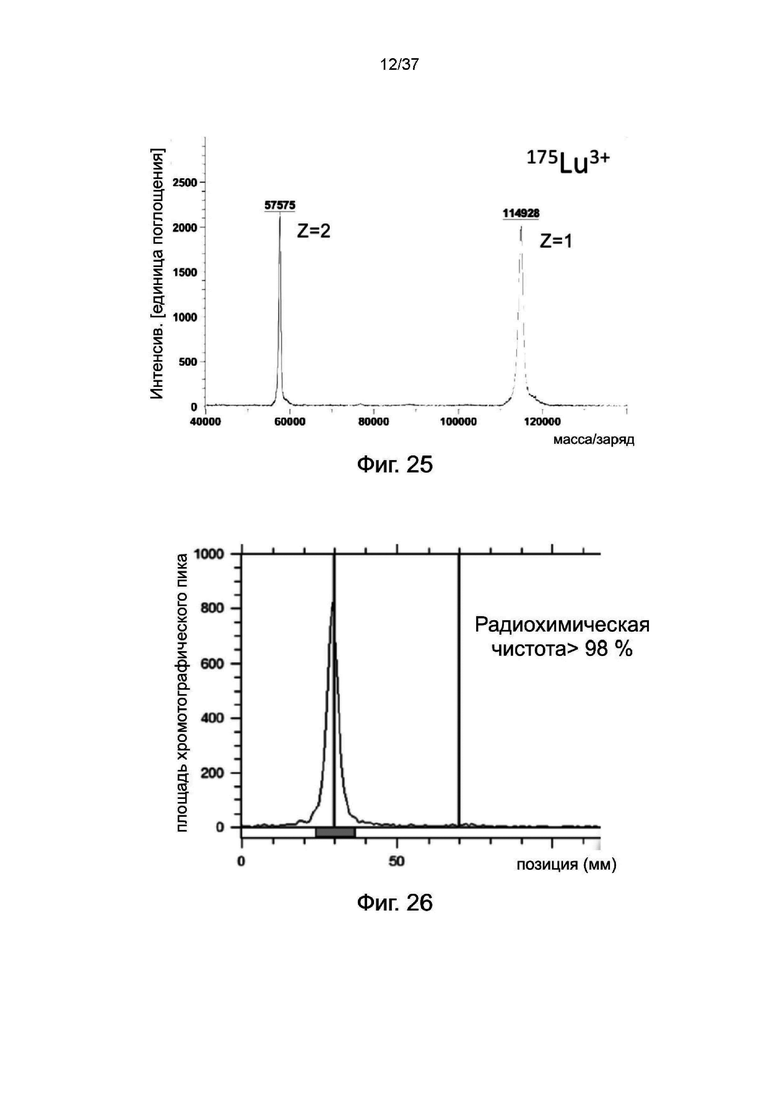
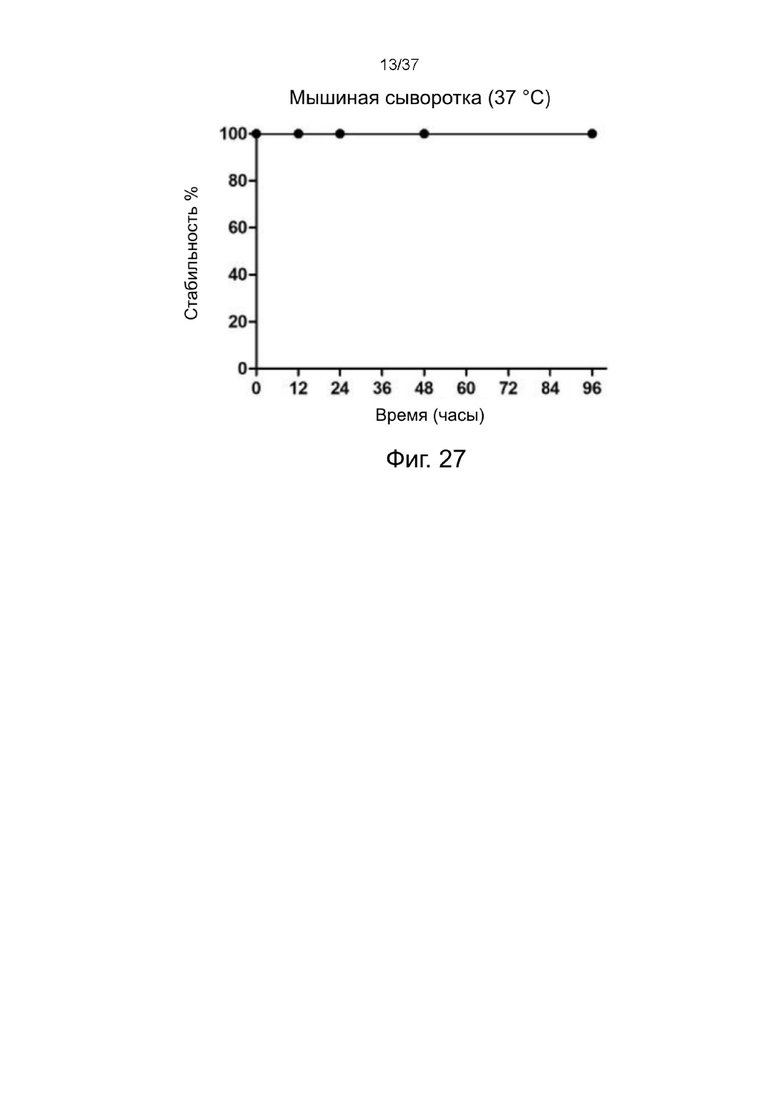
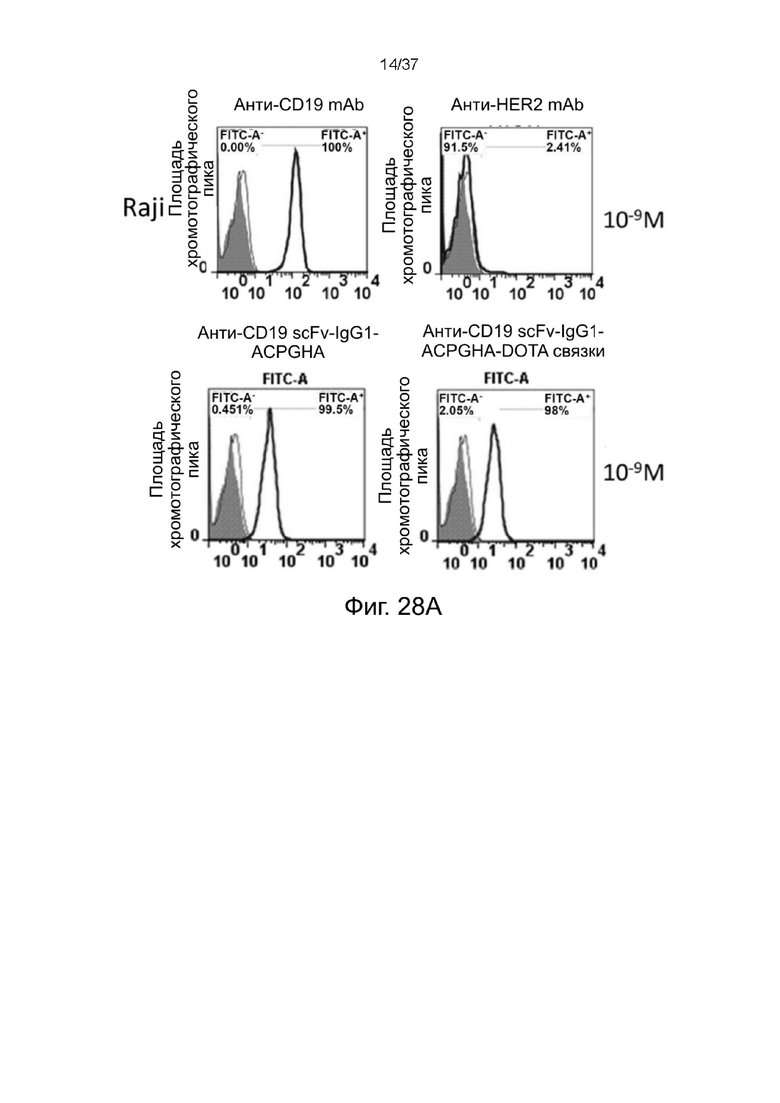
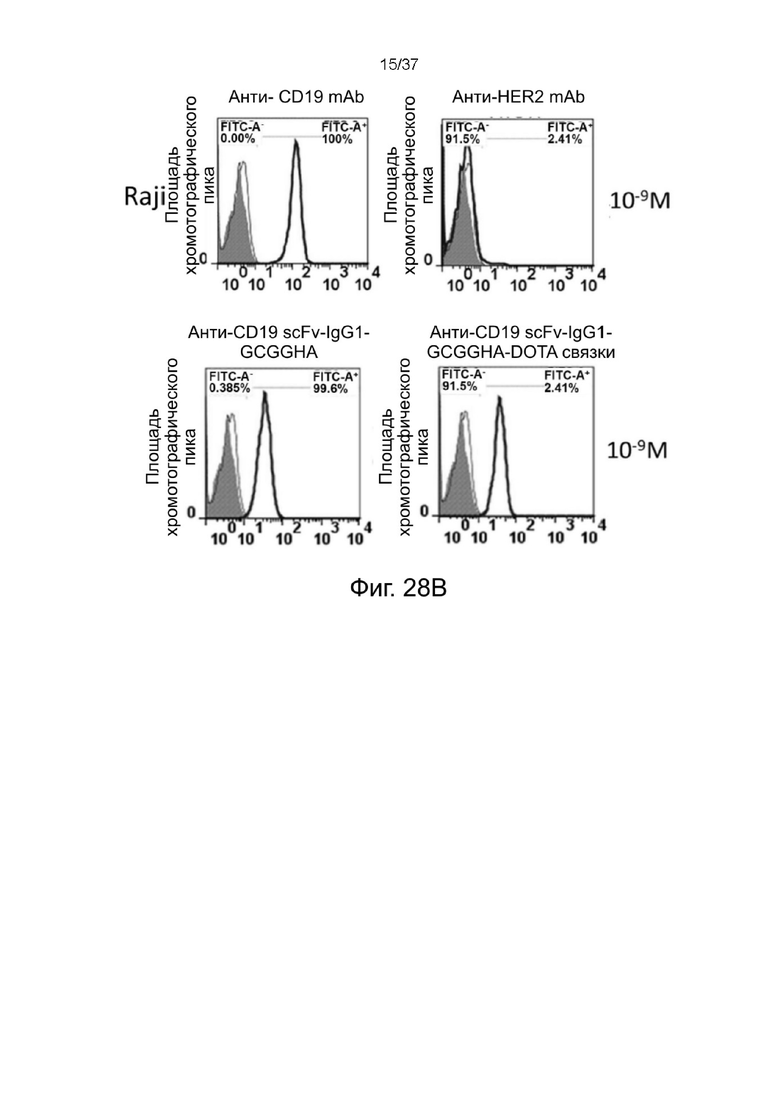
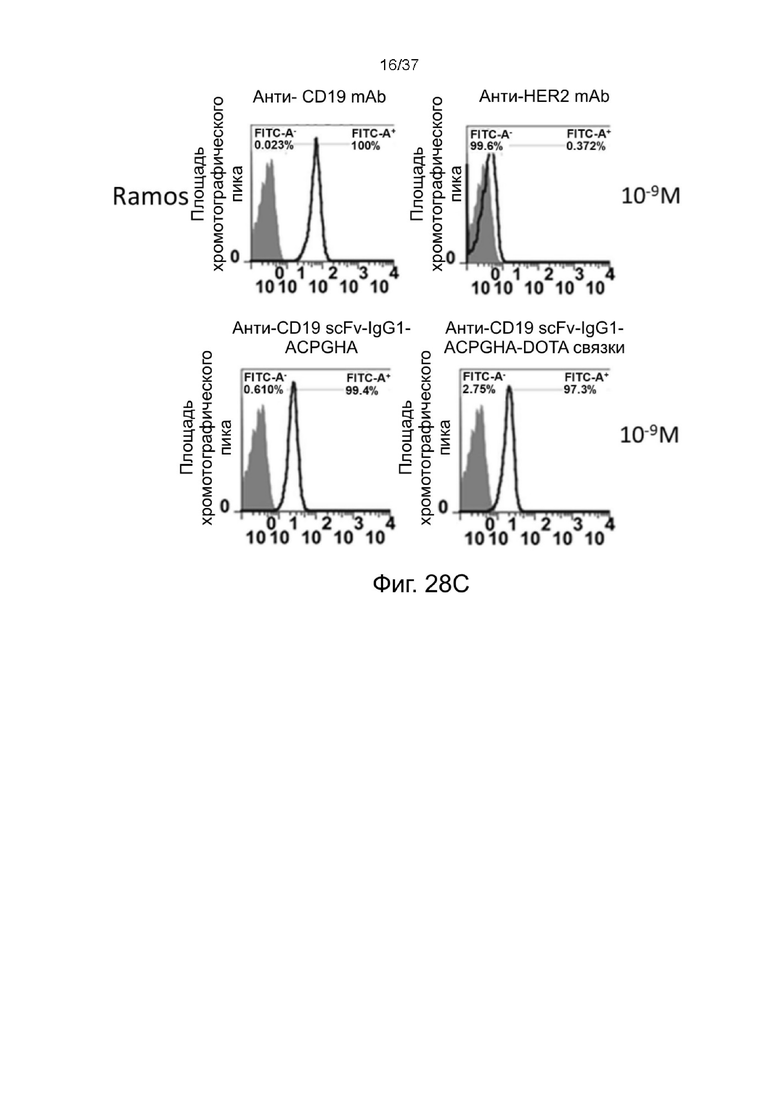

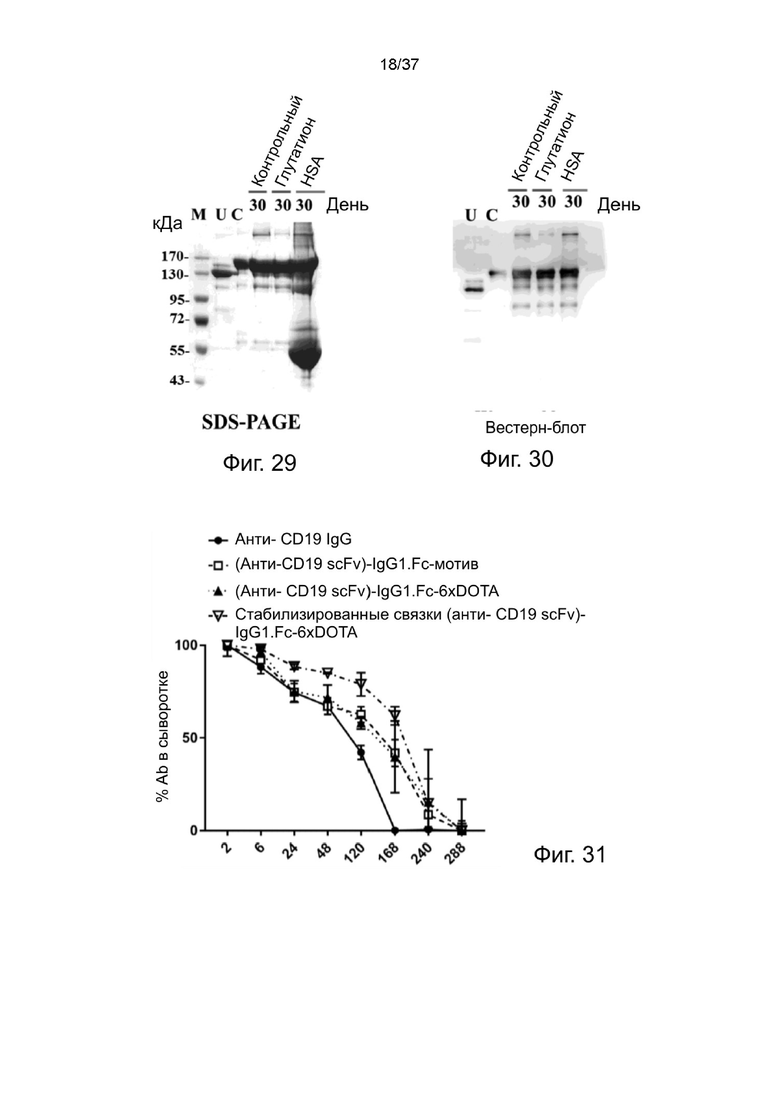
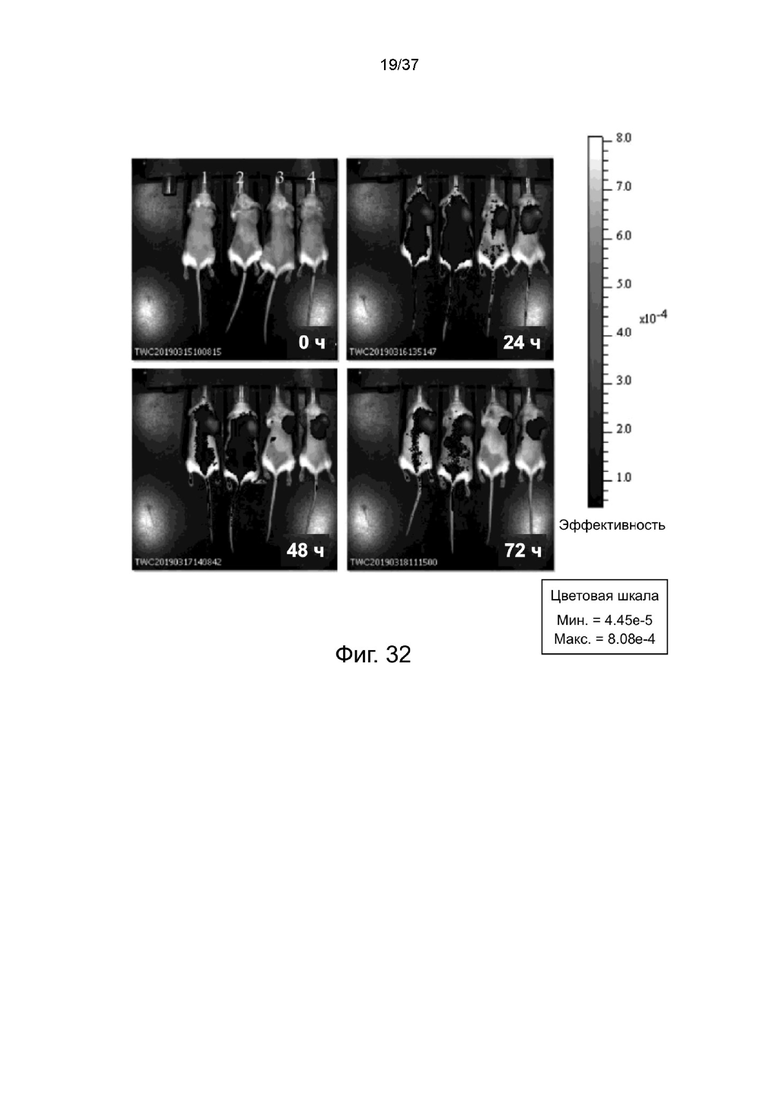
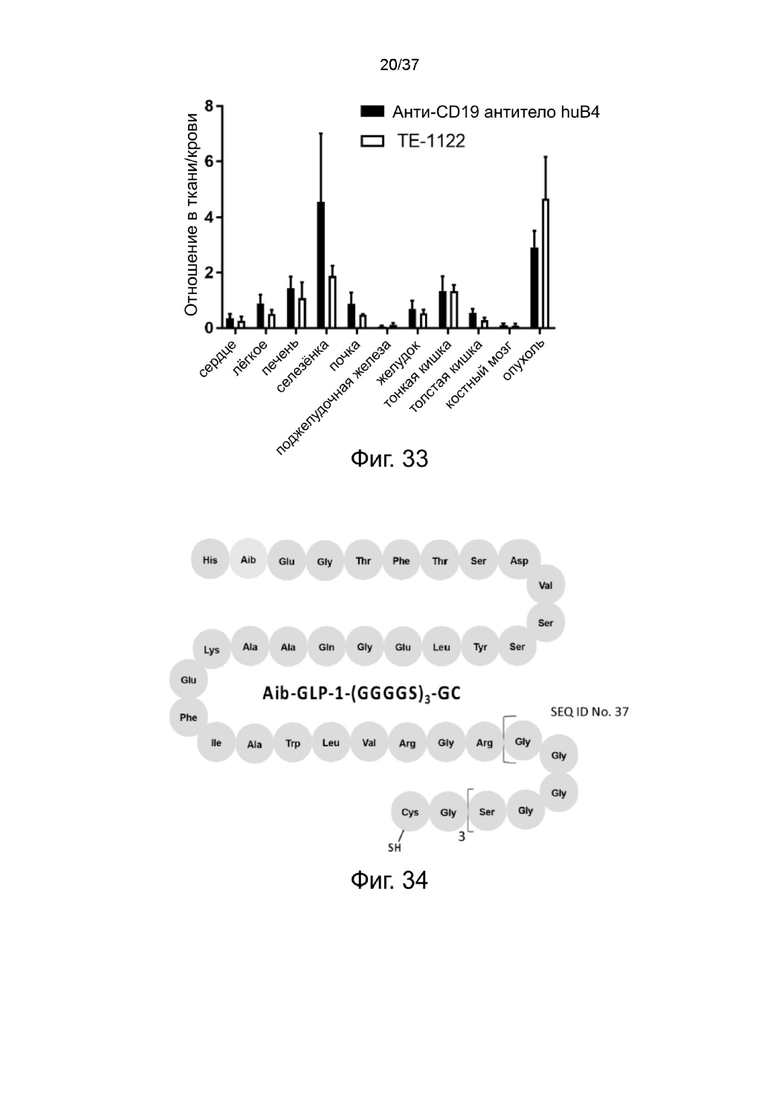
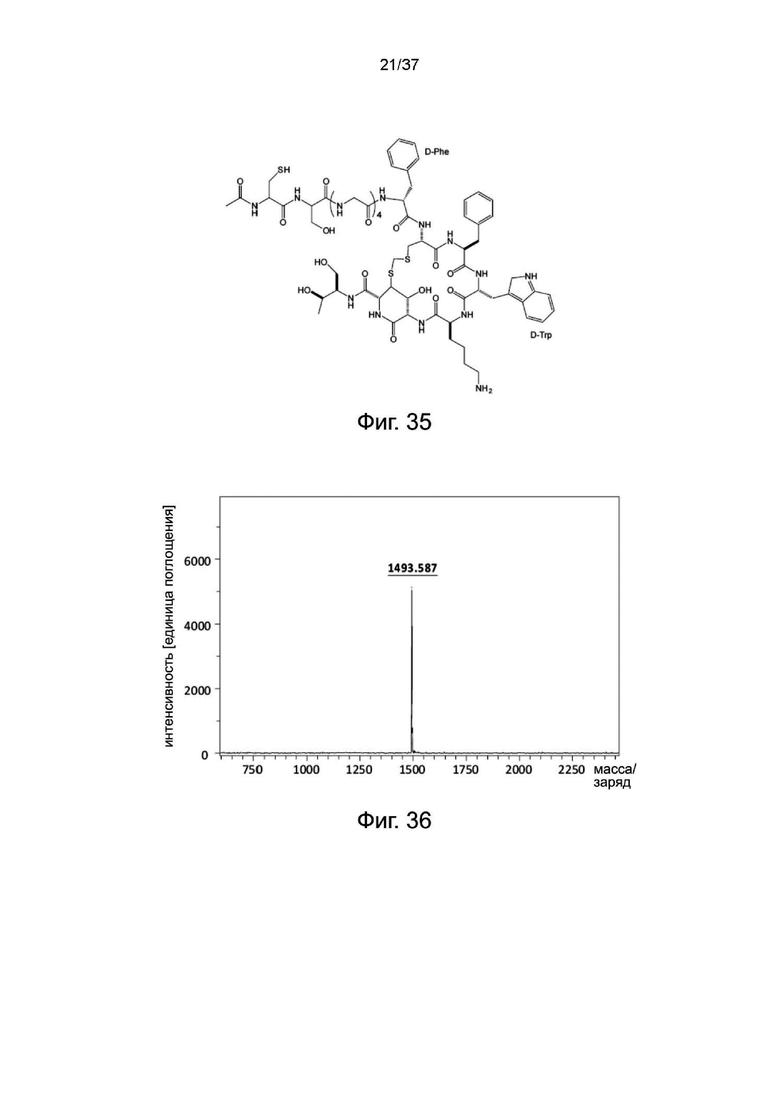
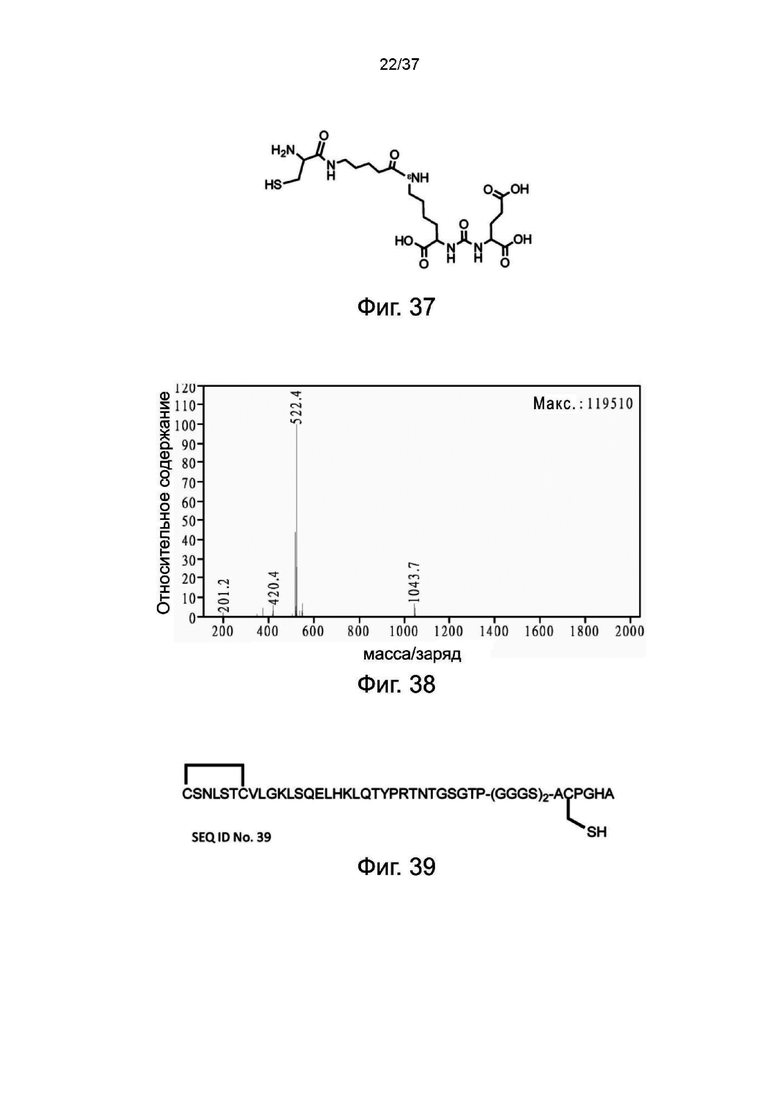
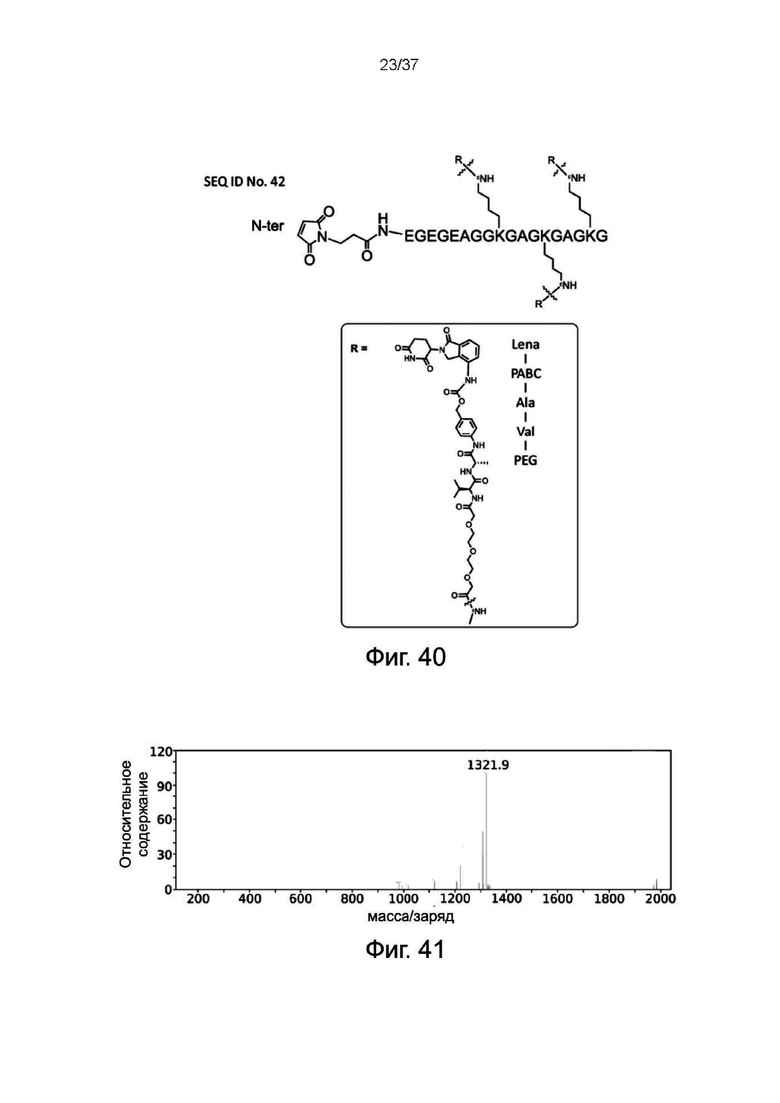
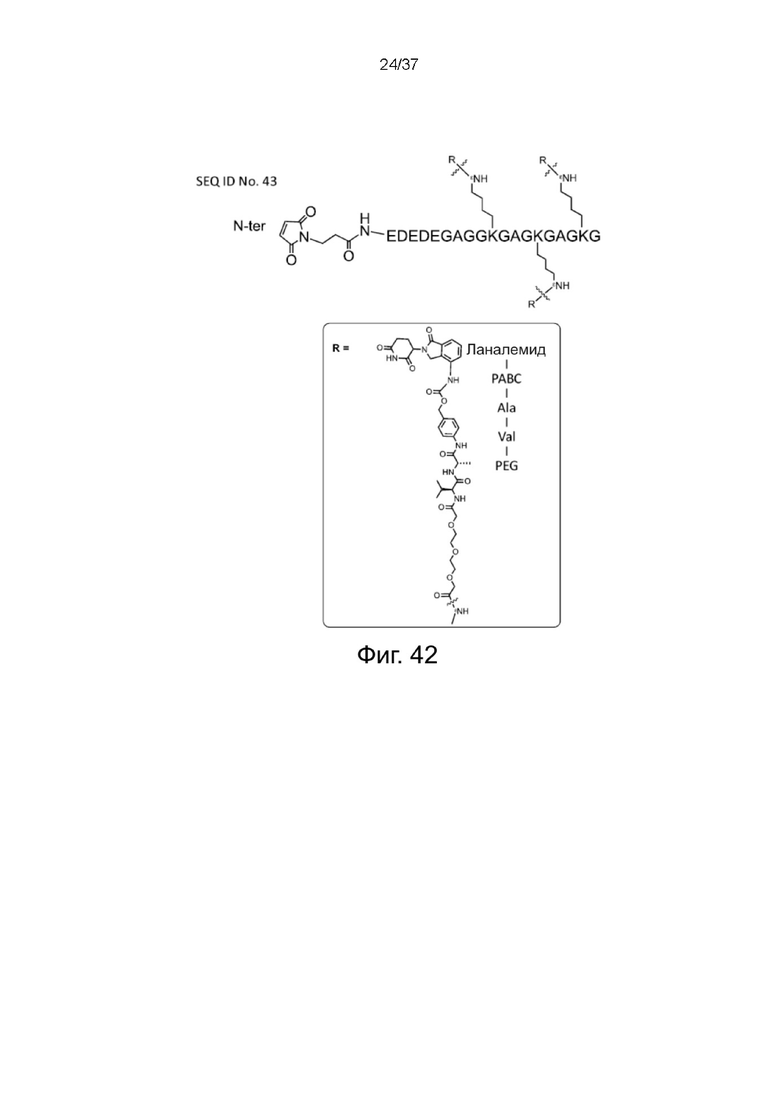
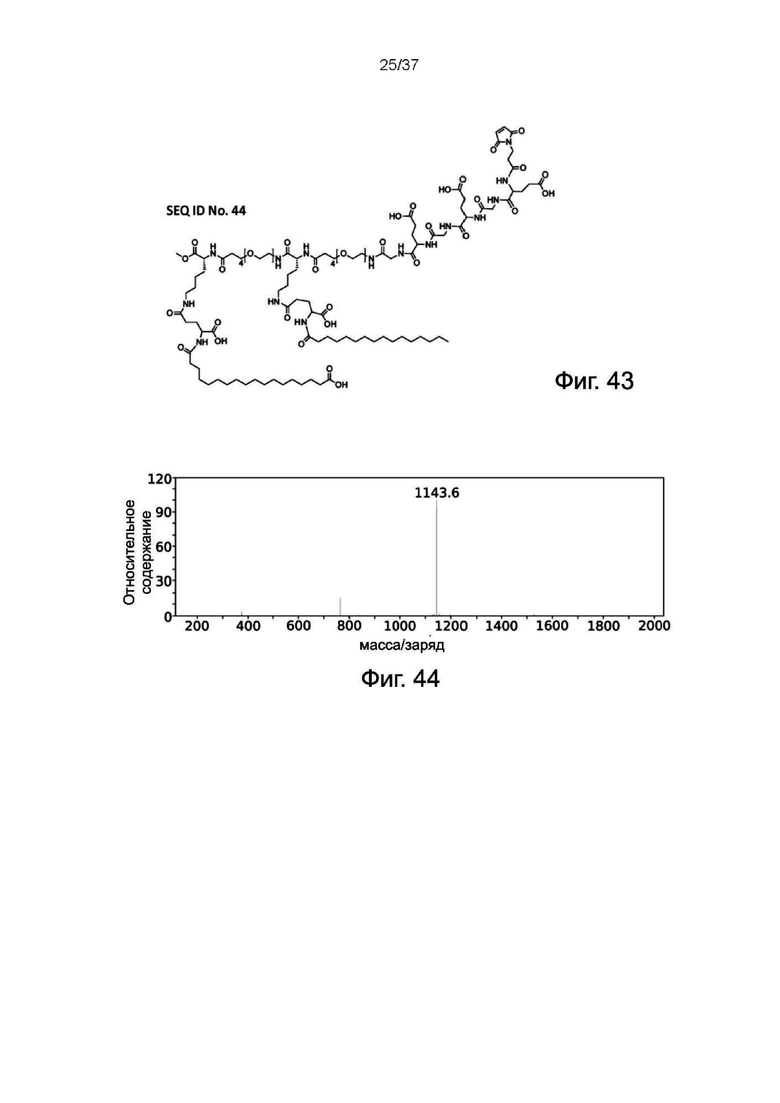
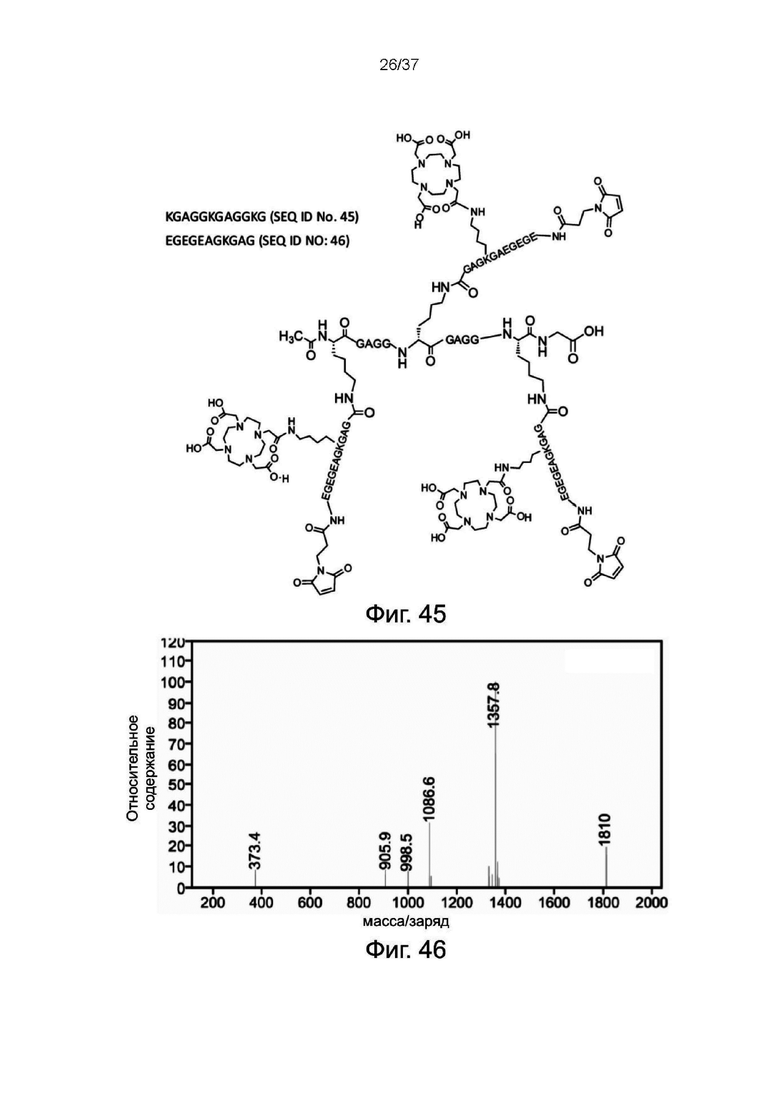
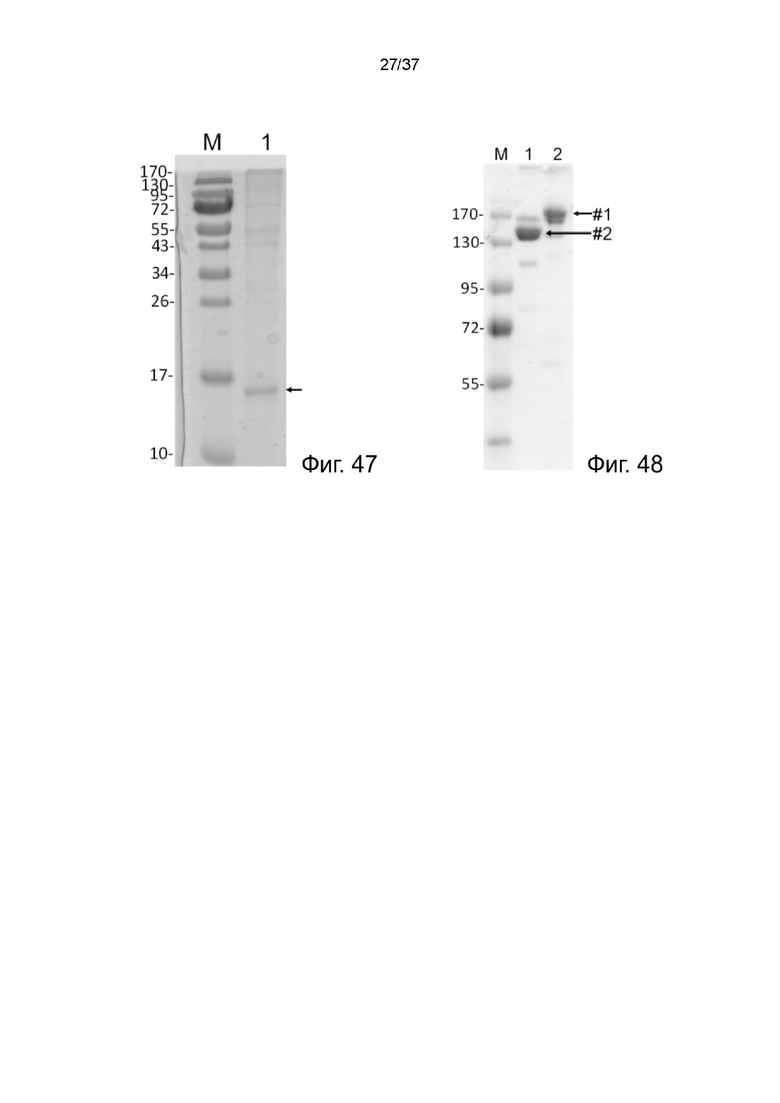
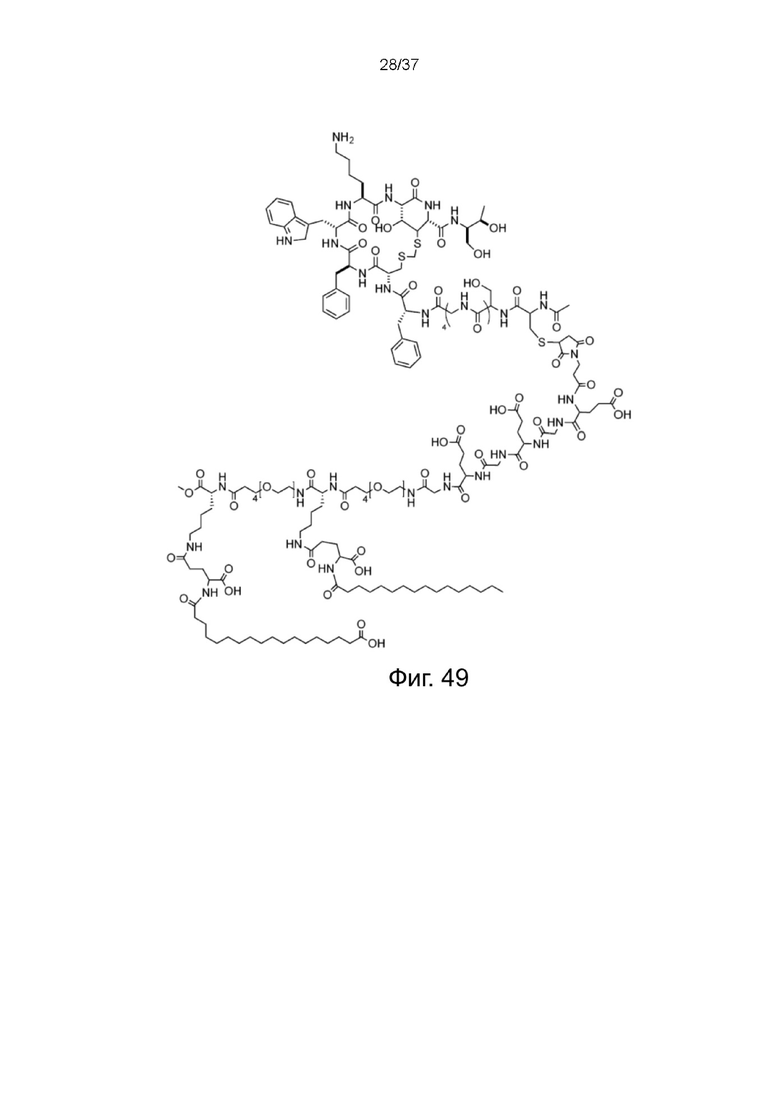
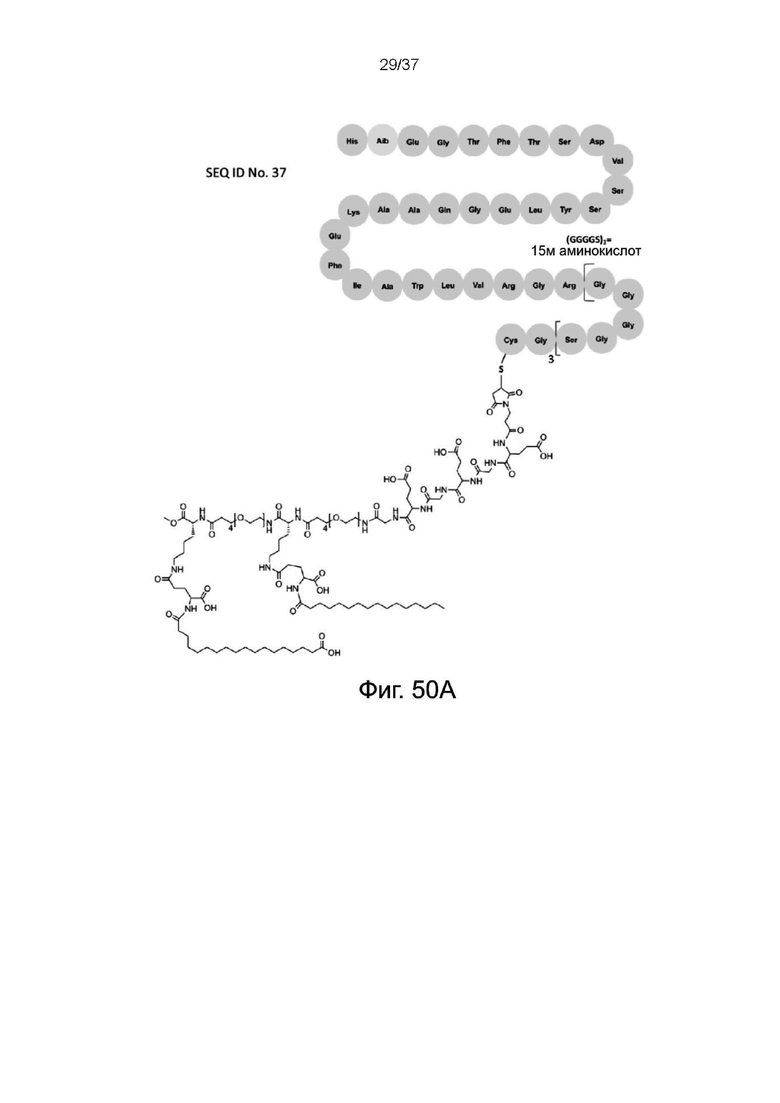
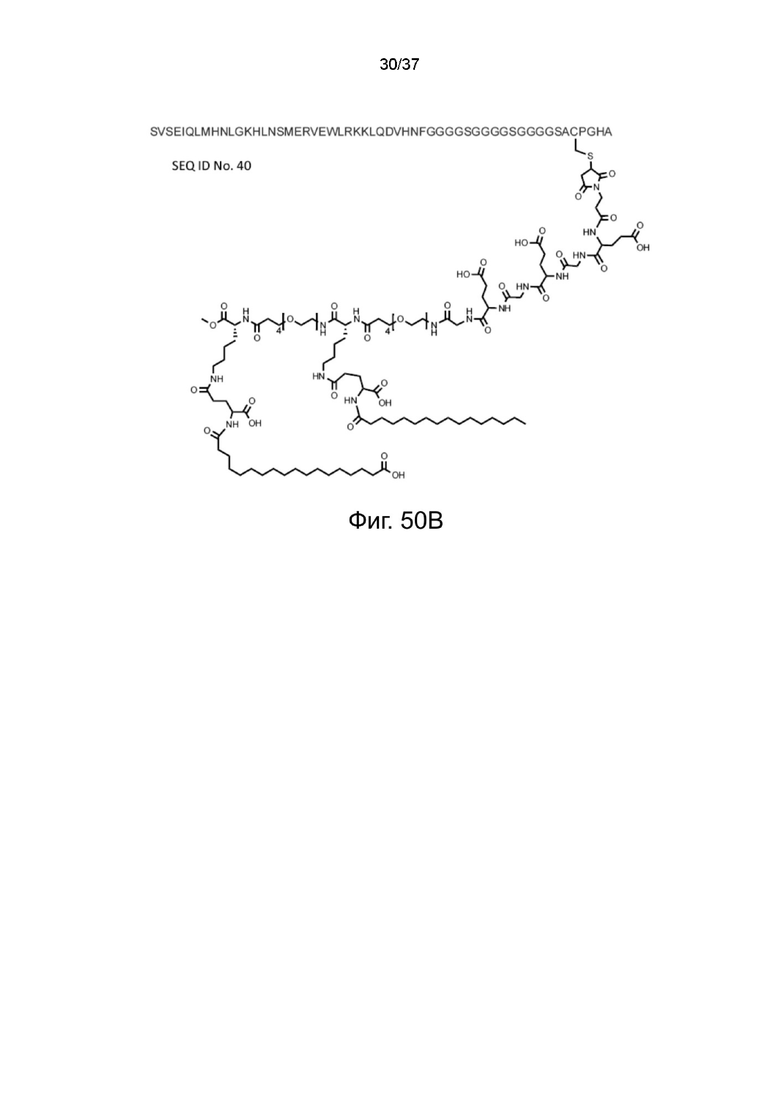
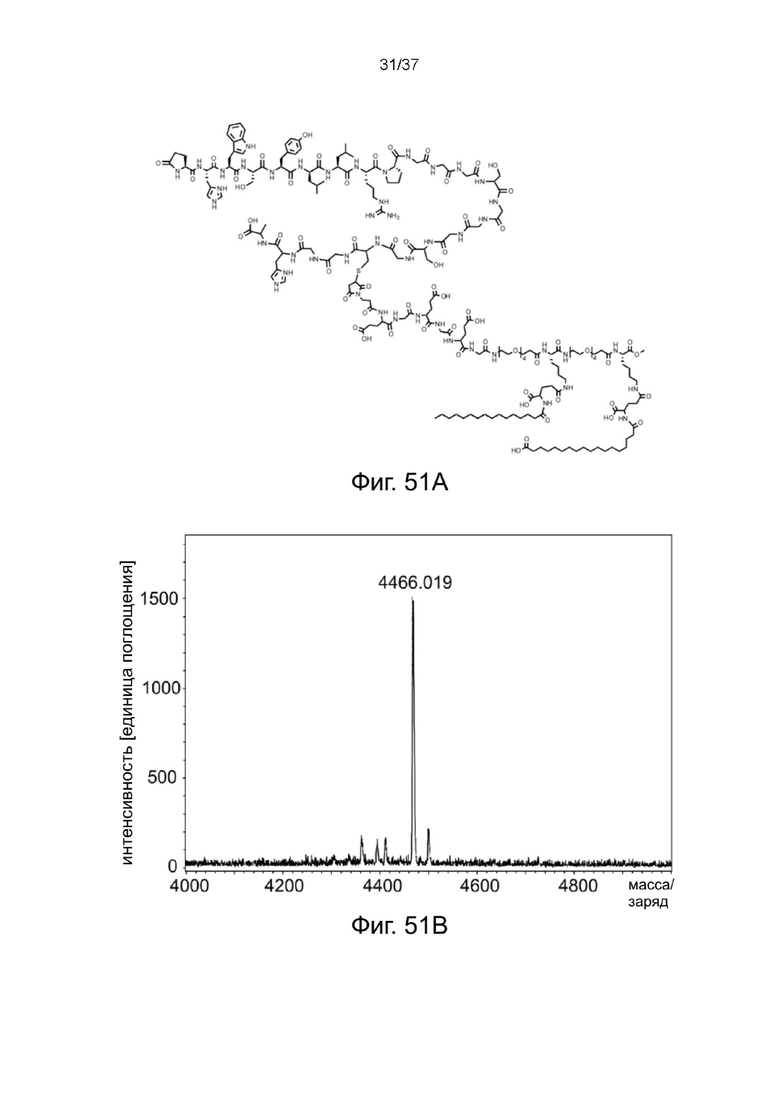
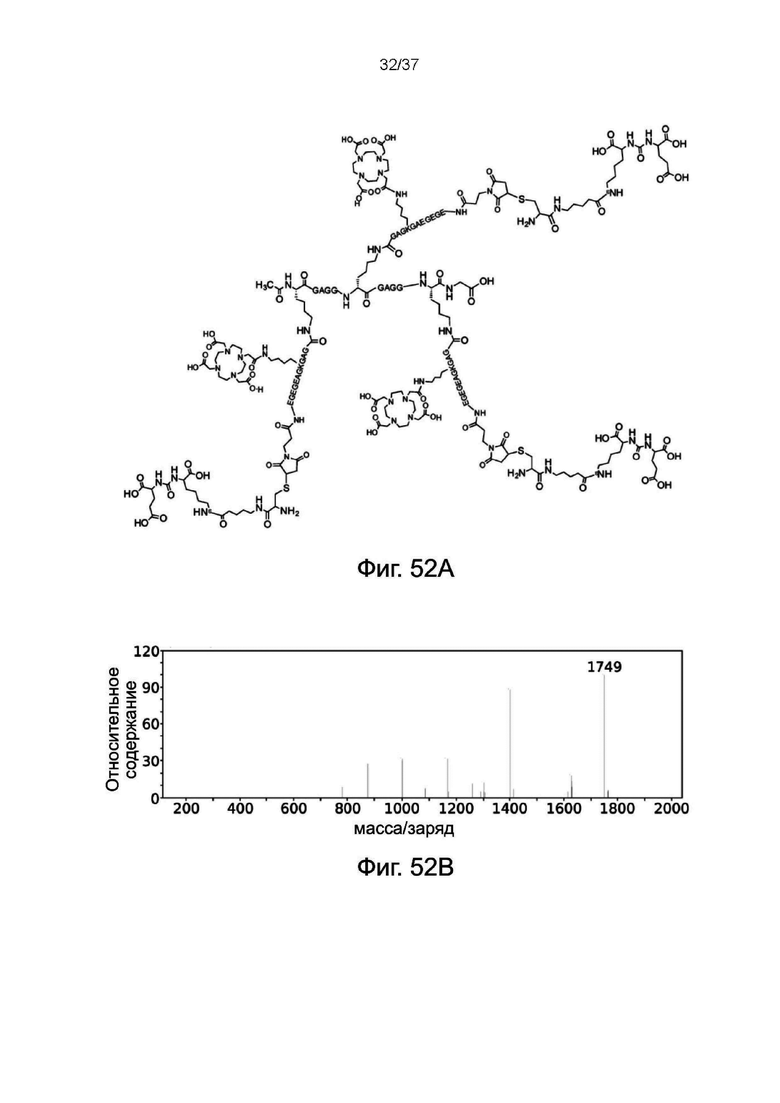
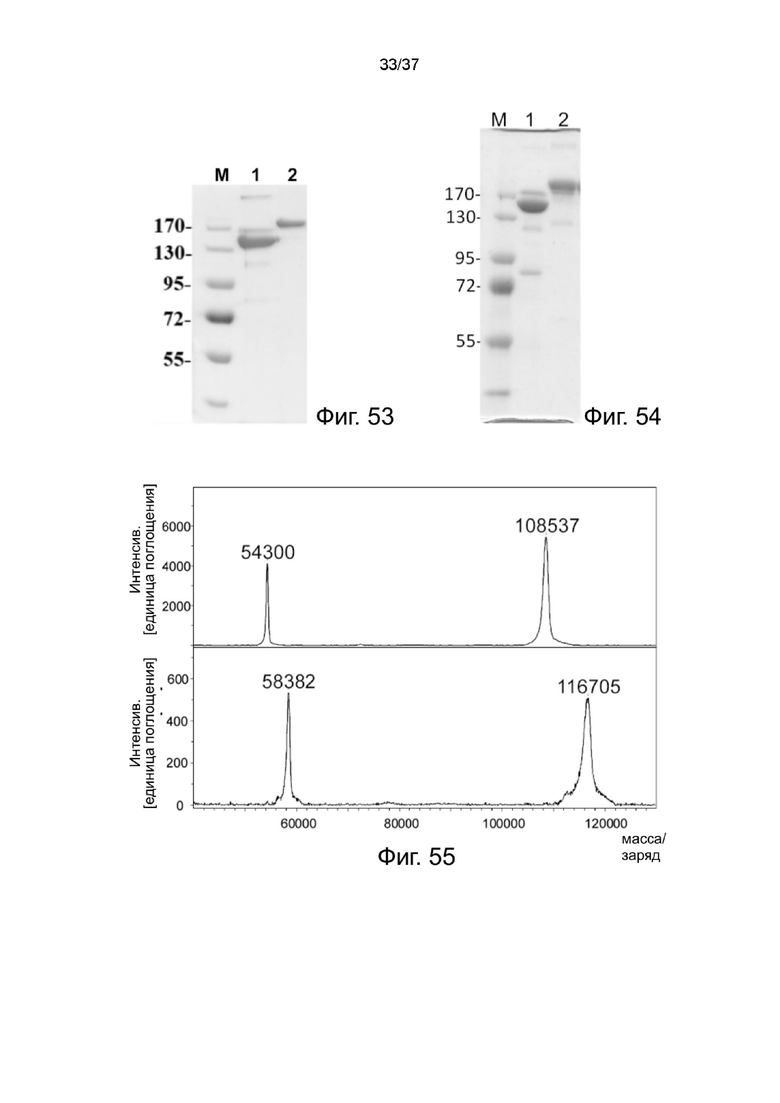
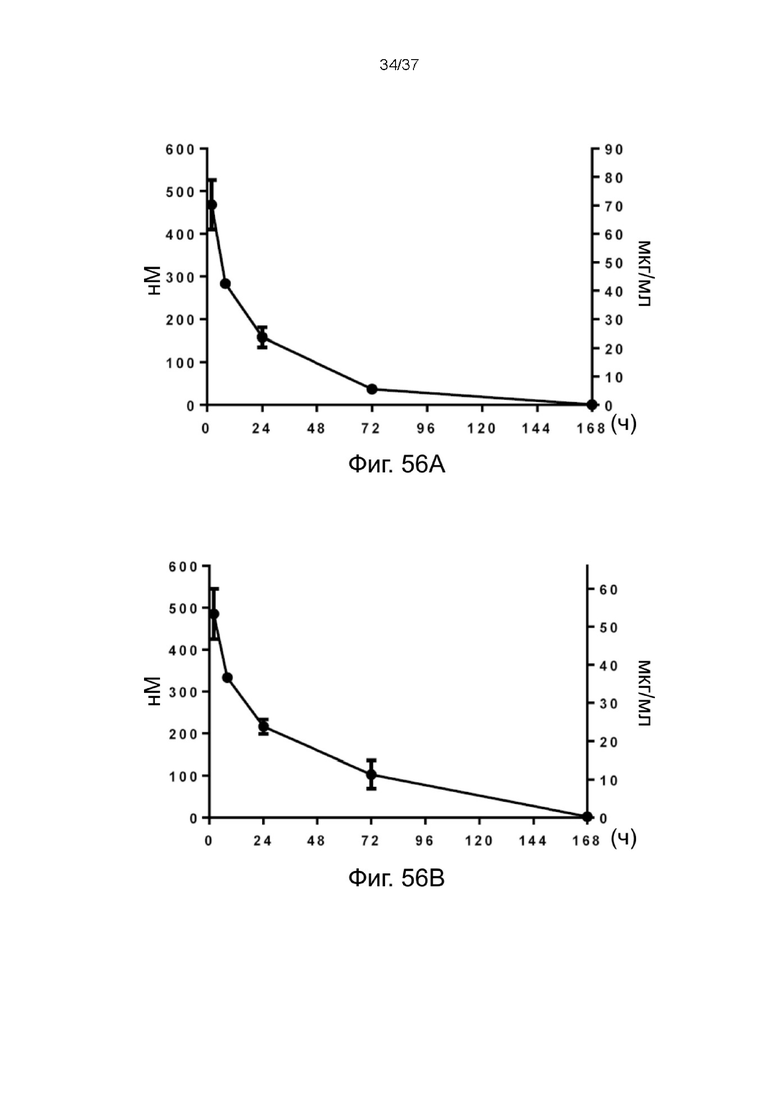
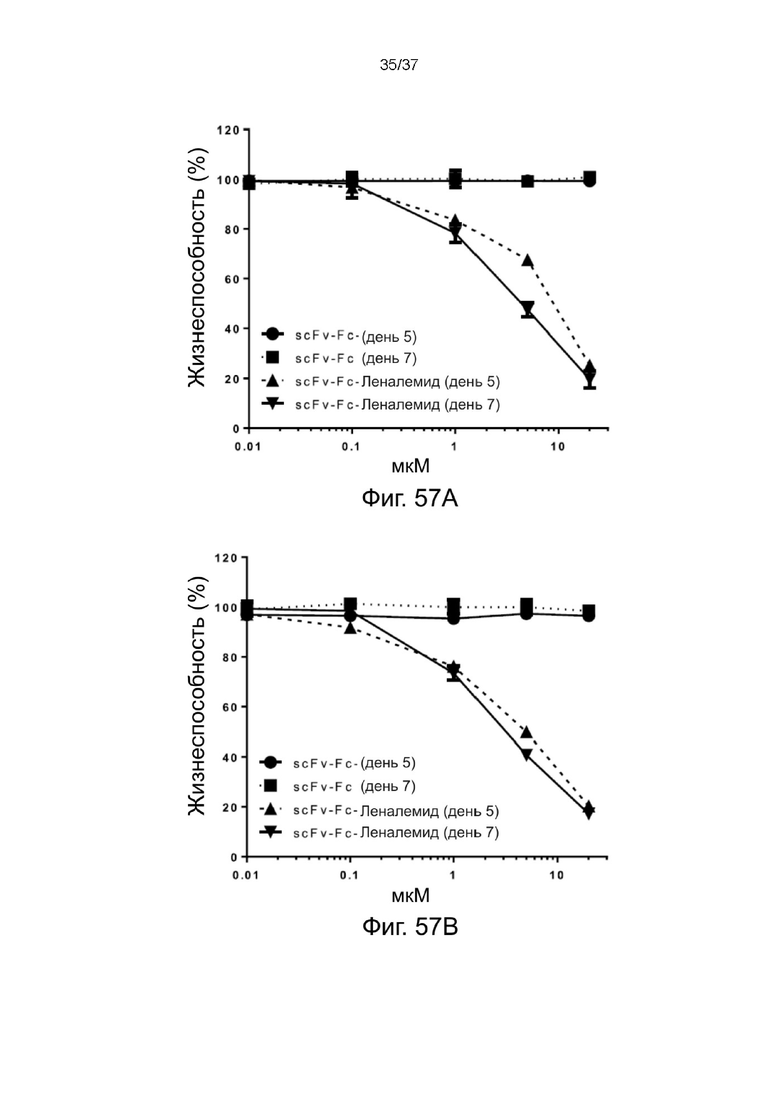
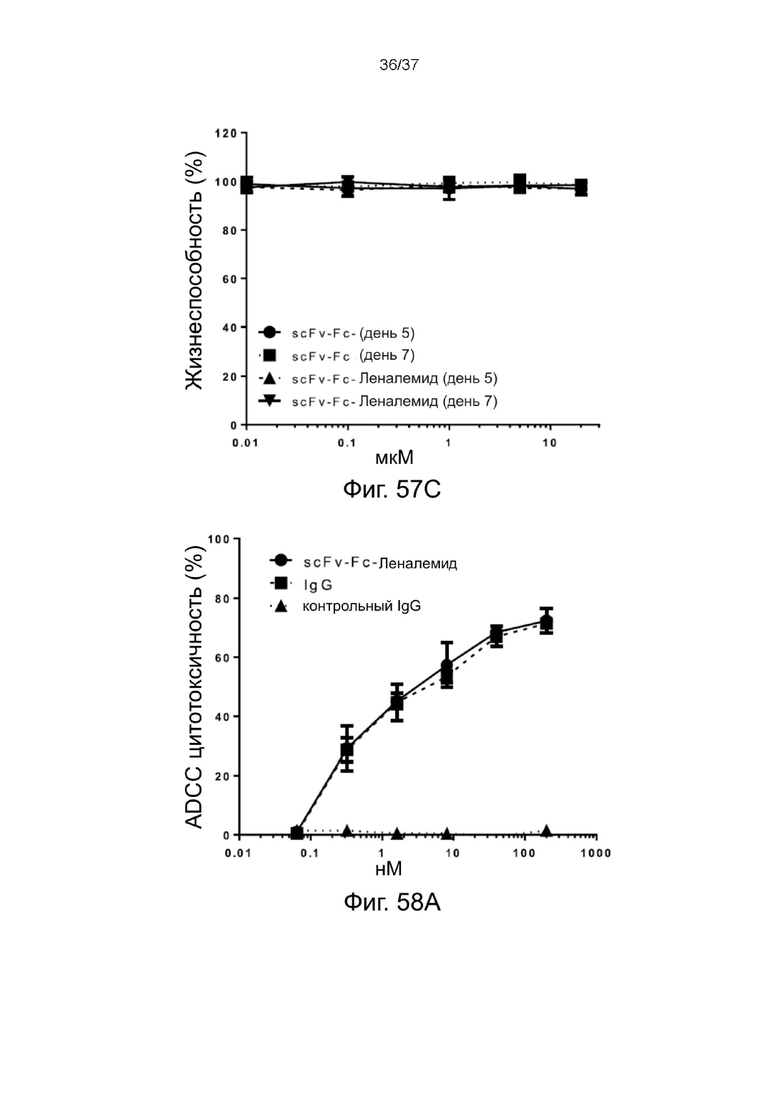
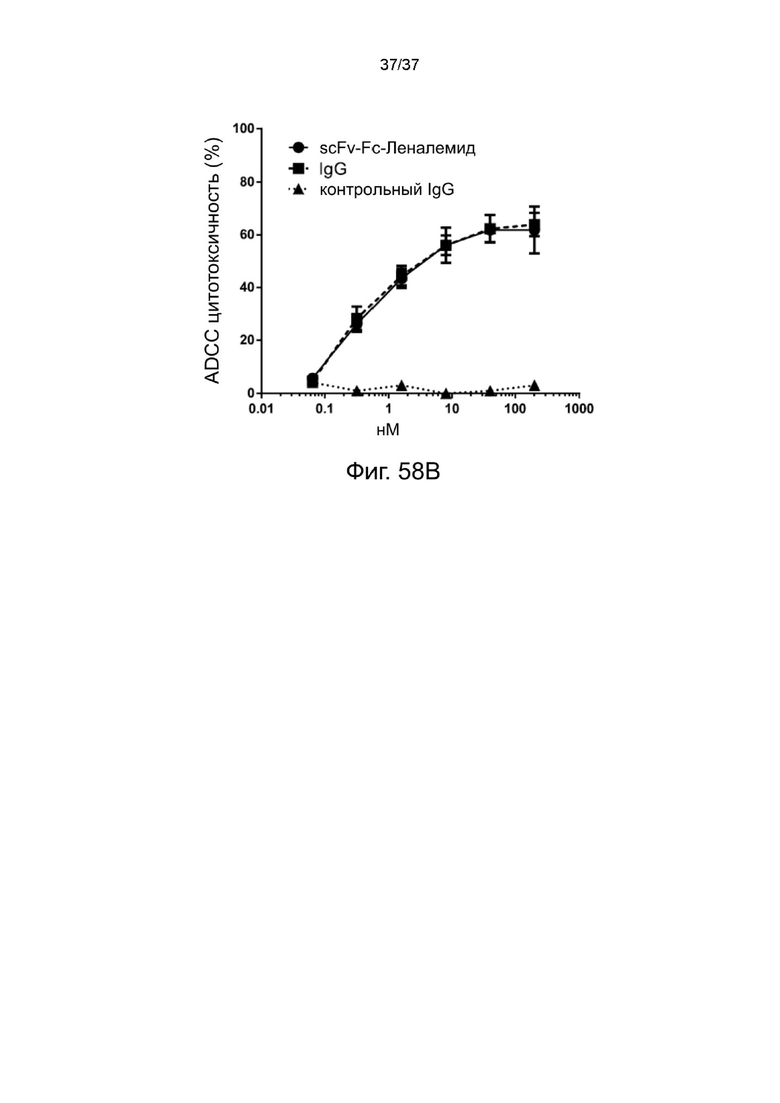
Настоящее изобретение относится к области биотехнологии, в частности к новым каркасным конъюгатам терапевтических полипептидов. Изобретение раскрывает составной полипептид, включающий центральное ядро из аминокислотных остатков лизина, к которому через короткие линкерные последовательности присоединены различные функциональные элементы, представляющие собой малые молекулы, способные вызывать терапевтический эффект в организме человека. Согласно некоторым вариантам осуществления настоящее изобретение направлено на увеличение времени полураспада пептидного гормона или цитокина. Согласно некоторым вариантам осуществления настоящее изобретение относится к составному полипептиду, содержащему антитело или его фрагмент, нацеленные на антиген поверхности раковых клеток, что может быть применимо в медицинской практике для терапии опухолевых заболеваний. 2 н. и 5 з.п. ф-лы, 54 пр., 58 ил.
1. Молекулярная конструкция для лечения опухоли, содержащая составной полипептид и функциональный элемент, где
составной полипептид содержит родительский полипептид, линкер и короткий олигопептид, где
короткий олигопептид включает аминокислотную последовательность GCGGHA (SEQ ID NO: 6), ACPGHA (SEQ ID NO: 7) или GCPGHA (SEQ ID NO: 8) в порядке от N-конца до C-конца и короткий олигопептид связан с N- или С-концом родительского полипептида при помощи линкера;
линкер имеет длину от 1 до 15 аминокислотных остатков, независимо выбранных из группы, состоящей из остатков глицина (G) и серина (S); и
родительский полипептид представляет собой антитело или фрагмент антитела, которое специфично для антигена клеточной поверхности, связанного с опухолью; и
функциональный элемент имеет сульфгидрильную (SH)-реакционоспособную группу, которая конъюгирована с тиоловой группой остатка цистеина в коротком олигопептиде,
при этом функциональный элемент включает:
центральное ядро, при этом центральное ядро содержит от 2 до 10 остатков лизина (K),
необязательно, один или несколько наполнителей, в которых любые два К остатка находятся рядом друг с другом или разделены наполнителем,
необязательно, концевой спейсер, где концевые спейсеры представляют собой N- концевой спейсер, связанный с N-концом первого K остатка, или C-концевой спейсер, связанный с C-концом последнего K остатка, и каждый из наполнителей и концевой спейсер содержит, независимо, (1) от 1 до 12 аминокислотных остатков, отличных от K, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG), и
SH-реакционноспособную группу, связанную с первым или последним K остатком центрального ядра путём образования с ним амидной связи, или, когда присутствует концевой спейсер, SH-реакционоспособная группа связана с концевым аминокислотным остатком концевого спейсера, образуя с ним амидную связь; а также
от 2 до 10 эффекторных элементов, где каждый эффекторный элемент представляет собой молекулу леналидомида, молекулу ауристатина или молекулу 1,4,7,10-тетраазациклододекан-N,N',N",N'"-тетрауксусной кислоты (DOTA) в комплексе с радиоактивным нуклидом;
где каждый эффекторный элемент связан с K остатком ядра, или,
когда молекулярная конструкция дополнительно содержит от 2 до 10 связывающих ветвей, один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остатка а другой конец каждой связывающей ветви связан с каждым эффекторным элементом, где связывающая ветвь представляет собой пептид, содержащий 2-12 аминокислотных остатков, отличных от K; или цепь полиэтиленгликоля (ПЭГ), имеющую от 2 до 24 повторов звеньев EG.
2. Молекулярная конструкция по п. 1, отличающаяся тем, что SH-реакционоспособная группа представляет собой малеимидную, иодацетильную, бромацетильную, винилсульфонную, моносульфоновую, метилсульфонилбензотиазольную или 2-пиридилдитиольную группу.
3. Молекулярная конструкция по п. 1, отличающаяся тем, что составной полипептид находится в димерной форме, каждый из которых имеет один конъюгированный с ним функциональный элемент.
4. Молекулярная конструкция по п. 1, отличающаяся тем, что центральное ядро несет локальный отрицательный заряд на аминокислотном остатке, связанном с SH-реакционноспособной группой, или рядом с ним.
5. Молекулярная конструкция по п. 4, отличающаяся тем, что центральное ядро имеет по меньшей мере один остаток глутамата (E) или остаток аспартата (D) на аминокислотном остатке, связанном с SH-реакционноспособной группой, или рядом с ним.
6. Молекулярная конструкция по п. 4, отличающаяся тем, что локальный отрицательный заряд присутствует в первых 5-15 аминокислотных остатках, начиная с аминокислотного остатка, связанного с SH-реакционноспособной группой.
7. Молекулярная конструкция для продления периода полураспада родительского полипептида, содержащая составной полипептид и функциональный элемент, в которой
составной полипептид содержит родительский полипептид, линкер и короткий олигопептид, причем
короткий олигопептид содержит аминокислотную последовательность GCGGHA (SEQ ID NO: 6), ACPGHA (SEQ ID NO: 7) или GCPGHA (SEQ ID NO: 8) в порядке от N-конца к C-концу, и короткий олигопептид связан с N- или C-концом родительского полипептида с помощью линкера;
линкер имеет длину от 1 до 15 аминокислотных остатков, независимо выбранных из группы, состоящей из остатков глицина (G) и серина (S); и
родительский полипептид представляет собой пептидный гормон или цитокин; и
функциональный элемент имеет сульфгидрильную (SH)-реакционоспособную группу, которая конъюгирована с тиоловой группой остатка цистеина в коротком олигопептиде, где функциональный элемент содержит:
центральное ядро, причем центральное ядро содержит от 2 до 10 остатков лизина (K),
необязательно, один или более наполнителей, в которых любые два из K остатков примыкают друг к другу или разделены наполнителем,
необязательно, концевой спейсер, где концевые спейсеры представляют собой N- концевой спейсер, связанный с N-концом первого K остатка, или C-концевой спейсер, связанный с С-концом последнего K остатка, и каждый из наполнителей и концевой спейсер содержит независимо (1) от 1 до 12 аминокислотных остатков, отличных от K, или (2) ПЭГилированную аминокислоту, имеющую от 1 до 12 повторов звена этиленгликоля (EG), и
SH-реакционоспособную группу, связанную с первым или последним K остатком центрального ядра путем образования с ним амидной связи, или, когда присутствует концевой спейсер, SH-реакционоспособная группа связана с концевым аминокислотным остатком концевого спейсера, образуя с ним амидную связь; а также
от 2 до 10 фармакокинетических элементов, где каждый фармакокинетический элемент представляет собой производное жирной кислоты C8-28 или производное дикарбоновой жирной кислоты C8-28; где
каждый фармакокинетический элемент связан с ε-аминогруппой K остатка, или,
когда молекулярная конструкция дополнительно содержит от 2 до 10 связывающих ветвей, один конец каждой связывающей ветви связан с K остатком ядра посредством образования амидной связи с ε-аминогруппой K остатка, а другой конец каждой связывающей ветви связан с каждым фармакокинетическим элементом, где связывающая ветвь представляет собой пептид, содержащий 2-12 аминокислотных остатков, отличных от K; или цепь полиэтиленгликоля (ПЭГ), имеющую от 2 до 24 повторов звеньев EG.
| WO 2018166529 A1, 20.09.2018 | |||
| WO 20161122870 A1, 21.07.2016 | |||
| US 2018055946 A1, 01.03.2018 | |||
| ПРОЛЕКАРСТВА, СОДЕРЖАЩИЕ КОНЪЮГАТ ЭКСЕНДИН-ЛИНКЕР | 2011 |
|
RU2593774C2 |
Авторы
Даты
2024-02-29—Публикация
2020-03-25—Подача