Изобретение относится к способу определения биологической активности дефибротида и, в частности, к непрямому ферментативному способу определения биологической активности дефибротида.
Область техники, к которой относится изобретение
Дефибротид (Merck Index, 1996, no. 2915) является веществом природного происхождения, которое получают экстракцией из органов животных и которое состоит из натриевой соли полидезоксирибонуклеотидов с низкой молекулярной массой. Дефибротид является предметом многочисленных фармакологических исследований, которые позволили предположить, что он может применяться в терапии в качестве антитромботического агента (патент США US 3829567).
Кроме того, дефибротид также успешно использовался в лечении периферических артериопатий, при острой почечной недостаточности (патент США US 4694134) или при острой ишемии миокарда (патент США US 4693995).
В настоящее время дефибротид проходит клинические испытания на предмет применения в лечении и профилактике веноокклюзионной болезни (ВОБ).
Подобно другим биологическим веществам, которые получают экстракцией, дефибротид является также предметом ограниченной вариабельности состава, что типично для природных биополимеров. Классическим примером данного явления является гепарин, вариабельность которого от партии к партии в отношении длины цепи, молекулярной массы, состава, степени сульфатирования и т.д. хорошо известна. Следствием этого является то, что одни и те же количества по массе дефибротида могут быть фактически неэквивалентными с точки зрения специфической биологической активности.
Процесс экстракции, выделения и очистки не может per se гарантировать абсолютную воспроизводимость этого продукта именно вследствие присущей ему биополимерной структуры.
Однако, при надлежащем контроле, можно уменьшить эту вариабельность: для этой цели проводились исследования стандартизованных промышленных процессов для выделения дефибротида экстракцией из органов, такие как, например, исследования, описанные в патенте США US 4985552.
Продукт, полученный в соответствии с вышеупомянутым процессом, характеризуется путем определения некоторых специфических физико-химических параметров, таких как, например, электрофоретическая подвижность, коэффициент экстинкции, способность к оптическому вращению и средняя относительная молекулярная масса. Однако эти параметры зависят, в основном, от структуры дефибротида и не могут обеспечить информацию о его биологической активности.
Насколько известно авторам заявленного изобретения, единственными способами, которые, как сообщалось до настоящего времени, использовались для оценки биологической активности дефибротида, являются чашечный тест определения лизиса фибрина и тромбоэластографическая регистрация времени лизиса эуглобулина [Prino G., Mantovani М., Niada R., Coccheri S., Butti A., Indagini preliminari sull'attività fibrinolitica, nell'animale e nell'uomo, di una nuova sostanza presente in diversi organi animali, Simposio Internazionale: La ricerca scientifica nell'industria farmaceutica in Italia, Rome, 2-4 Oct. 1975 - II Farmaco, Ed. Prat.) (1969), 24, 552-561] и основанный на применении плазмина способ, раскрытый в патенте США US 7338777, упомянутый в данном описании в ссылочном порядке.
Однако вышеупомянутый способ тромбоэластографической регистрации времени лизиса эуглобулина отличается значительной экспериментальной сложностью, неудовлетворительными воспроизводимостью и точностью и в конкретном случае тромбоэластографической регистрации линейностью ответа, ограниченной очень узкими диапазонами концентраций.
Ферментативную активность плазмина обычно определяют различными стандартными тестами in vitro. Одним из наиболее часто используемых способов является определение при помощи спектрофотометрии или флуориметрии хромогенных или флуорогенных соединений, которые высвобождаются посредством действия плазмина на различные субстраты (Haemostasis, (1978), 7, 138-145). Обычно используют пептидные субстраты, имеющие формулу A1-A2-A3-X, где A1 и A2 являются аминокислотами, которые являются преимущественно неполярными, A3 является лизином или аргинином и X представляет измеряемое высвобождающееся соединение, например пара-нитроанилин (pNa) или 2-нафтиламин (NA) (Haemostasis, (1978), 7, 146-149). Кроме вышеупомянутых пептидных субстратов, успех был достигнут с использованием других, более простых, соединений, таких как, например, п-нитробензил-п-толуолсульфонил-L-аргинин (Haemostasis, (1978), 7, 105-108).
В этих тестах скорость, с которой соединение X высвобождается в инкубационную среду, пропорциональна активности (в Международных Единицах/мг) плазмина, присутствующего в пробе.
Данный способ проводят в ТРИС-буфере без какого-либо другого плазменного/сывороточного активатора/ингибитора. Тем не менее, процедура не отражает физиологического состояния и не моделирует с какой-либо точностью механизм действия дефибротида in vivo.
Таким образом, до настоящего времени не были описаны и испытаны достоверные, точные и воспроизводимые способы определения биологической активности дефибротида, отражающие точным образом механизм действия продукта в комплексной биологической системе (in vivo).
Авторы заявленного изобретения разработали простой и надежный способ определения биологической активности дефибротида, который позволяет контролировать образцы, получаемые экстракцией и, следовательно, позволяет стандартизировать медицинские препараты на основе дефибротида.
Способ, к которому относится данное изобретение, позволяет определять специфическую биологическую активность дефибротида в сравнении со стандартным эталоном с высокой точностью и надежностью.
Краткое описание чертежей
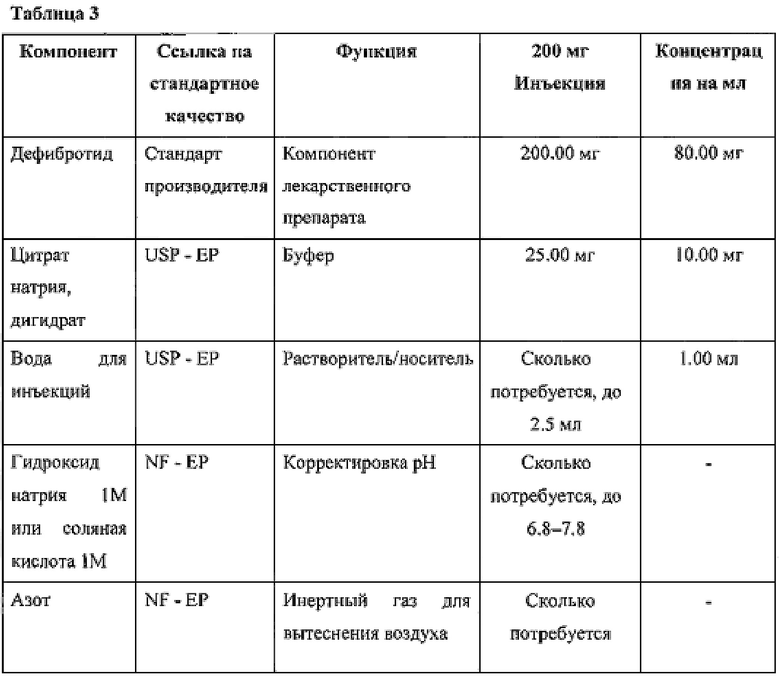
Фиг. 1 представляет кинетику высвобождения pNA из субстрата S-2251 под действием фракции эуглобулина млекопитающего, который активирован и не активирован дефибротидом (концентрация 0-50 мкг/мл, 0-100 минут).
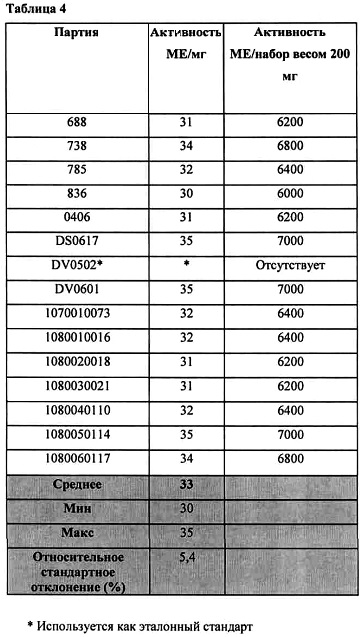
Фиг. 2 представляет сигмоидальную кривую, получаемую в зависимости от стандарта и анализируемого образца дефибротида.
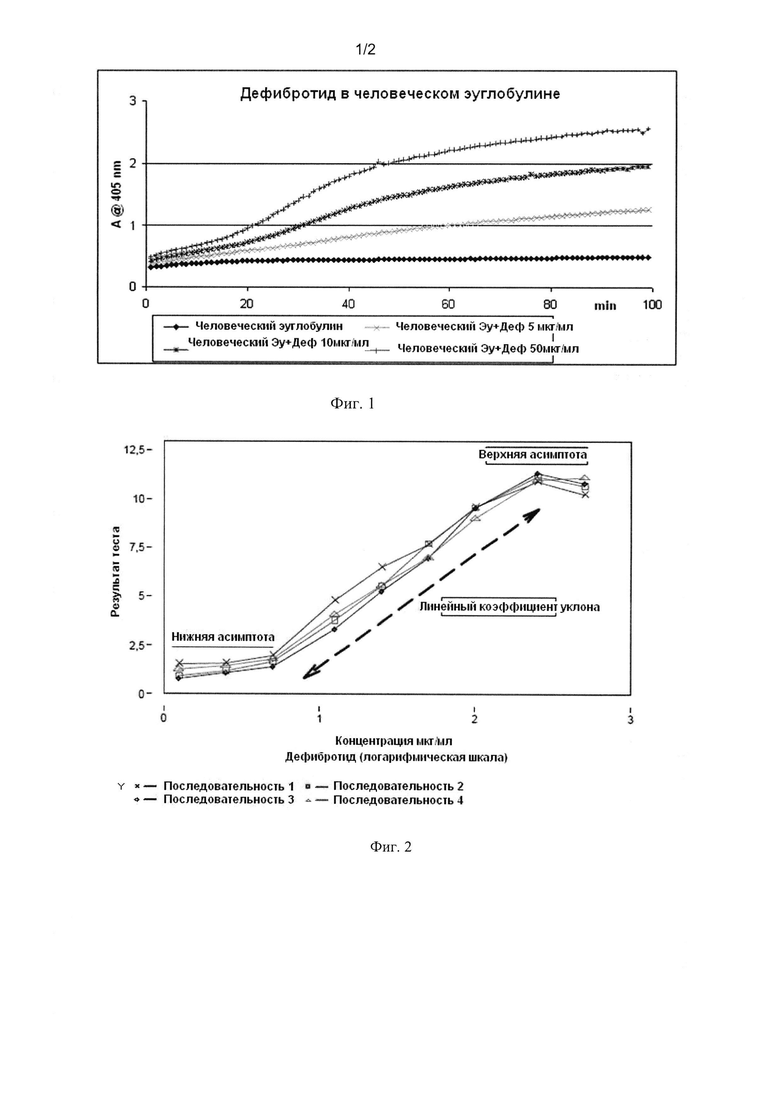
Фиг. 3 представляет «плотность в сравнении со временем» стандартных композиций (например: S1_Ca, S1_Cb, S1_Cc) с приемлемым диапазоном линейности (например: от 30 до 35 мин).
Описание изобретения
Данное изобретение относится к способу определения специфической биологической активности образцов дефибротида, включающему этапы:
а) приведения в контакт дефибротида, эуглобулина и субстрата, специфичного для плазмина, который посредством реакции с плазмином обеспечивает измеряемый продукт, и
б) измерения количества образованного продукта в последовательных временных точках.
Способ по заявленному изобретению является непрямым in vitro способом для определения активности дефибротида, который основан на функциональном взаимодействии между дефибротидом и эуглобулином.
Эуглобулин является фракцией сывороточного глобулина, которая нерастворима в дистиллированной воде, но растворима в солевых растворах.
Эуглобулин содержит фибриноген, ингибитор-1 активатора плазминогена, тканевой активатор плазминогена (ТАП, tPA), плазминоген и, в меньшем количестве, альфа2-антиплазмин, а также фактор VIII.
Авторы заявленного изобретения неожиданно обнаружили, что дефибротид катализирует гидролиз плазминогена в плазмин. Таким образом, при инкубации дефибротида эуглобулином и субстратом, специфичным для плазмина, например пептидом с формулой A1-A2-A3-X, как описано в Haemostasis, (1978), 7, 138-149, упомянутом в данном описании в ссылочном порядке, скорость, с которой соединение X высвобождается в инкубационную среду, возрастает пропорционально концентрации самого дефибротида.
Иными словами, дефибротид катализирует гидролиз плазминогена, содержащегося в эуглобулине, в плазмин; затем упомянутый плазмин ферментативно реагирует с субстратом, специфичным для плазмина, предпочтительно с хромогенным субстратом, для получения измеряемого продукта.
Следовательно, способ согласно заявленному изобретению дополнительно включает этапы: в) определения скорости высвобождения измеряемого продукта в ходе ферментативной реакции на стандартном и тестовом образцах дефибротида; г) корреляции, математически и/или графически, скорости высвобождения и соответствующей концентрации дефибротида для определения биологической активности тестового образца дефибротида.
Образец дефибротида, используемый для определения в соответствии с заявленным изобретением, обычно получают экстракцией из органов согласно известным процедурам, таким как, например, процедуры, описанные в патенте США US 4985552, который уже упоминался в ссылочном порядке.
Партию обычного, изготовляемого промышленным путем дефибротида выбирали в качестве эталонного образца (стандарта) и использовали для построения калибровочных кривых в соответствии со способом согласно заявленному изобретению.
В общем и целом, данный способ обеспечивает точные и правильные измерения дефибротида даже в присутствии примесей, таких как, например, РНК, гепарин, деградированный дефибротид (дефибротид, из которого был удален пурин или пиримидин) или этанол, при условии, что они находятся в концентрациях, обычно меньших чем 10% по массе, и при этом не нарушающих баланс системы.
Кроме возможности определения дефибротида, данный способ позволяет также определять другие биологически эквивалентные вещества, получаемые из дефибротида, такие как, например, деаминированный дефибротид или, более просто, дефибротид, денатурированный воздействием физико-химических параметров.
Данный способ является достаточно чувствительным для обнаружения концентраций дефибротида, равных или меньших чем 2,5 мкг/мл (конечная концентрация в этой системе определения), и обычно дает хорошую корреляцию до максимальных величин концентраций, равных или более высоких чем 1000 мкг/мл.
Используемый эуглобулин является обычно фракцией эуглобулина любого млекопитающего, таким как, например, бычий, свиной, кроличий или человеческий эуглобулин, причем предпочтительным является человеческий и бычий эуглобулин.
Хотя фракция эуглобулина является предпочтительной ферментативной системой, использование других эквивалентных ферментативних систем, таких как, например, разбавленная плазма и сыворотка (до 1:10 с буферами), искусственные или изолированные сочетания плазминогена, ТПА, урокиназного активатора плазминогена УАП, ингибиторов-1 и -2 активатора плазминогена, альфа2-антиплазмина и подобных ферментативних систем, которые являются химически и биологически родственными и имеют сходную функциональность, находится также в рамках данного изобретения.
В способе по данному изобретению под субстратом для плазмина может пониматься любой субстрат, специфичный для плазмина, который, в условиях заявленного способа, высвобождает детектируемый продукт гидролиза X.
В зависимости от природы детектируемой группы X могут использоваться равным образом успешно альтернативные системы детектирования, обычно известные специалисту в данной области. Спектрофотометрические или флуорометрические системы детектирования являются особенно предпочтительными, в особенности спектрофотометрические системы.
Обычно используемыми субстратами являются субстраты, которые являются специфичными для плазминоген-плазминной пробы. Предпочтительно использовать пептиды формулы A1-A2-A3-X, в которой A1 и A2 являются преимущественно неполярными аминокислотами, A3 является лизином или аргинином и X является детектируемой группой. Примерами таких субстратов являются Val-Leu-Lys-pNa, Val-Phe-Lys-pNa или пиро-Glu-Phe-Lys-pNa, в которых группа X, детектируемая при помощи спектрофотометрии, является пара-нитроанилином (pNa). Другие подходящие субстраты, например, Val-Gly-Arg-2NA, содержат 2-нафтиламин, который измеряют флуорометрией. Особенно предпочтительным субстратом является соединение H-D-валил-L-лейцил-L-лизин-п-нитроанилин (H-D-Val-Leu-Lys-pNa).
Плазмины и специфичные субстраты, используемые для определения активности дефибротида во фракции эуглобулина, являются обычно коммерчески доступными.
Способ определения согласно заявленному изобретению проводят помещением образца дефибротида в раствор эуглобулина при специфических pH и молярности.
В частности, фракции эуглобулина, полученные из плазмы млекопитающего, восстанавливают растворением и разбавлением эуглобулина до первоначального объема в солевом буфере (например, объем фракции эуглобулина, полученный из 10 мл плазмы, растворяют и восстанавливают до 10 мл с солевым буфером при pH от 7 до 8).
Что касается субстрата, концентрации от 0,3 до 4 мМ, предпочтительно от 2,5 до 3,5 мМ и наиболее предпочтительно 3 мМ, используют обычно в случае хромогенного субстрата, тогда как концентрации от 0,05 до 0,15 мМ используют в случае флуорогенного субстрата.
Способ определения согласно заявленному изобретению, подобно другим ферментативним способам, является чувствительным к pH среды.
Фактически он не может применяться при экстремальных значениях pH, при которых ферментативная система была бы инактивирована.
Предпочтительно также, чтобы pH среды не подвергался изменению в любой временной точке во время периода проведения измерений, и, следовательно, фракции эуглобулина обычно забуферивают с использованием буферных систем, выбранных из систем, обычно используемых в биологических тестах. Например, подходящими буферными системами могут быть фосфатный буфер, цитратный буфер или трис(гидроксиметил)аминометан-гидрохлоридный и натрий-хлоридный (ТРИС-NaCl) буфер. Восстановление фракции эуглобулина проводят предпочтительно в присутствии ТРИС-NaCl.
В данном способе обычно предпочтительно поддерживать pH среды в диапазоне приблизительно от 7 до 8, более предпочтительно при приблизительно 7,4.
Кроме того, предпочтительно поддерживать концентрацию буферной системы в диапазоне от 10 до 200 мМ, предпочтительно при приблизительно 50 мМ. Помимо этого, предпочтительно поддерживать концентрацию буферной системы в диапазоне от 10 до 200 мМ, предпочтительно на уровне примерно 50 мМ. Более предпочтительно, концентрацию ТРИС-NaCl поддерживать на уровне 50 мМ для ТРИС и 150 мМ для хлорида натрия.
В частности, для обеспечения возможности замеров предпочтительно предварительно разбавить/растворить дефибротид в ТРИС-NaCl буфере для получения исходного стокового раствора образца и стандарта. Из стоковых растворов, пробу и стандарт разбавляют серийным разбавлением до определенного объема фракции эуглобулина до момента достижения при анализе диапазона концентрации примерно от 1 до 1000 мкг/мл дефибротида. Способ данного изобретения для определения биологической активности дефибротида предусматривает прямое разбавление испытуемых растворов во фракции эуглобулина, с последующим добавлением хромогенного или флуорогенного субстрата. В частности, для обеспечения правильного проведения измерений, предусмотренных данным способом, предпочтительно добавлять плазмин или специфичный субстрат или оба к буферному раствору, содержащему образец дефибротида, перед началом стадии измерения. Субстрат для плазмина предпочтительно добавляют в последнюю очередь.
Важным параметром данного способа определения является температура. Предпочтительно поддерживать одну и ту же температуру на протяжении всей продолжительности измерений и для всех измеряемых образцов как при построении калибровочных кривых, так и во время стадии измерений. Для этой цели предпочтительно использовать прибор с возможностью контроля температуры, а также при необходимости следует проводить несколько серий измерений, изменяя положение образцов таким образом, чтобы гарантировать, что данная система имеет максимальную температурную гомогенность.
Обычно этот способ определения используют в диапазоне температур, например, от 25 до 40°C, предпочтительно от 35 до 39°C и еще более предпочтительно при 37°C.
Согласно заявленному изобретению, измерение концентрации соединения X, высвобождающегося в среду под действием дефибротида, начинают тогда, когда все реагенты были добавлены, и продолжают в течение заранее заданного времени и при заранее заданной частоте в зависимости от химической природы X и системы детектирования.
Подобно другим способам биологического определения, способ по заявленному изобретению также предусматривает этапы калибровки и измерения, которые предпочтительно проводят параллельно для уменьшения, насколько это возможно, экспериментальной погрешности.
Этап калибровки включает в себя получение данных оптической плотности, относящихся к пробам с известными увеличивающимися концентрациями дефибротида (стандарта), статистическую обработку этих данных и экстраполяцию калибровочных кривых, которые выражают корреляцию между увеличением скорости ферментативной реакции данного изобретения и концентрацией дефибротида, присутствующего во фракции эуглобулина. На этапе измерения, благодаря корреляции, полученной на этапе калибровки, возможно определить неизвестные биологические активности образцов дефибротида на основе величин оптической плотности, измеренных и обработанных при тех же самых условиях.
Более подробно, экспериментальный протокол обычно предусматривает подготовку нескольких образцов, как стандартных, так и неизвестных, при различных известных концентрациях дефибротида. Образцы дефибротида готовят последовательным разведением исходных растворов в соответствии с заданным заранее фактором разведения.
В заявленном способе предпочтительно подготовить по меньшей мере 5 концентраций стандарта и 5 концентраций тестируемого образца с получением как минимум 4 повторов по каждой концентрации стандарта и, аналогично, по каждой концентрации тестируемого образца, обычно при последовательном разведении 1:2 исходных растворов.
Концентрации как стандарта, так и анализируемого образца дефибротида обычно равны от 0,1 до 1000 мкг/мл.
Концентрации анализируемого образца имеют предпочтительно тот же самый порядок величин, что и концентрации стандарта.
Согласно приведенной выше иллюстрации, измерения для каждой концентрации предпочтительно проводят на одном микропланшете, где размещение каждого образца, стандарта и анализируемого образца, соответственно, при соответствующей концентрации является предпочтительно измененным. Согласно этой схеме для расположения образцов, которая объясняется более подробно в экспериментальной части, для каждой концентрации как стандарта дефибротида, так и анализируемого образца дефибротида измеряют по меньшей мере 4 значения оптической плотности для каждой временной точки.
Серию измерений, описанных выше, проводят в заданных заранее временных точках, то есть прежде всего во время t0, то есть когда все компоненты были добавлены, перед началом ферментативной реакции согласно заявленному изобретению и затем через точные интервалы и в течение времени, достаточного для получения необходимых данных.
Предпочтительно измерения оптической плотности продолжаются максимально до 90 минут со снятиями показаний, производимыми каждые 1-10 минут. Более предпочтительно снятия показаний производят каждую минуту. Фотометрические снятия показаний оптической плотности проводят при длине волны, которая зависит от характера детектируемой группы X, высвобождаемой в ходе ферментативной гидролитической реакции. В конкретном случае, когда X является pNA, оптическую плотность измеряют при 405 нм.
Показания оптической плотности стандартных и неизвестных образцов дефибротида, известные как исходные данные, обычно напрямую происходят из одного и того же прибора, который обеспечивает операцию снятия показаний; их сводят в таблицу таким образом, чтобы значение оптической плотности присутствовало для каждой временной точки и для каждой лунки.
Затем эти исходные данные подвергают обработке с использованием, например, электронной таблицы Microsoft Excel®. Эта первая операция обработки данных приводит к расчету средней оптической плотности и связанного с ней стандартного отклонения в каждой временной точке и для каждой серии показаний, причем каждая серия показаний содержит по меньшей мере 4 повтора для каждой концентрации как стандарта, так и анализируемого образца дефибротида.
Дальнейшая статистическая обработка данных проводится при помощи коммерчески доступного программного обеспечения для проведения биологических испытаний, как описано Finney D J, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London and relevant Pharmacopoeias.
В частности, согласно заявленному изобретению, проведение теста на определение биологической активности дефибротида можно осуществлять с использованием моделей параллельных линий, скошенного коэффициента и логистической кривой четырех параметров, как описано, например, в соответствующих параграфах European Pharmacopoeia General text 5.3, Statistical Analysis.
Как показано на фиг. 1, посредством откладывания времени по абсциссе, а оптической плотности по ординате получают прямые линии, наклон b которых будет пропорционален скорости ферментативной реакции: при увеличении концентрации дефибротида будет увеличиваться скорость гидролиза и пропорционально будет увеличиваться величина b. Наконец, величины наклона, рассчитанные, как описано выше, для каждой серии повторов стандарта дефибротида и анализируемого образца дефибротида, коррелируют с концентрацией дефибротида, к которой они относятся. Вместо реального значения, могут использовать приемлемые математические превращения данных по абсциссе (десятичный логарифм концентрации дефибротида).
Графически эта корреляция дает сигмоидальную кривую для стандарта и сигмоидальную кривую для анализируемого образца (фиг. 2); центральные части этих сигмоидальных кривых дают две прямые линии, которые обычно являются параллельными и расстояние между которыми является функцией разности между биологическими активностями анализируемого образца и стандарта. В этом интервале линейности определяют активность в соответствии с методологией биологического определения с использованием параллельных линий, описанной Finney D J, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London.
Для более точного определения используют модели логистических кривых с четырьмя параметрами и в данном случае полную сигмоидальную кривую стандарта и анализируемого образца используют для расчета относительной биологической активности образца.
В предпочтительном воплощении данного изобретения стандартные растворы и растворы образцов дефибротида, которые подлежат определению, вводят в соответствующие лунки микропланшетов. Фракцию эуглобулина готовят в момент использования, и она представляет собой разжижающую среду для исходного раствора дефибротида. Наконец, добавляют раствор, содержащий хромогенный субстрат. Затем этот микропланшет помещают в термостатированный планшет-ридер и после быстрого перемешивания снимают показания оптической плотности этой системы через заданные предварительно интервалы и в течение предварительно заданного периода времени. Затем полученные исходные данные обрабатывают, определяя, таким образом, неизвестные активности образцов дефибротида.
Как показано на нижеследующих примерах, способ согласно заявленному изобретению позволяет получить жидкие композиции дефибротида, предпочтительно водные растворы, с определенной биологической активностью и, в частности, с активностью от 25 до 35 МЕ/мг дефибротида, предпочтительно от 27.5 до 32.5 МЕ/мг и, более предпочтительно, от 28 до 32 МЕ/мг.
Жидкие композиции дефибротида предпочтительно поставляют в продажу в виде наборов, более предпочтительно флаконов, содержащих 200 мг дефибротида в 2.5 мл забуференного водного раствора (предпочтительно при pH от 6.5 до 8.5, более предпочтительно от 7 до 8), для разбавления перед использованием; соответственно, при определении биологической активности при помощи способа согласно заявленному изобретению каждый набор содержит дефибротид активностью от 5000 до 7000 ME, предпочтительно от 5500 до 6500 ME, более предпочтительно от 5600 до 6400.
Эти и другие аспекты данного изобретения будут проиллюстрированы более подробно в следующих примерах, которые, однако, не должны рассматриваться как ограничивающие заявленное изобретение.
Примеры
В приведенных здесь примерах использовали следующие материалы:

Программы и программное обеспечение
- Microsoft Excel® (Microsoft Corporation, Redmond, Wash., USA)
Вещества
- Дефибротид (Gentium)
- Хромогенный субстрат S-2251 (Chromogenix Instrumentation Laboratory S.p.A., Milan, Italy)
- Трис(гидроксиметил)аминометан (TPHC)-NaCl, (Sigma-Aldrich, Milan, Italy)
- 1н HCl (Carlo Erba reagenti, Milan, Italy)
- 1 н NaOH (Carlo Erba reagenti, Milan, Italy)
- Бычья плазма (Tebu Bio Italia, Magenta (MI), Italy)
- Уксусная кислота ледяная (Carlo Erba reagenti, Milan, Italy)
Растворы
- ТРИС-NaCl (раствор 1 л): в стакане 1 л L количественно переносят 6.06 г ТРИС-HCl и 2.2 г NaCl. Растворяют в 500 мл очищенной воды и корректируют pH до 7.4 с примерно 40 мл HCl 1N. Количественно переносят раствор в мерную колбу объемом 1 л и разбавляют раствор до объема с очищенной водой. Хранят раствор в холодильнике при (2-8°C).
- Хромогенный субстрат S2251 (CAS 63589-93-5) 3 мМ (раствор 15.2 мл): примерно 25 мг хромогенного субстрата растворяют в 15,2 мл дистиллированной воды и хранят в холодильнике при (2-8°C).
- Бычьи эуглобулины (раствор 10 мл). В контейнер с минимальным объемом 300 мл вводят 240 мл охлажденной на льду очищенной воды и при помешивании добавляют 10 мл бычьей плазмы. Корректируют pH до 5.3±0.1 с уксусной кислотой 1%. Оставляют отстояться при 2-8°C в течение 1-16 часов. Отделяют прозрачный раствор супернатанта путем откачки сифоном и собирают преципитат центрифугированием при 2.800 оборотах в минуту в течение 5 минут и при 4°C. Суспендируют преципитат путем механического диспергирования (например: при помощи лабораторной стеклянной указки) в 5 мл охлажденной на льду очищенной воды, встряхивают в течение примерно 5 мин и собирают преципитат центрифугированием при 2.800 оборотах в минуту в течение 5 минут и при 4°C. Диспергируют преципитат механически в примерно 10 мл ТРИС-NaCl; для облегчения растворения преципитата дробят преципитат в крошки при помощи приемлемого инструмента (например: лабораторной стеклянной указки). Хранят полученную суспензию при 2-8°C в течение не менее 1 часа и не более 6 часов до использования.
Стандартные и анализируемые растворы дефибротида
Стандартный стоковый раствор
В мерную колбу 20 мл количественно переносят 100 мг аккуратно взвешенного стандартного образца дефибротида. Растворяют порошок с примерно 10 мл ТРИС-NaCl и восстанавливают объем с этим же самым растворителем. Разбавляют 1:4 полученный раствор с ТРИС-NaCl для получения стандартного раствора дефибротида примерно 1.25 мг/мл.
Анализируемый стоковый раствор
В мерную колбу 20 мл количественно переносят 100 мг аккуратно взвешенной пробы дефибротида. Растворяют порошок с примерно 10 мл ТРИС-NaCl и восстанавливают объем с этим же самым растворителем. Разбавляют 1:4 полученный раствор с ТРИС-NaCl для получения анализируемого раствора дефибротида примерно 1.25 мг/мл.
Приготовление стандартного и анализируемого растворов
a) Дефибротид 125 мкг/мл: разбавляют 1:10 стоковый раствор дефибротида (стандартный и анализируемый) с ТРИС-NaCl (эквивалентно 50 мкг/мл в планшетную лунку). В пробирку Эппендорфа количественно переносят 500 мкл приготовленного раствора и смешивают с 500 мкл эуглобулина. Закрывают пробирку и хранят в охлаждаемой льдом воде.
b) Дефибротид 62.5 мкг/мл: разбавляют 1:2 раствор (а) с ТРИС-NaCl (эквивалентно 25 мкг/мл в планшетную лунку). В пробирку Эппендорфа количественно переносят 500 мкл приготовленного раствора и смешивают с 500 мкл эуглобулина. Закрывают пробирку и хранят в охлаждаемой льдом воде.
c) Дефибротид 31.25 мкг/мл: разбавляют 1:2 раствор (b) с ТРИС-NaCl (эквивалентно 12.5 мкг/мл в планшетную лунку). В пробирку Эппендорфа количественно переносят 500 мкл приготовленного раствора и смешивают с 500 мкл эуглобулина. Закрывают пробирку и хранят в охлаждаемой льдом воде.
d) Дефибротид 12.5 мкг/мл: разбавляют 1:2.5 раствор (d) с ТРИС-NaCl (эквивалентно 5 мкг/мл в планшетную лунку). В пробирку Эппендорфа количественно переносят 500 мкл приготовленного раствора и смешивают с 500 мкл эуглобулина. Закрывают пробирку и хранят в охлаждаемой льдом воде.
Бланковый раствор
Смешать 1 объем эуглобулинов с 1 объемом раствора ТРИС NaCl (например: 500 мкл + 500 мкл)
Размещение в лунках планшета
Согласно предлагаемой схеме размещения (см. Табл. 1 далее по тексту) добавляют в каждую лунку планшета 200 мкл стандартного или анализируемого или бланкового раствора. Необходимо отметить, что различные схемы размещения можно применять в соответствии с наличием и конфигурацией автоматических пипеток. Однако для теста нужно осуществить не менее 4 размещений для каждого стандартного и анализируемого раствора.
Непосредственно перед инкубированием планшета в ридере добавляют в каждую лунку 50 мкл хромогенного субстрата.
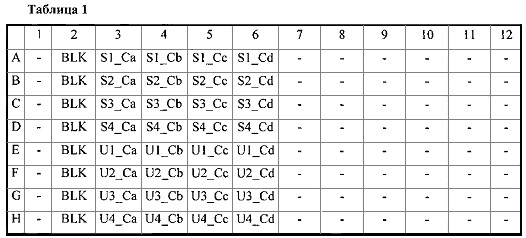
S1, S2, S3, S4: размещение 1 стандартного раствора, размещение 2, размещение 3, размещение 4,
U1, U2, U2, U5: размещение 1 анализируемого раствора, размещение 2, размещение 3, размещение 4,
Ca, Cb, Cc etc.: Концентрация дефибротида в стандартном и анализируемом растворе а, b, c и т.д.
BLK Бланковый раствор
Расчет и результаты
Из кинетической схемы «плотность и время» стандартных растворов (например: S1_Ca, S1_Cb, S1_Cc) определить приемлемый линейный диапазон (например: от 30 до 35 мин, см. фиг. 3).
Определение линейного кинетического диапазона (А@405 нм и время).
Рассчитать для каждого раствора стандарта и пробы ответ анализа (наклонная) в предопределенном диапазоне времени в следующем порядке.
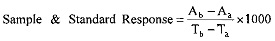
где:
Aa - величины плотности при временных значениях Time Та (30 мин из схемы выше по тексту),
Ab - величина плотности при временном значении Time Tb (35 мин из схемы выше по тексту).
Включить полученные значения в табличном виде, как показано в табл. 2.
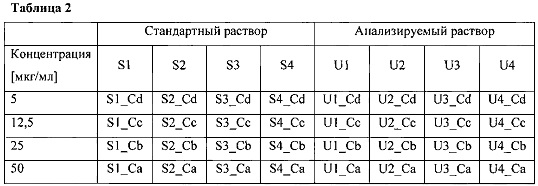
Отложить ответы на анализируемое вещество и стандарт на логарифмы концентрации и рассчитать активность исследуемого вещества, используя модель параллельных линий, как определено соответствующим параграфом 5.3.2 Ph. Eur Current edition.
Необходимо использовать не менее 3 последовательных серийных разбавлений стандарта и образца (например, концентрация дефибротида 5 мкг/мл, 12.5 мкг/мл, 25 мкг/мл, 50 мкг/мл, или 5 мкг/мл, 12.5 мкг/мл, 25 мкг/мл или 12.5 мкг/мл, 25 мкг/мл, 50 мкг/мл).
Дисперсионный анализ
Дисперсионный анализ проводят в соответствии с параграфом 5.3.2.3 Ph. Eur. current edition and Finney DJ (1964) Statistical Method in Biological Assay 2nd ed.
Тест на приемлемость
1) Данные линейной регрессии не критичны, т.е. расчетная вероятность менее 0.05. Если данный критерий не достигнут, невозможно рассчитать 95% C.I.
2) Данные непараллелизма не критичны, т.е. расчетная вероятность менее 0.05.
3) Данные нелинейности не критичны, т.е. расчетная вероятность менее 0.05.
Критерии приемлемости
4) Оцениваемая активность не ниже 90% и не выше 111% от заданной активности.
5) Границы доверительного интервала (P=0.95) оцениваемой активности не менее 80% и не более 125% от заданной активности.
Расчет
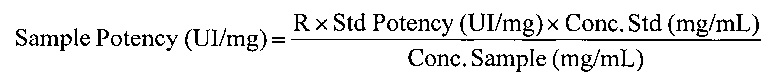
где:
- R: результат образца, полученный анализом модели параллельных линий,
- Std Potency: заданная активность стандарта (МЕ/мг сухого вещества),
- Cone. Std: концентрация стандарта (мг/мл сухого вещества),
- Cone. Sample: Концентрация образца (мг/мл сухого вещества).
Тест, проводимый на композициях дефибротида
Вышеописанный тест использовали для определения биологической активности жидких композиций, содержащих 200 мг дефибротида в 2.5 мл (80 мг на мл) и с количественно-качественным составом, указанным в табл. 3.
Результаты приведены в табл. 4.
Изобретение относится к области биотехнологии, а именно к способу определения биологической активности дефибротида. Приводят в контакт дефибротид, эуглобулин млекопитающего и субстрат, специфичный для плазмина, который в результате реакции с плазмином дает измеряемый продукт. Субстрат, специфичный для плазмина, представляет собой соединение формулы А1-А2-А3-Х, где A1 и А2 являются неполярными аминокислотами, А3 является лизином или аргинином и X является измеряемым продуктом. Измеряемый продукт выбирают из группы, состоящей из пара-нитроанилина и 2-нафтиламина. Измеряют количества образовавшегося продукта в последовательных временных точках для определения биологической активности дефибротида. Изобретение обеспечивает точные и правильные измерения активности дефибротида даже в присутствии примесей, таких как, например, РНК, гепарин, деградированный дефибротид. Способ является чувствительным для обнаружения концентраций дефибротида, равных или меньших чем 2,5 мкг/мл, и дает хорошую корреляцию до максимальных величин концентраций, равных или более высоких чем 1000 мкг/мл. 13 з.п. ф-лы, 3 ил., 4 табл.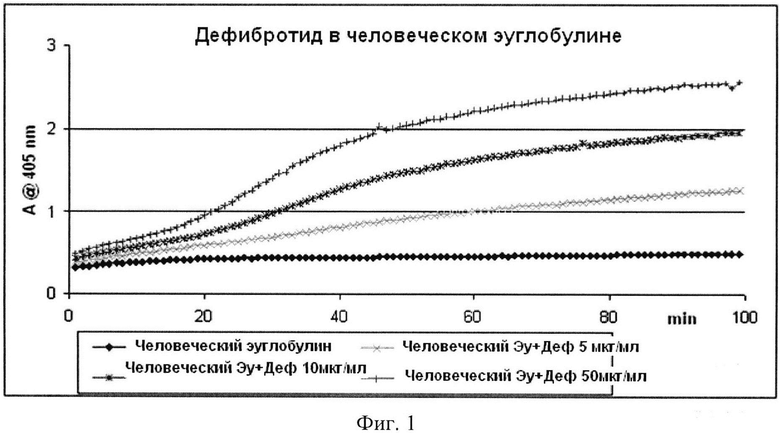
1. Способ определения биологической активности дефибротида, включающий этапы:
а) приведения в контакт дефибротида, эуглобулина млекопитающего и субстрата, специфичного для плазмина, который в результате реакции с плазмином дает измеряемый продукт; и
б) измерения количества образовавшегося продукта в последовательных временных точках для определения биологической активности дефибротида.
2. Способ по п. 1, в котором эуглобулин представляет собой эуглобулин млекопитающего.
3. Способ по п. 2, в котором эуглобулин представляет собой эуглобулин человека, кролика или животного подсемейства бычьих.
4. Способ по п. 1, в котором плазмин, реагирующий с субстратом, специфичным для плазмина, высвобождается плазминогеном, содержащимся в эуглобулине.
5. Способ по п. 1, в котором субстрат, специфичный для плазмина, представляет собой хромогенный субстрат.
6. Способ по п. 1, в котором субстрат, специфичный для плазмина, представляет собой соединение формулы А1-А2-А3-Х, где A1 и А2 являются неполярными аминокислотами, А3 является лизином или аргинином и X является измеряемым продуктом.
7. Способ по п. 6, в котором измеряемый продукт X выбирают из группы, состоящей из пара-нитроанилина и 2-нафтиламина.
8. Способ по п. 4, в котором субстратом, специфичным для плазмина, является H-D-валил-L-лейцил-L-лизин-п-нитроанилин.
9. Способ по п. 6, в котором измеряемый продукт X измеряют при помощи спектрофотометрии или спектрофлюорометрии.
10. Способ по п. 2, в котором эуглобулин млекопитающего ресуспендируют до объема первоначальной плазмы или разбавляют до соотношения 1:10 с приемлемым буфером, а хромогенный/флуорогенный субстрат имеет концентрацию от 2.5 до 3.5 мМ, предпочтительно 3 мМ.
11. Способ по п. 1, в котором реакционной средой является водный раствор, забуференный до рН в пределах от 7 до 8, предпочтительно до рН 7.4.
12. Способ по п. 1, в котором температуру этой системы поддерживают при 35-39°С, предпочтительно при 37°С.
13. Способ по п. 1, в котором концентрация субстрата, специфичного для плазмина, составляет от 0.3 до 4 мМ, предпочтительно от 2.5 до 3.5 мМ, более предпочтительно 3 мМ.
14. Способ по п. 1, включающий также этапы: в) определения скорости высвобождения измеряемого продукта в ходе ферментативной реакции на стандартном и анализируемом образцах дефибротида; г) математической и/или графической корреляции скорости высвобождения и соответствующей концентрации дефибротида для определения биологической активности анализируемого образца дефибротида.
| СПОСОБ ОПРЕДЕЛЕНИЯ БИОЛОГИЧЕСКОЙ АКТИВНОСТИ ДЕФИБРОТИДА | 2002 |
|
RU2323979C2 |
| US 4985552 A1, 15.01.1991 | |||
| RICHARDSON P | |||
| G | |||
| et al | |||
| Шланговое соединение | 0 |
|
SU88A1 |
| COCCHERI S | |||
| et al | |||
| "Defibrotide", Cardiovascular drug reviews, v.9, no.2, 01.06.1991, p.172-196 | |||
| RANIERI G | |||
| ET AL: "Defibrotide in the treatment of Raynaud's phenomenon in patients with progressive systemic sclerosis or essential mixed cryoglobulinemia", Current therapeutic research, v.53, no.1, 01.01.1993, p.48-58 | |||
| US 4693995 A, 15.09.1987 | |||
| ESPOSITO E et al | |||
| "Effect of Long-Term Stabilization of Cationic Liposomes as Defibrotide Delivery System for Antithrombotic Activity", Drug development research, 2002, v.55, p.127-138. | |||
Авторы
Даты
2017-08-03—Публикация
2012-06-22—Подача