Настоящее изобретение относится к области органической химии, а именно к способу получения α-тиоцианированных производных β-дикарбонильных соединений, таких как β-дикетонов, β-кетоэфиров и диэтилмалоната общей формулы:
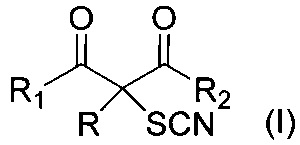 ,
,
где R = алкил С1-С6, незамещенный или замещенный бензил, аллил, (CH2)2COOEt, (CH2)2CN; R1 и R2=СН3 или OEt либо R+R1=(CH2)4, которые могут представлять интерес в качестве лекарственных препаратов (противораковых, антиастматических, болеутоляющих, противовоспалительных, жаропонижающих) и пестицидов.
Тиоцианаты играют значительную роль в органическом синтезе, так как на их основе осуществляется производство лекарственных препаратов, пестицидов и других соединений, обладающих биологической активностью.
Обнаружено, что тиоцианатная группа является фармакофорным фрагментом в природных противораковых соединениях, полученных дегликозилированием глюкозинолатов, выделенных из овощей семейства крестоцветных, таких как капуста, брокколи и горчица. [Shahidi F. Thioglucosides of Brassica Oilseeds and Their Process-Induced Chemical Transformations // Sulfur Compounds in FoodsAmerican Chemical Society, 1994. - C. 106-126; Mehta R.G., Liu J., Constantinou A., Thomas C.F., Hawthorne M., You M.,  C., Pezzuto J.M., Moon R.C., Moriarty R.M. Cancer chemopreventive activity of brassinin, a phytoalexin from cabbage // Carcinogenesis. - 1995. - T. 16, №2. - C. 399-404; Wittstock U., Kliebenstein D.J., Lambrix V., Reichelt M., Gershenzon J. Chapter five Glucosinolate hydrolysis and its impact on generalist and specialist insect herbivores // Recent Advances in Phytochemistry / John T.R. Elsevier, 2003. - C. 101-125; Peterson C.J., Tsao R., Coats J.R. Glucosinolate aglucones and analogues: insecticidal properties and a QSAR // Pesticide Science. - 1998. - T. 54, №1. - C. 35-42]. Направленное тиоцианирование является важной реакцией образования связи углерод - гетероатом в органическом синтезе. [Wood J.L. Substitution and Addition Reactions of Thiocyanogen // Organic Reactions. John Wiley & Sons, Inc., 1946. - C. 240-266; Guy R.G. Syntheses and preparative applications of thiocyanates // Cyanates and Their Thio Derivatives. John Wiley & Sons, Ltd., 1977. - C. 819-886; Erian A.W., Sherif S.M. The chemistry of thiocyanic esters // Tetrahedron. - 1999. - T. 55, №26. - C. 7957-8024; Castanheiro Т., Suffert J., Donnard M., Gulea M. Recent advances in the chemistry of organic thiocyanates // Chemical Society Reviews. - 2016. - T. 45, №3. - C. 494-505]. Тиоцианаты, полученные из дикарбонильных соединений, являются интермедиатами в синтезе серосодержащих гетероциклов [Nikiforov Т.Т., Connolly В.А. Straightforward preparation and use in oligodeoxynucleotide synthesis of 5'-O-(4,4'-dimethoxytrityl)-4-[S-(2-cyanoethyl)]-thiothymidine // Tetrahedron Letters. - 1992. - T. 33, №17. - C. 2379-2382; Nikiforov Т.Т., Connolly B.A. 5'-O-(4-4'-dimethylthoxytrityl)-4-thiocyanatothymidine A useful intermediate for the preparation of various 4-substituted thymidine analogues // Tetrahedron Letters. - 1991. - T. 32, №22. - C. 2505-2508], таких как тиазол [Kodomari M., Aoyama Т., Suzuki Y. One-pot synthesis of 2-aminothiazoles using supported reagents // Tetrahedron Letters. - 2002. - T. 43, №9. - C. 1717-1720; Aoyama Т., Murata S., Arai I., Araki N., Takido Т., Suzuki Y., Kodomari M. One pot synthesis using supported reagents system KSCN/SiO2-RNH3OAc/Al2O3: synthesis of 2-aminothiazoles and N-allylthioureas // Tetrahedron. - 2006. - T. 62, №14. - C. 3201-3213; Aoyama Т., Murata S., Takido Т., Kodomari M. Novel one-pot three-step reaction using supported reagents system: synthesis of 2-aminothiazoles // Tetrahedron. - 2007. - T. 63, №48. - C. 11933-11937], тиазолидин, циклические тиомочевины, некоторые из которых проявляют гербицидную активность [Sanemitsu Y., Kawamura S., Satoh J., Katayama Т., Hashimoto S. 2-Acylimino-3-phenylthiazolines: A New Family of Bleaching Herbicides // Synthesis and Chemistry of Agrochemicals VII American Chemical Society, 2007. - C. 197-207; Kawamura S., Sato J., Hamada Т., Sakaki M., Sanemitsu Y. Fused Heterocycles, Furo[3,2-d]pyrimidines and Dihydrocyclopenta[d]pyrimidines, as Potential New Herbicides // Bioscience, Biotechnology, and Biochemistry. - 1992. - T. 56, №11. - C. 1897-1899; Патент РФ №2067395, опубл. 10.10.1996 г.].
C., Pezzuto J.M., Moon R.C., Moriarty R.M. Cancer chemopreventive activity of brassinin, a phytoalexin from cabbage // Carcinogenesis. - 1995. - T. 16, №2. - C. 399-404; Wittstock U., Kliebenstein D.J., Lambrix V., Reichelt M., Gershenzon J. Chapter five Glucosinolate hydrolysis and its impact on generalist and specialist insect herbivores // Recent Advances in Phytochemistry / John T.R. Elsevier, 2003. - C. 101-125; Peterson C.J., Tsao R., Coats J.R. Glucosinolate aglucones and analogues: insecticidal properties and a QSAR // Pesticide Science. - 1998. - T. 54, №1. - C. 35-42]. Направленное тиоцианирование является важной реакцией образования связи углерод - гетероатом в органическом синтезе. [Wood J.L. Substitution and Addition Reactions of Thiocyanogen // Organic Reactions. John Wiley & Sons, Inc., 1946. - C. 240-266; Guy R.G. Syntheses and preparative applications of thiocyanates // Cyanates and Their Thio Derivatives. John Wiley & Sons, Ltd., 1977. - C. 819-886; Erian A.W., Sherif S.M. The chemistry of thiocyanic esters // Tetrahedron. - 1999. - T. 55, №26. - C. 7957-8024; Castanheiro Т., Suffert J., Donnard M., Gulea M. Recent advances in the chemistry of organic thiocyanates // Chemical Society Reviews. - 2016. - T. 45, №3. - C. 494-505]. Тиоцианаты, полученные из дикарбонильных соединений, являются интермедиатами в синтезе серосодержащих гетероциклов [Nikiforov Т.Т., Connolly В.А. Straightforward preparation and use in oligodeoxynucleotide synthesis of 5'-O-(4,4'-dimethoxytrityl)-4-[S-(2-cyanoethyl)]-thiothymidine // Tetrahedron Letters. - 1992. - T. 33, №17. - C. 2379-2382; Nikiforov Т.Т., Connolly B.A. 5'-O-(4-4'-dimethylthoxytrityl)-4-thiocyanatothymidine A useful intermediate for the preparation of various 4-substituted thymidine analogues // Tetrahedron Letters. - 1991. - T. 32, №22. - C. 2505-2508], таких как тиазол [Kodomari M., Aoyama Т., Suzuki Y. One-pot synthesis of 2-aminothiazoles using supported reagents // Tetrahedron Letters. - 2002. - T. 43, №9. - C. 1717-1720; Aoyama Т., Murata S., Arai I., Araki N., Takido Т., Suzuki Y., Kodomari M. One pot synthesis using supported reagents system KSCN/SiO2-RNH3OAc/Al2O3: synthesis of 2-aminothiazoles and N-allylthioureas // Tetrahedron. - 2006. - T. 62, №14. - C. 3201-3213; Aoyama Т., Murata S., Takido Т., Kodomari M. Novel one-pot three-step reaction using supported reagents system: synthesis of 2-aminothiazoles // Tetrahedron. - 2007. - T. 63, №48. - C. 11933-11937], тиазолидин, циклические тиомочевины, некоторые из которых проявляют гербицидную активность [Sanemitsu Y., Kawamura S., Satoh J., Katayama Т., Hashimoto S. 2-Acylimino-3-phenylthiazolines: A New Family of Bleaching Herbicides // Synthesis and Chemistry of Agrochemicals VII American Chemical Society, 2007. - C. 197-207; Kawamura S., Sato J., Hamada Т., Sakaki M., Sanemitsu Y. Fused Heterocycles, Furo[3,2-d]pyrimidines and Dihydrocyclopenta[d]pyrimidines, as Potential New Herbicides // Bioscience, Biotechnology, and Biochemistry. - 1992. - T. 56, №11. - C. 1897-1899; Патент РФ №2067395, опубл. 10.10.1996 г.].
Из литературы известно, что тиоцианирование β-дикарбонильных соединений представлено, главным образом, способами, основанными на замещении атома галогена или на one-pot галогенировании и последующем замещении атома галогена. Известен способ получения тиоцианатов общей формулы I, где R=CH3, С2Н5 или С6Н5, R1 и R2 = OEt, при котором малонаты сначала подвергают бромированию, с получением α-броммалоновых эфиров, которые затем смешивают с тиоцианатом калия при нагревании. Недостатком данного метода являются: достаточно низкие выходы (порядка 50%) и дополнительная стадия бромирования. Авторы указывают на возможность проведения реакции прямого тиоцианирования, при котором к смеси дикарбонильного соединения и тиоцианата аммония в ДМФА постепенно прибавляется бром. Но данный метод также характеризуется достаточно низкими выходами [Eiden F., Gauglitz G. Uber Thiocyansaure-Derivate aktivierter Methylenverbindungen. 14 Mitt. Uber Untersuchungen an Acyl-enaminen // Archiv der Pharmazie. - 1969. - T. 302. - №4. - C. 297-305].
Известен способ получения тиоцианатов общей формулы I, где R и R1=CH3, R2=OEt; R+R1=(CH2)3, R2=OEt, основанный на взаимодействии карбонильных соединений с тиоцианатотриметилсиланом и сульфурилхлоридом в присутствии морфолина или пиперидина. Реакцию проводят при комнатной температуре в течение 5 часов, выходы составляют 67 и 69% [Tanabe Y., Makita Т., Mori K. Direct and Electrophilic Preparation of α-Thiocyanatoketones and Aldehydes Using Thiocyanatotrimethylsilane and Sulfuryl Chloride // Chemistry letters. - 1994. - №. 12. - C. 2275-2278].
Известен способ получения органических тиоцианатов общей формулы I, где R=H, R1 и R2=OEt; R=CH3 R1=CH3, R2=OEt, из α-замещенных β-дикарбонильных соединений смешением диэтилхлормалоната и этил-2-хлор-метилацетоацетата с тиоцианатом натрия или аммония в этаноле с выходами 62 и 93%. При тех же условиях метил-2-хлорацетоацетат, этил-2-хлорацетоацетат и 3-хлорпентан-2,4-дион реагируют с образованием, в каждом случае, одного главного продукта и четырех побочных продуктов, ни один из которых не является тиоцианатом [Atkins Е.F., Dabbs S., Guy R.G., Mahomed A.A., Mountford P. Pseudohalogen chemistry. XI. Some aspects of the chemistry of α-thiocyanato-β-dicarbonyl compounds // Tetrahedron. - 1994. - T. 50, №24. - C. 7253-7264]. Также к недостаткам данного способа можно отнести то, что необходима дополнительная стадия галогенирования β-дикарбонильного соединения, что увеличивает затраты на производство целевых тиоцианатов.
Известен способ получения тиоцианатов общей формулы I, где R=H, СН3 или CH2Ph, R1 и R2=OEt; R и R1=CH3, R2=OEt; R=CH3, R1=Ph, R2=OEt; R, R1 и R2=CH3, one-pot галогенированием дикарбонильных соединений бромидом меди, нанесенным на оксид алюминия, с последующим тиоцианированием полученных бромпроизводных тиоцианатом калия, нанесенным на силикагель [Suzuki Y., Kodomari М. One-Pot Synthesis Using Supported Reagents System: Conversion of  -Dicarbonyl Compounds to α-Thiocyano-
-Dicarbonyl Compounds to α-Thiocyano- -dicarbonyl Compounds Using CuBr2/Al2O3-KSCN/SiO2 // Chemistry letters. - 1998. - №. 11. - С. 1091-1092]. Выходы данных реакций составляют 18-89%.
-dicarbonyl Compounds Using CuBr2/Al2O3-KSCN/SiO2 // Chemistry letters. - 1998. - №. 11. - С. 1091-1092]. Выходы данных реакций составляют 18-89%.
Известен способ получения тиоцианатов общей формулы I, R, R1 и R2=CH3; R=CH3, R1=Ph, R2=CH3; R и R1=CH3, R2=OEt; R=CH3, R1=Ph, R2=OEt; R=H, R1 и R2=OEt;) с использованием глины K10 для быстрого получения тиоцианатов из α-галоген карбонильных, α-галоген β-дикарбонильных соединений, бензил и алкил галогенидов, с выходами 90-98% [Meshram Н.М., Thakur Р.В., Babu В.М. A convenient, rapid, and general synthesis of α-oxo thiocyanates using clay supported ammonium thiocyanate // Tetrahedron Letters. - 2012. - T. 53. - №.14. - C. 1780-1785]. Данная методика отличается отсутствием дополнительного катализатора, органических растворителей и стадии экстракции. Однако предполагает дополнительную стадию нанесения тиоцианата аммония на подложку из монтмориллонитной глины К10.
Из литературы известен способ α-тиоцианирования β-дикарбонильных соединений с использованием бромдиметилсульфоний бромида и тиоцианата аммония [Bhalerao D.S., Akamanchi K.G. Mild and Efficient Method for α-Thiocyanation of Ketones and β-Dicarbonyl Compounds Using Bromodimethylsulfonium Bromide-Ammonium Thiocyanate // Synthetic Communications. - 2010. - T. 40, №6. - C. 799-807]. Было установлено, что реакция протекает в две стадии через образование бромпроизводного. Реакцию проводят в ацетонитриле при комнатной температуре в течение 5 часов, в результате целевые тиоцианаты общей формулы I, где R=H, R1 и R2=CH3; R=CH3, R1=Ph, R2=CH3; R=CH3, R1=Ph, R2=OEt, получают с выходом 90-96%. Коммерческая недоступность бромдиметилсульфоний бромида не позволяет использовать этот способ для промышленного применения.
В течение последних двух десятилетий широкое применение НРА в качестве катализатора для различных промышленных процессов было продемонстрировано для широкого разнообразия превращений органических субстратов. Принимая во внимание свойства и важность гетерополикислот (HPA), которые имеют хорошие свойства как катализатора в органическом синтезе, известен способ получения тиоцианатов общей формулы I, где R=H, R1 и R2=CH3; R=H, R1=Ph, R2=OEt; R=H, R1+R2=CH2C(CH3)2CH2, с использованием каталитических количеств HPA [Chaskar А.С, Yadav A.A., Langi В.P., Murugappan A., Shah C. Heteropoly Acids as Heterogeneous and Reusable Catalyst for α-Thiocyanation of Ketones // Synthetic Communications. - 2010. - T. 40, №19. - C. 2850-2856]. НРА не только окисляет тиоцианат аммония до тиоцианогена [(SCN)2], но также енолизирует карбонильную группу с получением α-тиоцианата. В конце реакции катализатор восстанавливается фильтрованием с последующим использованием. Тиоцианирование дикарбонильных соединений проходит с выходами 60-70%.
Известен способ получения тиоцианатов общей формулы I, где R=H, R1 и R2=CH3; R, R1 и R2=CH3; R=H, R1=Ph, R2=CH3; R и R1=CH3, R2=OEt; R=H, R1 и R2=OEt; R+R1=(CH2)3, R2=OEt, с использованием системы "system I" (PhICl2/Pb(SCN)2/CH2Cl2) целевые продукты получают с выходом от 45 до 97% [Prakash О., Kaur Н., Batra Н., Rani N., Singh S.P., Moriarty R.M. α-Thiocyanation of Carbonyl and β-Dicarbonyl Compounds Using (Dichloroiodo)benzene-Lead(II) Thiocyanate // The Journal of Organic Chemistry. - 2001. - T. 66, №6. - C. 2019-2023]. Недостатком данного способа является высокая стоимость (дихлорйод)бензола и тиоцианата свинца, а также высокая токсичность последнего.
Известен способ получения тиоцианата общей формулы I, где R=H, R1=OCH3, R2=CH(CH3)2, направленным α-тиоцианированием енолизируемого кетона в нейтральный условиях. Тиоцианирование дикарбонильного соединения тиоцинатом аммония с использованием молекулярного йода в кипящем метаноле идет 6,5 часа, а выход составляет 73% [Yadav, J.S., Reddy, В.S., Reddy, U.S., & Krishna, A.D. Iodine/MeOH as a novel and versatile reagent system for the synthesis of α-ketothiocyanates // Tetrahedron letters. - 2007. - T. 48. - №.30. - C. 5243-5246]. Известен наиболее близкий по своей химической природе и принят нами за прототип способ получения тиоцианатов общей формулы I, где R=H, R1=CH3 или Ph, R2=OCH3 или OEt, либо R1+R2=CH2C(CH3)2CH2, с использованием тиоцианатов аммония или калия, и персульфата калия и меди (II) как окисляющего агента в водном ацетонитриле (MeCN - H2O, 7:3). Данные реакции идут 5 часов при комнатной температуре. Выходы целевых тиоцианатов при использовании данной системы не превышают 60-70% [Kumar A., Ahamd P., Maurya R.A. Direct α-thiocyanation of carbonyl and β-dicarbonyl compounds using potassium peroxydisulfate-copper(II) // Tetrahedron Letters. - 2007. - T. 48, №8. - C. 1399-1401].
Технической задачей настоящего изобретения является повышение выхода α-тиоцианированных производных β-дикарбонильных соединений, а также расширение ассортимента получаемых соединений.
Поставленная техническая задача достигается предложенным способом получения α-тиоцианированных производных β-дикарбонильных соединений общей формулы:
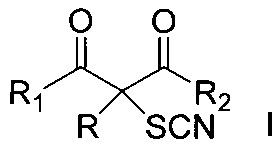 ,
,
где R = алкил С1-С6, незамещенный или замещенный бензил, аллил, (CH2)2COOEt, (CH2)2CN; R1 и R2=СН3 или OEt либо R1+R=(CH2)4, путем взаимодействия α-замещенных β-дикарбонильных соединений общей формулы:
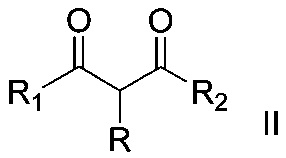 ,
,
где R, R1, R2 имеет вышеуказанные значения, с тиоцианатом натрия в присутствии сильного одноэлектронного окислителя церий (IV) аммоний нитрата и процесс проводят в среде органического растворителя при температуре 20-25°С и мольном соотношении α-замещенное β-дикарбонильное соединение:тиоцианат натрия:церий (IV) аммоний нитрат 1:2-4:2-4 соответственно.
Процесс протекает 3 часа по следующей схеме:
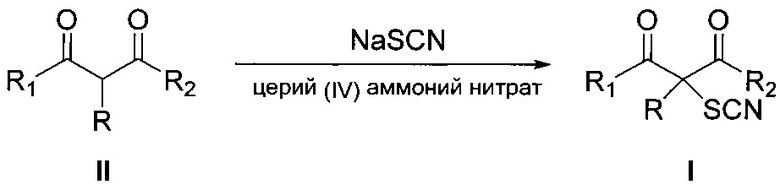
В результате образуются α-тиоцианированные производные β-дикарбонильных соединений общей формулы I с выходом от 80 до 98%. В качестве органического растворителя используют, например, уксусную кислоту, ацетон, этанол, этилацетат.
Технический результат - разработан удобный и простой в техническом исполнении способ получения α-тиоцианированных производных β-дикарбонильных соединений, позволяющий повысить выход целевого продукта до 80-98%, сократить время проведения процесса и отказаться от высокотоксичных реагентов и дополнительных стадий, а также расширить ассортимент получаемых соединений общей формулы I. Наряду с известными получены новые, неописанные в литературе, следующие соединения общей формулы I:
пример 1. 3-тиоцианат-3-бензил-2,4-пентандион, R=CH2Ph, R1 и R2=CH3;
пример 2. диэтил 2-бензил-2-тиоцианатомалонат, R=CH2Ph, R1 и R2=OEt;
пример 5. диэтил 2-бутил-2-тиоцианатомалонат, R=(CH2)3CH3, R1 и R2=OEt;
пример 6. диэтил 2-аллил-2-тиоцианатомалонат, R = аллил, R1 и R2=OEt;
пример 8. 3-тиоцианато-3-(4-хлорбензил)пентан-2,4-дион, R=4-ClC6H4CH2, R1 и R2=CH3;
пример 9. 3-тиоцианато-3-(4-бромбензил)пентан-2,4-дион, R=4-BrC6H4CH2, R1 и R2=CH3;
пример 10. этил 2-(тиоцианато)-2-(4-нитробензил)-3-оксобутаноат, R=4-NO2C6H4CH2, R1=CH3, R2=OEt;
пример 11. этил 2-(тиоцианато)-2-(4-метилбензил)-3-оксобутаноат, R=4-СН3С6Н4СН2, R1=CH3, R2=OEt;
пример 12. 3-(тиоцианато)-3-гексилпентан-2,4-дион, R=(CH2)5CH3, R1 и R2=CH3;
пример 13. 4-тиоцианат-4-ацетил-5-оксоэтилгексаноат, R=(CH2)2COOEt, R1 и R2=CH3;
пример 14. 4-ацетил-4-тиоцианато-5-оксогексанитрил, R=(CH2)2CN, R1 и R2=CH3;
пример 15. этил 2-ацетил-2-тиоцианатогексаноат, R=(CH2)3CH3, R1=CH3, R2=OEt;
пример 16. этил 2-ацетил-2-тиоцианатооктаноат, R=(CH2)5CH3, R1=CH3, R2=OEt;
пример 17. этил 1-(тиоцианато)-2-оксоциклогексанкарбоксилат, R+R1=(CH2)4, R2=OEt;
пример 18. этил 2-(тиоцианато)-2-(2-цианоэтил)-3-оксобутаноат, R=(CH2)2CN, R1=CH3, R2=OEt.
Предлагаемый способ получения α-тиоцианированных производных β-дикарбонильных соединений является новым, так как до настоящего времени не было известно из уровня техники о получении α-тиоцианированных производных β-дикарбонильных соединений с использованием церий (IV) аммоний нитрата.
Синтез α-тиоцианированных производных β-дикарбонильных соединений с использованием церий (IV) аммоний нитрата является необычным, поскольку церий (IV) аммоний нитрат является очень сильным окислителем и мог бы приводить к димеризации [Song, J., Zhang, Н., Chen, X., Li, X., Xu, D. Oxidative Coupling of 1,3-Dicarbonyl Compounds by Cerium (IV) Ammonium Nitrate // Synthetic Communications®. - 2010. - T. 40. - №.12. - C. 1847-1855.] или деацетилированию [Zhang Y., Jiao J., Flowers R.A. Mild conversion of β-diketones and β-ketoesters to carboxylic acids // The Journal of organic chemistry. - 2006. - T. 71. - №.12. - C. 4516-4520] исходного β-дикарбонильного соединения или окислению образующегося интермедиата диродана с образованием катион-радикала с дальнейшей полимеризацией по катионному или радикальному механизмам. При использовании других условий синтеза и соотношения реагентов образуются трудноразделимые смеси продуктов, в результате этого проведение синтеза теряет практический смысл. Таким образом, заявленное изобретение не вытекает для специалиста явным образом из известного уровня техники, что соответствует условию «изобретательский уровень».
Совокупность существенных признаков предлагаемого способа - проведение процесса в присутствии сильного одноэлектронного окислителя - церий (IV) аммоний нитрата при температуре 20-25°С и мольном соотношении α-замещенное β-дикарбонильное соединение:тиоцианат натрия:церий (IV) аммоний нитрат 1:2-4:2-4 соответственно - позволяет получать целевой продукт с выходом 80-98% и сократить время проведения процесса.
Изобретение соответствует условию «промышленная применимость», поскольку предложен безопасный способ получения соединений формулы I, которые могут представлять интерес в качестве лекарственных препаратов (противораковых, антиастматических, болеутоляющих, противовоспалительных, жаропонижающих) и пестицидов.
Пример 1. Получение 3-тиоцианат-3-бензил-2,4-пентандиона.
В круглодонную колбу с магнитной мешалкой загружали 3-бензил-2,4-пентандион (0,380 г; 2 ммоль), 10 мл уксусной кислоты. При перемешивании добавляли тиоцианат натрия (0,486 г; 6 ммоль) и CAN (3,29 г; 6 ммоль). Реакционную массу перемешивали в течение 3 часов при температуре 20-25°С. Далее к смеси добавляли CH2Cl2 (10 мл), выливали в воду (30 мл), перемешивали и экстрагировали CH2Cl2 (3×15 мл), объединенные органические экстракты промывали насыщенным водным раствором NaHCO3 (30 мл), затем водой (30 мл). Сушили над MgSO4, фильтровали, упаривали растворитель в вакууме водоструйного насоса. Продукт выделяли методом колоночной хроматографии на SiO2 с использованием в качестве элюента системы петролейный эфир-этилацетат с увеличением доли последнего от 0 до 20%. Выход 98% (0,485 г). Белые кристаллы. Тплавления = 53-54°С. Rf=0.58 (ПЭ:ЭА=10:1). 1Н NMR (300 MHz, δ ppm, J Hz, DMSO-d6): 2.44 (s, 6 H - 2CH3) 3.60 (s, 2 H - CH2) 7.09-7.32 (m, 5H - Ph). 13C NMR (75.47 MHz, DMSO-d6): 26.6, 36.3, 81.9, 111.0, 127.6, 128.5, 129.7, 133.6, 199.0.
Пример 2. Получение диэтил 2-бензил-2-тиоцианатомалоната.
В круглодонную колбу с магнитной мешалкой загружали диэтил 2-бензилмалонат (0,501 г; 2 ммоль), 10 мл этилацетата. При перемешивании добавляли тиоцианат натрия (0,486 г; 6 ммоль) и CAN (3,29 г; 6 ммоль). Реакционную массу перемешивали в течение 3 часов при температуре 20-25°С. Далее к смеси добавляли CH2Cl2 (10 мл), выливали в воду (30 мл), перемешивали и экстрагировали CH2Cl2 (3×15 мл), объединенные органические экстракты промывали насыщенным водным раствором NaHCO3 (30 мл), затем водой (30 мл). Сушили над MgSO4, фильтровали, упаривали растворитель в вакууме водоструйного насоса. Продукт выделяли методом колоночной хроматографии на SiO2 с использованием в качестве элюента системы петролейный эфир-этилацетат с увеличением доли последнего от 0 до 20%. Выход 96% (0,590 г). Rf=0.33 (ПЭ:ЭА=10:1) 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.35 (t, J=7.1, 6 H - 2CH3), 3.67 (s, 2 H - CH2), 4.21-4.46 (m, 4 H - 2CH2), 7.25-7.38 (m, 5 H - Ph). 13C NMR (75.47 MHz, CDCl3): 14.0, 39.5, 63.8, 67.2, 110.0, 128.2, 128.7, 130.3, 133.2, 165.9.
Пример 3. Получение диэтил 2-метил-2-тиоцианатомалоната.
В круглодонную колбу с магнитной мешалкой загружали диэтил 2-метилмалонат (0,348 г; 2 ммоль), 10 мл ацетона. При перемешивании добавляли тиоцианат натрия (0,649 г; 8 ммоль) и CAN (3,29 г; 6 ммоль). Реакционную массу перемешивали в течение 3 часов при температуре 20-25°С. Далее к смеси добавляли CH2Cl2 (10 мл), выливали в воду (30 мл), перемешивали и экстрагировали CH2Cl2 (3×15 мл), объединенные органические экстракты промывали насыщенным водным раствором NaHCO3 (30 мл), затем водой (30 мл). Сушили над MgSO4, фильтровали, упаривали растворитель в вакууме водоструйного насоса. Продукт выделяли методом колоночной хроматографии на SiO2 с использованием в качестве элюента системы петролейный эфир-этилацетат с увеличением доли последнего от 0 до 20%. Выход 86% (0,398 г). Rf=0.38 (ПЭ:ЭА=10:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.29 (t, J=7.1, 6 H - 2CH3), 1.95 (s, 3 H - CH3), 4.29 (q, J=7.1, 4 H - 2CH2). 13C NMR (75.47 MHz, CDCl3): 13.9, 22.5, 60.8, 63.7, 109.5, 166.6.
Пример 4. Получение диэтил 2-этил-2-тиоцианатомалоната.
В круглодонную колбу с магнитной мешалкой загружали диэтил 2-этилмалонат (0,376 г; 2 ммоль), 10 мл этанола. При перемешивании добавляли тиоцианат натрия (0,324 г; 4 ммоль) и CAN (3,29 г; 6 ммоль). Реакционную массу перемешивали в течение 3 часов при температуре 20-25°С. Далее к смеси добавляли CH2Cl2 (10 мл), выливали в воду (30 мл), перемешивали и экстрагировали CH2Cl2 (3×15 мл), объединенные органические экстракты промывали насыщенным водным раствором NaHCO3 (30 мл), затем водой (30 мл). Сушили над MgSO4, фильтровали, упаривали растворитель в вакууме водоструйного насоса. Продукт выделяли методом колоночной хроматографии на SiO2 с использованием в качестве элюента системы петролейный эфир-этилацетат с увеличением доли последнего от 0 до 20%. Выход 84% (0,412 г). Rf=0.40 (ПЭ:ЭА=10:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.03 (t, J=7.3, 3 H - CH3), 1.30 (t, J=7.1, 6 Н - 2CH3), 2.35 (q, J=7.3, 2H - CH2), 4.30 (q, J=7.1, 4 H - 2CH2). 13C NMR (75.47 MHz, CDCl3): 8.6, 14.0, 27.5, 63.6, 67.3, 109.5, 166.2.
Пример 5. Получение диэтил 2-бутил-2-тиоцианатомалоната.
Аналогично примеру 2 получают диэтил 2-бутил-2-тиоцианатомалонат с использованием исходного диэтил 2-бутилмалоната. Выход 96% (0,525 г). Rf=0.46 (ПЭ:ЭА=10:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 0.92 (t, J=6.8, 3 H - CH3), 1.29 (t, J=7.1, 6 H - 2CH3), 1.34-1.45 (m, 4 H - 2CH2), 2.21-2.34 (m, 2 H - CH2), 4.29 (q, J=7.1, 4 H - 2CH2). 13C NMR (75.47 MHz, CDCl3): 13.8, 13.9, 22.3, 26.3, 33.6, 63.6, 66.5, 109.5, 166.3.
Пример 6. Получение диэтил 2-аллил-2-тиоцианатомалоната.
Аналогично примеру 2 получают диэтил 2-аллил-2-тиоцианатомалонат с использованием исходного диэтил 2-аллилмалонат. Выход 96% (0,494 г). Rf=0.40 (ПЭ:ЭА=10:1) 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.31 (t, J=7.1, 6 H - 2CH3), 3.05 (d, J=7.1, 2 H - CH2), 4.31 (q, J=7.1, 4 H - 2CH2), 5.26 (d, J=10.0, 1H, =CH2), 5.30 (d, J=17.0, 1H, =CH2), 5.72 (ddt, J1=17.0, J2=10.0, J3=7.1, 1H, CH). 13C NMR (75.47 MHz, CDCl3): 14.0, 38.5, 63.8, 65.4, 109.5, 121.8, 129.5, 165.9.
Пример 7. Получение диэтил 2-фенил-2-тиоцианатомалоната.
Аналогично примеру 2 получают диэтил 2-фенил-2-тиоцианатомалонат с использованием исходного диэтил 2-фенилмалоната. Выход 90% (0,528 г). Rf=0.46 (ПЭ:ЭА=95:5). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.32 (t, J=7.1, 6 H - 2CH3), 4.28-4.47 (m, 4 H - 2CH2), 7.40-7.55 (m, 5 H - Ph). 13C NMR (75.47 MHz, CDCl3): 13.9, 64.1, 69.6, 110.0, 128.3, 128.9, 129.7, 132.9, 166.0.
Пример 8. Получение 3-тиоцианато-3-(4-хлорбензил)пентан-2,4-диона.
Аналогично примеру 2 получают 3-тиоцианато-3-(4-хлорбензил)пентан-2,4-дион с использованием исходного 3-(4-хлорбензил)пентан-2,4-диона. Выход 95% (0,535 г). Тплавления = 62-64°С. Rf=0.53 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 2.37 (s, 6 H - 2CH3) 3.60 (s, 2 H - CH2), 7.11 (d, J=8.4, 2 H - 2CH), 7.28 (d, J=8.4, 2 H - 2CH). 13C NMR (75.47 MHz, CDCl3): 26.7, 37.3, 82.8, 110.2, 129.1, 131.2, 131.7, 134.3, 198.0.
Пример 9. Получение 3-тиоцианато-3-(4-бромбензил)пентан-2,4-диона.
Аналогично примеру 2 получают 3-тиоцианато-3-(4-бромбензил)пентан-2,4-дион с использованием исходного 3-(4-бромбензил)пентан-2,4-диона. Выход 85% (0,555 г). Rf=0.31 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 2.37 (s, 6 H - 2CH3), 3.59 (s, 2 H - CH2), 7.05 (d, J=8.2, 2 H - 2CH), 7.44 (d, J=8.2, 2 H - 2CH). 13C NMR (75.47 MHz, CDCl3): 26.7, 37.4, 82.7, 110.2, 122.4, 131.5, 132.1, 132.3, 198.0.
Пример 10. Получение этил 2-(тиоцианато)-2-(4-нитробензил)-3-оксобутаноата.
Аналогично примеру 2 получают этил 2-(тиоцианато)-2-(4-нитробензил)-3-оксобутаноат с использованием исходного этил 2-(4-нитробензил)-3-оксобутаноата. Выход 80% (0,516 г). Тплавления = 92-94°С. Rf=0.64 (ПЭ:ЭА=3:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.32 (t, J=7.1, 3 H - CH3), 2.42 (s, 3H - CH3), 3.58 (d, J=15.0, 1H - CH2), 3.72 (d, J=15.0, 1H - CH2), 4.22-4.43 (m, 2 H - CH2CH3), 7.40 (d, J=8.6, 2 H - 2CH), 8.18 (d, J=8.6, 2 H - 2CH). 13C NMR (75.47 MHz, CDCl3): 14.0, 25.6, 38.1, 64.7, 72.5, 109.2, 123.9, 131.2, 141.1, 147.9, 165.8, 194.6.
Пример 11. Получение этил 2-(тиоцианато)-2-(4-метилбензил)-3-оксобутаноата.
Аналогично примеру 2 получают этил 2-(тиоцианато)-2-(4-метилбензил)-3-оксобутаноат использованием исходного этил 2-(4-метилбензил)-3-оксобутаноата. Выход 80% (0,466 г). Тплавления = 87-90°С. Rf=0.29 (ПЭ:ЭА=10:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.32 (t, J=7.1, 3 H - CH3), 2.33 (s, 3H - CH3Ph), 2.39 (s, 3H - CH3CO), 3.47 (d, J=15.2, 1H - CH2), 3.60 (d, J=15.2, 1H - CH2), 4.16-4.46 (m, 2 H - CH2CH3), 7.03-7.17 (m, 4 H - Ph). 13C NMR (75.47 MHz, CDCl3): 14.0, 21.2, 25.9, 38.2, 64.1, 73.6, 109.9, 129.5, 130.0, 130.3, 137.9, 166.4, 195.
Пример 12. Получение 3-(тиоцианато)-3-гексилпентан-2,4-диона.
Аналогично примеру 1 получают 3-(тиоцианато)-3-гексилпентан-2,4-дион с использованием исходного 3-гексилпентан-2,4-диона. Выход 83% (0,401 г). Rf=0.32 (ПЭ:ЭА=5:1). 1H NMR (300 MHz, δ ppm, J Hz, CDCl3): 0.88 (t, J=6.6, 3 H - CH3), 1.19-1.47 (m, 8 H - 4 CH2), 2.29 (s, 6 H - 2CH3). 13C NMR (75.47 MHz, CDCl3): 14.1, 22.6, 23.9, 26.1, 29.1, 31.4, 32.2, 82.8, 110.3, 199.1.
Пример 13. Получение 4-тиоцианат-4-ацетил-5-оксоэтилгексаноата.
Аналогично примеру 1 получают 4-тиоцианат-4-ацетил-5-оксоэтилгексаноат с использованием исходного 4-ацетил-5-оксоэтилгексаноата. Выход 95% (0,489). Rf=0.38 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.25 (t, J=7.1, 3 H - CH3), 2.32 (s, 6 H - 2CH3), 2.34-2.43 (m, 2 H - CH2), 2.62-2.71 (m, 2 H - CH2), 4.13 (q, J=7.1, 2 H - CH2CH3). 13C NMR (75.47 MHz, CDCl3): 14.2, 26.2, 27.3, 29.1, 61.3, 81.9, 109.6, 171.5, 198.5.
Пример 14. Получение 4-ацетил-4-тиоцианато-5-оксогексанитрила.
Аналогично примеру 1 получают 4-ацетил-4-тиоцианато-5-оксогексанитрил с использованием исходного 4-ацетил-5-оксогексанитрила. Выход 87% (0,366 г). Тплавления = 77-79°С. Rf=0.30 (ПЭ : ацетон = 3:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 2.36 (s, 6 H - 2СН3), 2.50 (t, J=7.2, 2 H - CH2), 2.70 (t, J=7.2, 2 H - CH2). 13C NMR (75.47 MHz, CDCl3): 12.8, 26.2, 28.0, 81.3, 108.9, 117.4, 197.5.
Пример 15. Получение этил 2-ацетил-2-тиоцианатогексаноата.
Аналогично примеру 1 получают этил 2-ацетил-2-тиоцианатогексаноат с использованием исходного этил 2-ацетилгексаноата. Выход 88% (0,428 г). Rf=0.40 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 0.94 (t, J=7.0, 3 H - CH3), 1.32 (t, J=7.0, 3 H - CH3), 1.20-1.54 (m, 4 H - 2CH2), 2.14-2.44 (m, 2 H - CH2), 2.30 (s, 3 H - CH3), 4.33 (q, J=7.0, 2 H - CH2O). 13C NMR (75.47 MHz, CDCl3): 13.8, 14.0, 22.5, 25.4, 26.2, 32.7, 63.9, 73.5, 109.8, 166.9, 197.0.
Пример 16. Получение этил 2-ацетил-2-тиоцианатооктаноата.
Аналогично примеру 1 получают этил 2-ацетил-2-тиоцианатооктаноат с использованием исходного этил 2-ацетилоктаноата. Выход 85% (0,461 г). Rf=0.59 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 0.88 (t, J=7.1, 3 H - CH3), 1.2-1.45 (m, 11 H), 2.15-2.28 (m, 2 H - CH2), 2.31 (s, 3 H - CH3CO), 4.33 (q, J=7.1, 2 H - CH2O). 13C NMR (75.47 MHz, CDCl3): 14.1, 22.6, 24.1, 25.4, 29.0, 31.5, 33.0, 63.9, 73.6, 109.8, 166.9, 197.1.
Пример 17. Получение этил 1-(тиоцианато)-2-оксоцикло-гексанкарбоксилата.
Аналогично примеру 1 получают этил 1-(тиоцианато)-2-оксоцикло-гексанкарбоксилат с использованием исходного этил 2-оксоциклогексанкарбоксилата. Выход 89% (0,405 г). Rf=0.52 (ПЭ:ЭА=5:1). 1Н NMR (300 MHz, δ ppm, J Hz, DMSO-d6): 1.23 (t, J=7.1, 3 H - CH3), 1.48-2.17 (m, 5 H - CH2), 2.45-2.70 (m, 2 H - CH2), 2.76-2.90 (m, 1 H - CH2), 4.20-4.38 (m, 2 H - CH2O). 13C NMR (75.47 MHz, DMSO-d6): 13.6, 22.6, 26.0, 37.2, 39.8, 63.2, 68.0, 110.0, 166.0, 201.6.
Пример 18. Получение этил 2-(тиоцианато)-2-(2-цианоэтил)-3-оксобутаноата.
Аналогично примеру 1 получают этил 2-(тиоцианато)-2-(2-цианоэтил)-3-оксобутаноат с использованием исходного этил 2-(2-цианоэтил)-3-оксобутаноата. Выход 85% (0,408 г). Rf=0.41 (ПЭ : ацетон = 3:1). 1Н NMR (300 MHz, δ ppm, J Hz, CDCl3): 1.31 (t, J=7.1, 3 H - CH3), 2.34 (s, 3 H - CH3), 2.46-2.74 (m, 4 H - 2CH2), 4.29-4.38 (m, 2 H - CH2O). 13C NMR (75.47 MHz, CDCl3): 12.9, 13.8, 25.2, 28.8, 64.9, 71.0, 108.3, 117.5, 165.6, 194.8.
| название | год | авторы | номер документа |
|---|---|---|---|
| Применение α-тиоцианированных производных β-дикарбонильных соединений в качестве фунгицидных средств и фунгицидная композиция на их основе | 2017 |
|
RU2643043C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| Применение замещенных 2,3,5,6-тетраоксабицикло[2.2.1]гептанов в качестве фунгицидных средств и фунгицидная композиция на их основе | 2016 |
|
RU2627309C1 |
| ПРИМЕНЕНИЕ ГИДРИРОВАННЫХ ПРОИЗВОДНЫХ ПИРРОЛО[3,2,1-IJ]ХИНОЛИН-1-ИЛИДЕН-2-ТИОКСОТИАЗОЛИДИН-4-ОНОВ В КАЧЕСТВЕ ИНГИБИТОРОВ ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ XA И XIA | 2023 |
|
RU2819897C1 |
| 1,3-Диметоксипропаны, содержащие 6,6-диметилбицикло[3.1.1]гептановый фрагмент природного происхождения и н-алкильный заместитель, способ их получения и титан-магниевый катализатор полимеризации пропилена, содержащий эти соединения в своем составе | 2024 |
|
RU2839765C1 |
| Способ получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов | 2020 |
|
RU2752940C1 |
| Способ получения органических нитросоединений | 2016 |
|
RU2611009C1 |
| Замещенные 4-нитропиразолин-5-оны, способ их получения и их применение в качестве фунгицидных средств | 2019 |
|
RU2709732C1 |
| АНАЛОГИ ВИТАМИНА D, СОЕДИНЕНИЯ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1994 |
|
RU2153491C2 |
| СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОГО УГЛЕВОДА, СПОСОБ ПОЛУЧЕНИЯ ФУКОЗИЛИРОВАННОЙ СИАЛИЛИРОВАННОЙ УГЛЕВОДНОЙ МОЛЕКУЛЫ, РЕАКЦИОННАЯ СИСТЕМА IN VITRO | 1992 |
|
RU2125092C1 |
Изобретение относится к способу получения α-тиоцианированных производных β-дикарбонильных соединений общей формулы I, где R = алкил С1-С6, незамещенный или замещенный бензил, аллил, (CH2)2COOEt, (CH2)2CN; R1 и R2=СН3 или OEt либо R+R1=(CH2)4, которые могут найти применение в качестве лекарственных препаратов (противораковых, антиастматических, болеутоляющих, противовоспалительных, жаропонижающих) и пестицидов. Способ заключается в том, что α-замещенные β-дикарбонильные соединения общей формулы II, где R, R1 и R2 имеют вышеуказанные значения, подвергают взаимодействию с тиоцианатом натрия в присутствии церий(IV) аммоний нитрата. Процесс проводят в среде органического растворителя при температуре 20-25°C и мольном соотношении α-замещенное β-дикарбонильное соединение:тиоцианат натрия:церий(IV) аммоний нитрат, равном 1:2-4:2-4, соответственно. Предлагаемый способ позволяет повысить выход целевых продуктов до 80-98%, сократить время проведения процесса, отказаться от высокотоксичных реагентов и дополнительных стадий, а также расширить ассортимент получаемых соединений общей формулы I. 18 пр.
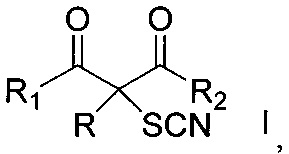 ,
, 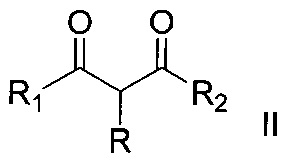
Способ получения α-тиоцианированных производных β-дикарбонильных соединений общей формулы
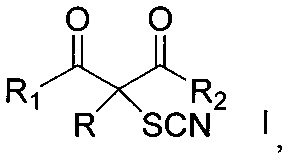
где R = алкил С1-С6, незамещенный или замещенный бензил, аллил, (CH2)2COOEt, (CH2)2CN; R1 и R2=СН3 или OEt либо R+R1=(CH2)4, заключающийся в том, что α-замещенные β-дикарбонильные соединения общей формулы
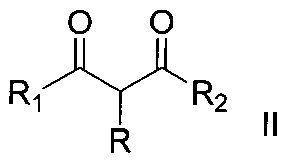 ,
,
где R, R1 и R2 имеют вышеуказанные значения, подвергают взаимодействию с тиоцианатом натрия в присутствии церий(IV) аммоний нитрата и процесс проводят в среде органического растворителя при температуре 20-25°C и мольном соотношении α-замещенное β-дикарбонильное соединение:тиоцианат натрия:церий(IV) аммоний нитрат 1:2-4:2-4 соответственно.
| A | |||
| KUMAR ET AL., Direct α -thiocyanation of carbonyl and β -dicarbonyl compounds using potassium peroxydisulfate-copper(II), TETRAHEDRON LETTERS, 2007, 48(8), 1399-1401 | |||
| И.В | |||
| СВИСТУНОВА И ДР., α -Замещенные ацетилацетонаты дифторида бора, ЖУРН | |||
| ОБЩЕЙ ХИМИИ, 2008, 78(8), 1280-1288 | |||
| Д.В | |||
| ГАЙДАРЕНКО И ДР., Тиоцианирование β -дикарбонильных соединений, УСПЕХИ В ХИМИИ И ХИМИЧЕСКОЙ ТЕХНОЛОГИИ, 2014, XXVIII, 62-65. |
Авторы
Даты
2017-08-14—Публикация
2016-10-20—Подача