Настоящее изобретение относится к области химии органических пероксидов, производных кетонов, конкретно к способу получения β-гидроперокси-β-пероксилактонов, а именно замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов. Благодаря циклической структуре, соединения могут найти применение в медицине для получения лекарственных препаратов.
Химия органических пероксидов насчитывает уже более ста лет (Baeyer, А; Villiger, V. Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1899, 32, 3625-3633; Baeyer, A; Villiger, V. Ueber die Einwirkung des Caro'schen Reagens auf Ketone. Chemische Berichte,. 1900, 33, 858-864). В настоящий момент органические пероксиды, получаемые, главным образом, по реакции кетонов с пероксидом водорода или гидропероксидами, находят широкое применение в разных областях науки и промышленности. Среди практически ценных выделяют пероксиды, задействованные в крупнотоннажном производстве и использующиеся в качестве инициаторов свободно-радикальной полимеризации непредельных мономеров (Ullman's Encyclopedia of Industrial Chemistry, Elvers, В., Hawkins, S., and Russey, W., Eds., VCH: New York, 1995, 5th ed.).
В последние несколько десятилетий органические пероксиды, а, в первую очередь, циклические органические пероксиды притягивают внимание специалистов в области медицины и фармакологии, благодаря обнаружению у данных соединений мощной противомалярийной (Van Agtmael М. А.; Eggelte Т.A.; van Boxtel C.J. Artemisinin Drugs in the Treatment of Malaria: from Medicinal Herb to Registered Medication. Trends Pharmacol. Sci. 1999, 20(5), 199-205), антигельминтной (Keiser, J.; Xiao, S.H.; Tanner, M.; Utzinger, J. Artesunate and Artemether are Effective Fasciolicides in the Rat Model and In vitro. J. Antimicrob. Chemother. 2006, 57, 1139-1145), антишистосомной (Keiser, J.; Ingram, K.; Vargas, M.; Chollet, J.; Wang, X.; Dong, Y.; Vennerstrom, J.L. In vivo Activity of Aryl Ozonides Against Schistosoma Species. Antimicrob. Agents Chemother. 2012, 56(2), 1090-1092) и фунгицидной активности (RU 2627309 C1, 07.08.2017).
Анализ научно-технической и патентной литературы за последние сто лет демонстрирует, что количество публикаций, связанных с получением пероксидов в реакции Н2О2 с монокетонами исчисляется тысячами. ( К.; Zupan, M; Iskra, J. α-Substituted organic peroxides: synthetic strategies for a biologically important class of gemdihydroperoxide and perketal derivatives. Org. Biomol. Chem. 2007, 5, 3895-3908). Показано, что β-дикетоны могут быть превращены в 1,2,4,5-тетраоксаны (Terent'ev, А.О.; Borisov, D.А.; Chernyshev, V.V.; Nikishin, G.I. Facile and Selective Procedure for the Synthesis of Bridged1,2,4,5-Tetraoxanes; Strong Acids as Cosolvents and Catalysts for Addition of Hydrogen Peroxide to β-Diketones. J. Org. Chem. 2009, 74, 3335-3340;), тогда как δ-дикетоны могут быть превращены в 1,2,4-триоксоланы (озониды) (Yaremenko, I.A.; Gomes, G.d.P.; Radulov, P.S.; Belyakova, Y.Y.; Vilikotskiy, A.E.; Vil', V.A.; Korlyukov, A.A.; Nikishin, G.I.; Alabugin, I.V.; Terent'ev, A.O. Ozone-Free Synthesis of Ozonides: Assembling Bicyclic Structures from 1,5-Diketones and Hydrogen Peroxide. J. Org. Chem. 2018, 83, 4402-4426). Пероксидирование малоновых кислот и их сложных эфиров приводит к образованию малонил пероксидов (Adam, W.; Cadiz, С.; Mazenod, F. Vacuum Flash Pyrolysis (VFP) of Malonyl Peroxides: Decarboxylation versus Decarbonylation of the Intermediary α-Lactones. Tetrahedron Lett. 1981, 22, 1203-1206; Terent'ev, A.O.; Vil', V.A.; Mulina, O.M; Pivnitsky, K.K.; Nikishin, G.I.A Convenient Synthesis of Cyclopropane Malonyl Peroxide. Mendeleev Commun. 2014, 24, 345). В этом контексте пероксидирование β-кетоэфиров является потенциально сложной задачей из-за большой разницы в реакционной способности кето- и сложноэфирных групп по отношению к перекиси водорода.
К.; Zupan, M; Iskra, J. α-Substituted organic peroxides: synthetic strategies for a biologically important class of gemdihydroperoxide and perketal derivatives. Org. Biomol. Chem. 2007, 5, 3895-3908). Показано, что β-дикетоны могут быть превращены в 1,2,4,5-тетраоксаны (Terent'ev, А.О.; Borisov, D.А.; Chernyshev, V.V.; Nikishin, G.I. Facile and Selective Procedure for the Synthesis of Bridged1,2,4,5-Tetraoxanes; Strong Acids as Cosolvents and Catalysts for Addition of Hydrogen Peroxide to β-Diketones. J. Org. Chem. 2009, 74, 3335-3340;), тогда как δ-дикетоны могут быть превращены в 1,2,4-триоксоланы (озониды) (Yaremenko, I.A.; Gomes, G.d.P.; Radulov, P.S.; Belyakova, Y.Y.; Vilikotskiy, A.E.; Vil', V.A.; Korlyukov, A.A.; Nikishin, G.I.; Alabugin, I.V.; Terent'ev, A.O. Ozone-Free Synthesis of Ozonides: Assembling Bicyclic Structures from 1,5-Diketones and Hydrogen Peroxide. J. Org. Chem. 2018, 83, 4402-4426). Пероксидирование малоновых кислот и их сложных эфиров приводит к образованию малонил пероксидов (Adam, W.; Cadiz, С.; Mazenod, F. Vacuum Flash Pyrolysis (VFP) of Malonyl Peroxides: Decarboxylation versus Decarbonylation of the Intermediary α-Lactones. Tetrahedron Lett. 1981, 22, 1203-1206; Terent'ev, A.O.; Vil', V.A.; Mulina, O.M; Pivnitsky, K.K.; Nikishin, G.I.A Convenient Synthesis of Cyclopropane Malonyl Peroxide. Mendeleev Commun. 2014, 24, 345). В этом контексте пероксидирование β-кетоэфиров является потенциально сложной задачей из-за большой разницы в реакционной способности кето- и сложноэфирных групп по отношению к перекиси водорода.
Публикаций, связанных с пероксидированием β-кетоэфиров с помощью Н2О2 и с получением β-гидроперокси-β-пероксилактонов, насчитывается несколько.
В работах (Cubbon, R.С.P.; Hewlett, С. Organic Peroxides Containing Functional Groups. Part II. The Reaction of Hydrogen Peroxide with β- and γ-Oxo-Acids and Esters. J. Chem. Soc. С 1968, 0, 2983-2986; Gibson, D.H.; Wilson, H.L.; Joseph, J.T. β-Peroxy-β-propiolactols: Cyclic Analogs of the Baeyer-Villiger Intermediate. Tetrahedron Lett. 1973, 14, 1289-1292) было получено всего три примера β-гидроперокси-β-пероксилактонов - замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов общей формулы:

где R=Me, R1=R2=Н или R=R1=R2=Me либо R+R1=-(СН2)3-, R2=Me. Способ включал в себя пероксидирование простейших β-кетоэфиров с использованием взрывчатой концентрированной перекиси водорода (88-98%) и разбавленной серной кислоты. Главным недостатком метода является использование высококонцентрованной перекиси водорода, для работы с которой требуются особые меры предосторожности и неметаллическая специальная аппаратура.
Известен и принят за прототип способ получения β-гидроперокси-β-пероксилактонов - замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов общей формулы (I):

где R=водород, адамантил, незамещенный или замещенный бензил, незамещенный или замещенный алкил С1-С3, при этом заместителями могут быть CN, COOEt, С=O или С≡СН группы; R1=фенил, незамещенный бензил, незамещенный или замещенный алкил С1-С4, при этом заместителями могут быть СООМе, COOEt; R2=Н, Me; R+R1=-(СН2)3-, -(СН2)4-, взаимодействием соответствующих β-кетоэфиров общей формулы:
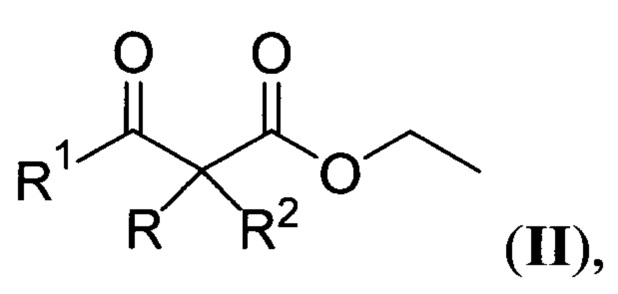
с эфирным раствором пероксида водорода (Н2О2 в Et2O) в присутствии кислот Льюиса и Бренстеда, например, BF3⋅Et2O или H2SO4 в качестве катализатора с выходом от 30 до 96% (Vil', V.A.; dos Passos Gomes, G.; Ekimova, M.V.; Lyssenko, K.A.; Syroeshkin, M.A.; Nikishin, G.I.; Terent'ev, A.O. Five Roads That converge at the Cyclic Peroxy-Criegee Intermediates: BF3-Catalyzed Synthesis of β-Hydroperoxy-β-peroxylactones. J. Org. Chem. 2018, 83, 13427-13445) по следующей схеме:

Для осуществления данного способа требуется предварительное приготовление эфирного раствора пероксида водорода путем экстракции 30-40% водных растворов диэтиловым эфиром. Эти безводные растворы, обычно 1-2 молярные, следует считать по своей сути нестабильными. Также, поскольку BF3⋅Et2O представляет собой агрессивную, едкую дымящуюся жидкость, его использование требует строгого соблюдения правил техники безопасности. При использовании серной кислоты в данном способе выходы пероксидов невысокие.
Технической задачей настоящего изобретения является создание способа, позволяющего с использованием безопасных и дешевых реагентов получать замещенные 5-гидроперокси-5-алкил-1,2-диоксолан-3-оны с высоким выходом, а также расширить их ассортимент.
Поставленная техническая задача достигается предлагаемым способом получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов общей формулы (I):

где R=незамещенный или замещенный бензил, при этом заместителями могут быть Hal, низший алкил, О-алкил; незамещенный или замещенный алкил, при это заместителями могут быть CN, COOEt; R1=алкил С1-С3; R2=Н; R+R1=-(СН2)3-, путем взаимодействия соответствующих β-кетоэфиров общей формулы (II):
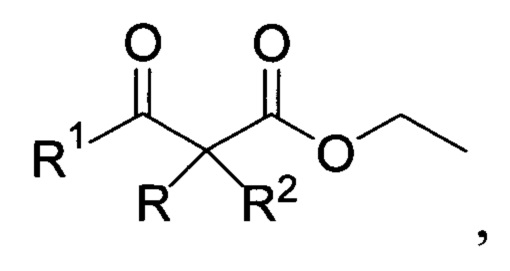
где R имеет вышеуказанные значения, с 30-40% водным раствором пероксида водорода в присутствии концентрированной серной кислоты в среде диэтилового эфира.
Процесс проводят с избытком водного раствора пероксида водорода и концентрированной серной кислоты, предпочтительно при мольном соотношении β-кетоэфир:пероксид водорода:серная кислота 1:9-10:9-10, при комнатной температуре и интенсивном перемешивании в течение 24 часов. В процессе используют 98% серную кислоту. Выход целевых продуктов достигает 99%.
Соединения общей формулы I, где R=4-МеС6Н4СН2, R1=Me, R2=Н и R=3-MeOC6H4CH2, R1=Me, R2=H, являются новыми и в литературе не описаны. Совокупное использование серной кислоты и водного раствора пероксида водорода позволило упростить процесс получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов за счет проведения процесса в более безопасных условиях, расширить ассортимент получаемых соединений с высокой селективностью и с высоким выходом. Изобретение соответствует критерию «новизна», так как в известной научно-технической и патентной литературе отсутствует полная совокупность признаков, характеризующих предлагаемое изобретение. Неочевидным являлось использование водного раствора пероксида водорода, поскольку в данной системе присутствует два нуклеофила: Н2О2 и Н2О, которые конкурируют за общий электрофильный карбонильный атом углерода исходного β-кетоэфира, повышая тем самым вероятность образования смеси пероксидных и непероксидных продуктов. Из уровня техники являлась неочевидной возможность использования совокупности водного раствора пероксида водорода и концентрированной серной кислоты, поскольку известно, что широко применяемые кислотно-катализируемые перегруппировки карбонильных соединений, такие как реакции Байера-Виллигера, Хока и Криге эффективно протекают под действием H2SO4 (Matsumoto, М., Kobayashi, K., & Hotta, Y. Acid-catalyzed oxidation of benzaldehydes to phenols by hydrogen peroxide. J. Org. Chem., 1984, 49(24), 4740-4741; Hamann, H.-J.; Liebscher, J.A Novel Outcome of the Hydroperoxide Rearrangement. J. Org. Chem., 2000, 65, 1873; Ogibin, Y.N., Terent'ev, A.O., Kutkin, A.V., & Nikishin, G.I.A rearrangement of 1-hydroperoxy-2-oxabicycloalkanes into lactones of ω-асу1оху-(ω-3)-hydroxyalkanoic acids related to the Criegee reaction. Tetrahedron Lett., 2002, 43(7), 1321-1324). Так как величина pKa серной кислоты уменьшается с ростом полярности растворителя, перенос H2SO4 из реакции, проводимой в органическом растворителе, в гетерогенную реакцию, в которой присутствует система вода-органический растворитель, повышает ее склонность катализировать вышеописанные перегруппировки карбонильных соединений. Кроме того, показано, что серная кислота в водной среде способна разлагать пероксиды, что понижает выход целевого продукта (RU 2472799 С1, 20.01.2013; RU 2494102 С1, 27.09.2013).
Как показали проведенные исследования, оптимальным и технологичным условием проведения реакции пероксидирования β-кетоэфиров пероксидом водорода в присутствии серной кислоты является ее осуществление в среде диэтилового эфира при мольном соотношении β-кетоэфир:пероксид водорода:серная кислота 1:9-10:9-10. Меньший избыток приводил к некоторому снижению выхода целевого продукта, поскольку затруднял превращение промежуточно образующегося гем-дигидропероксиэфира. Дальнейшее увеличение избытка пероксида водорода или серной кислоты не влияло на выход целевого продукта и являлось нецелесообразным. Замена эфирного раствора пероксида водорода на водный раствор Н2О2 влечет за собой уменьшение количества технологических стадий, а также -риска возникновения аварийных ситуаций.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем. Пример 1.
Синтез 4-бензил-5-гидроперокси-5-метил-1,2-диоксолан-3-она общей формулы I, где R=Bn, R1=Me, R2=Н
К раствору этил 2-бензил-3-оксобутаноата (0.220 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль этил 2-бензил-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-бензил-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получали белые кристаллы 4-бензил-5-гидроперокси-5-метил-1,2-диоксолан-3-она с выходом 98% (0.219 г, 0.98 ммоль), т.пл. 110-111°С. Rf=0.53 (РЕ:EtOAc=2:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 8.67 (s, 1Н), 7.22-7.40 (m, 5Н), 3.24-3.38 (т, 2Н), 3.05 (dd, J=13.8, 9.9 Hz, 1H), 1.20 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 175.0, 136.9, 129.2, 128.9, 127.3, 114.3, 51.3, 30.7, 18.4
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C11H12NaO5]+: 247.0577. Найдено: 247.0581.
Вычислено для C11H12NaO5: С: 58.93; Н: 5.39. Найдено: С: 59.03; Н: 5.02.
ИК (KBr): 3294, 2900, 1800, 1768, 1603, 1274, 1213, 1178, 1086, 844, 749, 698 cm-1.
Пример 2.
Синтез 4-(4-хлоробензил)-5-гидроперокси-5-метил-1,2-диоксолан-3-она общей формулы I, где R=4-ClC6H4CH2, R1=Me, R2=Н
К раствору этил 2-(4-хлоробензил)-3-оксобутаноата (0.254 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль этил 2-(4-хлоробензил)-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-(4-хлоробензил)-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получали белые кристаллы 4-(4-хлоробензил)-5-гидроперокси-5-метил-1,2-диоксолан-3-она с выходом 93% (0.239 г, 0.93 ммоль), т.пл. 107-108°С. Rf=0.29 (РЕ:EtOAc=2:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 8.79 (s, 1Н), 7.32 (d, J=8.4 Hz, 2Н), 7.25 (d, J=8.4 Hz, 2H), 3.35-3.18 (m, 2H), 3.03 (dd, J=13.7, 9.5 Hz, 1H), 1.23 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 174.7, 135.3, 133.2, 130.6, 129.1, 114.2, 51.1, 30.1, 18.5.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C11H11ClNaO5]+: 281.0187. Найдено: 281.0177.
Вычислено для C11H11ClO5: С: 51.08; Н: 4.29; Cl: 13.71. Найдено: С: 51.09; Н: 4.22; Cl: 13.75.
ИК (KBr): 3293, 2789, 2339, 1793, 1764, 1493, 1408, 1335, 1272, 1234, 1212, 1175, 1100, 1020, 925, 842, 825, 779, 626, 594, 552, 409 cm-1.
Пример 3.
Синтез 6а-гидроперокситетрагидроциклопента[с][1,2]диоксол-3(3aH)-она общей формулы I, где R+R1=-(СН2)3-, R2=Н
К раствору этил 2-оксоциклопентан-1-карбоксилата (0.316 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль этил 2-бензил-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-бензил-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получают 6а-гидроперокситетрагидроциклопента[с][1,2]диоксол-3(3aH)-он в виде бесцветного масла с выходом 93% (0.149 г, 0.93 ммоль). Rf=0.43 (РЕ:EtOAc=2:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 9.17 (s, 1Н), 3.56 (dd, J=10.7, 4.4 Hz, 1H), 2.37-1.99 (m, 6H).
13C ЯМР (75.48 МГц, CDCl3) δ 177.0, 126.1, 49.3, 34.9, 29.0, 25.5.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C6H8NaO5]+: 183.0264. Найдено: 183.0256.
Вычислено для C6H8O5: С: 45.01; Н: 5.04. Найдено: С: 45.14; Н: 5.37.
ИК(KBr): 3236, 2975, 1796, 1738, 1439, 1331, 1207, 1115, 944, 807, 661 cm-1.
Пример 4.
Синтез 5-гидроперокси-5-пропил-1,2-диоксолан-3-она общей формулы I, где R=Н, R1=Pr, R2=Н
К раствору этил 3-оксогексаноата (0.158 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.97 г, 0.872 мл, 10 ммоль H2O2/1 ммоль этил 2-бензил-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-бензил-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получали 5-гидроперокси-5-пропил-1,2-диоксолан-3-он в виде бесцветного масла с выходом 96% (0.155 г, 0.96 ммоль). Rf=0.46 (РЕ:EtOAc=4:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 8.85 (s, 1H), 3.19 (d, J=17.8 Hz, 1H), 3.05 (d, J=17.8 Hz, 1H), 2.06-1.92 (m, 1H), 1.87-1.73 (m, 1H), 1.61-1.34 (m, 2H), 0.98 (t, J=7.4 Hz, 3H).
13С ЯМР (75.48 МГц, CDCl3) δ 173.6, 115.9,38.2, 33.9, 17.7, 14.0.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C6H10NaO5]+: 185.0420. Найдено: 185.0423.
Вычислено для C6H10O5: С: 44.45; Н: 6.22. Найдено: С: 44.35; Н: 6.31.
ИК (KBr): 2970, 2940, 2879, 1804, 1467, 1404, 1329, 1203, 1121, 972, 833, 540 cm-1.
Пример 5.
Синтез 4-бензил-5-гидроперокси-5-пропил-1,2-диоксолан-3-она общей формулы I, где R=Bn, R1=Pr, R2=Н
К раствору этил 2-бензил-3-оксогексаноата (0.248 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2 /1 ммоль этил 2-бензил-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-бензил-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Продукт 4-бензил-5-гидроперокси-5-пропил-1,2-диоксолан-3-он выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат (5:1). Получали 4-бензил-5-гидроперокси-5-пропил-1,2-диоксолан-3-он в виде бесцветного масла с выходом 82% (0.197 г, 0.78 ммоль). Rf=0.61 (РЕ:EtOAc=5:1).
1H ЯМР (300.13 МГц, CDCl3) δ 8.53 (s, 1Н), 7.38-7.27 (m, 5H), 3.42-3.25 (m, 2H), 3.07 (dd, J=14.2, 9.1 Hz, 1H), 1.64-1.53 (m, 1H), 1.34-1.05 (m, 3H), 0.72 (t, J=7.0 Hz, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 175.2, 137.2, 129.2, 128.9, 127.3, 116.4, 48.6, 33.7,30.9, 17.0, 14.0.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C13H16NaO5]+: 275.0890. Найдено: 275.0894.
Вычислено для C13H16O5: С: 61.90; Н: 6.39. Найдено: С: 61.92; Н: 6.28.
ИК (KBr): 3286, 3033, 2968, 2871, 1788, 1758, 1458, 1418, 1337, 1268, 1201, 1169, 1121, 1085, 1029, 941, 934, 840, 749, 696, 603 cm-1.
Пример 6.
Синтез 5-гидроперокси-5-метил-4-(4-метилбензил)-1,2-диоксан-3-она общей формулы I, где R=4-MeC6H4CH2, R1=Me, R2=Н
К раствору этил 2-(4-метилбензил)-3-оксобутаноата (0.234 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль этил 2-(4-метилбензил)-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-(4-метилбензил)-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получали белые кристаллы 5-гидроперокси-5-метил-4-(4-метилбензил)-1,2-диоксан-3-она с выходом 99% (0.236 г, 0.99 ммоль), т.пл. 100-102°С. Rf=0.48 (РЕ:EtOAc=5:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 8.70 (s, 1H), 7.22-7.11 (m, 4H), 3.35-3.19 (m, 2H), 3.01 (dd, J=14.3, 10.3 Hz, 1H), 2.34 (s, 3H), 1.22 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 175.0, 136.9, 133.7, 129.6, 129.1, 114.3, 51.4, 30.2,21.9, 18.4.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C12H14NaO5]+: 261.0733. Найдено: 261.0709.
Вычислено для C12H14O5: С: 60.50; Н: 5.92. Найдено: С: 60.48; Н: 5.93.
Пример 7.
Синтез 5-гидроперокси-4-(3-метоксибензил)-5-метил-1,2-диоксолан-3-она общей формулы I, где R=3-MeOC6H4CH2, R1=Me, R2=Н
К раствору этил 2-(3-метоксибензил)-3-оксобутаноата (0.250 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль этил 2-(3-метоксибензил)-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-(3-метоксибензил)-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Получали 5-гидроперокси-4-(3-метоксибензил)-5-метил-1,2-диоксолан-3-она в виде желтого масла с выходом 64% (0.163 г, 0.64 ммоль). Rf=0.34 (РЕ:EtOAc=5:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 9.04 (s, 1Н), 7.31-7.23 (m, 1H), 6.96-6.77 (m, 1H), 3.83 (s, 3H), 3.38-3.22 (m, 2H), 3.04 (dd, J=14.3, 10.3 Hz, 1H), 1.26 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 175.0, 160.0, 133.7, 138.6, 129.9, 121.5, 115.1, 112.6, 55.4, 51.2, 30.7, 18.5.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C12H14NaO6]+: 277.0683. Найдено: 277.0684.
Вычислено для C12H14O6: С: 56.69; Н: 5.55. Найдено: С: 56.70; Н: 5.52.
Пример 8.
Синтез 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаннитрила общей формулы I, где R=CH2CH2CN, R1=Me, R2=H
К раствору этил 2-ацетил-4-цианобутаноата (0.183 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 30% водный раствор H2O2 (1.133 г, 1.019 мл, 10 ммоль H2O2/1 ммоль этил 2-ацетил-4-цианобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-ацетил-4-цианобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Продукт 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаннитрил выделяли хроматографией на SiO2, с использованием элюента петролейный эфир -этилацетат (5:1). Получали белые кристаллы 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаннитрила с выходом 87% (0.162 г, 0.87 ммоль), т.пл. 42-43°С. Rf=0.28 (PE:EtOAc=5:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 9.24 (s, 1Н), 3.25 (dd, J=8.7, 5.8 Hz, 1H), 2.88-2.65 (m, 2H), 2.35-2.23 (m, 1H), 2.14-2.00 (m, 1H), 1.67 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) 8 174.7, 118.6, 114.1, 47.3, 20.8, 18.2, 14.6. Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C7H9NNaO5]+: 210.0373. Найдено: 210.0378.
Вычислено для C13H16O5: С, 44.92; Н, 4.85; N, 7.48. Найдено: С, 45.03; Н, 5.02; N, 7.49.
ИК (KBr): 3397, 2340, 2251, 1800, 1719, 1586, 1425, 1384, 1242, 1176, 1127, 1086, 862, 838, 658 cm-1.
Пример 9.
Синтез этил 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаноата общей формулы I, где R=CH2CH2COOEt, R1=Me, R2=Н
К раствору диэтил 2-ацетилпентандионата (0.230 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 35% водный раствор Н2О2 (0.971 г, 0.872 мл, 10 ммоль Н2О2/1 ммоль диэтил 2-ацетилпентандионата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль диэтил 2-ацетилпентандионата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Продукт этил 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаноат выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат (5:1). Получали этил 3-(3-гидроперокси-3-метил-5-оксо-1,2-диоксолан-4-ил)пропаноат в виде бесцветного масла с выходом 55% (0.128 г, 0.55 ммоль). Rf=0.57 (РЕ:EtOAc=2:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 9.09 (s, 1H), 4.18 (q, J=7.1 Hz, 2Н), 3.30 (dd, J=8.4, 5.8 Hz, 1H), 2.75-2.59 (m, 2H), 2.22-2.02 (m, 2H), 1.67 (s, 3H), 1.29 (t, J=7.1 Hz, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 175.5, 173.1, 114.5, 61.1, 47.7, 30.2, 19.6, 18.2, 14.3.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C9H14NaO7]+: 257.0632. Найдено: 257.0633.
Вычислено для С9Н14О5: С, 46.16; Н, 6.03. Найдено: С, 46.11; Н, 6.08.
ИК (KBr): 3346, 2987, 1801, 1714, 1382, 1198, 1086, 1026, 858, 839, 582 cm-1.
Пример 10.
Синтез 4-(4-бромобензил)-5-гидроперокси-5-метил-1,2-диоксолан-3-она общей формулы I, где R=4-BrC6H4CH2, R1=Me, R2=Н
К раствору этил 2-(4-бромобензил)-3-оксобутаноата (0.299 г, 1 ммоль) в Et2O (5 мл) при интенсивном перемешивании прибавляли 40%) водный раствор Н2О2 (0.850 г, 0737 мл, 10 ммоль H2O2/1 ммоль этил 2-(4-бромобензил)-3-оксобутаноата), затем реакционную массу охлаждали на ледяной бане до 0°С. Прибавляли по каплям 98% H2SO4 (1.0 г, 0.54 мл, 10 ммоль H2SO4/1 ммоль этил 2-(4-бромобензил)-3-оксобутаноата) во избежание нагрева реакционной смеси, после чего охлаждение снимали. Интенсивно перемешивали при 20-25°С в течение 24 часов. После добавляли CHCl3 (30 мл), органический слой промывали водой (5 мл), затем 5% водным раствором NaHCO3 (2×5 мл), снова водой (5 мл). Органический слой сушили над Na2SO4, фильтровали и удаляли растворитель в вакууме водоструйного насоса. Продукт 4-(4-бромобензил)-5-гидроперокси-5-метил-1,2-диоксолан-3-он выделяли хроматографией на SiO2, с использованием элюента петролейный эфир - этилацетат (5:1). Получают белые кристаллы 4-(4-бромобензил)-5-гидроперокси-5-метил-1,2-диоксолан-3-она с выходом 85% (0.257 г, 0.85 ммоль), т.пл. 118-119°С. Rf=0.22 (РЕ:EtOAc=5:1).
1Н ЯМР (300.13 МГц, CDCl3) δ 8.59 (s, 1Н), 7.47 (d, J=8.3 Hz, 2Н), 7.20 (d, J=8.2 Hz, 2H), 3.33-3.17 (m, 2H), 3.01 (dd, J=14.2, 10.0 Hz, 1H), 1.24 (s, 3H).
13C ЯМР (75.48 МГц, CDCl3) δ 174.6, 135.8, 132.1, 131.0, 121.3, 114.1, 51.0, 30.2, 18.6.
Масс-спектр высокого разрешения (ESI) m/z [M+Na]+. Рассчитано для [C11H11BrNaO5]+: 324.9682. Найдено: 324.9675.
Вычислено для C11H11BrO5: С: 43.59; Н: 3.66; Br: 26.36. Найдено: С: 43.61; Н: 3.64; Cl: 26.17.
ИК (KBr): 3285, 2797, 1790, 1766, 1489, 1407, 1234, 1212, 1176, 1091, 1072, 1017, 926, 841, 822, 653, 552 cm-1.
Техническим результатом предлагаемого изобретения является повышение безопасности процесса и его упрощение, расширение ассортимента получаемых соединений и повышение выхода целевых продуктов до 99%, а также удешевление процесса благодаря широкой доступности серной кислоты и водного раствора пероксида водорода.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2494102C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО-[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2472799C1 |
| Способ получения N-замещенных мостиковых 1,2,4-диоксазолидинов | 2023 |
|
RU2804396C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| Замещенные 4-нитропиразолин-5-оны, способ их получения и их применение в качестве фунгицидных средств | 2019 |
|
RU2709732C1 |
| Замещенные 1,5-диметил-6,7,8-триоксабицикло[3.2.1]октаны, применение их в качестве фунгицидных средств и фунгицидные композиции на их основе | 2016 |
|
RU2623431C1 |
| Применение замещенных 2,3,5,6-тетраоксабицикло[2.2.1]гептанов в качестве фунгицидных средств и фунгицидная композиция на их основе | 2016 |
|
RU2627309C1 |
| Электрохимический способ получения производных тетрагидрохинолина, применение их в качестве фунгицидных средств и фунгицидные композиции на их основе | 2022 |
|
RU2784323C1 |
| Способ получения трициклических органических дипероксидов | 2020 |
|
RU2752957C1 |
| Способ получения ацилоксизамещенных барбитуровых кислот | 2017 |
|
RU2649146C1 |
Изобретение относится к способу получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов общей формулы

где R = незамещенный или замещенный бензил, при этом заместителями могут быть Hal, низший алкил, О-алкил, незамещенный или замещенный алкил, при этом заместителями могут быть CN, COOEt; R1 = алкил С1-С3; R2 = Н; R+R1= -(СН2)3-, заключающемуся в том, что соответствующие β-кетоэфиры общей формулы

где R, R1 и R2 имеют вышеуказанные значения, подвергают взаимодействию с 30-40% водным раствором пероксида водорода в среде диэтилового эфира в присутствии концентрированной серной кислоты в качестве катализатора, и процесс проводят предпочтительно при мольном соотношении β-кетоэфир : пероксид водорода : серная кислота 1 : 9-10 : 9-10. Технический результат – разработан способ получения 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов с высоким выходом, которые могут найти применение в медицине для получения лекарственных препаратов, а также в качестве инициаторов свободно-радикальной полимеризации непредельных мономеров в крупнотоннажном производстве. 1 з.п. ф-лы, 10 пр.
1. Способ получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов общей формулы

где R = незамещенный или замещенный бензил, при этом заместителями могут быть Hal, низший алкил, О-алкил; незамещенный или замещенный алкил, при этом заместителями могут быть CN, COOEt; R1 = алкил С1-С3; R2 = Н; R+R1 = -(СН2)3-, заключающийся в том, что соответствующие β-кетоэфиры общей формулы

где R, R1 и R2 имеют вышеуказанные значения, подвергают взаимодействию с 30-40% водным раствором пероксида водорода в среде диэтилового эфира в присутствии концентрированной серной кислоты в качестве катализатора.
2. Способ получения замещенных 5-гидроперокси-5-алкил-1,2-диоксолан-3-онов по п. 1, отличающийся тем, что процесс проводят при мольном соотношении β-кетоэфир : пероксид водорода : серная кислота 1 : 9-10 : 9-10.
| VERA A | |||
| VIL' ET AL., J.Org.Chem., 83, 2018, pp.13427-13445 | |||
| VERA A | |||
| VIL' ET AL., Chemistry - A European Journal 25(63), 2019, рр | |||
| Способ приготовления жидких органопрепаратов | 1926 |
|
SU14460A1 |
| VERA A | |||
| VIL' ET AL., Angew | |||
| Chem | |||
| Int | |||
| Ed., 57, 2018, pp | |||
| СКОРОДЕЙСТВУЮЩИЙ МНОГОКРАТНЫЙ АСИНХРОННЫЙ ТЕЛЕГРАФНЫЙ АППАРАТ | 1923 |
|
SU3372A1 |
| US 3639425 A1, 01.02.1972 | |||
| ЕНИ1 | 0 |
|
SU407882A1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ГИДРОПЕРОКСИ-3,5-ДИМЕТИЛ-1,2-ДИОКСОЛАН-3-ОЛА | 2012 |
|
RU2473548C1 |
Авторы
Даты
2021-08-11—Публикация
2020-12-14—Подача