Область изобретения
Настоящее изобретение относится к гербицидной композиции и т.п.
Предпосылки изобретения
В настоящее время продается и используется огромное количество гербицидов (например, см. не-патентную литературу 1).
Перечень ссылочных документов
Не-патентная литература
[Не-патентная литература 1] The Pesticide Manual, Fifteenth Edition (2009), British Crop Production Council (ISBN: 978-1-901396-18-8)
Краткое описание изобретения
Целью настоящего изобретения является обеспечение гербицидной композиции, обладающей отличным действием в борьбе с сорняками.
Авторами настоящего изобретения было обнаружено, что гербицидная композиция, содержащая циклогексаноновое соединение, представленное следующей формулой (I), и специальное соединение, обладает отличным эффектом в борьбе с сорняками.
Таким образом, настоящее изобретение представляет собой следующее.
[1] Гербицидная композиция, содержащая циклогексаноновое соединение, представленное формулой (I), и по меньшей мере одно соединение, выбранное из следующей Группы A;
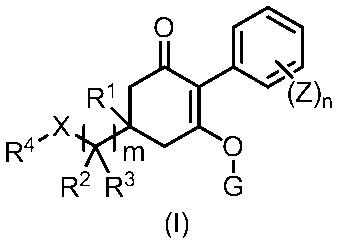
в формуле,
m имеет значение 1, 2, или 3,
n представляет собой целое число, имеющее значение от 1 до 5,
X представляет собой CH2, O, NR9, S, S(O) или S(O)2,
R1 представляет собой водород или метильную группу,
R2 и R3 каждый независимо представляют собой водород, C1-6 алкильную группу, C1-6 галогеналкильную группу, C3-8 циклоалкильную группу, C3-8 галогенциклоалкильную группу, (C1-6 алкил)C3-8 циклоалкильную группу, (C3-8 циклоалкил)C1-6 алкильную группу, (C3-8 циклоалкил)C3-8 циклоалкильную группу, (C3-8 галогенциклоалкил)C1-6 алкильную группу, {(C1-6 алкил) C3-8 циклоалкил}C1-6 алкильную группу, или
R2 и R3 связаны с образованием C2-5 алкиленовой цепи, или R2 и R3 вместе представляют собой C1-3 алкилиденовую группу, необязательно содержащую галоген, и, когда m имеет значение 2 или 3, две или три группы R2 являются одинаковыми или отличными друг от друга, и две или три группы R3 являются одинаковыми или отличными друг от друга,
R4 представляет собой C6-10 арильную группу или 5- или 6-членную гетероарильную группу,
где C6-10 арильная группа и 5- или 6-членная гетероарильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, (C1-6 алкил)аминогруппу, (C1-6 алкил)(C1-6 алкил)аминогруппу, бензоиламиногруппу, аминокарбонильную группу, (C1-6 алкил)аминокарбонильную группу, (C1-6 алкил)(C1-6 алкил)аминокарбонильную группу, пентафтортиогруппу, C1-6 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу, C6-10 арильную группу, C6-10 арилоксигруппу, C1-6 алкилсульфинильную группу, C1-6 алкилсульфонильную группу, гидроксильную группу, (C1-6 алкил)карбонильную группу, гидроксикарбонильную группу, (C1-6 алкокси)карбонильную группу и (C6-10 арил)C1-6 алкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где (C1-6 алкил)аминогруппа, (C1-6 алкил)(C1-6 алкил)аминогруппа, бензоиламиногруппа, (C1-6 алкил)аминокарбонильная группа, (C1-6 алкил)(C1-6 алкил)аминокарбонильная группа, C1-6 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-6 алкоксигруппа, C1-6 алкилтиогруппа, C3-6 алкенилоксигруппа, C3-6 алкинилоксигруппа, C6-10 арильная группа, C6-10 арилоксигруппа, C1-6 алкилсульфинильная группа, C1-6 алкилсульфонильная группа, (C1-6 алкокси)карбонильная группа и (C6-10 арил)C1-6 алкоксигруппа необязательно содержат один или несколько галогенов или C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы являются одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:
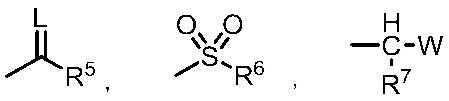
в формулах:
L представляет собой кислород или серу,
R5 представляет собой C1-6 алкильную группу, C3-8 циклоалкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C6-10 арильную группу, (C6-10 арил)C1-6 алкильную группу, C1-6 алкоксигруппу, C3-8 циклоалкоксигруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу, C6-10 арилоксигруппу, (C6-10 арил)C1-6 алкоксигруппу, (C1-6 алкил)(C1-6 алкил)аминогруппу, (C3-6 алкенил)(C3-6 алкенил)аминогруппу, (C1-6 алкил)(C6-10 арил)аминогруппу или 5- или 6-членную гетероарильную группу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где все из указанных C3-8 циклоалкильной группы, C6-10 арильной группы, арильной части (C6-10 арил)C1-6 алкильной группы, C3-8 циклоалкоксигруппы, C6-10 арилоксигруппы, арильной части (C6-10 арил)C1-6 алкоксигруппы, арильной части (C1-6 алкил)(C6-10 арил)аминогруппы и 5- или 6-членной гетероарильной группы необязательно содержат одну или несколько C1-6 алкильных групп, и, когда присутствуют две или более C1-6 алкильные группы, эти алкильные группы являются одинаковыми или отличными друг от друга,
R6 представляет собой C1-6 алкильную группу, C6-10 арильную группу или (C1-6 алкил)(C1-6 алкил)аминогруппу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где C6-10 арильная группа необязательно содержит одну или несколько C1-6 алкильных групп, и, когда присутствуют две или более C1-6 алкильные группы, эти C1-6 алкильные группы являются одинаковыми или отличными друг от друга,
R7 представляет собой водород или C1-6 алкильную группу,
W представляет собой C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C1-6 алкилсульфинильную группу или C1-6 алкилсульфонильную группу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга,
R9 представляет собой водород, C1-6 алкильную группу, C6-10 арильную группу, C6-10 арилтиогруппу, C6-10 арилсульфинильную группу или C6-10 арилсульфонильную группу,
где C1-6 алкильная группа необязательно содержит один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга и
где C6-10 арильная группа, C6-10 арилтиогруппа, C6-10 арилсульфинильная группа и C6-10 арилсульфонильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, цианогруппу, нитрогруппу и аминогруппу,
Z представляет собой галоген, цианогруппу, нитрогруппу, C1-6 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-6 алкоксигруппу, (C1-6 алкил)карбонильную группу, C1-6 алкилтиогруппу, C6-10 арилоксигруппу, 5- или 6-членную гетероарилоксигруппу, C3-8 циклоалкильную группу, C6-10 арильную группу или 5- или 6-членную гетероарильную группу,
где C1-6 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-6 алкоксигруппа, (C1-6 алкил)карбонильная группа и C1-6 алкилтиогруппа необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где C6-10 арильная группа, 5- или 6-членная гетероарильная группа, C6-10 арилоксигруппа и 5- или 6-членная гетероарилоксигруппа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, C1-6 алкильную группу и C1-6 галогеналкильную группу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где C3-8 циклоалкильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей галоген и C1-6 алкильную группу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
когда n представляет собой целое число, равное или больше 2, Z являются одинаковыми или отличными друг от друга,
Группа A: состоящая из беноксакора, клоквинтосет-мексила, циометринила, дихлормида, фенхлоразол-этила, фенхлорима, флуразола, фурилазола, мефенпир-диэтила, оксабетринила, изоксадифен-этила, ципросульфамида, флуксофенима, 1,8-нафталевого ангидрида и AD-67.
[2] Гербицидная композиция в соответствии с пунктом [1], где n представляет собой целое число, имеющее значение от 1 до 3,
R1 представляет собой водород,
R2 и R3, каждый независимо, представляют собой водород, C1-3 алкильную группу, или R2 и R3 связаны с образованием C2-5 алкиленовой цепи, и, когда m имеет значение 2 или 3, две или три группы R2 являются одинаковыми или отличными друг от друга, и две или три группы R3 являются одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, C1-3 алкильную группу, гидроксильную группу, (C1-3 алкил)карбонильную группу, (C1-3 алкокси)карбонильную группу, C1-3 алкоксигруппу, C1-3 галогеналкильную группу, C1-3 алкилтиогруппу, C1-3 галогеналкилтиогруппу, цианогруппу, нитрогруппу, аминогруппу, пентафтортиогруппу, бензоиламиногруппу и C1-3 галогеналкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей C1-3 алкильную группу и C6-10 арильную группу, при этом C1-3 алкильная группа и C6-10 арильная группа необязательно содержат один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы являются одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:
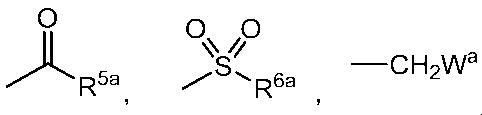
в формулах:
R5a представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C3-6 алкенилоксигруппу или C6-10 арилоксигруппу,
R6a представляет собой C1-6 алкильную группу, и
Wa представляет собой C1-3 алкоксигруппу,
R9 представляет собой водород, C1-6 алкильную группу или C6-10 арилсульфонильную группу, где C1-6 алкильная группа необязательно содержит один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и C6-10 арилсульфонильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей галоген и нитрогруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга,
Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу,
где C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-3 алкоксигруппа, фенильная группа и 5- или 6-членная гетероарилоксигруппа необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга.
[3] Гербицидная композиция в соответствии с пунктом [2], в которой
R2 и R3, каждый независимо, представляют собой водород, метильную группу, этильную группу, или R2 и R3 связаны с образованием этиленовой цепи, где две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа содержат один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, метоксигруппу, нитрогруппу, аминогруппу, цианогруппу, гидроксильную группу, ацетильную группу, метоксикарбонильную группу, пентафтортиогруппу, пентафторэтильную группу, дифторэтильную группу, гептафторизопропильную группу, трифторметилтиогруппу, бензоиламиногруппу, трифторметоксигруппу и трифторметильную группу, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей метильную группу и фенильную группу, и
где фенильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор и трифторметильную группу,
G представляет собой водород, ацетильную группу, пропионильную группу, бутилкарбонильную группу, бензоильную группу, метилсульфонильную группу, метоксикарбонильную группу, этоксикарбонильную группу, аллилоксикарбонильную группу, феноксикарбонильную группу, метоксиметильную группу или этоксиметильную группу,
R9 представляет собой водород, 2-нитрофенилсульфонильную группу или метильную группу, и
Z представляет собой метильную группу, этильную группу, фенильную группу, винильную группу, циклопропильную группу, нитрогруппу, фтор, хлор, бром, метоксигруппу, трифторметильную группу, 5-трифторметил-2-хлорпиридилоксигруппу или этинильную группу.
[4] Гербицидная композиция в соответствии с любым из пунктов [1]-[3], в которой G представляет собой водород.
[5] Гербицид, содержащий гербицидную композицию в соответствии с любым из пунктов [1]-[4].
[6] Способ борьбы с сорняками, включающий нанесение эффективных количеств циклогексанонового соединения, представленного формулой (I), и по меньшей мере одного соединения, выбранного из Группы A, указанной ниже, на сорняки или почву, где растут сорняки.
Формула (I):
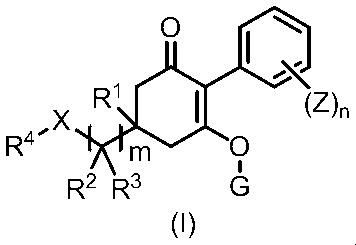
в формуле, m, n, X, R1, R2, R3, R4, G и Z каждый имеют значение, определенное в пункте [1].
Группа A представляет собой такую же группу, которая определена в пункте [1].
[7] Применение гербицидной композиции, содержащей соединение, представленное формулой (I), и по меньшей мере одно соединение, выбранное из Группы A, для борьбы с сорняками.
Формула (I):

в формуле, m, n, X, R1, R2, R3, R4, G и Z каждый имеют значение, определенное в пункте [1].
Группа A представляет собой такую же группу, которая определена в пункте [1].
Описание вариантов осуществления изобретения
Гербицидная композиция (далее указана как гербицидная композиция в соответствии с настоящим изобретением) по настоящему изобретению, представленная формулой (I):

в формуле, m, n, X, R1, R2, R3, R4, G и Z каждый имеют значение, определенное в пункте [1].
Группа A представляет собой такую же группу, которая определена в пункте [1].
Заместители циклогексанонового соединения, представленного формулой (I), которое является эффективным компонентом композиции по настоящему изобретению, описаны ниже.
C1-6 алкильная группа означает алкильную группу, содержащую от 1 до 6 атомов углерода, и примеры такой группы включают, например, метильную группу, этильную группу, н-пропильную группу, изопропильную группу, н-бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, н-пентильную группу, втор-пентильную группу, изопентильную группу, неопентильную группу, н-гексильную группу и изогексильную группу.
C1-6 галогеналкильная группа означает C1-6 алкильную группу, замещенную галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, трифторметильную группу, хлорметильную группу, 2,2,2-трихлорэтильную группу, 2,2,2-трифторэтильную группу и 2,2,2-трифтор-1,1-дихлорэтильную группу.
C3-8 циклоалкильная группа означает циклоалкильную группу, содержащую от 3 до 8 атомов углерода, и примеры такой группы включают, например, циклопропильную группу, циклопентильную группу и циклогексильную группу.
C3-8 галогенциклоалкильная группа означает циклоалкильную группу, содержащую от 3 до 8 атомов углерода, замещенную галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, 2-хлорциклопропильную группу и 4,4-дифторциклогексильную группу.
(C1-6 алкил)C3-8 циклоалкильная группа означает циклоалкильную группу, содержащую от 3 до 8 атомов углерода, замещенную алкильной группой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, этилциклопропильную группу, изобутилциклопропильную группу, 3-метилциклопентильную группу и 4-метилциклогексильную группу.
(C3-8 циклоалкил)C1-6 алкильная группа означает алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную циклоалкильной группой, содержащей от 3 до 8 атомов углерода, и примеры такой группы включают, например, циклопропилметильную группу и циклопентилметильную группу.
(C3-8 циклоалкил)C3-8 циклоалкильная группа означает циклоалкильную группу, содержащую от 3 до 8 атомов углерода, замещенную циклоалкильной группой, содержащей от 3 до 8 атомов углерода, и примеры такой группы включают, например, 2-циклопропилциклопропильную группу и 3-циклопропилциклопентильную группу.
(C3-8 галогенциклоалкил)C1-6 алкильная группа означает алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную циклоалкильной группой, которая содержит от 3 до 8 атомов углерода и замещена галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, 2-хлорциклопропилметильную группу и 3-хлорциклопентилэтильную группу.
{(C1-6 алкил) C3-8 циклоалкил}C1-6 алкильная группа означает алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную циклоалкильной группой, которая содержит от 3 до 8 атомов углерода, которая замещена алкильной группой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, 2-метилциклопропилметильную группу и 3-метилциклопентилметильную группу.
C2-5 алкиленовая цепь означает алкиленовую цепь, содержащую от 2 до 5 атомов углерода, и примеры такой группы включают, например, этиленовую цепь, пропиленовую цепь (триметиленовую цепь), бутиленовую цепь (тетраметиленовую цепь) и пентиленовую цепь (пентаметиленовую цепь).
Когда R2 и R3 связаны с образованием алкилена, содержащего от 2 до 6 атомов углерода, R2 и R3 представляют собой циклоалкильную группу, содержащую от 3 до 6 атомов углерода, вместе с углеродом, с которым R2 и R3 связаны. Например, когда этилен образован путем связывания R2 и R3, R2 и R3 представляют собой циклопропил, вместе с углеродом, с которым R2 и R3 связаны.
Когда R2b и R3b связаны с образованием алкилена, содержащего от 2 до 6 атомов углерода, R2b и R3b представляют собой циклоалкильную группу, содержащую от 3 до 6 атомов углерода, вместе с углеродом, с которым R2b и R3b связаны. Например, когда этилен образован путем связывания R2b и R3b, R2b и R3b представляют собой циклопропил, вместе с углеродом, с которым R2b и R3b связаны.
C1-3 алкилиденовая группа означает алкилиденовую группу, содержащую от 1 до 3 атомов углерода, и примеры такой группы включают, например, метилиден, этилиден и изопропилиден.
Примеры галогена включают, например, фтор, хлор, бром и иод.
C2-6 алкенильная группа означает алкенильную группу, содержащую от 2 до 6 атомов углерода, и примеры такой группы включают, например, винильную группу, аллильную группу, 1-бутен-3-ильную группу и 3-бутен-1-ильную группу.
C2-6 алкинильная группа означает алкинильную группу, содержащую от 2 до 6 атомов углерода, и примеры такой группы включают, например, этинильную группу, пропаргильную группу и 2-бутинильную группу.
C1-6 алкоксигруппа означает алкоксигруппу, содержащую от 1 до 6 атомов углерода, и примеры такой группы включают, например, метоксигруппу, этоксигруппу, н-пропилоксигруппу, изопропилоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, н-пентилоксигруппу, втор-пентилоксигруппу, изопентилоксигруппу, неопентилоксигруппу, н-гексилоксигруппу и изогексилоксигруппу.
C1-6 алкилтиогруппа означает алкилтиогруппу, содержащую от 1 до 6 атомов углерода, и примеры такой группы включают, например, метилтиогруппу, этилтиогруппу и изопропилтиогруппу.
C3-6 алкенилоксигруппа означает алкенилоксигруппу, содержащую от 3 до 6 атомов углерода, и примеры такой группы включают, например, аллилоксигруппу и 2-бутенилоксигруппу.
C3-6 алкинилоксигруппа означает алкинилоксигруппу, содержащую от 3 до 6 атомов углерода, и примеры такой группы включают, например, пропаргилоксигруппу и 2-бутинилоксигруппу.
(C6-10 арил)C1-6 алкоксигруппа означает алкоксигруппу, содержащую от 1 до 6 атомов углерода, замещенную арильной группой, содержащей от 6 до 10 атомов углерода, и примеры такой группы включают, например, бензилоксигруппу и фенетилоксигруппу.
(C6-10 арил)C1-6 алкильная группа означает алкильную группу, содержащую от 1 до 6 атомов углерода, замещенную арильной группой, содержащей от 6 до 10 атомов углерода, и примеры такой группы включают, например, бензильную группу и фенэтильную группу.
C3-8 циклоалкоксигруппа означает циклоалкоксигруппу, содержащую от 3 до 8 атомов углерода, и примеры такой группы включают, например, циклопропилоксигруппу, циклопентилоксигруппу и циклогексилоксигруппу.
(C1-6 алкил)(C1-6 алкил)аминогруппа означает аминогруппу, замещенную одинаковыми или отличными друг от друга двумя алкильными группами, содержащими от 1 до 6 атомов углерода, и примеры такой группы включают, например, диметиламиногруппу, диэтиламиногруппу и этилметиламиногруппу.
(C3-6 алкенил)(C3-6 алкенил)аминогруппа означает аминогруппу, замещенную одинаковыми или отличными друг от друга двумя алкенильными группами, содержащими от 3 до 6 атомов углерода, и примеры такой группы включают, например, диаллиламиногруппу и ди(3-бутенил)аминогруппу.
(C1-6 алкил)(C6-10 арил)аминогруппа означает аминогруппу, которая замещена алкильной группой, содержащей от 1 до 6 атомов углерода, и C6-10 арильной группой, и примеры такой группы включают, например, метилфениламиногруппу и этилфениламиногруппу.
C1-6 алкилсульфинильная группа означает алкилсульфинильную группу, содержащую от 1 до 6 атомов углерода, и примеры такой группы включают, например, метилсульфинильную группу, этилсульфинильную группу и изопропилсульфинильную группу.
C1-6 алкилсульфонильная группа означает алкилсульфонильную группу, содержащую от 1 до 6 атомов углерода, и примеры такой группы включают, например, метилсульфонильную группу, этилсульфонильную группу и изопропилсульфонильную группу.
C6-10 арильная группа означает арильную группу, содержащую от 6 до 10 атомов углерода, и примеры такой группы включают, например, фенильную группу и нафтильную группу.
5- или 6-членная гетероарильная группа означает ароматическую 5- или 6-членную гетероциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, и примеры такой группы включают, например, 2-пиридильную группу, 4-пиридильную группу, 3-фурильную группу, пиримидинильную группу, 3-тиенильную группу и 1-пиразолильную группу.
C6-10 арилоксигруппа означает арилоксигруппу, содержащую от 6 до 10 атомов углерода, и примеры такой группы включают, например, феноксигруппу и нафтилоксигруппу.
5- или 6-членная гетероарилоксигруппа означает ароматическую 5- или 6-членную гетероциклическую оксигруппу, содержащую от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, и примеры такой группы включают, например, 2-пиридилоксигруппу и 3-пиридилоксигруппу.
(C1-6 алкокси)карбонильная группа означает карбонильную группу, замещенную алкоксигруппой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, метоксикарбонильную группу и этоксикарбонильную группу.
(C1-6 алкил)аминогруппа означает аминогруппу, замещенную алкильной группой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, монометиламиногруппу и моноэтиламиногруппу.
(C1-6 алкил)аминокарбонильная группа означает аминокарбонильную группу, замещенную алкильной группой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, монометиламинокарбонильную группу и моноэтиламинокарбонильную группу.
(C1-6 алкил)(C1-6 алкил)аминокарбонильная группа означает аминокарбонильную группу, замещенную одинаковыми или отличными друг от друга двумя алкильными группами, содержащими от 1 до 6 атомов углерода, и примеры такой группы включают, например, диметиламинокарбонильную группу, диэтиламинокарбонильную группу и этилметиламинокарбонильную группу.
(C1-6 алкил)карбонильная группа означает карбонильную группу, замещенную алкильной группой, содержащей от 1 до 6 атомов углерода, и примеры такой группы включают, например, метилкарбонильную группу, этилкарбонильную группу и изопропилкарбонильную группу.
C6-10 арилтиогруппа означает арилтиогруппу, содержащую от 6 до 10 атомов углерода, и примеры такой группы включают, например, фенилтиогруппу и нафтилтиогруппу.
C1-3 алкильная группа означает алкильную группу, содержащую от 1 до 3 атомов углерода, и примеры такой группы включают, например, метильную группу, этильную группу, н-пропильную группу и изопропильную группу.
C1-3 алкоксигруппа означает алкоксигруппу, содержащую от 1 до 3 атомов углерода, и примеры такой группы включают, например, метоксигруппу, этоксигруппу, н-пропилоксигруппу и изопропилоксигруппу.
C1-3 галогеналкильная группа означает C1-3 алкильную группу, замещенную галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, трифторметильную группу, хлорметильную группу, 2,2,2-трихлорэтильную группу, 2,2,2-трифторэтильную группу и 2,2,2-трифтор-1,1-дихлорэтильную группу.
C1-3 галогеналкоксигруппа означает алкоксигруппу, содержащую от 1 до 3 атомов углерода, замещенную галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, трифторметоксигруппу, 2,2,2-трихлорэтоксигруппу, 3,3-дифторпропилоксигруппу и 2,2,2-трифторэтоксигрупп.
C1-3 галогеналкилтиогруппа означает C1-3 алкилтиогруппу, замещенную галогеном, таким как фтор, хлор, бром или иод, и примеры такой группы включают, например, трифторметилтиогруппу, хлорметилтиогруппу, 2,2,2-трихлорэтилтиогруппу, 2,2,2-трифторэтилтиогруппу и 2,2,2-трифтор-1,1-дихлорэтилтиогруппу.
Что касается соединения по настоящему изобретению, хотя в некоторых случаях циклогексаноновое соединение, представленное формулой (I), принимает форму сельскохозяйственно приемлемой соли с неорганическим основанием или органическим основанием, циклогексаноновое соединение, имеющее форму соли, также включено в настоящее изобретение. Примеры соли включают, например, соли, образованные путем смешивания с неорганическими основаниями (например, гидроксиды, карбонаты, бикарбонаты, ацетаты и гидриды щелочных металлов (лития, натрия, калия и т.п.), гидроксиды или гидриды щелочно-земельных металлов (магния, кальция, бария и т.п.) и аммиак), органическими основаниями (например, диметиламин, триэтиламин, пиперазин, пирролидин, пиперидин, 2-фенилэтиламин, бензиламин, этаноламин, диэтаноламин, пиридин, коллидин и т.п.), алкоксидами металлов (например, метоксид натрия, трет-бутоксид калия, метоксид магния и т.п.), и т.п.
В случае, когда соединение по настоящему изобретению содержит один или несколько асимметричных центров, два или более стереоизомеров (например, энантиомеры, диастереомеры и т.п.) присутствуют в соединении. Соединение по настоящему изобретению охватывает смесь всех таких стереоизомеров или любых двух или более из таких стереоизомеров.
Кроме того, в случае, когда соединение по настоящему изобретению имеет геометрическую изомерию в результате присутствия двойной связи и т.п., два или более геометрических изомеров (например, каждый изомер из E/Z или транс/цис, каждый изомер из S-транс/S-цис и т.п.) присутствуют в соединении. Смесь, образованная из всех таких геометрических изомеров или из любых двух или более таких геометрических изомеров, содержится в соединении по настоящему изобретению.
Примеры циклогексанонового соединения, представленного формулой (I), которое является эффективным компонентом гербицидной композиции в соответствии с настоящим изобретением, включают, например, соединения, описанные ниже.
Соединение, в котором m имеет значение 2;
Соединение, в котором n имеет значение 3;
Соединение, в котором m имеет значение 2 и n имеет значение 3;
Соединение, в котором X представляет собой S;
Соединение, в котором R2 представляет собой водород;
Соединение, в котором R3 представляет собой водород;
Соединение, в котором группа, представленная
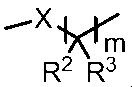
в Формуле (I), представляет собой -S-CH2CH2-, -S-CH2CH(CH3)-, -S-CH(CH3)CH2-, -O-CH2CH2-, -CH2-CH2CH2-, -S(O)-CH2CH2-, -S(O)-CH2CH(CH3)-, -S(O)2-CH2CH2-, -S(O)2-CH2CH(CH3)-, -S-CH2C(CH3)2-, -S-CH2C(циклопропил)-, -S-CH2CH(C2H5)-, -S-CH2-, -S-CH2CH2CH2-, -N(CH3)-CH2CH(CH3)- или -N(CH3)-CH2CH2-;
Соединение, в котором R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу или 3-фурильную группу;
Соединение, в котором Z представляет собой фенильную группу или C1-6 алкильную группу, которая может содержать галоген; и
Соединение, в котором
m имеет значение 1, 2 или 3,
n представляет собой целое число, имеющее значение 1, 2 или 3,
X представляет собой CH2, O, S, S (O), S (O)2 или N(CH3),
R1 представляет собой водород,
R2 и R3, каждый независимо, представляют собой водород или C1-6 алкильную группу, или R2 и R3 связаны с образованием C2-6 алкениленовой цепи,
R4 представляет собой C6-10 арильную группу или 5- или 6-членную гетероарильную группу,
где C6-10 арильная группа и 5- или 6-членная гетероарильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей галоген, цианогруппу, нитрогруппу, пентафтортиогруппу, C1-6 алкильную группу и C1-6 алкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
где C1-6 алкильная группа и C1-6 алкоксигруппа необязательно содержат один или несколько галогенов,
G представляет собой водород или любую группу из следующих формул:
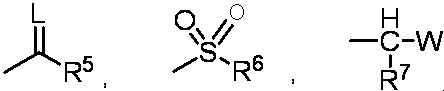
в формулах:
L представляет собой кислород,
R5 представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C3-6 алкенилоксигруппу или C6-10 арилоксигруппу,
R6 представляет собой C1-6 алкильную группу,
R7 представляет собой водород, и W представляет собой C1-6 алкоксигруппу,
Z представляет собой галоген, фенильную группу, C1-6 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу или 6-членную гетероарилоксигруппу,
где фенильная группа и 6-членная гетероарилоксигруппа могут содержать один или несколько заместителей, выбранных из группы, включающей галоген и C1-6 галогеналкильную группу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга.
Представленне соединение А является известным в качестве антидота, и представляет собой соединение, описанное в The Pesticide Manual, Fifteenth Edition (2009), British Crop Production Council (ISBN: 978-1-901396-18-8), или соединение обозначаемое номером CAS.
Ципросульфамид является известным соединением, и его можно получить, например, способом, описанным в Патенте США № 6251827.
Беноксакор, клоквинтосет-мексил, циометринил, дихлормид, фенхлоразол-этил, фенхлорим, флуразол, фурилазол, мефенпир-диэтил, оксабетринил, изоксадифен-этил, флуксофеним, 1,8-нафталевый ангидрид и AD-67 являются известными соединениями, и эти они являются коммерчески доступными. Кроме того, указанные выше соединения можно получить в соответствии со способами, описанными в The Pesticide Manual, Fifteenth Edition (2009), British Crop Production Council (ISBN: 978-1-901396-18-8).
Примеры гербицидной композиции в соответствии с настоящим изобретением включают, например, следующие композиции.
[Аспект 1]
Гербицидная композиция, содержащая соединение формулы (I), где n имеет значение от 1 до 3, и по меньшей мере одно соединение, выбранное из Группы A;
Гербицидная композиция, содержащая соединение формулы (I), где m имеет значение 1 или 2, и n имеет значение 3, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где X представляет собой CH2, O, S, S(O), S(O)2, N(H) или N(CH3), и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где R2 представляет собой водород или C1-3 алкильную группу, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где R3 представляет собой водород или C1-3 алкильную группу, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где группа, представленная формулой
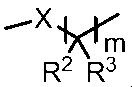
представляет собой -S-CH2CH2-, -S-CH2CH(CH3)-, -S-CH(CH3)CH2-, -O-CH2CH2-, -CH2-CH2-, -CH2-CH2CH2-, -S(O)-CH2CH2-, -S(O)-CH2CH(CH3)-, -S(O)2-CH2CH2-, -S(O)2-CH2CH(CH3)-, -S-CH2C(CH3)2-, -S-CH2C(циклопропил)-, -S-CH2CH(C2H5)-, -S-CH2-, -S-CH2CH2CH2-, -N(CH3)-CH2CH(CH3)- или -N(CH3)-CH2CH2-, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу или 3-фурильную группу, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил;
Гербицидная композиция, содержащая соединение формулы (I), где Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу, и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил; и
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I), где
n имеет значение от 1 до 3,
X представляет собой CH2, O, S, S(O), S(O)2, N(H) или N(CH3),
R2 представляет собой водород или C1-3 алкильную группу,
R3 представляет собой водород или C1-3 алкильную группу,
группа, представленная формулой
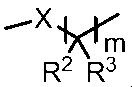
представляет собой -S-CH2CH2-, -S-CH2CH(CH3)-, -S-CH(CH3)CH2-, -O-CH2CH2-, -CH2-CH2-, -CH2-CH2CH2-, -S(O)-CH2CH2-, -S(O)-CH2CH(CH3)-, -S(O)2-CH2CH2-, -S(O)2-CH2CH(CH3)-, -S-CH2C(CH3)2-, -S-CH2C(циклопропил)-, -S-CH2CH(C2H5)-, -S-CH2-, -S-CH2CH2CH2-, -N(CH3)-CH2CH(CH3)- или -N(CH3)-CH2CH2-,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу или 3-фурильную группу, и Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу; и клоквинтосет-мексил, мефенпир-диэтил или фенхлоразол-этил.
[Аспект 2]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I), где
n представляет собой любое целое число от 1 до 3,
R1 представляет собой водород,
R2 и R3, каждый независимо, представляют собой водород, C1-3 алкильную группу, или R2 и R3 объединены с образованием C2-5 алкиленовой цепи, где, когда m имеет значение 2 или 3, две или три группы R2 могут быть одинаковыми или отличными друг от друга, и две или три группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей галоген, C1-3 алкильную группу, гидроксильную группу, (C1-3 алкил)карбонильную группу, (C1-3 алкокси)карбонильную группу, C1-3 алкоксигруппу, C1-3 галогеналкильную группу, C1-3 алкилтиогруппу, C1-3 галогеналкилтиогруппу, цианогруппу, нитрогруппу, аминогруппу, пентафтортиогруппу, бензоиламиногруппу и C1-3 галогеналкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей C1-3 алкильную группу и C6-10 арильную группу, при этом C1-3 алкильная группа и C6-10 арильная группа могут содержать один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы могут быть одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:

в формулах:
R5a представляет собой C1-6 алкильную группу, C6-10 арильную группу, C1-6 алкоксигруппу, C3-6 алкенильную группу, C3-6 алкинилоксигруппу или C6-10 арилоксигруппу,
R6a представляет собой C1-6 алкильную группу, и
Wa представляет собой C1-3 алкоксигруппу,
R9 представляет собой водород, C1-6 алкильную группу или C6-10 арилсульфонильную группу,
где C1-6 алкильная группа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга, и
где C6-10 арилсульфонильная группа может содержать один или несколько заместителей, выбранных из группы, включающей галоген и нитрогруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу,
где C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-3 алкоксигруппа, фенильная группа или 5- или 6-членная гетероарилоксигруппа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга; и
клоквинтосет-мексил.
[Аспект 3]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где n представляет собой любое целое число от 1 до 3,
R1 представляет собой водород,
R2 и R3, каждый независимо, представляют собой водород, C1-3 алкильную группу, или R2 и R3 связаны с образованием C2-5 алкиленовой цепи,
и, когда m имеет значение 2 или 3, две или три группы R2 могут быть одинаковыми или отличными друг от друга, и две или три группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей галоген, C1-3 алкильную группу, гидроксильную группу, (C1-3 алкил)карбонильную группу, (C1-3 алкокси)карбонильную группу, C1-3 алкоксигруппу, C1-3 галогеналкильную группу, C1-3 алкилтиогруппу, C1-3 галогеналкилтиогруппу, цианогруппу, нитрогруппу, аминогруппу, пентафтортиогруппу, бензоиламиногруппу и C1-3 галогеналкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей C1-3 алкильную группу и C6-10 арильную группу, при этом C1-3 алкильная группа и C6-10 арильная группа могут содержать один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы могут быть одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:

в формулах:
R5a представляет собой C1-6 алкильную группу, C6-10 арильную группу, C1-6 алкоксигруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу или C6-10 арилоксигруппу,
R6a представляет собой C1-6 алкильную группу, и
Wa представляет собой C1-3 алкоксигруппу,
R9 представляет собой водород, C1-6 алкильную группу или C6-10 арилсульфонильную группу,
где C1-6 алкильная группа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга, и
C6-10 арилсульфонильная группа может содержать один или несколько заместителей, выбранных из группы, включающей галоген и нитрогруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу,
где C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-3 алкоксигруппа, фенильная группа или 5- или 6-членная гетероарилоксигруппа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга; и
мефенпир-диэтил.
[Аспект 4]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где n представляет собой любое целое число от 1 до 3,
R1 представляет собой водород,
R2 и R3, каждый независимо, представляют собой водород, C1-3 алкильную группу, или R2 и R3 связаны с образованием C2-5 алкиленовой цепи,
где, когда m имеет значение 2 или 3, две или три группы R2 могут быть одинаковыми или отличными друг от друга, и две или три группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей галоген, C1-3 алкильную группу, гидроксильную группу, (C1-3 алкил)карбонильную группу, (C1-3 алкокси)карбонильную группу, C1-3 алкоксигруппу, C1-3 галогеналкильную группу, C1-3 алкилтиогруппу, C1-3 галогеналкилтиогруппу, цианогруппу, нитрогруппу, аминогруппу, пентафтортиогруппу, бензоиламиногруппу и C1-3 галогеналкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей C1-3 алкильную группу и C6-10 арильную группу, при этом C1-3 алкильная группа и C6-10 арильная группа могут содержать один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы могут быть одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:

в формулах:
R5a представляет собой C1-6 алкильную группу, C6-10 арильную группу, C1-6 алкоксигруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу или C6-10 арилоксигруппу,
R6a представляет собой C1-6 алкильную группу, и
Wa представляет собой C1-3 алкоксигруппу,
R9 представляет собой водород, C1-6 алкильную группу или C6-10 арилсульфонильную группу,
где C1-6 алкильная группа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга, и
C6-10 арилсульфонильная группа может содержать один или несколько заместителей, выбранных из группы, включающей галоген и нитрогруппу, и, когда присутствуют два или более заместителей, эти заместители могут быть одинаковыми или отличными друг от друга, и
Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу,
где C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-3 алкоксигруппа, фенильная группа или 5- или 6-членная гетероарилоксигруппа может содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга; и
фенхлоразол-этил.
[Аспект 5]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I), где R2 и R3, каждый независимо, представляют собой водород, метильную группу, этильную группу, или R2 и R3 связаны с образованием этиленовой цепи,
где две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, метоксигруппу, нитрогруппу, аминогруппу, цианогруппу, гидроксильную группу, ацетильную группу, метоксикарбонильную группу, пентафтортиогруппу, пентафторэтильную группу, дифторэтильную группу, гептафторизопропильную группу, трифторметилтиогруппу, бензоиламиногруппу, трифторметоксигруппу и трифторметильную группу, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей метильную группу и фенильную группу,
где фенильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор и трифторметильную группу,
G представляет собой водород, ацетильную группу, пропионильную группу, бутилкарбонильную группу, бензоильную группу, метилсульфонильную группу, метоксикарбонильную группу, этоксикарбонильную группу, аллилоксикарбонильную группу, феноксикарбонильную группу, метоксиметильную группу или этоксиметильную группу,
R9 представляет собой водород, 2-нитрофенилсульфонильную группу или метильную группу, и
Z представляет собой метильную группу, этильную группу, фенильную группу, винильную группу, циклопропильную группу, нитрогруппу, фтор, хлор, бром, метоксигруппу, трифторметильную группу, 5-трифторметил-2-хлорпиридилоксигруппу или этинильную группу; и
клоквинтосет-мексил.
[Аспект 6]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где R2 и R3, каждый независимо, представляют собой водород, метильную группу, этильную группу, или R2 и R3 связаны с образованием этиленовой цепи, две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, метоксигруппу, нитрогруппу, аминогруппу, цианогруппу, гидроксильную группу, ацетильную группу, метоксикарбонильную группу, пентафтортиогруппу, пентафторэтильную группу, дифторэтильную группу, гептафторизопропильную группу, трифторметилтиогруппу, бензоиламиногруппу, трифторметоксигруппу и трифторметильную группу, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей метильную группу и фенильную группу, и
где фенильная группа может содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор и трифторметильную группу,
G представляет собой водород, ацетильную группу, пропионильную группу, бутилкарбонильную группу, бензоильную группу, метилсульфонильную группу, метоксикарбонильную группу, этоксикарбонильную группу, аллилоксикарбонильную группу, феноксикарбонильную группу, метоксиметильную группу или этоксиметильную группу,
R9 представляет собой водород, 2-нитрофенилсульфонильную группу или метильную группу, и Z представляет собой метильную группу, этильную группу, фенильную группу, винильную группу, циклопропильную группу, нитрогруппу, фтор, хлор, бром, метоксигруппу, трифторметильную группу, 5-трифторметил-2-хлорпиридильную группу или этинильную группу; и мефенпир-диэтил.
[Аспект 7]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где R2 и R3, каждый независимо, представляют собой водород, метильную группу, этильную группу, или R2 и R3 связаны с образованием этиленовой цепи, где две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, метоксигруппу, нитрогруппу, аминогруппу, цианогруппу, гидроксильную группу, ацетильную группу, метоксикарбонильную группу, пентафтортиогруппу, пентафторэтильную группу, дифторэтильную группу, гептафторизопропильную группу, трифторметилтиогруппу, бензоиламиногруппу, трифторметоксигруппу и трифторметильную группу, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей метильную группу и фенильную группу,
где фенильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор и трифторметильную группу,
G представляет собой водород, ацетильную группу, пропионильную группу, бутилкарбонильную группу, бензоильную группу, метилсульфонильную группу, метоксикарбонильную группу, этоксикарбонильную группу, аллилоксикарбонильную группу, феноксикарбонильную группу, метоксиметильную группу или этоксиметильную группу,
R9 представляет собой водород, 2-нитрофенилсульфонильную группу или метильную группу, и Z представляет собой метильную группу, этильную группу, фенильную группу, винильную группу, циклопропильную группу, нитрогруппу, фтор, хлор, бром, метоксигруппу, трифторметильную группу, 5-трифторметил-2-хлорпиридилоксигруппу или этинильную группу; и фенхлоразол-этил.
[Аспект 8]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где R2 и R3, каждый независимо, представляют собой водород или метильную группу, где две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу или 2-пиридильную группу,
где фенильная группа и 2-пиридильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, пентафторэтильную группу, гептафторизопропильную группу и трифторметильную группу,
G представляет собой водород, X представляет собой O, S или S(O), и Z представляет собой метильную группу, этильную группу или фенильную группу; и клоквинтосет-мексил.
[Аспект 9]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I),
где R2 и R3, каждый независимо, представляют собой водород или метильную группу, и две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу или 2-пиридильную группу,
где фенильная группа и 2-пиридильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, пентафторэтильную группу, гептафторизопропильную группу и трифторметильную группу,
G представляет собой водород, X представляет собой O, S или S(O), и Z представляет собой метильную группу, этильную группу или фенильную группу; и мефенпир-диэтил.
[Аспект 10]
Гербицидная композиция, содержащая циклогексаноновое соединение формулы (I), где R2 и R3, каждый независимо, представляют собой водород или метильную группу, где две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу или 2-пиридильную группу, где фенильная группа и 2-пиридильная группа могут содержать один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, пентафторэтильную группу, гептафторизопропильную группу и трифторметильную группу,
G представляет собой водород, X представляет собой O, S или S(O), и Z представляет собой метильную группу, этильную группу или фенильную группу; и
фенхлоразол-этил.
Гербицидная композиция в соответствии с настоящим изобретением обладает гербицидной активностью против широкого ряда сорняков и может эффективно контролировать широкое разнообразие сорняков на участках, где выращивают зерновые культуры, на участках, где выращивают овощные культуры, на участках выращивания деревьев или не-сельскохозяйственных землях, где осуществляют обычную культивацию почвы или не осуществляют культивацию почвы.
Примеры объектов контроля для гербицидной композиции в соответствии с настоящим изобретением включают, например, следующие.
Сорняки, такие как росичка кровяная (Digitaria ciliaris), элевзина индийская (Eleusine indica), щетинник зеленый (Setaria viridis), лисохвост гигантский (Setaria faberi), щетинник золотистый (Setaria glauca), куриное просо (Echinochloa crus-galli), полевица белая (Agrostis alba), просо озимое (Panicum dichotomiflorum), просо техасское (Panicum texanum), ветвянка широколистая (Brachiaria platyphylla), александрийская трава (Brachiaria plantaginea), ветвянка ползучая (Brachiaria decumbens), дикое сорго (Sorghum halepense), суданская трава (Andropogon sorghum), бермудская трава (Cynodon dactylon), овсюг (Avena fatua), плевел многоцветковый (Lolium multiflorum), лисохвост мышехвостиковидный (Alopecurus myosuroides), костер кровельный (Bromus tectorum), костер бесплодный (Bromus sterilis), малый канареечник канарский (Phalaris minor), метлица обыкновенная (Apera spica-venti), мятлик однолетний (Poa annua), пырей (Agropyron repens), сыть вееровидная рисовая (Cyperus iria), сыть круглая (Cyperus rotundus), сыть съедобная (Cyperus esculentus), портулак (Portulaca oleracea), щирица колосистая (Amaranthus retroflexus), щирица гладкая (Amaranthus hybridus), пальмер-амарант (Amaranthus palmeri), посконник коноплевый (Amaranthus rudis), канатник Теофраста (Abutilon theophrasti), просвирник колючий (Sida spinosa), горец вьюнковый (Fallopia convolvulus), горец перечный зеленый (Polygonum scabrum), пенсильванская перечная трава (Persicaria pensylvanica), горец птичий (Persicaria vulgaris), щавель курчавый (Rumex crispus), щавель широколистный (Rumex obtusifolius), горец птичий японский (Fallopia japonica), марь белая (Chenopodium album), кохия (Kochia scoparia), горец длинностолбиковый (Polygonum longisetum), паслен черный (Solanum nigrum), дурман вонючий (Datura stramonium), вьюнок пурпурный обыкновенный (Ipomoea purpurea), ипомея плющевидная (Ipomoea hederacea), ипомея цельнолистная (Ipomoea hederacea var. integriuscula), ипомея ямчатая (Ipomoea lacunosa), вьюнок полевой (Convolvulus arvensis), яснотка красная (Lamium purpureum), яснотка (Lamium amplexicaule), дурнишник обыкновенный (Xanthium pensylvanicum), подсолнечник однолетний (Helianthus annuus), ромашка непахучая (Matricaria perforata или inodora), ромашка (Matricaria chamomilla), хризантема посевная (Chrysanthemum segetum), ромашка полевая (Matricaria matricarioides), амброзия обыкновенная (Ambrosia artemisiifolia), амброзия гигантская (Ambrosia trifida), мелколепестник канадский (Erigeron canadensis), полынь японская (Artemisia princeps), золотарник высокий (Solidago altissima), мелколепестник волосистый (Conyza bonariensis), конопля сесбания (Sesbania exaltata), резуха канадская (Cassia obtusifolia), флоридский клевер (Desmodium tortuosum), клевер ползучий (Trifolium repens), кудзу (Pueraria lobata), горошек узколистный (Vicia angustifolia), коммелина азиатская (Commelina communis), коммелина бенгальская (Commelina benghalensis), подмаренник цепкий (Galium aparine), звездчатка средняя (Stellaria media), редька дикая или полевая (Raphanus raphanistrum), горчица полевая (Sinapis arvensis), пастушья сумка обыкновенная (Capsella bursa-pastoris), вероника персидская (Veronica persica), вероника плющевидная (Veronica hederifolia), фиалка полевая (Viola arvensis), фиалка трехцветная (Viola tricolor), мак-самосейка (Papaver rhoeas), незабудка (Myosotis scorpioides), ваточник сирийский (Asclepias syriaca), молочай-солнцегляд (Euphorbia helioscopia), молочай (Chamaesyce nutans), герань каролинская (Geranium carolinianum), аистник обыкновенный (Erodium cicutarium), хвощ (Equisetum arvense), леерсия японская (Leersia japonica), ежовник обыкновенный (Echinochloa oryzicola), куриное просо (Echinochloa crus-galli var. formosensis), лептохлоя китайская (Leptochloa chinensis), сыть вееровидная мелкоцветная (Cyperus difformis), фимбристилист травовидный (Fimbristylis miliacea), болотница игольчатая (Eleocharis acicularis), камыш горный (Scirpus juncoides), тростник (Scirpus wallichii), сыть болотная (Cyperus serotinus), водяной орех (Eleocharis kuroguwai), клубнекамыш морской (Bolboschoenus koshevnikovii), шоеноплектус японский (Schoenoplectus nipponicus), монохория овальнолистная (Monochoria vaginalis), воробьиное просо (Lindernia procumbens), шмелиный глаз (Dopatrium junceum), ротала индийская (Rotala indica), аммания многоцветковая (Ammannia multiflora), повойничек трехтычиночный (Elatine triandra), людвигия (Ludwigia epilobioides), стрелолист трехлистный (Sagittaria pygmaea), частуха подорожниковая (Alisma canaliculatum), стрелолист (Sagittaria trifolia), рдест круглолистный (Potamogeton distinctus), петрушка японская (Oenanthe javanica), болотник (Callitriche palustris), японский ложный курослеп (Lindernia micrantha), низменный ложный курослеп (Lindernia dubia), ложная маргаритка (Eclipta prostrata), росичка болотная (Murdannia keisak), горец птичий (Paspalum distichum), леерсия рисовидная (Leersia oryzoides) и т.п. Водные растения, такие как очереднопыльник филоксеровый (Alternanthera philoxeroides), лягушатник (Limnobium spongia), цератоптерис (Salvinia genus), пистия (Pistia stratiotes), щитолистник (Hydrocotyle genus), нитевидные морские водоросли (Pithophora genus, Cladophora genus), роголистник жесткий (Ceratophyllum demersum), ряска (Lemna genus), лютик вееролистный (Cabomba caroliniana), гидрилла (Hydrilla verticillata), наяда южная (Najas guadalupensis), рдест (Potamogeton crispus, Potamogeton illinoensis, Potamogeton pectinatus и т.п.), вебстерия погруженная (Wolffia genus), тысячелистники (Myriophyllum spicatum, Myriophyllum heterophyllum и т.п.), водяной гиацинт (Eichhornia crassipes) и т.п. Мхи, печеночники и роголистники. Цианобактерии. Папоротники. Боковые побеги многолетних сельскохозяйственных культур (семечковые плодовые культуры, косточковые плодовые культуры, ягоды, орехи, цитрус, хмель, виноград и т.п.).
Гербицид по настоящему изобретению (далее указан как гербицид в соответствии с настоящим изобретением) содержит гербицидную композицию в соответствии с настоящим изобретением. Гербицид в соответствии с настоящим изобретением используют в качестве гербицида на сельскохозяйственных землях или не-сельскохозяйственных землях, таких как поле, рисовая плантация, газон или фруктовый сад. На сельскохозяйственных землях, где выращивают следующие "растения", гербицид в соответствии с настоящим изобретением может бороться с сорняками на этих сельскохозяйственных землях.
"Растения":
Зерновые культуры: кукуруза, рис, пшеница, ячмень, рожь, сорго, хлопчатник, соя, арахис, гречиха, сахарная свекла, рапс, подсолнечник, сахарный тростник, табак, хмель и т.п.
Овощные культуры:
Овощные растения семейства пасленовых (баклажан, помидор, зеленый перец, красный перец, картофель и т.п.), овощные растения семейства тыквенных (огурец, тыква, цукини, арбуз, дыня, дыня восточная и т.п.), овощные растения семейства крестоцветных (редис, репа, хрен, кольраби, китайская капуста, кочанная капуста, горчица, брокколи, цветная капуста и т.п.), овощные растения семейства сложноцветных (лопух, съедобная хризантема, артишок, салат и т.п.), овощные растения семейства лилейных (зеленый лук, лук, чеснок, спаржа и т.п.), овощные растения семейства зонтичных (морковь, петрушка, сельдерей и пастернак), овощные растения семейства маревых (шпинат, свекла листовая и т.п.), овощные растения семейства губоцветных (японский базилик, мята, базилик и т.п.), бобовые культуры (горох, фасоль обыкновенная, фасоль лучистая, бобы, турецкий горох и т.п.), земляника, сладкий картофель, японский сладкий картофель, таро, коньяк, имбирь, окра и т.п.
Фруктовые деревья: семечковые плодовые культуры (яблоня, груша, груша европейская, хеномелес китайская, айва и т.п.), косточковые плоды (персик, слива, нектарин, абрикос японский, вишня, абрикос, слива домашняя и т.п.), цитрусовые (катсума, апельсин, лимон, лайм, грейпфрут и т.п.), орехи (каштан, грецкий орех, лесной орех, миндаль, фисташковый орех, орех кэшью, австралийский орех и т.п.), ягоды (голубика, клюква, черная смородина, малина и т.п.), виноград, хурма, олива, мушмула японская, банан, кофейное дерево, финиковая пальма, кокосовая пальма, масличная пальма и т.п.
Деревья, отличные от фруктовых деревьев: чайное дерево, шелковица, цветущие деревья (азалия, камелия, гортензия древовидная, камелия японская, иллициум анисовый японский, вишневое дерево, тюльпанное дерево, индийская сирень, маслина ароматная и т.п.), придорожные деревья (ясень, береза, дерен, эвкалипт, гинкго, сирень, клен, дуб, тополь, багряник, амбровое дерево, платан, дзелькова японская, туя японская, ель, тсуга разнолистная, можжевельник, сосна, хвойное дерево, тис, вяз, конский каштан и т.п.), калина душистая, ель черная, цедрела японская, кипарис японский, кротон, бересклет японский, фотиния японская и т.п.
Другие: цветы и декоративные растения (роза, гвоздика, хризантема, степная горечавка Рассела, гипсофила, гербера, бархатцы, сальвия, петуния, вербена, тюльпан, астра, горечавка, лилия, анютины глазки, цикламен, орхидея, ландыш, лаванда, маттиола, декоративная капуста, примула, пуансеттия, гладиолус, каттлея, маргаритка, цимбидиум, бегония и т.п.), биотопливные растения (ятрофа, сафлор, рыжик, просо прутьевидное, китайский тростник, многолетний тростник, кенаф, маниока, ракита и т.п.), лиственные растения и т.п.
Указанные выше "растения", также охватывают генетически модифицированные культуры.
Гербицид в соответствии с настоящим изобретением содержит гербицидную композицию в соответствии с настоящим изобретением, то есть соединение по настоящему изобретению и соединение A. Кроме того, к гербициду в соответствии с настоящим изобретением, как правило, добавляют инертный носитель и адъюванты для формулирования, такие как поверхностно-активное вещество, связывающее вещество, диспергирующее вещество и стабилизатор, и гербицид в соответствии с настоящим изобретением формулируют в виде смачиваемого порошка, вододиспергируемых гранул, суспендируемого концентрата, гранул, сухого текучего материала, эмульгируемого концентрата, водной жидкой композиции, масляного раствора, аэрозоля или микрокапсул и т.п. В гербициде в соответствии с настоящим изобретением общая масса соединения по настоящему изобретению и соединения А обычно составляет от 0,1% до 80%.
Примеры инертного носителя включают, например, твердый носитель и жидкий носитель.
Примеры твердого носителя включают, например, тонкодисперсный порошок или твердые частицы глины (например, каолин, диатомовая земля, синтезированный водный оксид кремния, глина фубасами, бентонит и японская кислая глина), тальки и другие неорганические минералы (например, серицит, кварцевый порошок, серный порошок, активированный уголь, карбонат кальция и гидратированный диоксид кремния), и примеры жидкого носителя включают, например, воду, спирты (например, метанол и этанол), кетоны (например, ацетон и метилэтилкетон), ароматические углеводороды (например, бензол, толуол, ксилол, этилбензол и метилнафталин), алифатические углеводороды (например, н-гексан, циклогексан и керосин), сложные эфиры (например, этилацетат и бутилацетат), нитрилы (например, ацетонитрил и изобутилнитрил), простые эфиры (например, диоксан и диизопропиловый эфир), амиды кислот (например, N,N-диметилформамид и диметилацетамид), галогенированные углеводороды (например, дихлорэтан, трихлорэтилен и тетрахлорид углерода) и т.п.
Примеры поверхностно-активного вещества включают, например, сложные эфиры алкилсерной кислоты, алкилсульфонат, алкиларилсульфонат, алкилариловые эфиры и их полиоксиэтиленовые соединения, простые эфиры полиоксиэтиленгликоля, сложные эфиры многоатомных спиртов, производные сахарных спиртов и т.п.
Примеры других адъювантов для формулирования включают, например, связывающее вещество или диспергирующее вещество, и конкретные примеры таких веществ включают, например, казеин, желатин, полисахариды (например, крахмал, аравийская камедь, производные целлюлозы и альгиновая кислота), производные лигнина, бентонит, сахара, синтезированные водорастворимые полимеры (например, поливиниловый спирт, поливинилпирролидон и полиакриловые кислоты), PAP (изопропиловый кислый фосфат), BHT (2,6-ди-трет-бутил-4-метилфенол), BHA (смесь 2-трет-бутил-4-метоксифенола и 3-трет-бутил-4-метоксифенола), растительное масло, минеральное масло, жирные кислоты или их сложные эфиры и т.п.
При распылении раствора, полученного путем разбавления гербицида в соответствии с настоящим изобретением водой, к распыляемой жидкости можно добавить адъювант. Примеры адъюванта, который может быть добавлен, включают, например, поверхностно-активные вещества (неионные поверхностно-активные вещества, такие как алкиловый эфир жирной кислоты, алкиловый эфир полиоксиэтилена и т.п., и ионные поверхностно-активные вещества, такие как алкилбензолсульфонат, диалкилдиметиламмониевая соль и т.п.), масло зерновых культур, растительное масло, концентрат масла зерновых культур, метилированное растительное масло, органический силиконовый распыляющий агент, жидкое удобрение (сульфат аммония, нитрат аммония-мочевины и т.п.) и т.п. Эти адъюванты можно использовать отдельно, или два или более таких адъювантов можно использовать в комбинации.
Способ борьбы с сорняками с использованием гербицидной композиции в соответствии с настоящим изобретением включает способ нанесения эффективных количеств соединения по настоящему изобретению и соединения А на сорняки или почву, где растут сорняки. Примеры способа нанесения гербицида в соответствии с настоящим изобретением включают, например, способ, в котором листву сорняков обрабатывают гербицидом в соответствии с настоящим изобретением, способ, в котором поверхность почвы, где растут сорняки, обрабатывают гербицидом в соответствии с настоящим изобретением, и способ, в котором почву, где растут сорняки, обрабатывают путем смешивания с гербицидом в соответствии с настоящим изобретением. В способе борьбы с сорняками по настоящему изобретению, общее количество соединения по настоящему изобретению и соединения А на площадь 10000 м2 , где осуществляют борьбу с сорняками, обычно составляет от 1 г до 5000 г, предпочтительно от 1 г до 3000 г, и более предпочтительно от 1 г до 500 г.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой беноксакор, соотношение в смеси между соединением по настоящему изобретению и беноксакором находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой клоквинтосет-мексил, соотношение в смеси между соединением по настоящему изобретению и клоквинтосет-мексилом находится в пределах от 1:0,001 до 1:30, более предпочтительно в пределах от 1:0,002 до 1:20, и еще более предпочтительно в пределах от 1:0,05 до 1:2, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой циометринил, соотношение в смеси между соединением по настоящему изобретению и циометринилом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой дихлормид, соотношение в смеси между соединением по настоящему изобретению и дихлормидом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой фенхлоразол-этил, соотношение в смеси между соединением по настоящему изобретению и фенхлоразол-этилом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой фенхлорим, соотношение в смеси между соединением по настоящему изобретению и фенхлоримом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой флуразол, соотношение в смеси между соединением по настоящему изобретению и флуразолом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой фурилазол, соотношение в смеси между соединением по настоящему изобретению и фурилазолом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой мефенпир-диэтил, соотношение в смеси между соединением по настоящему изобретению и мефенпир-диэтилом находится в пределах от 1:0,001 до 1:30, более предпочтительно в пределах от 1:0,002 до 1:20, и еще более предпочтительно в пределах от 1:0,01 до 1:5, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой оксабетринил, соотношение в смеси между соединением по настоящему изобретению и оксабетринилом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой изоксадифен, соотношение в смеси между соединением по настоящему изобретению и изоксадифеном находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой ципросульфамид, соотношение в смеси между соединением по настоящему изобретению и ципросульфамидом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой флуксофеним, соотношение в смеси между соединением по настоящему изобретению и флуксофенимом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой 1,8-нафталевый ангидрид, соотношение в смеси между соединением по настоящему изобретению и 1,8-нафталевым ангидридом находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
В случае, когда соединение А в гербицидной композиции в соответствии с настоящим изобретением представляет собой AD-67, соотношение в смеси между соединением по настоящему изобретению и AD-67 находится в пределах от 1:0,001 до 1:30, и предпочтительно в пределах от 1:0,002 до 1:20, в расчете на массовое соотношение.
После формулирования каждого из эффективных компонентов, гербицид в соответствии с настоящим изобретением также можно получить путем смешивания этих компонентов.
Гербицид в соответствии с настоящим изобретением также можно использовать в смеси или в комбинации с инсектицидом, акарицидом, нематоцидом, фунгицидом, регулятором роста растений, удобрением или почвоулучшителем.
Соединение по настоящему изобретению, используемое в гербицидной композиции в соответствии с настоящим изобретением, можно получить, например, в соответствии со следующим способом.
Способ получения 1
Из соединений по настоящему изобретению, соединение формулы (1a), в котором G представляет собой водород, можно получить путем взаимодействия соединения, представленного формулой (2), с соединением, представленным формулой (3), в присутствии основания.
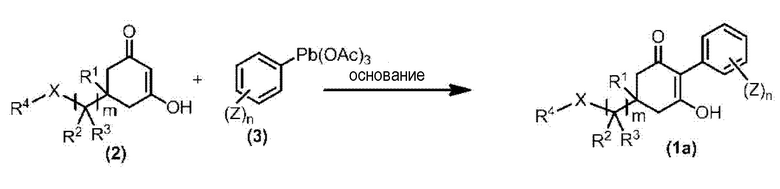
В формуле, R1, R2, R3, R4, X, n, m и Z каждый имеют такое же определение, как описано выше.
Эту реакцию обычно осуществляют в растворителе. Примеры растворителя, который можно использовать, включают, например, ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоны, такие как сульфолан; и смесь таких растворителей.
Примеры основания, используемого в этой реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен. Количество основания обычно составляет от 1 молярного эквивалента до 10 молярных эквивалентов, и предпочтительно от 2 молярных эквивалентов до 5 молярных эквивалентов, в расчете на соединение, представленное формулой (2). Количество соединения, представленного формулой (3), используемого в этой реакции, обычно составляет от 1 молярного эквивалента до 3 молярных эквивалентов в расчете на соединение, представленное формулой (2).
Температура этой реакции обычно находится в пределах от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции для осуществления этой реакции обычно составляет от 10 минут до 30 часов.
Завершение этой реакции можно подтвердить путем взятия части реакционной смеси в качестве образца и использования анализа, такого как тонкослойная хроматография или высоко-эффективная жидкостная хроматография. После завершения этой реакции, например, осуществляют процедуры, в которых реакционную смесь подкисляют путем добавления кислоты, смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1a).
Способ получения 2
Из соединений по настоящему изобретению, соединение формулы (1b), где G представляет собой группу, отличную от водорода, можно получить из соединения, представленного формулой (1a), и соединения, представленного формулой G1-X1.
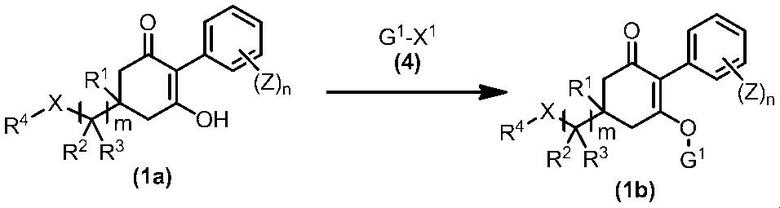
В формуле, G1 представляет собой любую группу, представленную следующими формулами:

в формулах: L, R5, R6, R7 и W, каждый имеют, такое же определение, как описано выше, X1 представляет собой галоген (например, хлор, бром или иод), C1-3 алкилсульфонилоксигруппу, которая может быть замещена галогеном (например, метилсульфонилоксигруппу или трифторметилсульфонилоксигруппу), или группу, представленную формулой OG1, где, когда G1 представляет собой группу, представленную следующей формулой:
X1 представляет собой галоген или C1-3 алкилсульфонилоксигруппу, которая может быть замещена галогеном), и R1, R2, R3, R4, X, n, m и Z, каждый, имеют такое же определение, как описано выше.
Эту реакцию можно осуществить в растворителе. Примеры растворителя, который можно использовать, включают, например, ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоксиды, такие как диметилсульфоксид; сульфоны, такие как сульфолан; и смесь этих растворителей.
Примеры соединения, представленного формулой (4), используемого в этой реакции, включают, например, галогенангидриды карбоновых кислот, такие как ацетилхлорид, пропионилхлорид, изобутирилхлорид, пивалоилхлорид, бензоилхлорид и хлоридангидрид циклогексанкарбоновой кислоты; ангидриды карбоновых кислот, такие как уксусный ангидрид и трифторуксусный ангидрид; галогенангидриды угольной кислоты полуэфира, такие как метилхлорформиат, этилхлорформиат и фенилхлорформиат; галогенангидриды карбаминовой кислоты, такие как диметилкарбамоилхлорид; галогенангидриды сульфоновой кислоты, такие как метансульфонилхлорид и п-толуолсульфонилхлорид; ангидриды сульфоновой кислоты, такие как метансульфоновый ангидрид и трифторметансульфоновый ангидрид; и алкилгалогеналкиловый эфир, такой как хлорметилметиловый эфир и этилхлорметиловый эфир. Количество соединения, представленного формулой (4), используемого в этой реакции, обычно равно или больше чем 1 молярный эквивалент, и предпочтительно составляет от 1 молярного эквивалента до 3 молярных эквивалентов, в расчете на соединение, представленное формулой (1a).
Эту реакцию обычно осуществляют в присутствии основания. Примеры основания, используемого в этой реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен; и неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия, карбонат калия, гидрокарбонат натрия, карбонат кальция и гидрид натрия. Количество основания обычно составляет от 0,5 молярных эквивалентов до 10 молярных эквивалентов, и предпочтительно от 1 молярного эквивалента до 5 молярных эквивалентов, в расчете на соединение, представленное формулой (1a).
Температура этой реакции обычно находится в пределах от -30°C до 180°C, и предпочтительно от -10°C до 50°C. Время реакции для осуществления этой реакции обычно составляет от 10 минут до 30 часов.
Завершение этой реакции можно подтвердить путем взятия части реакционной смеси в качестве образца и использования анализа, такого как тонкослойная хроматография или высоко-эффективная жидкостная хроматография. После завершения этой реакции, например, осуществляют процедуры, в которых реакционную смесь смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом может быть получено соединение, представленное формулой (1b).
Соединение, представленное формулой (4), может представлять собой известное соединение или может быть получено из известного соединения.
Способ получения 3
Из соединений по настоящему изобретению, соединение, в котором X представляет собой S(O), можно получить путем окисления соединения, в котором X представляет собой S. В случае, когда алкилтиогруппа, алкилсульфинильная группа, галогеналкилтиогруппа и/или галогеналкилсульфинильная группа являются включенными в часть, отличную от X, соединения, представленного формулой (1c), эти группы также являются окисленными в некоторых случаях.
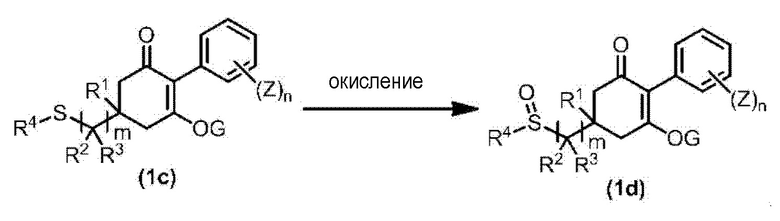
В формуле, R1, R2, R3, R4, G, n, m и Z, каждый, имеют такое же определение, как описано выше.
В этой реакции используют окислитель. Примеры окислителя включают, например, пероксид водорода; перкислоты, такие как перуксусная кислота, пербензойная кислота и м-хлорпербензойная кислота; метапериодат натрия, озон, диоксид селена, хромовая кислота, диоксид азота, ацетилнитрат, иод, бром, N-бромсукцинимид и иодосилбензол. Окислитель используют, в основном, в количестве от 0,8 моль до 1,2 моль, в расчете на 1 моль соединения, представленного формулой (1c).
Эту реакцию осуществляют в растворителе. Примеры растворителя, используемого в реакции, включают, например, насыщенные углеводороды, такие как гексан, гептан, октан и циклогексан; ароматические углеводороды, такие как бензол, толуол, ксилол, хлорбензол и дихлорбензол; галогенированные насыщенные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и тетрахлорид углерода; спирты, такие как метанол, этанол и пропанол; нитрилы, такие как ацетонитрил; амиды, такие как диметилформамид и диметилацетамид; сульфоны, такие как сульфолан; органические кислоты, такие как уксусная кислота и пропионовая кислота; воду и смеси таких растворителей.
Температура этой реакции обычно находится в пределах от -50°C до 100°C, и предпочтительно от 0°C до 50°C. Время реакции для осуществления этой реакции обычно составляет от 10 минут до 10 часов. Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых реакционную смесь смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1d).
Способ получения 4
Из соединений по настоящему изобретению, соединение, в котором X представляет собой SO2, можно получить путем окисления соединения, в котором X представляет собой S, или соединения, в котором X представляет собой SO. В случае, когда алкилтиогруппа, алкилсульфинильная группа, галогеналкилтиогруппа и/или галогеналкилсульфинильная группа включены в группу, отличную от X, соединения, представленного формулой (1e), эти группы также окислены в некоторых случаях.
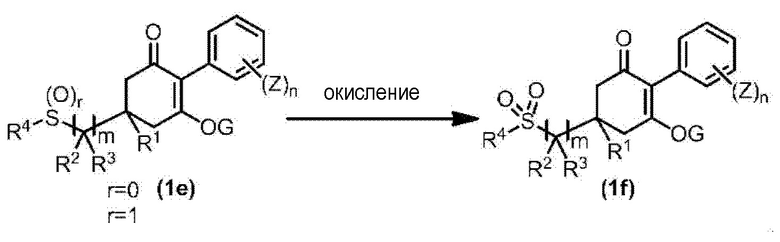
В формуле, r представляет собой 0 или 1, и R1, R2, R3, R4, G, n, m и Z каждый имеют такое же определение, как описано выше.
В этой реакции используют окислитель. Примеры окислителя включают, например, пероксид водорода; перкислоты, такие как перуксусная кислота, пербензойная кислота и м-хлорпербензойная кислота; метапериодат натрия, озон, диоксид селена, хромовая кислота, диоксид азота, ацетилнитрат, иод, бром, N-бромсукцинимид, иодосилбензол, комбинацию пероксида водорода и вольфрамового катализатора, комбинацию пероксида водорода и ванадиевого катализатора и перманганат калия. В случае, когда используют соединение, в котором r имеет значение 0, представленное формулой (1e), количество окислителя обычно составляет от 2 моль до 10 моль, и предпочтительно от 2 моль до 4 моль, в расчете на 1 моль соединения. Кроме того, в случае, когда используют соединение, в котором r имеет значение 1, представленное формулой (1e), количество окислителя обычно составляет от 1 моль до 10 моль, и предпочтительно от 1 моль до 3 моль, в расчете на 1 моль соединения.
Эту реакцию осуществляют в растворителе. Примеры растворителя, используемого в реакции, включают, например, насыщенные углеводороды, такие как гексан, гептан, октан и циклогексан; ароматические углеводороды, такие как бензол, толуол, ксилол, хлорбензол и дихлорбензол; галогенированные насыщенные углеводороды, такие как дихлорметан, хлороформ, 1,2-дихлорэтан и тетрахлорид углерода; спирты, такие как метанол, этанол и пропанол; нитрилы, такие как ацетонитрил; амиды, такие как диметилформамид и диметилацетамид; сульфоны, такие как сульфолан; органические кислоты, такие как уксусная кислота и пропионовая кислота; воду и смеси таких растворителей.
Температура реакции обычно составляет от 0°C до 200°C, и предпочтительно от 20°C до 150°C. Время реакции обычно составляет от 30 минут до 10 часов. Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых реакционную смесь смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1f).
Способ получения 5
Из соединений по настоящему изобретению, соединение, в котором G представляет собой водород, представленное формулой (1a), можно получить путем взаимодействия соединения, представленного формулой (2), с соединением, представленным формулой (31), в присутствии основания.
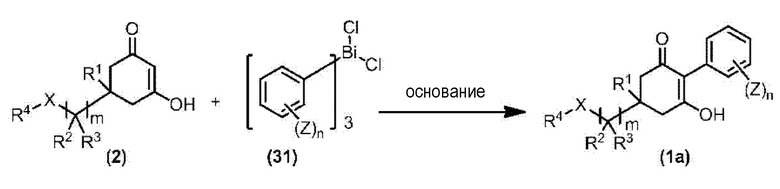
В формуле, R1, R2, R3, R4, X, n, m и Z, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя, который можно использовать, включают, например, ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоны, такие как сульфолан; и смесь таких растворителей.
Примеры основания, используемого в реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен. Количество основания обычно составляет от 1 моль до 10 моль, и предпочтительно от 1 моль до 5 моль, в расчете на 1 моль соединения, представленного формулой (2). Количество соединения, представленного формулой (31), используемого в этой реакции, обычно составляет от 1 моль до 3 моль в расчете на 1 моль соединения, представленного формулой (2).
Температура реакции обычно составляет от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1a).
Способ получения 6
Из соединений по настоящему изобретению, соединение, представленное формулой (1g), можно получить путем взаимодействия соединения, представленного формулой (22), с соединением, представленным формулой (21), в присутствии фосфина.
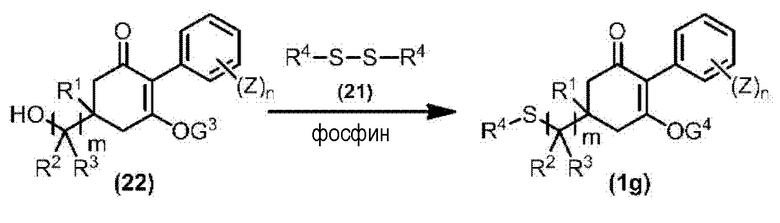
В формуле, G3 представляет собой группу, представленную следующей формулой:
В формуле, L и R5 каждый имеют такое же определение, как описано выше, G4 представляет собой водород или группу, представленную следующей формулой:
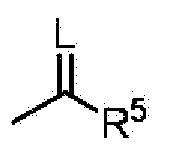
В формуле, L и R5, каждый, имеют такое же определение, как описано выше, R1, R2, R3, R4, n, m и Z, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; и смеси таких веществ.
Примеры фосфина включают, например, три-н-бутилфосфин и трифенилфосфин. Количество фосфина обычно равно или больше чем 1 молярный эквивалент, и предпочтительно составляет от 1 молярного эквивалента до 3 молярных эквивалентов, в расчете на соединение, представленное формулой (22). Количество соединения, представленного формулой (21), используемого в этой реакции, обычно равно или больше чем 1 молярный эквивалент, и предпочтительно составляет от 1 молярного эквивалента до 3 молярных эквивалентов, в расчете на соединение, представленное формулой (22).
Температура реакции обычно составляет от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1g).
Способ получения 7
Из соединений по настоящему изобретению, соединение, представленное формулой (1g), можно получить путем взаимодействия соединения, представленного формулой (34), с соединением, представленным формулой (10).
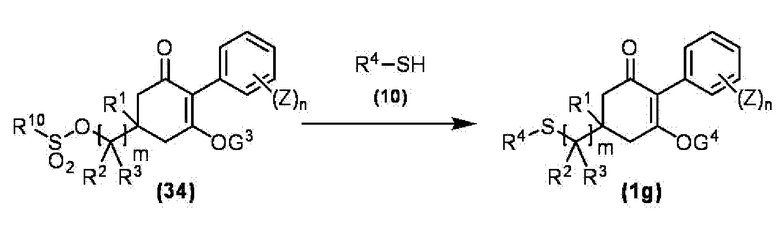
В формуле, R10 представляет собой C1-6 алкильную группу или C6-10 арильную группу, где C1-6 алкильная группа и C6-10 арильная группа могут содержать один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены могут быть одинаковыми или отличными друг от друга, и C6-10 арильную группу, которая может содержать одну или несколько C1-6 алкильных групп, и, когда присутствуют две или более C1-6 алкильных групп, эти алкильные группы могут быть одинаковыми или отличными друг от друга, и R1, R2, R3, R4, n, m, Z, G3 и G4, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, 1,4-диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; и смеси таких веществ. Количество соединения, представленного формулой (10), используемого в этой реакции, обычно равно или больше чем 1 молярный эквивалент, и предпочтительно составляет от 1 молярного эквивалента до 5 молярных эквивалентов, в расчете на соединение, представленное формулой (34).
Температура реакции обычно составляет от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1g).
Способ получения 8
Из соединений по настоящему изобретению, соединение, представленное формулой (1h), можно получить путем гидролиза соединения, представленного формулой (1g), в присутствии основания.
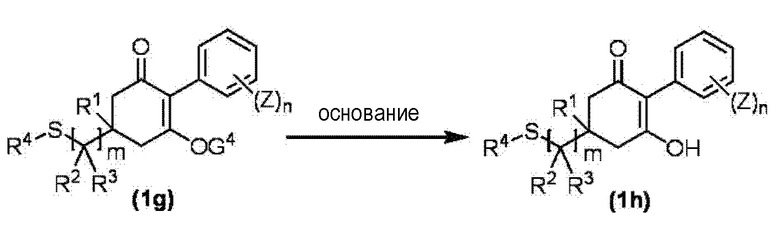
В формуле, R1, R2, R3, R4, n, m, Z и G4, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; спирты, такие как метанол и этанол; амиды, такие как диметилформамид и диметилацетамид; и смеси таких веществ.
Примеры основания, используемого в реакции, включают, например, гидроксид лития, гидроксид натрия, гидроксид калия, метоксид натрия и этоксид натрия. Количество основания обычно составляет от 1 моль до 10 моль, и предпочтительно от 1 моль до 5 моль, в расчете на 1 моль соединения, представленного формулой (1g).
Температура реакции обычно составляет от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1h).
Способ получения 9
Из соединений по настоящему изобретению, соединение, представленное формулой (1i), можно получить путем взаимодействия соединения, представленного формулой (35), с соединением, представленным формулой (11), в присутствии сульфата меди и аскорбата натрия.
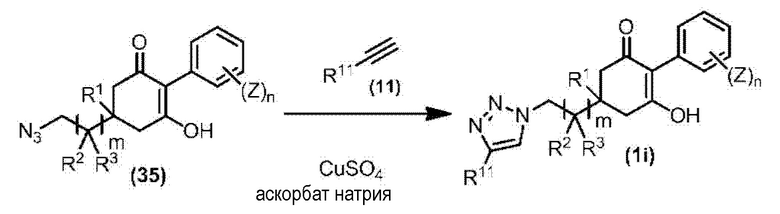
В формуле, R11 представляет собой C6-10 арильную группу, где C6-10 арильная группа может содержать один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы могут быть одинаковыми или отличными друг от друга, и R1, R2, R3, n, m и Z, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, нитрилы, такие как ацетонитрил; амиды, такие как диметилформамид; сульфоксиды, такие как диметилсульфоксид; и смеси таких веществ. Количество соединения, представленного формулой (11), используемого в этой реакции, обычно составляет от 1 молярного эквивалента до 10 молярных эквивалентов, и предпочтительно от 1 молярного эквивалента до 3 молярных эквивалентов, в расчете на соединение, представленное формулой (35). Количество сульфата меди, используемого в этой реакции, обычно составляет от 0,02 молярных эквивалентов до 0,2 молярных эквивалентов в расчете на соединение, представленное формулой (35). Количество аскорбата натрия, используемого в этой реакции, обычно составляет от 0,05 молярных эквивалентов до 0,5 молярных эквивалентов, в расчете на соединение, представленное формулой (35).
Температура реакции обычно составляет от 20°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (1i).
Соответствующие соединения, полученные способами получения 1-9, описанными выше, также могут быть выделены или очищены другими известными способами, например, такими как концентрирование, концентрирование при пониженном давлении, экстракция, перенос для растворения, кристаллизация, перекристаллизация и хроматография, в некоторых случаях.
Ссылочный пример получения 1
Соединение, представленное формулой (3), можно получить путем взаимодействия соединения, представленного формулой (5), с тетраацетатом свинца в присутствии основания, например, в соответствии со способом, описанным в Marie-Luise Huber and John T. Pinhey, Journal of Chemical Society Perkin Transion 1 (1990) 721.
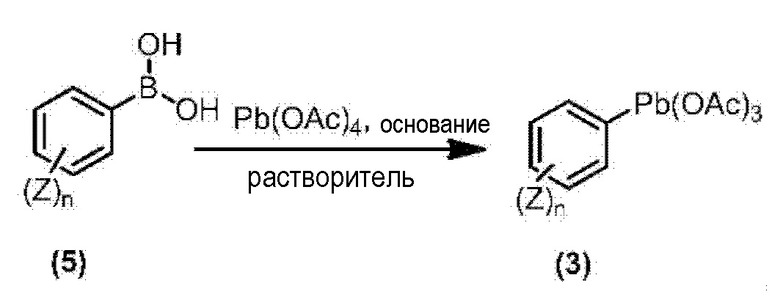
В формуле, Z и n, каждый, имеют такое же определение, как описано выше.
Соединение, представленное формулой (5), может представлять собой известное соединение или может быть получено из известного соединения. Например, соединение можно получить в соответствии со способом, описанным в публикации нерассмотренной японской патентной заявки № 2008-133252, или способом, основанным на этом описании.
Ссылочный пример получения 2
Соединение, представленное формулой (2), можно получить, например, в соответствии со следующей схемой реакций.
В формуле, R8 представляет собой C1-3 алкильную группу; и X, m, R1, R2, R3, R4 и n, каждый, имеют такое же определение, как описано выше.
Соединение, представленное формулой (2), можно получить, например, в соответствии со способом, описанным в Публикации нерассмотренной японской патентной заявки № 63-146856.
На стадии 1 соединение, представленное формулой (7), можно получить при помощи реакции Виттига соединения, представленного формулой (9), с 1-трифенилфосфоранилиден-2-пропаноном.
На стадии 2 соединение, представленное формулой (6), можно получить путем взаимодействия соединения, представленного формулой (7), с соединением, представленным формулой (8), в щелочных условиях. Из соединений по настоящему изобретению, представленных формулой (8), диметилмалонат или диэтилмалонат является предпочтительным. Эту реакцию осуществляют в подходящем растворителе, например, тетрагидрофуране, метаноле, этаноле или толуоле.
На стадии 3 соединение, представленное формулой (2), можно получить путем гидролиза соединения, представленного формулой (6), и путем декарбонизации полученного продукта.
Соединение, представленное формулой (9), может представлять собой известное соединение или может быть получено из известного соединения, и его можно получить, например, в соответствии со способом, описанным в Tetrahedron letter 28 (1987) 2893-2894, Tetrahedron letter 47 (2006) 5869-5873, Tetrahedron 42 (1986) 6071-6095, публикации нерассмотренной японской патентной заявки № 63-146856 или способами, основанными на этих способах.
Ссылочный пример получения 3
Соединение, представленное формулой (31), можно получить, например, следующим способом.
В формуле, Q представляет собой галоген, и Z и n каждый имеют такое же определение, как описано выше.
Соединение, представленное формулой (31), можно получить из соединения, представленного формулой (32), например, в соответствии со способом, описанным в Bull. Chem. Soc. Jpn., 65, 3504-3506 (1992).
Соединение, представленное формулой (32), может представлять собой известное соединение или может быть получено из известного соединения, и его можно получить, например, в соответствии со способом, описанным в WO2010102761 или WO2006084663, или способами, основанными на этих способах.
Ссылочный пример получения 4
Соединение, представленное формулой (22), можно получить, например, следующим способом.
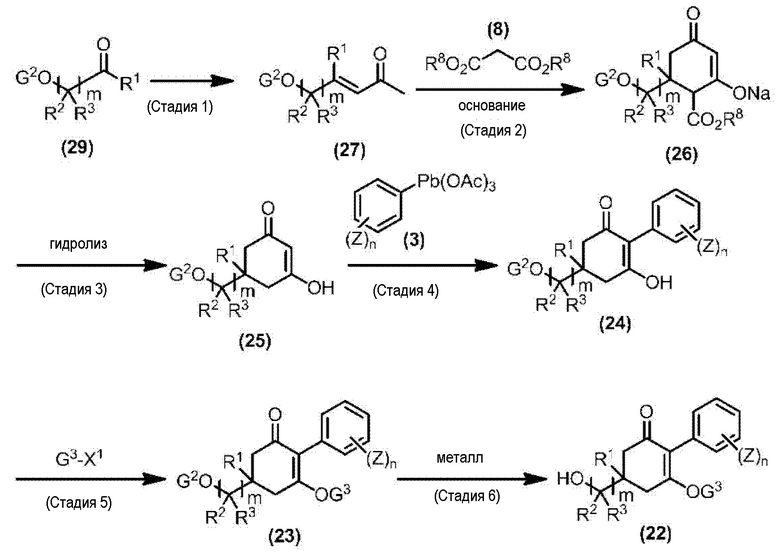
В формуле, G2 представляет собой бензильную группу или параметоксибензильную группу, и G3, m, R1, R2, R3, R8, Z, X1 и n, каждый, имеют такое же определение, как описано выше.
Соединение, представленное формулой (25), можно получить, например, в соответствии со способом, описанным в публикации нерассмотренной японской патентной заявки № 63-146856.
Стадия 1
Соединение, представленное формулой (27), можно получить при помощи реакции Виттига соединения, представленного формулой (29), с 1-трифенилфосфоранилиден-2-пропаноном.
Стадия 2
Соединение, представленное формулой (26), можно получить путем взаимодействия соединения, представленного формулой (27), с соединением, представленным формулой (8), в щелочных условиях.
Примеры соединения, представленного формулой (8), включают, например, диметилмалонат и диэтилмалонат. Примеры растворителя, используемого в реакции, включают, например, тетрагидрофуран, метанол, этанол и толуол.
Стадия 3
Соединение, представленное формулой (25), можно получить путем гидролиза соединения, представленного формулой (26), и декарбонизации полученного продукта.
Стадия 4
Соединение, представленное формулой (24), можно получить путем взаимодействия соединения, представленного формулой (25), с соединением, представленным формулой (3), в присутствии основания.
Реакцию обычно осуществляют в растворителе.
Примеры растворителя включают, например, ароматические углеводороды, такие как бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоны, такие как сульфолан; и смеси таких веществ.
Примеры основания, используемого в реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен. Количество основания обычно составляет от 1 моль до 10 моль, и предпочтительно от 2 моль до 5 моль, в расчете на 1 моль соединения, представленного формулой (25). Количество соединения, представленного формулой (3), используемого в этой реакции, обычно составляет от 1 моль до 3 моль, в расчете на 1 моль соединения, представленного формулой (25).
Температура реакции обычно составляет от -60°C до 180°C, и предпочтительно от -10°C до 100°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых после добавления кислоты к реакционной смеси, полученный продукт смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом может быть получено соединение, представленное формулой (24).
Стадия 5
Соединение, представленное формулой (23), можно получить путем взаимодействия соединения, представленного формулой (24), с соединением, представленным формулой G3-X1, в присутствии основания. Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоксиды, такие как диметилсульфоксид; сульфоны, такие как сульфолан; и смеси таких веществ.
Примеры соединения, представленного формулой G3-X1, используемого в реакции, включают, например, галогенангидриды карбоновых кислот, такие как ацетилхлорид, пропионилхлорид, изобутирилхлорид, пивалоилхлорид, бензоилхлорид и хлоридангидрид циклогексанкарбоновой кислоты; ангидриды карбоновых кислот, такие как уксусный ангидрид и трифторуксусный ангидрид; галогенангидриды эфира угольной кислоты, такие как метилхлорформиат, этилхлорформиат и фенилхлорформиат; галогенангидриды карбаминовой кислоты, такие как диметилкарбамоилхлорид; галогенангидриды сульфоновой кислоты, такие как метансульфонилхлорид и п-толуолсульфонилхлорид; ангидриды сульфоновой кислоты, такие как метансульфоновый ангидрид и трифторметансульфоновый ангидрид; и алкилгалогенoалкиловый эфир, такой как хлорметилметиловый эфир и этилхлорметиловый эфир.
Количество соединения, представленного формулой G3-X1, используемого в реакции, обычно равно или больше чем 1 моль, и предпочтительно от 1 моль до 3 моль, в расчете на 1 моль соединения, представленного формулой (24).
Примеры основания, используемого в реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен; и неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия, карбонат калия, гидрокарбонат натрия, карбонат кальция и гидрид натрия.
Количество основания обычно составляет от 0,5 моль до 10 моль, и предпочтительно от 1 моль до 5 моль, в расчете на 1 моль соединения, представленного формулой (24).
Температура реакции обычно составляет от -30°C до 180°C, и предпочтительно от -10°C до 50°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых реакционную смесь смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом может быть получено соединение, представленное формулой (23).
Соединение, представленное формулой G3-X1 может представлять собой известное соединение или может быть получено из известного соединения.
Стадия 6
Соединение, представленное формулой (22), можно получить путем взаимодействия соединения, представленного формулой (23), с металлом.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; спирты, такие как метанол и этанол; сложные эфиры, такие как этилацетат; и смеси таких веществ.
Примеры металла, используемого в реакции, включают, например, палладий и платину. Количество металла, используемого в реакции, обычно равно или больше чем 0,01 моль, и предпочтительно от 0,01 моль до 0,5 моль, в расчете на 1 моль соединения, представленного формулой (23).
Температура реакции обычно составляет от -30°C до 180°C, и предпочтительно от -10°C до 50°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии. После завершения реакции, например, осуществляют процедуры, в которых реакционную смесь фильтруют с использованием Целита (зарегистрированная торговая марка) и полученную жидкость концентрируют при пониженном давлении, таким образом, может быть получено соединение, представленное формулой (22).
Ссылочный пример получения 5
Соединение, представленное формулой (34), можно получить путем взаимодействия соединения, представленного формулой (22), с соединением, представленным формулой (35).
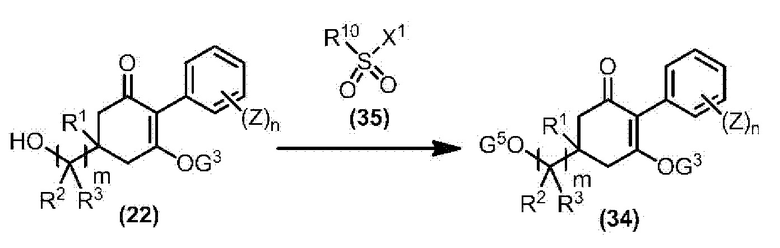
В формуле, R10, X1, R1, R2, R3, n, m, G3 и Z, каждый, имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, ароматические углеводороды, такие как бензол и толуол; простые эфиры, такие как диэтиловый эфир, диизопропиловый эфир, диоксан, тетрагидрофуран и диметоксиэтан; галогенированные углеводороды, такие как дихлорметан, хлороформ и 1,2-дихлорэтан; амиды, такие как диметилформамид и диметилацетамид; сульфоксиды, такие как диметилсульфоксид; сульфоны, такие как сульфолан; и смеси таких веществ.
Примеры соединения, представленного формулой (35), используемого в реакции, включают, например, галогенангидриды сульфоновой кислоты, такие как метансульфонилхлорид и п-толуолсульфонилхлорид; и ангидриды сульфоновой кислоты, такие как метансульфоновый ангидрид и трифторметансульфоновый ангидрид. Количество соединения, представленного формулой (35), используемого в реакции, обычно равно или больше чем 1 моль, и предпочтительно от 1 моль до 3 моль, в расчете на 1 моль соединения, представленного формулой (22).
Реакцию обычно осуществляют в присутствии основания. Примеры основания, используемого в реакции, включают, например, органические основания, такие как триэтиламин, трипропиламин, пиридин, диметиламинопиридин и 1,8-диазабицикло[5.4.0]-7-ундецен; и неорганические основания, такие как гидроксид натрия, гидроксид калия, гидроксид кальция, карбонат натрия, карбонат калия, гидрокарбонат натрия, карбонат кальция и гидрид натрия. Количество основания обычно составляет от 0,5 моль до 10 моль, и предпочтительно от 1 моль до 5 моль, в расчете на 1 моль соединения, представленного формулой (22).
Температура реакции обычно составляет от -30°C до 180°C, и предпочтительно от -10°C до 50°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии.
После завершения реакции, например, осуществляют процедуры, в которых реакционную смесь смешивают с водой и экстрагируют органическим растворителем и полученный органический слой сушат и концентрируют, таким образом, может быть получено соединение, представленное формулой (34).
Соединение, представленное формулой (35), может представлять собой известное соединение или может быть получено из известного соединения.
Ссылочный пример получения 6
Соединение, представленное формулой (35), можно получить путем взаимодействия соединения, представленного формулой (34-a), с азидом натрия в присутствии 15-краун 5-эфира.
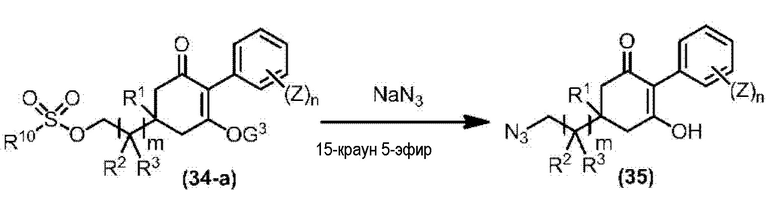
В формуле, R10, R1, R2, R3, G3, n, m и Z каждый имеют такое же определение, как описано выше.
Реакцию обычно осуществляют в растворителе. Примеры растворителя включают, например, амиды, такие как диметилформамид и диметилацетамид; сульфоксиды, такие как диметилсульфоксид; и смеси таких веществ. Количество азида натрия, используемого в этой реакции, обычно составляет от 1 молярного эквивалента до 20 молярных эквивалентов, и предпочтительно 2 молярных эквивалентов до 10 молярных эквивалентов, в расчете на 1 моль соединения, представленного формулой (34-a). Количество 15-краун 5-эфира, используемого в этой реакции, обычно составляет от 0,02 молярных эквивалентов до 0,2 молярных эквивалентов в расчете на 1 моль соединения, представленного формулой (34-a).
Температура реакции предпочтительно находится в пределах от -10°C до 120°C. Время реакции обычно составляет от 10 минут до 30 часов.
Завершение реакции можно подтвердить при помощи анализа части реакционной смеси методом тонкослойной хроматографии или высоко-эффективной жидкостной хроматографии.
После завершения этой реакции соединение, представленное формулой (35), можно получить, например, путем концентрирования реакционной смеси.
Соединение, представленное формулой (34-a), можно получить, например, в соответствии со способом, описанным в Ссылочном примере получения 5.
Некоторые соединения, которые можно получить описанными выше способами получения, представлены ниже.
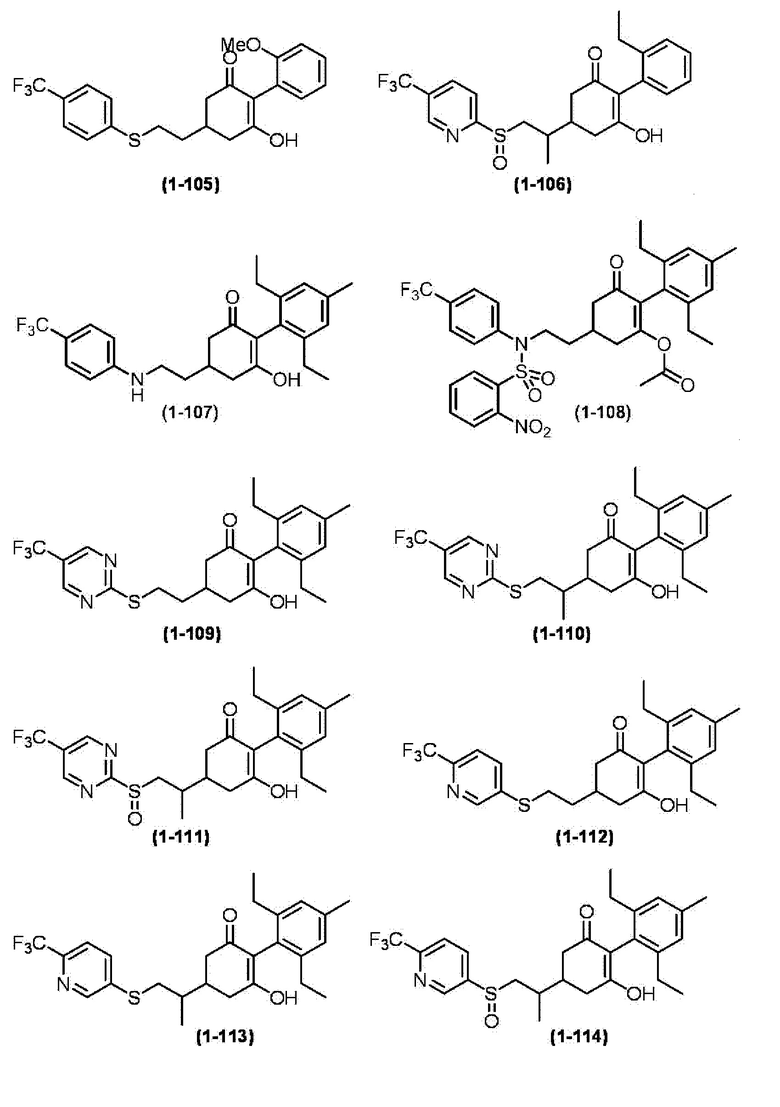
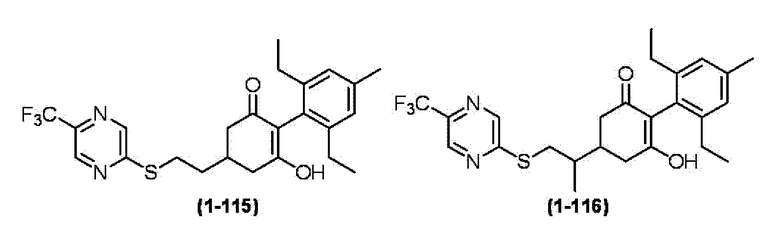
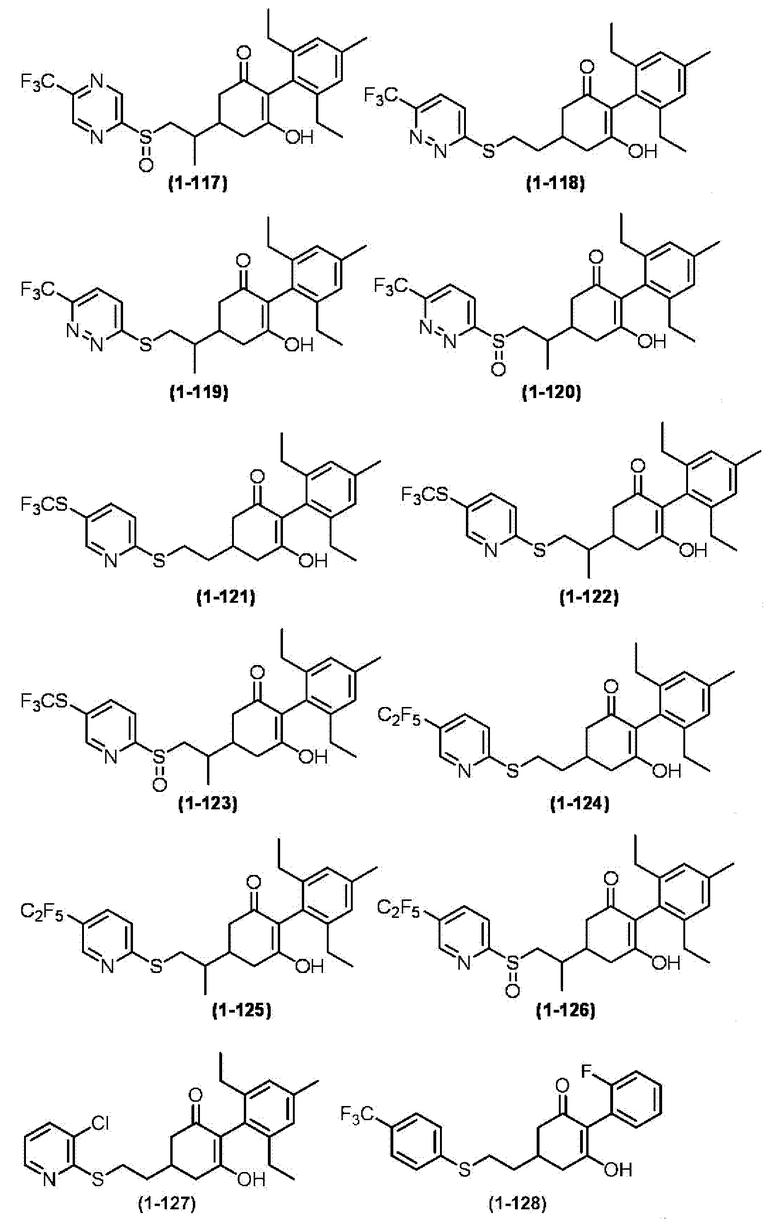
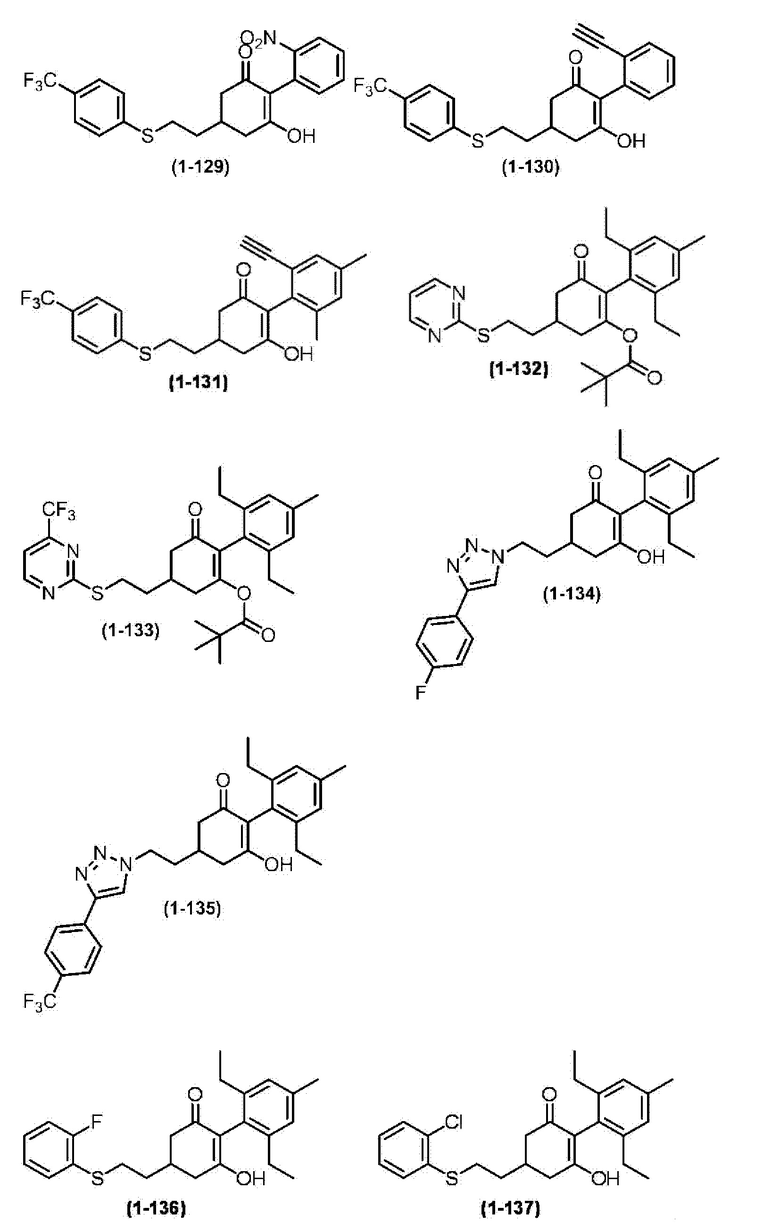
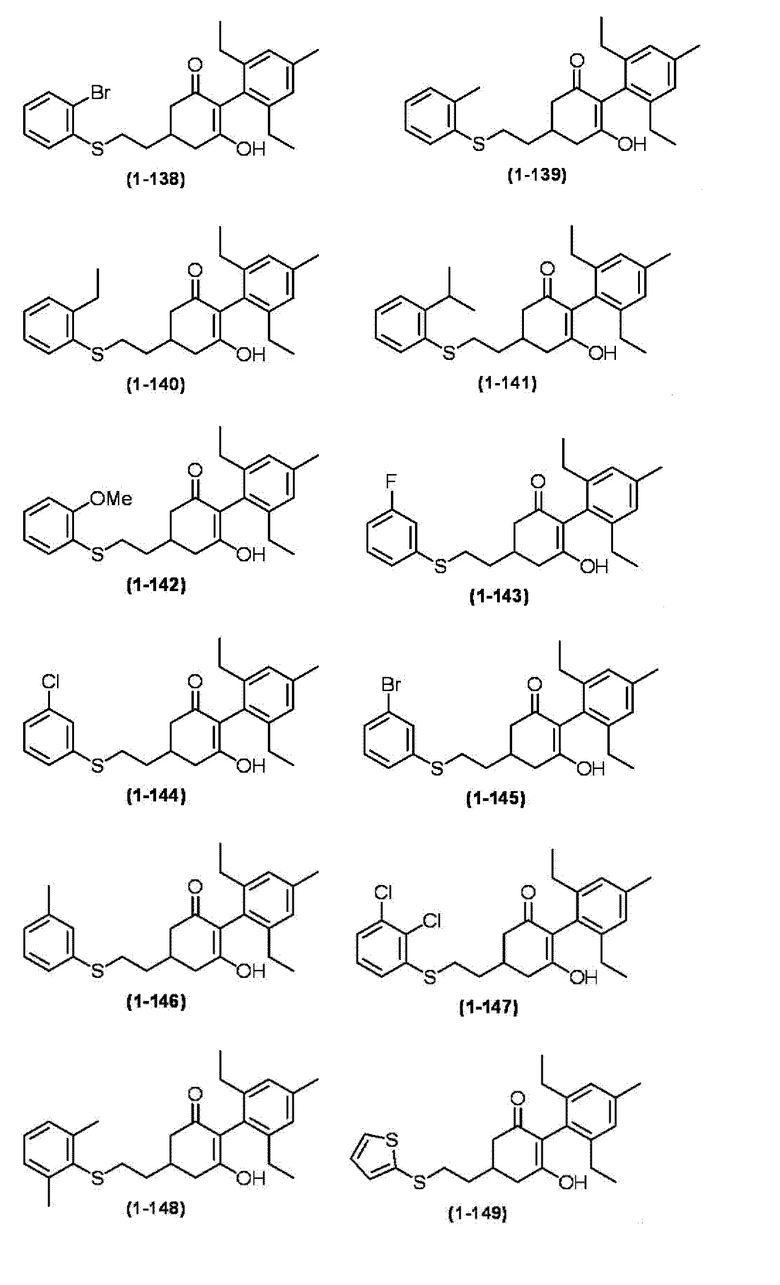
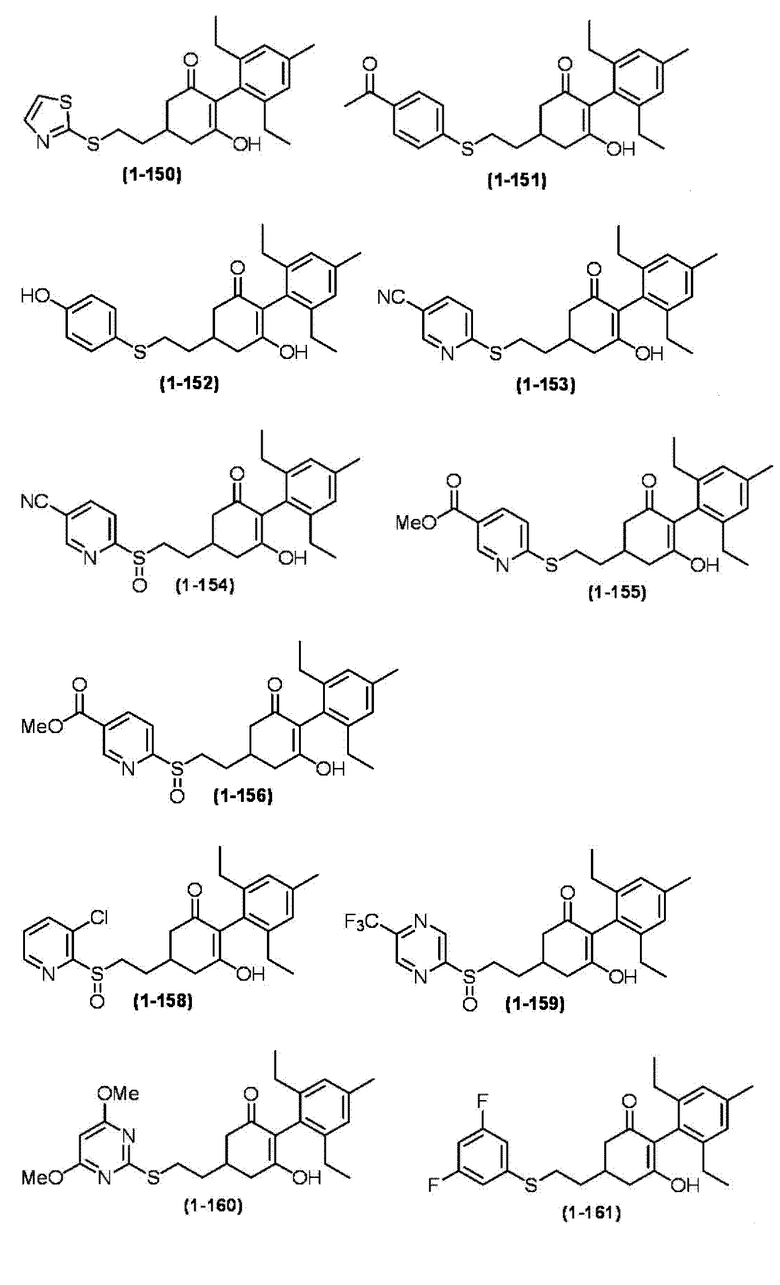
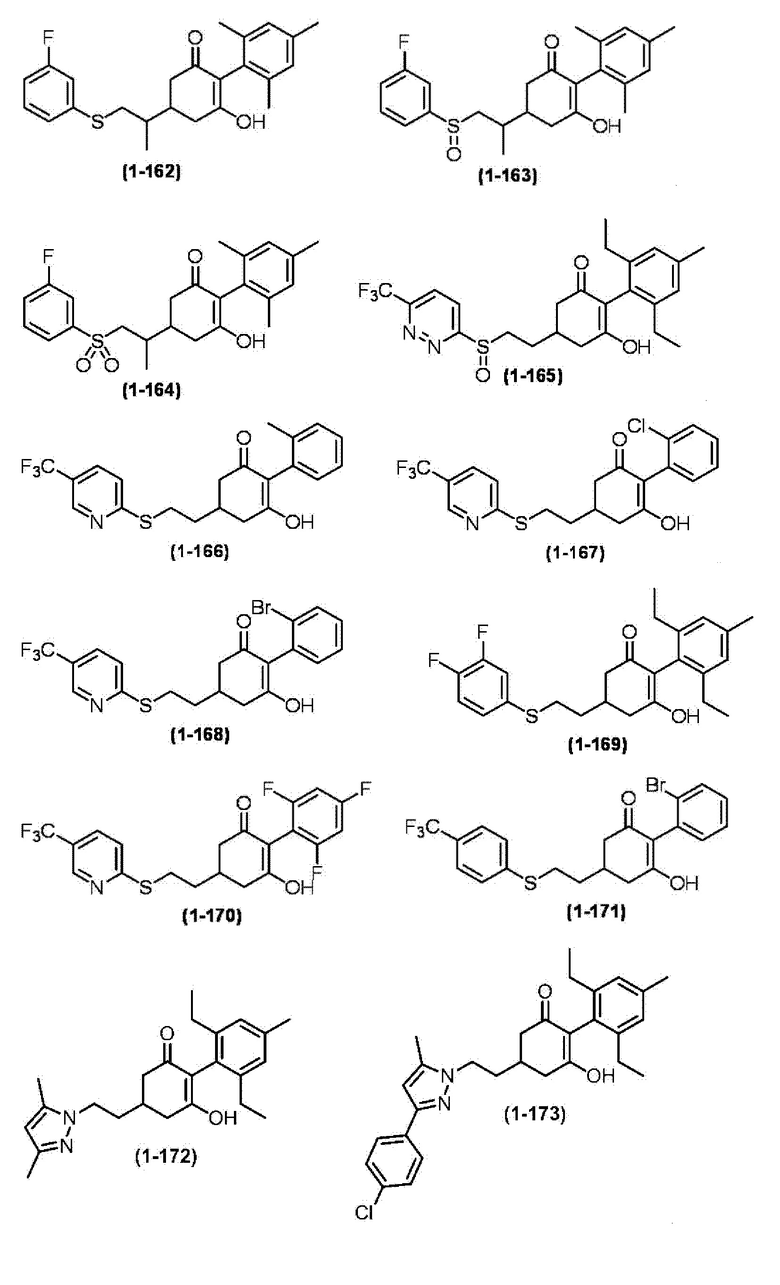
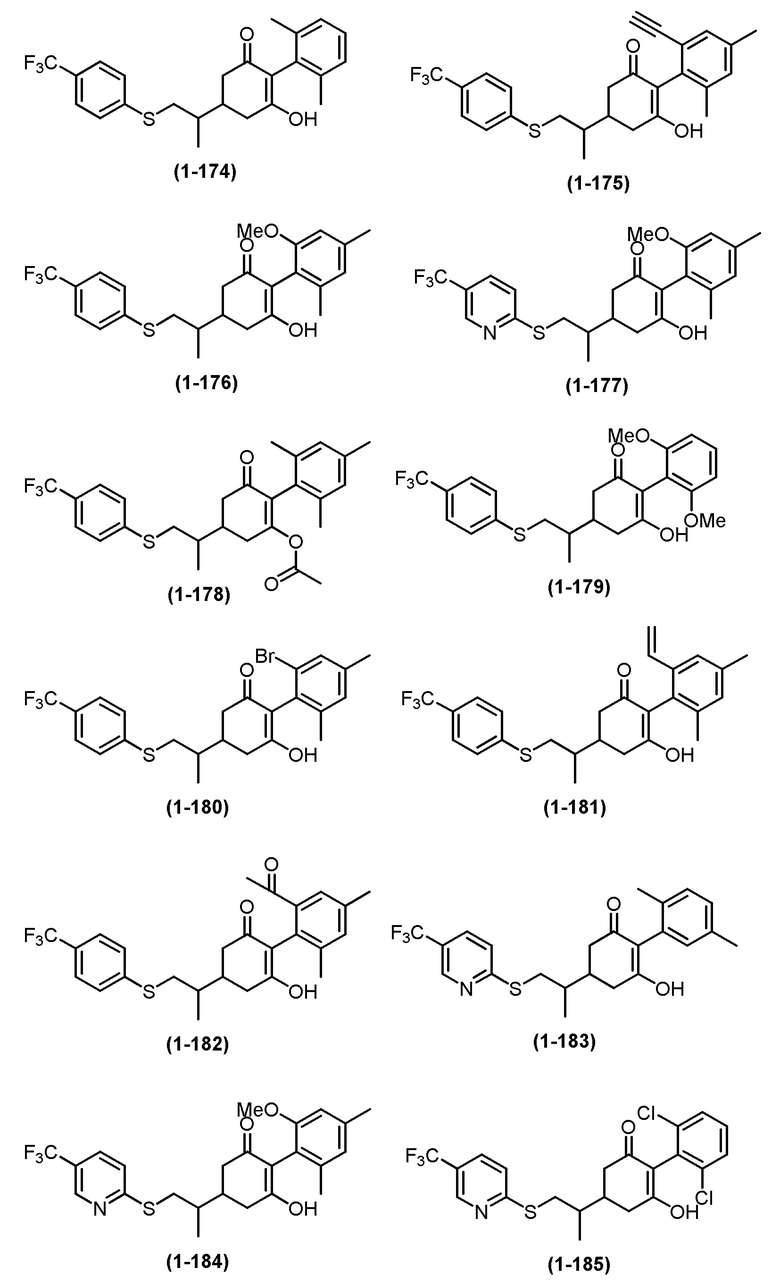
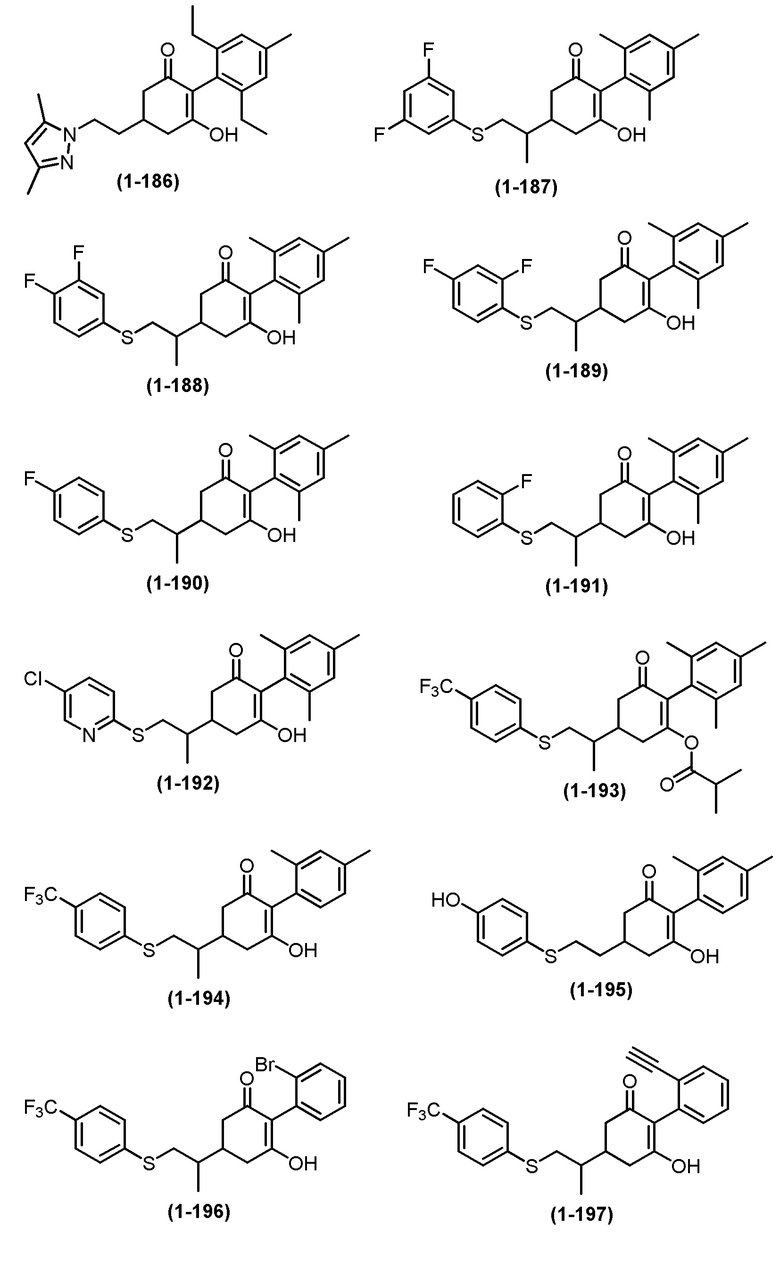
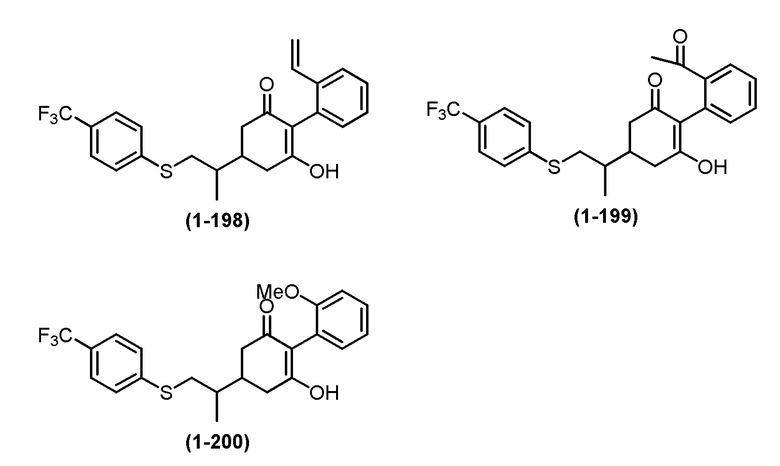
Примеры
Далее будут описаны примеры получения, ссылочные примеры получения, примеры формулирования и примеры испытаний, и изобретение будет описано более конкретно, но настоящее изобретение не ограничивается этими примерами.
В примерах получения и ссылочных примерах получения комнатная температура означает обычно температуру от 10°C до 30°C. 1H ЯМР означает спектр протонного ядерного магнитного резонанса, тетраметилсилан использовали в качестве внутреннего стандарта, и химический сдвиг (δ) представлен в м.д.
Символы, используемые в примерах получения и ссылочных примерах получения, имеют следующие значения.
CDCl3: дейтерированный хлороформ, с: синглет, д: дублет, т: триплет, кв.: квартет, шир.с: широкий синглет, м: мультиплет, J: константа взаимодействия, Me: метильная группа, Et: этильная группа, Phe: фенил, OMe: метоксигруппа, OAc: ацетоксигруппа, Pyr: пиридильная группа, Bn: бензильная группа, Ts: п-толуолсульфонильная группа.
Пример получения 1-1: Получение соединения, представленного формулой (1-1)
<Получение соединения, представленного формулой 9-1>
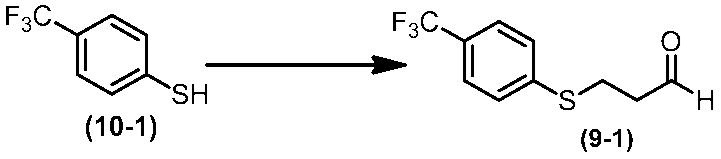
10 г соединения, представленного формулой (10-1), и 15 мл тетрагидрофурана смешивали при комнатной температуре с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 4,0 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем полученную смесь добавляли в воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 18,1 г соединения, представленного формулой (9-1).
1H-ЯМР (CDCl3) δ м.д.: 9,77 (1H,с), 7,51(2H,д), 7,36(2H,д), 3,28-3,20 (2H,м), 2,87-2,80(2H,м)
<Получение соединения, представленного формулой 7-1>
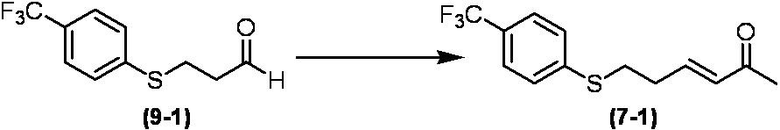
65,7 г соединения, представленного формулой (9-1), и 100 г трифенилфосфинацетилметилена растворяли в 330 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 28,6 г соединения, представленного формулой (7-1).
1H ЯМР (CDCl3) δ м.д.: 7,52(2H,д), 7,39(2H,д), 6,82-6,74(1H,м), 6,13(1H,дд), 3,11(2H,м), 2,63-2,56(2H,м), 2,23(3H,с)
<Получение соединения, представленного формулой 6-1>
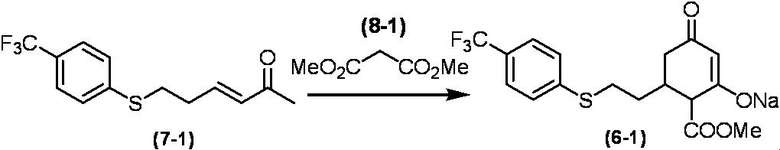
22 г 28% раствора метоксида натрия в метаноле и 7,6 г соединения, представленного формулой (8-1), растворяли в 250 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 28,6 г соединения, представленного формулой (7-1). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 24,5 г соединения, представленного формулой (6-1).
1H ЯМР (d-DMSO) δ м.д.: 7,63(2H,д), 7,45(2H,д), 4,39(1H,с), 3,46(3H,с), 3,11(1H,м), 2,95(1H,м), 2,83(1H,д), 2,34-2,26(1H,м), 2,12(1H,дд), 1,78(1H,дд), 1,53-1,47(2H,м)
<Получение соединения, представленного формулой 2-1>
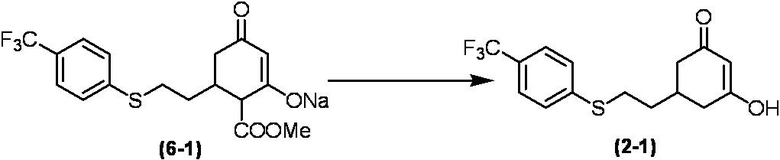
12 г соединения, представленного формулой (6-1), растворяли в 180 мл воды при комнатной температуре. К полученному раствору добавляли 10 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 18 г соединения, представленного формулой (2-1).
1H ЯМР (d-DMSO) δ м.д.: 11,07(1H,с), 7,63(2H,д), 7,48 (2H,д), 5,22 (1H,с), 3,16-3,05 (2H,м), 2,33-1,69 (7H,м)
<Получение соединения, представленного формулой 3-1>
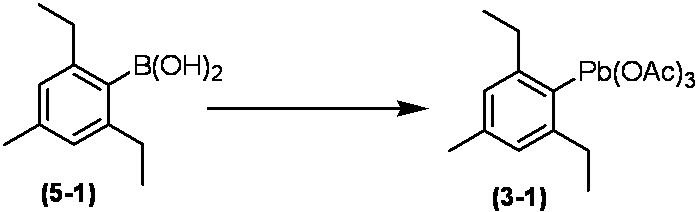
26,5 г тетраацетата свинца, 0,83 г ацетата ртути и 10 г соединения, представленного формулой (5-1), растворяли в 110 мл хлороформа при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем реакционную жидкость перемешивали при 40°C в течение 4 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. К полученному маслянистому веществу добавляли гексан и полученный продукт концентрировали при пониженном давлении, с получением, таким образом, желтого твердого вещества. Полученное твердое вещество растворяли в 260 мл хлороформа при комнатной температуре в атмосфере азота. К полученному раствору добавляли 86,2 г карбоната калия и полученный продукт быстро перемешивали в течение 10 минут. Затем реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 21 г соединения, представленного формулой (3-1).
1H ЯМР (CDCl3) δ м.д.: 7,05(2H,с), 2,90(4H,м), 2,35(3H,с), 2,06(9H,с), 1,33-1,27(6H,м)
<Получение соединения, представленного формулой 1-1>
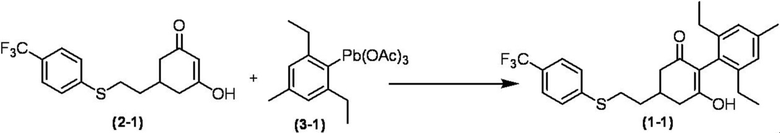
240 мг соединения, представленного формулой (2-1), и 460 мг диметиламинопиридина растворяли в смеси 2,5 мл хлороформа и 0,5 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 440 мг соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 120 мг соединения, представленного формулой (1-1).
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,д), 7,38 (2H,д), 6,98 (2H,с), 5,50 (1H,с), 3,07 (2H,ддд), 2,71 (2H,тд), 2,47-2,24 (10H,м), 1,88 (2H,кв), 1,10-1,03 (6H,м)
Пример получения 1-2: Получение соединения, представленного формулой (1-2)
<Получение соединения, представленного формулой 3-2>
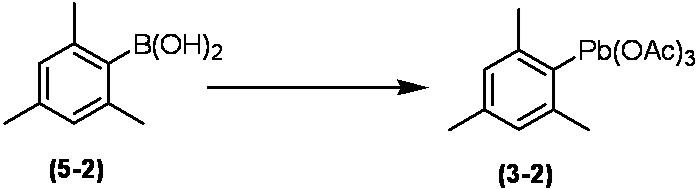
6,2 г тетраацетата свинца, 194 мг ацетата ртути и 2 г соединения, представленного формулой (5-2), растворяли в 25 мл хлороформа при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем реакционную жидкость перемешивали при 40°C в течение 4 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. К полученному маслянистому веществу добавляли гексан и полученный продукт концентрировали при пониженном давлении, с получением, таким образом, желтого твердого вещества. Полученное твердое вещество растворяли в 50 мл хлороформа при комнатной температуре в атмосфере азота. К полученному раствору добавляли 20 г карбоната калия и полученный продукт быстро перемешивали в течение 10 минут. Затем реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 4 г соединения, представленного формулой (3-2).
1H ЯМР (CDCl3) δ м.д.: 6,99(2H,с), 2,57(6H,с), 2,30(3H,с), 2,06(9H,с)
<Получение соединения, представленного формулой 1-2>
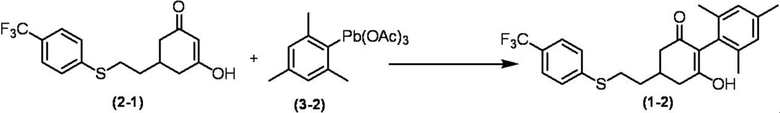
240 мг соединения, представленного формулой (2-1), и 460 мг диметиламинопиридина растворяли в смеси 2,5 мл хлороформа и 0,5 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 420 мг соединения, представленного формулой (3-2), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 125 мг соединения, представленного формулой (1-2).
1H ЯМР (CDCl3) δ м.д.: 7,54 (2H,д), 7,37 (2H,д), 6,94 (2H,с), 5,72 (1H,с), 3,11-3,01 (2H,м), 2,70 (2H,тд), 2,44-2,01 (12H,м), 1,87 (2H,кв)
Пример получения 1-3: Получение соединения, представленного формулой (1-3)
<Получение соединения, представленного формулой 3-3>
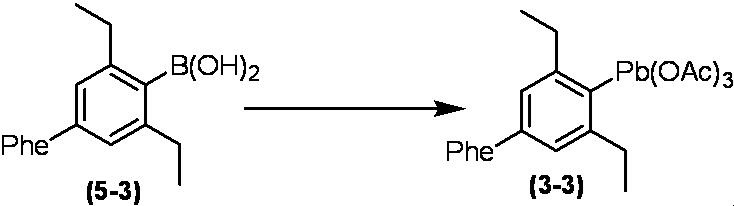
8,4 г тетраацетата свинца, 263 мг ацетата ртути и 4,2 г соединения, представленного формулой (5-3), растворяли в 35 мл хлороформа при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем реакционную жидкость перемешивали при 40°C в течение 4 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. К полученному маслянистому веществу добавляли гексан и полученный продукт концентрировали при пониженном давлении, с получением, таким образом, желтого твердого вещества. Полученное твердое вещество растворяли в 80 мл хлороформа при комнатной температуре в атмосфере азота. К полученному раствору добавляли 27,4 г карбоната калия и полученный продукт быстро перемешивали в течение 10 минут. Затем реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 6,4 г соединения, представленного формулой (3-3).
1H ЯМР (CDCl3) δ м.д.: 7,60-7,31 (7H,м), 3,06-2,93 (4H,м), 2,07 (9H,с), 1,39-1,32 (6H,м)
<Получение соединения, представленного формулой 1-3>
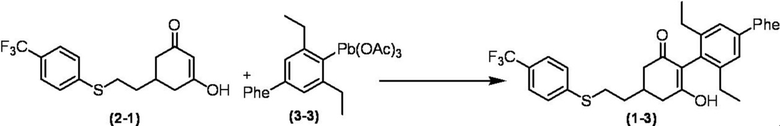
240 мг соединения, представленного формулой (2-1), и 460 мг диметиламинопиридина растворяли в смеси 2,5 мл хлороформа и 0,5 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 500 мг соединения, представленного формулой (3-3), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 190 мг соединения, представленного формулой (1-3).
1H ЯМР (CDCl3) δ м.д.: 7,57 (4H,тд), 7,45 (2H,дд), 7,40-7,34 (5H,м), 5,56 (1H,с), 3,10 (2H,дт), 2,78-2,71 (2H,м), 2,53-2,30 (7H,м), 1,90 (2H,кв), 1,17-1,09 (6H,м)
Пример получения 1-4: Получение соединения, представленного формулой (1-4)
<Получение соединения, представленного формулой 9-2>
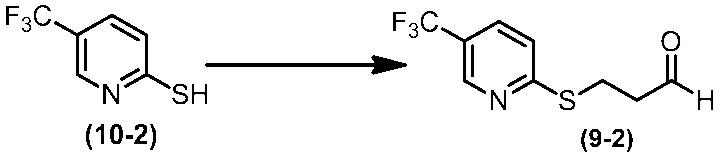
10 г соединения, представленного формулой (10-2), и 30 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 4,0 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 13 г соединения, представленного формулой (9-2).
1H ЯМР (CDCl3) δ м.д.: 9,80 (1H,с), 8,67-8,66 (1H,м), 7,67 (1H,дд), 7,26 (1H,дд), 3,48 (2H,ддд), 2,98-2,95(2H,м)
<Получение соединения, представленного формулой 7-2>
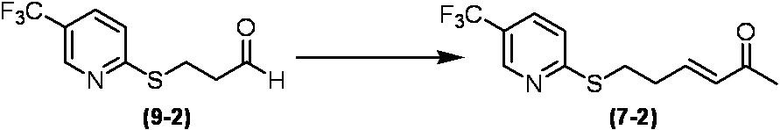
13 г соединения, представленного формулой (9-2), и 20 г трифенилфосфинацетилметилена растворяли в 65 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 13 г соединения, представленного формулой (7-2).
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H,дд), 7,69-7,66 (1H,м), 7,29 (1H,д), 6,88-6,80 (1H,м), 6,16 (1H,дт), 3,36(2H,т), 2,67 (2H,тт), 2,24(3H,с)
<Получение соединения, представленного формулой 6-2>
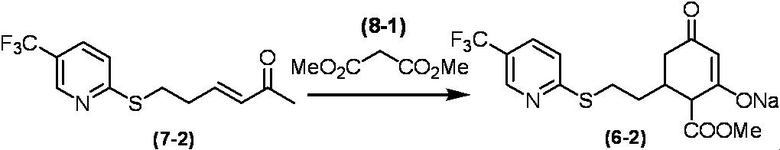
10 г 28% раствора метоксида натрия в метаноле и 6,7 г соединения, представленного формулой (8-1), растворяли в 130 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 13 г соединения, представленного формулой (7-2). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 15,4 г соединения, представленного формулой (6-2).
1H ЯМР (d-DMSO) δ м.д.: 8,78(1H,д), 7,98(1H,дд), 7,50(1H,д), 4,40(1H,с), 3,49(3H,с), 3,26(1H,дкв), 3,06(1H,дт), 2,83(1H,д), 2,34-2,24(1H,м), 2,13(1H,дд), 1,79(1H,дт), 1,63-1,49(2H,м)
<Получение соединения, представленного формулой 2-2>
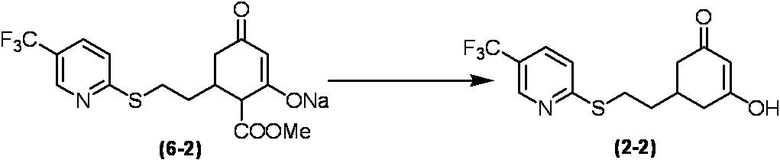
5 г соединения, представленного формулой (6-2), растворяли в 70 мл воды при комнатной температуре. К полученному раствору добавляли 4 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 3,1 г соединения, представленного формулой (2-2).
1H ЯМР (d-DMSO) δ м.д.: 11,07 (1H,с), 8,80 (1H,д), 7,98 (1H,дд), 7,52 (1H,д), 5,21 (1H,с), 3,23 (2H,т), 2,34 (2H,д), 2,13 (3H,м), 1,73 (2H,м)
<Получение соединения, представленного формулой 1-4>
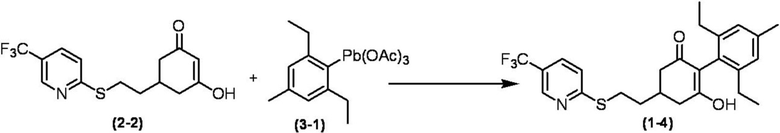
540 мг соединения, представленного формулой (2-2), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 320 мг соединения, представленного формулой (1-4).
1H ЯМР (CDCl3) δ м.д.: 8,68-8,67 (1H,м), 7,67 (1H,дд), 7,27 (1H,д), 6,98 (2H,с), 5,52 (1H,с), 3,31(2H,тт), 2,75 (2H,ддд), 2,51-2,23 (10H,м), 1,92(2H,ддд), 1,5(6H,дт)
Пример получения 1-5: Получение соединения, представленного формулой (1-5)
<Получение соединения, представленного формулой 1-5>
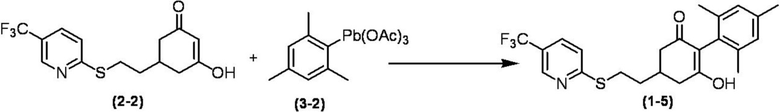
570 мг соединения, представленного формулой (2-2), и 1,1 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-2), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 410 мг соединения, представленного формулой (1-5).
1H ЯМР (CDCl3) δ м.д.: 8,66(1H,с), 7,66(1H,дд), 7,26(1H,д), 6,93(2H,с), 5,66(1H,с), 3,32-3,28(2H,м), 2,74(2H,т), 2,46-2,04(12H,м), 1,91(2H,м)
Пример получения 1-6: Получение соединения, представленного формулой (1-6)
<Получение соединения, представленного формулой 9-3>
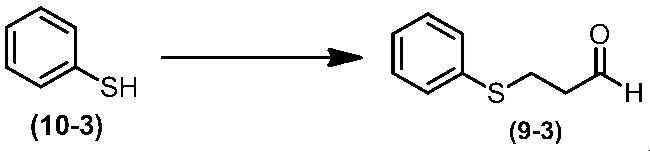
10 г соединения, представленного формулой (10-3), и 30 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 6,6 г 95% акролеина и 0,2 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 15 г соединения, представленного формулой (9-3).
1H ЯМР (CDCl3) δ м.д.: 9,74 (1H,с), 7,36-7,17 (5H,м), 3,17 (2H,т), 2,75 (2H,т)
<Получение соединения, представленного формулой 7-3>
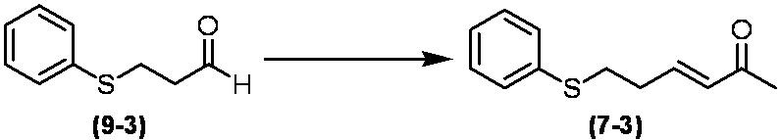
10 г соединения, представленного формулой (9-3), и 21 г трифенилфосфинацетилметилена растворяли в 70 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 7,2 г соединения, представленного формулой (7-3).
1H ЯМР (CDCl3) δ м.д.: 7,35-7,25 (4H,м), 7,18(1H,м), 6,80-6,71(1H,м), 6,07(1H,дт), 3,01(2H,тт), 2,51(2H,ддд), 2,23(3H,с)
<Получение соединения, представленного формулой 6-3>
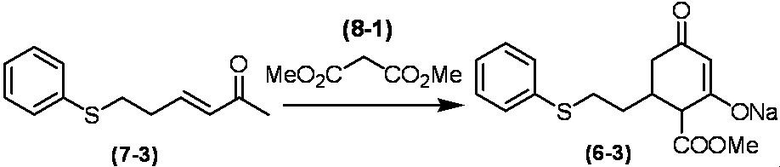
7,5 г 28% раствора метоксида натрия в метаноле и 5 г соединения, представленного формулой (8-1), растворяли в 100 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 7,2 г соединения, представленного формулой (7-3). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 10 г соединения, представленного формулой (6-3).
1H ЯМР (d-DMSO)δ м.д.: 7,33-7,27(4H,м), 7,17(1H,дкв), 4,37(1H,с), 3,48(3H,с), 3,02-2,96(1H,м), 2,87-2,78(2H,м), 2,33-2,23(1H,м), 2,08(1H,дд), 1,74(1H,дд), 1,44(2H,м)
<Получение соединения, представленного формулой 2-3>
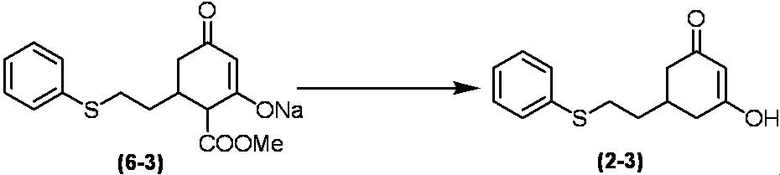
5 г соединения, представленного формулой (6-3), растворяли в 80 мл воды при комнатной температуре. К полученному раствору добавляли 4,8 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 3,4 г соединения, представленного формулой (2-3).
1H ЯМР (d-DMSO) δ м.д.: 11,05(1H,с), 7,31(4H,м), 7,18(1H,м), 5,19(1H,с), 3,00(2H,т), 2,33-1,99(5H,м), 1,63(2H,м)
<Получение соединения, представленного формулой 1-6>
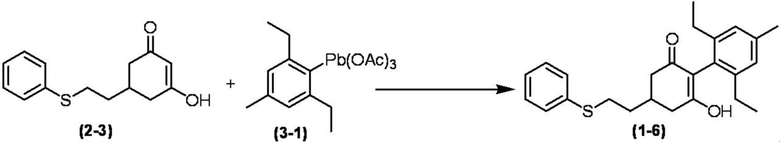
430 мг соединения, представленного формулой (2-3), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 310 мг соединения, представленного формулой (1-6).
1H ЯМР (CDCl3) δ м.д.: 7,36-7,20 (5H,м), 6,97 (2H,с), 5,59 (1H,с), 3,00 (2H,ддд), 2,67 (2H,ддт), 2,47-2,20 (10H,м), 1,82(2H,кв), 1,10-1,02 (6H,м)
Пример получения 1-7: Получение соединения, представленного формулой (1-7)
<Получение соединения, представленного формулой 9-4>
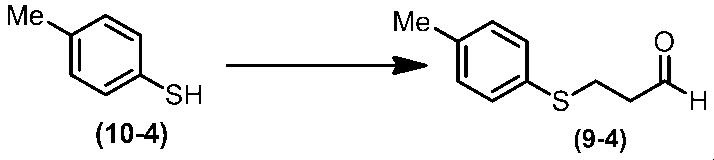
5 г соединения, представленного формулой (10-4), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 3,0 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 7,4 г соединения, представленного формулой (9-4).
1H ЯМР (CDCl3) δ м.д.: 9,72(1H,с), 7,24(2H,д), 7,18(2H,д), 3,12(2H,т), 2,71(2H,т), 2,31(3H,с)
<Получение соединения, представленного формулой 6-4>
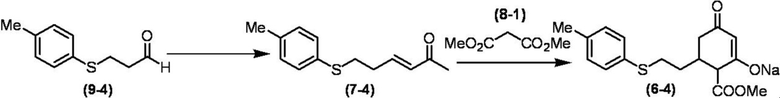
7,4 г соединения, представленного формулой (9-4), и 14,4 г трифенилфосфинацетилметилена растворяли в 50 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 6,0 г соединения, представленного формулой (7-4).
Затем 5,8 г 28% раствора метоксида натрия в метаноле и 4,0 г соединения, представленного формулой (8-1), растворяли в 80 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 6,0 г соединения, представленного формулой (7-4). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 6,7 г соединения, представленного формулой (6-4).
1H ЯМР (d-DMSO) δ м.д.: 7,19(2H,д), 7,12(2H,д), 4,39(1H,с), 3,48(3H,с), 2,97-2,90(1H,м), 2,82-2,75(2H,м), 2,24(3H,с), 2,10-2,04(1H,м), 1,72(1H,дд), 1,49-1,35(2H,м)
<Получение соединения, представленного формулой 2-4>
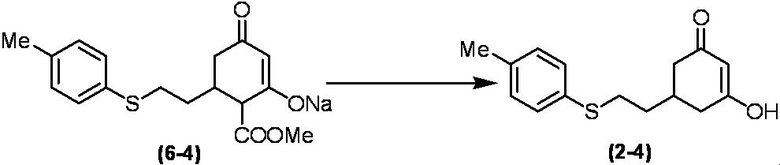
5 г соединения, представленного формулой (6-4), растворяли в 80 мл воды при комнатной температуре. К полученному раствору добавляли 4,6 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 2,9 г соединения, представленного формулой (2-4).
1H ЯМР (d-DMSO) δ м.д.: 11,04(1H,с), 7,23(2H,д), 7,13(2H,д), 5,19(1H,с), 2,95(2H,т), 2,42-1,99(8H,м), 1,60-1,58(2H,м)
<Получение соединения, представленного формулой 1-7>
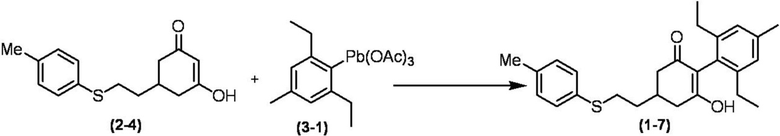
450 мг соединения, представленного формулой (2-4), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 340 мг соединения, представленного формулой (1-7).
1H ЯМР (CDCl3) δ м.д.: 7,27(2H,д), 7,12(2H,д), 6,98(2H,с), 5,47(1H,с), 2,96(2H,дт), 2,67(2H,ддд), 2,45-2,21(13H,м), 1,80(2H,кв), 1,06(6H,дт)
Пример получения 1-8: Получение соединения, представленного формулой (1-8)
<Получение соединения, представленного формулой 9-5>
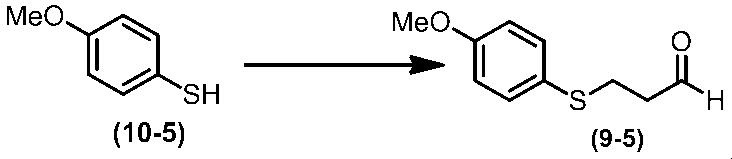
4 г соединения, представленного формулой (10-5), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 2,5 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 5,5 г соединения, представленного формулой (9-5).
1H ЯМР (CDCl3) δ м.д.: 9,73(1H,с), 7,36(2H,д), 6,85(2H,д), 3,80(3H,с), 3,06(2H,т), 2,68(2H,т)
<Получение соединения, представленного формулой 6-5>
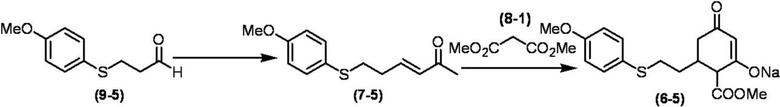
5,5 г соединения, представленного формулой (9-5), и 10 г трифенилфосфинацетилметилена растворяли в 40 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 5,4 г соединения, представленного формулой (7-5).
Затем 4,8 г 28% раствора метоксида натрия в метаноле и 3,3 г соединения, представленного формулой (8-1), растворяли в 70 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 5,4 г соединения, представленного формулой (7-5). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 5,7 г соединения, представленного формулой (6-5).
1H ЯМР (d-DMSO) δ м.д.: 7,28(2H,д), 6,90(2H,д), 4,38(1H,с), 3,75(3H,с), 3,47(3H,с), 2,90-2,69(3H,м), 2,30-2,22(1H,м), 2,04(1H,дд), 1,74-1,66(1H,м), 1,45-1,33(2H,м)
<Получение соединения, представленного формулой 1-8>
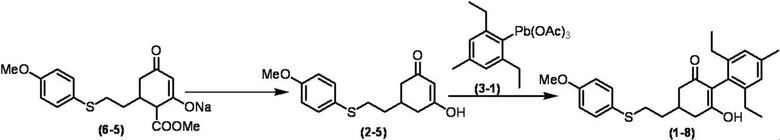
5 г соединения, представленного формулой (6-5), растворяли в 80 мл воды при комнатной температуре. К полученному раствору добавляли 4,4 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 3,8 г соединения, представленного формулой (2-5).
Затем 480 мг соединения, представленного формулой (2-5), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 174 мг соединения, представленного формулой (1-8).
1H ЯМР (CDCl3) δ м.д.: 7,36(2H,дд), 6,97(2H,д), 6,86(2H,дд), 5,57(1H,с), 3,80(3H,3H), 2,92-2,88(2H,м), 2,69-2,60(2H,м), 2,44-2,19(10H,м), 1,75(2H,дд), 1,06(6H,дт)
Пример получения 1-9: Получение соединения, представленного формулой (1-9)
<Получение соединения, представленного формулой 9-6>
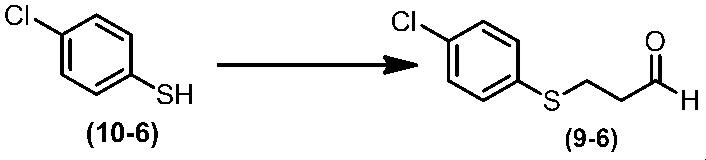
10 г соединения, представленного формулой (10-6), и 20 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 5,6 г 95% акролеина и 0,2 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 13 г соединения, представленного формулой (9-6).
1H ЯМР (CDCl3) δ м.д.: 9,73(1H,с), 7,29-7,20(4H,м), 3,14(2H,т), 2,75(2H,т)
<Получение соединения, представленного формулой 7-6>
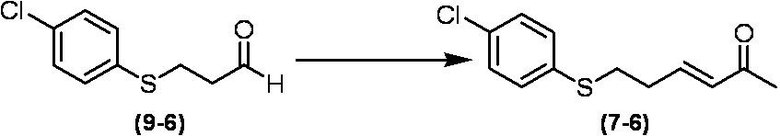
10 г соединения, представленного формулой (9-6), и 17,4 г трифенилфосфинацетилметилена растворяли в 60 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 9,4 г соединения, представленного формулой (7-6).
1H ЯМР (CDCl3) δ м.д.: 7,31-7,22(4H,м), 6,80-6,70(1H,м), 6,08(1H,д), 3,00(2H,м), 2,52(2H,м), 2,23(3H,с)
<Получение соединения, представленного формулой 6-6>
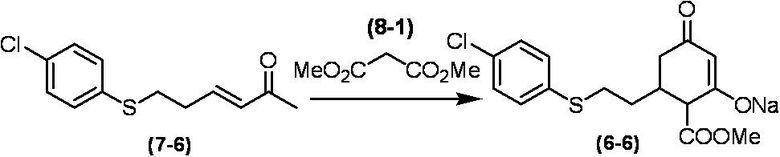
8,3 г 28% раствора метоксида натрия в метаноле и 5,7 г соединения, представленного формулой (8-1), растворяли в 100 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 9,4 г соединения, представленного формулой (7-6). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 10 г соединения, представленного формулой (6-6).
1H ЯМР (d-DMSO) δ м.д.: 7,36(2H,д), 7,30(2H,д), 4,38(1H,с), 3,48(3H,с), 3,00(1H,м), 2,84(2H,м), 2,32-2,22(1H,м), 2,09(1H,м), 1,78-1,71(1H,м), 1,44(2H,м)
<Получение соединения, представленного формулой 2-6>
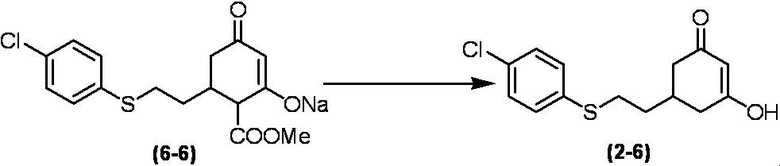
5 г соединения, представленного формулой (6-6), растворяли в 80 мл воды при комнатной температуре. К полученному раствору добавляли 4,4 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 2,9 г соединения, представленного формулой (2-6).
1H ЯМР (d-DMSO) δ м.д.: 11,06(1H,с), 7,36(4H,м), 5,19(1H,с), 3,01(2H,т), 2,32-1,99(5H,м), 1,62(2H,м)
<Получение соединения, представленного формулой 1-9>
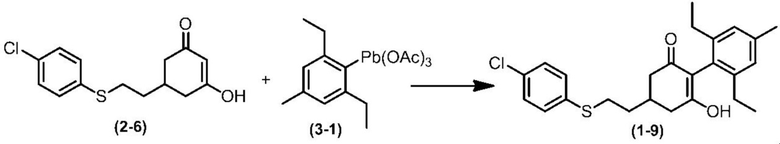
490 мг соединения, представленного формулой (2-6), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 350 мг соединения, представленного формулой (1-9).
1H ЯМР (CDCl3) δ м.д.: 7,29-7,24(4H,м), 6,97(2H,с), 5,66(1H,с), 3,02-2,93(2H,м), 2,66(2H,тт), 2,45-2,21(10H,м), 1,80(2H,кв), 1,10-1,01(6H,м)
Пример получения 1-10: Получение соединения, представленного формулой (1-10)
<Получение соединения, представленного формулой 6-7>
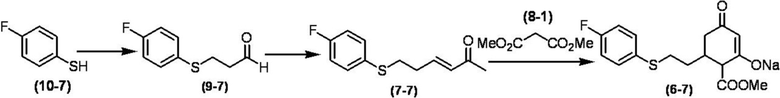
10 г соединения, представленного формулой (10-7), и 25 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 6,7 г 95% акролеина и 0,2 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 14 г соединения, представленного формулой (9-7).
Затем 14 г соединения, представленного формулой (9-7), и 30 г трифенилфосфинацетилметилена растворяли в 100 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 13 г соединения, представленного формулой (7-7).
Затем 12 г 28% раствора метоксида натрия в метаноле и 8,4 г соединения, представленного формулой (8-1), растворяли в 150 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 13 г соединения, представленного формулой (7-7). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 14,2 г соединения, представленного формулой (6-7).
1H ЯМР (d-DMSO) δ м.д.: 7,36(2H,ддд), 7,17(2H,тт), 4,37(1H,с), 3,49(3H,с), 3,00-2,93(1H,м), 2,85-2,77(2H,м), 2,27(1H,тдд), 2,06(1H,дд), 1,73(1H,дт), 1,42(2H,тт)
<Получение соединения, представленного формулой 2-7>
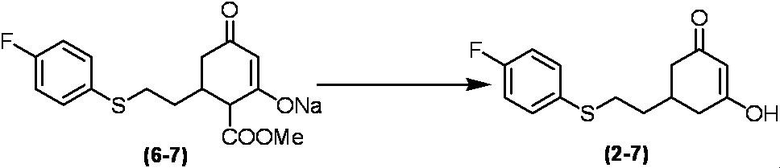
5 г соединения, представленного формулой (6-7), растворяли в 80 мл воды при комнатной температуре. К полученному раствору добавляли 4,6 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 2,4 г соединения, представленного формулой (2-7).
1H ЯМР (d-DMSO) δ м.д.: 11,04 (1H,с), 7,40 (2H,ддд), 7,17 (2H,тт), 5,19 (1H,с), 2,98 (2H,т), 2,28-1,91 (5H,м), 1,60 (2H,дд)
<Получение соединения, представленного формулой 1-10>
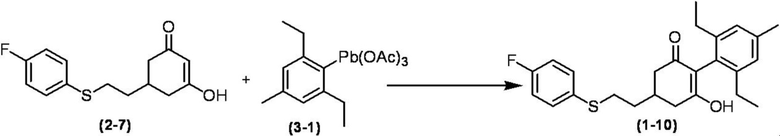
460 мг соединения, представленного формулой (2-7), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 330 мг соединения, представленного формулой (1-10).
1H ЯМР (CDCl3) δ м.д.: 7,39-7,33 (2H,м), 7,04-6,98 (2H,м), 6,97 (2H,с), 5,62 (1H,с), 2,95 (2H,ддд), 2,65 (2H,дд), 2,45-2,21 (10H,м), 1,78 (2H,кв), 1,06 (6H,ддд)
Пример получения 1-11: Получение соединения, представленного формулой (1-11)
<Получение соединения, представленного формулой 9-8>
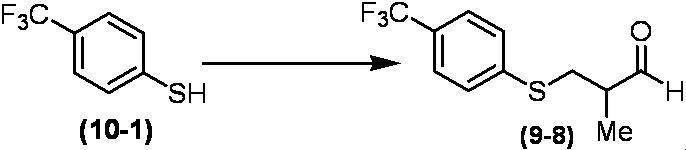
5 г соединения, представленного формулой (10-1), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 2,6 г метакролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 6,9 г соединения, представленного формулой (9-8).
1H ЯМР (CDCl3) δ м.д.: 9,69 (1H,с), 7,53 (2H,д), 7,40 (2H,д), 3,42-3,35 (1H,м), 3,00-2,95 (1H,м), 2,67 (1H,дд), 1,28 (3H,дд)
<Получение соединения, представленного формулой 7-8>
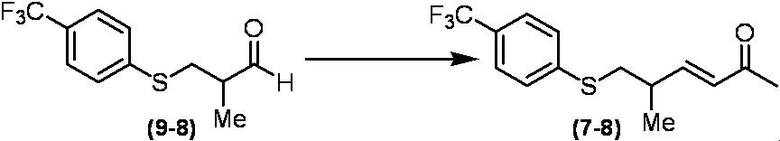
6,9 г соединения, представленного формулой (9-8), и 10 г трифенилфосфинацетилметилена растворяли в 50 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 5,3 г соединения, представленного формулой (7-8).
1H ЯМР (CDCl3) δ м.д.: 7,52 (2H,д), 7,36 (2H,д), 6,72 (1H,дд), 6,09 (1H,дд), 3,03 (2H,ддд), 2,67 (1H,дт), 2,24 (3H,с), 1,25 (3H,д)
<Получение соединения, представленного формулой 2-8>
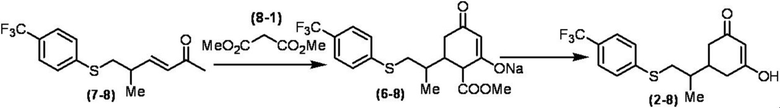
3,9 г 28% раствора метоксида натрия в метаноле и 2,7 г соединения, представленного формулой (8-1), растворяли в 60 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 5,3 г соединения, представленного формулой (7-8). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и к смеси добавляли гексан. Затем реакционную жидкость охлаждали льдом и осажденные кристаллы собирали фильтрованием и тщательно промывали гексаном, с получением, таким образом, 4,4 г соединения, представленного формулой (6-8).
Затем 1,6 г соединения, представленного формулой (6-8), растворяли в 30 мл воды при комнатной температуре. К полученному раствору добавляли 1,3 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении, с получением, таким образом, 1,3 г соединения, представленного формулой (2-8).
1H ЯМР (d-DMSO) δ м.д.: 7,52 (2H,т), 7,35 (2H,д), 5,51 (1H,с), 3,42 (1H,с), 3,09-2,82 (2H,м), 2,67 (1H,д), 2,46(2H,дт), 2,25 (2H,ддд), 1,90-1,84 (1H,м), 1,09 (3H,дд)
<Получение соединения, представленного формулой 1-11>
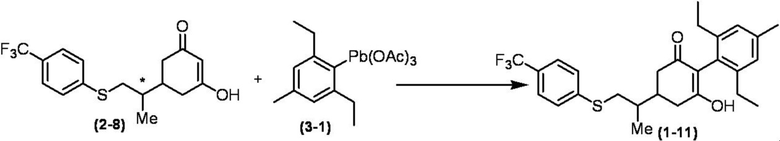
570 мг соединения, представленного формулой (2-8), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 480 мг соединения, представленного формулой (1-11).
1H ЯМР (CDCl3) δ м.д.: 7,53 (2H,д), 7,38 (2H,д), 6,98 (2H,с), 5,54 (1H,с), 3,22-3,14 (1H,м), 2,87 (1H,ддд), 2,67-2,23 (12H,м), 1,95-1,88 (1H,м), 1,16 (3H,дд), 1,11-1,04 (6H,м)
Пример получения 1-12: Получение соединения, представленного формулой (1-12)
<Получение соединения, представленного формулой 1-12>
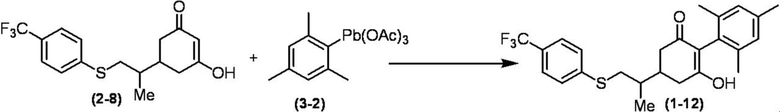
600 мг соединения, представленного формулой (2-8), и 1,1 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота в колбе. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-2), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 540 мг соединения, представленного формулой (1-12).
1H ЯМР (CDCl3) δ м.д.: 7,53 (2H,д), 7,38 (2H,д), 6,94 (2H,с), 5,56 (1H,с), 3,16 (1H,ддд), 2,87 (1H,ддд), 2,65-2,25 (8H,м), 2,08 (3H,д), 2,01 (3H,с), 1,90 (1H,тд), 1,15 (3H,дд)
Соединение, полученное в соответствии с Примером получения 1-12, показано ниже.
<Соединение, представленное формулой 1-162>
1H ЯМР (CDCl3) δ м.д.: 7,28-7,22(1H,м), 7,09(1H,д), 7,03 (1H,дт), 6,93 (2H,с), 6,90-6,85 (1H,м), 5,73 (1H,с), 3,10(1H,с), 2,83 (1H,дт), 2,60-2,22 (8H,м), 2,06-1,97 (6H,м), 1,86 (1H,с), 1,13 (3H,д)
Пример получения 1-13: Получение соединения, представленного формулой (1-13)
<Получение соединения, представленного формулой 9-9>
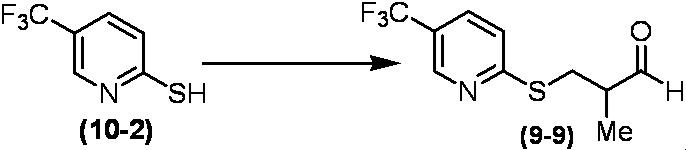
5 г соединения, представленного формулой (10-2), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 2,6 г метакролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 6,3 г соединения, представленного формулой (9-9).
1H ЯМР (CDCl3) δ м.д.: 9,72(1H,с), 8,66(1H,с), 7,66(1H,д), 7,27(1H,д), 3,56(1H,ддд), 3,38-3,31(1H,м), 2,84(1H,дд), 1,27-1,25(3H,м)
<Получение соединения, представленного формулой 7-9>
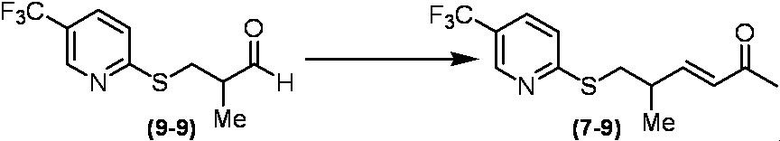
6,6 г соединения, представленного формулой (9-9), и 9 г трифенилфосфинацетилметилена растворяли в 40 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 2,8 г соединения, представленного формулой (7-9).
1H ЯМР (CDCl3) δ м.д.: 8,66(1H,с), 7,67-7,65(1H,м), 7,28(1H,д), 6,77(1H,дд), 6,10 (1H,дд), 3,32 (2H,ддд), 2,79-2,72 (1H,м), 2,22 (3H,с), 1,25 (3H,д)
<Получение соединения, представленного формулой 2-9>
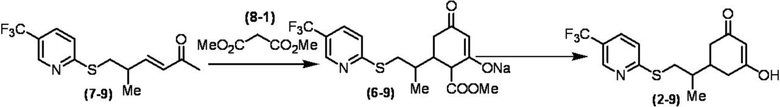
2,1 г 28% раствора метоксида натрия в метаноле и 1,4 г соединения, представленного формулой (8-1), растворяли в 40 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 2,8 г соединения, представленного формулой (7-9). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и к смеси добавляли гексан. Затем реакционную жидкость охлаждали льдом и осажденные кристаллы собирали фильтрованием и тщательно промывали гексаном, с получением, таким образом, 2,0 г соединения, представленного формулой (6-9).
Затем 1,8 г соединения, представленного формулой (6-9), растворяли в 25 мл воды при комнатной температуре в колбе. К полученному раствору добавляли 1,5 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении, с получением, таким образом, 1,3 г соединения, представленного формулой (2-9).
1H ЯМР (CDCl3) δ м.д.: 8,66 (1H,с), 7,67-7,64 (1H,м), 7,25-7,19 (1H,м), 5,52 (1H,с), 3,49-3,41 (1H,м), 3,05-2,96 (1H,м), 2,75 (1H,дд), 2,58-2,45 (2H,м), 2,37-2,18 (2H,м), 1,98-1,88 (1H,м), 1,06 (3H,дд)
<Получение соединения, представленного формулой 1-13>
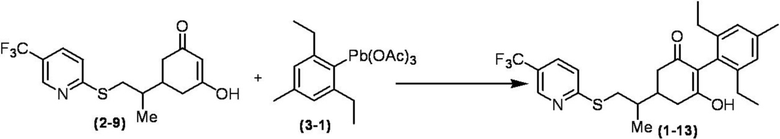
570 мг соединения, представленного формулой (2-9), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 570 мг соединения, представленного формулой (1-13). Полученное соединение, представленное формулой (1-13), разделяли на пик при времени удерживания 13 минут (далее указан как 1-13-A) и пик при времени удерживания 16 минут (далее указан как 1-13-B) с использованием хиральной колонки (CHIRALPAK (зарегистрированная торговая марка) IC-3 (изготовитель Daicel Corporation, 4,6 мм ×250 мм, 3 мкм, детектор: 254 нм) в следующих условиях: температура колонки 40°C, скорость потока подвижной фазы 2,0 мл/мин CO2 и 0,15 мл/мин MeOH, и обратное давление 15 МПа.
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H,с), 7,66 (1H,дд), 7,28 (1H,д), 6,98 (2H,с), 5,54 (1H,с), 3,59 (1H,ддд), 3,02 (1H,дддд), 2,76-2,26 (12H,м), 1,95 (1H,т), 1,15 (3H,дт), 1,09-1,02 (6H,м)
Пример получения 1-14: Получение соединения, представленного формулой (1-14)
<Получение соединения, представленного формулой 1-14>

450 мг соединения, представленного формулой (2-9), и 600 мг диметиламинопиридина растворяли в смеси 2,5 мл хлороформа и 0,5 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 500 мг соединения, представленного формулой (3-2), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 320 мг соединения, представленного формулой (1-14).
1H ЯМР (CDCl3) δ м.д.: 8,66(1H,с), 7,66(1H,дд), 7,27(1H,д), 6,93(2H,с), 5,65(1H,с), 3,57(1H,ддд), 3,07-2,96(1H,м), 2,74-2,27(6H,м), 2,07-1,94(9H,м), 1,17-1,10(3H,м)
Пример получения 1-15: Получение соединения, представленного формулой (1-15)
<Получение соединения, представленного формулой 7-10>
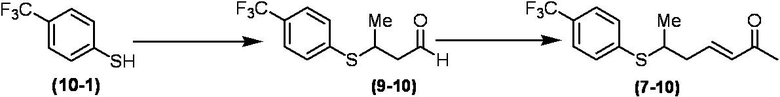
3 г соединения, представленного формулой (10-1), и 10 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 1,5 г кротональдегида и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 4,4 г соединения, представленного формулой (9-10).
Затем 4,4 г соединения, представленного формулой (9-10), и 6,2 г трифенилфосфинацетилметилена растворяли в 25 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 3,7 г соединения, представленного формулой (7-10).
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,д), 7,45(2H,д), 6,79(1H,дт), 6,14-6,10(1H,м), 3,51(1H,кв), 2,60-2,45(2H,м), 2,24(3H,с), 1,36(3H,д)
<Получение соединения, представленного формулой 2-10>
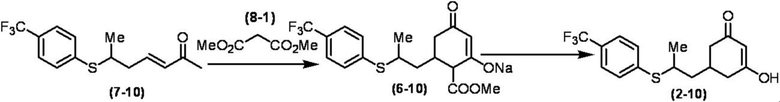
2,7 г 28% раствора метоксида натрия в метаноле и 1,8 г соединения, представленного формулой (8-1), растворяли в 40 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 3,7 г соединения, представленного формулой (7-10). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и к смеси добавляли гексан. Затем реакционную жидкость охлаждали льдом и осажденные кристаллы собирали фильтрованием и тщательно промывали гексаном, с получением, таким образом, 2,9 г соединения, представленного формулой (6-10).
Затем 2,9 г соединения, представленного формулой (6-10), растворяли в 40 мл воды при комнатной температуре. К полученному раствору добавляли 2,3 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении, с получением, таким образом, 2,1 г соединения, представленного формулой (2-10).
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,т), 7,42(2H,дд), 5,48(1H,с), 3,36(2H,тт), 2,78(2H,д), 2,53-2,34(2H,м), 2,13(1H,дд), 1,75-1,53(2H,м), 1,34-1,29(3H,м)
<Получение соединения, представленного формулой 1-15>
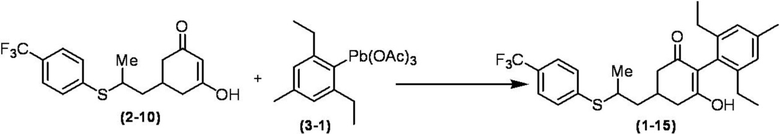
570 мг соединения, представленного формулой (2-10), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 360 мг соединения, представленного формулой (1-15).
1H ЯМР (CDCl3) δ м.д.: 7,56-7,52(2H,м), 7,46-7,41(2H,м), 6,98(2H,с), 5,53(1H,с), 3,49-3,42(1H,м), 2,76-2,23(12H,м), 1,83-1,71(2H,м), 1,38(3H,дд), 1,06(6H,тт)
Пример получения 1-16: Получение соединения, представленного формулой (1-16)
<Получение соединения, представленного формулой 9-11>
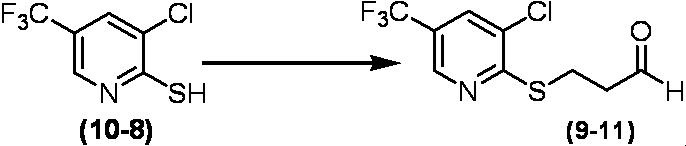
2 г соединения, представленного формулой (10-8), и 10 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 0,8 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 2,5 г соединения, представленного формулой (9-11).
1H ЯМР (CDCl3) δ м.д.: 9,84(1H,с), 8,59(1H,с), 7,76(1H,с), 3,49 (2H,т), 2,96 (2H,т)
<Получение соединения, представленного формулой 7-11>
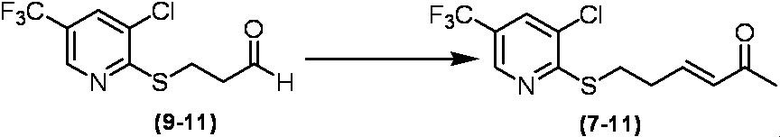
2,5 г соединения, представленного формулой (9-11), и 3,4 г трифенилфосфинацетилметилена растворяли в 15 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 1,2 г соединения, представленного формулой (7-11).
1H ЯМР (CDCl3) δ м.д.: 8,60 (1H,с), 7,76 (1H,с), 6,84 (1H,дт), 6,16 (1H,дт), 3,36 (2H,т), 2,68 (2H,ддд), 2,26 (3H,с)
<Получение соединения, представленного формулой 6-11>
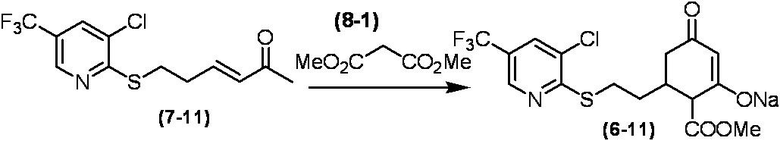
0,8 г 28% раствора метоксида натрия в метаноле и 0,56 г соединения, представленного формулой (8-1), растворяли в 15 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 1,2 г соединения, представленного формулой (7-11). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 0,8 г соединения, представленного формулой (6-11).
1H ЯМР (d-DMSO) δ м.д.: 8,81(1H,с), 8,34(1H,с), 4,38(1H,с), 3,50(3H,с), 3,42-3,25(1H,м), 3,15-3,07(1H,м), 2,82(1H,д), 2,33-2,23(1H,м), 2,12(1H,дд), 1,79(1H,дт), 1,63-1,50(2H,м)
<Получение соединения, представленного формулой 2-11>
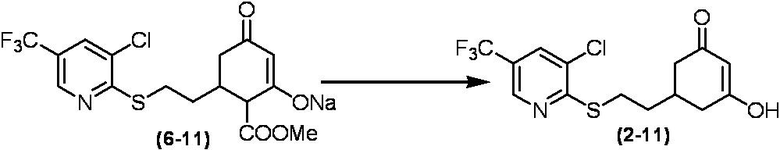
0,8 г соединения, представленного формулой (6-11), растворяли в 10 мл воды при комнатной температуре в колбе. К полученному раствору добавляли 0,6 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 0,6 г соединения, представленного формулой (2-11).
1H ЯМР (d-DMSO) δ м.д.: 11,06 (1H,с), 8,81 (1H,д), 8,35(1H,д), 5,20 (1H,с), 3,27 (2H,т), 2,51-1,91 (5H,м), 1,74 (2H,д)
<Получение соединения, представленного формулой 1-16>
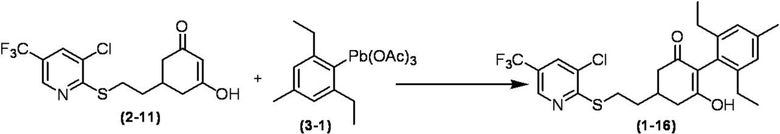
600 мг соединения, представленного формулой (2-11), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 360 мг соединения, представленного формулой (1-16).
1H ЯМР (CDCl3) δ м.д.: 8,60(1H,с), 7,75(1H,д), 6,97(2H,с), 5,71(1H,с), 3,31(2H,ддд), 2,75(2H,т), 2,51-2,23(10H,м), 1,94-1,88(2H,м), 1,09-1,00(6H,м)
Пример получения 1-17: Получение соединения, представленного формулой (1-17)
<Получение соединения, представленного формулой 7-12>
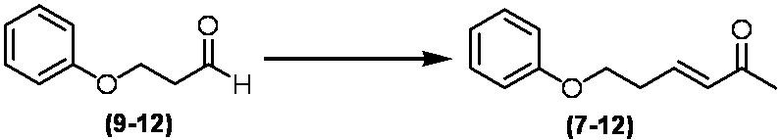
9,3 г соединения, представленного формулой (9-12), и 22 г трифенилфосфинацетилметилена растворяли в 90 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 2,1 г соединения, представленного формулой (7-12).
1H ЯМР (CDCl3) δ м.д.: 7,31-7,23(2H,м), 6,95(1H,тт), 6,92-6,82 (3H,м), 6,21-6,14 (1H,м), 4,09 (2H,т), 2,69 (2H,кв), 2,24 (3H,с)
<Получение соединения, представленного формулой 6-12>
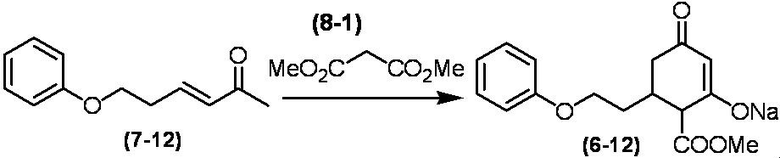
2,3 г 28% раствора метоксида натрия в метаноле и 1,6 г соединения, представленного формулой (8-1), растворяли в 40 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 2,1 г соединения, представленного формулой (7-12). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 2,6 г соединения, представленного формулой (6-12).
1H ЯМР (d-DMSO) δ м.д.: 7,27(2H,т), 6,92-6,89(3H,м), 4,40 (1H,с), 4,38-3,89 (2H,м), 3,54 (3H,с), 2,87 (1H,д), 2,40-2,30 (1H,м), 2,08 (1H,дд), 1,81 (1H,дд), 1,72-1,64 (1H,м), 1,60-1,51 (1H,м)
<Получение соединения, представленного формулой 2-12>
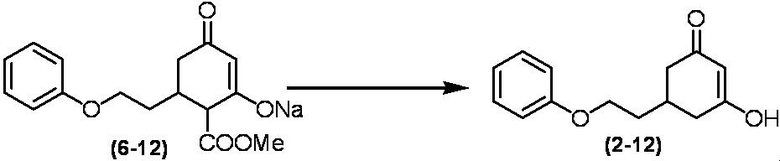
2,0 г соединения, представленного формулой (6-12), растворяли в 40 мл воды при комнатной температуре. К полученному раствору добавляли 2,0 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси промывали трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,2 г соединения, представленного формулой (2-12).
1H ЯМР (d-DMSO) δ м.д.: 11,06 (1H, с), 7,28 (2H, т), 6,92 (2H, дд), 5,20 (1H, с), 4,02 (2H, т), 2,50-1,99 (5H, м), 1,79 (2H, д)
<Получение соединения, представленного формулой 1-17>
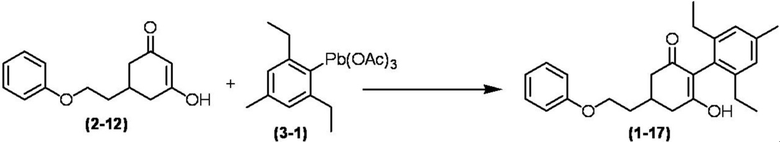
400 мг соединения, представленного формулой (2-12), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 380 мг соединения, представленного формулой (1-17).
1H ЯМР (CDCl3) δ м.д.: 7,32-7,27(2H,м), 6,97-6,89(5H,м), 5,68(1H,с), 4,11-4,06(2H,м), 2,78-2,69(2H,м), 2,60-2,25(10H,м), 1,97(2H,ддд), 1,11-1,05(6H,м)
Пример получения 1-18: Получение соединения, представленного формулой (1-18)
<Получение соединения, представленного формулой 7-13>
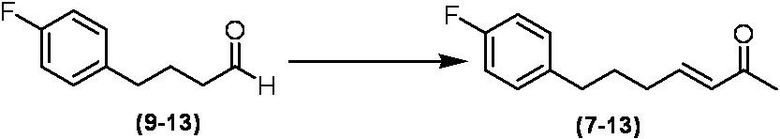
3,5 г соединения, представленного формулой (9-13), и 7,5 г трифенилфосфинацетилметилена растворяли в 30 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 1,1 г соединения, представленного формулой (7-13).
1H ЯМР (CDCl3) δ м.д.: 7,14-7,09(2H,м), 6,99-6,93(2H,м), 6,79 (1H,дт), 6,08 (1H,дт), 2,62 (2H,т), 2,27-2,20 (5H,м), 1,82-1,74 (2H,м)
<Получение соединения, представленного формулой 2-13>
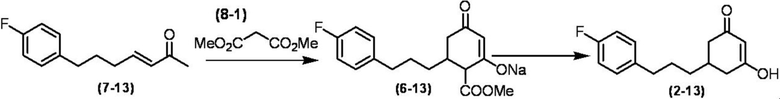
1,1 г 28% раствора метоксида натрия в метаноле и 0,8 г соединения, представленного формулой (8-1), растворяли в 20 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 1,1 г соединения, представленного формулой (7-13). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,0 г соединения, представленного формулой (6-13).
Затем 1,0 г соединения, представленного формулой (6-13), растворяли в 20 мл воды при комнатной температуре. К полученному раствору добавляли 1,0 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 650 мг соединения, представленного формулой (2-13).
1H ЯМР (d-DMSO) δ м.д.: 10,99(1H,с), 7,25-7,21(2H,м), 7,11-7,05(2H,м), 5,18(1H,с), 2,55(2H,т), 2,43-1,91(5H,м), 1,61-1,53(2H,м), 1,35-1,32(2H,м)
<Получение соединения, представленного формулой 1-18>
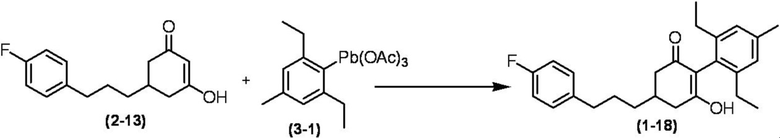
430 мг соединения, представленного формулой (2-13), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 440 мг соединения, представленного формулой (1-18).
1H ЯМР (CDCl3) δ м.д.: 7,15-7,11(2H,м), 6,99-6,93(4H,м), 5,60(1H,с), 2,67-2,61(4H,м), 2,40-2,19(10H,м), 1,74-1,66(2H,м), 1,52-1,46(2H,м), 1,08-1,00(6H,м)
Пример получения 1-19: Получение соединения, представленного формулой (1-69)
<Получение соединения, представленного формулой 7-14>
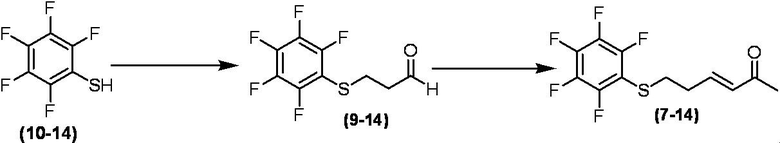
9,0 г соединения, представленного формулой (10-14), и 30 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 3,6 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 11 г соединения, представленного формулой (9-14).
Затем 11 г соединения, представленного формулой (9-14), и 15,8 г трифенилфосфинацетилметилена растворяли в 50 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:5), с получением, таким образом, 2,65 г соединения, представленного формулой (7-14).
1H ЯМР (CDCl3) δ м.д.: 6,79-6,71 (1H, м), 6,11 (1H, дт), 3,02 (2H, тд), 2,51 (2H, дт), 2,25(3H, дд)
<Получение соединения, представленного формулой 6-14>
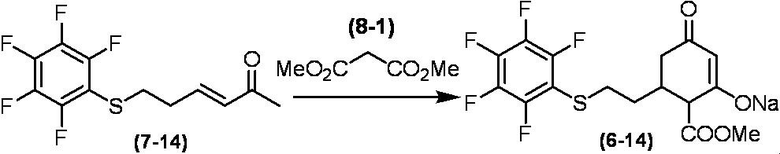
1,9 г 28% раствора метоксида натрия в метаноле и 1,3 г соединения, представленного формулой (8-1), растворяли в 35 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 2,65 г соединения, представленного формулой (7-14). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,1 г соединения, представленного формулой (6-14).
1H ЯМР (d-DMSO) δ м.д.: 4,39 (1H,с), 3,49 (3H,с), 2,99-2,92 (1H,м), 2,86-2,76 (2H,м), 2,28-2,19 (1H,м), 2,05-1,99 (1H,м), 1,76-1,65 (1H,м), 1,44-1,33 (2H,м)
<Получение соединения, представленного формулой 1-69>
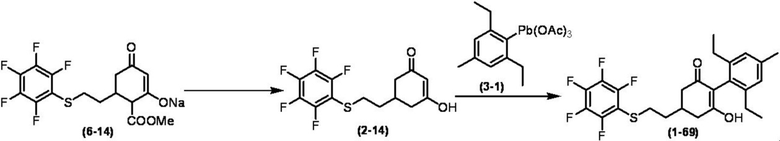
1,1 г соединения, представленного формулой (6-14), растворяли в 20 мл воды при комнатной температуре. К полученному раствору добавляли 840 мг безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и реакционную жидкость подкисляли путем добавления 2 н раствора хлористоводородной кислоты, с последующим экстрагированием этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 800 мг соединения, представленного формулой (2-14).
Затем 580 мг соединения, представленного формулой (2-14), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 150 мг соединения, представленного формулой (1-69).
1H ЯМР (CDCl3) δ м.д.: 6,99 (2H,с), 5,56 (1H,с), 3,00-2,95 (2H,м), 2,71-2,62 (2H,м), 2,47-2,22 (10H,м), 1,75 (2H,дд), 1,10-1,04 (6H,м)
Пример получения 1-20: Получение соединения, представленного формулой (1-31)
<Получение соединения, представленного формулой 9-15>
3,3 г соединения, представленного формулой (10-15), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 1,4 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 4,2 г соединения, представленного формулой (9-15).
1H ЯМР (CDCl3) δ м.д.: 9,76 (1H,с), 7,52 (2H,д), 7,37 (2H,д), 3,21-3,16 (2H,м), 2,80-2,76 (2H,м)
<Получение соединения, представленного формулой 7-15>
4,2 г соединения, представленного формулой (9-15), и 6,0 г трифенилфосфинацетилметилена растворяли в 20 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 2,7 г соединения, представленного формулой (7-15).
1H ЯМР (CDCl3) δ м.д.: 7,37(2H,д), 7,16(2H,д), 6,77(1H,дт), 6,09(1H,д), 3,04(2H,т), 2,58-2,52(2H,м), 2,23(3H,с)
<Получение соединения, представленного формулой 6-15>
2 г 28% раствора метоксида натрия в метаноле и 1,4 г соединения, представленного формулой (8-1), растворяли в 40 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 2,7 г соединения, представленного формулой (7-15). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,8 г соединения, представленного формулой (6-15).
1H ЯМР (d-DMSO) δ м.д.: 7,39(2H,д), 7,31(2H,д), 4,40(1H,с), 3,47(3H,с), 3,07-3,01(1H,м), 2,92-2,80(2H,м), 2,34-2,24(1H,м), 2,09(1H,дд), 1,75(1H,дд), 1,51-1,40(2H,м)
<Получение соединения, представленного формулой 1-31>
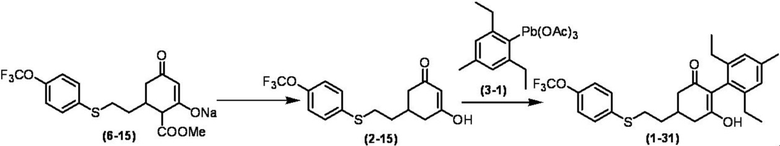
1,8 г соединения, представленного формулой (6-15), растворяли в 35 мл воды при комнатной температуре. К полученному раствору добавляли 1,4 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и реакционную жидкость подкисляли путем добавления 2 н раствора хлористоводородной кислоты, с последующим экстрагированием этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,6 г соединения, представленного формулой (2-15).
Затем 570 мг соединения, представленного формулой (2-15), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 290 мг соединения, представленного формулой (1-31).
1H ЯМР (CDCl3) δ м.д.: 7,36(2H,д), 7,15(2H,д), 6,98(2H,с), 5,59(1H,с), 3,00(2H,ддд), 2,71-2,65(2H,м), 2,48-2,22(10H,м), 1,83(2H,кв), 1,10-1,03(6H,м)
Пример получения 1-21: Получение соединения, представленного формулой (1-73)
<Получение соединения, представленного формулой 7-16>
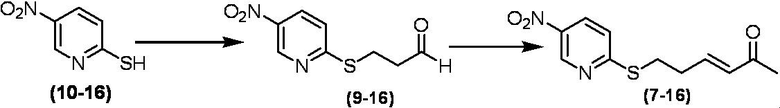
5,0 г соединения, представленного формулой (10-16), и 30 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 2,8 г 95% акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 6,7 г соединения, представленного формулой (9-16).
Затем 6,7 г соединения, представленного формулой (9-16), и 11,2 г трифенилфосфинацетилметилена растворяли в 40 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 5,0 г соединения, представленного формулой (7-16).
1H ЯМР (CDCl3) δ м.д.: 9,23(1H,д), 8,25-8,21(1H,м), 7,32-7,28(1H,м), 6,83(1H,дт), 6,16(1H,д), 3,41(2H,т), 2,72-2,67(2H,м), 2,24(3H,с)
<Получение соединения, представленного формулой 6-14>
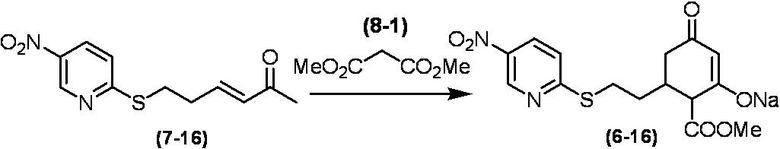
4,2 г 28% раствора метоксида натрия в метаноле и 2,9 г соединения, представленного формулой (8-1), растворяли в 80 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 5,0 г соединения, представленного формулой (7-16). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 4,9 г соединения, представленного формулой (6-16).
1H ЯМР (d-DMSO) δ м.д.: 9,21 (1H, д), 8,36 (1H, дд), 7,54 (1H, дд), 4,38 (1H, с), 3,52 (3H, с), 3,34-2,82 (3H, м), 2,33-2,24 (1H, м), 2,16-2,11 (1H, м), 1,83-1,74 (1H, м), 1,61-1,53 (2H, м)
<Получение соединения, представленного формулой 1-73>
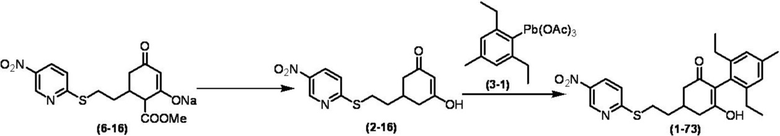
3,0 г соединения, представленного формулой (6-16), растворяли в 65 мл воды при комнатной температуре. К полученному раствору добавляли 2,7 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,1 г соединения, представленного формулой (2-16).
Затем 500 мг соединения, представленного формулой (2-16), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 2:3), с получением, таким образом, 50 мг соединения, представленного формулой (1-73).
1H ЯМР (CDCl3) δ м.д.: 9,25 (1H,д), 8,23 (1H,дт), 7,30 (1H,д), 6,98 (2H,с), 5,58 (1H,с), 3,36 (2H,т), 2,80-2,71 (2H,м), 2,52-2,25 (10H,м), 1,96-1,90 (2H,м), 1,09-1,03(6H,м)
Пример получения 1-22: Получение соединения, представленного формулой (1-74)
<Получение соединения, представленного формулой 7-17>
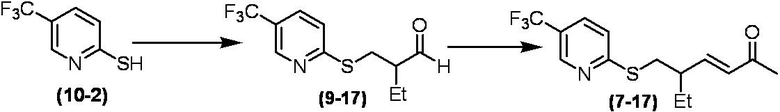
3,0 г соединения, представленного формулой (10-2), и 15 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 1,85 г 2-этилакролеин и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 1,5 часов при охлаждении льдом. Затем к полученной смеси добавляли воду. Полученную смесь экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 4,3 г соединения, представленного формулой (9-17).
Затем 4,3 г соединения, представленного формулой (9-17), и 5,8 г трифенилфосфинацетилметилена растворяли в 20 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 1,1 г соединения, представленного формулой (7-17).
1H ЯМР (CDCl3) δ м.д.: 8,66 (1H,с), 7,67-7,64 (1H,м), 7,28-7,24 (1H,м), 6,66-6,59 (1H,м), 6,10(1H,дд), 3,45-3,24 (2H,м), 2,53-2,47 (1H,м), 2,20 (3H,с), 1,79-1,46 (2H,м), 0,96-0,92 (3H,м)
<Получение соединения, представленного формулой 1-74>
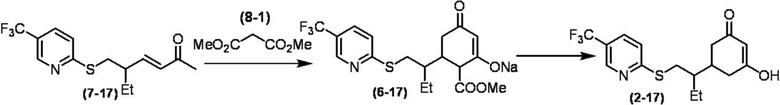
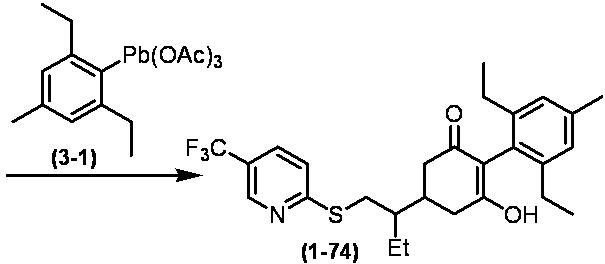
810 мг 28% раствора метоксида натрия в метаноле и 560 мг соединения, представленного формулой (8-1), растворяли в 15 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 1,1 г соединения, представленного формулой (7-17). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,6 г соединения, представленного формулой (6-17).
Затем 1,6 г соединения, представленного формулой (6-17), растворяли в 30 мл воды при комнатной температуре. К полученному раствору добавляли 1,2 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и реакционную жидкость подкисляли путем добавления 2 н раствора хлористоводородной кислоты, с последующим экстрагированием этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 1,2 г соединения, представленного формулой (2-17).
Затем 600 мг соединения, представленного формулой (2-17), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:5), с получением, таким образом, 200 мг соединения, представленного формулой (1-74).
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H,с), 7,66 (1H,дд), 7,27 (1H,д), 6,98 (2H,с), 5,52 (1H,с), 3,57-3,46 (1H,м), 3,31-3,17 (1H,м), 2,71-2,58 (3H,м), 2,44-2,25 (10H,м), 1,75-1,62 (2H,м), 1,08-1,00 (9H,м)
Пример получения 1-23: Получение соединения, представленного формулой (1-21)
<Получение соединения, представленного формулой 12-1>

31 г соединения, представленного формулой (11-1), 17 мл пиридина и 100 мл метиленхлорида смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и добавляли по каплям к смешанной жидкости, полученной путем растворения 11,4 г паратолуолсульфонилхлорида в 60 мл метиленхлорида. Полученную смешанную жидкость перемешивали при 0°C в течение 3 часов при охлаждении льдом. Полученную реакционную смешанную жидкость разбавляли этилацетатом и полученный продукт промывали насыщенным водным раствором гидрокарбоната натрия. Полученный этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 3:2), с получением, таким образом, 16 г (бесцветное маслянистое вещество) соединения, представленного формулой (12-1).
1H ЯМР (CDCl3) δ м.д.: 7,80-7,78 (2H,м), 7,34-7,30 (2H,м), 3,82 (2H,с), 3,37 (2H,с), 2,45 (3H,с), 0,88 (6H,с)
<Получение соединения, представленного формулой 13-1>
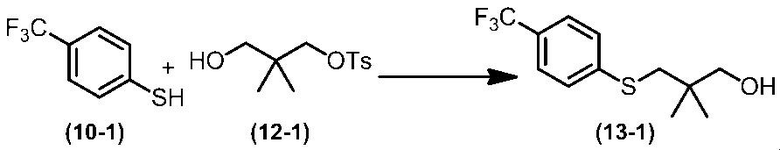
30 мл безводного N,N-диметилформамида добавляли к 1,55 г 60% гидрида натрия в атмосфере азота. К полученной смеси добавляли по каплям 7,2 г соединения, представленного формулой (10-1), при охлаждении льдом. Полученную смесь перемешивали в течение 25 минут при охлаждении льдом, затем к смеси добавляли по каплям раствор 8 г соединения, представленного формулой (12-1), в 15 мл безводного DMF и полученную смесь перемешивали при комнатной температуре в течение 1 часа, затем температуру реакции повышали до 90°C и смесь перемешивали в течение 8 часов. Полученную реакционную смешанную жидкость экстрагировали трет-бутилметиловым эфиром. Органические слои объединяли, промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, неочищенного продукта. Неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4 → 2:3), с получением, таким образом, 7,6 г соединения, представленного формулой (13-1), получали (маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 7,48 (2H,д), 7,39 (2H,д), 3,45 (2H,с), 3,02 (2H,с), 2,03 (1H,с), 1,01 (6H,с)
<Получение соединения, представленного формулой 9-18>
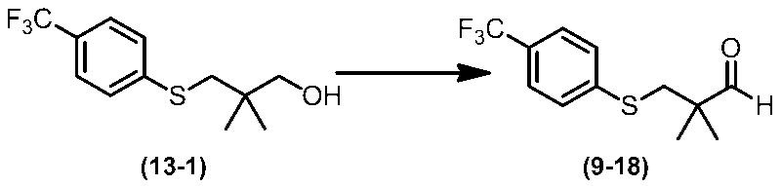
В атмосфере азота, смешанную жидкость, включающую 3,4 мл оксалилхлорида и 120 мл метиленхлорида, охлаждали до -78°C и к смеси медленно добавляли по каплям 5,7 мл диметилсульфоксида, с последующим перемешиванием в течение 10 минут. Затем к полученной смешанной жидкости добавляли по каплям раствор 7,6 г соединения, представленного формулой (13-1), в 50 мл метиленхлорида, с последующим перемешиванием в течение 30 минут. Затем к полученной смешанной жидкости добавляли 11,6 г триэтиламина и полученный продукт перемешивали при -78°C в течение 1 часа и далее перемешивали при 0°C в течение 6 часов при охлаждении льдом. Полученную реакционную жидкость разбавляли хлороформом и полученный продукт промывали 1 н водным раствором гидроксида натрия. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 6,7 г (маслянистое вещество) соединения, представленного формулой (9-18).
1H ЯМР (CDCl3) δ м.д.: 9,50 (1H, с), 7,51 (2H, д), 7,40 (2H, д), 3,16 (2H, с), 1,24 (6H, с)
<Получение соединения, представленного формулой 7-18>
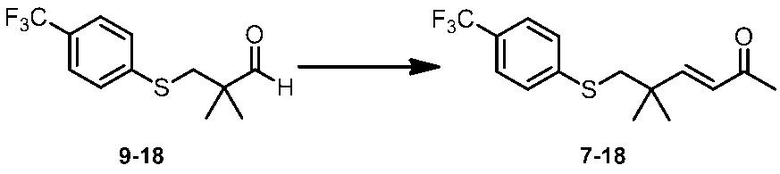
4,2 г соединения, представленного формулой (9-18), и 5,6 г трифенилфосфинацетилметилена растворяли в 20 мл ксилола при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 8 часов. Затем ксилол удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 4,1 г соединения, представленного формулой (7-18).
1H ЯМР (CDCl3) δ м.д.: 7,50 (2H,д), 7,38 (2H,д), 6,73 (1H,дд), 6,05 (1H,дд), 3,06 (2H,с), 2,17 (3H,с), 1,23 (6H,с)
<Получение соединения, представленного формулой 1-21>
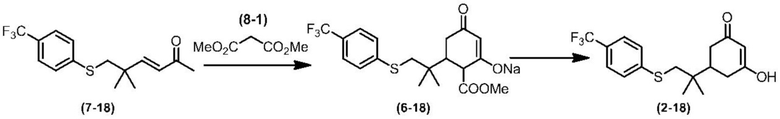
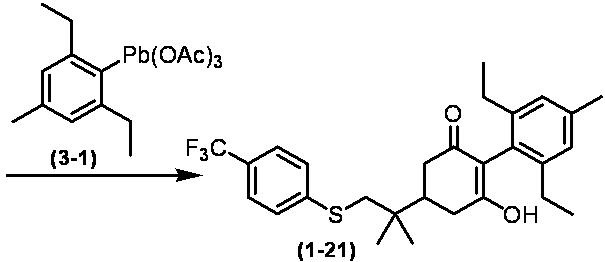
2,9 г 28% раствора метоксида натрия в метаноле и 2,0 г соединения, представленного формулой (8-1), растворяли в 35 мл 1,4-диоксана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 4,1 г соединения, представленного формулой (7-18). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную реакционную жидкость охлаждали до комнатной температуры и концентрировали при пониженном давлении и осажденные неочищенные кристаллы тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 5,7 г соединения, представленного формулой (6-18).
Затем 5,7 г соединения, представленного формулой (6-18), растворяли в 25 мл воды при комнатной температуре. К полученному раствору добавляли 1,05 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 970 мг соединения, представленного формулой (2-18).
Затем 970 мг соединения, представленного формулой (2-18), и 1,7 г диметиламинопиридина растворяли в смеси 7,5 мл хлороформа и 2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,5 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 300 мг (белое твердое вещество) соединения, представленного формулой (1-21).
1H ЯМР (CDCl3) δ м.д.: 7,52 (2H,д), 7,41 (2H,д), 6,99 (2H,с), 5,54 (1H,с), 3,04 (2H,дд), 2,67-2,24 (12H,м), 1,13-1,06 (12H,м)
Пример получения 1-24: Получение соединения, представленного формулой (1-22)
<Получение соединения, представленного формулой 13-2>
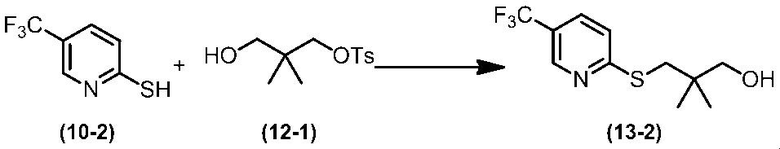
30 мл безводного N,N-диметилформамида добавляли к 1,55 г 60% гидрида натрия в атмосфере азота. К полученной смеси добавляли по каплям 7,2 г соединения, представленного формулой (10-2), при охлаждении льдом. Полученную смесь перемешивали в течение 25 минут при охлаждении льдом, затем к смеси добавляли по каплям раствор 8 г соединения, представленного формулой (12-1), в 15 мл безводного N,N-диметилформамида и полученную смесь перемешивали при комнатной температуре в течение 1 часа, затем температуру реакции повышали до 90°C и смесь перемешивали в течение 8 часов. Полученную реакционную смешанную жидкость экстрагировали трет-бутилметиловым эфиром. Органические слои объединяли, промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, неочищенного продукта. Неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 6,7 г соединения, представленного формулой (13-2).
1H ЯМР (CDCl3) δ м.д.: 8,61 (1H,с), 7,70-7,67 (1H,м), 7,36-7,32 (2H,м), 3,30 (2H,д), 3,23 (2H,д), 1,04 (6H,с)
<Получение соединения, представленного формулой 9-19>
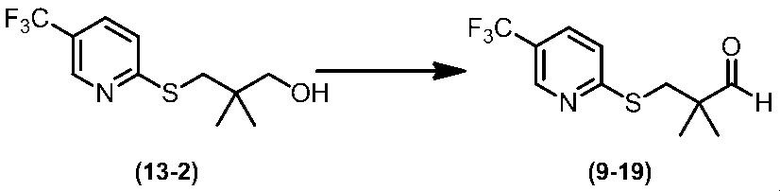
В атмосфере азота, смешанную жидкость, включающую 3,1 мл оксалилхлорида и 120 мл метиленхлорида, охлаждали до -78°C и к смеси медленно добавляли по каплям 5,0 мл диметилсульфоксида, с последующим перемешиванием в течение 10 минут. Затем к полученной смешанной жидкости добавляли по каплям раствор 6,7 г соединения, представленного формулой (13-2), в 50 мл метиленхлорида, с последующим перемешиванием в течение 30 минут. Затем к полученной смешанной жидкости добавляли 10,3 г триэтиламина и полученный продукт перемешивали при -78°C в течение 1 часа и перемешивали при 0°C в течение 6 часов при охлаждении льдом. Полученную реакционную жидкость разбавляли хлороформом и полученный продукт промывали 1 н водным раствором гидроксида натрия. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 6,2 г соединения, представленного формулой (9-19).
1H ЯМР (CDCl3) δ м.д.: 9,51 (1H,с), 8,64(1H,с), 7,65(1H,д), 7,27 (1H,д), 3,52 (2H,с), 1,24 (6H,с)
<Получение соединения, представленного формулой 7-19>
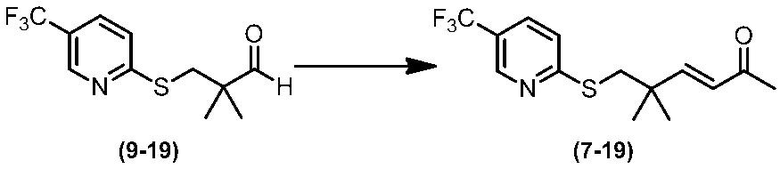
4,6 г соединения, представленного формулой (9-19), и 6,2 г трифенилфосфинацетилметилена растворяли в 25 мл ксилола при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 8 часов. Затем ксилол удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Затем полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 3,8 г соединения, представленного формулой (7-19).
1H ЯМР (CDCl3) δ м.д.: 8,64 (1H,с), 7,64 (1H,дд), 7,27 (1H,д), 6,04 (1H,д), 6,04 (1H,д), 3,43 (2H,с), 2,17 (3H,с), 1,22 (6H,с)
<Получение соединения, представленного формулой 1-22>
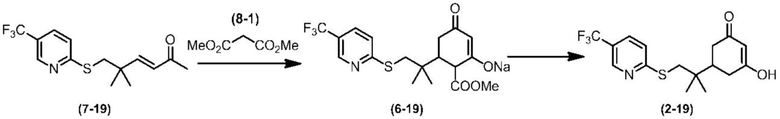
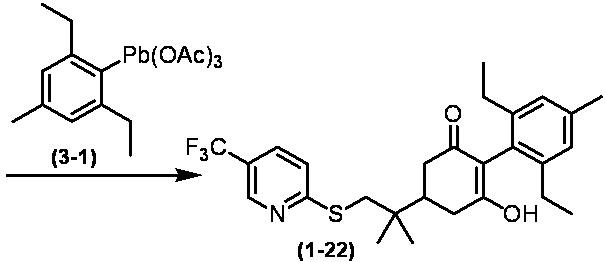
2,7 г 28% раствора метоксида натрия в метаноле и 1,8 г соединения, представленного формулой (8-1), растворяли в 35 мл 1,4-диоксана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 3,8 г соединения, представленного формулой (7-19). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную реакционную жидкость охлаждали до комнатной температуры и концентрировали при пониженном давлении и осажденные неочищенные кристаллы тщательно промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 5,3 г соединения, представленного формулой (6-19).
Затем 5,3 г соединения, представленного формулой (6-19), растворяли в 95 мл воды при комнатной температуре. К полученному раствору добавляли 4,0 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры, затем примеси удаляли путем промывки трет-бутилметиловым эфиром и водный слой, подкисленный путем добавления 2 н раствора хлористоводородной кислоты, экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 2,8 г соединения, представленного формулой (2-19).
Затем 600 мг соединения, представленного формулой (2-19), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,0 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:5), с получением, таким образом, 290 мг (белое твердое вещество) соединения, представленного формулой (1-22).
1H ЯМР (CDCl3) δ м.д.: 8,65 (1H,с), 7,65 (1H,дд), 7,30 (1H,д), 6,98 (2H,с), 5,54 (1H,с), 3,41 (2H,дд), 2,78-2,51 (3H,м), 2,48-2,26 (9H,м), 1,18-1,00 (12H,м)
Пример получения 1-25: Получение соединения, представленного формулой (1-40)
<Получение соединения, представленного формулой 3-3>
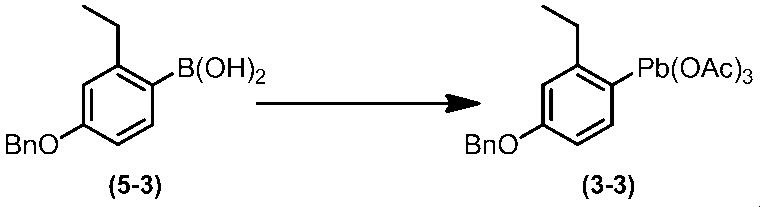
10 г тетраацетат свинца, 310 мг ацетата ртути и 5 г соединения, представленного формулой (5-3), растворяли в 40 мл хлороформа при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем реакционную жидкость перемешивали при 40°C в течение 4 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, красного маслянистого вещества. К полученному маслянистому веществу добавляли гексан и полученный продукт концентрировали при пониженном давлении, с получением, таким образом, 10,2 г (красное твердое вещество) соединения, представленного формулой (3-3).
1H ЯМР (CDCl3) δ м.д.: 7,61-7,59 (1H, м), 7,41-7,34 (5H,м), 7,00-6,97 (2H,м), 5,08 (2H,с), 2,83 (2H,кв), 2,09 (9H,с), 1,29 (3H,т)
<Получение соединения, представленного формулой 34-1>
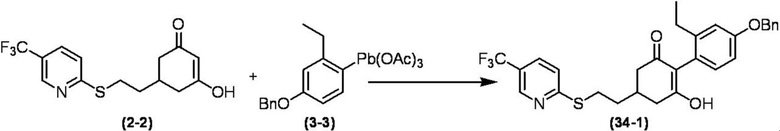
540 мг соединения, представленного формулой (2-2), и 1,05 г диметиламинопиридина растворяли в смеси 4,8 мл хлороформа и 1,2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,1 г соединения, представленного формулой (3-3), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:2), с получением, таким образом, 386 мг соединения, представленного формулой (34-1).
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H,с), 7,67 (1H,дд), 7,46-7,26 (6H,м), 6,98-6,92 (2H,м), 6,86 (1H,дт), 5,74 (1H,с), 5,08(2H,с), 3,30 (2H,т), 2,79-2,67 (2H,м), 2,50-2,24 (5H,м), 1,93-1,87 (2H,м), 1,08 (3H,дт)
<Получение соединения, представленного формулой 1-40>
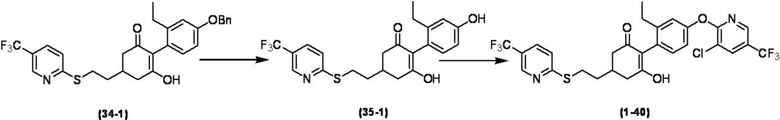
При комнатной температуре, 300 мг соединения, представленного формулой (34-1), растворяли в 2,2 мл уксусной кислоты и к полученной смешанной жидкости добавляли по каплям 0,7 мл 47% раствора бромистоводородной кислоты. Полученную реакционную жидкость нагревали до 100°C, с последующим перемешиванием в течение 30 минут. К реакционной жидкости добавляли 10 мл ледяной воды и полученный продукт экстрагировали этилацетатом. Полученный этилацетатный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 240 мг соединения, представленного формулой (35-1).
Затем 240 мг соединения, представленного формулой (35-1), 200 мг карбоната цезия и 118 мг 2,3-дихлор-5-трифторметилпиридина растворяли в 2 мл N,N-диметилформамида при комнатной температуре. Полученную реакционную жидкость нагревали до 70°C, с последующим перемешиванием в течение 2 часов. Полученную реакционную жидкость экстрагировали этилацетатом и полученный этилацетатный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:2), с получением, таким образом, 80 мг соединения, представленного формулой (1-40).
1H ЯМР (CDCl3) δ м.д.: 8,68 (1H,с), 8,24 (1H,дд), 8,00 (1H,д), 7,67 (1H,дд), 7,28-7,26 (1H,м), 7,14-7,03(3H,м), 6,33 (1H,с), 3,31 (2H,т), 2,79-2,68 (2H,м), 2,52-2,26 (5H,м), 1,94-1,89 (2H,м), 1,10 (3H,дт)
Пример получения 1-26: Получение соединения, представленного формулой (1-75)
<Получение соединения, представленного формулой 7-20>
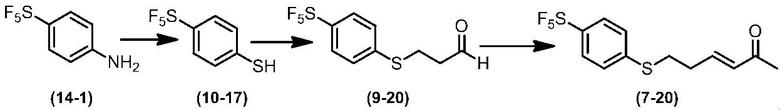
10 г соединения, представленного формулой (7-20), растворяли в 33 мл уксусной кислоты при комнатной температуре. К полученной смешанной жидкости добавляли 100 мл 35% раствора серной кислоты. Затем полученную реакционную смешанную жидкость охлаждали до 0°C и к смеси добавляли по каплям смесь 3,3 г нитрита натрия и 25 мл воды, с последующим перемешиванием при 0°C в течение 10 минут.
Затем полученную реакционную жидкость добавляли по каплям к смеси, полученной путем растворения 15 г сульфида натрия, 2 г серы и 3,3 г гидроксида натрия в 100 мл воды при 60°C, с последующим перемешиванием в течение 30 минут. Реакционную жидкость охлаждали до комнатной температуры, экстрагировали трет-бутилметиловым эфиром, промывали 10% водным раствором хлористоводородной кислоты, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат сушили при пониженном давлении и растворяли в 300 мл диэтилового эфира и к смеси добавляли 1,8 г литийалюминийгидрида при 0°C в атмосфере азота, с последующим перемешиванием при комнатной температуре в течение 1 часа. К полученной реакционной смешанной жидкости добавляли 500 мл 10% водного раствора хлористоводородной кислоты и полученный продукт экстрагировали диэтиловым эфиром. Полученный органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, неочищенного продукта соединения, представленного формулой (10-17). Полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 3,1 г соединения, представленного формулой (10-17).
Затем 3,0 г соединения, представленного формулой (10-17), и 10 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, затем полученную смесь охлаждали до 0°C и к смеси добавляли по каплям 1,05 г акролеина и 0,1 г триэтиламина. Полученную смесь перемешивали в течение 2 часов при охлаждении льдом. Затем к полученной смеси добавляли воду и полученный продукт экстрагировали трет-бутилметиловым эфиром. Органический слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, с получением, таким образом, 1,2 г соединения, представленного формулой (9-20).
Затем 1,2 г соединения, представленного формулой (9-20), и 1,4 г трифенилфосфинацетилметилена растворяли в 5 мл хлороформа при комнатной температуре. Полученный раствор перемешивали при 0°C в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 340 мг соединения, представленного формулой (7-20).
1H ЯМР (CDCl3) δ м.д.: 7,66 (2H,д), 7,32 (2H,д), 6,78 (1H,дт), 6,14 (1H,д), 3,12 (2H,т), 2,61 (2H,кв), 2,25(3H,с)
<Получение соединения, представленного формулой 6-20>
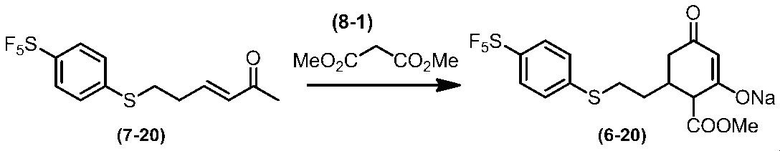
220 г 28% раствора метоксида натрия в метаноле и 150 мг соединения, представленного формулой (8-1), растворяли в 4 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 340 мг соединения, представленного формулой (7-20). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 30 минут. Полученную реакционную жидкость охлаждали до 0°C, затем к смеси добавляли гексан и осажденные кристаллы собирали фильтрованием и промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 460 мг соединения, представленного формулой (6-20).
1H ЯМР (d-DMSO) δ м.д.: 7,80 (2H,д), 7,44 (2H,д), 4,39 (1H,с), 3,65-3,48 (4H,м), 3,17-3,10 (1H,м), 2,99-2,91 (1H,м), 2,83(1H,д), 2,32-2,25 (1H,м), 2,15-2,03 (1H,м), 1,85-1,74 (1H,м), 1,53-1,47 (1H,м)
<Получение соединения, представленного формулой 1-75>
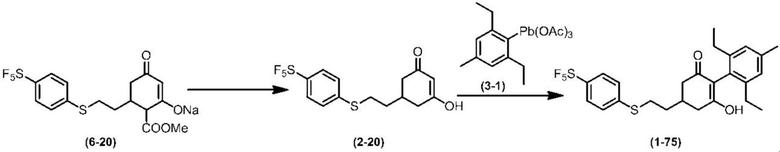
460 мг соединения, представленного формулой (6-20), растворяли в 10 мл воды при комнатной температуре. К полученному раствору добавляли 323 мг безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры и промывали трет-бутилметиловым эфиром и после добавления 2 н раствора хлористоводородной кислоты к водному слою полученный продукт экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 400 мг соединения, представленного формулой (2-20).
Затем 400 мг соединения, представленного формулой (2-20), и 620 мг диметиламинопиридина растворяли в смеси 3 мл хлороформа и 1 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 600 мг соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 150 мг соединения, представленного формулой (1-75).
1H ЯМР (CDCl3) δ м.д.: 7,66 (2H,д), 7,32 (2H,д), 6,98 (2H,с), 5,57 (1H,с), 3,13-3,01 (2H,м), 2,77-2,68 (2H,м), 2,49-2,22(10H,м), 1,88(2H,кв), 1,06(6H,ддд)
Пример получения 1-27: Получение соединения, представленного формулой (1-23)
<Получение соединения, представленного формулой 21-1>
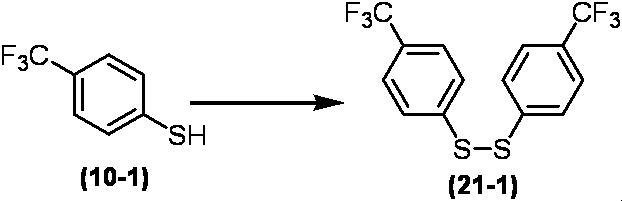
10 г соединения, представленного формулой (10-1), растворяли в 50 мл диметилформамида при комнатной температуре. К полученной смешанной жидкости добавляли 5,7 г триэтиламина при комнатной температуре и полученный продукт перемешивали в течение 6 часов при воздействии ультразвукового облучения. Полученную реакционную смешанную жидкость экстрагировали трет-метилэтиловым эфиром и полученный органический слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 9,3 г соединения, представленного формулой (21-1). (бесцветное твердое вещество).
1H ЯМР(CDCl3) δ м.д.: 7,60-7,53(8H, м)
<Получение соединения, представленного формулой 13-3>
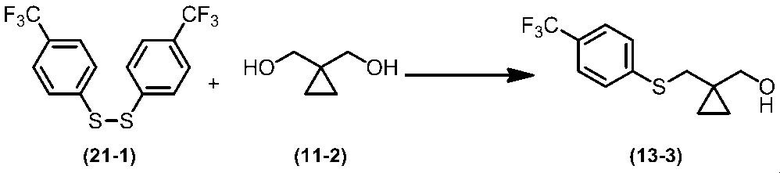
5 г соединения, представленного формулой (11-2), и 9,3 г соединения, представленного формулой (21-1), растворяли в 250 мл тетрагидрофурана. К полученной смешанной жидкости добавляли по каплям 5,8 г трибутилфосфина при комнатной температуре в атмосфере азота, с последующим перемешиванием в течение 2 часов. Полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 4,5 г соединения, представленного формулой (13-3) (бесцветное твердое вещество).
1H ЯМР(CDCl3) δ м.д.: 7,50 (2H,д), 7,41 (2H,д), 3,58 (2H,с), 3,17 (2H,с), 0,58(4H,с)
<Получение соединения, представленного формулой 7-21>
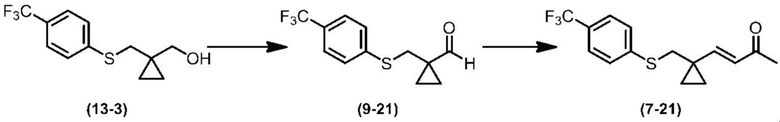
В атмосфере азота, смешанную жидкость, включающую 2,5 г оксалилхлорида и 45 мл метиленхлорида, охлаждали до -78°C и к смеси добавляли по каплям раствор 2,7 г диметилсульфоксида в 20 мл метиленхлорида, с последующим перемешиванием в течение 10 минут. Затем к полученной смешанной жидкости добавляли по каплям раствор 4,5 г соединения, представленного формулой (13-3), в 5 мл метиленхлорида, с последующим перемешиванием в течение 30 минут. Затем к полученной смешанной жидкости добавляли 8,8 г триэтиламина и температуру повышали до комнатной температуры, с последующим перемешиванием в течение 3 часов. Полученную реакционную жидкость выливали в 60 мл 1 н водного раствора хлористоводородной кислоты и полученный продукт экстрагировали хлороформом. Полученный органический слой сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 4,5 г неочищенного продукта соединения, представленного формулой (9-21).
Затем 4,5 г неочищенного продукта соединения, представленного формулой (9-21), и 6,1 г трифенилфосфинацетилметилена растворяли в 45 мл ксилола при комнатной температуре. Полученный смешанный реакционный раствор нагревали при температуре кипения с обратным холодильником в течение 8 часов. Затем ксилол удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Затем полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 3,8 г соединения, представленного формулой (7-21).
1H ЯМР (CDCl3) δ м.д.: 7,52 (2H,д), 7,35 (2H,д), 6,49 (1H,д), 6,17 (1H,д), 3,19 (2H,с), 2,22 (3H,с), 1,10-1,00(4H,м)
<Получение соединения, представленного формулой 6-21>
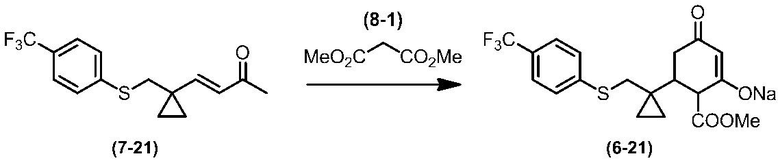
2,7 г 28% раствора метоксида натрия в метаноле и 1,8 г соединения, представленного формулой (8-1), растворяли в 30 мл 1,4-диоксана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 3,8 г соединения, представленного формулой (7-21). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную реакционную жидкость охлаждали до 0°C, затем к смеси добавляли гексан и осажденные кристаллы фильтровали и промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 4,5 г соединения, представленного формулой (6-21).
1H ЯМР (CDCl3) δ м.д.: 7,62 (2H,д), 7,45 (2H,д), 4,42 (1H,с), 3,57 (3H,с), 3,39-3,35 (1H,м), 3,23 (1H,д), 3,07 (1H,д), 2,32 (1H,т), 1,93 (1H,дд), 1,76 (1H,тд), 0,46-0,34 (4H,м)
<Получение соединения, представленного формулой 1-23>
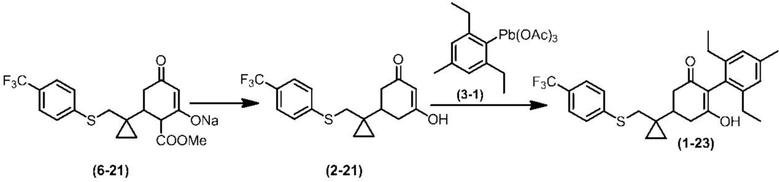
4,5 г соединения, представленного формулой (6-21), растворяли в 100 мл воды при комнатной температуре. К полученному раствору добавляли 3,37 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры и промывали трет-бутилметиловым эфиром и к водному слою добавляли 2 н раствор хлористоводородной кислоты, затем полученный продукт экстрагировали этилацетатом. Этилацетатный слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, с получением, таким образом, 3,4 г неочищенного продукта соединения, представленного формулой (2-21).
Затем 1,75 г неочищенного продукта соединения, представленного формулой (2-21), и 3,13 г диметиламинопиридина растворяли в смеси 14 мл хлороформа и 4 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 3 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 1,9 г соединения, представленного формулой (1-23).
1H ЯМР (CDCl3) δ м.д.: 7,52 (2H,д), 7,35 (2H,д), 6,97 (2H,с), 5,99 (1H,с), 3,12 (2H,дд), 2,65-2,58 (3H,м), 2,46-2,13 (9H,м), 1,07 (6H,т), 0,64(4H,с)
Пример получения 1-28: Получение соединения, представленного формулой (1-36)
<Получение соединения, представленного формулой 27-1>
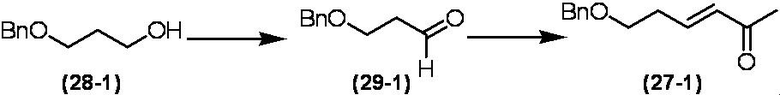
В атмосфере азота, смешанную жидкость, включающую 8,6 г оксалилхлорида и 150 мл метиленхлорида, охлаждали до -78°C и к полученной смешанной жидкости добавляли по каплям раствор 9,4 г диметилсульфоксида в 60 мл метиленхлорида, с последующим перемешиванием в течение 10 минут. Затем к полученной смешанной жидкости добавляли по каплям раствор 10 г соединения, представленного формулой (28-1), в 20 мл метиленхлорида, с последующим перемешиванием в течение 30 минут. Затем к полученной смешанной жидкости добавляли 30,4 г триэтиламина и температуру повышали до комнатной температуры, с последующим перемешиванием в течение 1 часа. Полученную реакционную жидкость выливали в 200 мл 1 н водного раствора хлористоводородной кислоты и полученный продукт экстрагировали хлороформом. Полученный органический слой сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 9,8 г неочищенного продукта соединения, представленного формулой (29-1).
Затем 9,8 г неочищенного продукта соединения, представленного формулой (29-1), и 22,6 г 1-трифенилфосфоранилиден-2-пропанона растворяли в 80 мл хлороформа при комнатной температуре. Полученный смешанный реакционный раствор нагревали при температуре кипения с обратным холодильником в течение 8 часов. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Затем полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 7,4 г соединения, представленного формулой (27-1) (бесцветное маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 7,38-7,26 (5H,м), 6,82 (1H,дт), 6,13 (1H,дт), 4,51 (2H,с), 3,63-3,57 (2H,м), 2,53 (2H,ддд), 2,24 (3H,с)
<Получение соединения, представленного формулой 25-1>
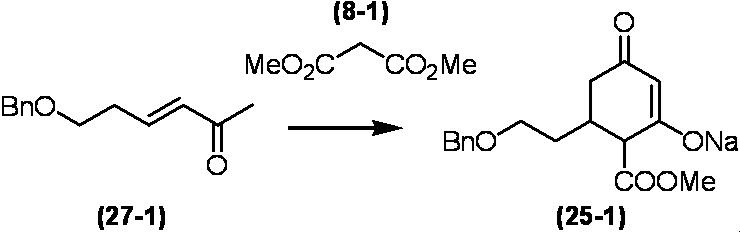
7,7 г 28% раствора метоксида натрия в метаноле и 5,3 г соединения, представленного формулой (8-1), растворяли в 100 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 15 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 7,4 г соединения, представленного формулой (27-1). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную реакционную жидкость охлаждали до 0°C, затем к смеси добавляли гексан и осажденные кристаллы фильтровали и промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 7,2 г соединения, представленного формулой (25-1).
1H ЯМР (CDCl3) δ м.д.: 7,37-7,26(5H,м), 4,50-4,38(3H,м), 3,59(3H,с), 3,43-3,40(3H, м), 2,84(1H,д), 2,32-2,24 (1H,м), 2,08(1H,дд), 1,76(1H,дд), 1,57-1,36(2H,м)
[0161]
<Получение соединения, представленного формулой 24-1>
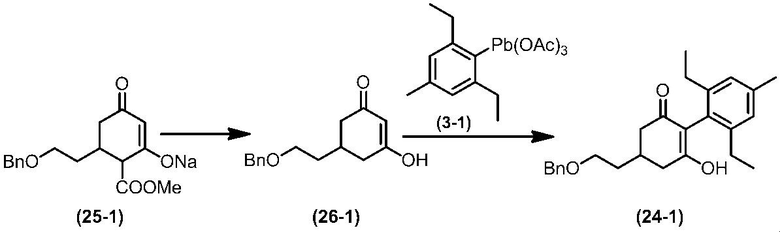
3 г соединения, представленного формулой (25-1), растворяли в 90 мл воды при комнатной температуре. К полученному раствору добавляли 2,9 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры и промывали трет-бутилметиловым эфиром и к водному слою добавляли 2 н раствор хлористоводородной кислоты, затем полученный продукт экстрагировали этилацетатом. Этилацетатный слой сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении, с получением, таким образом, 2 г неочищенного продукта соединения, представленного формулой (26-1) (желтое твердое вещество).
Затем 730 мг неочищенного продукта соединения, представленного формулой (26-1), и 1,8 г диметиламинопиридина растворяли в смеси 8 мл хлороформа и 2 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,7 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:2), с получением, таким образом, 890 мг соединения, представленного формулой (24-1).
1H ЯМР (CDCl3) δ м.д.: 7,39-7,27 (5H, м), 6,97 (2H, с), 5,70 (1H, с), 4,53 (2H, с), 3,62-3,53 (2H, м), 2,69-2,62 (2H, м), 2,52-2,22 (10H, м), 1,83-1,74 (2H, м), 1,08 (6H, ддд)
<Получение соединения, представленного формулой 23-1>
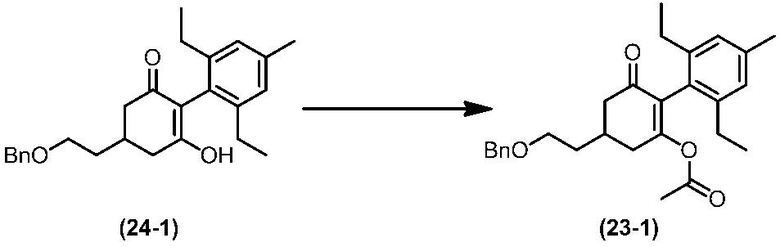
Раствор 1,8 г триэтиламина в 30 мл безводного тетрагидрофурана добавляли к 4,5 г соединения, представленного формулой (24-1). К полученной смеси добавляли раствор 1,8 г ацетилхлорида в 10 мл безводного тетрагидрофурана при охлаждении льдом. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. К реакционной смеси добавляли воду и полученный продукт экстрагировали хлороформом. Экстрагированный хлороформный слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 3,7 г соединения, представленного формулой (23-1), получали (бесцветное маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 7,35-7,24(5H,м), 6,88(2H,с), 4,50(2H,дд), 3,56(2H,т), 2,72-2,28(12H,м), 1,86-1,73(5H,м), 1,12-1,03(6H,м)
<Получение соединения, представленного формулой 23-1>
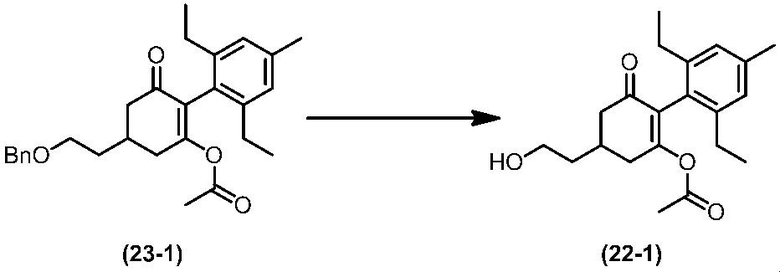
3,7 г соединения, представленного формулой (23-1), растворяли в 150 мл этилацетата. К полученной смешанной жидкости добавляли 1,5 г 10% палладия на углероде, с последующим перемешиванием при 35°C в течение 4 часов в атмосфере водорода. Полученную реакционную смешанную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка), и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 2,4 г соединения, представленного формулой (22-1), получали (бесцветное твердое вещество).
1H ЯМР (CDCl3) δ м.д.: 6,89(2H,с), 3,79(2H,д), 2,79-2,69(3H,м), 2,60-2,53(1H,м), 2,42-2,25(7H,м), 1,88(3H,с), 1,82-1,73(2H,м), 1,63-1,61(2H,м), 1,07(6H,кв)
<Получение соединения, представленного формулой 1-36>
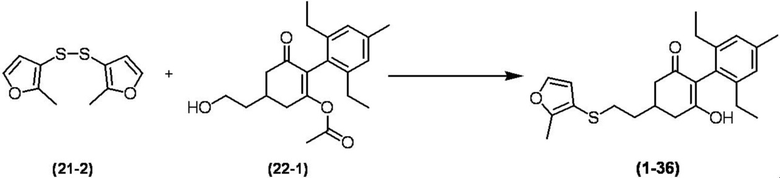
344 мг соединения, представленного формулой (22-1), и 227 мг соединения, представленного формулой (21-2), растворяли в 5 мл тетрагидрофурана. К полученной смешанной жидкости добавляли по каплям 223 мг трибутилфосфина при комнатной температуре в атмосфере азота, с последующим перемешиванием в течение 2 часов. Полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 400 мг соединения, представленного формулой (1-36) (бесцветное маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 7,29(1H,д), 6,96(2H,с), 6,34(1H,д), 5,88(1H,с), 2,71-2,60 (4H,м), 2,44-2,16 (13H,м), 1,70 (2H,дд), 1,10-1,01 (6H,м)
Пример получения 1-29: Получение соединения, представленного формулой (1-33)
<Получение соединения, представленного формулой 1-33>
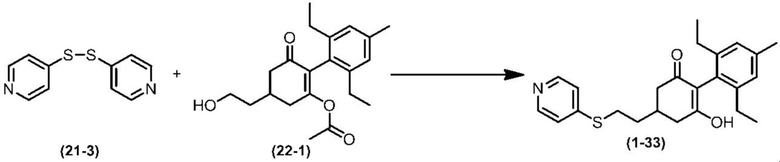
344 мг соединения, представленного формулой (22-1), и 121 мг соединения, представленного формулой (21-3), растворяли в 5 мл тетрагидрофурана. К полученной смешанной жидкости добавляли по каплям 121 мг трибутилфосфина при комнатной температуре в атмосфере азота, с последующим перемешиванием в течение 2 часов. Полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:2), с получением, таким образом, 80 мг соединения, представленного формулой (1-33).
1H ЯМР (CDCl3) δ м.д.: 8,41(2H,дд), 7,13(2H,дд), 6,90(1H,с), 3,08 (2H,т), 2,82-2,67 (3H,м), 2,58-2,24 (9H,м), 1,95-1,84 (3H,м), 1,13-1,03 (6H,м)
Пример получения 1-30: Получение соединения, представленного формулой (1-76)
<Получение соединения, представленного формулой 1-76>
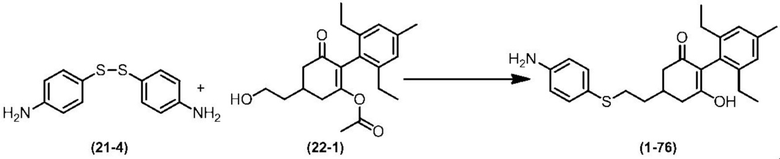
172 мг соединения, представленного формулой (22-1), и 124 мг соединения, представленного формулой (21-4), растворяли в 2,5 мл тетрагидрофурана. К полученной смешанной жидкости добавляли по каплям 0,14 мл трибутилфосфина при комнатной температуре в атмосфере азота, с последующим перемешиванием в течение 2 часов. Полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3 → 1:2 → 1:1), с получением, таким образом, 160 мг соединения, представленного формулой (1-76).
1H ЯМР (CDCl3) δ м.д.: 7,26-7,22 (2H,м), 6,97(2H,с), 6,61(2H,дт), 2,86-2,82(2H,м), 2,67-2,59(2H,м), 2,44-2,18(10H,м), 1,73(2H,дд), 1,11-1,02(6H,м)
Пример получения 1-31: Получение соединения, представленного формулой (1-77)
<Получение соединения, представленного формулой 1-77>
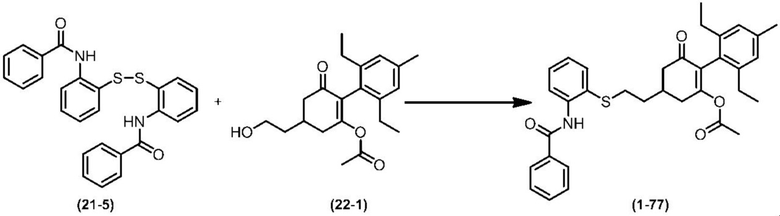
344 мг соединения, представленного формулой (22-1), и 456 мг соединения, представленного формулой (21-5), растворяли в 5 мл тетрагидрофурана. К полученной смешанной жидкости добавляли по каплям 111 мг трибутилфосфина при комнатной температуре в атмосфере азота, с последующим перемешиванием в течение 2 часов. Полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4 → 1:2), с получением, таким образом, 210 мг соединения, представленного формулой (1-77).
1H ЯМР (CDCl3) δ м.д.: 9,40(1H,с), 8,61(1H,дд), 7,98-7,95(2H,м), 7,61-7,51(4H,м), 7,42(1H,тд), 7,11(1H,тд), 6,87(2H,с), 2,87-2,83(2H,м), 2,68-2,54(3H,м), 2,46-2,22(9H,м), 1,85(3H,с), 1,79-1,73(2H,м), 1,04(6H,дт)
Пример получения 1-32: Получение соединения, представленного формулой (1-78)
<Получение соединения, представленного формулой 1-78>
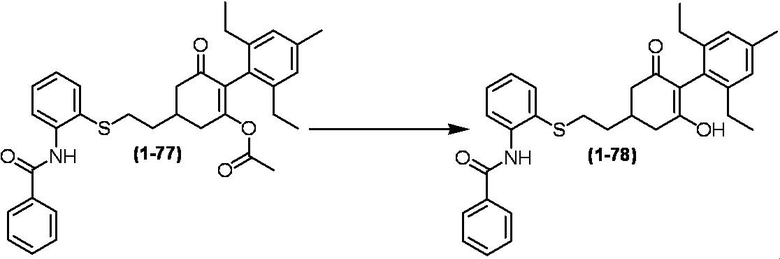
При комнатной температуре, 150 мг соединения, представленного формулой (1-77), растворяли в 20 мл метанола и к смеси добавляли 100 мг карбоната калия, с последующим перемешиванием в течение 1 часа. Полученную реакционную жидкость концентрировали при пониженном давлении, с получением, таким образом, неочищенного продукта соединения, представленного формулой (1-78). Затем полученный неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 160 мг соединения, представленного формулой (1-78).
1H ЯМР (CDCl3) δ м.д.: 9,39(1H,с), 8,59(1H,дд, 7,95(2H,м), 7,60-7,51(4H,м), 7,44-7,39(1H,м), 7,11(1H,тд), 6,94(2H,с), 5,91(1H,с), 2,88-2,83(2H,м), 2,60-2,57(2H,м), 2,32-2,15(9H,м), 1,76-1,71(2H, м), 1,06-0,97(6H,дт)
Пример получения 1-33: Получение соединения, представленного формулой (1-97)
<Получение соединения, представленного формулой 31-1>
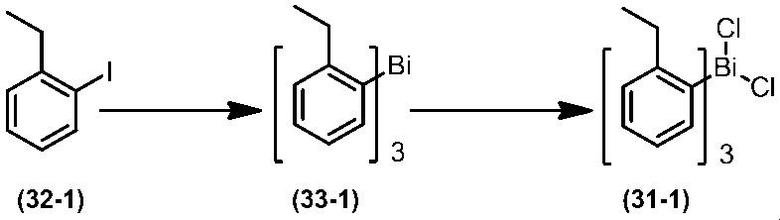
16 мл н-бутиллития (1,6 M раствор в гексане), добавляли к 3,2 мл тетраметилендиамина при 0°C в атмосфере азота, с последующим перемешиванием в течение 10 минут. Затем к смеси добавляли 5 г соединения, представленного формулой (32-1), при 0°C при охлаждении льдом. Затем полученный раствор охлаждали до -78°C, к смеси добавляли суспензию 2,3 г трихлорвисмута в 15 мл тетрагидрофурана, с последующим перемешиванием в течение 1 часа при нагревании до комнатной температуры. Затем к полученной реакционной жидкости добавляли 20 мл воды и водный слой экстрагировали хлороформом. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 2,6 г неочищенного продукта соединения, представленного формулой (33-1).
Затем 2,6 г полученного неочищенного продукта соединения, представленного формулой (33-1), растворяли в 25 мл безводного хлороформа при комнатной температуре, затем полученный продукт охлаждали до 0°C и к смеси добавляли 0,4 мл сульфурилхлорида. Затем температуру повышали до комнатной температуры, с последующим перемешиванием в течение 1 часа. Полученную реакционную жидкость концентрировали при пониженном давлении, затем кристаллы осаждали путем добавления гексана к полученному маслянистому веществу и кристаллы фильтровали, с получением, таким образом, 1,3 г соединения, представленного формулой (31-1).
1H ЯМР (CDCl3) δ м.д.: 8,00(1H,дд), 7,66(1H,дд), 7,54-7,46(2H,м), 3,03(2H,кв), 1,38(3H,т)
<Получение соединения, представленного формулой 1-97>
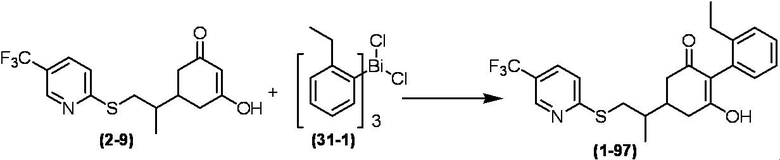
550 мг соединения, представленного формулой (31-1), и 290 мг соединения, представленного формулой (2-9), растворяли в смеси 1 мл хлороформа и 4 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 0,17 мл диазабициклоундецена в атмосфере азота. Полученную смесь перемешивали при комнатной температуре в течение 12 часов в атмосфере азота. Полученную реакционную жидкость экстрагировали хлороформом. Полученную разбавленную жидкость промывали водным раствором хлористоводородной кислоты, pH которого контролировали на уровне от 1 до 2, и промывали насыщенным солевым раствором. Затем полученный органический слой сушили над безводным сульфатом натрия и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 240 мг соединения, представленного формулой (1-97).
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,с), 7,66(1H,дд), 7,36-7,23(4H,м), 7,04-7,01(1H,м), 5,91-5,87(1H,м), 3,61-3,51(1H,м), 3,08-2,98(1H,м), 2,74-2,28(7H,м), 2,04-1,95(1H,м), 1,17-1,03(6H,м)
Пример получения 1-34: Получение соединения, представленного формулой (1-19)
<Получение соединения, представленного формулой 1-19>
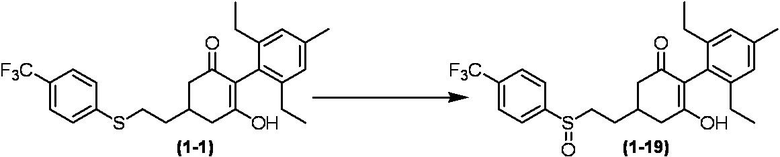
3 мл хлороформа добавляли к 250 мг соединения, представленного формулой (1-1), при комнатной температуре. Полученную смесь охлаждали до 0°C при перемешивании и к смеси добавляли по каплям смешанную жидкость, полученную путем растворения 120 мг метахлорпербензойной кислоты в 2 мл хлороформа. Полученную смесь перемешивали в течение 1 часа. Затем полученную смесь нагревали до комнатной температуры, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную жидкость разбавляли хлороформом и полученный продукт промывали 10% водным раствором сульфита натрия. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 9:1), с получением, таким образом, 154 мг соединения, представленного формулой (1-19).
1H ЯМР (CDCl3) δ м.д.: 7,83-7,75(4H,м), 6,97(2H,с), 5,53(1H, с), 3,03-2,94(1H,м), 2,89-2,62(3H, м), 2,46-2,19(10H,м), 2,13-1,78(2H,м), 1,08-1,00(6H, м)
Соединение, полученное в соответствии с Примером получения 1-34, показано ниже.
<Соединение, представленное формулой 1-79>
1H ЯМР (CDCl3) δ м.д.: 11,51(1H,с), 8,72(1H,д), 8,05(2H,д), 7,60-7,50(4H,м), 7,31(1H,д), 7,19(1H,т), 6,94(2H,с), 5,82(1H,с), 3,34-3,24(1H,м), 3,09-3,01(1H,м), 2,62-2,55(2H,м), 2,36-2,14(10H,м), 1,96-1,80(2H,м), 1,05-1,01(6H,м)
<Соединение, представленное формулой 1-81>
1H ЯМР (CDCl3) δ м.д.: 7,83-7,77(4H,м), 6,90-6,88(2H,м), 2,99-2,19(15H,м), 1,35-1,02(9H,м)
<Соединение, представленное формулой 1-83>
1H ЯМР (CDCl3) δ м.д.: 8,89(1H,с), 8,23-8,16(2H,м), 6,96(2H,д), 3,36-3,28(1H,м), 3,01-2,84(1H,м), 2,70-2,21(13H,м), 1,37-1,17(3H,м), 1,11-1,03(6H,м)
<Соединение, представленное формулой 1-85>
1H ЯМР (CDCl3) δ м.д.: 8,99(1H,с), 8,04(1H,с), 6,97(2H,с), 5,78(1H,с), 3,21-3,13(2H,м), 2,76-2,65(2H,м), 2,48-1,82(12H,м), 1,06-1,02(6H,м)
<Соединение, представленное формулой 1-87>
1H ЯМР (CDCl3) δ м.д.: 7,80(4H,дд), 6,98(2H,с), 3,00-2,92 (1H,м), 2,76-2,22 (13H,м), 1,36-1,33 (6H,м), 1,11-1,05 (6H,м)
<Соединение, представленное формулой 1-89>
1H ЯМР (CDCl3) δ м.д.: 8,90(1H,с), 8,24-8,18(2H,м), 6,98(2H,с), 3,24(1H,дд), 2,89(1H,дд), 2,76-2,67(2H,м), 2,57-2,23(10H,м), 1,40-1,35(6H,м), 1,11-1,05(6H,м)
<Соединение, представленное формулой 1-91>
1H ЯМР (CDCl3) δ м.д.: 7,84-7,76(4H,м), 6,98(1H,с), 5,86(1H,с), 2,95-2,25(14H,м), 1,11-1,06(6H,м), 1,00-0,94(1H,м), 0,86-0,74(2H,с), 0,64-0,59(1H,с)
<Соединение, представленное формулой 1-98>
1H ЯМР (CDCl3) δ м.д.: 7,96-7,93(4H,м), 6,92(1H,д), 3,01-2,84(2H,м), 2,66-2,26(10H,м), 2,09-1,97(6H,м), 1,40-1,15(3H,м)
<Соединение, представленное формулой 1-154>
1H ЯМР (CDCl3) δ м.д.: 8,90(1H,с), 8,24(1H,дт), 8,18(1H,дд), 6,98(2H,с), 5,50(1H,д), 3,35-3,19(1H,м), 3,11-2,99(1H,м), 2,73-2,64(2H,м), 2,44-2,23(12H,м), 1,08-1,03(6H,м)
<Соединение, представленное формулой 1-156>
1H ЯМР (CDCl3) δ м.д.: 9,21(1H,с), 8,55(1H,д), 8,12(1H,дд), 6,97(2H,с), 5,48(1H,д), 4,00(3H,с), 3,34-3,24(1H,м), 3,11-3,00(1H,м), 2,68-2,63(2H,м), 2,38-2,06(12H,м), 1,08-1,01(6H,м)
<Соединение, представленное формулой 1-158>
1H ЯМР (CDCl3) δ м.д.: 8,76(1H,д), 7,79(1H,д), 7,45(1H,дд), 6,97(2H,с), 5,50(1H,д), 3,18-3,14(2H,м), 2,72-2,65(2H,м), 2,47-2,24(11H,м), 2,05-2,01(1H,м), 1,09-1,02(6H,м)
<Соединение, представленное формулой 1-159>
1H ЯМР (CDCl3) δ м.д.: 9,33(1H,д), 8,98(1H,с), 6,98(2H,с), 5,53(1H,д), 3,36-3,28(1H,м), 3,20-3,11(1H,м), 2,75-2,66(2H,м), 2,49-2,20(11H,м), 1,84-1,63(1H,м), 1,08-1,01(6H,м)
<Соединение, представленное формулой 1-165>
1H ЯМР (CDCl3) δ м.д.: 8,39(1H,дд), 8,12(1H,дд), 6,97(2H,с), 5,52(1H,д), 3,49-3,42(1H,м), 3,27-3,20(1H,м), 2,74-2,64(2H,м), 2,46-2,14(11H,м), 1,76-1,66(1H,м), 1,08-1,02(6H,м)
Пример получения 1-35: Получение соединения, представленного формулой (1-20)
<Получение соединения, представленного формулой 1-20>
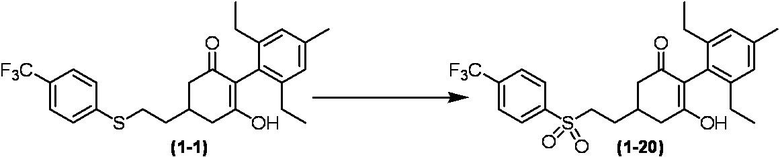
3 мл хлороформа добавляли к 250 мг соединения, представленного формулой (1-1), при комнатной температуре. Полученную смесь охлаждали до 0°C при перемешивании и к смеси добавляли по каплям смешанную жидкость, полученную путем растворения 440 мг метахлорпербензойной кислоты в 2 мл хлороформа. Полученную смесь перемешивали в течение 1 часа. Затем полученную смесь нагревали до комнатной температуры, с последующим перемешиванием при комнатной температуре в течение ночи. Реакционную жидкость разбавляли хлороформом и полученную разбавленную жидкость промывали 10% водным раствором сульфита натрия. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:2), с получением, таким образом, 154 мг соединения, представленного формулой (1-20).
1H ЯМР (CDCl3) δ м.д.: 8,08(2H,д), 7,88(2H,д), 6,97(2H,с), 5,52(1H,с), 3,27-3,15(2H,м), 2,73-2,60(2H,м), 2,45-2,21(10H,м), 2,02-1,90(2H,м), 1,08-1,00(6H,м)
Соединение, полученное в соответствии с Примером получения 1-35, показано ниже.
<Соединение, представленное формулой 1-80>
1H ЯМР (CDCl3) δ м.д.: 10,46(1H,с), 8,69(1H,д), 8,05-7,91(2H,м), 7,73(1H,тд), 7,64-7,52(4H,м), 7,34(1H,тд), 6,95(2H,с), 3,26-3,16(2H,м), 2,61-2,52(2H,м), 2,35-2,11(10H,м), 1,93-1,87(2H,м), 1,03(6H,дд)
<Соединение, представленное формулой 1-82>
1H ЯМР (CDCl3) δ м.д.: 8,09(2H,д), 7,88(2H,д), 6,98(2H,с), 3,28-2,99(2H,м), 2,61-2,21(13H,м), 1,28-1,22(3H,м), 1,08-1,04(6H,м)
<Соединение, представленное формулой 1-84>
1H ЯМР (CDCl3) δ м.д.: 9,02(1H,с), 8,27(2H,с), 6,98(2H,с), 5,67(1H,с), 3,69(1H,дт), 3,32(1H,ддд), 2,66-2,21(13H,м), 1,28-1,24(3H,м), 1,10-1,02(6H,м)
<Соединение, представленное формулой 1-86>
1H ЯМР (CDCl3) δ м.д.: 8,79(1H,с), 8,18(1H,с), 6,99(2H,с), 3,86-3,66(2H,м), 2,86-2,72(2H,м), 2,54-2,09(12H,м), 1,10-1,01(6H,м)
<Соединение, представленное формулой 1-88>
1H ЯМР (CDCl3) δ м.д.: 8,09(2H,д), 7,86(2H,д), 6,99(2H,д), 3,11(2H,дд), 2,68-2,24(12H,м), 1,35(6H,д), 1,08(6H,дт)
<Соединение, представленное формулой 1-90>
1H ЯМР (CDCl3) δ м.д.: 9,01(1H,с), 8,27-8,22(2H,м), 6,98(2H,с), 3,59-3,49(2H,м), 2,59-2,48(2H,м), 2,59-2,48(2H,м), 2,42-2,27(8H,м), 1,33-1,27(6H,м), 1,08(6H,тд)
<Соединение, представленное формулой 1-92>
1H ЯМР (CDCl3) δ м.д.: 8,08(2H,д), 7,86(2H,д), 6,98(2H,д), 5,86(1H,с), 3,26-3,08(2H,м), 2,88-2,73(1H,м), 2,68-2,52(2H,м), 2,47-2,17(9H,м), 1,12-1,05(6H,м), 0,83-0,53(4H,м)
<Соединение, представленное формулой 1-99>
1H ЯМР (CDCl3) δ м.д.: 8,09(2H,д), 7,88(2H,д), 6,93(2H,с), 5,59(1H,с), 3,23(1H,тд), 3,05-2,98(1H,м), 2,59-2,23(9H,м), 2,06-1,97(6H,м), 1,21(3H,дт)
Пример получения 1-36: Получение соединения, представленного формулой (1-59)
<Получение соединения, представленного формулой 1-59>
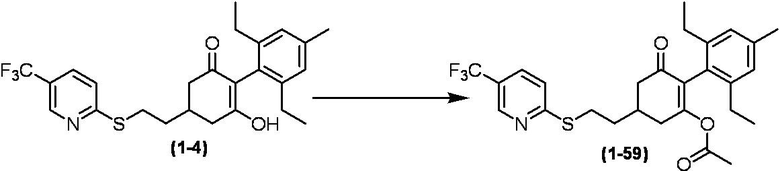
Раствор 175 мг триэтиламина в 3 мл безводного тетрагидрофурана добавляли к 500 мг соединения, представленного формулой (1-4). К полученной смеси добавляли раствор 170 мг ацетилхлорида в 1 мл безводного тетрагидрофурана при охлаждении льдом. Полученную смесь перемешивали в течение 12 часов при комнатной температуре. К реакционной смеси добавляли 5 мл воды и полученный продукт экстрагировали хлороформом. Полученный хлороформный слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:6), с получением, таким образом, 530 мг соединения, представленного формулой (1-59) (бесцветное маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,м), 7,67(1H,дд), 7,27(1H,д), 6,89(2H,с), 3,30(2H,т), 2,84-2,25(12H,м), 1,98-1,89(5H,м), 1,09-1,02(6H,м)
Соединение, полученное в соответствии с Примером получения 1-36, показано ниже.
<Соединение, представленное формулой 1-60>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,м), 7,67(1H,дд), 7,27(1H,д), 6,88(2H,с), 3,31(2H,т), 2,77-2,23(12H,м), 2,17-2,11(2H,м), 1,98-1,88(2H,м), 1,05(6H,ддд), 0,84(3H,т)
<Соединение, представленное формулой 1-61>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,м), 7,67(1H,дд), 7,27(1H,д), 6,87(2H,с), 3,31(2H,тд), 2,84-2,25(12H,м), 1,94(2H,дт), 1,05(6H,дт), 0,88(9H,с)
<Соединение, представленное формулой 1-62>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,дд), 7,67(1H,дд), 7,27(1H,д), 6,90(2H,с), 3,70(3H,с), 3,31(2H,т), 2,92-2,26(12H,м), 1,99-1,89(2H,м), 1,09-1,02(6H,м)
<Соединение, представленное формулой 1-63>
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H, дд), 7,67(1H, дд), 7,27 (1H, д), 6,90 (2H, с), 4,12-4,07 (2H, м), 3,34-3,27 (2H, м), 2,91-2,27 (12H, м), 1,99-1,88 (2H, м), 1,18 (3H, т), 1,09-1,00 (6H,м)
<Соединение, представленное формулой 1-66>
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H,дд), 7,66 (1H,дд), 7,26(1H,д), 6,90 (2H, с), 5,80-5,71 (1H,м), 5,21-5,15 (2H, м), 4,52-4,50 (2H, м), 3,30 (2H, т), 2,82-2,26 (12H, м), 1,97-1,88 (2H, м), 1,09-1,00 (6H, м)
<Соединение, представленное формулой 1-67>
1H ЯМР (CDCl3) δ м.д.: 8,67 (1H, т), 7,66 (1H, дд), 7,35-7,18 (4H, м), 6,95 (2H, с), 6,87-6,83 (2H, м), 3,31 (2H, т), 2,99-2,29 (12H, м), 2,00-1,90 (2H, м), 1,08-1,03 (6H, м)
<Соединение, представленное формулой 1-68>
1H ЯМР (CDCl3) δ м.д.: 8,69(1H,т), 7,67(1H,дд), 7,27(1H,д), 6,93(2H,с), 3,66-3,27(2H,м), 3,06(1H,дд), 2,84-2,76(2H,м), 2,56-2,26(12H,м), 1,99-1,88(2H,м), 1,14-1,04(6H,м)
<Соединение, представленное формулой 1-93>
1H ЯМР (CDCl3) δ м.д.: 8,91(1H,с), 8,24-8,18(2H,м), 6,90(2H,д), 4,13-4,05(2H,м), 3,33(1H,ддд), 3,07-2,24(14H,м), 1,39-1,02(12H,м)
Пример получения 1-37: Получение соединения, представленного формулой (1-64)
<Получение соединения, представленного формулой 1-64>
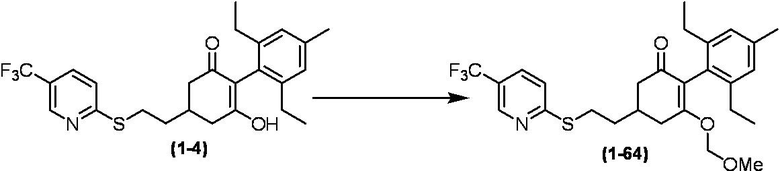
1 мл безводного N,N-диметилформамида добавляли к 110 мг 60% гидрида натрия. К полученной смеси добавляли по каплям раствор 500 мг соединения, представленного формулой (1-4), в 3 мл N,N-диметилформамида при охлаждении льдом. Полученную смесь перемешивали в течение 10 минут при охлаждении льдом, затем к смеси добавляли по каплям раствор 200 мг хлорметилметилового эфира в 1 мл безводного N,N-диметилформамида и полученную смесь перемешивали при комнатной температуре в течение 2 часов. К реакционной смеси добавляли 5 мл воды и полученный продукт экстрагировали этилацетатом. Полученный этилацетатный слой промывали водой, сушили над безводным сульфатом натрия и концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 208 мг соединения, представленного формулой (1-64) (желтое маслянистое вещество).
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,м), 7,67(1H,дд), 7,27(1H,д), 6,90(2H,с), 4,98(2H,с), 3,39-3,22(5H,м), 3,03-2,25(12H,м), 1,99-1,89(2H,м), 1,08-1,02(6H,м)
Соединение, полученное в соответствии с Примером получения 1-37, показано ниже.
<Соединение, представленное формулой 1-65>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,м), 7,67(1H,дд), 7,27(1H,д), 6,91(2H,с), 5,05-4,99(2H,м), 3,56-3,51(2H,м), 3,37-3,28(2H,м), 3,04-2,23(12H,м), 1,97-1,90(2H,м), 1,17-0,99(9H,м)
Пример получения 1-38: Получение соединения, представленного формулой (1-30)
<Получение соединения, представленного формулой 9-30>
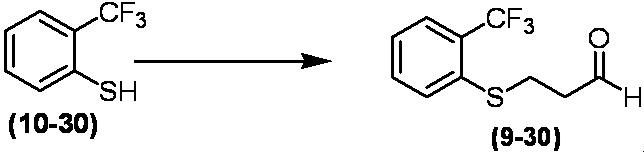
7,10 г соединения, представленного формулой (10-30), и 60 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, и к полученной смеси добавляли по каплям 3,64 г 95% акролеина и 1,21 г триэтиламина. Полученную смесь перемешивали в течение 5,5 часов при комнатной температуре. Затем полученную реакционную жидкость концентрировали при пониженном давлении, с получением, таким образом, 9,32 г соединения, представленного формулой (9-30).
1H ЯМР (CDCl3) δ м.д.: 9,78(1H,с), 7,67(1H,д), 7,54-7,46(2H,м), 7,35-7,31(1H,м), 3,24(2H,т), 2,80(2H,дт)
<Получение соединения, представленного формулой 7-30>
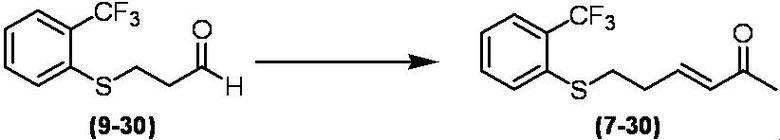
9,32 г соединения, представленного формулой (9-30), растворяли в 40 мл хлороформа при комнатной температуре. К полученному раствору добавляли 16,5 г трифенилфосфинацетилметилена при охлаждении льдом. Полученный раствор перемешивали в течение 17 часов при комнатной температуре. Затем хлороформ удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 9,76 г соединения, представленного формулой (7-30).
1H ЯМР (CDCl3) δ м.д.: 7,67(1H,д), 7,52-7,43(2H,м), 7,34-7,30(1H,м) 6,79(1H,дт), 6,11(1H,дт), 3,10(2H,т), 2,57(2H,квд), 2,24(3H,с)
<Получение соединения, представленного формулой 6-30>
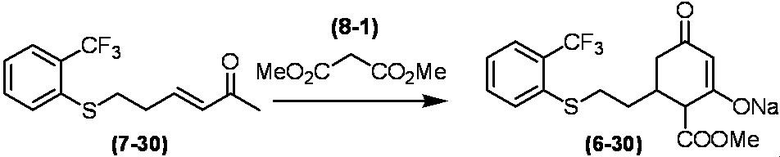
7,55 г 28% раствора метоксида натрия в метаноле и 5,17 г соединения, представленного формулой (8-1), растворяли в 70 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 10 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 9,76 г соединения, представленного формулой (7-30). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 2 часов. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 6,80 г соединения, представленного формулой (6-30).
1H ЯМР (d-DMSO) δ м.д.: 7,70 (1H, д), 7,61 (2H, дд), 7,36 (1H, кв), 4,39 (1H, с), 3,47 (3H, с), 3,15-3,08 (1H, м), 3,00-2,93 (1H, м), 2,83 (1H, д), 2,33-2,23 (1H,м), 2,11 (1H, дд), 1,77(1H, дд), 1,53-1,44 (2H, м)
<Получение соединения, представленного формулой 1-30>
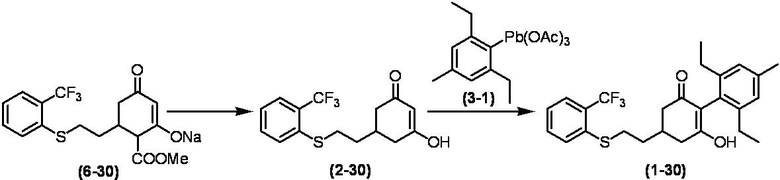
6,80 г соединения, представленного формулой (6-30), растворяли в 90 мл воды при комнатной температуре. К полученному раствору добавляли 5,78 г безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 5 часов. Реакционную жидкость охлаждали до комнатной температуры и подкисляли путем добавления 2 н раствора хлористоводородной кислоты. Полученную реакционную жидкость экстрагировали этилацетатом, с получением, таким образом, 6,01 г соединения, представленного формулой (2-30).
541 мг соединения, представленного формулой (2-30), и 1,04 г диметиламинопиридина растворяли в смеси 5,0 мл хлороформа и 2,0 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 1,00 г соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 75°C в течение 1,5 часов в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом натрия и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 387 мг соединения, представленного формулой (1-30).
1H ЯМР (CDCl3) δ м.д.: 7,67(1H,д), 7,49(2H,т), 7,32-7,28(1H,м), 6,98(2H,с), 5,54(1H,с), 3,07(2H,ддд), 2,69(2H,тд), 2,48-2,24(10H,м), 1,85(2H,кв), 1,08(3H,т), 1,05(3H,т)
Пример получения 1-39: Получение соединения, представленного формулой (1-29)
<Получение соединения, представленного формулой 7-29>
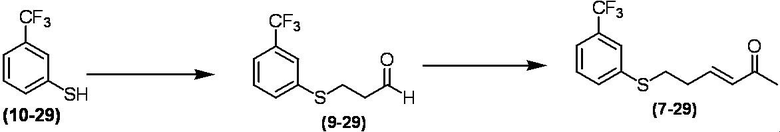
5,0 г соединения, представленного формулой (10-29), и 56 мл тетрагидрофурана смешивали при комнатной температуре, с последующим перемешиванием, и к полученной смеси добавляли по каплям 2,56 г 95% акролеина и 852 мг триэтиламина. Полученную смесь перемешивали в течение 2 часов при комнатной температуре. Затем полученную реакционную жидкость концентрировали при пониженном давлении, с получением, таким образом, 6,61 г соединения, представленного формулой (9-29).
6,61 г соединения, представленного формулой (9-29), и 11,6 г трифенилфосфинацетилметилена растворяли в 28 мл тетрагидрофурана при комнатной температуре. Полученный раствор перемешивали в течение 5 часов при комнатной температуре. Затем тетрагидрофуран удаляли из полученной реакционной жидкости при пониженном давлении. К полученному остатку добавляли трет-бутилметиловый эфир и гексан. Полученную смесь фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:4), с получением, таким образом, 1,01 г соединения, представленного формулой (7-29).
1H ЯМР (CDCl3) δ м.д.: 7,56(1H,с), 7,51-7,40(3H,м), 6,78(1H,дт), 6,13(1H,дт), 3,10(2H,т), 2,59(2H,квд), 2,25(3H,с)
<Получение соединения, представленного формулой 6-29>
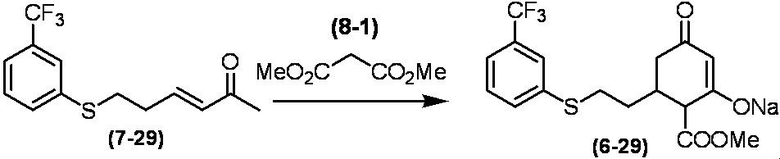
781 мг 28% раствора метоксида натрия в метаноле и 464 мг соединения, представленного формулой (8-1), растворяли в 7 мл тетрагидрофурана при комнатной температуре. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 10 минут. Затем нагревание прекращали и к полученной реакционной смеси добавляли 1,01 г соединения, представленного формулой (7-29). Затем полученную смешанную жидкость нагревали при температуре кипения с обратным холодильником в течение 1 часа. Полученную реакционную жидкость охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием и промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 873 мг соединения, представленного формулой (6-29).
1H ЯМР (CDCl3) δ м.д.: 7,57-7,51(4H,м), 4,38(1H,с), 3,45(3H,с), 3,10(1H,м), 2,96(1H,м), 2,81(1H,д), 2,28(1H,м), 2,11(1H,д), 1,75(1H,т), 1,47(2H,м)
<Получение соединения, представленного формулой 1-29>
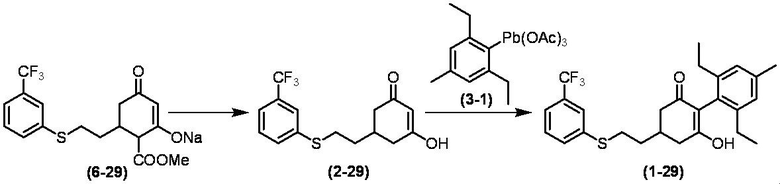
873 мг соединения, представленного формулой (6-29), растворяли в 12 мл воды при комнатной температуре. К полученному раствору добавляли 741 мг безводного карбоната натрия. Полученный раствор нагревали при температуре кипения с обратным холодильником в течение 6,5 часов. Реакционную жидкость охлаждали до комнатной температуры и подкисляли путем добавления 2 н раствора хлористоводородной кислоты. Полученную реакционную жидкость экстрагировали этилацетатом. Этилацетатный слой концентрировали при пониженном давлении и полученные кристаллы промывали последовательно трет-бутилметиловым эфиром и гексаном, с получением, таким образом, 434 мг соединения, представленного формулой (2-29).
430 мг соединения, представленного формулой (2-29), и 831 мг диметиламинопиридина растворяли в смеси 4 мл хлороформа и 1 мл толуола при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 795 мг соединения, представленного формулой (3-1), в атмосфере азота. Полученную смесь перемешивали при 80°C в течение 1 часа в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 15:85), с получением, таким образом, 144 мг соединения, представленного формулой (1-29).
1H ЯМР (CDCl3) δ м.д.: 7,56(1H,с), 7,50-7,40(3H,м), 6,98(2H,с), 5,54(1H,с), 3,10-3,01(2H,м), 2,70(2H,т), 2,47-2,24(10H,м), 1,86(2H,кв), 1,10-1,03(6H,м)
Пример получения 1-40: Получение соединения, представленного формулой (1-41)
<Получение соединения, представленного формулой 3-1>
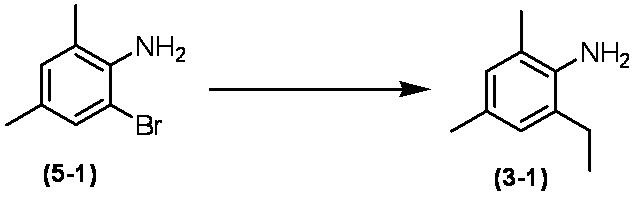
2,04 г комплекса 1,1'-бис(дифенилфосфино)ферроцен-палладий(II) дихлорид-дихлорметан, 48,8 г карбоната цезия и 10 г соединения, представленного формулой (5-1), растворяли в 125 мл N,N-диметилформамида при комнатной температуре в атмосфере азота. К полученному раствору добавляли по каплям 32,5 мл (1,0 M раствор в гексане) триэтилборана, с последующим перемешиванием при комнатной температуре в течение 16 часов в атмосфере азота. Реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка), затем к фильтрату добавляли воду, полученный продукт экстрагировали трет-бутилметиловым эфиром и органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Полученный органический слой концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:19 → 1:9), с получением, таким образом, 3,18 г соединения, представленного формулой (3-1).
1H ЯМР (CDCl3) δ м.д.: 6,78(2H,с), 3,49(2H,с), 2,51(2H,кв), 2,23(3H,с), 2,16(3H,с), 1,24(3H,т)
<Получение соединения, представленного формулой 11-4>
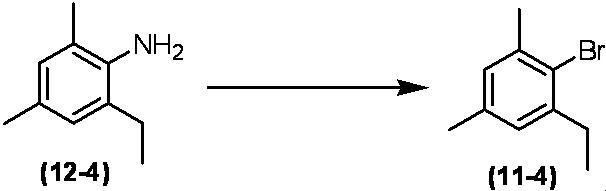
3,18 г соединения, представленного формулой (12-4), растворяли в 25 мл воды при комнатной температуре. К полученному раствору добавляли 26,6 мл 48% раствора бромистоводородной кислоты, с последующим перемешиванием при 40°C в течение 15 минут. К полученной реакционной жидкости добавляли по каплям 10 мл 2,34 M водного раствора нитрита натрия при 0°C, с последующим перемешиванием в течение 20 минут при охлаждении льдом. Полученную смесь добавляли по каплям к смеси, полученной путем добавления 26,6 мл 48% раствора бромистоводородной кислоты к 3,19 г сульфата меди(II) пентагидрата и 1,27 г меди (порошок) при 0°C и охлаждении. Полученный раствор перемешивали в течение 3,5 часов при комнатной температуре. Полученную реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка), и полученный фильтрат экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Полученный органический слой концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент гексан), с получением, таким образом, 1,91 г соединения, представленного формулой (11-4).
1H ЯМР (CDCl3) δ м.д.: 6,90(1H,с), 6,88(1H,с), 2,74(2H,кв), 2,38(3H,с), 2,25(3H,с), 1,21(3H,т)
<Получение соединения, представленного формулой 3-4>
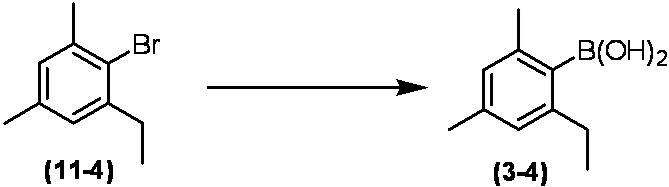
1,91 г соединения, представленного формулой (11-4), растворяли в 23 мл тетрагидрофурана при комнатной температуре в атмосфере азота. Полученный раствор охлаждали до -78°C и к смеси добавляли по каплям н-бутиллитий (1,63 M раствор в гексане) в атмосфере азота. Затем реакционную жидкость перемешивали при 40°C в течение 4 часов в атмосфере азота. Полученный раствор охлаждали до -78°C и к смеси добавляли по каплям 1,12 г триметоксиборана в атмосфере азота, с последующим перемешиванием при комнатной температуре в течение 23 часов. Полученный раствор охлаждали до 0°C и подкисляли путем добавления 1 н раствора хлористоводородной кислоты. Полученную реакционную жидкость экстрагировали хлороформом и органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом магния. Органический слой концентрировали при пониженном давлении и фильтровали и остаток промывали гексаном, с получением, таким образом, 654 мг соединения, представленного формулой (3-4).
1H ЯМР (CDCl3) δ м.д.: 6,86(1H,с), 6,85(1H,с), 4,58(2H,д), 2,63(2H,кв), 2,35(3H,с), 2,29(3H,с), 1,23(3H,т)
<Получение соединения, представленного формулой 1-41>
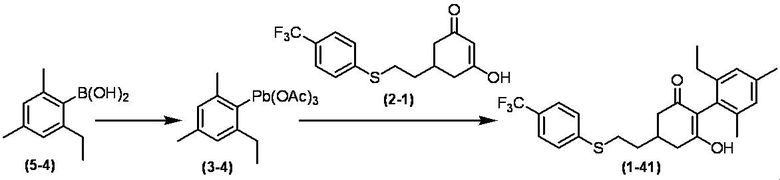
1,87 г тетраацетата свинца, 58,5 мг ацетата ртути и 654 мг соединения, представленного формулой (5-4), растворяли в 7 мл хлороформа при комнатной температуре в атмосфере азота. Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем реакционную жидкость перемешивали при 45°C в течение 4 часов в атмосфере азота. Реакционную жидкость охлаждали до комнатной температуры и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества. К полученному маслянистому веществу добавляли гексан и полученную смесь концентрировали при пониженном давлении, с получением, таким образом, желтого твердого вещества. Полученное твердое вещество растворяли в 16 мл хлороформа при комнатной температуре в атмосфере азота. К полученному раствору добавляли 6,09 г карбоната калия, с последующим перемешиванием в течение 15 минут.
Затем реакционную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 21 г соединения, представленного формулой (3-4).
332 мг соединения, представленного формулой (2-1), и 644 мг диметиламинопиридина растворяли в смеси 3 мл хлороформа и 1 мл толуола при комнатной температуре в атмосфере азота.
Полученный раствор перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. Затем к полученному раствору добавляли 600 мг соединения, представленного формулой (3-4), в атмосфере азота. Полученную смесь нагревали при температуре кипения с обратным холодильником в течение 2 часов в атмосфере азота. Полученную реакционную жидкость охлаждали до комнатной температуры, контролировали уровень pH = 1 при помощи 2 н раствора хлористоводородной кислоты и фильтровали с использованием Целита (зарегистрированная торговая марка). Полученный фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, желтого маслянистого вещества.
Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:9 → 3:17), с получением, таким образом, 361 мг соединения, представленного формулой (1-41).
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,д), 7,37(2H,д), 6,96(2H,с), 5,50(1H,с), 3,13-3,03(2H,м), 2,71(2H,т), 2,47-2,25(8H,м), 2,06-2,00(3H,м), 1,90-1,85(2H,м), 1,10-1,02(3H,м)
Соединение, полученное в соответствии с Примером получения 1-40, показано ниже.
<Получение соединения, представленного формулой 1-128>
1H ЯМР (CDCl3) δ м.д.: 7,53(2H,д), 7,37(3H,д), 7,23-7,12(3H,м), 3,05(2H,тд), 2,69(2H,д), 2,47-2,30(3H,м), 1,87-1,81(2H,м)
<Получение соединения, представленного формулой 1-167>
1H ЯМР (CDCl3) δ м.д.: 7,55-7,49(3H,м), 7,38-7,26(3H,м), 7,19-7,14(1H,м), 5,62(1H,с), 3,07-3,06(2H,м) ,2,72-2,63(2H,м), 2,48-2,21(3H,м), 1,87(2H,дт)
<Получение соединения, представленного формулой 1-168>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,с), 7,70-7,65(2H,м), 7,38(1H,тт), 7,29-7,23(2H,м), 7,16(1H,ддд), 5,58(1H,д), 3,31(2H,т), 2,81-2,67(2H,м), 2,55-2,24(3H,м), 1,97-1,88(2H,м)
<Получение соединения, представленного формулой 1-170>
1H ЯМР (CDCl3) δ м.д.: 8,63(1H,с), 7,66(1H,дд), 7,25(1H,д), 6,61(2H,с), 3,25-3,21(2H,м), 2,69(2H,д), 2,37-2,31(3H,м), 1,86-1,83(2H,м)
<Получение соединения, представленного формулой 1-171>
1H ЯМР (CDCl3) δ м.д.: 7,69(1H,ддд), 7,54(2H,д), 7,38(3H,д), 7,28-7,13(2H,м), 5,58(1H,с), 3,07(2H,кв), 2,77-2,25(5H,м), 1,91-1,85(2H,м)
<Получение соединения, представленного формулой 1-175>
δ м.д.: 7,53(2H,д), 7,39(2H,д), 7,29(1H,с), 7,11(1H,с), 5,57(1H,с), 3,21-3,12(1H,м), 2,92-2,82(1H,м), 2,66-1,91(13H,м), 1,19-1,14(3H,м)
<Получение соединения, представленного формулой 1-176>
δ м.д.: 7,52(2H,д), 7,36(2H,д), 6,71(1H,д), 6,59(1H,с), 6,13(1H,с), 3,70-3,63(3H,м), 3,15(1H,дд), 2,84(1H,тд), 2,59-1,88(12H,м), 1,13(3H,д)
<Получение соединения, представленного формулой 1-179>
δ м.д.: 7,58-7,35(5H,м), 6,67(2H,дд), 6,00(1H,с), 3,81(3H,с), 3,79(3H,с), 3,24(1H,д), 2,88(1H,т), 2,64-1,95(6H,м), 1,19(3H,д)
<Получение соединения, представленного формулой 1-180>
δ м.д.: 7,53-7,04(6H,м), 5,87(1H,с), 3,78-1,93(14H,м), 1,14(3H,ддд)
<Получение соединения, представленного формулой 1-181>
δ м.д.: 7,53(2H,д), 7,38(2H,д), 7,30(1H,д), 7,04(1H,д), 6,49(1H,ддд), 5,71-5,62(2H,м), 5,22-5,16(1H,м), 3,21-3,12(1H,м), 2,87(1H,м), 2,63-1,90(12H,м), 1,19-1,14(3H,м)
<Получение соединения, представленного формулой 1-182>
1H ЯМР (CDCl3) δ м.д.: 7,55(2H,д), 7,40(2H,д), 7,31-7,26(2H,м), 3,18-2,08(17H,м), 1,15(3H,с)
Пример получения 1-41: Получение соединения, представленного формулой (1-105)
<Получение соединения, представленного формулой 31-2>
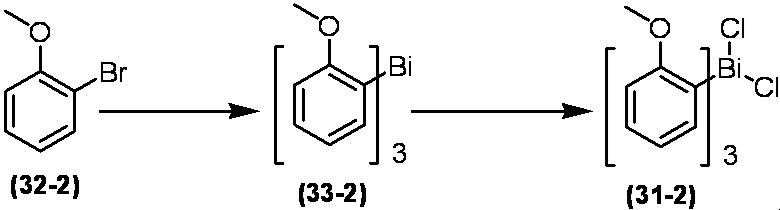
2,52 г соединения, представленного формулой (32-2), растворяли в 15 мл тетрагидрофурана при комнатной температуре в атмосфере азота. Полученный раствор охлаждали до -78°C и к смеси добавляли 10 мл н-бутиллития (1,6 M раствор в гексане), с последующим перемешиванием в течение 1 часа. Затем к смеси добавляли суспензию 1,44 г трихлорвисмута в 10 мл тетрагидрофурана, с последующим перемешиванием в течение 1 часа при нагревании до комнатной температуры. К полученной реакционной жидкости добавляли 20 мл воды и полученный продукт фильтровали с использованием Целита (зарегистрированная торговая марка). Фильтрат экстрагировали хлороформом. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 2,18 г неочищенного продукта соединения, представленного формулой (33-2).
Затем 2,18 г полученного неочищенного продукта соединения, представленного формулой (33-2), растворяли в 5 мл безводного хлороформа при комнатной температуре, затем полученный продукт охлаждали до 0°C и к смеси добавляли 0,55 мл сульфурилхлорида. Затем температуру повышали до комнатной температуры, с последующим перемешиванием в течение 30 минут. Кристаллы осаждали путем добавления к полученной реакционной жидкости трет-бутилметилового эфира и кристаллы концентрировали при пониженном давлении и фильтровали, с получением, таким образом, 1,86 г соединения, представленного формулой (31-2).
1H ЯМР (d-DMSO) δ м.д.: 8,03 (3H,дд), 7,62 (3H,т), 7,51 (3H,д), 7,34 (3H,т), 3,82 (9H,с)
<Получение соединения, представленного формулой 1-105>
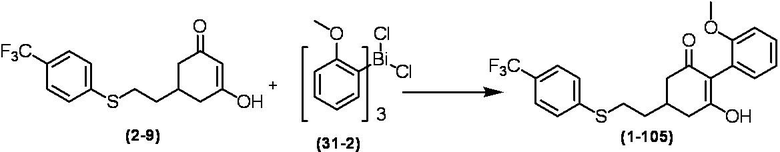
475 мг соединения, представленного формулой (2-9), 274 мг 1,8-диазабицикло[5.4.0]ундека-7-ена и 1,08 г соединения, представленного формулой (31-2), растворяли в смеси 1 мл хлороформа и 5 мл толуола при комнатной температуре в атмосфере азота, с последующим перемешиванием при комнатной температуре в течение 24 часов в атмосфере азота. Полученную реакционную жидкость разбавляли хлороформом, промывали водным раствором хлористоводородной кислоты, pH которого контролировали на уровне от 1 до 2, и промывали насыщенным солевым раствором. Затем полученный органический слой сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:9 → 3:7), с получением, таким образом, 72,4 мг соединения, представленного формулой (1-105).
1H ЯМР (CDCl3) δ м.д.: 7,53(2H,д), 7,38-7,34(3H,м), 7,14-6,98(3H,м), 6,30(1H,с), 3,80(3H,с), 3,10-3,02(2H,м), 2,73-2,65(2H,м), 2,47-2,39(2H,м), 2,31-2,24(1H,м), 1,88-1,82(2H,м)
Пример получения 1-42: Получение соединения, представленного формулой (1-96)
<Получение соединения, представленного формулой 31-3>
3,20 г соединения, представленного формулой (32-3), растворяли в 15 мл тетрагидрофурана при комнатной температуре в атмосфере азота. Полученный раствор охлаждали до -78°C и к смеси добавляли 10 мл н-бутиллития (1,6 M раствор в гексане), с последующим перемешиванием в течение 1 часа. Затем к смеси добавляли раствор 1,44 г трихлорвисмута, суспендированного в 10 мл тетрагидрофурана, с последующим перемешиванием в течение 1 часа при нагревании до комнатной температуры. К полученной реакционной жидкости добавляли 20 мл воды и водный слой экстрагировали хлороформом. Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 3,07 г неочищенного продукта соединения, представленного формулой (33-3).
Затем 3,07 г полученного неочищенного продукта соединения, представленного формулой (33-3), растворяли в 5 мл безводного хлороформа при комнатной температуре, затем полученный продукт охлаждали до 0°C и к смеси добавляли 0,55 мл сульфурилхлорида. Затем температуру повышали до комнатной температуры, с последующим перемешиванием в течение 30 минут. Полученную реакционную жидкость концентрировали при пониженном давлении и кристаллы осаждали путем добавления гексана к полученному маслянистому веществу. Полученные кристаллы фильтровали, с получением, таким образом, 1,25 г соединения, представленного формулой (31-3).
1H ЯМР (CDCl3) δ м.д.: 8,11(3H,д), 7,51-7,45(9H,м), 7,30(6H,д), 7,19-7,15(3H,м), 7,05(6H,т)
<Получение соединения, представленного формулой 1-96>
3,16 мг соединения, представленного формулой (2-9), 183 мг 1,8-диазабицикло[5.4.0]ундека-7-ена и 887 мг соединения, представленного формулой (31-3), растворяли в смеси 1 мл хлороформа и 4 мл толуола при комнатной температуре в атмосфере азота, с последующим перемешиванием при комнатной температуре в течение 24 часов в атмосфере азота. Полученную реакционную жидкость разбавляли хлороформом и полученную разбавленную жидкость промывали водным раствором хлористоводородной кислоты, pH которого контролировали на уровне от 1 до 2, и промывали насыщенным солевым раствором. Затем полученный органический слой сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 3:7), с получением, таким образом, 99 мг соединения, представленного формулой (1-96).
1H ЯМР (CDCl3) δ м.д.: 7,54-7,17 (13H,м), 5,66(1H,с), 3,02(2H,м), 2,73(2H,м), 2,59-2,17(3H,м), 1,82-1,77(2H,м)
Соединение, полученное в соответствии с Примером получения 1-42, показано ниже.
<Получение соединения, представленного формулой 1-42>
1H ЯМР (CDCl3) δ м.д.: 7,79(1H,д), 7,63-7,53(4H,м), 7,38(2H,д), 7,20(1H,дд), 5,40(1H,с), 3,06(2H,т), 2,75-2,25(5H,м), 1,86(2H,дт)
<Получение соединения, представленного формулой 1-166>
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,д), 7,38(2H,д), 7,31-7,06(2H,м), 7,04(1H,м), 5,65(1H,д), 3,11-3,03(2H,м), 2,75-2,65(2H,м), 2,49-2,39(2H,м), 2,32-2,23(1H,м), 2,11(3H,д), 1,87(2H,кв)
Пример получения 1-43: Получение соединения, представленного формулой (1-102)
<Получение соединения, представленного формулой 32-4>
20 мл диэтилцинка (1,0 M раствор в гексане), растворяли в 20 мл дихлорметана при охлаждении льдом в атмосфере азота и к смеси добавляли раствор 2,28 г трифторуксусной кислоты в 20 мл дихлорметана. Полученную смешанную жидкость перемешивали в течение 20 минут при охлаждении льдом и к смеси добавляли раствор 5,36 г дииодметана в 20 мл дихлорметана, с последующим перемешиванием в течение 20 минут. К полученному раствору добавляли раствор 1,83 г 2-бромстирола в 10 мл дихлорметана при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 6 часов. pH полученной реакционной жидкости контролировали на уровне 1-2 путем добавления 2 н водного раствора хлористоводородной кислоты и полученный продукт экстрагировали гексаном. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 1,76 г неочищенного продукта соединения, представленного формулой (32-4).
1H ЯМР (CDCl3) δ м.д.: 7,54(1H,дд), 7,20(1H,тд), 7,02(1H,тд), 6,93(1H,дд), 2,16(1H,тт), 1,01(2H,ддд), 0,68(2H,дт)
<Получение соединения, представленного формулой 31-4>
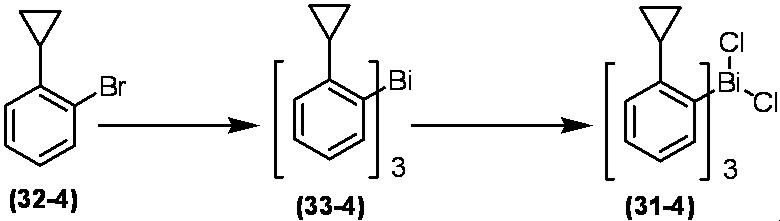
1,76 г соединения, представленного формулой (32-4), растворяли в 9 мл тетрагидрофурана при комнатной температуре в атмосфере азота. Полученный раствор охлаждали до -78°C и к смеси добавляли 6,6 мл н-бутиллития (1,6 M раствор в гексане), с последующим перемешиванием в течение 30 минут. Затем к полученной смеси добавляли суспензию 939 мг трихлорвисмута в 5 мл тетрагидрофурана, с последующим перемешиванием в течение 1 часа при нагревании до комнатной температуры. К полученной реакционной жидкости добавляли 20 мл воды и полученный продукт экстрагировали хлороформом.
Полученный хлороформный слой промывали насыщенным солевым раствором, сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 2,27 г неочищенного продукта соединения, представленного формулой (33-4).
Затем 2,27 г полученного неочищенного продукта соединения, представленного формулой (33-4), растворяли в 5 мл безводного хлороформа при комнатной температуре, затем полученный продукт охлаждали до 0°C и к смеси добавляли 0,36 мл сульфурилхлорида. Затем температуру повышали до комнатной температуры, с последующим перемешиванием в течение 1 часа. Кристаллы осаждали путем добавления к полученной реакционной жидкости трет-бутилметилового эфира и кристаллы концентрировали при пониженном давлении. Полученные кристаллы фильтровали, с получением, таким образом, 1,05 г соединения, представленного формулой (31-4).
1H ЯМР (d-DMSO) δ м.д.: 7,92(3H,т), 7,58-7,52(6H,м), 7,26(3H,т), 2,36-2,28(3H,м), 1,03-0,94(12H,м)
<Получение соединения, представленного формулой 1-102>
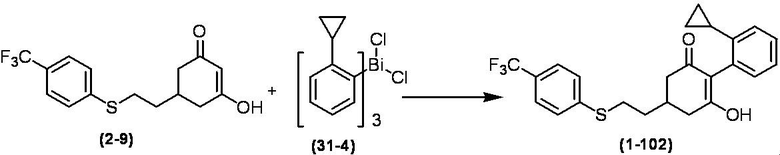
3,16 мг соединения, представленного формулой (2-9), 183 мг 1,8-диазабицикло[5.4.0]ундека-7-ена и 887 мг соединения, представленного формулой (31-4), растворяли в смеси 1 мл хлороформа и 4 мл толуола при комнатной температуре в атмосфере азота. Полученную смесь перемешивали при комнатной температуре в течение около 24 часов в атмосфере азота. Полученную реакционную жидкость разбавляли хлороформом, промывали водным раствором хлористоводородной кислоты, pH которого контролировали на уровне от 1 до 2, и промывали насыщенным солевым раствором. Затем полученный органический слой сушили над безводным сульфатом магния и фильтровали и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, маслянистого вещества. Полученное маслянистое вещество подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 3:7), с получением, таким образом, 56 мг соединения, представленного формулой (1-102).
1H ЯМР (CDCl3) δ м.д.: 7,54(2H,д), 7,38-7,22(4H,м), 7,06-7,00(2H,м), 5,76(1H,д), 3,08-3,02(2H,м), 2,75-2,68(2H,м), 2,55-2,10(4H,м), 1,90-1,86(2H,м), 0,87-0,65(3H,м), 0,57-0,47(1H,м)
Пример получения 1-44: Получение соединения, представленного формулой (1-71)
<Получение соединения, представленного формулой 23-2>
6,60 г соединения, представленного формулой (24-1), и 5,43 г диизопропилэтиламина растворяли в 50 мл безводного N,N-диметилформамида. К полученной смеси добавляли по каплям пивалоилхлорид при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 30 минут. К полученной смеси добавляли воду и полученный продукт экстрагировали трет-бутилметиловым эфиром. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении, с получением, таким образом, неочищенного продукта. Неочищенный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 3:17), с получением, таким образом, 7,14 г соединения, представленного формулой (23-2).
1H ЯМР (CDCl3) δ м.д.: 7,38-7,26 (5H, м), 6,87 (2H, с), 4,53(2H, дд), 3,63-3,54 (2H, м), 2,75-2,22 (12H, м), 1,86-1,76(2H, м), 1,10-1,03 (6H, м), 0,87 (9H, с)
<Получение соединения, представленного формулой 22-2>
7,14 г соединения, представленного формулой (23-2), растворяли в 45 мл этилацетата. К полученной смешанной жидкости добавляли 3,57 г 10% палладия на углероде, с последующим перемешиванием при 35°C в течение 18 часов в атмосфере водорода. Реакционную смешанную жидкость фильтровали с использованием Целита (зарегистрированная торговая марка), и полученный фильтрат концентрировали при пониженном давлении, с получением, таким образом, 5,10 г соединения, представленного формулой (22-2).
1H ЯМР (CDCl3) δ м.д.: 6,87 (2H, с), 3,81 (2H, д), 2,78-2,24 (12H, м), 1,83-1,73 (2H, м), 1,39-1,36 (1H, м), 1,10-1,04 (6H, м), 0,87 (9H, с)
<Получение соединения, представленного формулой 21-1>
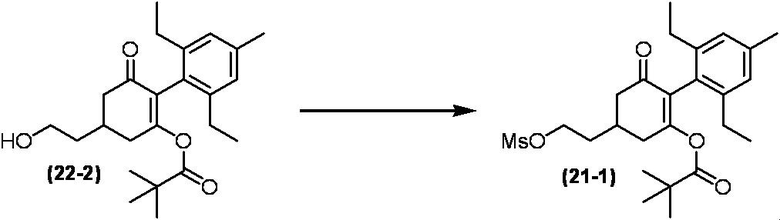
193 мг соединения, представленного формулой (21-2), и 162 мг диизопропилэтиламина растворяли в растворе 5 мл N,N-диметилформамида. К полученной смеси добавляли по каплям 68,7 мг метансульфонилхлорида при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 1 часа. К реакционной смеси добавляли воду и полученный продукт экстрагировали трет-бутилметиловым эфиром. Органический слой сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К остатку добавляли гексан и полученный продукт фильтровали, с получением, таким образом, 208 мг соединения, представленного формулой (21-1).
1H ЯМР (CDCl3) δ м.д.: 6,87(2H,с), 4,37(2H,дд), 3,05 (3H,с), 2,74-2,25 (12H,м), 2,00-1,97 (2H,м), 1,10-1,04 (6H,м), 0,88 (9H,с)
<Получение соединения, представленного формулой 1-71>
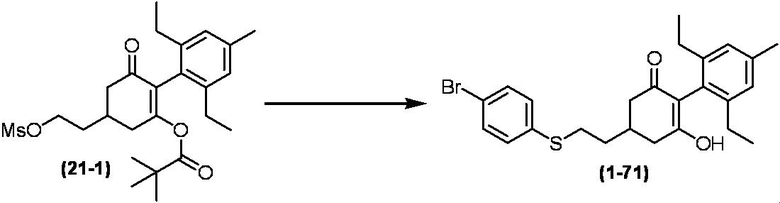
200 мг соединения, представленного формулой (21-1), и 167 мг диизопропилэтиламина растворяли в 5 мл N,N-диметилформамида. К полученной реакционной жидкости добавляли 195 мг парабромтиофенола, с последующим перемешиванием при комнатной температуре в течение 16 часов. Полученную смесь нагревали до 80°C и перемешивали в течение 2 часов. К смеси добавляли воду и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 0:100 → 1:4), с получением, таким образом, 193 мг соединения, представленного формулой (1-71).
1H ЯМР (CDCl3) δ м.д.: 7,42 (2H,дт), 7,21(2H,дт), 6,98(2H,с), 5,61(1H,с), 3,05-2,93(2H,м), 2,73-2,64 (2H,м), 2,48-2,21 (10H,м), 1,81(2H,кв), 1,10-1,03(6H,м)
Пример получения 1-45: Получение соединения, представленного формулой (1-132)
<Получение соединения, представленного формулой 1-132>
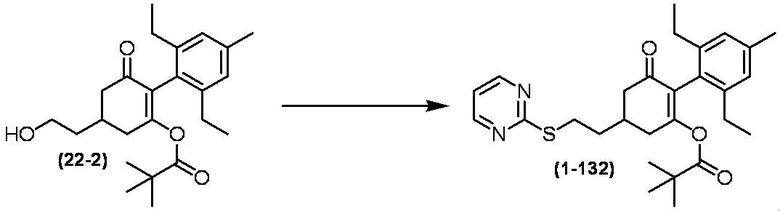
193 мг соединения, представленного формулой (22-2), и 258 мг диизопропилэтиламина растворяли в растворе 5 мл N,N-диметилформамида. К полученной смеси добавляли по каплям 68,7 мг метансульфонилхлорида при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 30 минут. К полученной смешанной жидкости добавляли 123 мг 2-меркаптопиримидина, с последующим перемешиванием при 80°C в течение 9 часов. pH полученной реакционной жидкости контролировали на уровне pH = 1 путем добавления 2 н раствора хлористоводородной кислоты и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 7:13), с получением, таким образом, 171 мг соединения, представленного формулой (1-132).
1H ЯМР (CDCl3) δ м.д.: 8,52(2H,дд), 6,98(1H,дт), 6,87(2H,д), 3,30-3,18(2H,м), 2,85-2,67(2H,м), 2,57-2,23(10H,м), 1,96(2H,кв), 1,09-1,02(6H,м), 0,87(9H,с)
Пример получения 1-46: Получение соединения, представленного формулой (1-34)
<Получение соединения, представленного формулой 1-34>

170 мг соединения, представленного формулой (1-132), растворяли в смешанном растворе 10 мл тетрагидрофурана, 10 мл метанола и 10 мл воды. К полученному раствору добавляли 44,5 мг гидроксида лития моногидрата, с последующим перемешиванием в течение 10 минут при комнатной температуре. Реакционную жидкость концентрировали при пониженном давлении и контролировали уровень pH = 1 путем добавления 2 н раствора хлористоводородной кислоты и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 2:3), с получением, таким образом, 126 мг соединения, представленного формулой (1-34).
1H ЯМР (CDCl3) δ м.д.: 8,53(2H,д), 7,00-6,96(3H,м), 5,57(1H,с), 3,29-3,21(2H,м), 2,81-2,73(2H,м), 2,51-2,43(2H,м), 2,41-2,25(8H,м), 1,95(2H,с), 1,09-1,03(6H,м)
Пример получения 1-47: Получение соединения, представленного формулой (1-104)
<Получение соединения, представленного формулой 1-104>
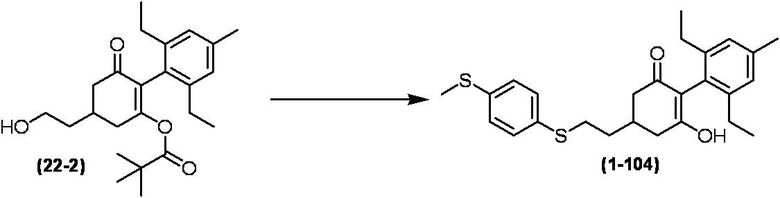
178 мг соединения, представленного формулой (22-2), и 238 мг диизопропилэтиламина растворяли в растворе 5 мл N,N-диметилформамида. К полученной смеси добавляли по каплям 63,3 мг метансульфонилхлорида при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 30 минут. К полученному раствору добавляли 158 мг пара(метилтио)тиофенола, с последующим перемешиванием при комнатной температуре в течение 1,5 часов. Полученную реакционную жидкость контролировали при уровне pH = 1 путем добавления 2 н раствора хлористоводородной кислоты и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:9 → 7:13), с получением, таким образом, 100 мг соединения, представленного формулой (1-104).
1H ЯМР (CDCl3) δ м.д.: 7,30 (2H, дт), 7,20 (2H, дт), 6,98 (2H, с), 5,58 (1H, с), 2,97 (2H, тд), 2,70-2,64 (2H, м), 2,47 (3H, с), 2,45-2,22 (10H, м), 1,80 (2H, кв), 1,10-1,03 (6H, м)
Пример получения 1-48: Получение соединения, представленного формулой (1-133)
<Получение соединения, представленного формулой 1-133>
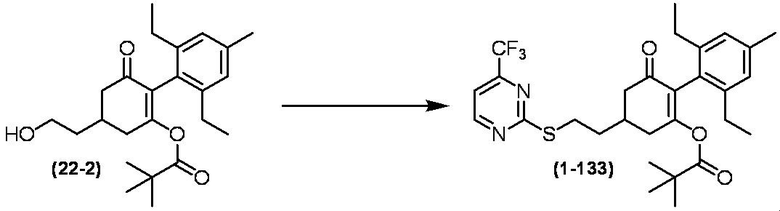
387 мг соединения, представленного формулой (22-2), и 516 мг диизопропилэтиламина растворяли в растворе 10 мл N,N-диметилформамида. К полученной смеси добавляли по каплям 137 мг метансульфонилхлорида при охлаждении льдом, с последующим перемешиванием при комнатной температуре в течение 1 часа. К полученной смешанной жидкости добавляли 396 мг 4-трифторметил-2-пиримидинтиола, с последующим перемешиванием при 80°C в течение 30 минут. pH реакционной жидкости контролировали на уровне pH = 1 путем добавления 2 н раствора хлористоводородной кислоты и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 546 мг соединения, представленного формулой (1-133).
1H ЯМР (CDCl3) δ м.д.: 8,76 (1H,д), 7,29 (1H,д), 6,87 (2H,д), 3,33-3,23 (2H,м), 2,82-2,68 (3H,м), 2,59-2,24(9H,м), 1,97(2H,кв), 1,10-1,03 (6H,м), 0,88 (9H,с)
Пример получения 1-49: Получение соединения, представленного формулой (1-35)
<Получение соединения, представленного формулой 1-35>
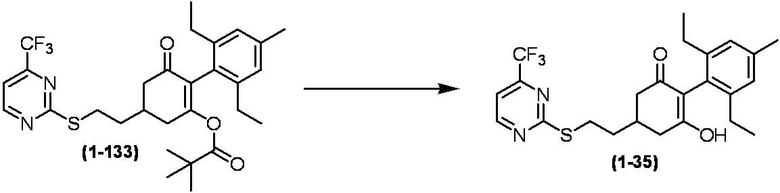
546 мг соединения, представленного формулой (1-133), растворяли в смешанном растворе 10 мл тетрагидрофурана, 10 мл метанола и 10 мл воды. К полученному раствору добавляли 126 мг гидроксида лития моногидрата, с последующим перемешиванием в течение 20 минут при комнатной температуре. Реакционную жидкость концентрировали при пониженном давлении и контролировали уровень pH = 1 путем добавления 2 н раствора хлористоводородной кислоты и полученный продукт экстрагировали трет-бутилметиловым эфиром. Полученный органический слой промывали водой, сушили над безводным сульфатом магния и фильтровали. Полученный фильтрат концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 1:3), с получением, таким образом, 435 мг соединения, представленного формулой (1-35).
1H ЯМР (CDCl3) δ м.д.: 8,76(1H,д), 7,29(1H,д), 6,99(2H,д), 5,62(1H,с), 3,27(2H,тд), 2,78-2,71(2H,м), 2,51-1,93(12H,м), 1,07(6H,м)
Соединение, полученное в соответствии с Примером получения 1-49, показано ниже.
<Получение соединения, представленного формулой 1-136>
1H ЯМР (CDCl3) δ м.д.: 7,38(1H,т), 7,26(1H,м), 7,10(2H,м), 6,98(2H,с), 5,51(1H,с), 3,00(2H,т), 2,77(2H,т), 2,50-2,20(10H,м), 1,79(2H,кв), 1,06(6H,кв)
<Получение соединения, представленного формулой 1-137>
1H ЯМР (CDCl3) δ м.д.: 7,37(1H,д), 7,30-7,20(2H,м), 7,15-7,06(1H,м), 6,98(2H,с), 5,51(1H,с), 3,02(2H,кв), 2,71(2H,т), 2,51-2,22(10H,м), 1,87(2H,кв), 1,06(6H,кв)
<Получение соединения, представленного формулой 1-138>
1H ЯМР (CDCl3) δ м.д.: 7,57(1H,д), 7,55-7,25(2H,м), 7,07-7,04(1H,м), 6,98(2H,с), 5,51(1H,с), 3,04-3,00(2H,м), 2,71(2H,т), 2,50-2,28(10H,м), 1,89(2H,кв), 1,06(6H,кв)
<Получение соединения, представленного формулой 1-139>
1H ЯМР (CDCl3) δ м.д.: 7,28-7,26(1H,д), 7,19-7,05(3H,м), 6,97(2H,с), 5,51(1H,с), 2,98(2H,т), 2,70(2H,т), 2,50-2,20(13H,м), 1,85(2H,кв), 1,06(6H,кв)
<Получение соединения, представленного формулой 1-140>
1H ЯМР (CDCl3) δ м.д.: 7,30-7,18 (4H, м), 6,97 (2H, с), 5,46 (1H, с), 3,00 (2H, т), 2,78 (2H, кв), 2,65 (2H, т), 2,50-2,21 (10H, м), 1,84 (2H, кв), 1,23 (3H, т), 1,06 (6H, кв)
<Получение соединения, представленного формулой 1-141>
1H ЯМР (CDCl3) δ м.д.: 7,34-7,10 (4H, м), 6,97 (2H, с), 5,53 (1H, с), 3,55-3,45 (1H, м), 2,98 (2H, т), 2,70 (2H, т), 2,50-2,22 (10H, м), 1,85 (2H, кв), 1,24 (6H, д), 1,06 (6H, кв)
<Получение соединения, представленного формулой 1-142>
1H ЯМР (CDCl3) δ м.д.: 7,32-7,19 (2H, м), 6,98-6,84 (4H, м), 5,53 (1H, с), 3,91 (3H, с), 3,08-2,94 (2H, м), 2,69 (2H, т), 2,48-2,20 (10H, м), 1,80 (2H, кв), 1,06 (6H, кв)
<Получение соединения, представленного формулой 1-143>
1H ЯМР (CDCl3) δ м.д.: 7,30-7,20 (1H, м), 7,10-6,98 (4H, м), 6,90-6,80 (1H, т), 5,52 (1H, с), 3,05-3,00 (2H, м), 2,70 (2H, т), 2,49-2,23 (10H, м), 1,83 (2H, кв), 1,06 (6H, кв)
<Получение соединения, представленного формулой 1-144>
1H ЯМР (CDCl3) δ м.д.: 7,30-7,15 (4H,м), 6,97 (2H,с), 5,54 (1H,с), 3,05-3,00 (2H,м), 2,70 (2H,т), 2,48-2,22 (10H,м), 1,85 (2H,кв), 1,06 (6H,кв)
<Получение соединения, представленного формулой 1-145>
1H ЯМР (CDCl3) δ м.д.: 7,48 (1H,с), 7,31-7,11 (3H,м), 6,95 (2H,с), 5,53 (1H,с), 3,09-3,00 (2H,м), 2,70 (2H,т), 2,47-2,25 (10H,м), 1,85 (2H,кв), 1,06 (6H,кв)
<Получение соединения, представленного формулой 1-146>
1H ЯМР (CDCl3) δ м.д.: 7,20-7,10 (3H,м), 7,12-6,98 (3H,м), 5,51 (1H,с), 3,01-2,95 (2H,м), 2,65 (2H,т), 2,45-2,20 (13H,м), 1,82 (2H,кв), 1,06 (6H,кв)
<Получение соединения, представленного формулой 1-147>
1H ЯМР (CDCl3) δ м.д.: 7,30-7,12 (3H,м), 6,98 (2H,с), 5,48 (1H,с), 3,10-3,00 (2H,м), 2,72 (2H,т), 2,52-2,22 (10H,м), 1,89 (2H,кв), 1,06 (6H,кв)
<Получение соединения, представленного формулой 1-148>
1H ЯМР (CDCl3) δ м.д.: 7,12-7,05 (3H,м), 6,92 (2H,с), 5,50 (1H,с), 2,71 (2H,т), 2,55 (6H,с), 2,61 (2H,т), 2,42-2,17 (10H,м), 1,80 (2H,кв), 1,06 (6H,кв)
<Получение соединения, представленного формулой 1-149>
1H ЯМР (CDCl3) δ м.д.: 7,36 (1H, дд), 7,14 (1H, дд), 6,99 (1H, дд), 6,96 (2H,с), 5,80 (1H,с), 2,86 (2H,т), 2,67-2,59 (2H, м), 2,47-2,18 (10H, м), 1,78 (2H, кв), 1,07 (3H, т), 1,05 (3H, т)
<Получение соединения, представленного формулой 1-150>
1H ЯМР (CDCl3) δ м.д.: 7,68 (1H, д), 7,24 (1H, д), 6,99(2H, с), 5,49 (1H, с), 3,32 (2H, т), 2,76-2,68 (2H, м), 2,46-2,25 (10H, м), 1,97 (2H, кв), 1,08 (3H, т), 1,05 (3H, т)
<Получение соединения, представленного формулой 1-151>
1H ЯМР (CDCl3) δ м.д.: 7,88 (2H,д), 7,33 (2H,д), 6,99 (2H,с), 5,52 (1H, с), 3,10 (2H, дт), 2,75-2,69 (2H, м), 2,58 (3H, с), 2,47-2,24 (10H, м), 1,90 (2H, кв), 1,09 (3H, т), 1,05 (3H, т)
<Получение соединения, представленного формулой 1-152>
1H ЯМР (CDCl3) δ м.д.: 7,31 (2H, д), 6,97 (2H, с), 6,78 (2H, д), 5,57 (1H, с), 5,18 (1H, с), 2,89 (2H, т), 2,68-2,61 (2H, м), 2,43-2,18 (10H, м), 1,76 (2H, кв), 1,08 (3H, т), 1,04 (3H, т)
<Получение соединения, представленного формулой 1-153>
1H ЯМР (CDCl3) δ м.д.: 8,67(1H,дд), 7,67(1H,дд), 7,27-7,25(1H,м), 6,99(2H,с), 5,50(1H,с), 3,33-3,29(2H,м), 2,79-2,71(2H,м), 2,51-2,24(10H,м), 1,94-1,89(2H,м), 1,07(3H,т), 1,04 (3H,т)
<Получение соединения, представленного формулой 1-155>
1H ЯМР (CDCl3) δ м.д.: 9,02-9,01(1H,м), 8,04(1H,дд), 7,23(1H,дд), 6,98(2H,с), 5,53(1H,с), 3,93(3H,с), 3,32(2H,т), 2,76(2H,т), 2,51-2,23(10H,м), 1,92(2H,кв), 1,05(6H,кв)
<Получение соединения, представленного формулой 1-127>
1H ЯМР (CDCl3) δ м.д.: 8,36 (1H, дд), 7,55 (1H, дд), 6,98-6,95 (3H, м), 5,46 (1H, с), 3,30 (2H, дт), 2,80-2,73 (2H,м), 2,52-2,25 (10H, м), 1,92 (2H, кв), 1,07(3H, т), 1,04 (3H, т)
<Получение соединения, представленного формулой 1-160>
1H ЯМР (CDCl3) δ м.д.: 6,98 (2H, с), 5,75 (1H, с), 5,55 (1H, с), 3,94 (6H, с), 3,29-3,18 (2H, м), 2,76-2,69 (2H, м), 2,47-2,26 (10H, м), 1,96 (2H, кв), 1,07 (6H, кв)
<Получение соединения, представленного формулой 1-161>
1H ЯМР (CDCl3) δ м.д.: 6,98 (2H, с), 6,84-6,78 (2H, м), 6,62 (1H, тт), 5,52 (1H, с), 3,03 (2H, ддд), 2,72 (2H, дт), 2,48-2,25 (10H, м), 1,87 (2H, дд), 1,07 (6H, дт)
<Получение соединения, представленного формулой 1-70>
1H ЯМР (CDCl3) δ м.д.: 7,61 (2H,д), 7,07 (2H,д), 6,97 (2H,с), 5,72 (1H,с), 3,04-2,92 (2H,м), 2,72-2,63 (2H,м), 2,45-2,21 (10H,м), 1,81 (2H,кв), 1,08 (3H,т), 1,04 (3H,т)
<Получение соединения, представленного формулой 1-75>
1H ЯМР (CDCl3) δ м.д.: 7,34-7,28 (4H,м), 6,98 (2H,с), 5,46 (1H,с), 2,99 (2H,дт), 2,71-2,64 (2H,м), 2,43-2,23 (10H,м), 1,82 (2H,кв), 1,31 (9H,с), 1,08 (3H,т), 1,04 (3H,т)
<Получение соединения, представленного формулой 1-109>
1H ЯМР (CDCl3) δ м.д.: 8,74 (2H,д), 6,98 (2H,с), 5,50(1H,с), 3,28 (2H,дт), 2,79-2,73 (2H,м), 2,52-2,25 (10H,м), 1,96 (2H,кв), 1,09-1,03 (6H,м)
<Получение соединения, представленного формулой 1-112>
1H ЯМР (CDCl3) δ м.д.: 8,62 (1H,д), 7,74 (1H,дд), 7,60 (1H,д), 6,98 (2H,с), 5,51 (1H,с), 3,15-3,07 (2H,м), 2,75-2,68 (2H,м), 2,47-2,24 (10H,м), 1,89 (2H,кв), 1,09 (3H,т), 1,05(3H,т)
<Получение соединения, представленного формулой 1-115>
1H ЯМР (CDCl3) δ м.д.: 8,70(1H,с), 8,51(1H,с), 6,98(2H,с), 5,49(1H,с), 3,33(2H,дт), 2,79-2,72(2H,м), 2,51-2,24(10H,м), 1,93(2H,кв), 1,07(3H,т), 1,04(3H,т)
<Получение соединения, представленного формулой 1-118>
1H ЯМР (CDCl3) δ м.д.: 7,56 (1H,д), 7,49 (1H,д), 6,98 (2H,с), 5,48 (1H,с), 3,54-3,46 (2H,м), 2,79-2,70 (2H,м), 2,53-2,27 (10H,м), 2,06-1,99 (2H,м), 1,08 (3H,т), 1,06 (3H,т)
<Получение соединения, представленного формулой 1-121>
1H ЯМР (CDCl3) δ м.д.: 8,61 (1H,д), 7,72 (1H,дд), 7,23 (1H, дд), 6,98(2H,с), 3,29 (2H,ддд), 2,76 (2H,ддд), 2,52-2,23 (10H,м), 1,95-1,89 (2H,м), 1,06 (6H,дт)
<Получение соединения, представленного формулой 1-169>
1H ЯМР (CDCl3) δ м.д.: 7,21-7,06 (3H,м), 6,95 (2H,с), 5,64 (1H, с), 2,97 (2H,ддд), 2,68 (2H,дт), 2,48-2,22 (10H,м), 1,83-1,74 (2H,м), 1,12-0,99 (6H,м)
<Получение соединения, представленного формулой 1-172>
1H ЯМР (CDCl3) δ м.д.: 6,95 (2H,с), 5,79 (1H,с), 4,07 (2H,т), 2,68 (2H,д), 2,37-2,16 (16H,м), 1,95 (2H,д), 1,09-0,98 (6H,м)
<Получение соединения, представленного формулой 1-173>
1H ЯМР (CDCl3) δ м.д.: 7,67 (2H,д), 7,32 (2H,д), 6,97 (2H,с), 6,30 (1H,с), 4,19-4,14 (2H,м), 2,79-2,66 (2H,м), 2,48-2,28 (13H,м), 2,08-1,98 (2H,м), 1,03 (6H,тд)
Пример получения 1-50: Получение соединения, представленного формулой (1-134)
<Получение соединения, представленного формулой 35-1>
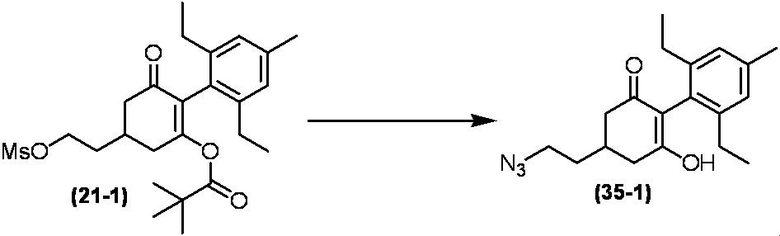
При комнатной температуре, 360 мг соединения, представленного формулой (21-1), растворяли в 4 мл N,N-диметилформамида и к смеси добавляли 500 мг азида натрия и 0,015 мл 15-краун 5 эфира. Полученную смешанную жидкость нагревали до 100°C, с последующим перемешиванием в течение около 4 часов. Затем полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 34:66), с получением, таким образом, 180 мг соединения, представленного формулой (35-1).
1H ЯМР (CDCl3) δ м.д.: 6,98(2H,с), 5,79(1H,с), 3,44-3,40(2H,м), 2,71-2,64(2H,м), 2,44-2,24(10H,м), 1,77(2H,кв), 1,07(6H,тд)
<Получение соединения, представленного формулой 1-134>
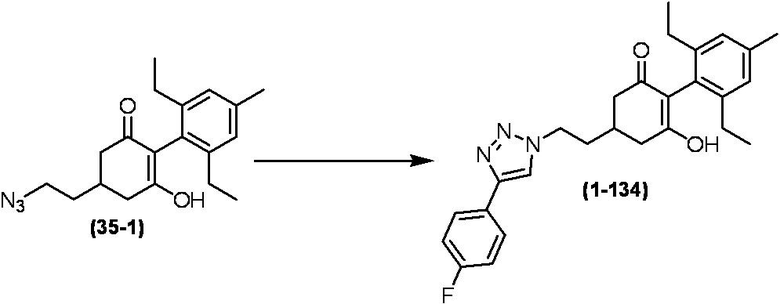
При комнатной температуре, 100 мг соединения, представленного формулой (35-1), и 40 мг 1-этинил-4-фторбензола растворяли в смеси 4 мл ацетонитрила и 1 мл диметилсульфоксида и к полученной смешанной жидкости добавляли 7 мг аскорбата натрия и 3 мг сульфата меди, с последующим нагреванием при температуре кипения с обратным холодильником в течение около 5 часов. Затем полученную реакционную смешанную жидкость концентрировали при пониженном давлении и полученный продукт подвергали колоночной хроматографии на силикагеле (элюент этилацетат:гексан = 66:34), с получением, таким образом, 54,1 мг соединения, представленного формулой (1-134).
1H ЯМР (CDCl3) δ м.д.: 7,83-7,78(2H,м), 7,75(1H,с), 7,13(2H,т), 6,98(2H, с), 5,77(1H,с), 4,57-4,46(2H,м), 2,80-2,67(2H,м), 2,52-2,12(12H,м), 1,04(6H,кв)
Соединение, полученное в соответствии с Примером получения 1-50, показано ниже.
Получение соединения, представленного формулой 1-135
1H ЯМР (CDCl3) δ м.д.: 7,95(2H,д), 7,88(1H,с), 7,69(2H,д), 6,97(2H, с), 5,79(1H,с), 4,60-4,48(2H,м), 2,80-2,68(2H,м), 2,53-2,12(12H,м), 1,04(6H,кв)
Далее представлены примеры формулирования. Соединения представлены с указанием номера структурной формулы.
Пример формулирования 1
Соединение (1-1), 30% масс.
Беноксакор 1% масс.
Полиоксиэтиленсорбитанмоноолеат 3% масс.
Карбоксиметилцеллюлоза 3% масс.
Вода 63% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 2
Соединение (1-1), 20% масс.
Клоквинтосет-мексил 5% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 60% масс.
Указанные выше вещества смешивают и измельчают с получением, таким образом, смачиваемого порошка. Полученный состав разбавляют водой соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 3
Соединение (1-1), 20% масс.
Циометронил 4% масс.
Полиоксиэтиленсорбитанмоноолеат 3% масс.
Карбоксиметилцеллюлоза 3% масс.
Вода 70% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 4
Соединение (1-1), 12% масс.
Дихлормид 2% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 71% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 5
Соединение (1-1), 20% масс.
Фенхлоразол-этил 5% масс.
Полиоксиэтиленсорбитанмоноолеат 3% масс.
Карбоксиметилцеллюлоза 3% масс.
Вода 69% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 6
Соединение (1-1), 12% масс.
Фенхлорим 4% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 69% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 7
Соединение (1-1), 15% масс.
Флуразол 5% масс.
Полиоксиэтиленсорбитанмоноолеат 3% масс.
Карбоксиметилцеллюлоза 3% масс.
Вода 74% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 8
Соединение (1-1), 30% масс.
Фурилазол 1% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 54% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 9
Соединение (1-1), 16% масс.
Мефенпир-диэтил 4% масс.
Полиоксиэтиленсорбитанмоноолеат 3% масс.
Карбоксиметилцеллюлоза 3% масс.
Вода 74% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 10
Соединение (1-1), 10% масс.
Оксабетринил 5% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 70% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют водой соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 11
Соединение (1-1), 10% масс.
Изоксадифен 1% масс.
Полиоксиэтиленсорбитанмоноолеат 5% масс.
Карбоксиметилцеллюлоза 5% масс.
Вода 79% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 12
Соединение (1-1), 10% масс.
Ципросульфамид 10% масс.
Натрий лигнинсульфонат 5% масс.
Алкиловый эфир полиоксиэтилена 5% масс.
Белая сажа 5% масс.
Глина 65% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют водой соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 13
Соединение (1-1), 10% масс.
Флуксофеним 3% масс.
Полиоксиэтиленсорбитанмоноолеат 4% масс.
Карбоксиметилцеллюлоза 6% масс.
Вода 77% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 14
Соединение (1-1), 14% масс.
1,8-Нафталевый ангидрид 6% масс.
Натрий лигнинсульфонат 6% масс.
Алкиловый эфир полиоксиэтилена 3% масс.
Белая сажа 6% масс.
Глина 65% масс.
Указанные выше вещества смешивают и измельчают, с получением, таким образом, состава. Полученный состав разбавляют водой соответствующим образом и используют.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Пример формулирования 15
Соединение (1-1), 20% масс.
AD-67 2% масс.
Полиоксиэтиленсорбитанмоноолеат 4% масс.
Карбоксиметилцеллюлоза 6% масс.
Вода 68% масс.
Указанные выше вещества смешивают и полученный продукт подвергают мокрому измельчению, пока размер частиц не становится равным или меньше чем 5 микрон, с получением, таким образом, состава.
Каждый состав получают таким же способом, за исключением того, что используют любое из соединений (1-2) - (1-156) или соединений (1-158) - (1-200) вместо соединения (1-1).
Далее представлены примеры испытаний.
Пример испытания 1 Испытание обработки сорняков путем нанесения на листву
Коммерчески доступную почву упаковывали в пластиковую чашу и засевали семенами петушьего проса (Echinochloa crus-galli) или овсюга (Avena fatua). Семена покрывали слоем почвы около 0,5 см и культивировали в теплице. Когда растение вырастало до стадии 1-2 листа, распыляемую жидкость гербицидной композиции в соответствии с настоящим изобретением равномерно распыляли на растение с использованием предварительно определенной дозы. Распыляемую жидкость получали путем растворения предварительно определенного количества каждого соединения в растворе (2%) Tween 20 (сложный эфир полиоксиэтилена с жирной кислотой сорбитана, изготовитель MP Biomedicals Inc.) в диметилформамиде и разбавления водой. После обработки препаратом растение помещали на 3 недели в теплицу. Гербицидный эффект оценивали в 101 стадию от 0 (отсутствие эффекта) до 100 (полная гибель).
Результаты представлены в Таблицах 2-78.
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
+Мефенпир-диэтил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
+Мефенпир-диэтил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Фенхлоразол-этил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Фенхлоразол-этил
(гал/га)
+Фенхлоразол-этил
+Фенхлоразол-этил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Фенхлоразол-этил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Клоквинтосет-мексил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Мефенпир-диэтил
+Мефенпир-диэтил
(гал/га)
+Мефенпир-диэтил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Клоквинтосет-мексил
(гал/га)
+Фенхлоразол-этил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
(гал/га)
+Клоквинтосет-мексил
+Фенхлоразол-этил
(гал/га)
+Клоквинтосет-мексил
+Мефенпир-диэтил
Промышленная применимость
В соответствии с настоящим изобретением, можно обеспечить гербицидную композицию, обладающую отличным эффектом в борьбе с сорняками.
Гербицидная композиция в соответствии с настоящим изобретением является полезной для борьбы с сорняками.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ДИГИДРОБЕНЗОФУРАНА, ГЕРБИЦИДНАЯ КОМПОЗИЦИЯ И СПОСОБ УНИЧТОЖЕНИЯ СОРНЯКОВ | 1994 |
|
RU2125993C1 |
| ПИРИДАЗИНОНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДА | 2007 |
|
RU2440990C2 |
| ПРОИЗВОДНОЕ ИНДОЛА, СОДЕРЖАЩЕЕ ПИПЕРИДИНОВЫЙ ЦИКЛ | 2005 |
|
RU2332413C1 |
| НИТРИЛЬНОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ | 2004 |
|
RU2351585C2 |
| СОЕДИНЕНИЕ ПИРИДАЗИНОНА ИЛИ ЕГО СОЛЬ И ГЕРБИЦИД, СОДЕРЖАЩИЙ УКАЗАННОЕ СОЕДИНЕНИЕ | 2017 |
|
RU2750986C2 |
| СОЕДИНЕНИЕ ПИРИДАЗИНА И ЕГО ПРИМЕНЕНИЕ | 2006 |
|
RU2416609C2 |
| ЦИННАМИДНОЕ СОЕДИНЕНИЕ | 2005 |
|
RU2361872C2 |
| НОВОЕ ПРОИЗВОДНОЕ ПИРИДИНА И ПРОИЗВОДНОЕ ПИРИМИДИНА (3) | 2006 |
|
RU2362771C1 |
| СОЕДИНЕНИЕ МАЛОНОНИТРИЛА В КАЧЕСТВЕ ПЕСТИЦИДА ДЛЯ БОРЬБЫ С ВРЕДИТЕЛЯМИ СЕЛЬСКОГО ХОЗЯЙСТВА | 2005 |
|
RU2347779C2 |
| ИНГИБИТОР СВЯЗЫВАНИЯ S1P | 2008 |
|
RU2468009C2 |
Изобретение относится к сельскому хозяйству. Гербицидная композиция содержит циклогексаноновое соединение, представленное формулой (I), и по меньшей мере одно соединение, выбранное из Группы A.
Формула (I)
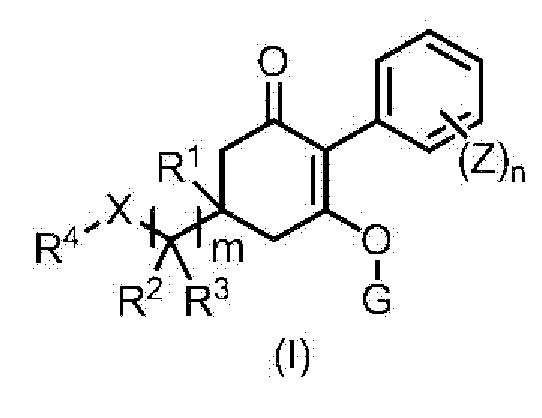
Группа A состоит из беноксакора, клоквинтосет-мексила, циометринила, дихлормида, фенхлоразол-этила, фенхлорима, флуразола, фурилазола, мефенпир-диэтила, оксабетринила, изоксадифен-этила, ципросульфамида, флуксофенима, 1,8-нафталевого ангидрида и AD-67. Изобретение позволяет повысить эффективность борьбы с сорняками. 4 н. и 3 з.п.ф-лы, 78 табл.
1. Гербицидная композиция, содержащая:
циклогексаноновое соединение, представленное формулой (I); и
по меньшей мере одно соединение, выбранное из Группы A,
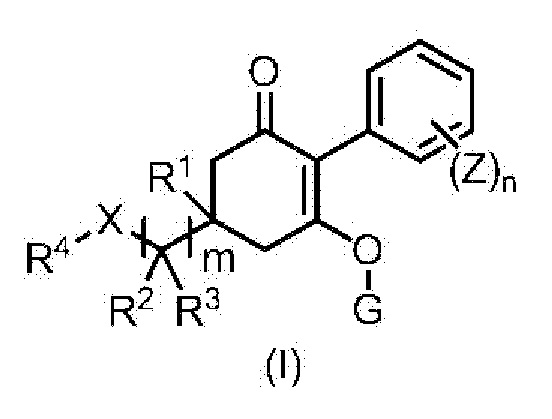
в формуле m имеет значение 1, 2 или 3,
n представляет собой целое число, имеющее значение от 1 до 5,
X представляет собой CH2, O, NR9, S, S(O) или S(O)2,
R1 представляет собой водород или метильную группу,
R2 и R3 каждый независимо представляет собой водород, C1-6 алкильную группу, C1-6 галогеналкильную группу, C3-8 циклоалкильную группу, C3-8 галогенциклоалкильную группу, (C1-6 алкил)C3-8 циклоалкильную группу, (C3-8 циклоалкил)C1-6 алкильную группу, (C3-8 циклоалкил)C3-8 циклоалкильную группу, (C3-8 галогенциклоалкил)C1-6 алкильную группу, {(C1-6 алкил)C3-8 циклоалкил}C1-6 алкильную группу, или
R2 и R3 связаны с образованием C2-5 алкиленовой цепи или R2 и R3 вместе представляют собой C1-3 алкилиденовую группу, необязательно содержащую галоген, и, когда m имеет значение 2 или 3, две или три группы R2 являются одинаковыми или отличными друг от друга и две или три группы R3 являются одинаковыми или отличными друг от друга,
R4 представляет собой C6-10 арильную группу или 5- или 6-членную гетероарильную группу,
при этом C6-10 арильная группа и 5- или 6-членная гетероарильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, цианогруппу, нитрогруппу, аминогруппу, (C1-6 алкил)аминогруппу, (C1-6 алкил)(C1-6 алкил)аминогруппу, бензоиламиногруппу, аминокарбонильную группу, (C1-6 алкил)аминокарбонильную группу, (C1-6 алкил)(C1-6 алкил)аминокарбонильную группу, пентафтортиогруппу, C1-6 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу, C6-10 арильную группу, C6-10 арилоксигруппу, C1-6 алкилсульфинильную группу, C1-6 алкилсульфонильную группу, гидроксильную группу, (C1-6 алкил)карбонильную группу, гидроксикарбонильную группу, (C1-6 алкокси)карбонильную группу и (C6-10 арил)C1-6 алкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где (C1-6 алкил)аминогруппа, (C1-6 алкил)(C1-6 алкил)аминогруппа, бензоиламиногруппа, (C1-6 алкил)аминокарбонильная группа, (C1-6 алкил)(C1-6 алкил) аминокарбонильная группа, C1-6 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-6 алкоксигруппа, C1-6 алкилтиогруппа, C3-6 алкенилоксигруппа, C3-6 алкинилоксигруппа, C6-10 арильная группа, C6-10 арилоксигруппа, C1-6 алкилсульфинильная группа, C1-6 алкилсульфонильная группа, (C1-6 алкокси)карбонильная группа и (C6-10 арил)C1-6 алкоксигруппа необязательно содержат один или несколько галогенов или C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы являются одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:
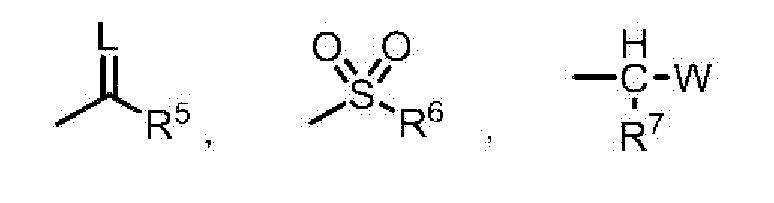
в формулах L представляет собой кислород или серу,
R5 представляет собой C1-6 алкильную группу, C3-8 циклоалкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C6-10 арильную группу, (C6-10 арил)C1-6 алкильную группу, C1-6 алкоксигруппу, C3-8 циклоалкоксигруппу, C3-6 алкенилоксигруппу, C3-6 алкинилоксигруппу, C6-10 арилоксигруппу, (C6-10 арил)C1-6 алкоксигруппу, (C1-6 алкил)(C1-6 алкил)аминогруппу, (C3-6 алкенил)(C3-6 алкенил)аминогруппу, (C1-6 алкил)(C6-10 арил)аминогруппу или 5- или 6-членную гетероарильную группу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где все из указанных C3-8 циклоалкильной группы, C6-10 арильной группы, арильной части (C6-10 арил)C1-6 алкильной группы, C3-8 циклоалкоксигруппы, C6-10 арилоксигруппы, арильной части (C6-10 арил)C1-6 алкоксигруппы, арильной части (C1-6 алкил)(C6-10 арил)аминогруппы и 5- или 6-членной гетероарильной группы необязательно содержат одну или несколько C1-6 алкильных групп, и, когда присутствуют две или более C1-6 алкильные группы, эти алкильные группы являются одинаковыми или отличными друг от друга,
R6 представляет собой C1-6 алкильную группу, C6-10 арильную группу или (C1-6 алкил)(C1-6 алкил)аминогруппу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где C6-10 арильная группа необязательно содержит одну или несколько C1-6 алкильных групп, и, когда присутствуют две или более C1-6 алкильные группы, эти C1-6 алкильные группы являются одинаковыми или отличными друг от друга,
R7 представляет собой водород или C1-6 алкильную группу, и
W представляет собой C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C1-6 алкилсульфинильную группу или C1-6 алкилсульфонильную группу,
где все из этих групп необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга,
R9 представляет собой водород, C1-6 алкильную группу, C6-10 арильную группу, C6-10 арилтиогруппу, C6-10 арилсульфинильную группу или C6-10 арилсульфонильную группу,
где C1-6 алкильная группа необязательно содержит один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где C6-10 арильная группа, C6-10 арилтиогруппа, C6-10 арилсульфинильная группа и C6-10 арилсульфонильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, цианогруппу, нитрогруппу и аминогруппу, и
Z представляет собой галоген, цианогруппу, нитрогруппу, C1-6 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-6 алкоксигруппу, (C1-6 алкил)карбонильную группу, C1-6 алкилтиогруппу, C6-10 арилоксигруппу, 5- или 6-членную гетероарилоксигруппу, C3-8 циклоалкильную группу, C6-10 арильную группу или 5- или 6-членную гетероарильную группу,
где C1-6 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-6 алкоксигруппа, (C1-6 алкил)карбонильная группа и C1-6 алкилтиогруппа необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и
где C6-10 арильная группа, 5- или 6-членная гетероарильная группа, C6-10 арилоксигруппа и 5- или 6-членная гетероарилоксигруппа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, C1-6 алкильную группу и C1-6 галогеналкильную группу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где C3-8 циклоалкильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей галоген и C1-6 алкильную группу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и, когда n представляет собой целое число, равное или больше 2, Z являются одинаковыми или отличными друг от друга,
Группа A состоит из беноксакора, клоквинтосет-мексила, циометринила, дихлормида, фенхлоразол-этила, фенхлорима, флуразола, фурилазола, мефенпир-диэтила, оксабетринила, изоксадифен-этила, ципросульфамида, флуксофенима, 1,8-нафталевого ангидрида и AD-67.
2. Гербицидная композиция по п. 1,
где n представляет собой целое число, имеющее значение от 1 до 3,
R1 представляет собой водород,
R2 и R3 каждый независимо представляют собой водород, C1-3 алкильную группу или R2 и R3 связаны с образованием C2-5 алкиленовой цепи, и, когда m имеет значение 2 или 3, две или три группы R2 являются одинаковыми или отличными друг от друга и две или три группы R3 являются одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей галоген, C1-3 алкильную группу, гидроксильную группу, (C1-3 алкил)карбонильную группу, (C1-3 алкокси)карбонильную группу, C1-3 алкоксигруппу, C1-3 галогеналкильную группу, C1-3 алкилтиогруппу, C1-3 галогеналкилтиогруппу, цианогруппу, нитрогруппу, аминогруппу, пентафтортиогруппу, бензоиламиногруппу и C1-3 галогеналкоксигруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей C1-3 алкильную группу и C6-10 арильную группу, при этом C1-3 алкильная группа и C6-10 арильная группа необязательно содержат один или несколько галогенов или одну или несколько C1-3 галогеналкильных групп, и, когда присутствуют два или более галогенов или две или более C1-3 галогеналкильных групп, эти галогены или C1-3 галогеналкильные группы являются одинаковыми или отличными друг от друга,
G представляет собой водород или любую группу из следующих формул:
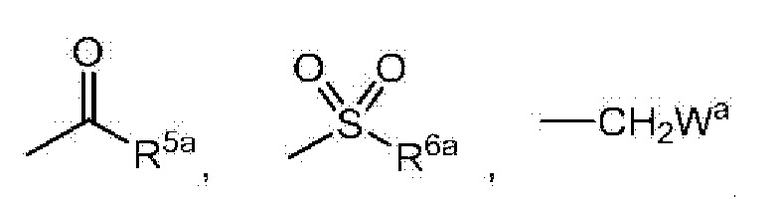
в формулах R5a представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C3-6 алкенилоксигруппу или C6-10 арилоксигруппу,
R6a представляет собой C1-6 алкильную группу, и
Wa представляет собой C1-3 алкоксигруппу,
R9 представляет собой водород, C1-6 алкильную группу или C6-10 арилсульфонильную группу, где C1-6 алкильная группа необязательно содержит один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга, и C6-10 арилсульфонильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей галоген и нитрогруппу, и, когда присутствуют два или более заместителей, эти заместители являются одинаковыми или отличными друг от друга, и
Z представляет собой галоген, C1-3 алкильную группу, C2-6 алкенильную группу, C2-6 алкинильную группу, C1-3 алкоксигруппу, C3-8 циклоалкильную группу, нитрогруппу, фенильную группу или 5- или 6-членную гетероарилоксигруппу,
где C1-3 алкильная группа, C2-6 алкенильная группа, C2-6 алкинильная группа, C1-3 алкоксигруппа, фенильная группа и 5- или 6-членная гетероарилоксигруппа необязательно содержат один или несколько галогенов, и, когда присутствуют два или более галогенов, эти галогены являются одинаковыми или отличными друг от друга.
3. Гербицидная композиция по п. 2,
где R2 и R3 каждый независимо представляют собой водород, метильную группу, этильную группу или R2 и R3 связаны с образованием этиленовой цепи, и две группы R2 могут быть одинаковыми или отличными друг от друга, и две группы R3 могут быть одинаковыми или отличными друг от друга,
R4 представляет собой фенильную группу, 2-пиридильную группу, 3-пиридильную группу, 4-пиридильную группу, 2-пиримидинильную группу, 2-пиразинильную группу, 3-пиридазинильную группу, 3-фурильную группу, 2-тиенильную группу, 2-тиазолильную группу, 1,2,3-триазолильную группу или 1-пиразолильную группу,
где фенильная группа, 2-пиридильная группа, 3-пиридильная группа, 4-пиридильная группа, 2-пиримидинильная группа, 2-пиразинильная группа, 3-пиридазинильная группа, 3-фурильная группа, 2-тиенильная группа и 2-тиазолильная группа содержат один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор, метильную группу, этильную группу, изопропильную группу, трет-бутильную группу, метоксигруппу, нитрогруппу, аминогруппу, цианогруппу, гидроксильную группу, ацетильную группу, метоксикарбонильную группу, пентафтортиогруппу, пентафторэтильную группу, дифторэтильную группу, гептафторизопропильную группу, трифторметилтиогруппу, бензоиламиногруппу, трифторметоксигруппу и трифторметильную группу, и
где 1,2,3-триазолильная группа и 1-пиразолильная группа необязательно содержат один или несколько заместителей, выбранных из группы, включающей метильную группу и фенильную группу, и
где фенильная группа необязательно содержит один или несколько заместителей, выбранных из группы, включающей хлор, бром, иод, фтор и трифторметильную группу,
G представляет собой водород, ацетильную группу, пропионильную группу, бутилкарбонильную группу, бензоильную группу, метилсульфонильную группу, метоксикарбонильную группу, этоксикарбонильную группу, аллилоксикарбонильную группу, феноксикарбонильную группу, метоксиметильную группу или этоксиметильную группу,
R9 представляет собой водород, 2-нитрофенилсульфонильную группу или метильную группу, и
Z представляет собой метильную группу, этильную группу, фенильную группу, винильную группу, циклопропильную группу, нитрогруппу, фтор, хлор, бром, метоксигруппу, трифторметильную группу, 5-трифторметил-2-хлорпиридилоксигруппу или этинильную группу.
4. Гербицидная композиция по любому из пп. 1-3,
где G представляет собой водород.
5. Гербицид, содержащий:
гербицидную композицию по любому из пп. 1-4.
6. Способ борьбы с сорняками, включающий нанесение эффективных количеств циклогексанонового соединения формулы (I) и по меньшей мере одного соединения, выбранного из следующей Группы A, на сорняки или почву, где растут сорняки,
Формула (I):
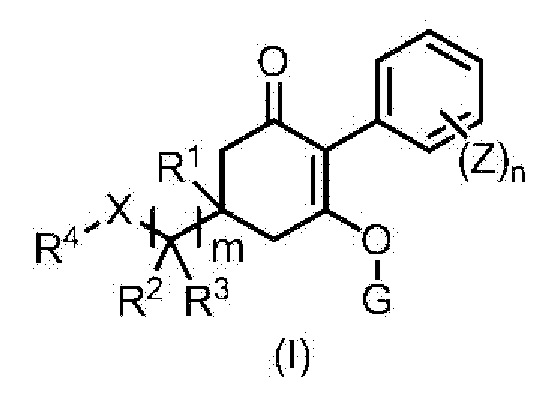
в формуле m, n, X, R1, R2, R3, R4, G и Z каждый имеет значение, определенное в п. 1, и
Группа A представляет собой такую же группу, которая определена в п. 1.
7. Применение гербицидной композиции, содержащей соединение, представленное формулой (I), и по меньшей мере одно соединение, выбранное из Группы A, для борьбы с сорняками,
Формула (I):

в формуле m, n, X, R1, R2, R3, R4, G и Z каждый имеет значение, определенное в п. 1, и
Группа A представляет собой такую же группу, которая определена в п. 1.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Приспособление для запирания паровозного реверса | 1933 |
|
SU32518A1 |
Авторы
Даты
2017-08-17—Публикация
2013-10-31—Подача