Область техники, к которой относится изобретение
Настоящее изобретение относится к новому азот-содержащему спироциклическому соединению и его фармацевтическому применению. Конкретно, настоящее изобретение относится к ингибитору Янус-киназы 3, далее в данном документе называемой JAK3, соединению для профилактики или лечения отторжения трансплантатов органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунных и аллергических заболеваний и к его применению в фармацевтике.
Настоящее изобретение также относится к ингибитору Янус-киназы 2, далее в данном документе называемой JAK2, соединению для профилактики или лечения хронического миелопролиферативного заболевания и его применению в фармацевтике.
Уровень техники
JAK3 представляет собой член семейства Янус-киназ, которое относится к протеинкиназам. Другие члены этого семейства экспрессированы в различных тканях, тогда как JAK3 экспрессирован только в гемопоэтических клетках.
Эта ограничивающая экспрессия участвует в важной функции JAK3 путем нековалентной ассоциации JAK3 с γ-цепями, общими для по-разному связывающихся рецепторов, включающих IL-2, IL-4, IL-7, IL-9, IL-15 и IL-21, в опосредованной рецепторами сигнальной трансдукции.
Значительно уменьшенные уровни белков JAC3 или дефекты генов в общих γ-цепях обнаружены в группе больных с тяжелым комбинированным иммунодефицитом, называемым далее в данном документе ТКИД (SCID). Это показывает, что иммуносупрессия продуцируется блокированием JAK3 опосредованного сигнального пути.
Из экспериментов на животных известно, что JAK3 играет важную роль в созревании NK клеток, В-лимфоцитов и Т-лимфоцитов, и она требуется главным образом для сохранения функций Т-клеток.
Известно, что ингибитор JAK3 СР-690,550 ((3R,4R)-3-[4-метил-3-[N-метил-N-(7Н-пирроло[2,3-d]пиримидин-4-ил)амино]пиперидин-1-ил]-3-оксопропионитрил) улучшает состояние больных ревматоидным артритом и псориазом и демонстрирует подавление отторжения трансплантата на модели трансплантации почки у обезьян, и подавление воспаления дыхательных путей на модели астмы мышей.
На основании вышеизложенного полагают, что регуляция иммунной активности ингибиторами JAK3 применима для профилактики или лечения отторжения трансплантатов органов, реакции "трансплантат против хозяина" после трансплантации, а также аутоиммунных и аллергических заболеваний.
С другой стороны, показано, что ингибирование JAK2 полезно для пациентов, страдающих хроническим миелопролиферативным заболеванием. Хронические миелопролиферативные заболевания включает истинную полицитемию, первичный миелофиброз, эссенциальную тромбоцитемию, хроническую миелоцитарную лейкемию, хроническую миеломоноцитарную лейкемию, хронический эозинофильный лейкоз, хроническую нейтрофильную лейкемию, системный мастоцитоз.
Полагают, что хронические миелопролиферативные заболевания, возможно, вызывается приобретенными мутациями в гемопоэтических стволовых клетках, и известно кроме того, что подавляющее большинство больных с истинной полицитемией, а также значительное число больных с первичным миелофиброзом и эссенциальной тромбоцитемией имеют мутации JAK2, при которых белковый продукт экспрессии мутантного гена приобретает новые и патологические функции. Известно также, что ингибирование JAK2V617F-киназы низкомолекулярными ингибиторами вызывает ингибирование пролиферации гемопоэтических клеток.
На основании вышеизложенного полагают, что регуляция пролиферации гемопоэтических клеток ингибиторами JAK2 полезна для профилактики или лечения хронических миелопролиферативных заболеваний.
Известны четыре типа членов семейства Янус-киназ, далее в данном документе именуемых JAK, включающих Янус-киназу 1, далее в данном документе именуемую JAK1, JAK2, JAK3 и тирозинкиназу 2, далее в данном документе именуемую Tyk2, считается, что ингибиторы JAK1 и ингибиторы Tyk2 тоже применимы для профилактики или лечения множества заболеваний, аналогично ингибитору JAK3.
Раскрытие изобретения
Задачи, решаемые настоящим изобретением
На основании обширных исследований, направленных на разработку нового тератевтического или профилактического средства для лечения и профилактики отторжения трансплантатов органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунных и аллергических заболеваний, которое являлось бы альтернативой обычно применяемым средствам, авторы настоящего изобретения получили азотсодержащие спиро-циклические соединения, обладающие ингибирующим эффектом в отношении JAK3, и таким образом создали настоящее изобретение.
Авторы настоящего изобретения получили также азотсодержащие спиро-циклические соединения, обладающие ингибирующим эффектом в отношении JAK2, и таким образом созданили настоящее изобретение.
Средства решения задач.
Конкретно, настоящее изобретение состоит в следующем.
[1] Соединение следующей общей формулы [I]:
[Химическая формула 1]
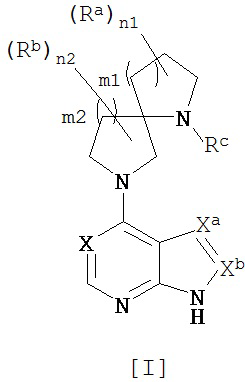 ,
,
где R3 одинаковые или разные и каждый представляет собой:
(1) C1-6алкил или
(2) атом галогена,
n1 представляет собой целое число, выбранное из чисел от 0 до 4,
Rb одинаковые или разные и каждый представляет собой:
(1) C1-6алкил или
(2) атом галогена,
n2 представляет собой целое число, выбранное из чисел от 0 до 4,
m1 представляет собой целое число, выбранное из чисел от 0 до 3,
m2 представляет собой целое число, выбранное из чисел от 1 до 4, Xa=Xb и представляет собой:
(1) СН=СН,
(2) N=CH или
(3) CH=N,
X представляет собой:
(1) атом азота или
(2) C-Rd, где Rd представляет собой атом водорода или атом галогена, Rc представляет собой группу, выбранную из следующих групп (1)-(6):
(1) атом водорода,
(2) C1-6алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей группы А,
(3) -C(=O))-Rc1,
(4) -C(=O)-O-Rc2,
(5) -C(=O)-NRc3Rc4
где Rc1, Rc2, Rc3, RC4 являются одинаковыми или разными и каждый представляет собой:
(i) атом водорода или
(ii) C1-6алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей ниже группы А, или
(6) группа формулы:
[Химическая формула 2]
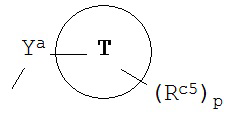 ,
,
в которой Ya представляет собой группу, выбранную из следующих групп (i)-(iii):
(i) C1-6алкилен,
(ii) -С(=O)- или
(iii) -C(=O)-O-,
Кольцо Т представляет собой:
(i) C6-10арил,
(ii) C3-10циклоалкил или
(iii) насыщенный моногетероциклил, который содержит 1-4 гетероатома, выбранных из атома азота, атома кислорода или атома серы, а также атомы углерода, и число атомов, составляющих кольцо, составляет 3-7,
Rc5 являются одинаковыми или разными и каждый представляет собой:
(i) циано или
(ii) нитрогруппу
p представляет собой целое число, выбранное из чисел от 0 до 4,
группа А представляет собой группу, состоящую из:
(a) гидроксила,
(b) C1-6алкокси,
(c) циано,
(d) C1-6алкоксикарбонила,
(e) C1-6алкилкарбонилокси и
(f) C2-6алкенилокси;
или его фармацевтически приемлемая соль или его сольват.[2] Соединение по пункту [1], в котором в общей формуле [I] n1 представляет собой целое число выбранное из чисел от 0 до 2,
n2 представляет собой целое число, выбранное из чисел от 0 до 2,
m1 представляет собой целое число, выбранное из чисел от 0 до 3,
m2 представляет собой целое число выбранное из чисел от 1 до 3,
Х представляет собой:
(1) атом азота или
(2) C-Rd, где Rd представляет собой атом галогена,
Rc представляет собой группу, выбранную из следующих групп (1)-(6):
(1) атом водорода,
(2) C1-6алкил, замещенный одним заместителем, выбранным из следующей ниже группы А,
(3) -C(=O)-Rc1,
(4) -C(=O)-O-Rc2,
(5) -C(=O)-NRc3Rc4
где Rc1 представляет собой C1-6алкил, необязательно замещенный одним заместителем, выбранным из следующей ниже группы А,
Rc2 представляет собой C1-6алкил,
Rc3 представляет собой C1-6алкил, необязательно замещенный одним заместителем, выбранным из следующей группы А,
Rc4 представляет собой
(i) атом водорода или
(ii) C1-6алкил или
(6) группа формулы:
[Химическая формула 3]
 ,
,
в которой Ya представляет собой группу, выбранную из следующих групп (i)-(iii):
(i) C1-6алкилен,
(ii) -С(=O)- или
(iii) -C(=O)-O-,
Кольцо Т представляет собой:
(i) фенил,
(ii) C3-6циклоалкил или
(iii) пирролидинил,
Rc5 представляет собой
(i) циано или
(ii) нитрогруппу,
p представляет собой целое число, выбранное из 0 или 1,
Группа А представляет собой группу, состоящую из:
(a) гидроксила,
(b) C1-6алкокси,
(c) циано,
(d) C1-6алкоксикарбонила,
(e) C1-6алкилкарбонилокси и
(f) C2-6алкенилокси; или его фармацевтически приемлемая соль или его сольват.
[3] Соединение по любому из пунктов [1] или [2], в котором m1 представляет собой целое число 0 или 1, и m2 представляет собой целое число 1 или 2; или его фармацевтически приемлемая соль или сольват.
[4] Соединение по пункту [3], в котором комбинация (m1, m2) обозначает числа (1, 2), и которое представляет собой соединение общей формулы [11]:
[Химическая формула 4]
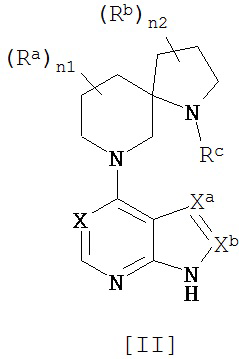 ,
,
в котором каждый символ имеет то же значение, которое определено в [1]; или его фармацевтически приемлемая соль или сольват.
[5] Соединение по пункту [3], в котором комбинация (m1, m2) обозначает числа (0, 2), и которое представляет собой соединение общей формулы [III]:
[Химическая формула 5]
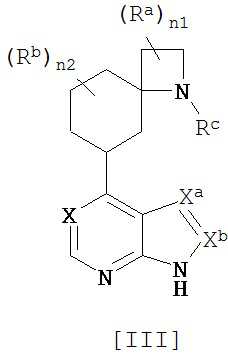 ,
,
в котором каждый символ имеет то же значение, которое определено в пункте 1;
или его фармацевтически приемлемая соль или сольват.
[6] Соединение по пункту [3], в котором комбинация (m1, m2) обозначает числа (0, 1), и которое представляет собой соединение общей формулы [IV]:
[Химическая формула 6]
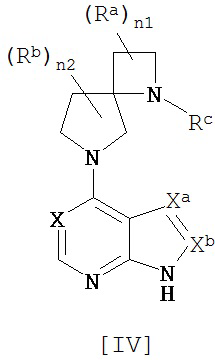 ,
,
в котором каждый символ имеет то же значение, которое определено в пункте [1];
или его фармацевтически приемлемая соль или сольват.
[7] Соединение по любому из пунктов [1] или [2], в котором комбинация (m1, m2) выбрана из чисел (0, 3), (2, 1), (2, 2) или (3,2), или его фармацевтически приемлемая соль или сольват.
[8] Соединение по любому из пунктов [1]-[7], в котором Xa=Xb представляет собой СН=СН, и Х представляет собой атом азота, или его фармацевтически приемлемая соль или сольват.
[9] Соединение по любому из пунктов [1] или [2], в котором комбинация (n1, n2) обозначает числа (0, 0); или его фармацевтически приемлемая соль или сольват.
[10] Соединение по любому из пунктов [1] или [2], в котором комбинация (n1, n2) обозначает числа (1, 0); или его фармацевтически приемлемая соль или сольват.
[11] Соединение по любому из пунктов [1] или [2], в котором комбинация (n1, n2) обозначает числа (0, 1); или его фармацевтически приемлемая соль или сольват.
[12] Соединение по любому из пунктов [1] или [2], в котором комбинация (n1, n2) обозначает числа (2, 0); или его фармацевтически приемлемая соль или сольват.
[13] Соединение по любому из пунктов [1] или [2], в котором комбинация (n1, n2) обозначает числа (0, 2); или его фармацевтически приемлемая соль или сольват.
[14] Соединение по любому из пунктов [10] или [12], в котором Ra представляет собой метил или атом фтора, или его фармацевтически приемлемая соль или сольват.
[15] Соединение по любому из пунктов [1]-[14],в котором Rc представляет собой -C(=O)-Rc1, или его фармацевтически приемлемая соль или сольват.
[16] Соединение по пункту [15], в котором Rc1 представляет собой C1-6алкил, замещенный одной гидроксильной или цианогруппой, или его фармацевтически приемлемая соль или сольват.
[17] Соединение по любому из пунктов [1]-[14], где Rc представляет собой -C(=O)-NRc3Rc4, или его фармацевтически приемлемая соль или сольват.
[18] Соединение по пункту [17], в котором Rc3 представляет собой C1-6алкил, замещенный одной цианогруппой и Rc4 представляет собой водород, или его фармацевтически приемлемая соль или сольват.
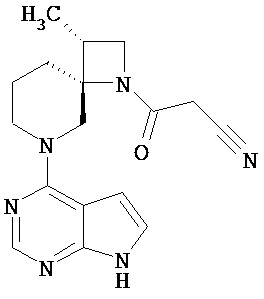
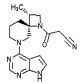
[19] Соединение по пункту [1], выбранное из следующих ниже химических структурных формул:
[Химическая формула 7]
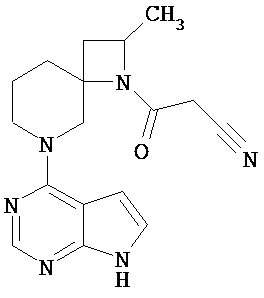
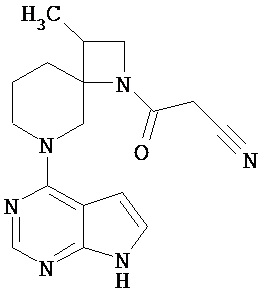
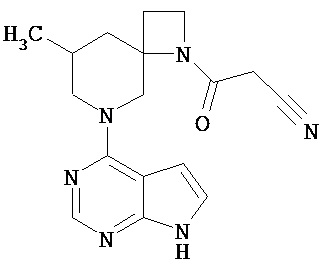
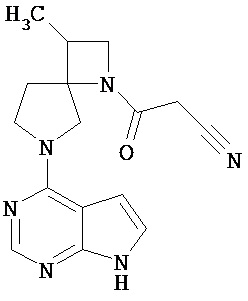

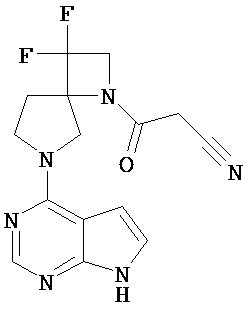
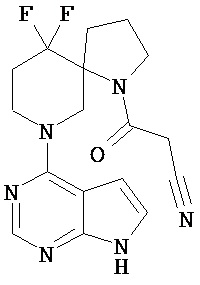
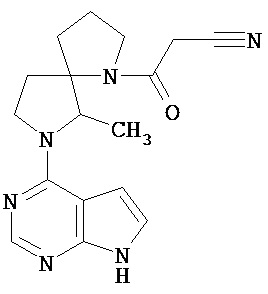
[Химическая формула 8]
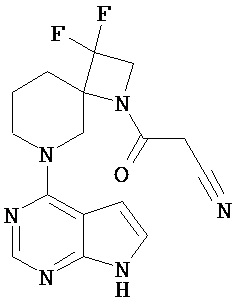
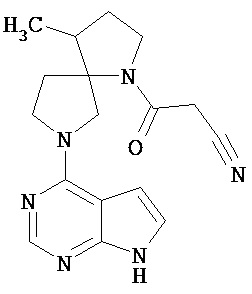
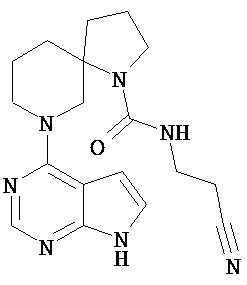
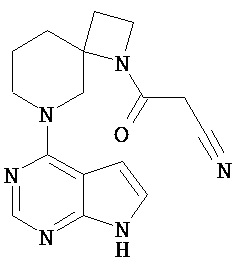
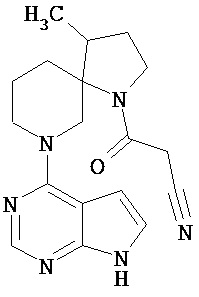
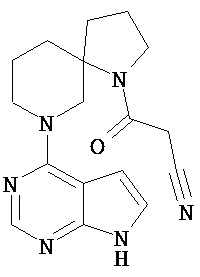 или
или 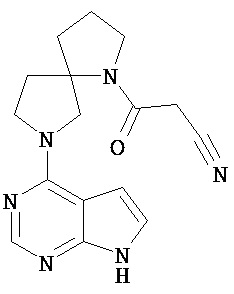
или его фармацевтически приемлемая соль или сольват.
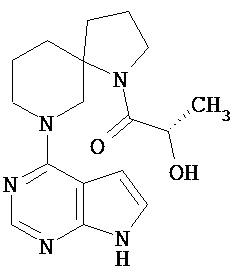
[20] Соединение по пункту [1], выбранное из следующих ниже химических структурных формул
[Химическая формула 9]
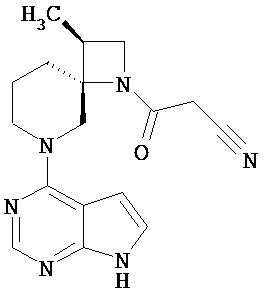
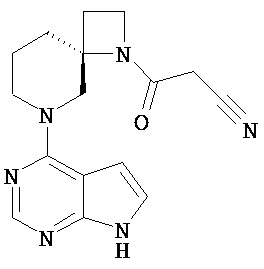
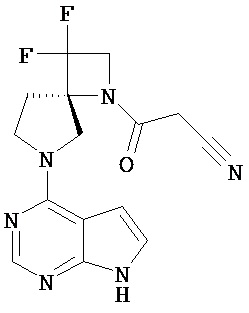
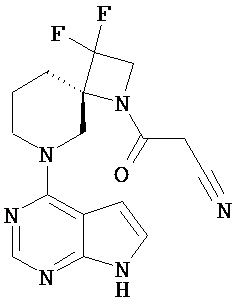
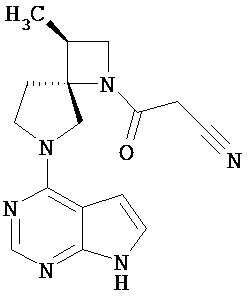
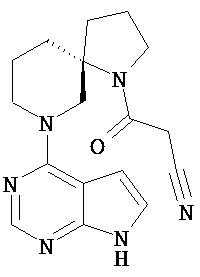
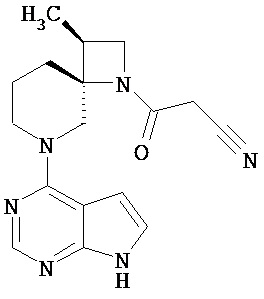
[Химическая формула 10]
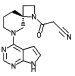
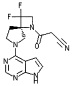
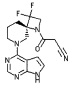
 или
или 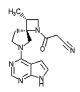
или его фармацевтически приемлемая соль или сольват.
[21] Фармацевтическая композиция, содержащая соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль, или сольват, и фармацевтически приемлемый носитель.
[22] Ингибитор Янус-киназы, содержащий соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль или сольват.
[23] Ингибитор Янус-киназы по пункту [22], в котором Янус-киназа представляет собой Янус-киназу 3.
[24] Ингибитор Янус-киназы по пункту [22], где Янус-киназа представляет собой Янус-киназу 2.
[25] Терапевтическое или профилактическое средство для лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунного заболевания, аллергического заболевания и хронического миелопролиферативного заболевания, содержащее соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль или сольват.
[26] Терапевтическое или профилактическое средство для лечения или профилактики ревматоидного артрита, включающее соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль или сольват.
[27] Терапевтическое или профилактическое средство для лечения или профилактики псориаза, включающее соединение по любому из пунктов [1]-[20], или его фармацевтически приемлемую соль или сольват.
[28] Способ ингибирования Янус-киназы, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата.
[29] Способ по пункту [28], в котором Янус-киназа представляет собой Янус-киназу 3.
[30] Способ по пункту [28], в котором Янус-киназа представляет собой Янус-киназу 2.
[31] Способ лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунного заболевания, аллергических заболеваний и хронического миелопролиферативного заболевания, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата.
[32] Способ лечения или профилактики ревматоидного артрита, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата.
[33] Способ лечения или профилактики псориаза, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата.
[34] Применение соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата для изготовления ингибитора Янус-киназ.
[35] Применение по пункту [34], в котором Янус-киназа представляет собой Янус-киназу 3.
[36] Применение по пункту [34], в котором Янус-киназа представляет собой Янус-киназу 2.
[37] Применение соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли, или сольвата в изготовлении лекарственного средства для лечения или профилактики заболевания выбранного из группы, состоящей из отторжения трансплантата органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунного заболевания, аллергических заболеваний и хронического миелопролиферативного заболевания.
[38] Применение соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для лечения или профилактики ревматоидного артрита.
[39] Применение соединения по любому из пунктов [1]-[20] или его фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для лечения или профилактики псориаза.
[40] Выпускаемый промышленно набор, включающий (а) фармацевтическую композицию, содержащую в качестве активного ингредиента соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль, или сольват; и (b) вкладыш в упаковке фармацевтической композиции, в котором указано, что фармацевтическую композицию можно использовать или следует использовать для лечения или профилактики ревматоидного артрита или псориаза.
[41] Выпускаемая промышленно упаковка, включающая (а) фармацевтическую композицию, содержащую в качестве активного ингредиента соединение по любому из пунктов [1]-[20] или его фармацевтически приемлемую соль, или сольват; и (b) вкладыш в упаковке фармацевтической композиции, в котором указано, что фармацевтическую композицию можно использовать или следует использовать для лечения или профилактики ревматоидного артрита или псориаза.
Эффект изобретения
Патентоспособное азотсодержащее спироциклическое соединение по настоящей заявке эффективно в качестве терапевтического и профилактического средства для лечения или профилактики отторжения трансплантата органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунного заболевания и аллергического заболевания и т.п. благодаря его ингибирующему действию в отношении JAK3.
Кроме того, патентоспособное азотсодержащее спироциклическое соединение по настоящей заявке является эффективным в качестве терапевтического средства для лечения или профилактики отторжения трансплантата органов, реакции "трансплантат против хозяина" после трансплантации, аутоиммунного заболевания и аллергического заболевания и т.п., благодаря его ингибирующему действию в отношении JAK2.
Осуществление изобретения
Ниже определены термины и выражения, используемые в настоящем документе. Выражение "необязательно замещенный" включает оба случая: (1) когда в рассматриваемой группе замещены положения, которые могут быть замещенными, и (2) когда такие положения не замещены (являются незамещенными). Термин «незамещенный» относится к такому случаю, когда в рассматриваемой группе все положения, которые могут быть замещены, замещены атомами водорода.
Например, выражение "C1-6алкил необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из группы А" включает оба случая: (1) положения в C1-6алкиле, которые могут быть замещенными, замещены 1-5 одинаковыми или разными заместителями, выбранными из группы А, и (2) такие положения не замещены (являются незамещенными).
Выражение "атом галогена" включает атом фтора, атом хлора, атом брома или атом йода, предпочтительно атом фтора или атом хлора.
Выражение "C1-6алкил" относится к C1-6 линейной или разветвленной углеводородной группе, такой, например, как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил, 2-этилбутил, предпочтительно метил, этил, пропил, изопропил и т.п.
Выражение "С2-6алкенил" относится к C2-6 ненасыщенной углеводородной группе с линейной или разветвленной цепью, содержащей одну или несколько двойных связей, такой, например, как винил, 1-метилвинил, 1-пропенил, аллил, метилпропенил (включая 1-метил-1-пропенил, 2-метил-1-пропенил и т.п.), 1-бутенил, 2-бутенил, 3-бутенил, метилбутенил (включая 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил и т.п.), пентенил, метилпентенил, гексенил, предпочтительно винил, 1-метилвинил, 1-пропенил, метилпропенил и т.п.
Выражение "C2-6алкилен" относится к двухвалентной группе, производной от C1-6алкила с линейной цепью, как определено выше, такой, например, как метилен, этилен, триметилен, тетраметилен, пентаметилен, гексаметилен, предпочтительно метилен, этилен и т.п.
Выражение "C6-10арил" относится к C6-10 ароматической углеводородной группе, такой, например, как фенил, 1-нафтил, 2-нафтил, предпочтительно фенил.
Выражение "C3-10циклоалкил" относится к C3-10 моноциклической насыщенной углеводородной группе, такой, например, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, предпочтительно C3-6циклоалкил (включающий циклопропил, циклобутил, циклопентил, циклогексил и т.п.).
Выражение "насыщенный моногетероциклил" обозначает насыщенный моногетероциклил, который содержит 1-4 гетероатома, выбранных из атома азота, атома кислорода или атома серы, а также атомы углерода, и число атомов, входящих в состав кольца составляет 3-7, и включает оксиранил, тиоланил, азиридинил, азетидинил, оксетанил, пирролидинил, пирролидино (включая 1-пирролидинил), тетрагидрофуранил, тетрагидротиенил, оксазолинил, оксазолидинил, изоксазолинил, изоксазолидинил, тиазолинил, тиазолидинил, изотиазолинил, изотиазолидинил, имидазолинил, имидазолидинил, пиразолинил, пиразолидинил, пиперидинил, пиперидине (включая 1-пиперидинил), морфолинил, морфолино (включая 4-морфолинил), тиоморфолинил, тиоморфолино (включая 4-тиоморфолинил), пиперазинил, пиперазино (включая 1-пиперазинил), гексагидро-1,3-оксазинил, гомоморфолин, гомопиперазин и т.п.
Выражение "C1-6алкокси" относится к C1-6 алкоксигруппе с линейной или разветвленной цепью, в частности, к метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси, изопентилокси, 2-метилбутокси, неопентилокси, 1-этилпропокси, гексилокси и т.п.
Выражение "C1-6алкоксикарбонил" относится к группе, в которой линейная или разветвленная C1-6 алкоксигруппа связана с карбонилом, конкретно, такой как метоксикарбонил, этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, изобутоксикарбонил, втор-бутоксикарбонил, трет-бутоксикарбонил, пентилоксикарбонил, изопентилоксикарбонил, 2-метилбутоксикарбонил, неопентилоксикарбонил, 1-этилпропоксикарбонил, гексилоксикарбонил, 4-метилпентилоксикарбонил и т.п.
Выражение "C1-6алкилкарбонилокси" относится к группе, в которой "группа, где C1-6алкил связан с карбонилом" связана с оксигруппой, в частности, к ацетилокси, пропионилокси, бутирилокси, изобутирилокси и т.п.
Выражение "C2-6алкенилокси" относится к группе, в которой "С2-6алкенил" связан с оксигруппой, в частности, к аллилокси, 1-бутенилокси и т.п.
Предпочтительные варианты для каждой группы в соединении общей формулы [1], которое также именуется далее настоящим соединением, показаны ниже.
Предпочтительные варианты осуществления R3 включают:
(1) метил или
(2) атом фтора и т.п.
Предпочтительные варианты осуществления n1 включают целые числа 0, 1 или 2.
Предпочтительные варианты осуществления R5 включают:
(1) метил или
(2) атом фтора и т.п.
Предпочтительные варианты осуществления n2 включают целые числа 0, 1 или 2.
Предпочтительные варианты осуществления m1 включают целое число, выбранное из чисел 0-3.
Предпочтительные варианты осуществления m2 включают целые числа 0, 1 или 2. Комбинация (m1, m2) включает (0, 1), (0, 2), (0, 3), (1, 1), (1, 2), (2, 1), (2, 2) или (3, 2).
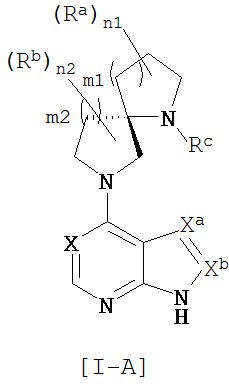
Предпочтительно, Ra и Rb на атомах углерода, входящих в состав каждого спироцикла общей формулы [1], могут быть замещены, за исключением спиро-углерода, и атомы углерода, которые не замещены заместителями Ra или Rb насыщены атомами водорода. В случае, когда n1 равно 2 или больше, Ra могут быть одинаковыми или разными, и каждый может быть замещен в одинаковых или разных положениях. Кроме того, в случае, когда n2 равно 2 или больше, R могут быть одинаковыми или разными, и каждый может быть замещен в одинаковых или разных положениях. Xa=Xb представляет собой:
(1) CH=CH,
(2) N=CH или
(3) CH=N,
предпочтительно (1) СН=СН.
Предпочтительными вариантами для Х являются:
(1) атом азота или
(2) C-Cl,
более предпочтительно (1) атом азота.
Предпочтительные варианты осуществления Rc включают атом водорода, цианоэтил, ацетил, бензил, цианометилкарбонил, пропенилоксиэтилкарбонил, 2-пропилкарбонил, этилкарбонил, метоксикарбонил, (S)-гидроксиэтилкарбонил, гидроксиметилкарбонил, 1-гидроксиэтилкарбонил, ацетоксиметилкарбонил, (S)-ацетоксиэтилкарбонил, метоксиметилкарбонил, метоксиэтилкарбонил, (S)-метоксиэтилкарбонил, (R)-метоксиэтилкарбонил, 3-цианопирролидинилкарбонил, 3-цианофенилкарбонил, 4-цианофенилкарбонил, метоксикарбонилэтилкарбонил, n-нитрофеноксикарбонил, 1-цианометилциклопропилкарбонил, трет-бутоксикарбонил, N-этилкарбамоил, N-цианометилкарбамоил, N-цианоэтилкарбамоил, N,N-метилцианометилкарбамоил, N,N-метилцианоэтилкарбамоил, N-пропилкарбамоил, предпочтительно цианометилкарбонил, гидроксиметилкарбонил или цианоэтилкарбамоил.
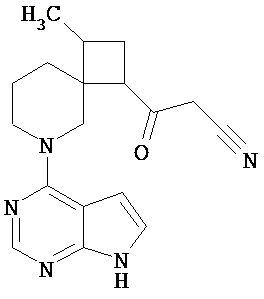
Предпочтительные варианты осуществления соединения общей формулы [1] включают соединения следующих формул:
[Химическая формула 11]



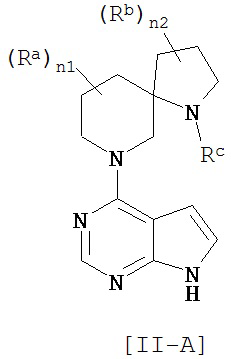
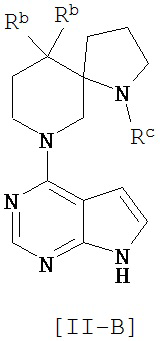
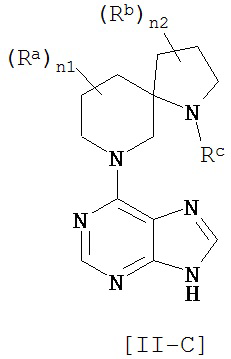
Соединение общей формулы [11] предпочтительно включает соединение общей формулы [II-A], [II-B] или [II-C].
[Химическая формула 12]
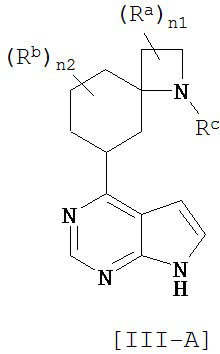
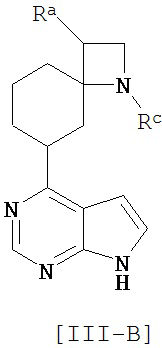
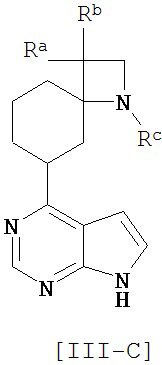
Соединение общей формулы [III] предпочтительно включает соединение общей формулы [III-A], [III-B] или [III-C].
[Химическая формула 13]
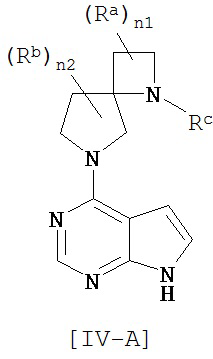
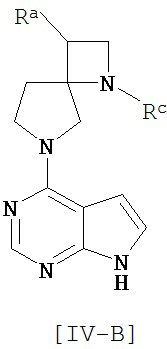
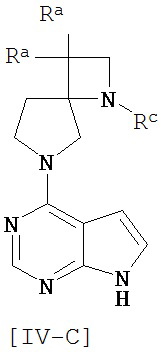
Соединение общей формулы [IV] предпочтительно включает соединение общей формулы [IV-А], [IV-B] или [IV-C]. [Химическая формула 14]
Другой предпочтительный вариант осуществления соединения общей формулы [1] включает соединения следующей формулы:
[Химическая формула 15]
Еще один предпочтительный вариант соединения общей формулы [1] обладает ингибирующим эффектом в отношении JAK.1 и/или JAK2 и/или Tyk2, а также ингибирующим эффектом в отношении JAK3. Более предпочтительно, соединение общей формулы [1] обладает ингибирующим эффектом в отношении всех киназ JAK.1, JAK2, JAK3 и Tyk2.
"Фармацевтически приемлемая соль" соединения общей формулы [1], которое также именуется здесь настоящим соединением, может представлять собой любую нетоксичную соль настоящего соединения и включает соль с неорганической кислотой, с органической кислотой, соль с неорганическим основанием, с органическим основанием, соль с аминокислотой и т.п.
Соли с неорганическими кислотами включают соли с соляной кислотой, азотной кислотой, серной кислотой, форфорной кислотой, бромистоводородной кислотой и т.п.
Соли с органическими кислотами включают соль со щавелевой кислотой, малеиновой кислотой, лимонной кислотой, фумаровой кислотой, молочной кислотой, яблочной кислотой, янтарной кислотой, винной кислотой, уксусной кислотой, трифторуксусной кислотой, глюконовой кислотой, аскорбиновой кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой, n-толуолсульфоновой кислотой и т.п.
Соли с неорганическими основаниями включают натриевую соль, калиевую соль, кальциевую соль, магниевую соль, аммониевую соль и т.п.
Соли с органическими основаниями включают соль с метиламином, диэтиламином, триметиламином, триэтиламином, этаноламином, диэтаноламином, триэтаноламиноми, этилендиамином, трис(гидроксиметил)метиламином, дициклогексиламином, N,N’-дибензилэтилендиамином, гуанидином, пиридином, пиколином, холином, цинхонином, меглумином и т.п.
Соли с аминокислотами включают соли с лизином, аргинином, аспартамовой кислотой, глутаминовой кислотой и т.п.
В соответствии с известными способами, каждую соль можно получать взаимодействием соединения общей формулы [I] с неорганическим основанием, органическим основанием, неорганической кислотой, органической кислотой или аминокислотой.
Термин «сольват» относится к веществу, в котором молекулы растворителя координированы с соединением общей формулы [I] или его фармацевтически приемлемой солью, и включает в себя термин «гидрат». Предпочтительный сольват представляет собой фармацевтически приемлемый сольват, включающий моногидрат, полугидрат или дигидрат соединения общей формулы [I], моногидрат натриевой соли соединения общей формулы [I], 1 метанолат, 1 этанолат или 1 ацетонитрилат соединения общей формулы [1], 2/3 этанолат of дигидрохлорида соединения общей формулы [I] и т.п. Более предпочтительным сольватом является моногидрат соединения общей формулы [I]. Сольват соединения общей формулы [I] может быть получен известными способами.
Соединение общей формулы [I] существует также в виде различных «изомеров». Например, его геометрические изомеры включают Е- и Z-изомеры. В случае существования асимметрических атомов углерода стереоизомеры, обусловленные наличием таких атомов углерода, включают энантиомеры и диастереомеры. В случае наличия хиральных осей, существуют стереоизомеры, обусловленные наличием таких осей. Соответственно, могут существовать и таутомеры. Следовательно, объем настоящего изобретения охватывает все такие изомеры и их смеси.
Соединение общей формулы [I] может также быть меченным изотопами (например, 3H, 14С, 35S и т.п.).
Предпочтительным соединением общей формулы [I] или его фармацевтически приемлемой солью или его сольватом является в значительной степени очищенное соединение общей формулы [1] или его фармацевтически приемлемая соль или его сольват. Более предпочтительным является соединение общей формулы [I] или его фармацевтически приемлемая соль или его сольват, которые очищены до чистоты 80% или выше.
В настоящем изобретении пролекарство соединения общей формулы [1] может также представлять собой полезное лекарство. Термин «пролекарство» относится к производному соединения по настоящему изобретению с функциональной группой, способной разлагаться химически или метаболически, которое вводят in vivo; затем оно превращается в соответствующее исходное соединение путем гидролиза, сольволиза или физиологического разложения, проявляя эффективность исходного лекарства, пролекарства включают любые их композиты с нековалентными связями и их соли Пролекарство используют для улучшения абсорбции при пероральном введении или для таргетного воздействия на место-мишень, например. Места модификации соединения по настоящему изобретению для образования пролекарства включают любые его реакционноспособные функциональные группы, в том числе гидроксильную, карбоксильную, амино, тиольную и т.п.
Группы для модификации гидроксила включают ацетил, пропионил, изобутирил, пивалоил, пальмитоил, бензоил, 4-метилбензоил, диметилкарбамоил, диметиламинометилкарбонил, сульфо, аланил, фумарил или образовавший натриевую соль 3-карбоксибензоил или 2-карбоксиэтилкарбонил и т.п.
Группы для модификации карбоксильной группы включают метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пивалоилоксиметил, карбоксиметил, диметиламинометил, 1-(ацетилокси)этил, 1-(этоксикарбонилокси)этил, 1-(изопропилоксикарбонилокси)этил, 1 -(циклогексилоксикарбонилокси)этил, (5-метил-2-охо-1,3-диоксол-4-ил)метил, бензил, фенил, о-толил, морфолиноэтил, N,N-диэтилкарбамоилметил, фталидил и т.п.
Группы для модификации аминогруппы включают трет-бутнл, докозаноил, пивалоилметилокси, аланил, гексилкарбамоил, пентилкарбамоил, 3-метилтио-1-(ацетиламино)пропилкарбонил, 1-сульфо-1-(3-этокси-4-гидроксифенил)метил, (5-метил-2-оксо-1,3-диоксол-4-ил)метил, (5-метил-2-оксо-1,3-диоксол-4-ил)метоксикарбонил, тетрагидрофуранил, пирролидилметил и т.п.
Термин «фармацевтическая композиция» включает пероральные препараты, такие, как таблетки, капсулы, гранулы, порошки, пастилки, сиропы, эмульсии, суспензии или парентеральные препараты, такие, как препараты для наружного применения, суппозитории, препараты для инъекций, капли, назальные лекарственные средства, пульмональные лекарственные средства.
Фармацевтическая композиция по настоящему изобретению может быть получена путем смешивания должным образом соединения общей формулы [I] или его фармацевтически приемлемой соли или его сольвата с по меньшей мере одним или несколькими типами фармацевтически приемлемых носителей в соответствующих количествах в соответствии с методами, используемыми в области медицинских препаратов. Содержание соединения общей формулы [I] или его фармацевтически приемлемой соли или его сольвата в фармацевтической композиции зависит от ее лекарственной формы, дозировки и т.п. и составляет, например, от 0,1 до 100% (масс.) композиции.
Термин «фармацевтически приемлемый носитель» включает различные общепринятые органические и неорганические носители для фармацевтических веществ, эксципиенты, разрыхлители, связующие, флюидизирующие вещества, лубриканты для твердых препаратов, или растворяющие среды, солюбилизирующие агенты, суспендирующие агенты, вещества, регулирующие тоничность, буферы, успокаивающие средства для жидких препаратов. Кроме того, в случае необходимости, могут быть использованы добавки, включающие консерванты, антиоксиданты, красители, подсластители.
Термин «эксципиент» включает лактозу, сахарозу, D-маннит, D-сорбит, кукурузный крахмал, декстрин, микрокристаллическую целлюлозу, кристаллическую целлюлозу, кармеллозу, кальциевую соль кармеллозы, натрий карбоксиметилкрахмал, гидроксипропилцеллюлозу с низкой степенью замещения, аравийскую камедь и т.п.
Термин «разрыхлитель» включает кармеллозу, кальциевую соль кармеллозы, натриевую соль кармеллозы, натрийкарбоксиметилкрахмал, натриевую соль кроскармеллозы, кросповидон, гидроксипропилцеллюлозу с низкой степенью замещения, гидроксипропилметилцеллюлозу, кристаллическую целлюлозу и т.п.
Термин «связующее» включает гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, повидон, кристаллическую целлюлозу, сахарозу, декстрин, крахмал, желатин, натриевую соль кармеллозы, аравийскую камедь и т.п.
Термин «флюидизирующее вещество» включает легкую безводную кремниевую кислоту, стеарат магния и т.п.
Термин «лубрикант» включает стеарат магния, стеарат кальция, тальк и т.п.
Термин «растворяющая среда» включает очищенную воду, этанол, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло, оливковое масло и т.п.
Термин «солюбилизирующий агент» включает пропиленгликоль, D-маннит, бензилбензоат, этанол, триэтаноламин, карбонат натрия, цитрат натрия и т.п.
Термин «суспендирующий агент» включает хлорид бензалкония, кармеллозу, гидроксипропилцеллюлозу, пропиленгликоль, повидон, метилцеллюлозу, глицерилмоностеарат и т.п.
Термин «вещество, регулирующее тоничность» включает глюкозу, D-сорбит, хлорид натрия, D-маннит и т.п.
Термин «буфер» включает гидрофосфат натрия, ацетат натрия, карбонат натрия, цитрат натрия и т.п.
Термин «успокаивающее средство» включает бензиловый спирт и т.п.
Термин «консервант» включает этил-n-оксибензоат, хлорбутанол, бензиловый спирт, дегидроацетат натрия, сорбиновую кислоту и т.п.
Термин «антиоксидант» включает сульфит натрия, аскорбиновую кислоту и т.п.
Термин «краситель» включает пищевые красители (например, пищевой красный №2 или 3, пищевой желтый №4 или 5 и т.п.), β-каротин и т.п.
Термин «подсластитель» включает сахарин натрия, глицирризинат дикалия, аспартам и т.п.
Фармацевтическую композицию по настоящему изобретению можно вводить перорально или парентерально (например, местно, ректально, внутривенно и т.д.) млекопитающему, кроме человека (например, мышам, крысам, хомякам, морским свинкам, кроликам, котам, собакам, свиньям, коровам, лошадям, овцам, обезьянам и т.п.), а также людям. Доза указанной фармацевтической композиции зависит от субъектов, которым ее вводят, заболеваний, состояний, лекарственных форм, путей введения, и доза в случае перорального введения взрослым пациентам (масса тела около 60 кг), страдающим такими заболеваниями, как отторжение трансплантатов органов, реакция "трансплантат против хозяина" после трансплантации, а также аутоиммунные и аллергические заболевания и т.п., обычно составляет от 1 мг до 1 г в день и содержит соединение по настоящему изобретению в качестве активного ингредиента. Дозу можно вводить за один прием или разделить ее на несколько доз.
Соединение общей формулы [I] или его фармацевтически приемлемая соль или его сольват, благодаря ингибирующей активности в отношении JAK3, могут быть использованы в качестве активного ингредиента терапевтического или профилактического средства для лечения или профилактики следующих заболеваний:
(a) отторжение трансплантатов органов, реакция "трансплантат против хозяина" после трансплантации;
(b) аутоиммунные заболевания, включающие ревматоидный артрит, псориаз, псориатический артрит, рассеянный склероз, язвенный колит, болезнь Крона, системную эритематозную волчанку, диабет I типа, тяжелую миастению, болезнь Кастлемена, ювенильный идиопатический артрит, сухость глаз и
(с) аллергические заболевания, включающие астму, атопический дерматит, ринит.
Соединение общей формулы [I] или его фармацевтически приемлемая соль или его сольват могут быть предпочтительно использованы в качестве активного ингредиента терапевтического или профилактического средства для лечения или профилактики ревматоидного артрита или псориаза.
Кроме того, соединение общей формулы [I] или его фармацевтически приемлемая соль или его сольват могут быть использованы в качестве активного ингредиента терапевтического или профилактического средства для лечения или профилактики хронических миелопролиферативных заболеваний, включающих истинную полицитемию, первичный миелофиброз, эссенциальную тромбоцитемию и т.п., что обусловлено их ингибирующей активностью в отношении JAK2.
Выражение "ингибирующий JAK" относится к ингибированию функций JAK, чтобы устранить или уменьшить ее активность, и к ингибированию любых функций семейства JAK. Предпочтительным "ингибирующим JAK" является "ингибирующий человеческую JAK".
Предпочтительный «ингибитор JAK» представляет собой «ингибитор человеческой JAK».
Выражение «ингибирующий JAK3» относится к ингибированию функций JAK3, чтобы устранить или уменьшить ее активность. Например, оно относится к ингибированию функций JAK3 в условиях примеров испытаний, как описано ниже в данном документе. Предпочтительным "ингибирующим JAK3" является "ингибирующий человеческую JAK3".
Предпочтительный «ингибитор JAK3» представляет собой «ингибитор человеческой JAK3».
Выражение «ингибирующий JAK2» относится к ингибированию функций JAK2, чтобы устранить или уменьшить ее активность. Например, оно относится к ингибированию функций JAK2 в условиях примеров испытаний, как описано ниже в данном документе. Предпочтительным "ингибирующим JAK2" является "ингибирующий человеческую JAK2".
Предпочтительный «ингибитор JAK2» представляет собой «ингибитор человеческой JAK2».
В качестве примера ниже проиллюстрирован способ получения соединений для осуществления настоящего изобретения. Подразумевается, что такой способ получения соединения по настоящему изобретению не ограничивает изобретение.
Если не указано иное, эффективные способы получения можно осуществлять путем введения любых защитных групп для любых функциональных групп, если это необходимо, и последующего удаления таких защитных групп на более поздней стадии; обработки любых предшественников функциональных групп на каждой стадии и превращения таких предшественников в соответствующие целевые функциональные группы на подходящей стадии; или путем изменения порядка осуществления способов и стадий.
На каждой стадии завершающую обработку реакционной смеси можно проводить обычным образом, а способ выделения и очистки можно необязательно выбрать из общепринятых методов, включающих кристаллизацию, перекристаллизацию, перегонку, разделение, хроматографию на силикагеле, препаративную ВЭЖХ или комбинировать такие методы. Термин комнатная температура обозначает температуру в интервале 1°C-40°C.
[Общий способ получения 1]: Общий способ получения соединения [1]
[Химическая формула 16]
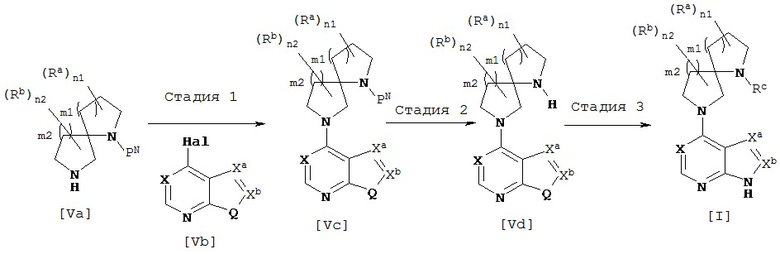
[В представленной схеме PN представляет собой защитную группу амина, предпочтительно трет-бутоксикарбонил, бензил, n-метоксибензил, бензилоксикарбонил;
Q представляет собой N (атом азота), замещенный защитной группой, или NH; Hal представляет собой атом галогена; Ra, Rb, n1, n2, Xa, Xb, X, m1, m2 и Rc имеют те же значения, которые определены в вышеприведенной формуле [I].]
(Стадия 1)
Соединение [Va] может быть введено в реакцию с соединением [Vb] в растворителе в присутствии основания с получением соединения [Vc].
Используемые в реакции растворители включают сложные эфиры, такие, как этилацетат, кетонные растворители, такие, как ацетон, амидные растворители, такие, как N,N-диметилформамид; спиртовые растворители, такие, как этанол, простые эфиры, такие, как диоксан, углеводородные растворители, такие, как толуол, галогенсодержащие углеводороды, такие, как хлороформ; воду, и растворители можно использовать по отдельности или в виде комбинации 2 или нескольких из них. Предпочтительным растворителем для реакции является вода.
Основание, используемое в реакции, включает триэтиламин, N,N-диизопропилэтиламин, пиридин, 4-диметиламинопиридин, N-метилморфолин, гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, бикарбонат натрия, предпочтительно карбонат калия.
Температурой реакции обычно является температура от комнатной до 110°C, предпочтительно от около 80°C до 110°C.
Время реакции обычно составляет от около 30 минут до 3 суток, предпочтительно от около 3 часов до 1 суток.
(Стадия 2)
Соединение [Vd] может быть получено путем удаления группы PN соединения [Vc] обычным способом снятия защиты аминогруппы. Реакцию снятия защиты можно проводить известными способами, которые зависят от выбранных защитных групп.
Например, соединение [Vc], в котором PN представляет собой трет-бутоксикарбонил, можно обрабатывать кислотой, включающей соляную кислоту, трифторуксусную кислоту, в простом или смешанном растворителе (хлороформ, диоксан, этилацетат, этанол, метанол, вода и т.п.)
Например, соединение [Vc], в котором PN представляет собой бензил или бензилоксикарбонил, можно гидрировать в простом или смешанном растворителе (хлороформ, тетрагидрофуран, диоксан, этилацетат, этанол, метанол и т.п.) в присутствии катализатора, включающего палладий на угле, гидроксид палладия.
(Стадия 3)
В соединение [Vd] в подходящем растворителе может быть введен заместитель Rc с получением соединения [1].
Например, соединение [Vd] может быть введено в реакцию с 1-цианоацетил-3,5-диметилпиразолом в растворителе в присутствии основания, получая таким образом соединение [1], в котором Rc представляет собой цианоацетил. Растворитель, используемый в этой реакции, включает сложный эфир, такой как этилацетат, кетонный растворитель, такой как ацетон, амидный растворитель, такой как N,N-диметилформамид; спиртовой растворитель, такой как этанол, простой эфир, такой как диоксан, углеводородный растворитель, такой как толуол, галогенированный углеводород, такой как хлороформ; и растворители можно использовать по отдельности или в виде комбинации 2 или нескольких из них. Предпочтительным растворителем для реакции является диоксан.
Основание, используемое в реакции, включает триэтиламин, пиридин, 4-диметиламинопиридин, N-метилморфолин, N,N-диизопропилэтиламин, предпочтительно N,N-диизопропилэтиламин. Обычно температура реакции составляет от комнатной до 110°C, предпочтительно около 80-110°C. Время реакции составляет от около 30 мин до 1 суток, предпочтительно около 2-4 часов.
Например, соединение [Vd] может быть введено в реакцию с производным карбоновой кислоты в обычной реакции амидирования в растворителе в присутствии конденсирующего агента и основания, получая таким образом соединение [1], в котором Rc представляет собой ацил. Растворитель, используемый в этой реакции, включает амидный растворитель, такой как N,N-диметилформамид; галогенированный углеводород, такой как хлороформ, и растворитель может быть использован отдельно или в виде комбинации 2 или нескольких из них. Предпочтительным растворителем для реакции является простой эфир, такой как тетрагидрофуран или диоксан. Конденсирующий агент, используемый в этой реакции, включает растворимый в воде карбодиимид (например, гидрохлорид 1-этил-3-(3’-диметиламинопропил)карбодиимид), N,N’-дициклогексилкарбодиимид, дифенилфосфорилазид, карбонилдиимидазол. Если необходимо, в реакционную смесь можно прибавить 1-гидрокси-1Н-бензотриазол, 4-диметиламинопиридин. Предпочтительным конденсирующим агентом для реакции является карбонилдиимидазол.
В вышеупомянутой реакции амидирования производное карбоновой кислоты можно также предварительно превратить в соответствующий хлорангидрид кислоты или смешанный ангидрид кислоты, который затем подвергают взаимодействию с соединением [Vd], получая соединение [1].
Например, соединение [Vd] может быть введено в реакцию с акрилонитрилом в присутствии основания, включающего триэтиламин, пиридин, N,N-диизопропилэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен в амидном растворителе, включающем N,N-диметилформамид, N,N-диметилацетамид или ацетонитрил, с получением соединения [1], в котором Rc представляет собой пропилнитрил.
Например, соединение [Vd] может быть введено в реакцию с алкилхлорформиатом и т.п. в соответствии с обычным способом синтеза карбамата для получения соединения [1], в котором Rc представляет собой алкоксикарбонил.
Например, соединение [Vd] может быть введено в реакцию с алкилизоцианатом и т.п. в соответсвтвии с обычным способом синтеза мочевины для получения соединения [1], в котором Rc представляет собой алкиламинокарбонил.
В вышеупомянутом способе синтеза мочевины производное алкиламина можно также вводить в реакцию с 4-нитрофенилхлорформиатом, получая 4-нитрофениловый эфир алкилкарбаминовой кислоты, который затем можно ввести в реакцию с соединением [Vd] для получения соединения [1].
Обычное снятие защиты аминогруппы в соединении [Vd], где N в группе Q, замещен защитной группой, можно необязательно проводить или после введения Rc, или перед его введением. Снятие защиты можно осуществлять известными способами, зависящими от выбранных защитных групп.
Например, снятие защиты в том случае, когда защитной группой является n-толуолсульфонил, можно проводить посредством обработки щелочью, включающей гидроксид натрия, гидроксид калия, карбонат цезия, в простом или смешанном растворителе: простом эфире, таком как тетрагидрофуран или диоксан; спиртовом растворителе, таком как этанол или метанол; воде и т.п.
Например, снятие защиты в том случае, когда защитной группой является n-метоксибензил, можно проводить посредством обработки кислотой, такой как соляная кислота, трифторуксусная кислота в простом или смешанном растворителе: простом эфире, таком как анизол; галогенированном углеводороде, таком как хлороформ; сложном эфире, таком как этилацетат; простом эфире, таком как тетрагидрофуран или диоксан; спиртовом растворителе, таком как этанол или метанол; воде и т.п.
В качестве примера некоторые способы синтеза соединения [Va] в общем способе получения 1 показаны в следующих ниже общих способах получения 2-4.
В следующих ниже общих способах получения 2-4 соединения [VIi] и [VIIo] соответствуют соединению [Va].
[Общий метод получения 2]
[Химическая формула 17]
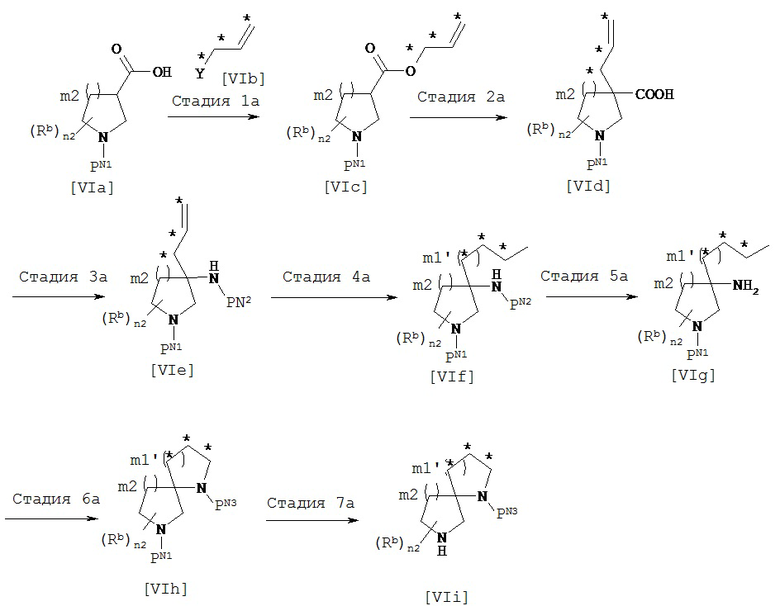
[В представленной выше схеме PN1, PN2 и PN3 являются защитными группами для амина, предпочтительно трет-бутоксикарбонильной, бензильной, бензилоксикарбонильной труппами, Y представляет собой гидроксил или уходящую группу, включающую атом хлора, атом брома, атом йода, мезилокси, тозилокси; m1’ равен 0 или 1; атомы углерода, обозначенные *, могут быть замещены R3 при условии, что это химически приемлемо; Ra, Rb, n1, n2 и m2 имеют те же значения, которые определены в представленной выше формуле [I].]
(Стадия 1а)
Соединение [Via] можно этерифицировать соединением [VIb] обычным путем в растворителе и получить соединение [VIe]. Например, соединение [Via] может быть введено в реакцию с соединением [VIb], в котором Y представляет собой гидроксил, в растворителе в присутствии конденсирующего агента и основания.
Используемые в реакции растворители включают амидный растворитель, такой как N,N-диметилформамид; простой эфир, такой как тетрагидрофуран, галогенированный углеводород, такой как хлороформ; и растворители можно использовать по отдельности или в виде комбинации 2 или нескольких из них. Предпочтительным растворителем для реакции является галогенированный углеводород, такой как хлороформ.
Предпочтительным конденсирующим агентом, используемым в этой реакции, является растворимый в воде карбодиимид (например, гидрохлорид 1-этил-3-(3’-диметиламинопропил)карбодиимид) и т.п.
Предпочтительным основанием, используемым в этой реакции, является органическое основание, такое, как 4-диметиламинопиридин и т.п.
Предпочтительной температурой реакции является комнатная температура.
Время реакции обычно составляет от около 30 минут до 1 суток, предпочтительно около 2-6 часов.
Например, соединение [VIa] может быть введено в реакцию с соединением [VIb], где Y представляет собой уходящую группу в растворителе в присутствии основания.
Уходящая группа включает атом хлора, атом брома, атом йода, мезилокси- и тозилоксигруппы, предпочтительной уходящей группой является атом брома.
Используемые в реакции растворители включают амидный растворитель, такой как N,N-диметилформамид; простой эфир, такой как диоксан, углеводородный растворитель, такой как толуол; и растворители можно использовать по отдельности или в виде комбинации 2 или нескольких из них. Предпочтительным растворителем для реакции является N,N-диметилформамид.
Основание, используемое в реакции, включает неорганическое основание, такое, как карбонат натрия, карбонат калия, фосфат калия, бикарбонат натрия, предпочтительно карбонат калия.
Обычно температура реакции находится в интервале от комнатной до 120°C, предпочтительно от комнатной до 60°C.
Время реакции составляет от около 30 мин до 1 суток, предпочтительно около 2-6 часов.
(Стадия 2а)
Соединение [Vie] можно подвергать обычной перегруппировке Кляйзена в растворителе в присутствии основания и получать соединение [VId].
Предпочтительным растворителем, используемым в этой реакции, является тетрагидрофуран.
Основания, используемые в реакции, включают такие, как диизопропиламид лития, гексаметилдисилазид лития, гексаметилдисилазид калия, гексаметилдисилазид натрия, гидрид натрия, трет-бутоксир. калия, предпочтительно гексаметилдисилазид лития.
Предпочтительная температура реакции составляет от около -80 до 0°C.
Время реакции обычно составляет от около 30 минут до 1 суток, предпочтительно около 2-4 часов.
(Стадия 3а)
Остаток карбоновой кислоты соединения [VId] может быть превращен в карбамат в растворителе, в результате получают соединение [VIe]. Такое превращение включает обычную перегруппировку Курциуса.
Предпочтительным реагентом, используемым в этой реакции, является дифенилфосфорилазид.
Растворитель, используемый в этой реакции, включает амидный растворитель, такой как N,N-диметилформамид; спиртовой растворитель, такой как бензиловый спирт, простой эфир, такой как диоксан, углеводородный растворитель, такой как толуол, и растворители можно использовать по отдельности или в виде комбинаций 2 или нескольких из них. Предпочтительным растворителем для реакции является смесь толуола и бензилового спирта.
Предпочтительным основанием, используемым в этой реакции, является триэтиламин.
Обычно температура реакции находится в интервале от комнатной до 110°C, предпочтительно от около 80 до 110°C.
Время реакции составляет от около 30 мин до 2 суток, предпочтительно от около 2 часов до 1 суток.
Если необходимо, используют добавку, включающую 4-диметиламинопиридин.
(Стадия 4а)
Олефиновую группу соединения [VIe] можно превратить в гидроксил и получить соединение [VIf]. Такое превращение иллюстрируется следующими стадиями 4а-1 или 2, в качестве примера.
(Стадия 4а-1)
Соединение [VIe] можно подвергать окислению озоном в растворителе с последующим восстановлением и получением соединения [VIf]. Окисление озоном можно проводить по общепринятой методике.
Предпочтительным растворителем, используемым в реакции окисления озоном, является смешанный растворитель, включающий хлороформ и метанол.
Обычно температура окисления озоном составляет от около -100°C до 0°C, предпочтительно от около -80°C до -60°C.
Время окисления озоном обычно составляет от около 5 минут до 6 часов предпочтительно от около 15 минут до 3 часов.
Предпочтительным реагентом, используемым для восстановления, является боргидрид натрия.
Обычно температура реакции восстановления составляет от около -100°C до комнатной температуры, предпочтительно от около -20°C до 0°C.
Время реакции восстановления составляет обычно от около 30 минут до 6 часов предпочтительно от около 1 до 3 часов.
(Стадия 4а-2)
Соединение [VIe] можно подвергать гидроборированию в растворителе с последующим окислением для получения соединения [VIf].
Реагенты, используемые для гидроборирования, включают комплекс боран-пиридин, комплекс боран-диметилсульфид, 9-борабицикло[3.3.1]нонан или раствор комплекса боран-тетрагидрофуран в тетрагидрофуране, предпочтительно раствор комплекса боран-тетрагидрофуран в тетрагидрофуране.
Предпочтительным растворителем, используемым для гидроборирования, является тетрагидрофуран.
Температура реакции гидроборирования составляет обычно от около -20°C до комнатной температуры, предпочтительно 0°C.
Предпочтительное время реакции гидроборирования составляет от 1 до 4 часов.
Реагенты, используемые для окисления, включают пероксид водорода или моногидрат пероксобората натрия, предпочтительно моногидрат пероксобората натрия.
Температура реакции окисления составляет обычно от около 0°C до комнатной температуры, предпочтительной является комнатная температура.
Предпочтительное время реакции окисления составляет от около 1 до 4 часов.
(Стадия 5 а)
Группа PN2 из PN1 и PN3 может быть селективно удалена из соединения [VIf] посредством обычного снятия защиты амина, аналогичного описанному выше для стадии 2 общего способа получения 1, в результате получают соединение [VIg]. Снятие защиты можно проводить известными способами, зависящими от выбранных защитных групп.
(Стадия 6а)
Соединение [VIg] можно подвергать циклизации в растворителе с последующим введением группы PN3 и получением соединения [VIh]. Циклизация может быть осуществлена введением уходящей группы в гидроксильную группу соединения [VIg] в растворителе в присутствии основания. В качестве примера ниже показана стадия 6а-1 или 2.
(Стадия 6а-1)
Соединение [VIg] может быть введено в реакцию с тетрабромидом углерода и трифенилфосфином (или, альтернативно, с метансульфонилхлоридом вместо этих двух реагентов) в растворителе в присутствии основания, с осуществлением в одну стадию введения уходящей группы и циклизации.
Предпочтительным растворителем, используемым в этой реакции, является дихлорметан.
Предпочтительным основанием, используемым в этой реакции, является триэтиламин.
Предпочтительная температура реакции находится в интервале от 0°C до комнатной температуры.
Обычно время реакции составляет от около 10 минут до 24 часов, предпочтительно от около 30 минут до 12 часов.
(Стадия 6а-2)
Введение уходящей группы и циклизацию можно разделить на две стадии.
Предпочтительным реагентом, используемым для введения уходящей группы, является метансульфонилхлорид.
Предпочтительным растворителем, используемым для введения уходящей группы, является хлороформ.
Предпочтительным основанием, используемым для введения уходящей группы, является триэтиламин.
Температура реакции для введения уходящей группы обычно составляет от около 0°C до комнатной температуры, предпочтительно 0°C.
Предпочтительное время реакции для введения уходящей группы обычно составляет от около 30 минут до 2 часов.
Предпочтительным растворителем, используемым в реакции циклизации, является N,N-диметилформамид.
Предпочтительным основанием, используемым в реакции циклизации, является гидрид натрия.
Температура реакции циклизации обычно составляет от около 0°C до комнатной температуры, предпочтительно 0°C.
Предпочтительное время реакции циклизации обычно составляет от около 10 минут до 2 часов.
В циклизованное соединение можно ввести PN3 посредством обычной защиты аминогруппы и получить соединение [VIh]. Защиту амина можно осуществить известными способами, зависящими от выбранных защитных групп.
Например, соединение, в котором PN3 представляет собой бензилоксикарбонил, можно получать обработкой бензилхлорформиатом в галогенированном углеводородном растворителе, таком как хлороформ, дихлорметан в присутствии органического основания, такого как триэтиламин.
Стадию 5а можно сократить, а затем осуществить стадию 6а-2.
(Стадия 7а)
Группу PN1 из PN2 и PN3 можно селективно удалить из соединения [VIh] посредством обычного снятия защиты аминогруппы, аналогичного вышеописанному на стадии 2 общего способа получения 1, и получить соединение [VIi]. Снятие защиты можно осуществить известными способами, зависящими от выбранных защитных групп.
Соединения [Va], [Vc], [Vd] или [1] в общем способе получения 1, или же соединения [VId]-[VIi] в общем способе получения 2 можно оптически расщеплять и получать оптически активные соединения.
Оптическое расщепление включает способ, в котором рацемическое соединение [VId] и оптически активное аминосоединение смешивают в растворителе с последующей кристаллизацией в виде отдельной диастереомерной соли. Полученную диастереомерную соль можно разложить по общепринятой методике и получить оптически активное соединение [VId]. (+)- или (-)-Изомеры соединения [VId] можно получать путем введения соответствующего оптически активного аминосоединения.
Оптически активные аминосоединения включают (S)-(-)-2-амино-3-фенилпропан-1-ол, (R)-(+)-2-амино-3-фенилпропан-1-ол, (S)-(-)-1-(1-нафтил)этиламин, (R)-(+)-l-(l-нафтил)этиламин, (S)-(+)-2-амино-2-фенилэтанол, (R)-(-)-2-амино-2-фенилэтанол.
Растворители включают кетонные растворители, такие, как ацетон, метилэтилкетон, метилизобутилкетон; сложноэфирные растворители, такие, как метилацетат, этилацетат, изопропилацетат, изобутилацетат; простые эфирные растворители, такие, как изопропиловый эфир, 1,2-диметоксиэтан; спиртовые растворители, такие, как метанол, этанол, изопропанол; воду, и растворители могут быть использованы по отдельности или в виде комбинации 2 или нескольких из них. Предпочтительный растворитель включает изопропилацетат, изопропанол или 1,2-диметоксиэтан.
Кроме того, опционально можно осущетсвить общепринятый способ увеличения оптической чистоты. Например, можно повторно провести перекристаллизацию.
Альтернативный способ расщепления на оптические изомеры включает способ, в котором рацемическое соединение [1] обрабатывают на колонке с хиральной стационарной фазой для отделения целевого оптически активного соединения [1] от его другого изомера.
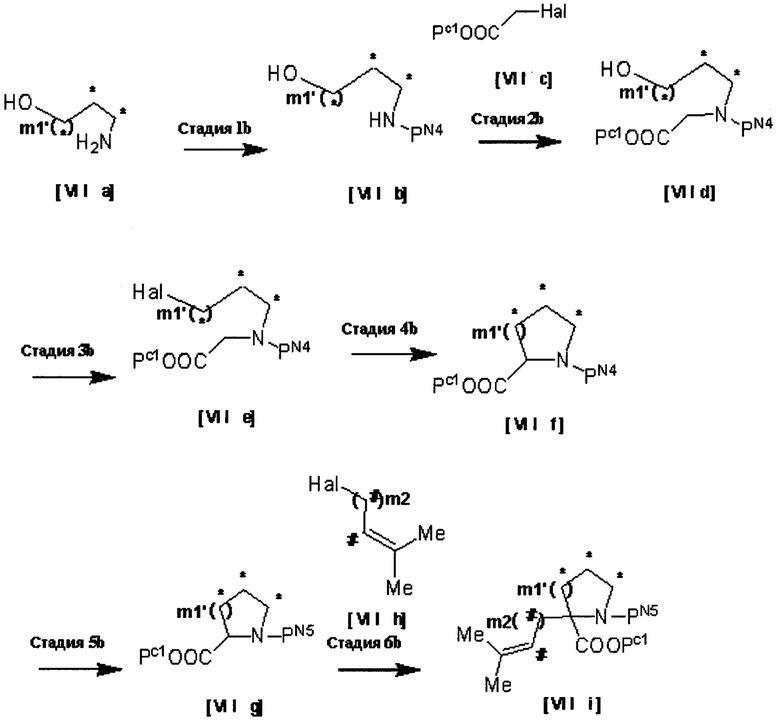
[Общий способ получения 3]
[Химическая формула 18]
[Химическая формула 19]
[В представленных выше схемах PN4, PN5, PN6 и PN7 представляют собой защитные группы амина, предпочтительно бензил, трет-бутоксикарбонил или бензилоксикарбонил; РС1 представляет собой защитную группу карбоновой кислоты, предпочтительно трет-бутиловый эфир, метиловый эфир или этиловый эфир; Hal представляет собой атом галогена; m1' представляет собой 0 или 1; атомы углерода, обозначенные *, могут быть замещены Ra при условии, что это химически приемлемо; атомы углерода, обозначенные # могут быть замещены Rb при условии, что это химически приемлемо; Ra, Rb, n1, n2 и m2 имеют те же значения, которые были определены в представленной выше формуле [I].]
(Стадия 1b)
В соединение [VIIa] можно ввести группу PN4 обычным способом введения защиты амина и получить соединение [VIIb]. Введение защиты амина можно осуществить по известным методикам, зависящим от выбранных защитных групп.
Например, в случае, когда PN4 представляет собой бензил, защиту можно осуществить путем гидрирования бензальдегидом в спиртовом растворителе, таком, как метанол, этанол, в присутствии палладиевого катализатора, такого, как палладий на угле.
(Стадия 2b)
Соединение [VIIb] может быть введено в реакцию с соединением [VIIc] в растворителе в присутствии основания с получением соединения [VIId].
Предпочтительным растворителем, используемым в этой реакции, является N,N-диметилформамид.
Предпочтительным основанием, используемым в этой реакции, является карбонат калия.
Обычно температура реакции составляет от комнатной до 120°C, предпочтительно от комнатной температуры до 60°C.
Время реакции обычно составляет от около 30 минут до 2 суток, предпочтительно от около 6 часов до 1 суток.
(Стадия 3b)
Соединение [VIId] можно галогенировать в растворителе обычным образом с последующей перегруппировкой и получением соединения [VIIe].
Предпочтительным реагентом, используемым для галогенирования, является тионилхлорид.
Предпочтительным растворителем, используемым для галогенирования, является хлороформ.
Предпочтительной температурой реакции галогенирования является температура в интервале от комнатной до 60°C.
Обычно время реакции галогенирования составляет около 30 минут до 1 суток, предпочтительно от около 1 до 6 часов.
Перегруппировка показана на следующей стадии 3b2. Конкретно соединение [VIIe2], полученное при галогенировании, может подвергаться перегруппировке в растворителе с образованием соединения [VIIe3].
[Химическая формула 20]
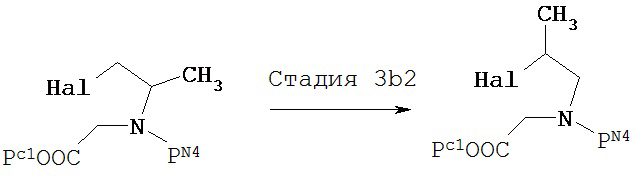
Предпочтительным растворителем, используемым для перегруппировки, является N,N-диметилформамид.
Предпочтительной температурой для перегруппировки является температура около 60°C-100°C.
Предпочтительное время перегруппировки составляет от около 30 минут до 3 суток.
(Стадия 4b)
Соединение [VIIe] может подвергаться внутримолекулярной циклизации в растворителе в присутствии основания и давать соединение [VIIf].
Предпочтительным основанием, используемым в этой реакции, является гексаметилдисилазид лития.
Предпочтительным растворителем, используемым в этой реакции, является смешанный растворитель из тетрагидрофурана и гексаметилфосфорамида.
Предпочтительной температурой реакции обычно является температура в интервале от около -100°C до 0°C, предпочтительно от около -80°C до 0°C.
Обычно время реакции составляет от около 30 минут до 6 часов, предпочтительно от около 1 до 2 часов.
(Стадия 5b)
Группу PN4 соединения [VIIf] может быть превращена в группу PN5 с получением соединения [VIIg].
Удаление PN4 можно осуществить посредством обычного снятия защиты амина, аналогичного вышеописанному в общем способе получения 1 (стадия 2). Снятие защиты можно осуществлять известными методами, зависящими от выбранных защитных групп.
Введение группы PN5 можно осуществить посредством обычной защиты аминогруппы, аналогично вышеописанному в общем способе получения 3 (стадия 1b). Защиту амина можно осуществлять известными методами, зависящими от выбранных защитных групп.
Например, в случае, когда группа PN4 соединения [VIIf] представляет собой бензил, а группа PN5 соединения [VIIg] представляет собой трет-бутоксикарбонил, группу PN4 можно превратить в PN5 в одну стадию гидрированием соединения [VIIf] трет-бутилдикарбонатом в смешанном растворителе из тетрагидрофурана и метанола в присутствии катализатора, такого как палладий на угле или гидроксид палладия.
(Стадия 6b)
Соединение [VIIg] может быть введено в реакцию с соединением [VIIh] в растворителе в присутствии основания с получением соединения [VIIi].
Предпочтительным основанием, используемым в этой реакции, является гексаметилдисилазид лития.
Предпочтительным растворителем, используемым в этой реакции, является тетрагидрофуран.
Температура реакции обычно составляет от около -80°C до комнатной температуры, предпочтительно от около -80°C до 0°C.
Обычно время реакции составляет от около 30 минут до 3 часов, предпочтительно от около 30 минут до 1 часа.
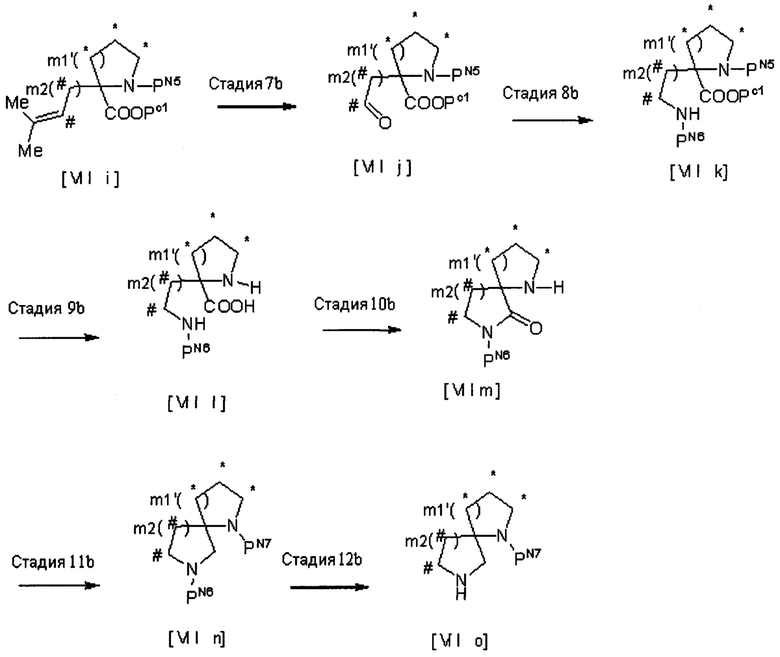
(Стадия 7b)
Олефиновый фрагмент соединения [VIIi] можно подвергать окислительному расщеплению в растворителе и получать соединение [VIIj].
Окислительное расщепление включает окисление озоном и обработку восстановителем.
Предпочтительным растворителем, используемым в этой реакции, является смешанный растворитель из хлороформа и метанола.
Обычно температура реакции составляет от около -100°C до 0°C, предпочтительно от около -80°C до 0°C.
Обычно время реакции составляет от около 5 минут до 6 часов, предпочтительно от около 30 минут до 2 часов.
Реагент, используемый в качестве восстановителя, включает диметилсульфид или трифенилфосфин, предпочтительно трифенилфосфин.
(Стадия 8b)
Соединение [VIIj] можно подвергать восстановительному аминированию в растворителе, получая при этом соединение [VIIk].
Предпочтительный амин, используемый в этой реакции, представляет собой бензиламин.
Предпочтительным растворителем, используемым в этой реакции, является тетрагидрофуран.
Предпочтительной температурой реакции является комнатная температура.
Предпочтительное время реакции составляет от около 12 часов до 1 дня.
Предпочтительным реагентом, используемым в качестве восстановителя, является триацетоксиборгидрид натрия.
(Стадия 9b)
Из соединения [VIIk] можно одновременно удалять группы РС1 и PN5 посредством обычного снятии защиты карбоновой кислоты и снятия защиты амина, получая при этом соединение [VIII]. Снятие защиты можно осуществлять известными методами, зависящими от выбранных защитных групп.
Например, соединение [VIIk], в котором PC1 представляет собой трет-буттовую сложноэфирную группу, а PN5 представляет собой трет-бутоксикарбонил, может быть обработано кислотой, такой как соляная кислота, трифторуксусная кислота, в простом или смешанном растворителе (анизол, хлороформ, этилацетат, диоксан, вода и т.п.).
(Стадия 10b)
Соединение [VIIl] может подвергаться внутримолекулярной циклизации в растворителе с образованием соединения [VIIm]. Циклизация включает обычное амидирование в присутствии конденсирующего агента и основания.
Предпочтительным конденсирующим агентом, используемым в этой реакции, является гексафторфосфат O-(7-азабензотриазол-1-ил)-N,N,N’,N-тетраметилурония.
Предпочтительным основанием, используемым в этой реакции, является диизопропилэтиламин.
Предпочтительным растворителем, используемым в этой реакции, является хлороформ.
Предпочтительной температурой реакции является комнатная температура.
Обычно время реакции составляет около 30 минут до 1 суток, предпочтительно от около 1 до 6 часов.
В качестве альтернативной циклизации из соединения [VIIk], в котором PC1 представляет собой этильную или метильную сложноэфирную группу, можно селективно удалить группу PN5 посредством обычного снятия защиты амина (при этом сохраняется группа PC1), а затем осуществить циклизацию действием 2М водного раствора гидроксида натрия в спиртовом растворителе, таком как этанол, при комнатной температуре, и получить соединение [VIIm].
(Стадия 11b)
Амидную группу соединения [VIIm] можно восстановить в амин в растворителе, затем ввести группу PN7 обычным введением защиты амина и получить соединение [VIIn].
Предпочтительным восстановителем, используемым для восстановления, является смесь алюмогидрида лития и концентрированной серной кислоты. Предпочтительно использовать концентрированную серную кислоту в количестве 0,5 моль на 1 моль алюмогидрида лития.
Предпочтительным растворителем, используемым для восстановления, является тетрагидрофуран.
Температурой реакции восстановления обычно является температура от 0°C до комнатной температуры, предпочтительно 0°C.
Обычно время реакции восстановления составляет от около 30 минут до 3 часов, предпочтительно от около 1 до 2 часов.
Защиту амина можно осуществлять известными методами, зависящими от выбранных защитных групп, аналогичными описанным выше в общем способе получения 3 (стадия 1b). Например, в случае, когда PN7 представляет собой трет-бутоксикарбонил, соединение [VIIm] может быть введено в реакцию с ди-трет-бутилдикарбонатом в тетрагидрофуране.
(Стадия 12b)
Защитную группу PN6 из групп PN6 и PN7 соединения [VIIn] можно селективно удалять посредством обычного снятия защиты амина, аналогично описанному в вышеприведенном общем способе получения 1 (стадия 2), и получать соединение [VIIo]. Снятие защиты можно осуществлять известными методами, зависящими от выбранных защитных групп.
[Общий способ получения 4]
[Химическая формула 21]
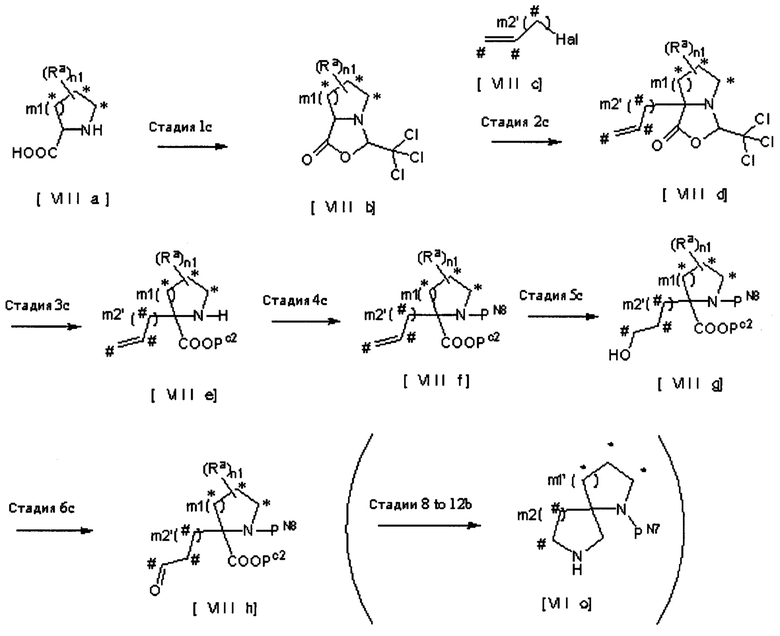
[В представленной выше схеме PN8 представляет собой защитную группу амина, предпочтительно трет-бутоксикарбонил; РС2 представляет собой защитную группу карбоновой кислоты, предпочтительно трет-бутиловую сложноэфирную группу; Hal представляет собой атом галогена; ь2’ представляет собой 1 или 2; атомы углерода, обозначенные *, могут быть замещены Ra при условии, что это химически приемлемо; атомы углерода, обозначенные #, могут быть замещены Rb при условии, что это химически приемлемо; Ra, Rb, n1, n2 и m1 имеют те же значения, которые были определены в представленной выше формуле [1]].
(Стадия 1с)
Соединение [VIIIa] может быть введено в реакцию с трихлорэтаналем в растворителе с получением соединения [VIIIb)].
Предпочтительным растворителем, используемым в этой реакции, является ацетонитрил.
Предпочтительной температурой реакции является комнатная температура.
Обычно время реакции галогенирования составляет от около 30 минут до 3 суток, предпочтительно от около 6 часов до 1 суток.
(Стадия 2 с)
Соединение [VIIIb] может быть введено в реакцию с соединением [VIIIc] в растворителе в присутствии основания с получением соединения [VIIId].
Предпочтительным растворителем, используемым в этой реакции, является тетрагидрофуран.
Предпочтительным основанием, используемым в этой реакции, является диизопропиламид лития.
Обычно температура реакции составляет от около -80°C до комнатной температуры, предпочтительно от около -80°C до 0°C.
Обычно время реакции составляет от около 30 минут до 1 суток, предпочтительно от около 1 до 3 часов.
(Стадия 3с)
Соединение [VIIId] можно подвергнуть сольволизу в кислых условиях в спиртовом растворителе и получить соединение [VIIIe].
Предпочтительным растворителем, используемым в этой реакции, является метанол.
Предпочтительной кислотой, используемой в этой реакции, является концентрированная серная кислота. Предпочтительно применять концентрированную серную кислоту в количестве 0,1-0,3 моль на 1 моль соединения [VIIId].
Предпочтительной температурой реакции является температура от комнатной до 65°C.
Обычно время реакции составляет от около 30 минут до 3 суток, предпочтительно от около 6 часов до 1 дня.
(Стадия 4с)
В соединение [VIIIe] можно ввести группу PN8 обычным способом введения защиты амина, аналогичным описанному выше в общем способе получения 3 (стадия 1b), и получить соединение [VIIIf]. Защиту амина можно осуществлять известными методами, зависящими от выбранных защитных групп. Например, в случае, когда PN8 представляет собой трет-бутоксикарбонил, соединение [VIIIe] может быть введено в реакцию с ди-трет-бутилдикарбонатом в тетрагидрофуране.
(Стадия 5с)
Соединение [VIIIf] можно подвергнуть гидроборированию в растворителе с последующим окислением и получением соединения [VIIIg] способом, аналогичным описанному в общем способе получения 2 (стадия 4а-2).
(Стадия 6с)
Соединение [VIIIg] можно окислять в растворителе, получая соединение [VIIIh].
Реагент, используемый в этой реакции, включает комплекс триоксид серы-пиридин или периодинан Десса-Мартина, предпочтительно периодинан Десса-Мартина.
Предпочтительным растворителем, используемым в этой реакции, является хлороформ.
Предпочтительной температурой реакции является температура от около 0°C до комнатной температуры.
Время реакции обычно составляет от около 30 минут до 1 суток, предпочтительно от около 2 до 6 часов.
Можно необязательно прибавить основание, включающее бикарбонат натрия в качестве добавки.
Полученное соединение [VIIIh] можно ввести в реакцию, аналогичную описанной в общем способе получения 3 (стадия 8b или позже) и получать аминосоединение, соотвествующее соединению [VIIo].
Примеры
Далее получение соединений по настоящему изобретению иллюстрируется конкретными примерами. Однако следует понимать, что объем настоящего изобретения не ограничивается приведенными примерами.
В примерах стереохимические данные в химических структурах соединений приводятся в виде сокращенных обозначений.
В примерах используются следующие приборы и условия для измерений.
Условия 1 для ВЭЖХ анализа
Способ получения раствора А: Дигидрат дигидрофосфата натрия (23,4 г) растворяют в воде (3000 мл), доводят pH до 2,1 фосфорной кислотой (10,2 мл).
Прибор для измерений: ВЭЖХ-система высокоэффективный жидкостной хроматограф Prominence (от SHIMADZU CORPORATION).
Колонка: DAICEL CHIRALPAK AD-3R 4,6 мм ϕ×150 мм
Температура колонки: 40°C.
Подвижная фаза: (раствор А) 100 мМ фосфатный (натриевый) буфер (рН 2,1), (раствор В) метанол
Раствор А: раствор В=30: 70 (постоянно 20-минутная подача).
Скорости подачи растворов: 0,5 мл/мин
Детектирование: УФ (220 нм)
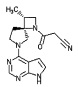
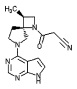
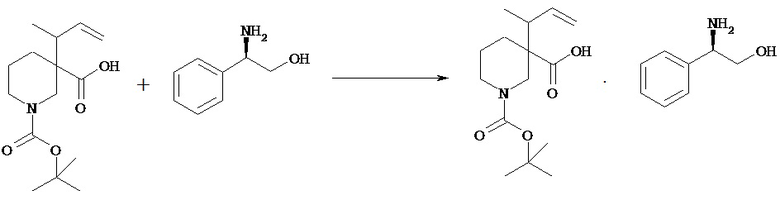
[Получение 1]: Синтез соединения 1
[Химическая формула 22]
(1) 1-трет-Бутиловый 3-((Е)-бут-2-енил)овый диэфир пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 23]
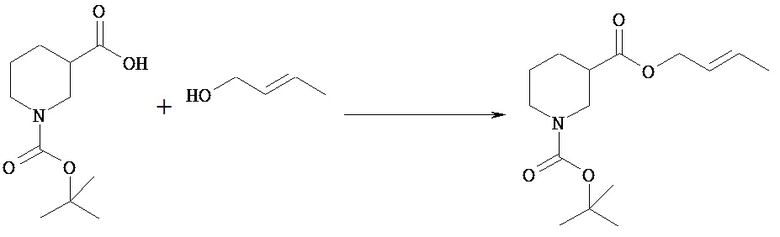
К раствору 1-(трет-бутоксикарбонил)-3-пиперидинкарбоновой кислоты (50,0 г) и 1-этил-3-(3-диметиламинопропил)карбодиимида (45,8 г) в хлороформе (500 мл) прибавляют 4-диметиламинопиридин (29,3 г), и смесь перемешивают в течение 50 минут. К смеси прибавляют (Е)-бут-2-ен-1-ол (22,1 мл) и перемешивают при комнатной температуре в течение 1,5 часов. К реакционной смеси прибавляют 10% водный раствор бисульфата калия (500 мл) и полученную смесь экстрагируют хлороформом. Отделенный органический слой промывают последовательно насыщенным водным раствором бикарбоната натрия (400 мл) и насыщенным водным раствором хлорида натрия (350 мл). Отделенный водный слой еще раз экстрагируют хлороформом (300 мл). Объединенный органический слой сушат над безводным сульфатом и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=7/1), получая указанное в заголовке соединение (57,1 г).
1H-NMR (CDCl3) δ: 5,84-5,73 (1Н, м), 5,62-5,52 (1Н, м), 4,51 (2Н, д, J=6,4 Гц), 4,37-4,00 (1Н, м), 3,95-3,88 (1Н, м), 3,19-2,87 (1Н, м), 2,84-2,76 (1Н, м), 2,48-2,40 (1Н, м), 2,08-2,01 (1Н, м), 1,74-1,66 (5Н, м), 1,63-1,55 (1Н, м), 1,46 (9Н, с).
(2) 1-отреот-Бутиловый эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты [Химическая формула 24]
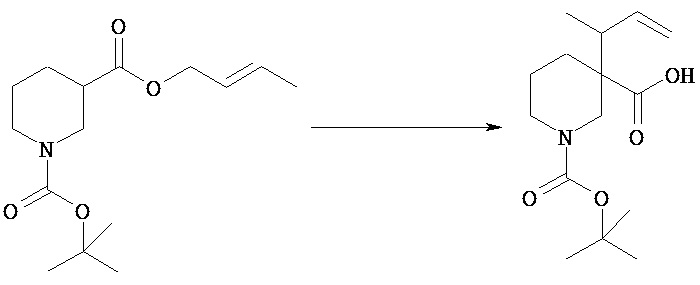
К раствору 1-трет-бутилового 3-((Е)-бут-2-енилового диэфира пиперидин-1,3-дикарбоновой кислоты (105,7 г) в тетрагидрофуране (1000 мл), охлажденному до -68°С, прибавляют гексаметилдисилазид лития (1,1 М раствор в тетрагидрофуране, 411 мл). Реакционную смесь нагревают до 0°С в течение 20 минут, перемешивают при той же температуре дополнительно в течение 30 минут и затем опять охлаждают до -68°С. К смеси прибавляют триметилсилилхлорид (56,6 мл). Реакционную смесь нагревают до комнатной температуры в течение 2 часов и перемешивают при той же температуре дополнительно в течение 2 часов. После охлаждения льдом к смеси последовательно прибавляют воду (1000 мл) и 2М водный раствор гидроксида натрия (136 мл) и полученную смесь промывают н-гексаном (1000 мл). Отделенный водный слой подкисляют 1М водным раствором соляной кислоты и затем экстрагируют этилацетатом (800 мл). Органический слой последовательно промывают водой (700 мл) и насыщенным водным раствором хлорида натрия (400 мл) и отделенный верхний слой опять экстрагируют этилацетатом (600 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (6/1, 700 мл) и получают указанное в заголовке соединение (59,8 г). Фильтрат концентрируют при пониженном давлении и полученный остаток опять промывают, суспендируя, раствором н-гексан/этилацетат (4/1, 200 мл), получая твердое вещество (14,4 г). Твердое вещество еще раз промывают, суспендируя раствором н-гексан/этилацетат (5/1, 100 мл), получая указанное в заголовке соединение (11,9 г). Получившиеся в результате твердые вещества объединяют, получая указанное в заголовке соединение (71,7 г).
1H-NMR (CDCl3) δ: 5,80-5,71 (1Н, м), 5,09-5,07 (1Н, м), 5,06-5,03 (1Н, м), 4,32-4,20 (1Н, м), 3,90-3,83 (1Н, м), 2,87-2,74 (2Н, м), 2,39-2,31 (1Н, м), 2,19-2,11 (1Н, м), 1,64-1,55 (2Н, м), 1,51-1,44 (1Н, м), 1,45 (9Н, с), 1,07 (3H, д, J=7,1 Гц).
(3) Оптически активный 1-трет-бутиловый эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 25]
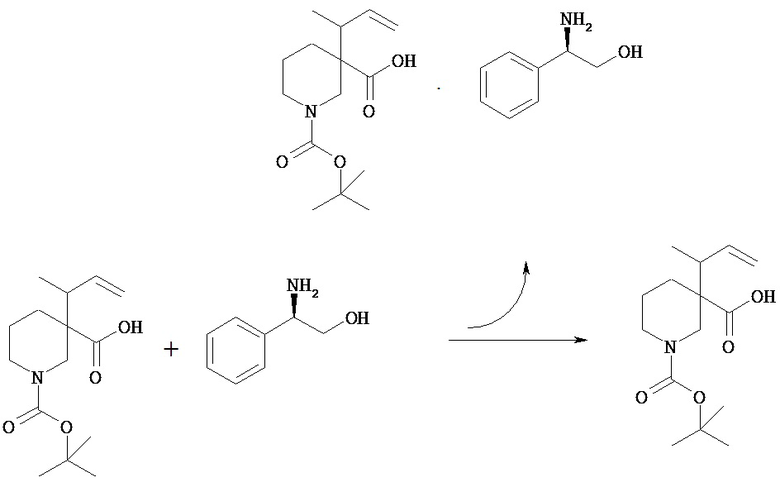
(3)-(1) Кристаллы-затравка соли оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты с (К)-(-)-2-амино-2-фенилэтанолом [Химическая формула 26]
1-трет-Бутповът эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (2,0 г) смешивают с изопропилацетатом (10 мл) и изопропанолом (10 мл) для растворения. К смеси прибавляют (R)-(-)-2-амино-2-фенилэтанол (484 мг) и перемешивают при комнатной температуре в течение 24 часов. Смесь-суспензию фильтруют и отфильтрованное твердое вещество промывают изопропилацетатом (6 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (735 мг).
(3)-(2) Соль оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты с (R)-(-)-2-амино-2-фенилэтанолом
1-трет-Бутиловый эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (106,6 г), (R)-(-)-2-амино-2-фенилэтанол (31,0 г), изопропилацетат (480 мл) и изопропанол (480 мл) смешивают для растворения при комнатной температуре. К раствору смеси прибавляют кристалл-затравку, полученный в примере (3)-(1), и смесь перемешивают в течение 16 часов. Смесь-суспензию фильтруют, получая указанное в заголовке соединение (47,0 г). Анализ полученного твердого вещества методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с меньшими временами удерживания. Изомер с меньшими временами удерживания (время удерживания 6,48 минут) Изомер с более продолжительными временами удерживания (время удерживания 10,70 минут)
(3)-(3) Оптически активный 1-трет-бутиловый эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты, извлеченный из фильтрата примера (3)-(2)
Фильтрат примера (3)-(2) концентрируют при пониженном давлении и полученный остаток смешивают с этилацетатом (500 мл) и водой (500 мл). Смесь подкисляют, прибавляя бисульфат натрия. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. К остатку прибавляют изопропанол и смесь концентрируют при пониженном давлении, получая указанное в заголовке соединение (75,0 г).
1H-NMR (CDCl3) δ: 5,80-5,71 (1Н, м), 5,09-5,07 (1Н, м), 5,06-5,03 (1Н, м), 4,32-4,20 (1Н, м), 3,90-3,83 (1Н, м), 2,87-2,74 (2Н, м), 2,39-2,31 (1Н, м), 2,19-2,11 (1Н, м), 1,64-1,55 (2Н, м), 1,51-1,44 (1Н, м), 1,45 (9Н, с), 1,07 (3H, д, J=7,1 Гц).
(4) Соль оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты с (S)-(+)-2-амино-2-фенилэтанолом
[Химическая формула 27]
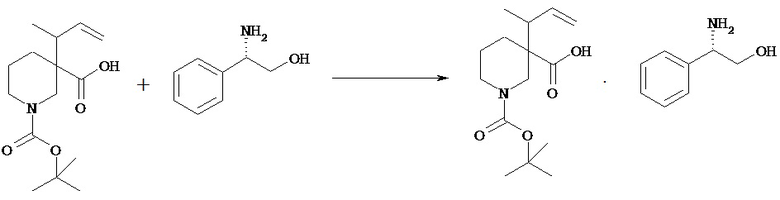
Остаток (75,0 г), полученный в примере (3)-(3), (S)-(+)-2-амино-2-фенилэтанол (31,0 г), изопропилацетат (335 мл) и изопропанол (306 мл) смешивают для растворения при комнатной температуре. К раствору смеси прибавляют кристалл-затравку, полученный в примере (3)-(1), и смесь перемешивают в течение 17,5 часов. Смесь-суспензию фильтруют и отфильтрованное твердое вещество промывают изопропилацетатом (150 мл), получая указанное в заголовке соединение (54,2 г). Анализ полученного твердого вещества методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с более длительными временами удерживания.
Изомер с меньшими временами удерживания (время удерживания 6,48 минут).
Изомер с более продолжительными временами удерживания (время удерживания 10,70 минут).
(5) Оптически активный 1-трет-бутиловый эфир 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 28]
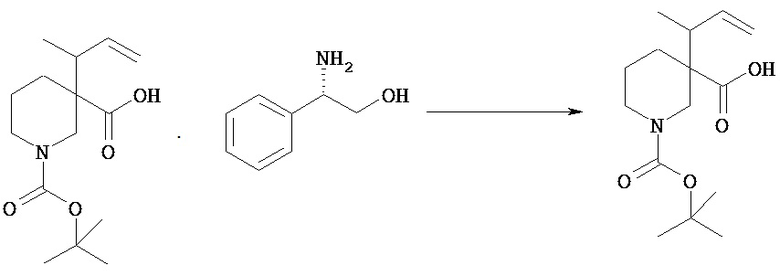
К оптически активному соединению 1-терет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты и соли (S)-(+)-2-амино-2-фенилэтанола (52,7 г) прибавляют этилацетат (264 мл) и воду (264 мл) для смешивания и смесь подкисляют, прибавляя бисульфат калия. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (36,0 г). Сырой продукт частично используют на следующей стадии без дополнительной очистки.
1H-NMR (CDCl3) δ: 5,80-5,71 (1Н, м), 5,09-5,07 (1Н, м), 5,06-5,03 (1Н, м), 4,32-4,20 (1Н, м), 3,90-3,83 (1Н, м), 2,87-2,74 (2Н, м), 2,39-2,31 (1Н, м), 2,19-2,11 (1Н, м), 1,64-1,55 (2Н, м), 1,51-1,44 (1Н, м), 1,45 (9Н, с), 1,07 (3H, д, J=7,1 Гц).
(6) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 29]
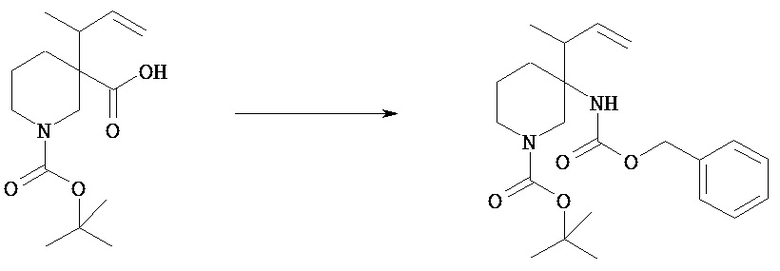
К кипящему раствору оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (9,0 г) и триэтиламина (8,9 мл) в толуоле (90 мл) прибавляют по каплям дифенилфосфорилазид (8,9 мл) в течение 25 минут. Реакционную смесь перемешивают в течение 2,5 часов при той же температуре и затем к ней прибавляют бензиловый спирт (10 мл) и 4-диметиламинопиридин (771 мг). Смесь перемешивают в течение 33 часов при кипячении с обратным холодильником, затем охлаждают до комнатной температуры и подкисляют, прибавляя 10% водный раствор бисульфата калия. Смесь экстрагируют этилацетатом, органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=20/1). Фракции, которые не могут быть выделены или очищены, концентрируют при пониженном давлении и полученный остаток опять очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=20/1). Очищенные фракции объединяют и концентрируют при пониженном давлении, получая указанное в заголовке соединение (11,0 г).
1H-NMR (CDCl3) δ: 7,37-7,29 (5H, м), 5,80-5,70 (1Н, м), 5,36-5,17 (0,5Н, м), 5,12-4,99 (4Н, м), 4,96-4,74 (0,5Н, м), 4,08-3,92 (2Н, м), 2,98-2,33 (4Н, м), 1,64-1,38 (4Н, м), 1,44 (9Н, с),1,03 (3Н, д, J=7,0 Гц).
(7) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(2-гидрокси-1-метилэтил)3-(1-метилаллил)пиперидин-1-карбоновой кислоты
[Химическая формула 30]
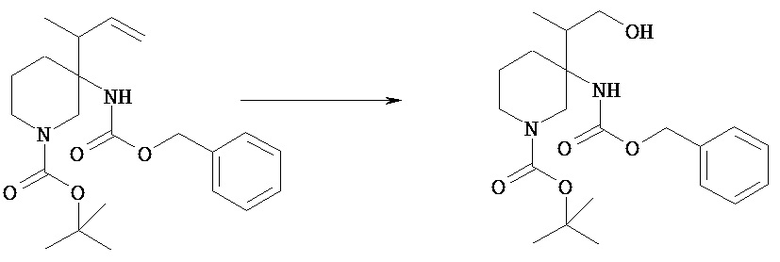
Раствор оптически активного 1-трет-бутияового эфира 3-бензилоксикарбониламино-3-(1-метилаллил)пиперидин-1-карбоновой кислоты (25,5 г) в смеси хлороформ/метанол (250 мл/250 мл), охлажденный до -78°C, продувают воздухом, насыщенным озоном, в течение 30 мин. В реакционную смесь прибавляют боргидрид натрия (7,5 г) небольшими порциями и смесь нагревают до комнатной температуры. К смеси прибавляют 5% водный раствор бикарбоната натрия (250 мл) и смесь экстрагируют хлороформом (125 мл). Отделенный водный слой опять экстрагируют хлороформом (125 мл). Объединенный органический слой промывают последовательно смешанным водным раствором бикарбонат натрия/тиосульфат натрия (12,5 г/25,0 г, 275 мл), водой (125 мл) и 10% водным раствором хлорида натрия (125 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=1/0-2/3), получая указанное в заголовке соединение (21,9 г).
1H-NMR (CDCl3) δ: 7,37-7,29 (5H, м), 5,54-5,15 (1Н, м), 5,06 (1Н, д, J=12,4 Гц), 5,02 (1Н, д, J=12,4 Гц), 4,03-3,93 (1Н, м), 3,84-3,64 (3Н, м), 3,27-2,84 (2Н, м), 2,16-1,86 (2Н, м), 1,66-1,59 (2Н, м), 1,52-1,45 (1Н, м), 1,44 (9Н, с), 1,04 (3H, д, J=7,1 Гц).
(8) Оптически активный 1-трет-бутиловый эфир 3-амино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 31]
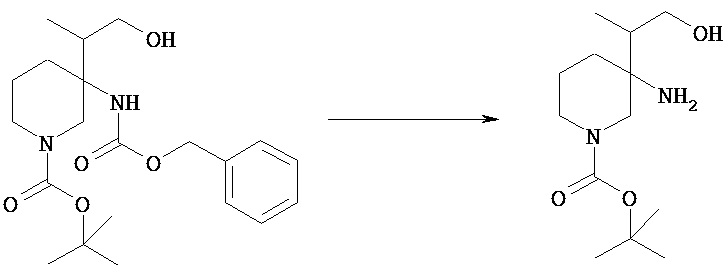
К раствору оптически активного 1-трет-бутиловото эфира 3-бензилоксикарбониламино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты (21,0 г) в метаноле (400 мл) прибавляют 10% палладий на угле (2,1 г) и смесь гидрируют при комнатной температуре и обычном давлении в течение 90 минут. Смесь фильтруют через целит, фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (13,8 г).
1H-NMR (CDCl3) δ: 3,96-3,87 (1Н, м), 3,86-3,77 (1Н, м), 3,74-3,65 (1Н, м), 3,63-3,58 (1Н, м), 3,09-2,91 (1Н, м), 2,87-2,77 (1Н, м), 1,70-1,43 (5H, м), 1,46 (9Н, с), 0,96 (3H, д, J=6,9 Гц).
(9) Оптически активный 1-бензиловый 6-трет-бутиповъш диэфир 3-метил-1,6-диазоспиро[3.5]нонан-1,6-дикарбоновой кислоты
[Химическая формула 32]
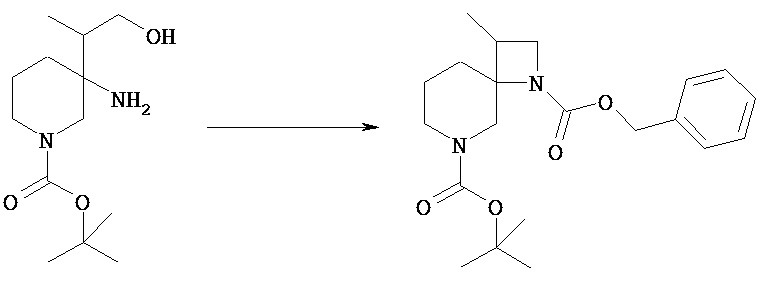
К раствору оптически активного трет-бутилового эфира 3-амино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты (12,9 г), трифенилфосфина (20,3 г) и триэтиламина (21,6 мл) в дихлорметане (400 мл), охлажденному до 0°C, небольшими плорциями прибавляют четырехбромистый углерод (25,9 г). Реакционную смесь перемешивают при комнатной температуре в течение 1 часа и охлаждают до 4°C. Затем прибавляют триэтиламин (10,8 мл) и бензилхлорформиат (10,3 мл) и смесь перемешивают при комнатной температуре в течение 40 минут. К смеси прибавляют 5% водный раствор бикарбоната натрия (125 мл) и смесь экстрагируют хлороформом (125 мл). Отделенный водный слой также экстрагируют хлороформом (125 мл). Объединенный органический слой промывают водой (125 мл), 10% водным раствором хлорида натрия (125 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=1/0-7/3), получая указанное в заголовке соединение (12,4 г).
1H-NMR (CDCl3) δ: 7,39-7,29 (5Н, м), 5,17-5,00 (2Н, м), 4,32-3,81 (3Н, м), 3,48-3,02 (2Н, м), 2,80-2,41 (2Н, м), 2,24-2,14 (1Н, м), 2,11-2,04 (0,5Н, м), 1,97-1,88 (0,5Н, м), 1,70-1,39 (2Н, м), 1,57 (9Н, с), 1,18 (3H, д, J=7,1 Гц).
(10) Оптически активный 1-бензиловый эфир 3-метил-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 33]
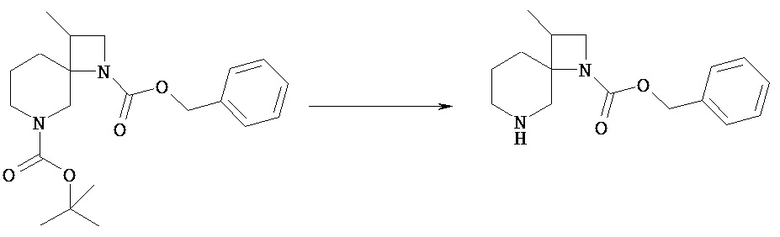
К раствору оптически активного соединения 1-бензилового 6-трет-бутилового диэфира 3-метил-1,6-диазоспиро[3,5]нонан-1,6-дикарбоновой кислоты (5,54 г) в хлороформе (83 мл), охлажденному до 4°C, прибавляют раствор трифторуксусная кислота/хлороформ (28 мл/55 мл), смесь нагревают до комнатной температуры и перемешивают дополнительно в течение 2 часов. Реакционную смесь охлаждают до 4°C и прибавляют 4М водный раствор гидроксида натрия (90 мл). Смесь подщелачивают до pH 9-10 и дважды экстрагируют смесью хлороформ/метанол (4/1, 60 мл × 2). Объединенный органический слой промывают последовательно 5% водным раствором бикарбоната натрия, 10% водным раствором хлорида натрия, сушат над безводным сульфатом магния, и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/метанол/28% водный раствор аммиака=90/10/1), получая указанное в заголовке соединение (2,20 г).
1H-NMR (CDCl3) δ: 7,40-7,29 (5Н, м), 5,18-5,03 (2Н, м), 4,02-3,94 (1Н, м), 3,41-3,26 (1,5Н, м), 3,15-3,08 (0,5Н, м), 2,97-2,72 (2,5Н, м), 2,51-2,34 (1,5Н, м), 2,24-2,13 (0,5Н, м), 2,06-1,58 (3,5Н, м), 1,53-1,35 (1Н, м), 1,30-1,15 (3H, м).
(11) Оптически активный бензиловый эфир 3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 34]
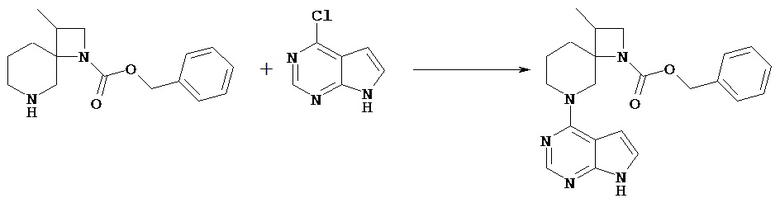
Оптически активный 1-бензиловый эфир 3-метил-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты (2,20 г) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (1,17 г), карбонатом калия (3,17 г) и водой (12 мл) и смесь перемешивают в течение 4 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры и дважды экстрагируют хлороформом. Объединенный органический слой промывают водой, 10% водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/этилацетат=1/0-1/3, с последующим элюированием смесью хлороформ/метанол=95/5), получая указанное в заголовке соединение (2,84 г).
1H-NMR (CDCl3) δ: 10,40-10,30 (1Н, м), 8,32 (1Н, с), 7,40-7,30 (5Н, м), 7,11-7,08 (1Н, м), 6,57-6,51 (1Н, м), 5,17-5,07 (2Н, м), 5,04-4,89 (1Н, м), 4,72-4,61 (1Н, м), 4,14-4,07 (1Н, м), 3,74-3,68 (0,5Н, м), 3,57-3,51 (0,5Н, м), 3,39-3,32 (1Н, м), 3,15-2,96 (1Н, м), 2,57-2,47 (1Н, м), 2,44-2,32 (0,5Н, м), 2,23-2,08 (1,5Н, м), 1,92-1,80 (1Н, м), 1,72-1,59 (1Н, м), 1,14-1,06 (3H, м).
(12) Оптически активный 4-(3-метил-1,6-диазоспиро[3,5]нон-6-ил)-7Н-пирроло[2,3-d]пиримидин
[Химическая формула 35]
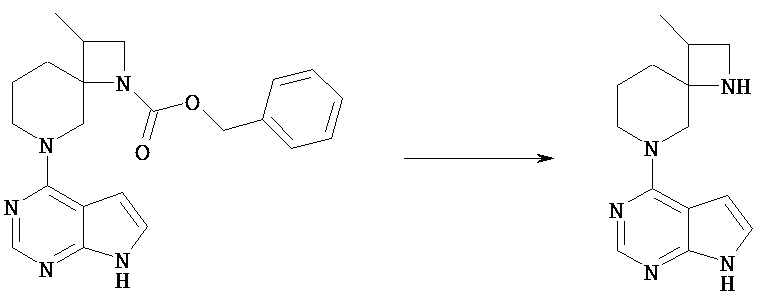
К раствору оптически активного бензилового эфира 3-метил-6-(7Н-пирроло[2,3-с1]пиримидин-4-ил)-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты (2,84 г) в смеси метанол/тетрагидрофуран (14 мл/14 мл) прибавляют 10% палладий на угле (568 мг) и гидрируют при давлении 4 атм. Смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя смесью толуол/тетрагидрофуран (95/5, 9 мл), получая указанное в заголовке соединение (1,74 г).
1H-NMR (CDCl3) δ: 10,63 (1H, уш.с), 8,32 (1Н, с), 7,08 (1Н, д, J=3,5 Гц). 6,54 (1Н, д, J=3,5 Гц), 4,45 (1Н, д, J=13,0 Гц), 4,21-4,14 (1Н, м), 3,85-3,79 (1Н, м), 3,57 (1Н, д, J=13,0 Гц), 3,55-3,47 (1Н, м), 3,08-3,01 (1Н, м), 2,48-2,38 (1Н, м), 2,03 (1Н, уш.с), 1,98-1,88 (1Н, м), 1,84-1,68 (3H, м), 1,19 (3H, д, J=7,3 Гц).
(13) Оптически активный 3-[3-метил-6-(7Н-пирроло[2,3-а]пиримидин-4-ил)-1,6-диазоспиро[3.5]нон-1-ил]-3-оксопропионитрил
[Химическая формула 36]
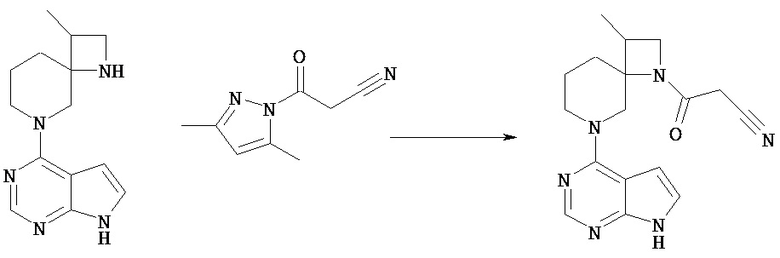
Оптически активный 4-(3-метил-1,6-диазоспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-о]пиримидин (1,8 г) смешивают с 1-цианоацетил-3,5-диметилпиразолом (2,3 г), N,N-диизопропилэтиламином (2,4 мл) и 1,4-диоксаном (18 мл) и смесь перемешивают при 100°C в течение 3 часов. Смесь охлаждают до комнатной температуры. Затем в нее прибавляют воду и насыщенный водный раствор хлорида натрия и смесь экстрагируют этилацетатом. Отделенный водный слой экстрагируют хлороформом и объединенный органический слой концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент: хлороформ/этилацетат=1/1, с последующим элюированием хлороформ/метанол=20/1-10/1). Полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=10/1-1/1). Полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=20/1-10/1), получая указанное в заголовке соединение (1,8 г).
1H-NMR (ДМСО-D6) δ: 11,71 (1Н, уш.с), 8,12 (1Н, с), 7,20 (1Н, дд, J=3,5; 2,4 Гц), 6,65 (1Н, дд, J=3,6; 1,9 Гц), 4,93-4,88 (1Н, м), 4,64-4,58 (1Н, м), 4,24-4,18 (1Н, м), 3,67 (2Н, с), 3,61 (1Н, д, J=12,8 Гц), 3,46-3,41 (1Н, м), 3,03-2,95 (1Н, м), 2,42-2,35 (1Н, м), 2,34-2,25 (1Н, м), 2,15-2,08 (1Н, м), 1,83-1,77 (1Н, м), 1,57-1,43 (1Н, м), 1,01 (3H, д, J=7,1 Гц).
[α]D=+168,10° (25°C, с=1,05, метанол)
[Получение 2]: Синтез соединения 2
[Химическая формула 37]
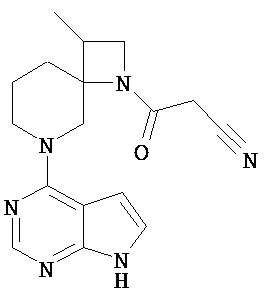
(1) 1-трет-Бутиловый 3-((Z)-бут-2-енил)овый диэфир пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 38]
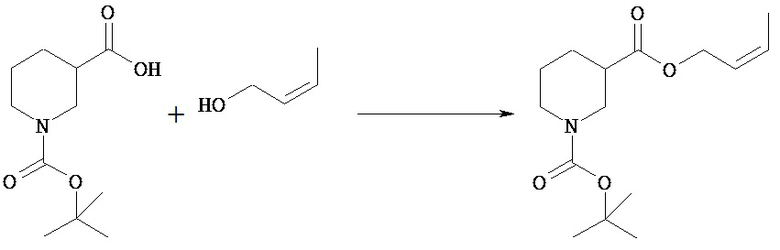
К раствору 1-(трет-бутоксикарбонил)-3-пиперидинекарбоновой кислоты (60,0 г) и 1-этил-3-(3-диметиламинопропил)карбодиимида (55,2 г) в хлороформе (600 мл) прибавляют 4-диметиламинопиридин (35,2 г) и перемешивают в течение 70 минут. К смеси прибавляют (7)-бут-2-ен-1-ол (26,8 мл) и смесь перемешивают при комнатной температуре в течение 14 часов. К реакционной смеси прибавляют воду (300 мл), насыщенный водный раствор хлорида натрия (100 мл) и смесь экстрагируют хлороформом. Отделенный органический слой концентрируют при пониженном давлении и к полученному остатку прибавляют этилацетат и н-гексан. Смесь промывают последовательно 3,5% водным раствором бисульфата калия три раза и насыщенным водным раствором хлорида натрия два раза. К отделенному органическому слою прибавляют силикагель (200 мл), смесь перемешивают и фильтруют через целит. Фильтрат концентрируют при пониженном давлении, и полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=9/1), получая указанное в заголовке соединение (68,3 г).
1H-NMR (ДМСО-D6) δ: 5,74-5,65 (1Н, м), 5,55-5,47 (1Н, м), 4,61 (2Н, д, J=6,8 Гц), 4,05-3,75 (1Н, м), 3,70-3,53 (1Н, м), 2,96-2,86 (2Н, м), 2,46-2,39 (1Н, м), 1,92-1,84 (1Н, м), 1,69-1,51 (6Н, м), 1,39 (9Н, с).
(2) 1-трет-Бутиловый эфир 3-(1-метилаллил)-пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 39]
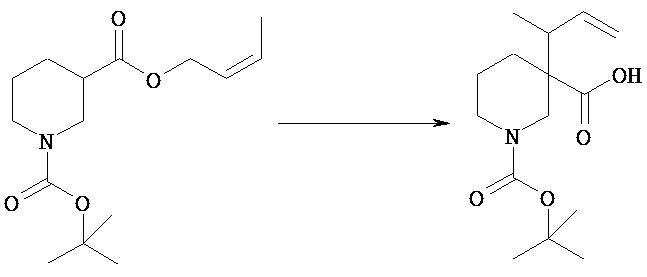
К раствору 3-((Z)-бут-2-енил)ового 1-трет-бутилового диэфира 3-(1-метилаллил)-пиперидин-1,3-дикарбоновой кислоты (68,3 г) в тетрагидрофуране(700 мл), охлажденному до -74°C, прибавляют гексаметилдисилазид лития (1,6 М тетрагидрофурановый раствор, 166 мл). Реакционную смесь нагревают до 0°C за 35 минут, перемешивают при той же температуре дополнительно в течение 25 минут и опять охлаждают до -74°C. К смеси прибавляют триметилсилилхлорид (39,6 мл). Реакционную смесь нагревают до комнатной температуры за 70 минут и перемешивают при той же температуре дополнительно 4 часа. К смеси последовательно прибавляют воду (600 мл), 2 М водный раствор гидроксида натрия (70 мл) и смесь промывают н-гексаном (600 мл). Отделенный водный слой подкисляют 2 М водным раствором соляной кислоты, затем трижды экстрагируют этилацетатом (300 мл, 200 мл, 150 мл). Объединенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (10/1), получая указанное в заголовке соединение (42,5 г).
1H-NMR (CDCl3) δ: 5,83-5,72 (1H, м), 5,09-5,06 (1Н, м), 5,05-5,02 (1Н, м), 4,33-3,90 (1Н, м), 3,73-3,63 (1Н, м), 3,31-2,73 (2Н, м), 2,43-2,34 (1Н, м), 2,07-1,97 (1Н, м), 1,64-1,56 (2Н, м), 1,54-1,42 (1Н, м), 1,45 (9Н, с), 1,05 (3H, д, J=7,3 Гц).
(3) Соль оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)-пиперидин-1,3-дикарбоновой кислоты и (S)-(+)-2-амино-2-фенилэтанола
[Химическая формула 40]
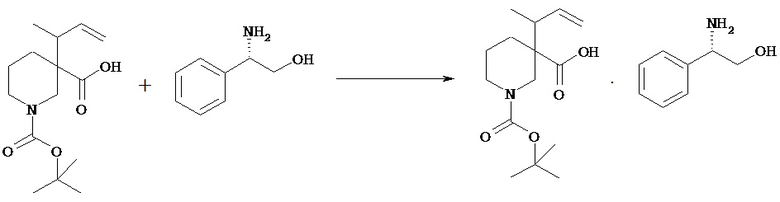
К раствору 1-трет-бутшового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (3,00 г) в 1,2-диметоксиэтане (30 мл) прибавляют (S)-(+)-2-амино-2-фенилэтанол (800 мг) и смесь перемешивают при комнатной температуре в течение ночи. Смесь-суспензию фильтруют и получают твердое вещество (1,8 г). К твердому веществу прибавляют 1,2-диметоксиэтан (45 мл) и смесь растворяют при 80°C. Смесь промывают, суспендируя, при комнатной температуре в течение 4 часов, получая указанное в заголовке соединение (1,46 г). Анализ методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с более длительным временем удерживания.
Изомер с меньшими временами удерживания (время удерживания 6,73 минут)
Изомер с более продолжительными временами удерживания (время удерживания 13,70 минут)
(4) Оптически активное соединение 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 41]

К соли оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (1,5 г) и (S)-(+)-2-амино-2-фенилэтанола (1,5 г) прибавляют этилацетат (15 мл) и воду (15 мл), смесь подкисляют, прибавляя бисульфат калия (567 мг). Отделенный водный слой дважды экстрагируют этилацетатом и объединенный органический слой два раза промывают 10% водным раствором бисульфата калия и один раз водой, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (1,02 г).
1H-NMR (CDCl3) δ: 5,83-5,72 (1Н, м), 5,09-5,06 (1Н, м), 5,05-5,02 (1Н, м), 4,33-3,90 (1Н, м), 3,73-3,63 (1Н, м), 3,31-2,73 (2Н, м), 2,43-2,34 (1Н, м), 2,07-1,97 (1Н, м), 1,64-1,56 (2Н, м), 1,54-1,42 (1Н, м), 1,45 (9Н, с), 1,05 (3H, д, J=7,3 Гц).
(5) Оптически активное соединение 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1-метилаллил)пиперидин-1-карбоновой кислоты
[Химическая формула 42]

К раствору оптически активного 1-трет-бутилового эфира 3-(1-метилаллил)пиперидин-1,3-дикарбоновой кислоты (1,02 г) и триэтиламина (967 мкл) в толуоле (10 мл), нагретому до 90°C, прибавляют по каплям дифенилфосфорилазид (1,1 мл). Реакционную смесь перемешивают при той же температуре в течение 1 часа и затем прибавляют бензиловый спирт (718 мкл) и 4-диметиламинопиридин (127 мг). Смесь перемешивают при кипячении с обратным холодильником в течение ночи, затем охлаждают до комнатной температуры, и прибавляют воду и этилацетат. Отделенный водный слой два раза экстрагируют этилацетатом и объединенный органический слой два раза промывают водой и один раз насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=50/1). Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=20/1-4/1), получая указанное в заголовке соединение (845 мг).
1H-NMR (ДМСО-D6) δ: 7,39-7,28 (5Н, м), 6,91-6,72 (1Н, м), 5,88-5,76 (1Н, м), 5,18-4,84 (4Н, м), 4,41-4,26 (1Н, м), 3,88-3,61 (1Н, м), 3,07-2,54 (2Н, м), 1,99-1,43 (3H, м), 1,35 (10H, с), 0,92-0,85 (3H, м).
(6) Оптически активный трет-бутиловый эфир 3-бензилоксикарбониламино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 43]

Через раствор оптически активного 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1-метилаллил)пиперидин-1-карбоновой кислоты (815 мг) в смеси хлороформ/метанол (6,6 мл/6,6 мл), охлажденный до -78°C, пропускают воздух, обогащенный озоном в течение 30 минут. В реакционную смесь прибавляют боргидрид натрия (318 мг) небольшими порциями и затем смесь нагревают до комнатной температуры в течение 40 минут. К смеси прибавляют насыщенный водный раствор бикарбоната натрия и смесь дважды экстрагируют хлороформом. Объединенный органический слой промывают водным раствором бикарбоната натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=3/2-0/1), получая указанное в заголовке соединение (406 мг).
1H-NMR (ДМСО-D6) δ: 7,39-7,27 (5Н, м), 6,74-6,55 (1Н, м), 5,17-4,83 (2Н, м), 4,53-4,41 (1Н, м), 4,32-3,93 (2Н, м), 3,76-3,47 (2Н, м), 3,26-3,00 (2Н, м), 2,95-2,68 (1Н, м), 2,30-2,00 (1Н, м), 1,83-1,66 (1Н, м), 1,64-1,44 (2Н, м), 1,36 (9Н, с), 0,92-0,77 (3H, м).
(7) Оптически активный трет-бутиловый эфир 3-амино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 44]

К раствору оптически активного трет-бутилового эфира 3-бензилоксикарбониламино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты (374 мг) в метаноле (6 мл) прибавляют 10% палладий на угле (38 мг) и смесь гидрируют при комнатной температуре при обычном давлении в течение 14 часов. Смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (269 мг).
1H-NMR (ДМСО-D6) δ: 4,83 (1Н, уш.с), 3,51-2,74 (4Н, м), 1,79-1,25 (7Н, м), 1,38 (9Н, с), 0,92 (3H, д, J=6,9 Гц).
(8) Оптически активный 1-бензиловый 6-трет-бутиловыи диэфир 3-метил-1,6-диазоспиро[3.5]нонан-1,6-дикарбоновой кислоты
[Химическая формула 45]

К раствору оптически активного трет-бутилового эфира 3-амино-3-(2-гидрокси-1-метилэтил)пиперидин-1-карбоновой кислоты (258 мг), трифенилфосфина (472 мг) и триэтиламина (502 мкл) в дихлорметане (7,7 мл), охлажденному до 0°C, прибавляют тетрабромистый углерод (596 мг). Реакционную смесь перемешивают при комнатной температуре в течение 2,5 часов и охлаждают до 4°C. Затем к смеси прибавляют триэтиламин (279 мкл) и бензилхлороформиат (267 мкл) и перемешивают в течение 40 минут. К смеси прибавляют воду и экстрагируют этилацетатом. Отделенный органический слой промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=20/1-2/1), получая указанное в заголовке соединение (85 мг).
1H-NMR (ДМСО-D6) δ: 7,40-7,29 (5Н, м), 5,07-4,98 (2Н, м), 4,20-4,11 (1Н, м), 3,99-3,83 (2Н, м), 3,39-3,20 (1Н, м), 3,13-2,83 (1Н, м), 2,58-2,45 (1Н, м), 2,44-2,32 (1Н, м), 2,16-2,07 (0,5Н, м), 2,01-1,82 (1,5Н, м), 1,68-1,58 (1Н, м), 1,39 (9Н, с), 1,37-1,28 (1Н, м), 1,14-1,03 (3H, м).
(9) Оптически активный 1-бензиловый эфир 3-метил-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 46]

К раствору оптически активного 1-бензилового 6-трет-бутиловото диэфира 3-метил-1,6-диазоспиро[3.5]нонан-1,6-дикарбоновой кислоты (78 мг) в хлороформе (2 мл), охлажденному до 4°C, прибавляют трифторуксусную кислоту (0,4 мл) и смесь нагревают до комнатной температуры и перемешивают дополнительно в течение 1 часа. Реакционную смесь подщелачивают, прибавляя 1 М водный раствор гидроксида натрия, и экстрагируют хлороформом. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (108 мг).
1H-NMR (ДМСО-D6) δ: 7,42-7,31 (5,0H, м), 5,20-4,99 (2,0H, м), 4,05-3,88 (1,0H, м), 3,64-3,55 (1,0H, м), 3,43-3,37 (0,5Н, м), 3,35-3,26 (0,5Н, м), 3,22-2,89 (3,0H, м), 2,39-2,29 (1,ОН, м), 2,22-2,13 (0,5Н, м), 2,07-1,49 (4,0H, м), 1,29-1,22 (0,5Н, м), 1,15 (1,5Н, д, J=6,9 Гц). 1,01-0,91 (0,5Н, м).
(10) Оптически активное соединение бензилового эфира 3-метил-6-(7Н-пирроло[2,3-(1]пиримидин-4-ил)-1,6-диазоспиро[3,5]нонан-1-карбоновой кислоты
[Химическая формула 47]

Оптически активный 1-бензиловый эфир 3-метил-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты (108 мг) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (32 мг), карбонатом калия (86 мг) и водой (2,1 мл) и перемешивают в течение ночи при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры и экстрагируют хлороформом. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=2/1-0/1, затем хлороформ/метанол=9/1), получая указанное в заголовке соединение (48 мг).
1H-NMR (ДМСО-D6) 6: 11,69 (1,ОН, уш.с), 8,15 (1,ОН, с), 7,41-7,27 (5,ОН, м), 7,18 (1,0H, дд, J=3,4, 2,6 Гц), 6,64-6,59 (1,0H, м), 5,09-4,92 (3,5Н, м), 4,63-4,55 (1,0H, м), 4,01-3,85 (1,0H, м), 3,45-3,39 (0,5Н, м), 3,35-3,27 (0,5Н, м), 3,25-3,20 (0,5Н, м), 2,99-2,84 (1,0H, м), 2,46-2,38 (1,0H, м), 2,35-2,25 (0,5Н, м), 2,20-2,10 (0,5Н, м), 2,03-1,95 (1,0H, м), 1,88-1,79 (1,0H, м), 1,66-1,52 (1,0H, м), 0,93 (3,0H, д, J=6,9 Гц).
(11) Оптически активное соединение 4-(3-метил-1,6-диазоспиро[3,5]нон-6-ил)-7Н-пирроло[2,3-(1]пиримидина
[Химическая формула 48]

К раствору оптически активного бензилового эфира 3-метил-6-(7Н-пирроло[2,3-(1]пиримидин-4-ил)-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты (46 мг) в смеси метанол/тетрагидрофуран (1,8 мл/1,8 мл) прибавляют 10% палладий на угле (15 мг) и гидрируют при давлении 4 атмосферы в течение 14 часов. Смесь фильтруют через целит, фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (27 мг).
1H-NMR (ДМСО-D6) δ: 11,73 (1Н, уш.с), 8,17 (1Н, с), 7,21 (1Н, дд, J=3,3; 2,0 Гц), 6,64-6,61 (1Н, м), 4,35 (0,5Н, уш.с), 4,09 (0,5Н, уш.с), 4,03 (1Н, д, J=13,5 Гц), 3,97 (1Н, д, J=13,2 Гц), 3,83-3,70 (2Н, м), 3,47-3,40 (1Н, м), 3,23-3,18 (1Н, м), 2,48-2,43 (1Н, м), 1,97-1,83 (2Н, м), 1,77-1,57 (2Н, м), 1,04 (3H, д, J=7,3 Гц).
(12) Оптически активный 3-[3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3,5]нон-1-ил]-3-оксопропионитрил
[Химическая формула 49]

Оптически активный 4-(3-метил-1,б-диазоспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-о]пиримидин (25 мг) смешивают с 1-цианоацетил-3,5-диметилпиразолом (32 мг) и 1,4-диоксаном (750 мкл) и смесь перемешивают при 100°C в течение 3,5 часов. Смесь охлаждают до комнатной температуры, прибавляют воду и насыщенный водный раствор бикарбоната натрия и экстрагируют этилацетатом. Отделенный водный слой пять раз экстрагируют этилацетатом и объединенный органический слой промывают водой и концентрируют при пониженном давлении. Полученный остаток очищают тонкослойной хроматографией на силикагеле (элюент:хлороформ/метанол=9/1). Полученный остаток также очищают тонкослойной хроматографией на силикагеле (элюент:этилацетат/метанол=93/7). Полученное твердое вещество (8,0 мг) промывают, суспендируя, раствором н-гексан/этилацетат, получая указанное в заголовке соединение (6,7 мг).
1H-NMR (ДМСО-D6) δ: 11,70 (1Н, уш.с), 8,14 (1Н, с), 7,19 (1Н, дд, J=3,5; 2,4 Гц), 6,64 (1Н, дд, J=3,6; 1,9 Гц), 5,03-4,96 (1Н, м), 4,66-4,59 (1Н, м), 4,11-4,06 (1Н, м), 3,70 (1Н, д, J=18,7 Гц), 3,65 (1Н, д, J=18,7 Гц), 3,60-3,55 (1Н, м), 3,45 (1Н, д, J=13,0 Гц), 2,97-2,89 (1Н, м), 2,46-2,41 (1Н, м), 2,40-2,34 (1Н, м), 2,00-1,94 (1Н, м), 1,88-1,80 (1Н, м), 1,64-1,51 (1Н,м), 0,91 (3H, д, J=7,1 Гц).
[α]]D=+202,79° (25°C, с=1,04, метанол)
[Получение 3]: Синтез соединения 3
[Химическая формула 50]
(1) 3-Аллиловый 1-трет-бутиловый диэфир пиперидин-1,3-дикарбоновой кислоты [Химическая формула 51]
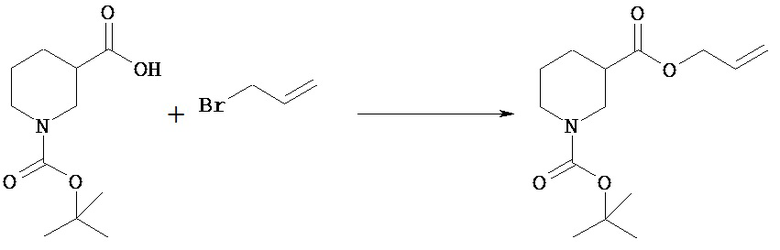
К раствору 1-(трет-бутоксикарбонил)-3-пиперидинкарбоновой кислоты (50,0 г) в N,N-диметилформамиде (500 мл) прибавляют карбонат калия (60,3 г) и аллилбромид (28,3 мл) и перемешивают смесь при комнатной температуре в течение 3 часов. К реакционной смеси прибавляют воду (600 мл) и смесь экстрагируют этилацетатом (600 мл). Органический слой промывают последовательно водой (600 мл) и насыщенным водным раствором хлорида натрия (400 мл). Отделенный водный слой также экстрагируют этилацетатом (300 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. К раствору полученного остатка в смеси н-гексан/этилацетат (4/1, 400 мл) прибавляют силикагель (70 г) и перемешивают при комнатной температуре. Смесь фильтруют и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (62,5 г).
1H-NMR (CDCl3) δ: 5,97-5,85 (1Н, м), 5,36-5,20 (2Н, м), 4,63-4,55 (2Н, м), 4,34-4,01 (1Н, м), 3,97-3,86 (1Н, м), 3,16-2,88 (1Н, м), 2,86-2,77 (1Н, м), 2,53-2,43 (1Н, м), 2,11-2,02 (1Н, м), 1,75-1,57 (2Н, м), 1,52-1,39 (1Н, м), 1,46 (9Н, с).
(2) трет-Бутиловый эфир 3-аллилпиперидин-1,3-дикарбоновой кислоты
[Химическая формула 52]
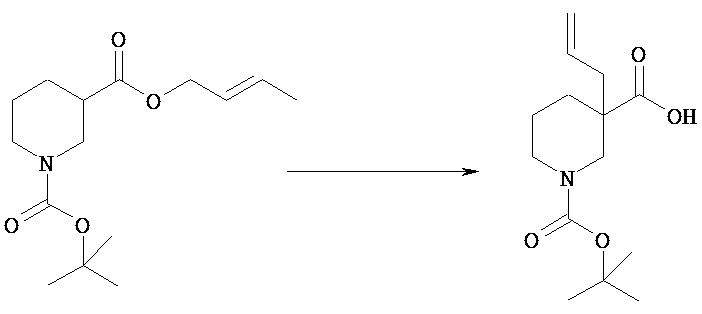
К раствору 3-аллилового 1-трет-бутлотго диэфира пиперидин-1,3-дикарбоновой кислоты (62,5 г) в тетрагидрофуране (625 мл), охлажденному до -72°С, прибавляют гексаметилдисилазид лития (1,6М раствор в тетрагидрофуране, 160 мл). Смесь перемешивают при той же температуре в течение 30 минут, затем реакционную смесь нагревают до 0°С в течение 12 минут и опять охлаждают до -67°С. К смеси прибавляют триметилсилилхлорид (35,2 мл). Реакционную смесь нагревают до 2,5°С в течение 1 часа и перемешивают при той же температуре в течение дополнительных 2 часов. К смеси прибавляют последовательно метанол (250 мл) и 1 М водный раствор гидроксида натрия (250 мл), смесь промывают н-гексаном (940 мл). Отделенный водный слой так же промывают н-гексаном (250 мл). Отделенный водный слой подкисляют 1М водным раствором соляной кислоты и затем экстрагируют этилацетатом (800 мл). Органический слой промывают последовательно водой (800 мл) и насыщенным водным раствором хлорида натрия (400 мл), отделенный водный слой также экстрагируют этилацетатом (500 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток - промывают, суспендируя, смесью н-гексан/этилацетат (10/1, 660 мл), получая указанное в заголовке соединение (53,4 г).
1H-NMR (CDCl3) δ: 5,81-5,69 (1Н, м), 5,14-5,06 (2Н, м), 3,93-3,78 (1Н, м), 3,54-3,45 (1Н, м), 3,29-3,14 (2Н, м), 2,43-2,34 (1Н, м), 2,29-2,21 (1Н, м), 2,07-1,98 (1Н, м), 1,65-1,49 (3H, м),1,45(9Н,с).
(3) Оптически активный трет-бутиловый эфир 3-аллилпиперидин-1,3-дикарбоновой кислоты
[Химическая формула 53]
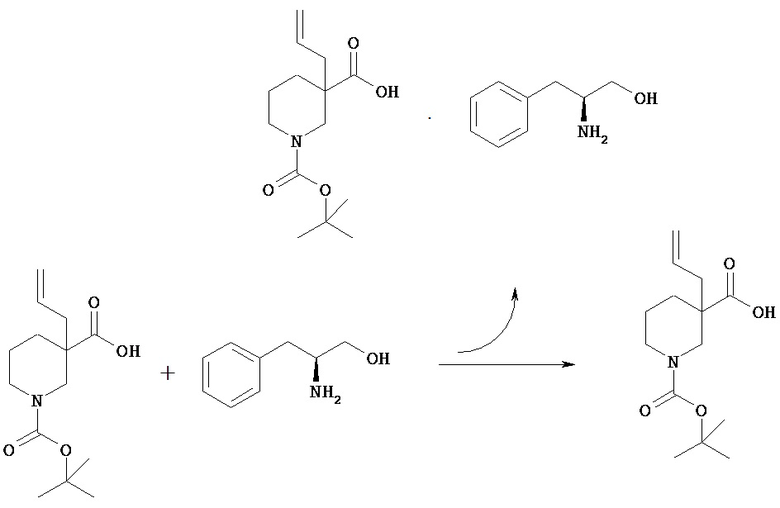
(3)-(1) Затравочные кристаллы соли оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (S)-(-)-2-амино-3-фенил-1-пропанолом
1-трет-Бутиловый эфир 3-аллилпиперидин-1,3-дикарбоновой кислоты (3,0 г) смешивают с изопропилацетатом (30 мл) и смесь нагревают до 80°C для растворения. К смеси прибавляют (S)-(-)-2-амино-3-фенил-1-пропанол (1,01 г) и перемешивают при комнатной температуре в течение 21 часа. Смесь-суспензию фильтруют, полученное твердое вещество промывают изопропилацетатом (8 мл) и сушат при пониженном давлении, получая указанное в заголовке соединение (1,5 г). Фильтрат концентрируют при пониженном давлении и используют в (4)-(1).
(3)-(2) Соль оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (S)-(-)-2-амино-3-фенил-1-пропанолом
[Химическая формула 54]
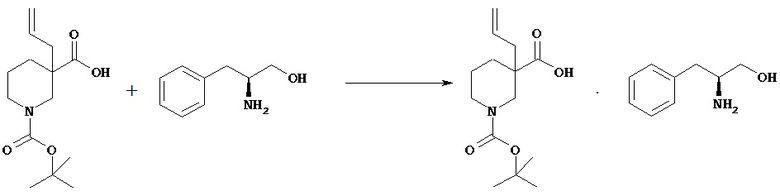
К раствору 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты в изопропилацетате (733 мл), нагретому до 80°C, прибавляют (S)-(-)-2-амино-3-фенил-1-пропанол (24,7 г). Полученный смешанный раствор охлаждают до комнатной температуры. Затем к смеси прибавляют затравочный кристалл, полученный в (3)-(1), и смесь перемешивают в течение ночи. Смесь-суспензию фильтруют, и полученное твердое вещество промывают изопропилацетатом (210 мл), получая указанное в заголовке соединение (37,4 г). Анализ методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с меньшими временами удерживания.
Изомер с меньшими временами удерживания (время удерживания 6,01 минут). Изомер с более длительными временами удерживания (время удерживания 8,94 минут).
(3)-(3) Оптически активный 1-трет-бутиловый эфир 3-аллилпиперидин-1,3-дикарбоновой кислоты из фильтрата (3)-(2)
Фильтрат (3)-(2) объединяют с промывным раствором и прибавляют водный раствор бисульфата калия (22,2 г/365 мл) и смесь перемешивают.Отделенный органический слой промывают последовательно 10% водным раствором бисульфата калия, водой, насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (49 г).
1H-NMR (CDCl3) δ: 5,81-5,69 (1Н, м), 5,14-5,06 (2Н, м), 3,93-3,78 (1Н, м), 3,54-3,45 (1Н, м), 3,29-3,14 (2Н, м), 2,43-2,34 (1М, м), 2,29-2,21 (1Н, м), 2,07-1,98 (1Н, м), 1,65-1,49 (3H, м), 1,45 (9Н, с).
(4) Соль оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (R)-(+)-2-амино-3-фенил-1-пропанолом
[Химическая формула 55]
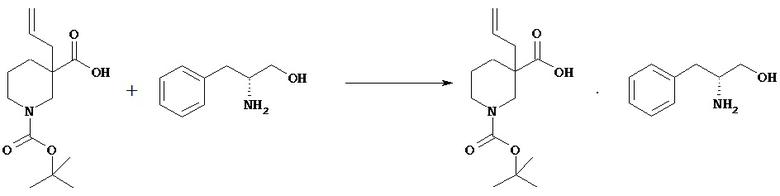
(4)-(1) Кристалл-затравка соли оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (R)-(+)-2-амино-3-фенил-1-пропанолом.
К остатку (2,74 г), полученному из фильтрата (3)-(1), прибавляют этилацетат (14 мл) и воду (14 мл) и смесь охлаждают до 0°C. Затем к смеси прибавляют бисульфат калия (494 мг). Смесь перемешивают при комнатной температуре в течение 30 минут и затем экстрагируют этилацетатом. Органический слой промывают последовательно 10% водным раствором бисульфата калия, водой (дважды) и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток (1,94 г) смешивают с изопропилацетатом (20 мл), и смесь нагревают до 80°C для растворения. К смеси прибавляют (R)-(+)-2-амино-3-фенил-1-пропанол (925 мг) и перемешивают при комнатной температуре в течение 19,5 часов, смесь-суспензию фильтруют, и полученное твердое вещество сушат при пониженном давлении, получая указанное в заголовке соединение (1,85 г).
(4)-(2) Соль оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (R)-(+)-2-амино-3-фенил-1-пропанолом
Остаток (49 г), полученный в (3)-(3), и изопропилацетат (490 мл) объединяют и смесь нагревают до 80°C для растворения. К смеси прибавляют (R)-(+)-2-амино-3-фенил-1-пропанол (23,7 г) и охлаждают до комнатной температуры. Затем прибавляют кристалл-затравку, полученный в (4)-(1) и смесь перемешивают в течение ночи. Смесь-суспензию фильтруют и промывают изопропилацетатом (150 мл), получая указанное в заголовке соединение (52 г). Анализ методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с более длительными временами удерживания.
Изомер с меньшими временами удерживания (время удерживания 6,01 минут)
Изомер с более длительными временами удерживания (время удерживания 8,94 минут)
(5) Оптически активный 1-трет-бутиловый эфир 3-аллилпиперидин-1,3-дикарбоновой кислоты
[Химическая формула 56]
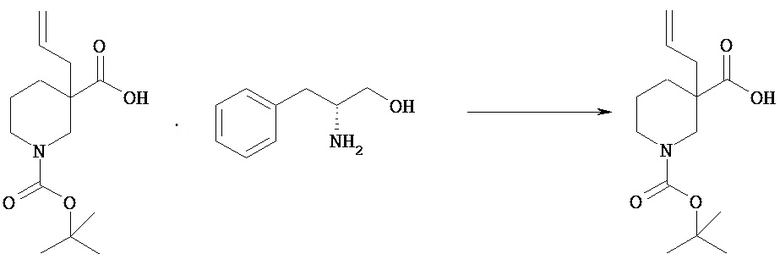
К соли оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты с (R)-(+)-2-амино-3-фенил-1-пропанолом (52 г), полученной в (4)-(2), прибавляют этилацетат (260 мл) и водный раствор бисульфата калия (20,2 г/260 мл) и смесь перемешивают. Отделенный органический слой промывают последовательно 10% водным раствором бисульфата калия, водой и насыщенным водным раствором хлорида натрия. Отделенный водный слой также экстрагируют этилацетатом (130 мл), и промывают последовательно водой и насыщенным водным раствором хлорида натрия. Объединенный органический слой концентрируют при пониженном давлении, получая указанное в заголовке соединение (32,2 г).
1H-NMR (CDCl3) δ: 5,81-5,69 (1Н, м), 5,14-5,06 (2Н, м), 3,93-3,78 (1Н, м), 3,54-3,45 (1Н, м), 3,29-3,14 (2Н, м), 2,43-2,34 (1Н, м), 2,29-2,21 (1Н, м), 2,07-1,98 (1Н, м), 1,65-1,49 (3H, м), 1,45 (9Н, с).
(6) Оптически активный 1-трет-бутиловый эфир 3-аллил-3-бензилоксикарбониламинопиперидин-1-карбоновой кислоты
[Химическая формула 57]
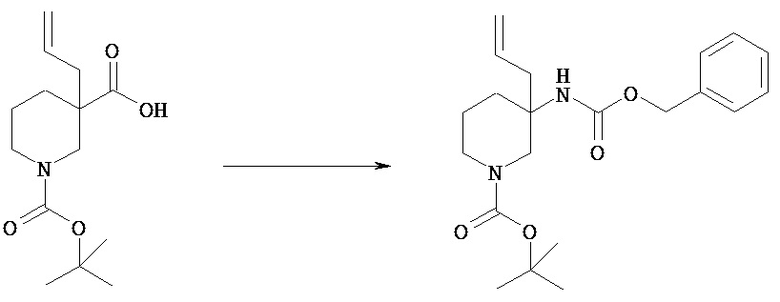
К раствору оптически активного 1-трет-бутилового эфира 3-аллилпиперидин-1,3-дикарбоновой кислоты (32,2 г) и триэтиламина (33,2 мл) в толуоле (320 мл), нагретому до 80°C, прибавляют по каплям дифенилфосфорилазид (33,4 мл) в течение 50 минут. Реакционную смесь перемешивают при той же температуре в течение 2 часов и охлаждают до комнатной температуры. К смеси прибавляют бензиловый спирт (24,6 мл) и 4-диметиламинопиридин (2,9 г), перемешивают при 100°C в течение 21 часа и охлаждают до комнатной температуры. Затем прибавляют этанол (200 мл) и воду (200 мл) и смесь экстрагируют н-гексаном (200 мл). Отделенный органический слой промывают последовательно насыщенным водным раствором хлорида аммония (200 мл), насыщенным водным раствором хлорида натрия (150 мл) и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=1/0-6/1), получая указанное в заголовке соединение (39,4 г).
1H-NMR (ДМСО-d6) δ: 7,39-7,27 (5Н, м), 6,90-6,68 (1Н, м), 5,75-5,63 (1Н, м), 5,13-4,85 (4Н, м), 4,07-3,94 (0,5Н, м), 3,63-3,47 (1Н, м), 3,39-3,12 (1Н, м), 3,11-2,88 (1,5Н, м), 2,79-2,54 (1Н, м), 2,28-2,01 (1Н, м), 1,79-1,66 (1Н, м), 1,63-1,45 (3Н, м). 1,36 (9Н, с).
(7) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(2-гидроксиэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 58]
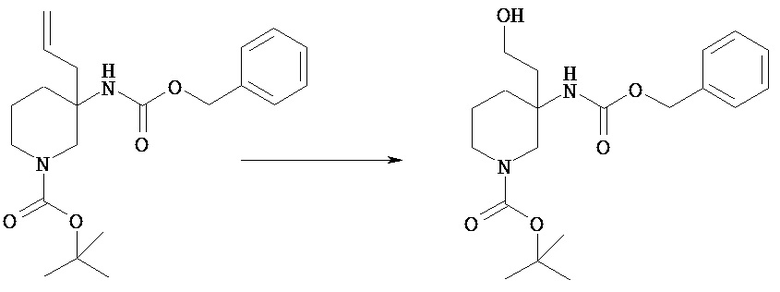
Через раствор оптически активного 1-трет-6утилового эфира 3-аллил-3-бензилоксикарбониламинопиперидин-1-карбоновой кислоты (39,4 г) в смеси хлороформ/метанол (493 мл/493 мл), охлажденный до -78°C, пропускают воздух, обогащенный озоном в течение 1 часа. К реакционной смеси прибавляют боргидрид натрия (19,9 г) небольшими порциями и нагревают до 4°C в течение 50 минут. К смеси прибавляют насыщенный водный раствор бикарбоната натрия (200 мл), воду (400 мл) и смесь экстрагируют хлороформом (200 мл). Отделенный водный слой также экстрагируют хлороформом (300 мл) и объединенный органический слой концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (1/1, 394 мл) и получают твердое вещество (23,5 г). Фильтрат концентрируют при пониженном давлении, и полученный остаток также промывают, суспендируя, раствором н-гексан/этилацетат (1/1), получая твердое вещество (2,4 г). Затем фильтрат концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=1/1-0/1), получая твердое вещество (1,5 г). Твердые вещества объединяют, получая указанное в заголовке соединение (27,4 г).
1H-NMR (ДМСО-D6) δ: 7,39-7,26 (5Н, м), 6,90-6,62 (1Н, м), 5,12-4,87 (2Н, м), 4,36 (1Н, т, J=4,9 Гц), 4,00-2,96 (6Н, м), 2,15-1,72 (2Н, м), 1,72-1,46 (2Н, м), 1,46-1,17 (2Н, м), 1,36 (9Н, с).
(8) Оптически активный трет-бутиловый эфир 3-амино-3-(2-гидроксиэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 59]
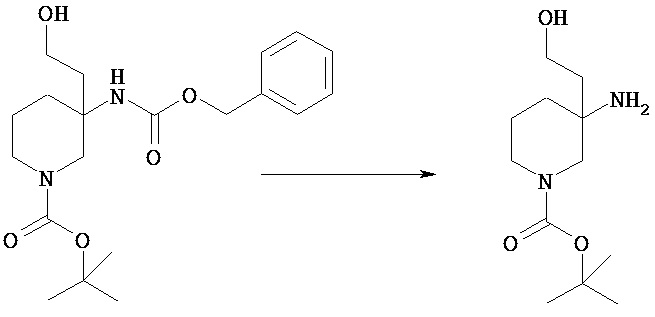
К раствору оптически активного трет-бутилового эфира 3-бензилоксикарбониламино-3-(2-гидроксиэтил)пиперидин-1-карбоновой кислоты (27,2 г) в метаноле (544 мл) прибавляют 10% палладий на угле (2,7 г) и смесь гидрируют при обычном давлении в течение 5 часов. Смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (17,2 г).
1H-NMR (ДМСО-D6) δ: 3,58-3,53 (2Н, м), 3,43-2,85 (5Н, м), 1,63-1,24 (6Н, м), 1,39 (9Н. с).
(9) Оптически активный 1-бензиловый 6-трет-бутиловый диэфир 1,6-диазоспиро[3.5]-нонан-1,6-дикарбоновой кислоты
[Химическая формула 60]
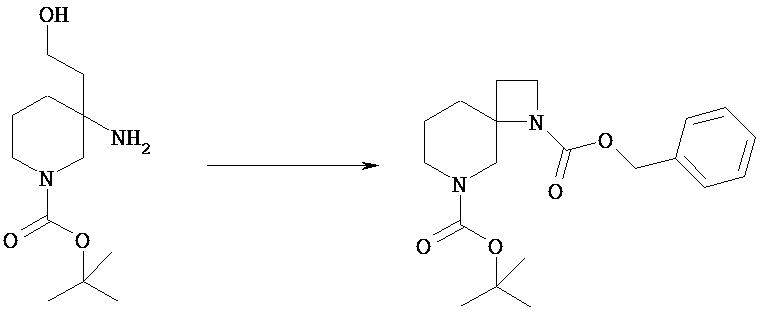
К раствору оптически активного 6-трет-бутиловото эфира 3-амино-3-(2-гидроксиэтил)пиперидин-1-карбоновой кислоты (6,46 г), трифенилфосфина (12,5 г) и триэтиламина (13,3 мл) в дихлорметане (226 мл), охлажденному до 0°C, прибавляют тетрабромид углерода (15,8 г). Реакционную смесь перемешивают при комнатной температуре в течение 40 минут и опять охлаждают до 0°C. Затем к смеси прибавляют триэтиламин (5,5 мл) и бензилхлорформиат (4,9 мл) и смесь перемешивают в течение 3,5 часов при комнатной температуре. К смеси прибавляют воду (200 мл) и экстрагируют хлороформом (100 мл). Органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=5/1), получая указанное в заголовке соединение (5,35 г).
1H-NMR (ДМСО-D6) δ: 7,40-7,29 (5Н, м), 5,07-4,98 (2Н, м), 4,10-3,96 (1Н, м), 3,91-3,69 (3H, м), 2,64-2,53 (1Н, м), 2,13-1,83 (4Н, м), 1,66-1,54 (1Н, м), 1,43-1,27 (2Н, м), 1,39 (9Н, с).
(10) Оптически активный бензиловый эфир 1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты [0421]
[Химическая формула 61]
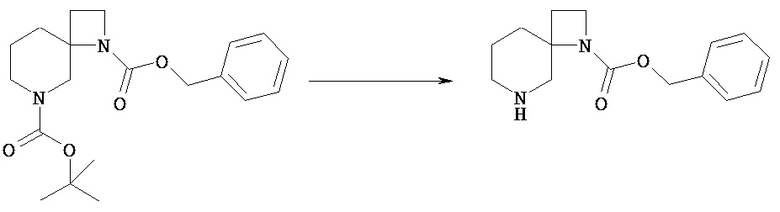
К раствору оптически активного 1-бензилового 6-трет-бутилового диэфира 1,6-диазоспиро[3.5]-нонан-1,6-дикарбоновой кислоты (5,35 г) в хлороформе (134 мл), охлажденному до 0°C, прибавляют трифторуксусную кислоту (27 мл) и смесь перемешивают в течение 30 минут, нагревают до комнатной температуры и дополнительно перемешивают 30 минут. Реакционную смесь охлаждают до 0°C и прибавляют 4М водный раствор гидроксида натрия (91 мл). Водный слой дважды экстрагируют хлороформом (100 мл, 50 мл), объединенный органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=20/1-4/1), получая указанное в заголовке соединение (2,37 г).
1H-NMR (ДМСО-D6) δ: 7,41-7,28 (5Н, м), 5,09-4,96 (2Н, м), 3,83-3,76 (1Н, м), 3,73-3,66 (1Н, м), 2,94-2,69 (3H, м), 2,38-2,15 (2Н, м), 2,12-1,77 (4Н, м), 1,58-1,45 (1Н, м), 1,38-1,26 (1Н, м).
(11) Оптически активный бензиловый эфир 6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 62]
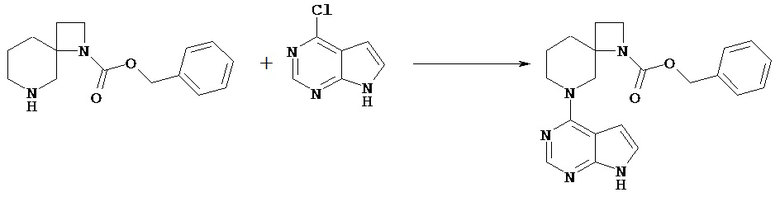
Оптически активный бензиловый эфир 1,6-диазоспиро[3.5]нонан-1-карбоновой кислоты (2,37 г) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (1,4 г), карбонатом калия (3,8 г) и водой (71 мл), нагревают до 100°C и перемешивают в течение 3 часов. Смесь охлаждают до комнатной температуры. Затем прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (1/1), получая указанное в заголовке соединение (2,55 г).
1H-NMR (ДМСО-D6) δ: 11,72 (1Н, с), 8,13 (1Н, с), 7,41-7,28 (5Н, м), 7,19 (111, дд, J=3,5; 2,6 Гц), 6,64-6,60 (1Н, м), 5,13-5,02 (2Н, м), 4,96-4,89 (1Н, м), 4,64-4,56 (1Н, м), 3,98-3,70 (2Н, м), 3,46-3,28 (1Н, м), 3,01-2,82 (1Н, м), 2,31-2,22 (0,5Н, м), 2,16-2,06 (0,5Н, м). 2,03-1,90 (3H, м), 1,83-1,75 (1Н, м), 1,61-1,47 (1Н, м).
(12) Оптически активный 4-(1,6-диазоспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-d]пиримидин
[Химическая формула 63]
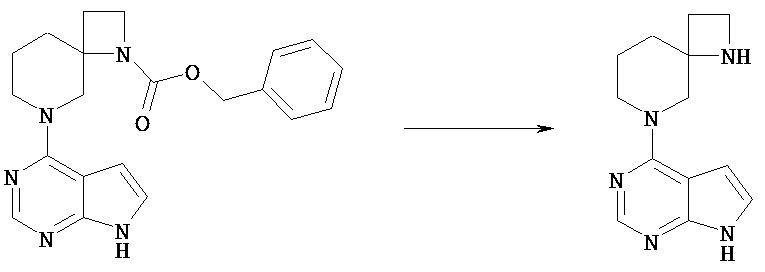
К раствору оптически активного бензилового эфира 6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3,5]нонан-1-карбоновой кислоты (2,55 г) в смеси метанол/тетрагидрофуран (51 мл/51 мл) прибавляют 20% палладий на угле (510 мг) и смесь гидрируют под давлением 4 атмосферы в течение 5 часов. Смесь фильтруют через целит, и фильтрат концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, диизопропиловым эфиром (30 мл), получая указанное в заголовке соединение (1,55 г).
1H-NMR (ДМСО-D6) δ: 11,68 (1Н, ш.с), 8,12 (1Н, с), 7,18 (1Н, д, J=2,6 Гц), 6,61 (1Н, д, J=3,2 Гц), 4,18 (1Н, д, J=12,8 Гц), 4,00-3,93 (1Н, м), 3,59 (1Н, д, J=12,8 Гц), 3,54-3,47 (1Н, м), 3,42-3,16 (3H, м), 2,03-1,82 (3Н, м), 1,72-1,62 (2Н, м), 1,57-1,46 (1Н, м).
(13) Оптически активный 3-оксо-3-[6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.5]нон-1-ил]пропионитрил
[Химическая формула 64]
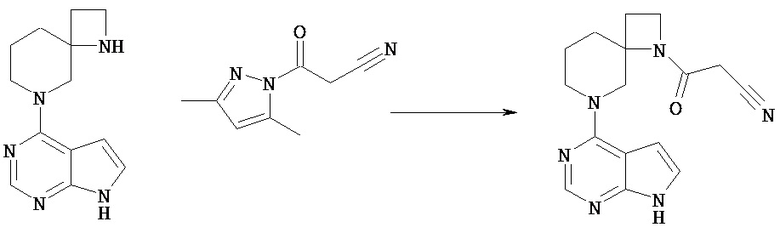
Оптически активный 4-(1,6-диазоспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-d]пиримидин (1,55 г) смешивают с 1-цианоацетил-3,5-диметилпиразолом (1,56 г), N,N-диизопропилэтиламином (1,66 мл) и 1,4-диоксаном (31 мл), смесь нагревают до 100°C, перемешивают в течение 2 часов и охлаждают до комнатной температуры. Затем прибавляют насыщенный водный раствор бикарбоната натрия, и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:этилацетат/метанол=20/1-9/1), получая указанное в заголовке соединение (1,50 г).
1H-NMR (ДМСО-D6) δ: 11,73 (1Н, ш.с), 8,13 (1Н, с), 7,22-7,18 (1Н, м), 6,67-6,63 (1Н, м), 4,96 (1Н, д, J=12,6 Гц), 4,68-4,60 (1Н, м), 4,11-4,03 (1Н, м), 4,01-3,93 (1Н, м), 3,71 (2Н, с), 3,53 (1Н, д, J=12,6 Гц), 2,98-2,88 (1Н, м), 2,40-2,30 (1Н, м), 2,03-1,90 (3H, м), 1,83-1,75 (1Н, м), 1,59-1,45 (1Н,м).
[α]D=+210,00° (25°C, с=1,01, метанол) [Получение 4]: Синтез соединения 4
[Химическая формула 65]
(1) 1-трет-бутиловый 3-(3,3-дифтораллил)овый диэфир пирролидин-1,3-дикарбоновой кислоты
[Химическая формула 66]
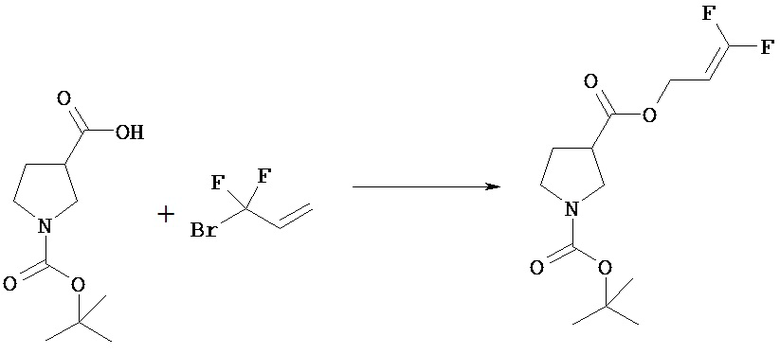
К раствору 1-трет-бутилового эфира пирролидин-1,3-дикарбоновой кислоты (3,40 г) в N,N-диметилформамиде (34 мл) прибавляют карбонат калия (4,37 г) и 3-бром-3,3-дифторпропен (1,93 мл) и смесь перемешивают при 60°C в течение 6 часов. К реакционной смеси прибавляют воду и смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=5/1), получая указанное в заголовке соединение (3,73 г).
1H-NMR (CDCl3) δ: 4,64-4,48 (3H, м), 3,67-3,42 (3H, м), 3,41-3,29 (1Н, м), 3,10-2,98 (1Н, м), 2,18-2,04 (2Н, м), 1,46 (9Н, с).
(2) 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты
[Химическая формула 67]
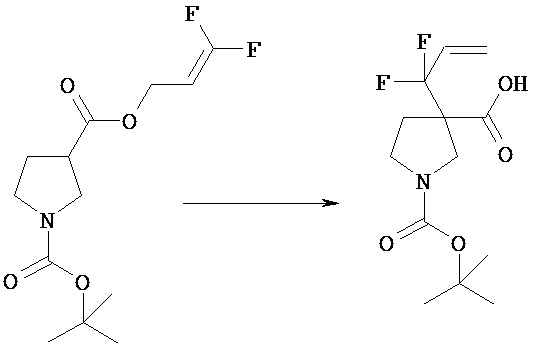
К раствору 1-трет-бутилового 3-(3,3-дифтораллил)ового диэфира пирролидин-1,3-дикарбоновой кислоты (3,73 г) в тетрагидрофуране (37 мл), охлажденному до -78°C, прибавляют гексаметилдисилазид лития (1,0 М раствор в тетрагидрофуране, 14 мл). Реакционную смесь нагревают до 0°C в течение 4 минут, перемешивают при той же температуре дополнительно в течение 14 минут и затем опять охлаждают до -78°C. К смеси прибавляют триметилсилилхлорид (2,0 мл). Реакционную смесь нагревают до комнатной температуры и дополнительно перемешивают при той же температуре 3 часа. Доводят pH реакционной смеси до pH 8-9, прибавляя воду, затем 2 М водный раствор гидроксида натрия и промывают смесью н-гексан/диэтиловый эфир (4/3). К отделенному органическому слою прибавляют н-гексан и смесь экстрагируют 2 М водным раствором гидроксида натрия. Объединенный водный слой 7 раз промывают смесью н-гексан/диэтиловый эфир (4/3), подкисляют 10% водным раствором лимонной кислоты и экстрагируют этилацетатом. Органический слой концентрируют при пониженном давлении, полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (5/1) и получают указанное в заголовке соединение (2,00 г).
1H-NMR (ДМСО-D6) δ: 13,47 (1Н, ш.с), 6,23-6,09 (1Н, м), 5,71-5,64 (1Н, м), 5,63-5,58 (1Н, м), 3,79-3,72 (1Н, м), 3,47-3,28 (2Н, м), 3,26-3,15 (1Н, м), 2,36-2,25 (1Н, м), 2,21-2,06 (1Н, м), 1,39 (9Н, с).
(3) Оптически активный 1-трет-бутповъш эфир 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты
[Химическая формула 68]
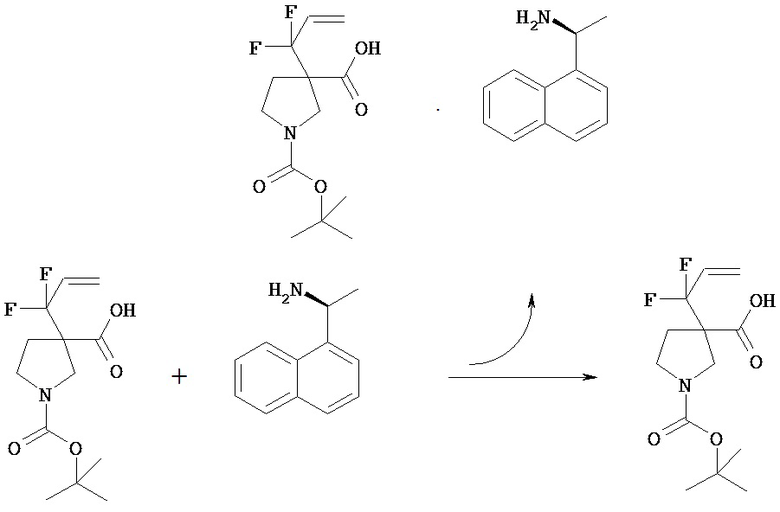
Оптически активный 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты (1,5 г), (S)-(-)-1-(1-нафтил)этиламин (826 мкл) и изопропилацетат (15 мл) объединяют и смесь перемешивают при комнатной температуре в течение 21 часа. Смесь-суспензию фильтруют для удаления твердого вещества. Фильтрат концентрируют при пониженном давлении и полученный остаток смешивают с этилацетатом (20 мл) и 10% водным раствором бисульфата калия (20 мл). Смесь перемешивают при 0°C в течение 1 часа. Отделенный органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (869 мг).
1H-NMR (ДМСО-D6) δ: 13,47 (1Н, ш.с), 6,23-6,09 (1Н, м), 5,71-5,64 (1Н, м), 5,63-5,58 (1Н, м), 3,79-3,72 (1Н, м), 3,47-3,28 (2Н, м), 3,26-3,15 (1Н, м), 2,36-2,25 (1Н, м), 2,21-2,06 (1Н, м), 1,39 (9Н,с).
(4) Соль оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты с (R)-(+)-1-(1-нафтил)этиламином
[Химическая формула 69]
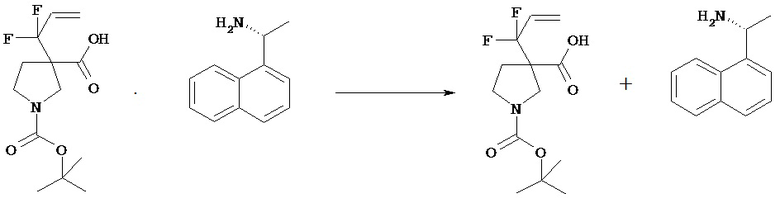
Остаток (869 мг), полученнный в (3), смешивают с (R)-(+)-1-(1-нафтил)этиламином (263 мкл) и изопропилацетатом (13 мл) и смесь перемешивают при комнатной температуре в течение ночи. Полученную смесь-суспензию фильтруют и полученное твердое вещество промывают изопропилацетатом (3 мл), получая указанное в заголовке соединение (754 мг). ВЭЖХ анализ твердого вещества в условиях 1 показал, что основным продуктом является изомер с более длительными временами удерживания.
Изомер с меньшими временами удерживания (время удерживания 5,32 минуты).
Изомер с более длительными временами удерживания (время удерживания 7,01 минут).
(5) Оптически активный 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты
[Химическая формула 70]
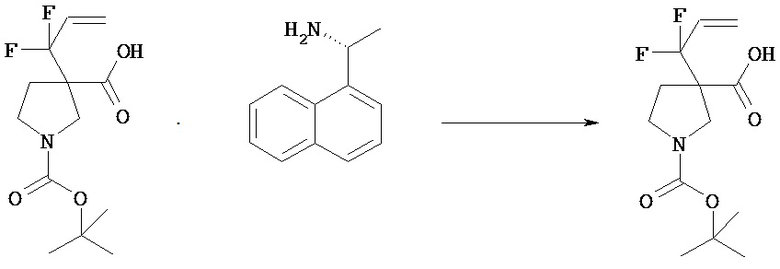
Соль оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты с (R)-(+)-1-(1-нафтил)этиламином (741 мг) смешивают с этилацетатом (7,4 мл) и водой (3,7 мл) и смесь подкисляют, прибавляя бисульфат калия (261 мг). Отделенный органический слой промывают насыщенным водным раствором хлорида натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (457 мг).
1H-NMR (ДМСО-D6) δ: 13,47 (1Н, ш.с), 6,23-6,09 (1Н, м), 5,71-5,64 (1Н, м), 5,63-5,58 (1Н, м), 3,79-3,72 (1Н, м), 3,47-3,28 (2Н, м), 3,26-3,15 (1Н, м), 2,36-2,25 (1Н, м), 2,21-2,06 (1Н, м), 1,39 (9Н,с).
(6) Оптически активный 1-трет-бутиповъм эфир 3-бензилоксикарбониламино-3-(1,1-дифтораллил)пирролидин-1-карбоновой кислоты
[Химическая формула 71]
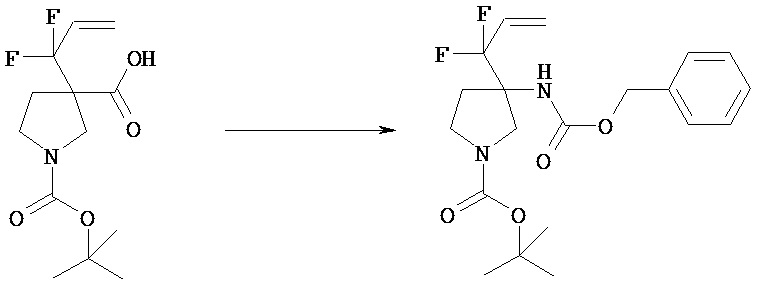
К раствору оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пирролидин-1,3-дикарбоновой кислоты (10,6 г) и триэтиламина (10,2 мл) в толуоле (106 мл), нагретому до 100°C, прибавляют по каплям дифенилфосфорилазид (10,2 мл). Реакционную смесь перемешивают при 100°C в течение 50 минут и затем прибавляют бензиловый спирт (5,6 мл) и 4-диметиламинопиридин (0,89 г). Смесь перемешивают при 100°C в течение 16,5 часов и затем охлаждают до комнатной температуры. Затем и прибавляют 5% водный раствор бисульфата калия и смесь экстрагируют толуолом. Органический слой промывают последовательно 1М водным раствором гидроксида натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/хлороформ/этилацетат=5/4/1-4/4/1), получая указанное в заголовке соединение (15,5 г).
1H-NMR (CDCb) δ: 7,40-7,30 (5,0Н, м), 6,04-5,89 (1,0Н, м), 5,76-5,68 (1,0Н, м), 5,56-5,49 (1,0Н, м), 5,07 (2,0Н, с), 4,90-4,83 (1,0Н, м), 3,85-3,79 (0,5Н, м), 3,74-3,40 (3,5Н, м), 2,90-2,76 (0,5Н, м), 2,63-2,49 (0,5Н, м), 2,27-2,18 (1,0Н, м), 1,46 (9,0Н, с).
(7) Оптически активный 1-трет-бутиловьш эфир 3-бензилоксикарбониламино-3-(1,1-дифтор-2-гидроксиэтил)пирролидин-1-карбоновой кислоты
[Химическая формула 72]
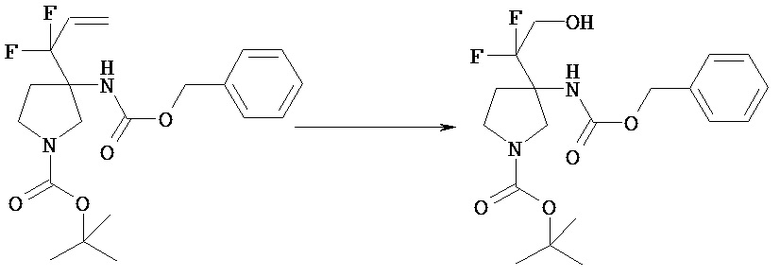
Через раствор оптически активного 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1,1-дифтораллил)пирролидин-1-карбоновой кислоты (15,5 г) в смеси хлороформ/метанол (154 мл/154 мл), охлажденный до -78°C, пропускают воздух, обогащенный озоном, в течение 30 минут. В реакционную смесь прибавляют боргидрид натрия (4,14 г) небольшими порциями, затем смесь нагревают до 0°C и дополнительно перемешивают при той же температуре в течение 4 часов. К смеси прибавляют насыщенный водный раствор бикарбоната натрия и насыщенный водный раствор хлорида натрия, и смесь экстрагируют хлороформом. Отделенный водный слой экстрагируют этилацетатом. Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=3/1). Фракции, которые не удалось разделить и выделить, концентрируют при пониженном давлении, и полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:н-гексан/хлороформ/этилацетат=5/4/1). Очищенные фракции объединяют и концентрируют при пониженном давлении, получая указанное в заголовке соединение (12,8 г).
1H-NMR (CDCl3) δ: 7,42-7,32 (5,0Н, м), 5,15-5,07 (2,0Н, м), 5,04-4,93 (1,0Н, м), 4,02-3,49 (6,0Н, м), 3,43-3,30 (1,0Н, м), 2,67-2,57 (0,4Н, м), 2,45-2,28 (1,6Н, м), 1,46 (9,0Н, с).
(8) Оптически активный трет-бутиловый эфир 3-бензилоксикарбониламино-3-(1,1-дифтор-2-метансульфонилоксиэтил)пирролидин-1-карбоновой кислоты
[Химическая формула 73]
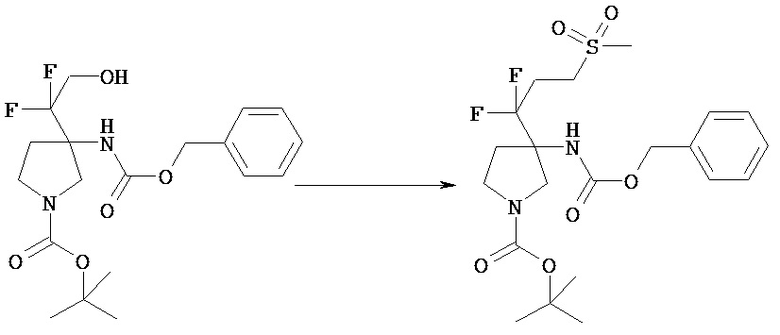
К раствору оптически активного соединения трет-бутилового эфира 3-бензилоксикарбониламино-3 -(1,1 -дифтор-2-гидроксиэтил)пирролидин-1-карбоновой кислоты (471 мг) и триэтиламина (328 мкл) в хлороформе (4,7 мл), охлажденному до 0°C, прибавляют метансульфонилхлорид (118 мкл) и смесь перемешивают в течение 50 минут. К смеси прибавляют 5% водный раствор бисульфата калия и смесь экстрагируют этилацетатом. Органический слой промывают последовательно 1 М водным раствором гидроксида натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (565 мг).
1H-NMR (CDCl3) δ: 7,41-7,33 (5Н, м), 5,10 (2Н, с), 4,94-4,86 (1Н, м), 4,57-4,48 (2Н, м), 3,92-3,84 (0,5Н, м), 3,80-3,52 (2,5Н, м), 3,47-3,33 (1Н, м), 3,09 (3H, с), 2,83.2,74 (0,5Н, м), 2,61-2,52 (0,5Н, м), 2,31-2,21 (1Н, м), 1,47 (9Н, с).
(9) Оптически активное соединение 1-бензиловый 6-трет-бутиловый диэфир 3,3-дифтор-1,6-диазоспиро[3.4]октан-1,6-дикарбоновой кислоты
[Химическая формула 74]
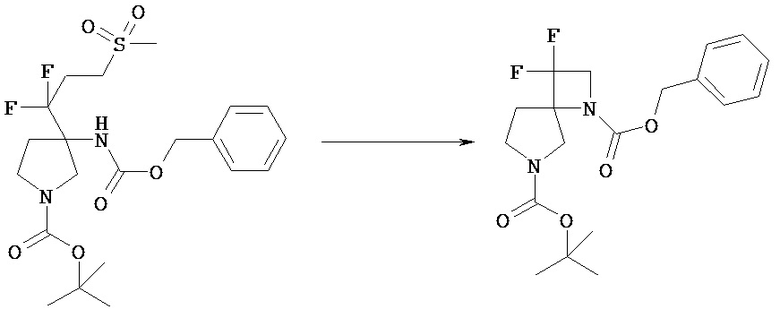
К раствору оптически активного трет-бутилового эфира 3-бензилоксикарбониламино-3-(1,1-дифтор-2-метансульфонилоксиэтил)пирролидин-1-карбоновой кислоты (565 мг) в N,N-диметилформамиде (17 мл), охлажденному до 0°C, прибавляют гидрид натрия (71 мг, с 40% минерального масла) и смесь перемешивают при той же температуре в течение 1 часа. В реакционную смесь прибавляют воду и смесь экстрагируют этилацетатом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (397 мг).
1H-NMR (CDCl3) δ: 7,41-7,31 (5Н, м), 5,25-5,06 (2Н, м), 4,27-4,17 (2Н, м), 3,96-3,82 (1Н, м), 3,79-3,49 (2Н, м), 3,41-3,27 (1Н, м), 2,65-2,41 (0,5Н, м), 2,38-2,17 (1,5Н, м), 1,50-1,44(9Н,м).
(10) Оптически активный трет-бутиловый эфир 3,3-дифтор-1,6-диазоспиро[3.4]октан-6-карбоновой кислоты
[Химическая формула 75]
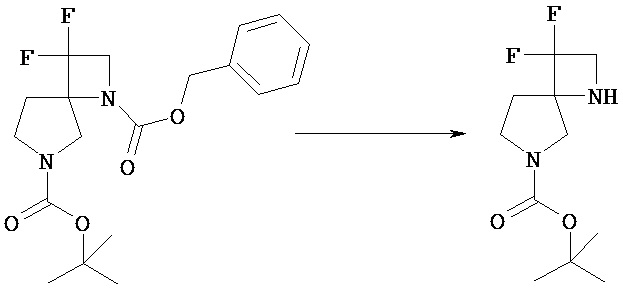
К раствору оптически активного 1-бензилового 6-трет-бутилового диэфира 3,3-дифтор-1,6-диазоспиро[3.4]октан-1,6-дикарбоновой кислоты (397 мг) в смеси метанол/тетрагидрофуран (3,2 мл/3,2 мл) прибавляют 10% палладий на угле (79 мг) и смесь гидрируют при комнатной температуре и обычном давлении в течение 14 часов. Смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. Полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=4/1 to 2/1). Фракции, которые не удалось разделить и выделить, концентрируют при пониженном давлении, и полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=2/1-1/1).
Очищенные фракции объединяют и концентрируют при пониженном давлении, получая указанное в заголовке соединение (211 мг).
1H-NMR (CDCl3) δ: 3,96-3,74 (3H, м), 3,55-3,37 (2Н, м), 3,35-3,25 (1Н, м), 2,45-2,35 (1Н, м), 2,00-1,88 (1Н, м), 1,73-1,56 (1Н, м), 1,46 (9Н, с).
(11) Дигидрохлорид 3,3-дифтор-1,6-диазоспиро[3.4]октана
[Химическая формула 76]
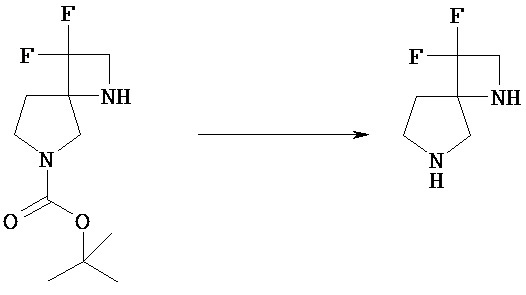
К оптически активному трет-бутиловому эфиру 3,3-дифтор-1,6-диазоспиро[3.4]октан-6-карбоновой кислоты (211 мг) прибавляют 4 М соляную кислоту в 1,4-диоксане (2,1 мл) и 2М соляную кислоту в метаноле (2,1 мл) и смесь перемешивают при комнатной температуре в течение 45 минут. В реакционную смесь прибавляют этилацетат и смесь фильтруют, получая указанное в заголовке соединение (163 мг).
1H-NMR (ДМСО-D6) δ: 9,80-9,42 (2Н, м), 4,58-3,83 (7Н, м), 3,47-3,33 (2Н, м), 2,82-2,72 (1Н, м).
(12) Оптически активный 4-(3,3-дифтор-1,6-диазоспиро[3.4]окт-6-ил)-7Н-пирроло[2,3-d]пиримидин
[Химическая формула 77]
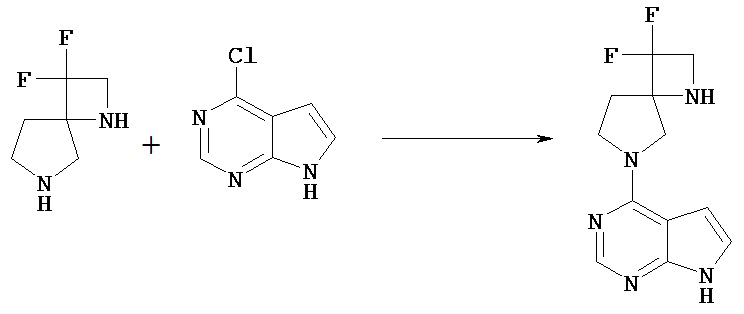
Оптически активный дигидрохлорид 3,3-дифтор-1,6-диазоспиро[3.4]октана (163 мг) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (113 мг), карбонатом калия (509 мг) и водой (2,8 мл) и смесь перемешивают в течение 16,5 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры. Прибавляют воду и смесь фильтруют, получая твердое вещество (126 мг). Фильтрат экстрагируют 4 раза смесью этилацетат/метанол и два раза смесью хлороформ/метанол. Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток объединяют с твердым веществом и очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=92/8-85/15), получая указанное в заголовке соединение (170 мг).
1H-NMR (ДМСО-D6) δ: 11,63 (1Н, ш.с), 8,10 (1Н, с), 7,14 (1Н, дд, J=3,6; 2,4 Гц), 6,57 (1Н, дд, J=3,6; 2,0 Гц), 4,15 (1Н, д, J=11,7 Гц), 3,92-3,65 (5Н, м), 3,35-3,22 (1Н, м), 2,47-2,39 (1Н, м), 2,17-2,07 (1Н, м).
(13) Оптически активный 3-[3,3-дифтор-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.4]окт-1-ил]-3-оксопропионитрил
[Химическая формула 78]
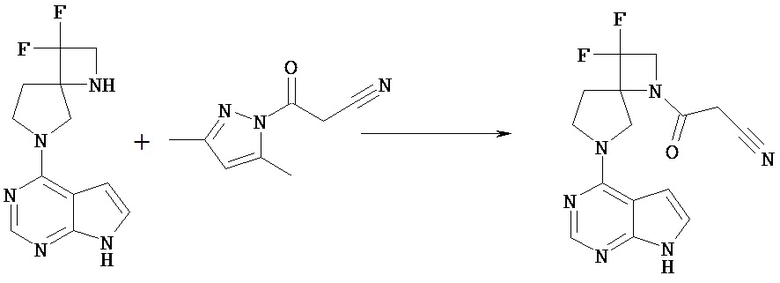
Оптически активный 4-(3,3-дифтор-1,6-диазоспиро[3.4]окт-6-ил)-7Н-пирроло[2,3-d]пиримидин (170 мг) смешивают с 1-цианоацетил-3,5-диметилпиразолом (209 мг), N,N-диизопропилэтиламином (117 мкл) и 1,4-диоксаном (3,4 мл) и смесь перемешивают при 100°C в течение 75 минут. Смесь охлаждают до комнатной температуры и прибавляют насыщенный водный раствор бикарбоната натрия, затем смесь экстрагируют этилацетатом. Отделенный водный слой дважды экстрагируют этилацетатом. Объединенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/этилацетат=2/1, затем хлороформ/метанол=92/8-3/1). Смесь концентрируют при пониженном давлении, и полученный остаток промывают, суспендируя, смешанным растворителем м-гептан/этанол (3/1), получая указанное в заголовке соединение (177 мг).
1H-NMR (ДМСО-D6) δ: 11,68 (1Н, ш.с), 8,11 (1Н, с), 7,17-7,14 (1Н, м), 6,58 (1Н, дд, J=3,3, 1,8 Гц), 4,66-4,58 (2Н, м), 4,24-4,13 (2Н, м), 4,12-4,02 (1Н, м), 3,89-3,78 (3H, м), 2,68-2,58 (1Н, м), 2,56-2,45 (1Н, м).
[α]D=+46,67° (25°C, с=0,54, метанол)
[Получение 5]: Синтез соединения 5
[Химическая формула 79]
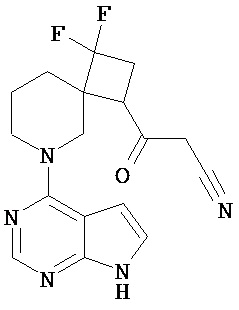
(1) 1-трет-бутиловый 3-(3,3-дифтораллил)овый диэфир пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 80]
К раствору 1-трет-бутилового эфира пиперидин-1,3-дикарбоновой кислоты (30,0 г) в N,N-диметилформамиде (300 мл) прибавляют карбонат калия (36,2 г) и 3-бром-3,3-дифторпропен (16 мл) и смесь перемешивают при 60°C в течение 4,5 часов. В реакционную смесь прибавляют воду и смесь экстрагируют раствором н-гексан/этилацетат (1/1). Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=10/1), получая указанное в заголовке соединение (33,5 г).
1H-NMR (CDCl3) δ: 4,62-4,46 (3Н, м), 4,34-3,98 (1Н, м), 3,95-3,80 (1Н, м), 3,18-2,89 (1Н, м), 2,87-2,77 (1Н, м), 2,50-2,40 (1Н, м), 2,08-1,98 (1Н, м), 1,75-1,55 (2Н, м), 1,52-1,41 (1Н, м), 1,46 (9Н, с).
(2) 1-трет-бутиловый эфир 3-(1,1-дифтораллил)-пиперидин-1,3-дикарбоновой кислоты [Химическая формула 81]
К раствору 1-трет-бутилового 3-(3,3-дифтораллил)ового диэфира пиперидин-1,3-дикарбоновой кислоты (28,5 г) в тетрагидрофуране (285 мл), охлажденному до -78°C, прибавляют гексаметилдисилазид лития (1,1 М раствор в тетрагидрофуране, 110 мл). Реакционную смесь нагревают до -2°C в течение 6 минут, перемешивают при той же температуре дополнительно 15 минут и затем опять охлаждают до -78°C. К смеси прибавляют триметилсилилхлорид (19 мл). Реакционную смесь нагревают до комнатной температуры и дополнительно перемешивают при той же температуре в течение 30 минут. Смесь подщелачивают, прибавляя воду (300 мл), затем 2М водный раствор гидроксида натрия (60 мл) и промывают н-гексаном (450 мл). Отделенный органический слой 3 раза экстрагируют 2М водным раствором гидроксида натрия. Объединенный водный слой подкисляют 10% водным раствором лимонной кислоты и экстрагируют этилацетатом. Органический слой концентрируют при пониженном давлении, и полученный остаток промывают, суспендируя, раствором н-гексан/этилацетат (5/1), получая указанное в заголовке соединение (23,9 г).
1H-NMR (CDCl3) δ: 6,05-5,89 (1Н, м), 5,72-5,65 (1Н, м), 5,56-5,52 (1Н, м), 4,67 (1Н, д, J=13,7 Гц), 4,12-4,02 (1Н, м), 3,46 (1Н, ш.с). 2,92 (1Н, д,.1=13,7 Гц), 2,70-2,61 (1Н, м), 2,37-2,30 (1Н, м), 1,71-1,54 (3Н, м), 1,45 (9Н, с).
(3) Оптически активный 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 82]
Оптически активный 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты (26,9 г), (R)-(-)-2-амино-2-фенилэтанол (6,6 г) и изопропанол (270 мл) смешивают и смесь перемешивают при комнатной температуре в течение ночи. Полученную смесь-суспензию фильтруют для удаления твердого вещества. Фильтрат концентрируют при пониженном давлении, полученный остаток смешивают с этилацетатом (97 мл) и 25% водным раствором бисульфата калия (97 мл) и смесь перемешивают в течение 25 минут. Отделенный органический слой промывают последовательно 5% водным раствором бисульфата калия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (16,2 г).
1H-NMR (CDCl3) δ: 6,05-5,89 (1Н, м), 5,72-5,65 (1Н, м), 5,56-5,52 (1Н, м), 4,67 (1Н, д, J=13,7 Гц), 4,12-4,02 (1Н, м), 3,46 (1Н, ш.с), 2,92 (1Н, д, J=13,7 Гц), 2,70-2,61 (1Н, м), 2,37-2,30 (1Н, м), 1,71-1,54 (3H, м), 1,45 (9Н, с).
(4) Соль оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты с (S)-(+)-2-амино-2-фенилэтанолом
[Химическая формула 83]
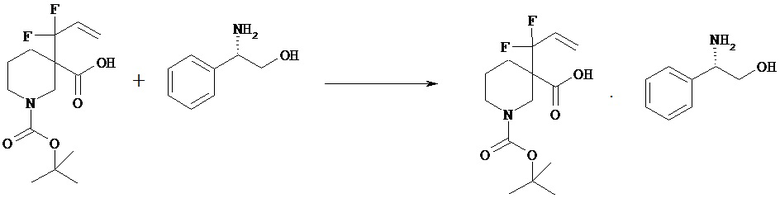
Остаток (16,2 г), полученный в (3), смешивают с (S)-(+)-2-амино-2-фенилэтанолом (6,6 г) и изопропанолом (162 мл) и смесь перемешивают при комнатной температуре в течение 20 часов. Полученную смесь-суспензию фильтруют и отделенное твердое вещество промывают изопропанолом (80 мл), получая твердое вещество (17,8 г), которое смешивают с изопропанолом (305 мл) и перемешивают при 105°C в течение 20 минут и при комнатной температуре в течение 19 часов. Смесь-суспензию фильтруют и полученное твердое вещество промывают изопропанолом (90 мл), получая указанное в заголовке соединение (16,0 г). Анализ методом ВЭЖХ в условиях 1 показал, что основным продуктом является изомер с более длительными временами удерживания.
Изомер с меньшими временами удерживания (время удерживания 5,41 минуты).
Изомер с более длительными временами удерживания (время удерживания 12,47 минут).
(5) Оптически активный 1-трет-бутиловый эфир 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты
[Химическая формула 84]
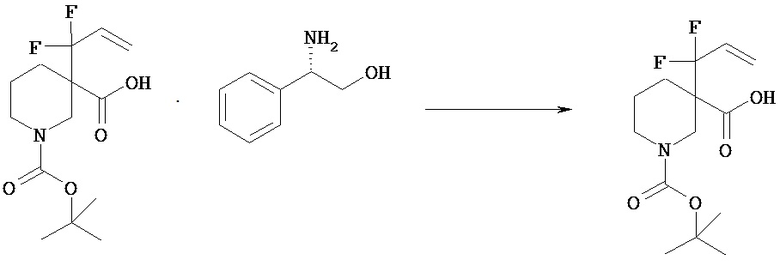
К соли оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты с (S)-(+)-2-амино-2-фенилэтанолом (17,8 г) прибавляют этилацетат (89 мл), 25% водный раствор бисульфата калия (89 мл) и смесь перемешивают в течение 15 минут. Отделенный органический слой промывают последовательно 5% водным раствором бисульфата калия (89 мл) и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (12,3 г).
1H-NMR (CDCl3) δ: 6,05-5,89 (1Н, м), 5,72-5,65 (1Н, м), 5,56-5,52 (1Н, м), 4,67 (1Н, д, J=13,7 Гц), 4,12-4,02 (1Н, м), 3,46 (1Н, ш.с), 2,92 (1Н, д, J=13,7 Гц), 2,70-2,61 (1Н, м), 2,37-2,30 (1Н, м), 1,71-1,54 (3H, м), 1,45 (9Н, с).
(6) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(1,1-дифтораллил)пиперидин-1-карбоновой кислоты
[Химическая формула 85]
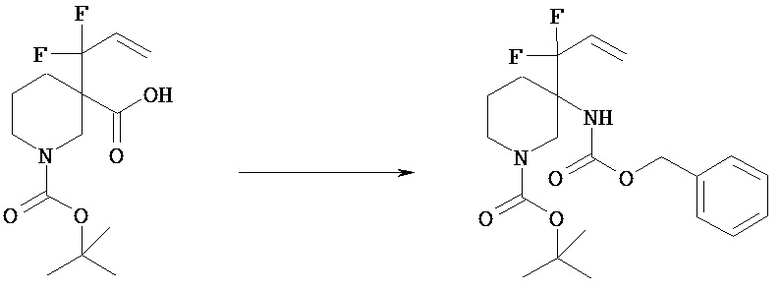
К раствору оптически активного 1-трет-бутилового эфира 3-(1,1-дифтораллил)пиперидин-1,3-дикарбоновой кислоты (12,3 г) и триэтиламина (11,2 мл) в толуоле (123 мл), нагретому до 100°C, прибавляют по каплям дифенилфосфорилазид (11,2 мл). Реакционную смесь перемешивают при 100°C в течение 25 минут и затем прибавляют бензиловый спирт (6,2 мл) и 4-диметиламинопиридин (0,98 г). Смесь перемешивают при 100°C в течение ночи и затем охлаждают до комнатной температуры и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=9/1-85/15), получая указанное в заголовке соединение (15,1 г).
1H-NMR (CDCl3) δ: 7,38-7,28 (5Н, м), 6,07-5,92 (1Н, м), 5,71-5,62 (1Н, м), 5,53-5,48 (1Н, м), 5,36 (0,5Н, ш.с), 5,09-4,97 (2Н, м), 4,89 (0,5Н, ш.с), 4,28-3,98 (2Н, м), 3,16-2,61 (3H, м), 1,64-1,52 (3H, м), 1,49-1,36 (9Н, м).
(7) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(1,1-дифтор-2-гидроксиэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 86]
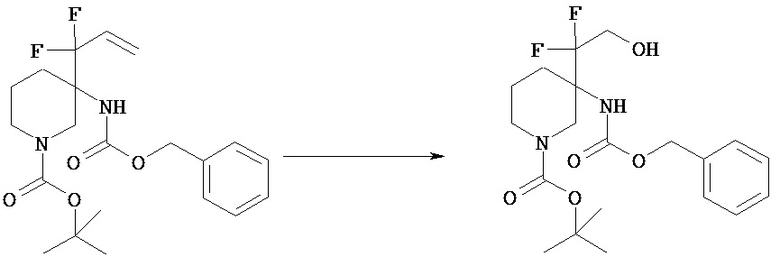
Через раствор оптически активного 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1,1-дифтораллил)пиперидин-1-карбоновой кислоты (15,1 г) в смеси хлороформ/метанол (150 мл/150 мл), охлажденный до -78°C, пропускают воздух, обогащенный озоном в течение 30 минут. В реакционную смесь небольшими порциями прибавляют боргидрид натрия (4,2 г) и затем смесь нагревают до 0°C и перемешивают при той же температуре 50 минут дополнительно. К смеси прибавляют насыщенный водный раствор бикарбоната натрия и насыщенный водный раствор хлорида натрия, и смесь экстрагируют хлороформом. Отделенный водный слой экстрагируют этилацетатом. Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=3/1-2/1), получая указанное в заголовке соединение (13,6 г).
1H-NMR (CDCl3) δ: 7,38-7,29 (5Н, м), 5,78 (1Н, ш.с), 5,15-4,99 (2Н, м), 4,42-3,97 (2Н, м), 3,95-3,75 (2Н, м), 3,55-3,44 (1Н, м), 3,15-2,60 (3H, м), 1,79-1,67 (1Н, м), 1,55-1,50 (1Н, м), 1,42 (9Н, с).
(8) Оптически активный 1-трет-бутиловый эфир 3-бензилоксикарбониламино-3-(1,1-дифтор-2-метансульфонилоксиэтил)пиперидин-1-карбоновой кислоты
[Химическая формула 87]
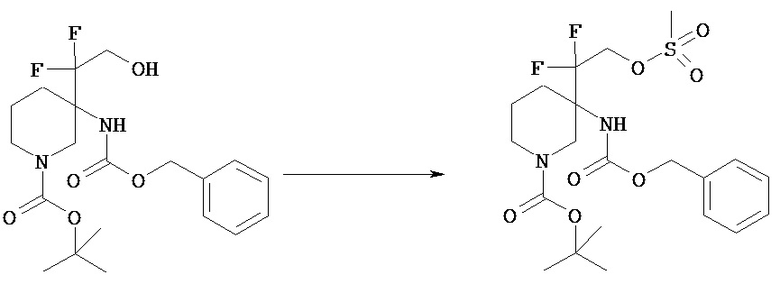
К раствору оптически активного 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1,1-дифтор-2-гидроксиэтил)-пиперидин-1-карбоновой кислоты (13,6 г) и триэтиламина (11,4 мл) в хлороформе (136 мл), охлажденному до 0°C, прибавляют метансульфонилхлорид (7,8 мл) и смесь перемешивают в течение 50 минут. К смеси прибавляют 5% водный раствор бисульфата калия и смесь экстрагируют этилацетатом. Отделенный органический слой промывают последовательно 4 М водным раствором гидроксида натрия два раза и один раз насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, и концентрируют при пониженном давлении, получая указанное в заголовке соединение (17,1 г).
1H-NMR (CDCl3) δ: 7,39-7,29 (5Н, м), 5,65 (1Н, ш.с), 5,15-4,97 (2Н, м), 4,65-4,51 (2Н, м), 4,39-3,98 (2Н, м), 3,15-2,62 (3H, м), 3,07 (3H, с), 1,70-1,53 (3H, м), 1,43 (9Н, с).
(9) Оптически активный 1-бензиловый 6-трет-бутиловый диэфир 3,3-дифтор-1,6-диазаспиро[3.5]нонан-1,б-дикарбоновой кислоты
[Химическая формула 88]
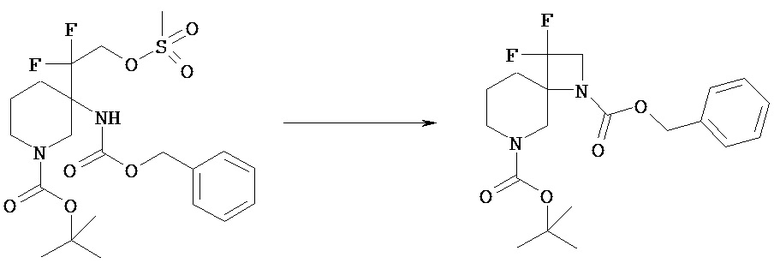
К суспензии гидрида натрия (1,7 г, содержащей 40% минерального масла) в N,N-диметилформамиде (428 мл), охлажденной до 0°C, прибавляют раствор оптически активного 1-трет-бутилового эфира 3-бензилоксикарбониламино-3-(1,1-дифтор-2-иетансульфонилоксиэтил)пиперидин-1-карбоновой кислоты (17,1 г) в N,N-диметилформамиде (86 мл) и смесь перемешивают при той же температуре в течение 15 минут. К реакционной смеси прибавляют воду и смесь экстрагируют этилацетатом. Отделенный органический слой промывают последовательно водой и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=5/1), получая указанное в заголовке соединение (12,6 г).
1H-NMR (CDCl3) δ: 7,41-7,30 (5Н, м), 5,21-5,02 (2Н, м), 4,56-4,31 (1Н, м), 4,25-4,14 (2Н, м), 4,13-3,89 (1Н, м), 3,41-2,98 (1Н, м), 2,80-2,41 (1Н, м), 2,33-2,12 (1Н, м), 2,03-1,87 (1Н, м), 1,80-1,67 (1Н, м), 1,65-1,52 (2Н, м), 1,45 (9Н, с).
(10) Оптически активный моногидрохлорид бензилового эфира 3,3-дифтор-1,6-диазаспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 89]
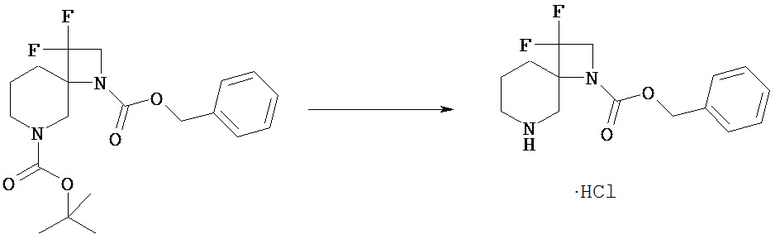
К оптически активному 1-бензиловому 6-трет-бутиловому диэфиру 3,3-дифтор-1,6-диазаспиро[3.5]нонан-1,6-дикарбоновой кислоты (12,6 г) прибавляют 4 М соляную кислоту в 1,4-диоксане (126 мл) и смесь перемешивают при комнатной температуре в течение 30 минут. Смесь концентрируют при пониженном давлении и прибавляют толуол. Смесь еще раз концентрируют при пониженном давлении, получая указанное в заголовке соединение (11,2 г).
1H-NMR (CDCl3) δ: 11,56 (1H, ш.с), 8,65 (1Н, ш.с), 7,43-7,32 (5Н, м), 5,13 (2Н, с), 4,43-4,20 (2Н, м), 3,82-3,72 (1H, м), 3,54-3,35 (2Н, м), 3,28-3,14 (1H, м), 2,34-1,91 (4Н, м).
(11) Оптически активный бензиловый эфир 3,3-дифтор-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазаспиро[3.5]нонан-1-карбоновой кислоты
[Химическая формула 90]
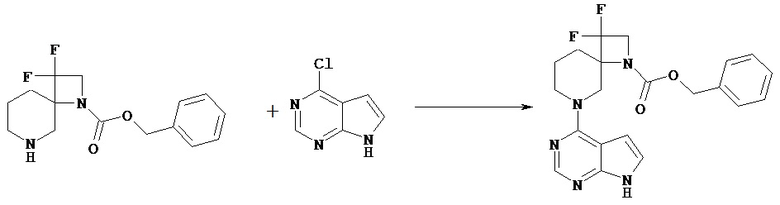
Оптически активный моногидрохлорид бензилового эфира 3,3-дифтор-1,6-диазаспиро[3.5]нонан-1-карбоновой кислоты (11,2 г) смешивают с 4-хлор-7Н-пирроло[2,3-(Цпиримидином (4,2 г), карбонатом калия (18,7 г) и водой (104 мл), и смесь перемешивают в течение 16,5 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры и прибавляют этилацетат и воду. Смесь фильтруют, фильтрат разделяют и полученный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=3/1). Полученный остаток также очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=2/1), получая указанное в заголовке соединение (12,0 г).
1H-NMR (CDCl3) δ: 10,22 (1H, ш.с), 8,37 (1H, с), 7,42-7,31 (5Н, м), 7,10 (1H, дд, J=3,3; 2,2 Гц), 6,56-6,51 (1H, м), 5,25-5,06 (3H, м), 4,77-4,62 (1H, м), 4,34-4,18 (2Н, м), 3,75-3,43 (1Н, м), 3,14-2,94 (1Н, м), 2,52-2,38 (0,5Н, м), 2,36-2,27 (1Н, м), 2,23-2,11 (0,5Н, м), 2,04-1,91 (1Н, м), 1,90-1,77 (1Н, м).
(12) Оптически активный 4-(3,3-дифтор-1,6-диазаспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-d]пиримидин
[Химическая формула 91]
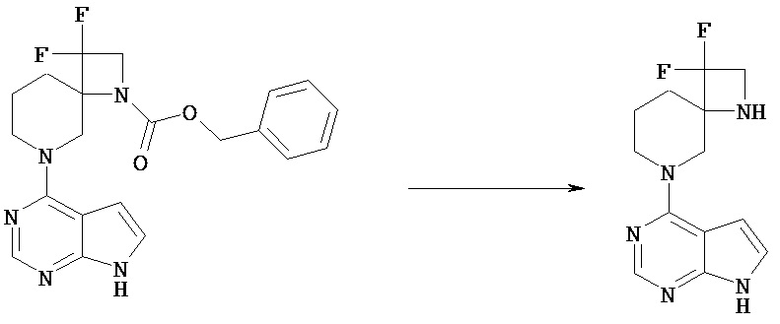
К раствору оптически активного бензилового эфира 3,3-дифтор-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазаспиро[3.5]нонан-1-карбоновой кислоты (12,0 г) в смеси метанол/тетрагидрофуран (120 мл/120 мл) прибавляют 10% палладий на угле (2,4 г) и смесь гидрируют при комнатной температуре и давлении 4 атмосферы в течение 21 часа. Смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении. Полученный остаток очищают, суспендируя в смеси растворителей н-гексан/этилацетат (2/1), и получают указанное в заголовке соединение (6,6 г).
1H-NMR (CDCl3) δ: 10,04 (1Н, ш.с), 8,32 (1Н, с), 7,10 (1Н, д, J=3,5 Гц), 6,53 (1Н, д, J=3,7 Гц), 4,60 (1Н, д, J=13,7 Гц), 4,20-4,13 (1Н, м), 4,08-3,97 (1Н, м), 3,92-3,81 (1Н, м), 3,76 (1Н, д, J=13,7 Гц), 3,64-3,55 (1Н, м), 2,08-1,78 (5Н, м).
(13) Оптически активный 3-[3,3-дифтор-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазаспиро[3.5]нон-1-ил]-3-оксопропионитрил
[Химическая формула 92]

Оптически активный 4-(3,3-дифтор-1,6-диазаспиро[3.5]нон-6-ил)-7Н-пирроло[2,3-е]пиримидин (6,6 г) смешивают с 1-цианоацетил-3,5-диметилпиразолом (7,7 г), N,N-диизопропилэтиламином (4,3 мл) и 1,4-диоксаном (132 мл) и смесь перемешивают при 100°C в течение 2 часов. Смесь охлаждают до комнатной температуры. Затем прибавляют воду и смесь экстрагируют этилацетатом. Отделенный водный слой дополнительно экстрагируют этилацетатом 5 раз. Объединенный органический слой промывают последовательно насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/ацетон=3/2-2/3). К полученному остатку прибавляют н-гептан и смесь концентрируют при пониженном давлении. К полученному остатку прибавляют диэтиловый эфир, смесь промывают, суспендируя, и фильтруют, получая твердое вещество (7,5 г). Фильтрат концентрируют при пониженном давлении. К полученному остатку прибавляют диэтиловый эфир, смесь промывают, суспендируя, и получают твердое вещество (0,2 г). Объединенное твердое вещество очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=97/3-9/1). К полученному твердому веществу прибавляют этанол и смесь концентрируют при пониженном давлении, получая указанное в заголовке соединение (7,1 г).
1H-NMR (ДМСО-D6) δ: 11,74 (1Н, ш.с), 8,15 (1Н, с), 7,22-7,19 (1Н, м), 6,65-6,62 (1Н, м), 5,13-5,07 (1Н, м), 4,69-4,46 (3H, м), 3,83 (1Н, д, J=18,8 Гц), 3,77 (1Н, д, J=19,2 Гц), 3,61-3,55 (1Н, м), 2,99-2,91 (1Н, м), 2,39-2,29 (1Н, м), 2,26-2,19 (1Н, м), 1,99-1,91 (1Н, м), 1,63-1,48 (1Н, м).
[α]D=+139,52° (25°C, с=1,04; метанол)
[Получение 6]: Синтез соединения 6
[Химическая формула 93]
(1) Оптически активный 2-бензиламинопропан-1-ол
[Химическая формула 94]
К раствору (S)-(+)-2-аминопропан-1-ола (50,0 г) и бензальдегида (74 мл) в этаноле (500 мл) прибавляют 5% палладий на угле (5,0 г) и смесь гидрируют при комнатной температуре и атмосферном давлении в течение 8 часов. Реакционную смесь фильтруют через целит и концентрируют при пониженном давлении, получая указанное в заголовке соединение (111,2 г).
1H-NMR (ДМСО-D6) δ: 7,34-7,27 (4Н, м), 7,23-7,18 (1Н, м), 4,53-4,47 (1Н, м), 3,76 (1Н, д, J=13,5 Гц), 3,66 (1Н, д, J=13,5 Гц), 3,29-3,24 (2Н, м), 2,65-2,55 (1Н, м), 1,99 (1Н, ш.с), 0,93 (3H, д, J=6,4 Гц).
(2) Оптически активный 1-трет-бутиловый эфир [бензил-(2-гидрокси-1-метилэтил)амино]уксусной кислоты
[Химическая формула 95]
К смеси оптически активного 2-бензиламинопропан-1-ола (111,2 г), карбоната калия (111,6 г) и N,N-диметилформамида (556 мл), охлажденной до 0°C, прибавляют по каплям трет-бутиловый эфир бромуксусной кислоты (109 мл) в течение 20 минут и смесь перемешивают при комнатной температуре в течение 19,5 часов. Смесь подкисляют, прибавляя 2 М водный раствор соляной кислоты и 6 М водный раствор соляной кислоты до достижения pH 2, и промывают толуолом (1000 мл). Отделенный органический слой экстрагируют 0,1 М водным раствором соляной кислоты (300 мл). Прибавляя 4 М водный раствор гидроксида натрия, доводят объединенный водный слой до 10 pH и экстрагируют этилацетатом (700 мл). Органический слой промывают последовательно водой (900 мл) и насыщенным водным раствором хлорида натрия (500 мл). Отделенный водный слой также экстрагируют этилацетатом (400 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (160,0 г).
1H-NMR (ДМСО-d6) δ: 7,37-7,26 (4Н, м), 7,24-7,19 (1Н, м), 4,26 (1Н, дд, J=6,9, 3,9 Гц), 3,76 (1Н, д, J=14,1 Гц), 3,68 (1Н, д, J=13,9 Гц), 3,45-3,39 (1Н, м), 3,29-3,20 (1Н, м), 3,24 (1Н, д, J=17,2 Гц), 3,13 (1Н, д, J=17,0 Гц), 2,84-2,74 (1Н, м), 1,37 (9Н, с), 0,96 (3H, д, J=6,8 Гц).
(3) Оптически активный 1-трет-бутиловый эфир [бензил(2-хлорпропил)амино]уксусной кислоты
[Химическая формула 96]
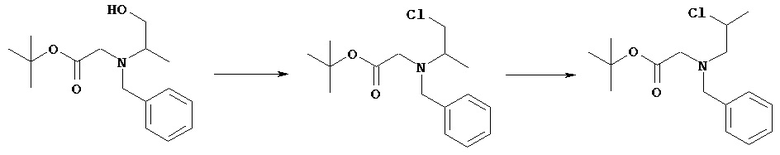
(3)-(1) Оптически активный 1-трет-бутиловый эфир [бензил-(2-хлор-1-метилэтил)амино]уксусной кислоты [Химическая формула 97]
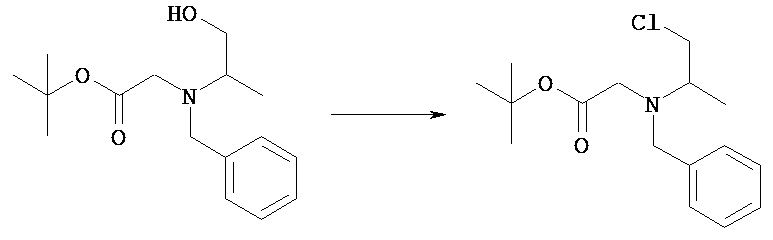
К раствору оптически активного 1-трет-бутипового эфира [бензил-(2-гидрокси-1-метилэтил)-амино]уксусной кислоты (160,0 г) в хлороформе (640 мл), охлажденному до 0°C, прибавляют по каплям тионилхлорид (50,0 мл) и смесь перемешивают при 60°C в течение 2 часов. Реакционную смесь охлаждают до 0°C. Затем прибавляют насыщенный водный раствор бикарбоната натрия (1000 мл) и хлороформ (100 мл) и смесь перемешивают. Отделенный органический слой промывают насыщенным водным раствором хлорида натрия (500 мл) и водный слой и в этом случае экстрагируют хлороформом (450 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (172,9 г).
1H-NMR (CDCl3) δ: 7,40-7,22 (5Н, м), 4,05-3,97 (0,4Н, м), 3,93-3,81 (2Н, м), 3,70-3,65 (0,6Н, м), 3,44-3,38 (0,6Н, м), 3,29 (0,8Н, с), 3,27 (1,2Н, д, J=2,4 Гц), 3,24-3,15 (0,6Н, м), 3,05-2,99 (0,4Н, м), 2,94-2,88 (0,4Н, м), 1,50 (1,2Н, д, J=6,4 Гц), 1,48 (3,6Н, с), 1,45 (5,4Н, с), 1,23 (1,8Н, д, J=6,8 Гц).
(3)-(2) Оптически активный 1-трет-бутиловый эфир [бензил-(2-хлорпропил)амино]уксусной кислоты
[Химическая формула 98]
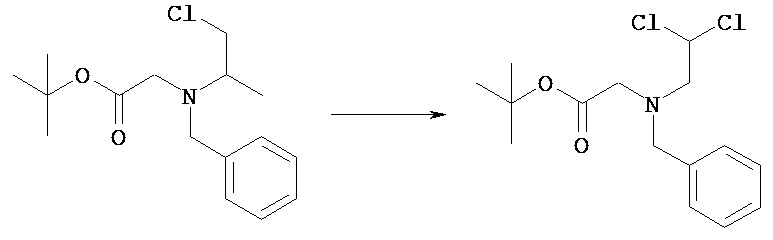
Оптически активный 1-трет-бутиловый эфир [бензил-(2-хлор-1-метилэтил)амино]уксусной кислоты (172,9 г) растворяют в N,N-диметилформамиде (520 мл) и перемешивают при 80°C в течение 140°C. Реакционную смесь охлаждают до 0°C.
Затем прибавляют воду (1200 мл) и экстрагируют смесью н-гексан/этилацетат (2/1, 1000 мл). Органический слой промывают последовательно водой (700 мл) и насыщенным водным раствором хлорида натрия (400 мл) и отделенный водный слой также экстрагируют смесью н-гексан/этилацетат (2/1,600 мл). Объединенный органический слой концентрируют при пониженном давлении и полученный остаток очищают колоночной хроматографией на силикагеле (элюент: н-гексан/этилацетат=50/1-40/1), получая указанное в заголовке соединение (127,0 г).
1H-NMR (CDCl3) δ: 7,37-7,29 (4H, м), 7,28-7,23 (1Н, м), 4,05-3,97 (1Н, м), 3,91 (1Н, д, J=13,5 Гц), 3.86 (1Н, д, J=13,7 Гц), 3,29 (2Н, с), 3,03 (1Н, J=13,9; 6,6 Гц), 2,91 (1Н, дд, J=13,9; 6,8 Гц), 1,50 (3Н, д, J=6,4 Гц), 1,48 (9Н, с).
(4) Оптически активный трет-бутиловый эфир 1-бензил-3-метилазетидин-2-карбоновой кислоты
[Химическая формула 99]
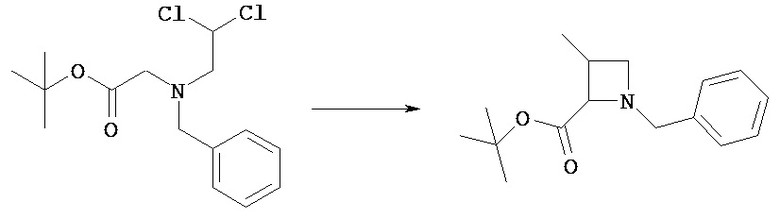
К раствору оптически активного трет-бутилового эфира [бензил-(2-хлорпропил)амино]уксусной кислоты (60,0 г) и гексаметилфосфорамида (36,0 мл) в тетрагидрофуране (360 мл), охлажденному до -72°C, прибавляют по каплям гексаметилдисилазид лития (1,0 М раствор в тетрагидрофуране, 242 мл) за 18 минут и смесь нагревают до 0°C в течение 80 минут. К реакционной смеси последовательно прибавляют насыщенный водный раствор хлорида аммония (300 мл) и воду (400 мл) и смесь экстрагируют этилацетатом (500 мл). Органический слой промывают последовательно водой (700 мл) и насыщенным водным раствором хлорида натрия (500 мл) и отделенный водный слой также экстрагируют этилацетатом (300 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=50/1-4/1) и получают указанное в заголовке соединение (50,9 г).
1H-NMR (CDCl3) δ: 7,34-7,21 (5Н, м), 3,75 (1Н, д, J=12,6 Гц), 3,70-3,67 (1Н, м), 3,58 (1Н, д, J=12,6 Гц), 3,05-3,01 (1Н, м), 2,99-2,95 (1Н, м), 2,70-2,59 (1Н, м), 1,41 (9Н, с), 1,24 (3Н,д,;=7,1 Гц).
(5) Оптически активный ди-трет-бутиловый эфир 3-метилазетидин-1,2-дикарбоновой кислоты
[Химическая формула 100]
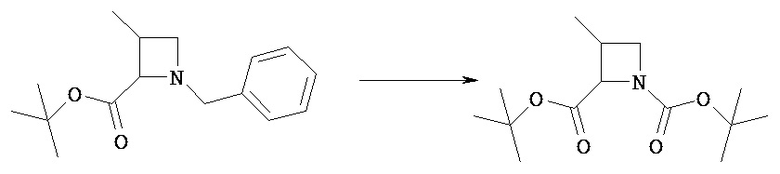
К раствору оптически активного трет-бутилового эфира 1-бензил-3-метилазетидин-2-карбоновой кислоты (43,5 г) и ди-тирет-бутилдикарбоната (38,2 г) в смеси тетрагидрофуран/метанол (130 мл/13 0 мл) прибавляют 20% гидроксид палладия на угле (3,5 г) и смесь гидрируют при давлении 4 атмосферы в течение 2 часов. Смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (48,0 г).
1H-NMR (ДМСО-D6) δ: 4,44 (1Н, д, J=8,8 Гц), 3,99-3,77 (1Н, м), 3,45-3,37 (1Н, м), 3.00-2,88 (1Н, м), 1,45 (9Н, с), 1,40-1,30 (9Н, м), 1,02 (3H, д, J=7,2 Гц).
(6) Оптически активный ди-тирет-бутиловый эфир 3-метил-2-(3-метил-бут-2-енил)азетидин-1,2-дикарбоновой кислоты
[Химическая формула 101]
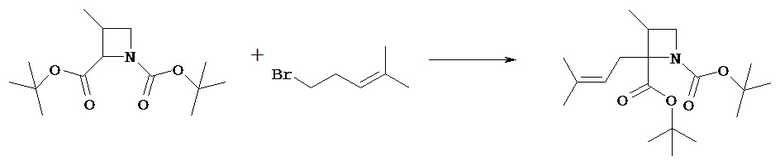
К раствору оптически активного ди-трет-бутилового эфира 3-метилазетидин-1,2-дикарбоновой кислоты (48,0 г) и 1-бром-3-метил-2-бутена (25,4 мл) в тетрагидрофуране (380 мл), охлажденному до -69°C, прибавляют гексаметилдисилазид лития (1,0 М раствор в тетрагидрофуране, 200 мл). Реакционную смесь нагревают до -20°C в течение более 40 минут и дополнительно перемешивают при той же температуре 20 минут. В реакционную смесь прибавляют последовательно насыщенный водный раствор хлорида аммония (200 мл) и воду (300 мл), смесь экстрагируют смешанным растворителем н-гексан/этилацетат (1/1, 500 мл). Отделенный органический слой промывают последовательно водой (200 мл) и насыщенным водным раствором хлорида натрия (200 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=15/1-8/1), получая указанное в заголовке соединение (44,5 г).
1H-NMR (CDCl3) δ: 5,29-5,21 (1Н, м), 3,77-3,72 (1Н, м), 3,49-3,44 (1Н, м), 2,73-2,52 (3H, м), 1,76-1,74 (3H, м), 1,66-1.65 (3H, м), 1,51 (9Н, с), 1,43 (9Н, с), 1,05 (3H, д, J=7,3 Гц).
(7) Оптически активный ди-тирет-бутиловый эфир 3-метил-2-(2-оксоэтил)азетидин-1,2-дикарбоновой кислоты [Химическая формула 102]
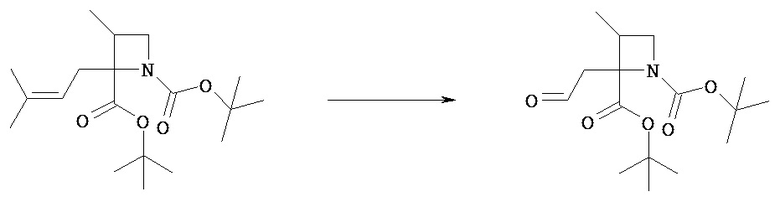
Через раствор оптически активного ди-трет-бутилового эфира 3-метил-2-(3-метил-бут-2-енил)азетидин-1,2-дикарбоновой кислоты (44,5 г) в смеси хлороформ/метанол (310 мл/310 мл), охлажденный до -70°C, в течение 1 часа пропускают воздух, обогащенный озоном. К реакционной смеси небольшими порциями прибавляют раствор трифенилфосфина (44,7 г) в хлороформе (45 мл) и смесь нагревают до комнатной температуры. К смеси прибаляют насыщенный водный раствор тиосульфата натрия (200 мл) и воду (300 мл), полученную смесь экстрагируют хлороформом (500 мл). Отделенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (95,0 г), которое используют на следующей стадии без дополнительной очистки.
1H-NMR (ДМСО-D6) δ: 9,65 (1Н, т, J=2,6 Гц), 3,79-3,74 (1Н, м), 3,45-3,40 (1Н, м), 2,99-2,80 (3H, м), 1,46 (9Н, с), 1,34 (9Н, с), 1,06 (3Н, д, J=7,2 Гц).
(8) Оптически активный ди-трет-бутиловый эфир 2-(2-бензиламиноэтил)-3-метилазетидин-1,2-дикарбоновой кислоты
[Химическая формула 103]
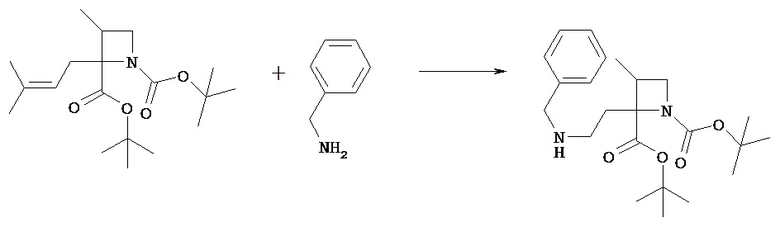
К раствору остатка (95,0 г), полученного в (7), в тетрагидрофуране (300 мл) прибавляют бензиламин (34 мл) при комнатной температуре и смесь перемешивают в течение 2 часов Смесь охлаждают до 0°C. Затем прибавляют триацетоксиборгидрид натрия (83,3 г),и смесь перемешивают при комнатной температуре в течение 1,5 часов. В реакционную смесь прибавляют воду (300 мл) и экстрагируют смесью н-гексан/этилацетат (1/3, 600 мл). Отделенный органический слой промывают водой (300 мл) и насыщенным водным раствором хлорида натрия (200 мл), затем два раза экстрагируют 5% водным раствором лимонной кислоты (300 мл, 200 мл) и 3 раза 10% водным раствором лимонной кислоты (250 мл × 3). Объединенный водный слой подщелачивают 4М водным раствором до pH 10 и экстрагируют хлороформом (300 мл). Органический слой промывают насыщенным водным раствором хлорида натрия (200 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (46,9 г).
1H-NMR (ДМСО-D6) δ: 7,34-7,26 (4Н, м), 7,22-7,17 (1H, м), 3,74-3,65 (2Н, м), 3,61 (1Н, т, J=7,8 Гц), 3,28 (1Н, т, J=7,5 Гц), 2,76-2,66 (2Н, м), 2,57-2,45 (1Н, м), 2,15 (1Н, ш.с), 2,05-1,89 (2Н, м), 1,42 (9Н, с), 1,27 (9Н, с), 0,96 (3H, д, J=7,1 Гц).
(9) Оптически активный дигидрохлорид 2-(2-бензиламиноэтил)-3-метилазетидин-2-дикарбоновой кислоты
[Химическая формула 104]
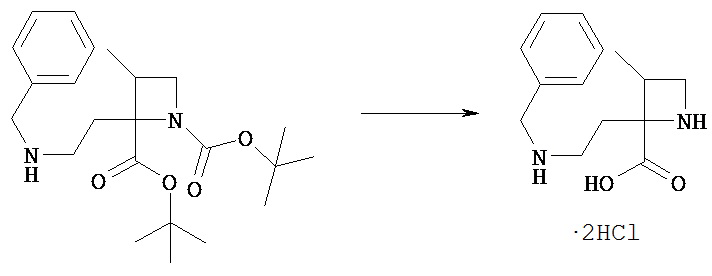
Оптически активный ди-трет-бутиловый эфир 2-(2-бензиламиноэтил)-3-метилазетидин-1,2-дикарбоновой кислоты (46,5 г) смешивают с 4 М соляной кислотой в диоксане (230 мл) и водой (4,1 мл) и смесь перемешивают при 80°C в течение 2 часов. Смесь концентрируют при пониженном давлении, подвергают азеотропной перегонке с толуолом и затем промывают, суспендируя, смесью н-гексан/этилацетат (1/1, 440 мл), получая указанное в заголовке соединение (30,1 г).
1H-NMR (ДМСО-D6) δ: 10,24 (1Н, ш.с), 9,64 (2Н, ш.с), 8,90 (111, ш.с), 7,58-7,53 (2Н, м), 7,47-7,41 (3H, м), 4,21-4,10 (2Н, м), 4,02-3,94 (1Н, м), 3,46-3,37 (1Н, м), 3,20-3,10 (1Н, м), 2,99-2,85 (2Н, м), 2,69-2,54 (2Н, м), 1,10 (3Н, д, J=7,2 Гц).
(10) Оптически активный 6-бензил-3-метил-1,6-диазоспиро[3.4]октан-5-он
[Химическая формула 105]
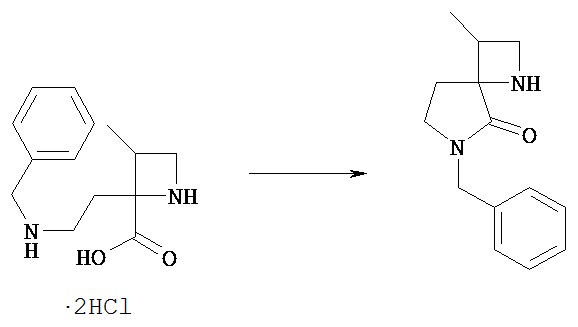
К раствору оптически активного дигидрохлорида 2-(2-бензиламиноэтил)-3-метилазетидин-2-дикарбоновой кислоты (29,1 г) и N,N-диизопропилэтиламина (65 мл) в хлороформе (290 мл) прибавляют гексафторфосфат 0-(7-азабензотриазол-1-ил)-N,N,N’,N’-тетраметилурония (41,3 г) при комнатной температуре и смесь перемешивают в течение 4 часов. В реакционную смесь прибавляют насыщенный водный раствор бикарбоната натрия (200 мл) и воду (100 мл), смесь экстрагируют хлороформом (200 мл). Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=20/1-10/1), получая указанное в заголовке соединение (21,3 г).
1H-NMR (ДМСО-D6) δ: 7,38-7,31 (2Н, м), 7,30-7,22 (3H, м), 4,52 (1Н, д, J=14,8 Гц), 4,29 (1Н, д, J=14,8 Гц), 3,35-3,27 (2Н, м), 3,22-3,17 (1Н, м), 3,05 (2Н, дд, J=9,5; 4,0 Гц), 2,77-2,66 (1Н, м), 2,16-2,10 (1Н, м), 1,96-1,87 (1Н, м), 0,94 (3H, д, J=7,1 Гц).
(11) Оптически активный трет-бутиловый эфир 6-бензил-3-метил-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты
[Химическая формула 106]
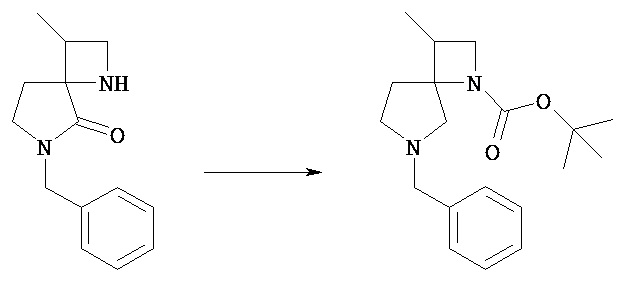
К суспензии алюмогидрида лития (6,8 г) в тетрагидрофуране (300 мл) при охлаждении льдом медленно прибавляют по каплям концентрированную серную кислоту (4,8 мл) и смесь перемешивают в течение 30 минут. К смеси по каплям прибавляют раствор оптически активного 6-бензил-3-метил-1,6-диазоспиро[3.4]октан-5-она (21,3 г) в тетрагидрофуране (100 мл) и смесь дополнительно перемешивают при той же температуре в течение 45 минут. К реакционной смеси прибавляют последовательно воду (7,0 мл), 4 М водный раствор гидроксида натрия (7,0 мл), воду (14,0 мл) и смесь сразу же перемешивают в течение 30 минут. К смеси прибавляют безводный сульфат магния и этилацетат (100 мл), перемешивают и затем фильтруют через целит. К фильтрату прибавляют ди-трет-бутилдикарбонат (23,4 г) при комнатной температуре и смесь перемешивают в течение 3 часов. Смесь концентрируют при пониженном давлении до уменьшения объема в два раза и дважды промывают насыщенным водным раствором хлорида аммония (200 мл × 2). К отделенному органическому слою прибавляют н-гексан (200 мл) и смесь 5 раз экстрагируют 10% водным раствором лимонной кислоты. Отделенный водный слой подщелачивают 4 М водным раствором гидроксида натрия и экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия (200 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=40/1-20/1), получая указанное в заголовке соединение (15,6 г).
1H-NMR (ДМСО-D6) δ: 7,34-7,27 (4Н, м), 7,26-7,21 (1Н, м), 3,84-3,69 (1Н, м), 3,62-3,47 (2Н, м), 3,19-3,05 (1Н, м), 3,02-2,92 (1Н, м), 2,76-2,69 (1Н, м), 2,47-2,24 (4Н, м), 1,95-1,77 (1Н, м). 1,36 (9Н, с), 1,03 (3H, д, J=7,0 Гц).
(12) Оптически активный трет-бутиловый эфир 3-метил-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты
[Химическая формула 107]
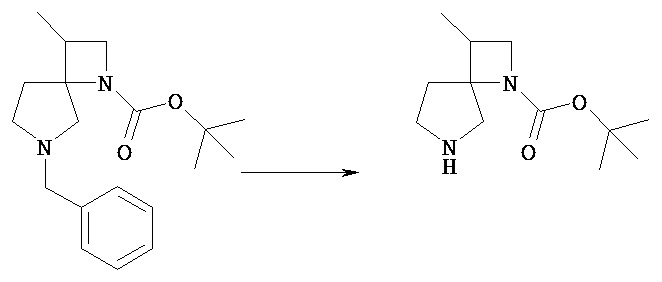
К раствору an оптически активного трет-бутилового эфира 6-бензил-3-метил-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты (10,0 г) в смеси тетрагидрофуран/метанол (50 мл/50 мл) прибавляют 20% гидроксида палладия на угле (2,0 г) и смесь гидрируют при давлении 4 атмосферы в течение 24 часов. Смесь фильтруют через целит и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение (7,3 г).
1H-NMR (ДМСО-D6) δ: 3,88-3,71 (1Н, м), 3,44-3,06 (2Н, м), 3,02-2,64 (4Н, м), 2,55-2,38 (1Н, м), 2,31-2,15 (1Н, м), 1,81-1,72 (1Н, м), 1,37 (9Н, с), 1,07 (3H, д, J=7,0 Гц).
[0245]
(13) Оптически активный трет-бутиловый эфир 3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты
[Химическая формула 108]
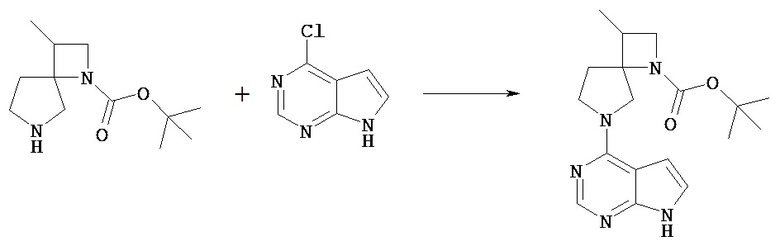
Оптически активный трет-бутиловый эфир 3-метил-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты (6,9 г) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (4,3 г), карбонатом калия (7,7 г) и водой (65 мл) и перемешивают в течение 4 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры, прибавляют воду (60 мл). Затем экстрагируют смесью хлороформ/метанол (10/1, 120 мл). Органический слой промывают последовательно водой, насыщенным водным раствором хлорида аммония, насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. К смеси прибавляют силикагель (4 г) и смесь перемешивают в течение 10 минут, фильтруют через целит и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/этилацетат=1/1, затем хлороформ/метанол=50/1-20/1), получая указанное в заголовке соединение (10,0 г).
1H-NMR (ДМСО-D6) δ: 11,59 (1Н, ш.с), 8,09 (1Н, с), 7,12-7,09 (1Н, м), 6,64-6,59 (1Н, м), 4,09-3,66 (5Н, м), 3,39-3,21 (1Н, м), 2,64-2,44 (2Н, м), 2,27-2,06 (1Н, м), 1,36 (3H, с), 1,21 (6Н, с), 1,11 (3H, д, J=6,5 Гц).
(14) Оптически активный дигидрохлорид 4-(3-метил-1,6-диазоспиро[3.4]окт-6-ил)-7Н-пирроло[2,3-d] пиримидина
[Химическая формула 109]
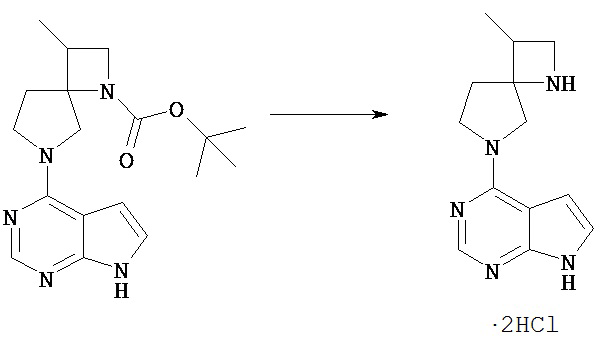
Оптически активный трет-бутиловый эфир 3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.4]октан-1-карбоновой кислоты (9,5 г) смешивают со смесью 4 М соляной кислоты и 1,4-диоксана (50 мл), хлороформом (50 мл) и метанолом (100 мл), перемешивают при 60°C в течение 30 минут. Смесь концентрируют при пониженном давлении и подвергают азеотропной перегонке с толуолом, получая указанное в заголовке соединение (9,3 г).
1H-NMR (ДМСО-D6) δ: 12,91 (1Н, ш.с), 9,97-9,64 (2Н, м), 8,45-8,35 (1Н, м), 7,58-7,47 (1Н, м), 7,04-6,92 (1Н, м), 4,99-4,65 (1Н, м), 4,32-3,21 (7Н, м), 3,04-2,90 (1Н, м), 2,46-2,31 (1Н, м), 1,27 (3H, д, J=6,0 Гц).
(15) Оптически активный 3-[3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.4]окт-1-ил]-3-оксопропионитрил
[Химическая формула 110]
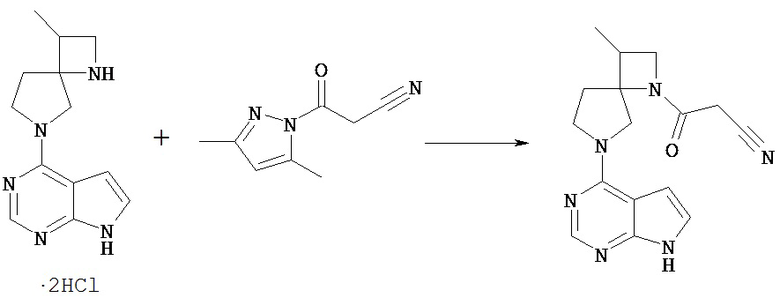
Оптически активный дигидрохлорид 4-(3-метил-1,6-диазоспиро[3.4]окт-6-ил)-7Н-пирроло[2,3-d]пиримидина (8,8 г) смешивают с 1-цианоацетил-3,5-диметилпиразолом (6,8 г), N,N-диизопропилэтиламином (20 мл) и 1,4-диоксаном (100 мл), смесь перемешивают при 100°C в течение 1 часа, охлаждают до комнатной температуры и прибавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют смешанным растворителем хлороформ/метанол (10/1). Отделенный органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=30/1-9/1) и концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, смесью н-гептан/этанол (2/1, 90 мл) и получают твердое вещество (7,3 г). Твердое вещество опять промывают, суспендируя, смесью н-гептан/этанол (5/1, 90 мл) и получают кристаллы 1 соединения, указанного в заголовке (6,1 г).
1H-NMR (ДМСО-D6) δ: 11,60 (1Н, ш.с), 8,08 (1Н, с), 7,11 (1Н, дд, J=3,5; 2,4 Гц), 6,58 (1Н, дд, J=3,4; 1,9 Гц), 4,18-4,14 (1Н, м), 4,09-3,93 (3H, м), 3,84-3,73 (1Н, м), 3,71 (1Н, д, J=19,0 Гц), 3,66 (1Н, д, J=18,7 Гц), 3,58 (1Н, дд, J=8,2; 6,0 Гц), 2,70-2,58 (2Н, м), 2,24-2,12 (1Н, м), 1,12 (3H, д, J=7,1 Гц).
[α]D=+47,09° (25°C, с=0,55, метанол)
К полученным кристаллам 1 (2,6 г) прибавляют 1-бутанол (39 мл) и смесь нагревают до 100°C и перемешиваают. После полного растворения твердых веществ раствор охлаждают до комнатной температуры со скоростью 10°C за 30 минут и затем перемешивают при комнатной температуре в течение ночи. Образовавшиеся кристаллы отфильтровывают, промывают 1-бутанолом (6,2 мл) и сушат при пониженном давлении, получая кристаллы 2 соединения, указанного в заголовке (2,1 г).
[Получение 7]: Синтез соединения 7
[Химическая формула 111]
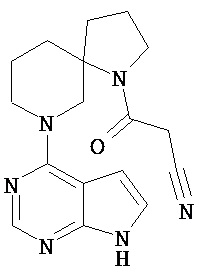
(1) Оптически активный 3-трихлорметилтетрагидропирроло[1,2-c]оксазол-1-он
[Химическая формула 112]
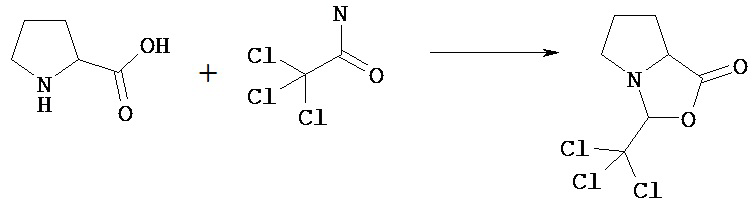
К раствору D-пролина (100,0 г) в ацетонитриле (400 мл) при комнатной температуре по каплям прибавляют хлораль (169 мл) и смесь перемешивают в течение 18 часов. Смесь фильтруют, фильтрат концентрируют при пониженном давлении. К полученному остатку прибавляют воду, и смесь экстрагируют хлороформом. Отделенный органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток промывают, суспендируя, смесью н-гексан/этилацетат (20/1,900 мл) и получают указанное в заголовке соединение (159,7 г).
1H-NMR (ДМСО-D6) δ: 5,83 (1Н, с), 4,10 (1Н, дд, J=9,0; 4,2 Гц), 3,34-3,27 (1Н, м), 3,20-3,13 (1Н, м), 2,19-2,07 (1Н, м), 1,98-1,90 (1Н, м), 1,83-1,73 (1Н, м), 1,67-1,55 (1Н, м).
(2) Оптически активный 7а-аллил-3-трихлорметилтетрагидропирроло[1,2-с]оксазол-1-он
[Химическая формула 113]
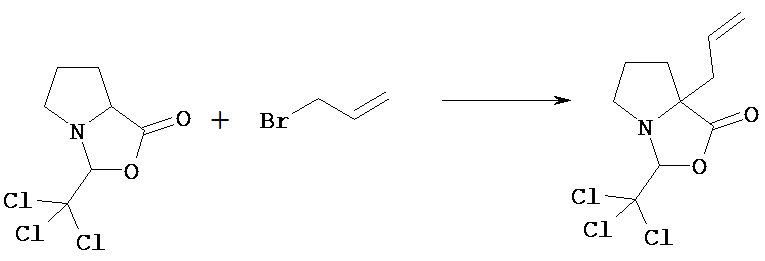
К раствору диизопропиламина (60 мл) в тетрагидрофуране (160 мл) за 20 минут при охлаждении льдом прибавляют по каплям н-бутиллитий (2,64 М раствор в гексане, 161 мл) и смесь сразу же перемешивают в течение 40 минут. К смеси, охлажденной до 068°C, за 30 минут прибавляют по каплям раствор 3-трихлорметилтетрагидропирроло[1,2-с]оксазол-1-она (80,0 г) в тетрагидрофуране (640 мл) и смесь перемешивают в течение 20 минут. Прибавляют аллилбромид (57 мл) и смесь перемешивают в течение 1 часа. К реакционной смеси прибавляют насыщенный водный раствор хлорида аммония (1000 мл) и экстрагируют этилацетатом (800 мл). Отделенный органический слой промывают водой (800 мл) и насыщенным водным раствором хлорида натрия (500 мл). Отделенный водный слой два раза экстрагируют этилацетатом (400 мл, 500 мл). Объединенный органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении, получая указанное в заголовке соединение (86,1 г).
1H-NMR (CDCl3) δ: 5,96-5,84 (1Н, м), 5,22-5,21 (1Н, м), 5,20-5,16 (1Н, м), 5,00-4,98 (1Н, м), 3,26-3,15 (2Н, м), 2,67-2,53 (2Н, м), 2,19-2,11 (1Н, м), 2,08-1,98 (1Н, м), 1,95-1,85 (1Н, м), 1,72-1,61 (1Н, м).
(3) Оптически активный 1-трет-бутиловый 2-метиловый диэфир 2-аллилпирролидин-1,2-дикарбоновой кислоты
[Химическая формула 114]
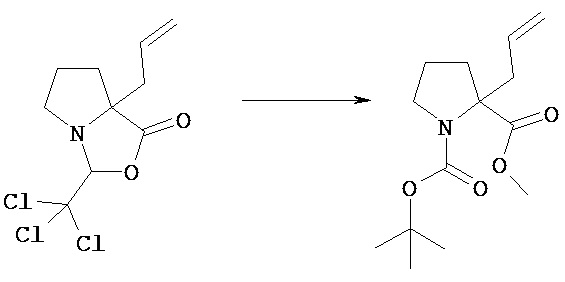
К раствору 7а-аллил-3-трихлорметилтетрагидропирроло[1,2-с]оксазол-1-она (86,1 г) в метаноле (430 мл), охлажденному до 0°C, прибавляют по каплям концентрированную серную кислоту (43 мл) и затем смесь перемешивают в течение 13,5 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. Затем к полученному остатку прибавляют этилацетат (500 мл) и смесь экстрагируют водой (500 мл). Отделенный органический слой еще раз экстрагируют водой (300 мл). Объединенный водный слой нейтрализуют 4М водным раствором гидроксида натрия, доводят pH до 7,5. К смеси прибавляют бикарбонат натрия (55 г), затем раствор ди-трет-бутилдикарбоната (85,7 г) в тетрагидрофуране (430 мл) при комнатной температуре и смесь перемешивают в течение ночи. К смеси прибавляют этилацетат (800 мл), и смесь экстрагируют.Отделенный органический слой промывают последовательно водой (1000 мл) и насыщенным водным раствором хлорида натрия (500 мл). Отделенный водный слой также экстрагируют этилацетатом (400 мл). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=30/1-10/1), получая указанное в заголовке соединение (61,2 г).
1H-NMR (CDCl3) δ: 5,82-5,70 (1,0Н, м), 5,16-5,14 (1,ОН, м), 5,13-5,09 (1,0Н, м), 3,73-3,66 (0,7Н, м), 3,72 (3,0Н, с), 3,63-3,56 (0,3H, м), 3,42-3,31 (1,0Н, м), 3,14-3,07 (0,3H, м), 2,96-2,89 (0,7Н, м), 2,65-2,57 (1,0Н, м), 2,17-1,98 (2,0Н, м), 1,94-1,75 (2,0Н, м), 1,46 (3,0Н, с), 1,43 (6,0Н,с).
(4) Оптически активный 1-трет-бутиловый 2-метиловый диэфир 2-(3-гидроксипропил)пирролидин-1,2-дикарбоновой кислоты
[Химическая формула 115]
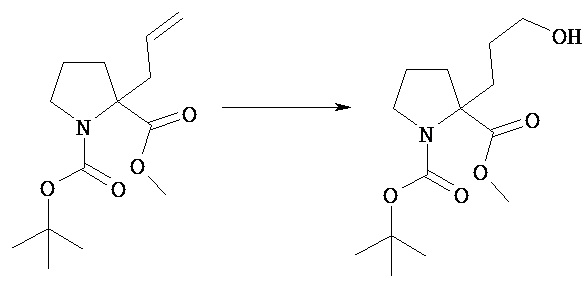
К раствору 1-трет-бутияового 2-метилового диэфира 2-аллилпирролидин-1,2-дикарбоновой кислоты (25,0 г) в тетрагидрофуране (125 мл), охлажденному до 0°C, за 30 минут прибавляют по каплям комплекс боран-тетрагидрофуран (1,0 М раствор в тетрагидрофуране, 105 мл) и смесь перемешивают при той же температуре в течение 2,5 часов. К реакционной смеси прибавляют по каплям дополнительную порцию комплекса боран-тетрагидрофуран (1,0 М раствор в тетрагидрофуране, 11 мл) и смесь перемешивают при той же температуре в течение 50 минут. К реакционной смеси за 30 минут прибавляют по каплям воду (180 мл), затем прибавляют небольшими порциями моногидрат пероксобората натрия (12,0 г). Смесь нагревают до комнатной температуры и перемешивают в течение ночи, затем прибавляют воду (500 мл). Смесь экстрагируют этилацетатом (600 мл). Отделенный органический слой промывают 20% водным раствором тиосульфата (600 мл) и насыщенным водным раствором хлорида натрия. Отделенный водный слой два раза экстрагируют этилацетатом (300 мл, 200 мл). Объединенный органический слой сушат над безводным сульфатом натрия, и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=2/1-1/1), получая указанное в заголовке соединение (17,4 г).
1H-NMR (CDCb) δ: 3,77-3,59 (2Н, м), 3,71 (3H, с), 3,47-3,36 (1Н, м), 2,37-1,76 (7Н, м), 1,68-1,50 (3H, м), 1,45 (4Н, с), 1,41 (5Н, с).
(5) Оптически активное соединение 1-трет-бутиловый 2-метиловый диэфир 2-(3-оксопропил)пирролидин-1,2-дикарбоновой кислоты
[Химическая формула 116]
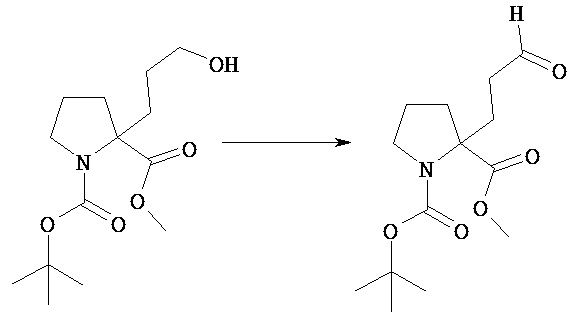
К суспензии 1-трет-бутилового 2-метилового диэфира 2-(3-гидроксипропил)пирролидин-1,2-дикарбоновой кислоты (17,4 г) и бикарбоната натрия (12,7 г) в хлороформе (175 мл), охлажденной до 0°С, прибавляют периодинан Десса-Мартина (28,3 г). Реакционную смесь нагревают до комнатной температуры и перемешивают в течение 1,5 часов. К реакционной смеси прибавляют дополнительное количество периодинана Десса-Мартина (1,0 г) и смесь перемешивают в течение 50 минут.К реакционной смеси, охлажденной до 0°C, прибавляют дополнительное количество периодинана Десса-Мартина (15 г) и смесь перемешивают в течение 2 часов. К смеси прибавляют 20% тиосульфат натрия (250 мл) и насыщенный водный раствор бикарбоната натрия (250 мл) и перемешивают при комнатной температуре в течение 20 минут. Смесь два раза экстрагируют хлороформом (200 мл × 2) и объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=4/1-3/2), получая указанное в заголовке соединение (5,68 г).
1H-NMR (CDCl3) δ: 9,78-9,76 (0,5Н, м), 9,70-9,68 (0,5Н, м), 3,76-3,69 (3,5Н, м), 3,61-3,52 (0,5Н, м), 3,44-3,32 (1,0Н, м), 2,68-2,40 (3,0Н, м), 2,29-2,06 (2,0Н, м), 2,03-1,76 (3,0Н, м), 1,44 (4,0Н, с), 1,41 (5,0Н, с).
(6) Оптически активный 1-трет-бутиловый 2-метиловый диэфир 2-(3-бензиламинопропил)пирролидин-1,2-дикарбоновой кислоты
[Химическая формула 117]
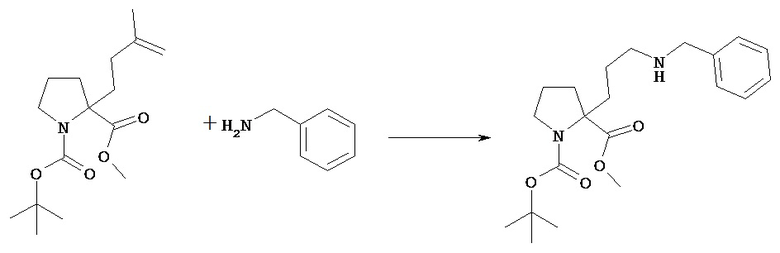
К раствору 1-трет-бутилового 2-метилового диэфира 2-(3-оксопропил)пирролидин-1,2-дикарбоновой кислоты (5,68 г) в тетрагидрофуране (57 мл) прибавляют бензиламин (6,53 мл) при комнатной температуре и смесь перемешивают в течение 1 часа. Смесь охлаждают до 0°С и прибавляют триацетоксиборгидрид натрия (5,07 г). Смесь перемешивают при комнатной температуре в течение 12,5 часов. К реакционной смеси прибавляют воду (12 мл) и насыщенный водный раствор хлорида аммония (200 мл) и экстрагируют 4 раза смесью н-гексан/этилацетат (1/2, 210 мл × 2, 120 мл × 2). К объединенному органическому слою прибавляют н-гексан (150 мл), и смесь 3 раза экстрагируют 10% водным раствором бисульфата калия (180 мл × 3). Объединенный водный слой нейтрализуют 4 М водным раствором гидроксида натрия до pH 7-8 и прибавляют насыщенный водный раствор бикарбоната натрия (100 мл). Смесь экстрагируют этилацетатом (200 мл). Отделенный водный слой дважды экстрагируют этилацетатом (200 мл × 2) и объединенный органический слой промывают насыщенным водным раствором хлорида натрия (200 мл). Органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (7,69 г).
1H-NMR (CDCl3) δ: 7,27-7,35 (5H, м), 3,80 (2Н, с), 3,65-3,75 (0,7Н, м), 3,69 (3H, с), 3,55-3,65 (0,5Н, м), 3,31-3,45 (1Н, м), 2,60-2,71 (2Н, м), 2,25-2,35 (0,2Н, м), 2,10-2,21 (0,5Н, м), 2,04 (1,ОН, с), 1,97-2,11 (2,4Н, м), 1,74-1,93 (3,ОН, м), 1,45-1,65 (1,7Н, м), 1,44 (3,5Н, с), 1,38 (5,5Н, с)
(7) Оптически активный метиловый эфир 2-(3-бензиламинопропил)пирролидин-2-карбоновой кислоты
[Химическая формула 118]
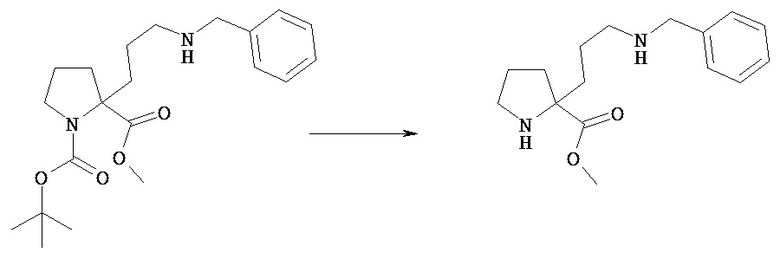
К раствору 1-трет-бутилового 2-метилового диэфира 2-(3-бензиламинопропил)пирролидин-1,2-дикарбоновой кислоты (7,69 г) в хлороформе (38 мл), охлажденному до 0°C, прибавляют 4 М соляную кислоту в этилацетате (18 мл) и смесь перемешивают при комнатной температуре в течение 3 часов. К смеси прибавляют дополнительное количество 4 М соляной кислоты в этилацетате (20 мл) и перемешивают при комнатной температуре в течение 50 минут. Реакционную смесь концентрируют при пониженном давлении и затем прибавляют насыщенный водный раствор бикарбоната натрия (150 мл). Смесь 4 раза экстрагируют хлороформом (100 мл × 2, 75 мл × 2). Объединенный органический слой сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая указанное в заголовке соединение (7,49 г).
1H-NMR (CDCl3) δ [delta]: 7,35-7,22 (5H, м), 3.77 (2Н, с). 3,71 (3H, с), 3,02-2,92 (2Н, м), 2,65-2,58 (2Н, м), 2,21-2,13 (1Н, м), 1,92-1,50 (8Н, м), 1,43-1,31 (1Н, м).
(8) Оптически активный 7-бензил-1,7-диазоспиро[4.5]декан-6-он
[Химическая формула 119]
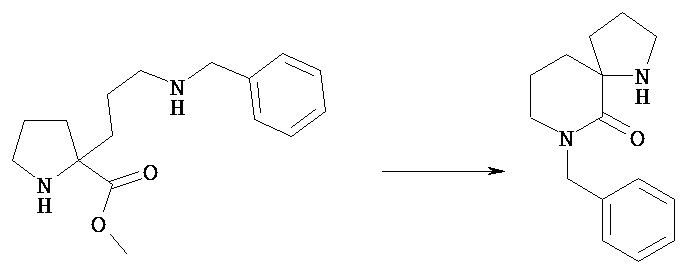
Раствор метилового эфира 2-(3-бензиламинопропил)пирролидин-2-карбоновой кислоты (133 мг) в ксилоле (1,5 мл) перемешивают при 130°C в течение ночи. Смесь охлаждают до комнатной температуры и очищают колоночной хроматографией на силикагеле (элюент:хлороформ/метанол=10/1), получая указанное в заголовке соединение (90 мг).
1Н NMR (CDCl3) δ: 7,35-7,21 (5H, м), 4,68 (1Н, д, J=14,6 Гц), 4,48 (1Н, д, J=14,6 Гц), 3,31-3,18 (3Н, м), 2,90-2,83 (1Н, м), 2,12-2,04 (1Н, м), 1,99-1,80 (7Н, м), 1,78-1,70 (1Н, м).
(9) Оптически активный отрете-бутиловый эфир 7-бензил-6-оксо-1,7-диазоспиро[4.5]декан-1-карбоновой кислоты
[Химическая формула 120]
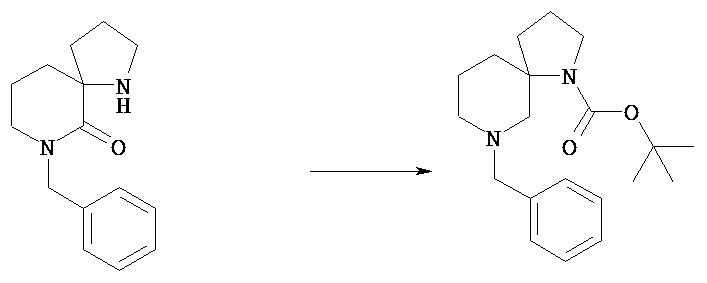
К суспензии алюмогидрида лития (45 мг) в тетрагидрофуране (1,5 мл), охлажденной до 0°C, прибавляют концентрированную серную кислоту (31 мкл) и смесь перемешивают в течение 50 минут. К смеси прибавляют по каплям раствор 7-бензил-1,7-диазоспиро[4.5]декан-6-она (90 мг) в тетрагидрофуране (0,5 мл) при 0°C и смесь перемешивают при той же температуре в течение 40 минут. К реакционной смеси последовательно прибавляют воду (45 мкл), 4 М водный раствор гидроксида натрия (45 мкл) и воду (45 мкл), смесь перемешивают в течение 30 минут. К смеси прибавляют этилацетат и безводный сульфат магния, смесь фильтруют через целит. К фильтрату при комнатной температуре прибавляют ди-тиретп-бутилдикарбонат (112 мг) и смесь перемешивают в течение 100 минут. Реакционную смесь концентрируют при пониженном давлении и очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=10/1 to 5/1), получая указанное в заголовке соединение (76 мг).
1H-NMR (ДМСО-D6) δ: 7,36-7,28 (4Н, м), 7,25-7,20 (1Н, м), 3,72-3,67 (2Н, м), 3,62 (2Н, с), 3,58 (1Н, с), 3,56-3,45 (1Н, м), 3,31-3,22 (1Н, м), 2,55-2,47 (1Н, м), 2,17-1,90 (3Н, м), 1,83-1,72 (3H, м), 1,54-1,41 (1Н, м), 1,37 (3H, с), 1,33-1,23 (1Н, м), 1,29 (6Н, с).
(10) Оптически активный трет-бутиловый эфир 1,7-диазоспиро[4.5]декан-1-карбоновой кислоты
[Химическая формула 121]
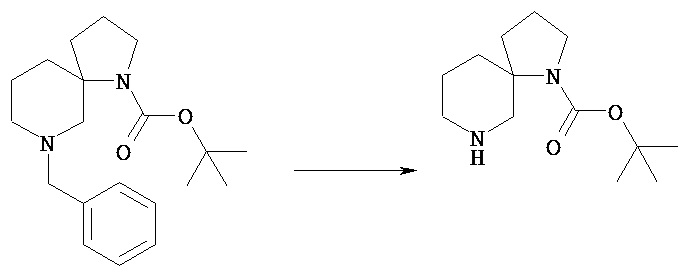
К раствору трет-бугиловото эфира 7-бензил-6-оксо-1,7-диазоспиро[4.5]декан-1-карбоновой кислоты (76 мг) в смеси тетрагидрофуран/метанол (1 мл/1 мл) прибавляют 20% гидроксид палладия на угле (15 мг) и смесь гидрируют под давлением 4 атмосферы. Смесь фильтруют через целит в атмосфере азота, фильтрат концентрируют при пониженном давлении и получают указанное в заголовке соединение (51 мг).
1H-NMR (CDCl3) δ: 3,57-3,31 (3H, м), 3,00-2,87 (1Н, м), 2,78-2,39 (3Н, м), 2,17-2,07 (1Н, м), 1,93-1,78 (1Н, м), 1,76-1,62 (3Н, м), 1,53-1,42 (12Н, м).
(11) Оптически активный трете-бутиловый эфир 7-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,7-диазоспиро[4.5]декан-1-карбоновой кислоты
[Химическая формула 122]
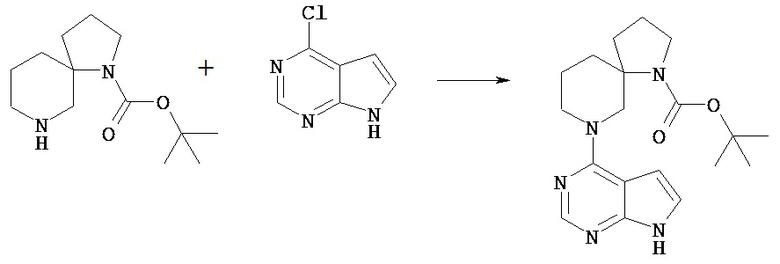
Трет-бутиловый эфир 1,7-диазоспиро[4.5]декан-1-карбоновой кислоты (51 мг) смешивают с 4-хлор-7Н-пирроло[2,3-d]пиримидином (36 мг), карбонатом калия (59 мг) и водой (1 мл) и смесь перемешивают в течение 1,5 часов при кипячении с обратным холодильником. Смесь охлаждают до комнатной температуры, прибавляют воду и экстрагируют хлороформом. Органический слой промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:н-гексан/этилацетат=1/1, затем хлороформ/метанол=20/1), получая указанное в заголовке соединение (60 мг).
1H-NMR (CDCl3) δ: 10,58-10,90 (1Н, м), 8,30 (1Н, ш.с), 7,07 (1Н, ш.с), 6,48-6,56 (1Н, м), 4,66-4,87 (1Н, м), 4,52-4,62 (1Н, м), 3,82-3,95 (0,6Н, м), 3,50-3,75 (1,4Н, м), 3,31-3,50 (1Н, м), 3,04-3,20 (0,6Н, м), 2,85-3,04 (1Н, м), 2,58-2,74 (0,4Н, м), 1,98-2,14 (1Н, м), 1,40-1,90 (6Н, м), 1,54 (3,6Н, с), 1,48 (5,4Н, с)
(12) Оптически активный 4-(1,7-диазоспиро[4.5]дец-7-ил)-7Н-пирроло[2,3-d]пиримидин
[Химическая формула 123]
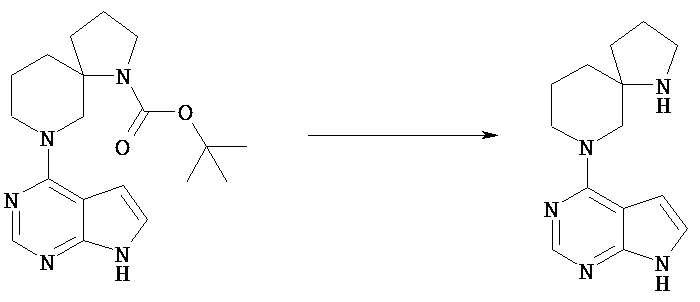
К раствору трет-бутилового эфира 7-(7Н-пирроло[2.3-d]пиримидин-4-ил)-1,7-диазоспиро[4.5]декан-1-карбоновой кислоты (60 мг) в хлороформе (1,0 мл) прибавляют 4М соляную кислоту в этилацетате (1,5 мл) и 2 М соляную кислоту в метаноле (0,5 мл), смесь перемешивают при комнатной температуре в течение 2,5 часов. Реакционную смесь концентрируют при пониженном давлении и затем подвергают азеотропной перегонке с толуолом. Остаток нейтрализуют прибавлением 4 М водного раствора гидроксида натрия и к нему прибавляют насыщенный водный раствор хлорида натрия. Смесь экстрагируют хлороформом. Отделенный органический растворитель концентрируют при пониженном давлении, получая указанное в заголовке соединение (30 мг).
1H-NMR (CDCl3) δ: 9,26 (1Н, ш.с), 8,28 (1Н, с), 7,04 (1Н, д, J=3,7 Гц), 6,52 (1Н, д, J=3,7 Гц), 3,92-3,86 (2Н, м), 3,81 (1Н, д, J=13,0 Гц), 3,72 (1Н, д, J=13,0 Гц), 3,10-3,00 (2Н, м), 1,94-1,80 (3Н, м), 1,78-1,70 (5Н, м), 1,55-1,47 (1Н, м).
(13) Оптически активный 3-оксо-3-[7-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,7-диазоспиро[4.5]дец-1-ил)пропионитрил
[Химическая формула 124]
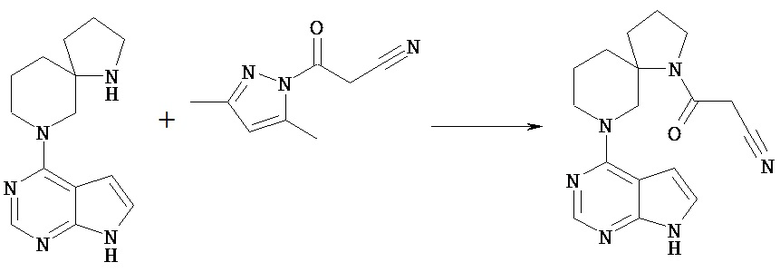
4-(1,7-Диазоспиро[4.5]дец-7-ил)-7Н-пирроло[2,3-а]пиримидин (30 мг) смешивают с 1-цианоацетил-3,5-диметилпиразолом (38 мг), N,N-диизопропилэтиламином (42 мкл) и 1,4-диоксаном (1 мл), смесь перемешивают при 110°C в течение 75 минут. Затем смесь охлаждают до комнатной температуры и прибавляют насыщенный водный раствор бикарбоната натрия. Смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток очищают колоночной хроматографией на силикагеле (элюент:хлороформ/этилацетат=1/2, затем хлороформ/метанол=25/1-20/1) и получают указанное в заголовке соединение (32 мг).
1H-NMR(ДМСО-D6) δ: 11,69 (1Н, ш.с), 8,09 (1Н, с), 7,19-7,15 (1Н, м), 6,59-6,55 (1Н, м), 4,74-4,66 (1Н, м), 4,55-4,47 (1Н, м), 3,95 (2Н, с), 3,86-3,78 (1Н, м), 3,57-3,48 (1Н, м), 3,45-3,37 (1Н, м), 2,99-2,82 (2Н, м), 1,89-1,68 (4Н, м), 1,66-1,56 (2Н, м), 1,55-1,47 (1Н, м).
[α]D=+185,58° (25°С., с=1,04, метанол)
[Получение 8]
Оптически активный 3-[3-метил-6-(7Н-пирроло[2,3-d]пиримидин-4-ил)-1,6-диазоспиро[3.4]окт-1-ил]-3-оксопропионитрил (Соединение 6) обрабатывают общепринятым методом и получают его моногидрат.
1H-NMR (ДМСО-D6) δ: 11,60 (1Н, ш.с), 8,08 (1Н, с), 7,11 (1Н, с), 6,58 (1Н, с), 4,16 (1Н, дд, J=8,2; 8,2 Гц), 4,11-3,61 (6Н, м), 3,57 (1Н, дд, J=7,65; 6,26 Гц), 2,70-2,57 (2Н, м), 2,24-2,10 (1Н, м), 1,11 (3Н, д, J=6,9 Гц).
В следующих ниже таблицах 1-3 показаны структурные формулы и 1H-NMR спектральные данные соединений 1-95, вышеописанными способами. 1H-NMR спектры записывают в CDCl3 или ДМСО-d6, используя тетраметилсилан в качестве внутреннего стандарта, и все значения 5 приведены в м.д. Если не указано иное, в ЯМР спектроскопии для измерений используют рабочую частоту 400 МГц.
Сокращения в таблице имеют следующие значения:
с - синглет
д - дублет
т - триплет
кв - квартет
дд - дублет дублетов
ддд - дублет дублетов дублетов
ш.с - широкий синглет
м - мультиплет
J - константа спин-спинового взаимодействия.

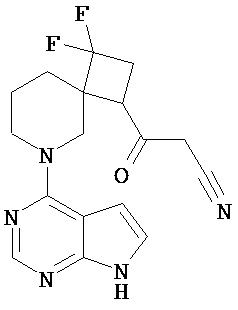
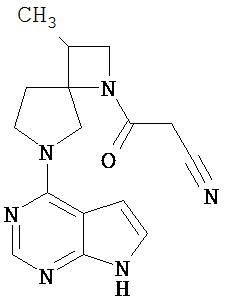
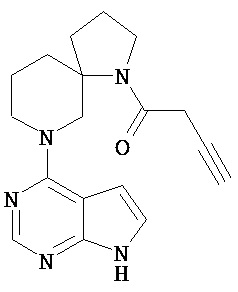
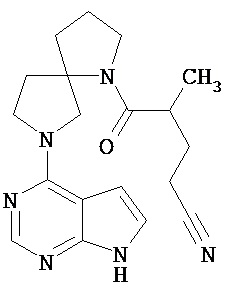




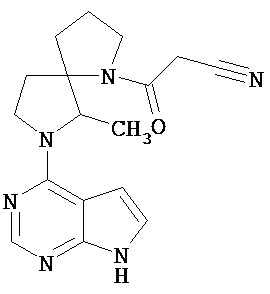
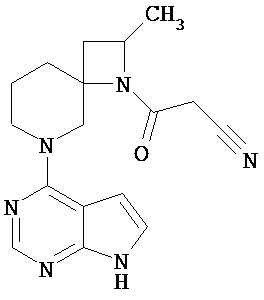

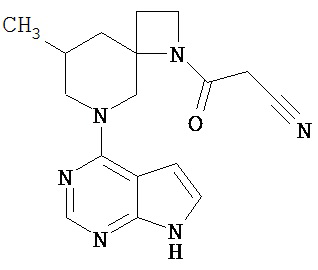
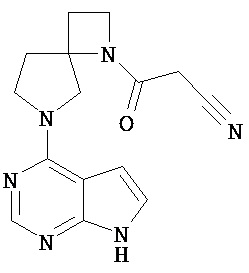
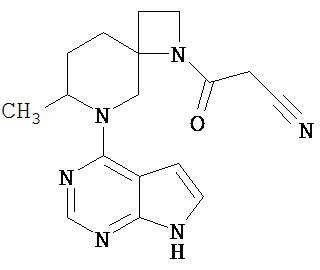
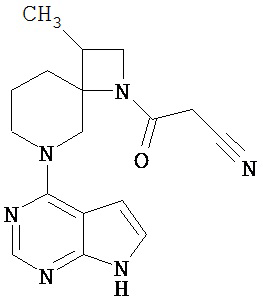
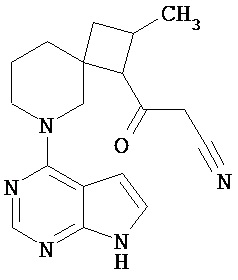

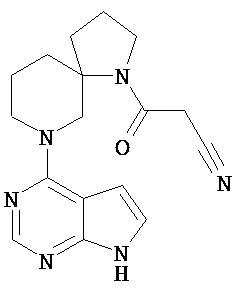
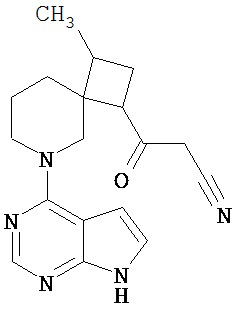
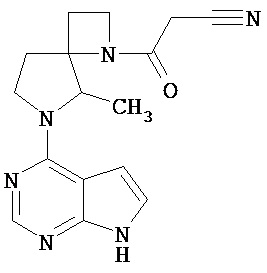
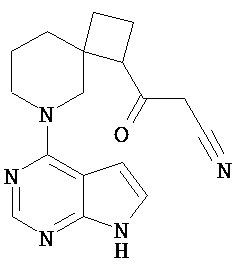
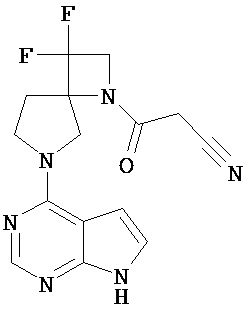
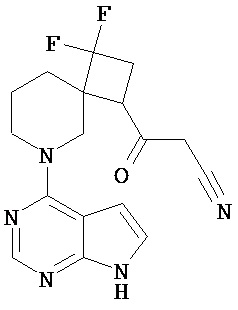
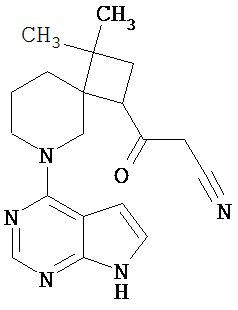
Таблица 1-8
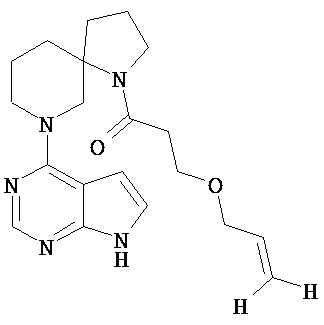
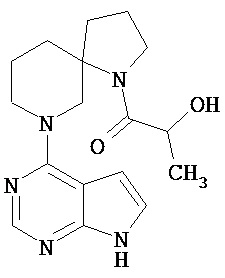
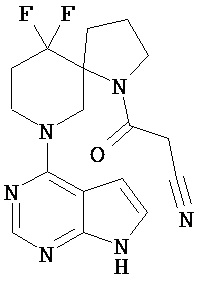
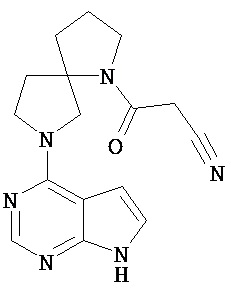
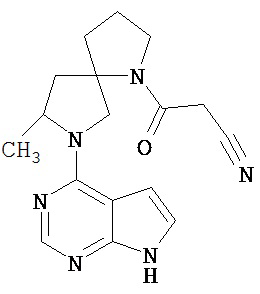
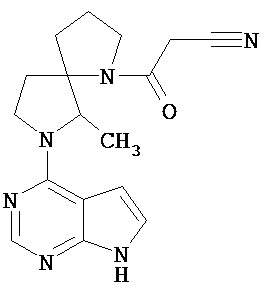
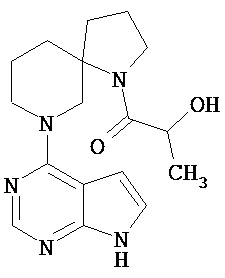

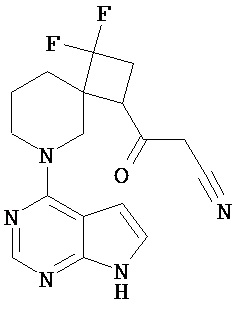
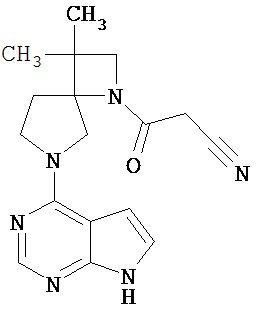
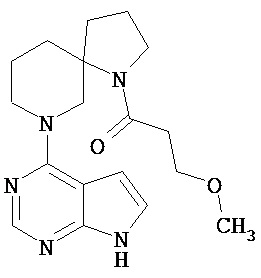
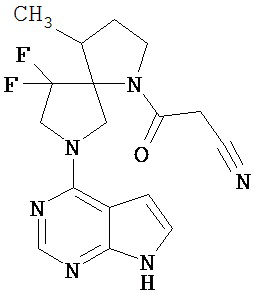
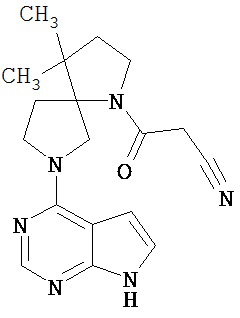
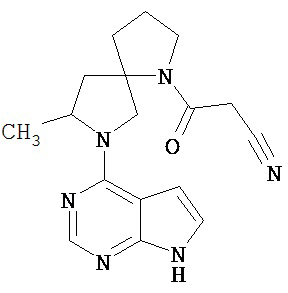
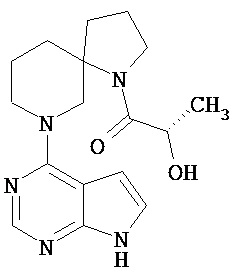
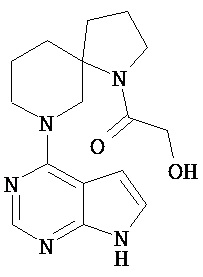
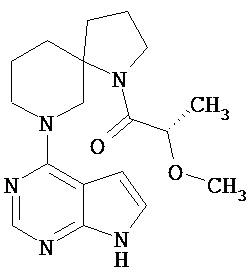
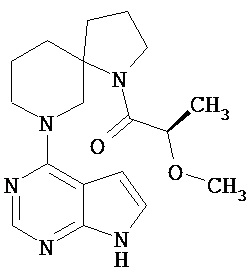
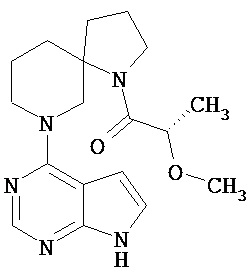
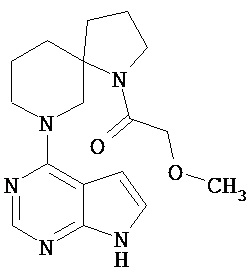
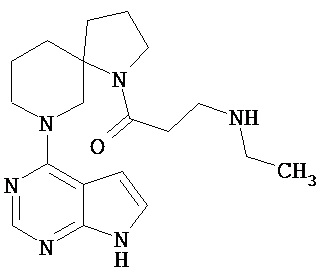
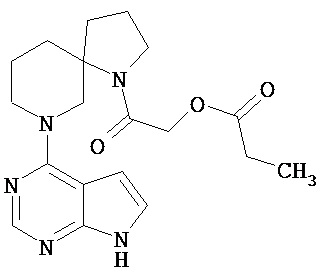
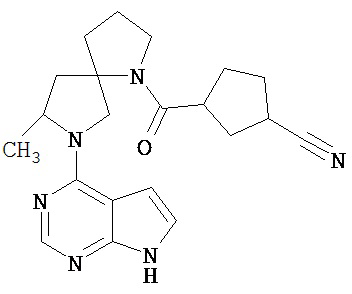
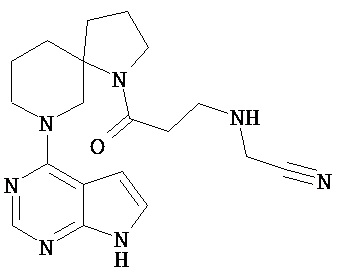
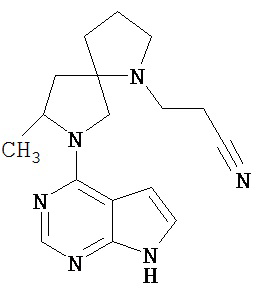
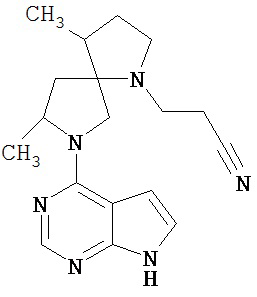
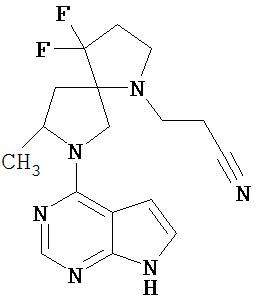
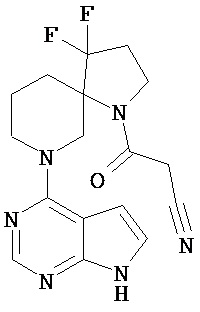
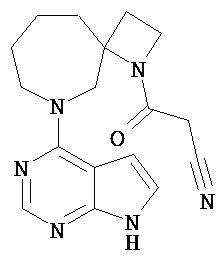
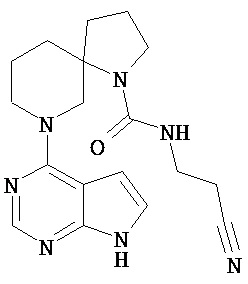
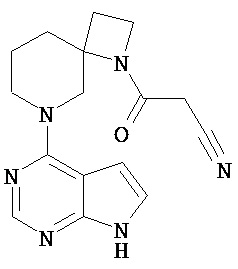
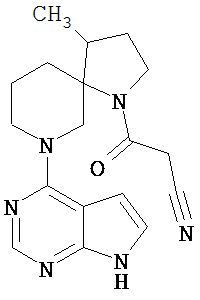
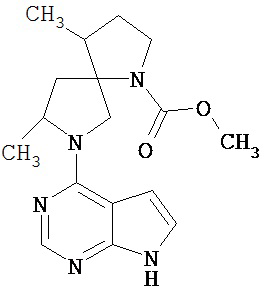
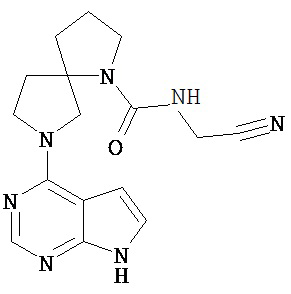
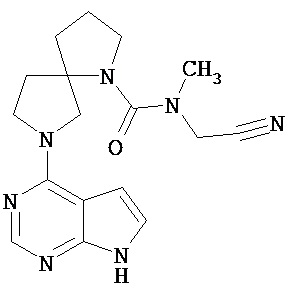
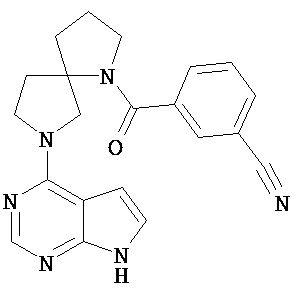
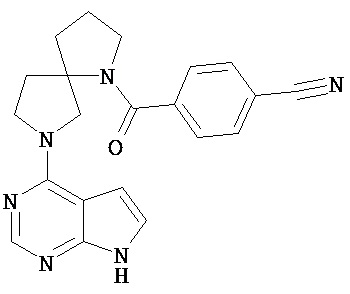
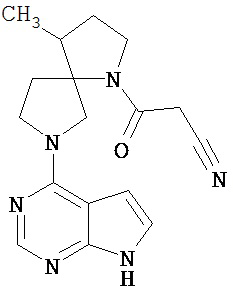
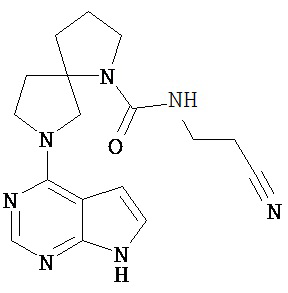
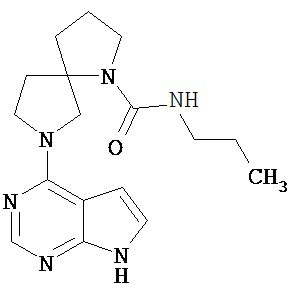
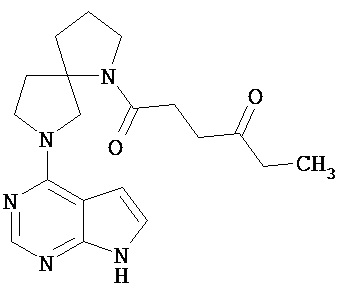

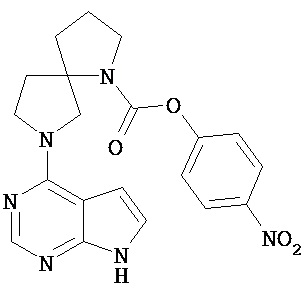
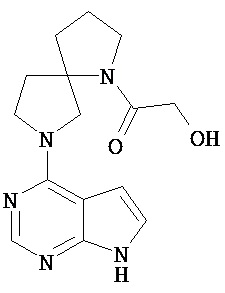
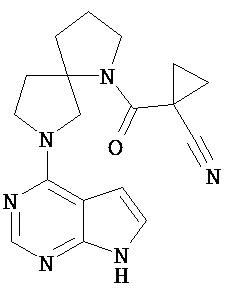
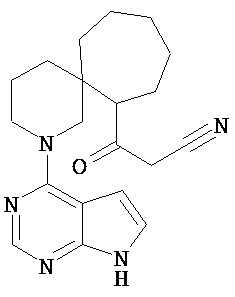
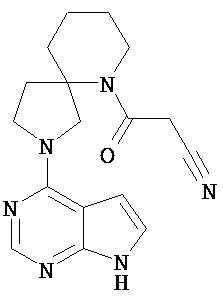
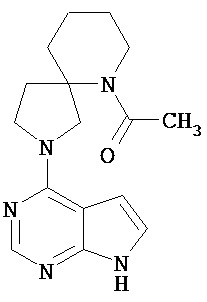
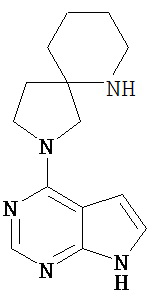
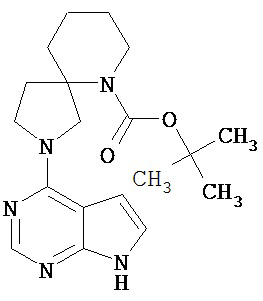
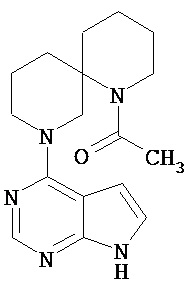
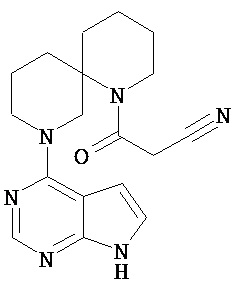
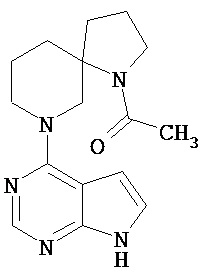
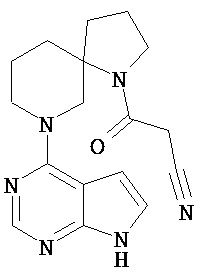
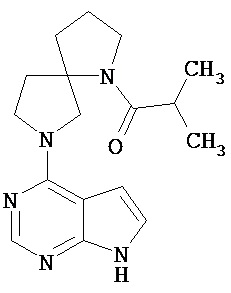
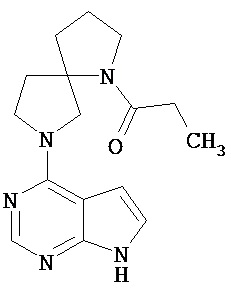
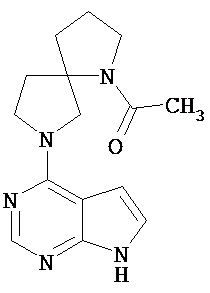
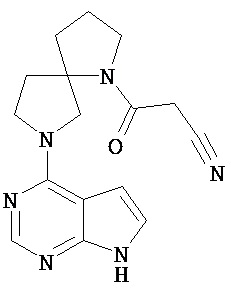
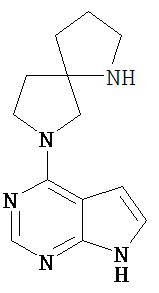
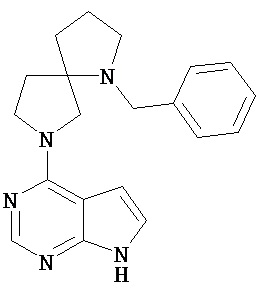
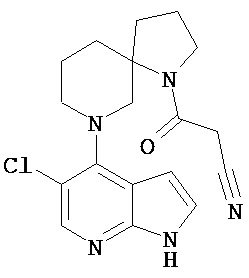
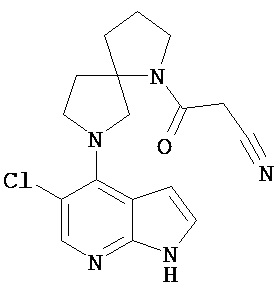
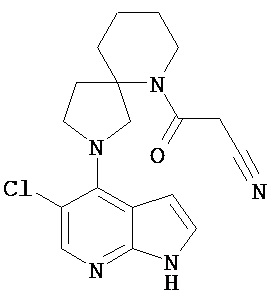
В следующей ниже таблице 4 представлены химические структуры соединений, абсолютные конфигурации которых указаны среди приведенных выше оптически активных соединений.
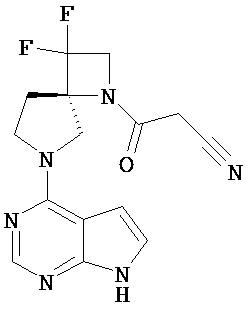
[Тест 1]
Ингибирующую активность тестируемых соединений в отношении JAK3 оценивают по следующим реакциям киназ.
В реакциях киназ используют слитые белки (слитые 6Н18-меченые домены киназ hJAK.3 (aa781-end)), которые соэкспрессированы в клетках Sf21 и очищены Ni2+/NTA агарозой. Реакции киназ инициируют прибавлением растворов (а)-(с) в 96-луночные белые планшеты с половинным объемом лунок (планшеты Coming Incorporated 3642).
(a) 5 мкмоль/л ТК. субстрат-биотин (Cisbio), разбавленный киназным буфером (50 ммоль/л 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (pH 7,0)), 0,02% азида натрия, 0,1 ммоль/л ванадата натрия, 5 ммоль/л хлорида магния, 1 ммоль/л дитиотреитола, 0,01% альбумина бычьей сыворотки), 25 мкмоль/л АТФ, 250 нмоль/л раствора добавочного ферментного буфера (Cisbio): 10 мкл на лунку.
(b) Раствор тестируемого вещества, приготовленный с использованием киназного буфера, содержащий 5% диметилсульфоксида: 10 мкл на лунку.
(c) 33 нг/мл фермента hJAK.3, разбавленного киназным буфером: 30 мкл на лунку.
Контрольной лункой считают лунку, в которую не добавляют АТФ.
Планшеты выдерживают при комнатной температуре в течение 10 минут от начала реакций.
В планшеты прибавляют (50 мкл на лунку) буфер для детектирования, содержащий ТК-антитело-криптат (5 тестов/50 мкл) и конъюгат стрептоавидина XL665 (62,5 нмоль/л) реагент (50 ммоль/л 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (pH 7,0), 20 mM ЭДТК, 800 ммоль/л фторида калия, 0,1% альбумина бычьей сыворотки).
Через 1 час после прибавления буфера для детектирования, для каждой лунки считывающим устройством для микропланшетов измеряют флуоресценцию. Более конкретно, измеряли флуоресценцию при длине волны 620 нм, возбужденную в области 337 нм, и флуоресценцию при длине волны 665 нм, возбужденную флуоресценцией в области 620 нм.
Отношение в каждой лунке рассчитывают из измеренной флуоресценции (флуоресценция при длине волны 665 нм/флуоресценция при длине волны 620 нм × 10000).
Данные получают, путем вычитания среднего отношения для контрольной лунки из отношения для каждой лунки. Величины IC50 (ИК50) испытываемых веществ рассчитывают из контрольных значений (%) двух доз до, а также после 50% при 100% в качестве контрольного значения (%) контрольного растворителя. Ингибирование в % также рассчитывают для концентраций 0,1 мкмоль/л или 1 мкмоль/л (при контрольных значениях 100%).
[Тест 2]
Ингибирующую активность испытываемых соединений в отношении JAK2 оценивают по следующим реакциям киназ.
В реакциях киназ используют слитые белки (слитые 6Н1з-меченые домены киназы hJAK2 (aa808-end)), которые соэкспрессированы в клетках Sf21 и очищены N12+/NTA агарозой. Реакции киназ инициируют прибавлением растворов (а)-(с) в 96-луночные белые планшеты с половинным объемом лунок (планшеты Coming Incorporated 3642).
(a) 5 мкмоль/л ТК субстрат-биотин (Cisbio), разбавленный киназным буфером (50 ммоль/л 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновой кислоты (pH 7,0)), 0,02% азида натрия, 0,1 ммоль/л ванадата натрия, 5 ммоль/л хлорида магния, 1 ммоль/л дитиотреитола, 0,01% альбумина бычьей сыворотки), 25 мкмоль/л АТФ, 250 нмоль/л раствора добавочного ферментного буфера (Cisbio): 10 мкл на лунку.
(b) Раствор тестируемого вещества, приготовленный с использованием киназного буфера, содержащий 5% диметилсульфоксида: 10 мкл на лунку.
(c) 7 нг/мл фермента hJAK3, разбавленного киназным буфером: 30 мкл на лунку.
[0276] Контрольной лункой считают лунку, в которую не добавляют АТФ.
Планшеты выдерживают при комнатной температуре в течение 10 минут от начала реакций.
В планшеты прибавляют буфер для детектирования (50 мкл на лунку), содержащий ТК-антитело-криптат (5 тестов/50 мкл) и конъюгат стрептоавидина XL665 (62,5 нмоль/л) реагент (50 ммоль/л 4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота (pH 7,0), 20 mM ЭДТК, 800 ммоль/л фторида калия, 0,1% альбумина бычьей сыворотки).
Через 1 час после прибавления буфера для детектирования, для каждой лунки считывающим устройством для микропланшетов измеряют флуоресценцию. Более конкретно, измеряют флуоресценцию при длине волны 620 нм, возбужденную в области 337 нм, и флуоресценцию при длине волны 665 нм, возбужденную флуоресценцией при длине волны 620 нм.
Отношение для каждой лунке рассчитывают из измеренной флуоресценции (флуоресценция при длине волны 665 нм/флуоресценция при 620 нм × 100000).
Данные получают, путем вычитания среднего отношения для контрольной лунки из отношения в каждой лунке. Величины IC50 (ИК50) испытываемых веществ рассчитывают из контрольных значений (%) двух доз до, а также после 50% в 100% в качестве контрольного значения (%) контрольного растворителя.
В следующих ниже таблицах 5-7 показаны данные по ингибирующей активности в отношении JAK.3 или данные по проценту ингибирования для соединений 1-95.
В следующей таблице 8 представлены данные по ингибирующей активности в отношении JAK2 или данные по проценту ингибирования для соединений 1-7.
[Композиции]
Примеры композиций по настоящему изобретению включают следующие композиции. Однако, подразумевается, что настоящее изобретение не ограничивается ими.
Композиция 1 (Препарат для капсул)
Компоненты 1), 2), 3) и 4) смешивают и заполняют желатиновые капсулы.
Композиция 2 (Препарат для таблеток)
Компоненты 1), 2) и 3) целиком, а также 30 г компонента 4) смешивают с водой, сушат в вакууме и затем гранулируют. Полученные гранулы смешивают с 14 г компонента 4) и 1 г компонента 5) и таблетируют в машине для изготовления таблеток. В этом случае получают 1000 таблеток, в каждой из которых содержится соединение 1 (10 мг).
Промышленная применимость
Настоящее изобретение применимо для лечения или профилактики:
(a) отторжения трансплантатов органов, реакции "трансплантат против хозяина" после трансплантации;
(b) аутоиммунных заболеваний, включающих ревматоидный артрит, псориаз, псориатический артрит, рассеянный склероз, язвенный колит, болезнь Крона, системную эритематозную волчанку, диабет I типа, тяжелую миастению, болезнь Кастлемена, ювенильный идиопатический артрит, сухость глаз и
(c) аллергических заболеваний, включающих астму, атопический дерматит, ринит. Настоящее изобретение также применимо для лечения или профилактики хронических миелопролиферативных заболеваний, включающих истинную полицитемию, первичный миелофиброз, эссенциальную тромбоцитемию и т.п.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЭТИЛЕНДИАМИНА И СОДЕРЖАЩИЕ ИХ ИНГИБИТОР FXa И АНТИКОАГУЛЯНТ | 2001 |
|
RU2268259C2 |
| ПРОИЗВОДНЫЕ ГУАНИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СПОСОБ ИНГИБИРОВАНИЯ NA/H - ОБМЕНА В КЛЕТКАХ | 1994 |
|
RU2141946C1 |
| РЕТИНОИДОПОДОБНЫЕ СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ | 1996 |
|
RU2163590C2 |
| ИНГИБИТОР ЭКСПРЕССИИ ИНТЕГРИНА | 2001 |
|
RU2240826C2 |
| ПРОИЗВОДНЫЕ БЕНЗОПИРАН-2-ОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 1997 |
|
RU2194052C2 |
| НОВОЕ ПРОИЗВОДНОЕ КУМАРИНА, ОБЛАДАЮЩЕЕ ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2007 |
|
RU2428420C2 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2795512C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| СУЛЬФОНИЛМОЧЕВИНЫ И РОДСТВЕННЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2739356C2 |
| ЗАМЕЩЕННЫЕ ПИРАЗОЛХИНАЗОЛИНОВЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ | 2011 |
|
RU2652638C2 |
Изобретение относится к новому соединению общей формулы [I] и его фармацевтически приемлемой соли, обладающим свойствами ингибитора Янус-киназы, в частности Янус-киназы 3 и Янус-киназы 2. Соединения могут быть использованы для получения лекарственного средства для лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции «трансплантат против хозяина» после трансплантации, аутоиммунного заболевания, аллергических заболеваний и хронического миелопролиферативного заболевания. Заболевание может быть выбрано из ревматоидного артрита, псориаза, атопического дерматита или заболевание, вызванное с сухостью глаз. В общей формуле [I]
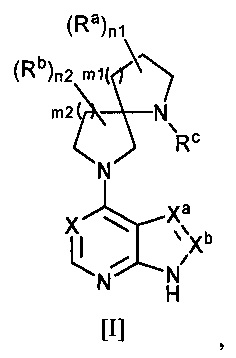
Ra одинаковые или разные и каждый представляет собой (1) C1-6 алкил или (2) атом галогена, n1 представляет собой целое число, выбранное из чисел от 0 до 2, Rb одинаковые или разные и каждый представляет собой (1) C1-6 алкил или (2) атом галогена, n2 представляет собой целое число, выбранное из чисел от 0 до 2, m1 представляет собой целое число, выбранное из чисел от 0 до 3, m2 представляет собой целое число, выбранное из чисел от 1 до 4, Ха=Xb представляет собой (1) СН=СН, (2) N=CH или (3) CH=N, X представляет собой (1) атом азота или (2) C-Rd, где Rd представляет собой атом водорода или атом галогена, Rc представляет собой группу, выбранную из следующих групп (1)-(6): (1) атом водорода, (2) С1-6 алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей ниже группы А, (3) -C(=O)-Rcl, (4) -C(=O)-O-Rc2, (5) -C(=O)-NRc3Rc4, где Rcl, Rc2, Rc3, Rc4 являются одинаковыми или разными и каждый представляет собой (i) атом водорода или (ii) С1-6 алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей ниже группы А, или (6) группы следующей формулы 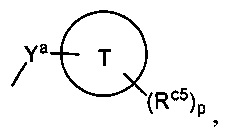
в которой Ya представляет собой группу, выбранную из следующих групп (i)-(iii) (i) С1-6 алкилен, (ii) -С(=O)- или (iii) -С(=O)-O-, кольцо Т представляет собой (i) фенил, (ii) С3-10 циклоалкил или (iii) насыщенный моногетероциклил, который содержит 1 атом азота, а также атомы углерода, и число атомов, составляющих кольцо, составляет 3-7, Rc5 являются одинаковыми или разными и каждый представляет собой (i) циано или (ii) нитрогруппу р представляет собой целое число, выбранное из чисел от 0 до 1, группа А представляет собой группу, состоящую из (a) гидроксила, (b) С1-6 алкокси, (c) циано, (d) C1-6 алкоксикарбонила, (e) С1-6 алкилкарбонилокси и (f) С2-6 алкенилокси. 20 н. и 40 з.п. ф-лы, 33 табл., 8 пр.
1. Соединение следующей общей формулы [I]
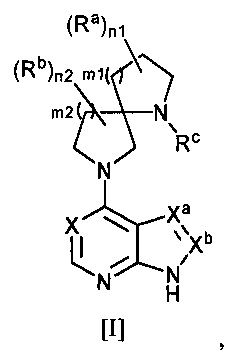
в котором Ra одинаковые или разные и каждый представляет собой
(1) C1-6алкил или
(2) атом галогена,
n1 представляет собой целое число, выбранное из чисел от 0 до 2,
Rb одинаковые или разные и каждый представляет собой:
(1) C1-6алкил или
(2) атом галогена,
n2 представляет собой целое число, выбранное из чисел от 0 до 2,
m1 представляет собой целое число, выбранное из чисел от 0 до 3,
m2 представляет собой целое число, выбранное из чисел от 1 до 4,
Ха=Xb представляет собой
(1) СН=СН,
(2) N=CH или
(3) CH=N,
X представляет собой:
(1) атом азота или
(2) C-Rd, где Rd представляет собой атом водорода или атом галогена,
Rc представляет собой группу, выбранную из следующих групп (1)-(6):
(1) атом водорода,
(2) С1-6алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей ниже группы А,
(3) -C(=O)-Rcl,
(4) -C(=O)-O-Rc2,
(5) -C(=O)-NRc3Rc4,
где Rcl, Rc2, Rc3, Rc4 являются одинаковыми или разными и каждый представляет собой:
(i) атом водорода или
(ii) С1-6алкил, необязательно замещенный 1-5 одинаковыми или разными заместителями, выбранными из следующей ниже группы А, или
(6) группы следующей формулы
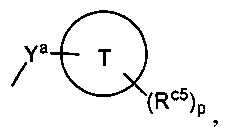
в которой Ya представляет собой группу, выбранную из следующих групп (i)-(iii):
(i) С1-6алкилен,
(ii) -С(=O)- или
(iii) -С(=O)-O-,
кольцо Т представляет собой:
(i) фенил,
(ii) С3-10циклоалкил или
(iii) насыщенный моногетероциклил, который содержит 1 атом азота, а также атомы углерода, и число атомов, составляющих кольцо, составляет 3-7,
Rc5 являются одинаковыми или разными и каждый представляет собой:
(i) циано или
(ii) нитрогруппу
р представляет собой целое число, выбранное из чисел от 0 до 1,
группа А представляет собой группу, состоящую из:
(a) гидроксила,
(b) С1-6алкокси,
(c) циано,
(d) C1-6алкоксикарбонила,
(e) С1-6алкилкарбонилокси и
(f) С2-6алкенилокси;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором в общей формуле [I] n1 представляет собой целое число, выбранное из чисел от 0 до 2,
n2 представляет собой целое число, выбранное из чисел от 0 до 2,
m1 представляет собой целое число, выбранное из чисел от 0 до 3,
m2 представляет собой целое число, выбранное из чисел от 1 до 3,
X представляет собой:
(1) атом азота или
(2) C-Rd, где Rd представляет собой атом галогена,
Rc представляет собой группу, выбранную из следующих групп (1)-(6):
(1) атом водорода,
(2) С1-6алкил, замещенный одним заместителем, выбранным из следующей ниже группы А,
(3) -C(=O)-Rcl,
(4) -C(=O)-O-Rc2,
(5) -C(=O)-NRc3Rc4,
где Rcl представляет собой C1-6алкил, необязательно замещенный одним заместителем, выбранным из следующей ниже группы А,
Rc2 представляет собой C1-6алкил,
Rc3 представляет собой C1-6алкил, необязательно замещенный одним заместителем, выбранным из следующей группы А,
Rc4 представляет собой
(i) атом водорода или
(ii) С1-6алкил или
(6) группа следующей формулы
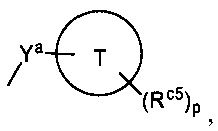
в которой Ya представляет собой группу, выбранную из следующих групп (i)-(iii):
(i) С1-6алкилен,
(ii) -С(=O)- или
(iii) -С(=O)-О,
кольцо Т представляет собой:
(i) фенил,
(ii) С3-6циклоалкил или
(iii) пирролидинил,
Rc5 представляет собой
(i) циано или
(ii) нитрогруппу,
р представляет собой целое число, выбранное из 0 или 1,
группа А представляет собой группу, состоящую из:
(a) гидроксила,
(b) С1-6алкокси,
(c) циано,
(d) С1-6алкоксикарбонила,
(e) С1-6алкилкарбонилокси и
(f) С2-6алкенилокси;
или его фармацевтически приемлемая соль.
3. Соединение по любому из пп. 1 или 2, в котором m1 представляет собой целое число 0 или 1 и m2 представляет собой целое число 1 или 2; или его фармацевтически приемлемая соль.
4. Соединение по п. 3, в котором комбинация (m1,m2) соответствует числам (1,2) и которое представляет собой соединение общей формулы [II]
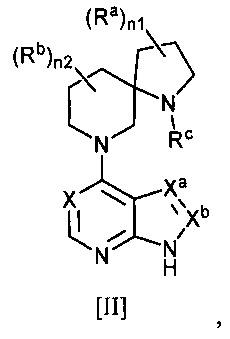
в которой каждый символ имеет то же значение, которое определено в п. 1; или его фармацевтически приемлемая соль.
5. Соединение по п. 3, в котором комбинация (m1,m2) соответствует числам (0,2) и которое представляет собой соединение общей формулы [III]
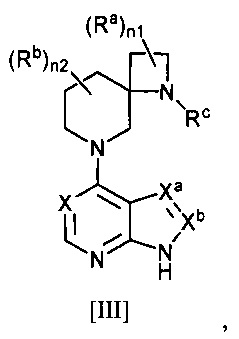
в которой каждый символ имеет то же значение, которое определено в п. 1; или его фармацевтически приемлемая соль.
6. Соединение по п. 3, в котором комбинация (m1,m2) соответствует числам
(0,1), и которое представляет собой соединение общей формулы [IV]
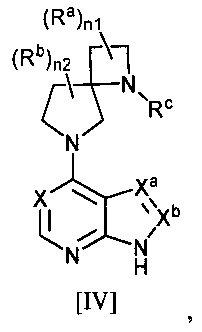
в которой каждый символ имеет то же значение, которое определено в п. 1; или его фармацевтически приемлемая соль.
7. Соединение по любому из пп. 1 или 2, в котором комбинация (m1,m2) выбрана из (0,3), (2,1), (2,2) или (3,2); или его фармацевтически приемлемая соль.
8. Соединение по любому из пп. 1 или 2, в котором Ха=Xb представляет собой СН=СН, и X представляет собой атом азота; или его фармацевтически приемлемая соль.
9. Соединение по любому из пп. 1 или 2, в котором комбинация (n1,n2) соответствует числам (0,0); или его фармацевтически приемлемая соль.
10. Соединение по любому из пп. 1 или 2, в котором комбинация (n1,n2) соответствует числам (1,0); или его фармацевтически приемлемая соль.
11. Соединение по любому из пп. 1 или 2, в котором комбинация (n1,n2) соответствует числам (0,1); или его фармацевтически приемлемая соль.
12. Соединение по любому из пп. 1 или 2, в котором комбинация (n1,n2) соответствует числам (2,0); или его фармацевтически приемлемая соль.
13. Соединение по любому из пп. 1 или 2, в котором комбинация (n1,n2) соответствует числам (0,2), или его фармацевтически приемлемая соль.
14. Соединение по любому из пп. 1 или 2, в котором Ra представляет собой метил или атом фтора, или его фармацевтически приемлемая соль.
15. Соединение по любому из пп. 1 или 2, в котором Rc представляет собой -C(=O)-Rcl, или его фармацевтически приемлемая соль.
16. Соединение по п. 15, в котором Rcl представляет собой C1-6 алкил, замещенный одной гидроксильной или цианогруппой, или его фармацевтически приемлемая соль.
17. Соединение по любому из пп. 1 или 2, в котором Rc представляет собой -C(=O)-NRc3Rc4, или его фармацевтически приемлемая соль.
18. Соединение по п. 17, в котором Rc3 представляет собой C1-6 алкил, замещенный одной цианогруппой, и Rc4 представляет собой водород, или его фармацевтически приемлемая соль.
19. Соединение по п. 1, выбранное из следующих химических структурных формул:
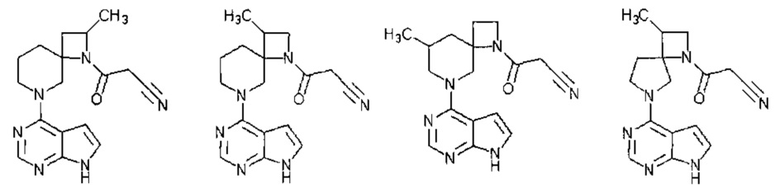
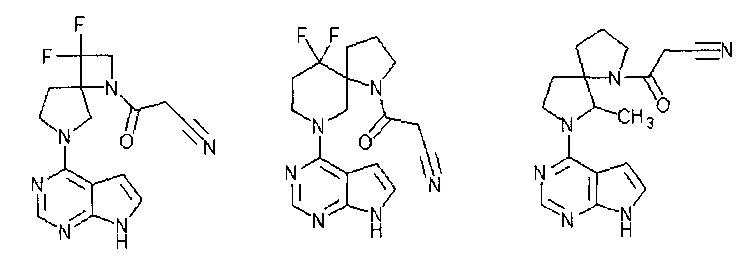
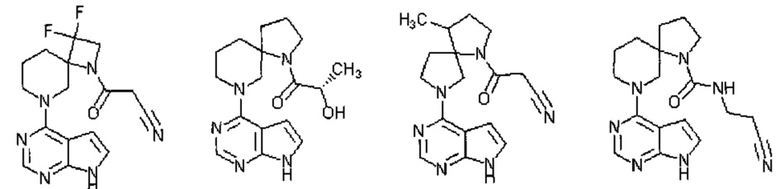
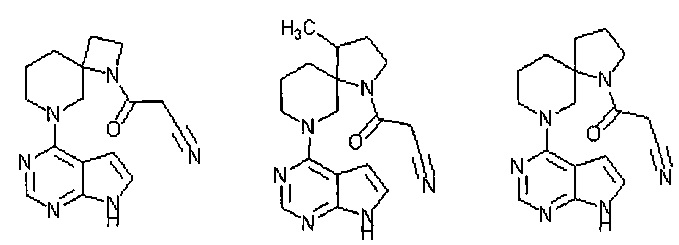 или
или 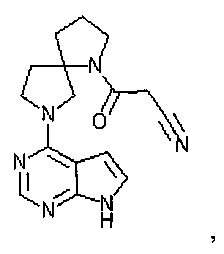
или его фармацевтически приемлемая соль.
20. Соединение по п. 1, имеющее следующую химическую структурную формулу
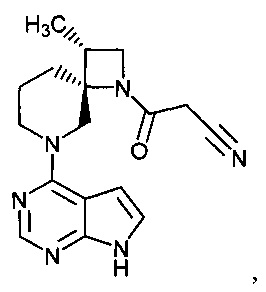
или его фармацевтически приемлемая соль.
21. Соединение по п. 1, имеющее следующую химическую структурную формулу
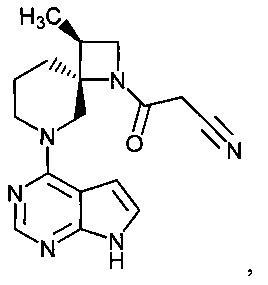
или его фармацевтически приемлемая соль.
22. Соединение по п. 1, имеющее следующую химическую структурную формулу
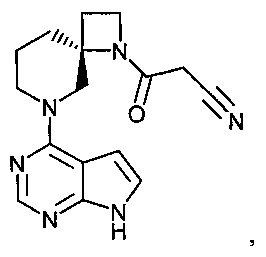
или его фармацевтически приемлемая соль.
23. Соединение по п. 1, имеющее следующую химическую структурную формулу
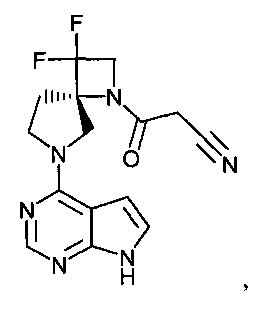
или его фармацевтически приемлемая соль.
24. Соединение по п. 1, имеющее следующую химическую структурную формулу
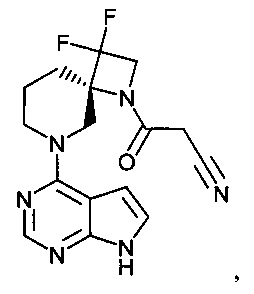
или его фармацевтически приемлемая соль.
25. Соединение по п. 1, имеющее следующую химическую структурную формулу
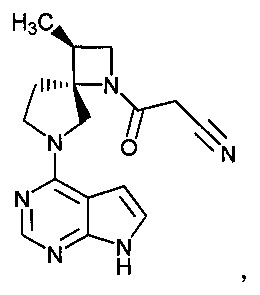
или его фармацевтически приемлемая соль.
26. Соединение по п. 1, имеющее следующую химическую структурную формулу
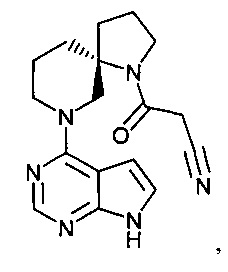
или его фармацевтически приемлемая соль.
27. Соединение по п. 1, имеющее следующую химическую структурную формулу
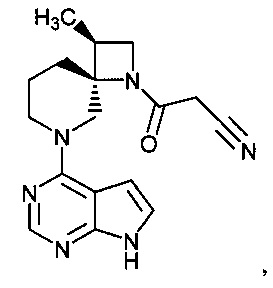
или его фармацевтически приемлемая соль.
28. Соединение по п. 1, имеющее следующую химическую структурную формулу
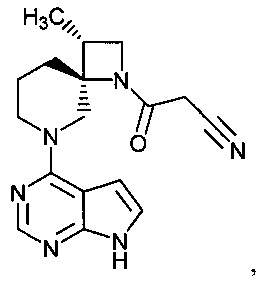
или его фармацевтически приемлемая соль.
29. Соединение по п. 1, имеющее следующую химическую структурную формулу
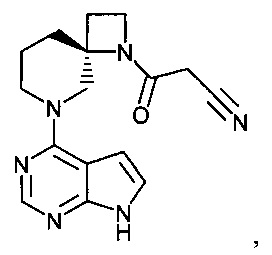
или его фармацевтически приемлемая соль.
30. Соединение по п. 1, имеющее следующую химическую структурную формулу
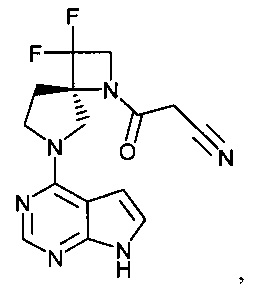
или его фармацевтически приемлемая соль.
31. Соединение по п. 1, имеющее следующую химическую структурную формулу
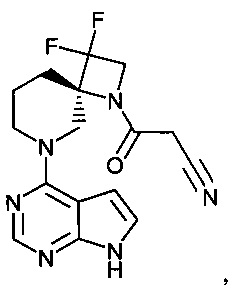
или его фармацевтически приемлемая соль.
32. Соединение по п. 1, имеющее следующую химическую структурную формулу
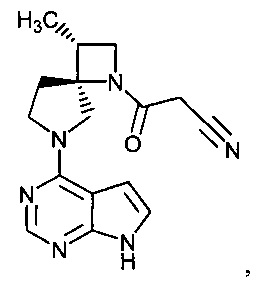
или его фармацевтически приемлемая соль.
33. Соединение по п. 1, имеющее следующую химическую структурную формулу
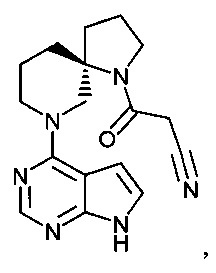
или его фармацевтически приемлемая соль.
34. Соединение по п. 1, имеющее следующую химическую структурную формулу
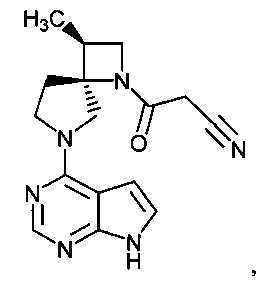
или его фармацевтически приемлемая соль.
35. Соединение по п. 1, имеющее следующую химическую структурную формулу
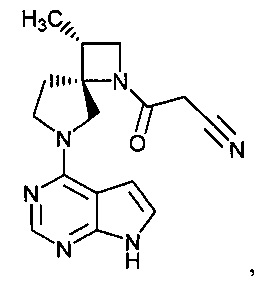
или его фармацевтически приемлемая соль.
36. Фармацевтическая композиция, обладающая активностью в отношении Янус-киназы и содержащая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль в фармацевтически эффективном количестве и фармацевтически приемлемый носитель.
37. Ингибитор Янус-киназы, представляющий собой соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
38. Ингибитор Янус-киназы по п. 37, в котором Янус-киназа представляет собой Янус-киназу 3.
39. Ингибитор Янус-киназы по п. 37, в котором Янус-киназа представляет собой Янус-киназу 2.
40. Фармацевтическая композиция, предназначенная для использования в качестве терапевтического или профилактического средства, полезного для лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции «трансплантат против хозяина» после трансплантации, аутоиммунных, аллергических заболеваний и хроническое миелопролиферативное заболевание, содержащая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
41. Фармацевтическая композиция, предназначенная для использования в качестве терапевтического или профилактического средства, полезного для лечения или профилактики ревматоидного артрита, включающая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
42. Фармацевтическая композиция, предназначенная для использования в качестве терапевтического или профилактического средства, полезного для лечения или профилактики псориаза, включающая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
43. Фармацевтическая композиция, предназначенная для использования в качестве терапевтического или профилактического средства, полезного при сухости глаз, включающая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
44. Фармацевтическая композиция, предназначенная для использования в качестве терапевтического или профилактического средства, полезного при атопическом дерматите, включающая соединение по любому из пп. 1-35 или его фармацевтически приемлемую соль.
45. Способ ингибирования Янус-киназы, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
46. Способ по п. 45, где Янус-киназа представляет собой Янус-киназу 3.
47. Способ по п. 45, где Янус-киназа представляет собой Янус-киназу 2.
48. Способ лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции «трансплантат против хозяина» после трансплантации, аутоиммунного заболевания, аллергических заболеваний и хроническое миелопролиферативное заболевание, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
49. Способ лечения или профилактики ревматоидного артрита, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
50. Способ лечения или профилактики псориаза, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
51. Способ лечения или профилактики сухости глаз, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
52. Способ лечения или профилактики атопического дерматита, включающий введение млекопитающему фармацевтически эффективного количества соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли.
53. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли для изготовления фармацевтической композиции, предназначенной для использования в качестве ингибитора Янус-киназ.
54. Применение по п. 53, где Янус-киназа представляет собой Янус-киназу 3.
55. Применение по п. 53, где Янус-киназа представляет собой Янус-киназу 2.
56. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики заболевания, выбранного из группы, состоящей из отторжения трансплантата органов, реакции «трансплантат против хозяина» после трансплантации, аутоиммунного заболевания, аллергических заболеваний и хроническое миелопролиферативное заболевание.
57. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики ревматоидного артрита.
58. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики псориаза.
59. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или предотвращения сухости глаз.
60. Применение соединения по любому из пп. 1-35 или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения или профилактики атопического дерматита.
| JP 2008545660 A, 18.12.2008 & RU 2011133825, 20.02.2013 | |||
| WO 2008119792 A1, 09.10.2008 & RU 2009140319, 10.05.2011 | |||
| JP 2009501130 A, 15.01.2009 & WO 2007007919 A2, 18.01.2007 | |||
| JP 2009520725 A, 28.05.2009 & RU 2008129379, 27.01.2010 | |||
| JP 2002518394 A, 25.06.2002 & EA10377B1, 29.08.2008 & EA006034 B1, 25.08.2005 | |||
| JP 2002518393 A, 25.06.2002 & EA 005852B1, 30.06.2005 | |||
| JP 2008525463 A, 17.07.2008 & WO2006069080 A2, 29.06.2006 | |||
| Jian-kang Jiang et al.,Examining the Chirality, Conformation and Selective Kinase Inhibition of 3-((3R,4R)-4-methyl-3-(methyl(7H-pyrrolo[2,3-d]pyrimidin-4-yl)amino)piperidin-1-yl)-3-oxopropanenitrile (CP-690, 550), Journal of Medicinal Chemistry, 2008, Vol: 51, Nr: 24, Page(s): 8012 - 8018. |
Авторы
Даты
2017-09-12—Публикация
2010-07-30—Подача