Изобретение относится к клинической биохимии, иммунологии, кардиологии, неврологии и может быть использовано для выделения из сыворотки крови человека и исследования атерогенности иммунных комплексов, содержащих множественно модифицированные липопротеины низкой плотности (ИК-ммЛНП).
Известны способы выделения иммунных комплексов, содержащих окисленные липопротеины низкой плотности, из сыворотки крови человека преципитацией их 2,5%, 3,5% и 4% растворами полиэтиленгликоля с молекулярной массой 6000 (ПЭГ-6000) в течение 24 часов. Агрегированные иммунные комплексы, содержащие множественно модифицированные ЛНП, осаждают центрифугированием, промывают преципитат 3 раза буфером, содержащим соответствующую концентрацию ПЭГ-6000 и определяют в преципитате холестерин после экстракции [1-4, 7-10].
Недостатком приведенных способов являются: длительность процедуры выделения, неполная преципитация ИК-ммЛНП, копреципитация иммунных комплексов, содержащих другие антигены (нелипопротеиновые) и как следствие - отсутствие единых, унифицированных стандартных способов избирательного выделения иммунных комплексов, содержащих ммЛНП.
В качестве прототипа использован экспресс-способ выделения и исследования атерогенности иммунных комплексов, содержащих множественно модифицированные липопротеины низкой плотности (ИК-ммЛНП) с использованием полиэтиленгликоля с молекулярной массой 3350 (ПЭГ-3350) и поливинилпирролидона с молекулярной массой 12600 (ПВП-12600) [5]. Использование буфера, содержащего 8,3% ПЭГ-3350 и 3,3% ПВП-12600, при соотношении сыворотка:буфер (1:1,2) позволило авторам преимущественно преципитировать из сыворотки циркулирующие иммунные комплексы, содержащие ммЛНП. Агрегаты ИК-ммЛПНП осаждают центрифугированием и преципитат растворяют в буфере без ПЭГ и ПВП, определяют содержание холестерина с использованием коммерческих наборов «Холестерин» и при уровне свыше 8,3 мг/дл констатируют повышенный уровень. В преципитете также определяют степень связывания комплемента морской свинки. Атерогенность ИК-ммЛПНП выражают как отношение степени связывания комплемента к холестерину в иммунных комплексах
Данная методика также не лишена недостатков. Способ не позволяет отделить иммунные комплексы, содержащие ммЛНП, от свободных ммЛНП, а в условиях 4,5% ПЭГ-3350 и 1,8% ПВП-12600 наблюдается неспецифическая копреципитация высокомолекулярных белков из сыворотки крови.
Техническим результатом предлагаемого способа является устранение вышеуказанных недостатков, эффективное разделение иммунных комплексов, содержащих ммЛНП, и свободных ммЛНП, устранение неспецифической копреципитации высокомолекулярных белков сыворотки крови, что дает возможность использовать данный способ для ранней диагностики субклинического атеросклероза за счет подтверждения гомогенности препаратов, оценки их патогенности в тесте связывания комплемента и расчета атерогенности как отношение степени связывания комплемента к холестерину в этих препаратах. Заявленный способ позволяет разделить ммЛНП и ИК-ммЛНП, полностью преципитировать патогенные ЛНП и точно вычислить атерогенность, поскольку атерогенность по способу-прототипу является суммарной реакцией степени связывания комплемента пулом ммЛНП и ИК-ммЛНП и отражает только общую тенденцию в тесте связывания комплемента.
Этот результат достигается тем, что специфическую преципитацию иммунных комплексов, содержащих множественно модифицированные липопротеины низкой плотности (ИК-ммЛНП), из сыворотки крови человека проводят путем инкубации супернатанта, полученного после предварительного осаждения ммЛНП в среде поливинилпирролидона с молекулярной массой 35000 (ПВП-35000), в течение 30 минут при 4°С, затем образовавшиеся агрегаты ИК-ммЛНП осаждают центрифугированием при 4°С в течение 10 мин при 3100g, декантируют, полученный преципитат растворяют в буфере без ПВП-35000 и определяют содержание холестерина, триацилглицеринов и IgG в иммунных комплексах с использованием коммерческих ферментативных наборов. Определяют степень связывания комплемента (ССК) морской свинки препаратом ИК-ммЛНП и рассчитывают атерогенность как отношение ССК к содержанию холестерина в ИК-ммЛНП.
Способ осуществляют следующим образом.
Проводят забор крови натощак из локтевой вены человека, отделяют сыворотку и определяют уровень содержания ммЛНП. К 15 мкл исследуемой сыворотки добавляют 150 мкл буфера, содержащего 10% ПВП-35000, тщательно перемешивают и инкубируют при комнатной температуре в течение 10 мин в 96-ти луночных иммунологических планшетах с плоским дном.
Способ выделения иммунных комплексов, содержащих ммЛНП включает:
- Буфер-1 для преципитации множественно модифицированных липопротеинов низкой плотности, который включает 20% ПВП-35000 в 0,01 М трис-HCl-буфере, pH 7,4, содержащем 0,15 М NaCl;
- Буфер-2 для растворения преципитата иммунных комплексов, который представляет собой 0,01М Трис-HCl-буфер, рН 7,4, содержащий 0,15 М NaCl.
Степень помутнения определяют турбидиметрически при длине волны 450 нм. В качестве бланка используют пробы сыворотки с соответствующим количеством Буфера-2. Рассчитывают уровень содержания ммЛНП по формуле
[ммЛНП], ЕД = [ЕО-ЕК]×100,
где [ммЛПН] - множественно модифицированные липопротеины низкой плотности в единицах (ЕД);
ЕО - оптическая плотность опытной пробы, сыворотки с соответствующим количеством буфера, содержащего 10% ПВП-35000, при длине волны 450 нм, ед. опт. пл.;
ЕК - оптическая плотность контрольной пробы при длине волны 450 нм, сыворотки с соответствующим количеством буфера-К, ед. опт. пл.;
100 - коэффициент перерасчета в единицы (ЕД).
Выделение множественно модифицированных липопротеинов низкой плотности. К 100 мкл сыворотки крови человека добавляют 84 мкл 20% ПВП-35000, тщательно перемешивают и после 10-ти минутной инкубации при комнатной температуре, агрегированные ммЛНП осаждают путем центрифугирования при 3100g в течение 10 мин при 23°С. ПВП-преципитат тщательно декантируют (супернатант в дальнейшем используют для выделения иммунных комплексов, содержащих ммЛНП) и осадок ресуспендируют в 100 мкл буфера-2. После растворения осадка в полученных ПВП-преципитатах определяют содержание холестерина с использованием коммерческих ферментных наборов [6].
Определение степени связывания комплемента препаратами ммЛНП и расчет их атерогенности. К 10 мкл растворов преципитатов ммЛНП, разбавленных в соотношении 1:99 вероналовым солевым буфером (VBS2+), добавляют 15 мкл раствора, разбавленного 1:9, комплемента морской свинки. Общий объем пробы доводят до 0,3 мл буфером VBS2+ и инкубируют в течение 20 мин при 37°С. После инкубации в пробы добавляют 200 мкл ЕА, тщательно перемешивают и продолжают инкубацию в течение 30 мин при 37°С. Реакцию комплемент-опосредованного лизиса останавливают добавлением 2,5 мл холодного раствора 0,15М NaCl, центрифугируют при комнатной температуре в течение 10 мин при 1800 оборотах в минуту и определяют величину гемолиза по выходу гемоглобина в супернатант. Контрольная проба не содержит преципитата ммЛНП. Пониженный гемолиз в опытных пробах по сравнению с контролем свидетельствует о наличии связывания комплемента. Степень лизиса эритроцитов (У) определяют по формуле
У(%)=[(X-R)/(H-R)×100],
где Н, R и X - величины оптической плотности А405 в гемолитических системах контрольной пробы, в контроле спонтанного лизиса ЕА и в опытной пробе, соответственно. Степень связывания комплемента (ССК) определяют по формуле:
ССК(%)=100-У.
Атерогенность иммунных комплексов, содержащих ммЛНП, рассчитывают как отношение степени связывания комплемента к количеству холестерина в преципитированных иммунных комплексов в индивидуальных сыворотках.
Выделение иммунных комплексов, содержащих множественно модифицированные липопротеинов низкой плотности. Супернатант, приготовленный как описано выше, инкубируют при 4°С в течение 30 минут. Агрегированные иммунные комплексы осаждают путем центрифугирования при 3100g в течение 10 мин при 4°С. Преципитат ИК-ммЛНП тщательно декантируют и полученный осадок ресуспендируют в исходном объеме, в 100 мкл буфера-2. После растворения осадка в полученных преципитатах определяют содержание холестерина с использованием коммерческих ферментных наборов.
Определение IgG в препарате ИК-ммЛНП в реакции торможения гемагглютинации (РТГА). Предварительно титруют преципитаты иммунных комплексов, разведенных 1:99, на 12 лунок в 96-ти луночных кругло донных иммунологических планшетах. В качестве стандарта титруют препарат IgG с исходной концентрацией 1 мг/мл. После титрования преципитатов и стандартного препарата IgG добавляют равный объем разбавленного раствора антител против IgG человека, содержащего 4 гемагглютинирующие единицы. Тщательно перемешивают и добавляют равный объем 1% суспензии иммунных комплексов, эритроцитов барана, сенсибилизированных гетерофильными антителами человека (ЕАЧ), повторно перемешивают и инкубируют в течение 1 ч при комнатной температуре. После инкубации определяют для каждой пробы лунку, где наблюдается торможение гемагглютинации. Расчеты проводят с использованием данных по торможению гемагглютинации стандартного раствора IgG человека.
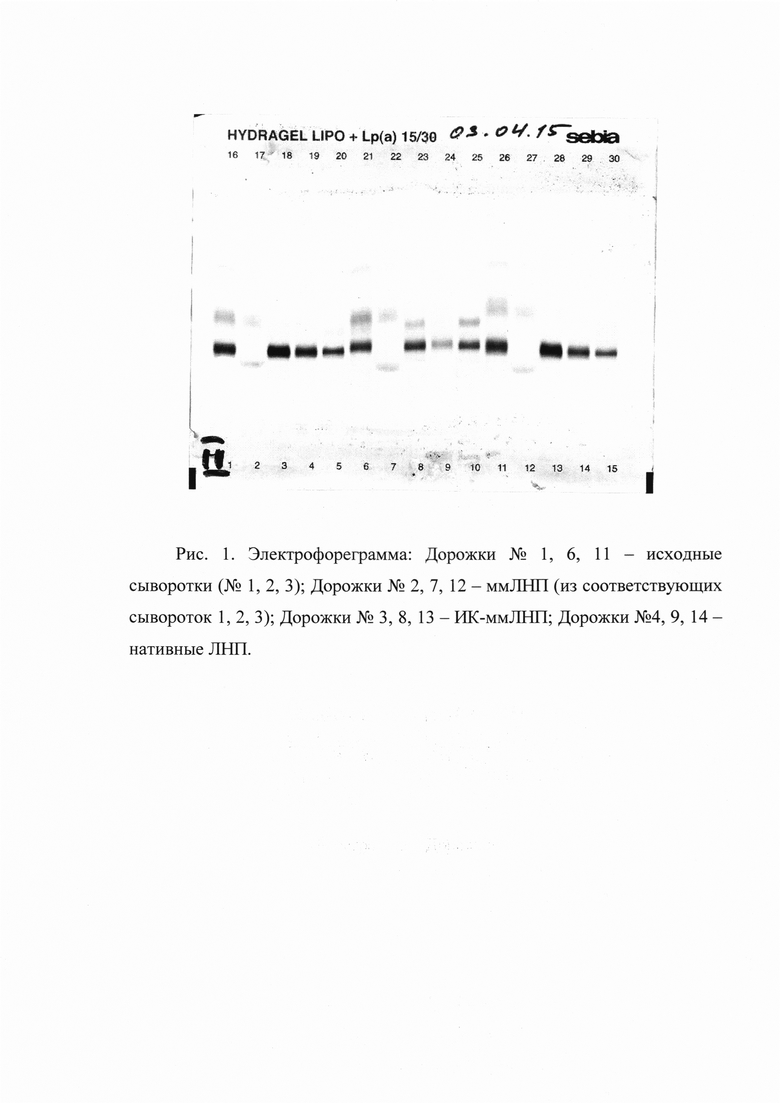
Электрофорез ммЛНП, ИК-ЛНП и исходной сыворотки. Электрофорез фракций ммЛНП, ИК-ммЛНП и исходной сыворотки проводят на ацетат-целлюлозной пленке с использованием наборов реагентов производства фирмы Sebia (Франция). Результаты представлены на рис. 1.
Как видно на рис. 1 (дорожки №1, 6 и 11), образцы исходной сыворотки на электрофореграмме разгоняются на три фракции (β-липопротеин (ЛНП), α-липопротеин (ЛВП) и альбумин). Препараты ммЛНП при электрофорезе (дорожки №2, 7 и 12) также разгоняются на три полосы (на старте остаются низкозаряженные липопротеины, липопротеины с подвижностью α-липопротеина и фракции альбумина). Препараты ИК-ммЛНП (дорожки №3, 8 и 13) характеризуются содержанием преимущественно липопротеинов с подвижностью β-липопротеинов, за исключением пробы на дорожке №8, который дал две фракции. Наиболее чистыми по данным электрофореза оказались препараты нЛНП (дорожки №4, 9 и 14). Для интерпретации полученных данных были проведены биохимические исследования приготовленных препаратов на анализаторе «Olympus AU400» (Япония).
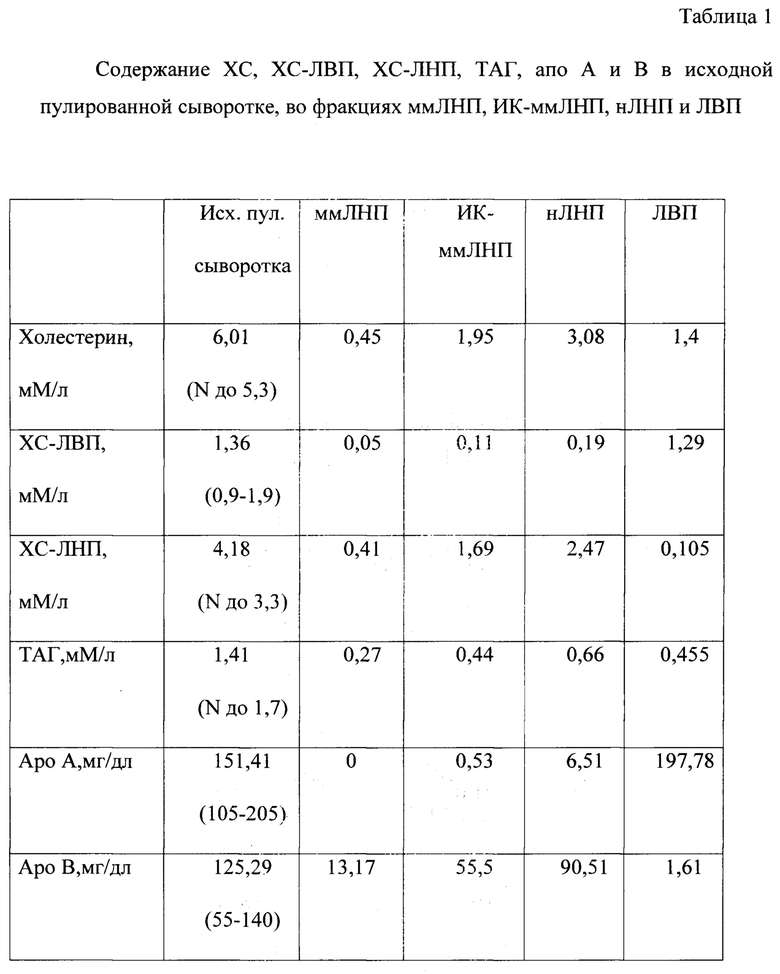
Биохимический анализ пулированной сыворотки крови и приготовленных из нее фракций ммЛНП и ИК-ммЛНП. Пулированную сыворотку готовили смешиванием сывороток крови от 10 больных с атеросклерозом каротидных артерий. Фракции ммЛНП, ИК-ммЛНП, нЛНП и ЛВП готовили как описано выше. Концентрацию общего ХС, ХС-ЛНП, липопротеинов высокой плотности (ХС-ЛВП), триацилглицеринов (ТАГ), аполипопротеинов А и В (апоА и В), определяли на биохимическом анализаторе «Olympus AU400» (Япония). Полученные данные представлены в таблице 1.
Как видно из данных, представленных в таблице 1, в пулированной сыворотке определяется повышенный уровень общего холестерина за счет холестерина ЛНП. Остальные показатели находятся в пределах референсных значений. Анализ фракций показал:
1. В препарате ммЛНП содержится до 11% ЛВП по холестерину и не определяется Аро А.
2. В препарате ИК-ммЛНП 0,15 мМ/л холестерина приходится на ХС-ЛОНП. На долю ХС-ЛНП приходится 87% из общего холестерина препарата ИК-ммЛНП. По Аро-протеину всего 1% приходится на Аро А. 6% приходится на ХС-ЛВП.
3. В препарате нЛНП содержится до 7% ЛВП по холестерину; из пула аропротеина 6,7% приходится на Аро А.
4. Содержание данных показателей в составе ЛВП свидетельствуют о том, что 0,4% в ЛВП содержится Х-ЛНП, 0,8% Аро В.
Разработанный способ выделения иммунных комплексов, содержащих ммЛНП, анализ их патогенности в тесте связывания комплемента и расчет атерогенности был использован при обследовании крови у больных с инструментально подтвержденным атеросклерозом каротидных артерий и у здоровых лиц.
Пример 1. Выделение и характеристика ммЛНП и иммунных комплексов, содержащих множественно модифицированные липопротеинов низкой плотности, из сыворотки крови у больных с инструментально подтвержденным атеросклерозом каротидных артерий.
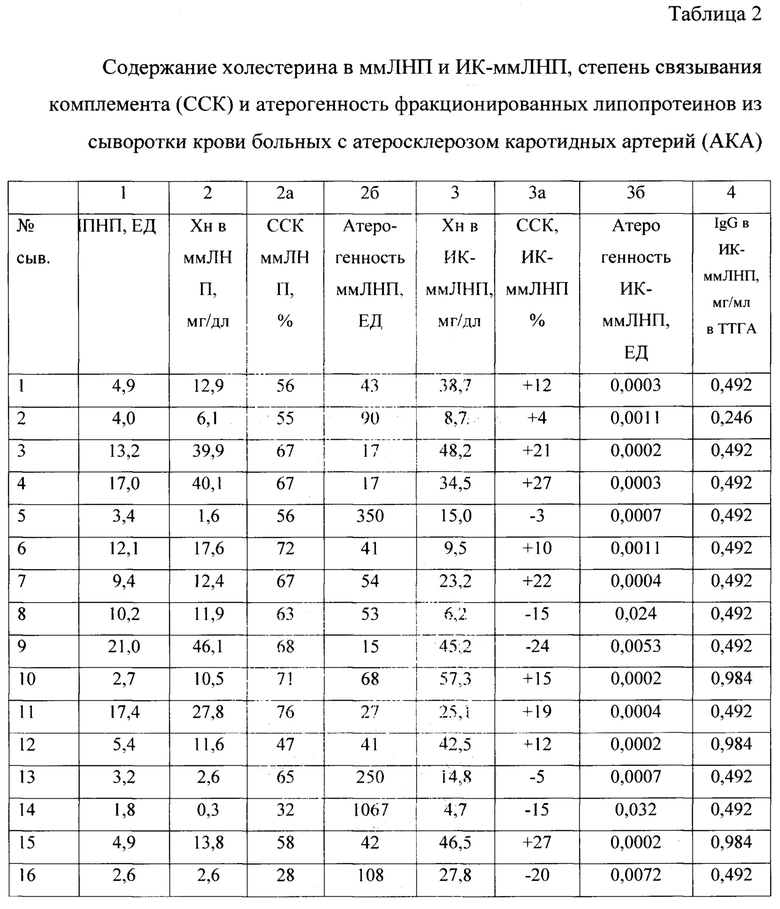
Проведены исследования у 16 больных с инструментально подтвержденным атеросклерозом каротидных артерий (АКА). Определение уровня ммЛНП, фракционирование ммЛНП и ИК-ммЛНП, степень связывания комплемента и расчет атерогенности проводили как описано выше. Полученные результаты представлены в таблице 2.
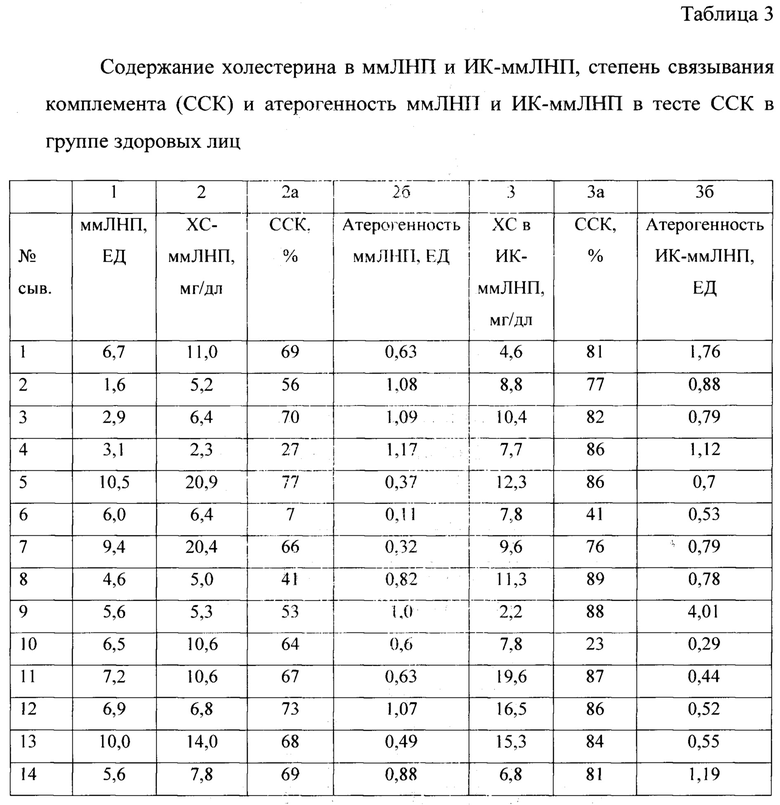
Пример 2. Выделение и характеристика ммЛНП и иммунных комплексов, содержащих множественно модифицированные липопротеинов низкой плотности, из сыворотки крови относительно здоровых лиц. Проведены исследования у 14 здоровых лиц с отсутствием изменений в интима-медиальном комплексе каротидных артерий. Определение уровня ммЛНП, фракционирование ммЛНП и ИК-ммЛНП, степень связывания комплемента и расчет атерогенности проводили как описано выше. Полученные результаты представлены в таблице 3.
Как видно из данных, представленных в таблице 3, определение уровня содержания ммЛНП методом турбидиметрии выявляет только у 3 человек (21%) повышенный уровень, в то время как у больных с АКА данный показатель составил 37,5% (табл. 2). Информативным оказался показатель холестерина в ммЛНП. У здоровых лиц у 43% наблюдается повышенный уровень холестерина в ммЛНП (у больных - 68,8%). Средние показатели степени связывания комплемента практически не отличаются в группах и составили 58% и 59%, соответственно.
Наиболее информативным оказался показатель атерогенности ммЛНП. В группе здоровых лиц данный показатель колебался от 0,32 ЕД до 1,17 ЕД, в то время как у больных с АКА данный показатель колебался от 15 до 1067 ЕД. Расчет удельной активности (атерогенности) ммЛНП в тесте связывания комплемента характеризует высокий воспалительный потенциал ммЛНП, особенно при «нормальном» уровне содержания ммЛНП у больных с инструментально подтвержденным атеросклерозом каротидных артерий.
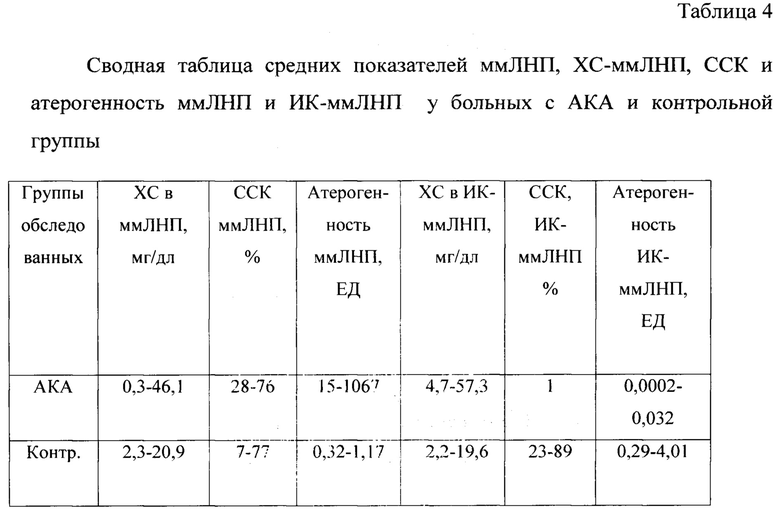
Данные содержания и патогенности иммунных комплексов, содержащих ммЛНП, в группах больных с АКА и здоровых лиц показали значимые различия. Так содержание холестерина в ИК-ммЛНП у больных с АКА в 2,8 раз было выше, чем в контрольной группе, причем эти комплексы у больных обладали очень низкой степенью связывания комплемента (только в 4 пробах наблюдается связывание комплемента из 16, а в остальных пробах наблюдается стабилизация комплемента в разной степени при предварительной инкубации). Расчет атерогенности ИК-ммЛНП выявил более существенные различия в комплемент-связывающей способности этих комплексов. В случае стабилизации комплемента (от + 12% до + 27%) для расчета атерогенности использовали величину 1% ССК. В таблице 4 представлены сводные данные со средними значениями исследованных показателей по двум группам.
Как видно из сравнительных данных, представленных в таблице 4, наиболее информативными показателями оказались данные, полученные при исследовании функциональной активности в тесте связывания комплемента. Представлены сравнительные данные по атерогенности ммЛНП и ИК-ммЛНП в тесте связывания комплемента. Отмечено превышение уровня холестерина в ммЛНП в 2 раза у пациентов с подтвержденным атеросклерозом каротидных артерий, что свидетельствует о наличии системной воспалительной реакции, причем атерогенность этих ммЛНП почти в 200 раз превышает данный показатель в контрольной группе. Колебания данного показателя от 15 ЕД до 1067 ЕД у больных с АКА свидетельствует о степени воспалительной реакции. Определение данного показателя при противовоспалительной терапии позволит контролировать эффективность лечения.
Пример 3. Выделение и характеристика иммунных комплексов, содержащих ммЛНП, из сыворотки крови относительно здоровых лиц и больных с атеросклерозом каротидных артерий, подтвержденных инструментальными методами исследования предлагаемым способом и прототипом.
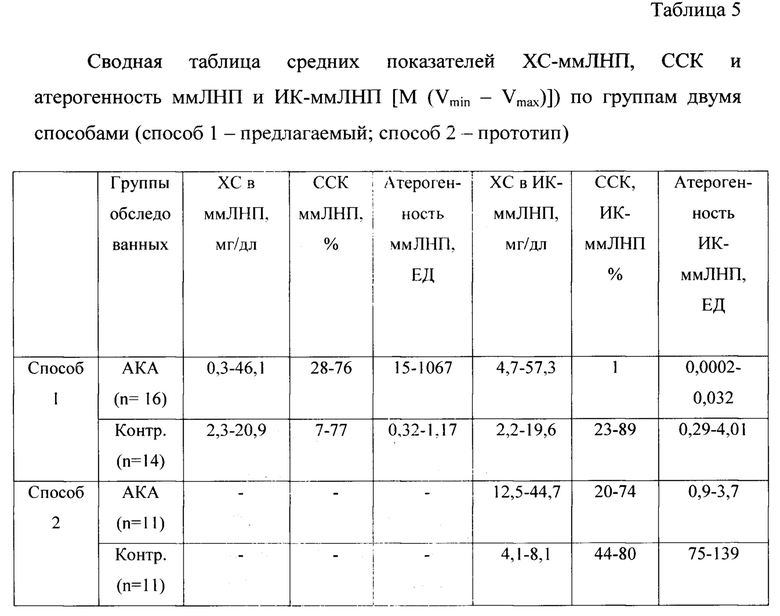
2.1. Приготовление преципитата сыворотки крови при условиях 1,8% ПВП-12600 и 4,5% ПЭГ-3350 (по прототипу). К 50 мкл сыворотки крови больных с атеросклерозом каротидных артерий и относительно здоровых доноров добавляли 60 мкл буфера, содержащего 8,3% ПЭГ-3350 и 3,3% ПВП-12600 и инкубировали 10 мин при 23°С. Образовавшиеся агрегаты иммунных комплексов осаждали центрифугированием при 23°С в течение 5 мин при 3100g. Супернатант декантировали и осадок растворяли в 50 мкл буфера без ПЭГа и ПВП. В преципитате определяли содержание холестерина с использованием коммерческого набора «Холестерин», степень связывания комплемента морской свинки и рассчитывали атерогенность ИК-ммЛНП. Полученные результаты с использованием предлагаемого способа и прототипа представлены в таблице 5.
Как видно из сравнительных данных, представленных в таблице 5, предлагаемый способ выделения иммунных комплексов, содержащих ммЛНП, показывает: 1. Содержание холестерина как в ммЛНП, так и в ИК-ммЛНП; 2. В контрольной группе содержание холестерина в ммЛНП и ИК-ммЛНП незначительно отличается, в то время как у больных с АКА содержание холестерина в ИК-ммЛНП в среднем почти в два раза больше, чем в ммЛНП; 3. Показатели атерогенности ммЛНП и ИК-ммЛНП в контрольной группе различаются незначительно, в то время как у больных с АКА атерогенность ммЛНП колебалась 15 до 1067 ЕД, а атерогенность ИК-ммЛНП - от 0,0007 до 0,032 ЕД.
Данные, полученные с использованием прототипа, не позволяют разделить ммЛНП и ИК-ммЛНП, а также полностью преципитировать патогенные ЛНП. Атерогенность в данном способе является суммарной реакцией степени связывания комплемента пулом ммЛНП и ИК-ммЛНП и отражает только общую тенденцию в тесте связывания комплемента.
Полученные данные о низкой атерогенности иммунных комплексов, содержащих ммЛНП, у больных с атеросклерозом каротидных артерий свидетельствует, с одной стороны, об антиатерогенном эффекте аутоиммунной реакции за счет связывания и нейтрализации патогенных ммЛНП. С другой стороны, низкая эффекторная (комплемент-активирующая) функция аутоантител к ммЛНП приводит к нарушению солюбилизации и элиминации иммунных комплексов, содержащих ммЛНП. Известно, что нарушение опсонизации иммунных комплексов компонентом C3b комплемента сопровождается незавершенным фагоцитозом. Возможно в этом и есть причина образования «пенистых» клеток - макрофагов, «фаршированных» липидными каплями.
Таким образом, заявленный способ специфического выделения иммунных комплексов позволяет проводить фундаментальные исследования процессов атерогенеза персонифицированно и контролировать эффективность терапии. Полученные экспериментальные данные об эффекторной функции аутоантител к ммЛНП в иммунных комплексах свидетельствуют о двойственной природе «антиатерогенной» аутоиммунной реакции организма человека на ммЛНП. Сравнительные исследования атерогенности иммунных комплексов, содержащих ммЛНП, в тесте связывания комплемента у здоровых доноров и больных с инструментально подтвержденным атеросклерозом каротидных артерий позволяют использовать данный способ как для ранней диагностики субклинического атеросклероза, так и для оценки характера аутоиммунной реакции у конкретных индивидуумов. Таким образом, определение атерогенности ИК-ммЛНП данным способом позволил выявить существенное его повышение у больных с атеросклерозом по сравнению со здоровыми лицами.
Литература
1. Гуревич B.C., Уразгильдеева С.А., Бутхашвили М.И., Васина Л.В. Эволюция представлений о про- и антиатерогенных свойствах липопротеинов // Атеросклероз и дислипидемия. - 2012. - №4. - С. 54-63.
2. Собенин И.А., Карагодин В.П., Мельниченко А.А., Орехов А.Н. Холестерин иммунных комплексов как индикатор атеросклероза // Патологическая физиология и экспериментальная терапия. - 2012. - №3. - С. 99-103.
3. Тертов В.В., Качарава А.Г., Саядян Х.С. и др. Холестеринсодержащие циркулирующие иммунные комплексы - компонент сыворотки крови больных с ишемической болезнью сердца, обуславливающий ее атерогенность // Кардиология. - 1989. - Т. 29, №8. - С. 35-38.
4. Шойбонов Б.Б., Борголов В.М., Баронец В.Ю., Панченко Л.Ф., Кубатиев А.А. Тест-система определения циркулирующих иммунных комплексов // Патент РФ №2452962 от 10.06.2012 г., Бюл. №16.
5. Шойбонов Б.Б., Кравченко М.А., Баронец В.Ю., Толпыго С.М., Костырева М.В., Шабалина А.А., Замолодчикова Т.С., Котов А.В., Панченко Л.Ф. Определение атерогенности иммунных комплексов, содержащих модифицированные липопротеины, в тесте связывания комплемента // Патологическая физиология и экспериментальная терапия. - 2014. - №4. - С. 133-138.
6. Шойбонов Б.Б., Шойбонова Б.В. Способ определения атерогенности крови // Патент РФ №2497116 от 10.08.2012.
7. Burut D.F.P., Karim Y., Ferns G.A.A. The Role of Immune Complexes in Atherosclerosis // Angiology. - 2010. - V. 61, №7. - P. 679-689.
8. Lopes-Virella M.F., Brent McHenry M., Lipsitz S., et al. Immune complexes containing modified lipoproteins are related to the progression of internal carotid intima-media thickness in patients with type 1 diabetes // Atherosclerosis. - 2007. - V. 190. - P. 359-369.
9. Szondy E., Mezey Z., Fust G. et al. Serial measurement of circulating immune complexes in myocardial infarction // Br Heart J. - 1981. - V. 46. - P. 93-98.
10. Virella G., Carter R.E., Saad A., et al. Distribution of IgM and IgG antibodies to oxidiesed LDL in immune complexes isolated from patients with type l diabetes and its relationship with nephropathy // Clin. Immunol. - 2008. - V. 127, №3. - P. 394-400.
АКА - больные с атеросклерозом каротидных артерий
Контр. - группа здоровых лиц без изменений в ИМК каротидных артерий
АКА - больные с атеросклерозом каротидных артерий
Контр. - группа здоровых лиц без изменений в ИМК каротидных артерий

| название | год | авторы | номер документа |
|---|---|---|---|
| МЕТОД ВЫДЕЛЕНИЯ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2592238C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ | 2013 |
|
RU2549467C1 |
| Способ оценки характера аутоиммунной реакции организма человека на множественно модифицированные липопротеины низкой плотности в литическом тесте | 2017 |
|
RU2680848C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА | 2013 |
|
RU2549466C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИТИЧЕСКОЙ АКТИВНОСТИ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2577719C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ КРОВИ ЧЕЛОВЕКА | 2012 |
|
RU2497116C1 |
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2013 |
|
RU2538685C1 |
| СРЕДА И СПОСОБ ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА | 2010 |
|
RU2444014C1 |
| Определение активности классического пути системы комплемента в тесте коагуляции фибриногена | 2019 |
|
RU2707568C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2012 |
|
RU2530627C2 |
Изобретение относится к медицине и предназначено для выделения и исследования иммунных комплексов, содержащих множественно модифицированные липопротеины низкой плотности (ИК-ммЛНП), из сыворотки крови человека. Агрегируют из сыворотки крови человека множественно модифицированные ЛНП в условиях 9,1% ПВП-35000 при комнатной температуре, осаждают центрифугированием, тщательно декантируют. Полученный супернатант инкубируют при 4°С в течение 30 мин. Образовавшиеся агрегаты ИК-ммЛНП осаждают повторным центрифугированием, декантируют, растворяют преципитат в буфере без ПВП и определяют содержание холестерина, триацилглицеринов. Определяют содержание IgG в составе преципитата. Исследуют комплемент-связывающую способность иммунных комплексов, содержащих ммЛНП. Способ может применяться для ранней диагностики субклинического атеросклероза. 1 ил., 5 табл., 3 пр.
Способ выделения и исследования атерогенности иммунных комплексов, содержащих множественно модифицированные липопротеины низкой плотности (ИК-ммЛНП), включающий приготовление преципитата из сыворотки крови человека в растворе 9,1% поливинилпирролидона (ПВП), его центрифугирование, отделение супернатанта декантацией, определение содержания холестерина в иммунных комплексах, степени связывания комплемента (ССК) и атерогенности как отношение ССК к холестерину в ИК-ммЛНП, отличающийся тем, что специфическую преципитацию ИК-ммЛНП проводят путем инкубации супернатанта в течение 30 минут при 4°С, затем образовавшиеся агрегаты ИК-ммЛНП осаждают центрифугированием при 4°С в течение 10 мин при 3100g, декантируют и преципитат растворяют в буфере без ПВП-35000.
| МЕТОД ВЫДЕЛЕНИЯ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2592238C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ | 2013 |
|
RU2549467C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИНИМАЛЬНО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ В СЫВОРОТКЕ ИЛИ ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА | 2012 |
|
RU2501013C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ КРОВИ ЧЕЛОВЕКА | 2012 |
|
RU2497116C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2012 |
|
RU2530627C2 |
| WO 2013036926 А2, 14.03.2013 | |||
| VIRELLA G | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Clin | |||
| Immunol | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Способ получения морфия из опия | 1922 |
|
SU127A1 |
| Способ передачи радиотелеграфных сигналов | 1922 |
|
SU394A1 |
Авторы
Даты
2017-10-02—Публикация
2016-07-21—Подача