Изобретение относится к клинической биохимии и может быть использовано в клинической лабораторной диагностике для определения наличия множественно модифицированных липопротеинов (ммЛП) в сыворотке крови человека.
Множественно модифицированные липопротеины являются одним из ключевых факторов атеросклероза, приводящего к возникновению сердечно-сосудистых заболеваний (ССЗ) - одного из основных причин смертности в развитых странах. Большинство ССЗ являются следствием атеросклероза коронарных артерий. Одним из ключевых моментов патогенеза атеросклероза является внутриклеточное накопление липидов в протеогликановом слое интимы артерий. В экспериментах in vitro показано, что химическая модификация липопротеинов низкой плотности (мЛП) (ацетилирование, обработка малоновым диальдегидом, окисление ионами металлов переменной валентности, избыточное гликозилирование и т.д.) приводит к накоплению липидов в культивируемых клетках эндотелия [4, 7]. Способность патологической сыворотки вызывать накопление липидов в эндотелиальных клетках определяют как атерогенность крови. Показано, что атерогенные свойства мЛП связаны с образованием ассоциатов мЛП [12]. После установления факта атерогенности модифицированных in vitro липопротеинов в сыворотке крови больных с ишемической болезнью сердца (ИБС) были обнаружены циркулирующие множественно модифицированные липопротеины низкой плотности (ммЛП) [8, 13], значительно отличающиеся от нативных по физико-химическим свойствам. Так, ммЛП имеют пониженное содержание сиаловых кислот, маннозы и других моносахаридов. Показано, что ммЛП избирательно связывают и активируют С1 компонент системы комплемента [2]. Окисленные липопротеины низкой плотности (охЛП) являются иммуногенными и индуцируют аутоиммунный ответ у людей. Аутоантитела к охЛП являются преимущественно провоспалительными IgGl и IgG3 изотипами и при образовании иммунного комплекса активируют классический путь системы комплемента и запускают фагоцитоз клетками, экспрессирующими Fcγ рецепторы [11]. Одним из наиболее патогенных свойств охЛП является взаимодействие с тромбоцитами, приводящее к их гиперреактивности [6] и к сосудистому воспалению [5].
Наиболее разрабатываемыми методами определения мЛП являются иммуноферментные тесты с использованием моноклональных антител к охЛП, МДА-модифицированным ЛП, избыточно гликозилированным ЛП [14].
Существенным недостатком иммуноферментых тест-систем является необходимость диссоциации комплексов мЛП-антитело, что требует предварительной преципитации иммунных комплексов с использованием полиэтиленгликоля 6000 (ПЭГ) с последующим отделением ПЭГ-преципитата центрифугированием, декантацией, отмыванием и растворением ПЭГ-преципитата в буфере, содержащем детергенты и хаотропные агенты для диссоциации иммунного комплекса. На следующей стадии избавляются от детергента и хаотропного агентов диализом [14]. Наличие мЛП требует проведения минимум двух тестов с разными моноклональными антителами. Многостадийность, трудоемкость и длительность иммуноферментного теста затрудняют использование их в рутинных исследованиях.
В настоящее время в клинической лабораторной практике отсутствуют доступные для рутинных исследований реагенты и методы определения содержания ммЛП в сыворотке. Учитывая важную патогенетическую роль ммЛП при атеросклерозе, остается актуальной разработка простых, доступных для клинических лабораторных исследований способов определения ммЛП.
Наиболее близким техническим решением является определение β- и пре-β-липопротеинов по методу Бурштейна и Самая с турбидиметрическим определением помутнения, образующегося при добавлении хлористого кальция и гепарина к сыворотке крови человека [1].
Недостатком этого способа является определение уровня β- и пре-β-липопротеинов, которые представляют собой липопротеины низкой (ЛПНП) и очень низкой плотности (ЛПОНП) сыворотки крови в норме. Только при наличии явного атеросклероза наблюдается повышение этого показателя.
Задачей настоящего изобретения является разработка буфера для избирательной преципитации ммЛП в сыворотке крови человека и способа определения ммЛП, являющегося ключевым маркером атерогенности крови.
Поставленная задача решается путем добавления к сыворотке крови человека раствора поливинилпирролидона (ПВП), определения степени помутнения раствора сыворотки турбидиметрическим способом и расчета содержания [ммЛП] по приведенной ниже формуле.
Техническим результатом, получаемым при реализации изобретения, является расширение арсенала реагентов для специфической агрегации ммЛП, получение тест-системы для определения уровня [ммЛП], упрощение, сокращение длительности процедуры исследования, а также его удешевление.
Этот результат достигается тем, что определение ммЛП в сыворотке крови человека проводят путем обработки ее 10% раствором поливинилпирролидона (ПВП)-12600 при объемном соотношении сыворотка:среда (1:8), инкубирования в течение 10 мин при комнатной температуре, измерения светопоглощения в опытной и контрольной пробах, вычисления разности между ними, при этом при величине разности более 2,7 У.Е. констатируют атерогенность крови.
Среду для преципитации ммЛП готовят растворением 10 г ПВП (относительная молекулярная масса 12600±2700) в 100 мл 0,01 М Трис-HCl-буфера, pH 7,4, содержащего 0,15 М NaCl. Среду добавляют к сыворотке крови, тщательно перемешивают, инкубируют, измеряют степень помутнения спетрофотометрически и рассчитывают уровень содержания [ммЛП] по формуле:
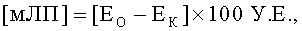
где
[ммЛП] - уровень содержания ммЛП в опытной пробе в условных единицах (У.Е.);
Ео - оптическая плотность опытной пробы при длине волны 450 нм, ед. опт. пл.;
ЕК - оптическая плотность контрольной пробы, сыворотки с соответствующим количеством буфера без ПВП (контрольный буфер), ед. опт. пл.;
100 У.Е - коэффициет перерасчета в условные единицы (У.Е.).
Пример 1. Определение оптимальной концентрации ПВП для преципитации ммЛП в сыворотке крови больных сердечно-сосудистыми заболеваниями. К 50 мкл пулированной сыворотки крови от 10 больных сердечно-сосудистыми заболеваниями (ССЗ) добавляют 100-800 мкл 10% раствора ПВП в 0,01 М Трис-HCl-буфере, pH 7,4, содержащем 0,15 М NaCl. тщательно перемешивают и инкубируют при комнатной температуре в течение 10 мин в 9-луночных плоскодонных кюветах биохимического анализатора FP-901 ("Labsystem", Финляндия). Степень помутнения определяют турбидиметрически при длине волны 450 нм. В качестве бланка используют пробы сыворотки с соответствующим количеством 0,01 М Трис-HCl-буфера, pH 7,4, содержащего 0,15 М NaCl. Рассчитывают уровень содержания [ммЛП] по формуле. Полученные результаты приведены в таблице 1.
Как видно из данных, представленных в таблице 1, с увеличением концентрации ПВП в инкубационной системе с 6,7% до 8,9% наблюдается агрегация ммЛП и помутнение раствора. Максимальная агрегация ммЛП достигается при концентрации 8,9%, т.е. при объемном соотношении сыворотка:среда (1:8). При дальнейшем увеличении концентрации ПВП свыше 8,9% наблюдается снижение степени агрегации.
Для подтверждения агрегации именно ммЛП сыворотки больных атеросклерозом в 8,9% растворе ПВП нами была исследована пулированная сыворотка от 10 здоровых доноров при условиях, описанных выше. Полученные результаты представлены в таблице 2.
Добавление к пулированной сыворотке крови здоровых доноров возрастающих концентраций 10% ПВП не приводит к агрегации нативных липопротеинов низкой и очень низкой плотности.
Пример 2. Определение содержания холестерина, триацилглицерида (ТАГ) и общих белков в ПВП-преципитатах. Для подтверждения наличия ммЛП в ПВП-преципитатах были проведены следующие эксперименты. Из 0,5 мл пулированной сыворотки больных ИБС и контрольных здоровых доноров были приготовлены ПВП-преципитаты в условиях 8,9% ПВП. Преципитат был осажден путем центрифугирования при 6000 об/мин в течение 20 мин при 23°C. Супернатант тщательно декантировали, ПВП-преципитат 2 раза отмывали 8,9% раствором ПВП и ресуспендировали в 0,5 мл 0,01 М Трис-HCl-буфера, pH 7,4, содержащего 0,15 М NaCl. В полученных ПВП-преципитатах определяли содержание холестерина, ТАГ и общих белков с использованием реактивов фирмы «Диакон-ДС», Россия. Полученные результаты представлены в таблице 3.
Как видно из данных, представленных в таблице 3, в ПВП-преципитате пулированной сыворотки больных ИБС содержание холестерина в 12 раз, а ТАГ в 16 раз больше, чем в ПВП-преципитате из сыворотки здоровых доноров. Содержание общего белка в 1,3 раза выше в ПВП-преципитате больных.
Таким образом, наличие холестерина, ТАГ и белка в ПВП-преципитатах из сывороток свидетельствует о липопротеиновой природе агрегатов, образующихся в присутствии 8,9% ПВП. Повышенный уровень ПВП-преципитата, содержащего ммЛП у больных с ИБС, является специфическим маркером атеросклеротического процесса.
Пример 3. Подбор оптимального времени инкубации смеси сыворотки с ПВП для агрегации ммЛП. К 50 мкл пулированной сыворотки больных ИБС и здоровых доноров добавляют 400 мкл 10% раствора ПВП в 0,01 М трис-HCl-буфере, pH 7,4, содержащем 0,15 М NaCl, тщательно перемешивают и инкубируют при комнатной температуре в течение 10, 20, 30 и 60 мин в 9-луночных плоскодонных кюветах биохимического анализатора FP-901 ("Labsystem", Финляндия). Степень помутнения определяют турбидиметрически при длине волны 450 нм. В качестве бланка используют пробы сыворотки с соответствующим количеством 0,01М Трис-HCl-буфера, pH 7,4, содержащего 0,15 М NaCl. Полученные результаты приведены в таблице 4.
Как видно из данных, представленных в таблице 4, в пулированной сыворотке больных ИБС агрегация ммЛП максимально протекает в течение 10 минут. При дальнейшей инкубации наблюдается незначительная агрегация остаточного количества ммЛП (примерно 8%). Уровень ммЛП в пулированной сыворотке здоровых доноров при инкубации 60 мин остается без изменений на уровне 8,3 У.Е.
Таким образом, для выявления повышенного уровня [ммЛП] 10-минутная инкубация является оптимальной для рутинных исследований атерогенности крови.
Пример 4. Определение связывания комплемента морской свинки преципитатами ммЛП в зависимости от концентрации. К 10-160 мкл раствора ПВП-преципитата (4,3 мг/мл по белку), приготовленного из пулированной сыворотки больных с ИБС и разбавленного в соотношении 1:99 буфером VBS2+, добавляют 20 мкл раствора, разбавленного 1:19 комплемента морской свинки. Общий объем доводили до 0,3 мл буфером VBS2+ и инкубировали 20 мин при 37°C. После предварительной инкубации добавляли 200 мкл эритроцитов барана, сенсибилизированных антителами кролика (ЕА) и инкубировали 30 мин при 37°C. После инкубации в каждую пробу добавляли по 2,5 мл холодного раствора 0,15 М NaCl, центрифугировали и определяли величину А405 супернатанта. Контрольная проба не содержала ПВП-преципитата. Пониженный гемолиз в опытных пробах по сравнению с контролем свидетельствовал о наличии связывания комплемента. Степень лизиса эритроцитов (У) определяли по формуле:
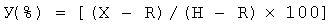 ,
,
где Н, R и Х - величины оптической плотности A412 в гемолитических системах контрольной пробы, в контроле спонтанного лизиса ЕА и в опытной пробе, соответственно. Степень связывания комплемента (ССК) определяли по формуле:
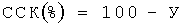
Данные о степени связывания комплемента при разных концентрациях ПВП-преципитата приведены в таблице 5.
Как видно из данных, представленных в таблице 5, ммЛП, преципитированные в растворе 8,9% ПВП, обладают комплементсвязывающей способностью, причем эффект является дозозависимым. При увеличении концентрации ПВП выше 8,9% в системе наблюдается уменьшение количества преципитированного холестерина, ТАГ, белков, а также комплементсвязывающей активности ПВП- преципитатов (данные не приведены).
Таким образом, определение комплементсвязывающей способности ПВП-преципитата свидетельствует о наличии ммЛП и о специфическом взаимодействии ммЛП с комплементом морской свинки. Определение холестерина, ТАГ и общих белков в ПВП-преципитате при концентрации 8,9%, а также максимальная комплементсвязывающая способность подтверждает оптимальную концентрацию 8,9% ПВП в системе для специфической агрегации ммЛП из сыворотки больных с атеросклеротической болезнью.
Пример 5. Влияние ммЛП на агрегацию тромбоцитов. ммЛП были приготовлены в условиях 8,9% ПВП, как описано в примере 2. Для исследования агрегации тромбоцитов получали кровь из краевой вены уха кролика в 3,8% раствор цитрата натрия (9:1 по объему). Центрифугировали кровь при 150 g в течение 10 мин. Супернатант, представляющий собой богатую тромбоцитами плазму (БТП) крови, использовали для анализа агрегации тромбоцитов. Исследования агрегации тромбоцитов проводили по методу Born [3] в модификации O'Brien [9, 10] с графической регистрацией на агрегометре фирмы Crono-Log Со. (США). Принцип метода основан на изменении оптической плотности БТП при добавлении индукторов агрегации. При агрегации суспензия тромбоцитов становится более прозрачной и за счет падения оптической плотности светопропускание растет. Графически это отображается отклонением кривой от нулевой линии (0% агрегации) до 100% агрегации.
Ход определения: 0,25 мл ТБП помещали в кювету агрегометра, прогревали до 37°C в течение 1 мин при постоянном перемешивании и выставляли 0% агрегации. В опытную пробу вносили препарат ммЛП, дополнительно инкубировали в течение 4 мин и проводили агрегацию тромбоцитов введением индуктора АДФ (конечная концентрация 1,25 мкМ). Регистрировали агрегацию в течение 5 мин. За 100% агрегации принимали светопропускание пробы, содержащей 0,25 мл тромбоцит бедной плазмы. В качестве параметров агрегации использовали максимальный процент снижения оптической плотности - В (%). Степень агрегации тромбоцитов при действии ммЛП характеризовали величиной Воп/Вк, где Воп и Вк - изменение светопропускания соответственно богатой тромбоцитами плазмы, содержащей ммЛП, и контрольного образца. Результаты представлены в таблице 6.
Как видно из данных, представленных в таблице 6, предварительное введение ммЛП при конечной концентрации 0,4 мкг/мл вызывает усиление агрегации, в то время как ПВП-преципитат из сыворотки контрольной группы здоровых доноров практически не оказывает влияния на функцию тромбоцитов.
Таким образом, ПВП-преципитат, приготовленный из сыворотки больных ИБС, вызывает гиперреактивность тромбоцитов.
Пример 6. Влияние концентрации и времени инкубации ммЛП на агрегацию тромбоцитов. Ход определения: 0,25 мл ТБП помещали в кювету агрегометра, прогревали до 37°C в течение 1 мин при постоянном перемешивании и выставляли 0% агрегации. В опытную пробу вносили возрастающие концентрации препарата ммЛП, приготовленного из сыворотки больных ИБС, дополнительно инкубировали в течение 4 мин и проводили агрегацию тромбоцитов введением индуктора АДФ (конечная концентрация 1,25 мкМ). Регистрировали агрегацию в течение 5 мин. Результаты представлены в таблице 7.
Как видно из данных, представленных в таблице 7, эффект усиления агрегации тромбоцитов под влиянием ммЛП имеет дозозависимый характер. Причем, до 10 мкг/мл ммЛП наблюдается усиление агрегации тромбоцитов, а свыше 10 мкг/мл наблюдается плато, что свидетельствует об эффекте насыщения, т.е. увеличение концентрации в 2 раза (20 мкг/мл) не вызывает дальнейший эффект.
Влияние времени предварительной инкубации ммЛП с тромбоцитами на функцию тромбоцитов. Для этих исследований использовали концентрацию 10 мкг/мл ммЛП. Использовали два интервала времени - 0 мин и 5 мин. В первой серии экспериментов к богатой тромбоцитами плазме добавляли ммЛП и сразу запускали агрегацию тромбоцитов добавлением АДФ без предварительной инкубации. Во второй серии экспериментов после добавления ммЛП к ТБП инкубировали 5 мин и затем добавляли индуктор АДФ. Полученные данные свидетельствуют о том, что эффект усиления агрегации тромбоцитов практически не зависит от времени предварительной инкубации.
Таким образом, эффект усиления агрегации тромбоцитов под действием ммЛП: 1) зависит от концентрации, причем наблюдается эффект насыщения; 2) для связывания ммЛП с тромбоцитами практически не требуется предварительная инкубация, что свидетельствует об очень высокой аффинности и скорее всего связано с взаимодействием ммЛП с рецепторами на мембране тромбоцитов.
Пример 7. Влияние хранения сыворотки на уровень содержания ммЛП. Определяли уровень содержания ммЛП предлагаемым способом в день забора крови и через 7 суток хранения при 4°C сыворотки больных ИБС и здоровых доноров. Результаты представлены в таблице 8.
Полученные результаты убедительно свидетельствуют о том, что уровень ммЛП в сыворотке крови при хранении в течение 7 суток при 4°C не меняется у здоровых доноров. В то время как данный показатель начинает возрастать при хранении сыворотки больных ИБС. Параллельно с повышением уровня ммЛП возрастает бланк сыворотки у больных ИБС. Данный факт может свидетельствовать о том, что при хранении сыворотки крови больных ИБС при 4°C, с одной стороны, наблюдается дальнейшая модификация липопротеинов низкой плотности, с другой стороны, повышение бланка сыворотки свидетельствует о наличии повышенного уровня криоглобулинов, которые преципитируют при 4°C.
Пример 8. Определение уровня содержания [ммЛП] в сыворотке крови у больных ИБС и здоровых доноров с использованием биохимического анализатора FP-901 ("Labsystem" Финляндия). Проведены исследования содержания [ммЛП] предлагаемым способом в сыворотке 18 больных ИБС и 60 здоровых доноров (контрольная группа) с использованием биохимического анализатора FP-901 ("Labsystem" Финляндия). К 50 мкл исследуемой сыворотки добавляли 400 мкл 10% ПВП в 0,01М трис-HCl-буфере, pH 7,4, содержащем 0,15 М NaCl, тщательно перемешивали и инкубировали при комнатной температуре в течение 10 мин в 9-луночных плоскодонных кюветах биохимического анализатора FP-901 ("Labsystem", Финляндия). Степень помутнения определяли турбидиметрически при длине волны 450 нм. В качестве бланка использовали пробы сыворотки с соответствующим количеством 0,01М Трис-HCl-буфера, pH 7,4, содержащего 0,15 М NaCl. Рассчитывали уровень содержания [ммЛП] по формуле, приведенной выше. Полученные результаты приведены в таблице 9.
В контрольной группе уровень содержания [ммЛП] колебался от 1,1 до 9,9 У.Е. и среднее значение составило 4,59±2,58. Данная величина ммЛП нами принята за нормальный показатель у здоровых доноров. У больных ИБС содержание [ммЛП] колебалось от 9,9 до 37,1 У.Е. и среднее значение составило 21,26±10,64 У.Е., что в 4,6 раза больше нормального показателя. Нужно отметить, что при использовании других биохимических анализаторов в каждой лаборатории должен быть уточнен диапазон нормальных величин [ммЛП] для обследуемого контингента людей.
Пример 9. Определение уровня содержания [ммЛП] в сыворотке крови у больных ИБС и здоровых доноров с использованием фотометра иммуноферментного анализа Multiskun MCC ("Labsystem" Финляндия). Проведены исследования содержания [ммЛП] предлагаемым способом в сыворотке 53 больных ИБС и 42 здоровых доноров (контрольная группа) с использованием фотометра иммуноферментного анализа Multiskun MCC ("Labsystem" Финляндия). К 14 мкл исследуемой сыворотки добавляли 116 мкл 10% ПВП в 0,01М трис-HCl-буфере, pH 7,4, содержащем 0,15 М NaCl, тщательно перемешивали и инкубировали при комнатной температуре в течение 10 мин в 96-луночных плоскодонных плашках. Степень помутнения определяли турбидиметрически при длине волны 450 нм. В качестве бланка использовали пробы сыворотки с соответствующим количеством 0,01М Трис-HCl-буфера, рН 7,4, содержащего 0,15 М NaCl. Рассчитывали уровень содержания [ммЛП] по формуле, приведенной выше. Полученные результаты приведены в таблице 10.
Как видно из данных, представленных в таблице 10, в контрольной группе уровень содержания [ммЛП] колебался от 1,6 до 2,7 У.Е. и среднее значение составило 2,24±0,39. Данная величина [ммЛП] нами принята за нормальный показатель у здоровых доноров, полученных с использованием фотометра иммуноферментного анализа. У больных ИБС содержание [ммЛП] колебалось от 2,8 до 19,9 У.Е. и среднее значение составило 8,08±4,14 У.Е., что в 3,6 раза больше нормального показателя.
Таким образом, использование фотометра иммуноферментного анализа для измерения уровня [ммЛП] позволяет повысить производительность лабораторных исследований, а также уменьшает расход сыворотки до 14 мкл на 1 тест. Учитывая оснащенность клинико-диагностических лабораторий фотометрами иммуноферментного анализа нами предлагается диапазон нормальных величин [ммЛП] на уровне от 1,6 до 2,7 У.Е.
Таким образом, из приведенных выше примеров следует следующее.
1. В присутствии 8,9% ПВП из сыворотки больных с ИБС преципитируют ммЛП, в то время как у здоровых доноров не наблюдается преципитация нативных ЛП.
2. 10 мин инкубация смеси сыворотки с ПВП приводит к максимальной преципитации ммЛП у больных ИБС.
3. Атерогенность ммЛП подтверждается двумя независимыми тестами: а) ммЛП обладают провоспалительным эффектом за счет связывания и активации системы комплемента; б) ммЛП обладают тромбогенным эффектом, обусловленным гиперагрегацией тромбоцитов.
4. Хранение сыворотки при 4°C не приводит к появлению ммЛП в сыворотке крови здоровых доноров, в то время как в сыворотке больных с ИБС наблюдается спонтанная ассоциация ммЛП наряду с криопреципитацией.
Предлагаемый способ отличается простотой, включает всего 2 операции: смешивание сыворотки с раствором ПВП и регистрацию мутности. Для приготовления среды необходимы широко распространенные реактивы: ПВП, NaCl и трис-HCl. Способ позволяет регистрировать наличие ммЛП непосредственно в сыворотке без предварительного ее фракционирования. Способ быстр (10 мин на 1 анализ, при проведении серии из 30 проб не более 30 мин). Использование простого и быстрого в осуществлении способа определения атерогенности крови позволяет выявлять доклинические состояния атеросклероза, может служить специфическим биохимическим маркером для терапии атеросклеротических заболеваний, позволит проводить углубленное исследование патогенеза атеросклероза, дает возможность их ранней профилактики и позволяет контролировать эффективность проводимой терапии.


ной сыворот
ке больных ИБС, У.Е.
ной сыворот
ке доноров, У.Е.
ень ммЛП
у боль
ных ИБС
вень ммЛП у здоро
вых доно
ров
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ КРОВИ (ВАРИАНТЫ) | 2010 |
|
RU2437098C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АТЕРОГЕННОСТИ КРОВИ ЧЕЛОВЕКА | 2012 |
|
RU2497116C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МИНИМАЛЬНО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ В СЫВОРОТКЕ ИЛИ ПЛАЗМЕ КРОВИ ЧЕЛОВЕКА | 2012 |
|
RU2501013C1 |
| ЭКСПРЕСС-СПОСОБ ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2012 |
|
RU2530627C2 |
| СПОСОБ И ТЕСТ-СИСТЕМА ОПРЕДЕЛЕНИЯ ЦИРКУЛИРУЮЩИХ ИММУННЫХ КОМПЛЕКСОВ | 2010 |
|
RU2452962C2 |
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ РЕЗИСТЕНТНОСТИ К ОКИСЛЕНИЮ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА | 2015 |
|
RU2578027C1 |
| СПОСОБ ВЫДЕЛЕНИЯ И ИССЛЕДОВАНИЯ АТЕРОГЕННОСТИ ИММУННЫХ КОМПЛЕКСОВ, СОДЕРЖАЩИХ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫЕ ЛИПОПРОТЕИНЫ | 2016 |
|
RU2632118C1 |
| МЕТОД ВЫДЕЛЕНИЯ И КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2592238C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЛИТИЧЕСКОЙ АКТИВНОСТИ МНОЖЕСТВЕННО МОДИФИЦИРОВАННЫХ ЛИПОПРОТЕИНОВ НИЗКОЙ ПЛОТНОСТИ | 2015 |
|
RU2577719C1 |
| СПОСОБ ЭКСПРЕСС-ОПРЕДЕЛЕНИЯ ХОЛЕСТЕРИНА В ИММУННЫХ КОМПЛЕКСАХ | 2013 |
|
RU2538685C1 |
Изобретение относится к клинической биохимии и описывает среду для определения наличия в сыворотке крови множественно модифицированных липопротеинов (ммЛП), которая содержит 10% раствор ПВП-12600 в 0,01М Трис-HCl-буфере, рН 7,4, содержащем 0,15 М NaCl. Также описан способ определения наличия в сыворотке крови множественно модифицированных липопротеинов (ммЛП) путем турбодиметрического определения помутнения, где обработку сыворотки проводят в среде, охарактеризованной в п.1, при объемном соотношении сыворотка: среда (1:8), инкубируют 10 мин при комнатной температуре, измеряют светопоглощение в опытной и контрольной пробах при длине волны 450 нм, вычисляют разность между ними, и при величине разности более 2,7 У.Е. констатируют наличие в сыворотке крови множественно модифицированных липопротеинов. Данное изобретение позволяет выявлять доклинические состояния атеросклероза, может служить специфическим маркером для терапии атеросклеротических заболеваний, позволит проводить углубленное исследование патогенеза атеросклероза, дает возможность его ранней диагностики, а также позволяет контролировать эффективность проводимой терапии. 2 н.п. ф-лы, 10 табл., 9 пр.
1. Среда для определения наличия в сыворотке крови множественно модифицированных липопротеинов (ммЛП), отличающаяся тем, что содержит 10%-ный раствор ПВП-12600 в 0,01М Трис-HCl-буфере, рН 7,4, содержащем 0,15М NaCl.
2. Способ определения наличия в сыворотке крови множественно модифицированных липопротеинов (ммЛП) путем турбодиметрического определения помутнения, отличающийся тем, что обработку сыворотки проводят в среде, охарактеризованной в п.1, при объемном соотношении сыворотка:среда (1:8), инкубируют 10 мин при комнатной температуре, измеряют светопоглощение в опытной и контрольной пробах при длине волны 450 нм, вычисляют разность между ними, и при величине разности более 2,7 У.Е. констатируют наличие в сыворотке крови множественно модифицированных липопротеинов.
| Камышников B.C | |||
| Справочник по клинико-биохимическим исследованиям и лабораторной диагностике | |||
| - М.: МЕДпресс-информ, 2004, 920 с | |||
| МАРКЕРЫ АТЕРОСКЛЕРОЗА | 2005 |
|
RU2384847C2 |
| RU 94010187 A1, 27.09.1996 | |||
| Tertov V.V., Orekhov A.N., Martsenyuk O.N., Perova N.V., Smirnov V.N | |||
| Low density lipoproteins isolated from the blood of patiens with coronary heart disease induce | |||
Авторы
Даты
2012-02-27—Публикация
2010-08-24—Подача